Перфтордиоксолы, способ их получения (варианты), гомополимеры и сополимеры перфтордиоксолов, термоперерабатываемые сополимеры тетрафторэтилена - RU2139866C1
Код документа: RU2139866C1
Чертежи


Описание
Изобретение относится к новому классу перфтордиоксолов, способам их получения и к гомополимерам и сополимерам, полученным из этих перфтордиоксолов. Оно также относится к новым термоперерабатываемым сополимерам тетрафторэтилена, полученным из фтордиоксолов, в особенности подходящим для покрытия электрического кабеля путем экструзии из расплава.
Известны сополимеры FEP/сополимеры тетрафторэтилена и гексафторпропилена, имеющие температуру плавления около 260-265oC, наделенные относительно хорошими механическими свойствами при температуре до 200oC, которые описаны, например, в патенте США N 2946763. Известно, что для обработки термообрабатываемых полимеров экструзией необходима низкая вязкость расплава, т.е. высокий индекс течения расплава. Уменьшение вязкости приводит к ухудшению механических свойств. Для ослабления этого воздействия получают сополимеры, имеющие повышенное процентное содержание гексафторпропилена. Однако, использование повышенного процентного содержания этого сомономера означает резкое уменьшение температуры плавления и, следовательно, нижнего допустимого значения температуры.
В патенте США N 4029866 представлены другой вид сополимера FEP, содержащих, кроме тетрафторэтилена и гексафторпропилена, от 0,5 до 3,0% по весу третьего мономера, состоящего из перфторпропилвинилового эфира или перфторэтилвинилового эфира.
Эти терполимеры обладают более низкой вязкостью, чем сополимеры FEP, содержащие только тетрафторэтилен и гексафторпропилен.
Тем не менее, механические свойства при высокой температуре (200oC) остаются все же приемлемыми. Согласно вышеприведенному патенту перфторметилвиниловый эфир не является пригодным в качестве третьего мономера (смотри, в частности, колонку 3, строки 38-39 и сравнительный пример A).
Патент США N 4587316 предлагает использование в качестве третьего мономера перфторалкилвиниловых эфиров, в которых перфторалкильная группа содержит даже более высокое количество углеродных атомов: от 4 до 10.
Обычно,
терполимер FEP, содержащий около 6% (по молям) гексафторпропилена и около 0,4% (по молям) перфторпропилвинилового эфира, и имеющий индекс расплава около 18-20, проявляет следующие свойства:
- температуру плавления: около 260oC;
- разрушающее напряжение при 200oC: около 4 МРа;
- напряжение пластического течения при 200oC: около 3 МРа;
Способы определения этих свойств будут описаны в дальнейшем.
Обычно превосходные механические свойства получают у сополимеров TFE и перфторалкилвинилового эфира, в частности, у сополимеров перфторпропилвинилового эфира, которые описаны в патенте США N 3635926, независимо от вязкости расплава.
Характеристики этого класса сополимеров улучшаются по мере возрастания числа углеродных атомов в алкильных группах перфторалкилвинилового эфира, даже если реакционная способность уменьшается с возрастанием длины перфторалкильного сегмента, однако перфторалкилвиниловый эфир остается все же более реакционноспособным, чем соответствующие α-алкилперфторолефины. Низкая реакционная способность перфторпропилвинилового эфира приводит к уменьшению производительности реактора полимеризации, что приводит к отрицательному воздействию на стоимость продукции и необходимости извлечения непрореагировавшего мономера, когда реакция завершена (смотри, например, патент Великобритании N 1514700). Этот недостаток также делает способ получения сополимеров TFE с перфторпропилвиниловым эфиром и другими перфторвиниловыми эфирами и даже более длинной перфторалкильной цепью более дорогостоящим.
Следовательно, в особенности чувствуется необходимость в нахождении новых сочетаний фторсодержащих мономеров, которые, с одной стороны, могут быть усовершенствованием в отношении сополимеров и терполимеров FEP, а с другой стороны могут сохранять ряд свойств, сравнимых, например, со свойствами сополимеров тетрафторэтилена с перфторпропилвиниловым эфиром, исправляющих в то же самое время недостатки, описанные выше.
К удивлению было обнаружено, что термообрабатываемые сополимеры TFE, полученные из определенного количества перфторметилового эфира и одного или нескольких перфтордиоксолов, которые будут описаны впоследствии, неожиданно наделены очень хорошим сочетанием термических и механических свойств при высоких температурах (даже при 250oC), и сопротивлением напряжению, что делает их в особенности подходящими для покрытия электрического кабеля экструзией из расплава. Превосходные свойства этих полимеров являются в особенности неожиданными, так как характеристики термообрабатываемых сополимеров тетрафторэтилена (TFE) только с перфторметилвиниловым эфиром являются несомненно плохими по сравнению с характеристиками сополимеров TFE и перфторпропилвиниловго эфира. Особое преимущество этих сополимеров, цель настоящего изобретения, исходит из того факта, что перфторметилвиниловый эфир является при сополимеризации с TFE значительно более реакционноспособным, чем перфторалкилвиниловые эфиры с перфторалкильной цепью, имеющей более высокое количество углеродных атомов, и гексафторпропилен.
Был также обнаружен, в соответствии с настоящим изобретением, новый класс перфтордиоксолов, подходящих для получения гомополимеров и сополимеров, обеспеченных превосходными механическими свойствами и хорошей термоустойчивостью. Эти новые перфтордиоксолы являются в особенности подходящими для получения термообрабатываемых сополимеров тетрафторэтилена.
Известны различные классы фтордиоксолов. В патенте США N 3865845 описано, в частности, следующее соединение:

В Европейской заявке на патент N 076581 описан следующий класс соединений:

где Y4, Y5 и Y6 являются фтором или хлором, в то время как R2 - перфторалкильный радикал, имеющий от 1 до 4 углеродных атомов. В Европейской заявке на патент N 080187 описан 2,2,4,5-тетрафтор-1,3-диоксол

который в дальнейшем будет обозначен как PD.
Из этих фтордиоксолов могут быть получены гомополимеры и сополимеры, в особенности с тетрафторэтиленом, и термополимеры, в особенности с тетрафторэтиленом и другим мономером с олефиновой ненасыщенностью. Эти гомополимеры, сополимеры и терполимеры описаны, в частности, в следующих патентах или заявках на патент: США - 3865845, США - 3978030, EP - 73087, EP - 76581 и EP - 80187.
Недостаток известных фтордиоксолов состоит в том, что они имеют большую склонность к самопроизвольной гомополимеризации. Это приводит к проблемам во время хранения и, в определенных случаях, при получении сополимеров с другими мономерами с равномерным распределением мономера вдоль полимерной цепи. Эта проблема в особенности возникает при получении аморфных сополимеров /а именно, сополимеров, содержащих более, чем 10-12% по молям фтордиоксола/.
Получение PD предпочтительно осуществляют в тетрагидрофуране, что описано в патенте США N 4558141. Несмотря на разницу в температурах кипения PD и тетрагидрофурана /67oC/, в перфтордиоксоле после дистилляции всегда присутствует около 1% тетрагидрофурана. Как правило, тетрагидрофуран в PD должен быть устранен перед осуществлением полимеризации PD, например, путем обработки водой и последующей дистилляции. Эти добавочные стадии, которые делают способ более громоздким, необходимы, потому что даже незначительные количества тетрагидрофурана вызывают изменения в конечных характеристиках полимера при уменьшении в значительной степени молекулярной массы полимера как таковой. Например, температура стеклования гомополимера /T9/ изменяется от 172oC до 84-92oC, тогда содержание тетрагидрофурана в диоксоле изменяется от 0% до 2%. Перфтордиоксол, очищенный от тетрагидрофурана во избежание гомополимеризации, необходимо хранить при -78oC или в растворах 1,1,2-трихлор-1,2, 2-трифторэтана, однако охлажденных.
Был обнаружен новый класс перфтордиоксолов, который к удивлению, не имеет склонности к самопроизвольной гомополимеризации, таким образом, их можно хранить при комнатной температуре после обычной дистилляции.
Было также обнаружено, что эти новые перфтордиоксолы можно отнести к вышеуказанным термообрабатываемым сополимерам, обладающим превосходными механическими свойствами по сравнению с таковыми, достижимыми у фтордиоксолов предшествующего уровня в данной области.
Известно, что фтордиоксолы получают из соответствующих диоксоланов, содержащих 2 атома хлора, один - в положении 4, а другой - в положении 5, путем дегалгенирования металлом, в частности, Mg: упомянутую реакцию проводят в растворителе, в частности, диметилформамиде (в этом отношении смотри вышеупомянутые патенты и заявки на патент: США - 43865845, EP - 76581 и EP - 80187.
Такое дегалогенирование является проблемой при синтезе перфтордиоксола, потому что при этом получают низкие выходы. В соответствии с Международной заявкой на патент WO 91/03472 выход дегалогенирования возрастает, если в исходном диоксолане относительное количество антиизомера, у которого два атома хлора находятся в анти-положении) выше, чем количество син-изомера/ у которого два атома хлора находятся в син-положении/. Некоторое увеличение количества анти-изомера получают путем обработки смеси изомеров SbCl5 и HF.
Было найдено три способа получения новых перфтордиоксолов, являющихся объектом данного изобретения, через посредство соответствующих диоксоланов, содержащих два атома хлора. Такие способы предоставляют очень хороший выход в реакции дегалогенирования без обогащения исходных диоксоланов анта-изомером.
Следовательно, целью настоящего изобретения является обеспечение нового класса перфтордиоксолов, которые не гомополимеризуются самопроизвольно, следовательно, их хранение не вызывает проблемы, а их применение в реакциях сополимеризации не вызывает проблем, связанных с неравномерным распределением мономера вдоль цепи полимера.
Другой целью настоящего изобретения является обеспечение способов получения перфтордиоксолов, в которых конечное дегалогенирование осуществляется с высоким выходом.
Еще одной целью изобретения является обеспечение новых гомополимеров и сополимеров вышеупомянутых перфтордиоксолов, наделенных хорошими механическими свойствами и хорошей термоустойчивостью.
Еще одной целью настоящего изобретения является обеспечение новых термообрабатываемых сополимеров тетрафторэтилена, которые преодолевают недостатки, встречающиеся при получении и использовании термообрабатываемых сополимеров тетрафторэтилена предшествующего уровня в данной области.
Другой целью изобретения является обеспечением новых термообрабатываемых сополимеров тетрафторэтилена, в особенности подходящих для покрытия электрического кабеля экструзией из расплава.
При описании настоящего изобретения слово "сополимер" используется для обозначения - в зависимости от обстоятельств продуктов сополимеризации 2х, 3х, 4х или более мономеров.
Одна из вышеупомянутых целей достигается новыми термообрабатываемыми
сополимерами тетрафторэтилена настоящего изобретения. Эти сополимеры получают на основе:
а/ перфторметилвиниловых эфиров в количестве от 0,5 до 13% по весу,
b/ одного или нескольких
перфтордиоксолов в количестве от 0,05 до 3% по весу, формулы XIII:

в которой: Z1 и Z2 являются одинаковыми или отличающимися друг от друга и при этом являются фтором, хлором, водородом или о OR1T, где R1 является перфторалкиленовым радикалом, имеющим от 1 до 5 углеродных атомов, а T является фтором или хлором при условии, что Z1 и Z2 не могут быть оба хлором или OR1T, Y1 или Y2 являются F или CF3, при этом одинаковы или отличаются друг от друга,
c/ тетрафторэтилена, причем в таком количестве, что сумма процентных содержаний различных мономеров равна 100% по весу.
Предпочтительным процентным содержанием по весу трех видов мономеров является следующее:
- перфторметилвиниловый эфир: 2-9%,
- фтордиоксол или фтордиоксолы в целом: 0,1 - 1,
5%,
- тетрафторэтилен: остальное до 100%.
В соответствии с настоящим изобретением сополимеры предпочтительно содержат только один перфтордиоксол.
Среди предпочтительных перфтордиоксолов можно сослаться на 4,5-дифтор-2,2-трифторметил-1,3-диоксол, перфтордиоксол PD и новые перфторированные диоксолы, которые будут описаны в дальнейшем.
Термообрабатываемые сополимеры, являющиеся объектом настоящего изобретения, могут быть получены путем радикальной полимеризации как в водной, так и в органической среде. Полимеризацию в водной среде можно осуществлять следующим образом. Инициатором полимеризации может быть любое вещество, способное к созданию радикалов, например, пероксид, персульфат или азо-соединение. Эти соединения обычно имеют в условиях реакции средний срок службы, достаточной для поддержания реакции и получения желаемой молекулярной массы.
Возможно добавление восстановителя, действующего в качестве промотора разложения инициатора, например, соли железа. Используемое количество инициатора зависит, как известно, от температуры реакции, возможного присутствия передатчиков кинетической цепи, от желательной молекулярной массы, и обычно, от реактивных условий.
Более того, при полимеризации в водной среде, необходимо присутствие поверхностно-активного вещества. Можно использовать соли перфторалкилкарбоновых кислот /например, перфторкаприлат аммония/. Другими подходящими соединениями являются соли перфторалкоксибензолсульфоновой кислоты, описанные, например, в Европейской заявке на патент N 184459. К водной среде необязательно, но возможно добавить вещества, которые являются растворителями для мономеров и, возможно, для инициатора. Этими растворителями могут быть, например, 1,1,2-трихлор-1,2,2, -трифторэтан, 1,2-дихлор-1,1,2,2-тетрафторэтан, трихлорфторметан, дихлордифторметан, CCIF2H и перфторциклобутан.
В особенности выгодным является проведение полимеризации в водной фазе в присутствии перфторполиэфиров. Их можно добавить к реакционной среде в виде водной эмульсии в присутствии подходящего диспергатора, как описано в Европейском патенте N 247379, или предпочтительно в виде термодинамически устойчивой водной микроэмульсии, которая описана в патенте США N 4864006.
Альтернативно полимеризацию можно осуществить в жидкой органической среде, которая описана, например, в патенте США N 3642742. Для полимеризации TFE в органической среде может быть использован любой подходящий инициатор. Предпочтительно, инициатор может быть растворимым в реакционном растворителе. Примерами подходящих инициаторов могут быть алкилперкарбонаты и перфторацилпероксиды.
Обычно
сополимеры подают в реактор в виде газообразной смеси. Новые перфтордиоксолы, составляющие еще один объект настоящего изобретения, имеют формулу I:

в которой RF является перфторалкильным радикалом, имеющим от 1 до 5 углеродных атомов, а X1 и X2 являются фтором или CF3, при этом могут быть одинаковыми или отличающимися друг от друга. Предпочтительно X1 и X2 являются оба атомами хлора.
Среди
предпочтительных перфтордиоксолов могут быть приведены следующие:

Наиболее предпочтительными перфтордиоксолами являются диоксолы формулы (IV) и (V).
Перфтордиоксолы формулы (I) могут быть получены следующим способом /названным в дальнейшем "первый способ"/, включающим:
1o /взаимодействие при температуре от N -140oC до +60oC /и предпочтительно от -110oC до -20oC/ диоксола формулы II:
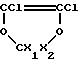
/в которой X1 и X2 - одинаковые или отличаются друг от друга и являются F или CF3/ с фтороксисоединением формулы RFOF /в которой RF является перфторалкильным радикалом, имеющим от 1 до 5 углеродных атомов/ при этом получают диоксолан формулы III:
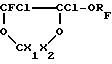
2o/ дегалогенирование диоксолана (III) путем реакции с металлом в апротонном биполярном растворителе, в соответствии с известными методиками.
Диоксолы формулы (II) являются известными соединениями, их можно получить, например, в соответствии со способом, описанным в Европейской заявке на патент N 460946.
Фтороксисоединения формулы RF-OF являются также известными соединениями. CF3OF можно получить, например, с помощью способа, описанного C.H.Cady и K. B. Kellogg, J. Am. Chem Soc.70, 3986, 1948, а превосходные гомологи - способом, описанным в патенте США N 4827024.
На первой стадии диоксол
(II) присутствует в жидкой фазе. Предпочтительно его растворяют в растворителе. Подходящими растворителями являются хлорфторуглероды и перфторполиэфиры, имеющие перфторалкильные группы, в частности,
такие, которые имеют среднечисленную массу 500-1000. Среди хлорфторуглеродов могут быть представлены: CFCl3, CF2Cl2 и CFCl2 - CF2Cl. Среди
перфторполиэфиров могут быть представлены коммерческие продукты Galder(R) и FombIin(R) Ausimont, Krytox(R), Du Pont de Nemours и Demnum(R) Daikin; примером
подходящего перфторполиэфира является GaIder(R) D02 формулы

имеющий отношение n/m, равное 40 и среднечисловую молекулярную массу 760.
Фторсоединение RF-OF можно подать полностью в одно и то же время в вышеупомянутой жидкой фазе. Однако, имеет смысл с промышленной точки зрения, подавать его непрерывно, обычно в виде газа, в жидкой фазе. Предпочтительно газообразное фторокси соединение подают с газом разбавителем, инертным в реакционных условиях, в частности, с N2, He или Ar. Когда используют газ-разбавитель, объемное отношение между таким газом и RR - OF обычно составляет от 3-х и более, обычно от 3-х до 6.
Последующее дегалогенирование можно осуществить одним из известных способов. Способ самого заявителя, описанный в Европейской заявке на патент N 499158, является в особенности подходящим, в соответствии с этим способом диоксолан, растворенный в биполярном апротонном растворителе, взаимодействует с цинком при температуре от 30oC до 130oC. В особенности подходящими растворителями являются диметилсульфоксид, диметилформамид и глимы.
Новые перфтордиоксолы, являющиеся объектом настоящего изобретения, могут быть получены
другим способом /названным в дальнейшем "второй способ"/, включающим:
1o /взаимодействие при температуре от -140oC до + 60oC /и предпочтительно от -110oC до -20oC/ олефина формулы
RF - O -CCI = CFCI /X/
в которой RF является перфторалкильной группой, имеющей от 1 до 5 углеродных атомов/ с
бифтороксисоединием формулы
CX1X2 /OF/2 /XI/
/в которой X1 и X2 - одинаковые или отличаются друг от друга и являются фтором или
CF3/ c получением диоксолана формулы III:

2o/ дегалогенирование диоксолана формулы /III/ реакцией с металлом в опротонном биполярном растворителе.
Олефин /X/ может быть получен путем взаимодействия CCl2 = CCl2 c RF OF для получения соединения RF - OCCl2 - CFCl2, которое путем реакции дехлорирования с порошком цинка в органическом растворителе дает олефин /X/.
К удивлению было обнаружено, что вопреки учению предшествующего уровня в данной области, нет необходимости начинать со смеси изомеров диоксолана /III/, /полученных или в первом или во втором способе/ обогащенных анти-изомером, для того, чтобы достигнуть высокого выхода при конечном дегалогенировании: в действительности, высокие выходы неожиданно получают, когда в диоксолане превалирует син- или анти-изомер.
Новые перфтордиоксолы, являющиеся объектом настоящего изобретения, могут также быть получены еще одним способом /названным в дальнейшем "третий способ"/,
включающим взаимодействие газообразного потока диоксолана формулы XI:

необязательно в смеси с диоксоланом формулы XII:

с KOH в твердом состоянии, при температуре от 20oC до 150oC. Эта реакция вызывает дегидрохлорирование с образованием диоксола /1/. Реакция протекает с высоким выходом.
Исходный диоксолан /XI/ может быть получен следующим образом: RFOF взаимодействует с трихлорэтиленом с получением RFO - CClH - CFCl2, который дехлорируют порошком цинка в органическом растворителе с получением олефина RF-OCH= CFCl. Путем взаимодействия олефина с CX1X2/OF/2 получают диоксолан /XI/.
Диоксолан /XII/ в смеси с диоксоланом /XI/ можно получить
следующим образом: CClH=CClH взаимодействует с CX1X2/OF/2 с получением диоксолана

который при дегидрогалогенировании с твердым КОН дает диоксол
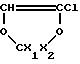
Диоксол взаимодействует с P2OF, при этом получают смесь диоксоланов /XI/ и /XII/.
Синтез новых перфтордиоксолов может быть проведен аналогично способам, описанным
выше, при использовании 1,2-дихлорэтилена, 1,1-дихлорэтилена или трихлорэтилена и гипофторитов формул:
RF - OF и /CX1X2/OF2,
с
чередованием реакций дехлорирования и дегидрохлорирования для синтеза промежуточных продуктов реакции.
После дистилляции перфтордиоксолы /I/, являющиеся объектом изобретения, можно хранить при комнатной температуре без самопроизвольной полимеризации.
Еще одним объектом настоящего изобретения являются гомополимеры новых фтордиоксолов /I/ и их сополимеры с одним или несколькими сомономерами, обладающими олефиновой ненасыщенностью.
Среди них предпочтительными сомономерами являются: тетрафторэтилен, винилиденфторид, винилфторид, трифторэтилен, перфторпропилен, перфторметилвиниловый эфир, перфторэтилвиниловый эфир, перфтордиоксол PD, перфтор/2,2-диметил/-1,3-диоксол, CF2= CF-O-CF2-CF2-SO2F, хлортрифторэтилен, винилхлорид, метилакрилат, метилметакрилат и этилен.
Предпочтительными сополимерами являются сополимеры тетрафторэтилена, в частности, сополимеры C2F4 и 2,2,4-трифтор-5-трифторметокси-1,3-диоксола (IV). Полимеризацию /для получения как гомополимеров, так и сополимеров/ можно осуществить в растворителе или в водной эмульсии. Растворитель обычно выбирают из хлорфторуглеродов и перфторполиэфиров, которые упомянуты выше. Реакцию проводят посредством радикальных инициаторов, обычно используемых для полимеризации TF1, например, перфторпропионилпероксида, бензоилпероксида, азо-бис/изобутиронитрила/ и перкарбонатов. Более того, могут быть использованы окислительно-восстановительные системы, например, такие, которые описаны в Prog. Polym. Sci, т. 8, с. 61, 1982.
Обычно используемые способы полимеризации в водной среде описаны, например, в Европейской заявке на патент N 247379 и в патенте США N 4846006, обычно используемые способы полимеризации в неводной среде описаны в патенте США N 4864006 и N 5182342.
Путем гомополимеризации, например, 2,2,4-трифтор-5-трифторметокси-1,3-диоксола
(IV) получают гомополимеры формулы IX:
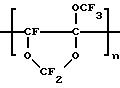
Гомополимеры с n = 4 - 7 являются вязкими маслами, при n > 10 получают прозрачные твердые тела.
Масла, полученные гомополимеризацией перфтордиоксолов, являющихся объектами настоящего изобретения, являются в особенности пригодными в качестве смазочных масел и маслянистых составляющих для смазочных жиров, твердые полимеры являются, в частности, подходящими для покрытий, имеющих низкий показатель дифракции, в частности, для оптических волокон.
Сополимеры перфтордиоксолов, являющихся объектом настоящего изобретения, с тетрафторэтиленом являются кристаллическими, если содержание фтордиоксола является относительно низким, и аморфными, если это содержание является относительно высоким. Установить четкую границу между двумя видами полимеров нелегко: кристаллические продукты обычно получают при содержании перфтордиоксола меньше, чем 10 - 12% по молям, а аморфные продукты - при содержании перфтордиоксола выше, чем 10 - 12% по молям.
Кристаллические сополимеры являются, кроме того, пригодными в качестве диэлектрических материалов. Аморфные сополимеры, кроме того, пригодны в качестве покрытия для изделий, которые подлежат электрической изоляции.
Более того, благодаря их низкому показателю преломления, они являются подходящими для покрытий оптических волокон.
Согласно настоящему изобретению сополимеры и термополимеры могут содержать перфтордиоксолы в количестве от 0,1 до 70% по молям и более, т.е. до полимеров, содержащих только несколько процентов мономера или мономеров, других, чем перфтордиоксол.
Следующие примеры представлены с иллюстративной целью и их не следует толковать, как ограничивающие область настоящего изобретения.
Пример 1. Получение 4,5-дихлор-2,2, 4-трифтор-5-трифторметокси-1,3-диоксолана /1-ый способ/.
В 250 мл многогорлый цилиндрический стеклянный лабораторный реактор, снабженный механической мешалкой, термопарой, погружным впускным отверстием для реакционной газовой смеси, выпускным отверстием для инертного газового потока загрузили 63 г 4,5-дихлор-2,2-дифтор-1,3-диоксола (356 миллимолей и 200 мл CF2Cl2 в качестве растворителя. Затем реактор довели с помощью криостата до - 100oC, при этой температуре и механическом перемешивании непрерывно в течение 7 часов подавали смесь CF3OF /1,3 нл/час/ и гелия /6 нл/час/. Затем в потоке гелия /1 нл/час/ температуру подняли до -70oC для устранения избытка CF3OF. Из реакционного продукта после дистилляции большей части растворителя фракционной дистилляцией выделили продукты реакции на тарельчатой колонне при атмосферном давлении. Собрали фракцию, имеющую температуру кипения 77 - 78oC и состоящую из 73,0 г 4,5-дихлор-2,2,4-трифтор-5-трифтор-метокси-1,3-диоксолана. Выделенный таким образом диоксолан состоял из смеси двух изомеров, анти-изомера /91%/, где два атома хлора находятся в анти-положении, и син-изомера /9%/, где два атома хлора находятся в син-положении. Во фракции, имеющей температуру кипения 47 - 50oC, выделили 10,2 г 4,5-дихлор-2,2,4,5-тетрафтор-1, 3-диоксолана при соотношении изомеров син/анти, равном 68/32.
Превращение исходного диоксолана было полным. Выход 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана, определяемый как соотношение между молями полученного диоксолана и молями исходного диоксола, составил 73%.
Свойства 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана.
Температура кипения при атмосферном давлении 77,5oC.
19F ЯМР-спектр в ppm /част. на миллион/ CFCl3 = 0.
Анти-изомер:
/2FO
- CF'-F''-O/F' = - 55,2, F'' = - 58,6, F'F'' = 67 Hz, /3F - OCF3/ - 55,0, /1F - CFCl-/ - 67,3
Син-изомер:
/2FO - CF'-F''-O/ F' = - 55,7, F'' =
- 57,2, F'F'' = 66 Hz, /3F
- OCF3/ - 54,8, /IF - CFCl-/ - 60,6
Масс-спектр /электронный удар/, главные пики и относительное распределение:
245/M+-Cl/, 179/C3F4O2
Cl+/, 132/C2F4O2+/, 85/CF2Cl+/, 69/CF3100%/.
Спектр инфракрасного излучения, основные полосы /СМ-1/: 1282, 1206, 1094, 1043, 940, 898, 877, 843.
Пример 2. Дегалогенирование 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана /1-й способ/.
В 1 л трехгорлую колбу, снабженную магнитной мешалкой, термометром, конденсатором и соединенную с ловушкой, поддерживаемой при температуре -75oC, загрузили под азотом 33,8 порошка цинка, активированного путем промывки 3NHCl, 600 мл ДМГ и 100 мг J2. Внутреннюю температуру довели до 90oC и добавили по каплям 47,2 г 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана /168 миллимолей/, полученного как в примере 1. Во время добавления температура увеличилась до 98oC. Когда добавление закончили, реакционную смесь перемешивали в течение еще одного часа при 90oC. В охлаждаемой ловушке конденсировали 26,1 г /124 миллимоля/ 2,2,4-трифторметокси-1,3-диоксола. Выход диоксола, определяемый как отношение между молями полученного диоксола и молями исходного диоксолана, составил 74%.
Свойства 2,24-трифтор-5-трифторметокси-1,3-диоксола:
Температура кипения при атмосферном давлении: 24oC.
19F спектр ЯМР в част. на
миллион CFCl3 = 0
- 147,1 /1F, = CF-/, -61,3 /3F, CF3-/, -47,0 /2F, -OCF2O/.
Масс-спектр, /электронный удар/ главные пики и относительное
распределение:
210/M+/, 191/M+ -F/, 135/C2F5O/, 69/CF3 100%/.
Спектр инфракрасного излучения, основные полосы /см-1/: 1850, 1394, 1276, 1239, 1189, 1068, 997.
Пример 3. Дегалогенирование 1,1,2,2-тетрахлор-1-фтор-2-трифторметоксиэтана /2-й способ/.
В 1 л трехгорлую колбу, снабженную магнитной мешалкой, термометром, капельной воронкой и соединенную посредством колонки Vigreux и конденсатора с ловушкой, поддерживаемой при -75oC, загрузили под азотом 80 г порошка цинка, активированного промывкой 3NHCl, 550 мл DMF и 50 г KJ. Внутреннюю температуру довели до 80oC и добавили по каплям 102 г 1,1,2,2-тетрахлор-1-фтор-2-трифторметоксиэтана /377 миллимолей/. Во время добавления температура увеличилась до 90oC. Когда добавление закончили, реакционную смесь перемешивали в течение еще одного часа при 90oC. В охлаждаемой ловушке конденсировали 62,8 г /315 миллимолей/ 1,2-дихлор-1-фтор 2-трифторметоксиэтана /цис/транс 50%/50%/. Выход 1,2-дихлор-1-фтор-2-трифторметоксиэтилена /транс + цис/ составил 83%.
Пример 4. Получение 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана /2-й способ/.
В 150 мл многогорлый цилиндрический стеклянный лабораторный реактор, снабженный механической мешалкой, термопарой, погружным впускным отверстием для реакционной газовой смеси, выпускным отверстием для потока инертного газа, загрузили 11,5 г 1,2-дихлор-1-фтор-2-трифторметоксиэтилена /57 миллимолей/ и 50 мл CF2Cl2 в качестве растворителя. Затем реактор довели посредством криостата до -50oC, затем при механическом перемешивании непрерывно в течение 1,7 часа подавали смесь CF2/OF/2 /0,4 нл/час/, CO2/0,2 нл/час/ и гелия /3 нл/час/, в конце добавления реакцию завершили. Затем под потоком гелия /1 нл/час/ устранили избыток CF2/F/2.
После удаления из реакционной смеси большей части растворителя, фракционной перегонкой на тарельчатой колонне при атмосферном давлении выделили продукты реакции. Собрали фракцию, имеющую температуру кипения 77 - 80oC, состоящую из 5,6 г 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана. Выделенный таким образом диоксолан состоял из смеси двух изомеров, анти-изомера /33%/, где два атома хлора находятся в анти-положении и син-изомера /67%/, где два атома хлора находятся в син-положении. Превращение исходного олефина было законченным. Выход 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана, определяемый как отношение между молями полученного диоксолана и молями исходного CF2/OF/2, составил 66%.
Пример 5. Дегалогенирование 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана /2-ой способ/.
В 100 мл трехгорлую колбу, снабженную магнитной мешалкой, термометром, конденсатором, и соединенную с ловушкой, сохраняемой при -75oC, загрузили под азотом 2,0 г порошка цинка, активированного промывкой в 3NHCl, 12 мл DMF и 10 мг J2. Внутреннюю температуру довели до 90oC и добавили по каплям 1,66 г 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана, полученного как в примере 4. Во время добавления температура возросла до 94oC. Когда добавление закончили, реакционную смесь перемешивали в течение еще 30 минут при 90oC. В охлаждаемой ловушке конденсировали 0,950 г смеси, содержащей 80% 2,2,4-трифтор-5-трифторметокси-1,3-диоксола и 20% исходного продукта, имеющей то же самое отношение син/анти, как у исходного диоксолана. Выход диоксола, определяемый как отношение между молями полученного диоксола и молями прореагировавшего диоксолана, составил 69%.
Пример 5. бис. Дегалогенирование 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана /2-й способ/.
В 250 мл трехгорлую колбу, снабженную магнитной мешалкой, термометром, конденсатором и соединенную с ловушкой, сохраняемой при -75oC, загрузили под азотом 11,6 г порошка цинка, активированного промывкой 3NHCl, 105 мл DMF и 20 мг J2. Внутреннюю температуру довели до 45oC и добавили по каплям 40 г 4,5-дихлор-2,2,4-трифтор-5-трифторметокси-1, 3-диоксолана, полученного как в примере 4. Во время добавления температура возросла до 53oC. Когда добавление завершили, реакционную смесь перемешивали в течение еще одного часа при 45oC. В охлаждаемой ловушке конденсировали 24,0 г 2,2,4-трифтор-5-трифторметокси-1,3-диоксола, содержащего следы исходного продукта. Реактор довели до 20oC, а давление уменьшили до 300 мм Hg. Через 30 минут собрали 3,5 г смеси, содержащей 90% желаемого продукта, 3% исходного продукта и 7% диметилформамида. Выход диоксола, определяемый как отношение между молями полученного диоксола и молями прореагировавшего диоксолана, составил 91%.
Пример 6. Дегидрохлорирование 4-хлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана /3-й способ/.
В трубчатый стальной лабораторный реактор, имеющий диаметр 3 см и длину 50 см, снабженный впускным и выпускным отверстием для реагирующих газов, загрузили 170 г гранул КОН, предварительно смешанных со 170 г стеклянных колец в качестве набивки, из загруженного таким образом реактора откачали воздух /10-3 мм Hg/ и нагрели до 102oC. Впускное отверстие для реагирующих газов соединили с колбой, содержащей 3,7 миллимолей 4-хлор-2,2,4-трифтор-5-трифторметокси-1,3-диоксолана, хранимого при температуре -45oC, выпускное отверстие реактора соединили со сборной ловушкой, хранимой при -196oC. Пары исходного продукта из ловушки при -45oC пропустили через КОН, хранимый при 102oC, где они прореагировали, и собрали в ловушку при -196oC. 3, 4 миллимоля смеси, содержащей 2,4 миллимоля 2,2,4-трифтор-5-трифторметокси-1,3-диоксола и 0,9 миллимолей исходного продукта, собрали в ловушку при 193oC. Превращение 4-хлор-2,2, 4-трифтор-5-трифторметокси-1,3-диоксолана составило 75%, выход диоксола составил 85%.
Пример 7. Термообрабатываемый сополимер тетрафторэтилена.
Использовали 5 л хромированный стальной автоклав AISI 316, снабженный мешалкой, работающей при 650 оборотах в минуту. После откачивания воздуха загрузили 3 л деминерализованной воды, CHCl3 в качестве переносчика кинетической цепи в количестве 0,67 мл/л H2O и диоксол формулу /IV/ в количестве 2,1 г/л H2O/ эквивалентно 0,01 моля/л H2O и в конце водную микроэмульсию перфторполиэфира, полученного в соответствии с примером 1 патента США N 4864006, с тем чтобы было 2 г поверхностно-активного вещества на л H2O. Автоклав нагрели до +75oC. Добавляли газообразную смесь TFE /перфторметилвинилового эфира/FMVE/ при молярном соотношении 37,5/1 посредством компрессора до достижения давления 20 абсолютных бар. Состав газообразной смеси в автоклаве анализировали газовой хроматографией.
Перед началом реакции газовая фаза имела следующий состав: /% по молям/ 80,9% TFE, 15,8 FMVE, 3,2% диоксола. Затем посредством дозирующего насоса непрерывно подавали 0,0215 молярный раствор персульфата калия при скорости потока 88 мл/час.
Давление полимеризации сохраняли постоянным путем подачи вышеупомянутой
мономерной смеси, и когда было подано 780 г, реакцию завершили. Состав конечной газообразной фазы был следующим /% по молям/:
87,73% TFE, 12% FMVE, 0,27% диоксола. Реактор охладили до
комнатной температуры, эмульсию выгрузили и коагулировали добавлением HNO3 /65%/. Полимер выделили, промыли водой и сушили. В таблице 1 представлены данные, относящиеся к свойствам
полимера. Характеристики и свойства терполимера определяли следующим образом. Вязкость расплава определяли в соответствии со стандартом ASTMD-1238-52T, при использовании модифицированного устройства,
в котором цилиндр, фильера и поршень выполнены из коррозионно-стойкой стали.
В цилиндр, имеющий внутренний диаметр 9,53 мм, находящийся при температуре 372±1oC, поместили 5 г пробы. Через 5 минут расплавленный полимер экструдировали через капиллярную трубку, имеющую диаметр 2,10 мм и длину 8,0 мм при нагрузке 5 кг/поршень + дополнительный вес/, соответствующей сдвиговому напряжению 0,457 кг/см2.
Вязкость расплава в пуазах вычисляли на основе геометрии оборудования и получили путем деления 53150 на наблюдаемую скорость экструзии, выраженную в г/мин.
Состав терполимера определяли с помощью материального баланса. Температуру плавления определяли дифференциальной сканирующей калориметрией /DSC/, используя калориметр Perkkin Elmer модели IV. Около 10 мг анализируемой пробы нагревали от комнатной температуры до 350oC со скоростью 10oC/мин. Пробу поддерживали при температуре 350oC в течение 5 минут, а затем охлаждали до комнатной температуры со скоростью 10oC/мин. Нагревание при 350oC повторяли при тех же самых модальностях. Во время этой стадии регистрировали температуру, соответствующую максимуму кривой ликвидуса, и ее указывали в качестве "второй температуры плавления" - [Tm/II/].
Для определения механических свойств /растягивающего напряжения и относительного удлинения при разрыве, напряжения пластического течения, предела удлинения, модуля Юнга/ получили путем прямого прессования диски, имеющие толщину 1,58 ± 0,08 мм, в соответствии со стандартом ASTMD3307-81. Из них получали микрообразцы для измерения механических свойств в соответствии со стандартом ASTMD-1708. При всех этих измерениях скорость вытяжки составила 50 мм/мин. Обычно для пробы каждого полимера проводили три измерения при комнатной температуре, при 200oC и при 250oC.
Когда работали при высоких температурах, образец держали перед измерением при температуре испытаний в течение 5 минут.
Чтобы определить сопротивление напряжению, использовали стандартное оборудование, описанное в ASTMD-2176-63Т для MIT Flex Life (определения выносливости при многократном изгибе). Измерения проводили на образцах, полученных из пленки толщиной 0,3 мм. Образец закрепляли в зажимах оборудования и, кроме того, прикладывали нагрузку весом 1 кг. Пленку изгибали под углом 135o направо по отношению к вертикальной линии и под тем же самым углом налево со скоростью 175 циклов в минуту. Регистрировали количество циклов, необходимое для достижения поломки образцов. На каждой пробе проводили 6 измерений и вычисляли среднее значение.
Пример 8. Термообрабатываемый сополимер тетрафторэтилена
Использовали перфтордиоксол PD, описанный в Европейской заявке на патент N 080187, имеющий формулу:

Действовали таким образом, как в примере 7, с той лишь разницей, что подали 1,43 г перфтордиоксола PD на л H2O /эквивалентно 0,01 моля /л H2O/. Исходная газовая фаза имела следующий состав /% по молям/:
TFE - 84,8%, FMVE - 12,2%, PD - 3%, в то время как конечный состав был следующим: TFE 88, FMVE 12, PD0. В таблице 1 представлены данные, относящиеся к свойствам полимера. При рассмотрении таблицы 1 можно отметить, что термообрабатываемые сополимеры в соответствии с настоящим изобретением имеют температуру плавления и механические свойства несомненно лучшие, чем таковые термополимеров FEP.
Более того, при сравнении данных примера 7 /относящихся к новому перфтордиоксолу в соответствии с настоящим изобретением/ с данными примерами 8 /относящимися к известному перфтордиоксолу/, можно отметить, что первые неожиданно относятся к упомянутому сополимеру с "превосходной выносливостью при многократном изгибе" и улучшенными механическими свойствами при высоких температурах, особенно при 250oC, что касается разрушающего напряжения и относительного удлинения при разрыве.
Пример 9. Кристаллический сополимер C2F4 и TTD /2,2,4-трифтор-5-трифторметокси-1,3-диоксола/.
В 42 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов, поместили 8 мл CCl2FCF2Cl, 1,5 мл 0,35% раствора перфторпропионилпироксида в CCl2F2CF2Cl, 0,33 миллимоля 2,2,4-трифтор-5-трифторметокси-1,3-диоксола и 10 миллимолей тетрафторэтилена. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали в течение 8 часов при 40oC и перемешивании. Сырой реакционный продукт получили в виде гелеобразной массы. Реактор довели до температуры жидкого азота, соединили с вакуумным насосом и держали под давлением 10-3 миллибар; затем ему дали прогреться до комнатной температуры, разделяя выделенные пары посредством охлаждающих ловушек при -90oC, -120oC и -196oC. Ловушка при -90oC содержала только CF2 Cl2CF2Cl. Ловушка при -120oC содержала 0,70 миллимолей CFCl2CF2Cl и 0,23 миллимолей непрореагировавшего диоксола. Ловушка при -196oC содержала 1,10 молей непрореагировавшего C2F4.
После перегонки растворителя и непрореагировавших мономеров и упаривания полимера в вакууме при 120oC в течение 2-х часов выделяли 0,910 г полимера. Массовый баланс, определенный путем g.l.c. /газожидкостной хроматографии/ ловушек, содержащих непрореагировавшие мономеры, позволили вычислить мольное процентное содержание диоксола в полимере, которое составило 1,1%.
Температуру плавления определяли DSC /дифференциальной сканирующей калориметрией/: полимер расплавлялся при 305oC при ΔH плавления 9,8 кал/г; термогравиметрический анализ /TGA/ показал потерю веса 2% при 448oC и 10% при 530oC. Полимер подвергали прямому прессованию /при 330oC, 122 атм/ в прозрачную и прочную пленку.
Пример 10. Кристаллический сополимер C2F4 и TTD.
В 42 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов поместили 15 мл CCl2FCF2Cl, 3,0 мл 0,35% раствора перфторпропионилпероксида в CCl2FCF2Cl, 1,17 миллимолей 2,2,4-трифтор-5-трифторметокси-1,3-диоксола и 20 миллимолей тетрафторэтилена. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали в течение 8-ми часов при 40oC и перемешивании. Сырой реакционный продукт получили в виде гелеобразной массы. Реактор довели до температуры жидкого азота, соединили с вакуумным насосом и держали под давлением 10-3 миллибар; затем ему дали прогреться до комнатной температуры, разделяя выделенные пары посредством охлаждаемых ловушек при -85oC, -120oC и -196oC. Ловушка при -85oC содержала только CFCl2CF2Cl. Ловушка при -120oC содержала 2,90 миллимолей CFCl2CF2Cl и 0,60 миллимолей непрореагировавшего диоксола. Ловушка при -196oC содержала 3,27 моля непрореагировавшего C2F4. После перегонки растворителя и непрореагировавших мономеров и упаривания полимера в вакууме при 120oC в течение 3-х часов выделили 1,830 г полимера. Массовый баланс, определенный путем газожидкостной хроматографии ловушек, содержащих непрореагировавшие мономеры, позволил вычислить молярное процентное содержание диоксола в полимере, которое составило 3,3%.
Температуру плавления определяли DSC: полимер расплавлялся при 296,7oC при ΔH плавления 7,5 кал/г; термогравиметрический анализ /TGA/ показал потерю веса 2% при 457oC и 10% при 537oC. Процентное содержание кристалличности, вычисленное из ΔH плавления, составило 38%. Полимер подвергали прямому прессованию /при 330oC, 122 атм/ в прозрачную и прочную пленку.
Пример 11. Аморфный сополимер TTD и C2F4.
В 42 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов поместили 3 мл CCl2FCF2Cl, 0,5 мл 1,3% раствора перфторпропионилпероксида в CCl2FCF2Cl, 2,0 миллимоля 2,2,4-трифтор-5-трифтор-метокси-1,3-диоксола и 10,0 миллимолей тетрафторэтилена. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали при 40oC в течение 8-ми часов и перемешивании. Сырой реакционный продукт получили в виде гелеобразной массы. Реактор довели до температуры жидкого азота, соединили с вакуумным насосом и держали под давлением 10-3 миллибар, затем ему дали прогреться до комнатной температуры, разделяя выделенные пары посредством охлаждающих ловушек при -85oC, -120oC и -196oC. Ловушка при -85oC содержала только CFCl2CF2Cl. Ловушка при -120oC содержала 3,50 миллимолей CFCl2CF2Cl и 1,4 миллимолей непрореагировавшего диоксола. Ловушка при -196oC содержала 7,89 молей непрореагировавшего C2 F4. После перегонки растворителя и непрореагировавших мономеров и упаривания полимера в вакууме при 120oC в течение 3-х часов выделили 0,335 г белого твердого полимера, выход полимеризации составил 24%. Массовый баланс, определенный путем газожидкостной хроматографии ловушек, содержащих непрореагировавшие мономеры, позволил вычислить молярное процентное содержание диоксола в полимере, которое составило 22%. Температура стеклования /Tg/ полимера, определенная DSC, составила 74oC; ловушка DSC не показала температуру плавления: полимер был аморфным.
Термогравиметрический анализ показал потерю веса 2% при 410oC и 10% при 457oC.
Пример 12. Аморфный сополимер ТТD и C2F4.
В 31 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов поместили 1,0 мл CCl2FCF2Cl, 1,0 мл 1,3% раствора перфторпропионилпероксида в CCl2FCF2Cl, 5,0 миллимолей 2,2,4-трифтор-5-трифторметокси-1,3-диоксола и 10,0 миллимолей тетрафторэтилена. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали при 40oC в течение 8-ми часов при перемешивании.
Сырой реакционный продукт получили в виде гелеобразной массы. Реактор довели до температуры жидкого азота, соединили с вакуумным насосом и держали под давлением 10-3 миллибар, затем ему дали прогреться до комнатной температуры, разделяли выделенные пары посредством охлаждаемых ловушек при -85oC, -120oC и -196oC. Ловушка при -85oC содержала только CFCl2CF2Cl. Ловушка при -120oC содержала 2,40 миллимолей CFCl2CF2Cl и 4,42 миллимолей непрореагировавшего диоксола. Ловушка при -196oC содержала 8,8 молей непрореагировавшего C2F4. После перегонки растворителя и непрореагировавших мономеров и упаривания полимера в вакууме при 120oC в течение 3-х часов выделили 0,240 г белого твердого полимера. Массовый баланс, определенный путем газожидкостной хроматографии ловушек, содержащих непрореагировавшие мономеры, позволили вычислить молярное процентное содержание диоксола в полимере, которое составило 32%. Температура стеклования полимера /Tg/, определенная DSC, составила 82oC, ловушка DSC не показала температуру плавления: полимер был аморфным. Термогравиметрический анализ /TGA/ показал потерю веса 2% при 381oC и 10% при 421oC.
Пример 13. Гомополимер TTD.
В 18 мл стеклянный лабораторный реактор полимеризации, снабженый магнитной мешалкой и внутренним впускным отверстием для подачи и выгрузки реагентов поместили 1,0 мл 7% раствора перфторпропионилпероксида в CCl2FCF2Cl и 5,0 миллимолей 2,2,4-трифтор-5-трифторметокси-1,3-диоксола. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали при 60oC в течение 8-ми часов при перемешивании. После перегонки растворителя и непрореагировавшего мономера и упаривания полимера в вакууме при 80oC в течение 2-ч часов выделили 0,550 г жидкого, вязкого, прозрачного, растворимого в CFCl2CF2Cl полимера.
Из анализа19F-ЯМР явствует, что в среднем присутствовало 6 повторяющихся звеньев TTD, в то время как концевыми группами были только звенья -CF2CF3, производные от инициатора; наблюдали полное отсутствие групп -C/O/F; более того, анализ с помощью инфракрасной спектроскопии показал полное отсутствие карбонильных продуктов, что указывает на то, что кольцо TTD не раскрывается во время полимеризации.
Это представляет особый интерес, поскольку известно, что во время полимеризации фтордиоксолы предшествующего уровня в данной области показывают определенную степень раскрытия диоксильного кольца с образованием карбонильных групп, входящих в полимерную молекулу, и последующее уменьшение термостойкости полимера. Это явление описано в Международной заявке на патент WO91/04251, стр. 26.
Пример 14. Гомополимер TTD.
В 18 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов поместили 0,075 мл 7% раствора перфторпропионилпероксида в CCl2FCF2Cl и 5,0 миллимолей 2,2,4-трифтор-5-трифторметокси-1, 3-диоксола. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуре, реактор держали при 25oC в течение 48-ми часов при перемешивании. После перегонки растворителя и непрореагировавшего сомономера и упаривания полимера в вакууме при 200oC в течение 5-ти часов выделили 0,3 г белого твердого полимера в виде порошка. Анализ с помощью инфракрасной спектроскопии показал полное отсутствие карбонильных продуктов. Tg полимера, определенная DSC, составила 162oC; ловушка DSC не показала температуру плавления: полимер был аморфным. TGA показал потерю веса 2% при 331oC и 10% при 381oC.
Пример 15. Аморфный сополимер TTD и CF2= CH2.
В 31 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов поместили 3,0 мл CCl2FCF2Cl, 0,5 мл 1,3% раствора перфторпропионилпероксида в CCl2FCF2Cl, 2,0 миллимоля, 2,2,4-трифтор-5-трифторметокси-1,3-диоксола и 10,0 миллимолей винилиденфторида. Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали при 40oC в течение 8-ми часов при перемешивании.
Реактор довели до температуры жидкого азота, соединили с вакуумным насосом и держали под давлением 10-3 миллибар, затем ему дали прогреться до комнатной температуры, разделяя выделенные пары посредством охлаждаемых ловушек при -85oC, -120oC и -196oC. Ловушка при -85oC содержали только CFCl2CF2Cl. Ловушка при -120oC содержала 4,20 миллимолей CFCl2CF2Cl и 1,3 моля непрореагировавшего диоксола. Ловушка при -196oC содержала 8,7 молей непрореагировавшего CF2 = CH2. После перегонки растворителя и непрореагировавших мономеров и упаривания полимера в вакууме при 120oC в течение 3-х час выделили 0,230 г полимера. Массовый баланс, определенный путем газожидкостной хроматографии ловушек, содержащих непрореагировавшие мономеры, позволил вычислить молярное процентное содержание диоксола в полимере, которое составило 34%. Tg полимера, определенная DSC, составила 33,5oC; ловушка DSC не показала температуру плавления; полимер был аморфным. TGA показал потерю веса 20 при 355oC и 10% при 397o C.
Пример 16 /сравнительный/. Аморфный сополимер PD и CF2=CF2.
В 31 мл стеклянный лабораторный реактор полимеризации, снабженный магнитной мешалкой и впускным отверстием для подачи и выгрузки реагентов поместили 1,0 мл CCl2FCF2Cl, 1,0 мл 1,3% раствора перфторпропионилпероксида в CCl2FCF2Cl, 4,0 миллимолей перфтордиоксола PD и 8,0 миллимолей тетрафторэтилена.
Затем реактор довели до -196oC и откачали воздух. После того, как ему дали прогреться до комнатной температуры, реактор нагревали и держали при 40oC в течение 8-ми часов при перемешивании. После перегонки растворителя и непрореагировавших мономеров и упаривания полимера в вакууме при 120oC в течение 3-х часов выделили 1,2 г полимера. Массовый баланс, определенный путем газожидкостной хроматографии ловушек, содержащих непрореагировавшие мономеры, позволил вычислить молярное процентное содержание диоксола в полимере, которое составило 32%. Tg полимера, определенная DSC, составила 90oC; ловушка DSC показала температуру плавления при 314oC и ΔH плавления 3,8 кал/г; следовательно, полученный полимер не был полностью аморфным.
Реферат
Описываются новые перфтордиоксолы формулы I

где RF является перфторалкильным радикалом, имеющим от 1 до 5 углеродных атомов, X1 и X2 - одинаковые или отличаются друг от друга и являются F или CF3. Новый класс перфтордиоксолов позволяет получать гомополимеры и сополимеры с превосходными механическими свойствами и хорошей термоустойчивостью, пригодным для покрытия электрического кабеля экструзией из расплава. Описывается также способ получения соединений формулы I, гомополимеры и сополимеры перфтордиоксолов, термоперерабатываемые сополимеры тетрафторэтилена. 5 с. и 11 з.п. ф-лы, 1 табл.
Формула

где RF является перфторалкильным радикалом, имеющим от 1 до 5 углеродных атомов;
Х1 и Х2 одинаковые или отличаются друг от друга и являются F или CF3.

4. Способ получения перфтордиоксолов по п.1, заключающийся в том, что проводят: 1) взаимодействие при температуре от -140 до +60oC диоксола формулы II

где Х1 и Х2 одинаковые или отличаются друг от друга и являются F или CF3,
с фтороксисоединением формулы RFOF, в которой RF является перфторалкильным радикалом, имеющим от 1 до 5 углеродных атомов, с получением диоксолана формулы III

2) дегалогенирование диоксолана (III) путем взаимодействия с металлом в апротонном биполярном растворителе.

2) дегалогенирование диоксолана формулы III путем взаимодействия с металлом в апротонном биполярном растворителе.

или его смеси с диоксоланом формулы XII

где RF является перфторалкильной группой, имеющей от 1 до 5 углеродных атомов,
Х1 и Х2 одинаковые или отличаются друг от друга и являются F или CF3,
с гидроксидом калия в твердом состоянии.

где RF является перфторалкильным радикалом, имеющим от 1 до 5 углеродных атомов,
Х1 и Х2 одинаковые или отличаются друг от друга и являются F или CF3,
взятого в количестве от 0,05 до 3% по весу; с) тетрафторэтилена, взятого в таком количестве, что сумма процентных содержаний различных мономеров равна 100% по весу.

Комментарии