Бензопирановое соединение - RU2366658C2
Код документа: RU2366658C2
Описание
Настоящее изобретение относится к бензопирановым соединениям, обладающим пролонгирующим действием на рефрактерный период, которые применяются для лечения аритмии у млекопитающих, включая человека.
В качестве примера бензопирановых производных известны 4-ациламинобензопирановые производные, представленные Cromakalim (опубликованный патент Японии № Sho 58-67683). Известно, что данные 4-ациламинобензопирановые производные, представленные Cromakalim, открывают АТФ-чувствительные K+-каналы, а потому эффективны при лечении гипертонии и астмы, но об их применении при лечении аритмии, основанном на пролонгирующем действии на рефрактерный период, ранее не упоминалось.
В настоящее время при терапии с применением общепринятых противоаритмических средств, главным механизмом действия которых является пролонгирующее действие на рефрактерный период (такие как лекарства I класса в соответствии с классификацией противоаритмических средств по Vaughan Williams или принадлежащие к III классу d-соталол или дофетилид), наблюдаются проблемы, которые выражаются в индукции очень опасных аритмий, приводящих к внезапной смерти (среди прочих, таких как «трепетание-мерцание»), вследствие пролонгации потенциала действия в мышце желудочка, которая коррелирует с пролонгирующим действием на рефрактерный период. Поэтому крайне желательны лекарственные средства, обладающие меньшим побочным действием.
Авторы изобретения тщательно изучали бензопирановые соединения и неожиданно обнаружили, что соединение формулы (I) обладает пролонгирующим действием на рефрактерный период, избирательным по отношению к мышце предсердия и не влияющим на рефрактерный период и потенциал действия в мышце желудочка. Так было оформлено настоящее изобретение.
Настоящее изобретение относится к следующим аспектам:
(1) Бензопирановое соединение формулы (I)
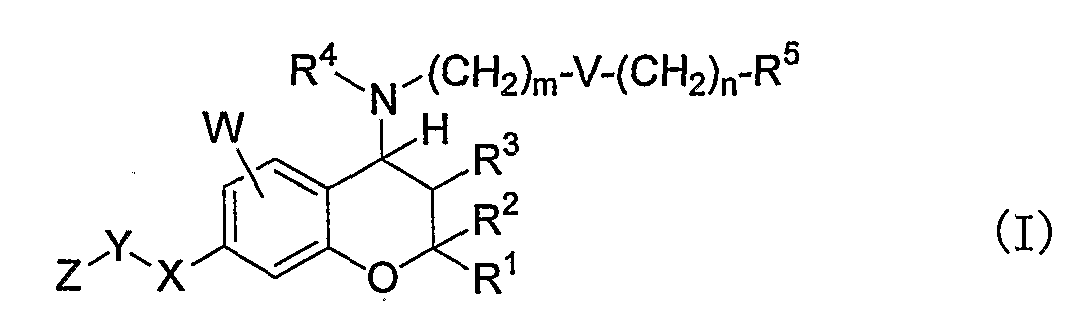
в которой X представляет собой NR6, где R6 представляет собой атом водорода или C1-4-алкильную группу;
Y представляет собой связь, SO или SO2;
Z представляет собой C1-4-алкильную группу (где
C1-4-алкильная группа может быть произвольно замещена 1-5 атомами галогена или фенильной группой (где фенильная группа может быть произвольно замещена C1-4-алкильной группой)) или фенильную группу (где фенильная группа может быть произвольно замещена C1-4-алкильной группой);
W представляет собой атом водорода, гидроксигруппу, C1-6-алкоксигруппу (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), атом галогена, C1-4-алкильную группу или C1-6-алкилсульфониламиногруппу;
R1 и R2 независимо друг от друга представляют собой C1-3-алкильную группу (где C1-3-алкильная группа может быть произвольно замещена гидроксигруппой, метоксигруппой, атомом галогена или трифторметоксигруппой);
R3 представляет собой атом водорода, гидроксигруппу или метоксигруппу;
m равно целому числу от 0 до 4;
n равно целому числу от 0 до 4;
V представляет собой одинарную связь, CR7R8, где R7 представляет собой
- C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, гидроксигруппой, C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), C6-14-арильной группой или C2-9-гетероарильной группой (где каждая C6-14-арильная группа или C2-9-гетероарильная группа может быть произвольно замещена 1-3 R10, где R10 представляет собой атом водорода; гидроксильную группу; C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, гидроксигруппой или C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена)); C1-6-алкоксигруппу (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена); нитрогруппу; цианогруппу; формильную группу; формамидную группу; сульфониламиногруппу; сульфонильную группу; аминогруппу; C1-6-алкиламиногруппу; ди-C1-6-алкиламиногруппу; C1-6-алкилкарбониламиногруппу; C1-6-алкилсульфониламиногруппу; аминокарбонильную группу; C1-6-алкиламинокарбонильную группу; ди-C1-6-алкиламинокарбонильную группу; C1-6-алкилкарбонильную группу; C1-6-алкоксикарбонильную группу; аминосульфонильную группу; C1-6-алкилсульфонильную группу; карбоксигруппу или C6-14-арилкарбонильную группу, и при наличии нескольких R10 они могут быть одинаковыми или отличаться друг от друга), C6-14-арильной группой или C2-9-гетероарильной группой (где каждая C6-14-арильная группа или C2-9-гетероарильная группа может быть произвольно замещена 1-3 R10, где значения R10 определены выше));
- гидроксигруппу или
- C1-6-алкоксигруппу (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), и R8 представляет собой
- атом водорода,
- C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, гидроксигруппой, C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена)),
- C6-14-арильную группу или C2-9-гетероарильную группу (где каждая C6-14-арильная группа или C2-9-гетероарильная группа может быть произвольно замещена 1-3 R11, где R11 представляет собой атом галогена; гидроксигруппу; C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, гидроксигруппой или C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена)); C1-6-алкоксигруппу (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена); нитрогруппу; цианогруппу; формильную группу; формамидную группу; сульфониламиногруппу; сульфонильную группу; аминогруппу; C1-6-алкиламиногруппу; ди-C1-6-алкиламиногруппу; C1-6-алкилкарбониламиногруппу; C1-6-алкилсульфониламиногруппу; аминокарбонильную группу; C1-6-алкиламинокарбонильную группу; ди-C1-6-алкиламинокарбонильную группу; C1-6-алкилкарбонильную группу; C1-6-алкоксикарбонильную группу; аминосульфонильную группу; C1-6-алкилсульфонильную группу; карбоксигруппу или C6-14-арилкарбонильную группу, и при наличии нескольких R11 они могут быть одинаковыми или отличаться друг от друга),
- гидроксигруппу или
- C1-6-алкоксигруппу (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), или R7 вместе с R8 могут представлять собой O или S, или
V представляет собой NR9, где R9 представляет собой водород или C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), гидроксигруппой, C6-14-арильной группой или C2-9-гетероарильной группой (где каждая C6-14-арильная группа или C2-9-гетероарильная группа может быть произвольно замещена 1-3 R11, где
значения R11 определены выше)); или O, S, SO или SO2;
R4 представляет собой водород или C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена) или гидроксигруппой); и
R5 представляет собой
- атом водорода,
- C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), аминогруппой, карбоксигруппой или гидроксигруппой),
- C3-8-циклоалкильную группу или C3-8-циклоалкенильную группу (где C3-8-циклоалкильная группа или C3-8-циклоалкенильная группа может быть произвольно замещена атомом галогена, C1-6-алкильной группой (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), аминогруппой, карбоксигруппой или гидроксигруппой), C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена), аминогруппой, карбоксигруппой или гидроксигруппой), или
- C6-14-арильную группу или C2-9-гетероарильную группу (где каждая C6-14-арильная группа или C2-9-гетероарильная группа может быть произвольно замещена 1-3 R12, где R12 представляет собой атом галогена; гидроксигруппу; C1-6-алкильную группу (где C1-6-алкильная группа может быть произвольно замещена атомом галогена, гидроксигруппой или C1-6-алкоксигруппой (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена)); C1-6-алкоксигруппу (где C1-6-алкоксигруппа может быть произвольно замещена атомом галогена); нитрогруппу; цианогруппу; формильную группу; формамидную группу; сульфониламиногруппу; сульфонильную группу; аминогруппу; C1-6-алкиламиногруппу; ди-C1-6-алкиламиногруппу; C1-6-алкилкарбониламиногруппу; C1-6-алкилсульфониламиногруппу; аминокарбонильную группу; C1-6-алкиламинокарбонильную группу; ди-C1-6-алкиламинокарбонильную группу; C1-6-алкилкарбонильную группу; C1-6-алкоксикарбонильную группу; аминосульфонильную группу; C1-6-алкилсульфонильную группу; карбоксигруппу, C6-14-арилкарбонильную группу, уреидогруппу, C1-6-алкилуреиленовую группу, C6-14-арил-C1-6-алкиламиногруппу,
C1-6-алкоксикарбониламиногруппу; C6-14-арилоксигруппу, или C6-14-арилкарбониламиногруппу, и при наличии нескольких R12 они могут быть одинаковыми или отличаться друг от друга);
(2) Бензопирановое соединение по п. (1), в котором и R1, и R2 представляют собой метильную группу, R3 представляет собой гидроксигруппу, и V представляет собой одинарную связь;
(3) Бензопирановое соединение по п. (1), в котором и R1, и R2 представляют собой метильную группу, R3 представляет собой гидроксигруппу, и V представляет
собой CR7R8;
(4) Бензопирановое соединение по п. (1), в котором и R1, и R2 представляют собой метильную группу, R3 представляет собой гидроксигруппу, и V представляет
собой NR9;
(5) Бензопирановое соединение по п. (2), в котором R5 представляет собой C1-6-алкильную группу, C3-8-циклоалкил или C6-14-арил;
(6) Бензопирановое соединение по п. (3), в котором R5 представляет собой C1-6-алкильную группу, C3-8-циклоалкил или C6-14-арил;
(7) Бензопирановое соединение по п. (4), в котором R5 представляет собой C1-6-алкильную группу, C3-8-циклоалкил или C6-14-арил;
(8) Бензопирановое соединение по п. (5), в котором W представляет собой атом водорода, гидроксигруппу, метоксигруппу, атом хлора, атом брома, метильную группу, этильную группу или метилсульфониламиногруппу;
(9) Бензопирановое соединение по п. (6), в котором W представляет собой атом водорода, гидроксигруппу, метоксигруппу, атом хлора, атом брома, метильную группу, этильную группу или метилсульфониламиногруппу;
(10) Бензопирановое соединение по п. (8), в котором R5 представляет собой C1-6-алкильную группу или C6-14-арил, R6 представляет собой атом водорода или метильную группу, Y представляет собой SO2, и Z представляет собой C1-4-алкильную группу;
(11) Бензопирановое соединение по п. (8), в котором R5 представляет собой C1-6-алкильную группу или C6-14-арил, R6 представляет собой атом водорода или метильную группу, Y представляет собой связь, и Z представляет собой C1-4-алкильную группу;
(12) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид;
(13) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3,6-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид;
(14) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}-N-метилметансульфонамид;
(15) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-4-[(2-циклогексилэтил)амино]-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид;
(16) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-пентиламино-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид;
(17) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3-гидрокси-2,2,8-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид;
(18) Бензопирановое соединение, которое представляет собой малеат N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида;
(19) Бензопирановое соединение, которое представляет собой гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}этансульфонамида;
(20) Бензопирановое соединение, которое представляет собой малеат 1,1,1-трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида;
(21) Бензопирановое соединение, которое представляет собой гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}-N-метилметансульфонамида;
(22) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-6-бром-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид;
(23) Бензопирановое соединение, которое представляет собой гидрохлорид (3R*,4S*)-2,2-диметил-7-диметиламино-4-[(2-фенилэтил)амино]-3-хроманола;
(24) Бензопирановое соединение, которое представляет собой гидрохлорид (3R*,4S*)-2,2-диметил-7-метиламино-4-[(2-фенилэтил)амино]-3-хроманола;
(25) Бензопирановое соединение, которое представляет собой гидрохлорид (3R*,4S*)-4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-7-диметиламино-3-хроманола;
(26) Бензопирановое соединение, которое представляет собой (3R*,4S*)-6-метокси-2,2-диметил-7-диметиламино-4-[(2-фенилэтил)амино]-3-хроманол;
(27) Бензопирановое соединение, которое представляет собой гидрохлорид (3R*,4S*)-6-метокси-2,2-диметил-7-метиламино-4-[(2-фенилэтил)амино]-3-хроманола;
(28) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}-4-метилбензолсульфонамид.
(29) Бензопирановое соединение, которое представляет собой N-{(3R*,4S*)-3-гидрокси-2,2-диметил-6-[(метилсульфонил)амино]-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид.
(30) Бензопирановое соединение, которое представляет собой гидрохлорид (3R*,4S*)-2,2-диметил-7-метилэтиламино-4-[(2-фенилэтил)амино]-3-хроманола.
(31) Бензопирановое соединение, которое представляет собой гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-хромен-7-ил}-N-изопропилметансульфонамида.
(32) Фармацевтический препарат, характеризующийся содержанием бензопиранового соединения по любому из пп. (1)-(31) или его фармацевтически приемлемой соли в качестве активного ингредиента; и
(33) Фармацевтический препарат для лечения аритмии, характеризующийся содержанием бензопиранового соединения по любому из пп. (1)-(31) или его фармацевтически приемлемой соли в качестве активного ингредиента.
Соединение по настоящему изобретению обладает мощным пролонгирующим действием на рефрактерный период и может применяться в качестве лекарства для лечения аритмии.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее подробно определены соответствующие заместители соединений (I) по настоящему изобретению.
При этом в данном описании изобретения «n» означает «нормальный», «i» означает «изо», «s» означает «вторичный», «t» означает «третичный», «c» означает «цикло», «o» означает «орто», «m» означает «мета», «p» означает «пара», «Me» означает «метил», «Et» означает «этил», «Pr» означает «пропил», «Ms» означает «метансульфонил», «Ts» означает «пара-толилсульфонил», «Ph» означает «фенил», и «Ac» означает «ацетил».
Примерами C1-3-алкильной группы являются такие группы, как метил, этил, н-пропил, изопропил, и тому подобное.
Примерами C1-4-алкильной группы являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, и тому подобное.
Примерами C1-6-алкильной группы являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, 1-пентил, 2-пентил, 3-пентил, изопентил, неопентил, 2,2-диметилпропил, 1-гексил, 2-гексил, 3-гексил, 1-метил-н-пентил, 1,1,2-триметил-н-пропил, 1,2,2-триметил-н-пропил, 3,3-диметил-н-бутил, и тому подобное.
В качестве предпочтительных C1-6-алкильных групп могут быть упомянуты метил, этил, н-пропил, изопропил и н-бутил.
Примерами атома галогена являются такие атомы, как атом фтора, атом хлора, атом брома и атом йода. В качестве предпочтительных атомов галогена могут быть упомянуты атом фтора и атом хлора.
Примерами C1-6-алкоксигруппы являются такие группы, как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, 1-пентилокси, 2-пентилокси, 3-пентилокси, изопентилокси, неопентилокси, 2,2-диметилпропилокси, 1-гексилокси, 2-гексилокси, 3-гексилокси, 1-метил-н-пентилокси, 1,1,2-триметил-н-пропокси, 1,2,2-триметил-н-пропокси, 3,3-диметил-н-бутокси, и тому подобное.
В качестве предпочтительных C1-6-алкоксигрупп могут быть упомянуты метокси, этокси, н-пропокси и изопропокси.
Примерами C6-14-арильной группы являются такие группы, как фенил, орто-бифенилил, мета-бифенилил, пара-бифенилил, α-нафтил, β-нафтил, 1-антрил, 2-антрил, 9-антрил, 1-фенантрил, 2-фенантрил, 3-фенантрил, 4-фенантрил, 9-фенантрил, и тому подобное.
В качестве предпочтительной C6-14-арильной группы может быть упомянут фенил.
C2-9-гетероарильная группа включает C2-6-однокольцевую гетероциклическую группу с 5-7-членным кольцом и конденсированную C5-9-двухкольцевую гетероциклическую группу с числом атомов от 8 до 10, которая может содержать 1-3 гетероатомов, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы, по отдельности или в сочетании.
Примерами C2-6-однокольцевой гетероциклической группы с 5-7-членным кольцом являются такие группы как 2-тиенильная группа, 3-тиенильная группа, 2-фурильная группа, 3-фурильная группа, 2-пиранильная группа, 3-пиранильная группа, 4-пиранильная группа, 1-пирролильная группа, 2-пирролильная группа, 3-пирролильная группа, 1-имидазолильная группа, 2-имидазолильная группа, 4-имидазолильная группа, 1-пиразолильная группа, 3-пиразолильная группа, 4-пиразолильная группа, 2-тиазолильная группа, 4-тиазолильная группа, 5-тиазолильная группа, 3-изотиазолильная группа, 4-изотиазолильная группа, 5-изотиазолильная группа, 2-оксазолильная группа, 4-оксазолильная группа, 5-оксазолильная группа, 3-изооксазолильная группа, 4-изооксазолильная группа, 5-изооксазолильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пирадинильная группа, 2-пиримидинильная группа, 4-пиримидинильная группа, 5-пиримидинильная группа, 3-пиридaзинильная группа, 4-пиридaзинильная группа, 2-1,3,4-оксадиазолильная группа, 2-1,3,4-тиадиазолильная группа, 3-1,2,4-оксадиазолильная группа, 5-1,2,4-оксадиазолильная группа, 3-1,2,4-тиадиазолильная группа, 5-1,2,4-тиадиазолильная группа, 3-1,2,5-оксадиазолильная группа, 3-1,2,5-тиадиазолильная группа, и тому подобное.
Примерами конденсированной C5-9-двухкольцевой гетероциклической группы с числом атомов от 8 до 10 являются 2-бензофуранильная группа, 3-бензофуранильная группа, 4-бензофуранильная группа, 5-бензофуранильная группа, 6-бензофуранильная группа, 7-бензофуранильная группа, 1-изобензофуранильная группа, 4-изобензофуранильная группа, 5-изобензофуранильная группа, 2-бензотиенильная группа, 3-бензотиенильная группа, 4-бензотиенильная группа, 5-бензотиенильная группа, 6-бензотиенильная группа, 7-бензотиенильная группа, 1-изобензотиенильная группа, 4-изобензотиенильная группа, 5-изобензотиенильная группа, 2-хроменильная группа, 3-хроменильная группа, 4-хроменильная группа, 5-хроменильная группа, 6-хроменильная группа, 7-хроменильная группа, 8-хроменильная группа, 1-индолизинильная группа, 2-индолизинильная группа, 3-индолизинильная группа, 5-индолизинильная группа, 6-индолизинильная группа, 7-индолизинильная группа, 8-индолизинильная группа, 1-изоиндолильная группа, 2-изоиндолильная группа, 4-изоиндолильная группа, 5-изоиндолильная группа, 1-индолильная группа, 2-индолильная группа, 3-индолильная группа, 4-индолильная группа, 5-индолильная группа, 6-индолильная группа, 7-индолильная группа, 1-индазолильная группа, 2-индазолильная группа, 3-индазолильная группа, 4-индазолильная группа, 5-индазолильная группа, 6-индазолильная группа, 7-индазолильная группа, 1-пуринильная группа, 2-пуринильная группа, 3-пуринильная группа, 6-пуринильная группа, 7-пуринильная группа, 8-пуринильная группа, 2-хинолильная группа, 3-хинолильная группа, 4-хинолильная группа, 5-хинолильная группа, 6-хинолильная группа, 7-хинолильная группа, 8-хинолильная группа, 1-изохинолильная группа, 3-изохинолильная группа, 4-изохинолильная группа, 5-изохинолильная группа, 6-изохинолильная группа, 7-изохинолильная группа, 8-изохинолильная группа, 1-фталазинильная группа, 5-фталазинильная группа, 6-фталазинильная группа, 1-2,7-нафтиридинильная группа, 3-2,7-нафтиридинильная группа, 4-2,7-нафтиридинильная группа, 1-2,6-нафтиридинильная группа, 3-2,6-нафтиридинильная группа, 4-2,6-нафтиридинильная группа, 2-1,8-нафтиридинильная группа, 3-1,8-нафтиридинильная группа, 4-1,8-нафтиридинильная группа, 2-1,7-нафтиридинильная группа, 3-1,7-нафтиридинильная группа, 4-1,7-нафтиридинильная группа, 5-1,7-нафтиридинильная группа, 6-1,7-нафтиридинильная группа, 8-1,7-нафтиридинильная группа, 2-1,6-нафтиридинильная группа, 3-1,6-нафтиридинильная группа, 4-1,6-нафтиридинильная группа, 5-1,6-нафтиридинильная группа, 7-1,6-нафтиридинильная группа, 8-1,6-нафтиридинильная группа, 2-1,5-нафтиридинильная группа, 3-1,5-нафтиридинильная группа, 4-1,5-нафтиридинильная группа, 6-1,5-нафтиридинильная группа, 7-1,5-нафтиридинильная группа, 8-1,5-нафтиридинильная группа, 2-хиноксалинильная группа, 5-хиноксалинильная группа, 6-хиноксалинильная группа, 2-хиназолинильная группа, 4-хиназолинильная группа, 5-хиназолинильная группа, 6-хиназолинильная группа, 7-хиназолинильная группа, 8-хиназолинильная группа, 3-циннолинильная группа, 4-циннолинильная группа, 5-циннолинильная группа, 6-циннолинильная группа, 7-циннолинильная группа, 8-циннолинильная группа, 2-птеридинильная группа, 4-птеридинильная группа, 6-птеридинильная группа, 7-птеридинильная группа, и тому подобное.
В качестве предпочтительных могут быть упомянуты 2-пиридильная группа, 3-пиридильная группа и 4-пиридильная группа.
Примерами C1-6-алкиламиногруппы являются такие группы, как метиламино, этиламино, н-пропиламино, изопропиламино, циклопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, циклобутиламино, 1-пентиламино, 2-пентиламино, 3-пентиламино, изопентиламино, неопентиламино, трет-пентиламино, циклопентиламино, 1-гексиламино, 2-гексиламино, 3-гексиламино, циклогексиламино, 1-метил-н-пентиламино, 1,1,2-триметил-н-пропиламино, 1,2,2-триметил-н-пропиламино, 3,3-диметил-н-бутиламино, и тому подобное.
В качестве предпочтительных C1-6-алкиламиногрупп могут быть упомянуты метиламино, этиламино, н-пропиламино, изопропиламино и н-бутиламино.
Примерами ди-C1-6-алкиламиногруппы являются такие группы, как диметиламино, диэтиламино, ди-н-пропиламино, диизопропиламино, дициклопропиламино, ди-н-бутиламино, диизобутиламино, ди-втор-бутиламино, ди-трет-бутиламино, дициклобутиламино, ди-1-пентиламино, ди-2-пентиламино, ди-3-пентиламино, диизопентиламино, динеопентиламино, ди-трет-пентиламино, дициклопентиламино, ди-1-гексиламино, ди-2-гексиламино, ди-3-гексиламино, дициклогексиламино, ди-(1-метил-н-пентил)амино, ди-(1,1,2-триметил-н-пропил)амино, ди-(1,2,2-триметил-н-пропил)амино, ди-(3,3-диметил-н-бутил)амино, иетил(этил)амино, метил(н-пропил)амино, метил(изопропил)амино, метил(циклопропил)амино, метил(н-бутил)амино, метил(изобутил)амино, метил(втор-бутил)амино, метил(трет-бутил)амино, метил(циклобутил)амино, этил(н-пропил)амино, этил(изопропил)амино, этил(циклопропил)амино, этил(н-бутил)амино, этил(изобутил)амино, этил(втор-бутил)амино, этил(трет-бутил)амино, этил(циклобутил)амино, н-пропил(изопропил)амино, н-пропил(циклопропил)амино, н-пропил(н-бутил)амино, н-пропил(изобутил)амино, н-пропил(втор-бутил)амино, н-пропил(трет-бутил)амино, н-пропил(циклобутил)амино, изопропил(циклопропил)амино, изопропил(н-бутил)амино, изопропил(изобутил)амино, изопропил(втор-бутил)амино, изопропил(трет-бутил)амино, изопропил(циклобутил)амино, циклопропил(н-бутил)амино, циклопропил(изобутил)амино, циклопропил(втор-бутил)амино, циклопропил(трет-бутил)амино, циклопропил(циклобутил)амино, н-бутил(изобутил)амино, н-бутил(втор-бутил)амино, н-бутил(трет-бутил)амино, н-бутил(циклобутил)амино, изобутил(втор-бутил)амино, изобутил(трет-бутил)амино, изобутил(циклобутил)амино, втор-бутил(трет-бутил)амино, втор-бутил(циклобутил)амино, трет-бутил(циклобутил)амино, и тому подобное.
В качестве предпочтительных ди-C1-6-алкиламиногрупп могут быть упомянуты диметиламино, диэтиламино, ди-н-пропиламино, диизопропиламино и ди-н-бутиламино.
Примерами C1-6-алкилкарбониламиногруппы являются такие группы, как метилкарбониламино, этилкарбониламино, н-пропилкарбониламино, изопропилкарбониламино, н-бутилкарбониламино, изобутилкарбониламино, втор-бутилкарбониламино, трет-бутилкарбониламино, 1-пентилкарбониламино, 2-пентилкарбониламино, 3-пентилкарбониламино, изопентилкарбониламино, неопентилкарбониламино, трет-пентилкарбониламино, 1-гексилкарбониламино, 2-гексилкарбониламино, 3-гексилкарбониламино, и тому подобное.
В качестве предпочтительных C1-6-алкилкарбониламиногрупп могут быть упомянуты метилкарбониламино, этилкарбониламино, н-пропилкарбониламино, изопропилкарбониламино и н-бутилкарбониламино.
Примерами C1-6-алкилсульфониламиногруппы являются такие группы, как метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изопропилсульфониламино, н-бутилсульфониламино, изобутилсульфониламино, втор-бутилсульфониламино, трет-бутилсульфониламино, 1-пентилсульфониламино, 2-пентилсульфониламино, 3-пентилсульфониламино, изопентилсульфониламино, неопентилсульфониламино, трет-пентилсульфониламино, 1-гексилсульфониламино, 2-гексилсульфониламино, 3-гексилсульфониламино, и тому подобное.
В качестве предпочтительных C1-6-алкилсульфониламиногрупп могут быть упомянуты метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изопропилсульфониламино и н-бутилсульфониламино.
Примерами C1-6-алкиламинокарбонильной группы являются такие группы, как метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил, н-бутиламинокарбонил, изобутиламинокарбонил, втор-бутиламинокарбонил, трет-бутиламинокарбонил, 1-пентиламинокарбонил, 2-пентиламинокарбонил, 3-пентил-аминокарбонил, изопентиламинокарбонил, неопентиламинокарбонил, трет-пентиламинокарбонил, 1-гексиламинокарбонил, 2-гексиламинокарбонил, 3-гексиламинокарбонил, и тому подобное.
В качестве предпочтительных C1-6-алкиламинокарбонильных групп могут быть упомянуты метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил и н-бутиламинокарбонил.
Примерами ди-C1-6-алкиламинокарбонильной группы являются такие группы, как диметиламинокарбонил, диэтиламинокарбонил, ди-н-пропиламинокарбонил, диизопропиламинокарбонил, дициклопропиламинокарбонил, ди-н-бутиламинокарбонил, диизобутиламинокарбонил, ди-втор-бутиламинокарбонил, ди-трет-бутиламинокарбонил, дициклобутиламинокарбонил, ди-1-пентиламинокарбонил, ди-2-пентиламинокарбонил, ди-3-пентиламинокарбонил, диизопентиламинокарбонил, ди-неопентиламинокарбонил, ди-трет-пентиламинокарбонил, дициклопентиламинокарбонил, ди-1-гексиламинокарбонил, ди-2-гексиламинокарбонил, ди-3-гексиламинокарбонил, и тому подобное.
В качестве предпочтительных ди-C1-6-алкиламинокарбонильных групп могут быть упомянуты диметиламинокарбонил, диэтиламинокарбонил, ди-н-пропиламинокарбонил, диизопропиламинокарбонил, дициклопропиламинокарбонил и ди-н-бутиламинокарбонил.
Примерами C1-6-алкилкарбонильной группы являются такие группы, как метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, трет-бутилкарбонил, 1-пентилкарбонил, 2-пентилкарбонил, 3-пентилкарбонил, изопентилкарбонил, неопентилкарбонил, трет-пентилкарбонил, 1-гексилкарбонил, 2-гексилкарбонил, 3-гексилкарбонил, и тому подобное.
В качестве предпочтительных C1-6-алкилкарбонильных групп могут быть упомянуты метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил и н-бутилкарбонил.
Примерами C1-6-алкоксикарбонильной группы являются такие группы, как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, 1-пентилоксикарбонил, 2-пентилоксикарбонил, 3-пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил, трет-пентилоксикарбонил, 1-гексилоксикарбонил, 2-гексилоксикарбонил, 3-гексилоксикарбонил, и тому подобное.
В качестве предпочтительных C1-6-алкоксикарбонильных групп могут быть упомянуты метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил и трет-бутоксикарбонил.
Примерами C1-6-алкилсульфонильной группы являются такие группы, как метансульфонил, этансульфонил, и тому подобное.
Примерами C6-14-арилкарбонильной группы являются такие группы, как бензоил, пара-метилбензоил, пара-трет-бутилбензоил, пара-метоксибензоил, пара-хлорбензоил, пара-нитробензоил, пара-цианобензоил, орто-бифенилилкарбонил, мета-бифенилилкарбонил, пара-бифенилилкарбонил, α-нафтилкарбонил, β-нафтилкарбонил, 1-антрилкарбонил, 2-антрилкарбонил, 9-антрилкарбонил, 1-фенантрилкарбонил, 2-фенантрилкарбонил, 3-фенантрилкарбонил, 4-фенантрилкарбонил, 9-фенантрилкарбонил, и тому подобное.
В качестве предпочтительных C6-14-арилкарбонильных групп могут быть упомянуты бензоил, пара-нитробензоил и пара-цианобензоил.
Примерами C1-6-алкилуреиленовой группы являются такие группы, как метилуреилен, этилуреилен, н-пропилуреилен, изопропилуреилен, н-бутилуреилен, изобутилуреилен, втор-бутилуреилен, трет-бутилуреилен, 1-пентилуреилен, 2-пентилуреилен, 3-пентилуреилен, изопентилуреилен, неопентилуреилен, 2,2-диметилпропилуреилен, 1-гексилуреилен, 2-гексилуреилен, 3-гексилуреилен, 1-метил-н-пентилуреилен, 1,1,2-триметил-н-пентилуреилен, 1,2,2-триметил-н-пентилуреилен, 3,3-диметил-н-бутилуреилен, и тому подобное.
Примерами C6-14-арил-C1-6-алкильной группы являются такие группы, как бензил, 1-фенэтил, 2-фенэтил, 1-фенилпропил, 2-фенилпропил, 3-фенилпропил, 4-фенилбутил, 5-фенилпентил, 6-фенилгексил, 1-нафтилметил, 2-нафтиметил, и тому подобное.
В качестве предпочтительных C6-14-арил-C1-6-алкильных групп могут быть упомянуты бензил, 2-фенэтил и 3-фенилпропил.
Примерами C1-6-алкоксикарбониламиногруппы являются такие группы, как метоксикарбониламино, этоксикарбониламино, н-пропоксикарбониламино, изопропоксикарбониламино, н-бутоксикарбониламино, изобутоксикарбониламино, втор-бутоксикарбониламино, трет-бутоксикарбониламино, 1-пентилоксикарбониламино, 2-пентилоксикарбониламино, 3-пентилоксикарбониламино, изопентилоксикарбониламино, неопентилоксикарбониламино, трет-пентилоксикарбониламино, 1-гексилоксикарбониламино, 2-гексилоксикарбониламино, 3-гексилоксикарбониламино, и тому подобное.
Примерами C6-14-арилоксигруппы являются такие группы, как фенокси, пара-метилфенокси, пара-трет-бутилфенокси, пара-метоксифенокси, пара-хлорфенокси, пара-нитрофенокси, пара-цианофенокси, орто-бифенилилокси, мета-бифенилилокси, пара-бифенилилокси, α-нафтилокси, β-нафтилокси, 1-анторилокси, 2-анторилокси, 9-анторилокси, 1-фенантрилокси, 2-фенантрилокси, 3-фенантрилокси, 4-фенантрилокси, 9-фенантрилокси, и тому подобное.
Примерами C6-14-арилкарбониламино группы являются такие группы, как бензоиламино, пара-метилбензоиламино, пара-трет-бутилбензоиламино, пара-метоксибензоиламино, пара-хлорбензоиламино, пара-нитробензоиламино, пара-цианобензоиламино, орто-бифенилилкарбониламино, мета-бифенилилкарбониламино, пара-бифенилилкарбониламино, α-нафтилкарбониламино, β-нафтилкарбониламино, 1-антрилкарбониламино, 2-антрилкарбониламино, 9-антрилкарбониламино, 1-фенантрилкарбониламино, 2-фенантрилкарбониламино, 3-фенантрилкарбониламино, 4-фенантрилкарбониламино, 9-фенантрилкарбониламино, и тому подобное.
Примерами C3-8-циклоалкильной группы являются такие группы, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, и тому подобное.
В качестве предпочтительных C3-8-циклоалкильных групп могут быть упомянуты циклопропил, циклобутил и циклогексил.
Примерами C3-8-циклоалкенильной группы являются такие группы, как 1-циклопентенил, 2-циклопентенил, 3-циклопентенил, 1-метил-2-циклопентенил, 1-метил-3-циклопентенил, 2-метил-1-циклопентенил, 2-метил-2-циклопентенил, 2-метил-3-циклопентенил, 2-метил-4-циклопентенил, 2-метил-5-циклопентенил, 2-метиленциклопентил, 3-метил-1-циклопентенил, 3-метил-2-циклопентенил, 3-метил-3-циклопентенил, 3-метил-4-циклопентенил, 3-метил-5-циклопентенил, 3-метиленциклопентил, 1-циклогексенил, 2-циклогексенил, 3-циклогексенил, 1-циклогептинил, 2-циклогептинил, 3-циклогептинил, 4-циклогептинил, 1-циклооктинил, 2-циклооктинил, 3-циклооктинил, 4-циклооктинил, и тому подобное.
В качестве предпочтительных C3-8-циклоалкенильных групп могут быть упомянуты 1-циклопентенил, 2-циклопентенил, 3-циклопентенил, 1-циклогексенил, 2-циклогексенил и 3-циклогексенил.
Конкретные примеры заместителей соединений, используемые в настоящем изобретении, являются следующими.
Конкретным примером R1 и R2 предпочтительно является метил.
Конкретным примером R3 предпочтительно является гидроксигруппа.
Конкретным примером R4 предпочтительно является атом водорода.
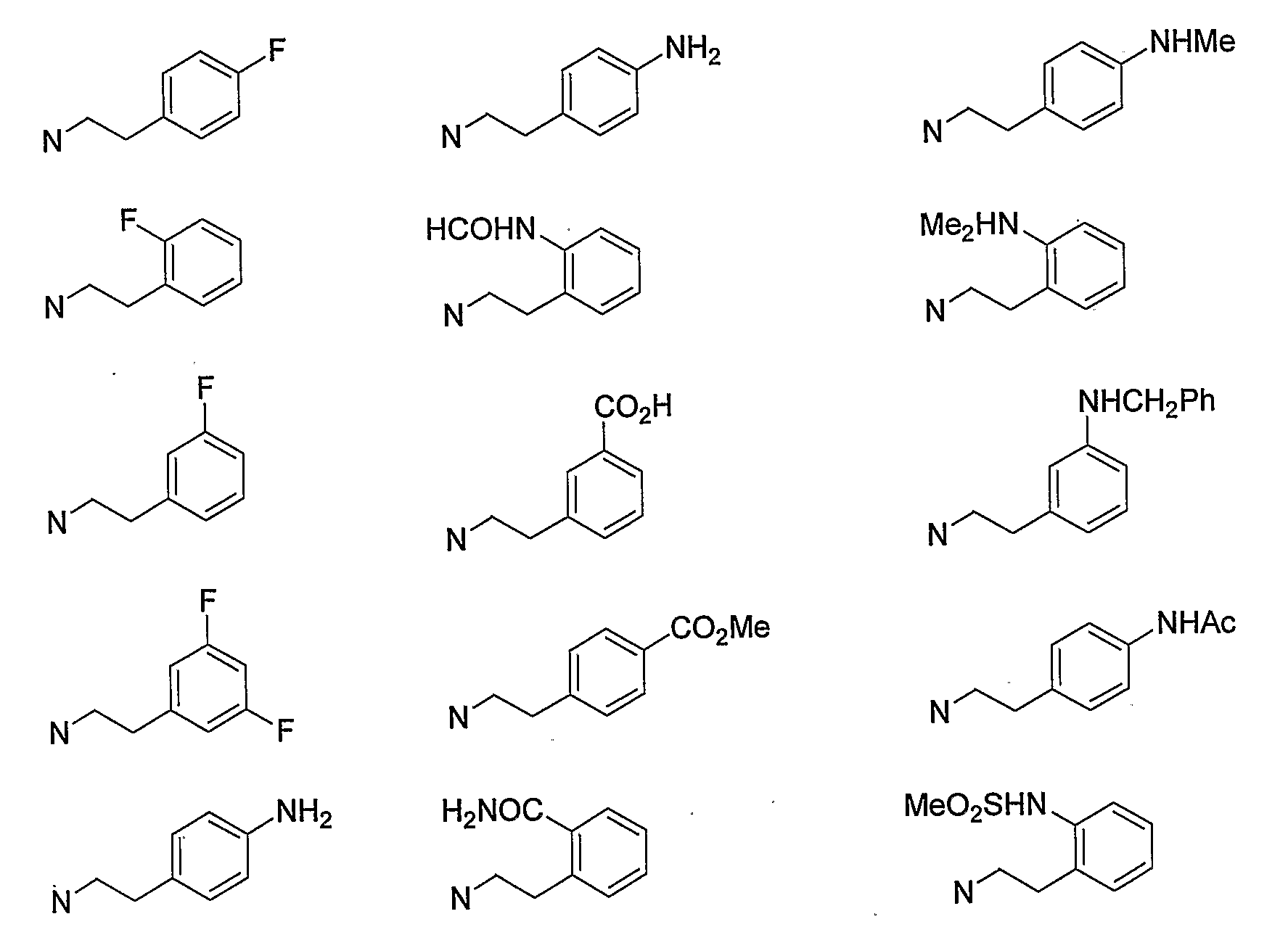
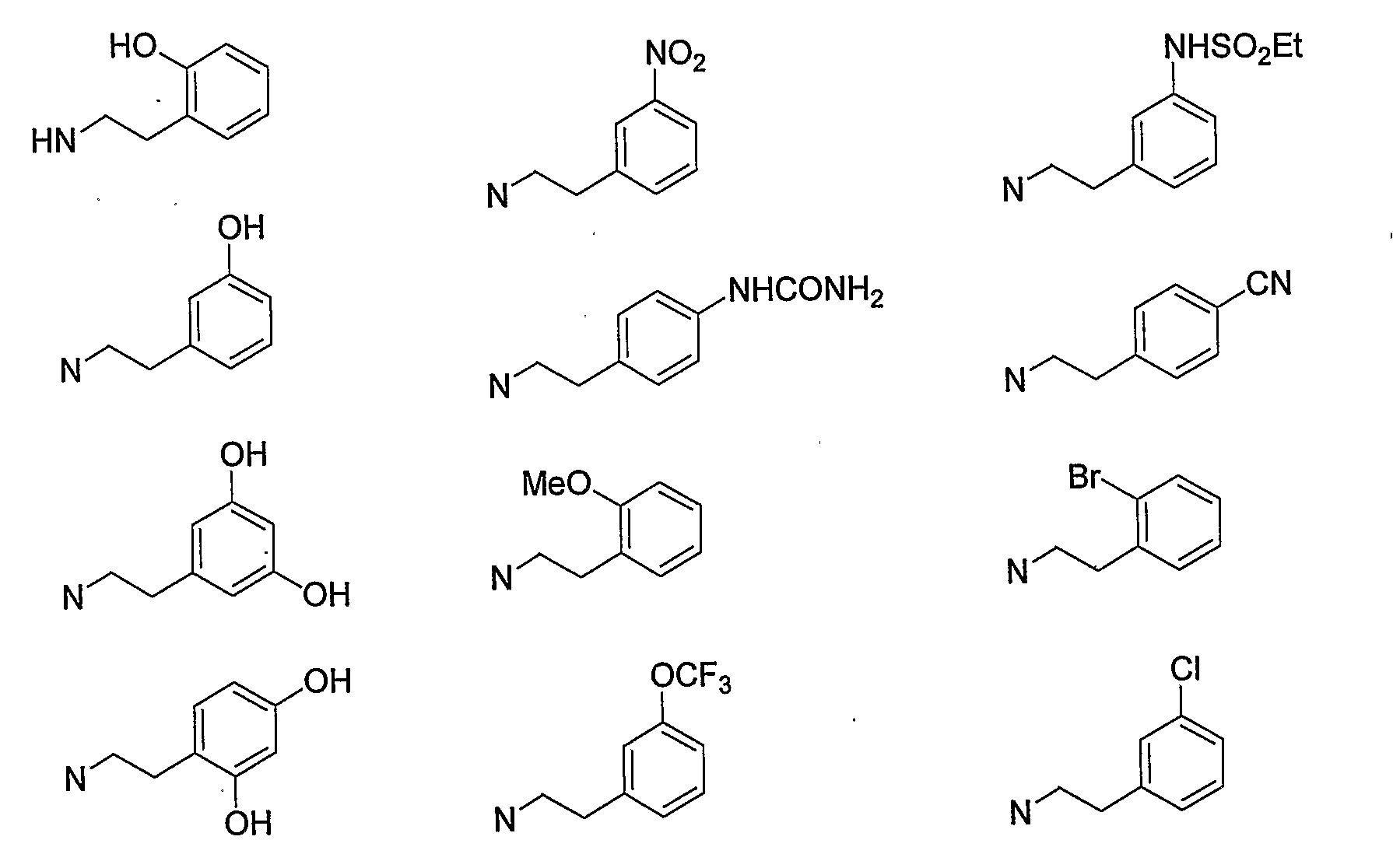
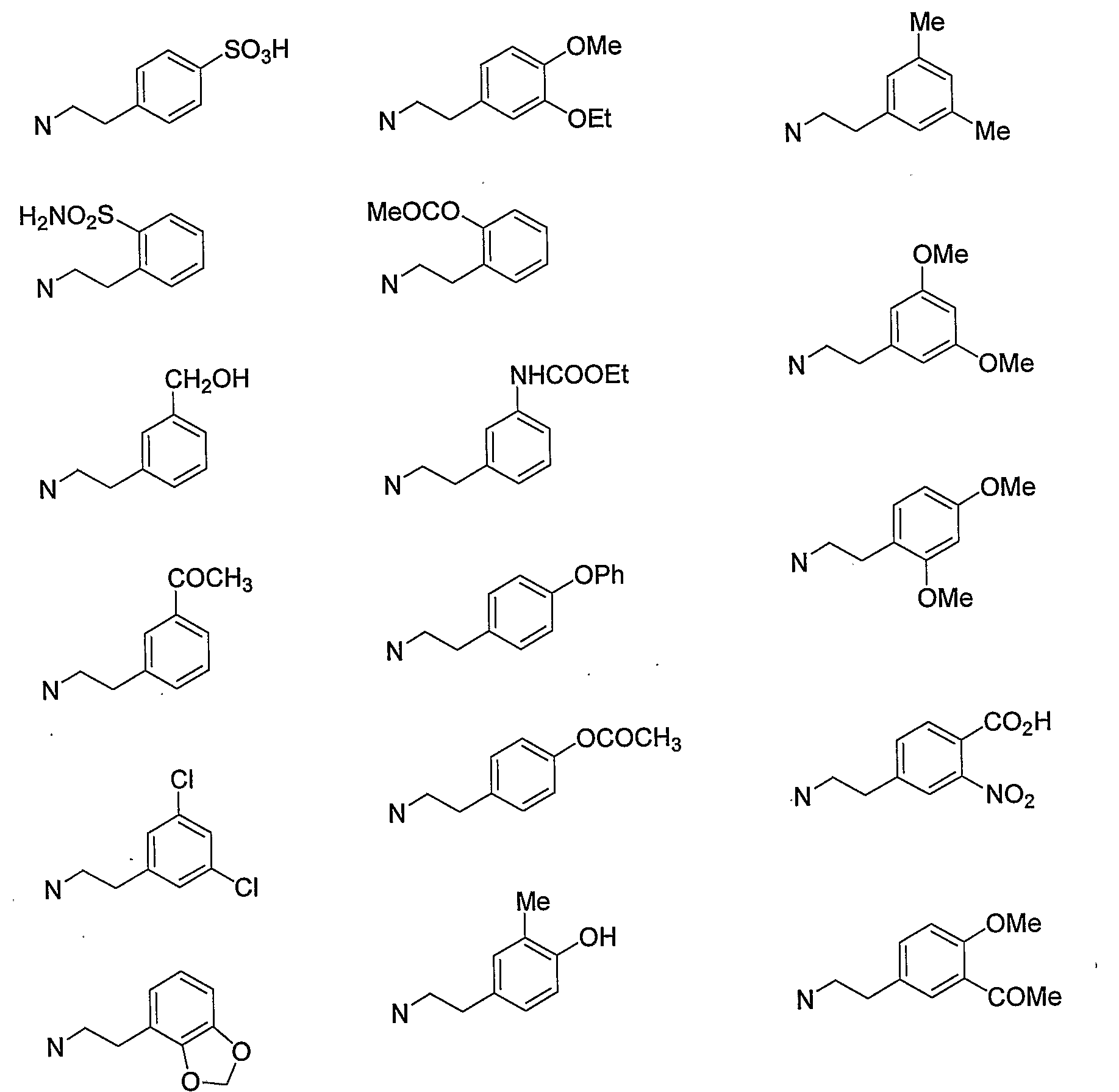
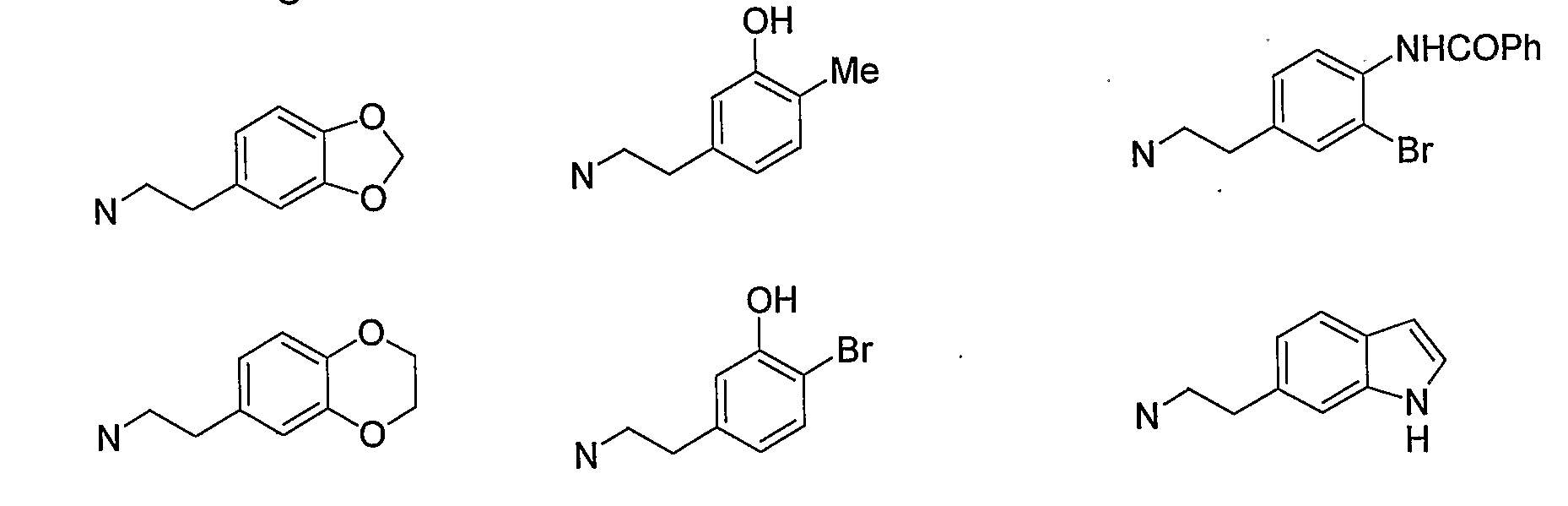
Конкретными примерами -X-Y-Z предпочтительно являются -NHSO2Me, -NMeSO2Me, -NHSO2Et, -NHSO2CF3, -NHTs, -NMe2 и -NHMe, и более предпочтительно -NHSO2Me и -NMeSO2Me.
Конкретными примерами W предпочтительно являются атом водорода, метил, этил, изопропил, атом фтора, атом хлора, атом брома, гидроксигруппа, метокси и NHSO2Me. В том случае, когда W находится в 5-м положении бензопиранового кольца, W предпочтительно представляет собой атом водорода. В том случае, когда W находится в 6-м положении, W предпочтительно представляет собой атом водорода, метил, этил, изопропил, атом фтора, атом хлора, атом брома, гидроксигруппу, метокси и NHSO2Me. Кроме того, в том случае, когда W находится в 8-м положении, W представляет собой атом водорода и метил.
Более предпочтительно, конкретные примеры W представляют собой атом водорода, атом брома, гидроксигруппу, метокси и NHSO2Me в 6-м положении, и атом водорода и метил в 8-м положении, и дополнительно атом водорода, гидроксигруппу и метокси в 6-м положении.
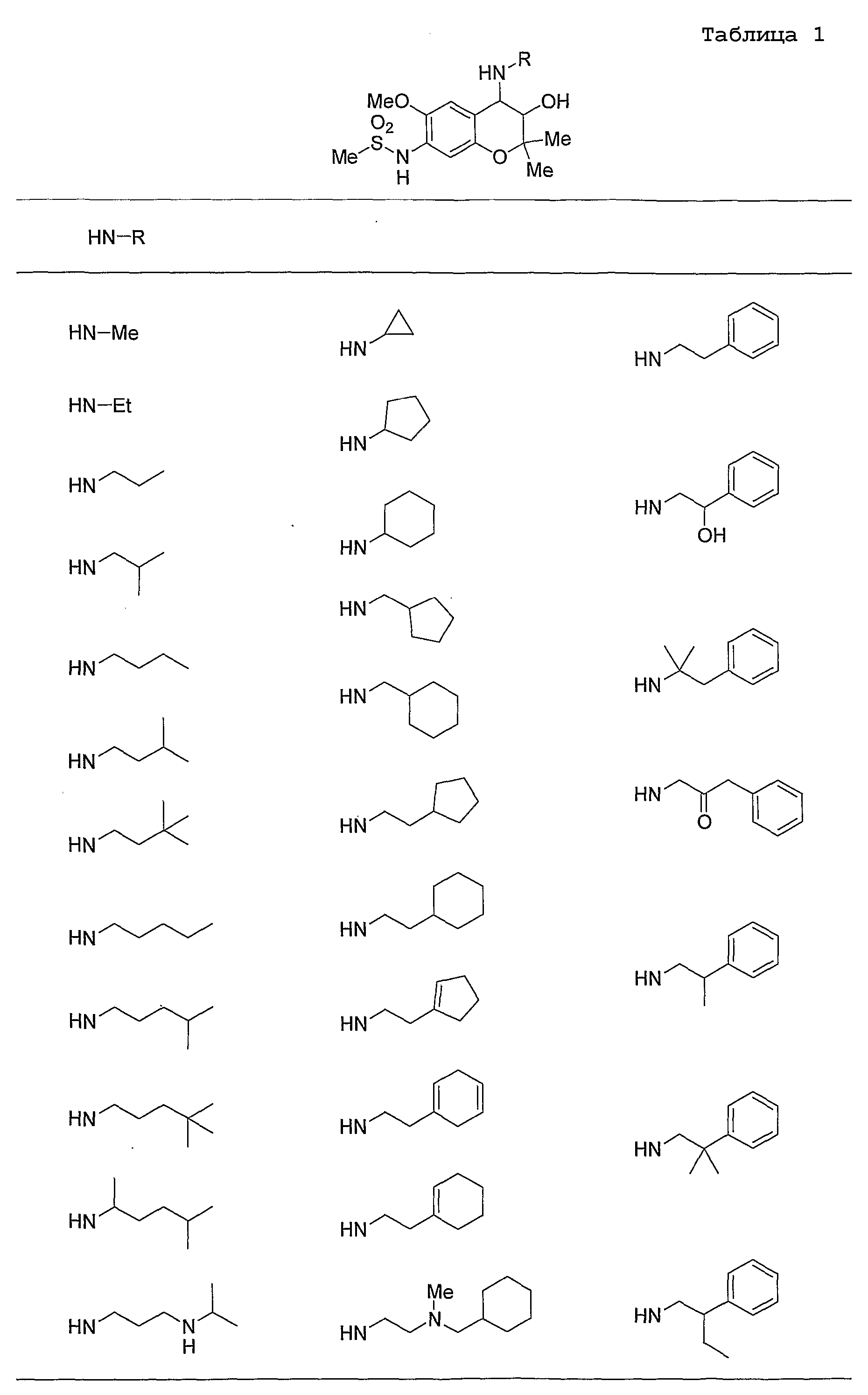
Конкретными примерами N-(CH2)m-V-(CH2)n-R5 предпочтительно являются следующие группы.
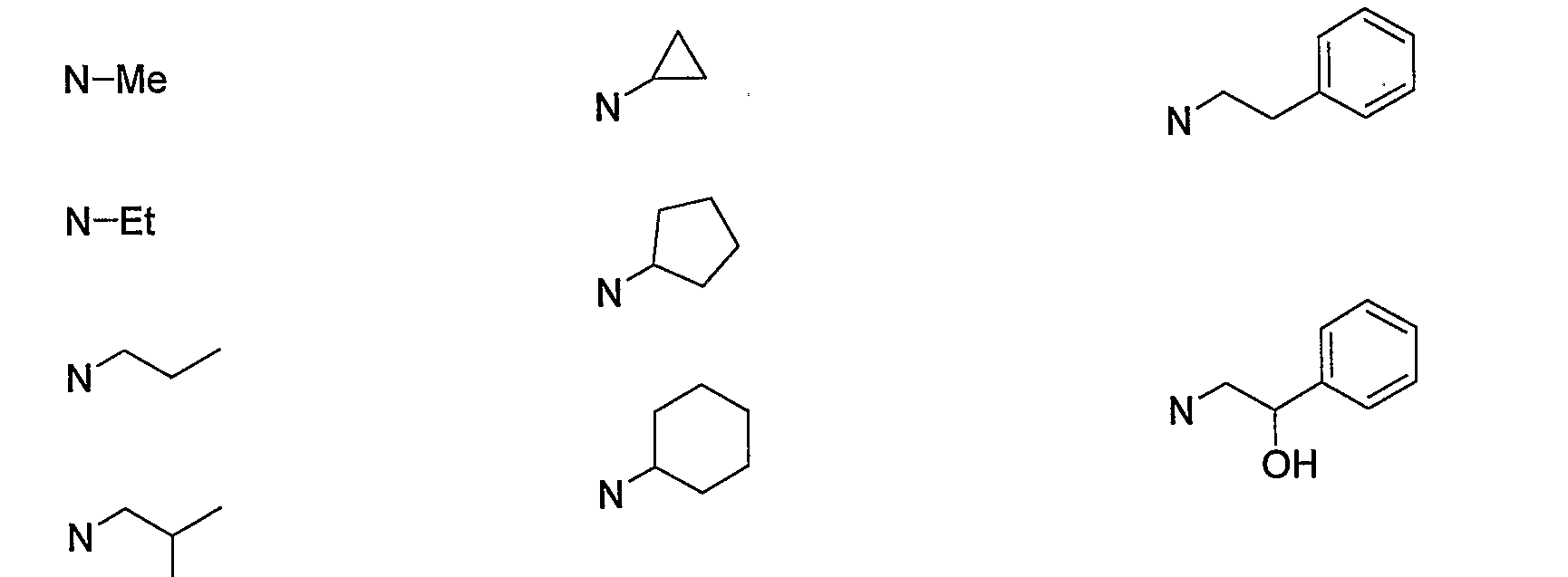
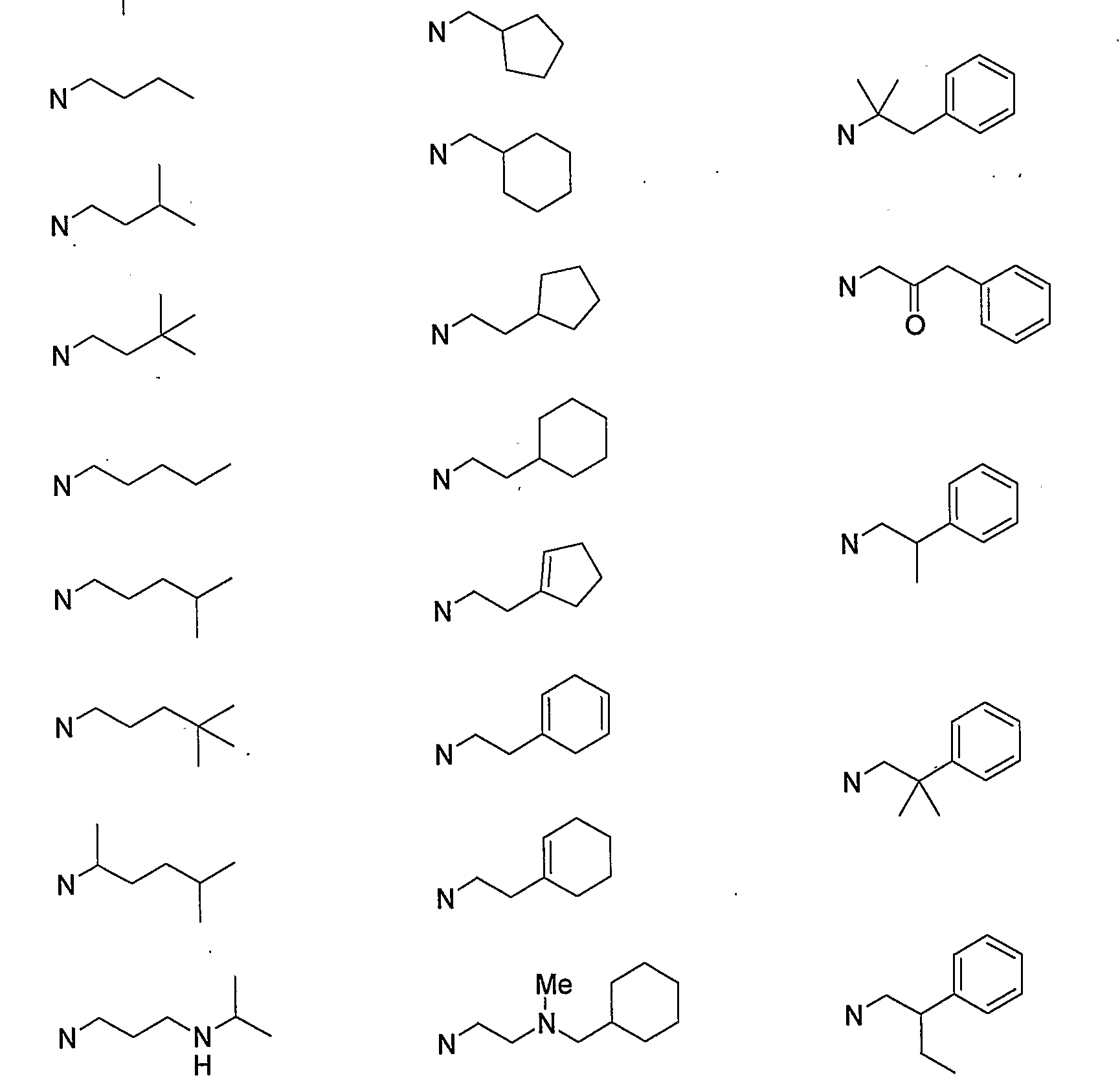
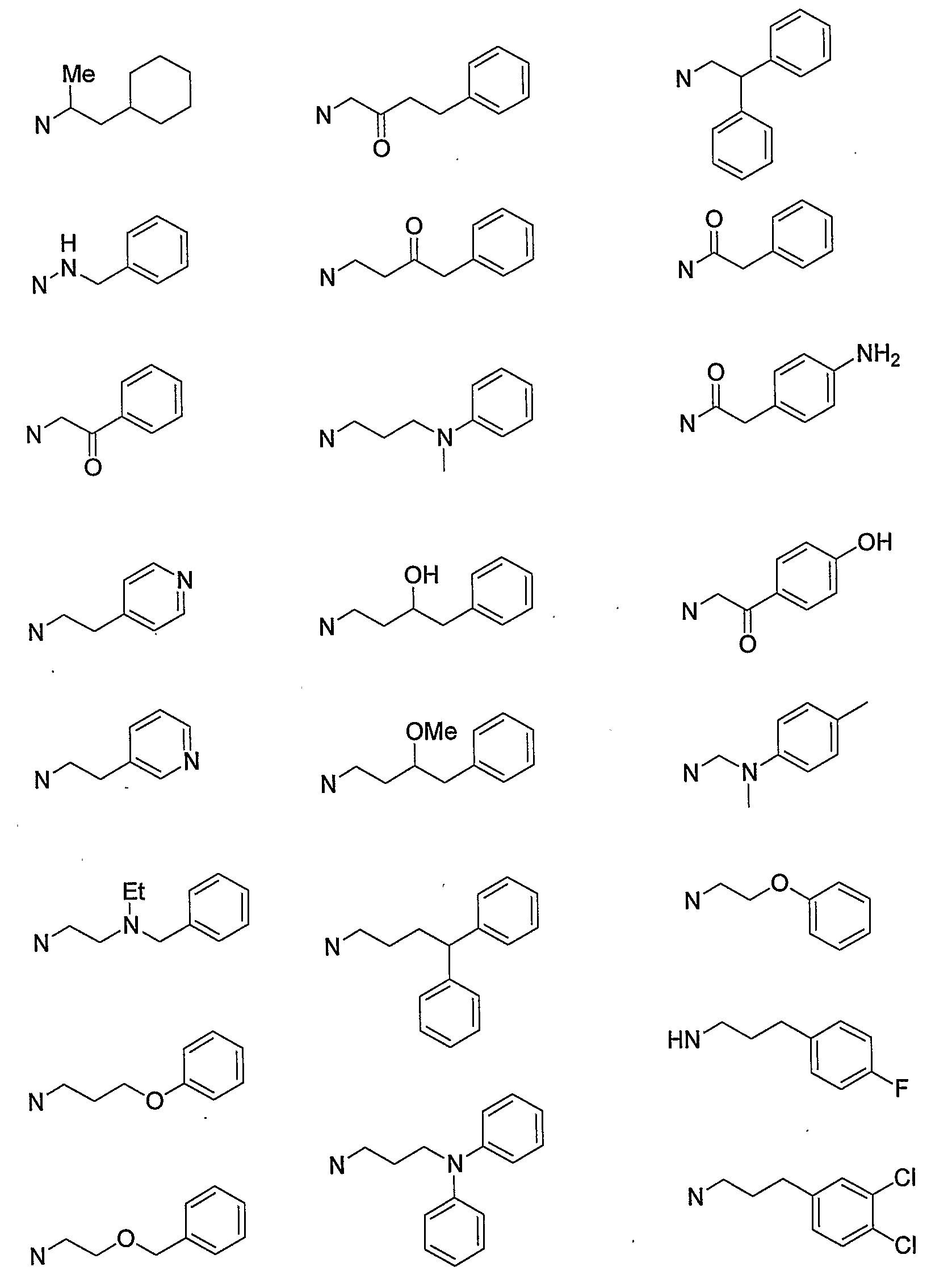
Более предпочтительными конкретными примерами N-(CH2)m-V-(CH2)n-R5 являются следующие группы
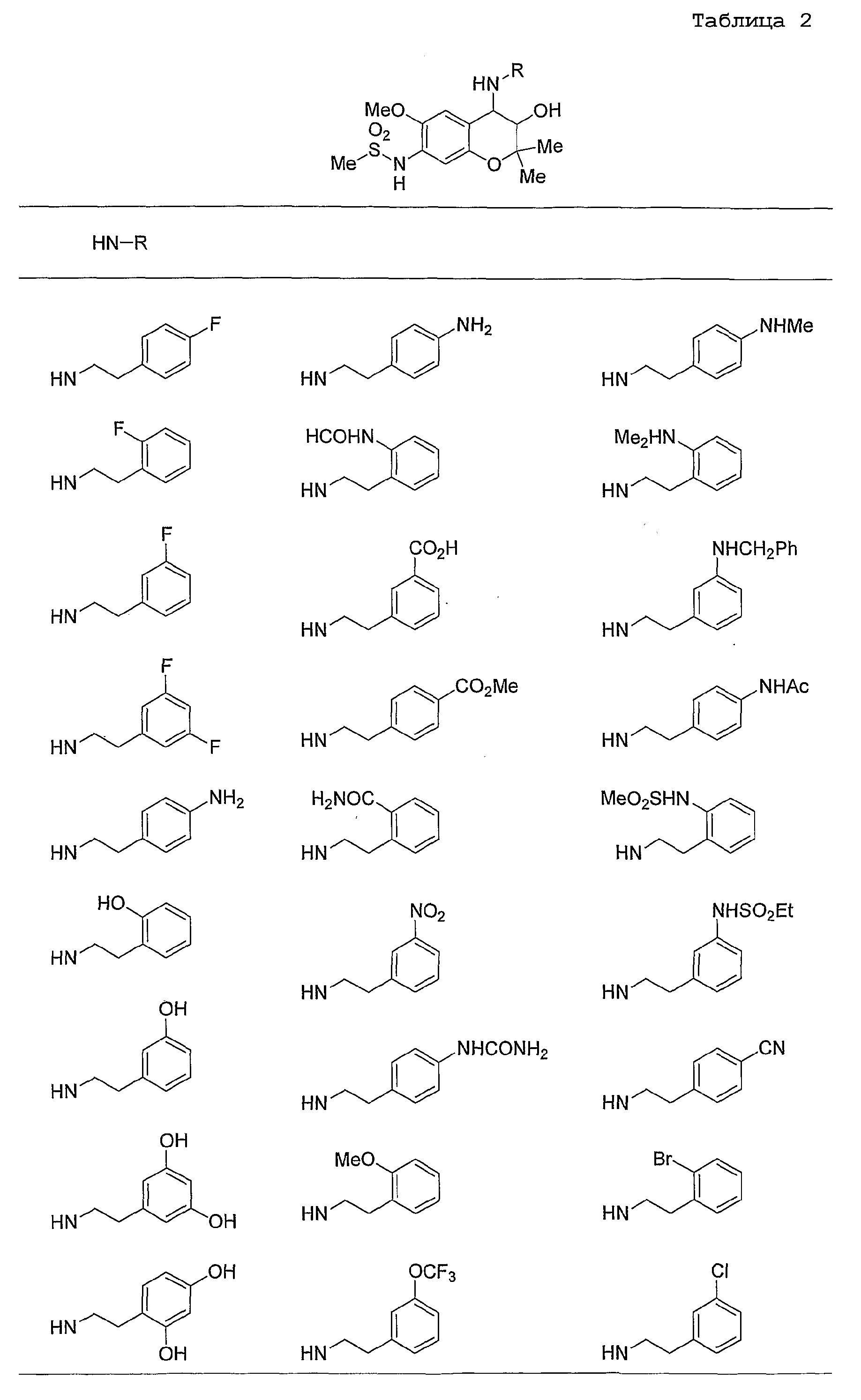
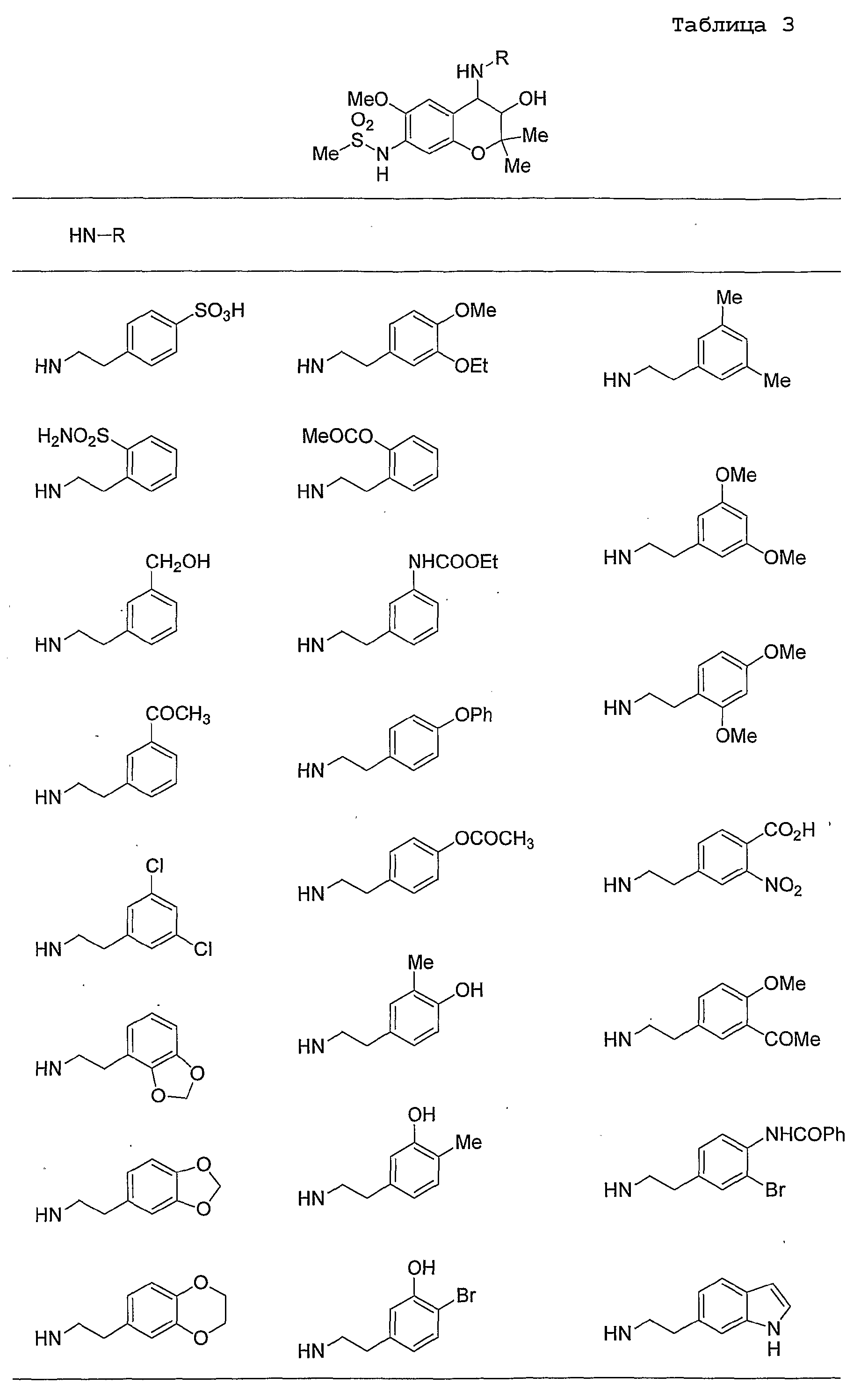
Конкретные примеры предпочтительных соединений, которые могут применяться по настоящему изобретению, представлены ниже в таблицах 1-59, но настоящее изобретение ими не ограничивается.
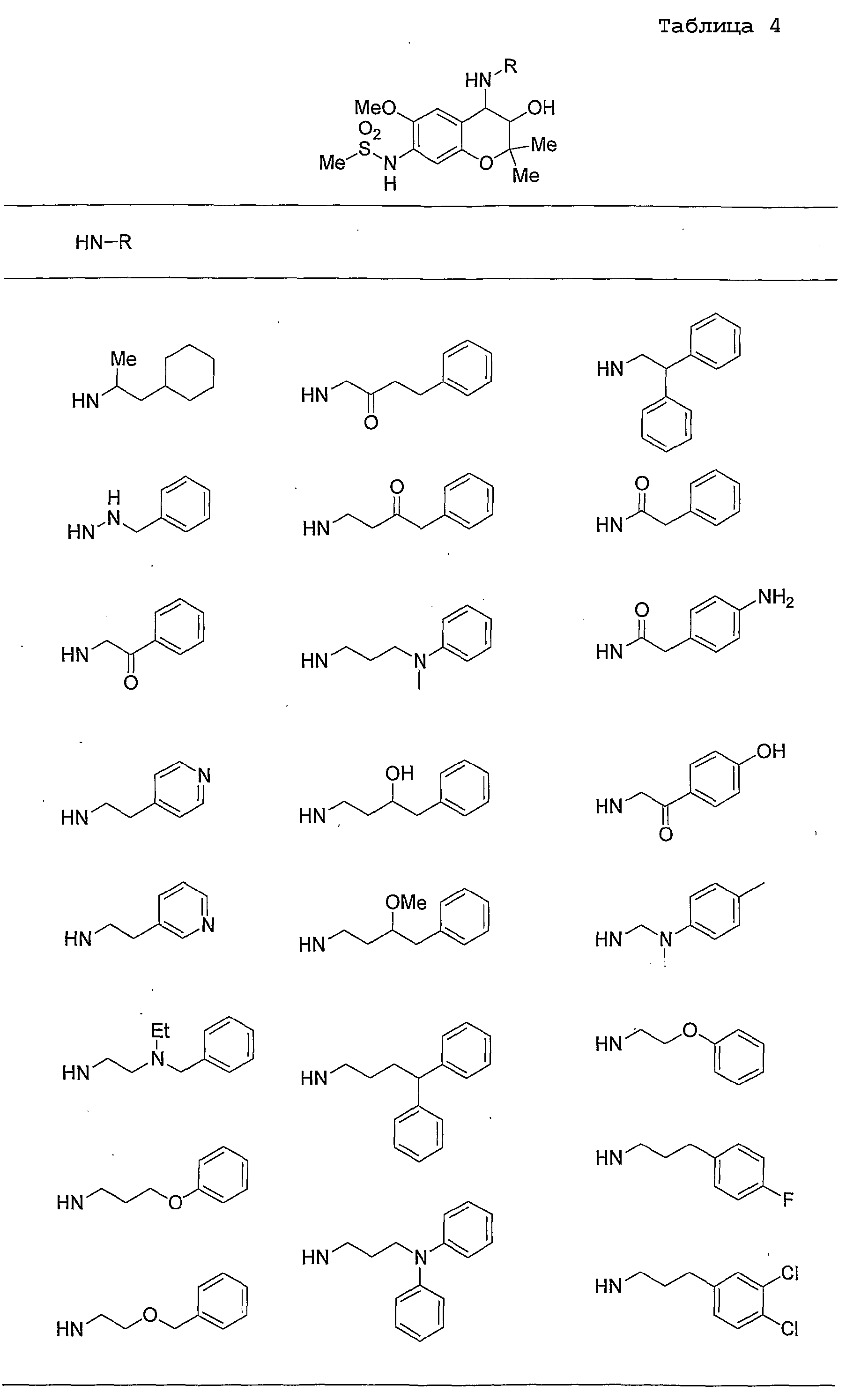
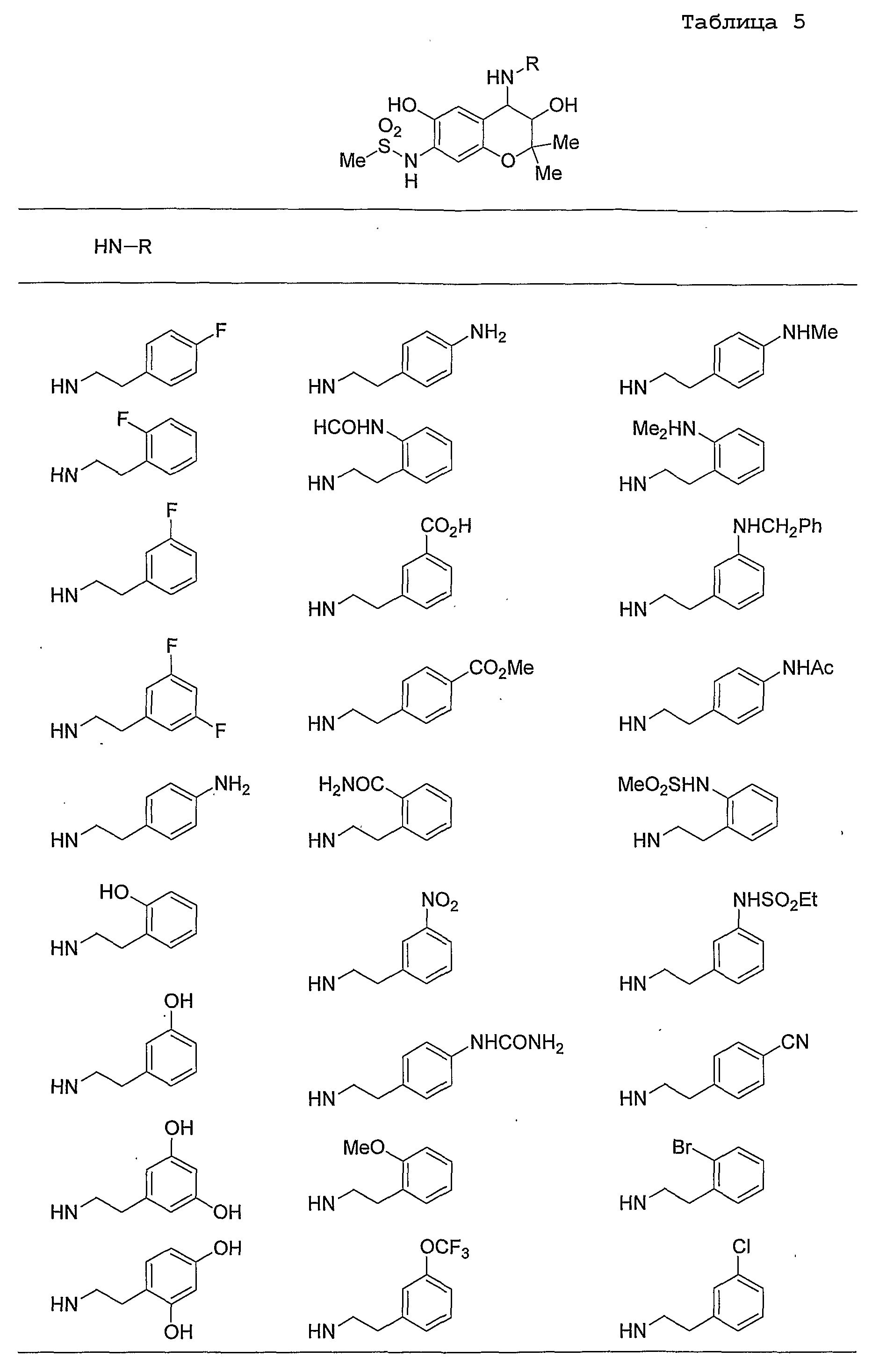
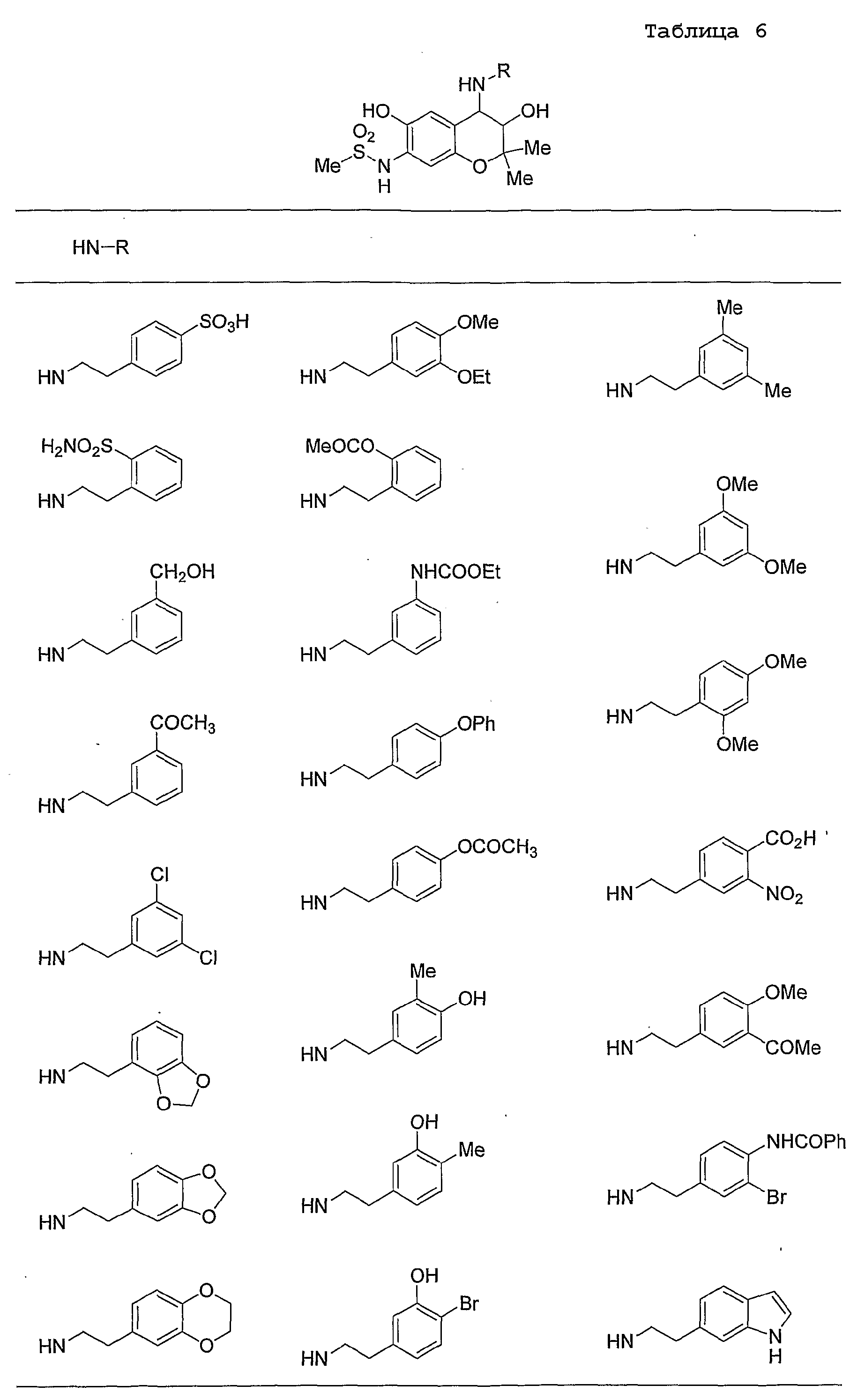
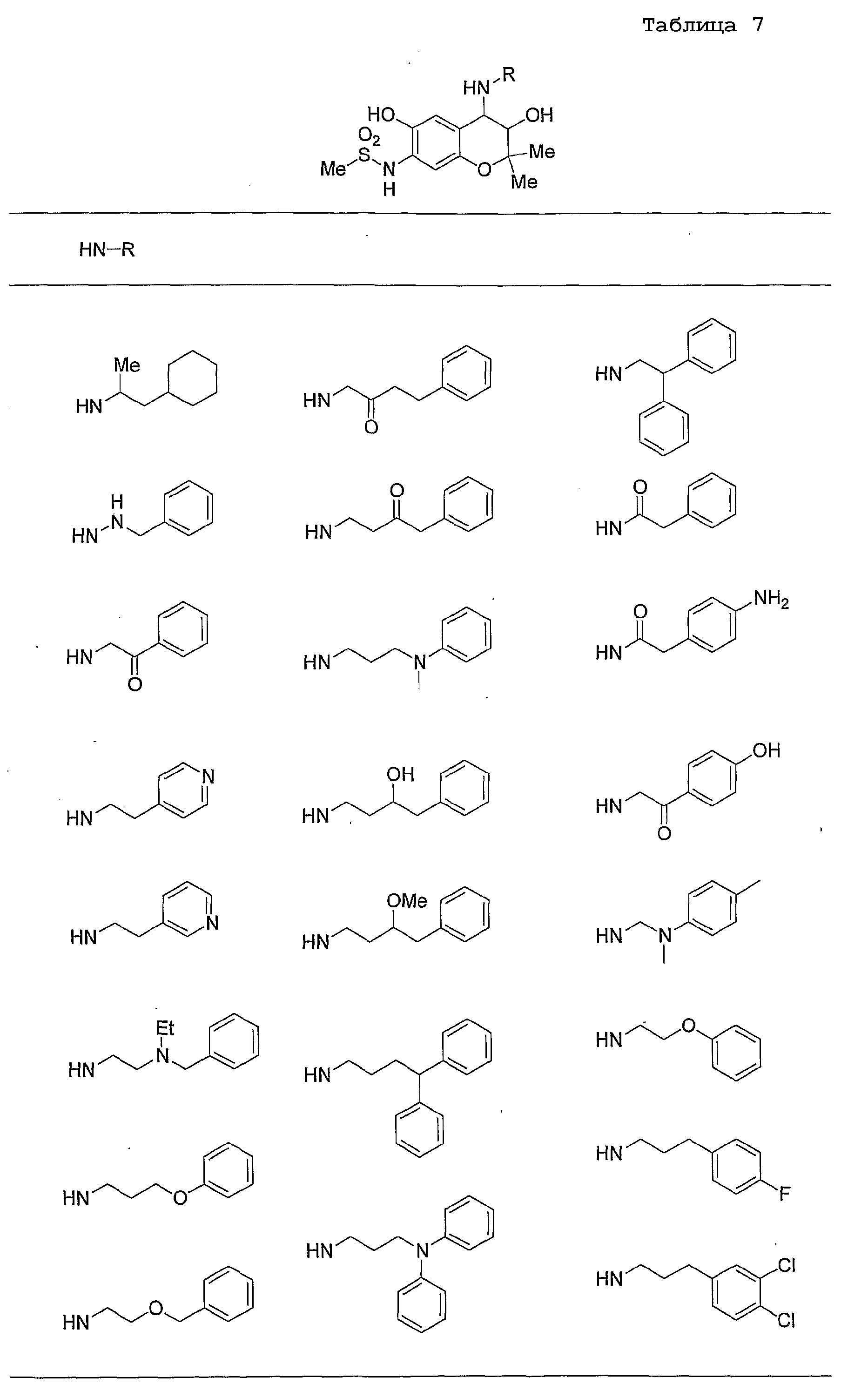
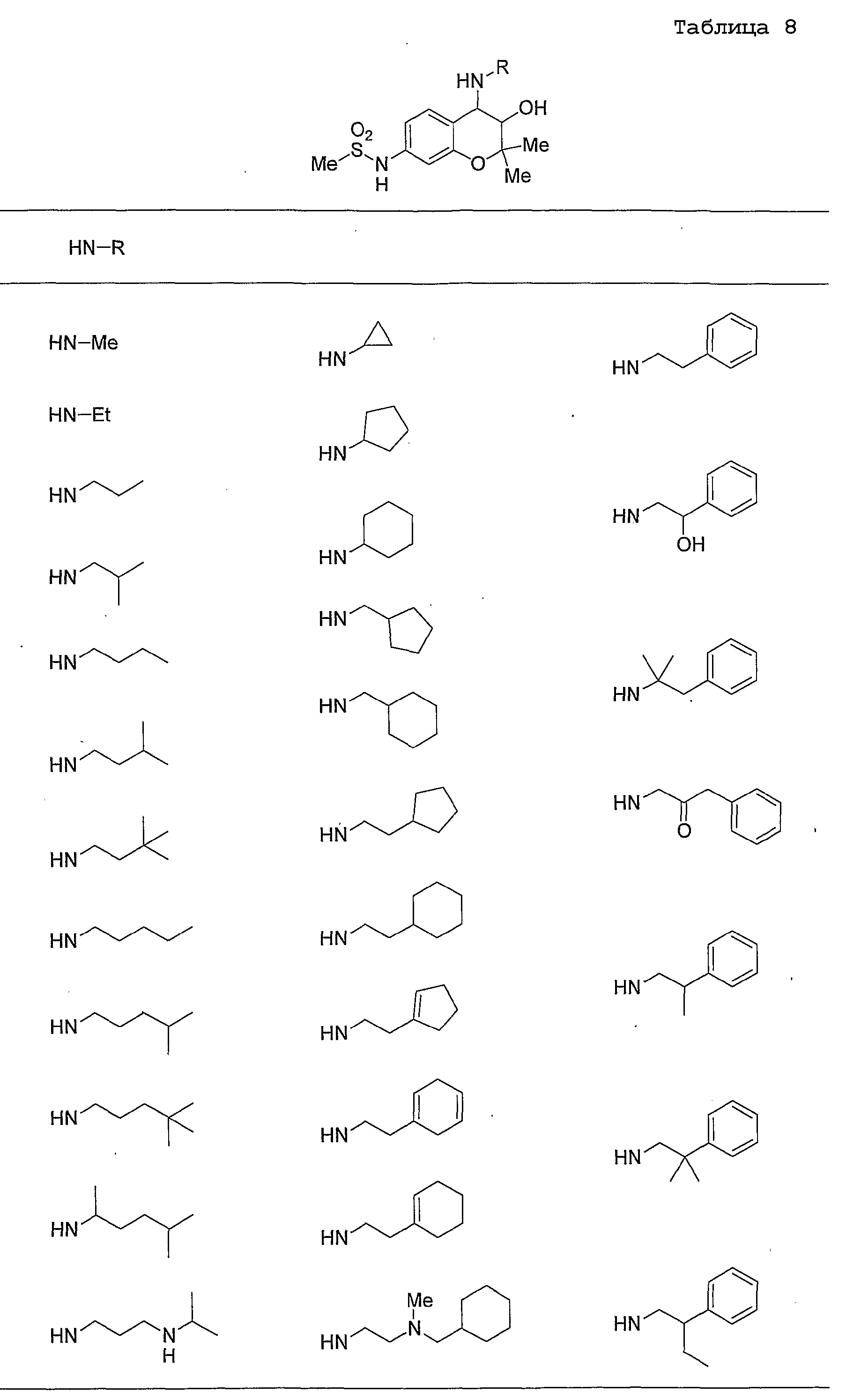
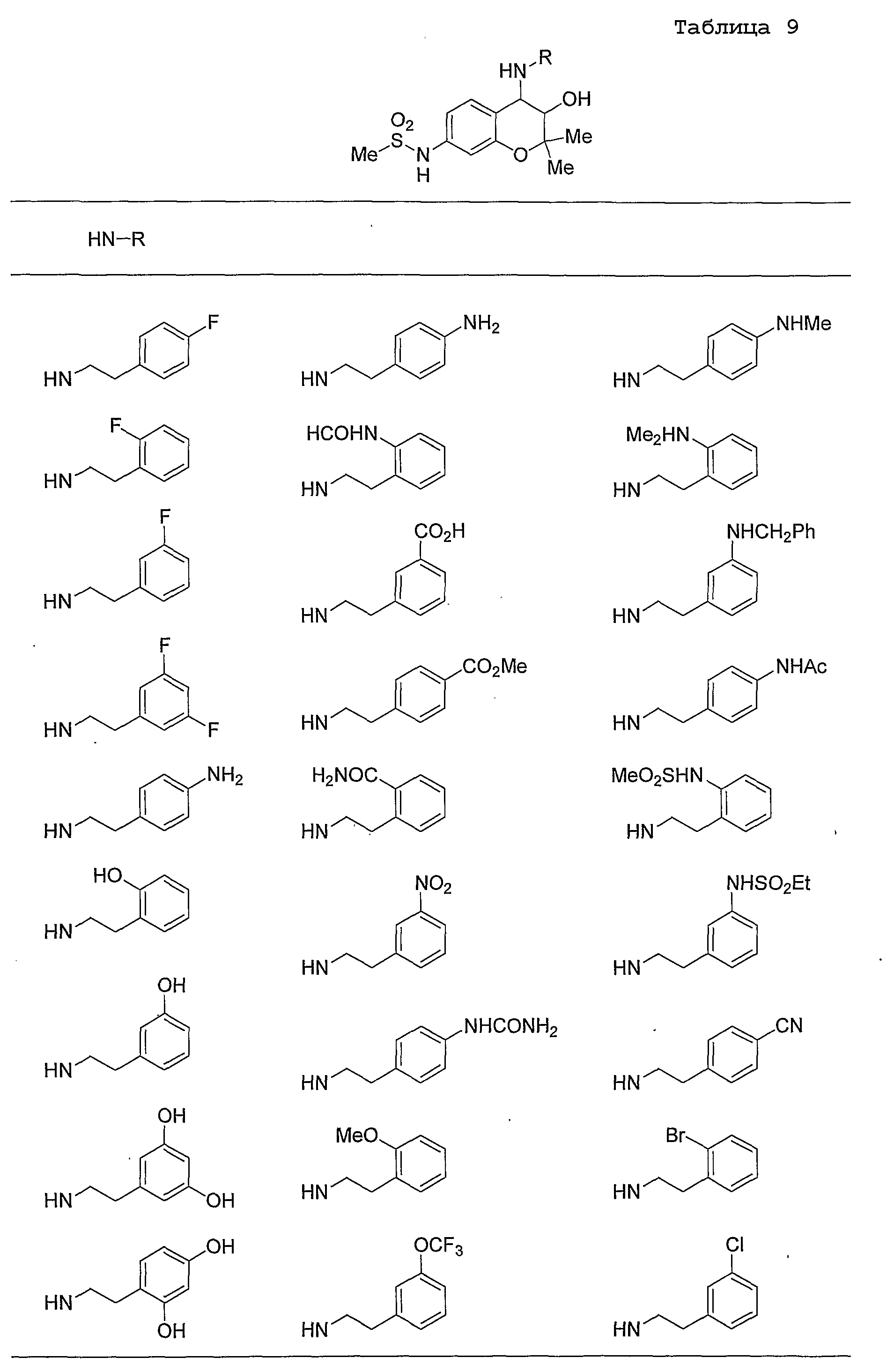
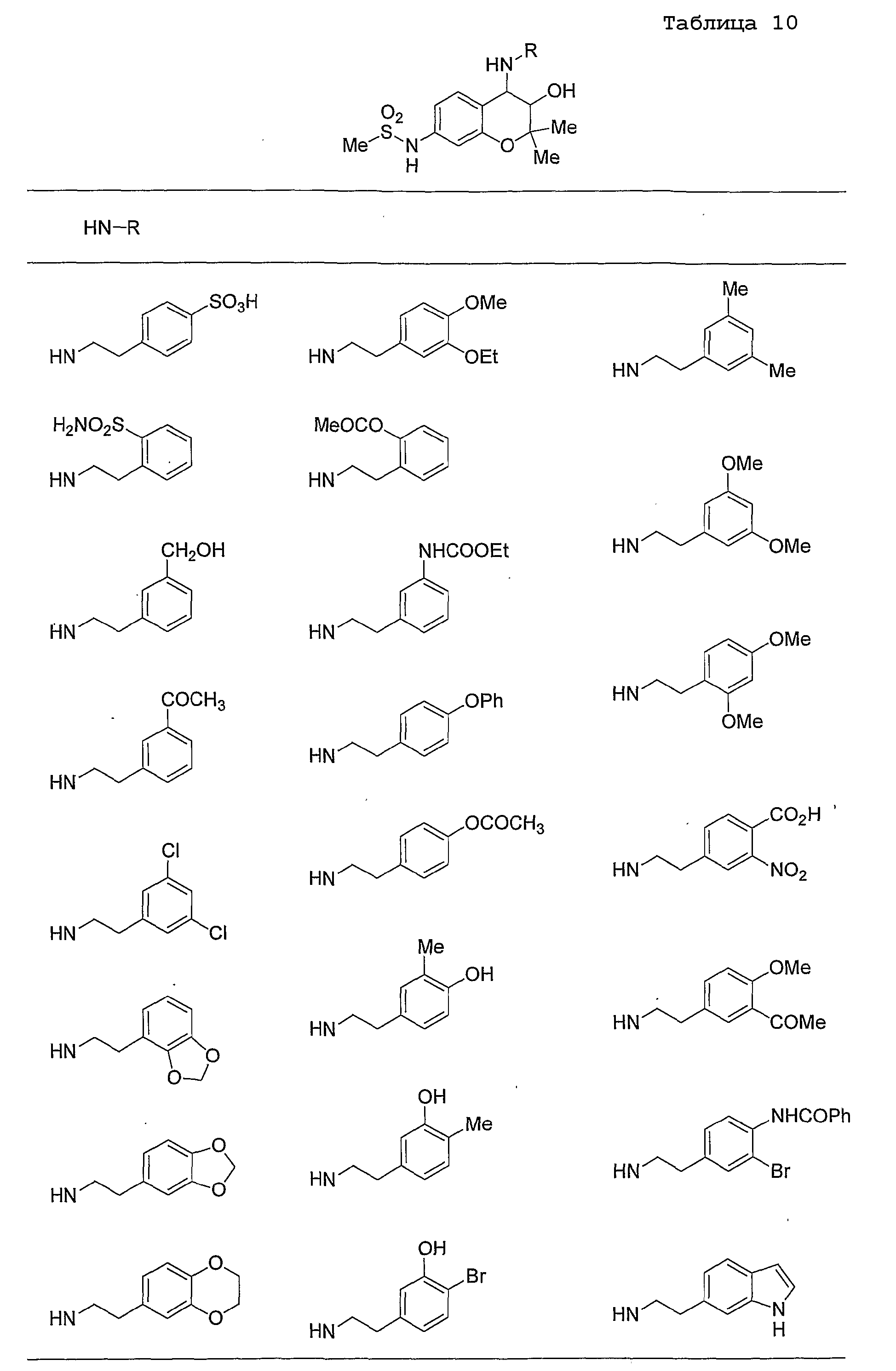
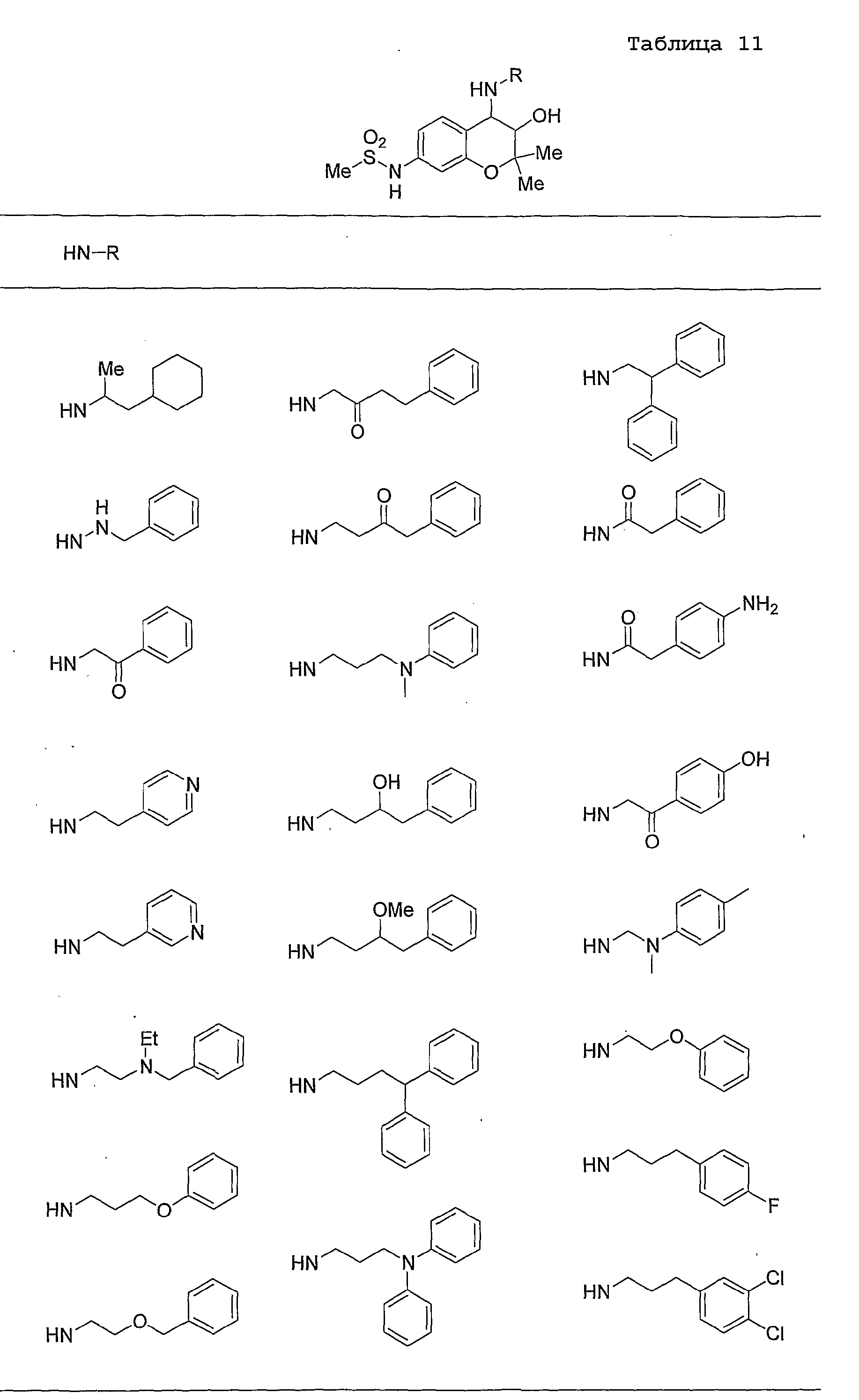
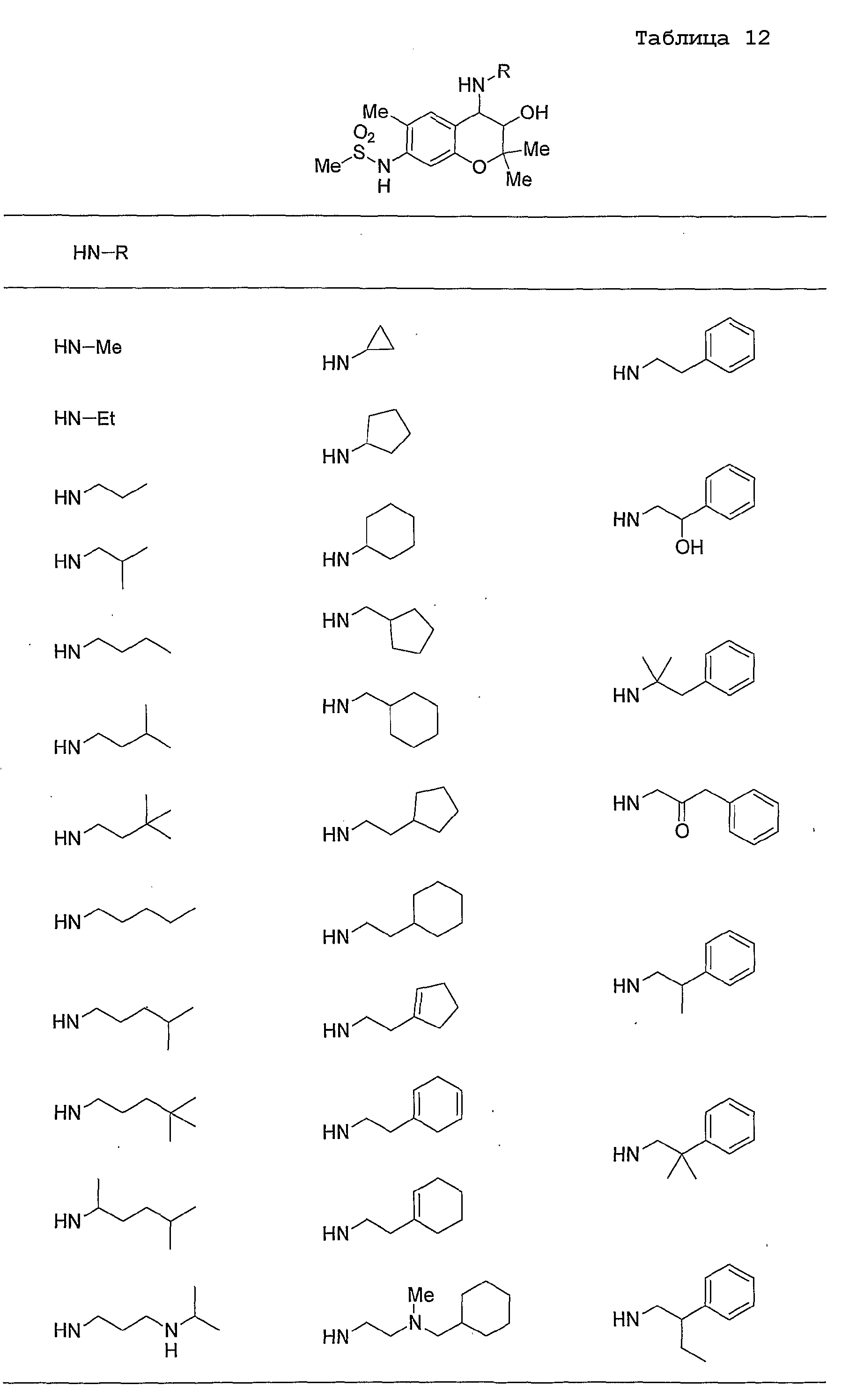
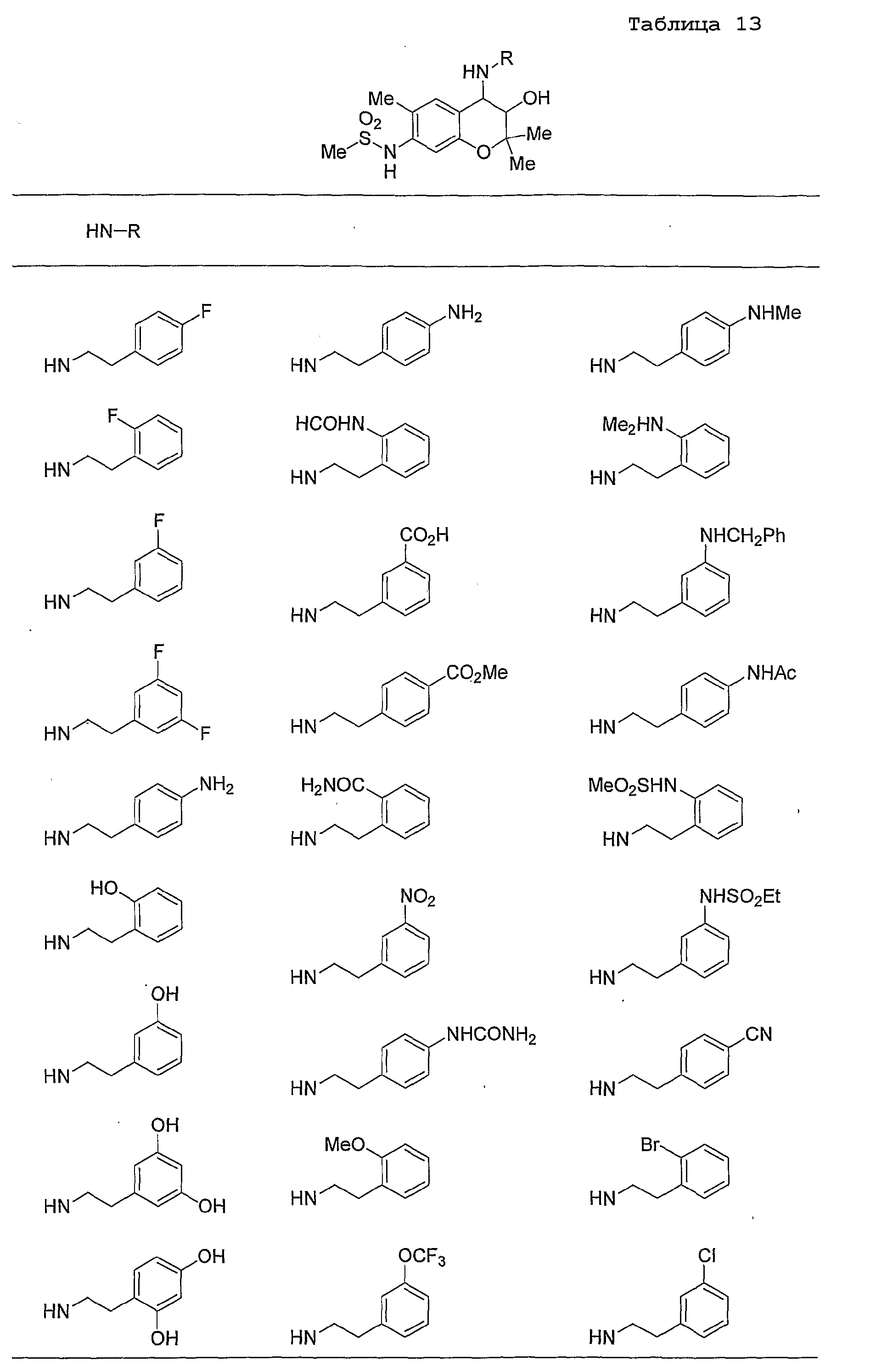
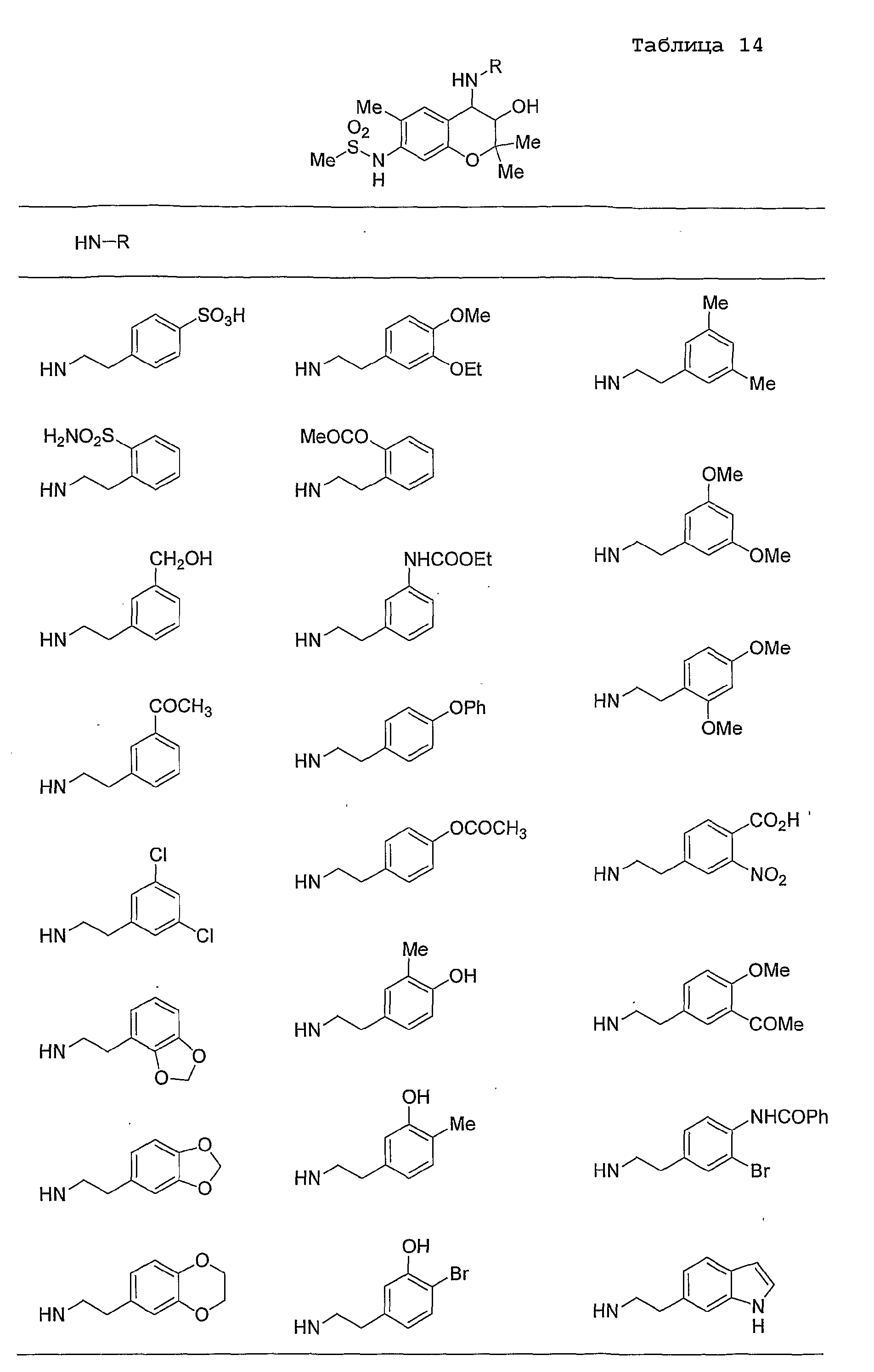
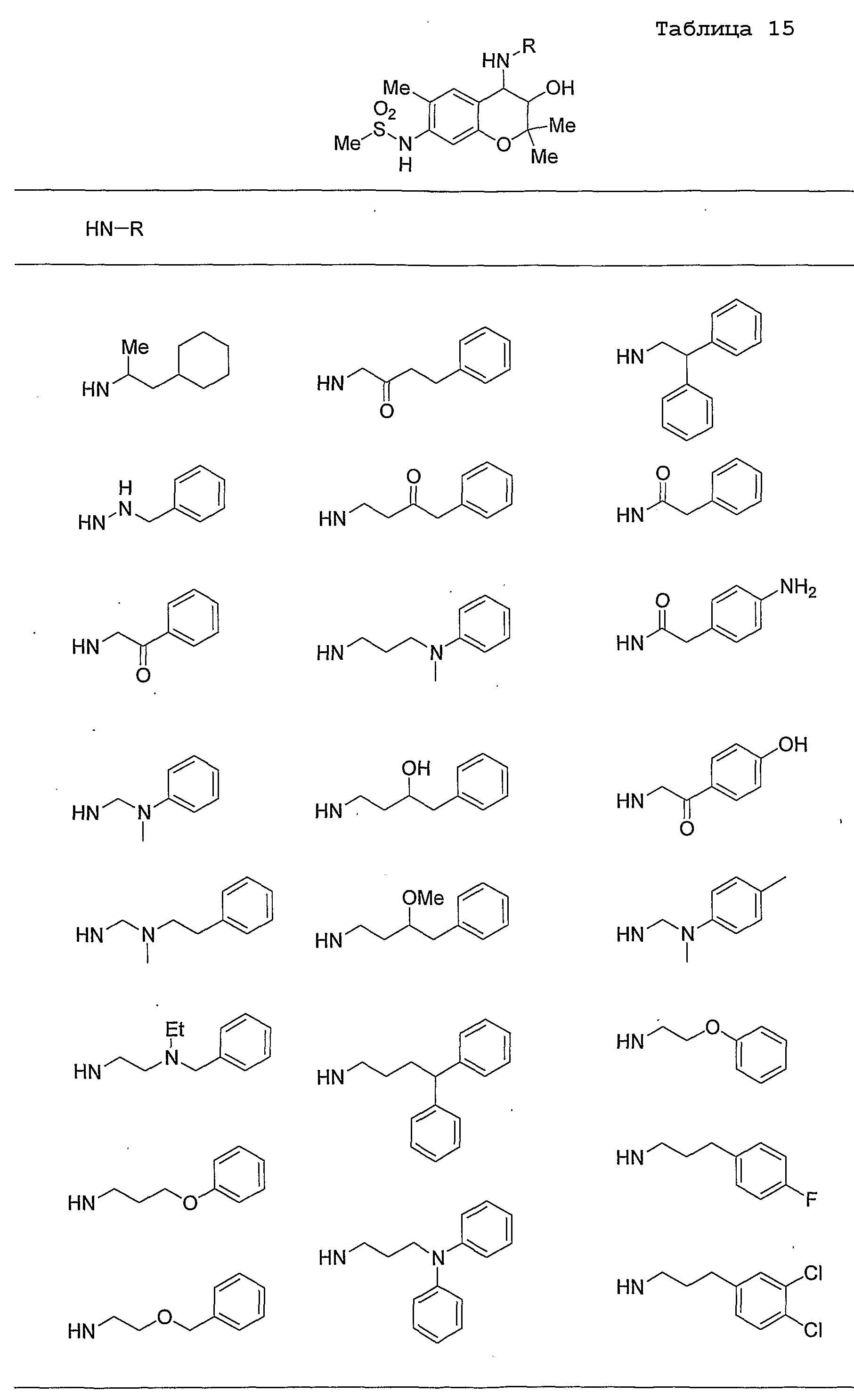
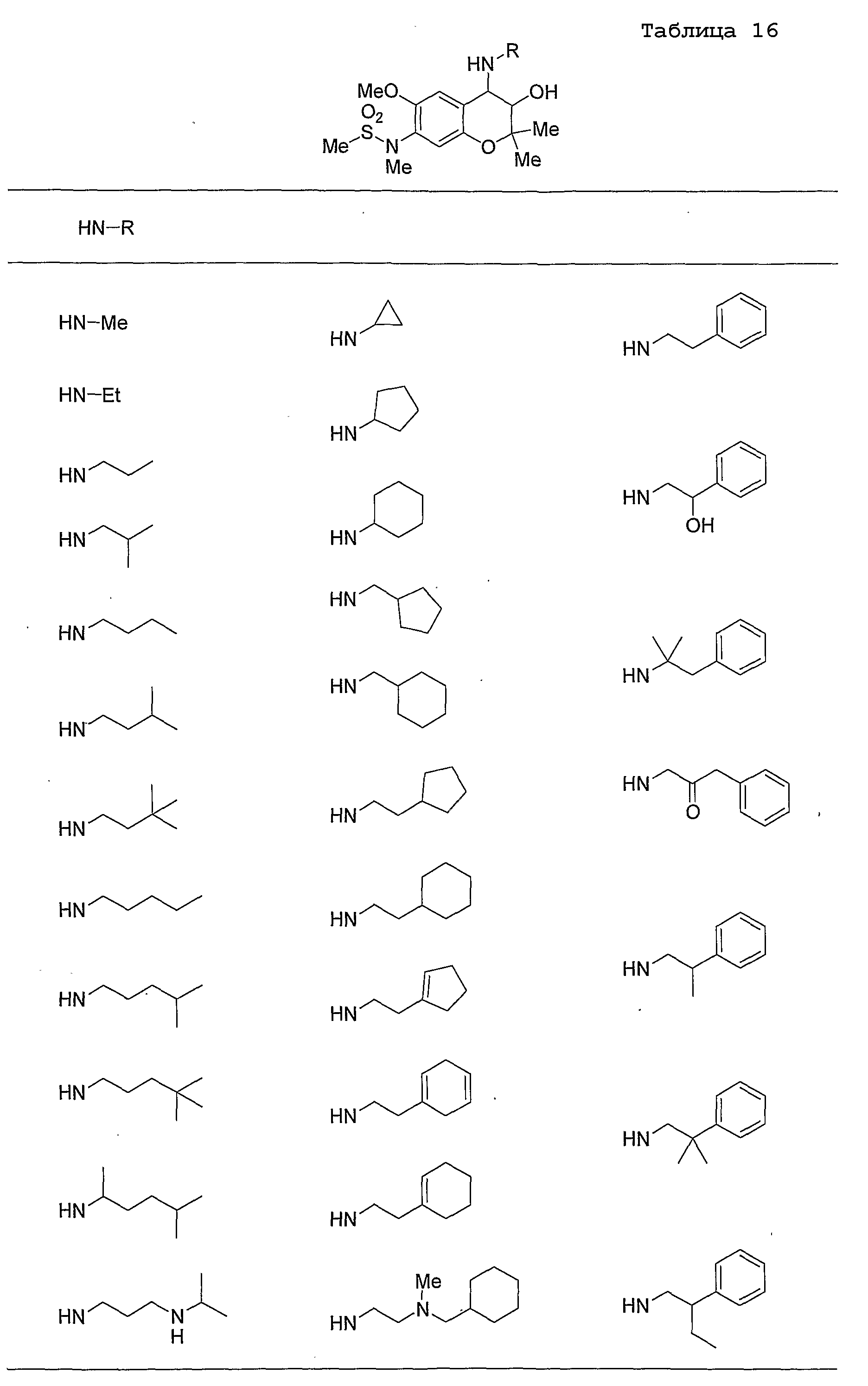
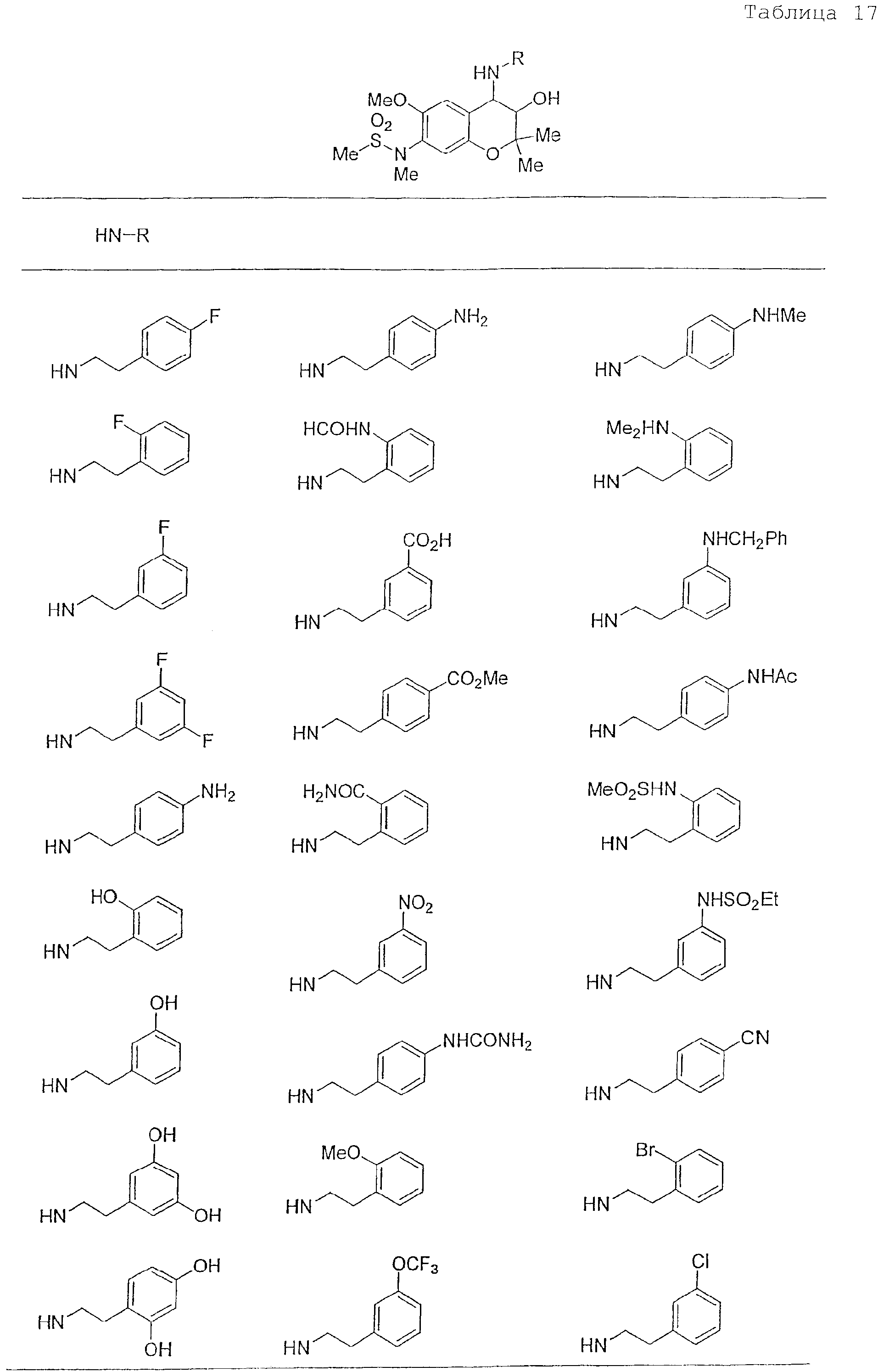
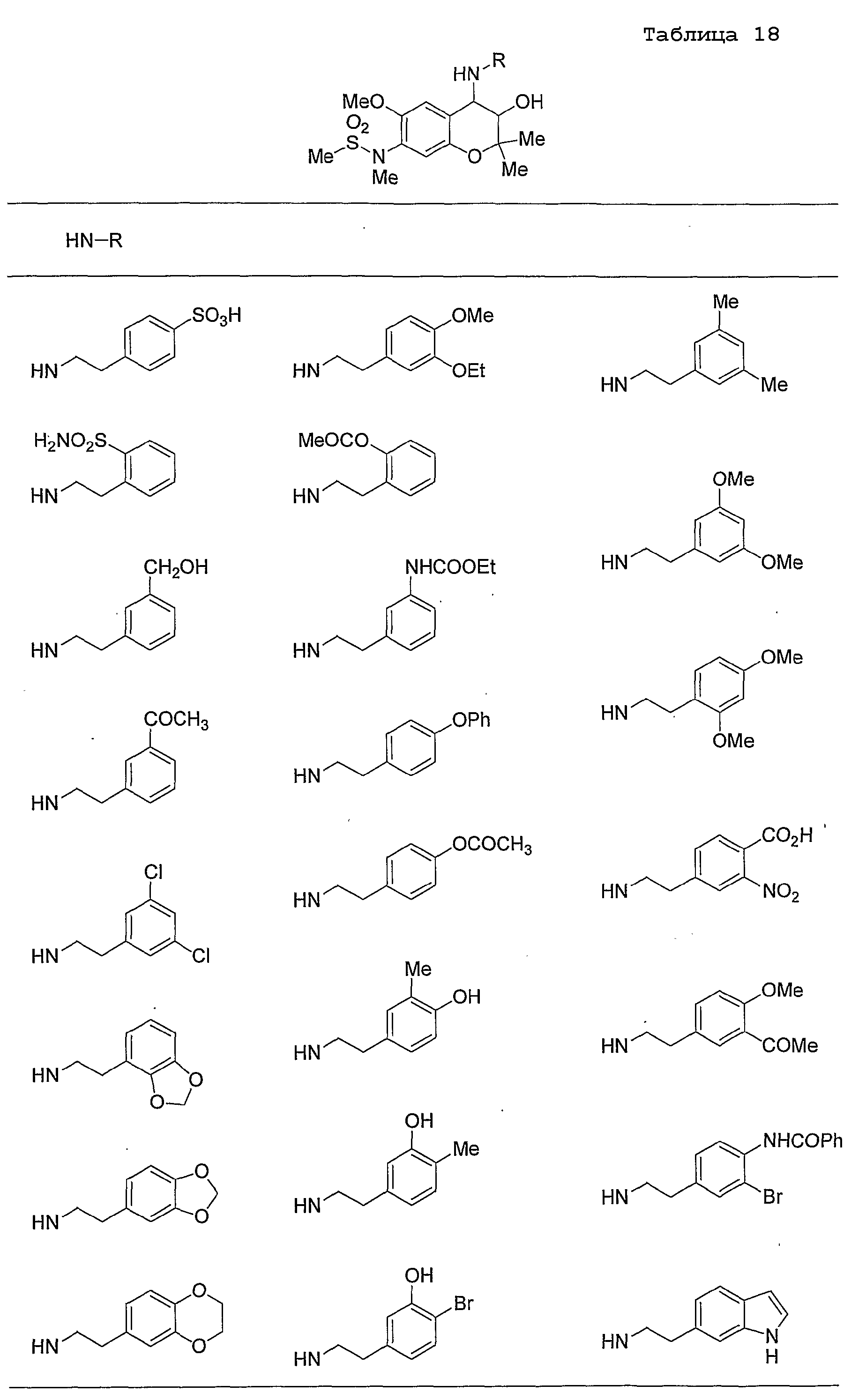
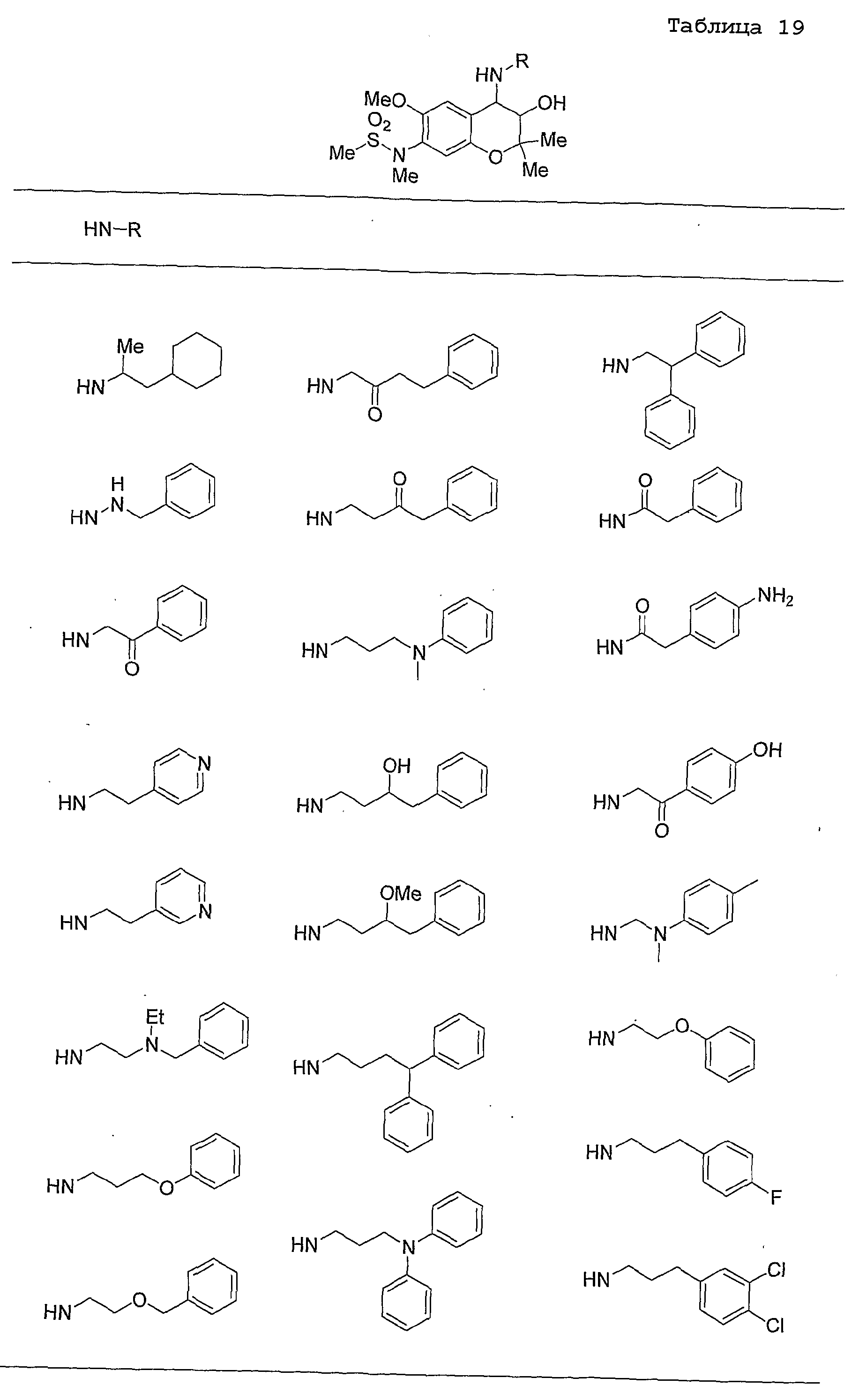
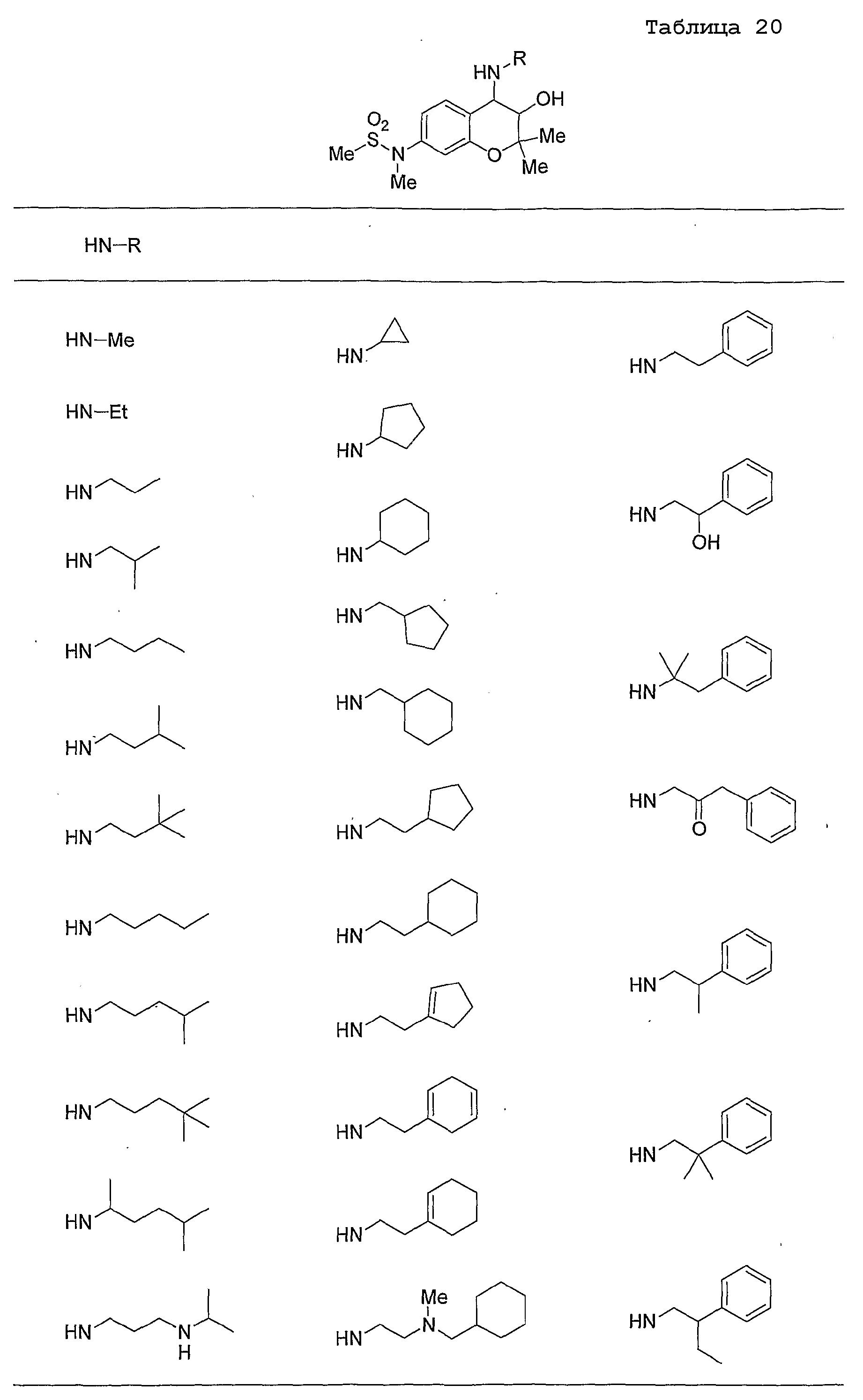
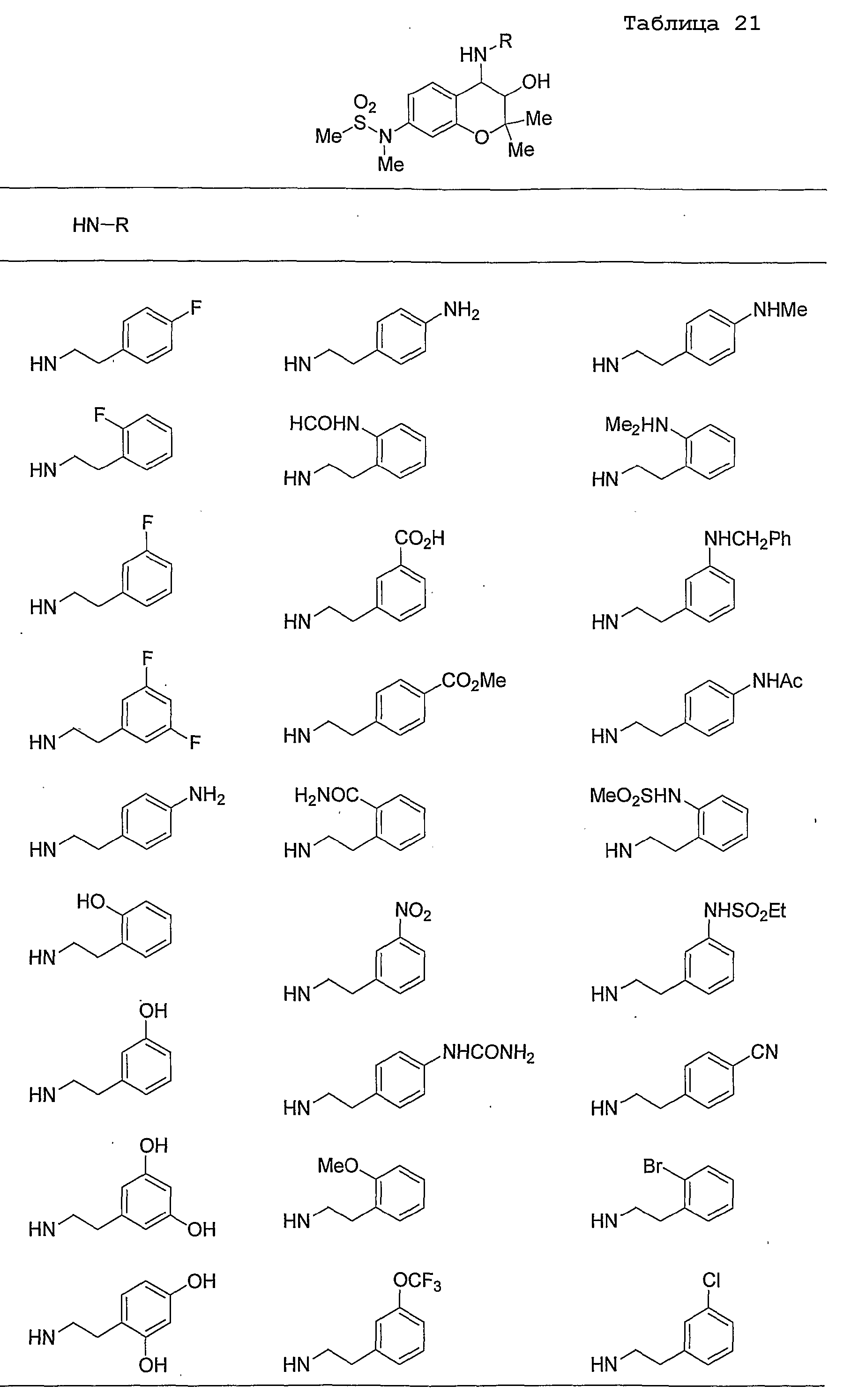
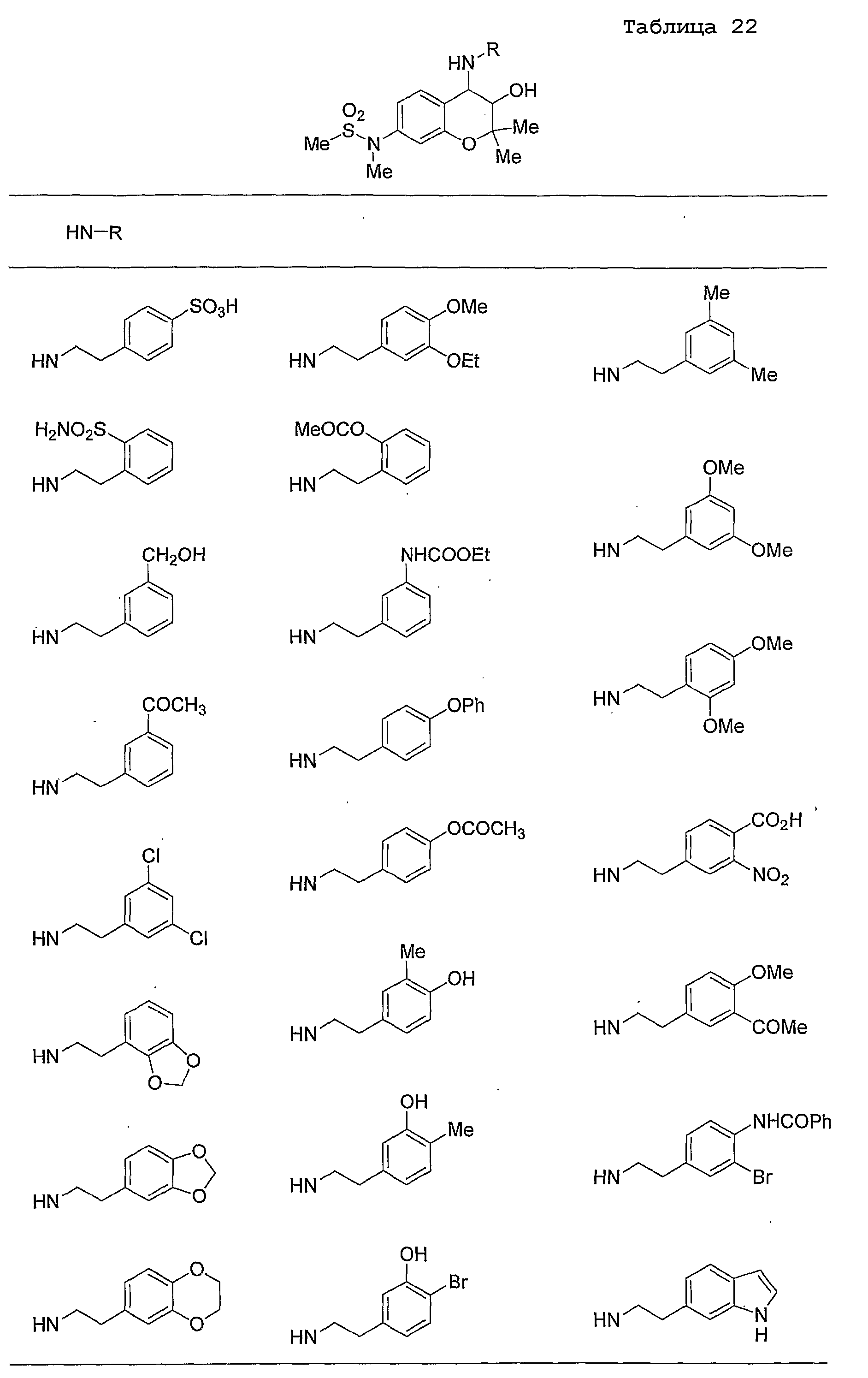
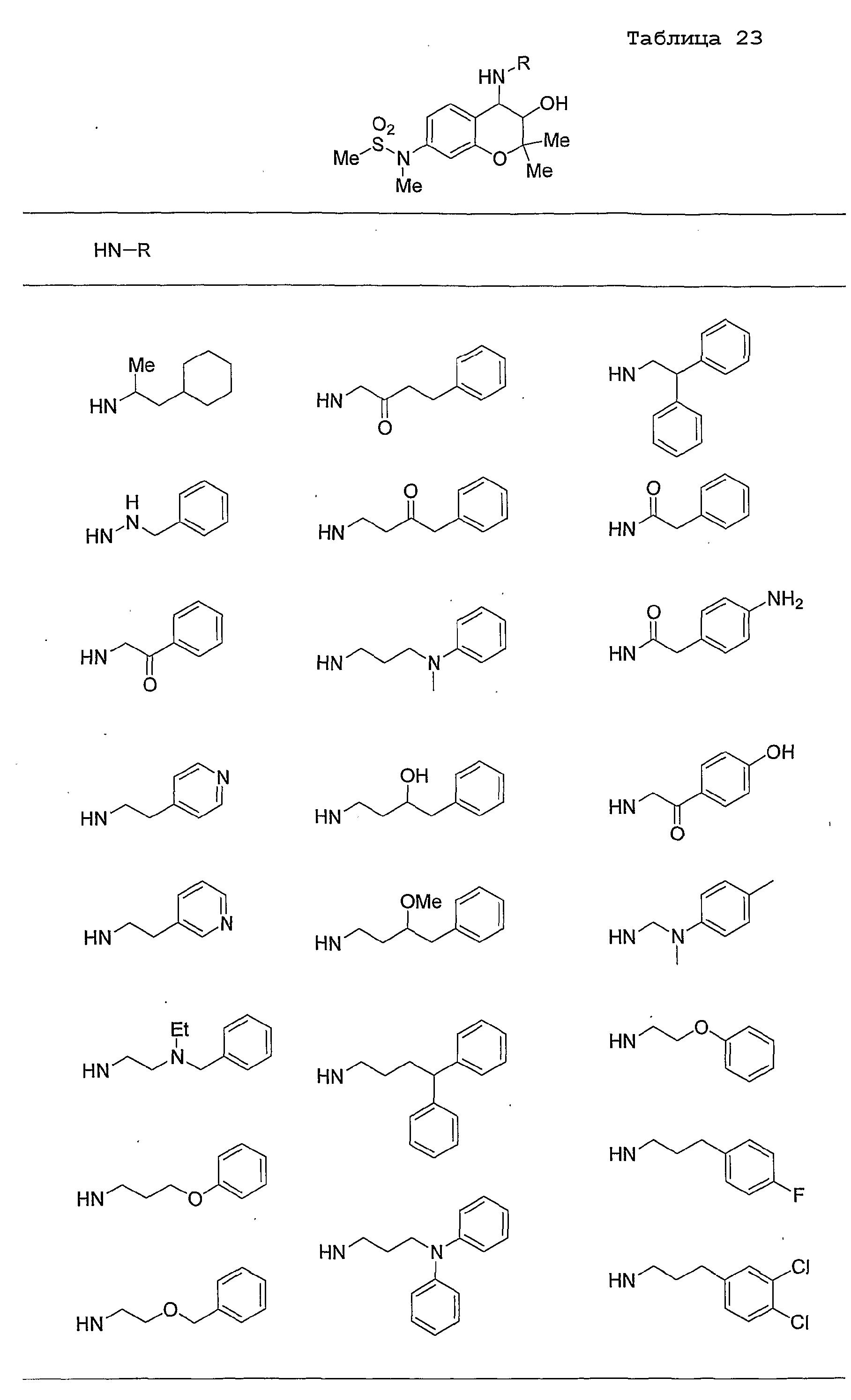
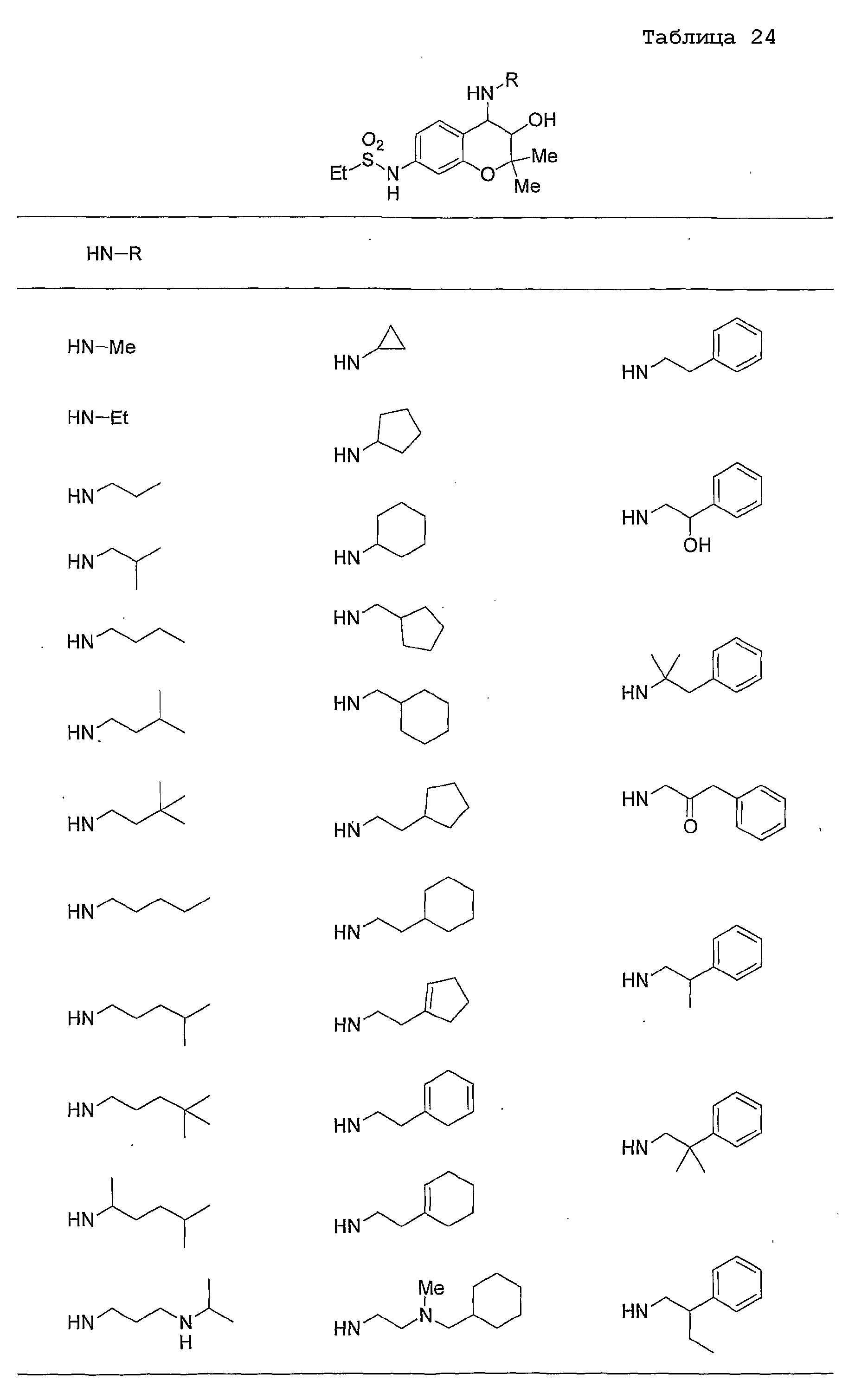
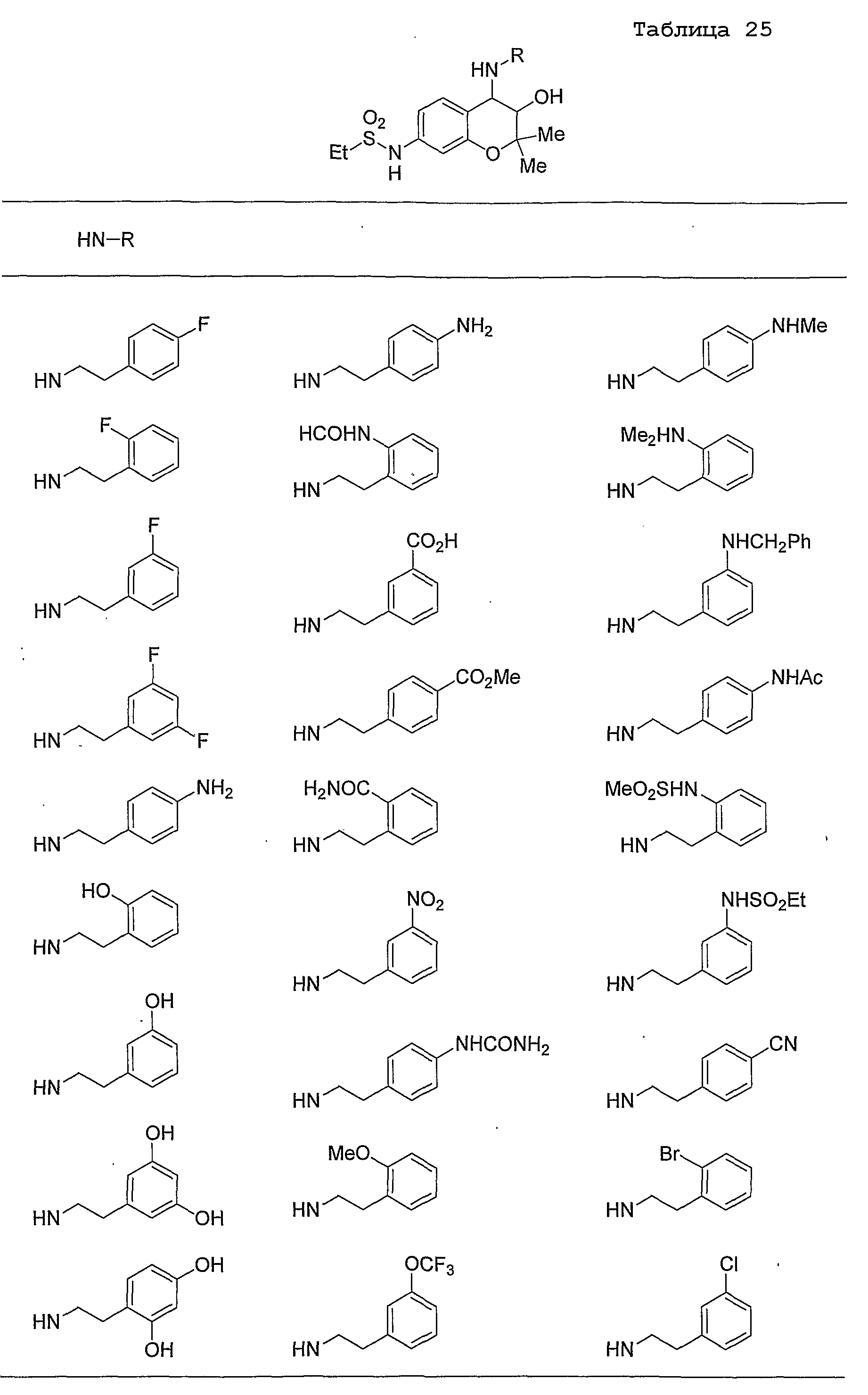
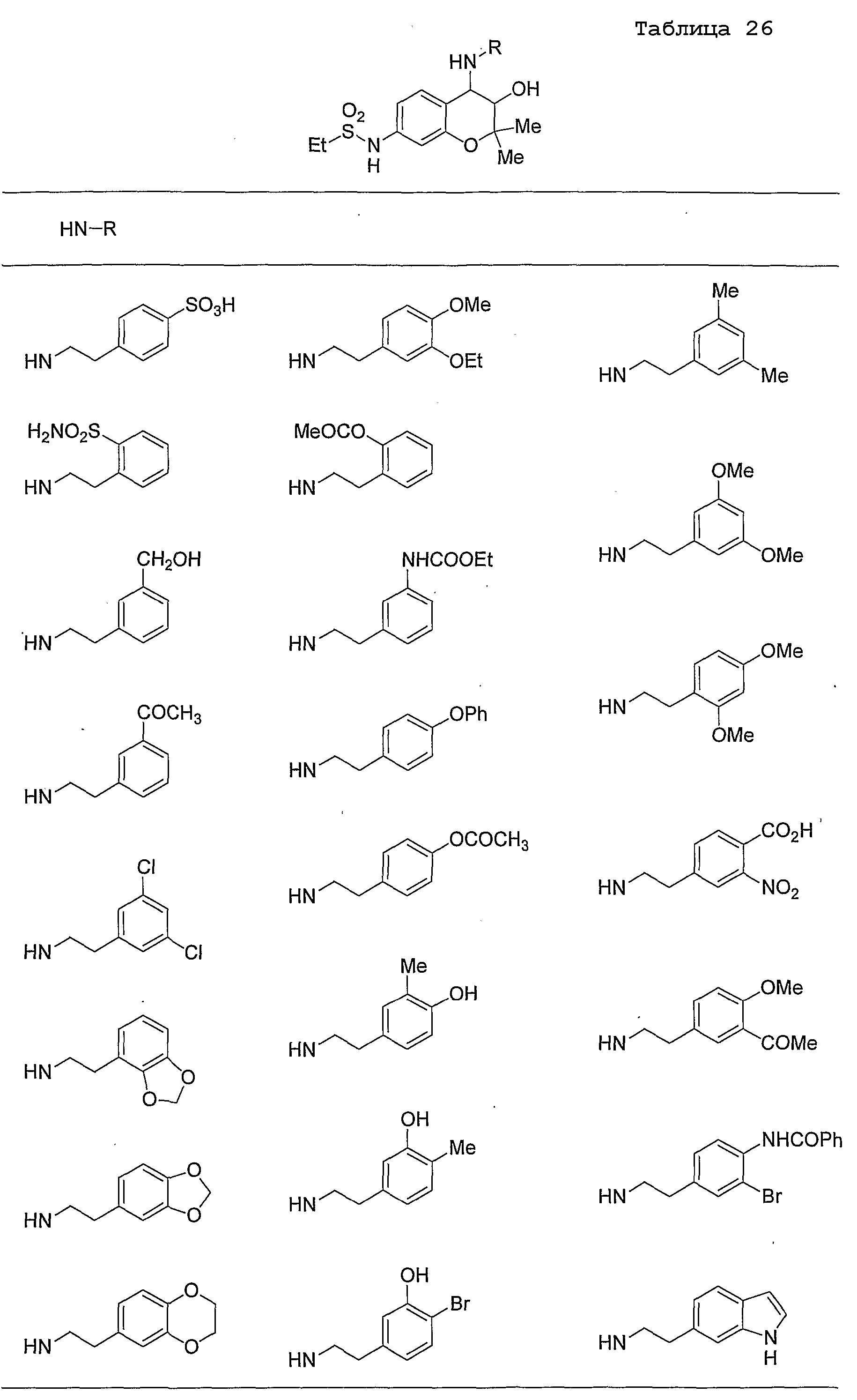
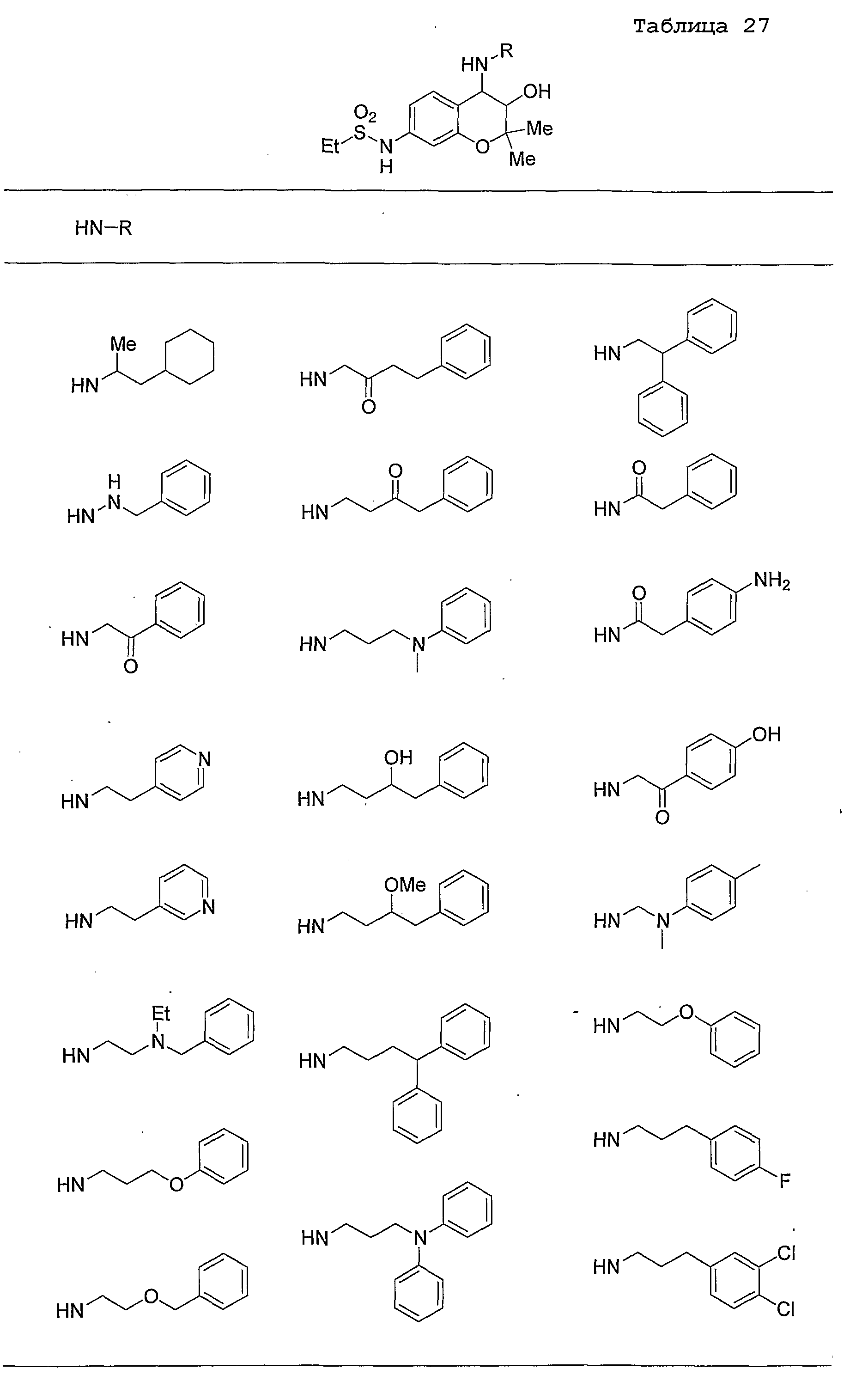
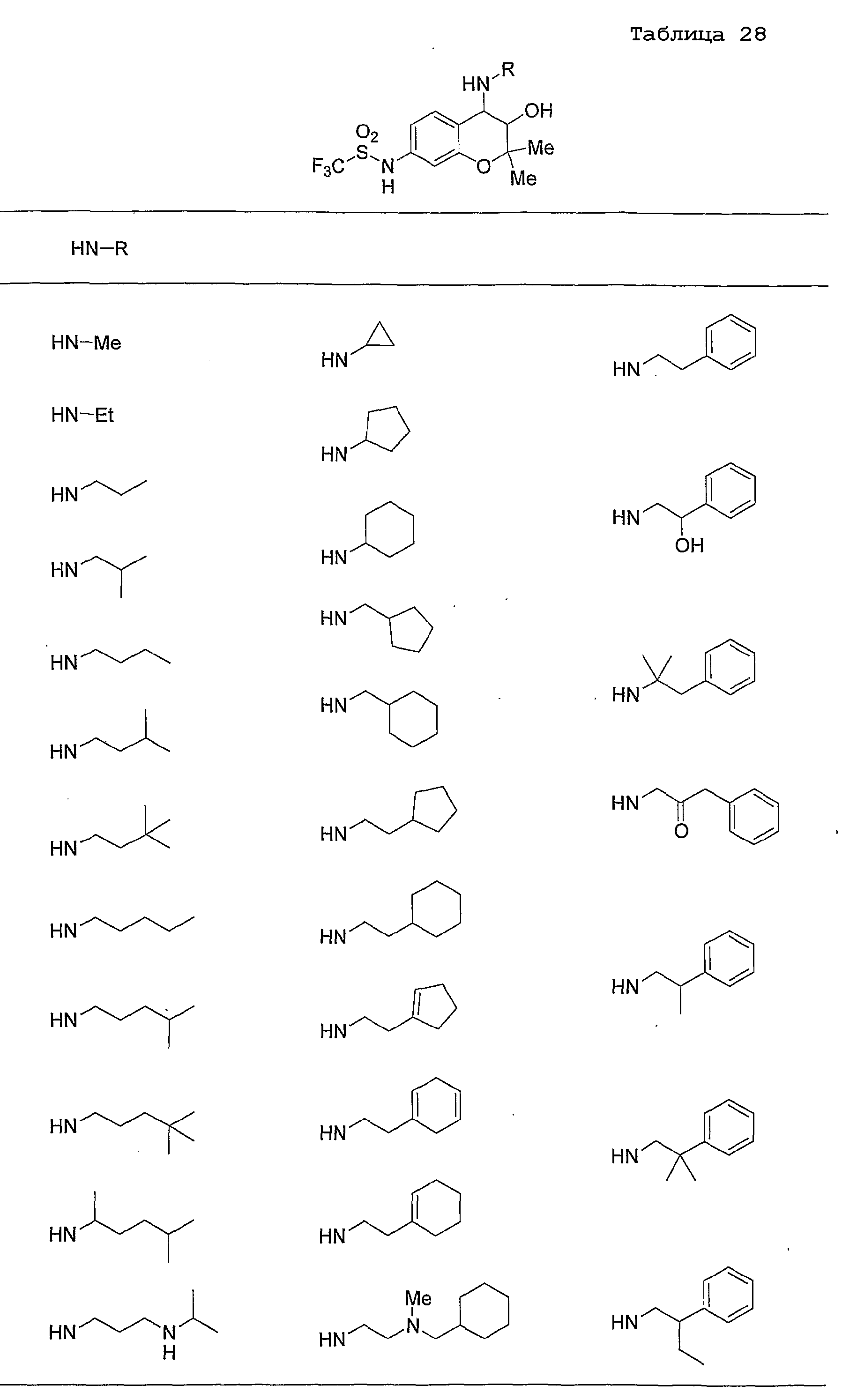
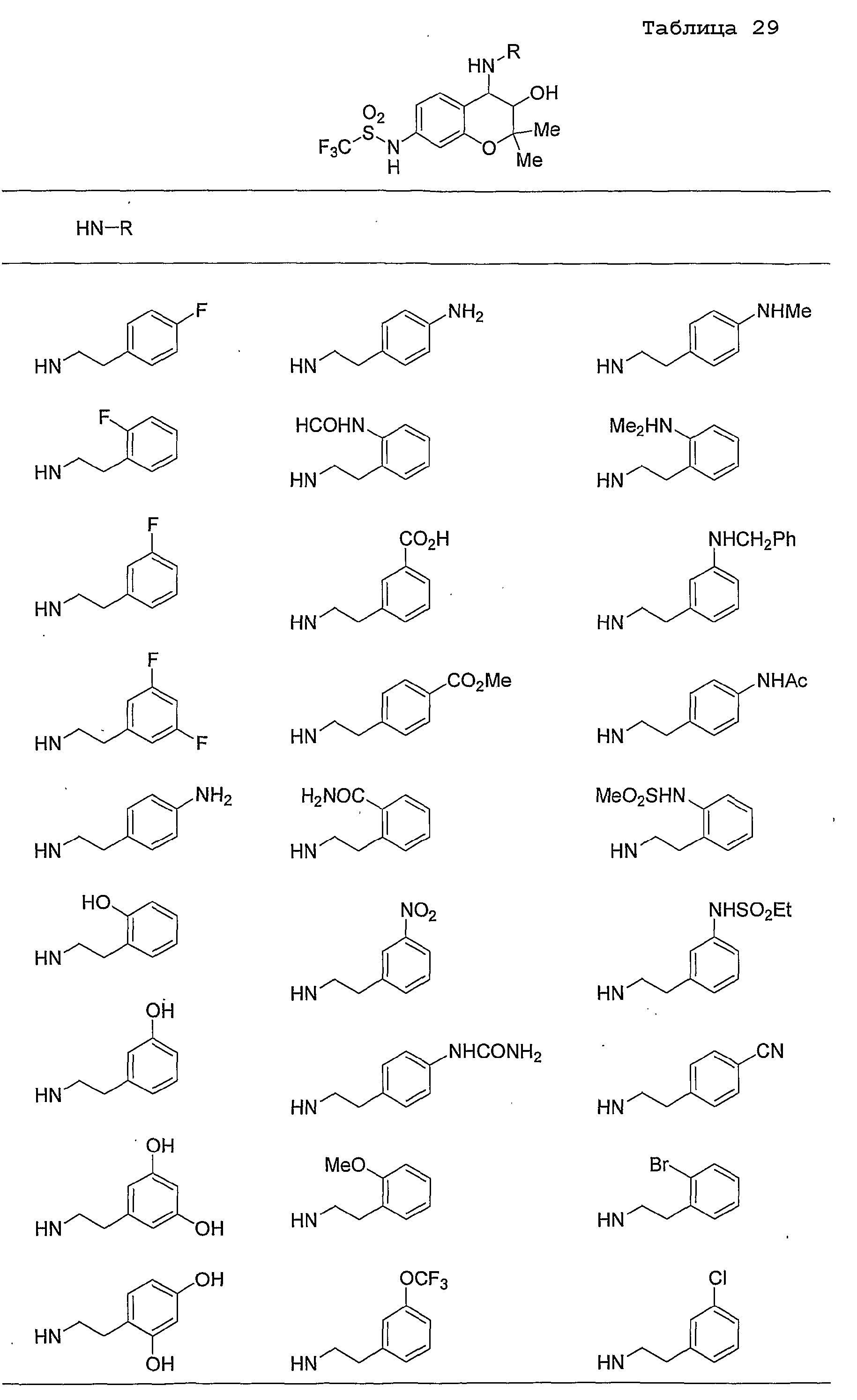
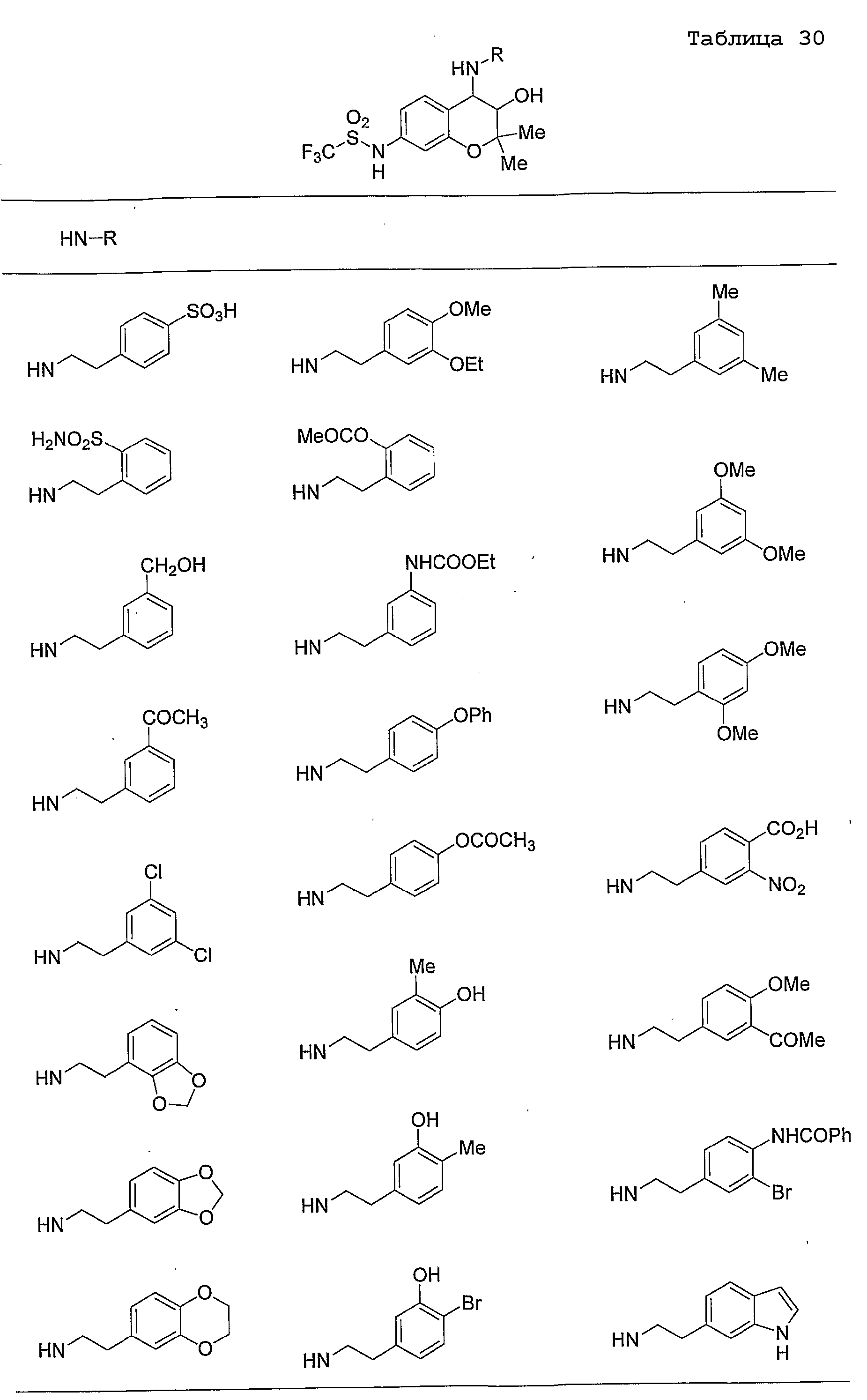
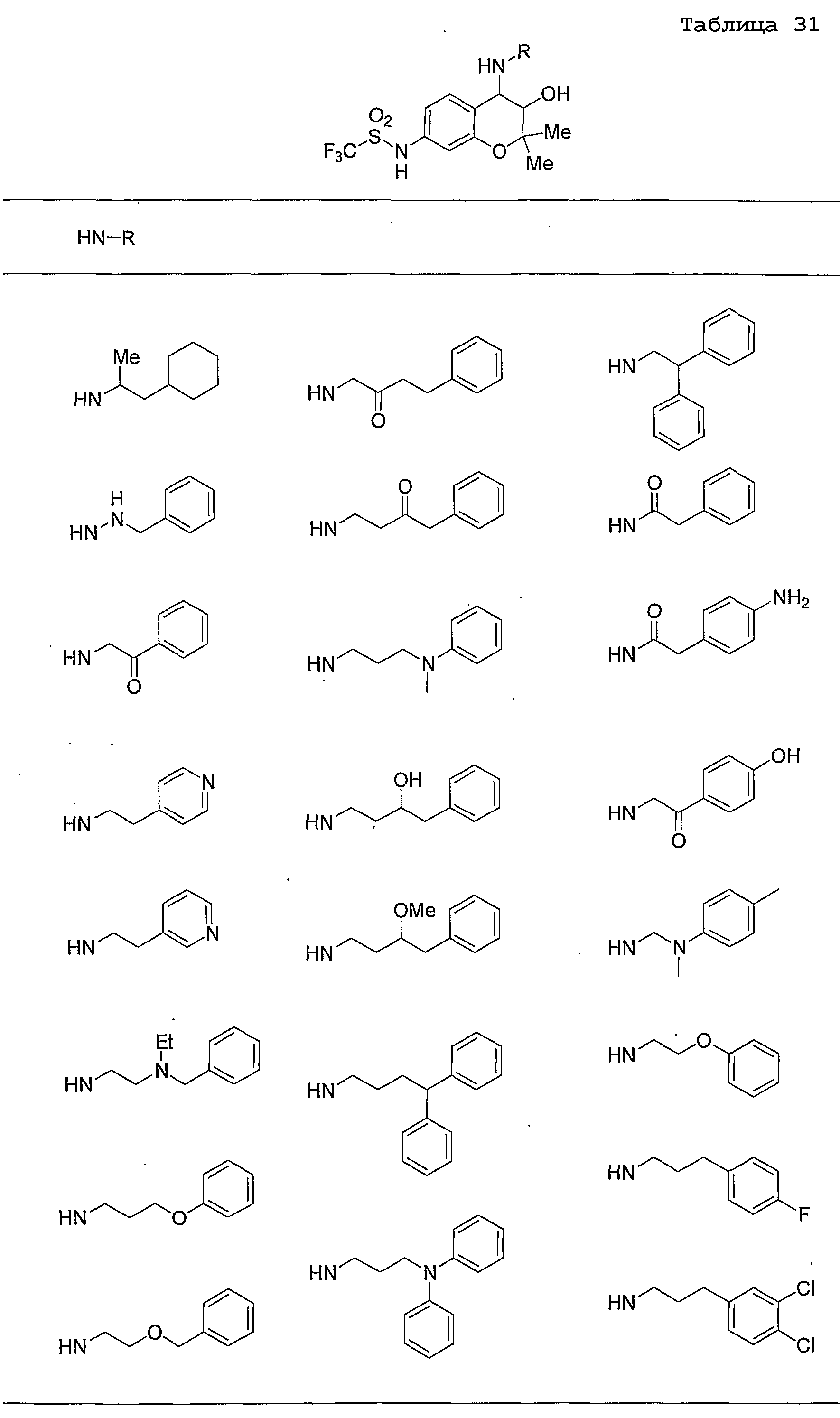
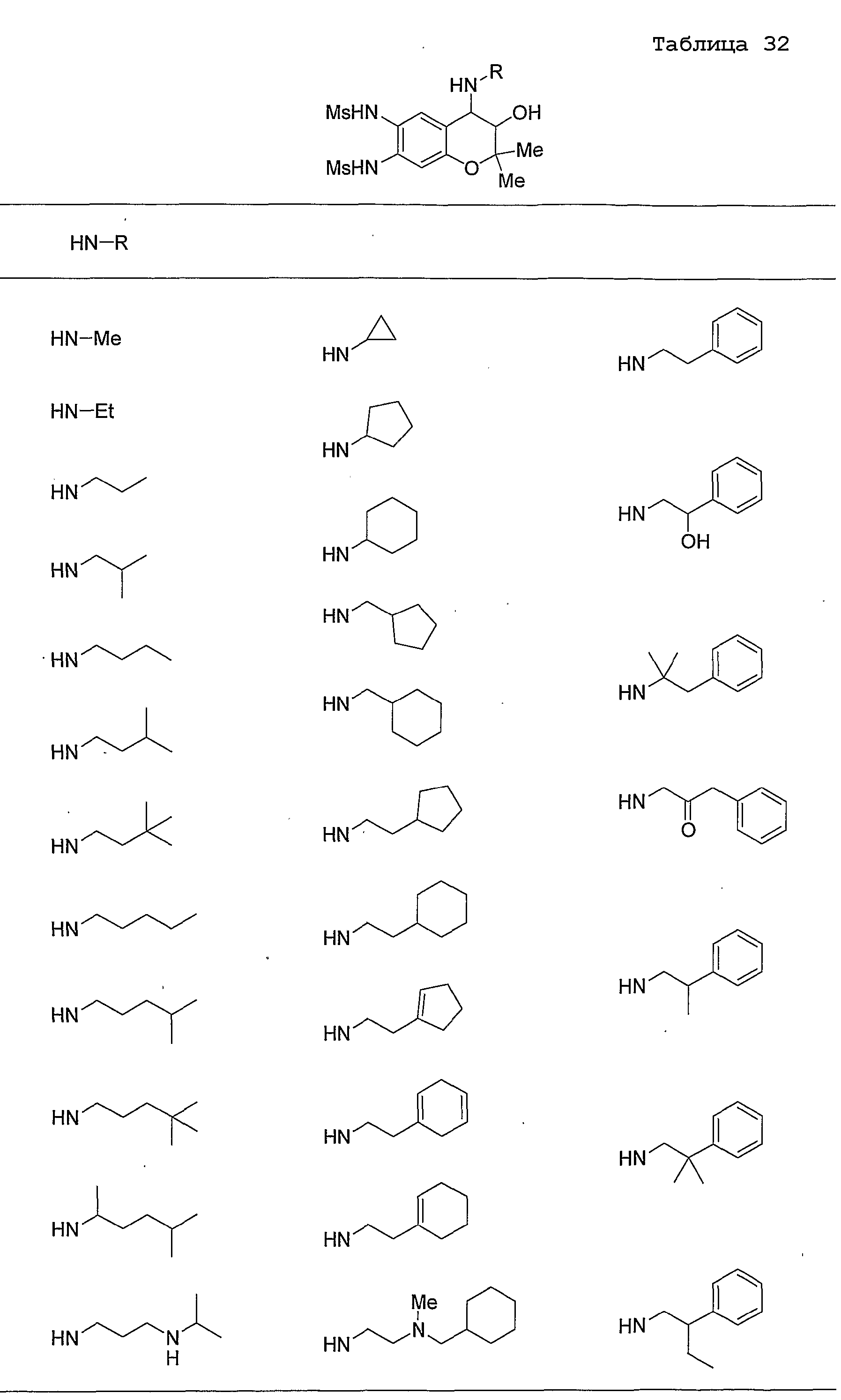
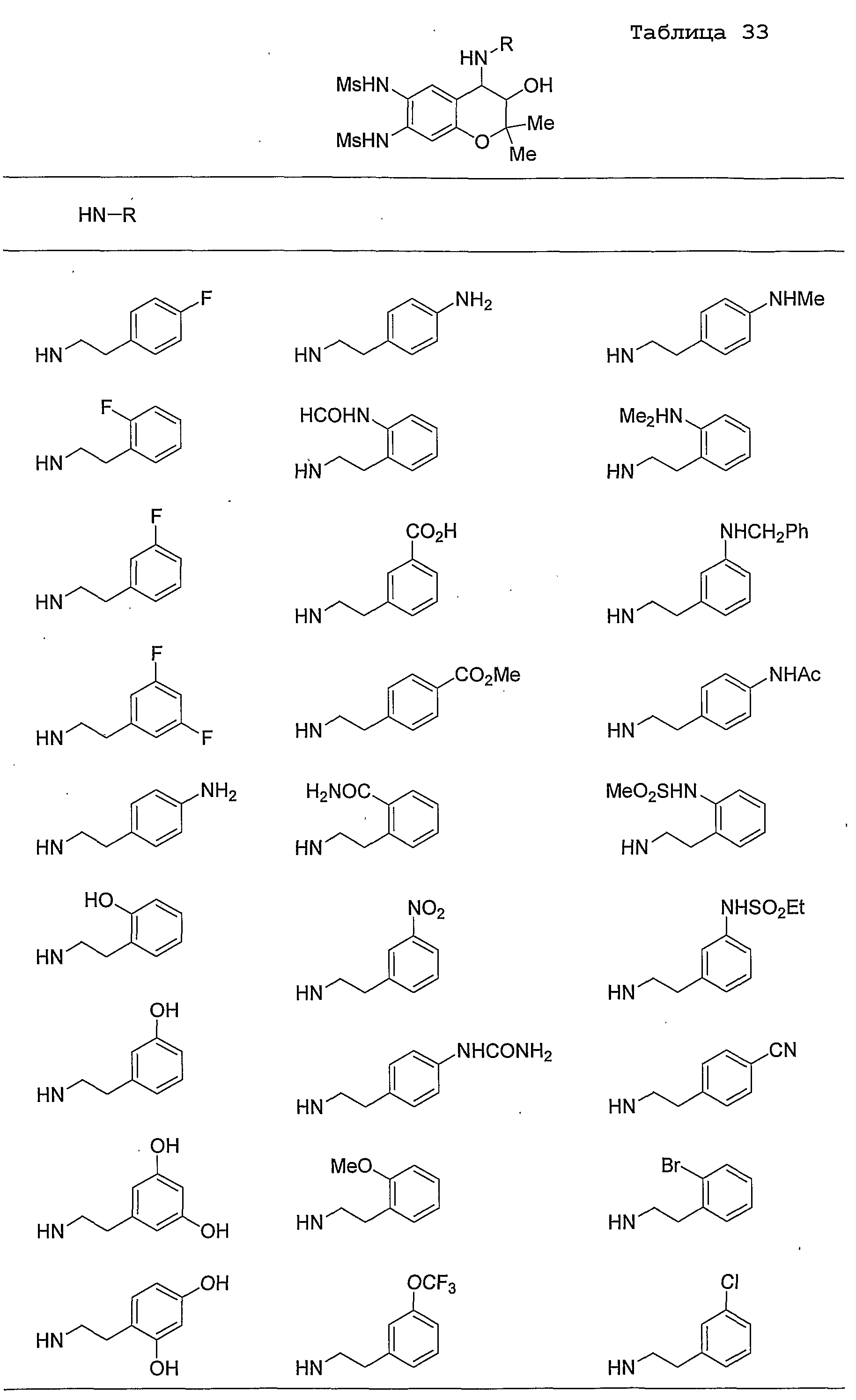
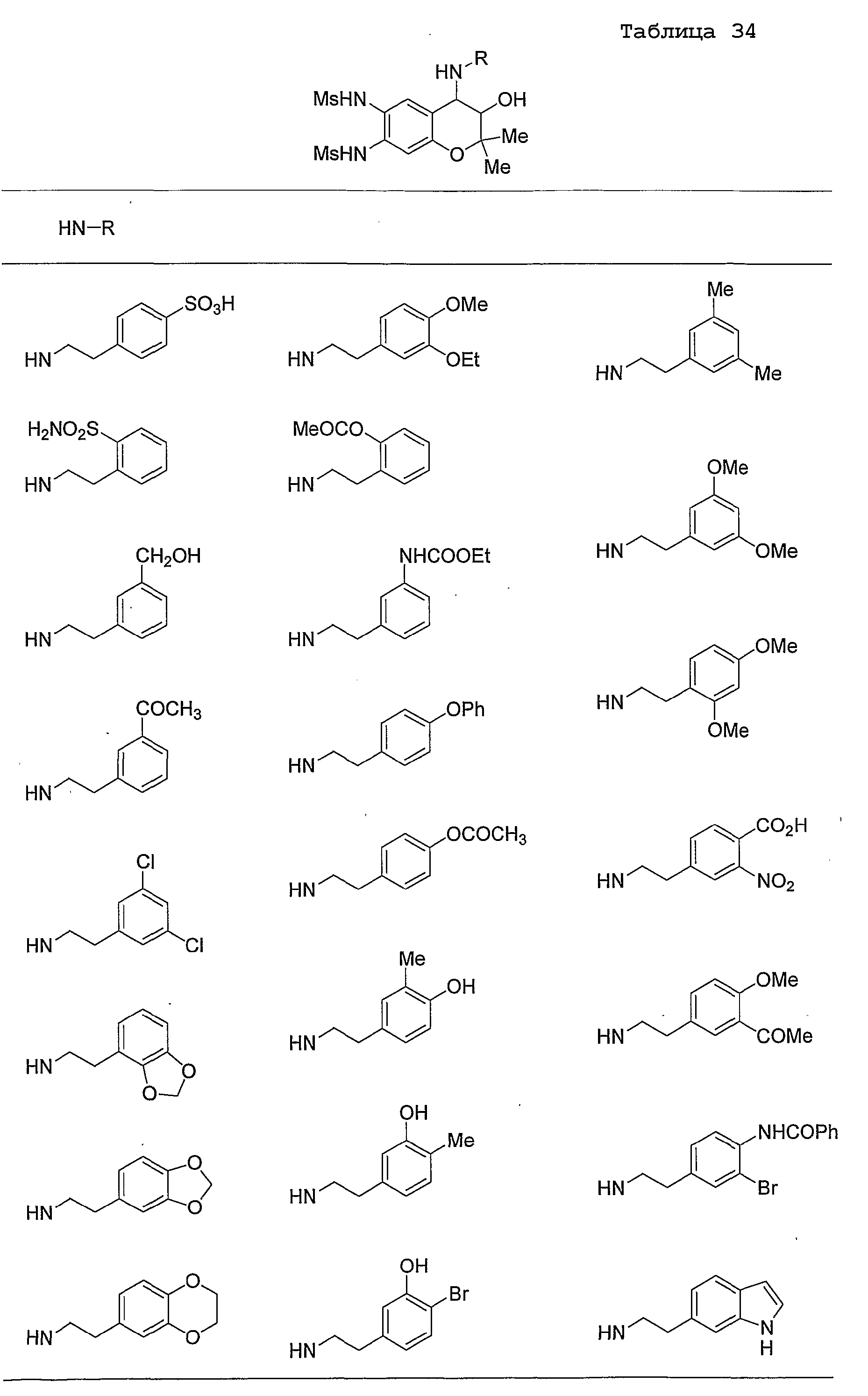
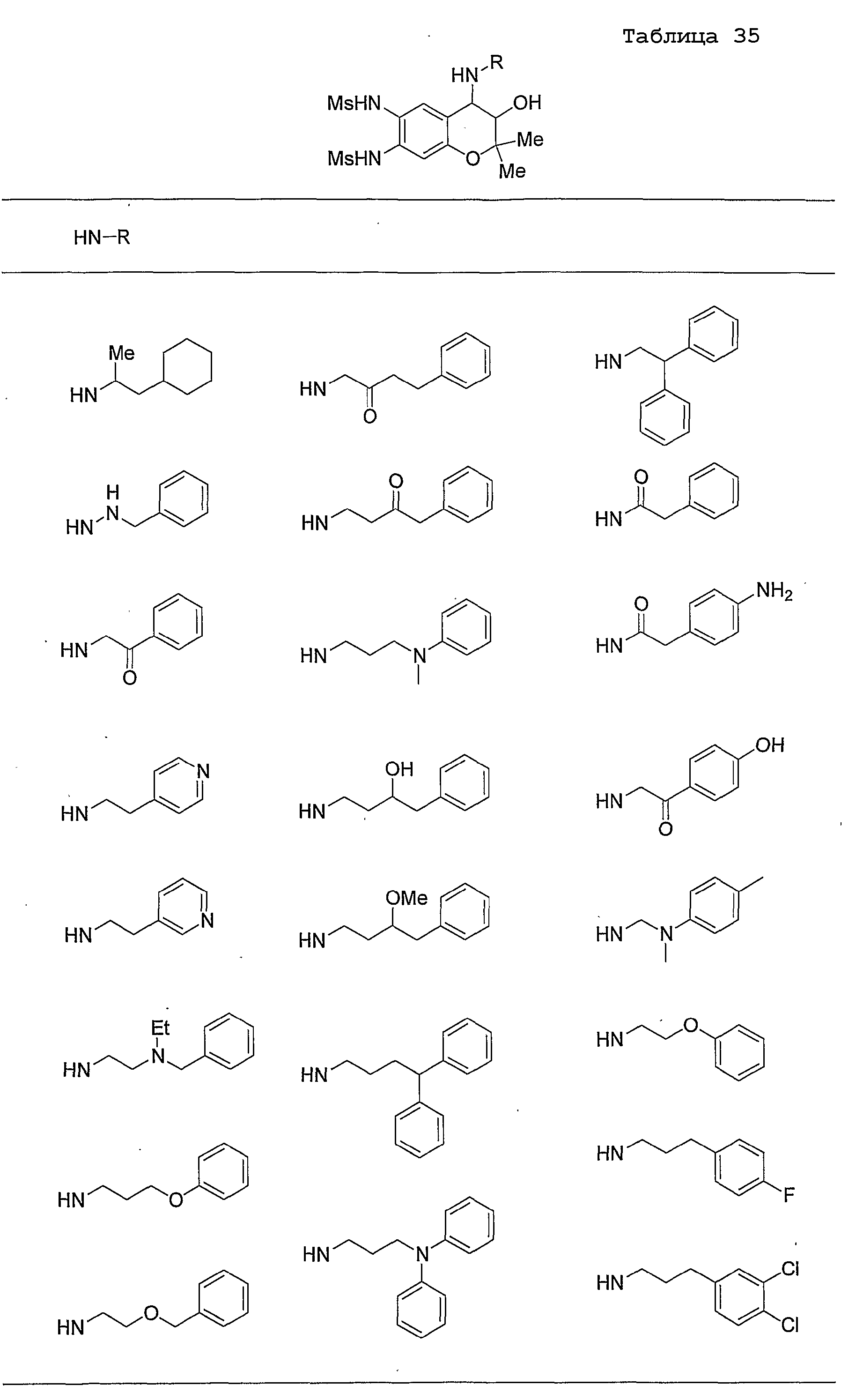
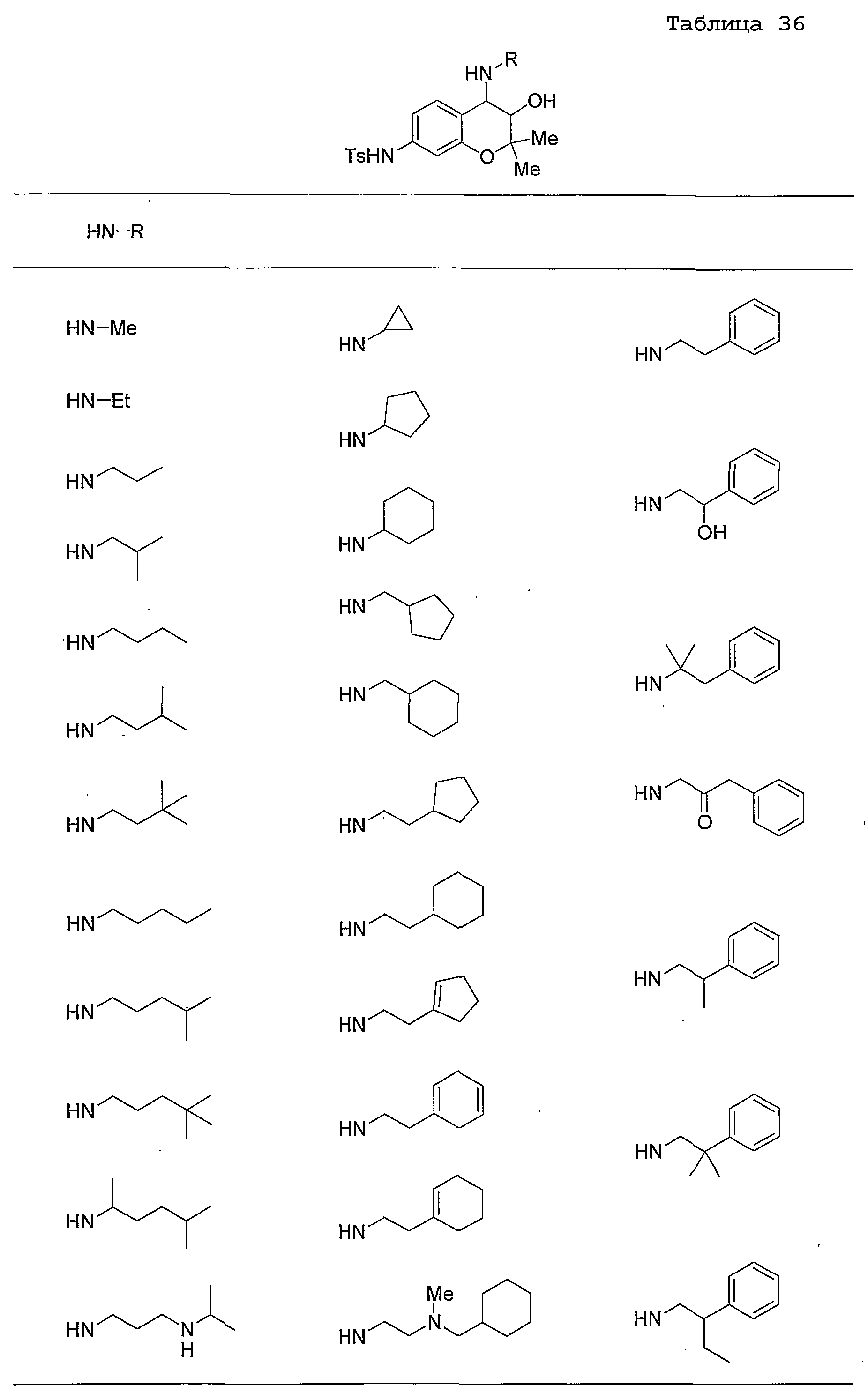
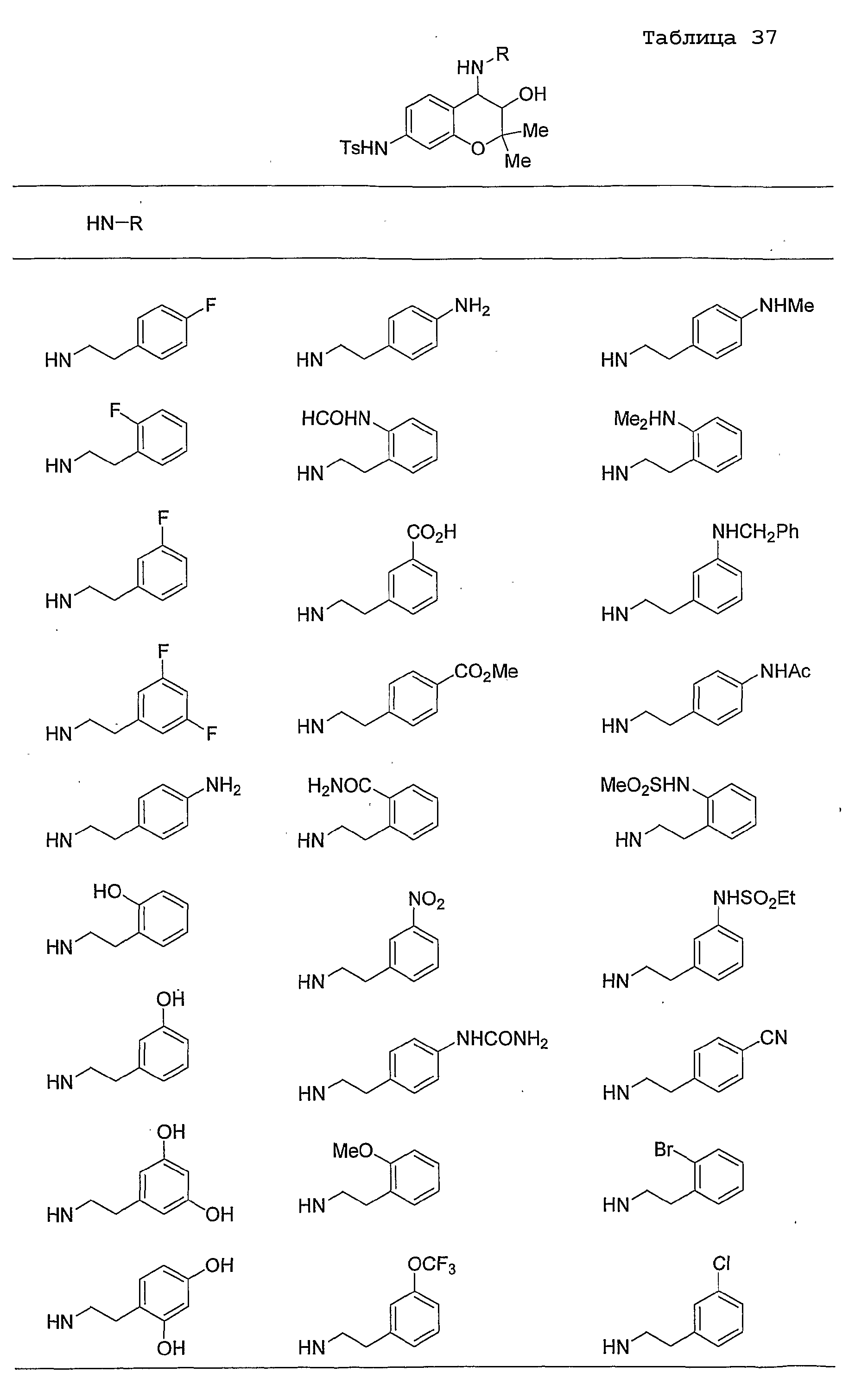
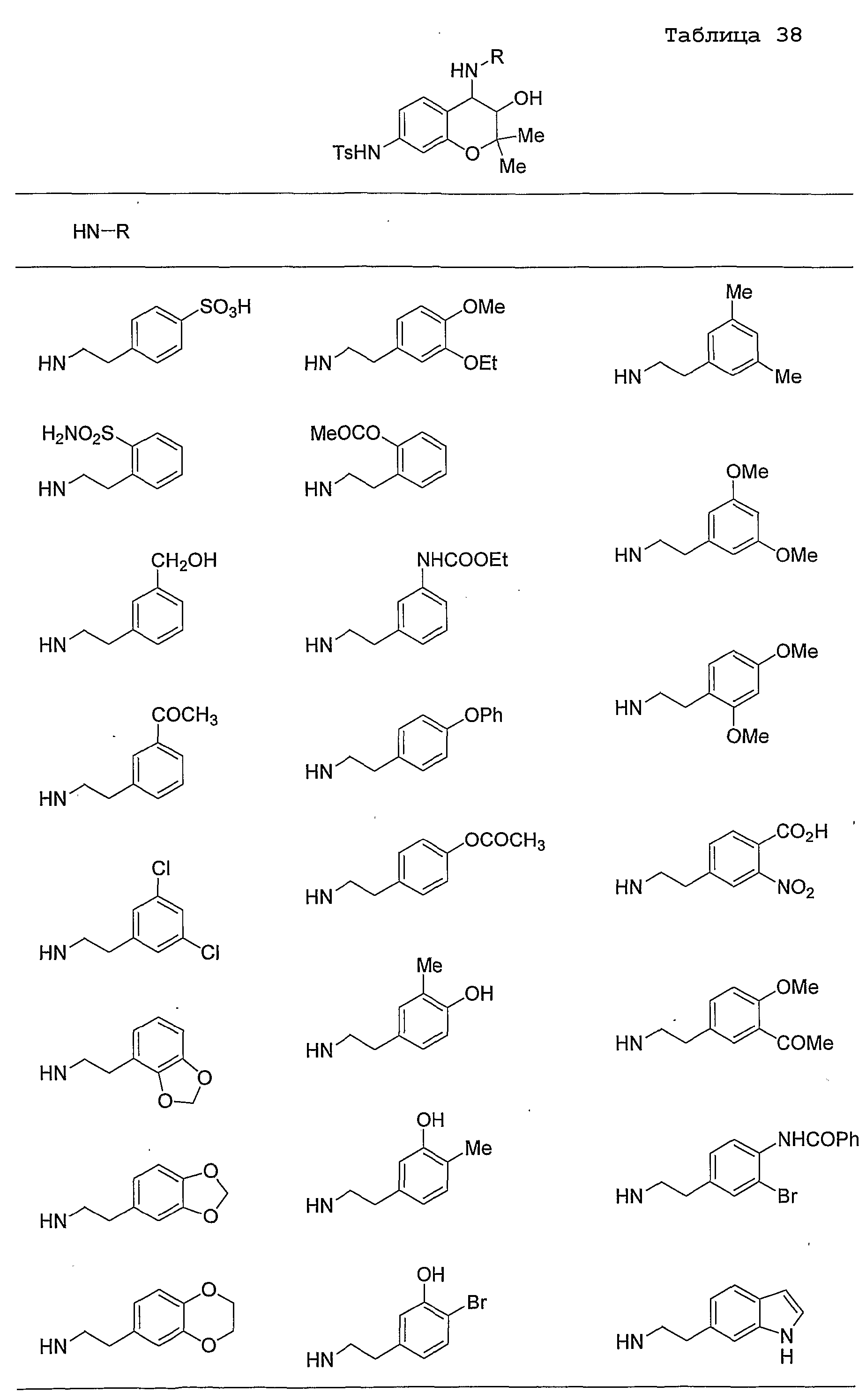
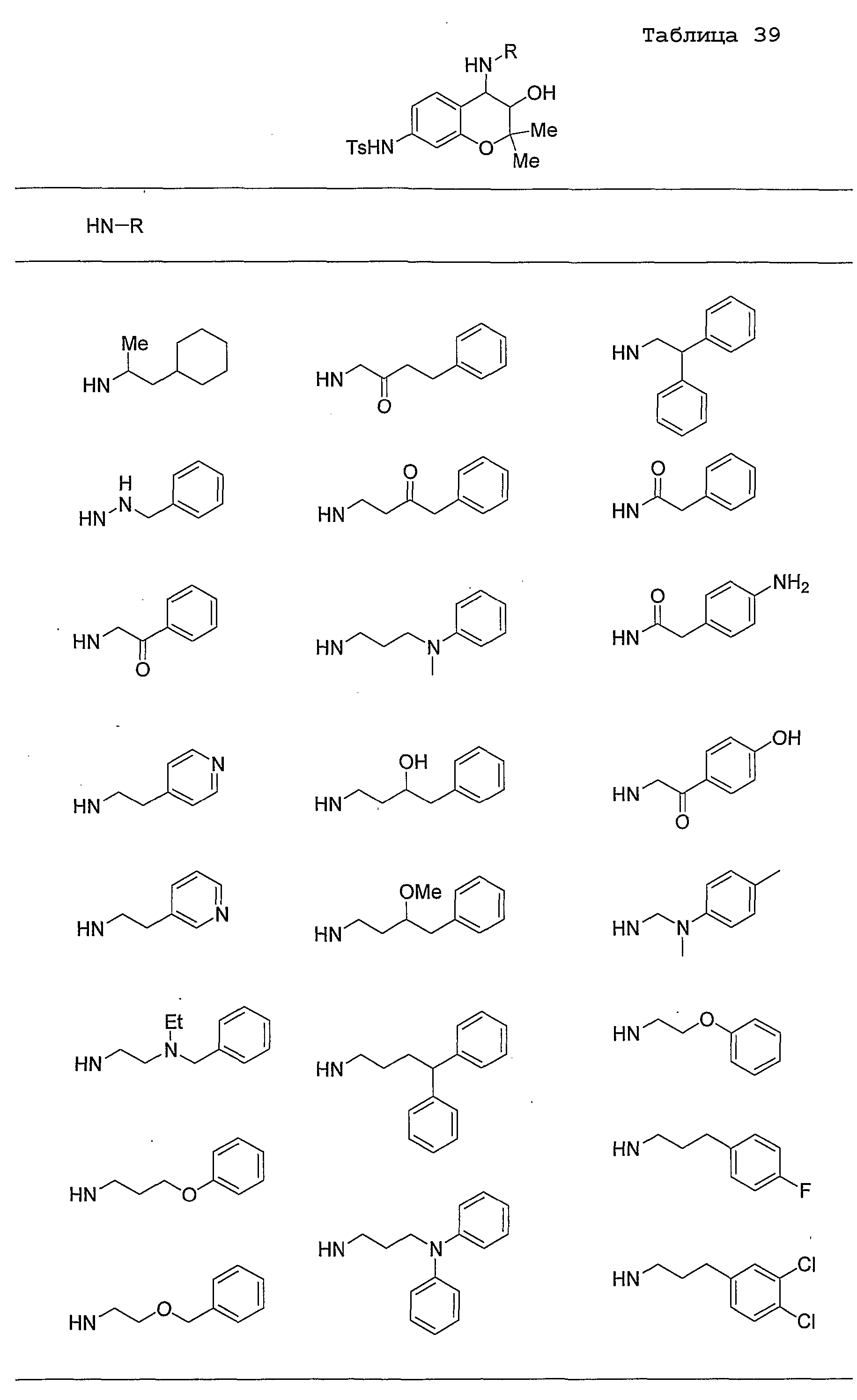
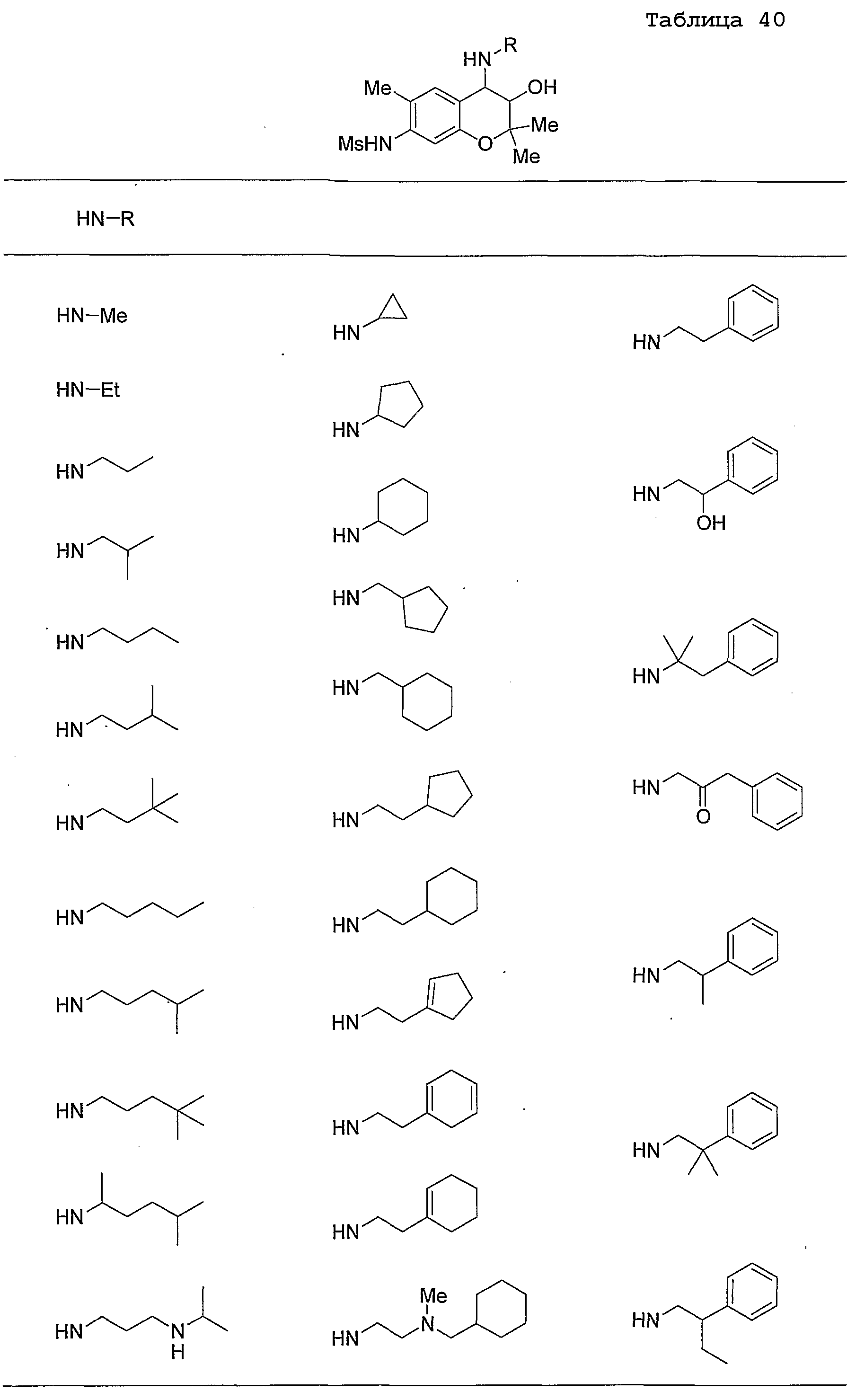
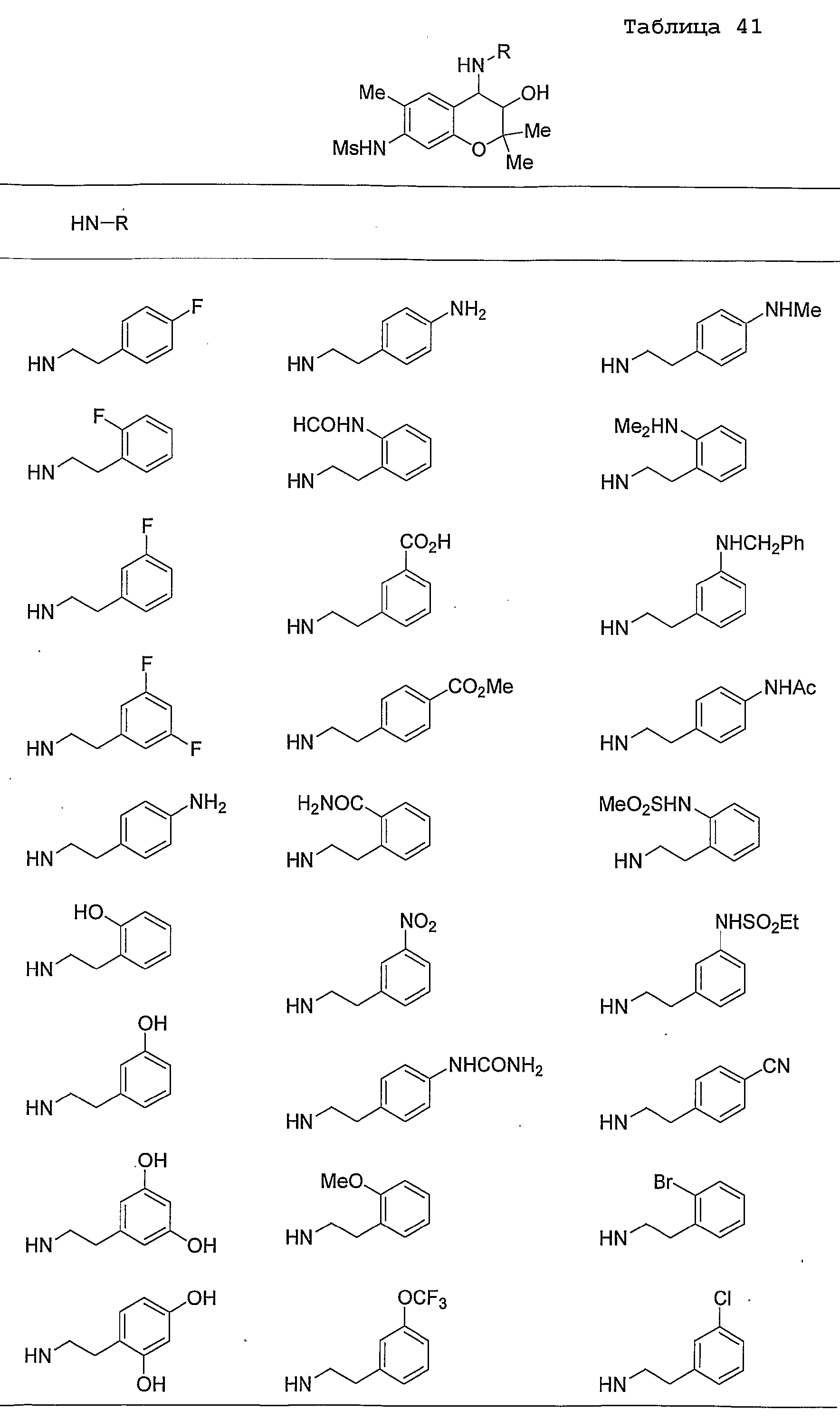
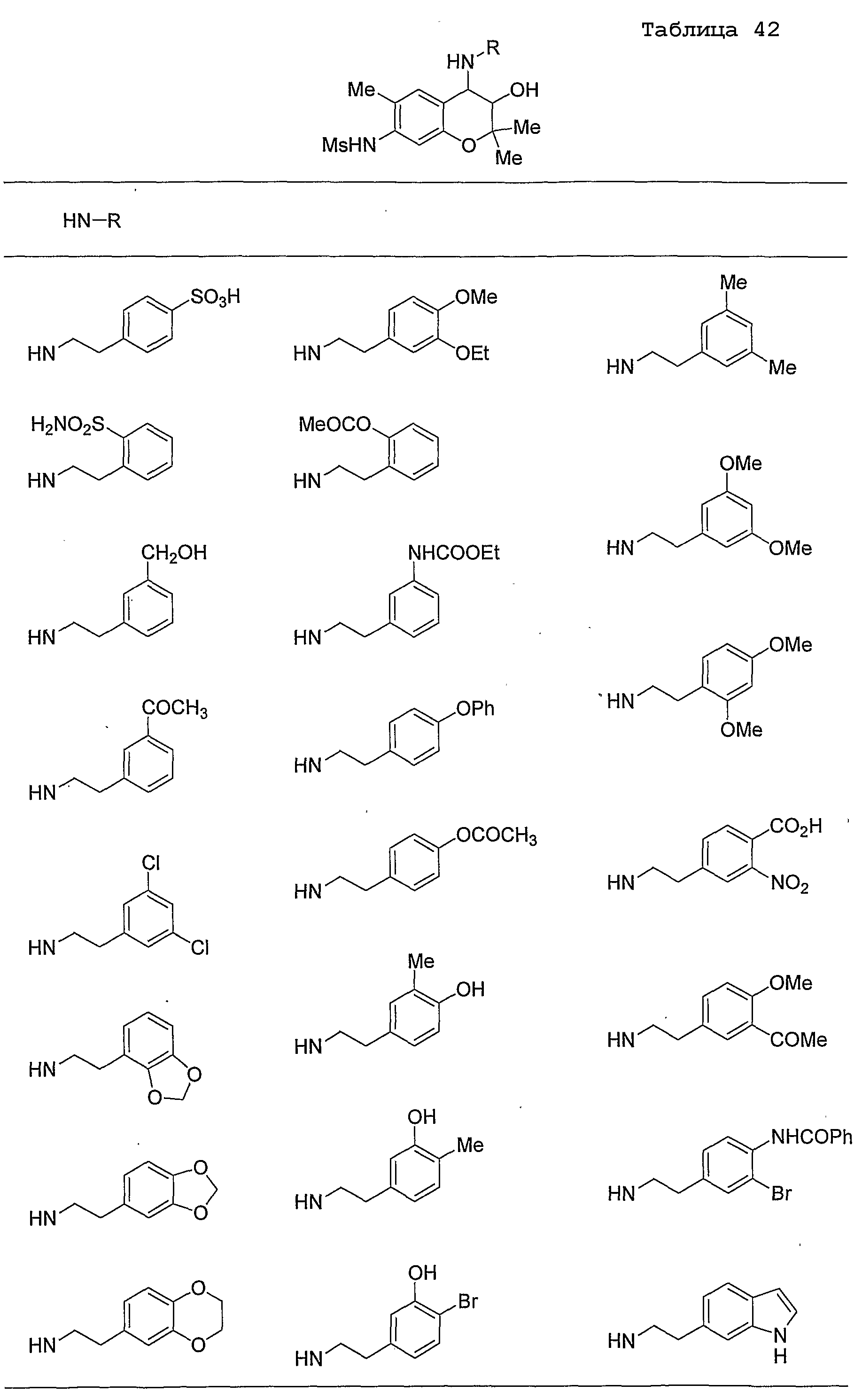
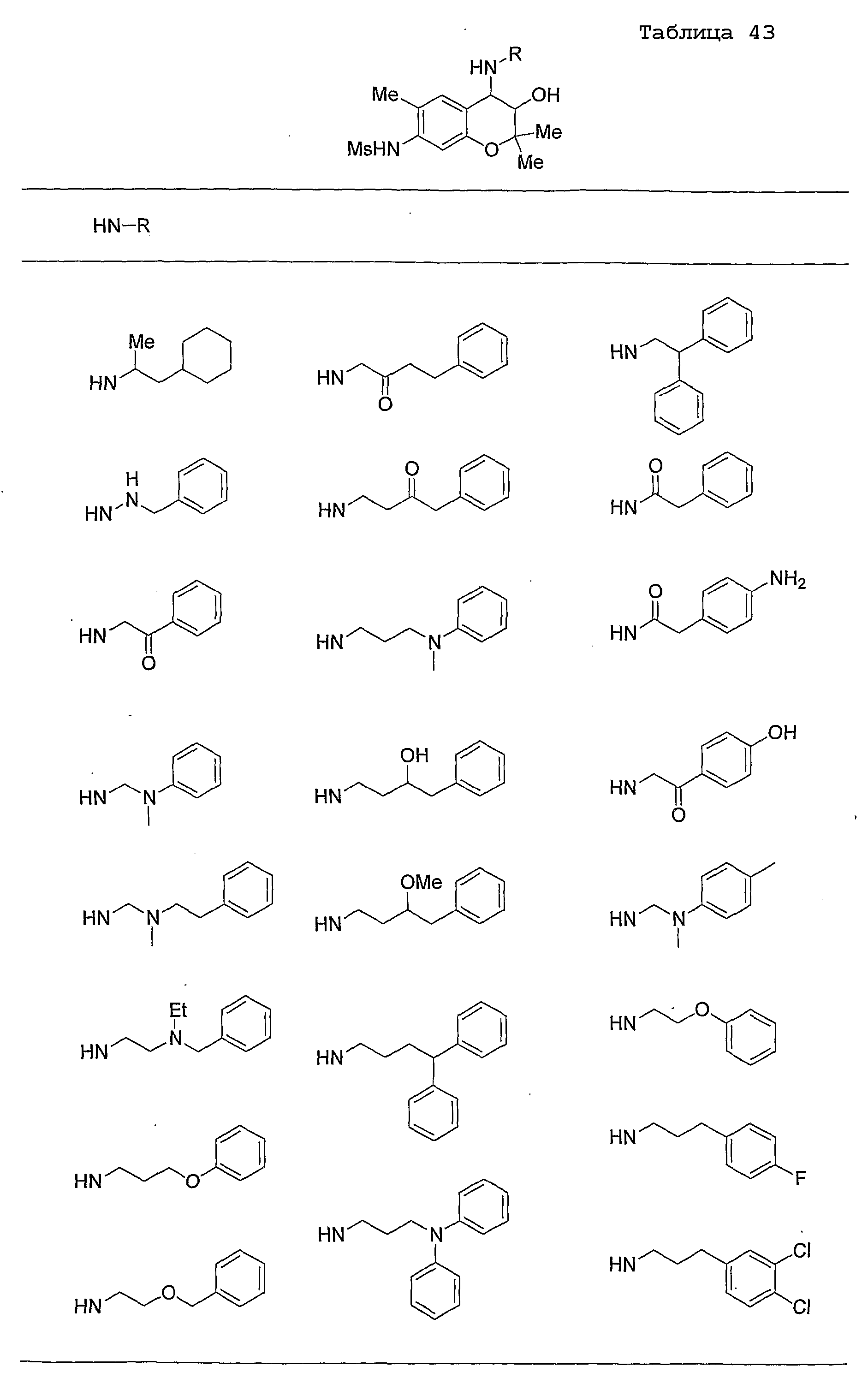
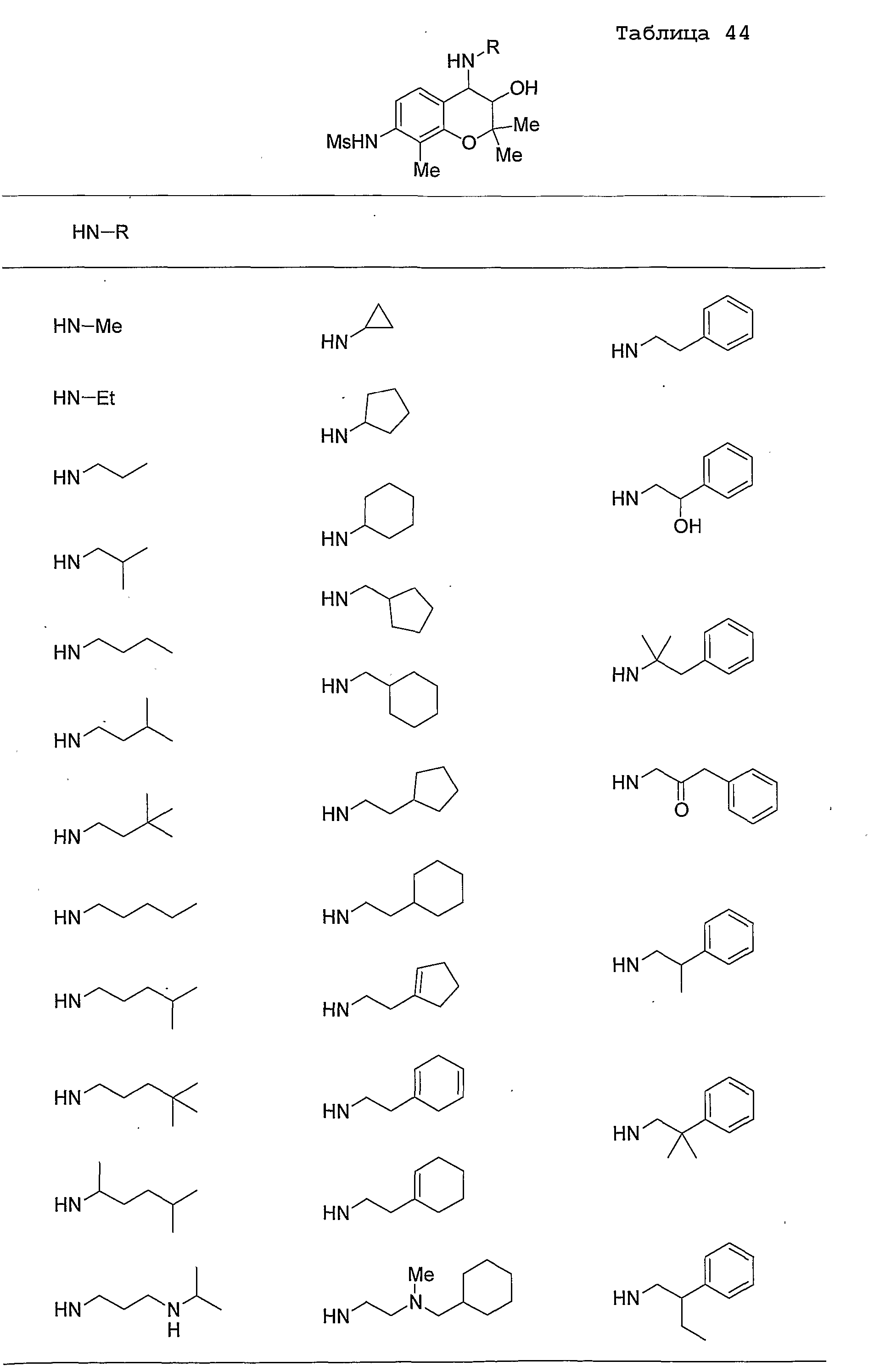
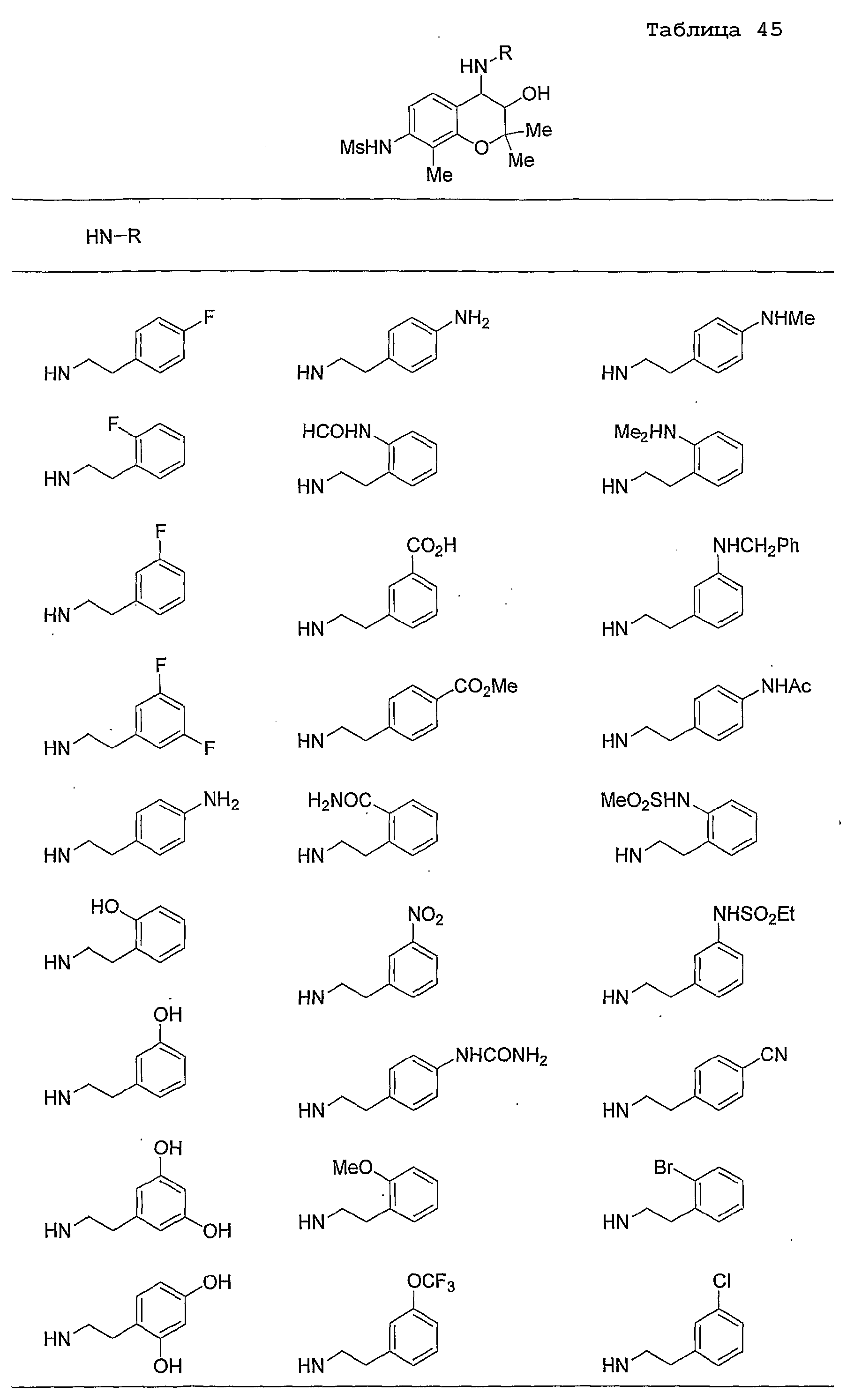
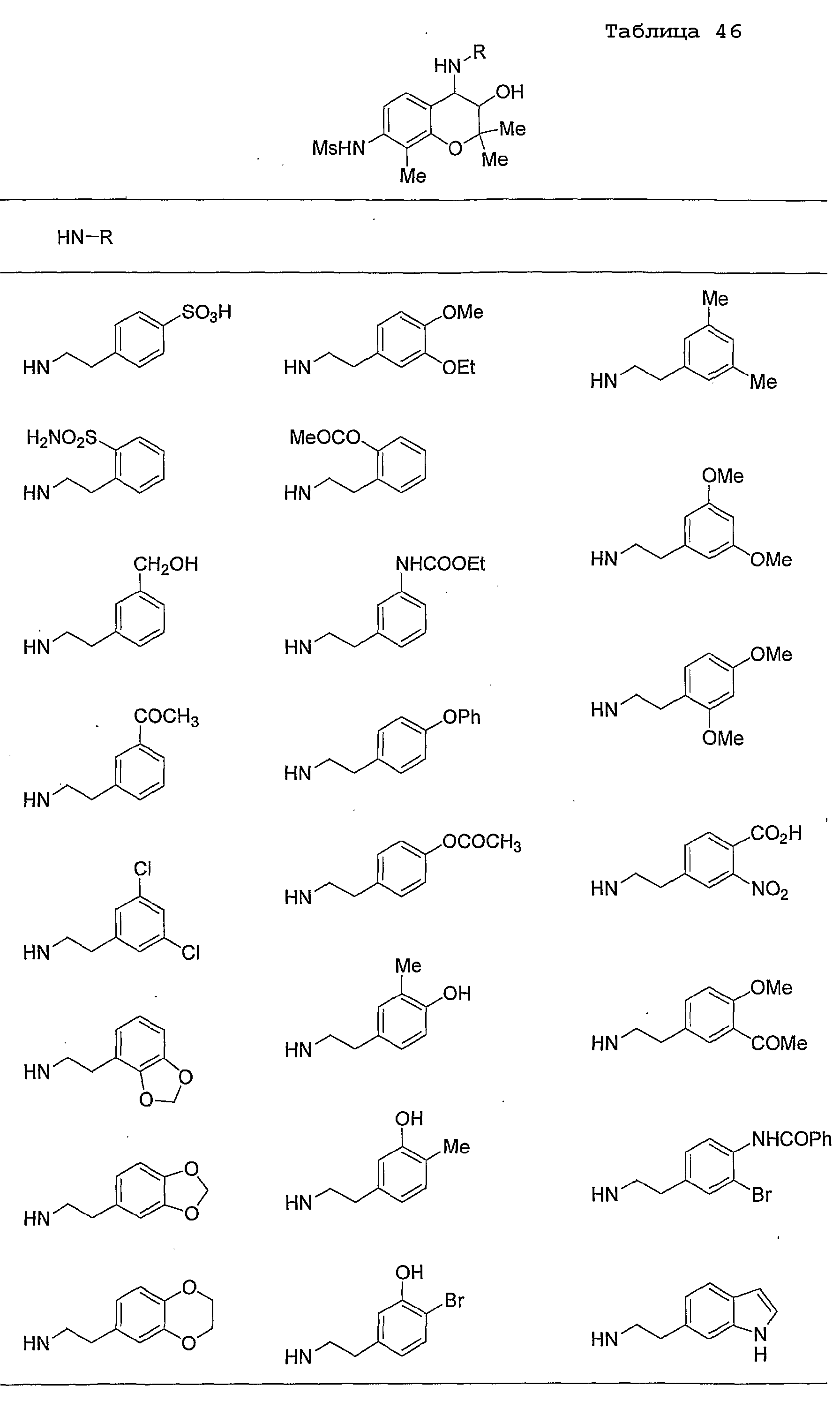
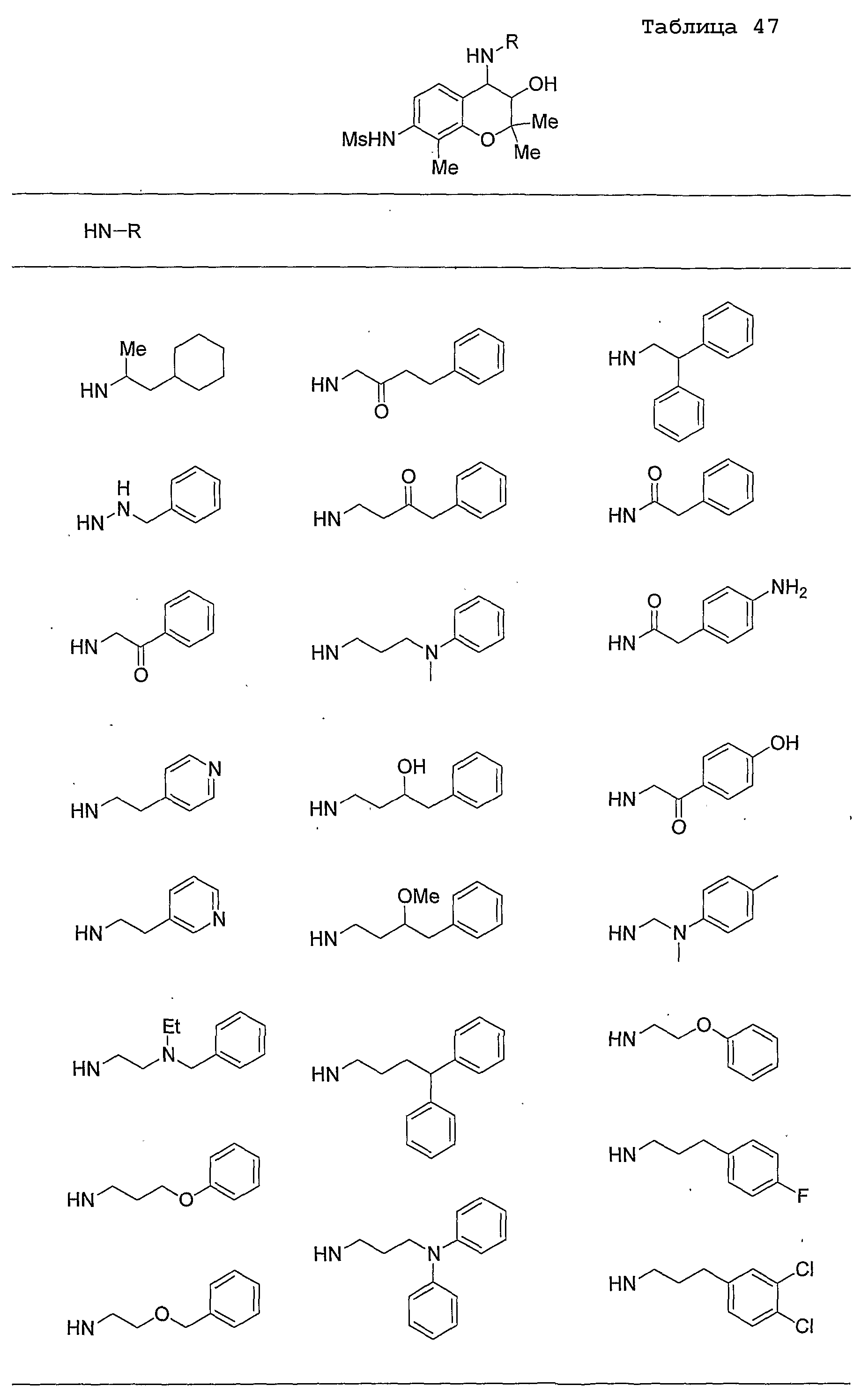
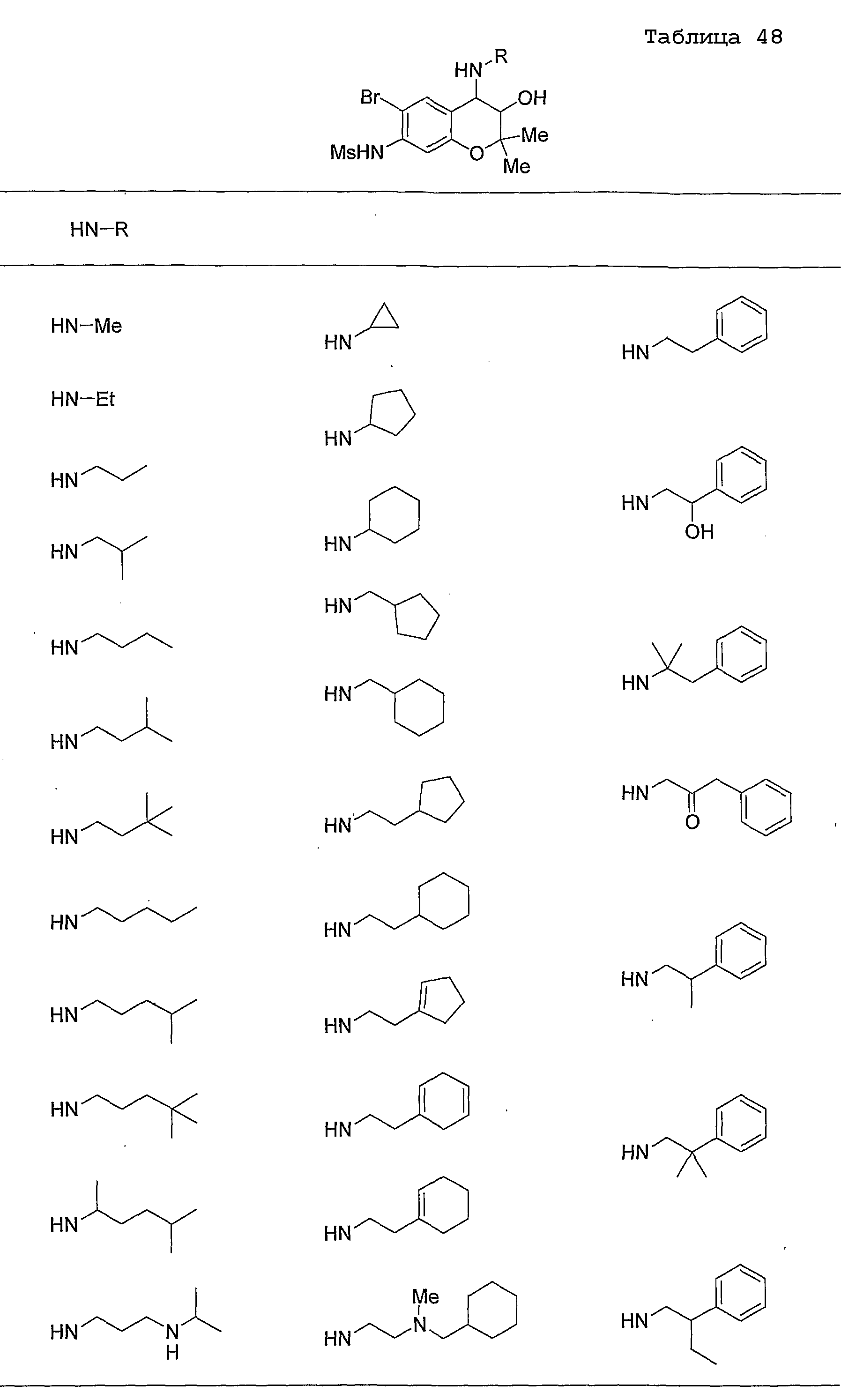
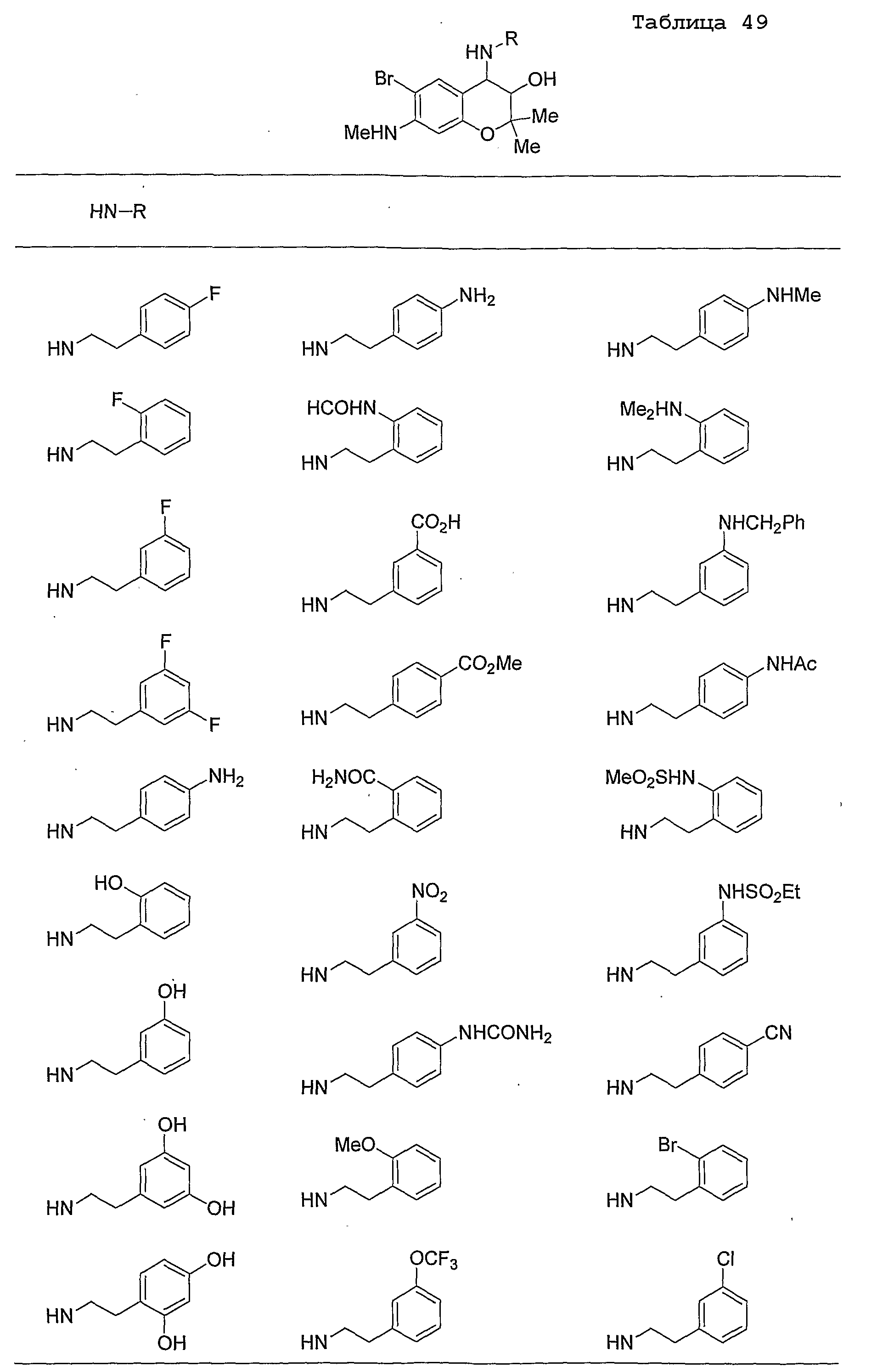
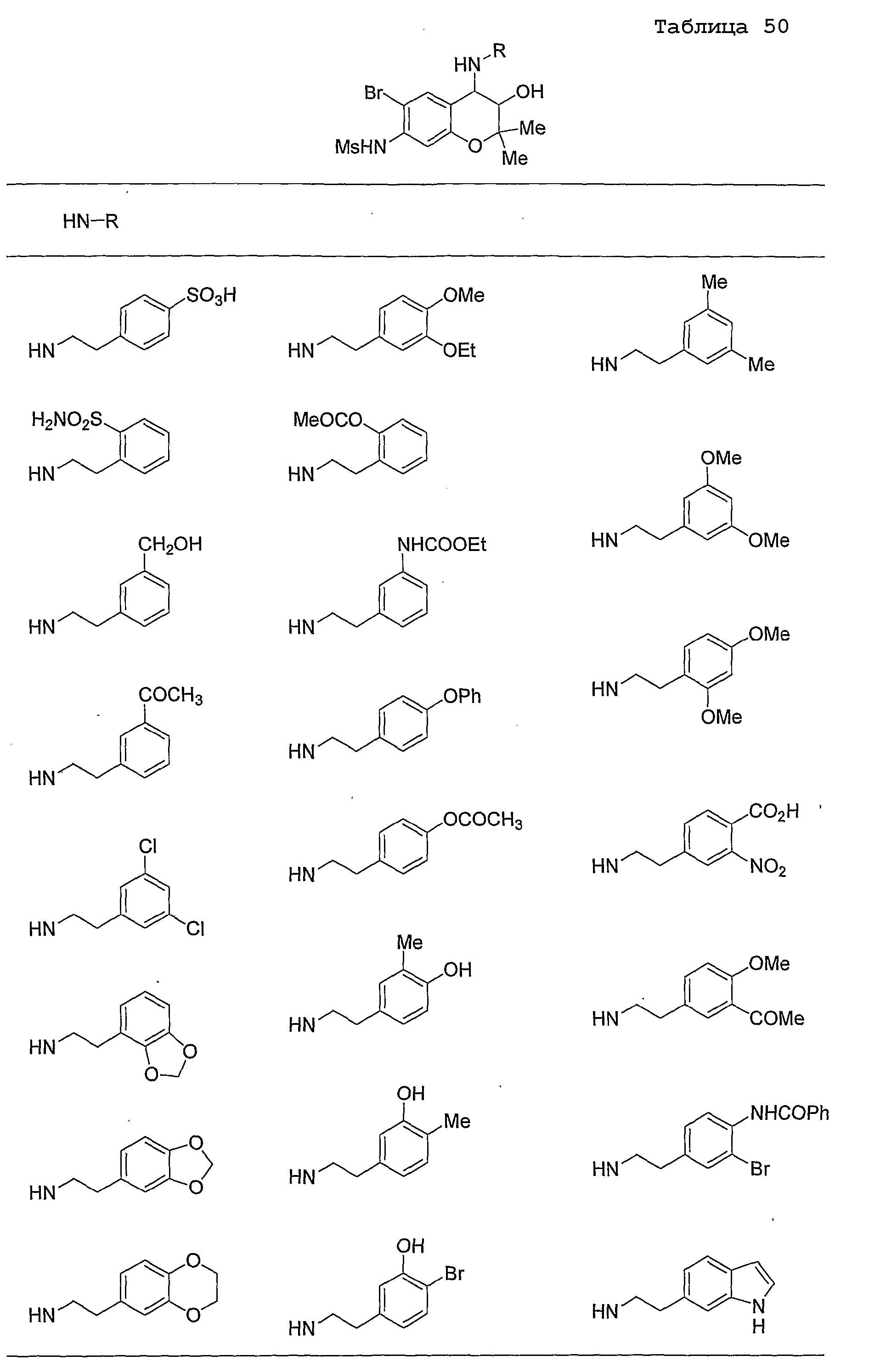
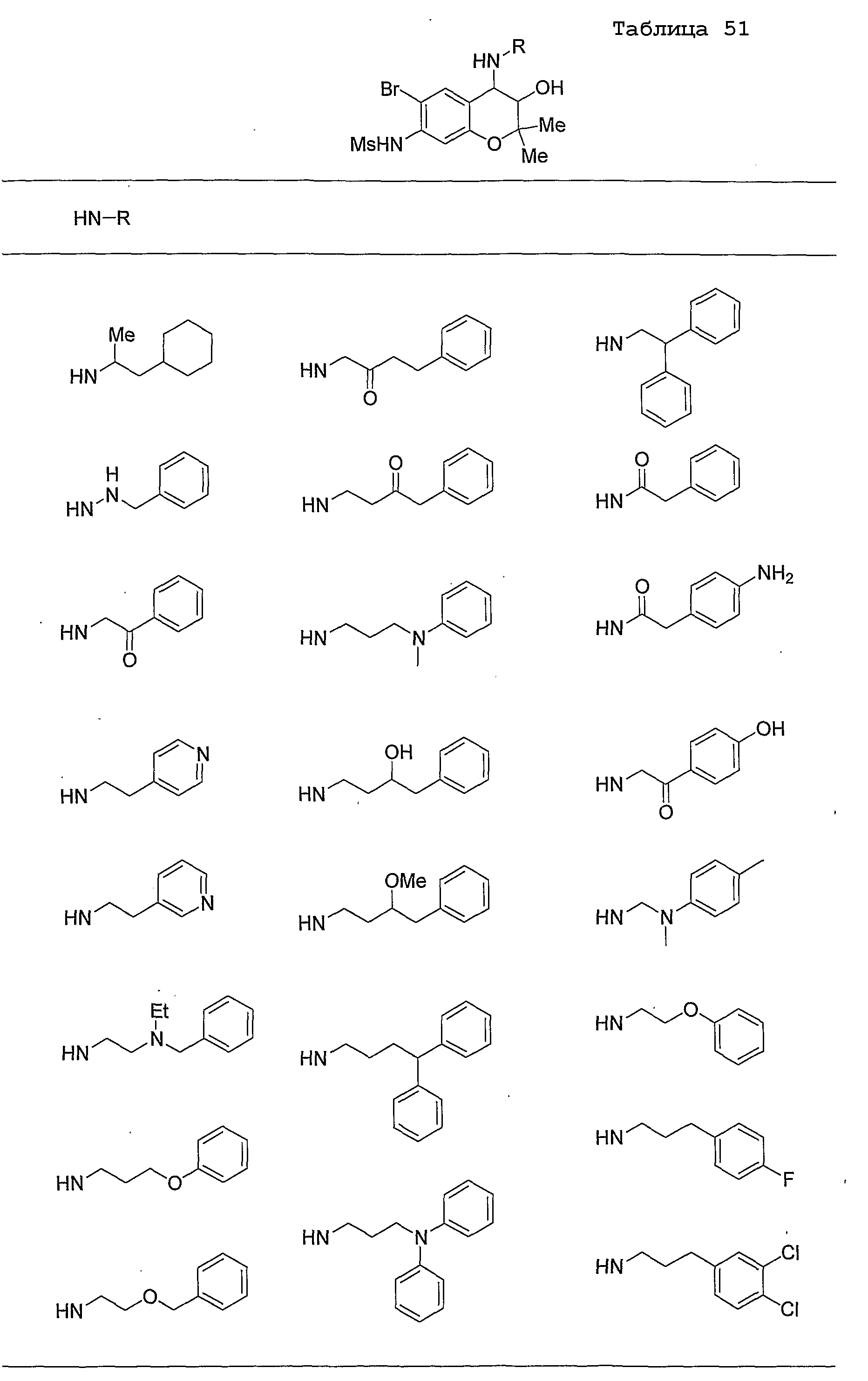
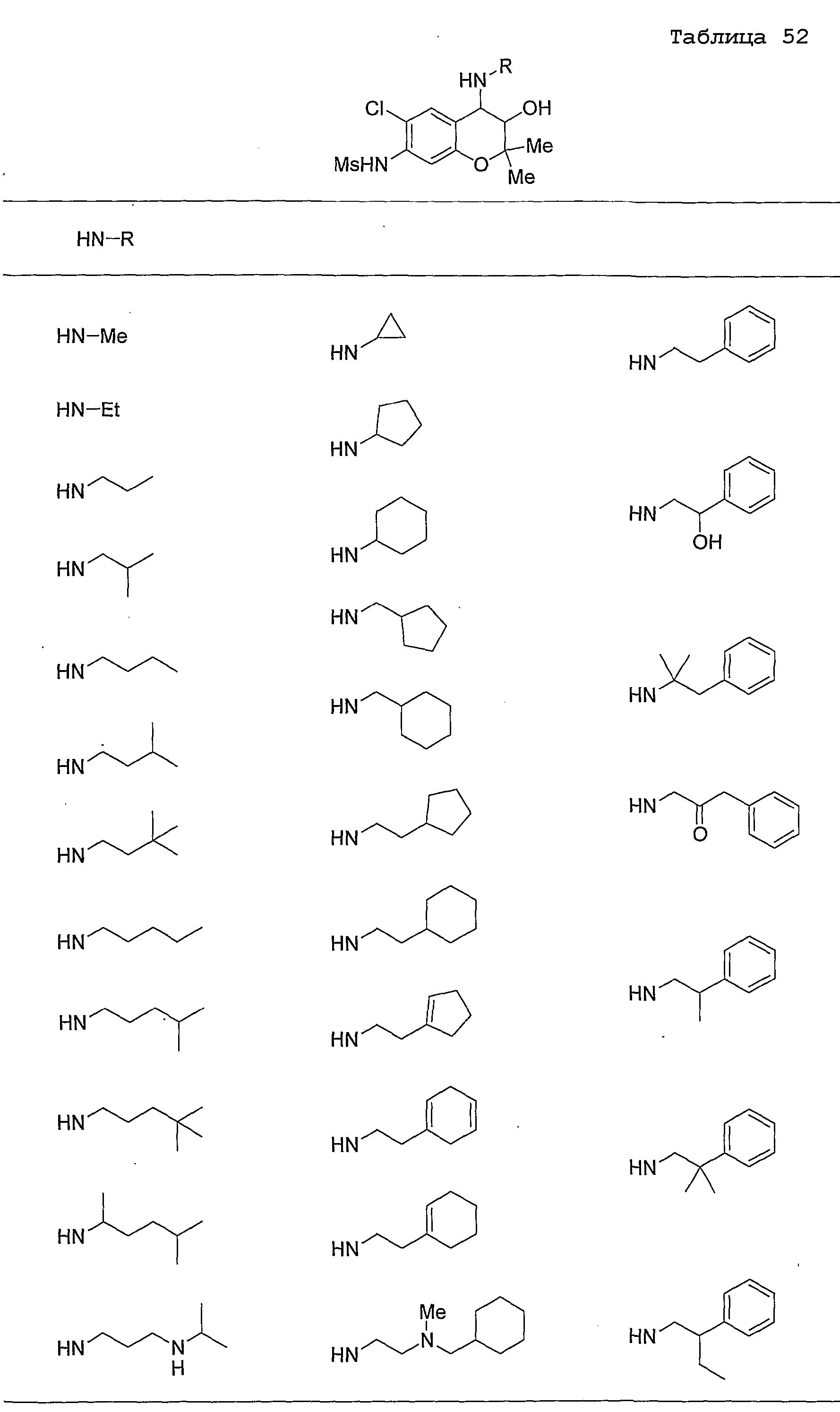
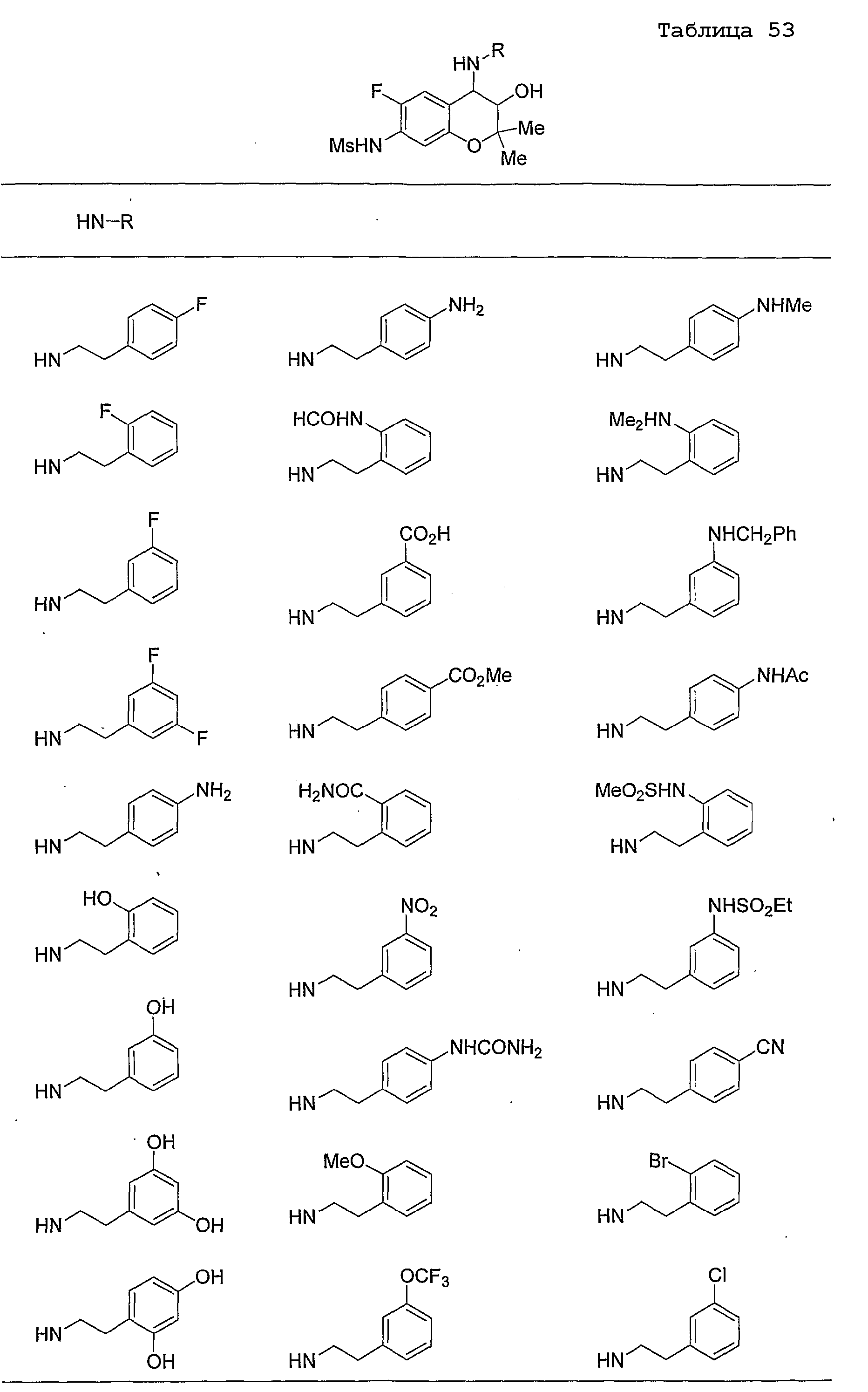
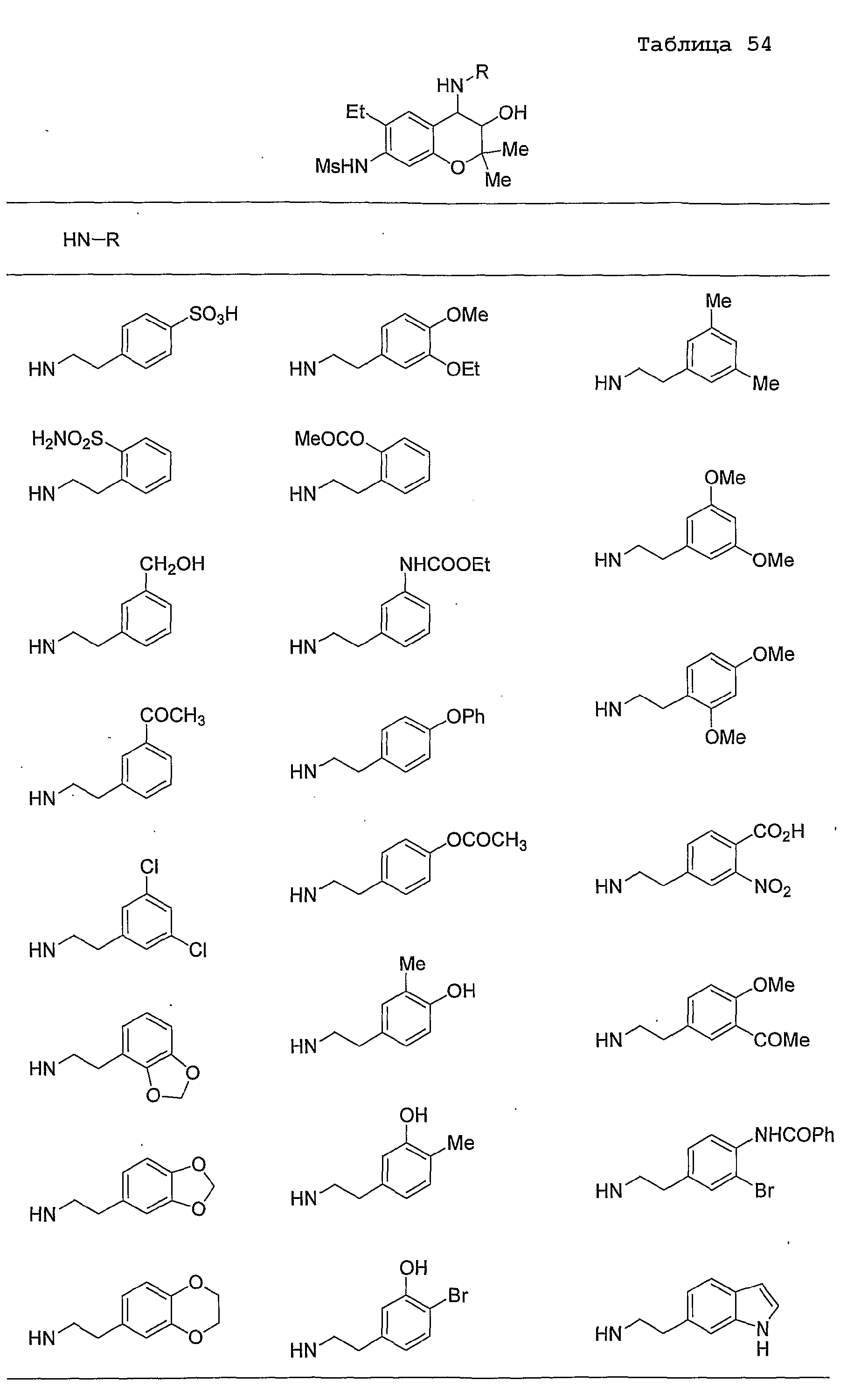
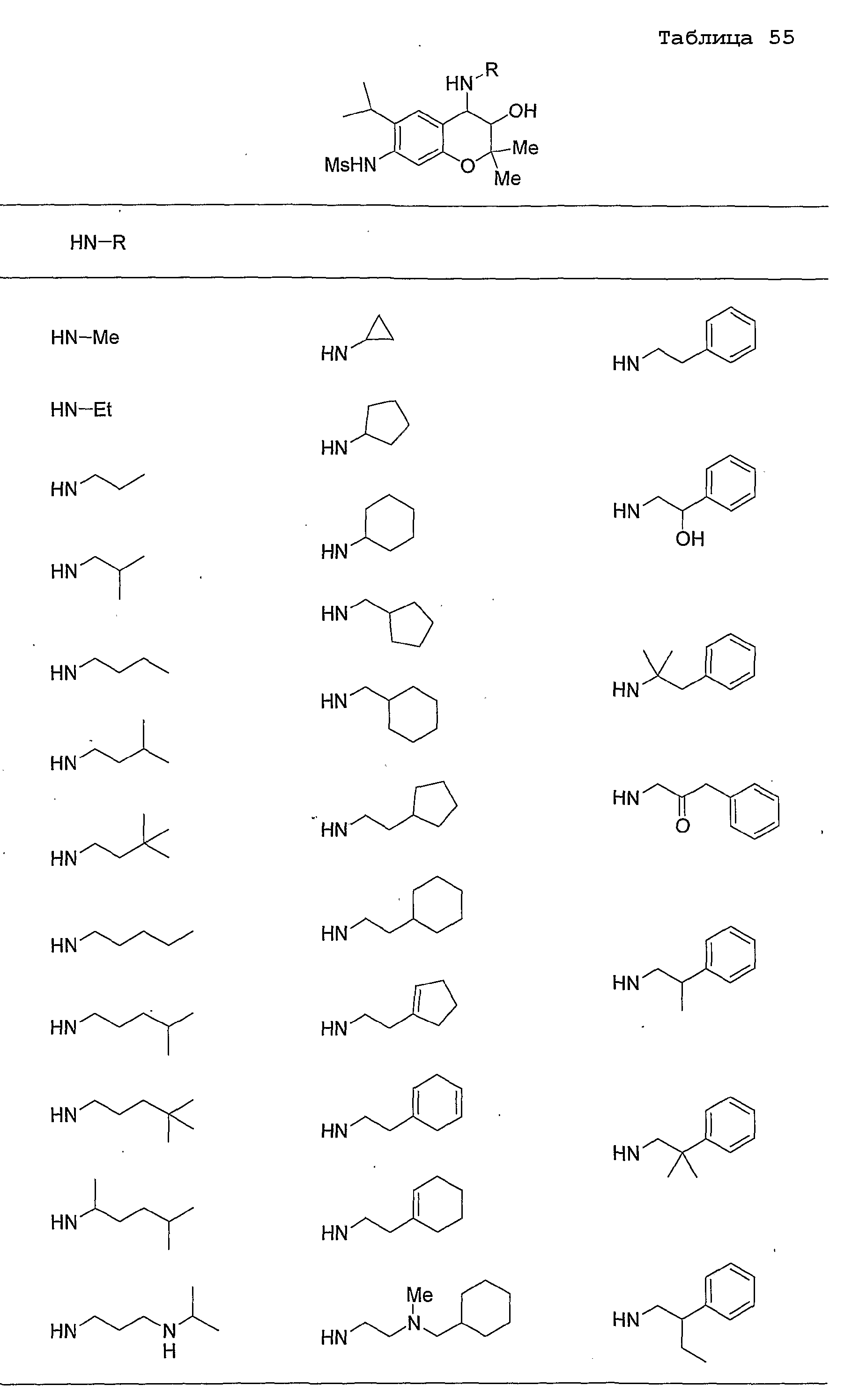
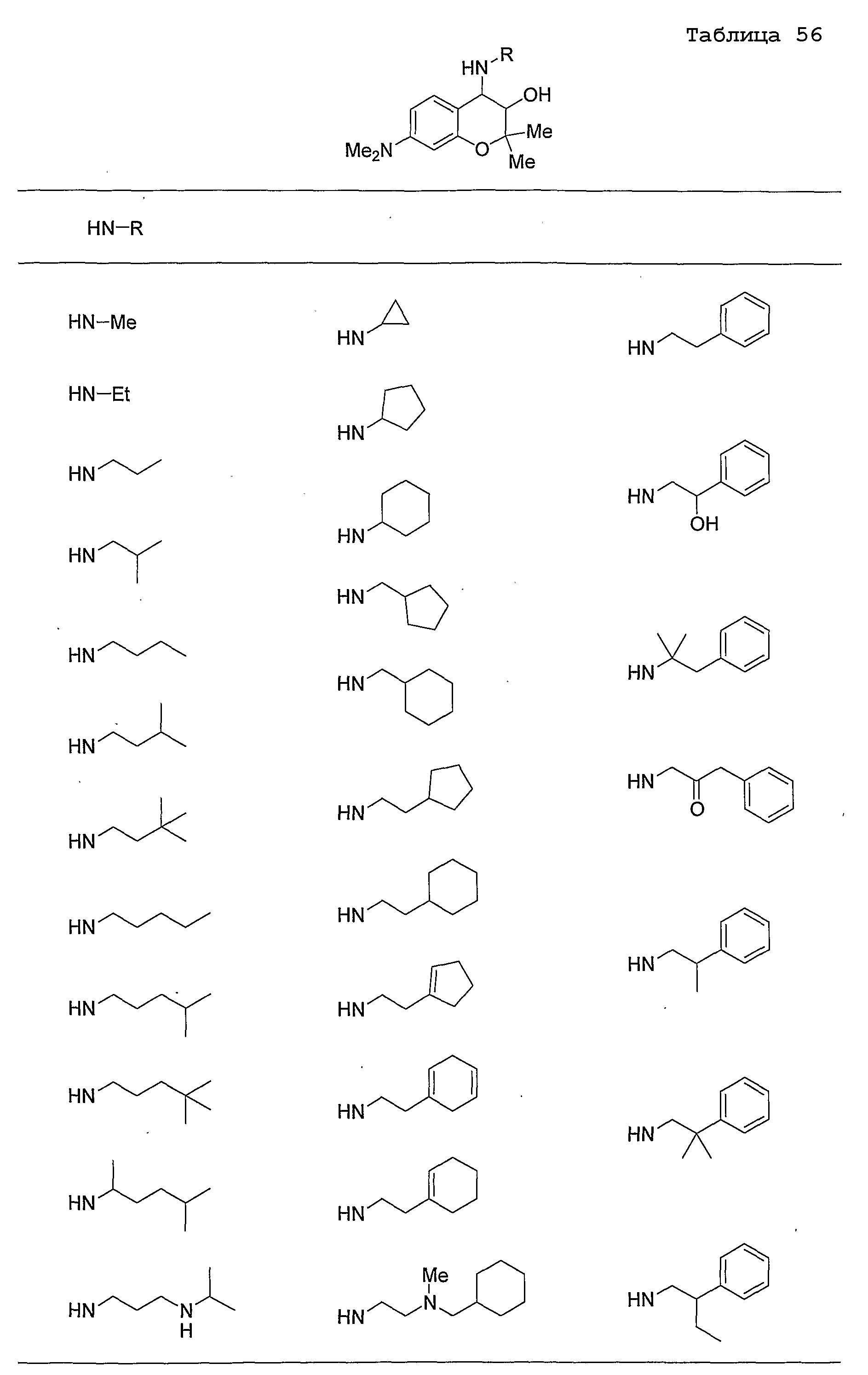
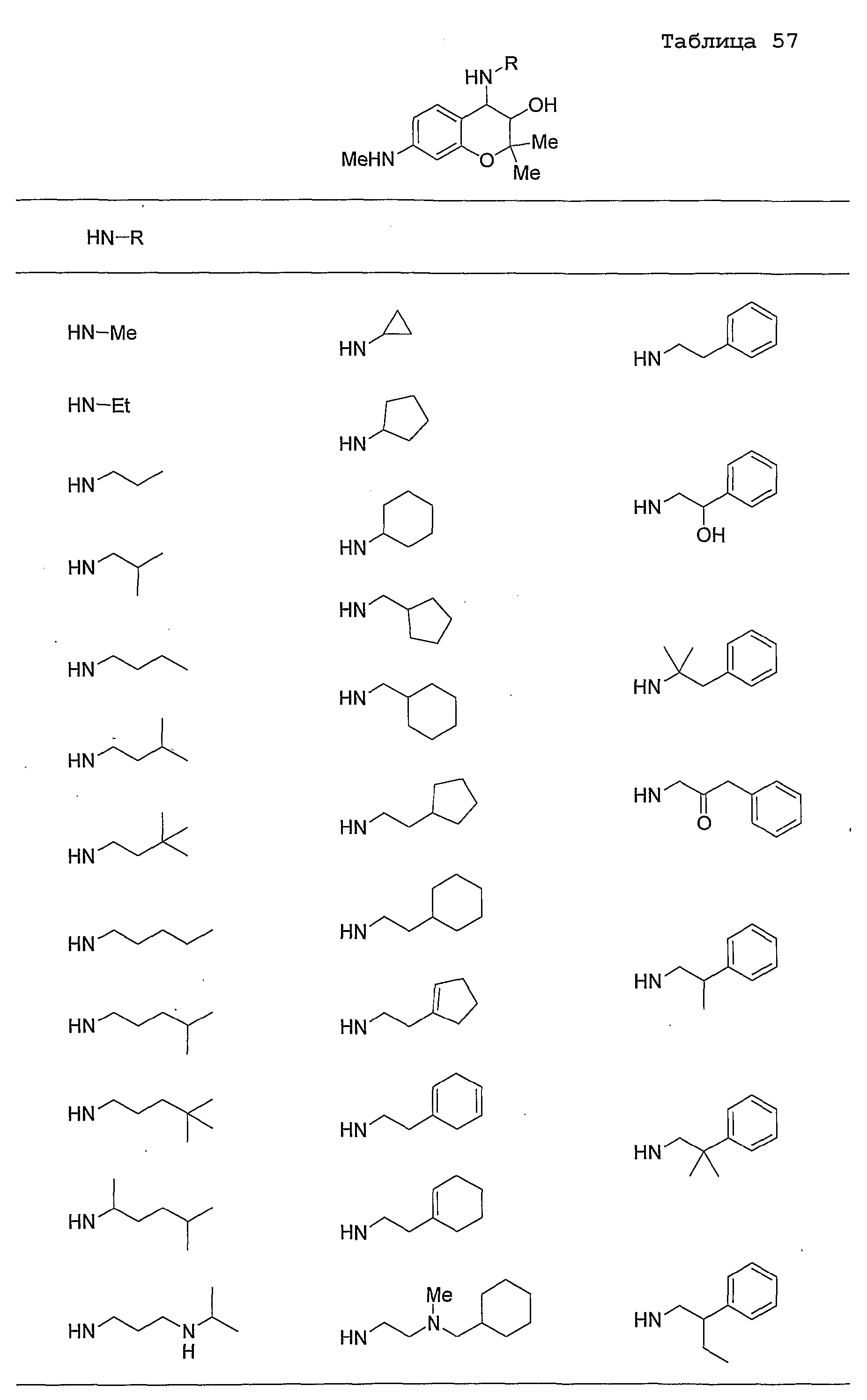
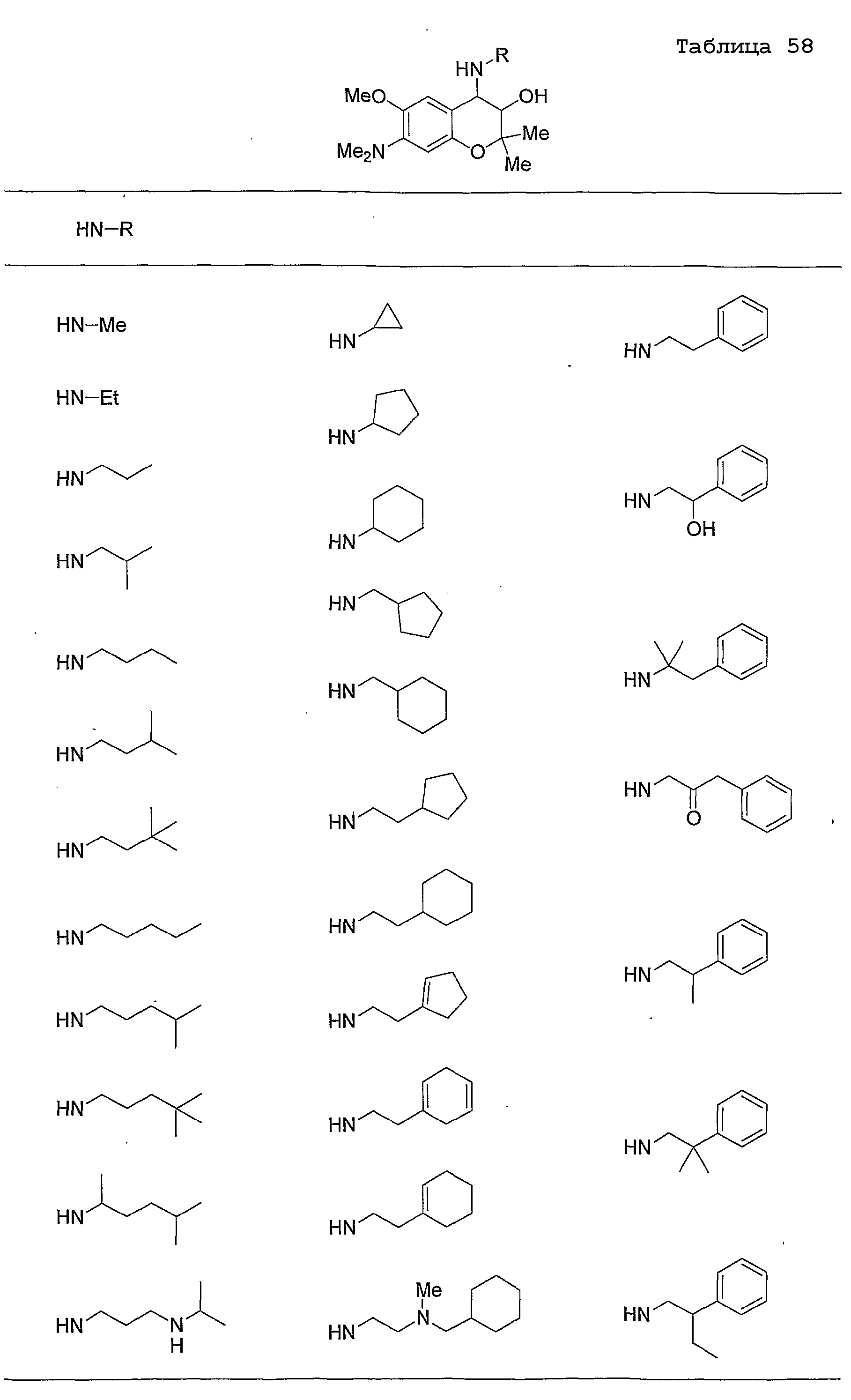
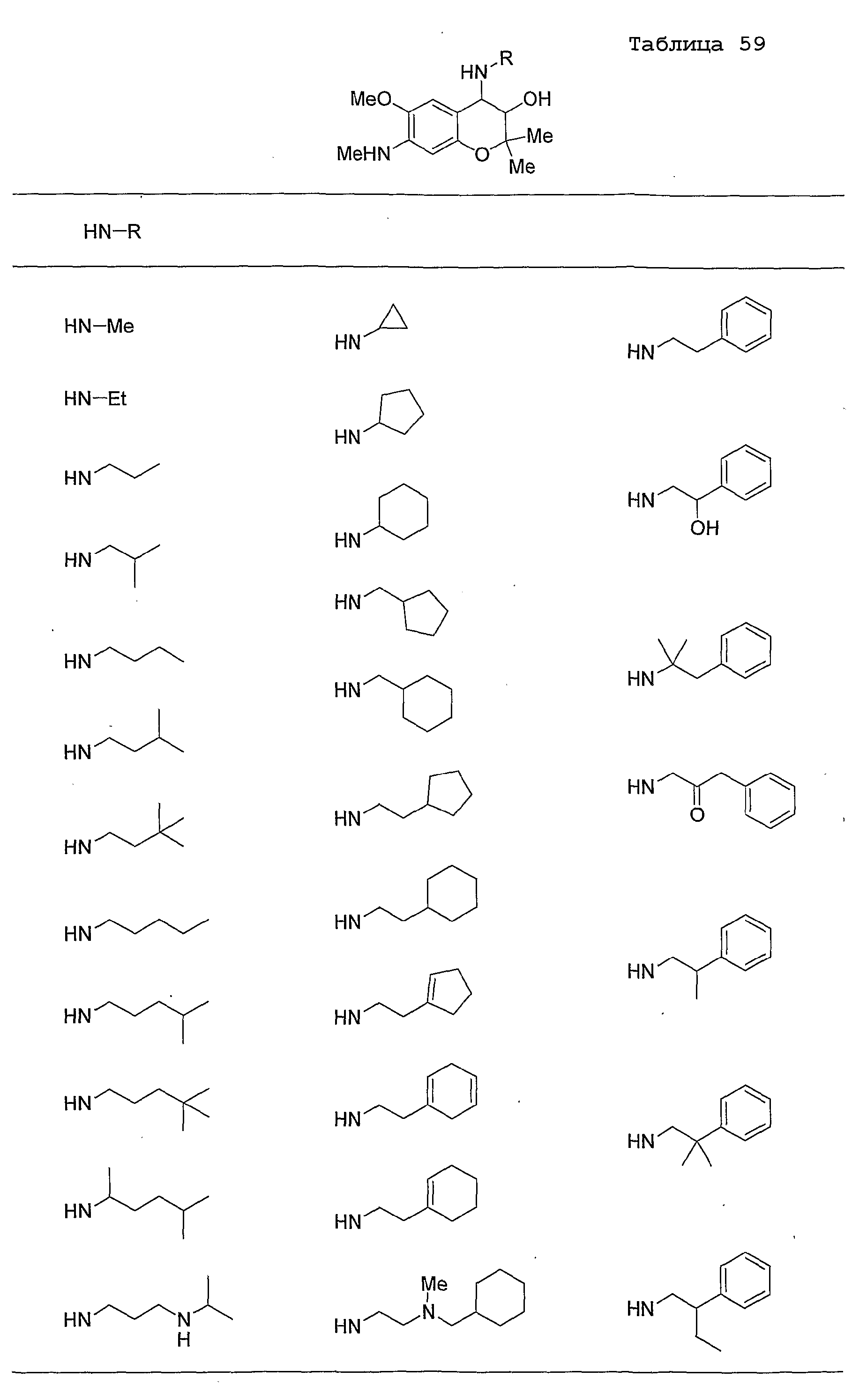
Соединение по настоящему изобретению содержит асимметрические атомы углерода в 3-м положении и 4-м положении, поэтому существуют его оптические изомеры относительно асимметрических атомов углерода, и для применения по настоящему изобретению могут также использоваться оптически активные вещества, такие как рацемические модификации. Более того, могут быть включены цис- и транс-изомеры относительно конфигурации в 3-м положении и 4-м положении, но предпочтительным является транс-изомер.
Более того, если соединения могут образовывать соли, то в качестве активных ингредиентов могут также использоваться их фармацевтически приемлемые соли.
Примерами фармацевтически приемлемой соли являются такие соли, как гидрохлориды, гидробромиды, сульфаты, метансульфонаты, ацетаты, бензоаты, тартраты, фосфаты, лактаты, малеаты, фумараты, малаты, глюконаты, салицилаты, и тому подобное.
В качестве предпочтительных солей могут быть упомянуты гидрохлориды, метансульфонаты и малеаты.
Представлен способ получения соединения по настоящему изобретению.
Как представлено ниже на схеме реакций, соединение формулы (I) может быть получено с использованием соединения формулы (2) в качестве исходного материала.
Соединение формулы (2) может быть синтезировано в соответствии с известными способами (способы описаны в J.M. Evans et al., J. Med. Chem. 1984, 27, 1127; J. Med. Chem. 1986, 29, 2194; J.T. North et al., J. Org. Chem. 1995,60, 3397; а также в опубликованных патентах Японии №№ Sho 56-57785, Sho 56-57786, Sho 58-188880, Hei 2-141, Hei 10-87650 и Hei 11-209366, и тому подобное).
Соединения формулы (I), в которой Y представляет собой SO или SO2 может быть получено в соответствии со способом, представленным ниже.

где значения R1, R2, R3, R4, R5, R6, m, n, V, W и Z определены выше, r равно 1 или 2,
X1 представляет собой уходящую группу, такую как атом хлора, атом брома, метансульфонилокси, пара-толуолсульфонилокси или трифторметансульфонилокси, и так далее, и X2 представляет собой уходящую группу, такую как атом хлора, атом брома, атом йода, метансульфонилокси, пара-толуолсульфонилокси или трифторметансульфонилокси, и так далее.
А именно соединение (I-1), в котором R6 представляет собой атом водорода, может быть получено путем осуществления взаимодействия соединения формулы (2) с Z-S(O)r-X1 в присутствии основания.
Кроме того, соединение (I-2), в котором R6 представляет собой C1-4-алкильную группу, может быть получено путем осуществления взаимодействия соединения (I-1) с R6-X2 в присутствии основания.
При этом в том случая, если R4 представляет собой атом водорода, перед осуществлением взаимодействия соединения формулы (2) с Z-S(O)r-X1 в положение R4 вводят защитную группу, такую как трет-бутоксикарбонильная группа или подобная, а после введения Z-S(O)r-X1 или R6-X2 удаляют защитную группу с получением соединения (I-1) или (I-2).
Введение и удаление защитной группы, такой как трет-бутоксикарбонил, и так далее, может проводиться в соответствии с любым известным способом.
В качестве растворителей, используемых при взаимодействии соединения формулы (2) с Z-S(O)r-X1, могут быть упомянуты следующие.
В качестве примера сульфоксидного растворителя может быть упомянут диметилсульфоксид; в качестве примеров амидных растворителей могут быть упомянуты диметилформамид или диметилацетамид; в качестве примеров эфирных растворителей могут быть упомянуты диэтиловый эфир, диметоксиэтан, тетрагидрофуран или циклопентилметиловый эфир; в качестве примеров галогеновых растворителей могут быть упомянуты дихлорметан, хлороформ и дихлорэтан; в качестве примеров нитрильных растворителей могут быть упомянуты ацетонитрил и пропионитрил; в качестве примеров кетоновых растворителей могут быть упомянуты ацетон, метилэтилкетон и метилизобутилкетон; в качестве примеров ароматических углеводородных растворителей могут быть упомянуты бензол и толуол; в качестве примеров углеводородных растворителей могут быть упомянуты гексан и гептан; и в качестве примера сложноэфирного растворителя может быть упомянут этилацетат. Кроме того, взаимодействие может быть осуществлено в отсутствие какого-либо растворителя. В качестве предпочтительных растворителей могут быть упомянуты растворители эфирного типа.
Температура реакции, как правило, составляет от -80°C до температуры перегонки реакционного растворителя, предпочтительно от -10°C до 80°C.
Мольное отношение между вступающим в реакцию Z-S(O)r-X1 и соединением (2) находится в диапазоне 0,5-20,0, предпочтительно 1,0-10,0.
Основание включает триалкиламины, представленные в качестве примера триэтиламином и этилдиизопропиламином; пиридиновые амины представленные в качестве примера пиридином, 2,6-лутидином, 2,6-ди-трет-бутилпиридином, 2,6-дибутил-4-метилпиридином и протоновой помпой; и неорганические основания, представленные в качестве примера гидроксидом натрия, гидроксидом калия и карбонатом калия.
В качестве предпочтительных оснований могут быть упомянуты триэтиламин, этилдиизопропиламин и пиридин.
В качестве растворителей, используемых при взаимодействии соединения формулы (I-1) с R6-X2, могут быть упомянуты следующие.
В качестве примера сульфоксидного растворителя может быть упомянут диметилсульфоксид; в качестве примеров амидных растворителей могут быть упомянуты диметилформамид или диметилацетамид; в качестве примеров эфирных растворителей могут быть упомянуты диэтиловый эфир, диметоксиэтан, тетрагидрофуран или циклопентилметиловый эфир; в качестве примеров галогеновых растворителей могут быть упомянуты дихлорметан, хлороформ и дихлорэтан; в качестве примеров нитрильных растворителей могут быть упомянуты ацетонитрил и пропионитрил; в качестве примеров кетоновых растворителей могут быть упомянуты ацетон, метилэтилкетон и метилизобутилкетон; в качестве примеров ароматических углеводородных растворителей могут быть упомянуты бензол и толуол; в качестве примеров углеводородных растворителей могут быть упомянуты гексан и гептан; и в качестве примера сложноэфирного растворителя может быть упомянут этилацетат. Кроме того, взаимодействие может быть осуществлено в отсутствие какого-либо растворителя. В качестве предпочтительных растворителей могут быть упомянуты кетоновые растворители и эфирные растворители.
Температура реакции, как правило, составляет от -80°C до температуры перегонки реакционного растворителя, предпочтительно от 20°C до температуры перегонки реакционного растворителя.
Мольное отношение между вступающим в реакцию R6-X2 и соединением (I-1) находится в диапазоне 0,5-20,0, предпочтительно 1,0-10,0.
Основание включает триалкиламины, представленные в качестве примера триэтиламином и этилдиизопропиламином; пиридиновые амины представленные в качестве примера пиридином, 2,6-лутидином, 2,6-ди-трет-бутилпиридином, 2,6-дибутил-4-метилпиридином и протоновой помпой; и неорганические основания, представленные в качестве примера гидроксидом натрия, гидроксидом калия и карбонатом калия.
В качестве предпочтительного основания может быть упомянут карбонат калия.
В соответствии со способом, представленным ниже, могут быть получены соединения формулы (I), в которой Y представляет собой одинарную связь, и Z представляет собой C1-4-алкильную группу (где C1-4-алкильная группа может быть произвольно замещена 1-5 атомами галогена или фенильной группой (где фенильная группа может быть произвольно замещена C1-4-алкильной группой)).
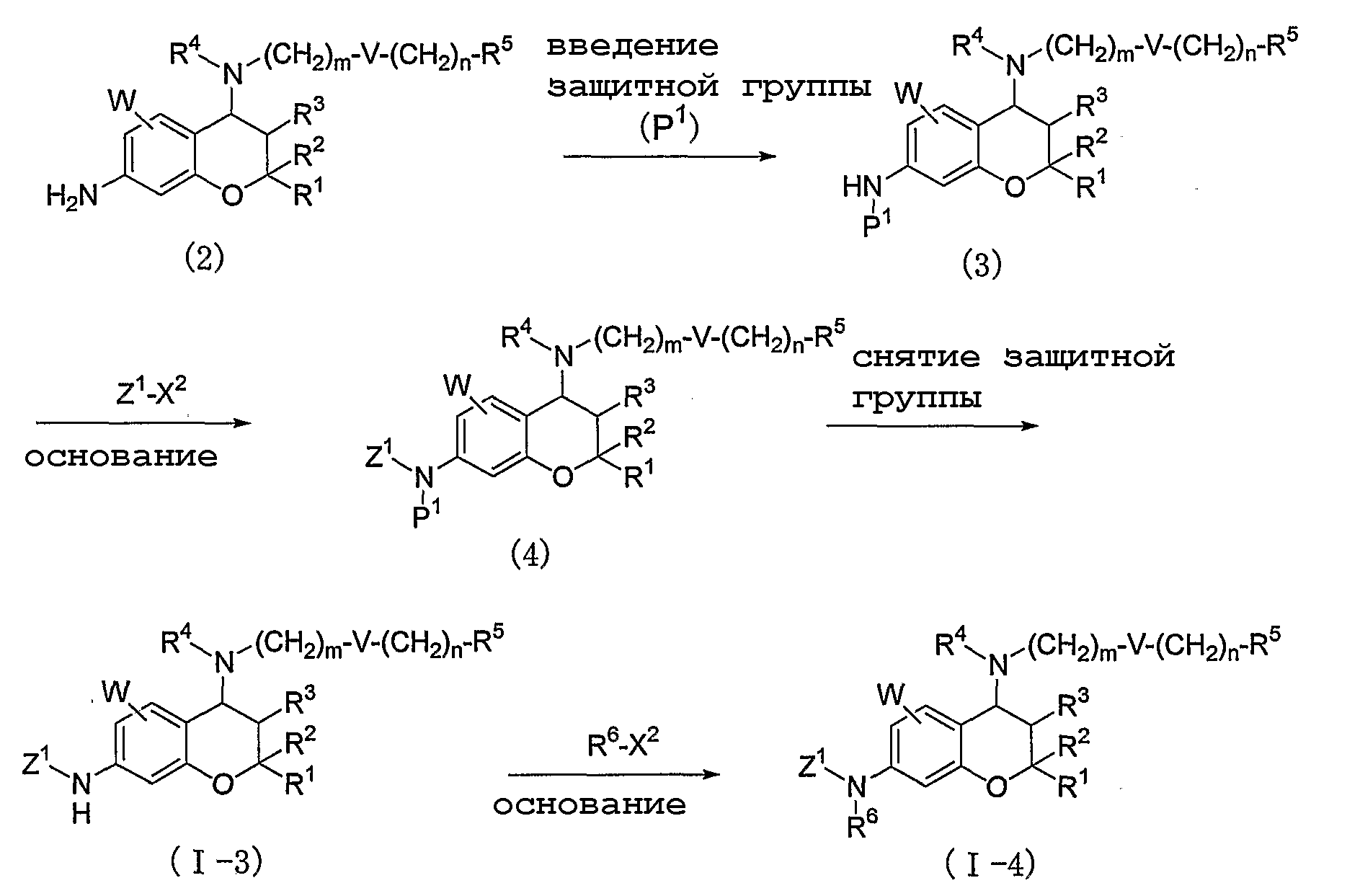
где значения R1, R2, R3, R4, R5, R6, m, n, V, W и X2 определены выше, Z1 представляет собой C1-4-алкильную группу (где C1-4-алкильная группа может быть произвольно замещена 1-5 атомами галогена или фенильной группой (где фенильная группа может быть произвольно замещена C1-4-алкильной группой)), и P1 представляет собой защитную группу, такую как формил, трет-бутоксикарбонил и бензилоксикарбонил, и так далее.
А именно соединение (I-3), в котором R6 представляет собой атом водорода, может быть получено путем введения защитной группы (P1) в соединение формулы (2) с получением соединения (3), осуществления взаимодействия соединения (3) с Z1-X2 в присутствии основания с получением соединения (4) с последующим удалением защитной группы.
Кроме того, соединение (I-2), в котором R6 представляет собой C1-4-алкильную группу, может быть получено путем осуществления взаимодействия соединения (I-3) с R6-X2 в присутствии основания.
При этом в том случае, если R4 представляет собой атом водорода, для введения защитных групп (P1) для двух атомов азота в 4-м и 7-м положениях агент для введения защитной группы (P1) в соединение формулы (2) используют в количестве двух или более эквивалентов, или перед введением защитной группы (P1) в положение R4 вводят защитную группу, такую как трет-бутоксикарбонильная группа или подобная, а защитную группу удаляют одновременно с осуществлением взаимодействия с Z1-X2 с получением соединения (I-3) или сразу после него.
Соединение (I-4), в котором R4 представляет собой атом водорода, может быть получено путем введения в положение R4 защитной группы, такой как трет-бутоксикарбонильная группа или подобная, перед осуществлением взаимодействия соединения (I-3) с R6-X2, с последующим удалением защитной группы после взаимодействия с R6-X2.
Введение и удаление защитной группы, такой как трет-бутоксикарбонил, и так далее, может проводиться в соответствии с любым известным способом.
Введения защитной группы (P1) достигают путем обработки муравьиной кислотой/уксусной кислотой, ангидридом кислоты или фенилформиатом, например, в случае формила, ди-трет-бутилдикарбонатом в случае трет-бутоксикарбонила, и бензилхлорформиатом, в случае бензилоксикарбонила, в соответствии с известным способом.
Условия проведения реакции получения соединения (4) из соединения (3) и Z1-X2 в присутствии основания сходны с условиями осуществления взаимодействия соединения формулы (I-1) с R6-X2.
Удаление защитной группы достигают путем обработки в соответствии с известным способом, таким как обработка кислотой или основанием, или путем гидролиза, и тому подобное.
Условия проведения реакции получения соединения (I-4) из соединения (I-3) и R6-X2 в присутствии основания сходны с условиями осуществления взаимодействия соединения формулы (I-1) с R6-X2.
В соответствии со способом, представленным ниже, могут быть получены соединения формулы (I), в которой Y представляет собой одинарную связь, и Z представляет собой фенильную группу (где фенильная группа может быть произвольно замещена C1-4-алкильной группой).
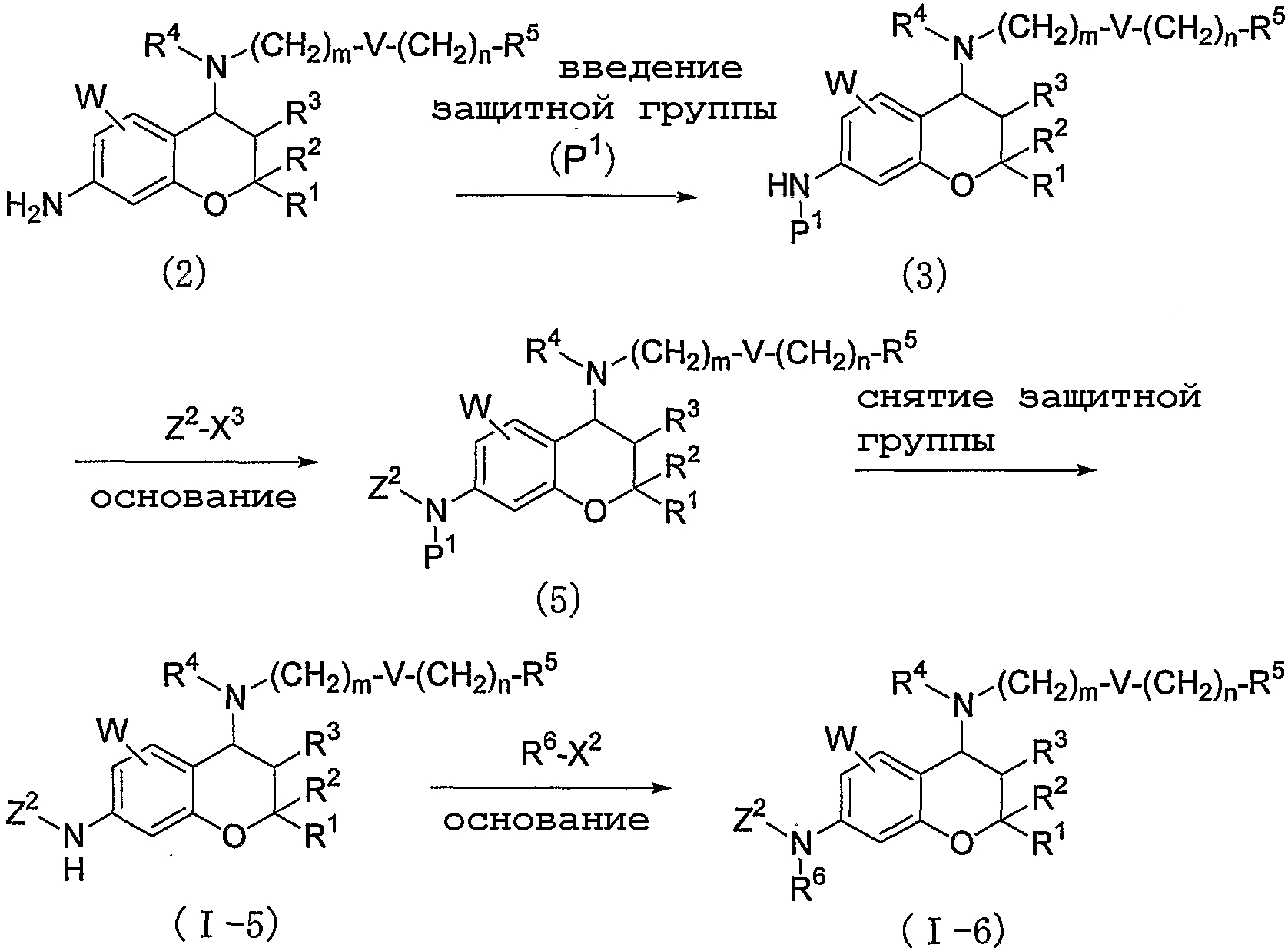
где значения R1, R2, R3, R4, R5, R6, m, n, V, P1, W и X2 определены выше, Z2 представляет собой фенильную группу (где фенильная группа может быть произвольно замещена C1-4-алкильной группой), и X3 представляет собой уходящую группу, такую как атом фтора, атом хлора, атом брома, атом йода, и так далее.
А именно соединение (I-5), в котором R6 представляет собой атом водорода, может быть получено путем введения защитной группы (P1) в соединение формулы (2) с получением соединения (3), осуществления взаимодействия соединения (3) с Z2-X3 в присутствии основания с получением соединения (5) с последующим удалением защитной группы.
Кроме того, соединение (I-6), в котором R6 представляет собой C1-4-алкильную группу, может быть получено путем осуществления взаимодействия соединения (I-5) с R6-X2 в присутствии основания.
При этом в том случае, если R4 представляет собой атом водорода, для введения защитных групп (P1) для двух атомов азота в 4-м и 7-м положениях агент для введения защитной группы (P1) в соединение формулы (2) используют в количестве двух или более эквивалентов, или перед введением защитной группы (P1) в положение R4 вводят защитную группу, такую как трет-бутоксикарбонильная группа или подобная, а защитную группу удаляют одновременно с осуществлением взаимодействия с Z2-X3 с получением соединения (I-5) или сразу после него.
Соединение (I-6), в котором R4 представляет собой атом водорода, может быть получено путем введения в положение R4 защитной группы, такой как трет-бутоксикарбонильная группа или подобная, перед осуществлением взаимодействия соединения (I-5) с R6-X2, с последующим удалением защитной группы после взаимодействия с R6-X2.
Введения защитной группы (P1) достигают путем обработки муравьиной кислотой/уксусной кислотой, ангидридом кислоты или фенилформиатом, например, в случае формила, ди-трет-бутилдикарбонатом в случае трет-бутоксикарбонила, и бензилхлорформиатом в случае бензилоксикарбонила, в соответствии с известным способом.
В качестве растворителей, используемых при взаимодействии соединения формулы (3) с Z2-X3, могут быть упомянуты следующие.
В качестве примера сульфоксидного растворителя может быть упомянут диметилсульфоксид; в качестве примеров амидных растворителей могут быть упомянуты диметилформамид или диметилацетамид; в качестве примеров эфирных растворителей могут быть упомянуты диэтиловый эфир, диметоксиэтан, тетрагидрофуран или циклопентилметиловый эфир; в качестве примеров галогеновых растворителей могут быть упомянуты дихлорметан, хлороформ и дихлорэтан; в качестве примеров нитрильных растворителей могут быть упомянуты ацетонитрил и пропионитрил; в качестве примеров кетоновых растворителей могут быть упомянуты ацетон, метилэтилкетон и метилизобутилкетон; в качестве примеров ароматических углеводородных растворителей могут быть упомянуты бензол и толуол; в качестве примеров углеводородных растворителей могут быть упомянуты гексан и гептан; и в качестве примера сложноэфирного растворителя может быть упомянут этилацетат. Кроме того, взаимодействие может быть осуществлено в отсутствие какого-либо растворителя. В качестве предпочтительных растворителей могут быть упомянуты углеводородные растворители, сульфоксидные растворители и амидные растворители.
Температура реакции, как правило, составляет от -80°C до температуры перегонки реакционного растворителя, предпочтительно от 50°C до 120°C.
Мольное отношение между вступающим в реакцию Z2-X3 и соединением (3) находится в диапазоне 0,5-20,0, предпочтительно 1,0-10,0.
Основание включает триалкиламины, представленные в качестве примера триэтиламином и этилдиизопропиламином; пиридиновые амины, представленные в качестве примера пиридином, 2,6-лутидином, 2,6-ди-трет-бутилпиридином, 2,6-дибутил-4-метилпиридином и протоновой помпой; алкоксиды металлов, представленные в качестве примера трет-бутоксидом калия, трет-бутоксидом натрия, этоксидом натрия и этоксидом калия; и неорганические основания, представленные в качестве примера гидроксидом натрия, гидроксидом калия, карбонатом калия, карбонатом натрия, гидрокарбонатом калия и гидрокарбонатом натрия. В качестве предпочтительных оснований могут быть упомянуты алкоксиды металлов и неорганические основания.
В реакционную систему могут быть добавлены металлические катализаторы. Металлические катализаторы включают медные катализаторы, такие как йодид меди(I), хлорид меди(I), окись меди(I); и палладиевые катализаторы, представленные в качестве примера хлоридом палладия, бромидом палладия, йодидом палладия, дихлорбис(ацетонитрил)палладием, дихлорбис(бензонитрил)палладием, дихлорбис(трифенилфосфин)палладием, дихлорбис(дифенилфосфиноэтан)палладием, дихлорбис(дифенилфосфинопропан)палладием, дихлорбис(дифенилфосфинобутан)палладием, ацетатом палладия, тетракистрифенилфосфинпалладием, палладийбензилиденацетоном, и тому подобное.
В случае применения металлического катализатора могут быть добавлены любые лиганды. Лиганды включают фосфиновые лиганды, представленные в качестве примера трифенилфосфином, трибутилфосфином, дифенилфосфиноэтаном, дифенилфосфинопропаном и дифенилфосфинобутаном.
Удаление защитной группы достигают путем обработки в соответствии с известным способом, таким как обработка кислотой, или основанием, или путем гидролиза, и тому подобное.
Условия проведения реакции получения соединения (I-6) из соединения (I-5) и R6-X2 в присутствии основания сходны с условиями осуществления взаимодействия соединения формулы (I-1) с R6-X2.
Синтез оптически активных соединений в числе соединений формулы (I) может быть осуществлен с использованием методов расщепления оптических изомеров (опубликованный патент Японии № Hei 3-141286, патент США № 5097037 и Европейский патент № 409165).
Кроме того, синтез оптически активных соединений формулы (2) может быть осуществлен с использованием методов асимметрического синтеза (перевод с японского патентной публикации № Hei 5-507645 согласно PCT, опубликованные патенты Японии №№ Hei 5-301878 и Hei 7-285983, опубликованный Европейский патент № 535377 и патент США № 5420314).
Как описано выше, авторы настоящего изобретения обнаружили, что соединение формулы (I) обладает пролонгирующим действием на рефрактерный период. Пролонгирующее действие на рефрактерный период является одним из механизмов противоаритмического действия и представляет собой важный индикатор оценки эффективности лечения при клинической аритмии. При терапии с применением общепринятых противоаритмических средств, главным механизмом действия которых является пролонгирующее действие на рефрактерный период (такими как d-соталол, принадлежащий к лекарства III класса в соответствии с классификацией противоаритмических средств по Vaughan Williams), наблюдаются проблемы, которые выражаются в индукции очень опасных аритмий, приводящих к внезапной смерти (среди прочих, таких как «трепетание-мерцание») вследствие пролонгации потенциала действия в мышце желудочка, которая коррелирует с пролонгирующим действием на рефрактерный период, а потому является проблемой при лечении, главным образом, аритмии мышцы предсердий (такой как суправентрикулярная тахикардия, трепетание предсердий, мерцание предсердий, и тому подобное).
С целью решения указанных проблем авторы настоящего изобретения провели исследование бензопирановых соединений, обладающих пролонгирующим действием на рефрактерный период, избирательным по отношению к мышце предсердия, но не к мышце желудочков, и обнаружили, что соединение формулы (I) обладает пролонгирующим действием на рефрактерный период, избирательным по отношению к мышце предсердия, и не влияет на рефрактерный период и потенциал действия в мышце желудочка. Различие между сделанными авторами изобретения открытиями и известным уровнем техники заключается в пролонгирующем действии указанной группы соединений на рефрактерный период, избирательном по отношению к мышце предсердий, что может быть подтверждено фактами отсутствия влияния на продолжительность потенциала действия в изолированной мышце предсердий и отсутствия влияния на участок QT электрокардиограммы у анестезированного животного. Исходя из вышеизложенного, соединения по настоящему изобретению не индуцируют аритмию в мышце предсердий, а потому могут способствовать более безопасному по сравнению с известным уровнем техники применению в случае аритмии, главным образом, мышцы предсердий. Технические знания по настоящему изобретению полезны для терапевтического и профилактического применения в качестве средств против фибрилляции предсердий, средств против трепетания предсердий и средств против тахикардии предсердий, имеющим отношение к пароксизмальной, хронической, предоперационной, интраоперационной или постоперационной аритмии предсердий, предупреждения прогрессирования, приводящего к эмболии вследствие аритмии предсердного генеза, предупреждения прогрессирования, приводящего к аритмии или тахикардии желудочков вследствие аритмии или тахикардии предсердий, и предотвращения угрожающего жизни состояния вследствие воздействия на аритмию или тахикардию предсердий, приводящую к аритмии или тахикардии желудочков.
Настоящее изобретение относится фармацевтической композиции или ветеринарной фармацевтической композиции, содержащей соединение формулы (I) в эффективном для указанных видов лечения количестве.
В качестве форм введения соединения по настоящему изобретению могут быть упомянуты формы для парентерального введения, такие как инъекционные растворы (инъекционные растворы для подкожного, внутривенного, внутримышечного и интраперитонеального введения), мази, суппозитории, аэрозоли, и тому подобное, и формы для перорального введения, такие как таблетки, капсулы, гранулы, пилюли, сиропы, растворы, эмульсии, суспензии, и тому подобное.
Описанная выше фармацевтическая или ветеринарная фармацевтическая композиция содержит соединение по настоящему изобретению в количестве приблизительно 0,01-99,5%, предпочтительно приблизительно 0,1-30%, относительно общей массы композиции.
В дополнение к соединению по настоящему изобретению или к содержащей соединение композиции могут содержаться другие фармацевтически активные или ветеринарные фармацевтически активные соединения.
Кроме того, данные композиции могут содержать несколько соединений по настоящему изобретению.
Количество соединения по настоящему изобретению, которое необходимо вводить для лечения, может варьировать в зависимости от возраста, массы тела и восприимчивости больного, симптоматики, и тому подобное, но, как правило, эффективное для лечения количество составляет приблизительно 0,003-1,5 г, предпочтительно 0,01-0,6 г, в сутки для взрослого человека. Однако, при необходимости, может применяться количество, выходящее за рамки упомянутого выше диапазона.
Соединение по настоящему изобретению вводят в состав для введения при помощи обычно применяемых в фармацевтике способов.
А именно, таблетки, капсулы, гранулы и пилюли для перорального введения получают с использованием наполнителей, таких как сахароза, лактоза, глюкоза, крахмал и маннит; связующих веществ, таких как гидроксипропилцеллюлоза, патока, аравийская камедь, желатин, сорбит, трагакант, метилцеллюлоза и поливинилпирролидин; разрыхлителей, таких как крахмал, карбоксиметилцеллюлоза или ее кальциевая соль, микрокристаллическая целлюлоза и полиэтиленгликоль; скользящие вещества, такие как тальк, стеарат магния или кальция, и двуокись кремния; смазывающих веществ, таких как лаурат натрия и глицерин, и тому подобное.
Инъекционные растворы, растворы, эмульсии, суспензии, сиропы и аэрозоли получают с использованием растворителей для активных компонентов, таких как вода, этиловый спирт, изопропиловый спирт, пропиленгликоль, 1,3-бутиленгликоль и полиэтиленгликоль; поверхностно-активных веществ, таких как эфир сорбита и жирной кислоты, эфир полиоксиэтиленсорбита и жирной кислоты, эфир полиоксиэтилена и жирной кислоты, полиоксиэтиленовый эфир гидрогенизированного касторового масла и лецитин; суспендирующих веществ, таких как карбоксиметилнатрий, производные целлюлозы, такие как метилцеллюлоза, и тому подобное, и натуральные каучуки, такие как аравийская камедь, трагакант, и тому подобное; и консервантов, таких как сложные эфиры пара-гидроксибензойной кислоты, хлорид бензалкония, соли сорбиновой кислоты, и тому подобное.
Для мазей, которые представляют собой всасываемые через кожу фармацевтические средства, например, используют белый вазелин, вазелиновое масло, высшие спирты, мази на основе Macrogol, мазь-эмульсии, водные гелеобразные основы, и тому подобное.
Суппозитории получают с использованием, например, какао-масел, полиэтиленгликоля, ланолина, триглицерида жирных кислот, кокосового масла, полисорбата, и тому подобное.
ПРИМЕРЫ
Настоящее изобретение подробно проиллюстрировано посредством последующих примеров, но настоящее изобретение не ограничивается данными примерами.
[Примеры синтеза]
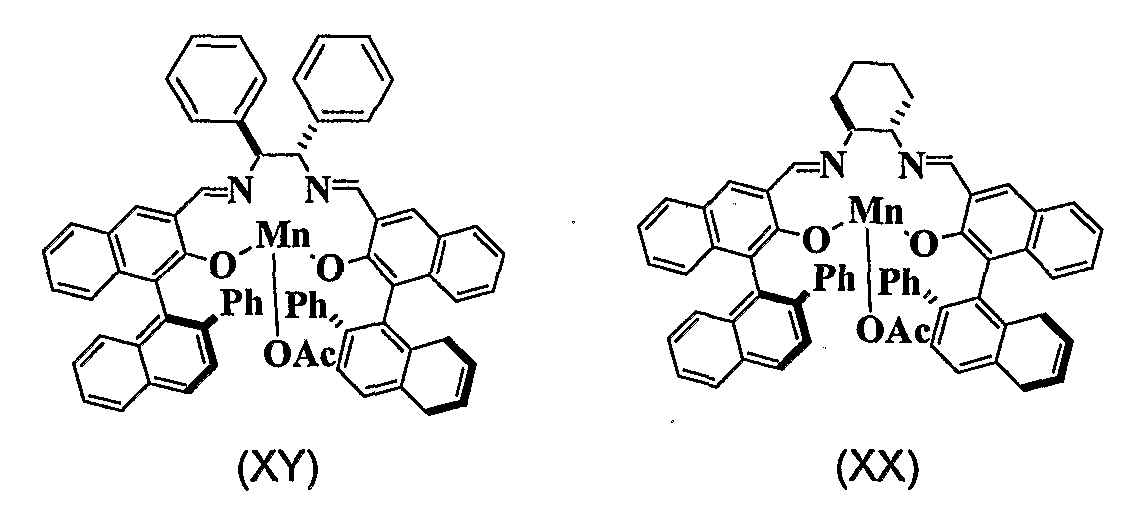
Более того, комплекс Ph,Ph-саленмарганца (XY) и комплекс Cyc,Ph-саленмарганца (XX) означают оптически активные соединения с представленными ниже формулами, которые были синтезированы в соответствии со способом, сходным с описанным в опубликованном патенте Японии № Hei7-285983.
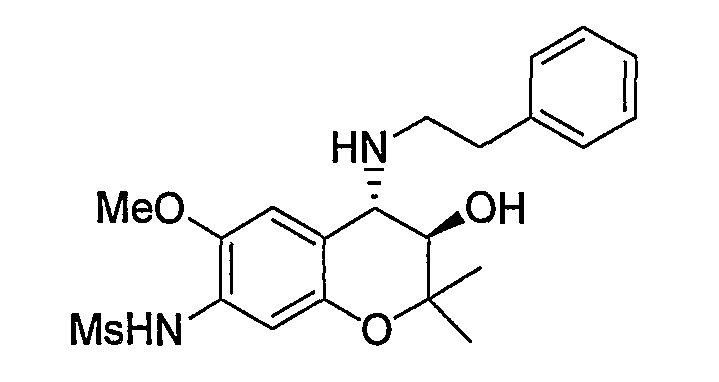
Пример синтеза 1
N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
4-(1,1-Диметил-2-пропенилокси)анизол

К раствору 4-метоксифенола (15,0 г, 121 ммоль) в ацетонитриле (75 мл) при охлаждении на льду добавляли 1,8-диазабицикло[5.4.0]ундецен (23,9 г, 157 ммоль) и перемешивали полученную смесь при 0°C в течение 30 минут (раствор 1). К раствору 2-метил-3-бутен-2-ола (11,7 г, 139 ммоль) в ацетонитриле (75 мл) при охлаждении на льду добавляли 1,8-диазабицикло[5.4.0]ундецен (23,9 г, 157 ммоль), перемешивали полученную смесь при 0°C в течение 30 минут, затем добавляли ангидрид трифторуксусной кислоты (25,4 г, 121 ммоль) и перемешивали полученную смесь при 0°C в течение 30 минут (раствор 2). К раствору 1 добавляли хлорид меди(I) (36 мг, 0,36 ммоль), а затем по каплям в течение 15 минут добавляли раствор 2. После завершения покапельного добавления температуру повышали до комнатной температуры и перемешивали смесь в течение ночи. После завершения реакции к реакционному раствору добавляли водный раствор хлорида аммония и отгоняли растворитель при пониженном давлении. К остатку добавляли 1М водный раствор соляной кислоты, полученную смесь экстрагировали этилацетатом, органическую фазу промывали один раз 1М водным раствором соляной кислоты, дважды насыщенным водным раствором гидрокарбоната натрия и один раз насыщенным раствором хлорида натрия. Затем органическую фазу сушили над безводным сульфатом магния. После отгонки растворителя остаток непосредственно использовали в последующей реакции.
6-Метокси-2,2-диметил-2H-1-бензопиран
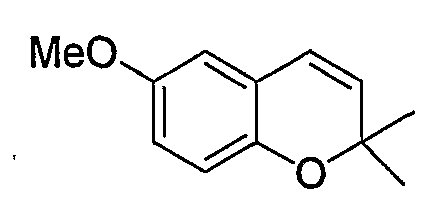
Раствор 4-(1,1-диметил-2-пропенилокси)анизола в 1,2-дихлорбензоле (50 мл) перемешивали при 190°C в течение 2 часов. После завершения реакции отгоняли растворитель при пониженном давлении. Остаток очищали по методу колоночной хроматографии (элюируя гексаном/хлороформом = 3/1) и получали требуемый продукт в виде красного маслянистого вещества (в 2 стадии, выход: 61%).
1Н-ЯМР (CDCl3) δ: 1,41 (с, 6H), 3,75 (с, 3H), 5,64 (д, J=9,9 Гц, 1H), 6,28 (д, J=9,9 Гц, 1H), 6,55 (д, J=2,7 Гц, 1H), 6,64-6,73 (м, 2H)
ЖХ/МС (ЭСИ+): 191 [М++1]
6-Метокси-2,2-диметил-7-нитро-2H-1-бензопиран
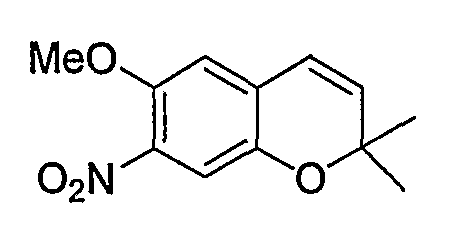
Смешанный раствор уксусной кислоты (6,2 мл) и ангидрида уксусной кислоты (6,2 мл), содержащий 6-метокси-2,2-диметил-2H-1-бензопиран (3,1 г, 16,4 ммоль), охлаждали на льду, по каплям добавляли азотную кислоту (1,37 мл, 18,0 ммоль), а затем перемешивали смесь при 0°C в течение 1 часа. После завершения реакции к реакционному раствору добавляли 1М водный раствор гидроксида натрия, полученный раствор экстрагировали этилацетатом (150 мл). Органическую фазу промывали дважды 1М водным раствором гидроксида натрия и один раз насыщенным раствором хлорида натрия. Затем органическую фазу сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 6/1) и получали требуемый продукт в виде желтого кристалла (выход: 79%).
1Н-ЯМР (CDCl3) δ: 1,44 (с, 6H), 3,91 (с, 3H), 5,85 (д, J=9,6 Гц, 1H), 6,33 (д, J=9,6 Гц, 1H), 6,69 (с, 1H), 7,34 (с, 1H)
ЖХ/МС (ЭСИ+): 236 [М++1]
(3R*,4R*)-3,4-эпокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран
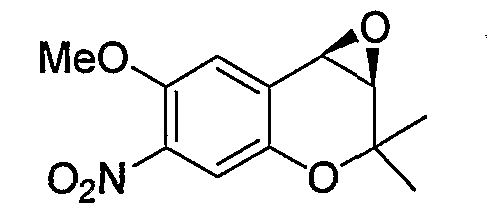
К раствору (300 мл) ацетонитрила, содержащему 6-метокси-2,2-диметил-7-нитро-2H-1-бензопиран (10,0 г, 42,5 ммоль), при комнатной температуре добавляли N-метилимидазол (0,678 мл, 8,50 ммоль), комплекс (R,R,S,S)-Ph,Ph-саленмарганца (XY) (880 мг, 0,850 ммоль) и йодозобензол (18,7 мг, 85,0 ммоль) и перемешивали смесь в течение 2 часов. После завершения реакции к реакционному раствору добавляли водный раствор тиосульфата натрия, полученный раствор фильтровали через броунмиллерит. Полученный фильтрат экстрагировали этилацетатом. Органическую фазу промывали водой и раствором хлорида натрия, а затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 4/1) и получали требуемый продукт в виде желтого кристалла (выход: 75%, оптическая чистота: 99,7% ee).
1Н-ЯМР (CDCl3) δ: 1,26 (с, 3H), 1,58 (с, 3H), 3,53 (д, J=4,3 Гц, 1H), 3,90 (д, J=4,3 Гц, 1H), 3,95 (с, 3H), 7,08 (с, 1H), 7,33 (с, 1H)
МС (EI): 251 [М+]
ВЭЖХ: 18,6 мин (энантиомер 24,1 мин)
Условия проведения ВЭЖХ: chiralcel OJ-RH, МeCN/МeOH/0,01 М NaCl водн. = 1/3/5,1,0 мл/мин, 40°C, 256 нм
(3R*,4S*)-6-метокси-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ол
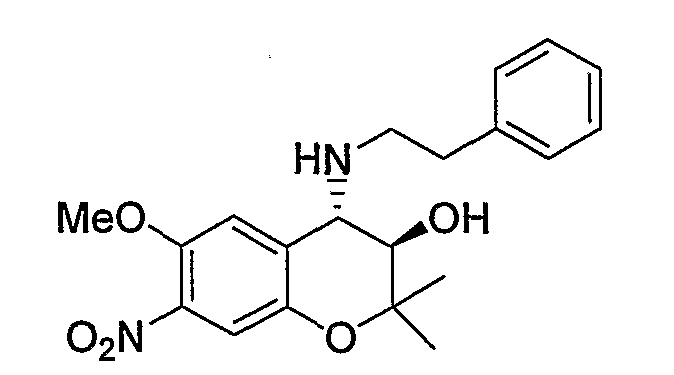
К раствору (3R*,4S*)-3,4-эпокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопирана (2,50 г, 9,95 ммоль) в 1,4-диоксане (5,0 мл) при комнатной температуре добавляли перхлорат лития (1,06 г, 9,95 ммоль) и 4-(фенилэтил)амин (1,50 мл, 11,9 ммоль) и перемешивали смесь при 80°C в течение 1 часа. После завершения реакции к реакционному раствору добавляли насыщенный водный раствор хлорида аммония и экстрагировали полученный раствор этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 6/4) и получали требуемый продукт в виде оранжевого аморфного вещества (с количественным выходом).
1Н-ЯМР (CDCl3) δ: 1,15 (с, 3H), 1,47 (с, 3H), 2,73-2,95 (м, 4H), 3,60 (д, J=10,0 Гц, 1H), 3,68 (д, J=10,0 Гц, 1H), 3,73 (с, 3H), 6,78 (с, 1H), 7,21-7,35 (м, 6H)
МС (EI): 372 [М+]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
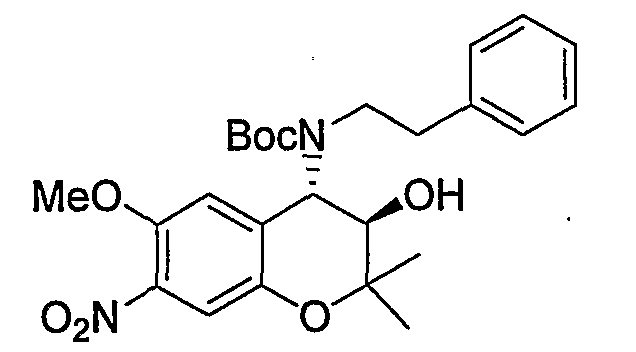
К раствору (3R*,4S*)-6-метокси-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ола (407 мг, 1,09 ммоль) и ди-трет-бутилкарбоната (477 мг, 2,19 ммоль) в тетрагидрофуране (6,0 мл) при 0°C добавляли триэтиламин (305 мл, 2,19 ммоль) и перемешивали смесь при комнатной температуре в течение ночи. После завершения реакции к реакционному раствору добавляли насыщенный водный раствор карбоната натрия и экстрагировали полученный раствор этилацетатом. Органическую фазу промывали 1М водным раствором соляной кислоты и насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 4/1) и получали требуемый продукт в виде желтого аморфного вещества (выход: 88%).
МС (EI): 473 [M++1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
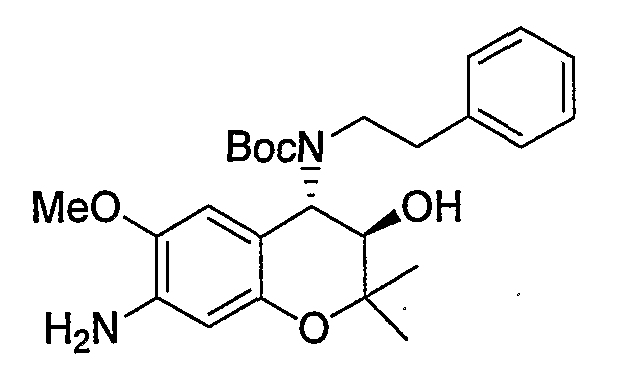
Раствор трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (1,32 г, 2,80 ммоль) и 5% палладированного угля (132 мг) в метаноле (26 мл) перемешивали в атмосфере водорода при комнатной температуре в течение ночи. После завершения реакции реакционный раствор фильтровали через броунмиллерит. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 4/1) и получали требуемый продукт в виде бесцветного твердого вещества (выход: 94%).
ЖХ/МС (ЭСИ+): 443 [M++1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
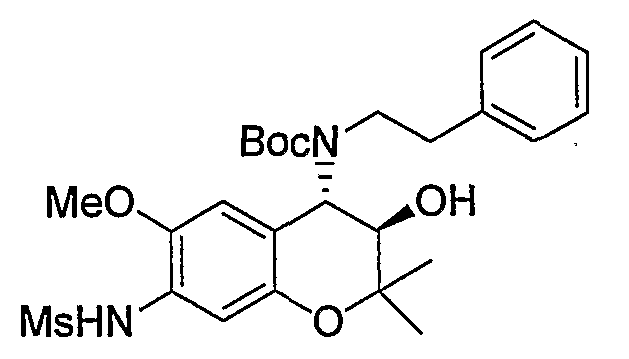
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (1,16 мг, 2,62 ммоль) в пиридине (11,6 мл) добавляли метансульфонилхлорид (0,223 мл, 2,88 ммоль), температуру повышали до комнатной температуры и перемешивали полученную смесь при комнатной температуре в течение ночи. После завершения реакции к реакционному раствору добавляли 1М водный раствор соляной кислоты (приблизительно 30 мл) для корректировки значения pH до pH 5-9, а затем экстрагировали смесь этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 3/1) и получали требуемый продукт в виде бесцветного маслянистого вещества (выход: 77%).
МС (EI): 520 [М+]
N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
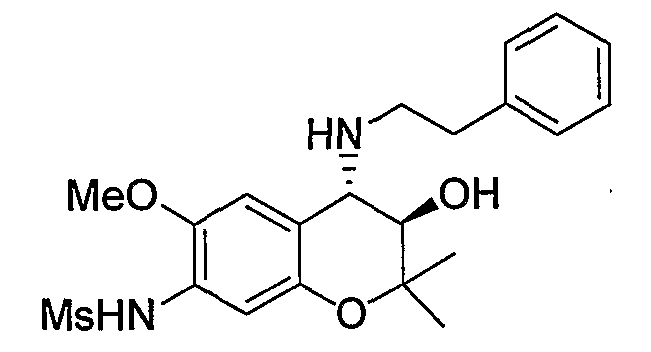
Раствор трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (300 мг, 0,577 ммоль) в дихлорметане (3,0 мл) охлаждали до 0°C, добавляли к нему трифторуксусную кислоту (3,0 мл) и перемешивали полученную смесь при 0°C в течение 1 часа. После завершения реакции отгоняли растворитель, очищали остаток по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 2/1) и получали требуемый продукт в виде серого аморфного вещества (выход: 99%).
1Н-ЯМР (CDCl3) δ: 1,12 (с, 3H), 1,49 (с, 3H), 2,93-3,16 (м, 4H), 3,03 (с, 3H), 3,81 (с, 3H), 3,95 (д, J=9,2 Гц, 1H), 4,55 (д, J=9,2 Гц, 1H), 7,02-7,32 (м, 7H)
МС (EI): 420 [М+]
Пример синтеза 2
N-{(3R*,4S*)-3,6-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
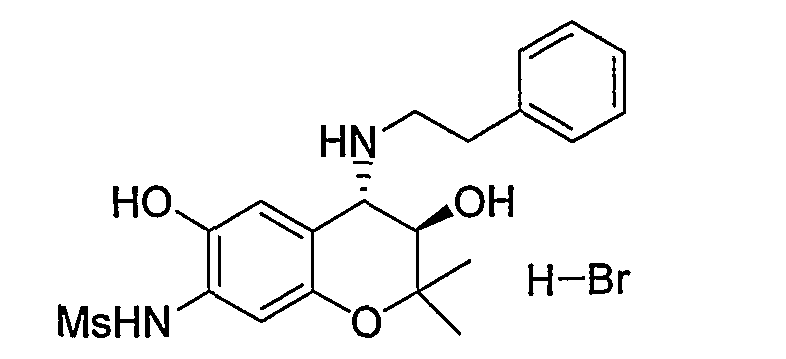
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-{(метилсульфонил)амино}-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (300 мг, 0,58 ммоль) в дихлорметане (3,0 мл) при охлаждении на льду добавляли 1М раствор трехбромистого бора/дихлорметана (2,88 мл, 2,88 ммоль) и перемешивали полученную смесь при 0°C в течение 1 часа. После завершения реакции добавляли метанол, перемешивали полученную смесь в течение 30 минут и отгоняли растворитель. Остаток промывали этилацетатом и сушили полученное твердое вещество при пониженном давлении при 50°C в течение 2 часов, получая тем самым гидробромид требуемого продукта в виде желтого твердого вещества (выход: 56%).
1Н-ЯМР (ДМCО-d6) δ: 1,08 (с, 3H), 1,39 (с, 3H), 2,99-3,11 (м, 4H), 3,00 (с, 3H), 3,89 (дд, J=6,6, 8,8 Гц, 1H), 4,30 (д, J=8,8 Гц, 1H), 6,12 (д, J=6,6 Гц, 1H), 6,73 (с, 1H), 7,10 (с, 1H), 7,23-7,36 (м, 5H), 8,82 (с, 1H), 8,88 (шир.с, 1H), 9,35 (шир.с, 1H), 9,54 (с, 1H)
ЖХ/МС (ЭСИ+): 407 [M++1], (ЭСИ-): 405 [М+-1]
Пример синтеза 3
N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}-N-метилметансульфонамид
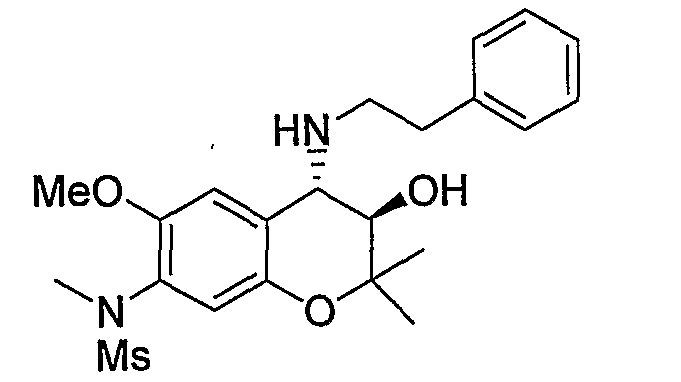
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-(N-метил-N-метилсульфониламино)-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
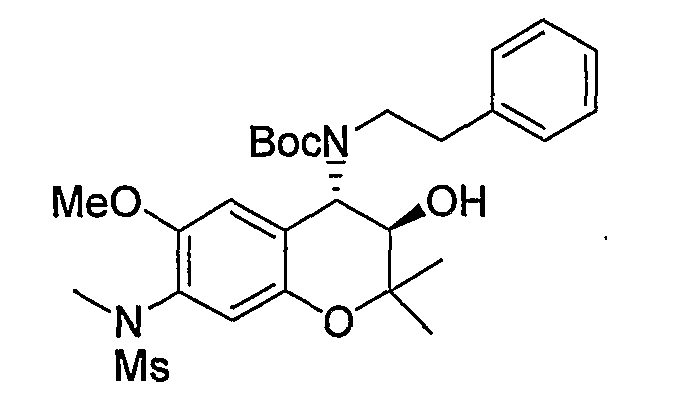
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-(N-метилсульфониламино)-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (227 мг, 0,423 ммоль) и карбоната калия (76 мг, 0,550 ммоль) в ацетоне (2,3 мл) при комнатной температуре добавляли метилйодид (0,040 мл, 0,635 ммоль) и перемешивали полученную смесь в течение ночи. После завершения реакции растворитель отгоняли и добавляли к остатку воду. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и отгоняли растворитель. Остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 3/1) и получали требуемый продукт в виде бесцветного аморфного вещества (выход: 93%).
ЖХ/МС (ЭСИ+): 535 [M++1], 557 [M++Na]
N-{3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}-N-метилметансульфонамид
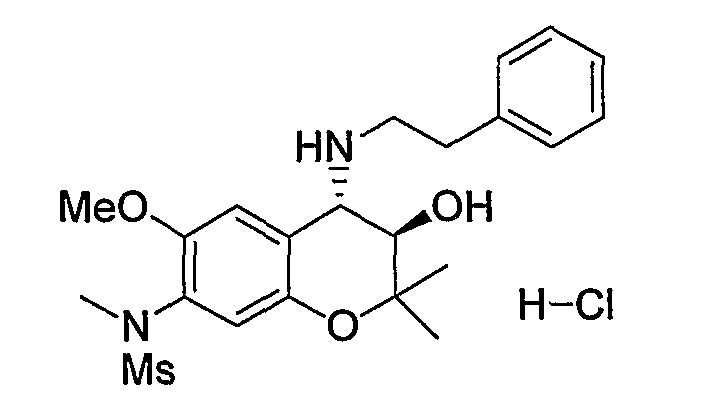
К трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-(N-метил-N-метилсульфониламино)-3,4-дигидро-2H-1-бензопиран-4-илкарбамату (201 мг, 0,389 ммоль) при комнатной температуре добавляли 4М раствор хлороводорода/1,4-диоксана (2,01 мл, 8,04 ммоль) и перемешивали полученную смесь при 100°C в течение 30 минут. После завершения реакции отгоняли растворитель. Полученное твердое вещество промывали 2-пропанолом, получая тем самым гидрохлорид требуемого продукта в виде бледно-голубого твердого вещества (выход: 84%).
1Н-ЯМР (ДМCО-d6) δ: 1,09 (с, 3H), 1,41 (с, 3H), 3,00 (с, 3H), 3,02-3,19 (м, 4H), 3,10 (с, 3H), 3,85 (с, 3H), 4,00 (дд, J=5,8, 9,3 Гц, 1H), 4,40 (д, J=9,3 Гц, 1H), 6,28 (д, J=5,8 Гц, 1H), 6,79 (с, 1H), 7,23-7,36 (м, 5H), 7,68 (с, 1H), 9,48 (шир.с, 1H), 9,81 (шир.с, 1H)
ЖХ/МС (ЭСИ+): 435 [M++1]
Пример синтеза 4
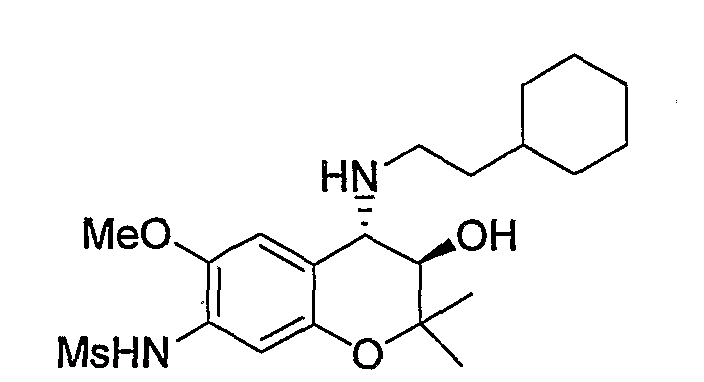
N-{(3R*,4S*)-4-[(2-циклогексилэтил)амино]-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
(3R*,4S*)-4-амино-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-3-ол
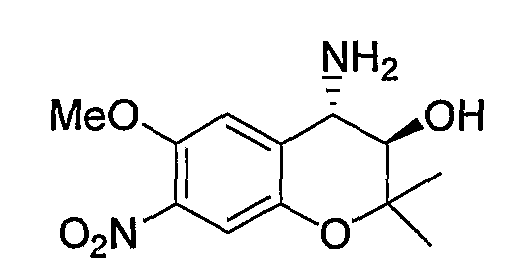
К раствору (3R*,4R*)-3,4-эпокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопирана (2,64 г, 10,5 ммоль) в этаноле (26 мл) добавляли аммиачную воду (26 мл) и перемешивали полученную смесь в герметичном сосуде при 100°C в течение 2 часов. После завершения реакции отгоняли растворитель. К остатку добавляли насыщенный водный раствор карбоната натрия и экстрагировали полученную смесь этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния, получая тем самым требуемый продукт в виде красного аморфного вещества (выход: 84%).
1Н-ЯМР (ДМCО-d6) δ: 1,20 (с, 3H), 1,50 (с, 3H), 1,60 (шир.с, 3H), 3,38 (д, J=9,6 Гц, 1H), 3,67 (д, J=9,6 Гц, 1H), 3,93 (с, 3H), 7,20 (с, 1H), 7,31 (с, 1H)
Трет-бутил{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-ил}карбамат
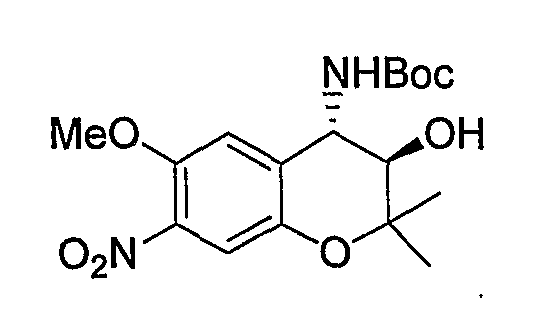
К раствору (3R*,4S*)-4-амино-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-3-ола (2,62 г, 9,77 ммоль) и ди-трет-бутилкарбоната (4,26 г, 19,5 ммоль) в тетрагидрофуране (52 мл) при 0°C добавляли триэтиламин (2,72 мл, 19,5 ммоль) и перемешивали смесь при комнатной температуре в течение ночи. После завершения реакции к реакционному раствору добавляли насыщенный водный раствор карбоната натрия и экстрагировали полученный раствор этилацетатом. Органическую фазу промывали 1М водным раствором соляной кислоты и насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 2/1) и получали требуемый продукт в виде желтого твердого вещества (выход: 92%).
1Н-ЯМР (CDCl3) δ: 1,24 (с, 3H), 1,48 (с, 3H), 1,52 (с, 9H), 1,61 (с, 1H), 3,47-3,51 (м, 1H), 3,62-3,67 (м, 1H), 3,90 (с, 3H), 4,72 (м, 1H), 4,87-4,94 (м, 1H), 6,98 (с, 1H), 7,32 (с,1H)
Трет-бутил{(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил}карбамат
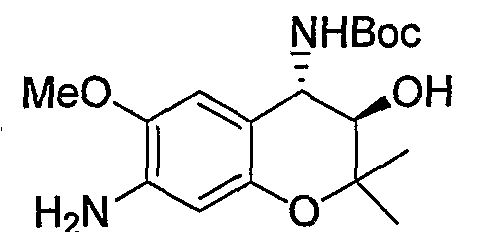
Раствор трет-бутил(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (3,31 г, 8,96 ммоль) и 5% палладированного угля (330 мг) в этаноле (66 мл) перемешивали в атмосфере водорода при комнатной температуре в течение ночи. После завершения реакции реакционный раствор фильтровали через броунмиллерит. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя хлороформом/метанолом = 30/1) и получали требуемый продукт в виде бесцветного аморфного вещества (выход: 33%).
1Н-ЯМР (CDCl3) δ: 1,20 (с, 3H), 1,43 (с, 3H), 1,51 (с, 9H), 3,59 (д, J=8,8 Гц, 1H), 3,80 (с, 3H), 3,97 (с, 1H), 4,62 (дд, J=7,4, 8,8 Гц, 1H), 4,84 (д, J=7,4 Гц, 1H), 6,17 (с,1H), 6,59(с, 1H)
ЖХ/МС (ЭСИ+): 339 [M++1], 361 [M++Na]
Трет-бутил{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-ил}карбамат
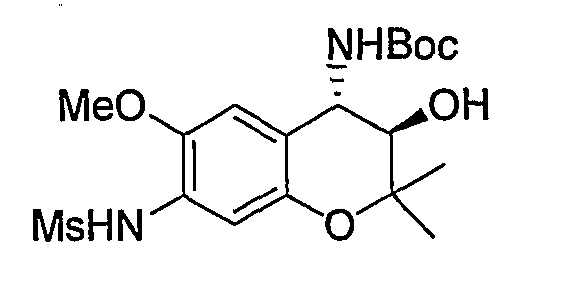
К раствору трет-бутил{(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил}карбамата (980 мг, 2,90 ммоль) в пиридине (9,8 мл) добавляли метансульфонилхлорид (0,25 мл, 3,19 ммоль) и перемешивали полученную смесь при комнатной температуре в течение ночи. После завершения реакции к реакционному раствору добавляли 1М водный раствор соляной кислоты (приблизительно 30 мл) для корректировки значения pH до pH=5-9, а затем экстрагировали смесь этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя затвердевший остаток промывали смесью метанола и диизопропилового эфира и получали требуемый продукт в виде розового твердого вещества (выход: 79%).
1Н-ЯМР (CDCl3) δ: 1,22 (с, 3H), 1,45 (с, 3H), 1,51 (с, 9H), 3,00 (с, 3H), 3,61 (дд, J=3,0, 8,9 Гц, 1H), 3,67 (с, 1H), 3,84 (с, 3H), 4,69 (дд, J=8,0, 8,9 Гц, 1H), 4,81 (д, J=8,0 Гц, 1H), 6,74 (с, 1H), 6,83 (с, 1H), 7,01 (с, 1H)
ЖХ/МС (ЭСИ+): 438 [M++Na], (ЭСИ-): 415 [M+-1]
Гидрохлорид N-{(3R*,4S*)-(4-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-7-ил)}метансульфонамида
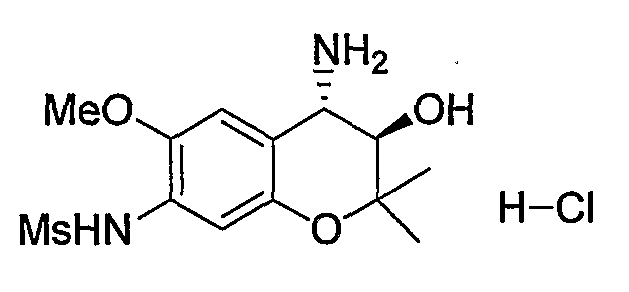
К трет-бутил{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-ил}карбамату (419 мг, 1,00 ммоль) при комнатной температуре добавляли 4М раствор хлороводорода/1,4-диоксана (2,52 мл, 10,0 ммоль) и перемешивали полученную смесь при 100°C в течение 30 минут. После завершения реакции отгоняли растворитель. Полученное твердое вещество промывали диизопропиловым эфиром, получая тем самым гидрохлорид требуемого продукта в виде бесцветного твердого вещества (выход: 99%).
ЖХ/МС (ЭСИ+): 339 [M++Na], (ЭСИ-): 315[I\/T-1]
N-{(3R*,4S*)-4-[(2-циклогексилэтил)амино]-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
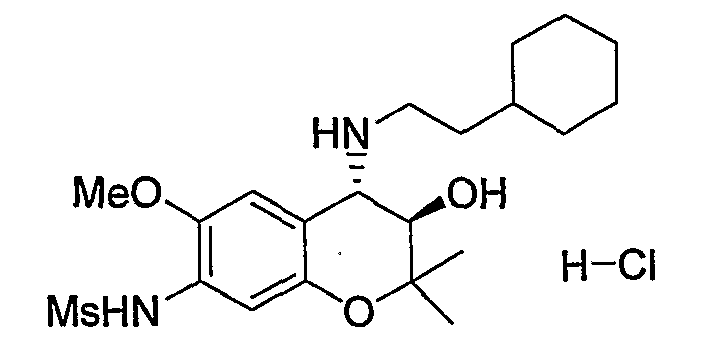
К раствору гидрохлорида N-(4-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-7-ил)метансульфонамида (118 мг, 0,34 ммоль), циклогексилацетальдегида (63 мг, 0,50 ммоль) и триэтиламина (0,034 мл, 0,34 ммоль) в метаноле (2,4 мл) при комнатной температуре добавляли цианборгидрид натрия (42 мг, 0,67 ммоль) и перемешивали смесь при указанной температуре в течение 2 часов. После завершения реакции к реакционному раствору добавляли воду и экстрагировали полученный раствор этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 1/2) и получали требуемый продукт в виде маслянистого вещества. К маслянистому веществу в виде раствора в 1,4-диоксане (0,40 мл) добавляли 4М раствор хлороводорода/1,4-диоксана (0,40 мл, 2,0 ммоль) и перемешивали полученную смесь при 0°C в течение 30 минут. Затем добавляли изопропиловый эфир (5 мл), перемешивали полученную смесь в течение 30 минут и отфильтровывали полученные кристаллы, получая тем самым гидрохлорид требуемого продукта в виде бесцветного твердого вещества (выход: 34%).
1Н-ЯМР (CDCl3) δ: 0,87-1,69 (м, 13H), 1,24 (с, 3H), 1,47 (с, 3H), 2,49-2,57 (м, 1H), 2,63-2,72 (м, 1H), 3,00 (с, 3H), 3,60 (д, J=9,6 Гц, 1H), 3,67 (д, J=9,6 Гц, 1H), 3,83 (с, 3H), 6,84 (с, 1H), 7,00 (с, 1H)
ЖХ/МС (ЭСИ+): 427 [М++1], (ЭСИ-): 425 [M+-1]
Пример синтеза 5
N-{(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-4-пентиламино-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
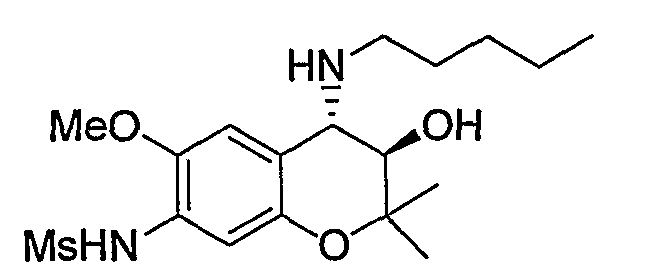
Гидрохлорид требуемого продукта в виде бесцветного твердого вещества (выход: 32%) получали путем синтеза, сходного с упомянутым выше способом.
1Н-ЯМР (CDCl3) δ: 0,90 (t, J= 6,8 Гц, 3H), 1,23-1,52 (м, 6H), 1,18 (с, 3H), 1,48 (с, 3H), 2,47-2,55 (м, 1H), 2,61-2,70 (м, 1H), 3,00 (с, 3H), 3,59 (д, J= 9,8 Гц, 1H), 3,66 (д, J= 9,8 Гц, 1H), 3,83 (с, 3H), 6,85 (с, 1H), 6,99 (с, 1H)
ЖХ/МС (ЭСИ+): 387 [М++1], (ЭСИ+): 385 [М+-1]
Пример синтеза 6
N-{(3R*,4S*)-3-гидрокси-2,2,8-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
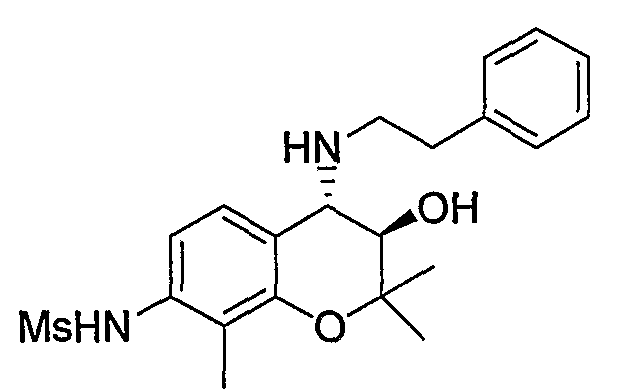
2,2,8-Триметил-7-нитро-2H-1-бензопиран
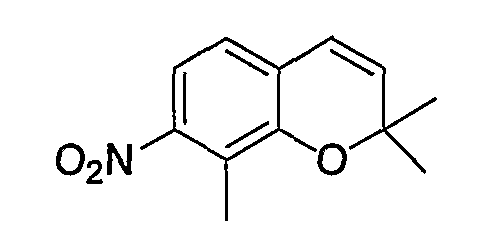
Соединение синтезировали в соответствии со способом, сходным с описанным для примера синтеза 1 (в 2 стадии, выход: 70%).
1Н-ЯМР (CDCl3) δ: 1,46 (с, 6H), 2,36 (с, 3H), 5,78 (д, J=9,6 Гц, 1H), 6,34 (д, J=9,6 Гц, 1H), 6,91 (д, J=8,3 Гц, 1H), 7,39 (д, J=8,3 Гц, 1H)
МС (EI): 219 [М+]
(3R*,4R*)-3,4-эпокси-2,2,8-триметил-7-нитро-3,4-дигидро-2H-1-бензопиран
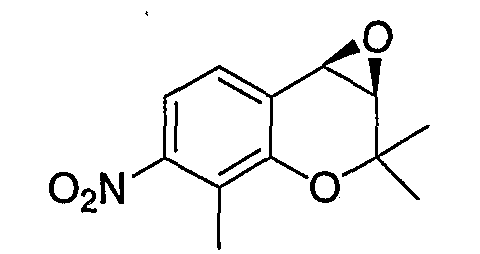
К раствору (50 мл) этилацетата, содержащего 2,2,8-триметил-7-нитро-2H-1-бензопиран (3,32 г, 15,1 ммоль), при комнатной температуре добавляли N-метилимидазол (0,482 мл, 6,05 ммоль) и комплекс (R,R,S,S)-Ph,Ph-саленмарганца (XY) (142 мг, 0,151 ммоль), по каплям добавляли водный раствор гипохлорита натрия (34,1 мл, 1,776 моль/кг, 60,5 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 1 часа. После завершения реакции к реакционному раствору добавляли водный раствор тиосульфата натрия и фильтровали полученный раствор через броунмиллерит. Полученный фильтрат экстрагировали этилацетатом. Органическую фазу промывали водой и водным раствором хлорида натрия, а затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 7/1) и получали требуемый продукт в виде бледно-желтого кристалла (выход: 78%, оптическая чистота: 99% ee).
1Н-ЯМР (CDCl3) δ: 1,25 (с, 3H), 1,64 (с, 3H), 2,32 (с, 3H), 3,55 (д, J=4,2 Гц, 1H), 3,94 (д, J=4,2 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,44 (д, J=8,3 Гц, 1H)
ВЭЖХ: 18,7 мин (энантиомер 21,8 мин)
Условия проведения ВЭЖХ: chiralcel OJ-RH, МeCN/МeOH/0,01 М NaCl акв. = 1/3/3, 1,0 мл/мин, 40°C, 256 нм
(3R*,4S*)-2,2,8-триметил-7-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ол
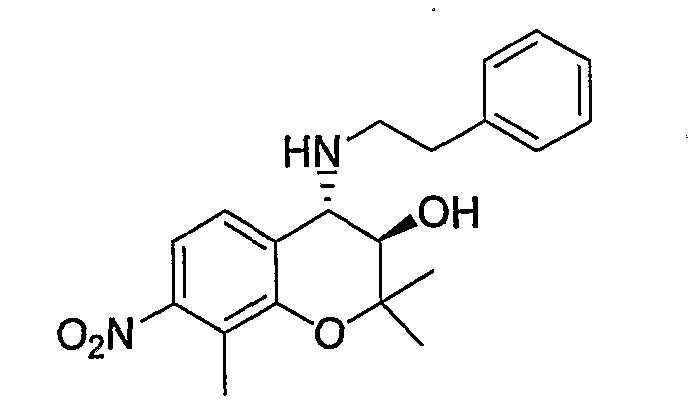
К раствору (3R*,4R*)-3,4-эпокси-2,2,8-триметил-7-нитро-3,4-дигидро-2H-1-бензопирана (600 мг, 2,55 ммоль) в 1,4-диоксане (1,2 мл) при комнатной температуре добавляли перхлорат лития (271 мг, 2,55 ммоль) и 4-(фенилэтил)амин (0,384 мл, 3,06 ммоль) и перемешивали смесь при 80°C в течение 1 часа. После завершения реакции к реакционному раствору добавляли насыщенный раствор хлорида аммония и экстрагировали полученный раствор этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 4/1) и получали требуемый продукт в виде оранжевого маслянистого вещества (выход: 99%).
1Н-ЯМР (CDCl3) δ: 1,16 (с, 3H), 1,52 (с, 3H), 2,31 (с, 3H), 2,72-2,91 (м, 4H), 3,54 (д, J=10,0 Гц, 1H), 3,67 (д, J=10,0 Гц, 1H), 6,91 (д, J=8,5 Гц, 1H), 7,19 (м, 6H)
МС (EI): 356 [М+]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2,8-триметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
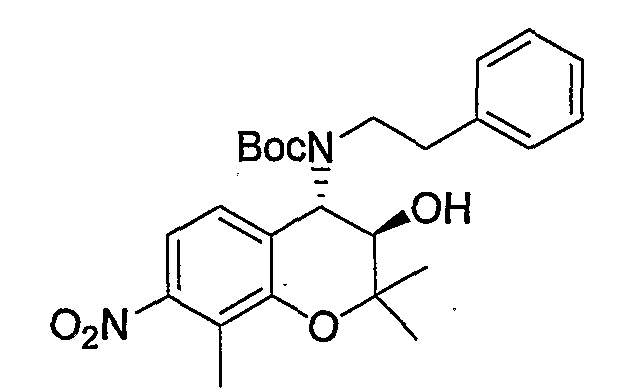
К раствору (3R*,4S*)-2,2,8-триметил-7-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ола (896 мг, 2,51 ммоль) и ди-трет-бутилкарбоната (1,10 г, 5,03 ммоль) в тетрагидрофуране (9,0 мл) при 0°C добавляли триэтиламин (700 мл, 5,03 ммоль) и перемешивали смесь при комнатной температуре в течение ночи. После завершения реакции к реакционному раствору добавляли насыщенный водный раствор карбоната натрия и экстрагировали смесь этилацетатом. Органическую фазу промывали 1М водным раствором соляной кислоты и насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 4/1) с получением требуемого продукта в виде бесцветного аморфного вещества (выход: 86%).
МС (EI): 456 [М+]
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2,8-триметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
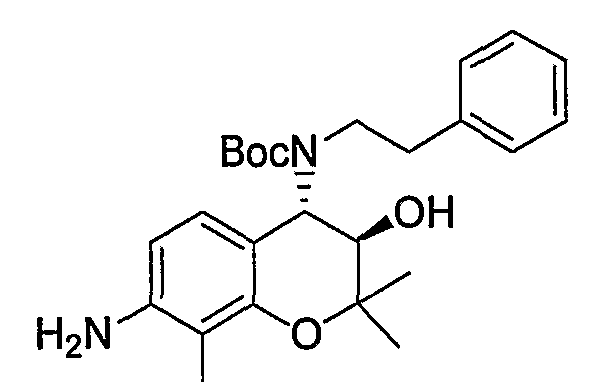
Раствор трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2,8-триметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (980 мг, 2,15 ммоль) и 5% палладированного угля (98 мг) в этаноле (19,6 мл) перемешивали в атмосфере водорода при комнатной температуре в течение ночи. После завершения реакции реакционный раствор фильтровали через броунмиллерит. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 3/1) с получением требуемого продукта в виде бесцветного твердого вещества (выход: 87%).
ЖХ/МС (ЭСИ+): 427 [М++1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2,8-триметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
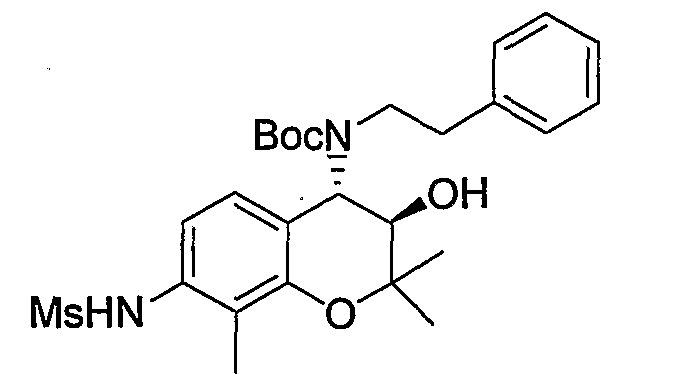
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2,8-триметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (440 мг, 1,03 ммоль) в пиридине (4,4 мл) при комнатной температуре добавляли метансульфонилхлорид (0,31 мл, 3,52 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 3 часов. После завершения реакции к реакционному раствору добавляли 1М водный раствор соляной кислоты (приблизительно 30 мл) для корректировки значения pH до pH 5-9, а затем экстрагировали смесь этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, а затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 3/1) и получали требуемый продукт в виде бесцветного маслянистого вещества (выход: 75%).
ЖХ/МС (ЭСИ+): 527 [М++Na], (ЭСИ-): 503 [М+-1]
N-{3-гидрокси-2,2,8-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
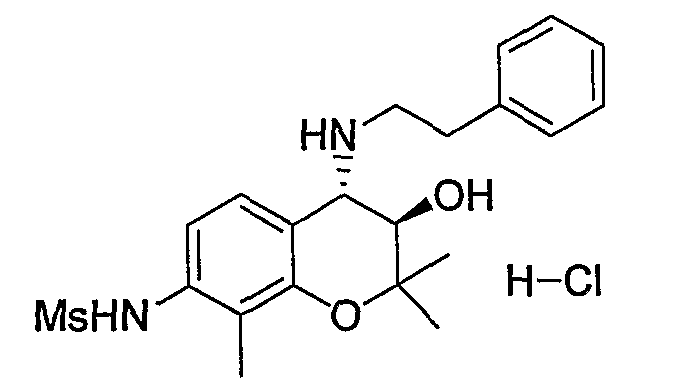
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2,8-триметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (390 мг, 0,77 ммоль) в 1,4-диоксане (3,9 мл) при комнатной температуре добавляли 4М раствор хлороводорода в 1,4-диоксане (1,94 мл, 7,8 ммоль) и перемешивали полученную смесь при 100°C в течение 30 минут. После завершения реакции отгоняли растворитель и промывали полученное твердое вещество раствором этилацетата/гексаном = 1/3 с получением гидрохлорида требуемого продукта в виде в виде бесцветного твердого вещества (выход: 92%).
1Н-ЯМР (ДМCО-d6) δ: 1,08 (с, 3H), 1,45 (с, 3H), 2,10 (с, 3H), 2,98 (с, 3H), 3,02-3,36 (м, 4H), 4,01 (дд, J=6,1, 8,2 Гц, 1H), 4,40 (д, J=8,2 Гц, 1H), 6,31 (д, J=6,1 Гц, 1H), 6,97 (д, J=8,5 Гц, 1H), 7,22-7,34 (м, 5H), 7,66 (д, J=8,5 Гц, 1H), 9,20(с, 1H), 9,35 (шир.с, 1H), 9,80 (шир.с, 1H)
ЖХ/МС (ЭСИ+): 405 [М++1], (ЭСИ+): 403 [М+-1]
Пример синтеза 7
Малеат N-{3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-амино-3,4-дигидро-2H-бензопиран-4-илкарбамат
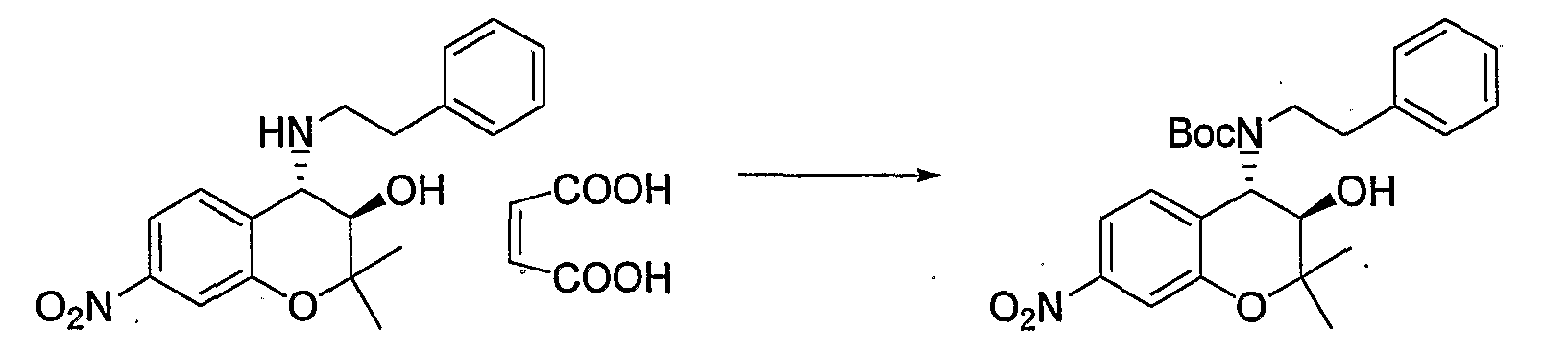
Суспензию малеата (3R*,4S*)-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола (5,20 г, 11,3 ммоль) в этилацетате нейтрализовывали насыщенным водным раствором гидрокарбоната натрия. Органическую фазу промывали насыщенным раствором хлорида натрия и сушили над сульфатом магния. После концентрирования при пониженном давлении полученный (3R*,4S*)-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ол разбавляли тетрагидрофураном (50 мл). Добавляли ангидрид трет-бутоксикарбонила (2,96 г, 27,1 ммоль), перемешивали полученную реакционную смесь при комнатной температуре в течение 1 суток и концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат, полученную смесь промывали водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 10/1) с получением трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-нитро-3,4-дигидро-2H-бензопиран-4-илкарбамата (выход: 91%).
МС (ЭСИ+) m/z; 443 [М++1]
МС (ЭСИ-) m/z; 441 [М+-1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамат

К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-нитро-3,4-дигидро-2H-бензопиран-4-илкарбамата (4,55 г, 10,3 ммоль) в этаноле (91 мл) добавляли палладированный уголь (230 мг), добавляли водород при нормальном давлении, а затем перемешивали смесь в течение 1 суток. Реакционный раствор фильтровали через броунмиллерит и концентрировали фильтрат при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии (элюируя гексаном/этилацетатом = 5/1) с получением трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамата (выход: 93%).
МС (ЭСИ+) m/z; 413 [М++1]
МС (ЭСИ-) m/z; 457 [М+-45]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[(метансульфонил)амино]-3,4-дигидро-2H-1-бензопиран-4-илкарбамат
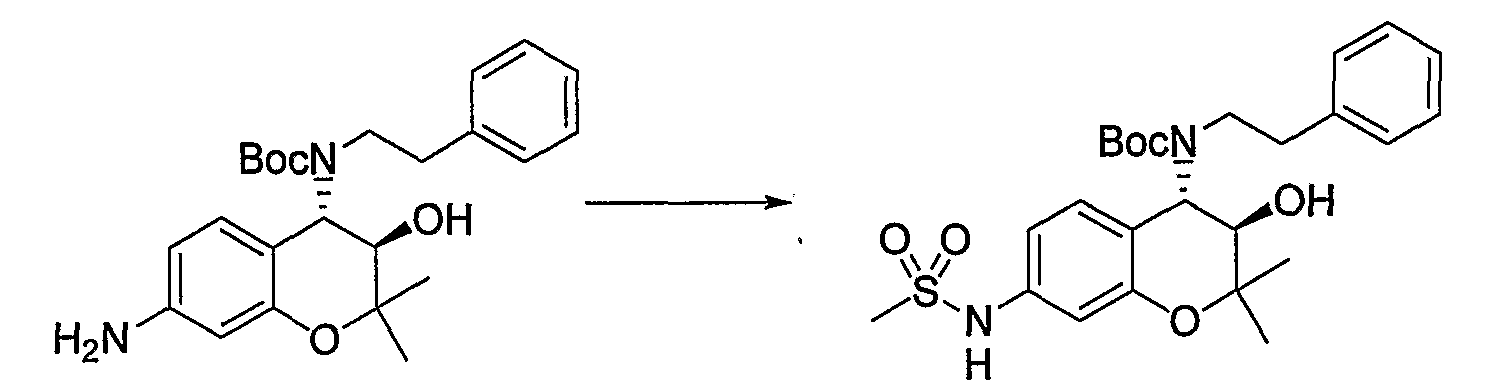
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамата (321 мг, 0,779 ммоль) в тетрагидрофуране (3,2 мл) добавляли триэтиламин (239 мкл, 1,71 ммоль) и при 0°C по каплям добавляли метилсульфонилхлорид (60,3 мкл, 0,779 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов, а затем при 0°C дополнительно добавляли метилсульфонилхлорид (60,3 мл, 0,779 ммоль). После перемешивания при комнатной температуре смесь нейтрализовывали добавлением насыщенного водного раствора гидрокарбоната натрия. К реакционному раствору добавляли этилацетат, реакционный раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, полученную органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[(метансульфонил)амино]-3,4-дигидро-2H-бензопиран-4-илкарбамата (выход: 65%).
МС (ЭСИ+) m/z; 491 [М++1]
МС (ЭСИ-) m/z; 489 [М+-1]
N-{3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид
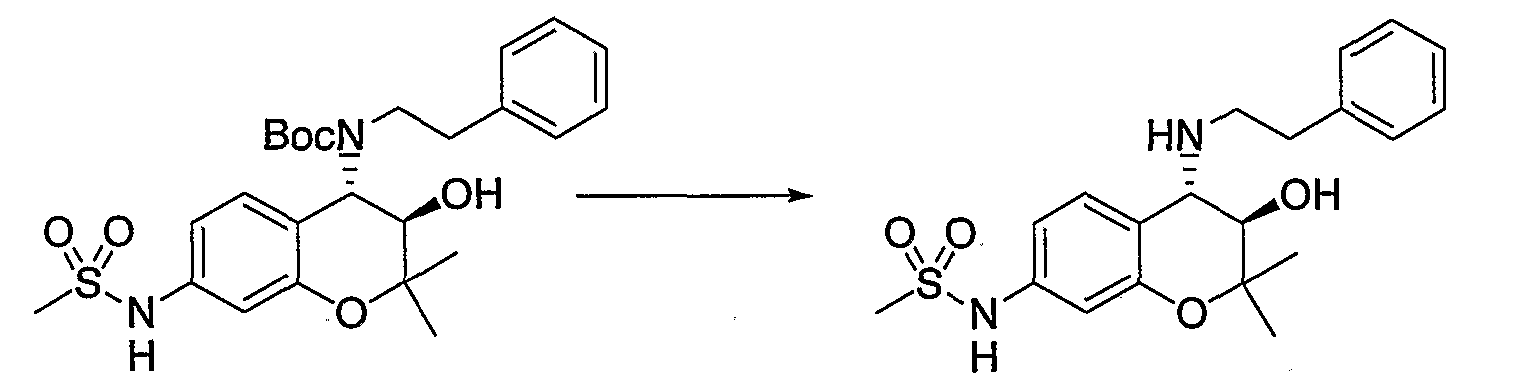
4М раствор соляной кислоты в диоксане (24 мл), содержащий трет-бутил(2-фенилэтил){(3R*,4S*)-3-гидрокси-2,2-диметил-7-[(метансульфонил)амино]-3,4-дигидро-2H-бензопиран-4-ил}карбамат (1,2 г, 2,4 ммоль), перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли этилацетат, реакционный раствор промывали 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 1/1) с получением N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (выход: 58%).
Малеат N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида
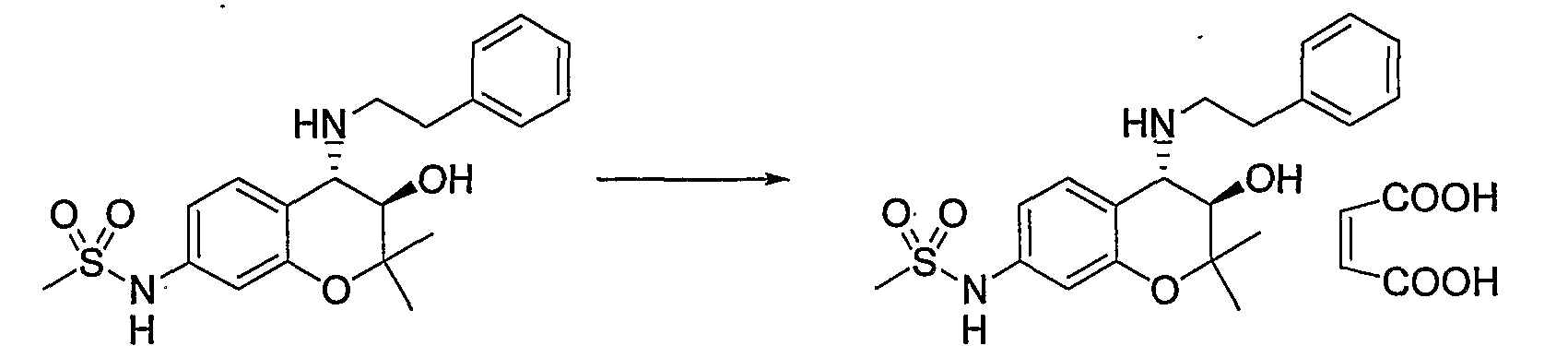
К раствору N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (66,8 мг, 0,171 ммоль) в этаноле по каплям добавляли раствор малеиновой кислоты (22 мг, 0,19 ммоль) в этаноле. После концентрирования при пониженном давлении полученное твердое вещество суспендировали в этилацетате. Перемешивали суспензию и отфильтровывали твердое вещество. Твердое вещество промывали этилацетатом, сушили и получали тем самым малеат N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (выход: 85%).
Белое твердое вещество:
1Н-ЯМР (ДМCО-d6) δ: 1,10 (с, 3H), 1,42 (с, 3H), 2,80-3,50 (м, 7H), 3,90 (м, 1H), 4,31 (м, 1H), 6,04 (с, 2H), 6,16 (м, 1H), 6,65 (м, 1H), 6,85 (м, 1H), 7,15-7,40 (м, 5H), 7,50 (м, 1H), 9,93 (шир., 1H)
МС (ЭСИ+) m/z; 391 [М++1]
МС (ЭСИ-) m/z; 389 [М+-1]
Пример синтеза 8
Гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}этансульфонамида
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамат
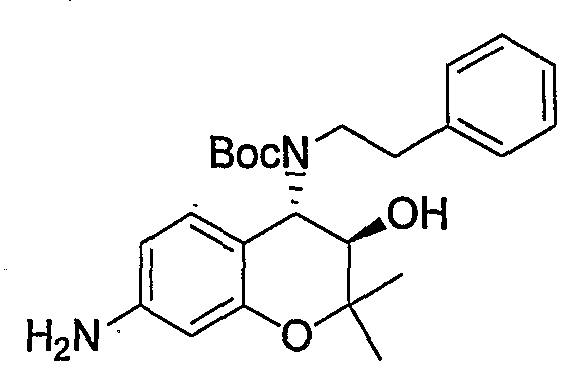
Соединение синтезировали в соответствии со способом синтеза, изложенным в примере синтеза 7.
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-[(этилсульфонил)амино]-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамат
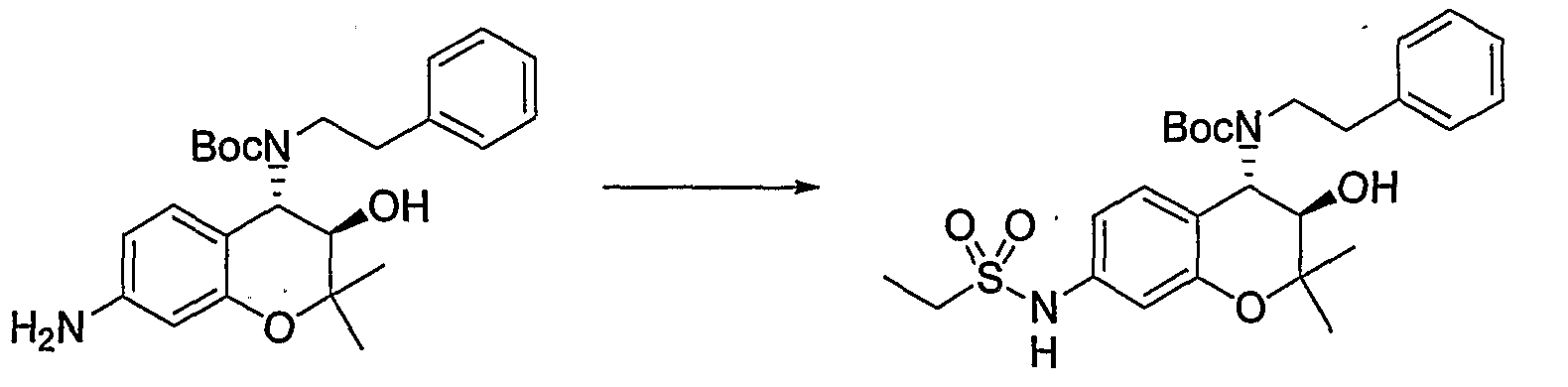
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамата (190 мг, 0,459 ммоль) в пиридине (2 мл) при 0°C по каплям добавляли этилсульфонилхлорид (48 мкл, 0,46 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 14 часов. К реакционному раствору добавляли этилацетат, раствор промывали 1М водным раствором соляной кислоты и насыщенным раствором хлорида натрия, после чего органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с количественным получением трет-бутил(2-фенилэтил)(3R*,4S*)-7-[(этилсульфонил)амино]-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамата.
МС (ЭСИ-) m/z; 503 [М+-1]
Гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}этансульфонамида
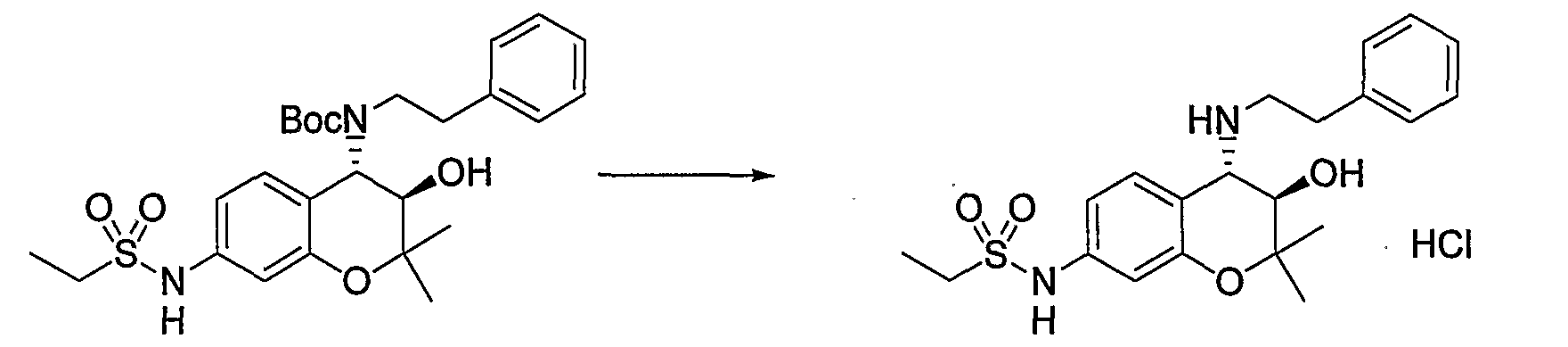
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-[(этилсульфонил)амино]-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамат (239 мг, 0,473 ммоль) суспендировали в 4М растворе соляной кислоты в диоксане (4 мл) и перемешивали полученную суспензию при комнатной температуре в течение 1,5 часов, а затем отфильтровывали твердое вещество. Твердое вещество промывали этилацетатом с получением гидрохлорида N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}этансульфонамида (выход: 66%).
Белое твердое вещество:
1Н-ЯМР (ДМCО-d6) δ: 1,11 (с, 3H), 1,91 (t, J=7,4 Гц, 3H), 2,90-3,40 (м, 6H), 3,13 (кв, J=7,4 Гц, 2H), 3,97 (м, 1H), 4,36 (м, 1H), 6,32 (м, 1H), 6,68 (м, 1H), 6,86 (м, 1H), 7,20-7,40 (м, 5H), 7,75 (м, 1H), 10,03 (с, 1H)
МС (ЭСИ+) m/z; 405 [М++1]
МС (ЭСИ-) m/z; 403 [М+-1]
Пример синтеза 9
N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}-4-метилбензолсульфонамид
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-{(4-метилфенил)сульфониламино}-3,4-дигидро-2H-бензопиран-4-илкарбамат
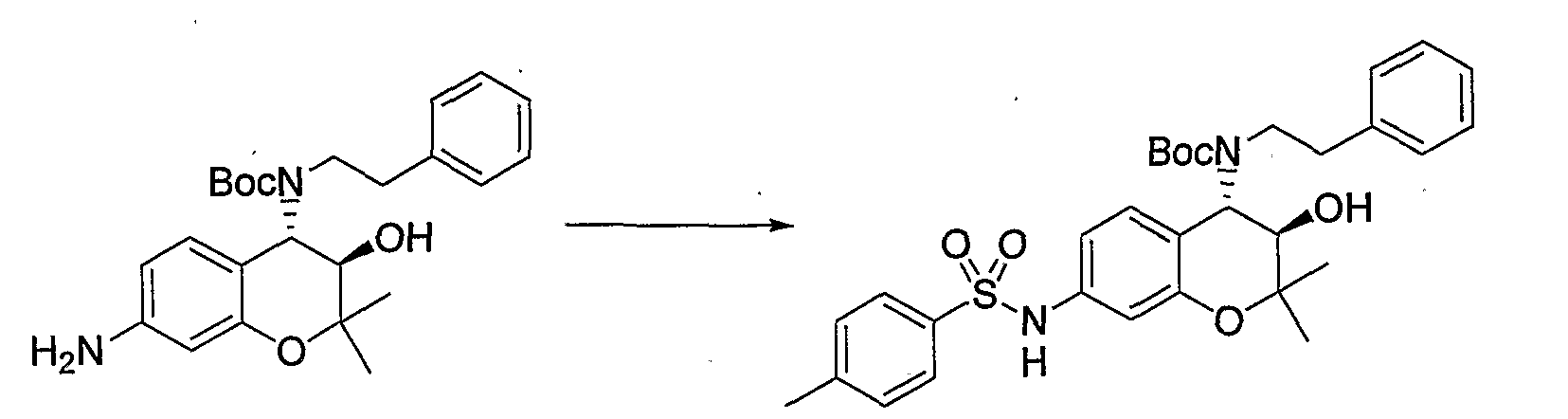
Соединение синтезировали в соответствии со способом синтеза, изложенным в примере синтеза 7.
МС (ЭСИ+) m/z; 567 [М++1]
МС (ЭСИ-) m/z; 565 [М+-1]
N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}-4-метилбензолсульфонамид
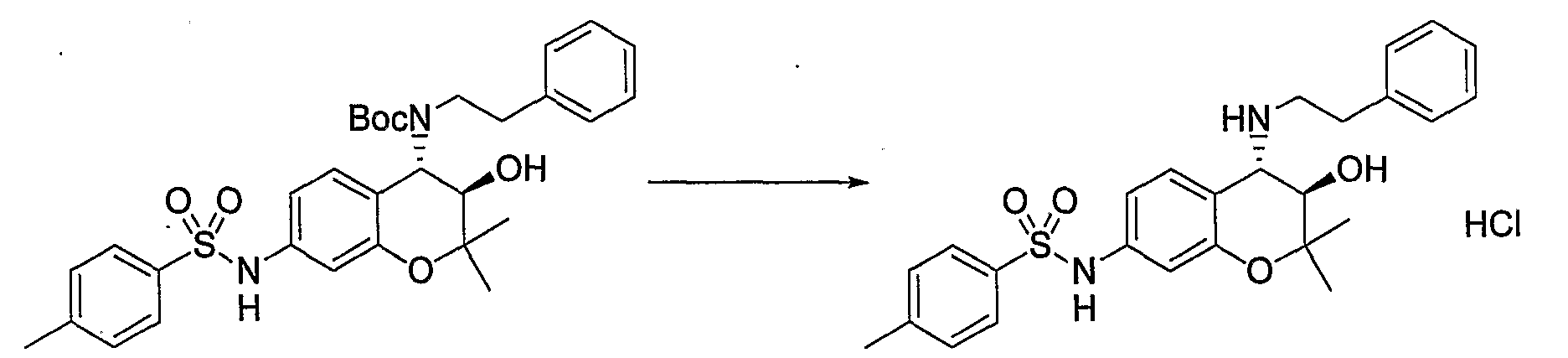
Соединение синтезировали в соответствии со способом синтеза, изложенным в примере синтеза 8.
Белое твердое вещество:
1Н-ЯМР (CDCl3) δ: 1,10 (с, 3H), 1,42 (с, 3H), 2,37 (с, 3H), 2,65-3,00 (м, 4H), 3,35-3,60 (м, 2H), 6,47 (д, J=1,9 Гц, 1H), 6,59 (дд, J=1,9 Гц, 8,3 Гц, 1H), 6,84 (д, J=8,3 Гц, 1H), 7,10-7,35 (м, 7H), 7,68 (м, 2H)
(Данные ЯМР-спектроскопии получены с использованием свободной формы полученного выше гидрохлорида)
Пример синтеза 10
Малеат 1,1,1-трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида
Трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамат
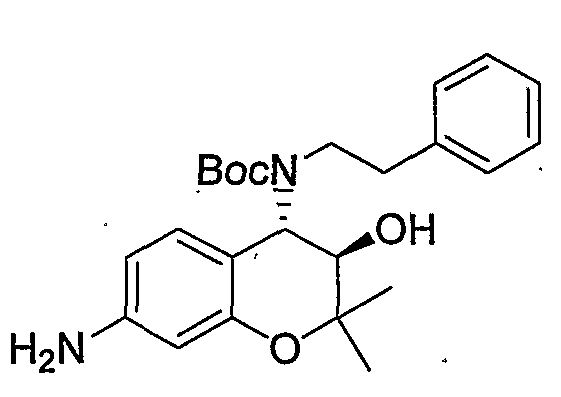
Соединение синтезировали в соответствии со способом синтеза, изложенным в примере синтеза 7.
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-{(трифторметил)сульфониламино}-3,4-дигидро-2H-бензопиран-4-илкарбамат
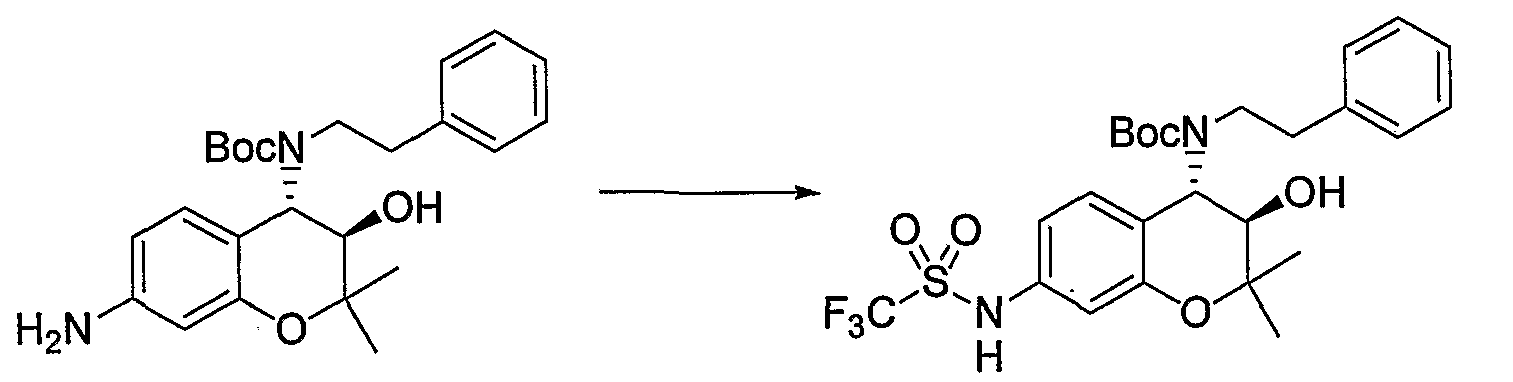
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамата (1,04 г, 2,52 ммоль) в дихлорметане (20 мл) добавляли триэтиламин (879 мкл, 6,30 ммоль) и при -78°C по каплям добавляли трифторметансульфонилхлорид (424 мкл, 2,52 ммоль). После перемешивания в течение 1 часа полученную смесь тушили добавлением насыщенного водного раствора гидрокарбоната натрия, нагревали до комнатной температуры и перемешивали. К реакционному раствору добавляли этилацетат, раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, после чего органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 2/1} с получением трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-{(трифторметил)сульфониламино}-3,4-дигидро-2H-бензопиран-4-илкарбамата (выход: 33%).
МС (ЭСИ-) m/z; 543 [М+-1]
1,1,1-Трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид
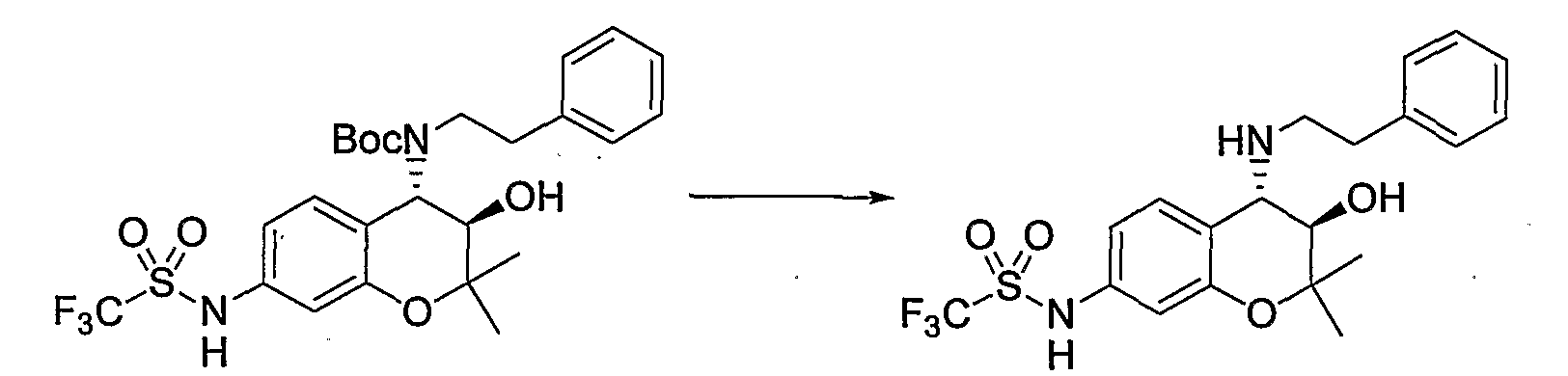
Раствор трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-{(тритформетил)сульфониламино}-3,4-дигидро-2H-бензопиран-4-илкарбамата (459 мг, 0,844 ммоль) в 4М растворе соляной кислоты в диоксане (9 мл) перемешивали при комнатной температуре. К реакционному раствору добавляли этилацетат и промывали раствор 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия. После сушки органической фазы над сульфатом магния ее концентрировали при пониженном давлении с получением 1,1,1-трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (выход: 91%) в виде бесцветного сиропа.
Малеат 1,1,1-трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида
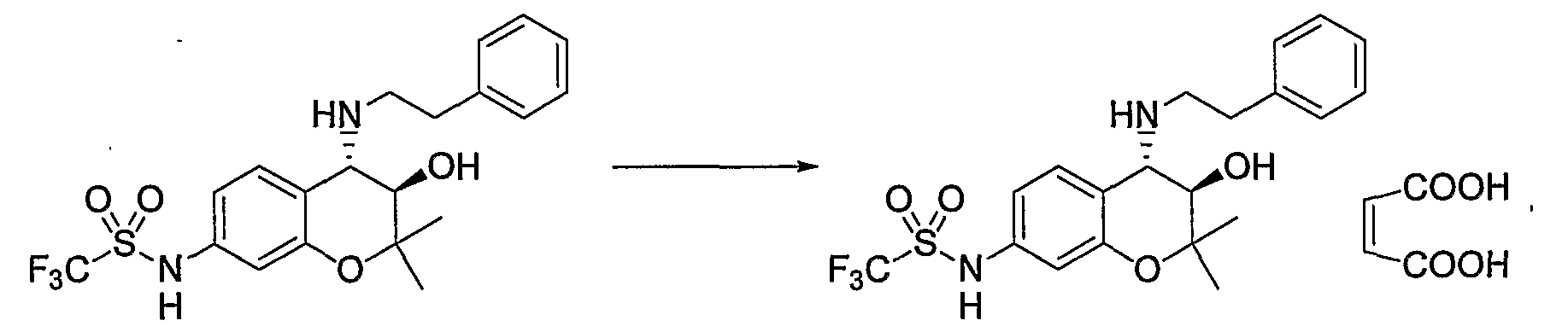
К раствору 1,1,1-трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (343 мг, 0,773 ммоль) в этаноле (6 мл) по каплям добавляли раствор малеиновой кислоты (100 мг, 0,862 ммоль) в этаноле (1 мл) и концентрировали полученный реакционный раствор при пониженном давлении. Полученное твердое вещество суспендировали в этилацетате, перемешивали полученную суспензию при комнатной температуре и отфильтровывали твердое вещество с получением малеата 1,1,1-трифтор-N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид а(выход: 65%).
Белое твердое вещество:
1Н-ЯМР (ДМCО-d6) δ: 1,08 (с, 3H), 1,40 (с, 3H), 2,85-3,40 (м, 4H), 3,89 (дд, J=4,0 Гц, 6,0 Гц, 1H), 4,30 (д, J=6,0 Гц, 1H), 6,11 (д, J=4,0 Гц, 1H), 6,16 (с, 2H), 6,55 (м, 1H), 6,70 (м, 1H), 7,15-7,40 (м, 6H)
МС (ЭСИ+) m/z; 445 [М++1]
МС (ЭСИ-) m/z; 443 [М+-1]
Пример синтеза 11
N-(3R*,4S*)-3-гидрокси-2,2-диметил-6-[(метилсульфонил)амино]-4-[(2-фенилэтил)-амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид
(3R*,4S*)-6,7-диамино-2,2-диметил-4-[(2-фенилэтил)амино]бензопиран-3-ол
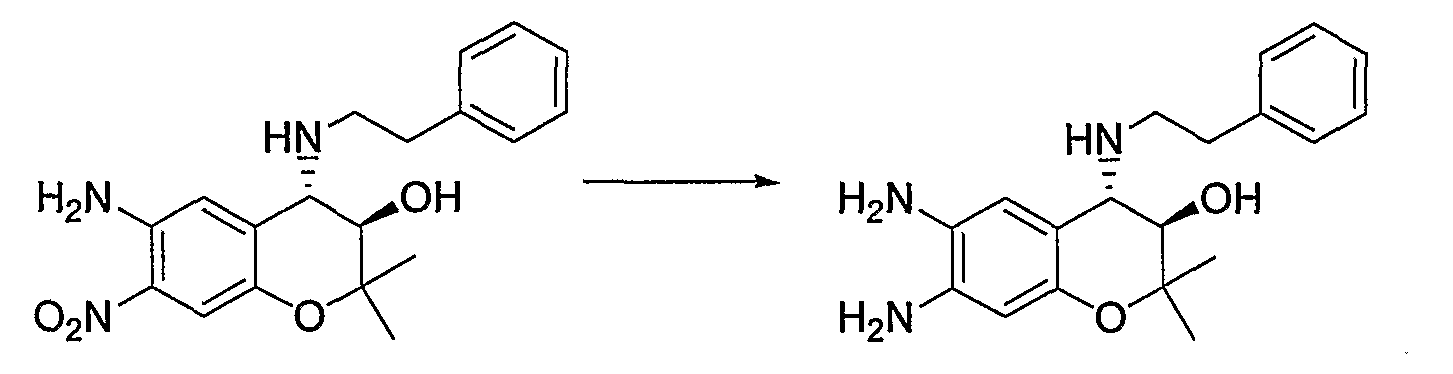
Под струей газообразного водорода при давлении 1 атм раствор этанола (200 мл), содержащий (3R*,4S*)-6-амино-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ол (10,0 г, 28,0 ммоль) и 5% палладированный уголь (AER-типа, 1 г) перемешивали при комнатной температуре в течение 6 часов. Реакционный раствор фильтровали через броунмиллерит и концентрировали полученный фильтрат при пониженном давлении с получением (3R*,4S*)-6,7-диамино-2,2-диметил-4-[(2-фенилэтил)амино]бензопиран-3-ола (выход: 98%).
N-{(3R*,4S*)-3-гидрокси-2,2-диметил-6-[(метилсульфонил)амино]-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид

К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-бензопиран-4-илкарбамата (186 мг, 0,569 ммоль) в пиридине (2 мл) при 0°C по каплям добавляли метилсульфонилхлорид (88,2 мкл, 1,14 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 14 часов. К реакционному раствору добавляли этилацетат, раствор промывали 1М водным раствором соляной кислоты. Водную фазу экстрагировали этилацетатом, объединенные органические фазы промывали насыщенным раствором хлорида натрия, затем сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу обращенно-фазовой колоночной хроматографии (элюируя ацетонитрилом/водой = 1/1) с получением N-{(3R*,4S*)-3-гидрокси-2,2-диметил-6-[(метилсульфонил)амино]-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (выход: 15%).
1Н-ЯМР (ДМCО-d6) δ: 1,14 (с, 3H), 1,42 (с, 3H), 2,90-3,30 (м, 10H), 3,96 (дд, J=6,0 Гц, 9,0 Гц, 1H), 4,38 (д, J=9,0 Гц, 1H), 6,34 (д, J=6,0 Гц, 1H), 6,93 (с, 1H), 7,20-7,35 (м, 5H), 7,84 (с, 1H), 9,07 (м, 2H)
МС (ЭСИ-) m/z; 482 [М+-1]
Пример синтеза 12
Гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}-N-метилметансульфонамида
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-бензопиран-4-илкарбамат
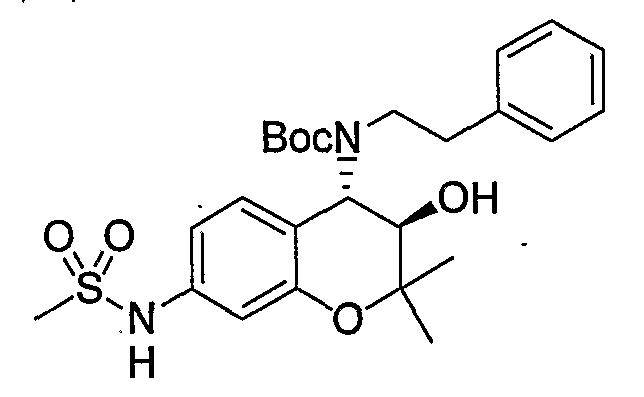
Соединение синтезировали в соответствии со способом синтеза, изложенным в примере синтеза 7.
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[N-метил-N-метилсульфониламино]-3,4-дигидро-2H-бензопиран-4-илкарбамат
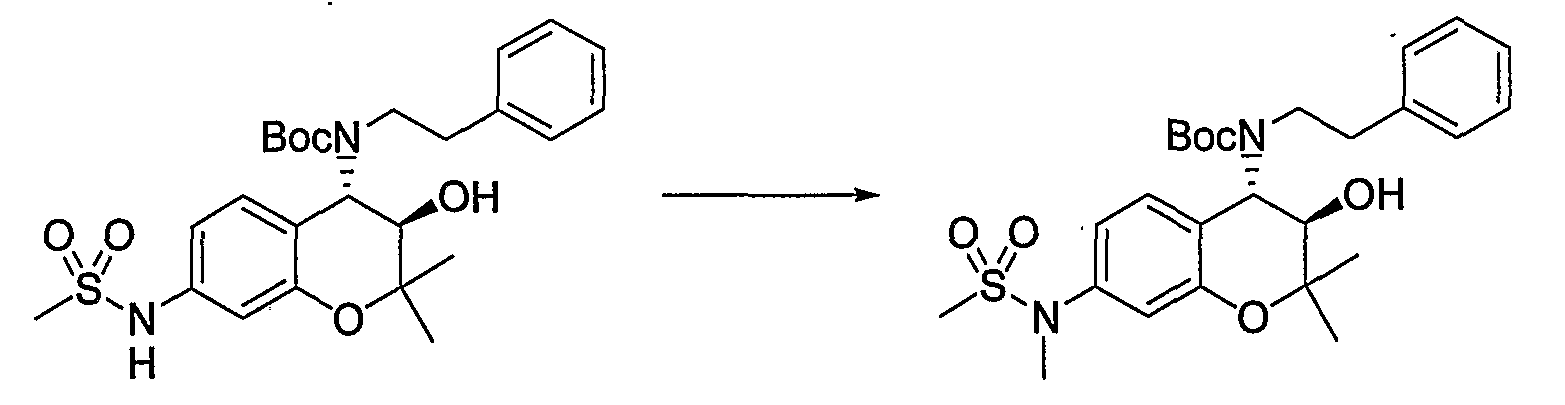
В растворе трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-(метансульфонил)амино-3,4-дигидро-2H-бензопиран-4-илкарбамата (500 мг, 1,02 ммоль) в ацетоне (5,4 мл) суспендировали карбонат калия (в избытке), добавляли к полученной суспензии метилйодид (152 мкл, 2,04 ммоль) и перемешивали полученную смесь при комнатной температуре в течение нескольких суток. К реакционному раствору добавляли этилацетат, раствор промывали водой и насыщенным раствором хлорида натрия, после чего органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[N-метил-N-(метилсульфонил)амино]-3,4-дигидро-2H-бензопиран-4-илкарбамата (выход: 81%).
МС (ЭСИ-) m/z; 505 [М++1]
Гидрохлорид N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}-N-метилметансульфонамида
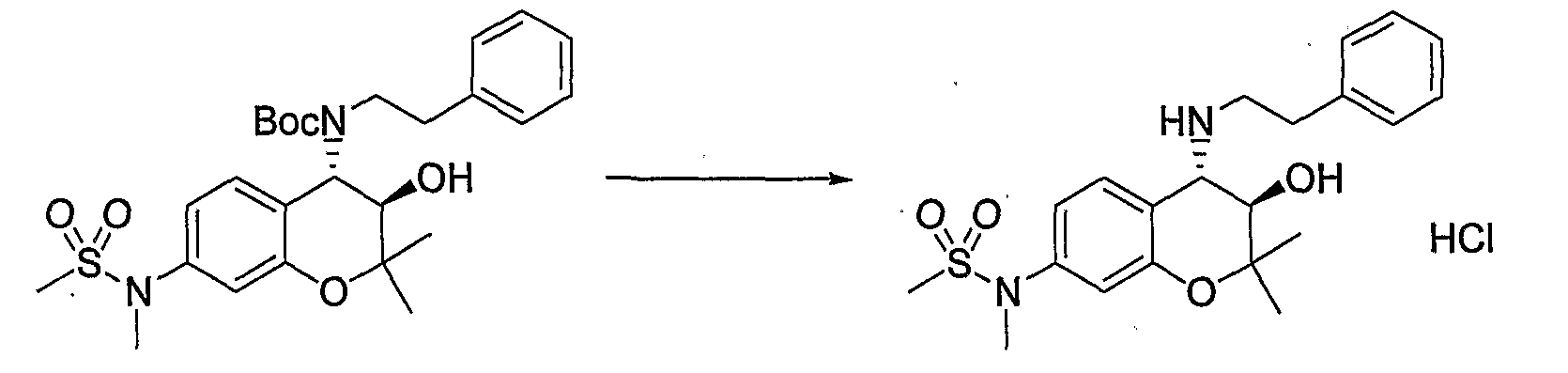
4М раствор соляной кислоты в диоксане, содержащий трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[N-метил-N-(метилсульфонил)амино]-3,4-дигидро-2H-бензопиран-4-илкарбамат (418 мг, 0,828 ммоль), перемешивали при комнатной температуре в течение 1,5 часов, затем отфильтровывали твердое вещество. Твердое вещество промывали этилацетатом с получением гидрохлорида N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)-амино]-3,4-дигидро-2H-бензопиран-7-ил}-N-метилметансульфонамида (выход: 75%).
Белое твердое вещество:
1Н-ЯМР (ДМCО-d6) δ: 1,12 (с, 3H), 1,43 (с, 3H), 2,92-3,19 (м, 4H), 2,94 (с, 3H), 3,21 (с, 3H), 4,00 (м, 1H), 4,41 (м, 1H), 6,30 (м, 1H), 6,92 (м, 1H), 7,07 (м, 1H), 7,2-7,4 (м, 5H), 7,75 (м, 1H)
МС (ЭСИ+) m/z; 405 [М++1]
Пример синтеза 13
N-{(3R*,4S*)-6-бром-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид
Малеат (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола
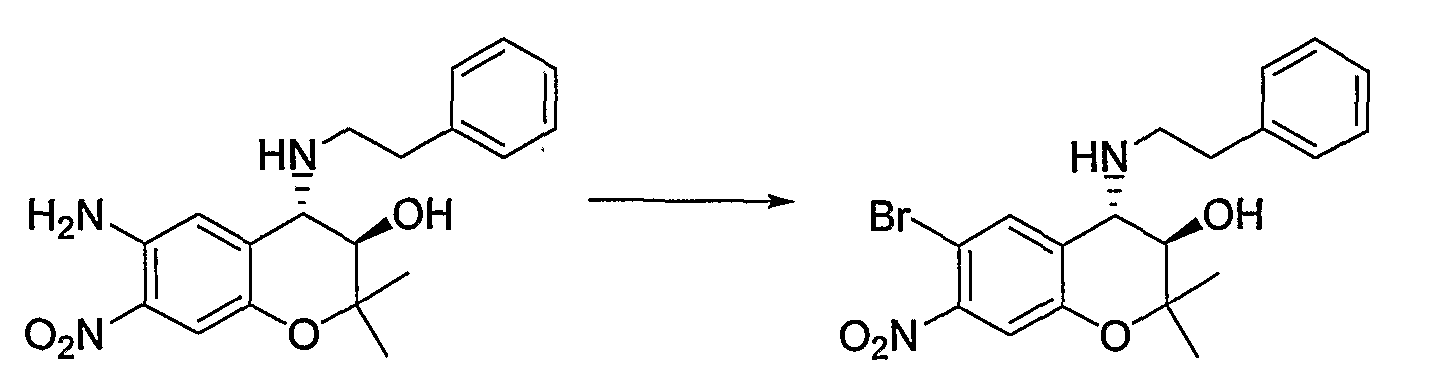
К раствору (3R*,4S*)-6-амино-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола в уксусной кислоте/бромистоводородной кислоте (1/1, 60 мл) при -20°C в течение 45 минут по каплям добавляли водный раствор нитрита натрия (965 мг, 14,0 ммоль/7 мл воды) и перемешивали полученный раствор при указанной температуре в течение 5 минут. Реакционный раствор добавляли к охлажденному при -20°C раствору бромида меди(I) (3,01 г, 21,0 ммоль) в бромистоводородной кислоте (30 мл), после перемешивания при указанной температуре в течение 2 часов нагревали раствор до комнатной температуры и дополнительно перемешивали до прекращения выделения пузырьков. К реакционному раствору добавляли этилацетат, полученный реакционный раствор промывали водой, аммиачной водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, а затем концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола (выход: 85%).
Малеат (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола
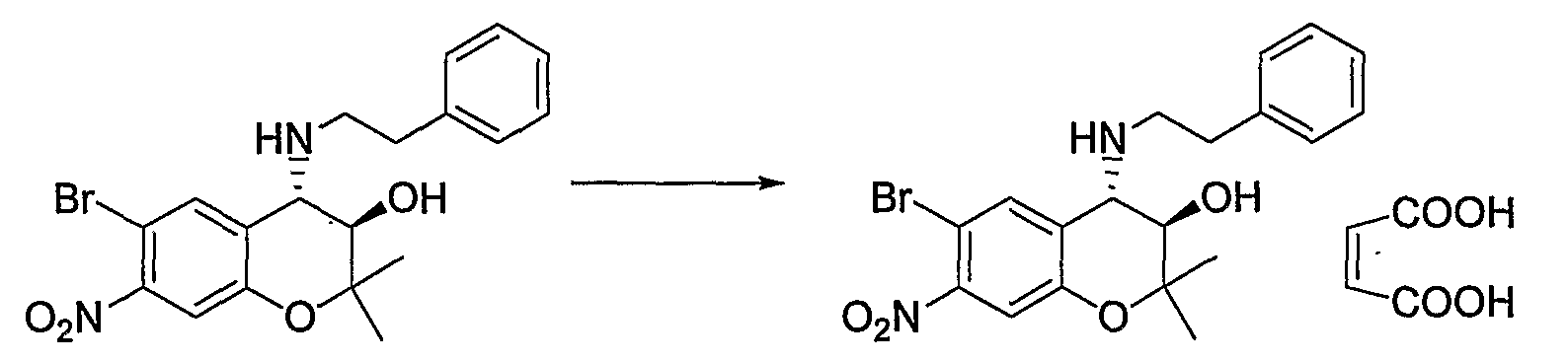
К раствору (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола (5,0 г, 12 ммоль) в этаноле (50 мл) при комнатной температуре по каплям добавляли раствор малеиновой кислоты (1,5 г, 13 ммоль) в этаноле. Полученное твердое вещество отфильтровывали, промывали этанолом, а затем сушили с получением малеата (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола (выход: 73%).
МС (ЭСИ+) m/z; 421 [М++1]
(3R*,4S*)-7-амино-6-бром-2,2-диметил-4-[(2-фенилэтил)амино]бензопиран-3-ол
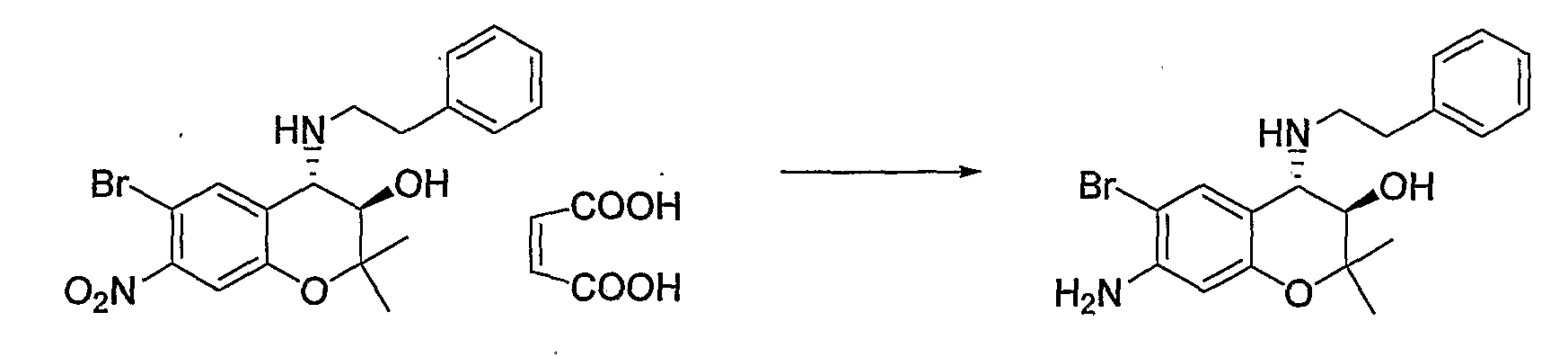
Малеат (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола суспендировали в этилацетате, полученную суспензию нейтрализовывали добавлением 1М водного раствора гидроксида натрия, а затем промывали 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия. Полученную органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. К раствору полученного (3R*,4S*)-6-бром-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]бензопиран-3-ола (2,46 г, 5,84 ммоль) в этаноле (25 мл) добавляли воду (5 мл) и железный порошок (1,08 г, 19,3 ммоль) и при комнатной температуре по каплям добавляли концентрированную соляную кислоту (246 мкл). После перемешивания при 70°C в течение 3 часов раствор оставляли остывать до комнатной температуры. К реакционному раствору добавляли этилацетат и промывали полученный раствор 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия (в ходе этой процедуры эмульсию удаляли путем фильтрации через броунмиллерит). Органическую фазу сушили над сульфатом магния, а затем концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = от 5/1 до 4/1) с получением (3R*,4S*)-7-амино-6-бром-2,2-диметил-4-[(2-фенилэтил)амино]бензопиран-3-ола (выход: 65%).
МС (ЭСИ+) m/z; 391 [М++1]
N-{(3R*,4S*)-6-бром-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамид
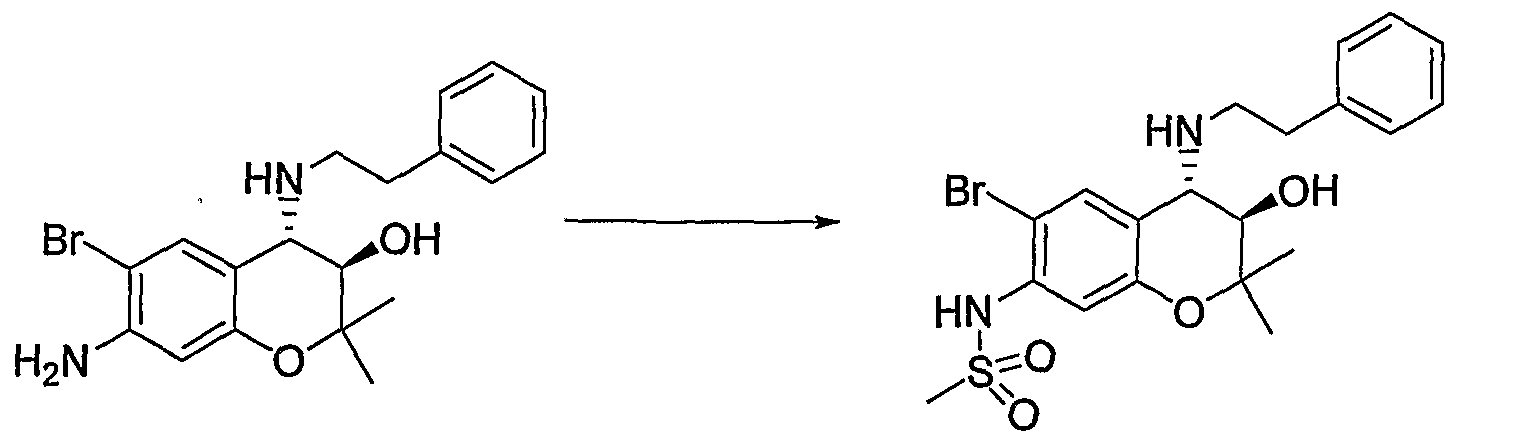
К раствору (3R*,4S*)-7-амино-6-бром-2,2-диметил-4-[(2фенилэтил)амино]бензопиран-3-ола (1,48 г, 3,78 ммоль) в пиридине (15 мл) при 0°C по каплям добавляли метансульфонилхлорид (29 мкл, 3,78 ммоль). После перемешивания при комнатной температуре в течение нескольких минут полученную смесь тушили добавлением 1М водного раствора соляной кислоты. К реакционному раствору добавляли этилацетат, раствор промывали 1М водным раствором соляной кислоты и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом =1/1) с получением N-{(3R*,4S*)-6-бром-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида (выход: 7%) в виде белого кристалла (неочищенный кристалл). Полученный неочищенный кристалл N-{(3R*,4S*)-6-бром-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида перекристаллизовывали в этилацетате с получением N-{(3R*,4S*)-6-бром-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-бензопиран-7-ил}метансульфонамида в виде белого кристалла (выход из неочищенного кристалла: 89%).
Белый кристалл:
1Н-ЯМР (CDCl3) δ: 1,24 (с, 3H), 1,46 (с, 3H), 2,65-3,00 (м, 4H), 3,13 (с, 3H), 3,91 (д, J=8,4 Гц, 1H), 4,04 (шир., 2H), 4,75 (д, J=8,4 Гц, 1H), 6,21 (с, 1H), 7,06 (с, 1H), 7,15-7,40 (м, 5H)
МС (ЭСИ+) m/z; 469 [М++1]
Пример синтеза 14
Гидрохлорид (3R*,4S*)-2,2-диметил-7-диметиламино-4-[(2-фенилэтил)амино]-3-хроманола
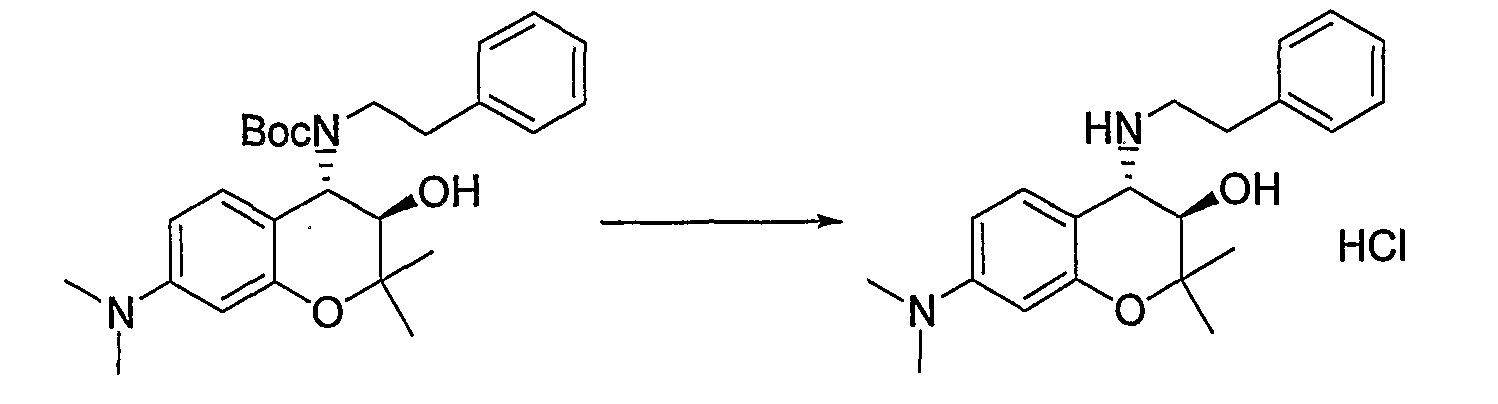
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-илкарбамат (79,5 мг, 0,175 ммоль) растворяли в 4М растворе соляной кислоты в диоксане (1,6 мл) и перемешивали полученный раствор при комнатной температуре. Полученное твердое вещество отфильтровывали, промывали этилацетатом, а затем сушили с количественным получением гидрохлорида (3R*,4S*)-2,2-диметил-7-диметиламино-4-[(2-фенилэтил)амино]-3-хроманола.
Белое твердое вещество: Гидрохлорид экстрагировали и для спектральных измерений использовали его свободную форму.
1Н-ЯМР (CDCl3) δ: 1,17 (с, 3H), 1,47 (с, 3H), 2,79-3,00 (м, 10H), 3,47 (д, J=9,9 Гц, 1H), 3,59 (д, J=9,9 Гц, 1H), 6,13 (д, J=2,7 Гц, 1H), 6,29 (дд, J=2,7 Гц, 8,4 Гц, 1H), 6,87 (д, J=8,4 Гц, 1 H), 7,20-7,31 (м, 5H)
МС (ЭСИ+) m/z; 341 [М++1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-илкарбамат (соединение A)
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метиламино-3,4-дигидро-2H-хромен-4-илкарбамат (соединение B)
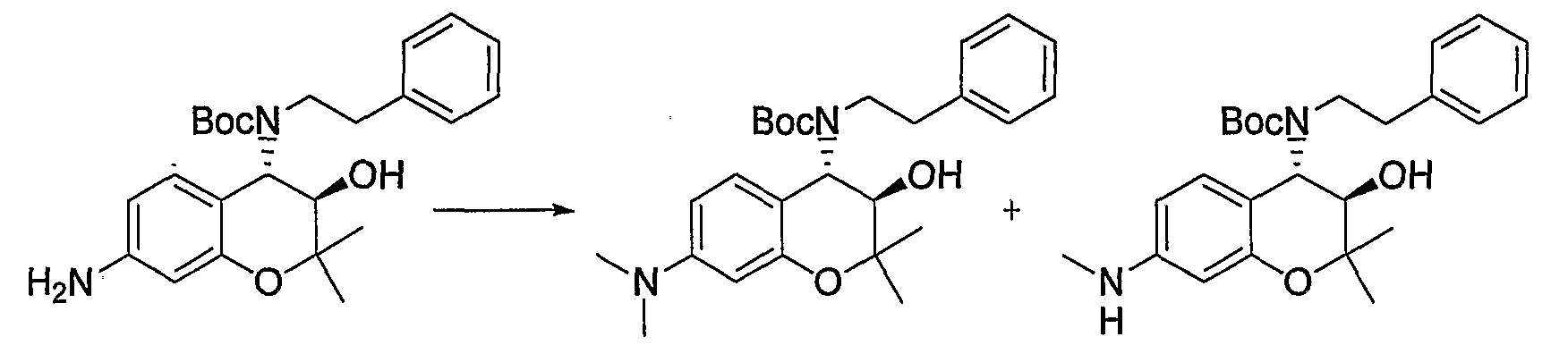
Соединение А Соединение В
В растворе трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-илкарбамата (240 мг, 0,581 ммоль) в N,N-диметилформамиде (2,4 мл) суспендировали карбонат калия (402 мг, 2,91 ммоль) и добавляли к полученной суспензии метилйодид (109 мкл, 1,74 ммоль). После перемешивания полученной смеси при комнатной температуре реакционный раствор разбавляли этилацетатом и промывали раствор водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением соединения A (выход: 31%) и соединения B (выход: 15%).
Соединение A:
МС (ЭСИ+) m/z; 441 [М++1]+
Соединение B:
МС (ЭСИ+) m/z; 427 [М++1]+
Пример синтеза 15
Гидрохлорид (3R*,4S*)-2,2-диметил-7-метиламино-4-[(2-фенилэтил)амино]-3-хроманола
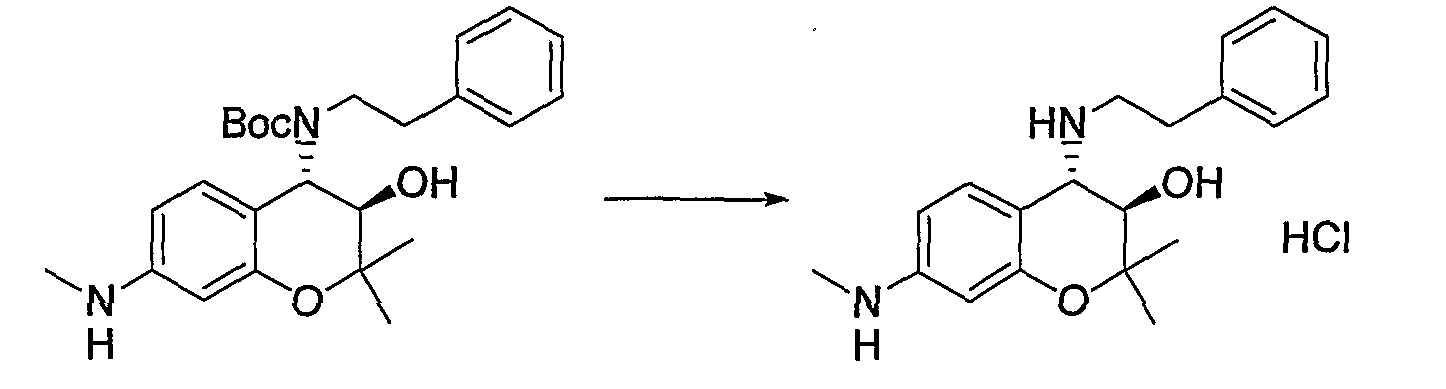
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метиламино-3,4-дигидро-2H-хромен-4-илкарбамат (41,5 мг, 0,0973 ммоль) растворяли в 4М растворе соляной кислоты в диоксане (1,5 мл), добавляли к нему несколько капель метанола и перемешивали полученный раствор при комнатной температуре. Полученное твердое вещество отфильтровывали, промывали этилацетатом, а затем сушили с количественным получением гидрохлорида (3R*,4S*)-2,2-диметил-7-метиламино-4-[(2-фенилэтил)амино]-3-хроманола.
Белое твердое вещество: Гидрохлорид экстрагировали и для спектральных измерений использовали его свободную форму.
1Н-ЯМР (CDCl3) δ: 1,17 (с, 3H), 1,46 (с, 3H), 2,77-3,01 (м, 7H), 3,46 (д, J=9,8 Гц, 1H), 3,55 (д, J=9,8 Гц, 1H), 6,03 (д, J=2,1 Гц, 1H), 6,16 (дд, J=2,1 Гц, 8,1 Гц, 1H), 6,79 (д, J=8,1 Гц, 1H), 7,20-7,33 (м, 5H)
МС (ЭСИ+) m/z; 327 [М+1]+
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метиламино-3,4-дигидро-2H-хромен-4-илкарбамат
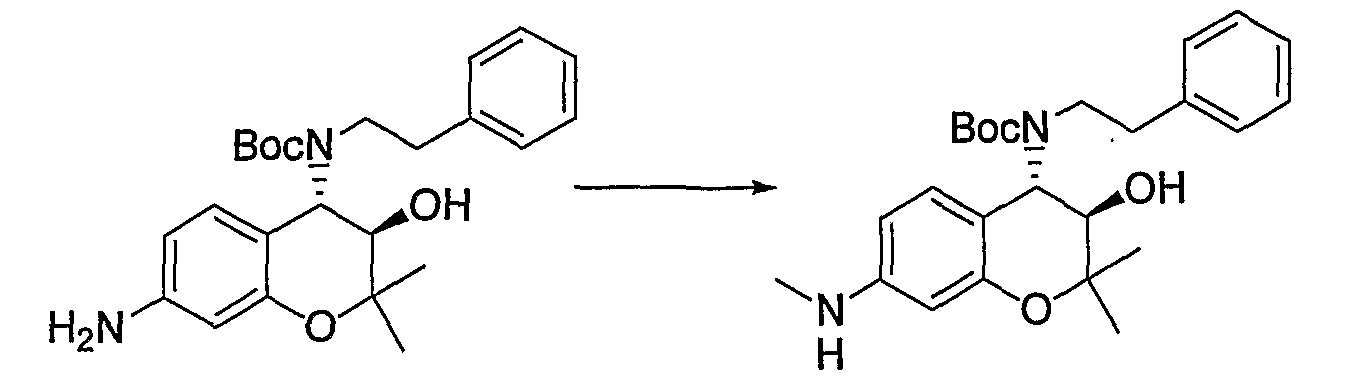
В растворе трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-илкарбамата (215 мг, 0,521 ммоль) в N,N-диметилформамиде (2 мл) суспендировали карбонат калия (360 мг, 2,61 ммоль) и к полученной суспензии по каплям добавляли метилйодид (32 мкл, 0,52 ммоль). После перемешивания полученной смеси при комнатной температуре реакционный раствор разбавляли этилацетатом и промывали раствор водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метиламино-3,4-дигидро-2H-хромен-4-илкарбамата (выход: 19%).
Пример синтеза 16
Гидрохлорид (3R*,4S*)-4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-7-диметиламино-3-хроманола
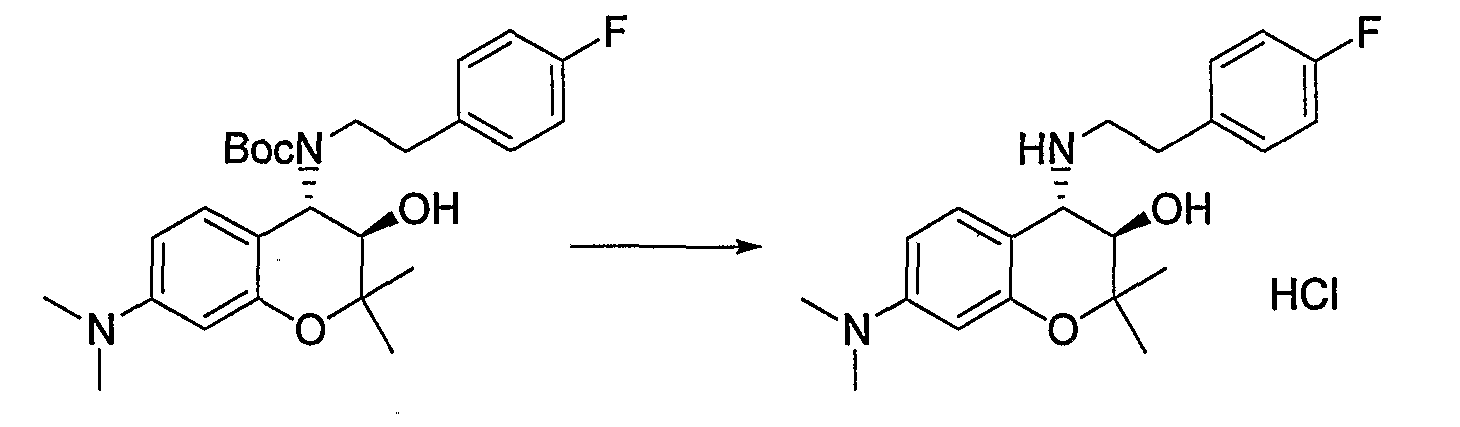
Трет-бутил(3R*,4S*)-3-гидрокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-ил[(2-(4-фторфенил)этил)]карбамат (72,2 мг, 0,157 ммоль) растворяли в 4М растворе соляной кислоты в диоксане (2 мл) и перемешивали полученный раствор при 50°C. Полученное твердое вещество отфильтровывали, промывали этилацетатом, а затем сушили с получением гидрохлорида (3R*,4S*)-4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-7-диметиламино-3-хроманола (выход: 97%).
Белое твердое вещество: Гидрохлорид экстрагировали и для спектральных измерений использовали его свободную форму.
1Н-ЯМР (CDCl3) δ: 1,19 (с, 3H), 1,48 (с, 3H), 2,73-2,97 (м, 10H), 3,47 (д, J=9,9 Гц, 1H), 3,58 (д, J=9,9 Гц, 1H), 6,14 (д, J=2,4 Гц, 1H), 6,30 (дд, J=2,4 Гц, 8,7 Гц, 1H), 6,87 (д, J=8,7 Гц, 1H), 6,97-7,03 (м, 2H), 7,15-7,20 (м, 2H)
МС (ЭСИ+) m/z; 359 [М+1]+
Трет-бутил(3R*,4S*)-3-гидрокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамат
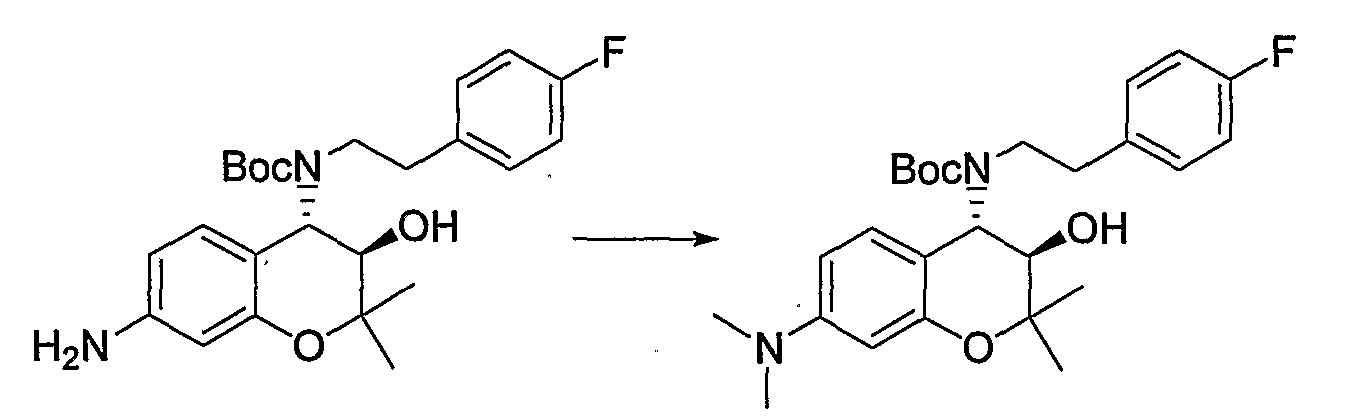
В растворе трет-бутил(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамата (177 мг, 0,412 ммоль) в N,N-диметилформамиде (2 мл) суспендировали карбонат калия (285 мг, 2,06 ммоль) и к полученной суспензии по каплям добавляли метилйодид (64 мкл, 1,0 ммоль). После перемешивания полученной смеси при 40°C реакционный раствор разбавляли этилацетатом и промывали раствор водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 5/1) с получением трет-бутил(3R*,4S*)-3-гидрокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамата (выход: 38%).
Бесцветный аморфный кристалл.
Трет-бутил(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамат
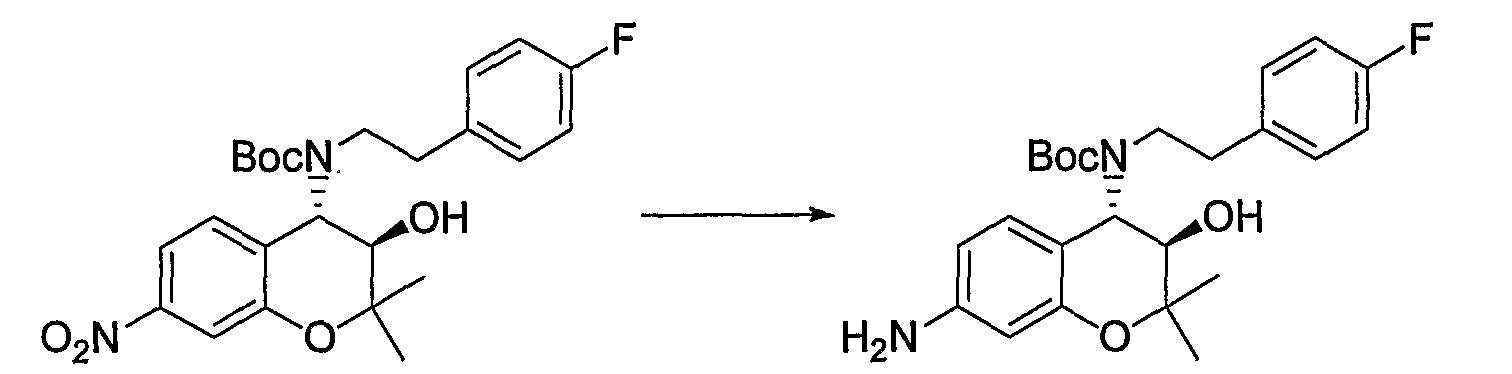
В растворе трет-бутил(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамата (3,35 г, 7,28 ммоль) в метаноле (30 мл) суспендировали палладированный уголь (480 мг), при нормальном давлении добавляли водород и перемешивали полученный раствор при комнатной температуре в течение 12 часов. Реакционный раствор фильтровали через броунмиллерит и концентрировали полученный фильтрат при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 4/1) с получением трет-бутил(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамата (выход: 57%).
Бесцветный аморфный кристалл.
Трет-бутил(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамат
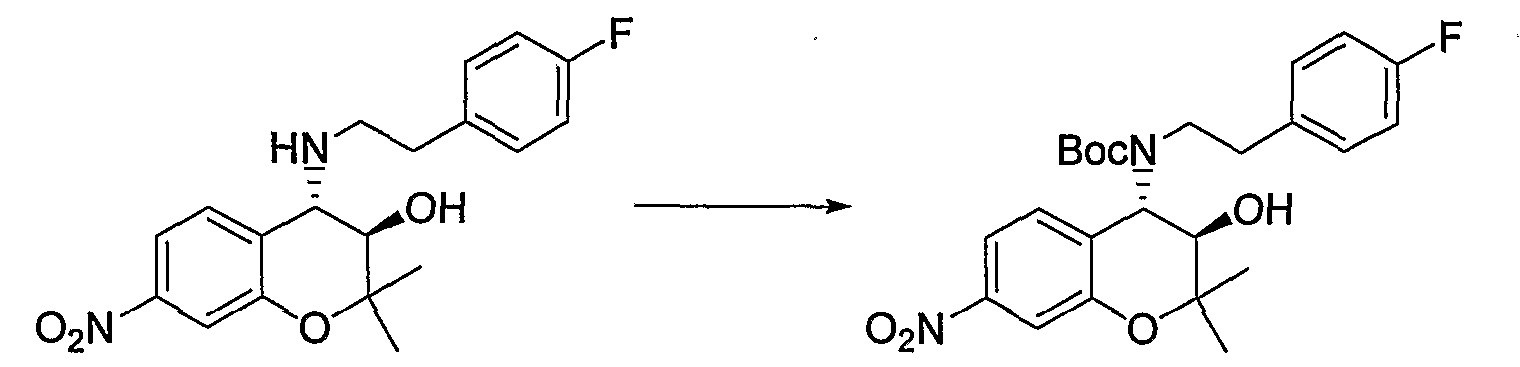
К раствору (3R*,4S*)-4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-7-нитро-3-хроманола (3,25 г, 9,02 ммоль) в тетрагидрофуране (30 мл) добавляли ангидрид трет-бутоксикарбонила (2,96 г, 27,1 ммоль) и триэтиламин (2,5 мл, 18 ммоль), полученный раствор перемешивали при комнатной температуре и концентрировали при пониженном давлении. Полученный остаток разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 4/1) с получением трет-бутил(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил[2-(4-фторфенил)этил]карбамата (выход: 81%).
Аморфный кристалл.
(3R*,4S*)-4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-7-нитро-3-хроманол
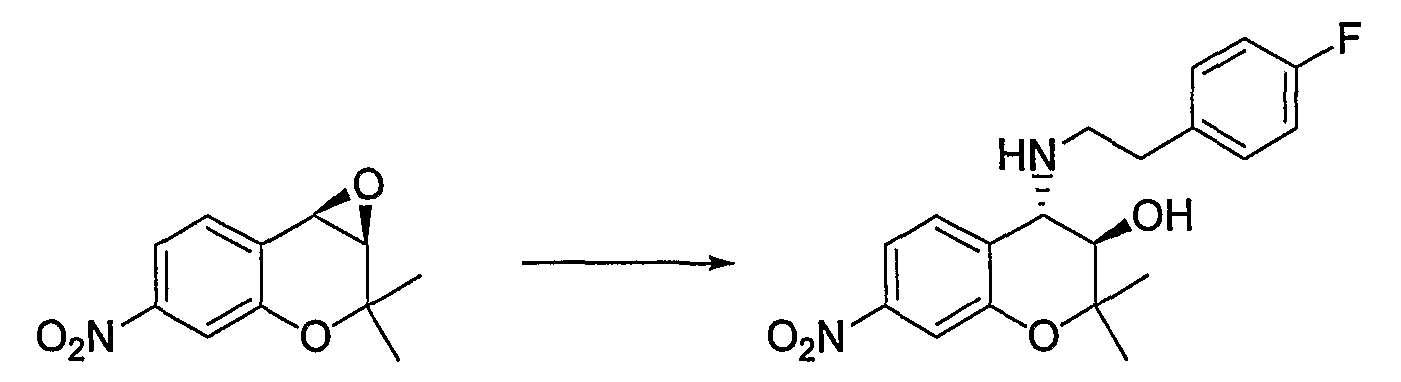
К раствору (3S*,4S*)-3,4-эпокси-2,2-диметил-7-нитро-3-хроманола (2,07 г, 9,37 ммоль) в диоксане (4 мл) добавляли перхлорат лития (997 мг, 9,37 ммоль) и 4-фторфениламин (1,47 мл, 11,3 ммоль) и перемешивали полученный раствор при 70°C в течение 3,5 часов в атмосфере азота. Реакционный раствор разбавляли этилацетатом, промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток разбавляли этанолом и по каплям добавляли к нему раствор малеиновой кислоты (1,20 г, 10,3 ммоль) в этаноле. Полученное твердое вещество отфильтровывали и промывали этилацетатом. Полученное твердое вещество суспендировали в этилацетате, полученную суспензию нейтрализовывали 1М водным раствором гидроксида натрия и промывали насыщенным раствором хлорида натрия. После сушки органической фазы над сульфатом магния ее сушили при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 4/1) с получением (3R*,4S*)-4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-7-нитро-3-хроманола (выход: 81%).
Аморфный кристалл.
МС (ЭСИ+) m/z; 361 [М+1]+
(3R*,4R*)-3,4-эпокси-2,2-диметил-7-нитро-3-хроманол
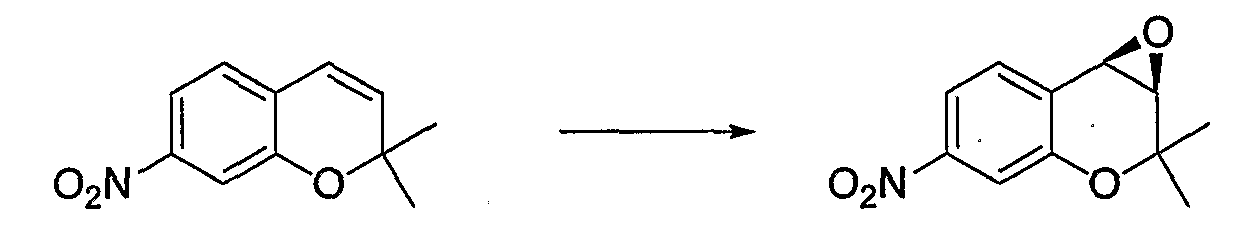
К раствору 2, 2-диметил-7-нитробензопирана (11,1 г, 53,9 ммоль) в этилацетате (165 мл) добавляли комплекс Cyc,Ph-саленмарганца (XX) (405 мг, 0,431 ммоль) и N-метилимидазол (858 мкл, 10,8 ммоль), и при 20°C в течение 15 минут по каплям добавляли к нему водный раствор гипохлорита натрия (101 г, 162 ммоль). После перемешивания полученной смеси при комнатной температуре в течение 3 часов к ней добавляли насыщенный водный раствор тиосульфата натрия при охлаждении водой. Полученный реакционный раствор фильтровали через броунмиллерит, органическую фазу промывали насыщенным водным раствором тиосульфата натрия и насыщенным раствором хлорида натрия, а затем сушили над сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество перекристаллизовывали в этаноле с получением (3S*,4S)-3,4-эпокси-2,2-диметил-7-нитро-3-хроманола (выход: 66%).
Желтовато-белый кристалл игольчатой формы:
1Н-ЯМР (CDCl3) δ: 1,29 (с, 3H), 1,62 (с, 3H), 3,57 (д, J=3,5 Гц, 1H), 3,97 (д, J=3,5 Гц, 1H), 7,50 (д, J=6,3 Гц, 1H), 7,67 (д, J=1,8 Гц, 1H), 7,80 (дд, J=1,8 Гц, 6,3 Гц, 1H)
100% ee (CHIRALCEL OJ, гексан/изопропанол = 6:4, 1 мл/мин, 40°C, 254 нм)
2,2-Диметил-7-нитробензопиран
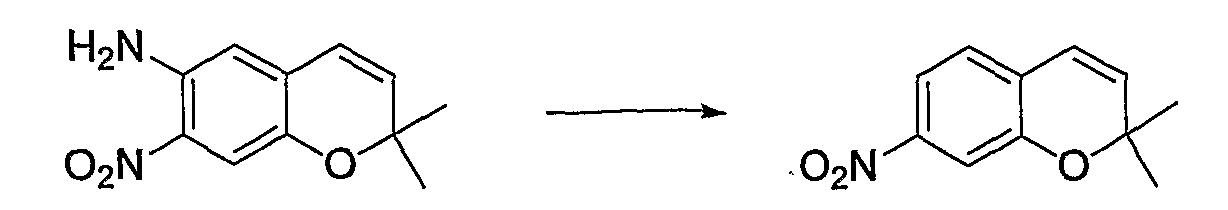
К смешанному раствору 6-амино-2,2-диметил-7-нитробензопирана (19,5 г, 88,7 ммоль) в метаноле/концентрированной соляной кислоте (1/1 по объему, 280 мл) и водного раствора гипофосфористой кислоты (100 мл) при -3°C в течение 30 минут по каплям добавляли водный раствор нитрита натрия (12,2 г, 178 ммоль) и перемешивали полученный раствор при комнатной температуре до прекращения образования пузырьков. Реакционный раствор разбавляли этилацетатом и промывали водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, а затем концентрировали при пониженном давлении. Полученное твердое вещество перекристаллизовывали в метаноле с получением 2,2-диметил-7-нитробензопирана (выход: 61%).
Оранжевый кристалл:
1Н-ЯМР (CDCl3) δ: 1,47 (с, 6H), 5,83 (д, J=7,5 Гц, 1H), 6,83 (д, J=7,5 Гц, 1H), 7,08 (д, J=6,3 Гц, 1H), 7,61 (д, J=1,5 Гц, 1H), 7,71 (дд, J=1,5 Гц, 6,3 Гц, 1H)
Пример синтеза 17
(3R*,4S*)-6-метокси-2,2-диметил-7-диметиламино-4-[(2-фенилэтил)амино]-3-хроманол
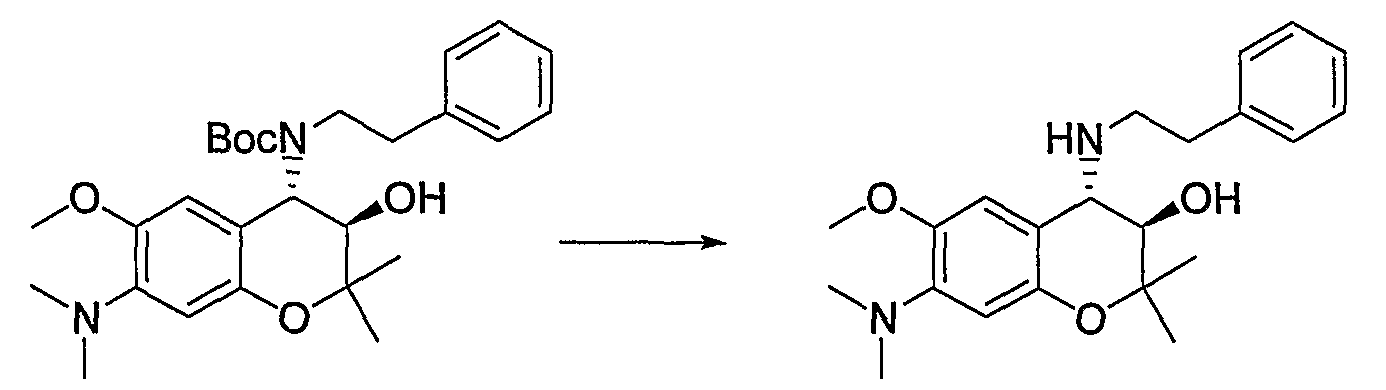
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-илкарбамат
(133 мг, 0,283 ммоль) растворяли в 4М растворе соляной кислоты в диоксане (2 мл), добавляли к нему несколько капель метанола и перемешивали полученный раствор при комнатной температуре. Реакционный раствор разбавляли этилацетатом, промывали 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия, затем сушили полученную органическую фазу над сульфатом магния и концентрировали при пониженном давлении с получением (3R*,4S*)-6-метокси-2,2-диметил-7-диметиламино-4-[(2-фенилэтил)амино]-3-хроманола (выход: 79%).
Прозрачное масло:
1Н-ЯМР (CDCl3) δ: 1,17 (с, 3H), 1,46 (с, 3H), 2,73 (с, 6H), 2,79-2,99 (м, 4H), 3,54 (д, J=9,8 Гц, 1H), 3,61 (д, J=9,8 Гц, 1H), 3,70 (с, 3H), 6,37 (с, 1H), 6,49 (с, 1H), 7,19-7,32 (м, 5H)
МС (ЭСИ+) m/z; 371 [М++1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-диметиламино-3,4-дигидро-2H-хромен-4-илкарбамат (соединение C)
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-метиламино-3,4-дигидро-2H-хромен-4-илкарбамат (соединение D)
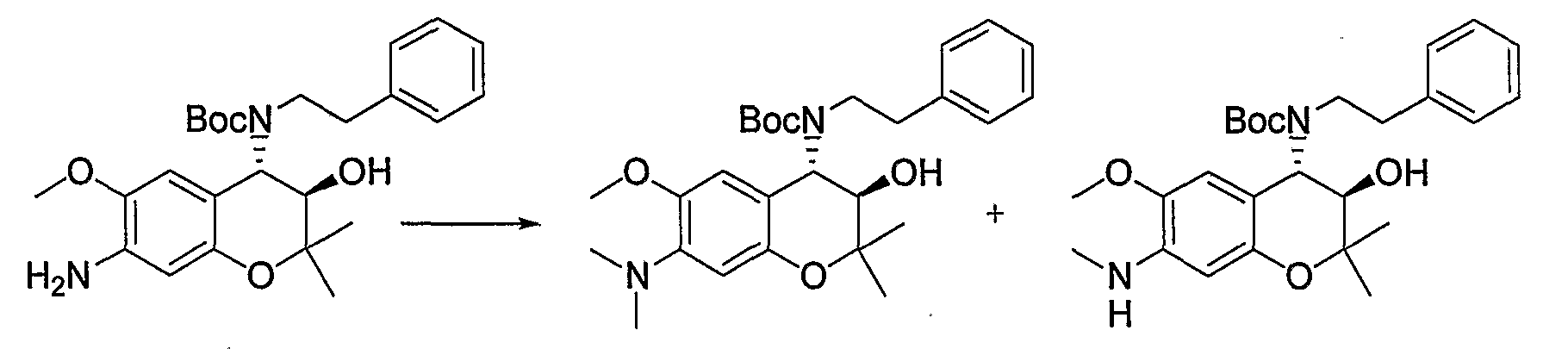
Соединение С Соединение D
В растворе трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-хромен-4-илкарбамата (1,05 г, 2,37 ммоль) в N,N-диметилформамиде (10 мл) суспендировали карбонат калия (1,64 мг, 11,8 ммоль) и по каплям добавляли к полученной суспензии метилйодид (368 мкл, 5,92 ммоль). После перемешивания полученной смеси при комнатной температуре в течение 1 часа реакционный раствор разбавляли этилацетатом и промывали раствор водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 4/1) с получением соединения C (выход: 12%) и соединения D (выход: 10%).
Соединение C: Бесцветный аморфный кристалл
Соединение D: Бесцветный аморфный кристалл
Пример синтеза 18
Гидрохлорид (3R*,4S*)-6-метокси-2,2-диметил-7-метиламино-4-[(2-фенилэтил)амино]-3-хроманола
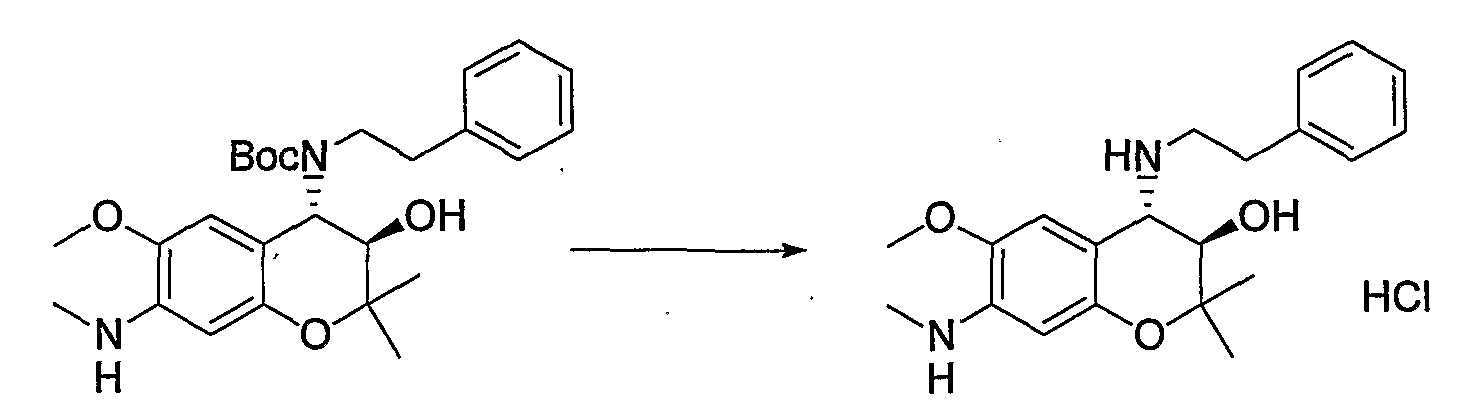
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-метиламино-3,4-дигидро-2H-хромен-4-илкарбамат (108 мг, 0,237 ммоль) растворяли в 4М растворе соляной кислоты в диоксане (2 мл) и перемешивали полученный раствор при комнатной температуре. Полученное твердое вещество отфильтровывали, промывали этилацетатом, а затем сушили с количественным получением гидрохлорида (3R*,4S*)-6-метокси-2,2-диметил-7-метиламино-4-[(2-фенилэтил)амино]-3-хроманола.
Белое твердое вещество:
1Н-ЯМР (ДМCО-d6) δ: 1,07 (с, 3H), 1,38 (с, 3H),2,69 (с, 3H), 3,01-3,08 (м, 2H), 3,16-3,23 (м, 2H), 3,80 (с, 3H), 3,92 (д, J=8,8 Гц, 1H), 4,82 (д, J=8,8 Гц, 1H), 6,20 (шир., 1H), 7,22-7,34 (м, 5H), 7,53 (шир., 1H)
Пример синтеза 19
Гидрохлорид (3R*,4S*)-2,2-диметил-7-метилэтиламино-4-[(2-фенилэтил)амино]-3-хроманола
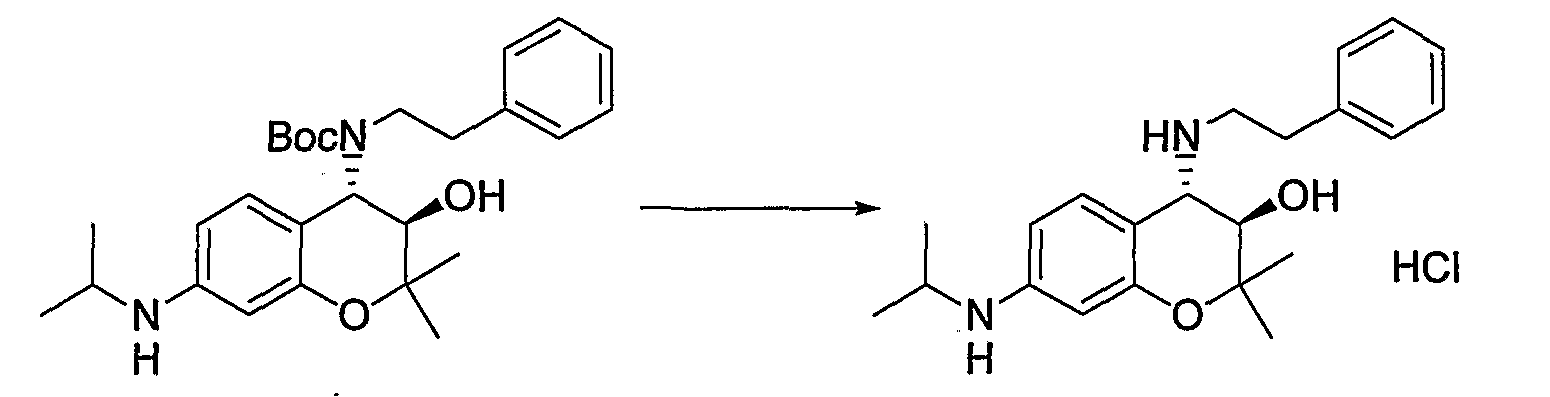
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метилэтиламино-3,4-дигидро-2H-хромен-4-илкарбамат (69 мг, 0,15 ммоль) растворяли в 4М растворе соляной кислоты в диоксане (1 мл) и перемешивали полученный раствор при комнатной температуре. Полученное твердое вещество отфильтровывали, промывали этилацетатом, а затем сушили с количественным получением гидрохлорида (3R*,4S*)-2,2-диметил-7-метилэтиламино-4-[(2-фенилэтил)амино]-3-хроманола.
Белое твердое вещество: Гидрохлорид экстрагировали и для спектральных измерений использовали его свободную форму.
1Н-ЯМР (CDCl3) δ: 1,11-1,13 (м, 9H), 1,41 (с, 3H), 2,75-2,91 (м, 4H), 3,38-3,52 (м, 3H), 5,95 (д, J=2,2 Гц, 1H), 6,06 (д, J=2,2 Гц, 8,3 Гц, 1H), 6,72 (д, J=8,3 Гц, 1H), 7,15-7,26 (м, 5H)
МС (ЭСИ+) m/z; 355 [М++1]
Трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метилэтиламино-3,4-дигидро-2H-хромен-4-илкарбамат
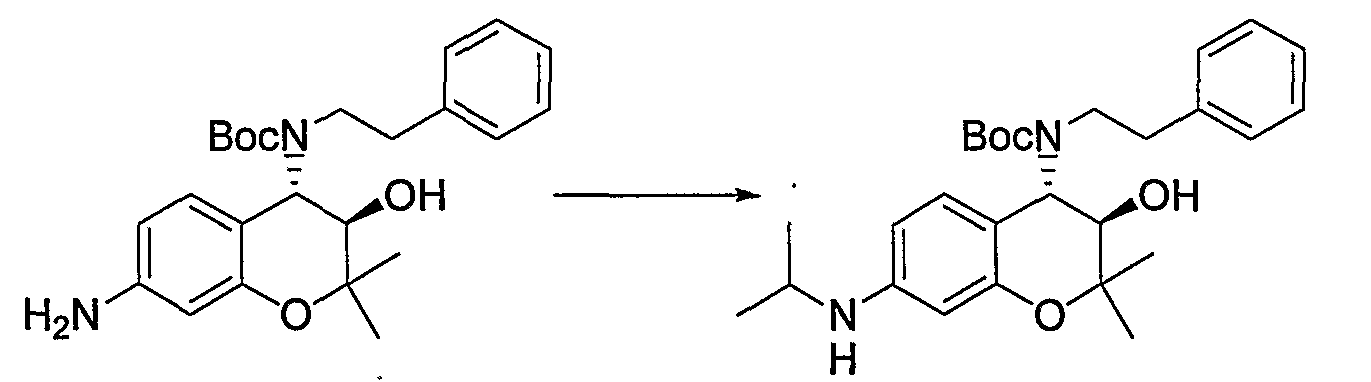
В растворе трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-илкарбамата (176 мг, 0,427 ммоль) в N,N-диметилформамиде (2 мл) суспендировали карбонат калия (295 мг, 2,13 ммоль) и по каплям добавляли изопропилйодид (56 мкл, 0,56 ммоль). После перемешивания при комнатной температуре реакционный раствор разбавляли этилацетатом и промывали водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, концентрировали при пониженном давлении и очищали полученный остаток по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 5/1) с получением трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-метилэтиламино-3,4-дигидро-2H-хромен-4-илкарбамата (выход: 36%).
МС (ЭСИ+) m/z; 455 [М++1]
Пример синтеза 20
Гидрохлорид N-(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-хромен-7-ил}-N-изопропилметансульфонамида
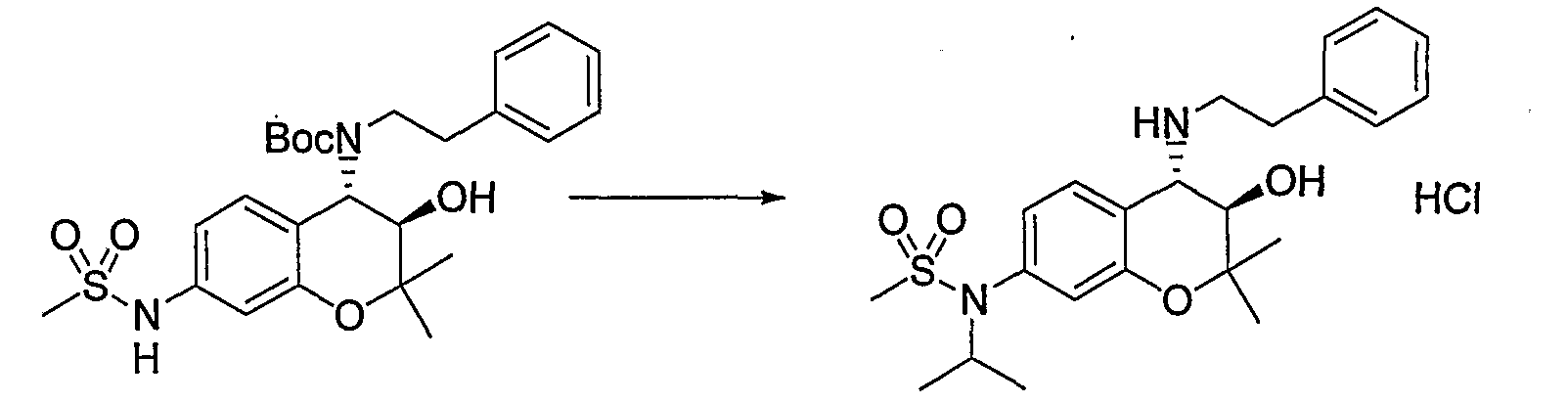
В растворе трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-2,2-диметил-7-[(метилсульфонил)амино]-3,4-дигидро-2H-хромен-4-илкарбамата (512 мг, 1,04 ммоль) в N,N-диметилформамиде (5 мл) суспендировали карбонат калия (в избытке), добавляли к полученной суспензии изопропилйодид (208 мкл, 2,09 ммоль) и перемешивали полученную смесь при комнатной температуре. Реакционный раствор разбавляли в этилацетате и воде, а затем промывали водой и насыщенным раствором хлорида натрия, после чего органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали по методу колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением аморфного кристалла (выход: 94%).
Полученный аморфный кристалл (523 мг, 0,982 ммоль) растворяли в 4 н.
растворе соляной кислоты в диоксане и перемешивали полученный раствор при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении и отфильтровывали полученное твердое вещество. Твердое вещество промывали этилацетатом с получением гидрохлорида N-{(3R*,4S*)-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-хромен-7-ил}-N-изопропилметансульфонамида (выход: 31%).
Белое твердое вещество:
1Н-ЯМР (CDCl3) δ: 1,14 (с, 3H), 1,17 (с, 3H), 1,19 (с, 3H), 1,48 (с, 3H), 2,75-3,10 (м, 7H), 3,49 (д, J=9,9 Гц, 1H), 3,64 (д, J=9,9 Гц, 1H), 6,67 (д, J=1,8 Гц, 1H), 6,76 (дд, J=1,8 Гц, 8,3 Гц, 1H), 7,05 (д, J=8,3 Гц, 1H), 7,1-7,4 (м, 5H). (Данные свободной формы)
МС (ЕI+) m/z; 433 [М++1]+
[Примеры препаратов]
Пример препарата 1
Таблетка:
Соединение по настоящему изобретению - 10 г
Лактоза - 260 г
Микрокристаллическая целлюлоза - 600 г
Кукурузный крахмал -350 г
Гидроксипропилцеллюлоза - 100 г
CMC-Ca - 150 г
Стеарат магния - 30 г
Общая масса - 1500 г
Упомянутые выше ингредиенты смешивают традиционным способом, а затем получают 10000 таблеток в сахарной облатке, каждая из которых содержит 1 мг активного ингредиента.
Пример препарата 2
Капсула:
Соединение по настоящему изобретению - 10 г
Лактоза - 440 г
Микрокристаллическая целлюлоза - 1000 г
Стеарат магния - 50 г
Общая масса - 1500 г
Упомянутые выше ингредиенты смешивают традиционным способом, а затем ими заполняют желатиновые капсулы с получением 10000 капсул, каждая из которых содержит 1 мг активного ингредиента.
Пример препарата 3
Мягкая желатиновая капсула:
Соединение по настоящему изобретению - 10 г
PEG 400 - 479 г
Триглицерид насыщенной жирной кислоты - 1500 г
Масло перечной мяты - 1 г
Полисорбат 80 - 10 г
Общая масса - 2000 г
Упомянутые выше ингредиенты смешивают традиционным способом, а затем ими заполняют мягкие желатиновые капсулы №3 с получением 10000 мягких желатиновых капсул, каждая из которых содержит 1 мг активного ингредиента.
Пример препарата 4
Мазь:
Соединение по настоящему изобретению - 1,0 г
Вазелиновое масло - 10,0 г
Цетанол - 20,0 г
Белый вазелин - 68,4 г
Этилпарабен - 0,1 г
1-Ментол - 0,5 г
Общая масса - 100 г.
Упомянутые выше ингредиенты смешивают традиционным способом с получением 1% мази.
Пример препарата 5
Суппозиторий:
Соединение по настоящему изобретению - 1 г
Witepsol H15* - 478 г
Witepsol W35* - 520 г
Полисорбат 80 - 1 г
Общая масса - 1000 г
(*торговое наименование соединений триглицеридного типа).
Упомянутые выше ингредиенты смешивают в расплаве традиционным способом, вливают в контейнер для получения суппозиториев и охлаждают для отвердевания с получением 1000 суппозиториев (1 г), каждый из которых содержит 1 мг активного ингредиента.
Пример препарата 6
Инъекционный раствор:
Соединение по настоящему изобретению - 1 мг
Дистиллированная вода для инъекций - 5 мл
Получают путем растворения при введении.
[Пример фармакологического теста]
Воздействия на эффективный рефрактерный период
Способ
Собак (породы бигль) анестезировали путем введения фенобарбитала натрия, проводили торакотомию вдоль срединной линии с искусственной вентиляцией легких и делали разрез на перикарде для выделения сердца. Электрокардиограмму (ECG) записывали с использованием биполярных электродов, присоединенных к поверхности свободной стенки правого предсердия, ушка правого предсердия и свободной стенке правого желудочка. Вагальные нервы стимулировали при помощи электростимулятора с нихромовыми проволочками, билатерально введенными в вагальные нервы в шее. Были заданы такие условия электростимуляции вагальных нервов, при которых продолжительность интервалов RR на ECG была увеличена приблизительно на 100 мс по сравнению с продолжительностью перед началом стимуляции.
Эффективные рефрактерные периоды предсердия и желудочка определяли с использованием программируемого электростимулятора, применяя во время билатеральной стимуляции вагальных нервов методику S1-S2-экстрастимулов при продолжительности основного цикла 300 мс. За последовательностью из 10 основных стимулов (S1) следовал ранний экстрастимул (S2), пороговая величина которого в 2 раза превышала диастолу. Интервал S1-S2 последовательно уменьшали на 2 мс и определяли эффективный рефрактерный период как точку как значение, при котором S2 был не способен индуцировать распространяющийся ответ.
Для оценки воздействия лекарств эффективные рефрактерные периоды предсердия и желудочка определяли перед введением лекарства, затем внутривенно вводили соответствующее соединение в дозе 0,3 мг/кг и определяли эффективные рефрактерные периоды предсердия и желудочка через 5 минут после введения.
Результаты представляли как выраженное в мс увеличение продолжительности эффективных рефрактерных периодов предсердия и желудочка, т.е. [эффективный рефрактерный период после введения лекарства]-[эффективный рефрактерный период до введения лекарства].
Результаты
Как представлено в таблице 60, соединения по настоящему изобретению обладают пролонгирующим действием на рефрактерный период, избирательным в отношении предсердия.
Эффект настоящего изобретения
соединения по настоящему изобретению обладают пролонгирующим действием на рефрактерный период, избирательным в отношении предсердия, а потому могут применяться в качестве средств против фибрилляции предсердий и суправентрикулярного противоаритмического средства, и применимы в качестве лекарственного средства. Кроме того, поскольку соединения по настоящему изобретению обладают незначительным воздействием на желудочки, они могут применяться для безопасного лечения упомянутых выше аритмических состояний.
Реферат
Настоящее изобретение относится к новым бензопирановым соединениям формулы (I) ! ! в которой Х представляет собой NR6, где R6 представляет собой атом водорода или С1-4-алкильную группу; Y представляет собой связь, SO, SO2; ! Z представляет собой С1-4-алкильную группу (где C1-4-алкильная группа может быть произвольно замещена 1-5 атомами галогена) или фенильную группу (где фенильная группа может быть произвольно замещена C1-4-алкильной группой); ! W представляет собой атом водорода, атом галогена, гидроксигруппу, C1-6-алкоксигруппу, C1-4-алкильную группу, C1-6-алкилсульфониламиногруппу; ! R1 и R2 независимо друг от друга представляют собой C1-3-алкильную группу; ! R3 представляет собой атом водорода, гидроксигруппу или метоксигруппу; ! m равно целому числу от 0 до 4; n равно целому числу от 0 до 4; V представляет собой одинарную связь; R4 представляет собой водород или C1-6-алкильную группу; и ! R5 представляет собой - атом водорода,- C1-6-алкильную группу, - С3-8-циклоалкильную группу или С3-8-циклоалкенильную группу или - С6-14-арильную группу (где каждая С6-14-арильная группа может быть произвольно замещена 1-3 R12, где R12 представляет собой атом галогена) и фармацевтической композиции на их основе. ! Данные соединения применимы в качестве противоаритмического средства. 2 н. и 25 з.п. ф-лы., 60 табл.
Формула
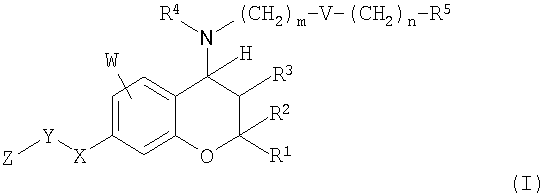
в которой X представляет собой NR6, где R6 представляет собой атом водорода или С1-4-алкильную группу;
Y представляет собой связь, SO, SO2;
Z представляет собой C1-4-алкильную группу (где C1-4-алкильная группа может быть произвольно замещена 1-5 атомами галогена) или фенильную группу (где фенильная группа может быть произвольно замещена C1-4-алкильной группой);
W представляет собой атом водорода, атом галогена, гидроксигруппу, C1-6-алкоксигруппу, C1-4-алкильную группу, C1-6-алкилсульфониламиногруппу;
R1 и R2 независимо друг от друга представляют собой С1-3-алкильную группу;
R3 представляет собой атом водорода, гидроксигруппу или метоксигруппу;
m равно целому числу от 0 до 4;
n равно целому числу от 0 до 4;
V представляет собой одинарную связь;
R4 представляет собой водород или C1-6-алкильную группу; и
R5 представляет собой
атом водорода,
C1-6-алкильную группу,
С3-8-циклоалкильную группу или С3-8-циклоалкенильную группу или
С6-14-арильную группу (где каждая С6-14-арильная группа может быть произвольно замещена 1-3 R12, где R12 представляет собой атом галогена),

Комментарии