Способ получения производных замещенного бензофурана или их фармацевтически приемлемых солей - RU2098415C1
Код документа: RU2098415C1
Чертежи
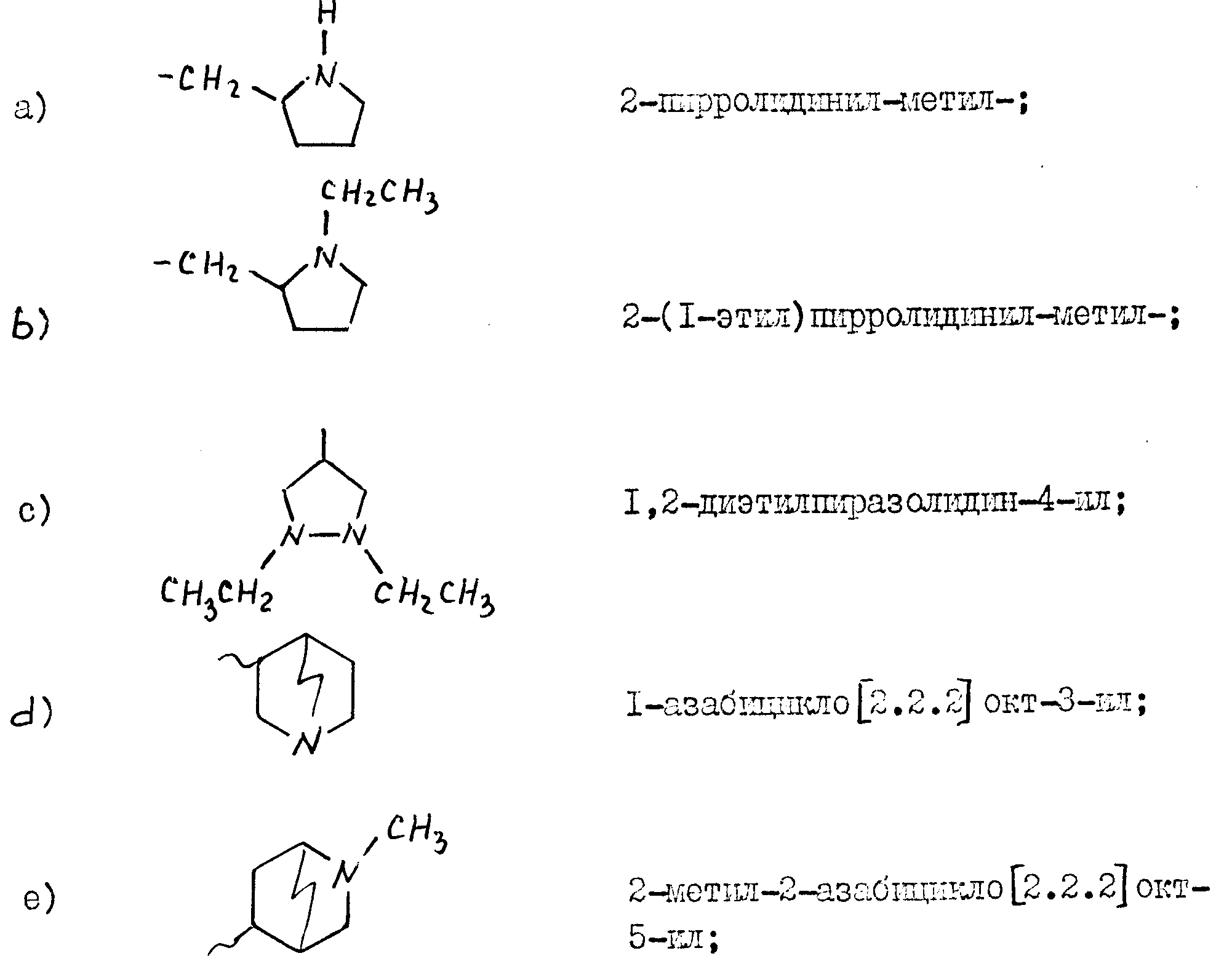
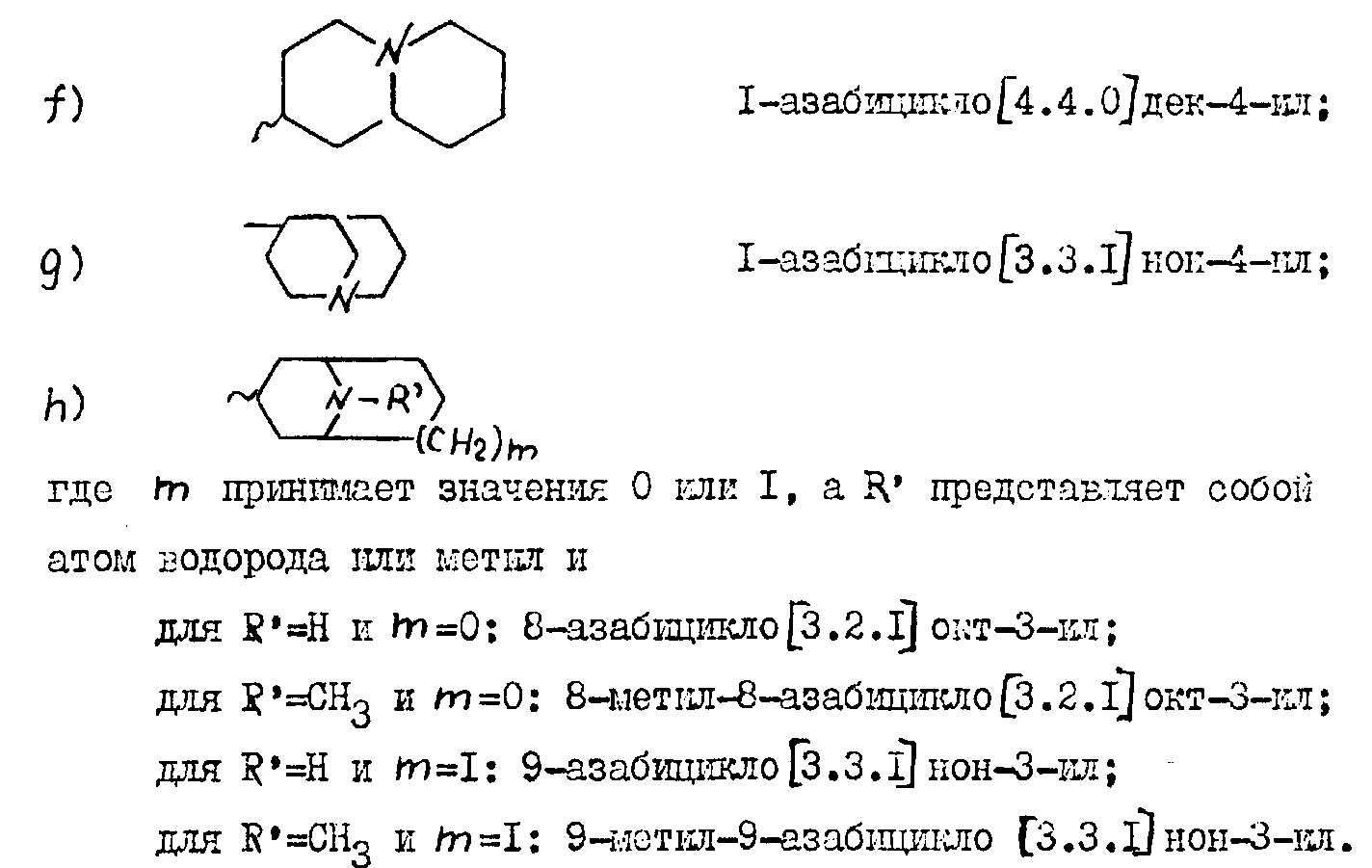
Описание
Изобретение относится к новому способу получения производных замещенного бензофурана.
Предметом изобретения является новый способ получения соединений формулы (I)

где один из заместителей R1 и R2 представляет собой атом водорода или атом галогена, а другой независимо от первого представляет собой амино-группу или C2-C4-алканоиламиногруппу;
R3 представляет собой атом водорода; линейный или разветвленный C1-C4-алкил, C1 -C4-алкоксигруппу или фенил, незамещенный или замещенный C1-C4-алкильной группой;
A представляет собой группу -(CH2)-Het, где Het представляет собой незамещенный или замещенный гетеромоноцикл или гетеробицикл, содержащий один или два атома азота и от 5 до 10 атомов углерода, а n принимает значение 0 или целые значения от 1 до 3;
символ

С использованием нового способа данного изобретения также могут быть получены соли и все возможные изомеры соединений формулы (I).
Если в вышеуказанной формуле (I) один из заместителей R1 и R2 представляет собой C2-C4-алканоиламиногруппу, то эта группа предпочтительно является ацетиламиногруппой или пропаноиламиногруппой, в особенности ацетиламиногруппой.
Предпочтительно заместитель R1 представляет собой аминогруппу, а заместитель R2 является атомом галогена, в частности атомом хлора или фтора, более предпочтительно атомом хлора.
Если заместитель R3 представляет собой C1-C4-алкильную группу, то она является предпочтительно метильной или этильной группами; если
заместитель
R3 представляет собой C2-C4-алкоксигруппу, то она является предпочтительно метокси- или этоксигруппами;
Если заместитель R3
представляет собой
фенил, замещенный C1-C4-алкилом, то он является предпочтительно 4-метилфенилом.
Заместитель R3 предпочтительно представляет собой атом водорода.
Гетероциклический фрагмент заместителя A предпочтительно представляет собой:
1) пятичленный или шестичленный, предпочтительно насыщенный гетеромоноцикл,
содержащий один или два атома
азота, незамещенный либо замещенный одной или более C1-C4-алкильными группами или бензольной группой; или
2) гетеробицикл, предпочтительно
насыщенный, содержащий один
атом азота, где каждый из конденсированных моноциклов, которые могут быть одинаковыми или различными, представляют собой пяти- или шестичленный моноцикл, причем
вышеуказанный гетеробицикл является
незамещенным или замещенным одной или несколькими C1-C4-алкильными группами или бензольными группами.
Предпочтительно n принимает значения 0 или 1.
Символ

В тех случаях, когда фрагмент Het заместителя A представляет собой гетеромоноцикл, описанный в 1), то он предпочтительно является пиррольным или пиразольным циклом, предпочтительно насыщенным, возможно замещенным по атому азота; более предпочтительно, если фрагмент Het представляет собой пиррольный цикл, то он, в частности, является пирролидином, незамещенным, или замещенным по атому азота C1-C4-алкилом или бензилом; если фрагмент Het представляет собой насыщенный пиразольный цикл, то он, в частности, является пиразолидином, замещенным по двум атомам азота C1-C4-алкилами.
В тех случаях, когда фрагмент Het заместителя A представляет собой гетеробицикл, описанный в 2), то он предпочтительно является насыщенным азагетеробициклом, содержащим один атом азота, возможно замещенный C1-C4-алкилом или бензилом.
Специфические примеры заместителя A представлены в конце описания.
Они имеют следующий вид:
m принимает значения 0 или 1, а R' представляет собой атом водорода или метил и
для R'=H и m=0: 8-азабицикло [2.3.1] окт-3-ил;
для R'=CH3 и m=0: 8-метил-8-азабицикло
[2.3.1] окт-3-ил;
для R'=H и m=1: 9-азабицикло [3.3.1] нон-3-ил;
для R'=CH3 и m=1: 9-метил-9-азабицикло [3.3.1]
нон-3-ил.
Что касается азабициклических структур настоящего изобретения, то есть тех структур, которые описаны выше, то символ ~ ~ ~ означает, что азабицикл может иметь или α (эндо), или b (экзо) ориентацию.
Следовательно, в любом случае, когда в формуле содержится заместитель с символом ~ ~ ~ то эта формула может обозначать соединение, содержащее азабицикл только в α (эндо) конфигурации или b (экзо) ориентации, или формула может соответствовать смеси двух соединений, содержащих азабицикл в a (эндо) ориентации и соединение, содержащее азабициклический фрагмент в b (экзо) ориентации.
В частности, когда заместитель A в соединениях формулы (I) представляет собой азабицилическое кольцо, имеющее строение, указанное в конце описания под обозначениями e), f), g) или h), то азабициклический остаток имеет предпочтительно a (эндо) ориентацию.
Кроме того, когда в молекуле присутствует хиральный центр, то формула настоящего описания соответствует обоим индивидуальным оптическим изомерам или их смесям, то есть рацематам.
Как уже говорилось, в соответствии со способом настоящего изобретения, могут быть получены фармацевтически приемлемые соли соединений формулы (I). Вышеуказанными солями могут быть соли подходящих кислот, такие как соли неорганических кислот, например соляной или серной, или органических кислот, таких как органические карбоновые кислоты, например лимонная, винная, фумаровая и им подобные, или органические сульфоновые кислоты, например метаносульфоновые или этаносульфоновая кислоты.
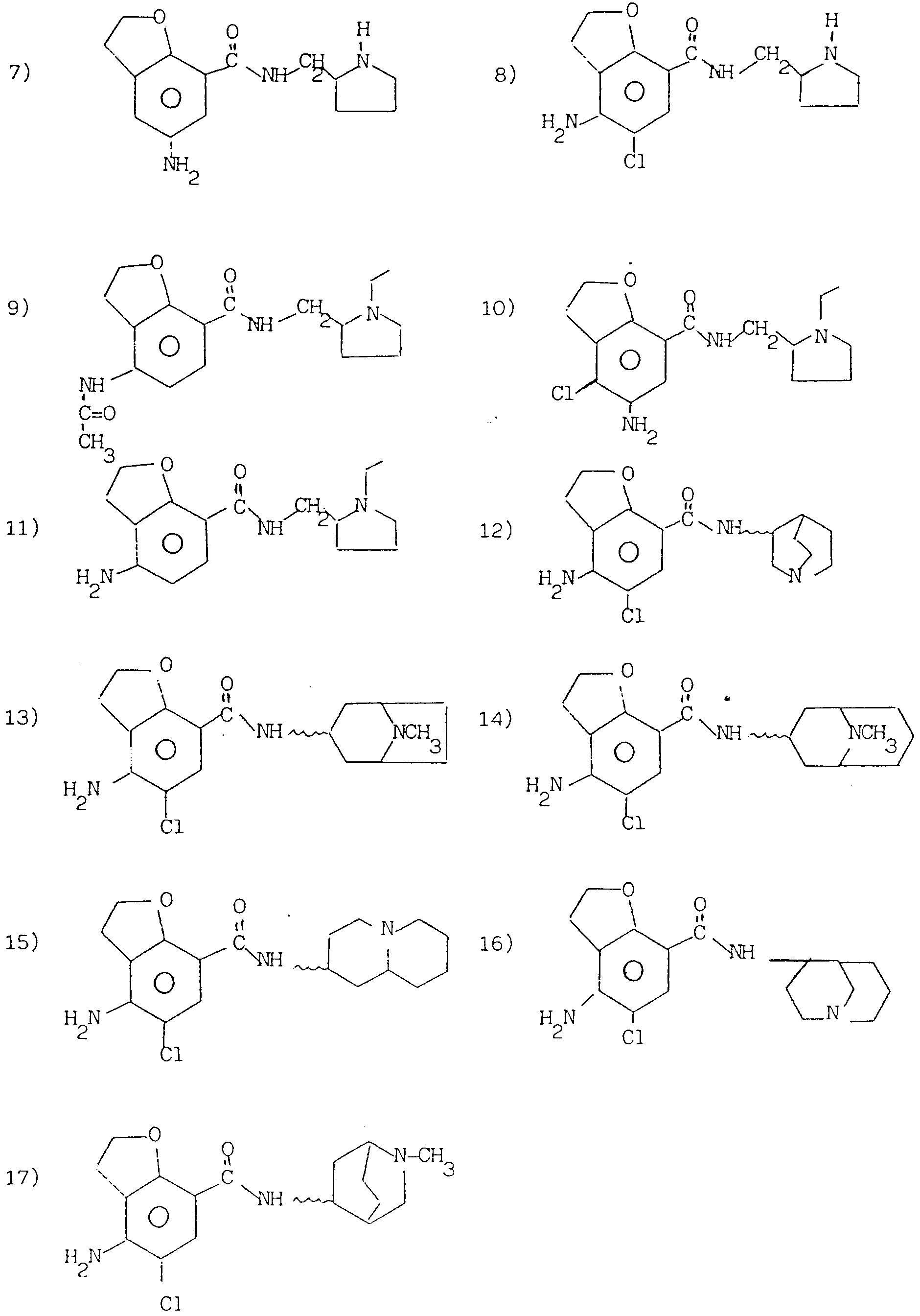
Конкретными примерами соединений формулы (I) являются следующие соединения, в частности, в форме хлоргидратов:
1)
5-амино-N-[2-(1-этил)-пирролидинил-метил] -2,3-дигидробензо [b]
фуран-7-карбоксамид;
2) 5-ацетиламино-N-[2-(1-этил)-пирролидинил-метил]-2,3-дигидробензо [b] фуран-7-карбоксамид;
3)
2-метил-4-хлор-5-амино-N-[2-(1-этил)-пирролидинил-метил]-2,
3- дигидробензо [b]фуран-7-карбоксамид;
4) 4-амино-5-хлор-N-[2-(1-этил)-пирролидинил-метил]-2,3-дигидробензо [b]
фуран-7-карбоксамид;
5) 4-амино-5-хлор-N-[(1,
2-диэтил)-пиразолидин-3-ил]-2,3-дигидробензо [b] фуран-7-карбоксамид;
6) 4-ацетиламино-5-хлор-N-[2-(1-этил)-пирролидинил-метил]-2,
3- дигидробензо [b]фуран-7-карбоксамид;
7)
5-амино-N-[2-пирролидинил-метил] -2,3-дигидробензо [b] фуран-7-карбоксамид;
8) 4-амино-5-хлор-N-[2-пирролидинил-метил] -2,3-дигидробензо
[b]фуран-7-карбоксамид;
9)
4-ацетиламино-N-[2-(1-этил)-пирролидинил-метил]-2,3- дигидробензо[b] фуран-7-карбоксамид;
10) 4-хлор-5-амино-N-[2-(1-этил)-пирролидинил-метил] -2,
3- дигидробензо[b]фуран-7-карбоксамид;
11) 4-амино-N-[2-(1-этил)-пирролидинил-метил]-2,3- дигидробензо[b]фуран-7-карбоксамид;
12) 4-амино-5-хлор-N-(1-азабицикло[2.2.2]окт-3-ил)-2,
3- дигидробензо[b] фуран-7-карбоксамид;
13) 4-амино-5-хлор-N-(8-метил-8-азабицикло[3.2.1]окт-3-ил)-2,3- дигидробензо[b]фуран-7-карбоксамид;
14)
4-амино-5-хлор-N-(9-метил-9-азабицикло[3.3.1]нон-3-ил)-2,
3- дигидробензо[b]фуран-7-карбоксамид;
15) 4-амино-5-хлор-N-(1-азабицикло[4.4.0]дец-4-ил)-2,3- дигидробензо[b] фуран-7-карбоксамид;
16)
4-амино-5-хлор-N-(1-азабицикло[3.3.1]нон-4-ил)-2,3- дигидробензо[b] фуран-7-карбоксамид;
17) 4-амино-5-хлор-N-(2-метил-2-азабицикло[2.2.2]окт-5-ил)-2,
3- дигидробензо[b]фуран-7-карбоксамид;
При этом соединения 12-17) находятся или в эндо- или в экзо-конфигурации, предпочтительно в эндо-конфигурации. Структурные формулы перечисленных выше
соединений в соответствии с их порядковым
номером приведены в конце описания.
Способ настоящего изобретения отличается простыми и мягкими условиями реакции, обеспечивающими получение чистого продукта с высоким выходом.
Известно, что когда в бензольном кольце присутствует большое число заместителей, то они значительно ограничивают синтетические возможности, что приводит к длительным и утомительным синтезам.
Мы установили, что способ настоящего изобретения особенно хорошо использовать также в тех случаях, когда в бензольном кольце присутствуют большое число заместителей, то есть в случае большинстве представленных соединений формулы (I).
В соответствии с новым способом настоящего изобретения соединения формулы
(I) получают:
A) реакцией в присутствии
каталитического количества катализаторора VIII группы в подходящем органическом растворителе в присутствии избытка органического основания соединения
формулы (II)

где один из заместителей R, R
заместитель L представляет собой уходящую группу; и заместитель R4 представляет собой атом водорода или карбоксильную защитную группу с соединением формулы (III)
R
где один из двух заместителей R'3 представляет собой атом водороде; линейный или разветвлений C1-C4-алкил; атом галогена; фенил, возможно замещенной C1-C4 -алкильной группой или три-C1-C4-алкил-силильной защитной группой, и другой, три-C1-C4-алкил-силильную группу, так что полученное соединение имеет формулу (IV)

где заместители R
B) циклизацией в органическом растворителе в присутствии органического основания соединения формулы (IV) и отщеплением заместителя R

где заместители R

С) возможно восстановлением соединения формулы (V), где символ


D) взаимодействием соединения формулы (V), где заместители R

H2N-A (VI)
где заместитель A принимает значения, определенные выше, и, если необходимо, после любой из стадий B), C) и D) снятием с аминогруппы заместителей возможно представленных


Когда один из заместителей R
Когда один из заместителей

Когда один из заместителей

Уходящая группа в соединении формулы (II) может представлять собой, например, возможно замещенный фенилсльфонат, такой как, например, тозилат, брозилат или пара-фторфенилсульфонат; возможно замещенный C1-C4-алкилсульфонат, такое как мезилат или трифлат; или атом галогена, такой как бром или иод.
Когда заместитель R4 представляет собой карбоксильную защитную группу, то он может быть, например, линейным или разветвленным C1-C4-алкилом, таким как метил, этил или трет.-бутил; аралкильной группой, такой как, например, бензил, пара-нитро-бензил или дифенилметил; или триалкилсилильной группой, такой как, например, триметилсилил или диметил-трет.-бутоксилил.
Предпочтительно заместитель
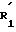

Предпочтительно в соединении формулы (I) уходящая группа L представляет собой атом галогена, более предпочтительно атом брома или иода.
Реакция между соединением формулы (I) и соединением формулы (II) может быть проведена в присутствии подходящего катализатора, такого как, например, металл VIII группы, например, палладий (Pd), или соли меди Cu (I), в подходящем органическом растворителе в присутствии избытка органического основания при температуре приблизительно от -40 до 120oC в течение приблизительно от 1 ч до 1 дня.
Подходящим катализатором может быть, например, металл, выбираемый из VIII группы, предпочтительно
катализатор на основе Pd (II) или
Pd (O) с лигандом или без лиганда. Предпочтительными лигандами являются: галогениды, ацетаты или лиганды на основе фосфора, такие как, например, PPh3,
P(o-Tol)3, dppe [1,
2-бис(дифенилфосфино)этан] или dppf [1,1-бис(дифенилфосфино)ферроцен]
Подходящей солью меди (I) может быть, например, соль, которая широко используется в
органических синтезах в качестве
металлирующего агента, например галогенид Cu (I), Cu2O, CuCN, комплекс CuCN-LiCl, предпочтительно CuI, CuCl или CuO.
Подходящим органическим растворителем является, например, диметилформамид (ДМФА), диоксан, тетрагидрофуран (ТГФ), ацетонитрил, диметилсульфоксид или ацетон; предпочтительно ДМФА, ТГФ или диоксан.
Подходящим основанием может быть, например, органическое основание, такое как, например, алкиламин, например, триэтиламин (Et3N) или диизопропиламин; или аралкиламин, например, бензиламин.
Циклизация соединения формулы (II) может быть осуществлена в подходящем органическом растворителе в присутствии подходящего органического основания при температуре приблизительно от -20 до 200oC с образованием соединения формулы (V), где символ

Подходящим органическим растворителем может быть, например, такой органический растворитель, как диметилформамид (ДМФА), диоксан, тетрагидрофуран (ТГФ), ацетонитрил, диметилсульфоксид, бензол, толуол или ксилол.
Подходящим основанием может быть, например, такое органическое основание, как моно-, ди- или три-C1-C4-алкиламин, предпочтительно триэтиламин; C1-C4-алкилзамещенный гуанидин, предпочтительно тетраметилгуанидин; возможно замещенный моно- или двухосновный фенилалкиламин; 1,5-диазабицикло [5.4.0] ундец-5-ен (ДБУ), 1, 5-диазабицикло[4.3.0]нон-5-ен (ДБН), 1,4-диазабицикло-[2.2.2]октан (ДАБКО), предпочтительно ДБУ или ДБН; неорганическое основание, такое как, например, основания, содержащие щелочные или щелочноземельные металлы, например, NaHCO3, Na2CO3, NaOH, KHCO3, K2CO3 или KOH, предпочтительно NaOH, Na2CO3, K2CO3 или KOH.
Особенно приемлемым основанием может быть, например, тетрабутиламмоний фторид, в частности, если он подходящим образом нанесен на, например, силикагель. Использование тетрабутиламмония в качестве основания дает на практике дополнительное преимущество, заключающееся в том, что если в соединении формулы (I) все еще присутствует триалкилсилильная защитная группа, то она одновременно снимается в процессе реакции циклизации.
Циклизация соединения (IV) может быть осуществлена без его предварительной очистки, то есть непосредственно циклизацией сырого продукта реакции между соединением формулы (II) и соединением формулы (III), например, используя подходящее основание, например, тетраметилгуанидин, подходящий растворитель, например, толуол, при температуре приблизительно от -20 до 200oC.
Альтернативно циклизация может быть осуществлена "in situ", т.е. без выделения каким- либо способом продукта реакции между соединением формулы (II) и соединением формулы (III) в качестве сырого продукта или в качестве очищенного продукта.
Если заместитель
R
Возможное восстановление соединения формулы (V), где символ


Подходящим растворителем может быть, например, такой органический растворитель, как ацетон, уксусная кислота, спирт, например метиловый, этиловый или изопропиловый, этилацетат, ТГФ, ДМФО или их смесь; водно-органическая смесь, например, спирт/вода, ТГФ/воды, уксусная кислота/вода.
Предпочтительными растворителями являются, например, метанол, этанол, уксусная кислота или смеси ацетон/этилацетат, уксусная кислота/метанол, уксусная кислота/этанол, ацетон/спирт или уксусная кислота/ацетон.
Подходящим катализатором может быть, например, переходный металл, такой как катализатор на основе Pd, Pt или Rh, как в гомогенный, так и в гетерогенной системе; предпочтительно Pd или Rh катализаторы.
Подходящим источником водорода может быть, например, молекулярный водород, триэтиламмонийформиат, циклогексадиен или гидрид триалкилолова.
Реакционноспособным производным соединения формулы (V), в котором заместитель R4 представляет собой атом водорода, может быть, например, соответствующий галогенид, в частности, хлорид, или смешанный ангидрид с подходящей карбоновой кислотой.
Предпочтительный смешанный ангидрид получают реакцией соединения формулы (V), в котором заместитель R4 представляет собой атом водорода, с этилхлорформатом.
Реакционноспособным производным соединения формулы (V), в котором заместитель R4 представляет собой атом водорода, является также соответствующий C1-C4-алкиловый эфир, то есть соединение формулы (V), где заместитель R4 представляет собой C1-C4-алкил.
Реакция между соединением формулы (V) или его реакционноспособным производным и соединением формулы (VI) может быть проведена по известным методикам, описанным в органической химии для реакцией амидирования, например по методике, описанной в патенте США 4888353.
Например, реакция между соединением формулы (V), где заместитель R4 представляет собой атом водорода, и соединением формулы (VI), может быть осуществлена в подходящем органическом растворителе, например, таком как хлористый метилен или ДМФА, в присутствии N, N-карбонилдиимидазола.
Снятие возможно присутствующей защитной группы с аминогруппы после проведения реакционных стадий B), C) и D) может быть осуществлено по известным методиками.
Возможное восстановление соединения формулы (I), где символ



Возможное образование соли из соединения формулы (I), возможное получение свободного основания формулы (I) из его соли и возможное разделение смеси изомеров формулы (I) на индивидуальные изомеры может быть проведено обычными способами с использованием известных и рутинных методик органической химии.
Соединения формул (II), (III) и (VI) являются известными соединениями или могут быть получены известными способами из известных соединений.
Например, соединение формулы (VI), где заместитель A представляет собой 2-пирролидинил-метил, может быть получено по методике, описанной в Английском патенте 1481251 или в патенте США 4888353; соединение формулы (VI), где заместитель A представляет собой эндо-8-метил-8-азабицикло[3.2.1]окт-3-ил, то есть эндо-8-метил-8-азабицикло[3.2.1]октан-3-амин, может быть получено по методике, описанной в статье Archr S. Lewis T. Unser M. J.Am.Chem. Soc. 1987, 79, 4194; а соединение формулы (VI), где заместитель A представляет собой эндо-9-метил-9-азабицикло[3.3.1]нон-3-ил, то есть эндо-9-метил-9-азабицикло[3.3.1]нонан-3-амин, может быть получено по методике, описанной в Европейском патенте 13.138, Hadley M. 1979, Chem. Abstracts, 1981, 94, 65477 или в Англ. пат. 2125398, 1984, Donatch P. Engel G. Uegi B. Richardson B. Stadler.
Соединения формулы (I) являются антагонистами 5HT3-рецепторов и могут быть использованы, например, при лечении нарушений центральной нервной системы, таких как тревожное состояние или психозы и/или при лечении расстройств перистальтики кишечника и/или рвоты.
Соединения настоящего изобретения могут быть также использованы, например, в качестве средства, активирующего познавательную способность.
Соединения настоящего изобретения могут быть назначены в различных дозируемых формах, например, орально в форме таблеток, пилюль, капсул, суспензий, капель или сиропов; парентально, например, внутривенно, внутривенно, внутримышечно в виде растворов или суспензий, или подкожно.
Фармацевтические препараты, содержащие соединения настоящего изобретения, могут быть приготовлены обычными способами с использованием обычных носителей или разбавителей.
Обычно носителями или разбавителями являются, например, воды, желатин, лактоза, крахмалы, стеарат магния, тальк, растительные масла и им подобные.
Таблетки, пилюли и капсулы могут, например, содержать связующее средство, такое как, например, трагакант; инертные наполнители, например, дикальцийфосфат; диспергирующую добавку, например кукурузный крахмал, смазочное вещество, например стеарат магния; подслаивающее средство, например сахарозу или вкусовую добавку, такую как вишневую вкусовую добавку.
Подходящие фармацевтические формы для парентального использования представляет собой стерильные водные растворы или дисперсии или стерильные порошки для их приготовления.
Дозировка соединений настоящего изобретения или в целях профилактики или для лечения будет зависеть от выбранного способа применения, от конкретного выбранного соединения, от пациента, а также от природы и тяжести заболевания.
Подходящей терапевтической дозой может быть, например, доза, лежащая в интервале приблизительно от 0,010 до 20 мг/кг веса.
Предпочтительно соединения могут быть, например, введены одной дозой или несколькими дозами так, чтобы общая дневная доза попадала в интервал от приблизительно 0,02% до 10 мг/кг в день.
Сокращения, используемые в настоящем описание,имеют следующие
значения:
PPh3 трифенилфорсфин
P(O-Tol)3 три(орто)толилфосфин
dppf 1,1-бис(дифенилфосфино)ферроцен
dppe 1,1-бис(дифенилфосфино)этан
ДВУ 1,8-диазабицикло[5.4.0]ундек-7-ен
ДВН 1,
5-диазабицикло[4.3.0]нон-5-ен
ДАБКО 1,4-диазабицикло[2.2.2]октан
ПТК пара-толуолсульфокислота и
ТБАФ тетрабутиламмоний
фторид.
Следующие примеры иллюстрирую получение промежуточных соединений и соединений данного изобретения. Эти примеры приведены только с целью иллюстрации изобретения, а не для того, чтобы каким-либо образом ограничить объем настоящего изобретения.
Пример 1. Получение исходных материалов. Стадия 1. Метиловый эфир 4-ацетамидо-5-хлор-салициловой кислоты. Способ A.
Через раствор метилового эфира 4-ацетамидосалициловой кислоты (5 г) в уксусной кислоте (200 мл) пропускали хлор (приблизительно 3 г). Затем раствор выливали в воду (500 мл). Перемешивали 30 мин, осадок отфильтровывали и промывали водой до нейтральной реакции.
После перекристаллизации из MeOH получали указанное соединение в виде белого твердого продукта (4, 4 г).
Способ B. К раствору метилового эфира 4-ацетамидосалициловой кислоты (10 г) в смеси уксусной кислоты (200 мл) и 15%-ной соляной кислоты (50 мл) добавляли хлорат натрия (1.95 г). Смесь перемешивали 1 ч, добавляли воду (200 мл) и перемешивали еще 30 мин. Выпавший осадок отфильтровывали, промывали водой и перекристаллизовывали из EtOH. Получали указанное соединение (7,1 г).
Стадия 2. Метиловый эфир 3-иод-4-ацетамидо-5-хлорсалициловой кислоты.
К раствору метилового эфира 4-ацетамидо-5-хлорсалициловой кислоты (2 г) в смеси CH2CI2 (200 мл) и абсолютного MeOH (80 мл) последовательно добавляли NaHCO3 (1,66 г) и бензилтриметиламмоний иододихлорид (2,8 г) и перемешивали при 25oC в течение ночи.
Растворитель упаривали в вакууме и остаток растворяли в CH2CI2 (440 мл). Органическую фазу промывали разбавленной соляной кислотой, тиосульфатом натрия и водой, отделяли и сушили безводным сульфатом натрия.
Большую часть растворителя удаляли в вакууме, а образующийся белый осадок отфильтровали. Получали 2,57 г указанного соединения.
Пример 2. Метиловый эфир 4-ацетамидо-5-хлорбензо[b]фуран-7-карбоновой кислоты. Способ A.
К раствору метилового эфира 3-иод-4-ацетамидо-5-хлорсалициловой ктслоты (2 г) в смеси перегнанного Et3N (60 мл) и диоксана (40 мл) добавляли триметилсилилацетилен (1 мл), Cul (23 г) и PdCl2 (PPh3)2 (152 мг). Реакционную смесь перемешивали при 40oC в течение 1,5 ч, после чего растворители удаляли в вакууме. Образец остатка очищали с помощью коленочной хроматографии (элюент диэтиловый эфир-гексан) и получали для аналитических целей метиловый эфир 3-триметилсилил-4-ацетамидо-5-хлорсалициловой кислоты.
Спектр ЯМР (CDCO3), δ м.д. 2,19 (3H, c); 3,96 (3H, c); 7,14 (1H, уш. с); 7, 87 (1H, c); 11,28 (1H, c).
СС-масс-спектр (электронный удар); 339 (M+.), 324 (M-Me), 304 (M-CI).
Неочищенный продукт помещали в толуол (160 г), нагревали до рефлюкса и добавляли тетраметилгуанидин (1,36 мл) и силикагель (4 г). Смесь кипятили в течение 2 ч, охлаждали до комнатной температуры и фильтровали. Фильтрат отделяли и силикагель тщательно промывали кипящим ацетоном. Фильтрат упаривали в вакууме, получали 0,92 г указанного продукта.
Спектр ЯМР (CDCl3), d м.д. 2,31 (3H, c); 3,99 (3H, c); 6,85 (1H, д, J= 2,3 Гц); 7,57 (1H, уш. с); 7,71 (1н. с. J=2,3 Гц); 8,0 (1H, c).
СС-масс-спектр (электронный удар): 267 (M+.), 225 (M-CH3CO).
Способ B. Реакцию проводили так же, как и в способе A, за исключением того, что добавляли только тетраметилгуанидин. Смесь кипятили в течение 2 ч.
Образец полученного раствора очищали с помощью колоночной хроматографии для аналогичных целей и получали 2-триметилсилильное производное метилового эфира 4-ацетамидо-5-хлорбензо[b]фуран-7-карбоновой кислоты.
Спектр ПМР (CDCl3), d м.д. 0,36 (9H, c); 2,29 (3H, c); 6,96 (1H, c); 7,58 (1H, уш. c); 7,94 (1H, c).
GC-масс-спектр (электронный удар): 341 (M+2), 339 (M+), 304 (M-Cl), 297 (M-CH3)CO, 282 (297-MeOH).
Добавляли силикагель и кипятили в течение 3 ч. После охлаждения смесь обрабатывали в соответствии с методикой, описанной в способе A. Названный продукт
получали с выходом 65
Способ C. Реакцию
проводили по методике, описанной в способе A, а промежуточный метиловый эфир 3-метилсилилэинил-4-ацетамидо-5-хлорсалициловый кислоты выделяли с
помощью колоночной хроматографии и десилировали с
использованием методик, описанных в литературе (например, с помощью AgNO3, KCN, EtOH по методике, представленной в статье Rec. Trav. Chim
86, 1138, 1967), получали метиловый эфир
3-этинил-4-ацетамидо-5-хлорсалициловой кислоты.
Спектр ПМР (CDCl3), d м.д. 2,2 (3H, c); 3,6 (1H, c); 7,2 (1H, уш. c); 7,9 (1H, c); 11,3 (1H, c).
Масс-спектр (электронный удар): 267(M+.), 232 (M-CI).
К раствору указанного выше продукта (267 мг) в MeOH (2 мл) добавляли Na2 CO3 (105 мг). Смесь нагревали при 35oC в течение 3 ч. Смесь выливали в CH2Cl2.
Органическую фазу отделяли, сушили и упаривали в вакууме. Получали названный продукт, соответствующий продукту, получаемому по способам A или B.
Способ D. Реакцию проводили по методике способа C, за исключением того, что промежуточный продукт метиловый эфир 3-метилсилилэтинил-4-ацетамидо-5-хлорсалициловой кислоты выделяли, разбавляя реакционный раствор гексаном и отфильтровывая образующийся осадок. Полученный продукт растворяли в толуоле, нагревали до кипения и добавляли равное количество тетрабутиламмоний-фторида, нанесенного на силикагель (1,1 моль фторида на 1 г). Кипятили при t рефлюкса 10 мин. Реакционную смесь фильтровали и после охлаждения раствора отфильтровывали названный продукт, выход 82 (3,3 г на 5 г исходного продукта).
Пример 2A. Метиловый эфир 4-ацетамидо-5-хлорбензо[b]-фуран-7-карбоновой кислоты.
К раствору метилового эфира 3-иод-4 ацетамидо-5-хлорсалициловой кислоты (0,25 г) в смеси 1,1,3,3-тетраметилгуанидина (10 мл) и диоксана (10 мл) добавляли (триметилсилил)ацетилен (0,1 мл), Cul (10 мг) и PdCl2(PPh3)2 (19 мг). Реакционную смесь перемешивали при 50-60oC в атмосфере аргона в течение ночи. Раствор выливали в смесь CH2Cl2 /10%-ного HCl, органическую фазу промывали водой, сушили безводным Na2SO4 и упаривали в вакууме. После очистки с помощью колоночной хроматографии получали твердый белый продукт (0,13 г, 72 ). Полученное соединение было идентично соединению, получаемому по методике примера 2.
Пример 3. Метиловый эфир 4-ацетамидо-5-хлор-2,2-дигидробензо[b]-фуран-7-карбоновой кислоты.
К раствору метилового эфира 4-ацетамидо-5-хлорбензо[b]-фуран-7-карбоновой кислоты (0,5 г) в ацетоне (300 мл) перемешивали в течение 3 ч в присутствии 50%-ного Rh/C (0,5 г) в атмосфере водорода.
Катализатор отфильтровывали и фильтрат упаривали в вакууме, получали 0,48 г названного продукта.
Спектр ПМР (CDCl3), d м.д. 2,21 (3H, c); 3,17 (2H, т, J=8,8 Гц); 3,86 (3H, c); 4,70 (2H, т, J=8,8 Гц); 7,45 (1H, уш. c); 7,70 (1H, c).
GC-масс-спектр (электронный удар): 269 (M+), 234 (M-Cl), 196 (M-MeOH-CH3CO).
Пример 4. Реакцию проводили в соответствии с методикой, описанной в примере 2, за
исключением того, что использовали Rh/Al2O3. После
обработки реакционной массы выделяли продукт, описанный в примере 2 с выходом 90
Пример 5. Реакцию осуществляли по
методике, описанной в примере 2, за исключением того, что использовали смесь
уксусная кислота/метанол и Pd/C. После обработки реакционной массы выделяли продукт, описанный в примерах 2 и 3 с выходом
62%
Пример 6. Метиловый эфир 4-ацетамидо-5-хлор-2-фенилбензо
[b]-фуран-7-карбоновой кислоты.
Метиловый эфир 3-оид-4-ацетамидо-5-хлорсалициловой кислоты взаимодействует с фенилацетиленом в условиях, аналогичных условиям, описанным в примере 1, в способах A и B, за исключением того, что не добавляется SiO2. После очистки с помощью колоночной хроматографии получали названный продукт.
По аналогичным методикам могут
быть получены при использовании подходящих исходных ацетиленовых производных следующие соединения:
Метиловый эфир
4-ацетамидо-5-хлор-2-метилбензо [b]-фуран-7-карбоновой кислоты;
Метиловый эфир 4-ацетамидо-5-хлор-2-этилбензо [b] -фуран-7-карбоновой кислоты;
Метиловый эфир
4-ацетамидо-5-хлор-2-хлорбензо [b] -фуран-7-карбоновой кислоты;
Метиловый эфир
4-ацетамидо-5-хлор-2-этоксибензо [b]-фуран-7-карбоновой кислоты;
Метиловый эфир
4-ацетамидо-5-хлор-2-метоксибензо [b]-фуран-7-карбоновой кислоты;
Метиловый эфир
4-ацетамидо-5-хлор-2-(4-метилфенил)бензо [b]-фуран-7-карбоновой кислоты;
Пример 7.
(S)-4-Амино-5-хлор-N-(2-пирролидинилметил)-2,3- дигидробезо[b] фуран-7-карбоксамид гидрохлорид.
К перемешиваемой суспензии 4-амино-5-хлор-2,3-дигидробезо [b]фуран-7-карбоновой кислоты (1,32 г; 0,0066 моль) в 30 мл метиленхлорида в атмосфере азота добавляли N,N-карбонилдиимидазол (1,08 г; 0.0066 моль). Через 3 ч смесь охлаждали до -20oC и по каплям добавляли раствор (S)-2-аминометилпирролидин (0,66 г; 0.0066 моль) в 1 мл метиленхлорида.
Через 6 ч реакционную смесь фильтровали и дважды промывали 20 мл 1 н. раствора NaOH. Органический слой сушили безводным сульфатом натрия. После фильтрования при охлаждении до 0-5oC добавляли раствор соляной кислоты в 2-пропаноле. Образующийся осадок отфильтровывали, промывали метиленхлоридом и перекристаллизовывали из смеси воды/2-пропанол. Получали 1,4 г названного продукта.
По
аналогичной методике могут быть также получены следующие соединения:
5-Амино-N-[2-(1-этил)пирролидинилметил]-2,3-дигидробезо[b]фуран -7-карбоксамид гидрохлорид;
5-Ацетиламино-N-[2-(1-этил)пирролидинилметил] -2,3-дигидробезо[b] фуран-7-карбоксамид гидрохлорид;
2-метил-4-хлор-5-амино-N-[2-(1-этил)пирролидинилметил]-2,3- дигидробезо[b]фуран
-7-карбоксамид гидрохлорид;
4-Амино-5-хлор-N-[2-(1-этил)пирролидинилметил] -2,3-дигидробезо [b]фуран
-7-карбоксамид гидрохлорид;
4-Амино-5-хлор-N-[2-(1-этил)пирролидин-3-ил] -2,
3-дигидробезо [b] фуран -7-карбоксамид гидрохлорид;
4-Ацеламино-5-хлор-N-[2-(1-этил)пирролидинилметил] -2,
3- дигидробезо [b] фуран -7-карбоксамид гидрохлорид;
5-Амино-N-(2-пирролидинилметил)-2,3-дигидробезо[b] фуран -7-карбоксамид гидрохлорид;
4-Ацетиламино-N-[2-(1-этил)пирролидинилметил] -2,3-дигидробезо[b] фуран-7-карбоксамид гидрохлорид;
4-хлор-5-амино-N-[2-(1-этил)пирролидинилметил] -2,3-дигидробезо[b] фуран-7-карбоксамид
гидрохлорид;
4-Амино-N-[2-(1-этил)пирролидинилметил] -2,3-дигидробезо[b] фуран-7-карбоксамид
гидрохлорид.
Пример 8. 4-Амино-5-хлор-N-(эндо-8-метил-8-азабицикло[3.2.1] окт-3-ил)-2,3-дигидробезо[b]фуран-7-карбоксамид гидрохлорид.
К раствору 4-амино-5-хлор-2, 3-дигидробезо[b]фуран-7-карбоновой кислоты (2,13 г; 0,010 моль) в 30 мл безводного диметилформамида при перемешивании добавляли N,N-карбонилдиимидазол (1,96 г; 0,012 моль).
В раствор пропускали азот и перемешивали при комнатной температуре в течение ночи, после чего по каплям добавляли раствор эндо-8-метил-8-азабицикло[3.2.1] октан-3-амина (1,4 г; 0,010 моль) в 5 мл безводного диметилформамида. Реакционную смесь грели при 70oC в течение 18 ч, охлаждали, выливали в воду и экстрагировали метиленхлоридом. Органический слой дважды промывали раствором бикарбоната натрия и сушили безводным сульфатом натрия. Раствор фильтровали, упаривали досуха и продукт очищали однократным хроматографированием на SiO2 (элюент CH2Cl2-MeOH-NH4OH 80:20:1), после чего обрабатывали раствором соляной кислоты а этаноле. Образующийся твердый продукт отфильтровывали и перекристаллизовывали из этанола, получали 1,6 г названного продукта.
Пример 9. Из соответствующей карбоновой кислоты и подходящего
амина по методике примера 8 могут быть также получены следующие соединения:
4-Амино-5-хлор-N-(эндо-9-метил-9-азабицикло[3.3.1] нон-3-ил)-2,3- дигидробезо[b]фуран-7-карбоксамид
гидрохлорид.
4-Амино-5-хлор-N-(1-азабицикло[4.4.0] дец-4-ил)-2,3-дигидробезо[b] фуран-7-карбоксамид гидрохлорид.
4-Амино-5-хлор-N-(1-азабицикло[3.3.1] нон-4-ил)-2, 3-дигидробезо[b] фуран-7-карбоксамид гидрохлорид.
4-Амино-5-хлор-N-(2-метил-2-азабицикло[2.2.2]окт-5-ил)-2,3- дигидробезо[b]фуран-7-карбоксамид гидрохлорид.
4-Амино-5-хлор-N-(1-азабицикло[2.2.2]окт-3-ил)-2,3-дигидробезо[b] фуран-7-карбоксамид гидрохлорид.
Пример 10. Таблетки каждая весом 150 мг и содержащие по 60 мг активного вещества
могут быть получены путем смешения и прессования следующих
ингредиентов:
4-Амино-5-хлор-N-(эндо-8-метил-8-азабицикло[3.2.1] окт-3-ил)-2,3- дигидробезо[b]фуран-7-карбоксамид гидрохлорид 60
мг
Крахмал 50 мг
Микрокристаллическая
целлюлоза 30 мг
Поливинилпирролидон 5 мг
Натриевая соль карбоксиметилкрахмала 4,5 мг
Стеарат магния 0,5 мг
Пример 11. Капсулы каждая весом 200 мг, содержащие по 80
мг активного вещества, могут быть получены из следующих ингредиентов:
4-Амино-5-хлор-N-(эндо-8-метил-8-азабицикло[3.2.1] окт-3-ил)-2,
3- дигидробезо[b]фуран-7-карбоксамид гидрохлорид 80 мг
Кукурузный крахмал 60 мг
Микрокристаллическая целлюлоза 59 мг
Стеарат магния 1 мг
Эта рецептура может быть
капсулирована в твердые желатиновые капсулы, состоящие из
двух частей при дозах для каждой капсулы 200 мг.
Реферат
Производные замещенного бензофурана формулы (I)

где один из заместителнй R1 и R2 представляет собой атом водорода или атом галогена, а другой независимо от первого представляет собой амино-группу или C2-C4-алканоиламиногруппу; R3 представляет собой атом водорода; линейный или разветвленный C1-C4-алкил, C1-C4-алкоксигруппу или C2-C4-алкоксикарбонильную группу; атом галогена; или фенил, незамещенный или замещенный C1-C4-алкильной группой; A представляет собой группу -(CH2 )n-Het, где Het представляет собой возможно замещенный гетеромоноцикл или гетеробицикл, содержащий один или два атома азота, а n принимает значение 0 или целые значения от 1 до 3; и символ


где заместитель L представляет собой уходящую группу; и заместитель R4 представляет собой атом водорода или карбоксильную защитную группу с соединением формулы (III)
R
с образованием соединения формулы (IV)
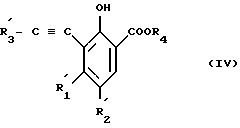
которое затем циклизуется до соединения формулы (V)

которое взаимодействует с соединением формулы (VI) H2N-A.
Формула

где один из R1 и R2 представляет атом водорода или галогена, а другой независимо аминогруппу или C2 - C4-алканоиламиногруппу;
R3 является атомом водорода, линейным или разветвленным C1 C4-алкилом, C1 C4-алкоксигруппой или фенилом, незамещенным или замещенным C1 C4-алкильной группой;
A является группой -(CH2)n-Het, в которой Het представляет незамещенное или замещенное гетеромоноциклическое или гетеробициклическое кольцо, не содержащее или содержащее два атома азота и 5 10 углеродных атомов;
n 0, 1, 2, 3;
символ
или их фармацевтически приемлемых солей, включающий (A) взаимодействие в присутствии каталитического количества катализатора металла YIII группы в среде соответствующего органического растворителя в присутствии избытка органического основания, соединения формулы II

где один из R
L является отщепляемой группой;
R4 является атомом водорода или защитной группой для карбоксигруппы,
с соединением формулы III
R
где одна из двух R
с получением соединения формулы IV
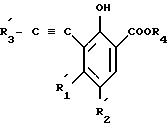
где R
и при желании, когда R

где R
символ

и (C) при необходимости восстановление соединения формулы V, где символ
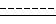


или его реакционноспособного производного с соединением формулы VI
H2N-A,
где A имеет указанные значения,
и при желании после любой из стадий B, C, D снятие защиты с аминозащитных групп, представленных возможно группами



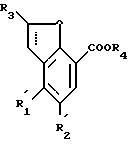
где один из заместителей R
R3 представляет собой атом водорода; линейный или разветвленный C1 C4-алкил, C1 C4-алкоксигруппу или фенил, незамещенный или замещенный C1 C4-алкильной группой;
R4 представляет собой атом водорода или карбоксильную защитную группу;
символ
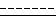
отличающийся тем, что он включает (A) взаимодействие в присутствии каталитического количества катализатора металла VIII группы в среде соответствующего органического растворителя в присутствии избытка органического основания соединения формулы II

где

L представляет собой уходящую группу,
с соединением формулы III
R
где один из двух заместителей

с образование соединения формулы IV
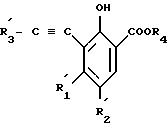
где заместители
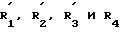
и, при желании, когда заместитель



Комментарии