1
Изобретение относится к способу получения новых соединений произпод-
Hbix 2,2 -иминобисэтанола, которые обладают р-адреноблокирующей ак- тивностью.
: Цель изобр етения - получение но- производных 2,2 -иминобисэтанола
которые обладают ценными биологически активными свойствами. .
Пример 1. В течение недели перемешивают 1,3 ч, (В)-5-бром-3,Д- дигидро-2-оксиранил 2Н-1-бензпирана
в 64 ч. метабола, насыщенного аммиа- ком. Продукт фильтруют (и откладыва-
ют), а фильтрат испаряют. Остаток переносят в метанол и обрабатывают 2,1 ч. (В)-6-бром-3,4-дигидро-2-ок-
сиранил-2Н-1-бензпирана, после чего п(гремешивают при кипячении 3ч. Про-
дукт фильтруют и кристаллизуют вместе с отложенным продуктом-из ацето
нитрила с получением 0,96 ч.(36,4%)
(В,В)-о(, о( - иминобис(метилен5|бис
.6-бром-3,4-дигидро-2Н-1-бензпиран- 2-метанола, т.пл. 195,4°С (1).
П р и м е р 2. Смес ь 1,5 ч. (А)- Зз4-дигидро-2-оксиранил-2Н-1-бензпи-
ран-6-карбонитрила; 1,45 ч. (В)-о(- (аминометил)-3,4-дигидро-2Н-1-бенз-
пиран-2-метанола и 40 ч. этанола перемешивают с кипячением сутки. Продукт кристаллизуют при охлаждении,
фильтруют и сушат с получением 1,2ч. (40,5%) (А;в)-2-Г2- 2-(3,4-дигидро-
2Н-1-бензпиран-2-ил)-2-гидроксиэтил амино -1 -гидроксиэтил -3,4-дигидро--
2Н-1-бензпиран-6-карбонитрила, т.пл. 154 С (2).
По аналогичной методике при эквивалентных количествах соответствующих
исходных продуктов получены еледзтощие соединения, представленные в
табл. 1 формулы А
Пример 3. По методике приме-
ра 2, используя соответствующие исходные соединения, получают соедине
Q
5 0
5
О
5
0
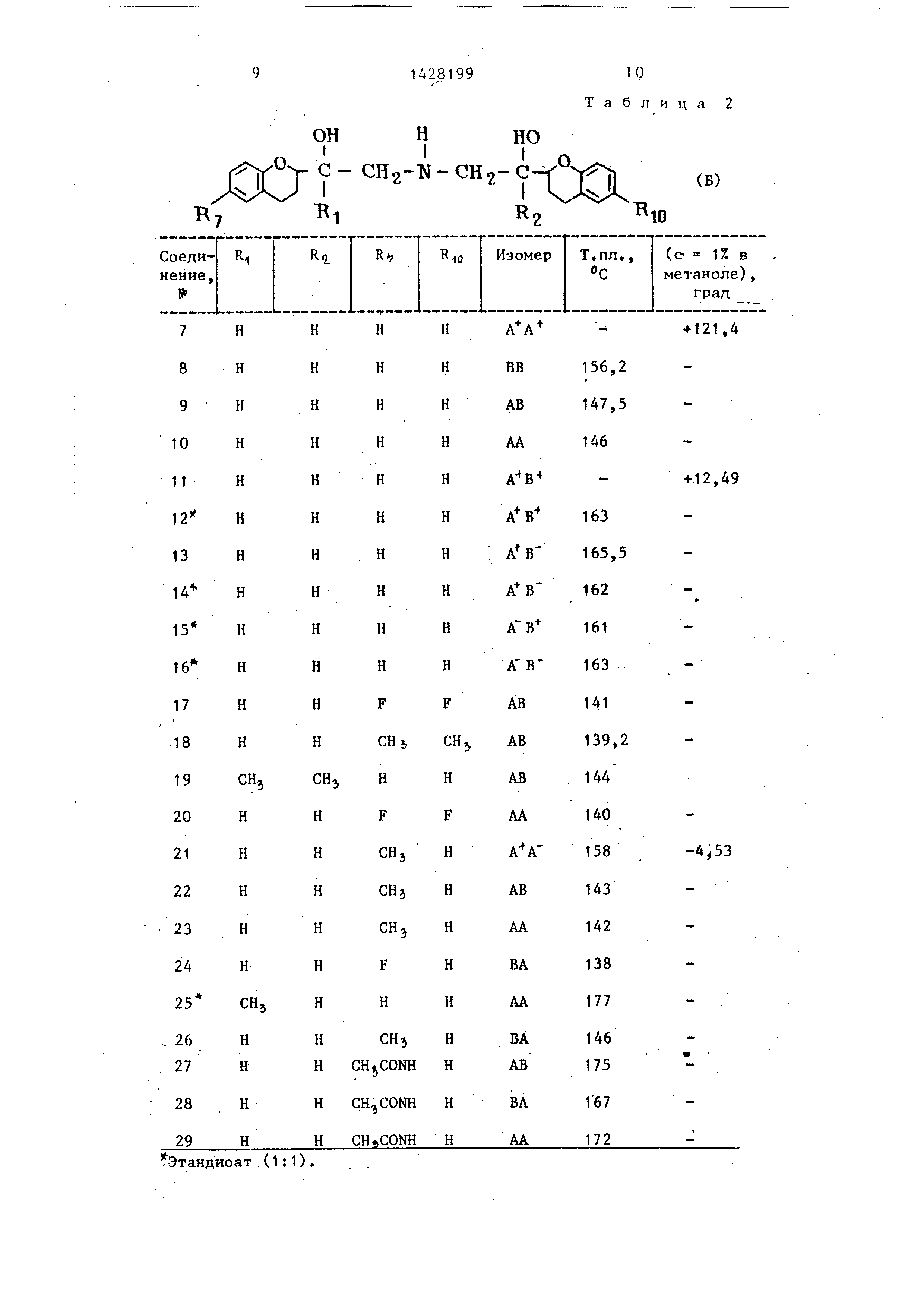
НИН, представленные в табл. 2 и 3 формулы Б и В.
Аналогичным способом также получены: (А,А)-0(, сУ -(иминобисметил)бис
2,З-дигидро-2-бензпиранметанолЗ, т.пл. 154,2 С (соединение 65); (А,А)-
(X- 2-(3,4-дигидро-2-Н-1-бензпиран 2-ил)-2-гидроксиэтил7 амино1метил1-
3,4-дигидро-2-метил-2Н, 1-бензпиран- 2-метанол, зтандиоат, т.пл. 179 с (соединение 66); (А,А)(имино-
бисметйлен)бис Гз,4-дигидро-2-метил- 2Н-1-бензпиран-2-метанолТ, хлоргид-
рат, моногидрат, т.пл. 134,5 С (соединение 67); (А,В)-о((3,4-дигид-
po-2H-1-бeнзпиpaн-2-ил)-2-гидpoкcи- этил аминоJ-метилJ-3,4-дигидро-2-
метил-2Н-1-бензпиран-2-метанол, этан- диоат (1:1), моногидрат, т.пл.165,8 (соединение 68); (В,А)(3,4-
дигидро-2Н-1-бензпиран-2-ил)-2-гидро- ксиэтил7аминоТ метил 1-3,4-ДИГИДРО-2-
метил-2Н-1-бензпиранил-2-метанол, этандиоат (1:1), т.пл. 165,2 с (соединение 69) .
Пример 4. В 120 ч. этанола переносят 11 ч. (А,В)-о(., о - иминобис
(метилен)З бис б-фтор-3,4-дигидро-2Н- бензпиран-2-метанола1 и к полученной
смеси добавляют 8 ч. 2-пропанола, на- сьш1енного хлористым водородом. После
перемешивания в течение 1 ч продукт отфильтровывают и дважды кристаллизуют
из этанола. Полученный продукт отфильтровывают и переносят в три-
хлорметан. Органический слой последовательно промывают 5%-ным раствором
гидроокиси натрия, 1%-ным раствором гидроокиси натрия и водой, сушат,
фильтруют и испаряют. Твердый остаток переносят в кипящий ацетонитрил,
и продукт кристаллизуют с получением 0,9 ч. (АВ)| -0, о(. -(иминобис(метилен)
бис б-фтор-3,4-дигидро-2Н-1-бензпи- ран-2-метанола1, т.пл. 156, С (соединение 70).
ПримерЗ. В12Пч. этанола переносят 11 ч. (Л,В),-о(, сС - имино-
бис(метилен) бис б-фтор-3,4-дигидро- 2Н-1-бензпиран-2-метанолаТ и к полученной
смеси прибавляют 8 ч. 2-пропа нола, насьпденного хлористым водородом . Осадок отфильтровывают, а фильтрат
испаряют. Остаток переносят в 80 ч. кипящего этанола. Выпавший осадок отфильтровывают, а фильтрат испаряют
. Остаток переносят в трихлорме- тан. Органический слой последовательно
промывают 10%-ным раствором гидроокиси натрия и водой, сушат, фильтруют и испаряют. Остаток дважды пере-
кристаллизовывают из ацетонитрила. Продукт фильтруют и сушат с получением
2 ч. (А,В)4-0, о - иминобис(метилен ) ,4-дигидро-2Н-1-бензпиран- 2-метанола1, т.пл. 161, (соединение
71 У.
П р и м .6 р 6. В 30 ч. этанола растворяют 10 ч. хлоргидрата ()-
оС, ct -Симинобис(метилен)бис 1з,4-ди- ГИДРО-2Н-1-бензпиран-2-метанолаJ,
после чего добавляют 20 ч. 10%-ного раствора гидроокиси натрия. Затем
смесь трижды экстрагирутот трихлор- метаном. Объединенные органические фазы испаряют, а остаток сушат в
вакууме при 80°С с получением 4,4 ч. (А A )-«i, о( - иминобис (метилен) бис
3,4-ДИГИДРО-2Н-1-бензпиран-2-мета- нола , т. пл. 130,8°С, (0)589 +121,50 (с 1% CHjOH) (соединение
7 ) .
Полезные характеристики -адрено-
рецептор-блокирующей активности соединений (1) иллюстрируются испытаниями
in vitro с использованием испытания на правом предсердии морских свинок
и испытания н.а трахеальном кольце морских свинок.
1. Испытание на правом предсердии морских свинок ().
У морских свинок (400+50 г) вырезают самопроизвольно бьющиеся правые
предсердия. Треугольную полоску предсердия , включающую синусно-предсерд-
ный узел, вырезают вместе с передней полой веной. Вену закрепляют на стек-
лянном мьш цедержателе, а противоположную предсердную мышцусоединяют с изометрическим датчиком Грасса.
Предсердия подвешивают с приложением оптимальной преднагрузки в 10П мл
раствора Кребса-ХензелаГгга, содержащем 2 г/л глюкозы, при 37,5°Си аэриру0
5
0
5
0
5
0
5
0
5
ют 95% Oj, и 5% СО . Частоту сокраще-. НИИ и сокращающее усилие записывают
с помощью изометрического датчика Грасс FT03C. Выходные сигналы уси- . ливают усилителем изометрического
датчика (J.S.1) через кардиотахометр (J.S.1) и записывают на XYY -самописце
Ханнуэлл. По истечении 45-минутного периода стабилизации производят
инфузию изопреналина с линейно возрастающими дозами на протяжении 7 мин.
Это вызывает связанное с дозой увеличение частоты сокращений (а), После
вымывания изопреналина следует 15-минутный период стабилизации. Затем на
протяжении 30 мин в среду ванны добавляют изучаемое лекарственное средство
. На протяжении этаго периода инкубирования определяют возможные прямые хронотропические и инотропи-
ческие эффекты лекарственного средства . Вслед за этим получают вторую
кривую доза-отклик для изопреналина при инфузии на протяжении 10 мин (Ь) .
I Графически оценивают угол увехййче- ния частоты сокращений для каждого
периода добавления изопреналина и рассчитывают отношение Ь/а. На основании
экспериментов с использованием растворителей отношение, меньшее 0,70, считается критерием ингибиру
ющей активности. Значения .оцениваются графически.
2. Испытание на трахеальном кольца морских свинок ((j).
У морских свинок (400+50 г) вырезают трахею. Из каждой трахеи вырезают
четыре кольца, приблизительной шириной 8 мм. Хрящевые участки трахе-
ального кольца устанавливают горизонтально между двумя металлическими
тягами, одна из которых крепится к стеклянному держателю.органа, а другая
соединена с изометрическим дат-. чиком Грасса. Благодаря такой конструкции
гладкая мьш1ца трахеи подвеши-. вается оптимальным образом,.т.е. между
хрящевыми участками. Препарированные кольца подвешивают в камере для
ор гана на 100 мл, заполненной раствором Tyrode, выдерживаемом при 15 С
и аэрируемом 95% Oj и 5% COg. Препарат на протяжении эксперимента сохраняют
в состоянии натяжения с усилием 1,5 г. Записываемые изменения натяжения являются таким образом выра-.
жением сокращения или релаксации. По прошествии периода стабилизации
где R и R - водород или G,-С -алкил; .
ЕЗ и Кд - водород, или метил; RJ - водород; Rg - водород, метил или метоксигруппа;
- водород или галоген; С -С4-алкил, ацетил- аминогруппа, циано-
группа, гидроксигруппа или метилсульфониламиногруппа; Rj - водород или С -С -апкил;
R c - водород; водород или галоген,
. гидроксигруппа или
С -Сл-алкил,
ли их кислотно-аддитивных солей, ли их стереохимически изомерных орм, отличающийся тем,
то амин общей формулы
Ьн
, 1
Bi7-C-C5H2- NH2
F
где R имеет указанные значения;
D;j-группа
«8
где Rj, Rj-Rj имеют указанные зна ения ,
подвергают взаимодействию с окисью
этилена
HgC
/%
С
I R,
D,
где R2 имеет указанные значения ,
40 DJ-группа где R, R и имеют указанные значения ,
в среде низшего алканола при кипячении и выделяют целевой продукт в виде
основания или в виде кислотно-аддитивной соли действием соответствующей
кислоты, и/или переводят соль в
основание действием щелочи, и/или переводят
ее в стереохимически изомерную форму.
2, Способ получения производных
2,2 -иминобисэтанола формулы
К.
Ка
Ri OHОННц
С-СНг- Н-СН2-С R ,
RI и Rj - водород или С.-Сл-алкил; R; и R - водород или метил;
RS - водород; . Rg - водород, метил или
метоксигруппа; .Rf - водород или галоген С -С -алкил, ацетил-
аминогруппа, циано- группа, гидроксигруп- па или метилсульфонил-
аминогруппа; Rg - водород или С -Сд-алкил;
Rg - водород;
R - водород или галоген, гидроксигруппа или С, -С -алкил,
их кислотно-аддитивных солей, их стереохимическй изомерных , отличающийся тем,
амин общей формулы
ОН Dg-C-CH NHg
R2
К4, имеет указанные значения, ynna
ОН но
II
Соль с этандикарбоновой кислотой
(1:1).
T iT-vOv
где RO и имеют указанные значения ,
подвергают взаимодействию с окисью
этилена общей формулы
,О
15
где R имеет указанные значения.
20
D -группа
в среде низшего алканола при кипячении и выделяют целевой.продукт в виде
основания или переводят его в кислотно-аддитивную соль действием
соответствующей кислоты, и/или кислотно-аддитивную соль переводят в основание действием щелочи, и/или
переводят ее в стереохимическй изомерную форму,
Т а б -л и ц а 1
7
8
9
10 11 12
13 14 15 16 17 18 19 20 21 22 23 24 25
26 27
28 29
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
CHj
Н
Н
Н
Н
Н
CHj
Н Н
Н Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
СНз
Н
Н
Н
Н
Н
Н
Н
Н
Н Н
Н Н Н Н Н Н Н Н Н Н F
СНь Н F
CHj СНз СНэ . F Н
СН5 CHjCONH
CHfiCGNH
Этандиоат (1:1).
Таблица 2
СН2-С
(Б)
j
вв
АВ АА А- В
А В
А ВА ВА В
А В
АВ
АВ
АВ
АА
АА ВА АА ВА
АВ
ВА АА
156,2 147,5 146
163
165,5
162
161
163
141
139,2
144
140
158
143
142
138
177
146 175
167 172
+121,4
+12,49
-4,53











Комментарии