Этиловый эфир (5z)-2-амино-5-[1-бром-2-(4-бромфенил)-2-оксоэтилиден]- 4-оксо-1н-4,5-дигидрофуран-3-карбоновой кислоты, проявляющий противогрибковую активность - RU2654207C1
Код документа: RU2654207C1
Описание
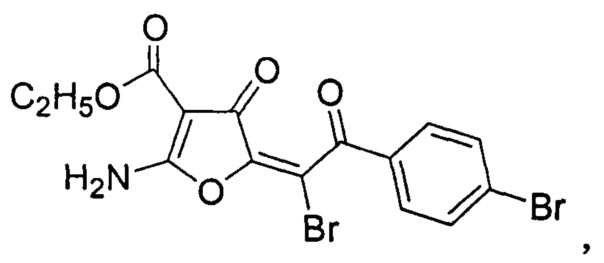
Изобретение относится к области органической химии, к производным 2-аминофурана, а именно к новым биологически активным веществам - этиловому эфиру (5z)-2-амино-5-[1-бром-2-(4-бромфенил)-2-оксоэтилиден]-4-оксо-1H-4,5-дигидрофуран-3-карбоновой кислоты формулы:

Соединение обладает противогрибковой активностью и, следовательно, может найти применение в качестве лекарственного противогрибкового препарата.
Известны структурные аналоги заявляемого соединения, получаемые взаимодействием 5-арил-2,3-дигидро-2,3-фурандионов с циануксусным эфиром [Иванов Д.В., Игидов Н.М., Рубцов А.Е. Синтез производных 2-амино-5-(2-арил-2-оксоэтилиден)-4-оксо-1H-4,5-дигидрофуран-3-карбоновых кислот рециклизацией 5-арилфуран-2,3-дионов под действием производных цианоуксусной кислоты // Журн. орган, химии - 2016. - Т. 52, вып. 5. - С. 691-695]

В качестве эталона сравнения нами был взят противогрибковый препарат флуконазол [Celeste De Monte, Simone Carradori, Bruna Bizzarri, Adriana Bolasco et al / Anti-Candida activity and cytotoxicity of a large library of new N-substituted-1,3-thiazolidin-4-one derivatives // European Journal of Medicinal Chemistry 2016, 107, P. 82-96].
Задачей предлагаемого изобретения является получение нового, не описанного ранее этилового эфира (5z)-2-амино-5-[1-бром-2-(4-бромфенил)-2-оксоэтилиден]-4-оксо-1H-4,5-дигидрофуран-3-карбоновой кислоты, обладающего противогрибковым действием.
Поставленная задача достигается взаимодействием этилового эфира (5Е)-2-амино-5-[2-(4-бромфенил)-2-оксоэтилиден]-4-оксо-1H-4,5-дигидрофуран-3-карбоновой кислоты с бромом в среде хлороформа по схеме:
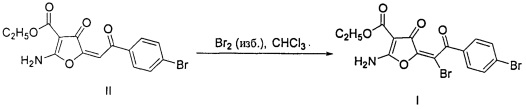
Пример 1. Получение соединения (I).
К 3 ммоль (1,10 г) этилового эфира (5Е)-2-амино-5-[2-(4-бромфенил)-2-оксоэтилиден]-4-оксо-1H-4,5-дигидрофуран-3-карбоновой кислоты II, растворенного в 40 мл абсолютного хлороформа, добавляли 10%-ный избыток брома (3,3 ммоль, 0,528 г) и кипятили в течение 20-30 минут до окончания выделения бромоводорода. Растворитель упаривали, сухой остаток перекристаллизовывали из этанола.
Получали 0,67 г (48%) бесцветного кристаллического вещества (I) с Тпл 232-234°С. C15H11Br2NO5. ИК-спектр, см-1: 3356 (NH), 1716 (СООС2Н5), 1692, 1674, 1606, 1587 (С=С, С=O). Спектр ЯМР1Н, δ, м.д.: 1,17 (т, 3Н, COOCH2CH3), 4,12 (кв, 2Н, СООСН2СН3), 7,77 (м, 2Наром.), 7,87 (м, 2Наром.), 8,90 (с, 1Н, NH), 10,14 (с, 1H, NH).
Спектр ЯМР13С, δ, м.д.: 14,18, 58,96, 86,85, 99,86, 128,66, 131,01, 132,17, 132,89, 147,20, 162,49, 172,40, 174,59, 187,26.
Заявляемое соединение представляет собой бесцветное кристаллическое вещество, растворимое в ДМФА, уксусной кислоте, при нагревании - в этиловом спирте, устойчивое при хранении.
Пример 2. Исследование биологической активности.
Токсичность изучали на белых мышах (самках) массой 16-18 г при однократном внутрибрюшинном введении в виде взвеси в 2% крахмальной слизи. За животными вели наблюдение в течение 10 суток, фиксируя поведение, интенсивность и характер двигательной активности, наличие и характер судорог, координацию движений, тонус скелетной мускулатуры, реакции на тактильные, звуковые и световые раздражители, частоту и глубину дыхательных движений, ритм сердечных сокращений, состояние волосяного и кожного покрова, окраску видимых слизистых оболочек, потребление воды и пищи, изменение массы тела. Для исследуемого соединения 1 ЛД50 составляет >1200 мг/кг.
Рассчитывали острую токсичность, соблюдая рекомендации государственного фармакологического комитета по изучению общетоксического действия биологически активных веществ [Методические рекомендации по изучению общетоксического действия фармакологических средств. Утв. 25,12,97 / Вестн. фармакоп. комитета. - 1998. -№1. - С. 27-32].
Согласно классификации токсичности препаратов соединения I относятся к V классу практически нетоксичных препаратов [Измеров Н.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов при однократном воздействии: Справочник. М., 1977. - с. 196].
Противогрибковую активность определяли методом двукратных серийных разведений в жидкой питательной среде Сабуро [Руководство по проведению доклинических исследований лекарственных средств. - Ч. 1. - М.: Гриф и К, 2012. - С. 576-578]. Для испытуемого соединения (I) были определены минимальные подавляющие концентрации (МПК) в отношении фармакопейных штаммов С.albicans АТСС 885-653, С.albicans АТСС 10231, полученных из НИИ медицинской микологии им. П.Н. Кашкина ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, а также в отношении клинических штаммов С. krusei (1), С. krusei (2). Посевы производили в жидкую среду Сабуро с различной концентрацией испытуемых соединений. Исследуемые соединения в количестве 0,05 г растворяли в 5 мл диметилсульфоксида, 1 мл полученного разведения 1:100 соединяли с 4 мл жидкой среды Сабуро. Далее готовили ряд серийных разведений соединений с двукратно уменьшающейся концентрацией.
Культуры выращивали в пробирках на скошенной агаризированной среде (плотная среда Сабуро). Для определения противогрибковой активности использовалась 48-часовая культура. Для приготовления рабочей взвеси микроорганизмов производили смыв выросшей культуры изотоническим раствором натрия хлорида и устанавливали плотность микробной взвеси по стандарту мутности 5 единиц. Далее из полученной микробной взвеси готовили рабочий раствор с концентрацией 5×105 КОЕ/мл. Данную взвесь вносили в количестве 0,1 мл в пробирки с серийными разведениями изучаемых соединений. Таким образом, микробная нагрузка при определении противогрибковой активности составила 2-2,5×104 КОЕ/мл.
Учет результатов производили через 48 часов выдержки контрольных и опытных пробирок в термостате при температуре 24°С±1°С. Минимальную подавляющую концентрацию (МПК) устанавливали по отсутствию признаков роста на питательной среде: последняя пробирка с задержкой роста (прозрачная) соответствует МПК соединения в отношении данного штамма.
Фунгистатический эффект исследуемого соединения I сравнивали с действием флуконазола [Celeste De Monte, Simone Carradori, Bruna Bizzarri, Adriana Bolasco et al. / Anti-Candida activity and cytotoxicity of a large library of new N-substituted-1,3-thiazolidin-4-one derivatives // European Journal of Medicinal Chemistry 2016, 107, P. 82-96]. Результаты испытаний представлены в таблице 1.
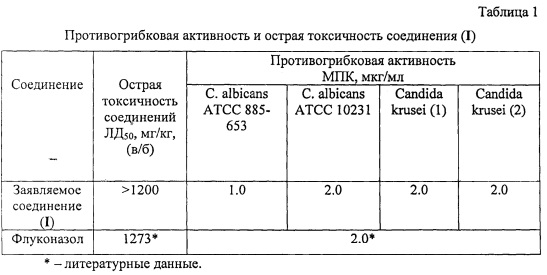
Как видно из таблицы 1, заявляемое соединение (I) при практической равной токсичности по противогрибковой активности сравнимо с препаратом сравнения - флуконазолом по отношению к Candida albicans АТСС 10231, Candida krusei (1, 2) и превосходит его по отношению к Candida albicans АТСС 885-653.
Следовательно, заявляемое соединение может найти применение в медицине в качестве противогрибкового лекарственного средства.
Реферат
Изобретение относится к производным 2-аминофурана, а именно к новым биологически активным веществам - этиловому эфиру (5Z)-2-амино-5-[1-бром-2-(4-бромфенил)-2-оксоэтилиден]-4-оксо-1H-4,5-дигидрофуран-3-карбоновой кислоты формулы I , который может найти применение в качестве лекарственного противогрибкового препарата. Соединение (I) получают взаимодействием этилового эфира (5E)-2-амино-5-[2-(4-бромфенил)-2-оксоэтилиден]-4-оксо-1H-4,5-дигидрофуран-3-карбоновой кислоты с бромом в среде хлороформа. Это соединение представляет собой бесцветное кристаллическое вещество, растворимое в диметилформамиде, уксусной кислоте, при нагревании - в этаноле, устойчивое при хранении. Технический результат - получение соединения, обладающего выраженным противогрибковым действием с минимальной подавляющей концентрацией 2.0 мкг/мл в отношении Candida albicans АТСС 10231, 1.0 мкг/мл в отношении Candida albicans АТСС 885-653. 1 табл., 2 пр.
Формула

Комментарии