Способ получения производных таксана и производные таксана - RU2095356C1
Код документа: RU2095356C1
Чертежи

Описание
Изобретение относится к
способу получения производного таксана общей формулы

в которой R является трет.бутокси или фенилом, R1 является атомом водорода или ацетилом, а Ar является фенилом, незамещенным или замещенным атомом галогена, С1-С4 алкилом или С1-С4 алкоксилом.
Изобретение также относится к новым производным таксана общей формулы (I), в которой R1 является атомом водорода, R является трет.бутокси или фенилом и Ar является замещенным фенилом или α или b нафтилом, необязательно замещенным, как указано ранее, т.е. к производным таксана формулы (Ia).

Более конкретно изобретение относится к новым производным таксана общей формулы (Ia), в которой Ar является фенилом, замещенным одним или несколькими атомами или радикалами, идентичными или различными, выбранными среди атомов галоида и алкилов, алкокси, амино, алкиламино, диалкиламино, ациламино, алкоксикарбониламино и трифторметила.
Еще более конкретно изобретение относится к продуктам общей формулы (II), в которой Ar является фенилом, замещенным атомом хлора или фтора, или алкилом (метилом), алкокси (метокси), диалкиламино (диметиламино), ациламино (ацетиламино) или алкоксикарбониламино (трет.бутоксикарбониламино).
ЕР-А-О 253 739 описано получение таксола из таксотера 3-трет.бутоксикарбониламино-3-фенил-2-оксипропионат-/2R, 3S/-4-ацетокси-2-бензоилокси-5β, 20-эпокси-7b, 10b-диокси-9-оксо-11-таксен-13a-ила, который сам может быть получен согласно способу, описанному в ЕР-А-О 336 841, путем конденсации 3-трет. бутоксикарбониламино-3-фенил-2-окси (защищенный) кислоты с 10-дезацетилбакксатином III, соответственно защищенным. Таксол и таксотер обладают противоопухолевыми и противоязвенными свойствами. Согласно Chem. Abstr. 114 945669 g, метаболиты таксола, которые являются гидроксильными производными по фенильному ядру в положении -3' или по фенильному ряду бензоила в положении -2, являются менее активными, чем таксол.
Согласно изобретению, производные таксана общей формулы (I) могут быть получены следующим образом:
1. Производное оксазолидина общей формулы

в которой Ar имеет указанные ранее значения. Boc является трет.бутоксикарбонилом и R6 и R7, одинаковые или различные, являются алкилом, содержащим 1-4 атома углерода, в некоторых случаях замещенным одним или несколькими арильными радикалами (фенил), или арилом (фенилом), или R6 и R7 образуют вместе с атомом углерода, к которому они присоединены, 4-7-членный цикл, конденсируют с производным таксана общей формулы:
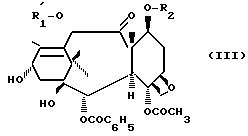
в которой R является ацетилом или группой, защищающей гидроксильную функцию, такой, как 2,2,2-трихлорэтоксикарбонил, и R2 является группой, защищающей гидроксильную функцию, такой, как 2,2,2-трихлорэтоксикарбонил или триалкилсилил, каждая алкильная часть которого содержит 1-4 атома углерода, чтобы получить продукт общей формулы
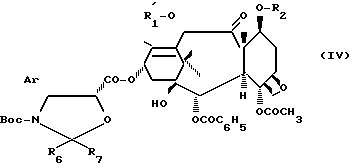
в которой Ar, R
Обычно этерификацию проводят в присутствии агента конденсации, такого, как карбодиимид, например дициклогексилкарбодиимид, или карбонатного реагента, например 2-дипиридилкарбоната, и агента активации, такого, как диалкиламинопиридин, например 4-диметил-аминопиридин, работая в органическом растворителе, таком, как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре 60 90oС.
Особенно выгодно использовать молярный избыток кислоты формулы (II) по отношению к производному таксана формулы (III), конденсирующий агент используют в стехиометрическом количестве по отношению к кислоте формулы (II), а активирующий агент используют в стехиометрическом количестве по отношению к производному таксана формулы (III).
Продукт общей формулы (IV), в которой



в которой Ar, R
Этерификация может быть осуществлена в указанных выше условиях.
Продукт общей формулы (IVa) может быть получен при обработке сложного эфира общей формулы (IV), в которой R2 является триалкилсилилом, каждая алкильная часть которого содержит 1-4 атома углерода, газообразным хлористым водородом в спирте, таком, как этанол.
Продукт общей формулы (IV), в которой R2 является 2,2,2-трихлорэтоксикарбонилом, может быть получен при обработке продукта общей формулы (IVa) 2,2,2-трихлорэтилхлорформиатом в таком основном органическом растворителе, как пиридин.
2. Продукт общей формулы (IV), в которой R2 является 2,2,2-трихлорэтоксикарбонилом, обрабатывают минеральной или
органической кислотой, возможно в спирте, в условиях, которые не оказывают влияния на защитные группировки R
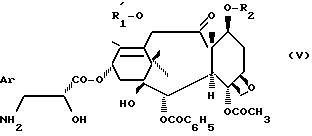
в которой Ar и R
Обычно используют муравьиную кислоту, при необходимости в спирте, таком, как этанол, или газообразный хлористый водород в спирте, таком, как этанол.
3. Продукт общей
формулы
(V) обрабатывают соединением, которое позволяет вводить в аминную функцию трет. бутоксикарбонильный радикал или бензоил, чтобы получить продукт общей формулы:
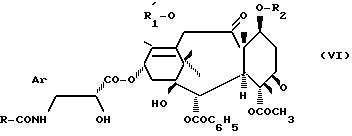
в которой Ar, R и R
Обычно проводят реакцию ди-трет. бутилкарбоната или бензоилхлорида с продуктом общей формулы (VI), работая в органическом растворителе, таком, как метиленхлорид, в присутствии минерального основания, такого, как бикарбонат натрия, или органического основания, такого, как третичный амин, например триэтиламин.
4. Продукт общей формулы (VI) превращают в продукт общей формулы (I) при замене 2,2,2-трихлорэтоксикарбонильных группировок, представленных R
Обычно продукт общей формулы (VI) обрабатывают цинком в присутствии уксусной кислоты при температуре 30 60o или минеральной или органической кислотой, такой, как соляная кислота или уксусная кислота, в алифатическом спирте, содержащем 1-3 атома углерода, в присутствии цинка.
Продукт общей формулы (III) может быть получен в условиях, описанных в европейском патенте ЕР N 0336841.
Кислота общей формулы (II) может быть получена путем омыления в щелочной среде сложного эфира общей формулы:

в которой Ar, R6 и R7 имеют указанные выше значения, а R3 является алкилом, содержащим 1-4 атома углерода, возможно замещенным фенилом.
Обычно омыление проводят с помощью минерального основания, такого, как гидроксид щелочного металла (лития, натрия, калия), карбонат или бикарбонат щелочного металла (бикарбонат натрия, карбонат или бикарбонат калия), в водно-спиртовой среде, такой, как смесь метанол-вода, при температуре 10 - 40oС, предпочтительно близкой к 20oC.
Сложный эфир общей формулы (VII) может быть получен при действии метоксиалкена, возможно замещенного одним или несколькими арильными радикалами (2-метоксипропен), гем-диметоксиалкана,
возможно замещенного одним или несколькими арильными радикалами (2,2-диметоксипропан), или гем-диметоксициклоалкана, содержащего 4-7 атомов углерода, на производное фенилизосерина общей формулы

в которой Ar и R3 имеют указанные ранее значения, в виде рацемата или предпочтительно в 2R,3S-форме.
Обычно реакцию метоксиалкена или гем-диметоксиалкана, или гем-диметоксициклоалкана с продуктом общей формулы (VIII) проводят, работая в инертном органическом растворителе в присутствии сильной кислоты, такой, как п-толуолсульфоновая кислота, при температуре между 0oC и температурой кипения реакционной среды. Растворители, которые особенно пригодны, выбраны среди ароматических углеводородов (бензол, толуол, ксилол).
Продукт общей формулы (VIII) может быть получен путем ацилирования производного β-фенилизосерина
общей формулы:

в которой Ar и R3 имеют указанные выше значения.
Реакцию обычно проводят при взаимодействии дитрет.бутилдикарбоната в инертном органическом растворителе, таком, как сложный эфир, например метилацетат или этилацетат, при температуре 0 40o C, предпочтительно около 20oC.
Производное β-фенилизосерина общей формулы (IX) может быть получено при восстановлении окси-азида общей формулы:

в которой Ar и R3 имеют указанные выше значения.
Обычно восстановление проводят с помощью водорода в присутствии катализатора, такого, как палладий на угле, работая в инертном органическом растворителе, таком, как этилацетат, предпочтительно работают при температуре 0 50oC. Выгодно проводить гидрирование под давлением 1 5 бар.
Продукт общей формулы (X) может быть получен при действии азида щелочного металла, такого, как азид натрия, на сложный
эфир β-фенилглицидиловой кислоты общей формулы:

в которой Ar и R3 имеют указанные ранее значения.
Обычно работают в водно-органической среде, такой, как смесь вода-тетрагидрофуран, при температуре кипения с обратным холодильником реакционной смеси.
Сложный эфир общей формулы (XI) может быть получен дегидрогалогенированием продукта общей формулы:
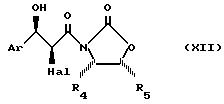
в которой Ar имеет указанные ранее значения, Hal является атомом галоида, предпочтительно атомом брома, а R4 и R5, одинаковые или различные, являются атомом, содержащим 1-4 атома углерода, или фенилом.
Обычно работают в присутствии избытка алкоголята щелочного металла, при необходимости полученного in situ, в инертном органическом растворителе, таком, как тетрагидрофуран, при температуре -80oC +25oC.
Продукт общей формулы (XII) может быть получен при действии альдегида общей формулы
(XIII):
Ar-CHO
в которой Ar имеет указанные ранее значения, с галоидным соединением общей формулы:

в которой Hal, R4 и R5 имеют указанные ранее значения, предварительно анионизированным.
Обычно работают в среде инертного органического растворителя, выбранного среди простых эфиров (этиловый эфир) и галоидированных алифатических углеводородов (метиленхлорид), при температуре -80oC 25oC, в присутствии третичного амина (триэтиламин) и энолизирующего агента (ди-н-бутилбортрифлат).
Продукт общей формулы (XIV) может быть получен при действии галоидангидрида галоидуксусной кислоты, предпочтительно бромида бромуксусной кислоты на соответствующий оксазолидинон.
Протонные спектры ядерного магнита резонанса снимали в деитерированном хлороформе. В
соответствии с природой боковой цепи нумерация атомов является следующей:

Использованные сокращения обозначают следующее: с синглет, д дублет, дд двойной дублет, т триплет, к квадруплет, м массив.
Пример 1. Раствор 0,5 г 3-трет.бутоксикарбониламино-3-/4-метилфенил/-2-окси-/2R, 3S/- пропионат-4-ацетокси-2α-бензоилокси-b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a или в смеси 10 мл метанола и 10 мл уксусной кислоты нагревают при перемешивании в атмосфере аргона до температуры около 60oC, потом добавляют 1 г цинкового порошка. Затем реакционную смесь перемешивают 30 мин при 60oC, охлаждают до температуры, близкой к 20oC, и фильтруют через плавленое стекло с целитом. Плавленое стекло промывают 3 раза 10 мл дихлорметана, фильтраты объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40oC.
К остатку прибавляют 20 мл дистиллированной воды и отфильтровывают
твердые
кристаллы, промывают 4 раза 5 мл дистиллированной воды и сушат при пониженном давлении (0,27 кПа) при 20oC в течение 16 ч. Получают 0,25 белой пены, которую очищают хроматографией
на 40 г
оксида кремния (0,063-0,2 мм), находящихся в колонке диаметром 2 см (элюент: дихлорметан-метанол (97-3 по объему), собирая фракции по 20 мл. Фракции 5-12 объединяют и концентрируют досуха при
пониженном давлении (0,27 кПа) при 40oC в течение 16 ч. Таким образом получают 0,2 г 3-трет.бутоксикарбониламино-3-/4-метилфенил/-2-окси-/2R,3S/- пропионат-4-ацетокси-2a-бензоилокси-5b,
20-эпокси-1,7b, 10b-триокси-9-оксо-11-таксен-13 a -ила в виде белой пены, которая имеет следующие характеристики:
удельное вращение: (a)20D -32o (с 0,1, метанол)
ЯМР-спектр /250 МГц, CDCl3/ d /ппм/: 1,14/с, 3Н: -CH3 16 или 17/; 1,24 /с, 3Н: -CH3 16 или 17/; 1,35 /с, 9Н: -C/CH3/3/; 1,7 /c, 1H: -OH
1/; 1,77
/c, 3H: -CH3 19/; 1,85 /м, 1H: y/CH/H6/; 1,87 /c, 3H: -CH3 18/; 2,26 /м, 2H: -CH2- 14/; 2,33 /c, 3H: -COCH3/; 2,4 /c, 3H: CH3-C6H4/; 2,6 /ддд, 1H, J 6,5 и 15 Гц: -/CH/-H6/; 3,38 /д, 1H, J 5,5 Гц: -OH 2'/; 3,92 /д, 1H, J 7 Гц -H3/; 4,18 /д, 1H, J 8 Гц: -/CH/-H20/; 4,22 /м, 2H: -H7 и -OH 10/; 4,33 /д, 1H, J 8
Гц:
-/CH/-H20/; 4,6 /м, 1H: -H2'/; 4,96 /дд, 1H, J 1,5 и 9,5 Гц: -H5/; 5,22 /c, 1H: -H 10/; 5,22 /м, 1H: -H3'/; 5,4 /д, 1H, J 9 Гц: -NHCO-/; 5,68 /д, 1H: -H J 7 Гц: -H2/; 6,2 /т, 1H, J 9 Гц: -H13/; 7,
23
/AB, 4H, JAB 8 Гц: CH3-C6H-4/; 7,5 /т, 2H, J 7,5 Гц: -OCOC6H5/-H3 и -H5/; 7,62 /тт, 1H, J 1 и 7,5 Гц: -OCOC6H5
/-H4//; 8,12 /д, 2H, J 7,5 Гц: -OCOC6H5/-H2 и -H6//.
3-Трет. бутоксикарбониламино-3-/4-метилфенил/-2-окси-/2R, 3S/пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ил может быть получен следующим образом.
К раствору 0,45 г 3-амино-2-окси-3/4-метилфенил/-4-ацетокси/2R, 3a/пропионат-2a-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила в 5 мл дихлорметана, выдерживаемому в атмосфере аргона, прибавляют 0,037 г бикарбоната натрия, потом по каплям при температуре около 20oC прибавляют раствор 0,108 г ди-трет.бутилдикарбоната в 5 мл дихлорметана. Полученный раствор перемешивают 24 ч при температуре около 20oC, потом прибавляют смесь 15 мл дистиллированной воды и 20 мл дихлорметана. Водную фазу отделяют декантацией, потом повторно экстрагируют с помощью 20 мл дихлорметана. Водную фазу отделяют декантацией, потом повторно экстрагируют с помощью 20 мл дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом, получают 0,5 г 3-трет. бутоксикарбониламино-3-/4-метилфенил/-2-окси-/2R, 3S/ пропионата-4-ацетокси-2aбензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила в виде белой пены.
3-Амино-2-окси-3-/-4-метилфенил/-4-ацетокси/2R,3S/ пропионат-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b -бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ил может быть получен следующим образом.
Раствор 0,6 г 3-трет.бутоксикарбонил-2,2-диметил-4-/4-метилфенил/-5-оксазолидинкарбоксилат /4S, 5R/4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2, 2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила в 6 мл муравьиной кислоты перемешивают 4 ч при температуре около 20oC, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. К остатку прибавляют 40 мл толуола, потом концентрируют полученный раствор при пониженном давлении (2,7 кПа) при 40oC. Повторяют операцию с 40 мл толуола. Полученную пену растворяют в 50 мл дихлорметана и к полученному раствору прибавляют 25 мл насыщенного водного раствора бикарбоната натрия. Водную фазу отделяют декантацией и повторно экстрагируют 25 мл дихлорметана. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 0,65 г белой пены, которую очищают хроматографией на 40 г оксида кремния (0,063-0,2 мм), находящегося в колонке диаметром 2 см (элюент: дихлорметан-метанол (98-2 по объему), собирают фракции по 20 мл. Фракции 5-9 объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40oC. Таким образом получают 0,45 г 3-амино-2-окси-3-/4-метилфенил/-4-ацетокси/2R, 3S /пропионат-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила в виде белой пены.
3-Трет. бутоксикарбонил-2,2-диметил-4-/4-метилфенил/-5-/4S,
5R/- оксазолидинкарбоксилат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b,
10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ил может быть получен следующим образом.
К раствору 0,4 г 3-трет.бутокси карбонил-2,2-диметил-4-/-метилфенил/-5-/4S, 5R/-оксазолидинкарбоновой кислоты в 10 мл толуола прибавляют 0,247 г N,N-дициклогексилкарбодиимида, 0,675 г 4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1,13a-диокси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксена и 0,046 г 4-диметиламинопиридина. Реакционную смесь затем 3 ч нагревают при перемешивании при температуре около 80oC, потом охлаждают до температуры около 20oC и прибавляют смесь 20 мл дихлорметана и 25 мл водного насыщенного раствора бикарбоната натрия. Отделяют водную фазу декантацией, потом повторно экстрагируют 15 мл дихлорметана. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 50oC. Получают 1,1 г желтой пены, которую очищают хроматографией на 40 г оксида кремния (0,063-0,2 мм), находящегося в колонке диаметром 2 см (элюент: дихлорметан-метанол (98-2 по объему), собирают фракции по 15 мл. Объединяют фракции 3-6 и концентрируют досуха при пониженном давлении (2,7 мПа) при температуре около 40oC. Таким образом получают 0,6 г 3-трет.бутоксикарбонил-2,2-диметил-4-/4-метилфенил/-5-/4S,5R/- оксазолидинкарбоксилат-4-ацетокси-2a -бензоил-окси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис/2,2, 2-трихлорэтокси/-карбонилокси-11-таксен-13а-ила в виде белой пены.
4-Ацетокси-2a-бензоилокси-5b, 20-эпокси-1,13a-диокси-9-оксо-7b, 10b бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен может быть получен согласно способу, описанному в европейском патенте ЕР N 0336841.
3-Трет. бутоксикарбонил-2,2-диметил-4-/-метилфенил/-5-оксазолидин-/4S, 5R/-карбоновая кислота может быть получена следующим образом.
К раствору 0,54 г этил-3-трет.бутиоксикарбонил-2,2-диметил-4-/4-метилфенил/-5-/4S, 5R/- оксазолидинкарбоксилата в 10 мл этанола прибавляют при температуре около 25oC раствор 0,19 г гидроксида лития в 3 мл дистиллированной воды. Реакционную среду перемешивают 20 мин при температуре около 25oC, потом концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Полученный остаток растворяют в 3,5 мл дистиллированной воды, потом экстрагируют 2 раза по 1 мл диизопропилового эфира. Затем водную фазу подкисляют до pH около 1 добавлением 5 мл 1Н водной соляной кислоты, потом 3 раза экстрагируют 4 мл дихлорметана. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Таким образом получают 0,43 г 3-трет. бутоксикарбонил-2, 2-диметил-4-/4-метилфенил/-5-оксазолидин-/4S, 5R/-карбоновой кислоты в виде оранжевого масла.
Этил-3-трет. бутоксикарбонил-2,2-диметил-4-/4-метилфенил/-5-оксазолидин-/4S, 5R/-карбоксилат может быть получен следующим образом.
Раствор 0,63 г этил-3-трет.бутоксикарбониламино-2-окси-3-4-/4- метилфенил/2R, 3S/-пропионата, 0,2 мл 2-метоксипропена и 3,4 мг пиридиний-п-толуолсульфоната в 18 мл толуола перемешивают в течение 2,5 ч при температуре около 20oC. Реакционную смесь нагревают до температуры кипения и собирают отгон в градуированный сосуд, в то время как прибавляют по каплям раствор 1,25 мл 2-метоксипропена в 15 мл толуола в реакционную среду, чтобы поддержать постоянный объем этой среды. После 15 мин отгона прибавляют 3,4 мг пиридиний-п-толуолсульфоната, потом продолжают отгонку в течение 15 мин. Объем отгона тогда составляет 20 мл. Реакционную среду охлаждают до температуры около 20oC, затем прибавляют 2 см3 насыщенного водного раствора бикарбоната натрия. Водную фазу декантируют, потом экстрагируют 2 раза 5 мл дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,3 кПа) при температуре около 40oC. Таким образом получают 0,54 г этил-3-трет.бутоксикарбонил-2,2-диметил-4-/4-метилфенил/-5/4S, 5R/-оксазолидинкарбоксилата в виде желтого масла.
Этил-3-трет.бутоксикарбониламино-2-окси-3-/4-метилфенил/- пропионат-/2R, 3S/ может быть получен следующим образом.
К раствору 0,8 г этил-3-амино-2-окси-3-/4-метилфенил/-/2R, 3S/-пропионата в 12 мл дихлорметана, выдерживаемому в атмосфере аргона, прибавляют 0,33 г бикарбоната натрия, потом по каплям при температуре около 20oC прибавляют раствор 0,94 г дитрет. бутил-дикарбоната в 4 мл дихлорметана. Полученный раствор перемешивают в течение 2,5 ч при температуре около 20oC, потом прибавляют 20 мл дистиллированной воды. Отделяют водную фазу декантацией, потом повторно экстрагируют 20 мл дихлорметана. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают после кристаллизации из циклогексана 0,65 г этил-3-трет.бутоксикарбониламино-2-окси-3-/4-метилфенил/-/2R, 3S/-пропионата, плавящегося при 130oC.
Этил-3-амино-2-окси-3-/4-метилфенил/-/2R, 3S/-пропионат может быть получен следующим образом.
К раствору 1,15 г этил-3-азидо-2-окси-3-/-метилфенил/-/2R, 3S/-пропионата в 35 мл этилацетата прибавляют 0,115 г 10%-го палладия на угле. Реакционную смесь перемешивают под давлением водорода 120 кПа при температуре около 22oC в течение 8 ч, потом фильтруют через спеченное стекло с целитом. Спеченное стекло промывают 5 мл этилацетата и объединяют фильтраты, потом концентрируют досуха при температуре около 40oС при пониженном давлении (2,7 кПа). Таким образом получают 0,83 г этил-3-амино-2-окси-3-/4-метилфенил/-/2R, 3S/-пропионата в виде светло-желтой пасты.
Этил-3-азидо-2-окси-3-/4-метилфенил/-/2R, 3S/-пропионат может быть получен следующим образом.
К раствору 2,2 г этил-3-/4-метилфенил/-2-/2R, 3R/-оксиранкарбоксилата в 60 мл этанола прибавляют 1,04 г азида натрия и 0,86 г хлористого аммония. Реакционную смесь перемешивают при кипячении с обратным холодильником 5,5 ч, потом охлаждают до температуры 20oC и прибавляют смесь 50 мл этилацетата и 50 мл дистиллированной воды. Отделяют водную фазу декантацией и снова экстрагируют 50 мл этилацетата. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40o C. Получают 2,4 г оранжевого масла, которое очищают хроматографией на 80 г оксида кремния (0,063-0,2 мм), находящегося в колонке диаметром 2 см (элюент: циклогексан-этилацетат (90-10 по объему), собирая фракции по 50 мл. Фракции 8-16 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Таким образом получают 1,55 г этил-3-азидо-2-окси-3-/4-метилфенил/-/2R, 3S/пропионата в виде оранжевого масла.
Этил-3-/4-метилфенил/-2-/2R, 3R/-оксиранкарбоксилат может быть получен следующим образом.
К раствору, охлажденному до -75oC, 2,3 мл этанола в 40 мл тетрагидрофурана прибавляют, поддерживая температуру -75oC, 25 мл 1,6М раствора н-бутиллития в гексане, потом по каплям прибавляют раствор 8,36 г 3-/2S, 3R/-[2-бром-3-окси-3/4-метилфенил/-1-оксопропил] -4-метил-5-фенил-2-/4S, 5R/-оксазолидинона в 120 мл тетрагидрофурана. Реакционную среду нагревают до температуры около 0oC, потом поддерживают температуру около 0oC в течение 1 ч и снова охлаждают до температуры около -75oC. Затем прибавляют, поддерживая температуру около -75oC, раствор 5,04 г лимонной кислоты в 28 мл тетрагидрофурана. Реакционную среду нагревают до температуры около 15oC, потом выдерживают температуру около 15oC в течение 1 ч и прибавляют смесь 40 мл дистиллированной воды и 200 мл диэтилового эфира. Водную фазу отделяют декантацией и снова экстрагируют 2 раза 50 мл диэтилового эфира. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 5,3 г оранжевого масла, которое очищают хроматографией на 200 г оксида кремния (0,063-0,2 мм), находящегося в колонке диаметром 2 см (элюент: циклогексан-этилацетат (90-10 по объему), собирая фракции по 50 мл. Объединяют фракции 10-20 и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Таким образом после кристаллизации из диизопропилового эфира получают 2,2 г этил-3-/4-метилфенил/-2-/2R, 3R/-оксиранкарбоксилата, плавящегося при 66oC.
3-/2S, 3R/-[2-бром-3-окси-3-/4-метилфенил/-1-оксопропил]-4-метил-5-фенил-2-/4S, 5R/-оксазолидинон может быть получен следующим образом.
К раствору 35,8 г 3-/2-бром-1-оксоэтил/-4-метил-5-фенил-2-/4S, 5R/-оксазолидинона в 300 мл безводного диэтилового эфира прибавляют при температуре около 20oC 23,4 мл триэтиламина, потом по каплям прибавляют 135 мл 1М раствора ди-н-бутилбортрифлата в дихлорметане. Реакционную среду охлаждают до температуры около -75oC, потом прибавляют, поддерживая температуру -75oC, 10,64 мл 4-метилбензальдегида и снова нагревают реакционную среду до температуры около 20oC и выдерживают при 20oC в течение 18 ч. Потом прибавляют 100 мл насыщенного водного раствора бикарбоната натрия и отделяют водную фазу декантацией, снова экстрагируют 2 раза 100 мл диэтилового эфира. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 69 г коричневого масла, которое очищают хроматографией на 2000 г оксида кремния (0,063-0,2 мм), находящегося в колонке диаметром 5 см (элюент: циклогексан-этилацетат (70-30 по объему), собирая фракции по 200 мл. Фракции 16-24 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Таким образом получают после кристаллизации из диизопропилового эфира 17 г 3-/2S, 3R/-[2-бром-3-окси-3-/4-метилфенил/-1-оксопропил-4-метил-5-фенил-2- /4S, 5R/-оксазолидинона, плавящегося при 139oC.
3-/2-Бром-1-оксоэтил/-4-метил-5-фенил-2-/4S, 5R/-оксазолидинон может быть получен следующим образом.
К раствору, охлажденному до температуры около -75oC, 106,2 г 4-метил-5-фенил-2-/4S, 5R/-оксазолидинона в 1080 мл безводного тетрагидрофурана прибавляют, поддерживают температуру -75oC, 375 мл 1,6М раствора н-бутиллития в гексане, потом прибавляют по каплям 62,6 мл бромацетилбромида. Реакционную смесь перемешивают при температуре около -75oC в течение 1,5 ч, потом нагревают до температуры около -10oC и прибавляют 600 мл водного насыщенного раствора хлористого аммония. Отделяют водную фазу декантацией и снова экстрагируют 500 мл диэтилового эфира. Объединяют органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 мПа) при 40oC. Получают 201 г желтого масла, которое очищают хроматографией на оксиде кремния (4000 г), (0,063-0,2 мм), находящемся в колонке диаметром 10 см (элюент: циклогексан-этилацетат (66-33 по объему), собирают фракции по 500 мл. Объединяют фракции 4-13 и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Таким образом получают 139,5 г 3-/2-бром-1-оксоэтил/-4-метил-5-фенил-2/4S, 5R/-оксазолидинона в виде светло-желтого масла.
Пример 2. Работают по методике примера 1, но исходя из 3-трет.бутоксикарбониламино-3-/2-фторфенил/-2-окси-/2R, 3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b,
10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила, получают 0,17 г 3-трет.бутоксикарбониламино-3-/2-фторфенил/-2-окси-/2R, 3S/ пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1,7b,
10b-треокси-9-оксо-11-таксен-13a-ил в виде белой пены, которая имеет следующие характеристики:
удельное вращение: (α)
ЯМР-спектр /400 МГц, CDCl3/ δ /ппм/: 1,14 /c, 3H: -CH3 16 или 17/; 1,25 /c, 3H: -CH3 16 или 17/; 1,32 /c, 9H: -C/CH3/3/; 1,76 /c, 3H -CH3 19/; 1,86 /м, 1H: -/CH/-H6/; 1,93 /c, 3H: -CH3 18/; 2,22 /дд, 1H, J 9 Гц и 16 Гц: -/CH/-H14/;
2,
37 /дд, 1H, J 9 Гц и 16 Гц: -/CH/-H14/; 2,45 /c, 3H: -COCH-3/; 2,6 /м, 1H: -/CH/-H 6/; 3,35 /c, 1H: -OH2'/; 3,94 /д, 1H, J 7 Гц: -H3/; 4,26 /AB, 2H, JAB 9 Гц: -CH2
20/; 4,28 /дд, 1H, J 7 и 12 Гц: -H7/; 4,62 /м, 1H: -H2'/; 4,98 /д, 1H, J 9 Гц: -H5/; 5.23 /c, 1H: -H10/; 5,45 и 5,58 /д и д, 1H каждый, J 10 Гц: -CH-NHCO-/; 5,7 /д, 1H, J 7 Гц: -H2/; 6,28 /1, 1H, J 9
Гц: -H13/; 7,06-7,4 /м, 4H: F-C6H4/; 7,5 /1, 2H, J 8 Гц; -OCOC6H5/-H4//; 8,13 /д, 2H, J 8 Гц: -OCOC6H5 /-H2 и Н6//.
Работают по методике примера 1, но исходя из соответствующих исходных материалов, получают следующие промежуточные продукты:
3-трет. бутоксикарбониламино-3-/2-фторфенил/-2-окси-/2R,
3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ил в виде белой пены.
3-амино-2-окси-3-/2-фторфенил/-/2R,3S/- пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ил в виде белой пены,
3-трет. бутоксикарбонил-2,2-диметил-4-/2-фторфенил/5-/4S, 5R/-оксазолидинкарбоксилат-4-ацетокси-2-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13
a-ил в виде белой пены.
3-трет. бутоксикарбонил-2,2-диметилл-4-/2-фторфенил/-5/4S, 5R/-оксазолидинкарбоновая кислота в виде белых кристаллов, плавящихся при 164oC.
этил-3-трет.бутоксикарбонил-2,2-диметил-4-/2-фторфенил/-5-/4S, 5R/-оксазолидинкарбоксилат в виде желтого масла.
этил-3-трет.бутоксикарбониламино-2-окси-3-/2-фторфенил/-/2R, 3S/-пропионат в виде белых кристаллов, плавящихся при 99oC.
этил-3-амино-2-окси-3-/2-фторфенил/-/2R, 3S/-пропионат в виде белых кристаллов, плавящихся при 73o C.
этил-3-азидо-2-окси-3-/2-фторфенил/-/2R, 3S/-пропионат в виде желтого масла.
3-/2S, 3R/-[2-бром-3-окси-3(2-фторфенил)-1-оксо-пропил] -4-метил-5-фенил-2-/4S, 5R/-оксазолидинон в виде желтой пены.
Пример 3. Работают по методике примера 1, но исходя из 3-трет.бутоксикарбониламино-3-/4-хлорфенил/-2-окси-/2R,
3S/-пропионат-4-ацетокси-2a-бензолокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила, получают 0,35 г
3-трет.бутоксикарбониламино-3-/4-хлорфенил/-2-окси-/2R, 3S/-пропионат-4-ацетокси-2a-бензолокси-5b, 20-эпокси-1,7 b, 10b-триокси-9-оксо-11-таксен-13 a -ила в виде белой пены, которая имеет следующие
характеристики:
удельное вращение (α)
ЯМР-спектр /400 МГц, CDCl3/ δ /ппм/: 1,15 /c, 3H: -CH3 16 или 17/; 1,25 (c, 3H: -CH3 16 или 17) 1,35 /c, 9H: -C/CH3/3/; 1,77 /c, 3H:
-CH3 19/; 1,9 /м, 1H: -/CH/-H 6 и с, 3H: -CH3 18/; 2,3 /д, 2H, J 8,5 Гц: -CH2 14/; 2,39 /c, 3H: -COCH3/; 2,6 /м, 1H:-/CH/-H 6/; 3,48 /c, 1H: -OH 2'//; 3,92
/д, 1H, J 7 Гц/: -H 3/ 4,24 /дд, 1H, J 7 и 12 Гц: -H 7//; 4,26 /AB, 2H, JAB 9 Гц: -CH2-20/; 4,61 /c, 1H:-H 2'/; 4,96 /д, 1H, J 9 Гц-H 5/; 5,24 /c, 1H: -H 10/; 5,26 /м, 1H:-H
3'/;
5,43 /д, 1H, J 9 Гц -NHCO-/; 5,68 /д, 1H, J 7 Гц: -H 2/; 6,25 /1, 1H, J 8,5 Гц -H 13/; 7,35 /м, 4H: Cl-C6H4/; 7,5 /1, 2H, J 8 Гц: -OCOC6H5/-H 3 и -H
5//; 7,
62 /т, 1H, J 8 Гц: -OCOC6H5/-H4//; 8,10 /д, 2H, J 8 Гц: -OCOC6H5/-H 2 и H 6/.
Работают по методике примера 1, но исходя из
соответствующих
исходных материалов, получают следующие промежуточные соединения:
3-трет. бутоксикарбониламино-3-/4-хлорфенил/-2-окси-/2R, 3S/-пропионат-4-ацетокси-2a-бензоилокси-5b,
20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ил в виде белой пены.
3-амино-2-окси-3-/4-хлорфенил/-/2R, 3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b -бис/2,2,2-трихлорэтокси/-карбонилокси-11-таксен-13 a-ил в виде белой пены.
3-трет.бутоксикарбонил-2, 2-диметил-4-/4-хлорфенил/-5-/4S, 5R/оксазолидинкарбоксилат-4-ацетокси-2a-бензоилокси-5b 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/-карбонилокси-11-таксен-13a-ил в виде белой пены.
3-трет.бутоксикарбонил-2,2-диметил-4-/4-хлорфенил/-5/4S, 5R/-оксазолидинкарбоновая кислота в виде бесцветного масла.
этил-3-бутоксикарбонил-2, 2-диметил-4-/4-хлорфенилл/-5-5/, 5R/-оксазолидинкарбоксилат в виде желтого масла.
этил-3-трет.бутоксикарбониламино-2-окси-3-/4-хлорфенил/-/2R, 3S/-пропионат в виде кремовых кристаллов с т.пл. 117oC.
этил-3-амино-2-окси-3-/4-хлорфенил/-/2R, 3S/-пропионат в виде коричневого масла.
этил-3-азидо-2-окси-3-/4-хлорфенил/-/2R,3S/-пропионат в виде желтого масла.
этил-3-/4-хлорфенил/-2-/2R,3S/-оксиранкарбоксилат в виде желтого масла.
3-2/S, 3R/-[2-бром-3-окси-3-/4-хлорфенил/-1-оксо-пропил]-4-метил-5-фенил-2-/4S, 5R/-оксазолидинон в виде белых кристаллов, плавящихся при 140oC.
Пример 4. Работают по методике примера 1, но исходя из
3-/трет.бутоксикарбониламино-3-/4-метоксифенил/2-окси-/2R,
3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10 b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ила,
получают 0,15 г
3-трет.бутокскарбониламино-3-/4-метоксифенил/-2-окси- /2R,3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1,7b, 10b-триокси-9-оксо-11-таксен-13a-ила в виде белой пены, которая
имеет следующие
характеристики:
удельное вращение: α
ЯМР-спектр /МГц, CDCl3/ δ /ппм/: 1,15 /c, 3H: -CH3 16 или 17/; 1,25 /c, 3H; -CH3 16 или 17/; 1,38 /c, 9H: -CH3/3; 1,7/м
1H:-OH 1/; 1,78 /c,
3H: -CH3 19/; 1,88 /м, 1H: -/CH/-H 6 и с, 3H: -CH3 18/; 2,28 /д, 2H, J 8,5 Гц: -CH2 14/; 2,38 /c, 3H: -COCH3/; 2,6 /м, 1H: -/CH/-H 6/;
3,4 /м, 1H: -OH 2'/;
3,8 /c, 3H: -C6H4-OCH3/; 3,92 /д, 1H, J 7 Гц: -H 3/; 4,2 и 4,33 /2д, 1H каждый, J 9 Гц: -CH2 20/; 4,25 /м, 1H: -H 7/; 4,1-4,4 /м шир.
1H: -OH 10/; 4,59/м,
1H: -H 2'/; 4,95 /д, 1H, J 9 Гц: -H 5/; 5,2 и 5,37 /2м, 1Н каждый: -CH-NHCOO-/; 5,22 /c, 1H: -H 10; 5,69 /д, 1H, J 7 Гц: -H 2/; 6,22 /т, 1H, J 8,5 Гц: -H 13/; 6,92 /д, 2H, J 8
Гц: -C6H4-OCH3/-H 3 и -H 5/; 7,31 /д, 2H, J 8 Гц: -C6H4-OCH3/ -H 2 и -H 6//; 7,45 /т, 2H, J 8 Гц: -OCOC6H5/-H 3
и -H 5//; 7,62 /т, 1H, J
8 Гц: -OCOC6H5/-H 4//; 8,11 /д, 2H, J 8 Гц: -OCOC6H5/-H2 и -H6//.
Работая по методике примера 1, но исходя из
соответствующих исходных
материалов, получают следующие промежуточные соединения:
3-трет. бутоксикарбониламино-3-/4-метоксифенил/-2-окси-/2R,3S/ пропионат-4-ацетокси-2a-бензоилокси-5b,
20-эпокси-1-окси-9-оксо-7b, 10
a-бис-/2,2,2-трихлорэтокси/карболокси-11-таксен-13a-ил в виде белой пены.
3-амино-2-окси-3-/4-метоксифенил/-2-окси-/2R, 3S/- пропионат-4-ацетокси-2b-бензолокси-5b, 20-эпокси-1-окси-9-оксо-7 b, 10a-бис-2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ил в виде белой пены.
3-трет. бутоксикарбониламино-2, 2-диметил-4-/4-метоксифенил/-5/4S, 5R/- оксазолидинкарбоксилат-4-ацетокси-2 b-бензолокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10a-бис-/2,2,2, -трихлорэтокси/карбонилокси-11-таксен-13a-ил в виде белой пены.
3-трет.бутоксикарбонил-2,2-диметил-4-/-метоксифенил/-5-/4S,5R/-оксазолидинкарбоновая кислота в виде белой пены.
3-этил-трет. бутоксикарбонилл-2, 2-диметил-4-/4-метоксифенил/-5/4S, 5R/оксазолидинкарбоксилат в виде желтого масла.
этил-3-трет.бутоксикарбониламино-2-окси-3-/4-метоксифенил/-/2R,3S/-пропионат в виде белых кристаллов, т.пл. 135oC.
этил-3-амино-2-окси-3-/4-метоксифенил/-/2R, 3S/-пропионат в виде желтого масла.
этил-3-азидо-2-окси-3-/4-метоксифенил-/-/2R,3S/-пропионат в виде желтого масла.
этил-3-/4-метоксифенил/-2-/2R, 3R/оксиранкарбоксилат в виде желтого масла.
3-/2S, 3R/-[2-бром-3-окси-3-/4-метоксифенил/1-оксопропил] -4-метил-5-фенил-2-/4S,5R/-оксазолидинона в виде белых кристаллов с т.пл. 130oC.
Пример 5. Работают по методике примера 1, но исходя из
3-трет.бутоксикарбониламино-3-/4-фторфенил/-2-окси-/2R, 3S/-пропионат-4-ацетокси-2
b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10a-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13 a-ила, получают
0,086 г 3-трет.бутоксикарбониламино-3-/4-фторменил/-2-окси- /2R,
3S/-пропионат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1,78b, 10 (α)
удельное вращение: a -35o /c
0,49, метанол/,
ЯМР-спектр /250 МГц,
CDCl3/b/ппм/: 1,14 /c, 3H: -CH3 16 или 17/, 1,25 /c, 3H:-CH3 16 или 17/; 1,35 /c, 9H: -C/CH3/3/; 1,
7 /м, 1H: -OH 1/; 1,77 /c, 3H: -CH3
19/; 1,87 /м, 1H: -/CH/-H 6/; 1,87 /c, 3H: -CH3 18/; 2,3 /д, 2H, J 9 Гц: -CH2 14/; 2,36 /c, 3H: -COCH3/; 2,6 /м, 1H:
-/CH/-H 6/; 3,43 /м, 1H: -OH 2'/; 3,93 /д, 1H, J 7
Гц: -H 3/; 4,2 и 4,33 /AB, 2H, JAB 8 Гц: -CH2 20/; 4,23 /м, 1H: -H 7/; 4,6 /м, 1H:-H 2'/; 4.96 /дд, 1H, J 2 и 10,5 Гц: -H 5/;
5,22 /c, 1H: -H 10/; 5,25 /м, 1H: -H 3'/; 5,42 /д,
1H, J 10 Гц: -CH-ПHCO-/; 5,7 /дд, 1H, J 7 Гц -H2/; 6,24 /т, 1H, J 9 Гц: -H 13/; 7,09 /т, 2H, J 8,5 Гц: F-C6H4-H 3 и -H 5//; 7,
38 /дд, 2H, J 8,5 Гц: F-C6H4
/-H 2 и -H 6//; 7,5 /т, 2H, J 8,5 Гц: -OCOC6H5-H 3 и -H 5//; 7,62 /т, 1H, J 8,5 Гц: -OCOC6H5/-H 4//; 8,1
/д, 2H, J 8,5 Гц: -OCOC6H5/-H
2 и -H 6//.
Работа по методике примера 1, но исходя из соответствующих исходных материалов, получают следующие промежуточные
продукты:
3-трет.
бутоксикарбониламино-3-/4-фторфенил/-2-окси-/2R, 3S/-пропионат-4-ацетокси-2b-бензоилокси-5 b, 20-эпокси-1-окси-9-оксо-7a, 10a-бис-/2,2,
2-трихлорэтокси/-карбонилокси-11-таксен-13b-ил в виде белой
пены.
3-амино-2-окси-3-/4-фторфенил/-/2R,3S/- пропионат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7a, 10b-бис-2, 2,2-трихлорэтокси/карбонилокси-11-таксен-13b-ил в виде белой пены.
3-трет. бутоксикарбонил-2,2-диметил-4-/4-фторфенил/-оксазолидин-5-/4S, 5R/-карбоксилат-4-ацетокси-2-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7a, 10 b-бис-/2,2, 2-трихлорэтокси/карбонилокси-11-таксен-13b-ил в виде белой пены.
3-трет. бутоксикарбонил-2,2-диметил-4-/4-фторфенил/-5-/4S, 5R/-оксазолидинкарбоновая кислота в виде желтого масла.
этил-3-трет. бутоксикарбонил-2,2-диметил-4-/4-фторфенил/-5-/4S,5R/-оксазолидинкарбоксилат в виде желтого масла.
этил-3-трет. бутоксикарбониламино-2-окси-3-/4-фторфенил/-/2R,3S/-пропионат в виде белых кристаллов, т.пл. 116oС.
этил-3-амино-2-окси-3-/4-фторфенил/-/2R, 3S/-пропионат в виде белых кристаллов, т.пл. 105oC.
этил-3-азидо-2-окси-3-/4-фторфенил-/2R, 3S/-пропионат в виде желтого масла.
этил-3-/4-фторфенил/-2/2R, 3S/-оксиранкарбоксилат в виде светло-желтых кристаллов, т.пл. 40oC.
3-/2S, 3R/-[2-бром-3-окси-3-/4-фторфенил/-1-оксопропил] -4-метил-5-фенил-2-/4S,5R/-оксазолидинон в виде желтой пены.
Пример 6. К раствору 5,52 г 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S, 5R/- оксазолидинкарбоновой кислоты в 350 мл толуола прибавляют 3,55 г N,
N'-дициклогексилкарбодиимида. Раствор
перемешивают 10 мин при температуре около 20oC, потом прибавляют 3 г 4,10a-диацетокси-2-бензоилокси-5b, 20-эпокси-1,13b-диокси-9-оксо-7
a-триэтилсилил-11-таксена (полученного по методике,
описанной Ж.Н.Денисом с сотр. в J.Am.Chem.Soc. 110, 5917(1988) и 0,52 г 4-диметиламинопиридина. Затем реакционную среду нагревают в течение 2 ч при
температуре около 80oC, затем реакционную
смесь охлаждают до примерно 20oC и прибавляют 250 мл водного насыщенного раствора бикарбоната натрия. Водную фазу декантируют, потом
экстрагируют 2 раза 200 мл дихлорметана. Объединяют
органические фазы, сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 30oC. Получают 10,8 г оранжевого масла, которое
очищают флэш-хроматографией (элюент: дихлорметан-метанол (99,5-0,5 по объему). После концентрирования досуха при пониженном давлении (2,7 кПа) при
температуре около 40oC фракцией 60-73
получают 3,7 г 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарбоксилат-4,10b-диацетокси-2b-бензоилокси-5a,
20-эпокси-1-окси-9-оксо-7(α)
удельное
вращение a -45,3o /c 0,5; метанол/.
ЯМР-спектр /400 МГц, смещения в ппм/: 7,35 ппм /м, 5H, C6H5/цепь/; 6,5 ппм /c, 1H, H-10/; 6,25 ппм /т, 1H, H-13/; 5,15 /м, 1H, CHII /H-4'/ 4,5 ппм /м, 2H, CHO /H-5'/ 4,15 и 4,25 ппм /2д, 2H, H-20/; 1,25 ппм /c, 15H, C/CH3/3 +2CH3 таксенового цикла /0,98 ппм /т, 9H, CH3C /; 0,6 ппм /к, 6H, CH2/.
Прибавляют 3 г 3-трет. бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,
5R/ оксазолидинкарбоксилат-4,10b-диацетокси-2b-бензоилокси-5a,
20-эпокси-1-окси-9-оксо-7 b -триэтилсилилокси-11-таксен-13a -ила к 60 мл 0,1 H этанольного раствора хлористого водорода при 0o
C. Реакционную смесь перемешивают 48 ч при 0oC,
потом прибавляют 250 мл дихлорметана, затем смесь 30 мл насыщенного водного раствора бикарбоната натрия и 30 мл воды. Декантируют
органическую фазу, сушат над сульфатом магния, фильтруют, потом
концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 30oC. Получают 2,8 г белой пены, которую
очищают флэшхроматографией (элюент: дихлорметан-метанол (99-1 по
объему). После концентрирования досуха при пониженном давлении (2,7 кПа) при температуре около 40oC фракцией 15-30 получают
2,33 г 3-трет.бутоксикарбоксилат-4,
10b-диацетокси-2b-бензоилокси-5a, 20-эпокси-1,7(α)
удельное вращение
β -65oC /c 1; метанол/.
ЯМР-спектр /250 Мгц, смещение в ппм/: 7,35 ппм /м, 5Н, C6H5 /цепь//; 6,3
ппм /м, 2Н, Н-10 и Н-13/, 5,1 ппм /м, 1Н, CHN
/H-4'// 4,5 ппм /д, 1H, CHO /H-5'/; 4,45 ппм /м, 1Н, Н-7/; 4,1 и 4,3 ппм /2д, 2Н, Н-20/; 1,05-1,15 ппм /м, 9Н, C/CH3/3/;
К
раствору 2,3 г 3-трет.бутоксикарбонил-2,
2-диметил-4-фенил-5-/3S,5R/- оксазолидинкарбоксилат-4-10a-диацетокси-2b-бензоилокси-5b, 20-эпокси-1,7a-диокси-9-оксо-11-таксен-13b-ила в 35 мл пиридина
прибавляют за 10 мин по каплям 0,4 мл 2,2,
2-трихлорэтилхлорформиата. Реакционную среду нагревают при 80oC в течение 1 ч, потом прибавляют 0,36 мл 2,2,2-трихлорэтилхлорформиата. Реакционную
смесь 4 ч выдерживают при 80oC,
потом прибавляют 0,36 мл 2,2,2-трихлорэтилхлорформиата и выдерживают температуру 80oC в течение 30 мин. После охлаждения реакционной среды до
температуры около 20oC прибавляют
174 мл воды, 175 мл насыщенного водного раствора бикарбоната натрия и 150 мл дихлорметана. Декантируют водную фазу, потом экстрагируют 2 раза 25 мл
дихлорметана. Объединяют органические фазы, сушат
над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (0,13 кПа) при температуре около 30oC. Получают 2,8 белой
пены, которую очищают флэшхроматографией (элюент:
дихлорметан-метанол (99-1 по объему). После концентрирования досуха при пониженном давлении (2,7 кПа) при температуре около 40oC фракцией
28-42 получают 2,57 г 3-трет.бутоксикарбонил-2,
2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарболат-4,10a-диацетокси-2 b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7a-/2,2,
2-трихлорэтокси/карбонилокси-11-таксен-13a-ила в виде белой пены, которая имеет
следующие характеристики:
удельное вращение: b -55o /с 0,5, метанол/.
ЯМР-спектр /400 МГц, смещение в ппм/: 7,35 ппм /м, 5Н, C6H5/цепь/; 6,4 ппм /c, 1H, H-10/; 6,25 ппм /т, 1H, H-13/; 5,6 ппм /дд, 1H, H-7/; 5,1 ппм /м, 1H, CHN/H-4'//; 5,05 и 4,65 ппм /2д, 2H, CH2CCl3/ 4,5 ппм /д, 1H, CHO /H-5'/; 4,1 и 4,3 ппм /2д, 2H, H-20/; 1,05 и 1,15 ппм /м, 9H, C/CH3/3/.
Раствор 3,2 г 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5/4S, 5R/-оксазолидинкарбоксилат-4, 10a-дицетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7a-/2,2,2-трихлорэтокси/карбонилокси-11- таксен-13b-ил в 32 мл муравьиной кислоты перемешивают 4,5 ч при температуре около 20oC. Реакционную среду концентрируют досуха при пониженном давлении (0,13 кПа) при температуре около 30oC. Полученный остаток растворяют в 150 мл дихлорметана, этот раствор промывают 50 мл насыщенного водного раствора бикарбоната натрия, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (0,13 кПа) при температуре около 30oC. Получают 2,74 г кремовой пены, которую очищают флэшхроматографией (элюент: дихлорметан-метанол (99-1 по объему). После концентрирования досуха при пониженном давлении (2,7 кПа) при температуре около 40oC фракцией 13-25 получают 2,17 г 3-амино-2-окси-3-фенил-/2R, 3S/-протионат-4, 10a-диацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7a-/2,2,2-трихлорэтокси/ карбонилокси-11-таксен-13a-ила в виде белой пены, которая имеет следующие характеристики.
удельное вращение: a -60,2o /c 0,5, метанол/.
ЯМР-спектр /400 МГц, смещение в ппм/: 7,4-7,25 ппм /м, 5Н, C6H5 /цепь/; 6,4 ппм /c, 1H, H-10/; 6,15 ппм /2д, 2H, H-13/; 5,55 ппм /дд, 1H, H-7/; 5,05 и 4,65 ппм /2д, 2H, CH2CCl3/; 4,35 ппм /м, 2H, H-2' и H-3'/; 4,15 и 4,3 ппм /2д, 2H, H-20/.
3-Амино-2-окси-3-фенил-/2R,
3S/-пропионат-4,10b-диацетон-2a- бензоилокси-5 b,20-эпокси-1-окси-9-оксо-7a-/2,2,2-трихлорэтокси/ -карбонилокси-11-таксен-13b-ил
также может быть получен следующим образом:
Раствор 0,1 г
3-трет. бутоксикарбонил-2,2-диметил-4-фенил-5-/4S, 5R/- оксазолидинкарбоксилат-4,
10b-диацетокси-2a-бензоилокси-5b20-эпокси-1-окси-9-оксо-7a-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13b-ила в смеси
1,4 мл 3,4 H этанольного раствора соляной кислоты и 0,6 мл дихлорметана
перемешивают 7 ч при температуре около 20oC. Прибавляют затем к реакционной смеси 2 м дихлорметана, 1 мл воды и 1 мл
насыщенного водного раствора бикарбоната натрия. Органическую фазу
декантируют, сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении (0,13 кПа) при температуре около 30oC. Получают 0,1 г желтой пены, которую очищают
флэшхроматографией (элюент: дихлорметан-метанол (98-2 по объему). После концентрирования досуха при пониженном давлении (2,7 кПа) при температуре
около 40oC фракцией 14-20 получают 0,023 г
3-амино-2-окси-3-фенил-/2R, 3S/- пропионат-4,10b-диацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7a /2,2,
2-трихлорэтокси/карбонил-окси-11-таксен-13b-ила в виде белой пены.
К
перемешиваемому раствору 2,1 г 3-амино-2-окси-3-фенил/2R,3S/-пропионат-4,10b-диацетокси-2a -бензоилокси-5 b,
20-эпокси-1-окси-9-оксо-7a-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13b-ила в 52,5 мл
этилацетата прибавляют смесь 140 мл воды. Затем прибавляют за 2 мин 0,277 мл бензоилхлориды. Реакционную смесь
перемешивают 15 мин при температуре около 24oC, декантируют водную фазу, потом
экстрагируют 3 раза 50 мл дихлорметана. Объединенные органические фазы сушат над сульфатом магния, фильтруют
и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 30oC. Получают 2,3 г кремовой пены, которую очищают флэшхроматографией (элюент: дихлорметан-метанол (99-1 по
объему). После концентрирования досуха при пониженном давлении (2,7 кПа) при
температуре около 40oC фракций 31-38 получают 2,03 г 3-бензоиламино-2-окси-3-фенил-/2R,3S/-пропионат-4,
10b-диацетокси-2a-бензоилокси-5a,20-эпокси-1-окси-9-оксо-7b-/ 2,2,
2-трихлорэтокси/карбонилокси-11-таксен-13a-ила в виде белой пены, которая имеет следующие характеристики:
удельное вращение:
b -41,9o /с 0,5, метанол/.
ЯМР-спектр /250 МГц, смещение в ппм/; 8,15 ппм /д,2H, 7,8 ппм /д, 2H/, 7,6 ппм /т, 1H/, 7,6-7,3 ппм /м, 10H/ /для всех вместе 2 • C6H5CO+C6H5/цепь//, 7,05 ппм /д, 1H, HH/; 6,35 /с, 1H-10/ 6,2 ппм /т, 1H, H-13/; 5,8 ппм /дд, 1H, H-3'/; 5,55 ппм /дд, 1H, H-7/; 5,05 и 4,62 ппм /2д, 2H, CH2CCl3/; 4,8 ппм /д, 1H, H-2'/; 4,2 и 4,35 ппм /2д, 2H, H-20/.
3-Бензоиламино-2-окси-3-фенил-/2R, 3S/-пропионат-4,10b-диацетокси-2aбензоилокси-5a, 20-эпокси-1-окси-9-оксо-7 a -/ 2,2,2-трихлорэтокси//карбонилокси-11-таксен-13a-ил может быть превращен в таксол путем замены 2,2,2-трихлорэтоксикарбонильной группы на атом водорода с помощью цинка в присутствии уксусной кислоты по методике, описанной в европейском патенте ЕР 0253738.
3-Трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарбоновая кислота может быть получена следующим образом.
К перемешиваемому раствору 12,8 г
этил-3-трет.бутокарбонил-2,2- диметил-4-фенил-5-/4S, 5R/-оксазолидинкарбоксилата в 200 мл этанола прибавляют в течение
10 мин раствор 4,62 г гидрата гидроксида лития в 80 мл воды. После 10 мин
дополнительного перемешивания реакционную среду концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около
40oC. Полученный остаток растворяют в 70 мл воды, поток
экстрагируют 3 раза 20 мл диизопропилового эфира. Затем водную фазу подкисляют до pH около 2,6 при добавлении примерно 100 мл
водного 1Н раствора соляной кислоты, потом 3 раза экстрагируют 50 мл
дихлорметана. Объединенные органические фазы сушат над сульфатом магния, фильтруют, потом концентрируют досуха при пониженном
давлении (2,7 кПа) при температуре около 40oC. Таким образом
получают 11,3 г 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/-оксазолидинкарбоновой кислоты в виде желтого масла,
которое имеет следующие характеристики:
удельное вращение: a -3,3o/c0,8, CHCl3/.
ЯМР-спектр /250 МГц, смещение в ппм/: 7,4 ппм /м, 5Н, C6 H5/; 5,2 ппм /м, 1H, CHH/; 4,55 ппм /д, 1H, CHO/; 1,85 ппм /с, 3H, C-CH3/, 1,75 ппм /с, 3H, C-CH3/, 1,2 ппм /м, 9H, C/CH3/3/.
Этил-3-трит. бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксолидинкарбоксилат может быть получен следующим образом.
Раствор 11,7 г этил-3-трет.
бутоксикарбониламино-2-окси-3-фенил- /2R, 3S/-пропионата, 3,6 мл 2-метоксипропена и 0,06 г п-толуолсульфоновой
кислоты в 120 мл толуола перемешивают в течение 1 ч при температуре около 20o
C. Реакционную среду нагревают до кипения, потом прибавляют 0,06 г п-толуолсульфоновой кислоты. Собирают отгон в
градуированный сосуд, в то время как добавляют по каплям раствор 18 мл
2-метоксипропена в 82 мл толуола, поддерживая постоянный объем реакционной смеси. После 1 ч 20 мин перегонки прибавляют 0,06 г
п-толуолсульфоновой кислоты, потом продолжают перегонку в течение 10 мин,
объем собранного отгона составляет тогда 100 мл. Реакционную среду охлаждают до температуры примерно 20oC, тогда
прибавляют 25 мл водного насыщенного раствора бикарбоната натрия. Водную
фазу декантируют, потом экстрагируют 2 раза 10 мл дихлорметана; объединенные органические фазы сушат над сульфатом магния,
фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) при
температуре около 40oC. Таким образом получают 20,8 г желтого масла, которое очищают хроматографией на 630 г
силикагеля (диаметр колонки: 5,5 см, элюент: циклогексанэтилацетат (70-30 по
объему), фракции по 100 мл). После концентрирования досуха при пониженном давлении (2,7 кПа) при температуре около 40oC фракций 3-9 получают 13 г этил-3-трет.бутоксикарбонил-2,
2-диметил-4-фенил-5- /4S,5R/-оксазолидинкарбоксилата в виде желтого масла, которое имеет следующие характеристики:
удельное
вращение: b -7,3o /с 1, CHCl3/.
ЯМР-спектр /250 МГц, смещение в ппм/: 7,3 ппм /м, 5H, C6H5/; 5,05 ппм /м, 1H, CHN/; 4,45 ппм /д, 1H, CHO/; 4,25 ппм /к, 2H, OCH2-/; 1,8 ппм /с, 3H, C-CH3/, 1,7 ппм /c, 3H, C-CH3/; 1,3 ппм /т, 3H, O-C-CH3/, 1,1 ппм /м, 9H, C/CH3/3/.
Этил-3-трет.бутоксикарбониламино-2-окси-3-фенил-/2R,3S/- пропионат может быть получен согласно следующей методике.
К перемешиваемому раствору 16 г этил-3-амино-2-окси-3-фенил-/2R, 3S/-пропионата в 160 мл дихлорметана прибавляют 7,1 г бикарбонат натрия, потом приливают в течение 40 мин раствор 22,1 г ди-трет.бутилдикарбоната в 40 мл дихлорметана. Реакционную среду перемешивают 3,25 ч при температуре около 20oC, потом прибавляют 150 мл воды. Декантируют органическую фазу, экстрагируют водную фазу 50 мл дихлорметана, потом объединенные органические фазы сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении (2,7 кПа) при температуре около 30oC. Полученный остаток тщательно растирают с 50 мл диизопропилового эфира; отфильтровывают полученный твердый продукт, потом сушат при пониженном давлении (2,7 кПа) при температуре около 20oC. Таким образом получают 11,9 г этил-3-трет.бутоксикарбониламино-2-окси-3-фенил-/2R, 3S/-пропионата в виде белого порошка, т.пл. 124oC, который имеет удельное вращение a 6,3o /c 1, CHCl3/.
Этил-3-амино-2-окси-3-фенил-/2R, 3S/-пропионат может быть получен по методике, описанной Х. Хенигом с сотр. Tetrahedron, 46, стр. 3841 /1990/.
Пример 7. Работают по
методике примера 6, но исходя из 10 г 3-трет.бутокискарбонил-2,2-диметил-4-фенил-5-/4S, 5R/-оксазолидинкарбоновой кислоты и 12,6 г 4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1,13 a-диокси-9-оксо, 7b,
10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксена получают после очистки флэшхроматографией /элюент: дихлорметан-метанол (98-2 по объему) и концентрирования досуха при пониженном давлении (2,7
кПа)
при температуре около 40oC фракцией 22-39 14 г 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S, 5R/-оксазолидинкарбоксилат-4-ацетокси-2b-бензоилокси-5a, 20-эпокси-1-окси-9-оксо-7a,
10a-бис-/ 2,2,2-трихлорэтокси /карбонилокси-11-таксен-13b-ила в виде белой пены, которая имеет следующие характеристики:
удельное вращение: a -37,2o /c1, метанол/.
ЯМР-спектр /400 МГц, смещение в ппм/: 7,4-7,2 ппм /м, 5H, C6H5 /цепь//, 6,25 ппм /т, 1H, H-13/, 6,2 ппм /c, 1H, H-10/, 5,55 ппм /дд, 1H, H-7/, 5,1 ппм /м, 1H, CHH /H-4'//, 4,9 и 4,6 ппм /2д, 2H, CH2CCl3/; 7,78 ппм /c, 2H, CH2CCl3/, 4,45 ппм /д, 1H, CHO/ H-5'//; 4,1 и 4,28 ппм /2д, 2H, H-20/; 1,1 ппм /м, 9H, C/CH3/3/.
4-Ацетокси-2b-бензоилокси-5b, 20-эпокси-1,13a-диокси-9-оксо-7b, 10 b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен может быть получен по методике, описанной в европейском патенте ЕР 0253738.
Пример 8. Работают по методике примера 6, но исходя из 14 г 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,
5R/-оксазолидин-карбоксилат-4-ацетокси-2b-бензоилокси-11-таксен-13a-ила, получают, после очистки фракций 7 и 8 флеш-хроматографией (элюент: дихлорметан-метанол (95-5 по объему) и концентрировании
досуха под уменьшенным давлением (2,7 кПа) при температуре около 40oC, 6,3 г 3-амино-2-окси-3-фенил-/2R, 3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,
2,
2-трихлорэтокси/карбонилокси-11-таксен-13a-ила в виде белой пены, которая имеет следующие характеристики:
удельное вращение: a -39,7o /с 1, метанол/.
ЯМР-спектр /400 МГц, смещение в ппм/: 7,45-7,3 ппм /м, 5H, C6H5 /цепь//, 6,3 ппм /c, 1H, H-10/, 6,32 ппм /т, 1H, H-13/, 5,6 ппм /дд, 1H, H-7/; 4,95 и 4,65 /2д, 2H, CH2CCl3/; 4,8 ппм /с, 2H, CH2CCl3/; 4,40 ппм /м, 3H, H-2' + H-3' + H-20/; 4,2 ппм /д, 1H, H-20/.
3-Амино-2-окси-3-фенил-/2R, 3S/-пропионат-4-ацетокси-2a-бензоил-окси-5b, 20-эпокси-1-окси-9-оксо-7b, 10 b-бис-/2,2,2-трихлорэтокси/-карбонилокси-11-таксен-13a-ил может быть превращен в 3-трет.бутоксикарбониламино-2-окси-3-фенил-/2R, 3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b,10b-/2,2,2-трихлорэтокси/-карбонилокси-11-таксен-13a-ил при действии дитрет. бутилдикарбоната в присутствии минерального или органического основания.
3-Трет. бутоксикарбониламино-2-окси-3-фенил-/2R, 3S/-пропионат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонил-11-таксен-13a-ил превращают в 3-трет.бутоксикарбониламино-2-окси-3-фенил-/2R, 3S/- пропионат-4-ацетокси-2a-бензоилокси-5b20-эпокси-1, 7b, 10b-триокси-9-оксо-11-таксен-13 a -ил при замене 2,2,2-трихлорэтоксикарбонильных группировок на атом водорода с помощью цинка в присутствии уксусной кислоты по методике, описанной в европейской заявке на патент ЕР 0253738.
Пример 9. Работают по методике примера 6, но исходя из 0,54 г 3-трет. бутоксикарбонил-2,2-диметил-4-фенил-5-/4SR, 5RS/-оксазолидинкарбоновой кислоты и 0, 47 г 4-ацетокси-2-бензоилокси-5b, 10-эпокси-1,13a-диокси-9-оксо-7b, 10b-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксена получают после очистки флэшхроматографией (элюент: дихлорметан-метанол (99,5-0, 5 по объему) и концентрировании досуха фракций 9-11 при пониженном давлении (2,7 кПа) при температуре около 40o 0,5 г 3-трет.бутоксикарбонил- 2,2-диметил-4-фенил-5-/4S, 5R/-оксазолидинкарбоксилат-4-ацетокси-2a-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b,10a-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ила в виде белой пены, которая имеет характеристики, идентичные характеристикам продукта, полученного в примере 7.
3-трет. бутоксикарбонил-2,2-диметил-4-фенил-5-/4S, 5R/- оксазолидинкарбоновая кислота может быть получена в условиях, описанных в примере 6 для получения 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарбоновой кислоты.
Также, исходя из 5 г этил-3-трет.бутоксикарбонил-2,
2-диметил-4- фенил-5-/4S, 5R/-оксазолидинкарбоксилата, получают 4.54 г 3-трет.-бутоксикарбонил-2,2-диметил-4-фенил-5- /4S,5R/-оксазолидинкарбоновой кислоты в виде твердого белого продукта, т.пл.
110oC, которая имеет следующие характеристики:
ЯМР-спектр /250 МГц, смещение в ппм /; 7,4 ппм /м, 5H, C6H5/ 5,2 ппм /м, 1H, CHH/; 4,55 ппм /д, 1H, CHO/; 1,85
/с, 3H, C-CH3/; 1,75 ппм /c, 3H, C-CH3/; 1,2 ппм /м, 9H, C/CH3/3/.
Этил-3-трет. бутоксикарбонил-2,2-диметил-4-фенил-5-/4S, 5R/-оксазолидинкарбоксилат может быть получен следующим образом.
Раствор 0,42 г этил-3-трет. бутоксикарбониламино-2-окси-3-фенил-/2RS, 3SR/-пропионата, 1 мл 2,2-диметоксипропана и 0,
01 г п-толуолсульфоновой кислоты в 10 мл толуола нагревают до кипения в течение 15 мин; собирают 5 мл отгона. Тогда прибавляют 5 мл толуола и 1 мл 2,2-диметоксипропана, потом снова отгоняют 5 мл
дистиллата за 15 мин. Этот прием повторяют 2 раза. Реакционную среду охлаждают до температуры около 20o, после этого прибавляют 20 мл насыщенного водного раствора бикарбоната натрия.
Декантируют водную фазу, потом экстрагируют 20 мл дихлорметана; объединенные органические фазы сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) при
температуре около 40o. Таким образом получат 0,42 г желтого масла, которое очищают хроматографией на 15 г силикагеля (диаметр колонки 1,5 см; элюент: дихлорметан; фракции по 10 мл). После
концентрирования досуха при пониженном давлении (2,7 кПа) при температуре около 40oC фракций 6-13 получают 0,2 г этил-3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4SR,
5RS/- оксазолидинкарбоксилата в виде желтого масла, которое имеет следующие характеристики:
ЯМР-спектр /250 МГц, смещение в ппм/: 7,3 ппм /м, 5H, C6H5/; 5,05 ппм /м, 1H,
CHN/; 4,45 ппм /д, 1H, CHO/; 4,25 /к, 2H, OCH2/; 1,8 ппм /c, 3H, C-CH3/; 1,7 ппм /с, 3H, C-CH3; 1,3 ппм /т, 3H, O-C-CH3/; 1,1 ппм /м. 9H. C/CH3
/3/.
Этил-3-трет.бутоксикарбониламино-2-окси-3-фенил-/2RS,3SR/- пропионат может быть получен по методике, описанной в примере 6 для получения этил-3-трет.бутоксикарбониламино-2-окси-3-фенил-/2RS,3SR/- пропионата.
Также, исходя из 0,78 г этил-3-амино-2-окси-3-фенил-/2RS,3SR/- пропионата получают 0,6 г этил-3-трет.бутоксикарбониламино-2-окси- 3-фенил-/2RS, 3RS/-пропионата в виде белого порошка, т.пл. 102oC.
Этил-3-амино-2-окси-3-фенил-/2RS, 3SR/-пропионат может быть получен по методике, описанной Х. Хенигом с сотр. Tetrahedron, 46, стр. 3841 (1990).
Пример 10. Работают по методике примера 6, но исходя из 1,7 г 3-трет. бутоксикарбонил-2, 2-диэтил-4-фенил-5-/4S, 5R/- оксазолидинкарбоновой кислоты и 2,9 г 4-ацетокси-2b-бензоилокси-5a,20-эпокси-1,13b-диокси-9-оксо-7b, 10 a-бис-/2,2,2-трихлорэтокси карбонилокси-11-таксена, получают 3,5 г 3-трет. бутоксикарбонил-2,2-диэтил-4-фенил-5-/4S, 5R/- оксазолидинкарбоксилат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b10a-бис-/2,2,2-трихлорэтокси/ карбонилокси-11-таксен-13a-ила в виде белой пены.
удельное вращение: a -41,2o /c1, метанол/.
3-Трет.бутоксикарбонил-2,2-диэтил-4-фенил-5-/4R, 5R/- оксазолидинкарбоксилат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10a -бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ил превращают в 3-амино-2-окси-3-фенил-/2R, 3S/-пропионат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7 b,10a-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ил при действии муравьиной кислоты, как описано в примере 6 для 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S, 5R/- оксазолидинкарбоксилат-4-ацетокси-2b-бензоилокси-5 b, 20-эпокси-1-окси-9-оксо-7b, 10a -бис-/2,2, 2-трихлорэтокси/карбонилокси-11-таксен-13a-ила.
Полученный таким образом продукт обладает физическими характеристиками, со всех точек зрения идентичными характеристиками, продукта примера 9 для того же продукта.
удельное вращение: a -38,3o /с0,8, метанол/.
3-Трет.бутоксикарбонил-2,2-диэтил-4-фенил-5-/4S,5R/- оксазолидинкарбоновая кислота может быть получена в условиях, описанных в примере 6, для получения 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарбоновой кислоты. Итак, исходя из 2,3 г этил-3-трет.бутоксикарбонил-2,2-диэтил-4-фенил-5-/4S,5R/- оксазолидинкарбоксилата получают 1,7 г 3-трет.бутоксикарбонил- 2,2-диэтил-4-фенил-5-/4S,5R/-оксазолидинкарбоновой кислоты в виде белых кристаллов с т.пл. 185o.
удельное вращение: a +2,4o (c 0,5, метанол).
Этил-3-трет. бутоксикарбонил-2,2-диэтил-4-фенил-5-/4S, 5R/- пропионата, 1, 12 г 3,3-диметоксипентана и 25 мг пиридиний-п-толуол-сульфоната в 25 мл толуола перемешивают в течение 3 часов при температуре около 20oC. Реакционную смесь нагревают до кипения и собирают отгон в градуированный сосуд. После сбора 20 мл отгона добавляют раствор 1,12 г 3,3-диметоксипентана и 25 мг пиридиний-п-толуолсульфоната в 10 мл толуола в реакционную среду и кипятят с обратным холодильником в течение 5 ч. Реакционную смесь охлаждают до температуры около 20oC, потом прибавляют 10 мл водного насыщенного раствора бикарбоната натрия. Водную фазу декантируют, потом экстрагируют 2 раза 10 мл дихлорметана. Объединяют органические фазы, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40o C. Получают таким образом 2,3 г этил-3-трет.бутоксикарбонил-2,2-диэтил-4-фенил-5-/4S,5R/- оксазолидинкарбоксилата в виде желтого масла.
удельное вращение: a -8,9o (с 1, метанол).
3,3-Диметоксипентан может быть получен по способу, описанному Лореттом с сотр. J. Org. Chem. 24, 1731 (1959).
Пример 11. Работают по методике примера 6, но исходя из 0,9 г 3-трет.бутоксикарбонил-2-циклогексанспиро-4-фенил-5-/4S, 5R/- оксазолидинкарбоновой кислоты и 1,443 г 4-ацетокси-2b-бензоилокси-5a,20-эпокси-1,13b-диокси-9-оксо-7b, 10a-бис-/2,2, 2-трихлорэтокси/карбонилокси-11-таксена, получают 1,85 г 3-трет. бутоксикарбонил-2-циклогексанспиро-4-фенил-5-/4S, 5R/- оксазолидинкарбоксилат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10a-бис-/2,2,2-трихлорэтокси/карбонилокси-11-таксен-13a-ила в виде белой пены.
3-Трет. бутоксикарбонил-2-циклогексанспиро-4-фенил-5-/4S, 5R/-оксазолидинкарбоксилат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7b, 10a-бис-/2,2,2-трихлорэтокси/ карбонилокси-11-таксен-13a-ил превращают в 3-амино-2-окси-3-фенил-/2R, 3S/пропионат-4-ацетокси-2b-бензоилокси-5b, 20-эпокси-1-окси-9-оксо-7 b, 10a -бис-/2,2,2-трихлорэтокси/-карбонилокси-11-таксен-13a-ил при действии муравьиной кислоты, как описано в примере 6, для 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарбоксилат-4-ацетокси-2 b -бензоилокси-5 b 20-эпокси-1-окси-9-оксо-7 b10 a -бис-/2,2,2-трихлорэтокси/ карбонилокси-11-таксен-13 a-ила. Полученный таким образом продукт обладает во всех отношениях идентичными физическими свойствами продукта, описанного в примере 8 для того же продукта.
удельное вращение: a -41, 7o (с 0,5, метанол).
3-трет. бутоксикарбонил-2-циклогексанспиро-4-фенил-5-/4S, 5R/- оксазолидинкарбоновая кислота может быть получена в условиях, описанных в примере 6 для получения 3-трет.бутоксикарбонил-2,2-диметил-4-фенил-5-/4S,5R/- оксазолидинкарбоновой кислоты. Так, из 1,2 г этил-3-трет.бутоксикарбонил-2-циклогексанспиро-4-фенил-5-/4S, 5R/- оксазолидинкарбоксилата получают 1 г 3-трет. бутоксикарбонил-2- циклогексанспиро-4-фенил-5-/4S,5R/-оксазолидиновой кислоты в виде белой пены.
удельное вращение: (α)
Этил-3-трет. бутоксикарбонил-2-циклогексанспиро- 4-фенил-5-/4S,
5R/-оксазолидинкарбоксилат может быть получен следующим образом:
Раствор 2,5 г этил-3-трет. бутоксикарбониламино-2-окси-3-фенил- /2R, 3S/-пропионата, 1,22 г 1,1-диметоксициклогексана и 25 мг
пиридиний п-толуолсульфоната в 25 мл толуола перемешивают в течение 3 часов при температуре около 20oC. Реакционную смесь нагревают до кипения и собирают отгон в градуированный сосуд.
После
сбора 20 мл отгона прибавляют раствор 1,22 г 1,1-диметоксициклогексана и 25 мг пиридиний п-толуолсульфоната в 10 мл толуола в реакционную среду и кипятят с отгоном толуола в течение 30 мин.
Реакционную среду охлаждают до температуры около 20oC, затем прибавляют 10 мл насыщенного водного раствора бикарбоната натрия. Декантируют водную фазу, потом экстрагируют 2 раза 10 мл
дихлорметана. Объединяют органические фазы, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40oC. Получают 2,6 г белой
пены, которую очищают хроматографией на 100 г оксида кремния (0,063-0,2 мм), находящегося в колонке диаметром 2 см (элюент: дихлорметан), собирают фракции по 25 мл. Объединяют фракции 6-13 и
концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 40oC. Таким образом получают 1,25 г этил-3-трет. бутоксикарбонил-2-циклогексанспиро-4-фенил-5-/4S,
5R/- оксазолидинкарбоксилата в виде желтого масла.
1,1-Диметоксициклогексан может быть получен по способу, описанному Лореттом с сотр. J. Org. Chem. 24, 1731 (1959).
Новые продукты общей формулы (Ia) обладают особенно интересной биологической активностью.
Новые продукты формулы (Ia) проявляют значительную ингибирующую активность по отношению к аномальной пролиферации клеток и обладают терапевтическими свойствами, позволяющими лечить больных, находящихся в патологических состояниях, связанных с аномальной пролиферацией клеток. Патологические состояния включают аномальную пролиферацию клеток, злокачественных или незлокачественных, различных тканей и/или органов, состоящих, неограничивающим образом, из мышечных тканей, костных или соединительных тканей, кожи, мозга, легких, половых органов, лимфатической или почечной систем, клеток груди и крови, печени, пищеварительного аппарата, поджелудочной железы и щитовидной железы или надпочечников. Эти патологические условия могут включать также псориаз, твердые опухоли, рак яичников, молочной железы, мозга, простаты, ободочной кишки, желудка, почек или мужских яичек, саркому Капоши, холангиокарционому (карцинома двенадцатиперстной кишки), хориокарциному, нервобластому, опухоль Уильямса, болезнь Ходкина, меланомы, множественные миеломы, хронические лимфоцитарные лейкемии, острые или хронические гранулоцитарные лимфомы. Новые продукты согласно изобретению являются особенно полезными для лечения рака яичников. Продукты согласно изобретению могут быть использованы для предупреждения или замедления появления или повторного возникновения патологических состояний или для лечения этих патологических состояний.
Продукты согласно изобретению могут быть введены больному в различных формах, приспособленных к выбранному способу введения, которым предпочтительно является парентеральный путь. Введение парентеральным путем включает внутривенное, внутрибрюшинное, внутримышечное или подкожное введение. Наиболее предпочтительным является интраперитональное или внутривенное введение.
Изобретение также включает фармацевтические композиции, которые содержат по крайней мере один продукт общей формулы (Ia) в количестве, достаточном для терапевтического применения для людей или в ветеринарии. Композиции могут быть приготовлены в соответствии с обычными методиками с использованием одного или нескольких вспомогательных веществ, носителей или экципиентов, приемлемых фармацевтически. Приемлемые носители включают разбавители, стерильные водные среды и различные нетоксичные растворители. Предпочтительно композиции находятся в виде водных растворов или суспензий, растворов для инъекций, которые могут содержать эмульгаторы, красители, консерванты или стабилизаторы.
Выбор вспомогательных веществ или экципиентов может быть определен растворимостью и химическими свойствами продукта, конкретным способом введения и фармацевтической практикой.
Для парентерального введения используют стерильные водные или неводные растворы или суспензии. Для приготовления неводных растворов или суспензий могут быть использованы природные растительные масла, такие, как оливковое масло, кунжутное масло или парафиновое масло, или органические сложные эфиры для инъекций, такие, как этилолеат. Стерильные водные растворы могут быть составлены из раствора фармацевтически приемлемой соли в воде. Водные растворы годятся для внутривенного введения тогда, когда удобно регулировать pH и когда достигается изотоничность, например с помощью достаточного количества хлорида натрия или глюкозы. Стерилизация может быть осуществлена при нагревании или любым другим способом, который не ухудшает композицию.
Разумеется, что все продукты, входящие в композицию согласно изобретению, должны быть чистыми и нетоксичными в используемых количествах.
Композиции могут содержать по крайней мере 0,01% терапевтически активного агента. Количество активного продукта в композиции является таким, чтобы могла быть предписана удобная позология. Предпочтительно композиции готовят таким образом, чтобы единичная доза содержала 0,01-1000 мг активного продукта для парентерального введения.
Терапевтическое лечение может быть
осуществлено конкурентно с
другими терапевтическими назначениями, включая антинеопластические медикаменты, моноклональные антитела, иммунологическую терапию или радиотерапию, или модификаторы
биологических ответов. Модификаторы
ответов включают, не ограничиваясь, лимфокины и цитокины, такие как интерлейкины, интерфероны (α)
Дозы, используемые для осуществления способов изобретения являются такими, которые позволяют проводить профилактическое лечение или давать максимальный терапевтический ответ. Дозы варьируют в зависимости от формы введения, конкретно выбранного продукта и точных данных объекта лечения. Обычно дозы являются такими, что они являются терапевтически эффективными для лечения расстройств, вызванных аномальной клеточной пролиферацией. Продукты согласно изобретению могут быть введены настолько часто, как это необходимо для получения желаемого терапевтического эффекта. Некоторые больные могут быстро отвечать на относительно высокие или низкие дозы, потом необходимая вводимая доза снижается или становится нулевой. Обычно в начале лечения используют низкие дозы и при необходимости вводят все более и более высокие дозы до получения оптимального эффекта. Для других больных может быть необходимым введение рабочих доз 1-8 раз в день, предпочтительно 1-4 раза, в зависимости от физиологической потребности данного больного. Для некоторых больных также может быть необходимо использовать только два введения ежедневно.
Для людей доза обычно составляет 0,01 200 мг/кг. При интраперитонеальном введении дозы обычно находятся между 0,1 и 100 мг/кг, а предпочтительно 0,5 50 мг/кг, а еще более определенно 1 10 мг/кг. При внутривенном введении дозы обычно составляют 0,1-50 мг/кг, предпочтительно 0,1 5 мг/кг, а еще более определенно 1 2 мг/кг. Разумеется, что для выбора наиболее подходящей дозы следует учитывать путь введения, массу больного, общее состояние его здоровья, его возраст и любые факторы, которые могут влиять на эффективность лечения.
Следующий пример иллюстрирует композицию согласно изобретению.
Пример. Растворяют 40 мг продукта, полученного в примере 1, в 1 мл эмульфора ЕЛ 620 и 1 мл этанола, потом раствор разбавляют 18 мл физиологической сыворотки.
Композицию вводят перфузией физиологического солюта в течение 1 ч.
1. Исследование цитотоксичности Р388 in vitro.
Активность in vitro таксотера и аналогов таксола оценивают на клеточной линии лейкоза мышей Р388.
3•105 клеток/мл выращивают в течение 96 ч в присутствии разных концентраций исследуемого соединения. После этого клетки инкубируют в течение 16 ч с 0,02% натурального красного, промывают и лизируют с помощью 1% ДСН (додецилсульфата натрия).
Включение красителя, отражающее клеточный рост, определяют при измерении оптической плотности при 540 и 346 нм.
Затем вычисляют концентрацию исследуемого соединения, дающую 50% ингибирование (ИК50).
Данные по ИК50 для таксотера и таксола представлены в табл. 1.
2. Противоопухолевая активность in vivo.
Противоопухолевую эффективность in vivo оценивают на мышах, несущих меланому В16. Опухоли имплантируют в виде подкожных билатеральных фрагментов в мышей линии В6D2F1 в день 0. Химиотерапию начинают через 3 или 4 дня после имплантации опухоли, применяя ежедневный или прерывающийся режим приема.
Препарат инъецируют внутривенно в количестве 0,4 мл в расчете на одну инъекцию (этанол 5% полисорбат 80 5% 5% глюкоза в воде 90% объем/объем/объем).
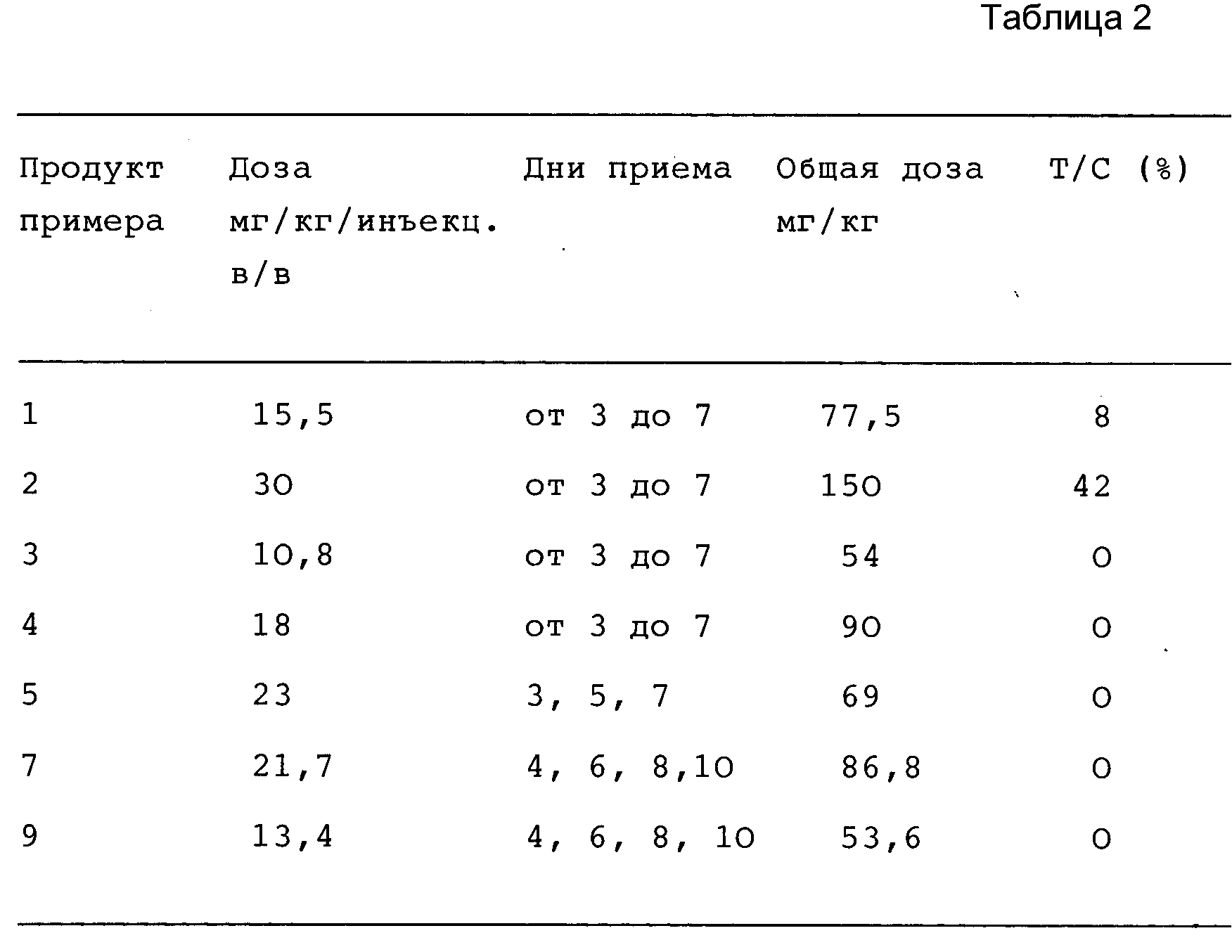
Размер опухолей измеряют 3 раза в неделю до достижения 2000 мг на мышь. Ингибирование роста опухоли (значение Т/С) используют для определения противоопухолевой активности, где Т/С (%) представляет собой значение среднего веса опухолей у животных в опытной группе, разделенное на значение среднего веса опухолей у животных в контрольной группе • 100.
(α, β или δ)
В соответствии с нормами НИК [Национального
института канцерогенеза (NCI)] Т/С ≅ 42% представляет собой минимальный уровень активности.
Величина Т/С < 10% оценивается как высокая противоопухолевая активность. В табл. 2
представлены результаты, полученные при использовании максимальной переносимой дозы каждого соединения.
Реферат
В общей формуле (I) R является трет.бутокси радикалом или фенилом, R1 является атомом водорода или ацетилом и Ar является незамещенным или замещенным фенилом. Причем заместители выбраны из атома галогена, С1-С4 алкила и С1-С4 алкоксигруппы. Новые производные таксана полезны в качестве противоязвенных и противоопухолевых средств. 2 с. и 2 з.п. ф-лы, 2 табл.

Формула

в которой R трет-бутокси-радикал или фенил;
R1 атом водорода или ацетил;
Ar фенил, незамещенный или замещенный атомом галогена, С1 - С4-алкил или С1 С4-алкоксигруппа,
отличающийся тем, что производное оксазолидина общей формулы II

где Ar имеет указанные значения;
Boc является трет-бутоксикарбонильным радикалом;
R6 и R7 одинаковые или различные, являются С1 - С4-алкилом, незамещенным или замещенным одним или несколькими фенилами, или R6 и R7 образуют с атомом углерода, с которым они связаны, 4 7-звенный цикл,
подвергают взаимодействию с производным таксана формулы III

где R1' ацетил или защитная группа для гидроксильной группы,
и полученный продукт общей формулы IV

где Boc, Ar, R1', R2, R6 и R7 имеют вышеуказанные значения,
селективно обрабатывают минеральной или органической кислотой, при желании, в спирте, и полученное соединение формулы V

где Ar, R'1 и R2 имеют указанные значения,
подвергают взаимодействию с ди-трет-бутилдикарбонатом или бензоилхлоридом для ввода трет-бутоксикарбонильного или бензоильного радикала в соединение формулы V с последующей заменой защищающих групп R1' и R2 атомами водорода в полученном соединении формулы VI

где R, R1' и R2 имеют указанные значения,
действием цинка в среде уксусной кислоты или с помощью минеральной или органической кислоты в алифатическом спирте в присутствии цинка и выделением целевого продукта и, в случае необходимости, его очисткой.

где R трет-бутокcил или фенил;
Ar фенил, незамещенный или замещенный атомом галогена, С1 - С4-алкилом или С1 С4 -алкоксигруппой.
от 23.11.90 п.1 R трет-бутокси радикал или фенил, R1 атом водорода или ацетил, Ar незамещенный фенил.

Комментарии