Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров - SU999973A3
Код документа: SU999973A3
Описание
группу -NsCRgR. где R водород или низший алкил, R-y - низший алкил, фенил, или ди{низший)алкиламинофеНИЛ ,
или их .фармацевтически приемлемых солей, или их оптически активных изомеров.
Способ заключается в том, что соединение формулы
(П)
или его таутомерные формы, или оптически активные изомеры,
где пунктирные линии - возможная
дополнительная связь;
R. -Rj имеют.указанные значения;
L - галоген, гидроксильная, или
п-толуолсульфонилоксиаминовая группа,
подвергают взаимодействию с соединением общей формулы
мулы III проводят обычно в присутствии кислотрсвязующих веществ, в качестве которых используют преимущественно карбонаты щелочных металлов (карбонат калия или натрия),
гидрокарбонаты щелочных металлов (например, гидрокарбонат калия или натрия), соли слабых органических кислот со щелочными металлами (например , ацетат натрия) или избыток
исходного соединения формулы 111. Реакцию можно проводить в инертном растворителе, В качестве реакционной среды находят особое применение ароматические углеводороды, например бензол, толуол, ксилол, или эфир, например этилацетат, спирты, например метанол или этанол или диметилформамид , Реакцию можно проводить в интервале 0-200°С, предпочтительно при комнатной температуре, однако можно также проводить при .нагревании или в точке кипения реакционной смеси,
В качестве промежуточного продукта в реакции возникает,вероятно, соединение общей формулы
HjN-NC
оп;
где R и Ry имеют указанные значения Целевой продукт выделяют или омыляют полученный сложный эфир, или полученную кислоту подвергают последую1пему превращению в сЬответствую111ИЙ сложный эфир, амид или гидразид, или проводят последующее бензоилирование полученного х:оединения формулы I, где R - водород, или проводят последующее взаимодействие полученного соединения формулы I, где IL и Rg - атомы водорода, с соединением общей формулы ОяС RgR7 где R.. и R имеют указанные значения.
Целевые продукты выделяют в свободном виде или в виде фармацевтически приемлемых солей (физиологически переносимых солей, гидратов, стереоизомеров, оптически Активных и пространственных изомеров и тауто,меров соединений общей формулы I). . Низшие алкилы, а также низшая алкоксигруппа - это нормальные или разветвленные алифатические, насыщенные группы углеводородов с 1-6, преимущественно с 1-4 атомами углерода , например метил, этил, и-пропил , изопропил, н-бутил, вторичный бутил, третичный бутил, н-пентил, неопентил, н-гексил и т.д. Низшая алканоилгруппа - кислотный остаток алканкарбоновых кислот с 1-6, преимущественно 1-4 атомами углерода, например формил-, ацетил-, пропионил-, бутирилгруппа.
Вэаимодействие соединения обией формулы II с соединением общей фор .7 я ,
где R связь, обозначенная пунктирной линией, имеют указанные значения, содержащееся в реакционной смеси, которое при воздействии
кислорода воздуха при комнатной температуре или нагревании, в. результате которого происходит окисление, превращается в соединение формулы I. Если используют исходное вещество
общей формулы II, в котором L - гидроксил , то реакцию целесообразно проводить в присутствии связывающего воду вещества, например дициклогексилкарбодиимида .
Соединения общей формулы I можно выделять известным способом из реакционной смеси. Во многих случаях соединение.общей формулы I осаждают из реакционной смеси в виде его солей или гидратоЕ, которые можно
отделить с помощью фильтрации или , центрофугирования. Если реакцию проводят вводнойсреде, то конечный продукт экстрагируют из реакционной смеси подходящим органическим растворителеМ , например 6eH3onoMj хлороформом , простым эфиром, и выделяют, упаривая органический экстракт. Если реакцию проводят в среде органического растворителя, то соеди1 ение
общей формулы I выделяют благодаря удалению растворителя. Полученные Соединения общей формулы I можно очистить их перекристаллизацией или хроматографическим способом. Полученное соединение общей формулы I можно по желанию перевести в другое соединение общей формулы , произведя превращения в группах R и/или , которые осуществляют известным способом- при обычных для такого вида реакций условиях. Карбоксильную группу, стоящую в качестве заместителя R или R можно этерифицировать известным, способе до алкоксикарбонил-арилокс карбонил- или аралкилоксикарбонилгруппы . Этерификация может происхо .дить, например, благодаря превращен с соответствующим спиртом или фенолом в присутствии кислого катализатора или обработкой диазоалканом, например диазометаном, диазоэтаном. Карбоксил соответствующего произ водного можно декарбоксилировать,-на гревая его, причем возникает соответствующее производное, содержащее на Месте карбоксильной группы водород . Декарбоксилированиё целесообразно проводить в присутствии кислоты , например фосфорной. Содержащее карбоксильную группу производное можно подвергнуть взаимодействию с соответствующим амином в гамещенный в данном случае амид кислоты. Замещенные амиды кислоты получают известным способом через а тивный сложный эфир, например актив ный эфир, образованный с этиловым эфиром хлормуравьиной кислоты. . Эфирную группу, содержащуюся в качестве заместителя Rj или R соот ветственно,, можно подвергнуть взаим действию при нагревании с избытком соответствующего спирта. Сложный эфир общей формулы I кислой или щелочной обработкой можно превратитьсоответствующую карбоновую кислоту общей формулы I. Щелочной гидролиз проводят нагреванием с гидроокисью щелоч ного металла в водной или спир товой среде, из образукяцейся соли щелочного металла кислоту высвобождают благодаря подкислению. При гид ролизе с минеральными кислотами получсшзт непосредственно свободную карбоновую кислоту. Сложный эфир общей формулы I пу тем реакции с аммиаком в водно-спир товой среде может быть превращен в соответствующий амид кислоты формулы I обработкой гидразином, в необходимом случае зеилещённым (нарример гидразином, метил- или фенилгидразином ) в соответствующий гидра 3ид общей формулы I. Соединения общей формулы 1, содержащие водород в качестве R, ,путем бензошшрования могут быть превращены в соответствующие соединения общей формулы I, содержащие в качестве заместит.елей R бензоильную группу. Ацилирование проводится известным уже образом соответствующей кислотой или ее реакционноспособными производными. Соединение общей формулы I, содержащее в качестве Яд -.и R водород , можно благодаря конденсации с альдегидом переводить в соответствующее соединение общей формулы 1, содержащее вместо группу общей формулы , Реакцию конденсации проводят в среде инертного растворителя (например, бензола, толуола) при .нагревании или кстлиатной температуре. Образующуюся в результате реакции воду можно удалить, используя метод азеотропной дистил- . ляции или связывающие воду вещества. В качестве альдегида можно применять например ацетальдегид или бензальдегид . Из соединений общей формулы 1 можно образовать с физиологически переносимыми кислотами соли, например гидрохлориды, гидробромиды, гидройодиды , сульфаты, нитраты, фосфаты , малеаты, сукцинаты, ацетаты, тартраты, лак-таты, фумараты, цитраты и т.д. Из соединений общей формулы I, содержащих карбоксил или сульфокислоту , можно образовать с физиологически переносимыми основаниями соли, например соли щелочных металлов, такие как натриевая и калиевая соли, а также соли, образованные с органическими аллинами, такие; как соли триэтиламина , этаноламина и т.д. Соединения общей формулы I можно известным способом выделить из солей, образованшлх ими с кислотами или щелочами . Из основных соединений общей формулы I можно благодаря взаимодействию с неорганическими или органическими кислотами образовать соединения аддитивные. Солеобразование проводят известным способом вводя орот-тветствующее соединение общей формулы I вместе с используемой в эквивалентном крличестве или в избытке кислотой в инертный орга нический растворитель. Соединения общей формулы I, содержащие кислые Группы (карбоксил или сульфокислоту), можно подвергнуть взаимодействию с основанием (например , гидроокисью щелочного, щелочноземельного металла, органическими аминами) в соли, образуемые с основанием , Те соединения общей формулы 1, которые содержат в качестве R отличные от водорода заместители, ют центр асимметрии и могут сущест вовать в качестве оптически активных соединений или рацемата. Оптически активные соединения общей фор мулы I могут, например, получать ис пользуя оптически активные исходные вещества или разделяя рацематное соединейие общей формулы I на его оптически активные антиподы. Это можно осуществить известным способо Соединения общей формулы 1, содержа щие карбоксильные группы, можно, например, разделить на,оптические изо меры, подвергая взаимодействую рацема с оптически активным основанием, например, с трео 1-(п-нитрофенил)-2-аминопропан-1 ,3-диолом. Члены образующейся пары диастереоизометри ческих солей отделяют друг от друга на основе их различающихся физических свойств и отделенные друг от др га оптические антиподы общей формулы 1 высвобождают из соли обработкой сильнь1м основанием. Соединения общей формулы I обнаруживают многие фармакологические действия: они являются противовоспа лительными, болеутолящими, антиатеросклеротическими , снижают агрегацию тромбов, регулируют кровеносную систему и функции сердца, действуют на центральную нервную систе1иу, обладают транквилизирующим, р;с/ -антагонистическим , антибактериальным, противогрибковым, а также противоязвенным действием. Поэтому соединения общей формулы I применимы в ветеринарии и медицине. Особо ценно их действие против аллергии и астмы Аллергические реакции, возникающие вследствие взаимодейс9Бия антигенов и антител, проявляются в различных органах и тканях. В качестве средства против астмы распространен динатрийхромогликат (1,3-1 бис- { 2 карбоксихромон-б-ил-окси )-2-оксипр пан, интал R), который не принимают орально, а используют лишь в виде ингаляций при применении сложных вспомогательных средств. Соединения общей формулы I как при оральном или внутривенном введении, так и в виде ингаляций дают положительные результаты при лечении аллергических симптомов. Действенность соединений формулы 1 была- доказана с помощью стандартных тестов, служащих для определения антиаллергического действия. Тесты проводили на крысах. Результаты приведены в таблице, Применение 1 А-теста, /JM/кг , при внутривенном введении дало следующие ре 3 уль таты: 9 (2-Карбоксифенил}-гидразоноу-б-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидйн-3-карбоновая кислота0,48 9-Г(4-Этоксифенил)-гидразоно -б-метил-4-ОКСО-6 ,7,8,9-тeтpaгидpo-4H-пиpидo (1 , 2 -а ) пиримидин- -3-карбоновая кислота 1,0 9- р4-Хлорфенил) -гидразрно -6-метил-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо ( 1 , 2 -а) пиримидин- 3-карбоновая кислота 0,53 9-(3-Пиридилгидразоно)-б-метил-4-оксо-6 ,7, 8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновая кислота 0,54 Из приведенных данных видно, что соединения формулы I действенны также при оральном использовании. При внутривенном введении соединения формулы Д также более действенны, чем известные контрольные соединения, Токсичность предлагаемых соединений незначительна, определена на крысах и мышах и при l-Dr-Q 500 мг/кг перорально. Соединения общей формулы I можно использовать в фармации в форме препаратов , содержащих активное вещество , а также твердые или жидкие, неорганические или органические аещвства-носители . Препараты изготовляют обычным при производстве лекарственных средств способом. Содержание активного вещеСтва в препарате может изменяться в широких пределах и лежит в интервале 0,00590% . Ежедневная доза в пересчете на активное вещество может изменяться в широких пределах и зависит от возраста , веса и состояния больного, а также от лекарственной формы препарата и активности действующего активного вещества. При оральном применении ежедневная доза составляет 0,015-15 мг/кг, в то время, как при внутривенном введении и ингаляции ежедневная доза, разделенная на несколько частичных доз, лежит в интервале 0,001-5 мг/кг. Эти данные носят ориентировочный характер; в отдельных случаях и в зависимости от предписаний врача могут отклоняться в сторону увеличения или уменьи1ения дозы.л Пример 1. 6,3г(0,02 моль) этилового эфира 9-бром-6-метил-4-(1Ксо-6 ,7,8,9-тетрагидро-4Н-пиридо {,2-а)пиримлдин-3-карбоновой кислоты растворяю.т в 30 мл бсзнодного этанола и добавляют к раствору 4 , 3 t-ui ( 0,044 моль) фенилгидразина. После 4-часового кипячения отгоняют при пониженном давлении растворитель. К остатку добавляют 30 мл воды и 15 мл хлороформа, затем при перемешивании -добавлением 10%-ного водного раствора соляной кислоты устанав ливают рН водной фазы равньгм 2-3. Органическую фазу отделяют, водную фазу- дважды экстрагируют 15 мл хлороформа . Очищенные органические фазы сушат над прокаленным сульфатом натрия, растворитель отгоняют при пониженном давлении. Остается масло красного цвета, которое выкристалли зовывают из двух-, трехкратного количества этанола. Получают 5,3 г (68,6%) продукта, плавится при 86-81 С. Соединение кристаллизуют с 1 мол этанола. Этанол удаляют сушкой при 9Q-iQO°C в .вакууме над фосфорным ангидридом. Высушенный этиловый эфир 9-(фенилгидразоно)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кисло ты плавится при 138-139 с, П р и Ме р 2. 2,5 г (0,01 моль этилового эфира 9-окси-6-метил-4-ок со-6,7-дигидро-4Н-пиридо(1,2-а)пиримидин- 3-карбоновой кислоты раство ряют в 7,5 мл безводного этанола, к раствору добсшляют 1,2 мл (0,12 моль) фенил1гидразина. После получасового кипячения реакционную смесь можно охладить Осаждаются кристаллы оранжевого цвета. Их выхо 3,5 г (90,6%), т.пл. 86-87 С. Соединение выкристаллизовывают с 1 мол этанола, который можно удалить сушкой при 90-100 С в вакууме над фос форным ангидридом. Высушенный этило вый эфир 9-(фенилгидразоно)-6-меТИЛ-4-ОКСО-6 ,7,8-тетрагидро-4Н-пири до(1,2-а) пиримидин-3-карбоновой кислоты плавится при 133-139 С и не имеет различия в температуре точки плавления продукта, получаемого в примере 1. Аналогичным образом получают сле дующие соединения. Этиловый эфир-б-метил-9-(м-метил фенилгидра,зоно)-4-оксо-6,7,8,9-тетрагидрс5-4Н-пиридо (1 ,2 -а )пиримидин-3-карбоновой кислоты, т.пл, 159leO Co Этиловый эфир 9-(и-хлорфенилгидразоно )-6-метил-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, т.пл. 177178°С , Этиловый эфир 6-метил-9-(и-метил фенилгидразоно)-4-оксо-6,7,8, 9-тетрагидро-4Н-пиридо (1 ,2 - а) пиримид1 н-3-карбоновой кислоты, т.пл. 147149 С . Этиловый эфир 9-(2,6-дихлорфенил гидразоно)-6-метил-4-оксо-6,7,8,9тетрагидро-4Н-пиридо (1,2-а)пиримидин- -3-карбоновой кислоты, т.пл. 153154 С . - Этиловый эфир 6-метил-9-(о-метилфенилгидраэрно )-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, т.пл. . Этиловый эфир 6-метил-9-(3,4-метилендиоксифенилгидразоно )-4-оксо-6, 7,8,9-тетрагидро-4Н-пиридо(1,2-а) пиримидин-3-карбоновой кислоты, т.пл. 172-173 С. Этиловый эфир 6-метил-8-(О-нитрофенилгидразоно )-4-оксо-6 i7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, т.пл. 190192С . Этиловый эфир б-метил-9-(и-нитрофенилгидразоно )-4-оксо-6,7,8,9-тетрагидро-4Н-пиридино (1,2-а)пиримидин-З-карбоновой кислоты, т.пл. 218219С . Этиловый эфир 9-LЯ -(амрносульфонил ) фенилгиот)азоноЗ -6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо(1,2-а) пиримидин-3-карбоновой кислоты, т.пл. 2iO-213 C. 9- (У1-Брс 1фенилгидразоно)-6-метил-4-ОКСО-6 ,7,8,9-тетрнгидро-4Н-пиридо (1 ,2-а ),ПИримидин-3-карбонов ую кислоту, т.пл. 250-252С. 9-(о-Карбокснфенилгидразоно)-6-метил-4-оксо-6 ,7,8,9-тбтраг.идро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, т.пл. 266-268 С. 9- (у1-Хлорфвнилгидразоно)-:6-метил-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту , т.пл. 262-264 С. 6-Метил-9-(о-метилфенилгидразоно) -4-оксо-6,7,8,9-тетрагидро-4Н-пири- . до(1,2-а)пиримидин-3-карбоновую кислоту , т.пл. 221-223 С. 6-Метил-9- (2,6-диметилфенилгидразоно )-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пнримидин-3-карбОновую кислоту, т.пл. 192-193 С. 6-Метил-9-(2,4,5-триметилфенилгидраэоно )-4-ОКСО-6,7,8,9-тетрагидРО-4Н-П5РИДО (1 ,2-а) пиримидйн-З карбОновую кислоту, т.пл. 224-226. 6-Метил-9-(2,4,6-триметилфенилгидразоно )-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, т.пл. 195-197 С. б-Метил-9-(2,4-динитрофенилгидразоно )-4-оксо-б,7,8,9-гетрагидро-4Н-пиридо (1 , 2-а) -пиримйди 3-карбоновую кислоту, т.пл. 257-258 С. 6-Метил-4-оксо-9-(И-сульфофенилгидразоно )-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-кар6оновую кислоту, т.пл. выше . 9-(И-ЭтокЬифенилгидразоно),-б-метш1-4-оксо-А 7 8/9-тетрагидро-4Н-пиридо (1,2-а Ъиримидин-3-карбоновую кислоту,т.пл. 218-219 С. (-)-9-Фенилгидразоно-6-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кисло ту, т.пл. 258-259С. (f) -9-Фенилгидразоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кисло ту, т.пл, 255-256 0. 9-Фенилгидраэоно-7-метил-4-оксо-б ,7,8,9-тетраридро-4Н-пиридо(1,2-а пиримидин-3-карбоновую кислоту, т.пл. 255-25б С. 9-(2-Фторфенилгидразоно)-6-метил-4-оксо-б ,7,8,9-тетрагидро-4Ч-пирид ( 1,2-а)пиримидин-3-карбоновую кислоту , т.пл. 21б-217с. 6-Метил-9- (2 ,4-дихлорфенилгидраз но)-4-оксо-б,7,8,5-тетрагидро-4Н-пйридоС1 ,2-а)пиримидин-3-карбонову кислоту, т.пл. 242-244 0. б-Метил-9-(3,4-дихлорфенилгидраэоно )-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо ( 1 ,2 -а )пиримидин-3-карбоновую кислоту, т.пл. 248-250 С. 9-(2-Оксифенилгидразоно)-6-мётил-4 -оксо-б ,7,8,9-тетрагидро-4Н-пиридо-; (1 , 2-а ) пиримидин-3-карбоновую кисло ту, т.пл. 252-254«С. 6-Метил-9-(3-нитрофенилгидразоно -4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кис лоту, т.пл. 268-270 С., 6-Метил-9- (2-нитрофенилгидразоно -4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоиовую.кис лоту, т.пл. 270-274®С. 9-(З-Хлорфенилгидразоно)-б-метил -4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (i,2-а)пиримидин-3-карб6новую кис лоту, т.пл, 263-265С. 9--(4-Йодфенилгидразоно7-б-мётил-4-оксо-б ,7,8, 9.-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, т.пл. 245-246 0, 6-Метил-9-(1-нафтилгидразоно)-4-оксо-б ,7,8,9-тетрагидро 4Н-пиридо{1 ,2-а)пиримидин-3-карбоновую кисло ту, т.пл. 240-242 0. 9-(4-Карбоксифенилгидразоно)-б-метил-4-оксо-6 ,7,8,9-тетрагидро-4Нпиридо (1,2-а)пиримидин-3-карбоновую .кислоту, т.пл. 280-281 0, б-Метил-9-(2-метил-б-хлорфенилгидраэоно ),-4-оксо-б ,7,8 ,9-тетрагидро-4Н-пиридо ( 1 ,2-а)пиримидин-3-карб новую кислоту, т.пл. 205-207 0. б-Метнд-9-(3-метилфенилгидразоно , -4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кис лоту, т.пл, 242-244 0. (Трифторметил)-фенилгидразоноЗ б-метил-4-оксо-б ,7,8 ,9-тетраг ро-4Н-пиридо(1,2-а)пиримидин-3-карб новую кислоту, т.пл. 2б8-2б90. (Трифторметил)-фенилгидразо нб -б-метил-4-оксо-б,7,8,9-тетрагид ро-4Н-пиридо(1,2-a)пиpимидин-3-кapбoнoвyю кислоту, т.пл. 273-274°О. 9-(2,б-Диэтилфенилгидразоно)-б -метил-4-оксо-б,7,8,9-тeтpaгидpo-4H-пйpидo ( 1 ,2-й)пиримидин-3-карбоно-вую кислоту, т.пл. 1бО-1630. 9-(4-Фторфенилгидразоно)-б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо ( 1 ,2-а)пиридин-3-карбоновую кислоту , т.пл. 246-248 0. б-Метил-9- (4-1у1етилфенилгидразоно) -4-оксо-б ,7,8, 9-тетрагидро-4Н-пиридо- (1,2-а)пиримидин-3-карбоновую кислоту/ т.пл. 242-244 0.: 9- (4-Оксифенилгидраэоно) -б-метил 4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту , т.пл. 240-242 0, 9- (2, бт-Дихлорфенилгидразоно) -6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, т.пл, 230-232°О. Гидрат-б-метил-9-(3,4-метилендиоксифенилгидразоно )-4-оксо-б/7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, т.пл. 2262270 , 9- (4,-Ацетилфенилгидразоно) -б-меТИЛ-4-ОКСО-6 ,7,8,9-тетрагидро-4Н -пиридо(1,2-а)пиримидин-3-карбоновую кислоту, т.пл. 245-2470. б-Метил-9-(2-метоксифенилгидразоно )-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1 ,2-а) пиримидин-3-карбоновую кислоту, т.пл. 21б-2180. б-Метил-9- (4-метоксифенилгидра-зоно )-4-оксо-б,7,8,9-тeтpaгидpo-4H-пиpидo (l , 2-a)пиpимидин-3-кapбo нoвyю кислоту, т.пл. 212-214С. 9- (4-Бром-2-хлорфенилгидразоно) -. -6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо ( 1 ,2-a)пиpи /IИДИн-3 кapбo нoвyю кислоту, т.пл. 245-247 0. Этиловый эфир 7-метил-9-фенилгидразоно-4-оксо-6 ,7,8,9-тетрагидро-4Н-п1сридо (1 ,2-а) пиримидин-3-карбоновой кислоты, т.пл. 1б5-1670, Этиловый эфир 8-метил-9-фенилгидразоно-4-оксо-б ,7,8,9-тетрагидрО -4Н-пиридо( 1 ,2-а)пиримидин--3-карбоновой кислоты, т.пл. 108-110о. 9-Фенилгидразоно-2,б-диметил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоксамид, т.пл. 235-237 0.: Этил-9-фенилгидразоно-б-метил- -4-оксо-б ,7, 8,9-тетрагидро-4И-пирйдо (1,2-а)пиримидин-3-ил-ацетат, т.пл. 100-102 С. 9-Фенилгидразоно-б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1 ,2-а) пиримидин-3-ил-уксусную кислоту, т.пл. 1бО:1б20. . 9-фёнилгндраэоно-б-метил-б,7,8,9-тетрагидро-4Н-пиридо 1 ,2-а)пириМИДИН-4-ОН , т.пл. 1бЗ-1б50. Этилойый эфир ЕЭ-(фенилгидразоно) -б-метил-4-оксо-б ,7,8 ,9-тетраг:.1дро74Н-пиридил (1,2-а)пиримидин-3-ил -ИРОПИОНОВОЙ КИСЛОТ., Т.ПЛ. .
9-(фенилгидразояо)-8-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пирило (1,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 234-236 0.
6-Метил-9-{4-нитрофенилгидразоно ) -4-ОКСО-6 ,7,8 ,9-гтетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 242-244 С.
Моногидрат 9-(З-карбокси-З-хлорфенилгидраэоно ) -6-метил-4-оксо-6,7, 8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин- 3-карбоновой кислоты, Т.ПЛ. 275-276 С.
9-(Фенилгидраэоно)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-(N-метилкарбоксамид ) , Т.ПЛ. 153-154 С.
2-Сб-Метил-4-оксо-б,7,8,9-тетрагцдро-4Н-пиридо (1,2-а)пиримидин-9--йЛиденгидразоно -бензойную кислоту, Т.ПЛ. 170-172вС.
3- б-Метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-илиденгидраэоноЗ-бензойную кислоту, Т.ПЛ. 260-262 С.
9-(4-Бифенилгидразон)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо-{1 ,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 160-162 С,
9- («-Феноксифенилгидразоно) -б-меТИЛ-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую Кислоту, Т.ПЛ. 220-222С.
9-(2-Нафтилгидразоно)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 172-174 С.
9- (2|-Карбокси-3-нафтилгидразоно)--б-метил-4 -оксо-б , 7,8,9-тетрагидоо-4Н-пнридо{1 ,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 260-262 С.
9-(4-Этилфенилгидразоно)-6-метил74-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо{1 ,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 208-210 0.
9-{4-Цианофенилгидразоно-б-меГИЛ-4-ОКСО-6 7,8,9-тетрагидро-4Н-пирИдо (1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 223-225 С.
9- (2- Ацетилфенилгидразоно) -б-ме-, ТИЛ-4--ОКСО-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 245-246 0.
9- (3-Ацетилфенилгидр азрнр) -6-меТИЛ-4-ОКСО-6 ,7,8,9-тетрагйдро-4Н-пнридо (I,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 238-240 0.
6-Метил-9- (i-трифторметилфёнилгидразоно )-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую к ислоту, Т.ПЛ. 238-240 0.
9- (2-Хлорфенилгидразоно) -б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-гй1ридо (1,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 2бО-2б2 С.
9-(2-Бромфенилгидразоно)-б-метил-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 265-267 0.
9-(3-Бромфенилгидразоно)-6-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 260-262 0.
9-(2-Йодфенилгидразоно)-б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (,2-а)пиримидин-3-карбоновую кислоту , Т.ПЛ. 246-248 0.
0 9-(3-Йодфенилгидразоно)-б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-З-карбоновую кислоту , Т.ПЛ. 258-260 0.
9-(З-Карбоксифёнилгидразоно)-б-ме5 тил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1.2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 263-265 0.
9-{2-Этоксифенилгидразоно)-6-меТИЛ-4-ОКСО-6 ,7,8,9-тетрагидро-4НQ -пиридо(1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 225-227 С.
9-(3-Этоксифенилгидразоно)-б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую 5 кислоту, Т.ПЛ. 210-211 0.
(+)-9-(4-Этоксифенилгидразоно)-6-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 208--209О.
(+)-9-(2-Карбоксифенилгидразоно) -6-метил-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновую кислоту, Т.ПЛ. 260-261 0.
()9-(2-Карбоксифенилгидразоно)-6-метил-4-оксо-б ,7,8,9-тетрагидро5 -4Н-пиридо(1,2-a)пиpимидин-3-кapбoнoэyю кислоту, Т.ПЛ. 2б1-2б2 0.
() -9- (4-Хлорфенилгидразоно) -б-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбо0 новую кислоту, т.пл. 255-256 0.
Пример 3. К 780 мл метанола добавляют 80,0 г (0,28 моль) 9-бром-6-метил-4-оксо-6 ,7,8,9-тетрагидро2 -г4Н-пиридо( 1 , 2-а)пиримидин-3-карбоновой кислоты, затем быстро добавляют к суспензии 15,5 мл 50%-ного водного раствора гидразингидрата. Ре: акциониая смесь нагревается и переходит в светлый раствор. Раствор
0 при комнатной температуре перемешивают в течение 2-3 ч, затем отфильтровывают выпавшие кристаллы. Отделенную смесь гидразония растворяют в 400 мл воды и добавлением эквива5 лентного количества гидросульфонат калия высвобождают кислоту. Выпавшие кристаллы отфильтровывают, промывают небольшим количеством и затем сушат. После перекристалли0 зации из 50%-ного водного этанола получают 40,2 г (60,3%) 9-гидраэоно-б-метил-4- ксо-б ,7,8,9-тетрагидро-4Н-пириДо (1,2-а)пиримидин-3-карб6новой кислоты, которая плавится при
5 202-203«0.
Элементный анализ.
Рассчитано,%: С 50,84; Н 5,12; ,N 23,72.
Найдено,%: С 50,46; Н 5,30; N 23,68.
Пример 4. К раствору г (12,73 ммоль) этилового эфира 9-бро -6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-ПИРИДО (1,2-а)пиримидин-3-карбоновой кислоты в 20. мл этанола при перемешивании по каплям добавляют 8 мл 50%-ного водного раствора гидразингидрата . Рас;вор при комнатной температуре перемешивают в течение 2 ч. Выпавшие кристаллы отфильт ровывают, промывают небольшим коли ,чеством этанола и затем сушат. Посл перекристаллизации из этанола получают 1,6 г (50,2%) 9-гидразоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-пиридо (-1 i 2-а )пиримидин-3-карбогидразида , который плавится при 219220°С .
Пример 5. 10,О г
(34,95 ммоль) 9-брсж4-6-метил-4-оксо 6,7,8,9-тетрагидро-4Н-пириДо(1,2-а пиримидина-3-карбоксамида при нагревании растворяют в 150 мл метанола. К раствору осторожно, при перемешивании , в течение 10 мин прикапывают 20 мл гидразингидрата. Реакционную смесь кипятят 40 мин и затем отгоняют в вакууме метанол. Кристаллы отфильтров,ывают, промывают водой и затем перекристаллизовывают из .воды Получают 3,8 г (46,5%) 9-гидразоноб-метил-4-оксо-6 ,7, 8,9-тетрагидро-4Н-пиридо (1,2а)пиримидин-3-карбоксамида , который плавится при 248250 С .
Элементный анализ.
Рассчиаано,%: С 51,06; Н 5,57; N 29,77.
Найдено,%: С 50,59; Н 5,46; N 29,85.- .
Приме,р 6. К приготовленному с 20 мл метанола раствору 2,9 г (0,01 моль) 9-бром-6-метил-4-оксо б ,7,8,9ттетрагидро-4Н-пиридо(1 ,2-а) пиримидин-3-карбоксамида добавляют 0,025 моль п-(N,N-диaмeтилaминo)-бензальдегидгидразона . Смесь при перемешивании кипятят в течение 1-3 ч. Получают 6-метил-9 4-(N ,Н-диметиламино )-бензилйденгидразоно -4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоксамид, который плавится при 220-222 С.
Элементный анализ.
Рассчитано,%: С 62,28i.H 6,05; N 22,98.
«гг 6 О а
Найдено,%: С 62,12; Н 6,00;
N 22,87.
Пример 7. Работают по описанному в примере 6 способу, однако в качестве производного гидразина используют метилгидразин. Получают 40%-ный выход 6-метил-9-метилгидразно-4-оксо-6 ,7,8,9-тетрагидро-4Н-пирдо (1,2-а)пиримидин-3-карбоксамида, который плавится при 228-230Ci
Элементный анализ,
Расчитано,%: С 53,00; Н 6,06; N 28,09.
С % %0 2
Найдено,%: С 52,57 Н 6,03; N 28,00.
Пример 8. Работают по способу примера 6; однако исходят от 2-капролактамгидразона. Получают 55%-ный Выход 9-(2-азепинилиденгидразона )-6-метил-4-оксо-6,7,8,9 тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоксамида , который плавится при 228-2300С.
Элементный анализ.
Рассчитано,%s С 58,16; Н 6,71 N 25,43.
.%02
Найдено,%: С 58,12; Н 6,57;
N 25,41.
Пример 9. К приготовленному с 20 мл метанола раствору 2,9 г (0,01 моль) 9-бром-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо( 1 , пиримидин-3- сарбоновой кислоты добавляют 0,025 моль метилгидразина. Реакционную смесь при перемешивании кипятят 1-3 ч. Получают 25%-ный выход 6-мвтил-9-метилгидразоно-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1 ,2-.а)пиримидин-3-карбоновой кисло ,ты, которая плавится при 216-,,218 С,
Элементный анализ.
Рассчитано,%г С 52,79; Н 5,62; N 22,38,
C H H4%02.
Найдено,%: С 51,99; Н 5,49.
N 22,28.
Пример 10. Работают по описанному в примере 9 способу, однако исходят из 8-капролактангидразона. Получают 40%-ный выход9-(2-азепинилиденгидразоно )-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо(1,2-а пирнмидин-3-карбоновой кислоты, которая плавится при 166-170®С.
Элементный анализ.
Рассчитано,%5 С 57,99; Н 6,38; N 21,13.
C feHlfNg-O
Найдено,%: С 57,82; Н 6,29; N 21,10.
П р и м е р 11.5,7 г ((о,2 моль 9-бром-6-мети.71-4-оксо-6,7,8, 9-тетрагидpo-4H-пиpJ дo{ 1 ,2-а)пиримидик-3-карбоновой кислоты растворяют в 30 мл безводного этанола и добавляют 4,3 мл 30,044 моль фенилгидразина . Реакционную смесь нагревают с обратным холодильником при переме 1иивании в течение 4 ч, после чего отфильтровывают образовавйиеся крис таллы и промывают их этанолом. Таки способом получают 4,7 г (75,2%). 9-(фенилгидразоно)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо(1 ,2-а пиримидин-3-карбоновой кислоты, т,пл. 258-2бОС. После перекристаллизации из диметилформамида темпера тура плавления повышается до 267268°С . Пример 12. Проводят те же операции в той же последовательност что и в примере 11, но используют (-)-9-бром-б-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-8-карбоновую кислоту -45° (сг1, метанол). Таким способом полу чают ( + )-9-(фенилгидразоно )-6-метил -4-ОКСО-6,7,8,9-тетрагидро-4Н-пирид ( 1,2-а)пиримидин 3-карбоновую кислоту . Выход 76,0%, т.пл. 256-257С Cd-J|j + 407,5(, диметилформамид ). Пример 13. В соответствии с примером 2, но с заменой фенилгид разина,N-аминопиперидином, с выпариванием реакционной смеси в вакууме , растворением остатка в метаноле и прибавлением 0,15 мл .70%-ной по весу хлорной кислоты, с конечным фильтрованием для выделения кристал лов, промываемых метанолом, получаю п ерхлора т 6-метил-9-(1-пипериди ноим но)-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоново кислоты, плавящийся при 167-178 С. Выход составляет 53,7%. Элементный анализ. Рассчитано,%: С 44,51; Н 5,23; N 13,84; се 8,78. сео4 Найдено;%: С 44,20} Н 5,21; N 13,81; се 8,91. Пример 14, Согласно примеру 2, но заменяя фенилгидразин на 2-гидразинопиридин и перекристаллизовывая сырой продукт из ацетонитрила получают 6-метил-9-(2-пиридилгидразон ) -4-окси-6,7,8,9-тетрагидро 4Н-пиридо( 1 ,2-а-)пиримидин-3-карбокислоту , т.пл. 233-234°С. Выход 66,2%. Элементный анализ. Рассчитано,%: С 57,50; Н 4,83; N 22,35. С.г H.g NC-OI, Найдено, %: CJ 57,83; Н 4,86; N 22,05. Пример 15. К раствору 0,6 (0,015 моль) гидроокиси натрия в 25 мл воды добавляют 3,4 г (0,01 мол этилового эфира 9-(фенилгидразойо) 6-метил-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты. Суспензию перемешивают при 50-60 С в течение 4-5 ч. причем все компоненты переходят в раствор. Разбавленной 1:1 водной соляной кислотой устанавливгиот рН раствора равный 2. Выпавшие кристаллы отфильтровывают и промывают небольшим количеством воды. Получают 2,1т (86,4%) 9-(фенилгидразоно)-6-метил-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, которая плавится при 267268 С . Пример 16. В суспензию 34,0 г (0,14 моль) 9-гидразоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты в. 700 мл безводного этанола при 10-15 С .и перемешивании вводят сухой хлористый водород. После насыщения раствора его оставляют стоять на ночь в холодильном шкафу. На следующий день растворитель отгоняют при пониженном давлении . Остаток растворяют в 50. мл воды. Раствор нейтрализуют 5%-ным водным содовым раствором и экстрагируют 4i100 мл хлороформом. Объединенные органические фазы сушат над прокаленным сульфатом натрия и затем упаривают в вакууме. Остаток перекристаллизовывают из мет.анола. Получают 18,0 г (48,6%) этилового эфира 9-гидразоно-6-метил-4-оксо-6, 7,8,9-тетрагидро-4Н-пиридо(1 , 2-а )пиримидин-3-карбоновой кислоты, который плавится при 199-200°С. Элементный анализ. Рассчитано,%: С 54,54; Н 6,10; N 21,20. C-fi Нуб 4 0 Найдено,%: С 53,88; Н 6,20; N 21,10. Пример 17. Суспензию 2,0 г (7,57 ммоль) этилового эфира 9-гидразоно-6-метил-4-окс6-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты и 20 мл этанола доводят до кипения и по каплям смешивают с 4 мл 50%-ного водного раствора гидразингидрата. После 15-минутного кипения получают раствор , из которого при охлаждении иачи нают выпадать кристаллы. Сырой продукт перекристаллизовывают из метанола . Получают 1,0 г (52,8%) 9-гидразоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбогидразида , который плавится при 219-220 с. Элементный анализ. Рассчитано,%: С 47,99; Н 5,64; N 23,58. Cyg, Найдено,%: С 48,43; Н 5,67; N 23,59. Пример 18. К раствору 2,0 г (7,57 ммоль) этилового эфира 9-гидраэоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты в 20 мл безводного хлороформа добавляют 1,6 мл ,(11,35 моль) триэтиламина и 1,3 мл (11,35 ммоль) бензоилхлорида. Смесь кипятят в течение 2 ч, затем охлаждают до комнатной температуры и основател1зно встряхивают с 20 мл воды Органическую фазу отделяют, водную фазу экстрагируют 10 мл хлороформа. Объединенные органические фазы суша над прокаленным сульфатом натрия и затем упаривают в вакууме. Остаток перекристаллизовывают из метанола. Получают 1,5 г (53,8%) этилового эфира 9-(бензоилгидразоно)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо-« (1 , 2-а)пиримидин-3-карбоновой кислоты , который плавится при 209-210 с
Элементный анализ.
Рассчитано,%: С 61,96; Н 5,47; N 15,20.
С 9 го 4-°4Найдено ,%: С 62,02; Н 5,58;
N 15,61.
Пример 19. К 12 мл диметилсульфоксида добавляют 2,0 г (7,57 ммоль) этилового эфира 9-гидразоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты. Суспензию смешивсцот с 1,2 мл (11,88 ммоль) бензальдегида. Реакционную смесь оставляют стоять при комнатной температуре на 4-6 дней, Причем за это время образуется раствор. Раствор разбавляют 20 мл воды и встряхивают мл бензола. Объединенные органические фазы сушат над прокаленным сульфатом на.трия и упаривают при пониженном давлении. Остается масло темного цвета, из которого при добавлении 25 мл диэтилового эфира выпадают кристаллы. Кристаллы отфильтровывают и промывают небольшим количеством эфира. Получают 2,0 г (75fO%) продукта. Конечный продукт является смесью изомеров.. Изомеры разделяют методом препаративной тонкослойной хроматографии на пластине со слоем силикагеля ( см, толщина слоя 1,5 мл, силикагель 60 Рр 254366 ), причем в качестве проявителя используют бензол-метанольную смесь Е соотношении 7:1, а в качестве растворителя - метанолдихлорметановую смесь в соотношении 1:10.
Веществом с наибольшим значением R является этиловый эфир 9-(бензилид енгидразино)-б-метил-4-оксо-6, 7-дигидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты. После перекристаллизации из метанола получают 0,12 г продукта, плавящегося при 142-144 С.
Элe teнтный анализ.
Рассчитано,%: С 64,77; Н 5,72; N 15,89.
Изо N40%
Найдено,%: С 64,70; Н 5,85; N 15,73.
Веществом с наименьшим значением R{ является этиловый эфир 9-(бензилиденгидразоно )-6-метил-4-оксо-6,7 8,9-тетрагидро-4Н-пиридо(1 ,2 - а)пиримидин-З-карбоновой кислоты. После перекристаллизации из метанола получают 0,75 г плавящегося при. 133134С продукта.
Элементный анализ.
Рассчитано,%: С 64,77; Н 5,72; 15,89.
С.рН.
Наадено,%: С 64,43;
Н 5,53; 5 N 15,82.
Пример 20. 7,8 г ( О, О 2 моль; этиловогб эфира 9-фенилгидразоно-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоQ новой кислоты растворяют в 100 мл этанола. Раствор смешивают с 6,0 мл 98%-ного гидразингидрата и затем два часа кипятят с флегмой. При охлаждении начинают выпадать кристал5 лы. Кристаллы отфильтровывают и промывают этанолом. Получают 5,4 г (82,7%) 9-фенилгидразоно-6-метил-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбогидразида, который плавится при 205-207®С, Элементный анализ. Рассчитано,%: С 58,89; Н 5,56;
N 25,75.
Н-/0 6 Oi
Найдено,%: С 58,06; Н 5,47j N 25,52.
П ри м е р 21. К раствору 2,15 т (0,036 моль) гидрата окиси калия в 50 мл воды прибавляют 4,3 г (0,012 моль) этилового эфира 9-(фенилгидразоно )-6-метил-4-оксо-6,7, 8,9-тетрагидро-4Н-пиридо(1,2-а) пиримийин-3-илЗ уксусной кислоты и полученную смесь перемешивают при комнатной температуре 4 ч. Величину 5 РН раствора устанавливают на уровне 3 при помощи 10%-ного по весу раствора соляной кислоты. Осадившиеся кристаллы отфильтровывают и промывают водой Получают 2,95 г (75,6%) 9-(фенилгидразоно)-б-меТИЛ-4-ОКСО-6 ,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-ил}-уксусной кислоты, плавящейся при 161162С .
Пример 22. раствор 2,1 г этилового эфира 9-(4-метилфенилсульфонил )-(оксиимино)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо(1 , 2-а )пиримидин-3-карбоновой кислоты и 1,08 г фекилгидразйна в 40 мл толуола кипятят в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и осадившиеся кристаллы отфильтровывают. Фильтрат выпаривают при пониженном давлении и 5 остаток растворяют в 7 мл 30%-ного
(вес/объем) раствора хлористого водорода в метаноле. ОсадившИйся гидрохлорид отфильтровывают, суспендируют в 100 мл воды и величину рН раствора устанавливают на уровне 8 при помощи 20%-ного (вес/объем) раствора карбоната натрия. Осадившаяся маслянистая фаза кристаллизуется при царапании стеклянной палочкой по стенкам сосуда. Получают 1,4 этилового эфира 9-(фенилгидразоно)-6-метил-4-оксо-6 ,7,8,9-тетрагидро-4Н-ПИРИДО (1,2-а)пиримидин-3-карбоаовой кислоты, кристаллизующегося с 1 моль этанола. Продукт плавится при 80-82 С. Водную фазу встряхивают с хлороформом, раствор сушат и выпаривают для получения дополнительного количества продукта в количестве 3,3 г. После перекристаллизации 1,7 г продукта из 20 мл этилацетата получают этиловый эфир 9-(фенилгидразоно )-6-метил-4-оКсо-6,7,8,9-твтрагидро-4Н-пиридо (t,2-а)пиримидин-3-карбоновой кислоты, плавящийся при 137 -Д39С.
Пример 23. 2,2 г (0,01 моль) 9-гидрокси-б-метил-4-оксо-6,7-дигидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты растворяют в 15 мл безводного этанола и к полученному раствору добавляют 1,2 мл (О,012 мол фенилгидразина. Реакционную смесь
нагревают с обратным холодильником при перемешивании в течение получаса; выпадающие при атом кристгшлы отфильтровывают и промывают этанолом. Таким способом получают 2,4 г (76%) 5 9-(фенилгидразоно)-6-метйл-4-оксо-6 ,7,8,9-тетрагидро-4Н-пиридо( 1 ) пиримидйн-3-карбоновой кислоты с т.пл. 267-2б8 С (из диме тил формамида ).
0 Пример. 24. К 20 мл ацетона прибавляют 0,5 г 9-(фeнилгидpaзинo)-б-мeтил-4-oкco-6 ,7 ,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбогидраэила . Реакционную смесь кипя5 тят в течение 3 ч при энергичном перемешиван1;и . После этого смесь охлаждают ,- осадившиеся кристаллы отфильтровывают и промывают ацетоном. .Получают 0,35 г М -изопропилиден-90 -(фенилгидразоно)-6-метил-4-оксо 6 ,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-3-карбогидразида , плавящегося при 293-295 С после перекристаллизации из смеси хлороформа и этанола.
5
Элементный анализ. Рассчитано,%: С 62,29; Н 6,05) N 22,93.
N«OI
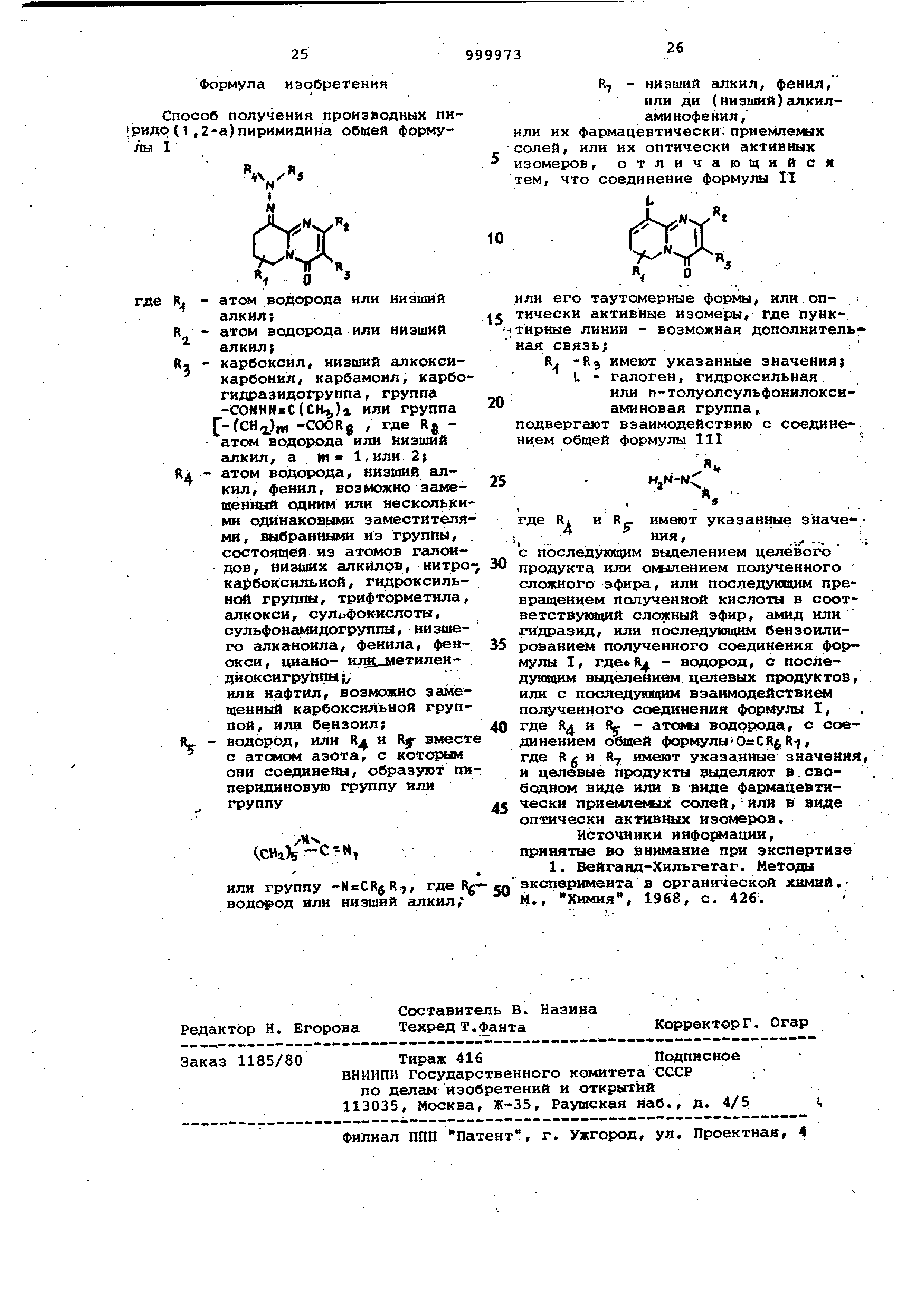
Найдено,%: С 62,29; Н 6,14; N 23,10. Формула изобретения Способ получения производных пи| .ридр (1 ,2-а)пиримидина общей форму-1 О где R, - атсяи водорода или низшей алкил; атом водорода или низший алкил J карбоксил, НИЗШИЙ алкоксикарбонил , карбамоил, карбо гидразидогруппа, группа -CONHNsC{CK,,)a или группа r-fCH)w -COORg , где Rg атом водорода или низший сшкил, а W 1,или 2; атом водорода, низший алкил , фенил, возможио замещенный одним или нескольки ми одинаковыми заместителя ми, выбранными из группы, состоящей из атомов галоидов/ низиих алкйлов, нитро карбоксильной, гидроксильной группы, трифторметила сшкокси, сулифокислоты, сульфонамидогруппы, низшего апканоила, фенила, фенокси , циано- илн л1етилеидйоксигруппы}/ или нафтил, возможно замещенный карбоксильной груп пой, или бензоил} водород, или Kj и Rf вмест с атомом азота, с которым они соединены, образуют пи перидиновуго группу или группу ССИг), или группу -NsCRgR7f Д® % водород или низший алкил/ R - низший алкил, фенил, илн ди (низший) гшкиламинофенил/ или их фармацевтически приемлемых солей, или их оптически активных изомеров, отличающийся тем, что соединение формулы II или его таутомериые формы, или оптически активные изомеры, где пунктирные линии - возможная дополнительная связь; R -Rj имеют указанные значения; L - галоген, гидроксильная или п-толуолсульфонилоксиамйновая группа, подвергают взаимодействию с соединением общей формулы 111 где RI и Rg. имеют указанные значе- ,ния, .... ;. с последующим выделением целевого продукта или омылением полученного сложного эфира, или последующим превращением полученной кислоты в соответстВукяций сложный эфир, амид или гидразид, или последующим бензоилированием полученного соединения формулы I, где Rj|. - водород, с последующим выделением целевых продуктов, или с последу ощим вэаимодейс гвием полученного соединения формулы I, . где R и Ry - атома водорода, с соединением общей формулы) Rf, где RgH R имеют указанные значения, и целевые продукты выделяют в свободном виде или в -виде фармацевтически приемлемых солей,-или в виде оптически активных изомеров. Источники инфо1Я4ации, принятые во внимание при экспертизе 1. Вейганд-Хильгетаг. Методы эксперимента в органической химий. М., Химия, 1968, с. 426.












Реферат

Формула


Комментарии