Антибактериальные замещенные 7-ациламино-3-(метилгидразоно)метилцефалоспорины, способ их получения, фармацевтические композиции на их основе, промежуточные соединения и способ лечения заболеваний, вызванных микроорганизмами - RU2201933C2
Код документа: RU2201933C2
Чертежи


















Описание
Изобретение относится к антимикробным цефалоспоринам. Первым объектом
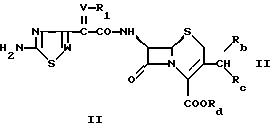
настоящего изобретения является соединение формулы

где
R1 означает водород, ацил, карбоксил или алкил,
R2 и R3 являются одинаковыми или различными и каждый независимо друг от друга означает водород, циклоалкил, алкил, алкенил или алкинил,
R4 означает водород или группу формулы

где
R6 означает амино, гидразино, аминоалкиламино, алкокси, арил, циклоалкил, арилокси, гетероциклил, алкил, алкенил, алкинил,
R5 означает водород или сложноэфирный остаток,
W означает СН или N,
V означает СН или N-O и
Z означает О, S или NR7, где R7 имеет значения, указанные для R2, при условии, что R2, R3 и R4 одновременно не означают водород, и, если R4 означает водород, то R1 не означает Н или СН3.
Соединение формулы I включает
соединение формулы

где
W и R5 имеют значения, указанные выше,
R1 означает водород или алкил, включая, например незамещенный алкил, например, С1-С12алкил, такой как (низш. алкил), или алкил, замещенный, например, галогеном, карбоксигруппой, например, означает водород или СН2F,
R2, и R3, являются одинаковыми или различными и каждый независимо друг от друга означает водород, алкенил, например С2-С4алкенил, или алкил, например, незамещенный или замещенный галогеном, арилом, предпочтительно арилом, включая незамещенный арил или арил, замещенный, например, алкоксигруппой, такой как С1-С4алкокси или гидрокси, например, R2, означает водород, алкил или алкенил, а R3, означает водород или алкил, и
R4, означает водород или группу формулы

где
Z' означает О или NR'7, где R'7 означает водород или алкил, например, (низш.)алкил, и
R6, означает амино, включая, например ди(низш.)алкиламино, амино-алкиламино, включая, например, (ди(низш.)алкил)ами-но(низш.)алкиламино, гидразино, алкокси, например (низш.)алкокси, незамещенный арил или арил, замещенный, например, (низш.)алкилкарбонилокси, (низш.) алкокси, циклоалкил, 5-6-членный гетероцикл, содержаший 1-3 атома азота, и/или серы, и/или кислорода, например, 1-3 атома азота, например, такой как пирролидинил, алкил, алкенил, алкинил, включая алкил, алкенил, алкинил, прерванные N, S и/или О, например незамещенные алкил, алкенил, алкинил или алкил, алкенил, алкинил, замещенные гидроксигруппой, арилом, гидроксиарилом, гуанидиногруппой, нитрогуанидиногруппой, алкоксигруппой, арилоксигруппой, ацилоксигруппой, карбамоилоксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой, триалкиламмонием, ациламиногруппой, уреидогруппой, алкоксиминогруппой, оксиминогруппой, иминогруппой, карбоксигруппой, оксогруппой, галогеном, нитрогруппой, производным карбоновой кислоты, производным сульфокислоты или гетероциклилом, например, такой как алкил, например алкил, однократно или многократно замещенный арилом, незамещенной или замещенной гидроксигруппой, алкоксигруппой и феноксигруппой; арилокси, например, фенокси; амино, включая, например, ди(низш.)алкиламино; гидрокси, карбокси, гуанидино или нитрогуанидино, или гетероциклилкарбоксиминогруппой;
при условии, что R2, R3 и R4 одновременно не означают водород.
Если не указано иное, в контексте настоящего изобретения любая алифатическая группа означает алифатическую группу, содержащую до 20, например 12, в частности 8 С-атомов. Ацил включает алифатический или ароматический ацил. (Низш.)алкил включает С1-С4алкил. Арил включает арил, содержащий до 18, например 12, С-атомов, включая, например, фенил, нафтил. Циклоалкил включает С3-С8циклоалкил, такой как С1-С6циклоалкил.
Гетероциклил включает, например, насыщенный или (частично) ненасыщенный гетероциклил, содержащий в цикле 5 или 6 атомов, например 1-5 атомов, в том числе 1-3 атома азота и/или 1-3 атома серы и/или кислорода в качестве гетероатомов, включая, например, конденсированный гетероциклил, такой как бензтиазолил. По определению любая группа может быть незамещенной или замещенной, например, группами, которые являются обычными в химии β-лактамных соединений. Замещенный гетероциклил предпочтительно включает гетероциклил, замещенный аминогруппой, гидроксигруппой, алкоксигруппой, ацилоксигруппой, карбоксигруппой или меркаптогруппой. Сложноэфирный остаток включает алкил, предпочтительно С1-С6алкил, например С1 -С4алкил, аралкил, например бензил, алкоксибензил, такой как 4-метоксибензил, инданил, фталидил, алкоксиметил, например метоксиметил, С1-С6алканоилокси С1 -С6алкил, С1-С6алкоксикарбонилокси С1-С6алкил, глицилоксиметил, фенилглицилоксиметил, (5-метил -2-оксо-1,3-диоксолен-4-ил)метил; сложноэфирный остаток также включает такие группировки, которые образуют с СОО-группой физиологически гидролизуемый и физиологически приемлемый сложный эфир, например, такие как известные в химии цефалоспоринов гидролизуемые сложноэфирные группы. Таким образом, соединение формулы I может быть получено в форме физиологически гидролизуемого и физиологически приемлемого сложного эфира. Термин физилогически гидролизуемый и физиологически приемлемый сложный эфир в контексте настоящего изобретения означает сложный эфир, в котором СОО-группа этерифицирована и который гидролизуется в физиологических условиях с образованием кислоты, которая сама физиологически переносима в дозах, подлежащих введению. Таким образом, этот термин следует понимать как относящийся к обычному пролекарству.
Сложноэфирная группа предпочтительно означает группировку, которая легко гидролизуется в физиологических условиях. Предпочтительно такие сложные эфиры вводятся перорально. Парентеральное введение может назначаться в том случае, если сложный эфир сам по себе является активным соединением или если его гидролиз протекает в кровотоке. Силильная группа означает обычную силильную защитную группу, такую как триалкилсилил, например триметилсилил. Уходящая группа означает обычную уходящую группу для описанных типов реакций; в реакции ацилирования аминогруппы в качестве ацилирующих агентов используются, например, производные карбоновых кислот, такие как галоидангидриды, активированные эфиры, смешанные ангидриды. Термин катион означает такой катион, который образует фармацевтически приемлемую соль с соединением формулы I, например соль металла, такого как натрий, калий, соль амина (аммониевая), такого как триалкиламин, прокаин, дибензиламин, бензиламин, аммоний.
Соединение формулы I включает соединение формулы

где
R5 имеет значения, указанные выше,
R2s и R3s каждый независимо друг от друга означает алкил, например С1-С6алкил, такой как (низш. )алкил; циклоалкил, аралкил, например ар-С1-С6алкил, такой как ар-С1-С4алкил; арил; алкенил, например С1-С6алкенил, такой как С2 -С4алкенил; или алкинил; R3s, кроме того, означает водород; например, R2s означает алкил, алкенил или аралкил, а R3s, например, означает водород или алкил; например, соединение формулы
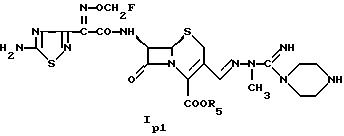
где R5 имеет значения, указанные выше.
Соединение формулы I
включает соединение формулы

где
R1, R5, W и V имеют значения, указанные выше,
R2p и R3p являются одинаковыми или различными и каждый независимо друг от друга означает водород, циклоалкил или алкил, замещенный галогеном или гидроксигруппой,
R6p означает амино, незамещенный или замещенный алкиламино или диалкиламино, алкокси, арил, циклоалкил, арилокси, незамещенный, 5- или 6-членный, насыщенный, частично насыщенный или ненасыщенный гетероцикл, который может быть сконденсирован, содержащий 1-5 атомов азота и/или 1-3 атома серы и/или кислорода, замещенный 5- или 6-членный, насыщенный, частично насыщенный или ненасыщенный гетероцикл, который может быть сконденсирован, содержащий 1-5 атомов азота и/или 1-3 атома серы и/или кислорода, имеющий в качестве заместителя амино-, гидрокси-, алкокси-, ацилокси-, карбокси- или меркаптогруппы; циклоалкил или незамещенные линейные или разветвленные С1-С20алкил, С1-С20алкенил или С1-С20 алкинил, которые могут быть прерваны N, S и/или О, однократно или многократно замещенные, линейные или разветвленные С1-С20алкил, С1-С20алкенил или С1-С20алкинил, которые могут быть прерваны N, S и/или О, имеющие в качестве заместителя гидрокси, алкокси, арилокси, ацилокси, карбамоилокси, амино, алкиламино, диалкиламино, триалкиламмоний, ациламино, уреидо, оксимино, имино, карбокси, оксо, галоген, нитро, производные карбоновой кислоты, производные сульфокислоты, незамещенный 5- или 6-членный, насыщенный, частично насыщенный или ненасыщенный гетероцикл, содержащий 1-5 атомов азота, и/или 1-3 атома серы, и/или кислорода, который может быть сконденсирован; либо замещенный 5- или 6-членный, насыщенный, частично насыщенный или ненасыщенный гетероцикл, который может быть сконденсирован, содержащий 1-5 атомов азота и/или 1-3 атома серы и/или кислорода, имеющий в качестве заместителя амино-, гидрокси-, алкокси-, ацилокси-, карбокси- или меркаптогруппы;
Zp означает кислород или NR7p, где R7p имеет значения, указанные для R2p. Соединение формулы I включает соединение формулы

где
W и R5 имеют значения, указанные выше,
R1p означает водород или СН2F и
R6p' означает водород, С1-С20 алкил или С1-С20 алкил, однократно либо двукратно замещенный фенилом, фенокси, амино, гидроксифенилом, гидрокси, карбоксилом, гуанидино или нитрогуанидино; незамещенный фенил или фенил, замещенный ацетокси, пирролидинилом; или соединение формулы

Соединение формулы I включает соединения, имеющие формулы Ia, Is, Ip1, Ip2 и Ip3, и может существовать, например, в свободной форме или в форме соли и/или в форме сольвата.
Соль включает любую возможную соль, например кислотно-аддитивную соль, такую как гидрохлорид, внутреннюю соль, соль с металлом, четвертичную соль или соль с амином соединения формулы I. Соли с металлами включают соли с натрием, калием, кальцием, барием, цинком, алюминием, предпочтительны соли с натрием и калием. Соли с аминами включают, например, соли с триалкиламином, прокаином, дибензиламином и бензиламином. Предпочтительная соль является фармацевтически приемлемой солью соединения формулы I.
Сольват включает сольват с органическим растворителем и сольват с водой, такой как гидрат.
Соединение формулы I может существовать, например, в форме гидрохлорида, такого как моногидрохлорид, дигидрохлорид, тригидрохлорид, например, в кристаллической форме и/или в форме сольвата, например гидрата.
Соединение формулы I в свободной форме может быть переведено в соль и наоборот. Сольватная форма соединения формулы I, например свободной формы или соли, может быть превращена в несольватную форму и наоборот.
Соединение формулы I включает соединение формулы I в любой конфигурации, например в любой возможной стереоизомерной форме. Смеси стереоизомерных форм могут быть разделены обычными методами, например хроматографией, фракционной кристаллизацией. Например, R1 в группе -C=VR1 может иметь конфигурацию син [(Z)] или анти [(Е)], предпочтительно, например, преимущественно син [(Z)], например, с содержанием [(Е)]-формы 0-5%, например 0-2%.
Соединение формулы I может быть получено в форме
смеси 3(Е)-формы и 3(Z)-формы или, например, преимущественно в 3(Z)-форме,
например, в соответствии с формулой

или, например, преимущественно в 3(Е)-форме в соответствии с формулой

где R1 и R2 имеют значения, указанные выше, и где группа

связанная с атомом азота группы -C=N в положении 3 циклической системы имеет, например, конфигурацию 3(Е) и/или 3(Z). Соединение формулы I может существовать, например, преимущественно в 3(Е)-форме, содержащей 3(Z)-форму в количестве 0-5%, например 0-2%, или преимущественно в 3(Z)-форме, содержащей 3(Е)-форму в количестве 0-5%, например 0-2%. Соединение формулы Is и Ip1 может существовать, например, преимущественно в 3(Е)- форме, содержащей 3(Z)-форму в количестве 0-5%, например 0-2%.
Соединение формулы I может быть
получено следующим способом:
а) взаимодействием соединения формулы
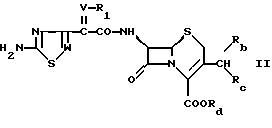
где W, V и R1 имеют значения, указанные выше, и где
α) Rb означает гидрокси, Rc и Rd вместе означают химическую связь или
β) Rd означает водород, катион, сложноэфирный остаток или силильную группу и Rb и Rc означают оксогруппу, например, в свободной форме или в форме кислотно-аддитивной соли с соединением формулы

где
R2, R3 и R4 имеют значения, указанные выше, например, в свободной форме или в форме кислотно-аддитивной соли в приемлемых, например, в обычных условиях,
б) для получения соединения формулы

где W, V, Z, R1, R2, R3, R5 и R6 имеют значения, указанные выше, ацилированием соединения формулы

где Z, R2, R3, R5 и R6 имеют значения, указанные выше, например, в свободной форме или в форме кислотно-аддитивной соли в приемлемых, например, в обычных условиях, соединением формулы

где V, W и R1 имеют значения, указанные выше, а Х означает уходящую группу, например, в свободной форме или в форме кислотно-аддитивной соли в приемлемых, например, в обычных условиях;
или взаимодействием соединения формулы
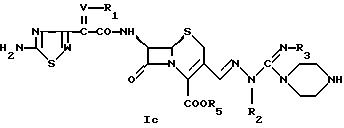
где R1, R2, R3, R5, V и W имеют значения, указанные выше, например, в свободной форме или в форме кислотно-аддитивной соли в приемлемых, например, в обычных условиях с соединением формулы
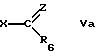
где R6 и Z имеют значения, указанные выше, а Х означает уходящую группу.
Реакционноспособные группы в соединении формулы I, Ib, Iс, II, III, IV, V и Va блокируют защитными группировками, например, известными в химии цефалоспорина. Для защиты реакционноспособных групп может использоваться методика присоединения силильной группы в присутствии растворителя, инертного к реагенту, например хлорированного углеводорода, такого как дихлорметан, нитрила, такого как ацетонитрил, простого эфира, такого как тетрагидрофуран, диполярного апротонного растворителя, например N, N-диметилформамида, или системы растворителей, например смеси индивидуальных растворителей, например, описанных выше. Защитные группировки могут быть удалены, например, по обычной методике в ходе проведения соответствующей реакции или по завершении соответствующей реакции. Соединение формулы I, где R5 означает водород, может быть превращено в другое соединение формулы I, где R5 означает сложноэфирную группу, или наоборот. Соединение формулы I выделяют из реакционной смеси обычными методами. Соединение формулы I может быть получено в свободной форме или в форме соли и/или гидрата. Соединение формулы I в свободной форме может быть превращено в соединение формулы I в форме соли и/или гидрата и наоборот.
Способ а) проводят следующим образом.
Соединение формулы II подвергают взаимодействию с соединением формулы III, например, в растворителе, инертном в условиях реакции, таком как вода, смесь воды, например, с низшим С1 -С4 спиртом или диоксаном, или в диполярном апротонном растворителе, например диметилформамиде, диметил-сульфоксиде, диметилацетамиде, при необходимости в смеси со спиртом и/или водой, при температуре от -20 до 50oС. Величину рН доводят до оптимального значения, например? добавлением органической или неорганической кислоты или основания. Полученное соединение формулы I выделяют и/или очищают, например, обычным способом, например добавлением осадителя (антирастворителя) или хроматографией.
Способ б) проводят, например, в обычных условиях реакции ацилирования. Например, соединение формулы IV подвергают взаимодействию с соединением формулы V, или соединение формулы 1с взаимодействует с соединением формулы Va, например, в пригодном растворите, таком как смесь воды с ацетоном или ацетонитрилом при приемлемой температуре, например при комнатной температуре.
Исходные соединения известны или могут быть получены по известным, например, аналогичным методам или в соответствии с приведенными ниже примерами. Часть исходных соединений по настоящему изобретению являются новыми.
Другим объектом настоящего
изобретения является соединение, выбранное из группы, включающей
1-[(1-метилгидразино)иминометил]пиперазин,
1-[(1-этилгидразино)иминометил]пиперазин,
1-[(1-аллилгидразино)иминометил]пиперазин,
1-[(1-(4-метоксибензил)гидразино)иминометил]пиперазин,
1-[(1-(3,4,5-триметоксибензил)гидразино)иминометил]пиперазин,
1-[(1-метилгидразино)(метилимино)метил]пиперазин,
глицин(4-гидразиноиминометил)пиперазид,
1-(R)-(амино(4-гидроксифенил)ацетил)-4-(гидразиноиминометил)пиперазин,
1,
4-бис-(гидразиноиминометил)пиперазин,
1-(гидразиноиминометил)-4-[этилимино[(3-диметиламинопропил)амино] метил] пиперазин, например, в форме соли, такой как гидрохлорид, и/или в форме
сольвата;
а также соединение формулы

где R5 имеет значения, указанные в п.1, a Rint означает группу

которая образована связью концевой аминогруппы гидразинового фрагмента одного из перечисленных выше соединений, и где -N-группа замещена одним из перечисленных выше соединений, т. е. вышеуказанное производное гидразина присоединено к циклической системе концевой аминогруппой по метильной группе в положении 3 цикла с образованием группы

где -N-группа замещена вышеуказанным производным гидразина.
Соединения формулы I, обозначенные как "активное(ые) соединение(я) по изобретению", проявляют фармакологическую активность
и
неожиданно низкую токсичность и, следовательно, применимы в качестве лекарственных средств. В частности, активные соединения по изобретению обладают антимикробной, например, антибактериальной
активностью в отношении аэробных и анаэробных бактерий, например грамположительных и грамотрицательных бактерий, таких как Enterobacter, например Enterobacter cloacae; Enterococcus, например
Enterococcus faecalis, Enterococcus faecium; Moraxella, например Moraxella catarrhalis; Haemophilus, например Haemophilus influenza; Klebsiella, например Klebsiella edwardsii, Klebsiella pneumoniae;
Streptococcus, например Streptococcus pyogenes; Staphylococcus, например Staphylococcus aureus MSSA (штаммы, чувствительные к метициллину), Staphylococcus aureus MRSA (штаммы, устойчивые к
метициллину); Escherichia, например Escherichia coli; Proteus, например Proteus mirabilis; Salmonella, например Salmonella typhimurium; Serratia, например Serratia marcescens; Pseudomonas, например
Pseudomonas aeruginosa; Pneumococci, например Pneumococcus pneumoniae (пенициллин-устойчивые штаммы и штаммы, устойчивые ко многим препаратам), при тестировании in vitro методом серийных разведений
на
агаре согласно требованиям Национального комитета по стандартизации клинических лабораторий (NCCLS) (1993),
- Document M7-A3 т. 13, 25: "Methods for dilution antimicrobial susceptibility
tests for bacteria that grow aerobically, 3-е издание, Approved Standard", и
- Document M11-A3 в отношении анаэробных бактерий, в концентрации примерно от 0,001 до примерно 50 мкг/мл (МИК),
например, на штаммах Staphylococcus aureus (ATCC 29213 и АТСС 9144), Enterococcus faecalis (АТСС 29212), Haemophilus influenza (NTCC 49247 и NCTC 11931), Escherichia coli (ATCC 25922 и АТСС 35218),
Klebsiella pneumoniae (NCTC 11228), Klebsiella edwardsii (NCTC 10896), Pseudomonas aeruginosa (ATCC 27853 и ATCC 25668), и in vivo на модели септицемии у мышей по методике 159 А-5, утвержденной
органами здравоохранения Австрии (МА 58, 2968/95, 12 октября 1995), например, при введении в дозах примерно от 0,05 до 50 мг/кг веса тела, таких как 0,1-50 мг/кг веса тела (величина ЭД50).
Например, мышей инфицируют Staphylococcus aureus (ATCC 4995), Streptococcus pyogenes (ATCC 29218), Escherichia coli (Δ12 культуральной коллекции NFI) в ЭД 95% и начинают лечение через 1, 5 и
24
ч после заражения. Величины ЭД 50%, составляющие примерно от 0,2 до 50 мг/кг веса тела, рассчитывают пробит-анализом введенных доз соединений. Активность определяют по количеству выживших животных
в
группе из 8 мышей, которым вводилась одинаковая доза соединения, на 5 день после заражения.
Активные соединения по изобретению обнаруживают неожиданно широкий спектр активности. Было установлено, что величина МИК (мкг/мл) соединения по примеру 1 при действии, например, на штамм Enterococcus faecalis, составляет примерно 0,1-0,4, на штамм Staphylococcus aureus (MSSA) - примерно <0,125-0,8, на устойчивый к метициллину штамм Staphylococcus aureus - 0,8-6,4, на резистентный ко многим препаратам штамм Pneumococcus - 0,4.
Следовательно, соединения по изобретению применимы при лечении микробных, например, бактериальных заболеваний.
При этом показании приемлемая дозировка будет варьироваться в зависимости, например, от конкретного соединения формулы I, реципиента, способа введения, природы и тяжести заболевания, подлежащего лечению. Однако в целом для получения удовлетворительных результатов у большинства млекопитающих, например у человека, назначаемая ежедневная доза варьируется в пределах примерно от 0,05 до 5 г, например от 0,1 до примерно 2,5 г соответствующим образом вводимого активного соединения по изобретению, например, отдельными дозами до 4 раз в день.
Активное соединение по изобретению может вводиться любым общепринятым способом, например перорально, например, в форме таблеток или капсул, или парентерально в форме инъекционных растворов или суспензий, например, аналогично цефотаксиму.
Соединение 7-(((5-амино-1,2, 4-тиадиазол-3-ил)-(Z)-(фтор-метоксиимино)ацетил)амино)-3-((имино-1-пиперазинилметил)метил-гидразоно)метил-3-цефем-4-карбоновая кислота (соединение по примеру 1) является предпочтительным соединением по изобретению для применения в качестве противомикробного агента. Например, установлено, что МИК (мкг/мл) соединения по примеру 1 (тестированного в форме гидрохлорида) в отношении, например, Haemophilus influenza, составляет примерно <0,125-0,4, а, например, у цефотаксима величина МИК (мкг/мл) равна примерно <0,125-0,4. Эти данные свидетельствуют о том, что при лечении заболеваний, вызванных микроорганизмами, например бактериями, предпочтительные соединения по изобретению могут вводиться большинству млекопитающих, например человеку, таким же способом и в тех же дозах, что и цефотаксим.
Соединение формулы I может вводиться в форме фармацевтически приемлемой соли, например кислотно-аддитивной соли или соли с основанием, либо в соответствующей свободной форме, а при необходимости в форме сольвата. Такая соль/сольват может обладать активностью того же порядка, что и свободная форма.
Кроме того, объектом настоящего изобретение является фармацевтическая композиция, включающая соединение формулы I по п.1 в форме фармацевтически приемлемой соли или в свободной форме в сочетании по крайней мере с одним фармацевтическим носителем или разбавителем.
Такие композиции готовят обычными методами. Например, унифицированная дозируемая форма может содержать, например, от 10 мг до примерно 1 г, например от 10 мг до примерно 700 мг, например около 500 мг активного соединения.
Что касается лекарственных средств, то активные ингредиенты по изобретению могут вводиться непосредственно или в пригодных медицинских формах вместе с неорганическими или органическими, фармакологически инертными эксципиентами. Например, они используются в качестве составных компонентов капсул, препаратов для инъекции или инстилляции, которые содержат активное соединение в количестве, достаточном для достижения оптимального уровня в крови, т. е. примерно 10-500 мг в капсуле. При таком применении доза, подлежащая введению, зависит от типа соединения, способа введения, а также от характера лечения. У большинства млекопитающих удовлетворительные результаты получают при введении ежедневной дозы примерно в 0,5-6 г. При необходимости это количество может быть введено соответственно меньшими дозами 2-4 раза в день или в виде форм пролонгированного действия.
Другим объектом настоящего изобретения является соединение формулы I или композиция, представляющая собой соединение формулы I в форме фармацевтически приемлемой соли или в свободной форме в сочетании по крайней мере с одним фармацевтическим носителем или разбавителем, для применения в качестве фармацевтического препарата, например, такого как антибиотик, а также применение соединения формулы I или композиции, представляющей собой соединение формулы I в форме фармацевтически приемлемой соли или в свободной форме в сочетании по крайней мере с одним фармацевтическим носителем или разбавителем, в качестве фармацевтического препарата.
Кроме того, объектом настоящего изобретения является способ лечения заболеваний, вызванных микроорганизмами, например бактериями,
выбранными из группы,
включающей Pseudomonas, Enterobacter, Enterococcus, Moraxella, Haemophilus, Klebsiella, Streptococcus, Staphylococcus, Escherichia, Proteus, Salmonella, Serratia и Pneumococci,
причем этот способ
предусматривает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I, например, в форме фармацевтической композиции по настоящему
изобретению. Объектом
изобретения является также соединение формулы I для применения при изготовлении фармацевтического препарата для лечения заболеваний, вызванных микрорганизмами, например
заболеваний, вызванных
бактериями, выбранных из группы, включающей Pseudomonas, Enterobacter, Enterococcus, Moraxella, Haemophilus, Klebsiella, Streptococcus, Staphylococcus, Escherichia, Proteus,
Salmonella, Serratia и
Pneumococci. Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Все температуры указаны в градусах Цельсия.1ЯMP: 200 МГц, ДМСО-d6
Пример
1
7-(((5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-(фторметоксиимино)ацетил)амино)-3-(имино-1-пиперазинилметил)метилгидразоно)метил-3-цефем-4-карбоновая кислота
а)
Амид N-(1,4,5а,
6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-ацето(2,1-b)фуро(3,4-d)(1,3)-тиaзин-6-ил)-2-(5-aминo-1,2,4-тиaдиaзoл-3-ил)-(Z)-2-(фторметоксиимино)уксусной кислоты
(гидроксилактон7-(((5-амино-1,2,
4-тиадиазол-3-ил)-(Z)-(фторметоксиимино)ацетил)амино)-3-формил-3-цефем-4-карбоновой кислоты).
Суспензию 10 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты в смеси 220 мл хлористого метилена и 80 мл ацетонитрила перемешивают при 0o с 43 мл N, O-бис(триметилсилил)ацетамида. К полученному прозрачному раствору добавляют 15,7 г хлорангидрида (5-амино-1,2, 4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоуксусной кислоты и реакционную смесь перемешивают приблизительно в течение 1 ч, поддерживая температуру около 0o. Смесь разбавляют 1250 мл ацетонитрила, содержащего 70 мл воды. К полученной смеси добавляют 12%-ный водный аммиак до рН 3,5, разбавляют 2,5 л воды и экстрагируют этилацетатом. Слой этилацетата сушат и концентрируют.
Концентрат перемешивают со 100 мл ацетонитрила в течение 1 ч при 20o. Амид N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-ацето(2,1-b)фуро(3,4-d)(1, 3)-тиазин-6-ил)-2-(5-амино-1,2,4-тиадиазол-3-ил)-(Z)-2- (фторметоксиимино) уксусной кислоты выпадает в осадок в кристаллической форме, осадок отфильтровывают и сушат.
б)
7-(((5-Амино-1,
2,4-тиадиазол-3-ил)-(Z)-(фторметоксиимино) ацетил)амино)-3(Е)-(имино-1-пиперазинилметил)метилгидразоно) метил-3 - цефем-4-карбоновая кислота
3,77 гамида N-(1,4,5а,
6-тетрагидро-3-гидрокси-1,
7-диоксо-3Н, 7Н-ацето(2,1-b)фуро(3,4-d)(1,3)-тиазин-6-ил)-2-(5-амино-1,2,4-тиадиазол-3-ил)-(Z)- 2- (фторметоксиимино) уксусной кислоты суспендируют в смеси 75 мл
ацетонитрила и 11 мл воды и
обрабатывают раствором 2 г 1-(1-метилгидразино)иминометил)пиперазина в форме дигидрохлорида в 4,5 мл 2 н. НСl.
Реакционную смесь перемешивают в течение приблизительно одного дня при комнатной температуре и выливают в 600 мл ацетонитрила при перемешивании. Выпавшую в осадок 7-(((5-амино-1,2,4-тиадиазол-3-ил)-(Z)-(фторметоксиимино)ацетил) амино)-3(Е)-(имино-1-пиперазинил-метил)метилгидразоно)метил-3-цефем-4-карбоновую кислоту в форме тригидрохлорида отфильтровывают, промывают ацетонитрилом и сушат.
в) 7-(((5-Амино-1,2,
4-тиадиазол-3-ил)-(Z)-(фторметоксиимино) ацетил) амино)-3(Е)-(имино-1-пиперазинилметил)метилгидразоно)метил-3-цефем-4-карбоновая кислота
0,65 г неочищенной 7-(((5-амино-1,2,
4-тиадиазол-3-ил)-(Z)- (фторметоксиимино) ацетил) амино) -3(Е)-(имино-1-пиперазинилметил)метилгидразоно)метил-3-цефем-4-карбоновой кислоты в форме тригидрохлорида, полученной на стадии б), растворяют
в 2 мл воды и наносят на колонку, заполненную 50 г сорбента RP-18■ (LiChroprep RP-18■, размер гранул 40-63 мкм, фирма Меrск), и элюируют водой (скорость потока 20 мл/мин). Фракции,
содержащие 7-(((5-амино-1,2,4-тиадиазол-3-ил)-(Z)-(фторметоксиимино) -ацетил)-амино)-3(Е)-(имино-1-пиперазинилметил)метилгидразоно)метил-3-цефем-4-карбоновую кислоту в форме моногидрохлорида (по
данным аналитической ЖХВР), объединяют и сушат лиофилизацией.
Аналогично примеру 1 при использовании соответствующих соединений формул II и III, где W, V, R1, R2, R3, R4 и R5 имеют значения, указанные в табл.1, получают соединения формулы I, где W означает N, V означает N-O, R4 и R5 каждый означает водород, R1 означает CH2F, a R2 и R3 имеют значения, указанные в табл.1, например, в форме указанных в таблице солей.
Пример 8
6R-(6α,
7β (Z))-7-[2-(2-аминотиазол-4-ил)-2-гидроксииминоацетиламино] -3-[[(имино-4-(этоксикарбонил)пиперазин-1-илметил)гидразоно] метил] -3-цефем-4-карбоновая кислота
5,2 г N,
O-бис-триметилсилилацетамида добавляют по каплям при перемешивании к суспензии 1 г 6R-(6α,7β (Z))-7-[2-(2-аминотиазол-4-ил)-2-гидроксииминоацетиламино]
-3-[[(имино-1-пиперазинилметил)-гидразоно]метил]-3-цефем-4-карбоновой кислоты в форме тригидрохлорида в смеси 50 мл абсолютного хлористого метилена и 50 мл абсолютного ацетонитрила. К полученному
прозрачному раствору добавляют при перемешивании 0,28 г этилового эфира хлормуравьиной кислоты. Смесь перемешивают при комнатной температуре в течение приблизительно 20 мин и обрабатывают 0,95 г
воды.
Выпавшую в осадок 6R-(6α,7β (Z))-7-[2-(2-аминотиазол-4-ил)-2-гидроксииминоацетиламино] -3-[[(имино-4-(этоксикарбонил)пиперазин-1-илметил)гидразоно] метил] -3-цефем-4-карбоновую
кислоту
отфильтровывают, промывают и сушат.
Пример 9
6R-(6α,7β (Z))-7-[2-(2-аминотиазол-4-ил)-2-гидроксииминоацетиламино]
-3-[[(имино-4-(аминоацетил)пиперазин-1-илметил)гидразоно] метил]-3-цефем-4-карбоновая кислота
0,6 г глицин-4-(гидразиноиминометил)пиперазида в форме дигидрохлорида добавляют одной порцией к
раствору 0,6 г амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1, 7-диоксо-3Н, 7Н-ацето[2, 1-b]фуро[3, 4-d] [1,3]тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-(гидроксиимино)уксусной кислоты в смеси 10,7 мл
ацетонитрила, 3,6 мл воды и 0,7 мл 8 н. НСl и полученную реакционную смесь перемешивают при комнатной температуре. При перемешивании в течение 2 ч 6R- (6α,7β
(Z))-7-[2-(2-аминотиазол-4-ил)-2-гидроксииминоацетиламино] -3-[[(имино-4-(аминоацетил)пиперазин-1-илметил)гидразоно] метил] -3-цефем-4-карбоновая кислота в форме тригидрохлорида выпадает в осадок,
который отфильтровывают, промывают и сушат.
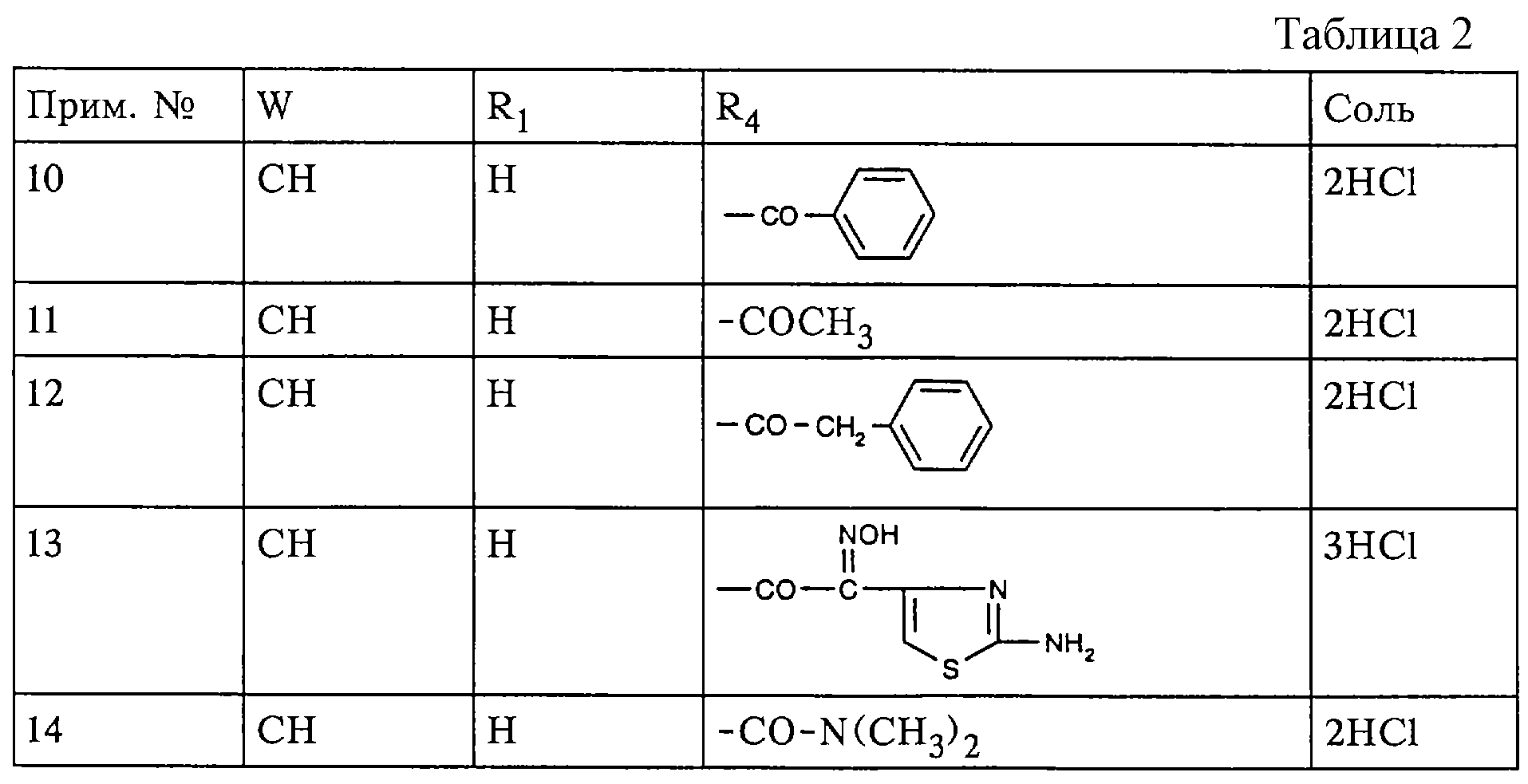
Аналогично примерам 8 и 9 при использовании соответствующих соединений формул II и III, где W, V, R1, R2, R3 , R4 и R5 имеют значения, указанные в табл. 2, получают соединения формулы I, где V означает N-0, R2, R3 и R5 каждый означает Н, а W, R1 и R4 имеют значения, указанные в табл.1, например, в форме описанных в табл.1 солей.
Пример 46
1-(Изопропоксикарбонилокси) этиловый эфир
[6(R)-6α,
7β (Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино)ацетил] амино] -3-[(имино-4-ацетилпиперазин-1-илметил)гидразонометил]-3-цефем-4-карбоновой кислоты
1,5 г
1-(изопропоксикарбонилокси) этилового эфира [6(R)-6α,7β (Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино)ацетил] амино] -3-[(иминопиперазин-1-илметил)гидразонометил]
-3-цефем-4-карбоновой кислоты в форме дигидрохлорида перемешивают при 0o в смеси 30 мл хлористого метилена, 10 мл ацетонитрила и 15 мл диметилформамида с 2,2 мл N,
O-бистриметилсилилацетамида. К полученному прозрачному раствору добавляют 160 мл ацетилхлорида и продолжают перемешивание в течение приблизительно 60 мин, поддерживая ту же температуру. Реакционную
смесь выливают в 100 мл воды. В полученную смесь добавляют 0,5 н. раствор бикарбоната натрия до рН 7 и экстрагируют этилацетатом. Слой этилацетата промывают водой, сушат над сульфатом натрия и
растворитель выпаривают. Остаток обрабатывают эфиром. Выпавший в осадок 1-(изопропоксикарбонилокси) этиловый эфир [6(R)-6α,7β (Z)] -7-[[(5-амино-1,2,4-тиадиазол-3-ил)
(фторметоксиимино)ацетил] амино] -3-[(имино-4-ацетилпиперазин-1-илметил)гидразонометил]-3-цефем-4-карбоновой кислоты (смесь двух диастереоизомеров в соотношении 1:1) отфильтровывают и сушат.
Пример 47
1-(Изопропоксикарбонилокси) этиловый эфир [6(R)-6α,7β (Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил)
(фторметоксиимино)ацетил]амино]-3-[(иминопиперазин-1-илметил)гидразонометил]-3-цефем-4-карбоновой кислоты
3,1 г 1-(изопропоксикарбонилокси)этилового эфира [6(R)-6α,7β
(Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино)ацетил] амино] -3-формил-3-цефем-4-карбоновой кислоты в 30 мл ацетонитрила обрабатывают раствором 1,11 г 1-(гидразиноиминометил)пиперазина в
форме дигидрохлорида в 2,5 мл 2 н. НСl. Смесь перемешивают в течение приблизительно 1 ч и выливают в 300 мл ацетонитрила. Выпавший в осадок 1-(изопропоксикарбонилокси)этиловый эфир [6(R)-6α,
7β (Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино) ацетил] амино] -3-[(иминопиперазин-1-илметил)гидразонометил]-3-цефем-4-карбоновой кислоты в форме дигидрохлорида (смесь двух
диастереоизомеров в соотношении 1:1) отфильтровывают, промывают и сушат.
Аналогично примеру 47 при использовании соответствующих исходных соединений формул II и III, где W, V, R1, R2, R3, R4 и R5 имеют значения, указанные в табл.3, получают соединения формулы I, где W означает N, V означает N-O, R1 означает СН2F, R2 и R3 каждый означает Н, a R4 и R5 имеют значения, указанные в табл.3.
Соединения, используемые по настоящему изобретению в качестве исходных, могут быть получены следующим образом.
Пример А
1-((1-Метилгидразино)иминометил)пиперазин
а) S-Метил-2-метилизотиосемикарбазид
Раствор
239,
8 г S-метил-2-метилизотиосемикарбазида в форме гидроиодида в 100 мл воды вносят в колонку, заполненную 1500 мл сильноосновного ионообменника в хлоридной форме (амберлит IRA 420R), и
элюируют водой. Фракции, содержащие S-метил-2-метил-изотиосемикарбазид в форме гидрохлорида (ЖХВР), лиофилизируют. Лиофилизат обрабатывают эфиром, осадок отфильтровывают и сушат.
S-метил-2-метилизотиосемикарбазид в форме гидрохлорида получают в виде белого твердого вещества.
tпл:116o (изопропанол).
б) Бензилиденовое
производное 4-формил-1-((1-метилгидразино) иминометил) пиперазина
Раствор 40,9 г S-метил-2-метилизотиосемикарбазида в форме гидрохлорида в 350 мл этанола смешивают с 30 г свежеперегнанного
формилпиперазина и кипятят с обратным холодильником в течение приблизительно 39 ч. Реакционную смесь охлаждают до комнатной температуры, смешивают с 26,4 мл бензальдегида и перемешивают в течение
приблизительно 24 ч. Полученный осадок отфильтровывают, промывают этанолом и сушат. Таким путем получают бензилиденовое производное 4-формил-1-((1 -метилгидразино) иминометил) пиперазина в форме
гидрохлорида.
в) 1-((1-Метилгидразино)иминометил) пиперазин
К 10 г бензилиденового производного 4-формил-1-((1-метилгидразино)иминометил) пиперазина в форме гидрохлорида
добавляют 48 мл 2 н. НСl и отщепляют бензальдегид перегонкой с паром. Полученную водную суспензию концентрируют и полученный масляный остаток обрабатывают кипящим этанолом. Слой этанола концентрируют
в вакууме. Таким путем получают дигидрохлорид 1-((1-метилгидразино)иминометил)пиперазина в виде белого твердого вещества.
Пример Б
1-[(1-Этилгидразино)иминометил]пиперазин
а) Бензилиденовое произвояное 1-(гидразиноиминометил)пиперазина
К раствору 10,7 г дигидрохлорида бензилиденового производного 1-(гидразиноиминометил) пиперазина в 100 мл воды добавляют
8 н. NaOH до рН 10 и экстрагируют этилацетатом. Этилацетатный слой сушат и выпаривают растворитель. Таким путем получают бензилиденовое производное 1-(гидразиноиминометил)пиперазина в виде белого
аморфного порошка.
б) Бензилиденовое производное 1-формил-4-(гидразиноиминометил) пиперазина 12,7 мл ангидрида уксусной кислоты добавляют по каплям к 42 мл муравьиной кислоты, охлажденной льдом, смесь перемешивают в течение приблизительно 1 ч, а затем добавляют по каплям 16 г бензилиденового производного 1-(гидразиноиминометил) пиперазина в 42 мл муравьиной кислоты. Смесь выдерживают при 0o в течение приблизительно 2 ч, а затем выпаривают растворитель. Остаток обрабатывают водой, в полученную смесь добавляют 10 н. КОН до рН 11, экстрагируют дихлорметаном, дихлорметановый слой сушат и выпаривают растворитель. Таким путем получают бензилиденовое производное 1-формил- 4- (гидразиноиминометил) пиперазина в виде белого порошка.
в)
Бензилиденовое производное 1- [(этилгидразино)иминометил] -4-формилпиперазина
Охлажденный льдом раствор 2 г бензилиденового производного 1-формил-4-(гидразиноиминометил) пиперазина в 40 мл
сухого тетрагидрофурана обрабатывают 9,3 мл бис(триметилсилил)литийамида (1М раствор в тетрагидрофуране) и перемешивают при 0o в течение приблизительно 1 ч. К реакционой смеси добавляют 2,
4
г этилиодида и перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают и остаток очищают экспресс -хроматографией на сухой колонке (элюент: 1. метанол, 2. метанол с уксусной
кислотой, 90%:10%). Фракции, содержащие бензилиденовое производное 1-[(этилгидразино)иминометил] -4-формилпиперазина (по данным аналитической ЖХВР), объединяют и выпаривают растворитель, при этом
получают бензилиденовое производное 1-[(этилгидразино)имино-метил]-4-формилпиперазина в виде белого порошка.
г) 1-[(1-Этилгидразино)иминометил] пиперазин
2,7 г
бензилиденового
производного 1-[(этилгидразино)иминометил]-4-формилпиперазина растворяют в 11,6 мл 2 н. НСl и перегоняют с паром. Из полученой смеси после выпаривания воды и высушивания остатка
получают дигидрохлорид
1-[(1-этилгидразино)иминометил]пиперазина в виде белого твердого вещества.
Аналогично примеру Б при использовании соответствующих реагентов получают следующие соединения.
Пример В
1-[(1-Аллилгидразино)иминометил]пиперазин(в форме дигидрохлорида).
Пример Г
1-[[1-(4-Метоксибензил)гидразино]
иминометил]пиперазин(в форме
дигидрохлорида).
Пример Д
1-[[1-(3,4,5-Триметоксибензил)гидразино] иминометил] пиперазин (в форме дигидрохлорида).
Пример Е
1-[(1-Метилгидразино)
(метилимино)метил]пиперазин
а) Бензилиденовое производное 1-формил-4-[(гидразино (метилимино)метил] пиперазина
37 г
1-формил-4-[гидразино(метилимино)метил] пиперазина в форме
дигидрохлорида растворяют в смеси 80 мл ацетонитрила и 185 мл воды и обрабатывают 30 г бензальдегида. Смесь перемешивают в течение
приблизительно 3 ч при комнатной температуре и экстрагируют эфиром.
Из водной фазы выпаривают воду. Остаток обрабатывают водой и добавляют 2 н. NaOH до рН 11. Смесь экстрагируют дихлорметаном,
органическую фазу сушат, растворитель выпаривают и остаток сушат. Таким
путем получают бензилиденовое производное 1-формил-4-[(гидразино(метилимино)метил] пиперазина в виде белого порошка.
б) Бензилиденовое производное
1-формил-4-[(1-метилгидразино)(метилимино)метил]пиперазина
Раствор 1,62 г бензилиденового производного 1-формил-4- [гидразино(метилимино)метил]
пиперазина в 30 мл ацетонитрила обрабатывают 4,
56 г метилиодида и смесь кипятят с обратным холодильником в течение ночи. Растворитель выпаривают, остаток перемешивают с 20 мл воды и 10 мл
ионообменной смолы амберлит IRA-400 (Cl)®
в течение приблизительно 1 ч при комнатной температуре. Смесь фильтруют, в водный раствор добавляют 2 н. NaOH до рН 11 и экстрагируют
дихлорметаном. Органическую фазу сушат и концентрируют, упаривая
растворитель. С целью очистки концентрат обрабатывают аналогично тому, как это описано в примере Б на стадии в). Таким путем получают
бензилиденовое производное
1-формил-4-[(1-метилгидразино)(метилимино)метил]пиперазина в виде белого порошка.
в) 1-[(1-Метилгидразино)(метилимино)метил]пиперазин
1,14 г
бензилиденового производного
1-формил-4-[(1-метилгидразино) (метилимино)метил]пиперазина растворяют в 6 мл 2 н. НСl и обрабатывают аналогично тому, как это описано в примере Б на стадии г). Таким
путем получают
1-[(1-метилгидразино) (метилимино)метил] пиперазин в форме дигидрохлорида в виде белого твердого вещества.
Пример Ж
Аналогично примеру Е при использовании
соответствующих
реагентов получают 1-[(1-метилгидразино)(этилимино)метил] -пиперазин (в форме дигидрохлорида).
Пример 3
Глицин(4-гидразиноиминометил)пиперазид
а)
Бензилиденовое
производное 1-(гидразиноиминометил) пиперазина
15 г 1-(гидразиноиминометил) пиперазина в форме дигидрохлорида в смеси 50 мл метанола и 50 мл воды обрабатывают 12 г
бензальдегида. Смесь
перемешивают в течение приблизительно 1 ч при комнатной температуре и экстрагируют эфиром. Водную фазу упаривают и остаток обрабатывают абсолютным метанолом. После выпаривания
растворителя в виде
бесцветного порошка получают бензилиденовое производное 1-(гидразиноиминометил)пиперазина в форме дигидрохлорида.
б) Бензилиденовое производное
N-бензилоксикарбонилглицин-(4-гидразиноиминометил) пиперазида
2 г N-сукцинимидного эфира бензилоксикарбонилглицина в 50 мл абсолютированного хлористого метилена обрабатывают 2 г триэтиламина
и 2 г бензилиденового производного 1-(гидразиноиминометил)пиперазина в форме дигидрохлорида. Смесь перемешивают при комнатной температуре в течение приблизительно 20 мин. Выпавшее в осадок
бензилиденовое производное N-бензилоксикарбонилглицин- (4 -гидразиноиминометил) пиперазида отфильтровывают и сушат.
в) Глицин (4-гидразиноиминометил) пиперазид
Смесь 2,3 г
N-бензилоксикарбонилглицин-(4-гидразиноиминометил) -пиперазида, 60 мл этанола, 5,5 мл 2 н. НСl и 1,2 г 10%-ного палладия на угле обрабатывают водородом в автоклаве при перемешивании и при комнатной
температуре. Через 12 ч смесь фильтруют, из фильтрата выпаривают растворитель. Остаток обрабатывают этанолом, этанол выпаривают. Таким путем получают глицин-(4-гидразиноиминометил)пиперазид в форме
дигидрохлорида в виде белого порошка.
Пример И
1,4-бис (гидразиноиминометил) пиперазин
а) 1,4-бис-тиокарбамоилпиперазин
4,4 г 1,4-дицианопиперазина в
растворе 3,5 г сероводорода и 1,5 г триэтиламина в 150 мл этанола нагревают в автоклаве при 110o в течение приблизительно 3 ч, а затем охлаждают до комнатной температуре. Выпавший в осадок
дигидрохлорид 1,4-бис-тиокарбамоилпиперазина отфильтровывают и сушат.
б) 1,4-бис[имино(метилтио)метил]пиперазин
5,5 г 1,4-бистиокарбамоилпиперазина в 150 мл метанола
обрабатывают 15 г метилиодида. Полученную смесь кипятят с обратным холодильником в течение приблизительно 5 ч и перемешивают в течение приблизительно 43 ч при комнатной температуре. Выпавший в осадок
дигидроиодид 1,4-бис[имино(метилтио)метил] пиперазина отфильтровывают, промывают метанолом, сушат, растворяют в воде и обрабатывают сильноосновной ионообменной смолой в хлоридной форме при
перемешивании в течение приблизительно 24 ч. Ионообменную смолу отфильтровывают и фильтрат лиофилизируют, получая 1,4-бис [имино(метилтио) метил] пиперазин в форме дигидрохлорида.
в)
1,
4- бис(гидразиноиминометил)пиперазин
4,2 г 1,4-бис[имино(метилтио)метил] пиперазина в форме дигидрохлорида в 60 мл воды обрабатывают 1,45 г гидразингидрата. Смесь перемешивают в течение
приблизительно 15 ч при комнатной температуре и растворитель выпаривают. Остаток растворяют в 15 мл горячей воды. К полученному раствору добавляют 400 мл этанола и перемешивают при комнатной
температуре и при 0o. Выпавший в осадок дигидрохлорид 1,4-бис (гидразиноиминометил) пиперазина отфильтровывают и сушат.
Пример К
1-(Гидразиноиминометил)-4-[(этилимино)[(3-диметиламинопропил)амино] метил] пиперазин
а) Бензилиденовое производное 1-(гидразиноиминометил) пиперазина
К раствору 10,7 г
бензилиденового производного 1-(гидразиноиминометил) пиперазина в форме дигидрохлорида (полученного согласно примеру З, стадия а)) в 100 мл воды добавляют 8 н. NaOH до рН 10 и экстрагируют
этилацетатом. Этилацетатный слой сушат над Na2SO4, растворитель выпаривают. Таким путем получают бензилиденовое производное 1-(гидразиноиминометил) пиперазина в виде порошка.
б) Бензилиденовое производное 1-(гидразиноиминометил)-4-[(этилимино) [(3-диметиламинопропил)амино]метил] пиперазина
1 г 1-(гидразиноиминометил) пиперазина в 5 мл диметилформамида
обрабатывают 828 мг 1-(3-диметиламинопропил)-3-этилкарбодиимида в форме гидрохлорида и перемешивают в течение приблизительно одной недели при комнатной температуре. Смесь выливают в 100 мл эфира,
осевшее масло отделяют и растворяют в ацетонитриле, полученный раствор обрабатывают 8,6 мл 1 н. соляной кислоты в эфире. Бензилиденовое производное 1-(гидразиноиминометил)-4-[(этилимино)
[(3-диметиламинопропил)амино] метил] пиперазина в форме тригидрохлорида выпадает в виде кристаллического осадка, который отфильтровывают и сушат.
в)
1-(Гидразиноиминометил)-4-[(этилимино)[(3-диметиламино-пропил) амино] метил]пиперазин
1,4 г бензилиденового производного 1-(гидразиноиминометил)-4-[ (этилимино) [(3-диметиламинопропил)амино]
метил] пиперазина в форме тригидрохлорида нагревают в 20 мл воды и перегоняют, добавляя воду, до отсутствия в дистиллате бензальдегида. Затем из кубового остатка выпаривают воду, остаток обрабатывают
изопропанолом, изопропанол удаляют трехкратной перегонкой. Таким путем получают 1-(гидразиноиминометил)-4-[ (этилимино) [(3-диметиламинопропил)амино] метил] пиперазин в форме тригидрохлорида в виде
белого твердого вещества.
Пример Л
1-(Изопропоксикарбонилокси) этиловый эфир [6(R)-6α,7β(Z)]-7-[ [(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино) ацетил]
амино] -3-формил-3 -цефем-4-карбоновой кислоты
а) [6(R)-6α,7β(Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино) ацетил] амино] -3-формил-3-цефем-4-карбоновая кислота
0,4 мл основания Хюнига добавляют по каплям к 1 г амида N-(l,4,5a,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-ацето[2,1-b]фуро[3,4-d] [1,3]тиазин-6-ил) -2- (5-амино-1, 2,4-тиадиазол-3-ил)- (Z)
-2- (фторметоксиимино) уксусной кислоты в 76 мл ацетонитрила. Полученный раствор обрабатывают 0,38 г иодида натрия, растворенного в 5 мл ацетонитрила. Выпавшую в осадок натриевую соль [6(R)-6α,
7β(Z)] -7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино) ацетил] амино]-3-формил-3-цефем-4-карбоновой кислоты отфильтровывают и сушат.
б) 1-(Изопропоксикарбонилокси)
этиловый эфир [6(R)-6α,7β(Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил) (фторметоксиимино) ацетил] амино] -3-формил-3 -цефем-4-карбоновой кислоты
1 г [6(R)-6α,7β
(Z)]-7-[[(5-амино-1,2,4-тиадиазол-3-ил)(фторметоксиимино)ацетил] амино] -3-формил-3-цефем-4-карбоновой кислоты в форме натриевой соли в 10 мл диметилацетамида обрабатывают при 0o и при
перемешивании раствором 0,65 г 1-иодэтилизопропилкарбоната в 4 мл толуола и полученную смесь перемешивают в течение приблизительно 90 мин при 0o. Полученную смесь разбавляют 100 мл
этилацетата и экстрагируют водным раствором гидрокарбоната калия. Органическую фазу экстрагируют водой, сушат над Na2SO4 и концентрируют до 10 мл. Полученный концентрат выливают
в 120 мл н-гексана, выпавший осадок отфильтровывают и сушат. Таким путем получают 1-(изопропоксикарбонилокси) этиловый эфир [6(R)-6α,7β(Z)] -7-[[(5-амино-1,2,4-тиадиазол-3-ил)
(фторметоксиимино)ацетил] амино]-3-формил-3-цефем-4-карбоновой кислоты (смесь двух диастереоизомеров в соотношении 1:1) в виде твердого вещества.
Пример М
1-(R)-(Амино(4-гидроксифенил)ацетил)-4-(гидразиноиминометил)пиперазин
а) Бензилиденовое производное 1-(R)-(амино (4-гидроксифенил)ацетил)-4-(гидразиноиминометил)пиперазина
4,85 г
(R)-4-гидрокси-α-[(3-метокси-1-метил-3-оксо-1-пропенил) амино] фенилуксусной кислоты в форме калиевой соли в 30 мл хлористого метилена обрабатывают при перемешивании 1,28 г диметилацетамида и
1
каплей 3-пиколина. Полученную смесь охлаждают до приблизительно -30o, обрабатывают 2 г пивалоилхлорида в 10 мл хлористого метилена и перемешивают в течение приблизительно 35 мин при
приблизительно -12o. Полученную смесь охлаждают до -40o и обрабатывают охлажденной до 0o смесью 5 г бензилиденового производного 1-(гидразиноиминометил)пиперазина в
форме дигидрохлорида и 3,4 г триэтиламина в 30 мл хлористого метилена. Полученную смесь перемешивают в течение приблизительно 20 мин при приблизительно -30o и в течение приблизительно 20
мин при -10o, обрабатывают при 0o смесью 75 мл воды, 10 мл конц. НСl и 6 мл хлористого метилена, перемешивают в течение приблизительно 20 мин при 0o и нагревают до
комнатной температуры. Получают двухфазную смесь. Фазы разделяют, в водную фазу добавляют триэтиламин до рН 8,0, выпавший осадок отфильтровывают и сушат. Таким путем получают бензилиденовое
производное 1-(R)-(амино(4-гидроксифенил)ацетил)-4-(гидразиноиминометил)пиперазина виде белого твердого вещества.
б) 1-(R)-(Амино
(4-гидроксифенил)ацетил)-4-(гидразиноиминоэтил)пиперазин
Смесь 0,3 г бензилиденового производного 1-(R)-(амино- (4-гидроксифенил)ацетил)-4-(гидразиноиминометил)пиперазина, 60 мл этанола, 1
мл
2 н. НСl и 0,1 г 10%-ного палладия на угле обрабатывают водородом в автоклаве при перемешивании в течение ночи при комнатной температуре. Полученную смесь фильтруют, фильтрат концентрируют в
вакууме.
Полученный концентрат обрабатывают 50 мл этанола, растворитель выпаривают. Таким путем получают 1-(R)-(амино(4-гидроксифенил) ацетил) -4- (гидразиноиминоэтил) пиперазин в форме
тригидрохлорида в виде
белого твердого вещества.
Реферат
Изобретение относится к новым производным 7-ациламино-3-(метилгидразоно)метилцефалоспорина общей формулы Is, в которой R5 означает водород или сложноэфирный остаток, R2s означает алкил, аралкил, алкенил или алкинил, R3s означает водород, алкил, аралкил, алкенил, алкинил или циклоалкил, в свободной форме, форме соли и/или сольвата. Способ получения соединения формулы Is путем взаимодействия соединения формулы II с соединением III и выделение соединений формулы Is. Фармацевтическая композиция, обладающая антибактериальным действием, содержащая соединение формулы Is с, по меньшей мере, одним фармацевтическим носителем или разбавителем. Способ лечения заболеваний, вызванных микроорганизмами, который предусматривает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы Is. Технический результат - получение новых соединений, обладающих антибактериальной активностью. 5 с. и 4 з.п. ф-лы, 3 табл.


Формула

где R5 означает водород или сложноэфирный остаток;
R2s означает алкил, аралкил, алкенил или алкинил;
R3s означает водород, алкил, аралкил, алкенил, алкинил или циклоалкил,
в свободной форме, в форме соли и/или сольвата.
1-[(1-метилгидразино)иминометил]пиперазин,
1-[(1-этилгидразино)иминометил] пиперазин,
1-[(1-аллилгидразино)иминометил] пиперазин,
1-[(1-(4-метоксибензил)гидразино)иминометил] пиперазин,
1-[(1-(3,4,5-триметоксибензил)гидразино)иминометил] пиперазин,
1-[(1-метилгидразино) (метилимино) метил] пиперазин,
1-[(1-метилгидразино) (этилимино) метил] пиперазин.

где W означает N;
V означает NO;
R1 означает СН2F;
где любой α) Rb означает гидрокси, a Rc и Рd вместе означают химическую связь, или β) Rd означает водород, катион, сложноэфирный остаток или силильную группу, a Rb и Rc означают оксогруппу,
с соединением формулы

где R4 означают водород;
R2 означают алкил, аралкил, алкенил или алкинил;
R3 означает водород, алкил, аралкил, алкенил, алкинил, циклоалкил,
и выделение соединений формулы Is.

Комментарии