Способ получения производных 2-фенил-3-ароилбензотиофена или их солей - SU701539A3
Код документа: SU701539A3
Описание
Цель изобретения - разработка сп соба получения новых биологически активных производных 2-фенил-З-ароил бенэотиофенов общей формулы I или их солей. Поставленная цель достигается опи сываемым способом получения производ ных 2-фенил-З-ароилбензотиофенов общей формулы I или их солей, заклю чающимся в том, что соединение обще формулы II где RC( - водород, алкоксигруппа с 1-5 атомами углерода, фена цилокси- или п-галокдфенацилоксигруппа; водород, галоид, алкоксигрупиа с 1-5 атомами углерода , фенацилокси- или п-галоидфенацилоксигруппа , или группа формулы -OCH2 CH2NR3R4. где Кз и Е имеют вышеуказанное значение, при условии , что по крайней мере один из радикалов Н, и имеет значение иное, чем водород; А - водород или группа - СОСЕ подвергают взаимодействию с соединением общей формулы III где R,, - водород, алкоксигруппа с 1-5 атомами углерода, фен цилокси- или п-галоидфенацилоксигруппа , или гр па формулы -OCH2CH2NR,,R4. где КдИ R имеют вышеуказанное значение; Т - водород или группа - СОСе при условии, что не является атомом хлора, ко да Reel водород, и А и Т нэ одинаковы, в присутствии катализатора Фри-г д.зля-Крафтса в среде инертного раст ворителя при температуре от -20°С д температуры кипения реакционной сме си или, если А представляет собой группу СОСЕ с соединением общей фор мулы IY )г и полученное соединение общей форму лы I а где Rq, R и Н имеют вышеуказанное значение, выделяют или в случае необходимости переводят в соединение общей формулы I, где R, R., и Rg имеют значение , отличное от RQ, и соответственно, Соединение общей формулы 1а, где Rg. или R2g-фeнaцилoкcи- или п1-галоидфенацилоксигруппа , обрабатывают цинком в уксусной кислоте для получения соединений общей формулы I, где R, R или Rg. гидроксил. Соединение общей формулы I, где Rg, или -алкоксигруппа, подвергают взаимодействию с хлоргидратом пиридина, этилмеркаптидом натрия и трехбромистым бором для получения соединений общей формулы I, где R, R или R,2. - гидроксил. Соединение общей формулы I, где R, R или .R 2.гидроксильная группа, подвергают взаимодействию с соединением формулы CtCH2CH2.NR R. для получения соединений общей формулы I, где R, R и R2 - группа формулы -OCHj CHjNRjjR Обработкой соединений общей формулы I, где R - гидроксил, соединением общей формулы RgCE, где Rg - ацильная или алкоксикарбонильная группа, содержащая 2-6 атомов углерода , бензоильная или адамантоильная группа, получают соединения общей формулы I, где R - ацильная или алкоксикарбонильная группа с .2-6 атомами углерода, бензоильная или адамантоильная группа. Соединения общей формулы I, где п О, окисляют м-хлорнадбензойной кислотой при температуре от -30 до +30°С для получения соединений общей формулы I, где п 1. Синтез исходных веществ. А. 2 Фенилбензотиофен, К 300 мл 2-бромадетофенона и 83 г (0,75 моль) пиридина прибавляют 150 г (0,75 моль) тиофена. Реакционнуюсмесь кипятят с обратным холодильником в течение 6 ч. После этого пиридин упаривают и полученный остаток растворяют в этилацетате . Этилацетатный раствор тщательно промывают 1 н. водным раствором гидроокиси натрия и 1 н. соляной кислотой, затем сушат над безводным сульфатом магния, фильтруют и упаривают досуха. Коричневое масло перекристаллизовывают из спирта при температуре получают 116 г (68% от теории) ос-(фенилтио)-ацетофенона в виде белых кристаллов;т.пл. 5253°С . Вычислено для .: OS,%: С 73,65; Н 5,30; О 7,01; S 14,о4. Найдено, %: С 73,46; н 5,50; ; О 7,25; S 14,30. 63,8 о - (фенилтио)-ацетофенона прибавляют к 450 г полифосфорной ки лоты при 100°С, нагревают до 190с в течение 3 ч, после чего охлаждают и добавляют лед. Продукт экстрагируют из водноорганической смеси эфи ром. Эфирный экстракт сушат безводным сульфатом магния и затем упаривают в вакууме досуха, получают смолистое вещество, которое перекри таллизовывают из смеси ацетона и спирта, получают 35,2 г (60%) 2-фенилбензотиофена; т.пл. 171-172°G. Б. 2-(4-метоксифенил)-бензотиофе К смеси 45,8 г (0,2 моль) п-метокси фенацилбромида и 22 г тиофена в спи те прибавляют по каплям при перемешивании раствор 12 г гидроокиси калия в 30 мл воды. После перемешивания реакционной смеси в течение 30 мин осадок отделяют фильтрование и растворяют в эфире. Эфирный раствор сушат, концентрируют и охлаждаю отделяют фильтрованием осадок dL - (фенилтио)-4-метоксиацетофенона; т.пл. 83-85°с. Вычислено для ,,1: С 69, Н 5,46.. Найдено , %г С 69,52; Н 5,48. Полученный продукт подвергают ци лизации с одновременной изомеризаци по методике, описанной в пункте А, путем нагревания на масляной бане с полифосфорной кислотой при температуре около 110°с. Реакционную смесь перемешивают и вьщерживают в течени 1 ч при 100-110°С. Затем смесь охлаж дают и прибавляют воду. Водную смесь экстрагируют хлороформом, органическ слой отделяют, сушат и упаривают в вакууме, осадок отделяют от исто-чник фильтрованием, получают 6 г 2-(4-метоксифенил )-бензотиофена с т.пл.188- 190°С,который очищают перекристаллиз цией из этанола. Вычислено для С,, Р., OS , % : С 74,97; Н 5,03; О 6,66, Найдено, %: С 74,69; Н 5,19; О 6,75. В, 2-(4-Метоксифенил)-6-метоксибензотиоЬен . К 700 мл этанола прибавляют 50 (0,356 моль) м-метокситиофенола и 20 г (0,36 моль) гранулированной гидроокиси калия, после чего небольшими порциями вводят в реакционную смесь 82,5 г (0,36 моль) сс-бром-4-метоксиацетофенона. Прибавление реагентов приводят при температуре около 25°с. Затем реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Далее этанол упаривают и полученное коричневое масло обрабатывают 2 л воды и 1,5 л эфира. Эфирный слой отделяют, промывают водой, сушат безводным сул фатом магнйя и упаривают досуха. Остаток растворяют в смеси диэтилового и петролейного эфира в отношени 3:1, твердое вещество отфильтровывают , сушат до постоянного веса и получают 78,5 г (76%) «1. - (3-метоксифенилтио )-4-метоксиацетофенона в виде розоватого кристаллического вещества ); т.пл. 53-54С, . Вычислено для ,%: С 66,4; Н 5,59; О 16,64; S 11,12. Найдено,%: С 66,55; Н 5,87; О 16,82; S 10,86. Полученный продукт подвергают циклизации с одновременной изомеризацией путем прибавления 50 г (0,173 моль) продукта к 250 г полифосфорной кислоты, нагретой предварительно до 95°С. Реакционную смесь энергично перемешивают и температуру постепенно повышают до 115-120°С. Анализ смеси с помощью тонкослойной хроматографии показал, что реакция практически полностью завершается примерно за 5 мин. По истечении 30 мин к реакционной смеси добавляют лед. Затем температуру повышают до 130°С, причем все это время к ней прибавляют дополнительные порции льда а затем воду, осадок отделяют от маточника фильтрованием. Полученное дегтеобразное твердое вещество растирают в горячем метаноле, затем охлаждают и отфильтровывают. Осадок перекристаллиэовывают из 2,5 л этилацетата, получают 30 г 2-(4-метокси фенил) -6-метоксибензотиофена; т.пл. 193-194°С. Вычислено для .С Н 1402 S , % : С 71,08; Н 5,22; О 11,84;S 11,86. Найдено, %: С 71,03; Н 5,30; 011,81; S 11,60. Пример 1. Получение 2-фенил 3-(4 метокснбензоил)-бензотиофена. К 75 мл дихлорэтана прибавляют 7 г (0,033 моль) 2-фенилбензотиофена и 5,80 г (0,084 моль) 4-анизоилхлорида . Смесь охлаясдают до 0°С и осторожно прибавляют к ней 4,65 г (0,035 г) хлористого алюминия. Реакционную смесь перемешивают в течение 1ч и затем прибавляют к ней лед. Образовавшийся органический слой отделяют, промывают водой и упари ,вают. К остатку прибавляют 250 мл метанола и 10 мл 5%-ного водного раствора гидроокиси натрия. -Полученную смесь кипятят с обратным холодильником в течение 30 мин, после чего упаривают в вакууме. К остатку прибавляют эфир и воду. Эфирный слой отделяют и промывают 1 н. раствором гидроокиси натрия, затем 1 н.соляной кислотой и насыщенным водным раствором хлористого натрия. Далее эфирный слой сушат безводным сульфатом магния, фильтруют и упаривёиот. Остаток перекристаллизовывают из метанола с добавлением активированного угля, получают 7,7 г (67% от теории ) 2-фенил-З-(4-кетоксибенэоил)-бензотиофена в виде светло-коричневых кристаллов; т.пл. 107-109°С. Пример 2. Получение 2-фенил -3-{4-оксибензоил)-бензотиофена. Смесь 4 г (0,012 моль) из примера 1 и 20 г гидрохлорида пиридина ки пятят с обратным холодильником в течение 1 ч, после чего горячую реакционную смесь выливают в смесь воды со льдом, находящуюся в смесителе. Образующийся кристаллический осадок отделяют фильтрованием. Полученные кристаллы растворяют в этилацетате и этилацетатный, раствор промывают насыщенным водным раствором хлористо го натрия, после чего сушат над безводным сульфатоммагния. Высушенный этилацетатный раствор быстро хроматографируют на колонке с силикагелем используя этилацетат в качестве элюента . Этилацетатный элюент упаривают в вакууме досуха и в остатке полуЧают темное масло, которое медленно эакристаллизовывается при стоянии. Полученный кристаллический продукт перекристаллизовывают из смеси метанола и воды и после сушки в вакуум получают 2,79 г (73%) 2-фенил-З-(4-оксибензил )-бензотиофена в виде све ло-коричневых кристаллов;ТоПл. 163- 165°С. Вычислено для С-ц .S,%: С 76,3 . Н 4,27 О 9,68; S 9,70. Найдено, %:С7б,31;Н4,48 О 9,76; S 9,70. Пример 3. Получение 2-фенил З-бензоил-б-метоксибензотиофёна. 100 г (0,788 моль) оксалилхлорид растворяют в 100 мл дихлорэтана и к полученному раствору, температура к торого 25°С, прибавляют по каплям п пе1ремешивании раствор 25г (0,179мол м-метокситиофенола в 50 мл дихлорэт на.После прибавления указанного рас вара смесь кипятят с обратным холодильником в течение 1 ч и оставляют при перемешивании на ночь.Затем рас воритель и избыток оксалилхлорида у ривают н вакууме и к остатку прибавл ют 100 мл дихлорэтана.Полученную см охлаждают до О с и при перемешивани прибавляют к ней тремя порциями 23, (0,178 моль) хлористого алюМиния.Ре ционную смесь перемешивают в течени 15 мин, после чего добавляют лед. Дихлорэтан упаривают из смеси и образовавшиеся при этом желтоватооранжевые кристаллы отфильтровывают и кристаллы сушат в вакууме при 40°С до постоянного веса и получают 31,2 г (89% от теории)-6-метокси-2 , З-диоксо-2, 3-диг1 дробензотиофе на. Аналитический образец продукта перекристаллизовывают из смеси метанола и воды, получают чистое веще ство; т,пл, 165-166 с. К 350 мл кипящей воды добавляют 31 г (1,159 г) синтезированного диоксибензотиофена и 24,8. г (0,234 моль) карбоната натрия. К еще горячей смеси прибавляют раствор 79,4 г (0,466 моль) oi-хлорфенилуксусной кислоты и 37,0 г (0,349 моль) карбоната натрия в 500 мл воды. После завершения прибавления этого раствора реакционную смесь нагревают в течение 5 мин, добавляют активированный уголь и смесь охлаждают до 30°С, Далее реакционную смесь фильтруют и фильтрат подкисляют 100 мл 12 н. соляной кислоты, при этом происходит образование желтого маслообразного осадка, который при стоянии кристаллизуется. Смесь гомогенизируют в смесителе, промывают водой, осадок отфильтровывают и сушат в вакууме при 35-40°С, получают 53,9 г (98% от теории) оС -(2-карбоксикарбонил-5-метоксифенилтио )-фенйлуксусной кислоты. Вычислено для С, ,%: С 58,95; Н 4,07; О 21,12; S 9,26. Найдено,%: С 58,83; Н 4,12; О 27,89; S 9,03. Смесь 53 г (0,153 моль) синтезированного производного фенйлуксусной кислоты и 63 г (0,765 моль) безводного ацетат-а натрия в 780 г (7,65 моль) уксусного ангидрида медленно нагревают при перемешивании до кийения и затем кипятят с обратным холодильником в течение 15 мин. Избыток уксусного ангидри-. да гидролизуют осторожным добавлением к реакционной смеси 1 л воды. Полученную смесь выливают на измельченный лед и разбавляют до 3,5 л добавлением дополнительного количества льда, при этом наблюдается образование коричневого осадка, ; который отделяют фильтрованием и тщательно промывают холодной водой. Полученный влажный твердый продукт используют на следующей стадии синтеза без дальнейшей очистки. Анализ образца продукта показывает, что он представляет собой смесь 2-фенил-З-карбокси-8-метоксибензотиофена и его предшественника ангидрида 2-фенил-3-ацетокси-6-метоксй-2 ,3-дигидробензотиофен-2 ,3-дикарбоновой кислоты. Влажный продукт, полученный на предыдущей стадии синтеза, кипятят с обратным холодильником в смеси 700 мл 2 н, раствора гидроокиси натрия и 250 мл этанола в течение 20 мин, после чего этанол упаривают, к остатку добавляют лед и холодную воду и смесь подкисляют, добавляя 25Л мл 6 н, соляной кислоты при , при этом наблюдается образование твердого рыжевато-коричневого осадка, который отделяют фильтрованием. Этот коричневый Твердый продукт перекристаллизовывают из метанола и получают 31,2 г (71% от теории) 2-фенил-З-ка бокси-6-метоксибензотиофена;т,пл. 1 199°С. Вычислено для С 67,59; Н 4,25; О 16,88; S 11,8. Найдено, %: С 67,38 ; Н 4,47 ; О 16,85; S 11,16. Масс-спектр вычислено 284;найд но 284. Полученное вещество 10,0 г (0,0352 моль превращают в соответст вующий хлорангидрид перемешиванием с 8,3 г (0,07 моль) тионилхлорида и двумя каплями пиридина в 200 мл без водного эфира при 25°С в течение 12 ч. Затем эфир и избыток тионилхло рида упаривают в вакууме, к остатку прибавляют 50 мл бензола, смесь упа ривают досуха и обработку остатка бензолом повторяют еще раз. Полученный таким образом хлоранги рид растворяют в 100 мл сухого эфйра и к раствору прибавляют суспензию дифенилкадмия, полученного в результ те прибавления при 25с 5,7 г (0,031 -моль) хлористого кадмия к 100 мл эфира, содержащего 0,07 моль фенилмагнийбромида. После завершения прибавления суспензии реакционную смесь кипятят с обратным холодильником в течение 15 мин. После этого к смеси добавляют лед, образовавшийся эфирный слой отделяют и промывают последовательно 1 н, соляной кислотой , 1 н. раствором гидроокиси натри и насыщенным водным раствором хлорис того натрия. Далее эфирный слой сушат , получают 12,3 г желтого кристал лического продукта; его перекристаллизовывают из смеси 700 мл бензола и 40 мл гексана. Первая порция кристаллов (6,4 г) и вторая порция крис таллов (2,2 г) составляют в сумме 71% от теоретически возможного выход целевого продукта. Аналитический образец продукта 2-фенил-3-бензоил-6-метоксибензотиофена , перекристаллизованный еще раз, имеет т.пл. 108- 110°С. Продукт идентифицирован по данным элементного анализа. Вычислено для % С 76,2; Н 4,68; О 9,23; S 9,31. Найдено, %: С 76,65; 4,92;О 9,56 S 9,33. Пример 4. Получение 2-фенил -З-бензоил-6-оксибензотиофена. Смесь 6 г (0,017 моль) продукта из примера 3 и 25 г гидрохлорида пиридина нагревают с обратным холодиль ником (кипятят) в течение 1 ч, затем обрабатывают и хроматографируют как в примере 2, получают желтое кристал лическое вещество. Эти кристаллы растворяют в горячем ацетоне, к раст вору добавляют метанол и ацетон отгоняют . Оставшуюся смесь упаривают до объема, равного примерно 100 мл и прибавляют к ней 10 мл горячей воды . Затем смесь охлаждают и затирают до получения 4,4 г (76%) 2-фенил-З-бензоил-6-оксибензотиофена в виде желтовато-золотистых кристаллов; т.пл, 221-222°с. Продукт идентифицируют по данным элементного анализа. Вычислено для QZ-, 4 г С 76,34; Н 4,27; О 9,68; S 9,70. Найдено, %: С 76,18; Н 4,39; О 9,40; S 9,85. Пример 51 Получение 2-фенил-3- (4-метоксибензоил)-6-мвтрксибензотиофена . Используя методику примера 3, 10 г (0,0352 моль) 2-фенил-З-карбокси-6-метоксибензотиофен превращают в соответствующий хлорангидрид. Полученный хлорангидрид растворяют в 150 мл дихлорэтана. К этому раствору прибавляют 3,89 г (0,036 моль) анизола . Смесь охлаждают до 0°С и осторожно прибавляют к ней 4,80 г (0,036 моль) хлористого алюминия. Реакционную смесь перемешивают при 0°С в течение 1 ч, после чего к ней прибавляют лед, образовавшийся органический слой отделяют, промывают водой, сушат безводнЕлм сульфатом магния и после упаривания в вакууме досуха получают желтое масло , которое кристаллизуют из метанола , получают 11,60 г (88% от теории ) 2-фенил-З-(4-метоксибензил)-6-метоксибензотиофена в виде почти бесцветных кристаллов;т.пл. 132- 132,5°С. Вычислено для C,T, С 73,77; Н 4,85; О l2,32; S 8,56. Найдено, %: С 74,02; Н 4,96; О 13,05; S 8,38. Пример 6. Получение 2-фенил 3- (4-оксибензоил)-6-оксибензотиофена . Используя процедуру диметилирования , описанную в примере 2, 70 г продукта (0,0187 моль), полученного в примере 5, подвергают обработке гидрохлоридом пиридина, получают 5,72 г (88% от теории) 2-фенил-З- (4-оксибензоил)-6-оксибензотиофена) т.пл. 245-246°С. Вычислено для Сан OjS,% : С 72,81 Н 4,07; О 13,86; S 9,26. Найдено, %: С 72,58; Н 4,24; О 13,82; S 9,40. Пример 7. Получение 2-(4-метоксифенил )-З-бензоил-6-метоксибензотиофен . К 300 мл дихлорэтана, охлажленного до , прибавляют 6,0 г (0,022 моль) 2-(4-метоксифенил)-6-метоксибензотиофена и 3,10 г (0,22 моль) бензоилхлорида. Поддерживая температуру смеси на уровне осторожно прибавляют к ней при интенсивном перемешивании хлористый алюминий небольшими порциями. Полученный реакционный раствор, окрашенный в красный цвет, перемешивают в течение 1ч, после, чего разбавляю водой. Желтый органический слой отделяют , промывают 200 мл 1 н. водного раствора гидроокиси натрия и з тем 200 мл насьощенного водного раст вора хлористого натрия. Далее органический слой сушат безводным карбо натом калия и после упаривания раст ворителя получают вещество слегка желтоватого цвета, которое очищают хроматографией на колонке с силикагелем , используя бензол и 5%-ный ра вор этилацетата в бензоле в качеств элюентов . .. Упаривание соответствующих фракций элюата приводит к получению продукта в виде желтоватых кристаллов. Этот продукт перекриста лизовывают из метанола и получают 3,5 г (42% от теоретически возможного выхода) 2-(4-метоксифенил)-3-бензоил-б-метоксибензотиофена; т,пл. 110,5-111 С. Пример 8. Получение 2-(4-оксифенил )-З-бензоил-6-оксибензотиофена . Продукт, полученный в примере 7, взятый в количестве 2,5 г (0,067 мо подвергают диметилированию в соотве ствии с методикой примера 2, исполь зуя для этого 10 г гидрохлорида пиридина . В результате диметилирования получают 2,1 г (91% от теоретически возможного выхода) целевого соединения; т.пл. 203-205°С (с, разложением ) . Вычислено для С, , %: С 72,81; Н.4,07; О 13,86; S 9,26. Найдено, %: С 72,54; Н 4,09; О 13,80; S 9,23. Масс-спектр: вычислено 346; найдено 346. Пример 9.Получение 2-(4-ме оксифенил) -3-(4-метоксибензоил)-6-метоксибензотиофена . Смесь 10 г (0,037 моль) 2-(4-метоксифенил )-6-метоксибензотиофе на в 700 мл дихлорэтана охлаждают до и при перемешивании прибавляют к ней по каплям смесь 6,31 г (0,087 моль) 4-анизоилхлорида и, 5,07 г (0,038 моль) хлористого алюм ния в дихлорэтане. Реакционную смесь перемешивгиот при 0°С в течение 2 ч, после чего ливают ее в смесь воды со льдом,Орг нический слой отделяют от водного в делительной воронке, водный слой экстрагируют хлороформом и хлорофор менный экстракт объединяют с органи ческим слоем, который промывают вод ным раствором бикарбоната натрия, затем водой. Органический экстракт сушат безводным сульфатом магния и после упаривания в вакууме получаю масло, которое растворяют в 500 мл метанола, и к полученному раствору прибавляют 15 мл 5 н. водного раст ра гидроокиси натрия. Полученную смесь кипятят с обратным холодильником в течение 30 мин, после чего метанол упаривают. Остаток экстрагируют эфиром и эфирный слой промывают сначала воднымраствором хлористого натрия, а затем водой. Затем эфирный слой отделяют и упаривают в вакууме досуха, получают 14,6 г желтоватого масла, очистка которого хроматографией дает 13,9 г (93% от теоретически возможного выхода) 2-(4-метоксифенил)-3-(4-метоксибензоил ) -б-метоксибензотиофена в виде желтого масла. Вычислено для %5 С 71,25; Н 4,98; О 15,82;S 7,93. Найдено, %: С 71,25; Н 4,90; О 15,78; S 7,65. Пример 10. Получение 2-(4-оксифенил )-3-(4-метоксибензоил)-б-оксибензотиофен , Смесь 53 г продукта, полученного в примере 9, с сухим хлороформом охлаждают до и осторожно прибавляют к ней 75 г трехбромистого бора. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, после чего выливают в воду, хлороформеннуй слой отделяют , а водный слой экстрагируют дополнительным количеством хлороформа., причем эту хлороформенную вытяжку объединяют с первоначальным хлороформенным слоем, Полученную хлороформенную смесь фильтруют., и фильтрат концентрируют в вакууме досуха. Остаток растворяют в бензоле, бензольный раствор фильтруют, концентрируют досуха и остаток хроматографируют из силикагеля, используя 10%-ный раствор эфира в бензоле в качестве элюента. Фракции, содержащие вещество с одинаковым значением R г объединяют и повторно хроматографируют на окиси алюминия, используя эфир в качестве растворителя с последующим элюированием продукта 10%-ным раствором метанола в эфире. 2-(4-Оксифенил )-3-(4-метоксибензоил)-6-оксибензотиофен , получают с выходом 5,8 г; т.пл, 138-140С. Вычислено для , , % : С 70,20; Н 4,28; О 17,00. Найдено, %: С 70,46; Н 4,50; О 16,87. Пример 11. Получение лимоннокислой соли 2 фенил-3- 4-(2-пирролидиноэтокси )-бензоил -бензотиофена. К 50 г (0,328 моль) метилового эфира п-оксибензойной кислоты в 250 мл безводного диметилформамида прибавляют 68 г (0,4 моль) хлоргидрата N-(2-хлорэтил)-пирролидин. К полученной смеси прибавляют порциями 19,2 г (0,8 моль) гидрида натрия. Когда выделение газа прекращается, .реакционную смесь нагревают до
в течение 72 ч. Избыток гидрида натрия разлагают, добавляя к реакционной смеси по каплям 50 мл метанола. Остаток после отгонки растворителя растворяют в смеси этилацетата в ледяной воде. Этилацетатный слой отделяют , трижды промывают его (порциями по 50 мл) водным раствором хлористого натрия, затем безводным сульфатом магния и упаривают в вакууме досуха получают темно-коричневое масло, которое растворяют в эфире и полученный эфирный раствор экстрагируют 400мл 1 н. соляной кислоты . Соляйокислый экстракт дважды промывают 500 мл эфира, затем охлаждают до и нейтрализуют 250 мл 2 н. водного раствора гидроокиси натрия . Полученную смесь, имеющую щелочную -реакцию, экстрагируют эфиром, эфирный экстракт сушат безводным сульфатом магния и упаривают в вакууме досуха, получают 53 г (65% от теории) метилового эфира 4-(2-пирролидиноэтокси )бензойной кислоты в виде почти бесцветного масла; т,кип, 151-155°С при 0,1 рт.ст.
К 150 мл метанола прибавляют 30,5 г {0,122 моль) полученного метилбензоата и 61,2 мл 2 н, водного раствора гидроокиси натрия, Реакционную смесь кипятят с обратным холодильником в течение 12 ч, после чего охлаждают и упарива от досуха. Полученный остаток растворяют в зоде п раствор промывают несколько раз эфиром . После этого водный слой подкисляют 42 мл (0,25 моль) 6 и, соляной кислоты. Полученный кислый раствор концентрируют до объема пор,чдка 300 мл и нагревают на паровой бане до образования прозрачного ра.створа, который затем охлаждают до 5°С. Выпавшие в осадок белые кристаллы собирают , проплывают ледяной водой ипосле сушки в вакууме получают 29,1 г (87,5% от теории) солянокислой соли 4-(2-пирролидиноэтокси)-бензойной кислоты т.пл. 255 250°С, Соль идентифицируют по данным элементного анализа.
Вычислено для С, M-IB CeNO , %: С 57,46; Н 6,68; N 5,15;Се 13,05,
Найдено, %: С 57,24; Н 6,75; N5,11; се 13,07.
К 50 мл бензола прибавили 5,0 (0,018/моль синтезированной солянокислой соли 4-(2-пирролидиноэтокси)-бензойной кислоты и 25 мл (0,35 мол тионилхлорида. Реакционную соль кипятят с обратным холодильником в течение двух часов с добавлением двух кап.ель диметил формами да, при этом наблюдается растворение кислоты с образованием раствора бледно-желтого цвета. Далее реакционную смесь упаривают досуха и к остатку прибавляют 50 мл дихлорэтана. Полученную смесь
снова упаривают досуха. К полученной солянокислой соли, представляющее более кристаллическое вещество, прибавляют 150 мл дихлорэтана, 2,4 г (0,018 моль) хлористого алюминия и 3,78 г (0,018 моль) 2-фенилбензотиофена . К этому раствору добавляют дополнительно 2,4 г хлористого алюми- . ния и смесь оставляют при перемешивании на ночь, при этом наблюдается выделение хлористого водорода и обра0 зование раствора красно-коричневого цвета, К этой реакционной смеси прибавляют лед, затем подщелачивают 5 н. водным раствором гидроокиси натрия и затем упаривают. Остаток после упа5 ривания растворяют в этиладетате и Этилацетатный раствор промывают снаЧсШа 2 н. раствором гидроокиси натрия и затем водой. Далее этот этилацетатный раствор сушат безводным
0 сульфатом магния, затем фильтруют и упаривают в вакууме досуха. Остаток хроматографируют на силикагеле, получают 6,2 г (81%) свободного основания , которое превращают в лимонно5 кислую соль прибавлением к нему 3,05 г лимонной кислоты в 60 мл о метилэтилкетона, получают 8,23 г лимоннокислой соли 2-фенил-З- 4-(2-пирролидиноэтокси )-бензоил -бензотиофена
Вычислено для С К з ЫОоВ, %: С 63,96; Н 5,37; Ы 2,26.
Найдено, %: С 63,67; Н 5,26; N 2,18.
Пример 12, Полученр е лимонЭ нокислой соли 2-фенил-З- 4-(2-пирролидиноэтокси ) -бензонл -6-метокси-бензотиофена .
К 200 МП дихлорэтана прибавляют 6,72 г (0,035 моль) 2-пирролидиноэтоксибемзола , полученного при обработке фенола солянокислой солью 1-пиррол дино-2 хлорэтана в присутствии гидрида натрия в безводном диметилформамиде при 0°С. Смесь ох5 лаждают до 0°С и пропускают через нее избыток хлористого водорода. Полученный раствор упаривают досуха и белый кристаллический остаток суспендируют в 200 мл дихлорэтана. К
0 этой смеси прибавляют при перемешивании хлорангидрид, полученный из 10 г (0,035 моль) 2-фенил-З-карбокси-6-метоксйбе .нзотиофена. Полученную смесьохлаждают до 0°С и при5 бавляют к ней 4,8 г (0,036 моль) хлористого алюминия и через некоторое время еще 4,8 г хлористого алюминия , оставляют при перемешивании на ночь. Затем прибавляют лед и
0 подщелачивают 5 н. водным раствором гидроокиси натрия. Далее смесь упаривают, а остаток растворяют в .смеси этилацетата и воды с добавлением небольшого количества хлороформа . Органический слой отделяют и
промывают 2 н. водным раствором гидроокиси натрия. Продукт экстрагируют из органического слоя, используя для этой цели избыток 0,05 н. соляной кислоты, Солянокислый экстракт промывают эфиром и затем подщелачивают 5 н, раствором гидроокиси натрия. Полученный продукт экстрагируют этилацетатом и этилацетатный раствор сначала сушат безводным сульфатом магния, затем фильтруют и упаривают в вакууме досуха, получают 6,75 г свободного основания, которое превращают в лимоннокислую соль обработкой 3,4 г лимонной кислоты в 60 мл ацетона. Упаривание ацетона и растирание остатка с эфиром дает 8,85 г (39% от теории) целевого продукта в виде кристаллического тведого вещества.
Вычислено для с Нд. S, % С 62,85; Н 5,43; N 2,16;.S 4,91.
Найдено, %: С 62,95; Н 5,48; N 1,99; S 5,05.
Пример 13. Получение 2-(4-метоксифенил )-3-(4-метоксибензоил)-бензотиофена .
К 250 мл дихлорэтана прибавляют 15 г (0,0625 моль) 2-(4-метоксифенил )-бензотиофена, 10,74 г (0,063 моль) анизоилхлорида и 8,4 г (0,063 моль) хлористого алюминия. Реакционную смесь выдерживают при 0°С в течение 1 ч. Тонкослойная хроматография реакционной смеси показала , что по истечении указанного периода в реакционной смеси обнаруживгиотся следы исходного бензотиофена Поэтому к смеси прибавляют дополни , тельно 1,1 г анизоилхлорида и 0,8 г хлористого алюминия и перемешивают в течение 1 ч. Используя методику выделения продукта, описанную в примере 1, получают 22,7 г (98% от теоретически возможного выхода) 2-(4-метоксифенил )-3-(4-метоксибензоил)-бензотиофена; т.пл. 124-126°С.
Вычислено для , %: С 73,77; Н 4,85; О 12,82; S 8,56.
Найдено, %: С 73,68; Н 4,95; О 13,01; s;8,38.
Пример 14,Получение 2-(4-ок .сифенил) -3- (4-метоксибензЬил) -бензотиофена.
К 500 мл хлороформа прибавляют 15 г (0,04 моль) бензотиофена из примера 13. К этой смеси, температуру которой поддерживают на уровне 25°С при перемешивании добавляют 17,9 г (0,071 моль) трехбромистого бора. Смесь перемешивают в течение 36 ч, после чего прибавляют к ней воду и лед. Хлороформенный слой отделяют, сушат безводным сульфатом магния и упаривают в вакууме досуха, получают 15,2 г коричневого масла, которое хроматографируют из колонки диаметром 2,54 см и длиной 30 см, заполненной силикагелем, с использованием градиентной элюции. Градиент создают с помощью 1500 мл бензола и 1500 мл 10%-ного раствора этилацетата в бензоле. Фракции, содержащие вещество, упаривают и получают 9,21 (64% от теории) 2-(4-оксифенил)-3- (4-метоксибензоил)-бензотиофена.
Пример 15. Получение лимоннокислой .соли (2-пирролидиноэтокси ) -фенил -3-(4-метоксибензоил)-бензотиофена .
К 100 мл диметилформамида, охлажденного до 0°С, прибавляют 9,2 г (0,0256 моль) бензотиофена, полученного в примере 14, 4,35 г (0,0256 мо гидрохлорида N-(2-хлорэтил)-пирролидина и 1,44 г (0,060 моль) гидрида ,натрия. Смесь нагревают при 70°С в течение 4 ч. Анализ реакционной смеси методом тонкослойной хроматографии показал наличие в ней исходного вещества. Поэтому к смеси прибавляют дополнительно 0,72 г гидрида натрия и нагревают при в течение 1 ч, после чего ее охлаждают и смешивают со льдом. Далее из полученной смеси отгоняют в вакууме диметилформамид и к остатку прибавляют воду и эфир. Эфирный слой отделяют, промывают дважды 50 мл 2 н. водного раствора гидроокиси натрия, а затем 50 мл насыщенного водного раствора хлористого натрия. Эфирный слой сушат безводным карбонатом калия и после упаривания в вакууме получают 9,3 г (80% от теории) масла, которое растворяют в 50 мл горячего метилэтилкетона и к полученному раствору прибавляют 4,28 г (0,02035 моль) моногидрата лимонной кислоты, растворенного в 50 мл горячего метилэтилкетона . При охлаждении реакционной смеси наблюдается выпадение кристаллического осадка. Эту смесь разбавляют 400 мл эфира и оставляют .при 0°С, после чего извлекают образовавшийся осадок и получают 11 г (64% от теории) соединения в виде бесцветных кристаллов; т.пл, 86-92 С
Вычислено для Сз4 Н этМО S, % : С 61,16; Н 5,59; N 2,10; 026,36; S 4,80.
Найдено, %: С 61,43; Н 5,46; N 2,26; О 26,58; S 4,62.
Пример 16. Получение (2-пирролидиноэтркси)-фенил -3-(4-метоксибензоил )-бензотиофена.
Продукт, полученный в примере 15 (3,33 г 0,005 моль), смешивают с 75 мл воды, к этой смеси прибавляют лед вместе с 150 мл эфира и затем осторожно прибавляют при перемешивании и встряхивании 10 мл2 н. водного раствора гидроокиси натрия. Эфир ,ный слой отделяют, промывают 25 мл насыщенноговодного раствора хлористого натрия, сушат безводным сульфатом магния и упаривают в вакууме досуха. Полученное желтоватое маслЬ сушат в вакууме при до постоянного веса, получают 2,21 г (97% от теоретически возможного выхода) соединения ,
Вычислено для , %: С 78,50; Н 5,95; N 3,06; S 7,01.
Найдено, %:С73,35;Н5,96; N 3,00; S 7,06.
Пример 17. Получение солянокислой соли (2-пирролидино этокси)-фенил)(4-метоксибензоил} -бензотиофена.
Продукт, полученный в примере 15 (3,82 г 0,005 моль), превращают в свободное основание по методике, описанной в примере 16. Далее продукт растворяют в 50 мл метиленхлорида . Смесь охлаждают до и прибавляют к ней избыток сухого хлористого водорода. После этого метиленхлоридный раствор упаривают и остаток сушат в вакууме при 40°С, получают 2,31г (94%) гидрохлорида (2-пирролидиноэтокси).-фенил 3- (4-метоксибензиол )-бензотиофена в виде 1белой вспенившейся массы.
Пример 18. Получение (2-пирролидиноэтокси)-фенил -3- (4-оксибензоил)-бензотиофена.
К 50 мл сухого диметилформамида прибавляют 1,2 г (2,6 моль) продукта , полученного в примере 16 К этой смеси прибавляют в атмосфере азота 0,625 г (25 ммоль) гидрида натрия, а затем медленно вводят из шприца
0,620 (10 ммоль) этилмеркаптана, при этом наблюдается бурное вскипание .реакционной смеси, обусловленное интенсивным выделением газа. Когда выделение газа прекращается, реакционную см&сь нагревают при .7 5° С на масляной бане в течение 12 ч, после чег к ней по каплям прибавляют 5 мл этилового спирта. Полученного смесь упаривают досуха и остаток растворяют в смеси этилацетата и воды. Этилгщетатный слой отделяют, промывают 50 м.л насыщенного водного раствора хлористого натрия и затем многократно 15 м 1 н. соляной кислоты. Солянокислые вытяжки объединяют, промывают эфиром и подщелачивают холодным раствором 1 н. гидроокиси натрия. Далее щелочн смесь экстрагируют этилацетатом, этилацетатный слой отделяют, сушат безводным сульфатом магния и упаривают в вакууме досуха, получают 0,54 желтого масла, которое очищают хроматографией , получают 0,4 г соединения в виде желтой вспенившейся массы
Пример 19, Получение лимоннокислой соли (2-диэтиламинЬэтокси )-фенил -3-(4-метоксибензоил)-бензотиофена .
Используя методику, описашную в пмере 15, 4,9 г (а,014 моль) 2-(4-окс
фенил)-3-(4-метоксибензоил)-бензотиофена обрабатывают гидридом натрия и 1-диэтиламино-2-хлорэтаном. Продук обрабатывают лимонной кислотой и пол чают 4,8 г цитрата (2-диэтиламнозтокси )-фенил -3-(4-мвтоксибензоилбензотиофена; т.пл. 128-132°С.
Вычислено для С Н37 NO.,c,S, %: С 62,66; Н 5,72 О 24,55; S 2,15,
Найдено, %: С 62,95; Н 5,46; О 24,36; S 2,02.
Пример 20. Получение 2-(4-оксифенил )-3-(4-оксибензоил)-бенэотиофена .
5 Г (0,0134 моль) 2-(4-метоксифенил )-3-(4-метоксибензоил)-бензотиофена , полученного по методике примера 13, смешивают с 20 г гидрохлорида пиридина. Полученную смесь обрабатывают по методике примера 2. получают 4,22 г (91% от теоретически возможного выхода) 2-(4-оксифенил)-3- (4-оксибензоил)-бензотиофена в виде красновато-коричневых кристаллов,. т.разм. 90°С.
Вычислено для С,, ,S,%s С 72,81; Н 4,07; О 13,96; S 9,26.
Найдено, %: С 73,05; Н 4,27; о О 14,10; S 8,95.
Пример 21. Получение (2-пирролидиноэтокси)-фенил -3- 4- (2-пирролидиноэтокси)-бензоил -бензотиофена в виде бислшлоннокислой соли .
Продукт, полученный-в примере 20, обрабатывают двумя эквивалентами гидрида натрия и двумя эквивалентами N-(2-хлорэтил)-пирролидина в соответствии с методикой примера 19, получают 16,5 г красновато-коричневого масла.
Это масло, обрабатывают лимонной кислотой и затем нагревают в ацетоне . Образовавшуюся суспензию охлаждают и прибавляют к ней эфир. Масло отделяют и растворяют в метаноле. Полученный раствор оставляют при комнатной температуре до получения кристаллического осадка целевого соединения;т.пл. 115°С.
Вычислено-для S, %: С 58,43; Н 5,67; N 3,03; О 29,40,
Найдено, %: С 58,20; К 5,43; N 2,91; О 29,54.
Пример 22. Получение 2-(4-метоксифенил )-3-(4-оксибензоил)-бензотиофена .
К суспензии 2,9 г (0,12 моль) гидрида натрия в масле прибавляют при перемешивании 13 г (0,35 моль) 2-(4-метоксифенил)-3-(4-мвтоксибензоил ) -бензотиофена, полученного по методике примера 13, в диметилформамиде . Смесь прибавляют к холодному раствору 7,5 г этилмеркаптана в диметилфорнамиде . Реакционную смесь перемешивают при 70°С в течение 2ч, контролируя окончание реакции с помслдью тонкослойной хроматографии. Общпя продолжительность реакции составляет около двух часов. Далее реакционную смесь упаривают в вакууме досуха, к остатку прибавляют воду, водную смесь подкисляют и экстрагируют этилацетатом. Этилацетатный экстракт промывают, сушат безводным сульфатом магния и упаривают в вакууме досуха. Остаток пере кристаллизовывают из бензола и получают 9,1 г (73% от теории) 2-{4-метоксифенил )-3-(4-оксибенэоил)-бензотиофена; т.пл. 188-189°C, Вычислено для С 73,31; Н 4,47; О 13,32. Найдено, %: С 73,14; Н 4,45; О 13,54. Пример 23. Получение лимоннокислой соли 2-(4-метоксифенил -3- 4-(2-пирролидиноэтокси)-бензоил -бензотиофена . . К 100 мл безводного диметилформа мида прибавляют 10,0 г (0,028 моль бензотиофена, полученного в примере 22, и 4,76 г (0,028 моль) Н-(2-хлор этил)-пирролидингидрохлорида при ко натной температуре и перемешивании 1,7 г (0,07 моль) гидрида натрия, при этом наблюдают бурное вскипани реакционной смеси. Когда выделение газа прекратится, смесь нагревают течение ночи при . Тонкослойна хроматография реакционной смеси по казала наличие в ней исходного вещества , поэтому к ней добавляют 0, (0,024 моль) гидрида натрия и 1,7 (0,01 моль) гидрохлорида амина. Ре ционную смесь перемени вам т при 80 еще в течение 1 ч затем добавляют ней 50 мл этанола и упарИвают досу ха. Остаток растворяют в смеси вод и эфира. Эфирный слой отделяют и экстрагируют несколько раз 0,5 н. соляной кислотой. Солянокислые экстракты объединяют и промывают э ром, после чего подщелачивают, пол ченное основание экстрагируют эфир Эфирный слой отделяют, сушат безво ным сульфатом магния и упаривают в вакууме досуха, получают 10,5 г (83% от теории) соединения;т.пл. 9 П р и м, е р 24. Получение лимо нокислой соли 2-(4-метоксифенил)-3 -.4- (2-пиперидиноэтокси) -бензоил зотиофена . Сначала приготовляют смесь 3,6 (0,01 моль) 2-(4-метоксифенил)-3-( -оксибензоил)-бензотиофена, получе ного по методике примера 22, и 0,01 моль гидрида натрия (50%-ная дисперсия в масле) в диметилформамиде . Эту смесь нагревают при 35°С течение 1,5 ч. Затем реакционную смесь охлаждают до комнатной темпе туры и прибавляют к ней при переме вании 0,01 моль N-(2-хлорэтил)-пип ридина, Эту смесь нагревают до 65- 70С в течение 1 ч, после чего переешивание продолжают при комнатной температуре в течение ночи. Далее реакционную смесь упаривают в вакууме досуха. К остатку прибавляют воду и экстрагируют этилацетатом. Этилацетатный экстракт отделяют, промывают и упаривают в вакууме К остатку прибавляют 0,01 моль лимонной кислоты в горячем ацетоне. Ацетон упаривают и заменяют его метилэтилкетоном , после чего смесь охлаждают до комнатной температуры, выпадает осадок, который отфильтровывают и сушат в вакууме; т , пл. 105-107°С. Вычислено для С С 63,34; Н 5,62; N 2,11; О 24,10. Найдено, %: С 63,11; Н 5,82; N 2,34; О 24,33. Пример 25. Получение лимоннокислой соли 2-(4-метоксифенил) (2-гексаметилениминоэтокси)-бензоил -бензотиофена . По методике, описанной в примере 24, с использованием N-12-хлорэтил)-гексаметиленимина получают кристаллическое твердое вещество. Вычислено для Н S % С 63,80; Н 5,80; ,07; О 23,61. Найдено, %:С63,62;Н5,84; N 2,14; О 23,33. Пример 26. Получение лимоннокислой соли 2-(4-метоксифенил) (2-диизопропиламиноэтокси)-бензоил -бензотиофена. Использование методики, описанной в примере 24 и 1-хлор-2-диизопропиламиноэтана вместо Н-(2-хлорэтил )-пиперидина приводит к получению твердого кристаллического продукта . Вычислено для , % : С 63,61; Н 6,08; 2,06; О 23,54. Найдено, %j С 63,37; Н 6,31; 1,84;; О 23,51. Пример 27, Получение 2-(4-оксифенил )(2-пирродиноэтокси)-бензоил -бензотиофена . Продукт из примера, 23 (10 г, 0,05 моль) преврардают в свободное основание , используя для этой цели 2 н. раствор гидроокиси натрия. Соответствующее свободное основание экстрагируют эфиром. Эфирный экстракт упаривают, свободное основание сушат в вакууме до постоянного веса и затем растворяют в 100 мл диметилформамида . К этому раствору при перемешивании прибавляют (при комнатной температуре ) в атмосфере азота 3,6 г (0,149 моль) гидрида натрия, а затем вводят шприцем 4,65 г (0,075 моль) этилмеркаптана, при этом наблюдается вскипание смеси. Когда выделение газа прекращается, реакционную смесь нагревают при 100°С в течение 4 ч. Тонкослойная хроматография реакционной
смеси, сделанная по истечении указанного периода, показывает, что произошло частичное отщепление в боково цепи амина. Поэтому реакцию прерывают и реакционную смесь упаривают досуха. Остаток растворяют в смеси
этилацетата и воды, и полученную сме сначала подкисляют до рН 4, а затем подщелачивают добавлением водного раствора бикарбоната натрия. Этилацетатный слой отделяют, промывают насыщенным водным раствором хлористого натрия и упаривают, получают коричневое масло, которое очищают хроматографией , получают 3 г (14% от теории) соединения.
Пример 28, Получение солянокислой соли 2-(4-ацетоксифенил) (2-пирролидиноэтокси)-бензоил -бензотиофена .
К 50 мл метиленхлорида прибавляют 1,1 г (0,0024 моль) продукта, полученного в примере 27. Полученную смесь охлаходают до и прибавляют к ней 0,44 г (0,006 моль) ацетилхлорида . Реакционную смесь оставляют при перемешивании на ночь, а затем упаривают в вакууме досуха, получают белую вспенивающую массу, которую сушат в вакууме при остаточном давлении 0,1 мм рт,ст, и температуре в течение ночи, получают 1,2 г соединения в виде светло-коричневой пены.
Вычислено для С29 fbgCfNO Sf%: С 66,72; Н 5,41 О S 6,14; N 2,68; СУ; 6,79,
Найдено, %:С66,48;И5,48; О 12,48; S 5,87; N 2,61; Qt 7,02.
ИспольЭуя методику, аналогичную вышеописанной, и применяя в качестве исходного вещества продукт примера 2 получают слелующие соединения:
2-(4-пропионилоксифенил)(2-пирролидиноэтокси )-бензоил -бензотифен из пропионилхлорида;
2-(4-валерилоксифенил)(2--пирролидиноэтокси )-бензоил -бензотиофен из валероилхлорида;
2- (4-бензоилоксифенил)(2-пирролидиноэтокси )-бензоил -бензотиофен из бенэоилхлорида;
2-(4-адамантоилоксифенил) (2-пирролидиноэтокси)-бензоил -бензотиофен из адамантоилхлорида;
2-(4-этоксикарбонилоксифенил) (2-пирролидиноэтокси)-бензоил -бензотиофен из этилортохлорформиата .
Пример 29. Получение 2-(4-метоксифенил )-3-(4-оксибензоил)-6-метоксибензотиофена ,
К 19,8 г (0,049 моль) 2-(4-метокс фенил)-3-(4-метоксибензоил)-6-метоксибензотиофена , полученного в условиях примера 9, в диметилформамиде прибавляют 10 г 50%-ной дисперсии гидрида натрия (0,2 моль) в масле.
Полученную смесь прибавляют при пермешивании к холодному раствору 12,4 г этилмеркаптана в диметилформамиде , нагревают при 65-70°С до тех пор, пока тонкослойная хроматография реакционной смеси не покажет отсутствие исходного вещества, Реакционную смесь упаривают досуха. К остатку прибавляют воду, водную смесь подкисляют и экстрагируют этилацетатом. Этиладетатный экстрак промывают и упаривают досуха. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента сначала 1500 мл бензола, затем бензол, содержащий 1,0% этилацетата и бензол, содержащий 3% этилацетата. Продукт выделяют при элюации из колонки последней системой растворителей. Этот продукт собирают и перекристаллизовывают из бензола, получают 10,7 г 2-(4-метокфенил )-3-(4-оксибензоил)-6-метоксибензотиофена; т.пл. 114-116°С.
Вычислено для , %: С 70,75; Н 4,65,- О 16,39.
Найдено, %: С 70,88; Н 4,50; О 16,11.Q
Пример 30. Получение лимоннокислой соли 2-(4-метоксифенил) -3- 4-(2-пирролидиноэтокси)-бензоил -5-метоксибензотиофена.
К 150 мл диметилформамида, содержащего 1,5 г гидрида натрия, взятого в виде 50%-ной- дисперсии в масле (указанное количество эквивалентно 0,03 моль), прибавляют 9,55 г (0,025 моль) бензотиофена из примера 29. Полученную смесь нагревают до 35-40с в течение 1,5 ч затем охлаждают до комнатной температуры и прибавляют к ней 3,34 г N-(2-хлорэтил)-пирролидина в небольшом количестве диметилформамида. Реакционную смесь нагревают до 60- 70°С в течение 1 ч и затем перемешивают ночь при комнатной температуре Далее реакционную смесь упаривают досуха и остаток растворяют в этилацетата , Этилацетатный раствор несколько раз промывают водой, сушат .безводным сульфатом магния и концентрируют в вакууме. Полученное мало несколько раз растирают с гексан для удаления из него остаточных ко .личеств минерального масла, в котором диспергирован гидрид натрия, после высушивания продукта в вакуум получают 10,8 г 2-(4-мвтоксифенил) (2-пиррапидиноэтокси)-бензоил -6-метоксибензотиофена в виде свободного основания.
Вычислено для C29H2gNCij.S,%: С 71,43; Н 5,99; -N 2,87; О 13,21.
Найдено, %: С 71,33 Н 6,29; N 2,67; О 13,08.
4,4 г полученного основания растворяпот в ацетоне, раствор нагревают и смешивают его с раствором одного эквивсшента лимонной кислотьа в ацетоне . Далее смесь охлаждают до ком натной температуры и вьаделяют 3,4 г лимоннокислой соли в виде кристаллического вещества; т.пл. 112-114с Вычислено для , % : С 61,84; Н 5,49; N 2,06; О 25,8. Найдено, %: С61,94; Н 5,51; N 1,89; О 25,64. Пример 31. Получение 2-(4-оксифенил )(2-пирролидиноэток си)-бензоил -6-оксибенэотиофена. Смесь 16,5 г 2-{4-этоксифенил)-6-метоксибензотиофена и 50 г гидро хлорида пиридина нагревают при 220° в течение 6 ч, затем выливают в смесь воды со льдом, образовавшийся при этом осадок отфильтровывают, ос док сушат на воздухе и перекристаллизовывают из метанола, получают 10,5 г 2-(4-оксифенил)-6-оксибензотиофена , т.пл. 305-ЗОб°С. Вычислено для С. , % : С 69,40; Н 4,16; О 13,21; S 13,23. Найдено, %: С 69,68; Н 4,41; О 12,29; S 12,90. К 300 мл ацетона, содержапдего 50 мг 18-краун-6-эфира прибавляют 10 г (0,041 моль) синтезированного дифенола, 21 г {0,09 моль) оС-бром-п-хлорацетофенона и 13,8 г (0,1 м . порошкообразного карбоната калия кипятят с обратным холодильником в течение 18 ч. Затем к смеси добавляют еще 4,2 г сС-бром-п-хлорацето фенона и 2,76 г карбоната калия в 200 мл диметилформамида. Смесь наг ревают при в течение ночи. З тем ее упаривают досуха, к остатку, прибавляют воду и образовавшиеся кристаллы отфильтровывают. Кристал лическое вещество на фильтре промы вают водой и метанолом. Желтоватокоричневый остаток экстрагируют 300 мл горячего ацетона и остаток после экстракции перекристаллизовы вают дважды из кипящего диметилформ мида, получгиот 9,1 г (41% от теори (п-хлорфвнацилоксифенил -6-(п -хлорфенадилокси)-бензотиофена в в почти бесцветных кристаллов; т.пл. . вычислено, для С НаоСед ОдЗ, %: С 65,82; Н 3,68; О 11,69; S 5,86; Cf 12,95. Найдено, %: С 66,04; Н 3,55; О 11,52; S 5,77; Ct 13,19. . .К 400 мл дихлорэтана прибавляют 9 г (16,4 ммоль) синтезированного бисфенацильного эфира, 16,4 ммоль 4-(2-пирролидиноэтокси)-бензоилхло рида и 8,8 г хлористого алюминия, эту суспензию перемешивают в течение 24 ч при комнатной температуре затем кипятят с обратным холодильником в течение 1 ч. Затем реакционную смесь выливают в смесь льд с 50 мл 2 Н. раствора гидроокиси натрия. Далее полученную смесь фильтруют , вещество на фильтре промывают метанолом и промывные метанольные воды объединяют с фильтратом. Этот фильтрат концентрируют в вакууме и остаток растворяют в этилацетате. Этилацетатный раствор промывают водным насыщенным раствором хлористого натрия и сушат безводным сульфатом магния, Упаривание этилацетата привело к получению 7,6 г частично закристаллизовавшегося желтоватого масла, анализ которого методом ЯМР показал, что он представляет собой смесь примерно 80% (п-хлорфенилацилокси)-фенил (2-пирролидиноэтокси)-бензоил -6- (п-хлорфенадилокси)-бензотиофена и 20% исходного вещества. Эту смесь используют для проведения последующей стадии синтеза без дополнительной очистки, К 200 мл ледяной уксусной кислоты прибавляют 7,6 г сырого продукта, нагревают до 60°С и прибавляют при перемешивании 20 г порошкообразного цинка, причем температуру все это время поддерживают на уровне . После этого реакционную смесь перемешивают в течение 1ч,затем фильтруют, фильтрат упаривают и остаток растворяют в смеси этилацетата и водного раствора бикарбоната натрия. Этилацетатный слой отделяют, промывают зоднът раствором бикарбоната натрия и сушат безводнЕлм карбонатом калия. Смесь упаривают в вакууме, получгиот 5 г желтоватого масла, которое хро матографируют на колонке с силикагелем , используя метод градиентной элюации. Для создания градиента первоначально в качестве элюента используют этилацетат, постепенно разбавляя его метанолом в процессе хроматографии и завершая элюцию. смесью этилацетата и метанола в соотношении 1:1, выделяют 2,6 г соединения в виде желтоватого масла. ВЕЛчислено для Сг.- H2.5NO4.S HjiO, % : С 67,90; Н 5,70; N 2,93; О 16,75. Найдено, С 68,56; Н 5,80;N 3,32; О 16,87. Пример 32. Получение 2-(4-оксифенил )-8-бензоил-6-оксибензотиофен-1-оксида , , К смеси 1 г (3,26 ммоль) 2-(4-оксифенил )-8-бензоил-6-оксибензотиофена в 50 мл этилацетата, охлажденной до 0°С, прибавляют при перемешивании 620 г (3,59 ммоль) м-хлорнадбензойной кислоты. Реакционную смесь перемешивают в течение 1 ч и затем оставляют на ночь в холодильнике . Продукт быстро хроматографируют на колонхе с силикагелем (колонка представляет собой стеклянную трубку с пористой стеклянной плас-линкой в нижней части), осуществляя элюцию сначс1ла смесью бензола и эт илацетата в отношении 7:3, а затем чистым этилацетатом- выделяют 220 мл (19% от теории) соединения.
Пример 33. Получение 2-(4-хлорфенил )(2-пирролидиноэтокси )-бензоил -бензотиофена.
К 400 мл этанола прибавляют 47,2 г (0,428 моль) тиофена и 24 г (0,428 моль) гидроокиси калия. Смесь охлаждают до и прибавляют к ней при перемешивании 100 г (0,0428 моль о(.-бром-4-хлорацетофенона небольцдими порциями. Реакционную смесь оставляют при перемешивании при комнатной температуре на ночь. К полученной реакционной смеси прибавляют 0,5 моль 1 н. соляной кислоты и 2 л воды, образовавшиеся при этом кристаллическое вещество бле.дножелтого цвета отфильтровывают и перекристаллизовываю из метанола, получают 87,5 г (78% от теории) cxL - (фенилтио)-4 хлорадетофенона; т.пл, 52-54°С.
Вычислено для С О,%: С 64 ,1)Т; Н4 , 22 ;Об , 09 ; S1 2 , 20 ;С11 3 , 49 ,9
Найдено, %: С 64,01; Н3,93; О 6,22; S 12,52; СС 12,94.
Смесь 70 г (0,267 моль) с,-(фенилтио )-4-хлорацетофвнона и 450 г .пблифосфорной кислоты перемег-аивают при , затем нагревают до 190°С и выдерживают при этой температуре в течение 3 ч. Полученную реакционную смесь выливают и смесь воды со льдом объемом около 2 л. Выпавшие в осадок маслянистые кристаллы отделяют от маточника, промывают водой и перекриталлизовывают из этилацетата, получают 21,34 г (33% от теории) 2-(4-хлорфенил )-бензотиофена в виде кристаллического вещества; т.пл. 193- 194°С.
Вычислено для Сб S , % : С 68,7 Н 3,71; S 13,10; СЬ 14,49.
Найдено, %: С 69,45; Н 3,93; S 13,16; С 14,23.
Солянокислую соль 4-(2-пирролидиноэтокси )-бензойной кислоты (7, ,027 моль) превращают в соответствую щий хлорангидрид по обычной методике Далее к этому хлорангидриду прибавляют 7 г (0,028 моль) 2-(4-хлорфенил )-бензотиофена и 250 мл дихлорэтана получают белую суспензию, которую охлаждают до температуры в пределах от О до и Осторожно добавляют небольшими порциями 7,5 г (0,57 моль) хлористого алюминия.
Реакционную смесь перемешивают при 0-25°С в течение ночи, а затем выливают в смесь 200 мл льда и 75 мл 5 н. раствора гидроокиси натрия. Полученную смесь упаривают почти досух и остаток растворяют в хлороформе. ХЛорофррменный раствор промывают водой .- и упаривают, .а остаток нагревают
в смеси 200 мл метанола и 15 мл н. водного раствора гидроокиси натрия. Затем смесь упаривают досуха и остаток растворяют в смеси хлороформа и воды, ллороформенный слой отделяют, сушат безводным сульфатом натрия и упаривают досуха, получают масло, к которому прибавляют небольшое количество этилацетата и полученную смесь растирают. Кристаллы отделяют , а маточную жидкость - фильт6 рат концентрируют до небольшого объема и после хроматографической очистки получают дополнительное количество кристаллического продукта (всего 11,5 г), который пере3 кристаллизовывают из эфира, получают 6,68 г (50% от теории). 2-(4-хлорфенил )(2-пирролидиноэтокси )-бензоил -бензотиофена в виде кристаллического вещества;т.пл. 97-
0 98°С.
Вычислено для С27 Н2,4Се NOaS, %: С 70,10; Н 5,24; Се 7,67; N 3,03; О 6,93; S 6,94,
Найдено, %: С 70,30; Н 5,48;
5 се 7,73; N 2,93; О 6,92; S 6,85.
Формула изобретения
Способ получения производных 2-фенил-3-ароилбензотиофена общей формулы I
35
О или 1; .
где п R
0 водород, гидроксил или алкоксигруппа с 1-5 атомами углерода; водород, гидроксил, галоид, алкоксигруппа с 1-5 атома5 ми углерода, ацилоксигруппа или алкоксикарбонилоксигруппа с 2-6 атомами углерода , бензоилокси- или адамантоилоксигруппа , а также
0 группа формулы -OCHjCH NR R где ЕЗ и Нц - независимо - друг от друга алкил с 1-4 атомами углерода или R и Rjj. вместе с атомом
5 азота образуют пирролидиновый , пиперидиновый или гексаметилениминовый циклы;
водород, гидроксил алкокRO сигруппа с 1-5 2lTOMclMH
0 углерода или группа формулы -OCH2.CHiNRзR дe R, и RJ. имеют вышеуказанные значения при условии, что если RI - водород, RI водород , гидроксил, алкоксигруппа с 1-5 атомами углерода или группы формулы -OCH2.CH2NR5R4 и по крайней мере один из радикалов R и R имеет значение , отличное от водорода, или солей указанных соединений , в которых любой из радикалов R и Rj. - группа формулы ,NRjR4 о тличающийся Тем, что соединение общей формулы II
где R - водород, алкоксигруппа с 1-5 атомами углерода, фенадилокси или п-галоидфенацилоксигруппа , или группа формулы -OCH- CHgNR R -. где Rg и Н имеют вышеуказанное значение; Т - водород или группа - СОСС при условии, что не является атомом хлора, когда Rgg - водород, и А и Т неодинаковы
в присутствии катализатора Фриделя- Крафтса в среде инертного растворителя при температуре от -20 °С до температуры кипения реакционной смеси , или,если А представляет собой группу - СОСе с соединением общей формулы IY
де Rqi - водород, алкоксигруппа с
1-5 атомами углерода, фена- 20 цилокси- или п-галоидфенацилоксигруппа;
- водород, галоид, алкоксигруппа с 1-5 атомами углерода , фенацилокси- или п- 25 - галоидфенацилоксигруппа или группа формулы -OCH2CH2 NRJR4,Гдe RзИ R имеют вышеуказанное значение при условии, что по 30 крайней мере один из радикалов Rf и имеет значение , водород; А - водород или группа - СОСб подвергают взаимодействию с Ъоеди- 35
ением общей формулы JII
и полученное соединение общей формулы la
где Rq, R/t0 и R2ciимеют вьляеуказанное значение,
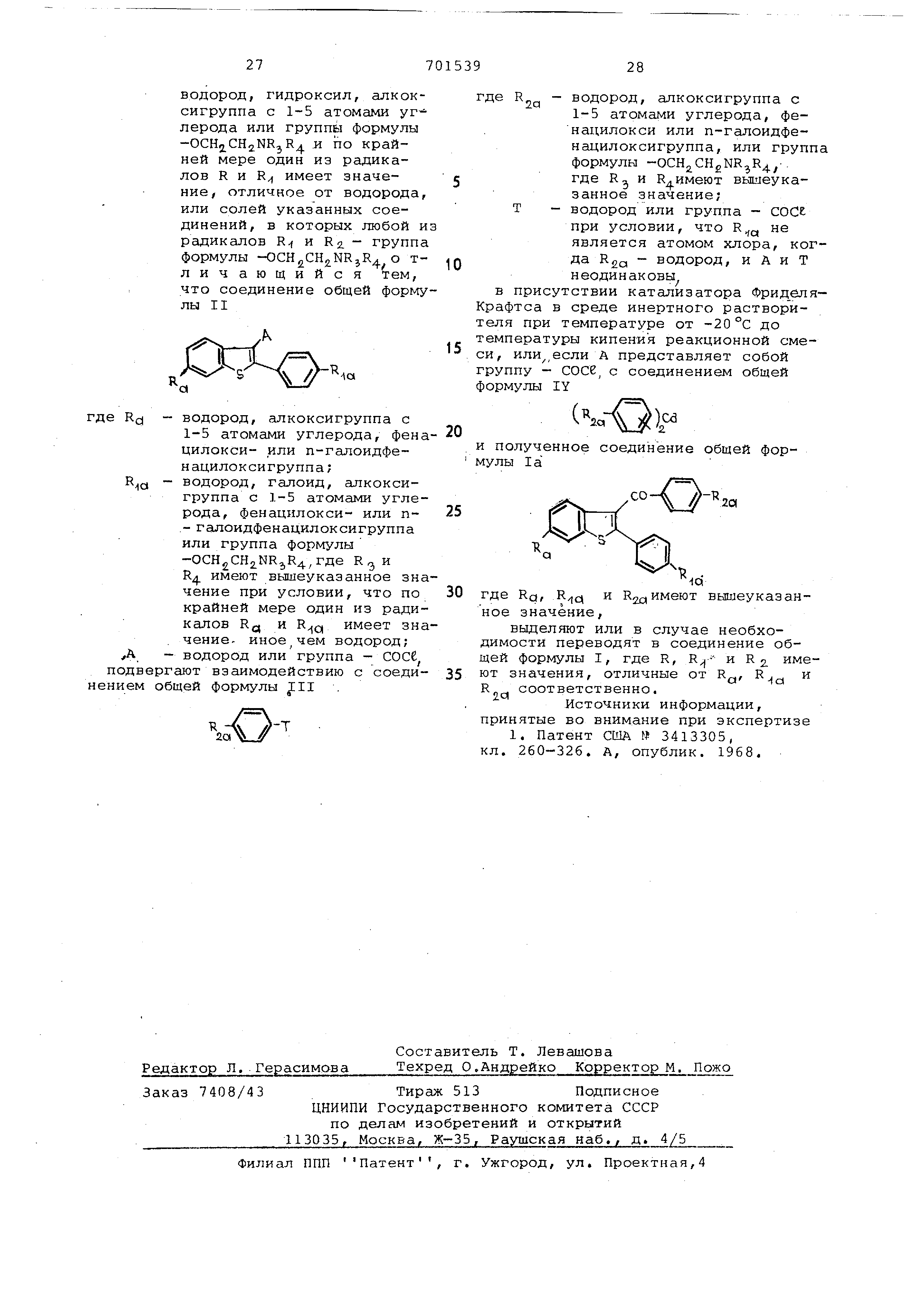
выделяют или в случае необходимости переводят в соединение общей формулы I, где R, и R имеют значения, отличные от R, R и R соответственно.
Источники информации, принятые во внимание при экспертизе
1. Патент США № 3413305, кл. 260-326. А, опублик. 1968.













Реферат

Формула


Комментарии