Способ получения 2-деоксистрептаминаминогликозодов или их солей - SU617017A3
Код документа: SU617017A3
Описание
(54) СПОСОБ ПОЛУЧЕНИЯ 2-ДЮКСИСТгеПТАМ1«АМИНОГЛИМОЗИДОВ ИЛИ ИХ СОЛЕЙ
где Rj -Й4 и п имеют вышеуказаниьге значения и X предЕЛ-авляет илк -СО- остаток в виде кислохно-адш-ит-тной сога, подвергают восстановлению дибораном в среде, безводного органического {йютворихеля с последующей обработкой реакциошюй смеси водой.
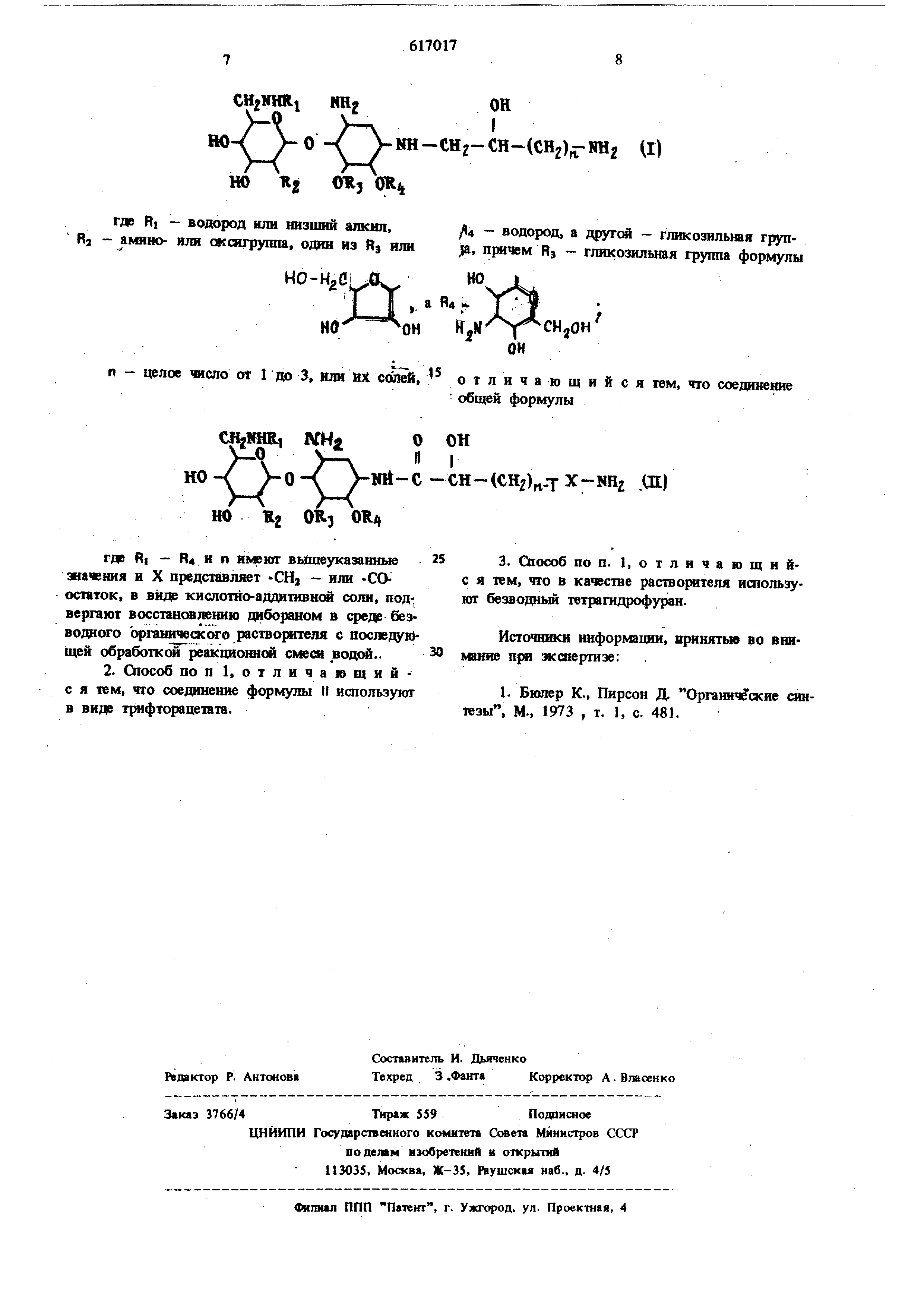
Для обеше нйя растворирлости соедгшения формулы tt способ предусматр1а$а8т образование соответствующей адциотвной сел. Такая реакция может быть, например осуществлена путем растворегдая соединег-шя форг.улы if в безводной трифторуксзсной кислоте, применяемой в избытке, при геьшературе от колетатной до 0°С. Избыток кислоты удаляется выпариванием досуха в вакууме. Затем соль растворяют в взводном ifflepTKOM органическом растворителе г-шпример, Б тетрагндрофуране или диметоксязтане, и обрабатьшают воссташвлйваняцим агентом, д -5бораном, прешочтительно в виде pacTBoi® дибора ш в тетрап1Дрофуране, обычно в избытке, при тегушерат фе от комнатной до точки кипеш1Яз в зависимости от природы данных реактантов и взятого растворителя. В случае, когда X - гр}тша, применяют количество воссгш-1авливаю1цего агента, досгато Ч ное для восстановлеш1я обеих амидньк карбонильных групп. Реаквдя полностью заканчивает ся через 24 часа, когда ее проводят в тетрагидрофуране при 50 С с избытком д борана. Затем продукт выделяют путем добавле}-шя воды для разрушения ненрореагировавшего дкборана.и испарения органического растворителя под вакуумом . рН оставшегося воддгого pacraopa доводят до 5 и неочищенный очищают от непрореагировавшегсэ исходного материала Е побочных . продуктов xpoIv1нтorpaфичecким методом Приемлемыми солями соедикеш1Й формулы I являются соли, образованные 1 ислота№1, которые образуют не токс гчлые соли, содержащие фаргуйцевтически приемлемые ajmoHbi, например, соли Х.ГГОрИСТОВОДОрОДНОЙ кислоты, брОМИСТОВОдородной кислоты, иодистоводородной кислоты, сульфаты и бисульфаты, фосфаты и кислые фос фаты, ацетаты, малеаты, фумараты, оксалаты, лактаты, тартраты, 11итраты, глюконаты, caxaf©ты , пара-толуолсульфонаты и карбонаты. Соединение формулы Я, где X -СО-, груп па ,могут бьпь получены адилированием 1-аминогруппы 2-деоксистрептаминаминоглЕкозидов по методам, аналогичным применяемым при получении соеданений 11, где X - -СНз- группа, но применяя в качестве ацилнруккцего aiCHTa реакционносяюсобное производное кислоты формулы ОН ЮОССН(СН2)п. СОМНг Новые соединения формулы I могут находиться в различных конформационных формах. Обычно каждое из колец А и В находится в форме кресла/а Rj, ОЯз и соответственно ямино- и гидрокшльные группы расположены экваториально по отношению колец А и В. Кроме того, гликозидная связь между гексапиранозильным кольцом А и 2-деоксз1Стрептаминовым кольцом В обычно является а-связью по отношению первой, в частности, когда соединения формулы Л являются производными 2 деоксистрептаминаминогликозидов.
iJ-oKoi- со-аминоалкильная группа в положении 1-N может существовать в S илн R конфигурации шш присутствовать как смесь обоих
оптических изомеров.
Пример. 150 г 1-N-(S)-4-aминo-2-oкcибyтиpшl -кaнaмнщшa А, растворяют в 10 мл трифторуксушой кислоты, при 0°С. Раствор упаривают досуха и высушивают в высоком вакууме при 20° С в течение 15 мин. Получают стекловидное твердое вещество, которое растворяют в 5 мл сухого тетрагидрофурана и порциями добавляют 20 мл Ш раствора диборана в тетрагидрофуране в атмосфере азота, Получеаяьт
прозрзшый раствор нагревают 3 часа при 50°С, оставляют стоять при кошитной температуре 16 час и нагревают еще 3 час при 50° С. Избыток диборана разрушают осторожным добавле1шем нескольких капель воды и затем органический растворттель удаляют в вакууме. Остаток растворяют в Ш мл водЬг и подщелачивают 0,1 н едким гатрием. Добавляют 2 н соляной кислоты до рН 5. Затем раствор хроматографируют на колонке с ионообменной смолой Амберлит С - 50 в аммонийной форме, элюируя сначала дистиллированной водой для удаления неорганических твердых веществ, затем водными растворами аммиака с концентрациями , увеличивающимися от 0,1 и до 1,0 н Фракщш, содержащие продукт,объединяют, выпартают в вакууме, получают 75 г (50%) 1N- ((S)-4-aivfflHo-2-oKCH6ymn канамип|1на А. Электрофорез в тонком слое R« 0,6. Электролит состоит из смеси равных частей уксусной и муравьиной кислот с рН 2; пластинка 20 cм пoкpытaя кремнеземом. Потенциал в 900 вольт в течение 45 мин. Детектарование вьшолнянтт HjrreM сушки пластинки, распыления циклогексанового раствора трет.бутилгипохлорита и затем сущки, охлаждения и проявления пластинки раствором крахмал-йодистый калий. В этих условиях эталонный ВВ-К8 дает величину R. 1 и канамидин А величину R.,9. ИК-спектр подтверждает потерю полосы поглощения амид-карбонила, габлюданнцуюся у ВВ-К8 при 1635 см . (с 1,0; HjO). Масс спектроскопия (десорбция поля) показьшает сильный пик Р + 1 при 572 м/е. Образец превращают в летучее производное пента-М-ацетил-окта-Отриметилошила, путем обработки угссусным анга/фидом в метаноле коЪнатнсй температуре в течение 24 час и затем смесью гексаметилдиоксисилазана и триметилхлорсилана (2:1), при комнатной тем ператзфе в течение 24 час. Найдено М 1357 CssHj i9f sOi7Sig Вычислено М 1357 Шйдено,%: С 40,1; Н 6J; (М 9,6. q sNsOij -l H.COj , Вычислено,%: С 40,5; Н 6,9; N 9,6. П р и м е р 2. 100 мт бутироз1т I-N- (3)-4-амино-2-оксибутирил pибocта шцинa в виде свободного основания растворщот в 5 мл трифторуксусной кислоты при ко пи-гаой ткмп ратуре. Избыток кислоты вьшаривают досуха в вакууме и получают стекловидную трифторацетатную соль. Ее извлекают 10 ьи диметидового эфира диэтиле гликоля (да1глим) и добавлЯ ют 10 мл 1М раствора диборана в тетрагидрофуране и получают прозрачный растеор, которы выстаивают 18 час при комнатной теЛШературе. Затем добавляют еще 5 мл раствора диборана и выстаивают при комнатной телетературе 24 щ Избыток даборана разрушают осторожным доба лением нескольких капель воды, органический {ястворитель удалшот под вакуумом при 50° С. Остаток подщелачивают несколькими кашшми 2 и МаОН, добавлшот i 2 н соляной кислоты, рН доводдт до 5. Продукт выделяют путем ионообменной хр01 тограф1ш на смоле Амберлит С-50, как описано в примере 1. Фракида, содержащие продукт, об-ьед1шяют и упаривают в вакууме. Получают 1-N-(S)-4-aминo-2-OfKcи бyтил5 -рибоста мидии. Электрофорез в тонком слое Hf 0,5. (Условия тгхие же, как оииса 1ные ранее, в качестве эталона применяют бзггарозин с R,: 1,0). Примерз. 0,35 г (5)-5-амшю-2-оксивалерил1-канамициш А превращают в трифторадетатн ю соль, восстанавливают и хроматографируют как описано в примере 1. Полу чают 0,12 г (35%) 1-N-(S)-5-.a шнo-2-oкcипeнтилЬкaнaмицинa А. Электрофорез в тонком слое Й 0,7. (Условия такие же, как описано в примере 1, исходное соедшкние используют в качестве эталона с R 1,0). П р и м е р 4. ОЛ 5 г l-W- (З-амшо-2-оксИ; «Н1ропионил)-канаш{1 : 1ш А восстанавливают, как в примере, и получают 0,04 г (27%) l-N-(3амино-2-оксипропил ) -канаг/ящина А. Электрофорез в тошсом слое R, 0,6. (Условия такие ;«е,как описано в примере 1, исходаое соединение используют в качестве эталона с R.J 1,0).- П р и м е р 5. 6-N-MeTHj l-N-(8)-4-ами но-2-оксибутирилЬканамицин А восстанавливают как описано в примере 1 и получают 6-N{ (8)-4-амино-2-окси-бутил канамяцина А. Электрофорез в тонком слж R,. 0,7. (Условия такие же, как описано к примере 1, исходное соединение применяют в качестве эталона с R.j 1,0 и канамнцин А дает величину Rp 1,03). П р н м е р 6. 1-N-(S)-4-aмипo2-oкcибyтшI канамицин В. 1 - N-1 (S) -Фалшно- 2- ок си бутирил J какамипин В превращают в трифторацетат, восстанавливают дабораном и хроматографнруют на ионооб менной смоле по методике, описа1шой в примере ,1, полуиют 2-деоксистрептаминаминогликозид . Методрм тонкослойного электрофореза получают Rr 0,6 (при условиях, описаинтлх в исходное вещество применяют в примере эталона 1,0 и канаржци.п В качестве имеет значе1Э1е Re 0,95). П р и м е р 7. По мето/jjtKC примерз I, с примене1Я1ем в качестве исходаштх вепдестт;: 1-М-(3-аМ1Шо-2-окс -шропнокнл) кяналнгизтна В, 6-N-метил- 1-N- (1)-3-ам1 но-2-оксилропип нил канамнщ111а А, 6-Ы-эт1Ш-1-М- ((S)5-a s нo-2-oкcifflaлcpшгi канамищпш А, 6-М-бутил- 1-N- (5)-5-амяио-2-сжс;шалеркл канамиюша В; 1- М- (3-ам1-шо-2-оксипропионил) рнбостамищша , 6-М-метил-1-М- {8)-4-аштно-2-окси6ур1рз1л ркбостамицщга , б-М-ирощл- J- N- (S) -5-амино-2-скснва.таргш рибостамйщша, 1-М- (3-амино-2 окс5трош1ошт)кеог-.5зизь- я Б, 1-N- (4-а№ 1О-2-окс1 б а15рвл)) С и б-Ыбуткл- 1-N- (5-аь-я1на-2-оксгталерил)згеомнI3jjna В получают соответственно: (3-8М5ШО-2;-ок(31Прогшл) кана1 1пд 1Н В, 6- М-метил-1- N-1 (L) 3- gjvfKHO- 2- oKCPriponiiJi 1 канаш дин А,. 6- -этйп-1-М- i(S)-5-ab«mo-2-oKC meim:jji канамицин А, 6- N-бугал-1 - № (S) - 5-амино- 2- окслкекош канамодш В, 1 - N- (3-а№но- 2- оксипропил) риооск мцик,, б-Н-ые-пш- 1-N- {(8)-4-агй {но-2-оксибут ш|рйбостами1шн ,: 6- Ы-пррпкл-1 - М- (S) 5-амш1о- 2- скс яткя 1 рибостамищга, l-N-i3-aAfflHO-2-oKCHnponHjTJ neoMiHsjiH R, 1-М- Фамино-2-оксибутил1нео мш 1 С и 6-1 -бутнл-1- -N- (5-ашп о-2 ОКсип-знтил)1 неомющн В. Формула и 3 о б р е т l. Сиособ полу 1ения 2-деокс {стрстй л55н миногликозидов общей формулы
MR;
0 - VNH--CH M V4
HO 1l2 ОИз OR RJ - п - целое число ot 1 до
с - сн (сн2).т X-Шг ,tn)
где RI - R4 и п имеют вьШюуказаннью значения и X представляет --СИ - или -СОостаток , в виде кислотно-аддитивной соли, под-; вергают восстановлению дибораном в среде безводного орпшичеосся-о растворителя с последунЬ щей обработкой решсционной смеси водой..
2. Способ по п 1, о т л и ч а ю 0} и и с я тем, что соединение формулы II используют в виде т жфторацетата.
снго он
п I
3. Способ по п. 1, о т л и ч а ю щ и йс я тем, что в качестве растворителя ишользуют безводньш тетрагидрофуран.
Источники информации, приняты во внимание при жсяертизе:
1. Бюлер К., Пирсон Д. Органич схие синтезы , М., 1973 , т. 1, с. 481. где RI - водород или низший алкнп, - водород, а другой - гликоэильная труп амяио- или с|ссигрушш, один из Rj или да, П{Я1чем Rj - гликозильная группа формулы , °уН о S СН jOH 3, или tiX солей, отличающийся тем, что соединение формулы



Реферат

Формула


Комментарии