Фрагмент днк (варианты), слитый фрагмент днк для экспрессии в растениях и способ получения трансгенного растения и его потомков - RU2130491C1
Код документа: RU2130491C1
Чертежи


























































Описание
Изобретение относится к фрагментам ДНК, содержащим химически регулируемый район гена, слитому гену и способу получения трансгенных растений и его потомков. Главным образом, изобретение относится к некодирующим ДНК-последовательностям, которые, в присутствии химических регуляторов, регулируют транскрипцию других ДНК-последовательностей в растениях.
Предпосылки создания изобретения
Достижения в области технологии рекомбинантной ДНК совместно с успехами в области трансформации растений и технологии регенерации позволяют вводить новый генетический материал в клетки растений,
растения 20 или их ткани, в результате чего реализуется новый признак, например, фенотипы, повышающий ценность растения или ткани растения. Недавняя демонстрация подвергнутых методам генной инженерии
растений, устойчивых к действию патогенов (EP-A 240332 и EP-A 223452), или насекомых [Vaeck М. et al., Nature 328, 33 (1987)] , а также создание растений, устойчивых к действию гербицидов [DeBlock М.
et al., EMBO J. 6, 2513 (1987)], показывает потенциальные возможности для повышения урожая. Число таких культур достаточно широко: от деревьев и кустарников до декоративных цветов и полевых культур.
Термин "культура" охватывает культуру растительной ткани, выращенной в биореакторе в качестве источника аналогичного природного продукта.
В некоторых случаях желательно контролировать время и/или степень экспрессии введенного генетического материала в растениях, растительных клетках или тканях. Идеальным условием является регуляция экспрессии желаемого признака, созданного методами генной инженерии, с помощью регулирующего промежуточного вещества, который может легко применяться на полевых культурах, декоративных кустарниках, в биореакторах и тому подобное.
В настоящее время такая ситуация может быть реализована с помощью настоящего изобретения, которое, помимо прочего, относится к химически регулируемой системе экспрессии химерного гена, включающей химически регулируемую, некодирующую ДНК-последовательность, соединенную, например, с геном, кодирующим фенотипический признак, в результате чего экспрессия такого признака контролируется регулятором, например, так, что экспрессия регулируемого гена определяется наличием или отсутствием химического регулятора. Такая система служит первой демонстрацией концепции химической регуляции экспрессии химерного гена в растениях или растительных тканях. Такая система позволяет создавать трансгенные растения или ткань растения и регулировать экспрессию с помощью химического регулятора.
A. Общий обзор технологии трансформации растений
Известны различные методы реализации генетической трансформации растений и растительных тканей (например, стабильное введение в растения
посторонней ДНК). Такие методы включают трансформацию с помощью разновидности Agrobacterium и трансформацию путем прямого переноса гена.
1. Трансформации с помощью Agrobacterium
A. tumefaciens представляет собой этиологический агент корончатого галла, заболевания которому подвержено большое число двудольных и голосеменных растений, в результате которого происходит
образование опухолей или галлов в растительных тканях на участке инфицирования. Agrobacterium, обычно инфицирующий растение на раневых участках, является носителем крупного экстрахромосомного элемента,
называемого Ti (индуцирующая опухоль) плазмиды.
Ti плазмиды содержат два участка, ответственных за возникновение новообразований. Одним участком является Т-ДНК (трансферриционная ДНК), представляющая собой ДНК-последовательность, которая в устойчивом состоянии переносится в растительную геномную ДНК. Другой участок, ответственный за появление новообразований, представляет собой vir (вирулентный) участок, принимающий участие в механизме переноса. Хотя vir участок абсолютно необходим для стабильной трансформации, vir ДНК в действительности не переносится в инфицированное растение. Трансформация растительных клеток под действием инфицирования разновидностью Agrobacterium tumefaciens и последующий перенос Т-ДНК описаны в литературе. См., например, работу Bevan M.W. и Chilton M.-D., Int. Rev. Genet. 16, 367 (1982).
После ряда лет интенсивных поисков во многих лабораториях была разработана Agrobacterium система, позволяющая осуществлять рутинную трансформацию ряда растительных тканей. Примерами тканей, трансформированных таким методом, могут служить табак, помидоры, подсолнечник, хлопок, редька, картофель, соя и polplar. Хотя для Ti плазмидной трансформации с использованием в качестве инфицирующего агента A. tumefaciens могут использоваться самые разнообразные хозяева, лучшим из них является табак, поскольку с ним легко манипулировать.
В качестве вектора для трансформации растений используется также Agrobacterium rhizogenes. Эта бактерия, возбуждающая образование волосяного корня у многих разновидностей двудольных растений, несет крупный экстрахромосомный элемент, называемый Ri (корень-индуцирующей) плазмиды, которая выполняет функции, аналогичные функциям Ti плазмиды A. tumefaciens. Трансформация с использованием A. rhizogenes была разработана аналогично трансформации с применением A. tumefaciens и с успехом осуществлена для трансформации, например, люцерны, Solanum nigrum L.. и polplar.
2. Прямой перенос гена.
Некоторые методики так называемого прямого переноса гена были разработаны для трансформации растений и растительных тканей без использования промежуточного хозяина Agrobacterium. При прямой трансформации протопластов внедрение в него экзогенного генетического материала может быть усилено при использовании химического агента или электрического поля. Затем экзогенный материал может встраиваться в ядерный геном. Ранее работа была проведена на двудольном табаке и было показано, что посторонняя ДНК вводится и передается потомству растений, см., например, работу Paszkowski J. et al., EMBO J. 3, 2717 (1984); и Potrykus I. et al., Mol. Gen. Genet. 199, 169 (1985).
По этой методике была также осуществлена трансформация однодольных протопластов, например, Triticum monococcum, Lolium multiflorum (итальянский плевед), маиса и черной мексиканской сладкой кукурузы.
Экзогенная ДНК может также вводиться в клетки или протопласты путем микроинъекции. В этом случае раствор плазмидной ДНК вводят непосредственно в клетку с помощью хорошо вытянутой стеклянной иглы. Этим способом протопласты люцерны были трансформированы большим числом плазмид, см., например, работу Reich T/J/ et al., Bio/Technology 4, 1001 (1986).
Позже разработанная методика прямого переноса гена включает бомбардировку клеток микроснарядами несущими ДНК, см. работу Klein T.M. et al., Nature 327, 70 (1987). По этой методике вольфрамовые частицы, покрытые экзогенной ДНК, ускоряются в направлении целевых клеток, в результате чего имеет место по крайней мере временная экспрессия, например, как в приведенном примере (лук).
B. Регенерация трансформированной растительной ткани.
Существует большое число методов трансформации растительных тканей, как и большое число методов регенерации растений из растительных тканей. Конкретный метод регенерации будет зависеть от исходной растительной ткани и конкретной разновидности растения, подвергаемого регенерации. В последние годы появилась возможность регенерации многих разновидностей растений из каллюсовой ткани эксплантатов растений. Растения, которые могут быть регенерированы из каллюса, включают такие однодольные, как пшеница, рис, ячмень, кукуруза и рожь, а также такие двудольные, как подсолнечник, соя, хлопок, редька и табак.
Регенерация растений из ткани трансформированной A. tumefaciens была продемонстрирована для нескольких разновидностей растений. Эти растения включают подсолнечник, помидоры, белый клевер, редьку, хлопок, табак и polplar. Была также продемонстрирована регенерация люцерны из ткани трансформированной с помощью A. rhizogenes. Особенно полезной технологией является регенерация растения из протопластов, см. работу Evans, D.A. et al., в: Handbook of Plant Cell Culture, том 1, MacMillan Publ. Co., 1983, стр.124. В том случае, когда разновидности растений могут быть регенерированы из протопластов, можно использовать методы прямого переноса гена и трансформация не зависит от использования A. tumefaciens. Регенерация растений из протопластов была продемонстрирована для риса, табака, редьки, картофеля, баклажанов, огурцов, porplar и кукурузы.
Технологические успехи в области трансформации растений и в их регенерации создают возможность улучшения культур методами генной инженерии. Имеются сообщения о созданных методами генной инженерии растениях табака и помидор, обладающих устойчивостью к заражению, например, мозаичным вирусом табака (TMV), и устойчивых в отношении различных классов гербицидов. Методами генной инженерии были созданы растения табака и помидор, обладающие устойчивостью к действию насекомых.
C. Клеточные культуры.
Объекты, подходящие для генной инженерии, не ограничиваются полевыми культурами, а включают декоративные растения, фуражные культуры и деревья. Менее очевидной задачей растительной биотехнологии, включающей использование методов генной инженерии и тканевой культуры, является расширенное производство большого числа химических соединений растительного происхождения, включающих отдушки, ароматизирующие добавки, пигменты, природные вкусовые агенты, промышленное сырье, антимикробные агенты и фармацевтические агенты. В большинстве случаев такие соединения принадлежат к достаточно широкой метаболической группе, которую обычно обозначают как вторичные продукты. Растения могут продуцировать такие вторичные продукты, предназначенные для отпугивания хищников, привлечения опылителей или борьбы с инфекционными заболеваниями.
Растительные клеточные культуры могут быть получены из большого числа разновидностей растений и они могут быть размножены в биореакторе. Типичные растительные разновидности включают большинство таких разновидностей, которые продуцируют вторичные продукты, представляющие коммерческий интерес. Было убедительно показано на ряде культурных растений, важных с сельскохозяйственной точки зрения, что устойчивые генетические варианты, возникающие из клеточной культуры растительных соматических клеток (сомаклональная вариация), могут быть индуцированы и подвергнуты селекции. Из продуцирования тканевой культуры вторичных метаболитов вытекают многочисленные преимущества. Они включают: (1) возможность достижения повышенной чистоты получаемых продуктов, (2) превращение дешевых предшественников в дорогостоящие конечные продукты в результате биотрансформации, и (3) возможность использования субстрата аналогичного культуре с целью создания новых соединений.
D. Преимущества регулируемой экспрессии генов.
Хотя целью генной инженерии растений являются полевая культура, декоративный кустарник, цветы, деревья и тканевые культуры, предназначенные для использования в биореакторе, реализация принципиального преимущества состоит в регулировании экспрессии химерного гена таким образом, чтобы он экспрессировал за соответствующее время и в соответствующей степени и, в некоторых случаях, в конкретных частях растения. Так, например, для достижения желаемого фенотипа химерный ген должен экспрессировать до уровней порядка 1% от общего содержания протеина или выше. Это особенно касается случаев фунгицидной устойчивости за счет экспрессии химерной хитиназы или устойчивости к действию насекомых за счет усиленной экспрессии ингибитора протеинкиназы. В таких случаях энергия, затрачиваемая на продуцирование высоких уровней протеина, может оказывать вредное воздействие на растения, тогда как при экспрессии гена только в тех случаях, когда это желательно, например, при примерно одинаковой инвазии грибками и насекомыми, потребление энергии и, следовательно, выход могут быть уменьшены.
С другой стороны, фенотип, экспрессированный химерным геном, может оказывать вредное влияние на растение, если его экспрессия происходит в несоответствующие времена на стадии развития. Так, например, если химерный генный продукт представлял собой растительный гормон, индуцирующий опадание стручков, ранняя экспрессия может вызвать опадение плодов с растения до созревания семени, в результате чего уменьшится урожай. В этом случае значительно полезнее индуцировать экспрессию гена такого типа в то время, когда опадание стручков является предпочтительным или по крайней мере вредным для растения.
Для ткани в культуре или в биореакторе преждевременное продуцирование вторичного продукта может приводить к понижению скорости роста культуры, в результате чего может уменьшаться урожай продукта. Поэтому выгодно дать культуре расти без экспрессии вторичного продукта и затем индуцировать химерный ген в надлежащее время с тем, чтобы реализовать оптимальную экспрессию желаемого продукта.
На основании высказанных выше соображений, а также и по другим причинам, совершенно очевидно, что контроль времени, степени и/или участка экспрессии химерного гена в растениях или растительных тканях весьма желателен. Особенно коммерчески ценным будет контроль, который можно легко осуществлять в полевых условиях, в теплице или в биореакторе.
E. Известные системы регулируемой экспрессии гена в растениях.
Известно, что некоторые растительные гены могут быть индуцированы различными внутренними и внешними факторами, включающими растительные гормоны, тепловой шок, химические агенты, патогены, отсутствие кислорода и света. Хотя лишь некоторые из таких систем описаны детально, для наиболее изученных известно, что повышенная аккумуляция и РНК приводит к повышению содержания специфического протеинового продукта. В качестве примера регуляции гена под действием растительного гормона, можно привести индукцию с помощью абсцизной кислоты (АБК), и РНК хлопка, присутствующих на стадии позднего эмбриогенеза, (см. , работу Galau G.A. et al., Plant Mol. Biol. 7, 155, 1986). Другим примером такого действия является индукция под действием гиббереллиновой кислоты (GA3) транскрипции синтазы яблочной кислоты в семенах касторового масла, а также изозимов альфа-амилазы в слоях алейрона ячменя, см., работу Rodriguez D. et al., Plant Mol. Biol. 9, 277 (1987); Nolan R.C. et al., Plant Mol. Biol. 8, 13 (1987).
Детально изучена регуляция протеиновых генов сои под действием теплового шока. Обработка растений в течение нескольких часов при 40oC приводит к de novo синтезу нескольких так называемых тепло-шоковых протеинов [Key J. et al. , Proc. Natl. Acad. Sci. USA, 78, 3526 (1981)]. Некоторые из таких генов были выделены и их регуляция была подробно изучена. Экспрессия таких генов контролируется главным образом на уровне транскрипции. Промотор hsp70 гена был лигирован с неомицин-фосфотрансферазным II (NptII) геном и было показано, что химерный ген индуцируется под действием теплового шока [Spena A. et al., EMBO J. 4, 2736 (1985)], причем на более низком уровне в сравнении с эндогенными тепло-шоковыми генами.
Другой класс индуцируемых генов в растениях включает легкие регулируемые гены, в большинстве случаев находящийся в ядерном ДНК закодированный ген мелкой субъединицы рибулоза-1,5-бифосфаткарбоксилазы (RUBISCO). Morelli G. et al (Nature 315, 200 (1985)) и Hererra-Estrella L. et al (Nature 310, 115 (1984)) показали, что 5'-фланкирующие последовательности горохового RUBISCO гена могут придавать гену-репортеру способность к индукции на свету при слиянии. Эти наблюдения относятся и к другим свето-индуцируемым генам, например, к хлорофилл a/b связывающему протеину.
Гены спиртовой дегидрогеназы (adh) кукурузы были подвергнуты тщательному изучению. Был выделен adhl-ген кукурузы и было показано, что часть 5'-последовательности ДНК способна индуцировать экспрессию химерного гена-репортера (например, хлорамфеникол-ацетилтрансфераза, CAT), в том случае, когда временно трансформированную ткань помещают в анаэробные условия (Howard E. et al., Planta 170, 535 (1987)).
Была разработана группа химических веществ, известных как защитные агенты с целью защиты "охраняемых" культур от потенциально вредного воздействия гербицидов. Хотя общий механизм действия таких соединений полностью не выяснен, одним из возможных механизмов является регуляция под действием таких веществ природно регулируемых генов. Недавно было сообщено, что более высокие уровни содержания глютатион-s-трансферазы (GST) индуцируются в кукурузе, обработанной таким охраняющим агентом, как бензиловый эфир 2-хлор-4-(трифторметил)-5-метилтиазолкарбоновой кислоты, см. работу Wiegand R.C. et al. , Plant Mol. Biol. 7, 235 (1986). Хотя в ходе такой обработки повышается уровень содержания иРНК GST, о механизме, приводящем к такому повышению, ничего не сообщается.
Многие растения с гиперчувствительной реакцией на различные патогены стимулируются к продуцированию группы экстрагируемых кислотой патогенез-родственных (PR) протеинов низкого молекулярного веса (Van Loon L.C., Plant Mol. Biol. 4, 111 (1985)). Однако наибольший интерес вызывает наблюдение того факта, что такие же PR-протеины аккумулируются в высоких количествах в растениях, обработанных такими химическими агентами, как полиакриловая кислота и ацетилсалициловая кислота (Gianinazzi S. et al., J. Gen. Virol. 23, 1 (1974); White R.F., Virology 99, 410 (1979)). Присутствие PR-протеинов коррелирует с индукцией как местной, так и системной устойчивости к действию большого числа патогенов. Было показано, что межвидовой табачный гибрид, устойчивый к действию мозаичного вируса табака (TMV), в существенной степени экспрессирует PR-протеины (Ahl P. et al., Plant Sci. Lett. 26, 173 (198-2)). Кроме того, иммуноосаждение продуктов in vitro трансляции с использованием иРНК инфицированного TMV или химически обработанного табака (Cornelissen B. J. C. et al., EMBO J. 5, 37 (1986); Carr J.P. et al., Proc. Natl. Acad. Sci. USA 82, 7999 (1985)) показало, что повышенное содержание PR-протеина является результатом аккумуляции РНК. Поэтому индукция PR- протеиновых генов под действием химических агентов или патогенов представляет собой метод, имеющий отношение к проблеме химической регуляции генной экспрессии в растениях и растительной ткани.
Описание изобретения.
Согласно настоящему изобретению предлагается фрагмент ДНК, представляющий собой регуляторную область химически регулируемого гена, получаемого из гена PR-1a табака, имеющего последовательность 1 (см. в конце описания).
Изобретение относится также к фрагменту ДНК, представляющему собой регуляторную область химически регулируемого гена, получаемого из гена PR-1 табака, который имеет нуклеотидную последовательность 2 (см. в конце описания). Объектом изобретения является также фрагмент ДНК, представляющий собой регуляторную область химически регулируемого гена, получаемого из гена PR хитиназы огурца, нуклеотидную последовательность 3 ( см. в конце описания).
Изобретение относится к фрагменту ДНК, представляющему собой регуляторную область химически регулируемого гена, проявляющему регуляторную область химически регулируемого гена, получаемого из основной формы гена PR-R, кДНК которого, кодирующая основной белок PR-R, имеющему нуклеотидную последовательность 4 (см. в конце описания).
Объектом изобретения является фрагмент ДНК, представляющий собой регуляторную область химически регулируемого гена, получаемого из гена основной бета-1,3-глюканазы табака, содержащегося в клоне pBS Glue 39.1. имеющего нуклеотидную последовательность 5 (см. в конце описания).
Изобретение также относится к фрагменту ДНК, представляющему собой регуляторную область химически регулируемого гена, получаемого из гена основной бета-1,3-глюканазы табака, включенный в клон pBS Glue 39.3, имеющего нуклеотидную последовательность 6 (см. в конце описания).
Объектом изобретения является фрагмент ДНК, представляющий собой регуляторную область химически регулируемого гена, получаемого из гена PR-Q табака, кДНК которого, кодирует белок PR-Q, имеющий нуклеотидную последовательность 7 (см. в конце описания).
К данному изобретению также относится фрагмент ДНК, представляющий собой регуляторную область химически регулируемого гена, получаемого из гена кислотной формы бета-1,3-глюканазы, кДНК которого, кодирует бета-1,3-глюканазу, имеющий нуклеотидную последовательность 8 (см. в конце описания).
Предпочтителен слитый фрагмент ДНК для экспрессии в растениях, содержащий любой из вышеуказанных функционально связанный со структурным геном и способный транскрибироваться в растении или ткани растения, в частности, слитый фрагмент ДНК функционально связанный со структурным геном, представляющим собой кодирующую последовательность, обусловливающую фенотипический признак.
При этом предпочтителен слитый фрагмент ДНК, в котором ген кодирует бета-1,3-глюкуронидазу (GUS), ацетогидрокислотную синтазу (AHAS) и эндотоксин Bacillus thuringiensis (B.T.), в частности, кодирует сигнальный пептид, который преимущественно имеет последовательность сигнального пептида белка PR, и предпочтительно имеет следующую нуклеотидную последовательность.
Желательно, чтобы предпочтительный слитый фрагмент ДНК был функционально связан со структурным геном, содержащим 2 области, при этом одна область кодирует сигнальный пептид, который преимущественно имеет последовательность сигнального пептида белка PR, а вторая область кодирует фенотипический признак.
Объектом изобретения также является способ получения трансгенного растения и его потомков, предусматривающий выделение ДНК-последовательности регуляторной области, конструирование рекомбинантной плазмиды, содержащий указанную ДНК-последовательность и структурный ген, трансформацию растений или растительного материала плазмидой, отбор трансформированных клеток и получение трансформированных регенерантов. Отличием предлагаемого способа является выделение одного из вышеуказанных фрагментов ДНК, представляющих регуляторную область, конструируют рекомбинантную плазмидную ДНК, содержащую указанный фрагмент, функционально связанный со структурным геном, и необязательно генетический маркер, трансформированные клетки обрабатывают химическим индуктором, и дополнительно отбирают клетки, экспрессирующие фенотипический признак, кодируемый структурным геном.
Преимущественно используют индуктор, который представляет собой бензойную кислоту, или салициловую кислоту, или бензо-1,2, 3-тиадиазол-7-карбоновую кислоту, или бензо-1,2,3-тиадиазол-7- тиокарбоновую кислоту, или бензо-1,2,3-тиадиазол-7-тиабензолкарбоновую кислоту, или бензо-1,2,3-тиадиазолкарбоновую кислоту, или метил-бензо-1,2,3-тиадиазол-7-карбоксилат, или н-пропил-бензо-1,2,3-тиадиазол- 7-карбоксилат, или бензил-бензо-1,2,3-тиадиазол-7-карбоксилат, или 2,6-дихлоризоникотиновую кислоту, или 2, 6-дихлоризоникотинат, или метил-бензо-1,2,3-тиадиазол-7-карбоксилат.
Регуляторную область получают как правило из регуляторной области генов, кодирующих PR-1a или PR-1', или PR-Q, или PR-R табака, или хитиназу огурца, или основную или кислотную бета-1,3-глюканазу табака.
Указанная регуляторная область, как правило, содержит от 600 до 1000 п. о., примыкающих к сайту начала транскрипции.
Предпочтительно регуляторная область является 5'-фланкирующим районом гена PR-1a табака и содержит 300 п.о., примыкающих к сайту начала транскрипции.
Как правило, плазмиду выбирают из группы, которая включает pBS-PR-1013Cla, депонированную под номером ATCC 40426, pBS-PR 1019, депонированную под номером ATCC 40427, pBS-Gluc 39.1, депонированную под номером ATCC 40526, pBS-Gluc 39.3, депонированную под номером ATCC 40527, pBS Gucchi/chitinase, депонированную под номером ATCC 40528, pBS-GL6e, депонированную под номером ATCC 40535.
При этом растения, подлежащие трансформации, преимущественно выбирают из группы, включающей табак, морковь, подсолнечник, томаты, хлопок, сорго, Petunia и Glycine, или выбирают из группы, включающей Zea mays, Dactylis и Lolium.
Краткое описание чертежей.
Фиг.1. Частичная рестриктная карта лямбда tobchrPR1013. Геном рекомбинантного фага размером 49 kb изображен слева и справа от указанного фага. Вставка из генома табака размером 19 kb в увеличенном виде показана снизу физической карты фага лямбда. Указано положение PR-1a гена (заштрихованный блок) и направление транскрипции (стрелка). P=Pst, H=HindIII, C=ClaI, R=EcoRI.
Фиг.2. Показана конструкция pBS-PR1013Cla из лямбда tobchrPR1013. Фрагмент ДНК размером 19 kb между двумя ClaI сайтами субклонировали в плазмиду bluescript, C=ClaI, LGT агароза = агароза с низкой температурой стеклования.
Фиг. 3. Изображена конструкция pBS-PR1013Eco из лямбда tobchrPR1013. Фрагмент EcoRI размером 3,6 kb, содержащий PR-1A ген из лямбда tobchrPR1013, субклонировали в bluescript. R=EcoRI, LGT агароза = агароза с низкой температурой стеклования.
Фиг. 4. Показана конструкция pBS-PR1013Eco из pBS-PR1013Cla. Фрагмент EcoRI размером 3,6 kb, содержащий PR-1A ген, субклонировали в EcoRI сайт плазмиды bluescript. C=ClaI, R= EcoRI, LGT = агароза с низкой температурой стеклования.
Фиг.5. Показана конструкция pBS-PR1013EcoΔPst из pBS-PR1013Eco. Фрагмент PstI размером 600 bp выделен из pBS-PR1013Eco. P=PstI, R=EcoRI, X=XhoI, S= SalI, LGT агароза = агароза с низкой температурой желатинирования.
Фиг. 6. Показана конструкция pBS-PR1013EcoΔPstΔXho из pBS-PR1013EcoΔPst. Фрагмент XhoI размером 2 kb выделен из плазмиды pBS-PR1013EcoΔPst.R = EcoRI, P=PstI, X=XhoI, S=SalI, LGT агароза = агароза с низкой температурой желатинирования.
Фиг.7. Показана конструкция pCIB270 из pBI101.3 и pBS-PR1013E- coΔPstΔXho.. Фрагмент PstI-Xhol, содержащий часть PR-1a гена и 5'-фланкированной последовательности субклонировали в pBI101.3 расщепленную SalI-BamHI. Сайты XhoI и SalI совместимы и при лигировании разрушают оба рестрикционных сайта. PstI сайт адаптирован к BamHI сайту с использованием молекулярного адаптера. X=XhoI, P=PstI, (X/S) = сайт слияния XhoI и SalI. В результате этого никакой энзим не способен расщеплять такой (X/S) сайт. LB = левая граница Т-ДНК, RB = правая граница Т-ДНК. Направление транскрипции из PR-1a индуцируемого участка показано стрелкой в направлении pCIB270. Заштрихованная площадь на pCIB270 обозначает 3'-процессионный сайт NOS-гена. Закрашенная область pCIB270 обозначает бета-глюкуронидазный ген. Площадь pCIB270, отмеченная пунктиром, представляет собой неомицин фосфотрансферазный II ген. Площадь pCIB270, отмеченная полосками, представляет собой NOS промотор.
Фиг. 8. Показана конструкция
Фиг.9. Схема, изображающая конверсию ATG кодона PR-1a в NcoI сайт. Однонитевая ДНК M13mp18-PR1013EcoΔPstΔXho показана сплошной линией. Последовательность TCATGG превращается в CCATGG в результате сайт-специфического мутагенеза. K=KpnI, X=XhoI, B=BstEII, P=PstI.
Фиг.10. Показана конструкция pCIB268. Фрагмент BstEII-PstI является производным репликативной формы M13mp18-PR1013EcoΔPstΔXho.Nco субклонировали в BstEII-PstI расщепленную, pBS-PR1013EcoΔPstΔXho c образованием pCIB268. X= XhoI, B=BstEII, N=NcoI, P=PstI.
Фиг.11. Показана конструкция pCIB269 из pBS-GUS1.2 и pCIB268. X=XhoI, N= NcoI, P=PstI. Заштрихованный блок pCIB269 обозначает последовательности GUS гена, а затемненный блок обозначает последовательности, являющиеся производными PR-1a гена.
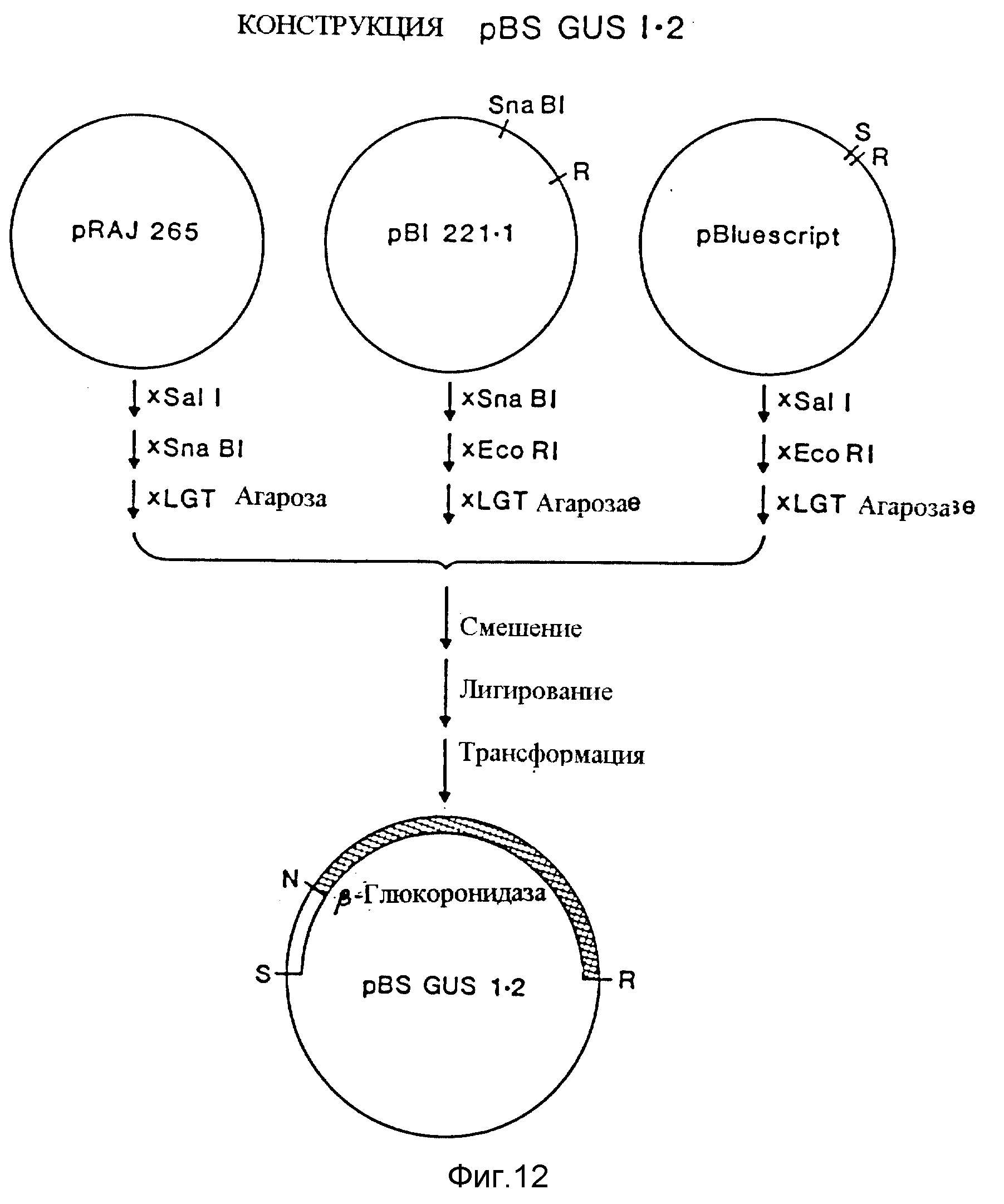
Фиг. 12. Показана конструкция pBS-GUS1.2, полученная путем лигирования трех фрагментов, являющихся производными pRAJ265, pBI1221.1 и pBluescript. S=SalI, R=EcoRI, N=NcoI.
Фиг. 13. Показана конструкция pCIB271 из pCIB2269 и pCIB200. X=XhoI, N= NcoI, R= EcoRI, S=SalI, (S/X) = слияние сайтов SalI и XhoI, LGT = агароза с низкой температурой желатинирования.
Фиг. 14. Рестриктная карта pCIB219. Эту плазмиду конструировали путем добавления EcoRI/XhoI адаптера к pCIB269 XhoI/EcoRI фрагменту, содержащему PR-1 и GUS ген и лигирования их с SalI, расщепленной pCIB712.
Фиг. 15. Рестриктная карта pCIB272. Эту плазмиду конструировали лигированием Asp718I/BamHI фрагмента из pCIB272, содержащей PR-1/GUS ген (от -833 до +1 PR-1a) с фрагментом Asp718I/BamHI плазмиды pCIB200.
Фиг. 16. Рестриктная карта pCIB273. Эту плазмиду конструировали лигированием Asp718I/BamHI фрагмента из pCIB283, содержащей PR-1/GUS ген (от -603 до +1 PR-1a) с Asp718I/BamHI фрагментом плазмиды pCIB200.
Фиг. 17. Рестриктная карта pCIB1004. Эту плазмиду конструировали лигированием XhoI/NcoI фрагмента из pCIB269 (содержащего PR-1a промотор) с BT геном, полученным из pCIB10/35Bt (607) как NcoI/BamHI фрагмент и SalI/BamHI фрагмент плазмиды pCIB710.
Фиг.18. Рестриктная карта pCIB200/PR1-BT. Эту плазмиду конструировали из pCIB1004 и pCIB200.
Фиг.19. Рестриктная карта pCIB1207. Фрагмент XbaI размером 5,8 kb из геномного клона фага λ, содержащего Arabidopsis AHAS ген, клонировали в XbaI расщепленную bluescript.
Фиг. 20. Рестриктная карта pCIB1216. Фрагмент NcoI/XbaI размером 3,3 kb из pCIB1207 клонировали в pCIB269, которую расщепляли с помощью NcoI и XbaI с целью удаления GUS гена.
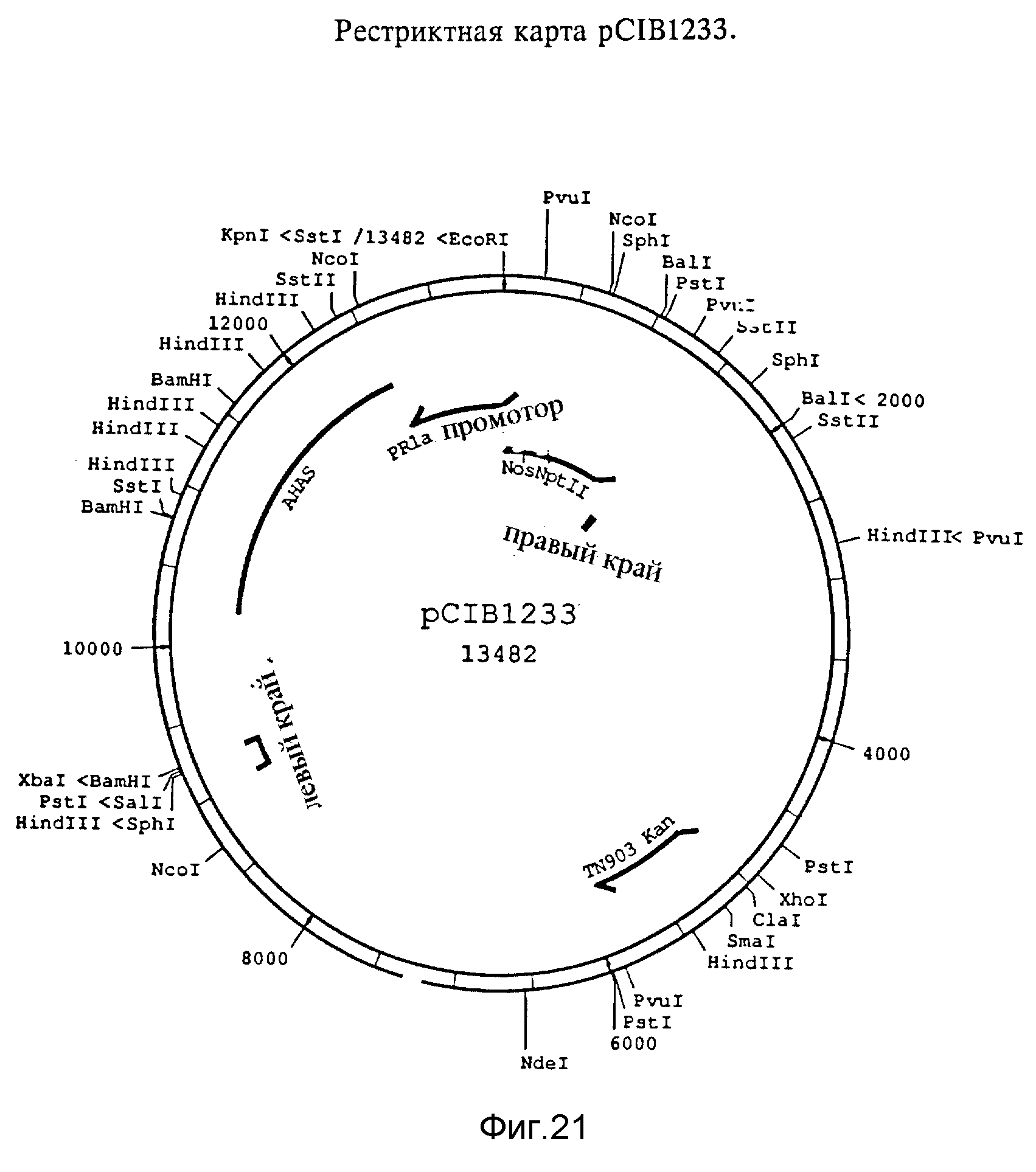
Фиг. 21. Рестриктная карта pCIB1233. Фрагмент KpnI/XbaI размером 4,2 kb выделяли из pCIB216 и лигировали с pCIB200, которую расщепляли с помощью KpnI и XbaI.
Фиг.22. Рестриктная карта pBSGluc39.1/GUS. Фрагмент pBSGluc39.1 размером 1462 bp клонировали в pBS-GUS1.2, которую расщепляли с помощью NcoI и KpnI.
Фиг. 23. Рестриктная карта pCIB200/Gluc39.1-GUS. Фрагмент KpnI/XbaI, содержащий β - глюканазный промотор и GUS ген, выделяли из pBSGluc39.1/GUS и лигировали с pCIB200, обработанной KpnI и XbaI.
Фиг. 24. Рестриктная карта pCIB200/Gluc39.1-BT. KpnI/NcoI фрагмент из pCIB1004, содержащей BT ген, KpnI/NcoI фрагмент из pBSGluc39.1/GUS и pCIB200 обработанную KpnI, обрабатывали щелочной фосфатазой телячьего тимуса и лигировали.
Фиг. 25. Рестриктная карта pBSGluc39.1/AHAS, которая сконструирована из NcoI/XbaI фрагмента pBSGluc39.1/GUS и фрагмента NcoI/XbaI размером 3,3 kb из pCIB1207, содержащего AHAS ген.
Фиг.26. Рестриктная карта pCIB200/Gluc39.1-AHAS. KpnI/XbaI фрагмент, содержащий β- глюканазный промотор и AHAS ген, выделяли из pBSGluc39.1/AHAS и лигировали с pCIB200, расщепленной KpnI и XbaI.
Фиг.27. Рестриктная карта pBSGluc39.3/GUS. Фрагмент pBSGluc39.3 размером 1677 bp клонировали в pBS-GUS1.2, которая была расщеплена NcoI и KpnI.
Фиг. 28. Рестриктная карта pCIB200/Gluc39.3-GUS. KpnI/XbaI фрагмент, содержащий β- глюканазный промотор и GUS ген, выделяли из pBSGluc39.3/GUS и лигировали с pCIB200, расщепленной KpnI и XbaI.
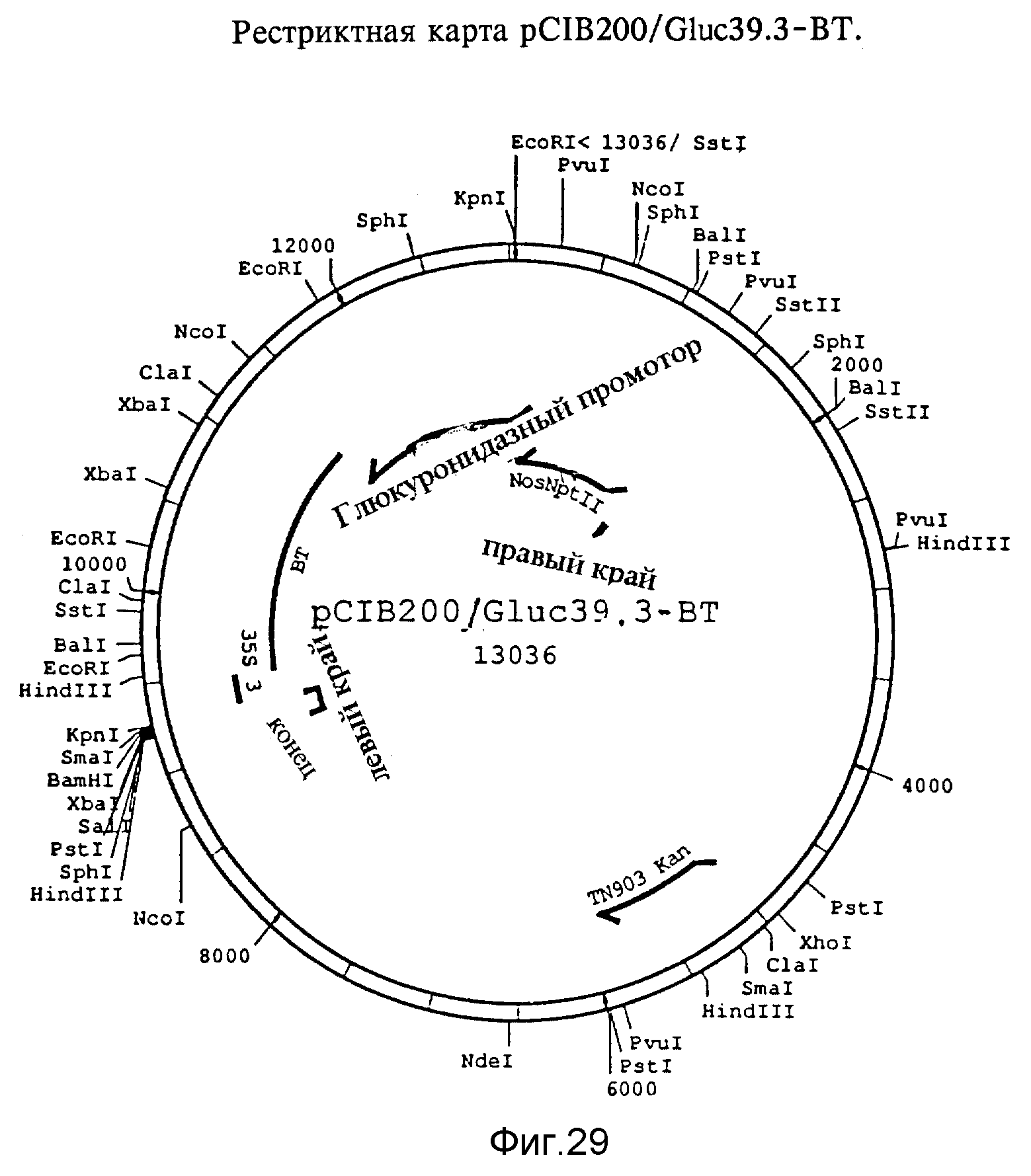
Фиг. 29. Рестриктная карта pCIB200/Gluc39.3-BT. KpnI/NcoI фрагмент pCIB1004, содержащий BT ген, KpnI/NcoI фрагмент pBSGluc39.3/GUS и pCIB200, расщепленную с помощью KpnI обрабатывали щелочной фосфатазой телячьего тимуса и лигировали.
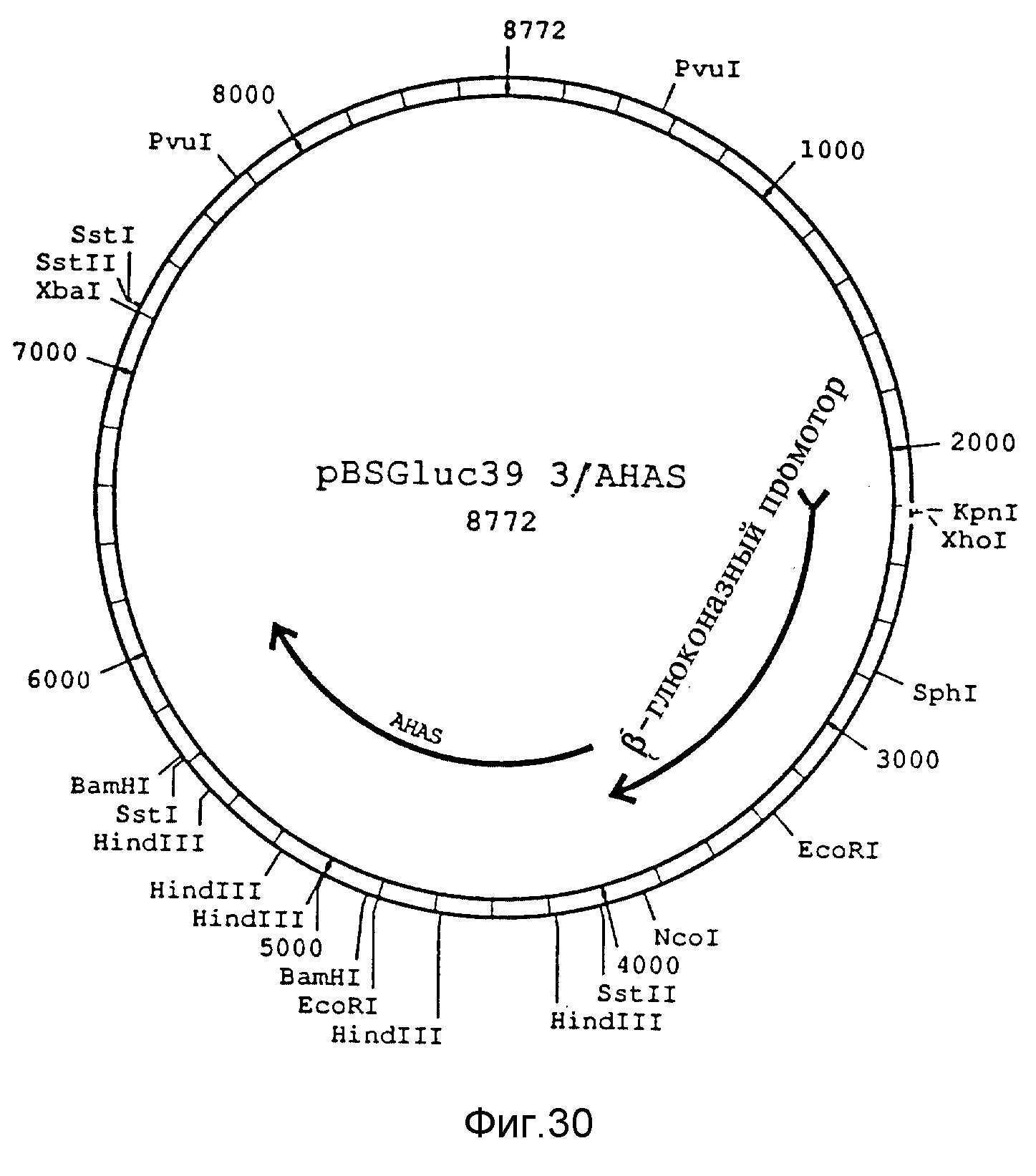
Фиг. 30. Рестриктная карта pBSGluc39.3/AHAS, сконструированная из NcoI/XbaI фрагмента pBSGluc39.3/GUS и фрагмента NcoI/XbaI размером 3,3 kb из pCIB1207, содержащей AHAS ген.
Фиг. 31. Рестриктная карта pCIB200/Gluc39.3-AHAS. KpnI/XbaI фрагмент, содержащий β- глюканазный промотор и AHAS ген, выделяли из pBSGluc39.3/AHAS и лигировали с pCIB200, расщепленной с помощью KpnI и XbaI.
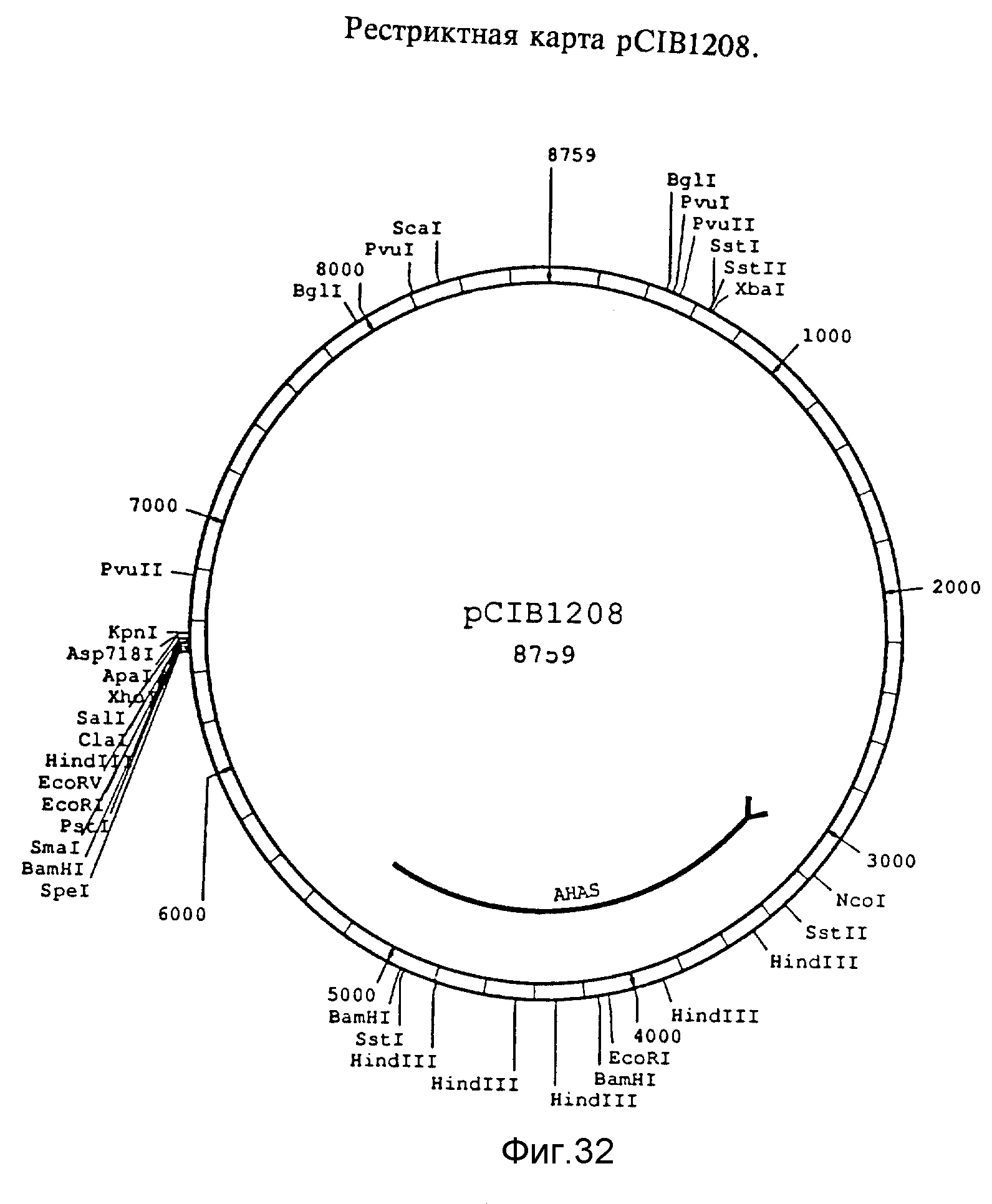
Фиг. 32. Рестриктная карта pCIB1208. Фрагмент XbaI размером 5,8 kb геномного клона фага λ, содержащий мутированный Arabidopsis AHAS ген, клонировали в обработанную XbaI Bluescript.
Фиг. 33. Рестриктная карта pCIB1230. Фрагмент NcoI/XbaI размером 3,3 kb из pCIB1208 клонировали в pCIB269, которую расщепляли с помощью NcoI и XbaI с целью удаления GUS гена.
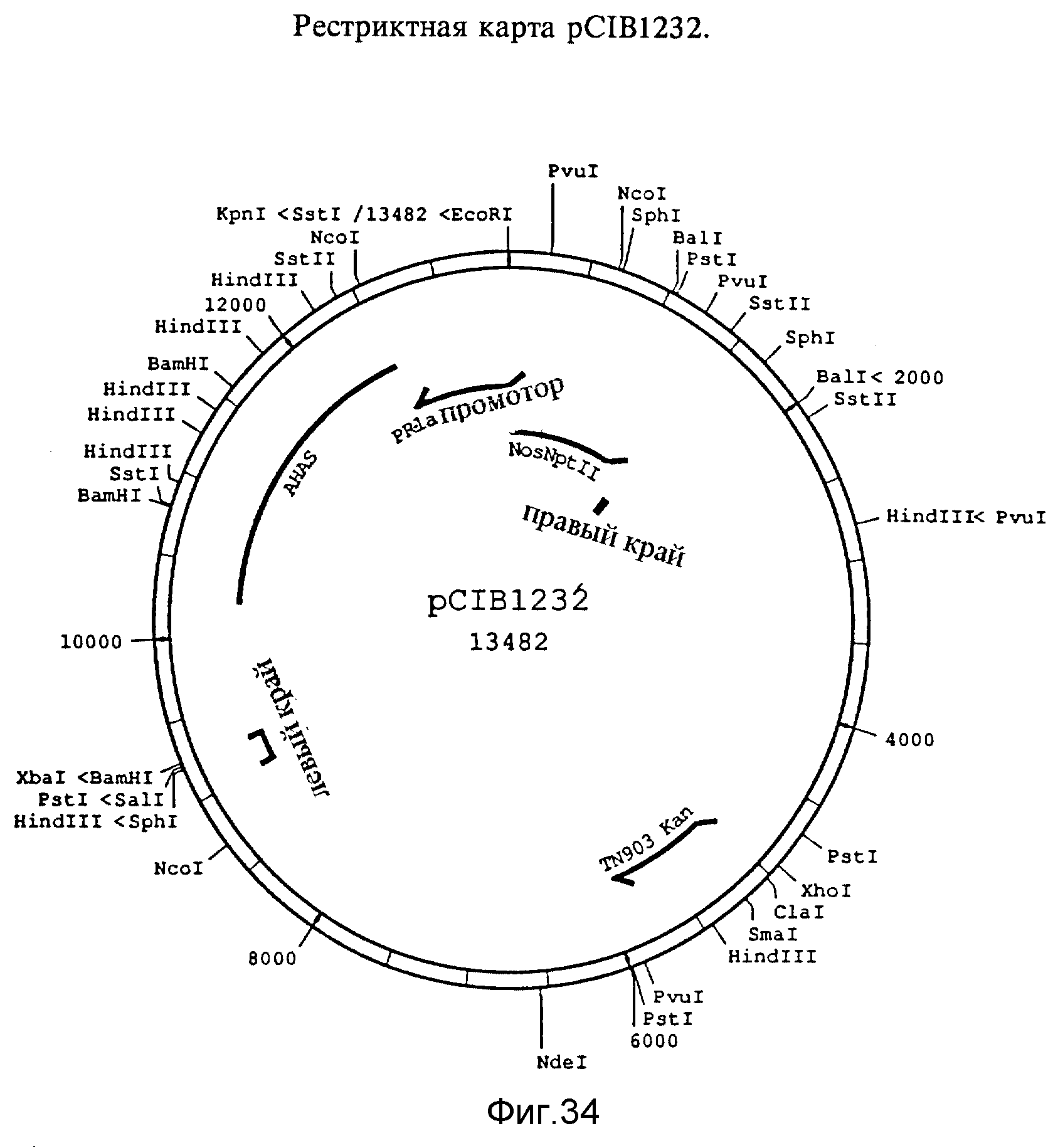
Фиг. 34. Рестриктная карта pCIB1232. Фрагмент KpnI/XbaI размером 4,2 kb выделяли из pCIB1230 и лигировали с pCIB200, которую расщепляли с помощью KpnI и XbaI.
Фиг. 35. Рестриктная карта pBSGluc39.1/AHAS-SuR, сконструированная из NcoI/XbaI фрагмента pBSGluc39.1/GUS и NcoI/XbaI фрагмента размером 3,3 kb, pCIB1208, содержащего AHAS ген.
Фиг.36. Рестриктная карта pCIB200/Gluc39.1-AHAS-SuR. KpnI/XbaI фрагмент, содержащий β- глюканазный промотор и AHAS ген, выделяли из pBSGluc39.1/AHAS-SuR и лигировали с pCIB200, расщепленной с помощью KpnI и XbaI.
Фиг. 37. Рестриктная карта pBSGluc39.3/AHAS-SuR, сконструированная из фрагмента NcoI/XbaI pBSGluc39.3/GUS и NcoI/XbaI фрагмента из pCIB1208, размером 3,3 kb, содержащего AHAS ген.
Фиг.38. Рестриктная карта pCIB200/Gluc39.3-AHAS-SuR. KpnI/XbaI фрагмент, содержащий β - глюканазный промотор и AHAS ген, выделяли из pBSGluc39.3/AHAS-SuR и лигировали с pCIB200, расщепленной с помощью KpnI и XbaI.
Краткое описание последовательностей.
Последовательность 1 показывает последовательность геномной ДНК фрагмента размером 2 kb, расположенного между XhoI и BglII сайтами табачного PR-1a гена. Стрелка на нуклеотиде 903 показывает сайт начала транскрипции, а вертикальные стрелки, указывающие на 207 и 313, идентифицируют окончания двух независимых кДНК клонов. Приведена также полипептидная последовательность, закодированная кодирующим участком гена.
Последовательность 2 показывает последовательность геномной ДНК табачного PR-1' гена и аминокислотную последовательность полипептида, которая закодирована кодирующим участком гена.
Последовательность 3 показывает кДНК последовательность RP хитиназы огурцов и аминокислотную последовательность полипептида, которая закодирована кодирующим участком гена.
Последовательность 4 показывает кДНК последовательность основной формы табачного PR-R гена и (4a) раскрывает как последовательность (4), так и аминокислотную последовательность полипептида, который закодирован кодирующим участком гена.
Последовательность 5 раскрывает последовательность геномной ДНК табачного основного β-1, 3- глюканазного гена, содержащегося в клоне pBSGluc39.1.
Последовательность 6 раскрывает последовательность геномной ДНК табачного основного β-1,3- глюканазного гена, содержащегося в клоне pBSHluc39.3.
Последовательность 7 раскрывает кДНК последовательность табачного PR-Q, содержащегося в плазмидной pBScht15.
Последовательность 8 раскрывает ДНК последовательность выделенной кДНК, содержащейся в плазмидной pBSGL6e. Такая кДНК кодирует кислотную форму β-1,3- глюканазы.
Подробное описание изобретения.
В настоящем изобретении описывается выделение, клонирование и идентификация ДНК-последовательностей, которые способны к регуляции транскрипции в растительной ткани, ассоциированной с ними ДНК-последовательности, когда регуляция зависит от химического регулятора. Такие ДНК-последовательности могут использоваться для конструирования химерных генов, в которых экспрессия генов может регулироваться такими регуляторами. Способность к регуляции экспрессии химерного гена в трансгенном растении химическим методом полезна для получения надлежащей экспрессии фенотипического признака при минимальном вредном влиянии на рост и развитие растения. Такая регуляция важна для продуцирования вторичных продуктов или других клонированных продуктов в растительных тканях, в культуре или в биореакторах. Регулирование клонированной последовательности также важно для регуляции других генных продуктов по антисмысловому механизму.
Экспрессия данной кодирующей последовательности в любое конкретное время может регулироваться путем использования химического регулятора применяемого обычно в растительной ткани. Гены, ответственные за контроль действительных переходных стадий развития, могут также регулироваться путем ассоциации химически регулируемой ДНК-последовательности с соответствующей кодирующей ДНК-последовательностью. Таким методом развитие растения может останавливаться на конкретной стадии или ускоряться с конкретной скоростью в результате увеличения или уменьшения уровня содержания химического регулятора.
Химически регулируемые ДНК-последовательности могут использоваться для реализации экспрессии посторонних генов, которые, например, придают гербицидную устойчивость или толерантность (например, толерантность сои к действию атразина), придают устойчивость к действию насекомых (например, кристаллический протеин хлопка Bacillus thuringiensis) или в том случае, когда требуется селективная экспрессия (как, например, в случае стерильности мужских и женских особей). Химически регулируемые ДНК-последовательности могут также использоваться для реализации транскрипции ДНК-последовательности, которая будет контролировать экспрессию вторичной кодирующей последовательности по антисмысловому механизму.
Таким образом, настоящее изобретение имеет ряд целей:
a. Основной целью
изобретения является химерный ген, экспрессия которого в растительной ткани регулируется химическим регулятором.
b. Практически чистые химически регулируемые ДНК-последовательности, способные контролировать генетическую активность в растительных тканях других ДНК-последовательностей в ответ на действие химического регулятора.
c. Химически регулируемые ДНК-последовательности в комбинации с частью, но не со всей кодирующей ДНК-последовательностью, с которой они ассоциированы во встречающихся в природе генах.
d. Векторы, содержащие химически регулируемые ДНК-последовательности в присутствии или отсутствии других частей, встречающихся в природе генов, в которых они могут существовать.
e. Векторы, содержащие химерные гены, являющиеся принципиальной целью изобретения.
f. Растительная ткань, растения и семена, являющиеся производными клеток, трансформированных такими векторами.
g. Способ химического регулирования экспрессии ДНК-кодирующих последовательностей, связанных с химически регулируемыми ДНК-последовательностями, например, для регуляции фенотипического признака.
h. Способ идентификации новых химических регуляторов с использованием химерных генов настоящего изобретения и растительных тканей, содержащих их.
i. Последовательности сигнальных пептидов в протеинах, закодированных химически регулируемыми генами.
j. Практически чистые PR-гены.
Другие цели настоящего изобретения станут ясными из последующего описания.
Обозначения.
Для ясного и последовательного понимания описания и формулы изобретения, включая используемые термины,
использованы следующие обозначения:
Антисмысловой механизм: Механизм генной регуляции, основанный на контроле скорости трансляции иРНК в протеине за счет присутствия в клетке комплементарной
молекулы РНК по крайней мере к части иРНК, подвергаемой трансляции.
Ассоциированная ДНК-последовательность: ДНК-последовательность, клеточная активность которой (1) регулирует активность другой ДНК-последовательности или (2) регулируется другой ДНК-последовательностью. Такое определение конкретно охватывает, но не ограничивается последовательностями, которые физически соседствуют в сплошной ДНК-нити или которые физически разделены. Физическая сепарация включает, например, разделение в пределах одной нити ДНК, расположение в разных нитях ДНК или относится к перемежающимся интерспергированным последовательностям (например, чередующиеся регулируемые и кодирующие последовательности) в пределах одной нити.
Химически регулируемые ДНК-последовательности: ДНК последовательность, способная к регуляции транскрипции ассоциированной ДНК-последовательности в том случае, когда такая регуляция зависит от химического регулятора. Такие последовательности могут быть как природного, так и синтетического происхождения.
Химически регулируемый ген: Ген, содержащий по крайней мере одну некодирующую химически регулируемую ДНК-последовательность, и по крайней мере одну связанную кодирующую ДНК-последовательность. Такие гены могут быть природного, синтетического или частично природно-синтетического происхождения.
Химический регулятор (для химически регулируемой ДНК-последовательности): Элементарные или молекулярные разновидности, которые контролируют (например, инициируют, обрывают, повышают или понижают), в результате прямого или косвенного действия, активность химически регулируемой ДНК-последовательности в системе, в которой химический регулятор обычно не присутствует в активной форме в количестве, достаточном для осуществления регуляции транскрипции, в желательной степени и в желательное время, способной к транскрипции ДНК-последовательности, связанной с химически регулируемой ДНК-последовательностью. Такая терминология охватывает случаи, когда желательно, чтобы во время транскрипции регулятор отсутствовал или присутствовал в незначительной степени, или когда присутствует некоторое количество регулятора, но требуется усиленная или пониженная регуляция для осуществления транскрипции в меньшей или большей степени.
Так, например, если система, содержащая химически регулируемую ДНК-последовательность, представляет собой растение, например, трансгенное растение, химический регулятор представляет собой вещества, отсутствующие в растении в естественном состоянии в количестве, достаточном для осуществления химической регуляции и, следовательно, транскрипции связанного гена, в желательное время и в желательной степени.
Под термином "прямое воздействие" подразумевается, что действие химического регулятора происходит в результате прямого взаимодействия между химическим регулятором и ДНК-последовательностью. Под термином "косвенное воздействие" подразумевается, что действие регулятора происходит при прямом взаимодействии между химическим регулятором и некоторым другим эндогенным или экзогенным компонентом системы, причем конкретным результатом такого прямого взаимодействия является активация или подавление активности ДНК-последовательности. Термин "активная форма" подразумевает тот случай, когда химический регулятор находится в форме, требуемой для эффективного контроля.
Химерная последовательность или ген: ДНК-последовательность, содержащая по крайней мере две гетерологических части, например, части, являющиеся производными встречающихся в природе ДНК-последовательностей, не связанных между собой в естественном состоянии, или содержащая по крайней мере одну часть синтетического происхождения, не встречающуюся в природе.
Кодирующая ДНК-последовательность: ДНК-последовательность, транскрипция и трансляция которой приводят в результате к получению клеточного полипептида.
Ген: Дискретная область хромосомы, ответственная за дискретный клеточный продукт.
Некодирующая ДНК-последовательность: ДНК-последовательность, не подвергающаяся транскрипции и трансляции, приводящей к образованию клеточного полипептида при ассоциации с конкретной кодирующей ДНК- последовательностью. Так, например, последовательность, не являющаяся кодирующей при ассоциации с одной кодирующей последовательностью, может в действительности быть кодирующей при ассоциации с другой кодирующей или некодирующей последовательностью.
Фенотипический признак: Наблюдаемое свойство, возникающее в результате экспрессии гена.
Растительная ткань: Любая ткань растения в растении или в культуре. Этот термин включает, но не ограничивается ими, сами растения, растительные клетки, органы растений, семена растений, протопласты, каллюс, клеточные культуры и любые группы растительных клеток, организованных в структурные и/или функциональные единицы. Использование такого термина совместно или в отсутствии любого конкретного типа растительной ткани из перечисленных выше, или как-либо иначе, охватываемым таким определением, не исключает любой другой тип растительной ткани.
PR, или патогенез-родственные протеины: Протеины, экспрессированные в растениях, обладающих гиперчувствительной реакцией на патогены. Такой термин может охватывать кислотные и основные формы табачных протеинов PR-1a, PR-1b, PR-1c, PR-1', PR-2, PR-N, PR-O, PR-R, PR-Q, PR-S, PR-P, хитиназу, являющуюся основной копией PR-R или PR-O, а также бета-1,3-глюканазу (глюкан эндо -1,3-β- глюкозидаза, EC 3.2.1.39), являющуюся основной копией PR-2, PR-N или PR-O, а также патоген-индуцируемую хитиназу из огурцов.
Гиперчувствительная реакция характеризуется местным некрозом тканей немедленно окружающим инфицированный участок патогена с последующей локализацией патогена, и отличается от чувствительной реакции, в которой патоген распределяется в растении. Патогенами являются, например, вирусы или вироиды, например, мозаичный вирус табака или огурцов, вирус кольцевой пятнистости или вирус некроза, вирус завитка листвы пеларгонии, вирус мозаичной болезни красного клевера, вирус кустистой карликовости помидор, и аналогичные вирусы, грибки, например, Phytophthora parasitica или Peronospora tabacina, бактерии, например, Pseudomonas syringae или Pseudomonas tabaci, или тля, например, Myzus persicae. Приведенный перечень не имеет ограничительного характера.
Регуляция: Увеличение (индуцирование) или понижение (подавление) уровня экспрессии гена или уровня транскрипции ДНК-последовательности. Такое определение не относится к конкретному механизму действия.
Практически чистая ДНК-последовательность: ДНК-последовательность, выделенная в практически чистой форме из природного или неприродного источника. Такая последовательность может встречаться в природной системе, например, в бактериях, вирусах или растительных либо животных клетках, или может быть получена, например, синтетическими средствами или в виде кДНК-последовательности. Практически чистые ДНК-последовательности обычно выделяют в виде вектора, включающего требуемую ДНК. Термин "практически чистая" означает, что другие ДНК-последовательности, помимо целевой, присутствуют лишь в незначительных количествах, например, менее 5%, менее 1%, или предпочтительно менее 0,1%. Практически чистые ДНК-последовательности и содержащие их векторы могут находиться и обычно находятся в растворе, например, в водном растворе, содержащем буфер или в обычной культурной среде.
Существенная гомология последовательности: Существенная гомология последовательности означает близкую структурную взаимосвязь между последовательностями нуклеотидов или аминокислот. Так, например, практически гомологичные ДНК-последовательности могут быть гомологичны на 80%, предпочтительно на 90% или 95%, а практически гомологичные аминокислотные последовательности обычно могут быть гомологичными на 50% или более. Гомология включает также такую взаимосвязь, когда одна или несколько последовательностей нуклеотидов или аминокислот пропущены или дополнены дополнительными нуклеотидами. или аминокислоты интердиспергированы.
A. Химически регулируемые ДНК-последовательности.
Настоящее изобретение относится к некодирующим ДНК-последовательностям, которые способны к регуляции под влиянием химического регулятора, транскрипции ассоциированной ДНК-последовательности в растении или растительной ткани. Если говорить более конкретно, то настоящее изобретение охватывает некодирующую ДНК-последовательность, способную регулировать транскрипцию ассоциированной ДНК-последовательности в растении или растительной ткани, когда такая регуляция зависит от химического регулятора. Предпочтительно, чтобы ДНК-последовательности находились в практически чистой форме относительно гена и генома, в котором они находятся, если их используют из природного источника, или относительно ДНК-смеси, если они находятся в синтетической смеси.
Предпочтительно, некодирующие химически регулируемые ДНК-последовательности настоящего изобретения представляют собой также последовательности, которые при ассоциации с кодирующей ДНК-последовательностью, регулируют экспрессию кодирующей последовательности в растительной ткани, причем степень регуляции зависит от химического регулятора. Такие последовательности могут быть синтезированы de novo или могут являться производными (например, быть выделенными или клонированными) из химически регулируемого гена естественного происхождения. Распространение химически регулируемых ДНК-последовательностей настоящего изобретения не ограничивается растительной тканью; то есть химически регулируемые ДНК-последовательности могут быть получены из большого числа природных источников, например, из бактериального, вирусного или животного источников. Они могут быть выделены, например, из 5'- участка или из 3'- участка последовательности химически регулируемого гена естественного происхождения. С другой стороны, некодирующая ДНК- последовательность может быть химически синтезирована или энзиматически синтезирована в виде кДНК, идентичной или обладающей существенной гомологией к последовательности, из которой она получена. Путем клонирования химически регулируемой, некодирующей ДНК-последовательности, такая последовательность может быть отделена от других последовательностей, соседствующих с ней в гене естественного происхождения. Таким образом могут быть получены практически чистые ДНК-последовательности.
В контексте настоящего изобретения термин регуляции относится к химическим регуляторам, являющимся либо индуцирующими, либо подавляющими регуляторами. Примерами химически подавляемых генов, то есть генов, которые подавляются химическими агентами, могут служить, например, такие гены, как TrpR или AroH, в том случае, когда добавление триптофанового репрессора или самого триптофана подавляет экспрессию таких генов. Существует большое число других генов, которые регулируются по такому типу репрессии конечным продуктом и в каждом таком случае конечный продукт действует, как химический регулятор, который может использоваться для подавления экспрессии гена. Настоящее изобретение охватывает регулируемые участки таких генов, как таковых или как часть химерных конструкций, которые могут химически регулироваться в отношении транскрипции ассоциированной ДНК-последовательности в растении или в растительной ткани.
Примерами химически индуцируемых генов, то есть генов, которые индуцируются под действием индуцирующего химического регулятора могут служить PR-протеиновые гены, особенно табачные PR-протеиновые гены, например, PR-1a, PR-1b, PR-1c, PR-1', PR-Q, PR-P и PR-S гены, хитиназный ген огурцов, а также основные и кислотные табачные β-1,3- глюканазные гены. Конкретный аспект настоящего изобретения охватывает практически чистую ДНК-последовательность, которая представляет собой некодирующую химически регулируемую ДНК-последовательность, которая является частью химически регулируемого гена естественного происхождения, например, встречающегося в природе химически регулируемого гена в растениях или растительных тканях однодольных, двудольных или голосеменных, или обладает существенной гомологией последовательности к ней. Предпочтительно, чтобы такая ДНК-последовательность обладала способностью регулировать транскрипцию ассоциированной ДНК-последовательности в растении или растительной ткани, в которых указанная ассоциированная ДНК-последовательность является кодирующей последовательностью. Транскрипция указанной ДНК-последовательности может регулироваться путем подавления химическим регулятором или индукции химическим регулятором. ДНК-последовательности, представляющие особой интерес, это последовательности, в которых химически регулируемый ген представляет собой PR-протеиновый ген, например, двудольного растения, например, табака или огурцов. Наиболее предпочтительными являются ДНК-последовательности, в которых химически регулируемый ген представляет собой табачный PR-1a, PR-1b, PR-1c, PR-1', PR-Q или PR-R ген, хитиназный ген огурцов, или основной или кислотный β-1,3- глюканазный ген, особенно табачный PR-1a и PR-1' ген, но также и хитиназный ген огурцов и основной и кислотный табачный β-1,3- глюканазные гены. Особенно важными являются ДНК-последовательности, в которых химически регулируемый ген представляет собой табачный PR-1a или основной β-1,3- глюканазный ген.
Химически индуцируемые ДНК-последовательности предпочтительного PR и родственных генов настоящего изобретения встречаются в 5'-некодирующих последовательностях соседнего участка, находящегося сбоку от кодирующих последовательностей. В качестве примера можно указать, что в последовательности, выделенной из фрагмента, размером примерно в 6500 пар оснований табачного PR-1a гена, содержащего часть кодирующего участка, участок размером от 900 пар оснований до 1200 пар оснований, в естественном состоянии соседствующий с сайтом начала транскрипции, как было установлено, является химически индуцируемым. Индуцируемость сохраняется в его фрагменте, содержащем от 500 до 700 пар оснований, который в естественном состоянии соседствует с сайтом начала транскрипции. Поэтому наиболее предпочтительными являются ДНК-последовательности, которые находятся в 5'-фланкирующем участке последовательности указанного PR и родственных генов, например, на участке размером в 1200 пар оснований, соседствующим с сайтом начала транскрипции.
Способ получения некодирующей последовательности, способной к регуляции транскрипции ассоциированной ДНК-последовательности в растении и растительных тканях, в которых такая регуляция зависит от химического регулятора и ДНК-последовательностей, обладающих существенной гомологией к указанным некодирующим последовательностям, заключается в том, что ДНК выделяют из встречающегося в естественном состоянии гена в практически чистой форме либо синтезируют химическими или энзимными методами.
В основном способ получения практически чистой химически регулируемой ДНК-последовательности из химически регулируемого гена во встречающейся в естественном состоянии
системе, содержащей такой ген, включает стадии:
(a) активацию экспрессии в указанной системе РНК из химически регулируемого гена;
(b) выделение указанной РНК;
(c)
дифференцированный скрининг геномной библиотеки на РНК генерированной из РНК, выделенной из указанной активированной системы, а также
РНК генерированную из РНК выделенной из контрольной
системы, не подвергнутой активации;
(d) выделение геномного клона;
(e) субклонирование химически регулируемого гена из указанного геномного клона; и
(f) выделение желаемой
химически регулируемой ДНК-последовательности.
Способ, в котором указанная система представляет собой растение, включает стадии:
(a) активацию экспрессии в указанном растении
полиA + РНК из химически регулируемого гена;
(b) выделение указанной полиA + РНК;
(c) конструирование кДНК-банка из указанной полиA + РНК;
(d) дифференцированный скрининг
указанного кДНК-банка с кДНК полученной из РНК в контрольном растении, не подвергнутом активации;
(e) выделение кДНК клонов, которые могут быть химически регулируемыми;
(f) выделение
геномного клона из геномной библиотеки указанного растения с использованием в качестве зонда кДНК клона со стадии (e);
(g) субклонирование химически регулируемого гена из указанного геномного
клона; и
(h) выделение желаемой химически регулируемой ДНК-последовательности.
Предпочтительным является такой способ, в котором указанный химически регулируемый ген представляет собой химически индуцируемый ген, например, PR-протеиновый ген, такой как табачный PR-1a, PR-1b, PR-1c, PR-1', PR-Q или PR-R ген, хитиназный ген огурцов, или табачный основной или кислотный β-1,3- глюканазный ген. Также предпочтительным является способ, в котором указанный PR-протеиновый ген активируется на стадии (a) химическим индуктором или патогеном.
Настоящее изобретение охватывает также практически чистую ДНК, полученную указанными выше способами.
B. Химически регулируемые ДНК-последовательности с участками кодирующих последовательностей естественного происхождения.
Помимо полностью некодирующих химически регулируемых ДНК-последовательностей, описанных выше в части A, настоящее изобретение относится также к некодирующей ДНК-последовательности, встречающейся в природе химически регулируемой ДНК-последовательности в комбинации с частью, но не всей, кодирующей последовательностью, с которой регулируемая последовательность ассоциирована в гене естественного происхождения. Если говорить более конкретно, то настоящее изобретение охватывает предпочтительно в практически чистой форме ДНК-последовательность, которая включает в качестве первого компонента ДНК-последовательность, являющуюся или обладающую значительной гомологией к некодирующей химически регулируемой ДНК-последовательности встречающегося в природе химически регулируемого гена, причем такая первая последовательность способна регулировать транскрипцию > io ассоциированной ДНК-последовательности в растении или растительной ткани, в которых такая регуляция зависит от химического регулятора, а в качестве второго компонента ДНК-последовательность, которая является или обладает существенной гомологией последовательности к ней частью, но не всей способной к транскрипции ДНК-последовательности, в которой первый компонент ассоциирован в химически регулируемом гене естественного происхождения. Встречающийся в природе химически регулируемый ген может быть растительного происхождения, например, обнаруживаться в однодольном или двудольном растении, и он может регулироваться путем подавления или индукции под действием химического регулятора. Такая вторая ДНК-последовательность обычно является кодирующей последовательностью. Предпочтительно второй ДНК-последовательностью настоящего изобретения является последовательность, кодирующая сигнальный пептид любого протеина, экспрессированного химически регулируемым геном естественного происхождения.
Главным образом, настоящее изобретение охватывает такую ДНК-последовательность, включающую первую некодирующую химически регулируемую ДНК-последовательность и вторую кодирующую ДНК-последовательность PR-протеинового гена, например, PR-протеинового гена двудольного растения, предпочтительно табака или огурцов, такого как PR-1a, PR-1b, PR-1c, PR-1', PR-Q или PR-R гена, хитиназный ген, либо основной или кислотный β-1,3- глюканазный ген. Предпочтительной является ДНК-последовательность PR протеинового гена, в котором транскрипция регулируется индуцирующим химическим регулятором. Главным образом, настоящее изобретение охватывает ДНК-последовательность, в которой первая некодирующая ДНК-последовательность находится в 5'-фланкирующей области последовательности одного из упомянутых PR-протеиновых генов, например, находится в пределах 2000 пар оснований по соседству с сайтом начала транскрипции указанного PR протеинового гена. Наиболее предпочтительной является ДНК-последовательность, включающая предпочтительную-первую некодирующую последовательность упомянутую выше, и вторую ДНК-последовательность кодирующую сигнальный пептид, в соответствии с упомянутым выше.
Наиболее предпочтительными являются практически чистые ДНК-последовательности, обозначенные как "Последовательность 1", "Последовательность 2", "Последовательность 5" и "Последовательность 6", а также практически чистые ДНК-последовательности, обладающие значительной гомологией последовательности к таким "Последовательностям" 1, 2, 5 и 6. Такие "Последовательности" служат примерами химически регулируемых ДНК-последовательностей, включающих первую некодирующую и вторую кодирующую ДНК-последовательность и они являются производными PR протеиновых генов табака PR-1a, PR-1' и двух форм основной табачной β-1,3- глюканазы, соответственно. "Последовательность 1" демонстрирует последовательность PR-1a гена табака. Нуклеотиды 1-1150 являются некодирующей 5'-боковой химически индуцируемой ДНК-последовательности и частью PR-1a кодирующей последовательности, которые встречаются в естественном состоянии в табачном растении. В этом случае химически индуцируемая последовательность находится по соседству с кодирующей последовательностью. Те нуклеотиды, которые кодируют первые тридцать аминокислот, составляют кодирующую последовательность сигнального пептида PR-1a протеина. Кодирующая последовательность может удаляться из некодирующей последовательности для генерации некодирующей химически индуцируемой ДНК-последовательности, свободной от кодирующей последовательности, описанной выше в части A. Такое удаление может осуществляться традиционными методами, например, с использованием рестриктазы.
Способ получения ДНК-последовательности, которая включает в качестве первого компонента ДНК-последовательность, представляющую или обладающую существенной гомологией с ней, некодирующую химически регулируемую ДНК-последовательность химически регулируемого гена естественного происхождения, причем такая первая последовательность способна к регуляции транскрипции ассоциированной ДНК- последовательности в растении или растительной ткани, в которых такая регуляция зависит от химического регулятора, а в качестве второго компонента ДНК-последовательность, являющуюся или обладающую существенной гомологией с ней частью, но не всей, способной к транскрипции ДНК-последовательности, с которой первый компонент связан в химически регулируемом гене естественного происхождения, характеризуется тем, что ДНК выделяют из встречающегося в природе гена в достаточно чистой форме либо синтезируют химическим или ферментативным методами. Предпочтительным является способ, указанный в части A, и получаемые в результате практически чистые ДНК- последовательности.
C. Химерные гены, содержащие химически регулируемые ДНК-последовательности
Химерная ДНК-последовательность (химерный ген), содержащая по крайней мере одну химически регулируемую ДНК-последовательность. В качестве примера получены два типа таких химерных последовательностей.
Более простой или состоящий из 2 частей тип химерной ДНК-последовательности включает химически регулируемую ДНК-последовательность и способную к транскрипции ДНК-последовательность так, что химерный
ген способен к экспрессии в растительной ткани в соответствующих условиях
химической регуляции. Более конкретно, настоящее изобретение охватывает химически регулируемую химерную
ДНК-последовательность, включающую в качестве первого компонента некодирующую химически регулируемую ДНК-последовательность, которая способна регулировать транскрипцию ассоциированной
ДНК-последовательности в растении или растительной ткани, в которой такая регуляция зависит от химического регулятора, а в качестве второго компонента - ДНК-последовательность, способную к
транскрипции в растении или растительной ткани. Такие ДНК-последовательности могут быть получены из естественных источников или могут быть синтезированы.
Вторая ДНК-последовательность может транскрибироваться как РНК, которая способна регулировать экспрессию фенотипического признака по антисмысловому механизму. С другой стороны, вторая ДНК-последовательность в химерной ДНК-последовательности может транскрибироваться и транслироваться, то есть кодироваться в растительной ткани с целью получения полипептида и соответствующего фенотипического признака. Химерный ген конструируется таким образом, что вторая ДНК-последовательность надлежащим образом связывается, обычно по соседству и в соответствующей ориентации с химически регулируемой ДНК-последовательностью с целью обеспечения транскрипции. Такое связывание осуществляют традиционными методами.
Предпочтительной является химерная ДНК-последовательность, включающая первый некодирующий химически регулируемый ДНК-компонент, и второй, способный к транскрипции ДНК-компонент, в которых первая некодирующая ДНК-последовательность представляет собой одну из предпочтительных ДНК-последовательностей, упомянутых выше в части A. Последовательность, содержащая один компонент (фрагмент), может регулироваться путем репрессии или индукции химическим регулятором. Конкретная последовательность настоящего изобретения представляет собой химерную ДНК-последовательность, в которой первая ДНК-последовательность обладает значительной гомологией с химически регулируемой ДНК-последовательностью во встречающемся в природе химически регулируемом гене из растения.
Предпочтительной является химерная ДНК-последовательность, в которой первая ДНК-последовательность обладает значительной гомологией с ней или представляет собой химически регулируемую ДНК-последовательность в химически регулируемом гене естественного происхождения из растения, а вторая ДНК-последовательность представляет собой кодирующую последовательность, которая транскрибируется и транслируется с получением полипептида и соответствующего фенотипического признака. Предпочтительно, чтобы такая вторая ДНК-последовательность находилась по соседству с первой ДНК-последовательностью. Особенно предпочтительной является такая химерная ДНК-последовательность, в которой первая ДНК-последовательность представляет собой химически индуцируемую ДНК-последовательность в PR протеиновом гене, например PR протеин двудольного растения, такого как табак или огурцы, или обладает значительной гомологией к ней. Их примеры указаны выше в части A.
Второй тип химерной ДНК-последовательности содержит три ДНК-последовательности, происходящие из двух или более источников. Согласно наиболее простому воплощению, такая химерная ДНК-последовательность включает ДНК-последовательность, состоящую из двух частей, в соответствии с описанным выше в части B, и третью ДНК-последовательность, происходящую по крайней мере из одного источника, отличного от указанных выше. Более конкретно, такой тип химерной ДНК-последовательности включает последовательность первого компонента ДНК, представляющую или обладающую значительной гомологией к ней, некодирующую химически регулируемую ДНК-последовательность химически регулируемого гена естественного происхождения, эта последовательность первого компонента ДНК способна к регуляции транскрипции ассоциированной с ней ДНК-последовательности в растении или растительной ткани, в которых такая регуляция зависит от химического регулятора, последовательность второго компонента ДНК, представляющую собой часть, но не всю, способной к транскрипции ДНК-последовательности, или обладающую значительной гомологией с ней, с которой первый компонент связан в химически регулируемом гене естественного происхождения, и последовательность третьего компонента ДНК, способную к транскрипции в растении или растительной ткани. Предпочтительно, чтобы химически регулируемый ген естественного происхождения представлял собой ген растения.
Последовательности второго и третьего компонентов ДНК обычно являются кодирующими последовательностями. Третий ДНК-компонент может происходить из одного или более естественных или синтетических источников. Два первых компонента ДНК обычно имеют естественное происхождение. Если они происходят из растения, то оно может быть однодольным, двудольным или голосеменным. Согласно предпочтительному воплощению, вторая ДНК-последовательность включает нуклеотидную последовательность, которая кодирует сигнальный пептид химически регулируемого гена, в котором находятся две первые ДНК-последовательности. Если химически регулируемая ДНК-последовательность связана с частью кодирующей последовательности гена, из которого она происходит, то третья ДНК-последовательность должна не только быть в правильной ориентации, но также находится в надлежащей рамке считывания со второй ДНК-последовательностью. Такая ориентация может быть достигнута методами, хорошо известными в данной области.
Предпочтительными являются химерные ДНК-последовательности, в которых первый и второй компоненты ДНК-последовательности относятся к числу предпочтительных из указанных выше, в части B. Так, например, предпочтительной химерной ДНК-последовательностью является последовательность, в которой последовательность первого компонента ДНК представляет собой химически индуцируемую последовательность ДНК в PR-протеиновом гене из двудольного растения, например, табака или огурцов, или обладает значительной гомологией к ней. Примеры PR-протеиновых генов приведены выше.
Химерные гены, описанные выше, охватывают большое число возможных конструкций. Химически регулируемая некодирующая последовательность может быть связана с геном, контролирующим цветение или созревание плодов; геном, осуществляющим толерантность или устойчивость к гербицидам или многим типам паразитов, например, грибков, вирусов, бактерий, насекомых, нематод или пауков; геном, контролирующим продуцирование энзимов или вторичных метаболитов; геном стерильности мужских или женских особей; карликовости; аромата; питательных свойств; и тому подобное. С использованием настоящего изобретения такие признаки могут усиливаться фермером или садоводом, и перестают зависеть только от природных факторов. Особенно интересным фенотипическим признаком в смысле его регуляции является получение метаболитов в тканевой культуре или в биореакторе.
Предпочтительная химерная ДНК-последовательность представляет собой двух- или трехкомпонентную последовательность, в которой последовательность кодирующей ДНК кодирует фенотипический признак, например, выбранный из группы, состоящей из толерантности или устойчивости к действию гербицида, грибков, вирусов, бактерий, насекомых, нематод или пауков; продуцирования вторичных метаболитов; стерильности мужских или женских особей; продуцирования энзима или другого соединения-репортера. Особенно предпочтительной является двух- или трехкомпонентная химерная ДНК-последовательность, в которой последовательность кодирующего фрагмента кодирует толерантность или устойчивость к действию гербицидов, например, кодирует ацетогидроксикислотную синтазу (AHAS) дикого типа или устойчивую к действию гербицидов или в которой последовательность кодирующего фрагмента кодирует устойчивость к действию насекомых, например, кодирует эндотоксин (BT) Bacillus thuringiensis.
Если химерная последовательность предполагается для использования в анализе на химические регуляторы, фенотипическим признаком предпочтительно является способный анализироваться маркер. Подходящие для этой цели маркеры включают, но не ограничиваются ими, люциферазу (LUX), хлорамфениколацетилтрансферазу (CAT), неомицинфосфотрансферазу (NPT), нопалинсинтазу (NOS), октопинсинтазу (OCS), бета-1,3-глюкуронидазу (GUS), ацетогидроксикислотную синтазу (AHAS) и эндотоксин Bacillus thuringiensis (BT). Предпочтительными маркерами являются бета-1,3-глюкуронидаза (GUS), ацетогидроксикислотная синтаза (AHAS) и эндотоксин Bacillus thuringiensis (BT).
В качестве примера такой химерной ДНК последовательности, подробно описанной в примерах, можно привести состоящую из двух частей химерную ДНК-последовательность, которая содержит 5' фланкирующий участок некодирующей последовательности PR-1a гена. Хотя одним из описанных в примере маркеров является кодирующая последовательность GUS гена, может использоваться любой из маркеров, упомянутых выше. Аналогичная, состоящая из трех частей, химерная последовательность содержит часть кодирующей последовательности PR-1a гена. Такие конструкции особенно ценны, поскольку эффект химической индукции, например, активность бета-глюкуронидазного энзима, легко детектируется в растительных клетках или их экстрактах. Другие конкретные примеры включают некодирующую последовательность одного из табачных β-1,3- глюконазных генов и те, что включают кодирующую последовательность ацетогидроксикислотной синтазы, устойчивой к действию гербицидов или дикого типа или эндотоксина Bacillus thuringienis. описаны в части L примеров.
Предпочтительная химерная ДНК-последовательность представляет собой двухкомпонентную или трехкомпонентную химерную ДНК-последовательность, в которых первая последовательность представляет собой 5'-фланкирующую последовательность табачного PR-1a гена и содержит более 300, например, 300-2000, предпочтительно 600-1000 пар оснований по соседству с сайтом начала транскрипции.
Также предпочтительной является химерная ДНК-последовательность, включающая три фрагмента, в которой вторая последовательность ДНК кодирует сигнальный пептид, например, в которой вторая последовательность ДНК кодирует пептид, который представляет собой сигнальный пептид из PR-протеинового гена, предпочтительно PR-1a гена, или обладает значительной гомологией к нему.
Способ получения химически регулируемой химерной ДНК-последовательности, включающей последовательность первую, некодирующую химически регулируемую ДНК, которая способна регулировать транскрипцию ассоциированной с ней ДНК-последовательности в растении или в растительной ткани, в которых такая регуляция зависит от химического регулятора, и вторую последовательность ДНК, способную к транскрипции в растении или растительной ткани, характеризуется тем, что лигируют ДНК-последовательности. Аналогично способ получения химерной ДНК-последовательности, включающей первую последовательность ДНК, являющуюся химически регулируемой ДНК-последовательностью химически регулируемого гена естественного происхождения или обладающую значительной гомологией к некодирующей, причем первая последовательность ДНК способна регулировать транскрипцию ассоциированной с ней ДНК-последовательности в растении или растительной ткани, в которых такая регуляция зависит от химического регулятора, вторая последовательность ДНК, которая представляет собой способную к транскрипции ДНК-последовательность, с которой связан первый компонент в химически регулируемом гене естественного происхождения, или обладает значительной гомологией к части, но не всей этой последовательности, и третья последовательность ДНК, способная к транскрипции в растении или растительной ткани, заключается в том, что ДНК-последовательности подвергают конкурентному или последовательному лигированию.
D. Векторы.
Векторы, получаемые стандартными методами, включают химически регулируемые ДНК-последовательности, описанные в частях A или B, либо химерные ДНК-последовательности, описанные в части C. Векторы представляют собой последовательности рекомбинантной ДНК, которые могут использоваться для выделения и размножения упомянутой ДНК-последовательности и для трансформации подходящих хозяев такими последовательностями. Подходящими векторами для выделения и размножения являются плазмиды, которые могут размножаться в подходящем микроорганизме-хозяине, например, в E.coli. Предпочтительными для трансформации векторами являются те, которые используются для трансформации растительных клеток или Agrobacteria. Более конкретно, если трансформации подвергаются растительные клетки, отличные от протопластов, то предпочтительным вектором является вектор - производное Ti-плазмиды. Для прямого переноса ДНК в протопласты может использоваться любой из упомянутых выше векторов. Соответствующие векторы, которые могут использоваться в качестве исходных материалов, известны из литературы. Подходящие векторы для трансформации растительной ткани и протопластов описаны deFramond A. et al., Bio/Technology 1, 263 (1983); An G. et al, EMBO J. 4, 277 (1985); Potrykus I. et al. , см. выше: Rothstein S.J. et al., Gene 53, 153 (1987). Кроме этого, в литературе описаны многие другие векторы, которые могут использоваться в качестве исходных материалов настоящего изобретения.
Векторы, которые содержат только химически регулируемую ДНК-последовательность, в соответствии с описанным в частях A и B, могут использоваться в качестве промежуточных для получения вектора, содержащего химерную ДНК-последовательность в соответствии с описанным в части С, выше. Внедрение соответствующей последовательности, способной к транскрипции, в такой промежуточный вектор обеспечивает получение вектора, включающего химерную ДНК-последовательность настоящего изобретения, который далее может использоваться для трансформации желаемой растительной ткани, протопласта или другого хозяина. С другой стороны, химерная ДНК-последовательность может быть получены и встроена в подходящий вектор, который далее может использоваться для трансформации желаемой растительной ткани или другого хозяина.
Конструирование и размножение векторов может осуществляться в подходящем хозяине, например, в E. coli. Подходящие для этой цели E. coli штаммы включают HB101, JM83, DH1, DH5α, LE392 и тому подобные. Векторы настоящего изобретения могут использоваться как таковые для прямого переноса гена в методе микроинъекции. В некоторых случаях предпочтительно линеаризовать векторы до применения. С другой стороны, векторы могут быть перенесены в Agrobacterium хозяина. Такой перенос осуществляют традиционными методами, включающими бипарентальное скрещивание (Simon R. et al., Bio/Technology 1, 74 (1983)); трипарентальное скрещивание (Ditta G. et al., Proc. Natl. Acad. Sci. USA 77, 7347 (1980)) или трансформацию (Holsters М. et al., Mol. Gen. Genet/ 163, 181 (1978)). Подходящие штаммы Agrobacterium включают, но не ограничиваются ими, A. tumefaciens LBA4404, CIB542 и C58Z707.
Предпочтительными векторами являются такие, которые включают предпочтительные ДНК-последовательности, упомянутые выше в частях A, B и C. Кроме этого, предпочтительным вектором является вектор, функционирующий в растительных клетках или Agrobacterium. Особенно предпочтительными являются векторы, описанные в части L, примерах.
E. Растительные ткани, растения и семена.
Еще одним аспектом настоящего изобретения являются растительная ткань, растения или семена, содержащие химерные ДНК-последовательности, описанные выше. Предпочтительными являются растительные ткани, растения или семена, содержащие те химерные ДНК-последовательности, что были упомянуты выше как предпочтительные. Клетки растительной ткани трансформируются векторами, описанными выше с помощью методов, известных в данной области, включая методы, описанные в указанных выше ссылках, и методы, описанные подробно в примерах, приведенных ниже. Такие методы включают прямое инфицирование или совместное культивирование растений или растительной ткани с Agrobacterium. Весьма подходящим методом является трансформация лиственного диска, описанная Horsch R. B. et al., Science 225, 1229 (1985). С другой стороны, вектор может быть перенесен непосредственно, например, методом электропорации микроинъекции или путем трансформации протопластов в присутствии полиэтиленгликоля (ПЭГ), хлористого кальция или в электрическом поле, как это достаточно полно описано выше.
Трансформированные клетки могут быть клетками однодольных или двудольных растений и могут содержать один или более химически регулируемых химерных генов настоящего изобретения. Так, например, гены, которые, например, кодируют устойчивость или толерантность к гербицидам и большому числу насекомых, вирусов, бактерий, грибков и других паразитов, стерильность, размер, цветение и созревание фруктов, вводятся в растительную ткань, и такие клетки или протопласты развиваются в растениях, в которых указанные признаки могут регулироваться в результате манипуляций с химическим регулятором. С другой стороны, клетки могут размножаться в тканевой культуре или в биореакторе с целью продуцирования энзимов или вторичных метаболитов. Если желателен энзимный анализ, кодирующая секция химерного гена может включать, например, LUX, CAT, NPT, NOS, OCS, GUS, AHAS или BT гены, описанные выше. Такие химерные гены, содержащие химически индуцируемую последовательность PR гена, являются предпочтительным воплощением настоящего изобретения в связи с легкостью применения регулятора и легкостью обнаружения энзимного продукта.
После трансформации трансформированную клетку или растительную ткань подвергают селекции или скринингу с помощью традиционных методов. Трансформированная клетка или растительная ткань содержит химерную ДНК-последовательность, обсужденную выше, и затем регенерируется, если желательно, с помощью известных методов, включая те, что описаны в указанных выше ссылках и в следующих ниже примерах для однодольных и двудольных растений. Разновидности, которые могут быть регенерированы такими методами, включают, но не ограничиваются ими, маис, подсолнечник, семена капусты, клевер, табак, морковь, хлопок, люцерну, рис, картофель, баклажан и огурцы. Регенерированные растения подвергают скринингу на трансформацию с помощью стандартных методов. Потомство регенерированных растений непрерывно подвергают скринингу и селекции на наличие интегрированной ДНК-последовательности с тем, чтобы создать улучшенное растение или линии семян, ДНК-последовательности могут вводиться в другие генетические линии большим числом методов, включающих классическую селекцию, слияние протопластов, перенос ядер и перенос хромосом.
F. Преимущества и применения.
Настоящее изобретение предполагает ряд преимуществ и использований, связанных с легко контролируемой регулируемой экспрессией в растениях или растительных тканях химерных генов, содержащих химически регулируемые ДНК-последовательности. Возможна регуляция генов, протекающая по антисмысловому механизму, или генов, экспрессия которых приводит к продуцированию фенотипического признака. Особенно важно то, что появляется возможность контролировать время и степень генной экспрессии и легко осуществлять такой контроль либо во всем растении, или в его локализованных частях.
Осуществление такого контроля может достигаться простым применением химического регулятора в растительной ткани, или в растении и его частях таким методом и в таком количестве, чтобы регулировать химерные гены, экспрессия которых в растительных клетках, растительных тканях или растениях является желательной. Так, например, если признак, подлежащий экспрессии, предпочтительно экспрессировать лишь в клетках, то их опрыскивают или посыпают во время, которое оптимально для такой экспрессии в листьях до миграции в другие части растения, в результате чего легко и эффективно достигается поставленная цель. С другой стороны, однородная экспрессия в части растения, расположенной над почвой, может быть результатом применения на всем растении (например, на стебле и на обеих сторонах листьев). Если желательна экспрессия в корневой системе, то возможным методом регуляции может служить применение на семенах или на почве вокруг семян или корней. Экспрессия в биореакторе осуществляется очень легко, например, путем применения химического регулятора в среде, контактирующей с клетками.
Возможность контролирования времени, степени и/или генной экспрессии нового фенотипического признака в трансгенных растениях предполагает ряд полезных преимуществ. Так, например, если толерантность по механизму детоксификации к действию гербицида или другого пестицида вводится в растение, то такой признак может быть усилен надлежащим выбором времени применения химического регулятора. Так, например, регулятор может применяться перед, совместно или после применения гербицида или другого пестицида, в зависимости от того, какой метод обеспечивает оптимальную толерантность.
Также появляется возможность регулировать получение соединений, биосинтез которых контролируется эндогенными или посторонними генами. В результате химического индуцирования получение таких продуктов может быть начато в желательное время. Индуцированный процесс может представлять собой многостадийный биосинтез или одностадийную конверсию метаболита.
Другое преимущество настоящего изобретения состоит в способности регулировать процессы развития в желательное время путем применения регулирующего химикалия. Так, например, может осуществляться синхронизация развития растения (прорастание, ветвление, проращивание, цветение, образование цветов, созревание фруктов, высушивание, опадание и тому подобное). Кроме этого, может предотвращаться нормальное развитие растения. Такая операция может осуществляться, например, путем введения токсинового гена, который препятствует желаемой стадии развития, ДНК-последовательности, которая может блокировать стадию развития по антисмысловому механизму, или гена, экспрессия которого блокирует переход к новой стадии развития и который может химически подавляться, препятствуя развитию. Одним из использований такого метода может служить индукция стерильности мужских или женских особей с целью регулирования гибридизации культур.
Дополнительными преимуществами настоящего изобретения являются новые методы анализа, предпочтительно методики энзимного анализа. Так, например, можно легко осуществлять идентификацию новых химических регуляторов. Такие методы анализа включают применение трансформированных растений или растительных клеток, которые содержат химерную ДНК-последовательность настоящего изобретения. На трансформированном хозяине применяют химический агент и транскрипцию последовательности ДНК, способной к транскрипции, измеряют относительно контрольного образца; обычно транскрипцию детектируют в форме продукта трансляции или как действие такого продукта. Такой анализ может проводиться различными путями, но, как правило, его осуществляют с использованием регенерированных растений целиком (путем применения химического агента на растении) или на культурированных клетках или ткани (путем применения химического агента на клетках или ткани), после чего субстрат подвергают действию энзима. Далее продукт энзимной активности детектируют стандартными методами, например, путем спектрофотометрических измерений.
Главным образом, настоящее изобретение охватывает способ идентификации химического регулятора, который заключается в трансформации хозяина химерной ДНК-последовательностью в соответствии с описанным выше, в части С, или вектором, содержащем указанную химерную ДНК-последовательность, применении на трансформированном хозяине надлежащего химического регулятора и измерении экспрессии фенотипического признака. Предпочтительным способом является такой способ, в котором трансформированный хозяин представляет собой растительную ткань или растительные клетки. Также предпочтительным является способ, в котором химерная ДНК-последовательность представляет собой последовательность, отмеченную выше, как предпочтительную, например, такой способ, в котором первая последовательность ДНК указанной химерной ДНК представляет собой индуцируемую последовательность, являющуюся химически индуцируемой последовательностью PR-протеинового гена, или обладающую значительной гомологией к ней, и в котором фенотипический признак, закодированный химерной ДНК, представляет собой анализируемый энзимный маркер.
Другим достижением настоящего изобретения является возможность разработки новых методов идентификации других химически регулируемых ДНК-последовательностей. Вектор, содержащий предполагаемую химически регулируемую ДНК-последовательность, конструируют, например, из селективного маркера. Подходящие селективные маркеры включают гены, обеспечивающие устойчивость к антибиотику и гербицидам. Примерами генов, обеспечивающих устойчивость к действию антибиотиков, могут служить гены устойчивости к гигромицину, канамицину, хлорамфениколу, блеомицину, пуромицину, ленкомицину, G418 и метотрексату. Особенно подходящим геном, обеспечивающим устойчивость к гигромицину, является аминогликозид фосфотрансфераза IV. Векторы, подходящие для трансформации растений, содержащие ген устойчивости к гигромицину, описаны Rothstein S.J. et al, Gene 53, 153 (1987). Примерами генов устойчивости к гербицидам могут служить гены, кодирующие устойчивость, например, к сульфонилмочевинам, глифосату, фосфинотрицину и атразину.
Подходящие маркеры, продукты которых анализируются, включают гены энзимов, антигенов, иммуноглобулинов и т.п., а также гены устойчивости к антибиотикам. Подходящие энзимные маркеры включают LUX, CAT, NPT, NOS, OCS, GUS, AHAS и BT. Особенно подходящим энзимом является бета- 1,3-глюкуронидаза (GUS), что связано с легкостью его обнаружения при энзимном анализе. ДНК-последовательность, кодирующая анализируемый маркер, может вставляться в вектор с использованием традиционных методов. Предлагаемую регулируемую ДНК-последовательность обычно встраивают рядом с геном маркера, в результате чего экспрессия маркера контролируется ДНК-последовательностью. Затем вектор используется для трансформации растительной ткани или другого соответствующего хозяина. Трансформированная растительная ткань или хозяин подвергаются селекции по признаку устойчивости к антибиотикам. Затем к растительной ткани или другому хозяину применяют химический регулятор с последующей селекцией или регенерацией трансформированной ткани. Индукция подавления маркера после применения химического регулятора позволяет идентифицировать предполагаемую ДНК последовательность как последовательность, которая способна регулировать транскрипцию соседней ДНК-последовательности, в которой регуляция зависит от химического регулятора. Анализ может осуществляться на целом, регенерированном или трансформированном растении, например, в результате применения химического регулятора на листьях или других растительных тканях и измерения экспрессии способного к анализу маркера. С другой стороны, анализ может проводиться на трансформированной каллюсной ткани или другом хозяине в клеточной культуре, путем применения предполагаемого химического регулятора на каллюсе или другой культуре и измерения экспрессии маркера.
Главным образом, настоящее изобретение позволяет идентифицировать химически регулируемую ДНК-последовательность путем проведения
следующих стадий:
(а) трансформации хозяина предполагаемой химически регулируемой ДНК-последовательностью или вектором, содержащим указанную последовательность, второй ДНК-последовательностью,
которая представляет собой маркер гена, способного к селекции хозяина, и третьей ДНК-последовательностью, которая кодирует фенотипический признак;
(b) применения химического регулятора на
указанном трансформированном хозяине; и
(c) измерения экспрессии или селекции на изменение экспрессии фенотипического признака, закодированного третьей ДНК-последовательностью.
Предпочтительным является такой способ, в котором указанная третья ДНК-последовательность представляет собой маркер для анализируемого гена, или селективного маркера, а также способ, в котором вторая или третья ДНК-последовательность представляет собой селективный маркер устойчивости к гербицидам или антибиотикам, выбранный, например, из группы, состоящей из генов устойчивости к гигромицину, канамицину, хлорамфениколу, блеомицину, пуромицину, линкомицину и метотрексату, например, ген, устойчивый к аминогликозидфосфотрансферазе IV гигромицина.
Также предпочтительным является способ, в котором предполагаемая химически регулируемая ДНК-последовательность связана и предпочтительно находится по соседству с третьей ДНК-последовательностью, и способ, в котором трансформированный хозяин представляет собой растительную ткань или растительные клетки.
Предпочтительным является способ, в котором третья ДНК-последовательность кодирует анализируемый энзимный маркер, выбранный из группы, состоящей из люциферазы (LUX), хлорамфеникол-ацетилтрансферазы (CAT), неомицин-фосфотрансферазы (NPT), нопалин-синтазы (NOS), октопин-синтазы (OCS), бета-1,3-глюкуронидазы (GUS), ацетогидроксикислотной синтазы (AHAS) и Bacillus thuringiensis эндотоксина (BT).
Результатом настоящего изобретения является практически чистая химически регулируемая ДНК-последовательность, идентифицированная указанными выше способами.
Настоящее изобретение позволяет осуществить способ селекции трансформированного растительного материала. Растительный материал, на который воздействовали экзогенной ДНК-последовательностью, содержащей химически регулируемую ДНК-последовательность, для которой известен химический регулятор и вторую ДНК-последовательность для фенотипического признака, обрабатывали регулятором и выявляли экспрессию фенотипического признака. Наблюдение такого признака подтверждает тот факт, что трансформация предполагаемых трансформантов действительно имеет место. Типичные фенотипические признаки для целей такого способа включают селективные маркеры и анализируемые маркеры, описанные ранее.
Главным образом, настоящее изобретение позволяет осуществить способ селекции трансформированных растительных клеток или ткани, подвергнутых действию трансформирующей ДНК, включающей последовательность первого компонента ДНК, которая может химически регулироваться известным химическим регулятором, и связанную вторую ДНК-последовательность, кодирующую фенотипический маркер, причем такой способ включает стадии (a) обработки предполагаемых трансформантов указанным известным химическим регулятором, и (b) селекции трансформантов в соответствии с экспрессией фенотипического признака, закодированного второй ДНК-последовательностью. Предпочтительным способом является такой способ, в котором указанным фенотипическим признаком является устойчивость к антибиотику, например, устойчивость к гигромицину, канамицину, хлорамфениколу, блеомицину, пуромицину, линкомицину, G418 и метатрексату, или способный анализируемый энзимный маркер, выбранный, например, из группы, состоящей из люциферазы (LUX), хлорамфеникол ацетилтрансферазы (CAT), неомицин-фосфотрансферазы (NPT), нопалин-синтазы (NOS), октопин-синтазы (OCS), бета-1,3-глюкуронидазы (GUS), ацетогидроксикислотной синтазы (AHAS) и Bacillus thuringiensis эндотоксина (BT).
G. Сигнальные пептиды.
Сигнальный пептид или сигнальная последовательность представляет собой специальную N-терминальную аминокислотную последовательность в протеине, входящем в эндоплазматическую сеть. Такая последовательность в эукариотных клетках обычно содержит 15-40 аминокислотных остатков, большинство из которых являются гидрофобными. Такая последовательность в конечном счете отщепляется от зрелого протеина.
Сигнальный пептид химически регулируемого гена используется для конструирования состоящих из 3 частей химерных конструкций, в соответствии с описанным выше. Такие химерные конструкции содержат первую химически регулируемую последовательность, вторую ДНК-последовательность, кодирующую сигнальный пептид в протеинах, и третью последовательность, которая кодирует фенотипический признак. Предпочтительным фенотипическим признаком является такой признак, который легко анализировать. Включение в химерную конструкцию ДНК-последовательности, которая кодирует сигнальный пептид, позволяет продукту, экспрессированному третьей ДНК-последовательностью, выходить за эндоплазматическую мембрану клетки хозяина и направляться к отдаленному целевому месту.
Конкретно к таким сигнальным пептидам относится сигнальный пептид табачного PR-1a
протеина, а также протеин, аминокислотная последовательность которого обладает значительной гомологией последовательности в отношении такого пептида. Аминокислотная последовательность такого пептида
имеет следующий вид:
MetGlyPheValLeuPheSerGlnLeuProSerPheLeuLeuVal-
SerThrLeuLeuLeuPheLeuValIleSerHisSerCysArgAla.
Настоящее изобретение позволяет получить ДНК-последовательность, кодирующую такой пептид (см. последовательность 1) и ДНК-последовательности, обладающие в значительной гомологией к такой последовательности. Как отмечалось ранее, настоящее изобретение относится к (1) ДНК-последовательностям, содержащим химически регулируемую последовательность в комбинации с последовательностью, кодирующей сигнальный пептид, и (2) химерным ДНК-последовательностям, состоящим из трех частей и содержащим химически регулируемый компонент, участок, кодирующий сигнальный пептид и ДНК-последовательность, способную к транскрипции, предпочтительно с трансляцией.
H. Новые PR гены.
Настоящее изобретение позволяет выделить и идентифицировать PR-геномную ДНК и кДНК-последовательности из генов, указанных выше, как PR-1a, PR-1' и PR-R из табака, индуцируемая патогеном хитиназа огурцов, PR-Q табака, основная β-1,3- глюканаза 39.1 и 39.3 из табака, кислотная β-1,3- глюканаза табака и ДНК-последовательности, обладающие значительной гомологией к таким генам. ДНК-последовательности таких генов представлены последовательностями 1-8. Новые гены с последовательностями 1, 2, 5 и 6 (PR-1a, PR-1' и β-1,3- глюканаза 39.1 и 39.3, соответственно) также представляют собой конкретные воплощения некодирующих химически регулируемых ДНК-последовательностей настоящего изобретения, в соответствии с упомянутым выше. Новые последовательности 3, 4, 7 и 8 кодируют PR-протеины огуречной хитиназы, табачный PR-R, табачный PR-Q и кислотную форму табачной β-1,3- глюканазы. Подробности такого выделения и характеристика генов приведены в примерах.
I. Химические регуляторы.
Химическим регулятором называют вещество, которое регулирует экспрессию гена через химически регулируемую ДНК-последовательность. Такое вещество, в ионной или нейтральной форме, содержащее или не содержащее сольватирующие или другие комплексообразующие молекулы или анионы, обычно является экзогенным относительно системы, содержащей химически регулируемый ген во время регуляции, если это желательно. Использование экзогенных химических регуляторов является предпочтительным из-за легкости и удобства контролирования количества регулятора в системе. Однако возможно использование эндогенных регуляторов, в частности, химических агентов, активность которых или их уровень содержания в системе искусственно контролируются другими компонентами, содержащимися в системе или бездействующими на нее.
Химические регуляторы включают химические агенты, являющиеся индукторами PR-протеинов в растениях или их близкими производными. Эти вещества включают: бензойную кислоту, салициловую кислоту, полиакриловую кислоту и их замещенные производные; подходящие заместители включают низший алкил, низший алкоксил, низший алкилтио и галоген. При применении на растительной ткани, как правило, на листьях всего растения, в растительной ткани повышается уровень содержания иРНК и PR-протеинов.
Используемая группа регуляторов химически регулируемых ДНК-последовательностей и химерных генов настоящего изобретения основана на производных бензо-1,2,3-тиадиазола и включает, но не ограничивается ими, следующие типы соединений: бензо-1,2,3-тиадиазолкарбоновую кислоту, бензо-1,2,3-тиадиазолтиокарбоновую кислоту, цианобензо-1,2,3-тиадиазол, амид бензо-1,2,3-тиадиазолкарбоновой кислоты, гидразид бензо-1,2,3-тиадиазолкарбоновой кислоты и их производные.
Из них предпочтительными являются бензо-1,2,3-тиадиазол-7-карбоновая кислота, бензо-1,2,3-тиадиазол-7-тиокарбоновая кислота, 7-цианобензо-1,2,3-тиадиазол, амид бензо-1,2,3-тиадиазол-7-карбоновой кислоты, гидразид бензо-1,2,3-тиадиазол-7-карбоновой кислоты и их производные.
Подходящие производные охватывают, но не ограничиваются ими, такие представители соединений указанного типа, в которых бензо-1,2,3-тиадиазол может быть незамещенным или замещенным небольшими заместителями, обычно используемыми агрохимикалиев ароматического ряда, такими как низший алкил, низший алкокси, низший галоалкил, низший галоалкокси, низший алкилтио, циано, нитро и галоген. Подходящие производные, кроме того, охватывают, но не ограничиваются ими, те представители указанных бензо-1,2,3-тиадиазольных соединений, в которых функциональные группы карбоновой кислоты, тиокарбоновой кислоты, амида карбоновой кислоты или гидразида карбоновой кислоты не замещены или замещены алифатическим, аралифатическим или ароматическим остатками. Подходящие для этой цели остатки включают, но не ограничиваются ими, алкил (особенно низший алкил), алкокси (особенно низший алкокси, низший алкоксиалкил, алкоксиалкоксиалкил, циклоалкил, циклоалкилалкил, фенилалкил (особенно бензил), нафтилалкил, феноксиалкил, алкенил, и алкинил, в которых алкильная часть заместителя не замещена или замещена гидрокси, галогеном, циано или нитро, а ароматическая часть заместителя не замещена или замещена небольшими заместителями, которые обычно используются в агрохимикалиях ароматического ряда, например, такими как низший алкил, низший алкокси, низший галоалкил, низший галоалкокси, низший алкилтио, циано, нитро и галоген.
Регуляторы на основе бензо-1,2,3-тиадиазола охватывают также группы соединений, из которых могут быть выделены вещества, действующие как регулятор.
Предпочтительная группа регуляторов на основе бензо-1,2,3-тиадиазола включает бензо-1,2,3-тиадиазолкарбоновую кислоту, алкил-бензо-1,2, 3-тиадиазолкарбоксилат, где алкильная группа содержит 1-6 углеродных атомов, а также замещенные производные этих соединений. Подходящими заместителями являются низший алкил, низший алкокси, низший алкилтио и галоген. В частности, бензо-1,2,3-тиадиазол-7-карбоновая кислота и ее алкиловые эфиры, например, метил-бензо-1,2,3-тиадиазол-7-карбоксилат, являются предпочтительными индукторами химерных ДНК-последовательностей, включающих химически регулируемые ДНК-последовательности, выделенные из PR-протеиновых генов. Синтез упомянутых химических регуляторов и их использование в качестве биоцидов описаны в патенте Великобритании 1176799 и в статье Kirby P. et al., J. Chem. Soc. C 2250 (1970).
Производные бензо-1,2,3-тиадиазолов, которые могут использоваться в качестве регуляторов согласно настоящему изобретению, описаны в заявке на патент США 234241, поданной 18 августа 1988 года.
Среди предпочтительных производных бензо-1,2,3-тиадиазола можно, например, упомянуть бензо-1,2,3-тиадиазол-7-карбоновую кислоту, метил- бензо-1,2,3-тиадиазол-7-карбоксилат, н-пропил-бензо-1,2,3-тиадиазол-7- карбоксилат, бензил-бензо-1,2,3-тиадиазол-7-карбоксилат, втор.- бутилгидразид бензо-1,2,3-тиадиазол-7-карбоновой кислоты и т.п.
Другая группа регуляторов химически регулируемых ДНК-последовательностей настоящего изобретения выбирается из производных пиридинкарбоновой кислоты, например, изоникотиновой кислоты и, предпочтительно, галогенизоникотиновой кислоты. Предпочтительной кислотой является дихлоризоникотиновая кислота и ее производные, например, низшие алкиловые эфиры. Подходящими регуляторами соединений такого класса являются, например, 2,6-дихлоризоникотиновая кислота и ее низшие алкиловые эфиры, особенно метиловый эфир.
Способ регуляции транскрипции химически регулируемого гена заключается в применении указанного химического регулятора на растительной ткани, растении или семенах, содержащих химически регулируемую ДНК-последовательность, в соответствии с описанным выше в части A, B и C. Предпочтительным является такой способ, в котором растительная ткань, растение или семена содержат химически регулируемую ДНК-последовательность, упомянутую выше, как предпочтительную.
Химические регуляторы могут применяться в чистом виде, в растворе или суспензии, в виде порошков или дустов, или в других традиционных рецептурах, используемых в сельском хозяйстве или в процессах, протекающих в биореакторах. Такие рецептуры могут включать твердый или жидкий носитель, то есть материал, с которым смешивают регулятор для облегчения его применения на растении, ткани, клетке или тканевой культуре, или для улучшения свойств, используемых для хранения, обращения и транспортировки. Примерами подходящих носителей могут служить силикаты, глины, угль, сера, смолы, спирты, кетоны, ароматические углеводороды и т.п. При формировании в виде традиционного смачиваемого порошка или водной эмульсии рецептура регулятора может содержать одно или более общепринятых поверхностно-активных соединений, как ионных, так и неионных, например, смачивающих, эмульгирующих или диспергирующих агентов.
Регуляторы могут также применяться на растениях в комбинации с другим агентом, с помощью которого желают принести некоторую пользу растению, причем такая польза связана или не связана с признаком, контролируемым химерным геном, который регулируется регулятором. Так, например, регулятор может быть смешан с удобрением и его применяют перед экспрессией трансгенного признака, не связанного с удобрением. Регулятор может быть также объединен с гербицидом и использован для смягчения действия гербицида во время, когда такой эффект в ином случае достигает максимума.
В качестве жидкой рецептуры регулятор может применяться в виде спрея на листьях, стеблях или ветвях растения, на семенах перед посевом или на почве или другой растительной среде, поддерживающей растение. Регуляторы могут также использоваться в биореакторных системах, причем в этом случае регуляция достигается одноразовым добавлением регуляторной рецептуры в реакционную среду или непрерывном добавлением в течение определенного времени.
Регулятор применяют в количестве и в течение времени, достаточных для осуществления желаемой регуляции. Предпочтительным регулятором является такой регулятор, который не оказывает или оказывает минимальное фитотоксическое или другое вредное действие на растение, растительную ткань или растительные клетки, на которых он применяется в используемом количестве.
Предпочтительными ДНК-последовательностями среди описанных выше в части A или B и предпочтительными химерными ДНК-последовательностями среди описанных выше в части C являются, главным образом, те, в которых транскрипция регулируется химическим регулятором, упомянутым выше, например, выбранным из группы, состоящей из бензойной кислоты, салициловой кислоты, ацетилсалициловой кислоты, полиакриловой кислоты и их замещенных производных, или выбранным из группы, состоящей из бензо-1,2,3-тиадиазолкарбоновой кислоты, бензо-1,2,3-тиадиазолтиокарбоновой кислоты, цианобензо-1,2,3-тиадиазола, амида бензо-1,2,3-тиадиазолкарбоновой кислоты, гидразида бензо-1,2,3-тиадиазолкарбоновой кислоты и их производных, или дихлоризоникотиновой кислоты или ее производных. Наиболее предпочтительными являются такие ДНК-последовательности, в которых транскрипция регулируется упомянутыми выше предпочтительными химическими регуляторами, например, бензо-1,2,3-тиадиазол-7-карбоновой кислотой, метил-бензо-1,2,3-тиадиазол-7- карбоксилатом, н-пропил-бензо-1,2,3-тиадиазол-7-карбоксилатом, бензил-бензо-1,2, 3-тиадиазол-7-карбоксилатом, втор. -бутилгидразидом бензо-1,2,3-тиадиазол-7-карбоновой кислоты, 2,6-дихлоризоникотиновой кислотой или метил-2,6-дихлоризоникотинатом, главным образом бензо- 1,2, 3-тиадиазол-7-карбоксилатом.
J. Депонирование ATCC.
Следующие бактерии, плазмиды и суспензионные культуры были депонированы Американской коллекцией типовых
культур:
E. coli HB101/pTJS75-Km, ATCC номер 67628, депонирована 12 февраля 1988 года;
плазмида pBS-PR1013Cla, ATCC номер 40426, депонирована 12 февраля 1988 года;
плазмида
pBS-PR1019, ATCC номер 40427, депонирована 12 февраля 1988 года;
Zea mays суспензионная культура 6-2717-GC, ATCC номер 40326, депонирована 20 марта 1987 года;
плазмида pBS-Gluc39.1,
ATCC номер 40526, депонирована 29 декабря 1988 года;
плазмида pBS-Gluc39.3, ATCC номер 40527, депонирована 29 декабря 1988 года;
плазмида pBScucchi/хитиназа, ATCC номер 40528,
депонирована 29 декабря 1988 года;
плазмида pBSGL6e, ATCC номер 40535, депонирована 18 января 1989 года.
K. Резюме экспериментальных протоколов.
Химерные гены настоящего изобретения содержат химически регулируемые ДНК-последовательности из любого источника, как естественного, так и синтетического, в комбинации с одной или более способных к транскрипции ДНК-последовательностей; обычно по крайней мере часть способной к транскрипции последовательности будет транслироваться в фенотипический признак, хотя настоящее изобретение охватывает также химерные гены, действующие по антисмысловому механизму. Хотя следующее ниже описание и большое число примеров относится к химически регулируемым ДНК-последовательностям, обнаруживаемым в естественном состоянии в растительном геноме, настоящее изобретения в равной степени применимо к тем последовательностям, которые присутствуют в других природных системах, например, бактериальных, вирусных и животных системах, поскольку хорошо известны методы выделения таких последовательностей из их природных систем. Аналогичным образом настоящее изобретение охватывает также последовательности, являющиеся производными синтетических или других неприродных систем.
Химически регулируемую ДНК-последовательность выделяют из источника, в котором она существует в естественном состоянии или в синтетической форме и, если необходимо, ее охарактеризовывают традиционными методами. Если ДНК-последовательность выделяют из встречающегося в природе гена, то такой ген активируют соответствующим регулятором, как химическим, так и другим известным регулятором гена. РНК, полученную в результате такой активации, выделяют и используют для конструирования банк кДНК. Такую библиотеку используют для дифференцированного скрининга с применением радиационномеченой кДНК, генерируемой как из (1) РНК, выделенной из активированной системы, так и (2) из РНК, выделений из второй системы, не активированной регулятором. Такой дифференцированный скрининг является особым аспектом настоящего изобретения. Клоны, содержащие кДНК, подвергнутую химической регуляции, затем выделяют и на этой стадии предпочтительно устанавливают их последовательность. Затем кДНК клоны используют для идентификации и выделения геномного клона из геномного банка, причем такой геномный клон содержит химически регулируемую ДНК-последовательность. Предпочтительно устанавливают последовательность такого гена и химически регулируемую ДНК-последовательность картируют путем субклонирования фрагментов такого гена, лигирования их с геном-репортером и оценивают его активность на трансгенном растительном материале или иных растительных экспрессионных системах.
В случае PR- протеиновых генов табака лямбда геномный банк конструируют с использованием стандартных методов и клоны, содержащие химически регулируемые ДНК-последовательности, идентифицируют и очищают. Один из таких клонов охарактеризовывают. Рестриктные фрагменты, несущие химически регулируемую ДНК-последовательность, идентифицируют; в случае PR-1a гена такие генные фрагменты включают Clal фрагмент из 20000 пар оснований, HindIII фрагмент размером в 6500 пар оснований и EcoRI фрагмент размером 3600 пар оснований. Фрагмент HindIII содержит около 500 кодирующих пар оснований и около 6000 некодирующих оснований в 5'-фланкирующем участке последовательности по соседству с переходным стартовым сайтом. Некоторые из таких фрагментов субклонируют в плазмиды для использования в качестве источников ДНК для последующего субклонирования и полного охарактеризовывания, то есть рестрикционного картирования, установления ДНК-последовательностей и идентификации сайта начала транскрипции гена. В случае PR-1a гена, фрагмент EcoRI размером 3600 пар оснований непосредственно субклонируют из лямбда геномного клона и далее субклонируют в конечный клон размером 1200 пар оснований, с XhoI и PstI сайтами. Такой клон содержит химически индуцируемую ДНК-последовательность из PR-1a гена и часть соседней кодирующей области такого гена; такая часть включает кодирующую последовательность сигнального пептида PR-1a протеинового гена.
Аналогичным образом выделяют геномные клоны, которые кодируют основную форму бета-1,3-глюканазы. Два клона 39.1 и 39.3 охарактеризованы и идентифицированы рестриктные фрагменты, включающие химически регулируемые ДНК-последовательности.
С использованием векторов настоящего изобретения такие клоны далее могут применяться для получения химерных генов, содержащих три части, в соответствии с обсужденным выше. Такие химерные ДНК-последовательности содержат химически регулируемую последовательность, часть способной к транскрипции ДНК и третью ДНК-последовательность из постороннего источника. С другой стороны с такими клонами можно производить и дальнейшие операции, например, путем сайт-направленного мутагенеза, с целью удаления всех или большинства кодирующих фрагментов из родственного гена перед присоединением к кодирующей последовательности из постороннего источника с целью получения химерного гена, состоящего из двух частей. Согласно предпочтительному воплощению, та часть химерного гена, которая не является химически регулируемой последовательностью, представляет собой ген-репортер для легко наблюдаемого или детектируемого фенотипического признака. Следующие ниже примеры иллюстрируют гены бета-1,3-глюкуронидазы, ацетогидроксикислотной синтазы, гены устойчивости устойчивую к гербициду и дикого типа, и гены эндотоксина Bacillus thuringiensis. однако могут использоваться и другие гены-репортеры в соответствии с изложенным выше. Согласно предпочтительному воплощению последовательность кодирующего участка ДНК химерного гена кодирует толерантность или устойчивость к гербицидам или устойчивость к насекомым. В примерах, относящихся к такому воплощению, упоминаются гены ацетогидроксикислотной синтазы и эндотоксина Bacillus thuringiensis.
Химерные гены и векторы, содержащие такие гены, могут вводиться в растительные клетки различными методами. Эти клетки дают начало трансформированным клеткам, тканям и растениям. Они могут вводиться также в клеточные культуры, используемые в биореакторах. Некоторые из таких методов подробно описаны в следующих ниже примерах и они относятся как к однодольным, так и к двудольным растениям. Некоторые методы, по возможности упомянутые здесь, относятся к другим заявкам на патент, в особенности к заявке на патент США 056506, поданной 29 мая 1987 года, и заявке на патент США 165665, поданной 8 марта 1988 года.
Затем трансформированный растительный материал обрабатывают химическим регулятором и наблюдают и/или измеряют экспрессию фенотипического гена-репортера. Система такого типа обеспечивает устройство для идентификации регуляторной активности конкретных химических агентов. Настоящее изобретение также позволяет улучшить анализ бета-1,3-глюкуронидазы (GUS), энзиматическая активность которой позволяет проводить скрининг большого числа образцов с высокой точностью и за короткий период времени. Главным образом такой анализ предполагает обработку экстрактов растительной ткани в образцах менее 0,5 мл, 1,5-3 мМ 4-метилумбеллилферил глюкуронидом, при 37oC в течение 1-5 часов, и определение концентрации выделившегося флуоресцентного индикатора.
Количественное определение промежуточных уровней содержания РНК представляет собой существенную стадию анализа экспрессии генов. В настоящее время разработан анализ предусматривающий удлинение праймера. Такой способ включает мечение ген-специфичного олигонуклеотида до высокой удельной радиоактивности, гибридизацию олигонуклеотида с РНК-образцом и удлинение гибрида в присутствии обратной транскриптазы. Продукты удлинения отделяют на денатурированных акриламидных гелях и наблюдают визуально методами авторадиографии. Преимущества такого метода по сравнению с известными методами анализа включают легкость получения пробы, простоту методики анализа и время, требуемое для проведения анализа. Такой анализ предусматривающий удлинение праймера является чувствительным и количественным в виде S1 картирования.
Анализ удлинение праймера, применяемый в конкретных условиях реакции, описанных ниже в примерах, используется при определении уровня содержаний PR-1 и РНК в общем количестве РНК, экстрагированном из инфицированных TMV листьев табака. PR-1 и РНК экспрессируется в количестве 1% в таких листьях в соответствии с количественным анализом согласно методу удлинения праймера и чистоте кДНК клонов в кДНК-библиотеке, полученной такой РНК. Усовершенствования метода по сравнению с ранее описанными методами заключаются в мечении олигонуклеотида до высокой удельной активности, пониженном молярном количестве пробы, используемой в анализе (обычно 0,01-0,05 пмоль), оптимальной гибридизации и повышении длительности, а также в возможности использования оптимальных концентрация нуклеотидтрифосфата.
В связи с этим настоящее изобретение охватывает
способ определения количества специфичной РНК в растворе РНК, заключающийся в:
(a) мечении РНК-специфичного затравочного олигонуклеотида длиной 12-18 нуклеотидов до высокого значения удельной
радиоактивности,
(b) гибридизации РНК с меченым олигонуклеотидом при концентрации 0,1-20 нМ в течение времени от 2 минут до 24 часов при температуре около 37oC,
(c)
удлинении праймера олигонуклеотида с помощью обратной транскриптазы в присутствии нуклеотидтрифосфатов при концентрациях между 0,003 и 1 мМ в течение времени в пределах между 1 и 120 минутами, и
(d) разделения и визуализации удлиненных продуктов методом авторадиографии.
L. Примеры.
Следующие примеры подробно иллюстрируют настоящее изобретение. Они никоим образом не могут быть истолкованы как ограничение объема и существа формулы изобретения.
Ферментные реакции проводят в соответствии с методиками, рекомендованными производителем, если не указано особо. Химерные гены и векторы настоящего изобретения конструируют, используя методики, хорошо известные в этой области. Подходящие методики описаны Maniatis Е. et al., в Molecular Cloning, Cold Spring Harbor Laboratory, New York (1982); Methods in Enzyumology, тома 68, 100, 101 и 118 (1979, 1983, 1983 и 1986); и DNA Cloning, Glover D.M. Ed. IRL Press, Oxford (1985). Составы среды описаны Miller J.H.d Experiments in Molecular Genetics, Cold Spring Harbor Laboratory, New York (1972), а также в ссылках, указанных ранее.
Сокращения.
АТФ - аденозинтрифосфат
bp - пара оснований
CETAB - гексадецилтриметиламмонийбромид
2,4-D - 2,4-дихлорфеноксиуксусная кислота
DTT - дитиотреитол
lbrfv,f
- 3,6-дихлор-2-метоксибензойная кислота
EDTA - этилендиамин-N,N,N'N-тетрауксусная кислота
kb - 1000 пар оснований
MES - 2-(N-морфолин)этансульфокислота
MU
- 4-метилумбеллиферилглюкуронид
PEG - полиэтиленгликоль
picloram - 4-амино-3,5,6-трихлорпиколиновая кислота
SDS - додецилсульфат натрия
TEA - трифторуксусная
кислота
TMV - вирус табачной мозаики
Трис-HCl - трис(оксиметил) метиламин гидрохлорид
Среда
SH-O среда: Среда Schenk, R.U. et al., Can. J. Bot., 50 (1972) 199-204;
без гормонов. SH среда может быть жидкой или отвержденной 0,8% агаром или 0,5% GelRiteR. Среду стандартно стерилизуют нагреванием в автоклаве при 110-121oC в течение 15-20
минут.
SH-30 среда: SH-O среда, содержащая 30 мкг дикамба
SH-45 среда: SH-O среда, содержащая 45 мкг дикамба
RY-2 среда: Среда Yamada Y. et. al, Plant Cell Reports,
5, 85-88 (1986).
OMS-среда: Среда Murashige T. и Skoog F., Physiologia Plantarum 9, 473 (1968).
Среда может быть отверждена 0,8% агаром или агарозы или 0,5% GelRiteR. (См. табл. I).
Материалы.
Агароза: Приготовление и очистка агарозы описаны Guiseley и Renn, "The Agarose Monograph", Marine Colloids Division FMC Corp., 1975. Агароза является одной из составных частей агара. Коммерчески используемый агар стандартно состоит из смеси нейтральной агарозы и ионного агаропектина с большим числом боковых групп. Обычно некоторое число боковых цепей остается неповрежденными и определяет физико-химические свойства агарозы, такие как гельобразование и температура плавления. Агароза с низкой температурой плавления, особенно SeaPlaqueR агароза, является предпочтительным отверждающим агентом.
Гидролизат казеина: Гидролизат казеина - ферментированный гидролизат из молока рогатого скота, Type 1, Sigma Co., PO.Box 14508, St.Louis, MO 63178, USA.
Целлюлаза RS: Yakult Honsha Co., Ltd., 1.1.19 Higashi-Shinbashi, Minato-ku, Tokyo, 105 Japan.
GelRiteR: GelRite Gellan Gum, Scott Laboratories Inc., Fiskerville, R.I. 02823, USA. GeneScreen PlusR: Cat. No. NEF 976, NEN Research Products, 549 Albany St., Boston, MA 02118, USA.
IBI Random primer kit: 'Prime Time' random primer kit, International Biotechnologies Inc., PO Box 1565, New Haven, CT 07606, USA.
NalgeneR filter: Nalge Co., Division of Sybron Corp., Rochester, N.Y., 14602, USA.
Пектолаза Y-23R: Seishin Pharmaceutical Co., Ltd., 4-13 Koami-cho, Nihonbashi, Tokyo, Japan.
ParafilmR: ParafilmR лабораторная пленка - American Can Co., Greenwich, CT 06830, USA.
SSC: 1,54 мМ NaCI, 0,154 мМ цитрат натрия.
Спин колонка: SephadexR G25 предварительно приготовленная колонка, Cat. No. 100402, Boehringer Mannheim Biochemicals, Piscataway, NJ, USA.
TAE буфер и TBE буфер: Трис-ацетатный буфер и Трис-боратный буфер, соответственно - обычные для электрофореза, Maniatis et al., см. выше.
1. Основные методики.
Эта группа примеров описывает основные приемы, используемые для выполнения последующих конкретных примеров.
Пример 1. Лигирование в агарозе.
Вслед за расщеплением с помощью рестриктаз плазмиды ДНК и электрофоретическим разделением фрагментов на TAE геле с низкой температурой плавления, цепи, содержащие соответствующие фрагменты, точно иссекают и нагревают до 65oC, чтобы расплавить агарозу. 2-5 мкл добавляют к 15 мкл воды и раствор выдерживают при 65oC в течение 10 минут. Этот раствор охлаждают до 37oC и выдерживают в течение 5 минут, чтобы уравновесить температуру. 2 мкл 10 X буфера лигазы (200 мМ Трис, pH 8,0, 100 мМ MgCl2 100 мМ DTT, 10 мМ АТФ) добавляют вместе с 1 мкл T4 ДНК лигазы (New England BioLabs), и этому раствору дают возможность отверждаться и выдерживают в термостате при 15oC в течение ночи.
Пример 2. Трансформация из агарозы.
Агарозу, содержащую соответствующую ДНК, расплавляют путем термостатирования при 65oC в течение 10 минут. 10 мкл этого раствора добавляют к 30 мкл TE буфера (10 мМ Трис, pH 7,5, 1 мМ EDTA), перемешивают и дают возможность отстояться при комнатной температуре. Замороженные компетентные клетки (E. coli, штамм DH5 α ) помещают на влажный лед для оттаивания. Разбавленный раствор ДНК добавляют к 200 мкл клеток и выдерживают на льду в течение 20 минут. Клетки, содержащие ДНК, затем подвергают быстрому нагреву в течение 90 секунд при 41oC. Клетки затем выдерживают при комнатной температуре в течение 10 минут. 0,8 мл SOC среды (Hanahan D., J. Mol. Biol., 166, 557-580 (1983)) добавляют и культуру термостатируют при 37oC в течение 1 часа. 100 мкл культуры высевают на LB чашки (Miller, см. выше), содержащие 100 мкг/мл ампициллина (L-amp) и чашки термостатируют в течение ночи при 37oC. Отбирают положительные колонии и переносят на вторую L-amp чашку и чашки термостатируют при 37oC в течение ночи.
Пример 3. Блоттинг по Саузерну.
3 мкг ДНК табака расщепляют с помощью различных рестриктаз в условиях, предлагаемых производителем. ДНК экстрагируют фенолом, осаждают этанолом и затем повторно суспендируют в геле, наполненным буфером (15% фикол, 0,025% бромфенол синий, 10 мМ EDTA, pH 8). Образцы дозируют и подвергают электрофорезу на 0,5% агарозном геле при 5 V/см до тех пор, пока бромфеноловый синий краситель не достигнет конца геля. ДНК переносят в Gene-Screen Plus (DuPont), используя методику щелочного переноса, как описано производителем. Предгибридизацию, гибридизацию и промывку проводят согласно рекомендациям производителя. Гибридизацию определяют с помощью авторадиографии.
Пример 4. Молекулярные адаптеры.
Типичный молекулярный адаптер представляет собой последовательность
5'-GGGATCCCTGCA-3'
для конверсии PstI сайта в BamHI сайт. Эту молекулу синтезируют на
прикладном биосистемном синтезаторе, используя B-цианоэтилфосфорамидатный метод и очищают HPLC с обращаемой фазой. Около 2 мкг этого олигонуклеотида подвергают действию киназы согласно Maniatis et al.,
см. выше, с.125. Раствор олигонуклеотида нагревают до 65oC на водяной бане и охлаждают до комнатной температуры в течение около 30 минут. Приблизительно 10-кратный молярный избыток этого
нагретого адаптера добавляют к переваренной ДНК вместе с 10 X буфером лигазы, T4 ДНК лигазы и соответствующим количеством воды. Типичная реакция представляет собой:
ДНК, подлежащая адаптации
- 1-2 мкл (≈ 1 пмоль)
Адаптер - 1 мкл (≈ 10 пмоль)
10 X буфер лигазы - 1 мкл
T4 ДНК лигазы - 1 мкл
Вода - 5-6 мкл
Этот раствор термостатируют
при 12-15oC в течение 30 минут и нагревают до 65oC в течение 30 минут, для того чтобы инактивировать лигазу. Концентрацию соли и объем регулируют для соответствующей рестрикции
расщепления и адаптированную ДНК расщепляют для того, чтобы обнажить "липкий конец". Невключенные адаптеры удаляют либо электрофорезом на агарозном геле, либо последующими осаждениями
изопропанолом.
Пример 5. Картирование развертывания праймера.
А. Синтез и мечение 5'-фланкирующего участка последовательности праймеров для удлинения праймеров.
Следующие олигомеры праймера синтезируют, используя прикладной синтезатор биосистем и β -цианэтилфосфоримидатной метод:
PR-1: 5'-ATAGTCTTGTTGAGAGTT-3'
GUS:
5'-TCACGGGTTGGGGTTTCTAC-3'
AHAS: 5'-AGGAGATGGTTTGGTGGA-3'
BT: 5'-ATACGTTCTACTATCATAGT-3'
Олигонуклеотиды очищают методом жидкостной хроматографии высокого давления с
обращаемой фазой (HPLC). 5 пмоль каждого олигонуклеотида подвергают действию киназы (Maniatis N. et al., см. выше, на стр.125), используя 200 мкК32P-АТФ (6000 Ci/ммоль, 10 μ
Ci/ μ 1). После термостатирования при 37oC в течение 30 минут реакционную смесь разбавляют до 100 мкл, экстрагируют смесью фенол/хлороформ и затем трижды переосаждают с 50 мкг
носителя РНК. Получающийся осадок повторно суспендируют в 1 кратном буфере обратной транскриптазы (50 мМ трис-HCl, pH 7,5, 40 мМ KCl, 3 мМ MgCl2) при концентрации 2 нМ. Как определено,
удельная активность меченого олигонуклеотида составляет около 3 • 106 Cvcpm/пмоль.
B. Приготовление общей РНК.
Общую РНК приготавливают в основном, как описано Lagrimini L.M. et. al., Proc. Natl. Acad. Sci. USA 84, 7542 (1987). Ткань измельчают в жидком азоте в ступке пестиком. Размельченную ткань добавляют к диспергирующему буферу (Lagrimini et al. , см. выше), используя 2,5 мл на грамм ткани. Затем добавляют равный объем фенола и эмульсию гомогенизируют в политроне Брикмана. Добавляют пол-объема хлороформа и эмульсию осторожно перемешивают в течение 15 минут. Фазы разделяют центрифугированием и водную фазу удаляют. РНК осаждают добавлением ацетата натрия до 0,3 М и 2,5 объемов этанола. Осадок собирают центрифугированием и повторно суспендируют в 2 мл стерилизованной воды. Добавляют хлорид лития до конечной концентрации 3 М и выдерживают в течение ночи при 4oC. Осадок собирают центрифугированием и шарик промывают 80% этанолом, охлажденным льдом. Шарик сушат и вновь суспендируют в 500 мкл стерилизованной воды. Концентрацию приготовленной таким образом РНК определяют спектрофотометрически. С другой стороны, РНК экстрагируют из каллюса, как описано выше, за исключением того, что ткань каллюса режут на кубики размером приблизительно 3 мм, и помещают в предварительно охлажденную ступку с пестиком для измельчения в жидком азоте, предшествующему стадии гомогенизации в политроне.
C. Удлинение праймера.
50 мкг общей РНК лиофилизируют в 500-мкл пробирке Эппендорфа. РНК вновь суспендируют в 30 мкл раствора радиоактивной меченой пробы и нагревают до 70oC в течение 10 минут. Пробирку медленно охлаждают до 37oC и термостатируют в течение ночи. Не удаляя пробирку из водяной бани, термостатированной при 37oC, добавляют 2 мкл 10 кратного буфера обратной транскриптазы (500 мМ Трис-HCl, pH 7,5, 400 мМ KCl, 30 мМ MgCl2), 1 мкл 5 мг/мл сыворотки бычьего альбумина, 5 мкл 100 мМ дитиотреитола, 5 мкл 10 X dNTPs (10 мМ каждого dNTP в H2O), 3 мкл H2O, 2 мкл RNasin (80 единиц) и 2 мкл обратной транскриптазы (400 единиц) и реакционную смесь термостатируют при 37oC в течение 30 минут. Для того, чтобы остановить реакцию, добавляют 5 мкл 3 М ацетата натрия, pH 5, и 150 мкл абсолютного этанола. Пробирку выдерживают при -20oC в течение 30 минут, осадок собирают центрифугированием, промывают 80% этанолом и сушат на воздухе. Осадок повторно суспендируют в 10-20 мкл загруженного красителя (90% формамид, 0,05% бромфенол синий, 0,05% ксилол цианол, 1 мМ EDTA) и продукты удлинения отделяют на 6% программированном геле (Maniatis Т. et al., см. выше). Продукты удлинения визуализируют методом авторадиографии.
Пример 6. Картирование с помощью S1 нуклеазы.
Плазмиду pBS-PR1013Cla расщепляют SfaNI, дефосфорилируют кишечной фосфатазой кишок теленка и подвергают действию киназы с32P-АТФ. После экстракции фенолом и осаждения этанолом, ДНК расщепляют BstEII и фрагмент размером 306 bp от 750 до 1035 на фиг.1 изолируют после электрофореза на агарозном геле с низкой температурой плавления. Пробу повторно суспендируют в формамидном гибридизационном буфере (Berk A.J. et al., Cell 12, 721 (1977)) с концентрацией около 2 нМ. Удельная активность пробы составляет приблизительно 5 • 10 Cvcpm/пмоль.
Лиофилизованную общую РНК (50 мкг) растворяют в 30 мкл раствора пробы, и пробирки нагревают до 65oC в течение 10 минут, затем оставляют для гибридизации в течение ночи при 48oC. Обработку нуклеазой S1 и электрофорез на геле в основном проводят, как описано, используя концентрацию S1 400 единиц/мл и температуру термостатирования 30oC. Соответствующую концентрацию S1 нуклеазы определяют в контрольных экспериментах.
Пример 7. Картирование сайта начала транскрипции.
Сайт начала транскрипции для PR-1a гена определяют комбинацией картирования S1 нуклеазы и анализа предусматривающего удлинение праймера. Исследуют авторадиограмму эксперимента по удлинению праймера, используя либо РНК, выделенную из TMV-инфицированных листьев, либо mp19 субклон фрагмента XhoI-PstI в качестве матрицы и олигонуклеотид, состоящий из 17 оснований, комплементарный последовательности в 1025-1042 положениях PR-1a последовательности в качестве специфического праймера. Сам праймер метят в положение 5'-фосфата, поэтому размер продукта удлинения будет идентичным размеру соответствующей полосы в секвенируемых промежутках. Появление двух сильных полос, соответствующих положениям 902 и 903, и слабой полосы в положении 901 геномного клона подтверждает транскрипцию, начинающуюся в любом из этих положений. Однако анализ удлинения праймера сам по себе не может быть использован для идентификации 5'-фланкирующего участка последовательности иРНК.
Чтобы определить окончательно 5'-фланкирующий участок последовательности, используют картирование высокого разрешения с помощью S1 нуклеазы в соединении с развертыванием праймера. Фрагмент SfaNI метят в положение 5'-фланкирующего участка последовательности и расщепляют BstEII, получая однонитевую специфическую пробу, соответствующую положениям от 759 до 1040. Эту пробу используют, чтобы нанести на карту 5'-фланкирующий участок последовательности PR-1a транскриптов в РНК, выделенной из TMV-инфицированных листьев табака. Находят основную полосу 137±2 оснований, которая соответствует положениям от 901 до 905 геномного клона. В высокоразрешающих экспериментах по SI картированию, где продукты расщепления подвергают электрофорезу совместно со стандартом размера последующих реакций, выполненных в пробе, отмечают три полосы, соответствующие положениям 901, 902 и 903. Эти результаты подтверждают анализ удлинения праймера и место 5'-фланкирующего участка последовательности PR-1 иРНК в любом положении 901, 902 или 903. Что касается инициирования транскрипции, то одна из возможных интерпретаций этих результатов заключается в том, что РНК полимераза начинает транскрипцию при любом основании 901, 902 или 903 с более или менее равной вероятностью. Однако, поскольку эукариотическая транскрипция благоприятствует инициации при A, более вероятное объяснение для кажущейся сложной структуры 5'-фланкирующего участка последовательности состоит в том, что иРНК PR-1A начинается в положении 903 (А) а иРНК PR-1b и -1c начинается каждая в других положениях на их соответствующих генах.
2. Идентификация и характеристика белка.
PR-белки, соответствующие этим примерам, выделяют, очищают и выстраивают в последовательность, в некоторых случаях впервые и в соответствии с литературными методиками в других случаях, с целью подтверждения способности генов к химическому возбуждению.
Пример 8. Очистка PR-1A и PR-1b белков.
Растения Nicotiana tabaccum cv. Xanthi выращивают в теплице и заражают через 8 недель путем легкого перетирания листьев суспензией обычного штамма (UI) TMV (0,5 мкг/мл). Листья собирают через 7 дней после заражения и внутриклеточную жидкость (ICF) листьев и собирают согласно Parent J.G. et al., Can. J. Bot. 62, 564 (1984). 250 мл ICF концентрируют до 50 мл путем лиофилизации и загружают в колонку Ultragel ACA54, уравновешенную с Трис-HCl, pH 8,0 и 1 мМ EDTA. Элюаты анализируют методом электрофореза на 10% полиакриламидных гелях. Фракции, содержащие PR-1 белки, объединяют, лиофилизируют, повторно суспендируют в 3 мл воды и затем диализуют в течение ночи против воды. Этот осадок далее очищают с помощью HPLC анионно-обменной хроматографией на TSK-DEAE 5PN колонке. Колонку элюируют раствором с градиентом концентрации 0-0,6 М NaCI в 50 мМ Трис-HCl, pH 8,0, 1 мМ EDTA. Фракции анализируют методом электрофореза на полиакриламидном геле (PAGE). PR-1b элюирует первым из колонки при 0,18 М NaCl и PR-1a элюируется при 0,28 М NaCl. Фракции, содержащие каждый белок по отдельности, собирают вместе, диализуют против воды и лиофилизируют. Чистоту приготовления белков PR-1a и PR-1b подтверждают методом жидкостной хроматографии высокого давления с обращаемой фазой, используя колонку Aquapore фенил (2,1 x 100 мм, Brownlee) и элюируя с линейным градиентом (5-80%) концентрацией смеси ацетонитрил/изопропанол (1: 1) в 0,1 TFA.
Пример 9. Определение последовательности белка.
Очищенный, лиофилизированный PR-1a белок растворяют в 6 М гуанидин-HCl, содержащем 1 М Трис-HCI, pH 8,6, 10 мМ EDTA. Дитиотреитол добавляют до концентрации 20 мМ и 4-винилпиридин добавляют до конечной концентрации 50 мМ. Затем образец термостатируют в течение 1,5 часов в атмосфере азота. Пиридилэтилированный материал обессоливают методом жидкостной хроматографии высокого давления, используя колонку Aquapore фенил (2,1 x 10 см, Brownlee). Колонку элюируют смесью ацетонитрил/изопропанол (1:1) с линейным градиентом 5-80% концентраций в 0,1% трифторуксусной кислоты (TFA).
Автоматизированные деградации по Edman осуществляют на газообразном секвенторе Applied Biosystems 470A. Фенилтиогидантоин (PTH)аминокислоты идентифицируют с помощью анализатора Applied Biosystems 120A PTH.
Цианогенбромидное расщепление проводят in situ согласно Simpson R.J. et al. , Biochem. Intl. 8, 787 (1984). PR-1 с пироглютаматом аминопептидазы (Boehringer Mannheim) проводят согласно Alien G., Plant Sci. Lett. 26, 173 (1982).
PR-1a расщепляют эндопротеиназой Lys-C (Boehringer Mannheim) в 0,1 М Трис-HCI, pH 8,5, в течение 24 часов при комнатной температуре, используя фермент, чтобы получить субстрат в отношении 1:10. Пептиды выделяют методом жидкостной хроматографии высокого давления, используя колонку Aquapore (1 x 22 см, Brownlee) смесью ацетонитрил/изопропанол (соотношение 1:1) с линейным градиентом (от 0 до 60%) концентраций в 0,1% EDTA/.
Расщепление N-концевого Lys-C пептида трипсином (Cooper) осуществляют в 0,1 М бикарбонате аммония, pH 8,2, содержащем 0,1 М хлорида кальция в течение 5 часов при 37oC, используя фермент, чтобы получить субстрат с соотношением 1: 100. Два генерированных пептида разделяют методом жидкостной хроматографии высокого давления (HPLC), используя те же самые условия, как и для Lys-C пептидов.
Пример 10. Последовательность белка PR-1a пептидов.
Корреляция последовательности ДНК трех клонов кДНК с PR-1a, -1b и -1с белков первоначально сделанная Cornellissen B.J.C. et al., (см. выше), основана на сравнении опубликованных данных последовательности белка трех пептидов, выведенных из PR-1a (Lucas J. et al., EMBO J. 4, 2745 (1985)) и первичной структуры белка, выведенного из клонов кДНК. Однако клон кДНК, обозначенный как PR-1a, отрезают под прямым углом к длинной оси на 5'-фланкирующей последовательности и сравнивают лишь с двумя из трех пептидов с ошибочным спариванием одного остатка. Кодированная аминокислотная последовательность, выведенная из кДНК, приготовленная и анализированная, как указано выше, и последовательность PR-1a кДНК по Pfitzner U.M. et al., (см. выше), не только содержит ошибочное спаривание остатка триптофана опубликованной последовательности белка, но также и ошибочное спаривание трех других остатков на аминоконцевой белковой последовательности. Эта аномалия ставит под сомнение идентификацию этого клона как PR-1a. Поэтому идентичность tobchrPR1013 клона и PR-1a гена подтверждают путем определения большой части первичной структуры очищенного PR-1a белка по порядку следования аминокислот.
Данные по порядку чередования аминокислот для PR-1a белка сравнивают с аминокислотными последовательностями, выведенными из кДНК клонов для PR-1a, -1b и -1c. Данные по последовательности кДНК, использованные в анализе, представляют собой кДНК клоны, изолированные, как упомянуто выше, и последовательности по Pfitzner U.M. et al, (см. выше), которые совпадают по каждому положению. Определяют свыше 80% последовательностей созревшего PR-1a белка и эта последовательность соответствует последовательности выделенного белка для tobchrPR1013. При сравнении выведенной аминокислотной последовательности, полученной из предполагаемых PR-1b и PR-1c кДНК клонов (Cornelissen B.J.C. et al., см. выше), находят 7 или 6 неправильных спариваний соответственно. Таким образом, данные ясно демонстрируют, что tobchrPR1013 действительно является клоном PR-1a гена.
3. Получение клонов.
Эта группа примеров описывает клоны, приготовленные в результате выделения генов, и идентификацию химически регулируемых последовательностей и химерные гены, содержащие эти последовательности.
Пример 11. Приготовление tobchrPR1013.
Ядра выделяют из листьев Nicotiana tabaccum путем первичного замораживания 35 г ткани в жидком азоте и растирания в мелкий порошок с помощью ступки и пестика. Этот порошок добавляют к 250 мл перемешанного буфера (0,3 М сахарозы, 50 мМ Трис, pH 8,5, 5 мМ хлорида магния, 5 мМ бисульфита натрия, 0,5% NP40) и перемешивают на льду в течение 10 минут. Эту смесь фильтруют через шестислойную марлю, жидкость переносят в центрифужные пробирки и подвергают центрифугированию при 700 • g в течение 10 минут. Гранулы дважды ресуспендируют в буфере при перемешивании и рецентрифугируют. Затем гранулы вновь ресуспендируют в буфере при перемешивании и эту суспензию наслаивают на 20 мл холодной сахарозной подушки, содержащей 10 мМ Триса, pH 8, 1,5 мМ хлорида магния, 140 мМ хлорида натрия, 24% сахарозу и 1% NP40. Эти пробирки центрифугируют при 17000 • g в течение 10 минут. Гранулы в этой стадии содержат в основном ядра и зерна крахмала. ДНК с высоким молекулярным весом выделяют из ядер в соответствии с методом Maniatis T. et al., (см. выше). ДНК частично расщепляют с помощью MboI и лигируют в BamHI сайт EMBL3 клонирующего вектора. Приблизительно 300000 бляшек скринируют с помощью меченой кДНК PR-1b в качестве зонда. 50 положительных клонов выделяют и изучают. Положительные бляшки очищают и изучают с помощью рестриктного анализа. Эти колны классифицируют на 8 различных групп путем рестриктного картирования. Один из купонов идентифицируют как tobchrPR1013. Неполная рестриктная карта tobchrPR1013 показана на фиг. 1. Выделение ДНК и манипуляции с ДНК проводят в соответствии с описанным Maniatis T. et al., (см. выше).
Пример 12. Получение pBS-PR1013Cla.
Фрагмент ClaI из клона tobchrPR1013 субклонируют в Bluescript плазмиду (Stratagene Cloning Systems), получая в результате pBS-PR1013Cla (см. фиг. 2). XhoI-BglII фрагмент размером 2 kb из pBS- PR1013Cla секвенируют и находят, что его положение с 913 по 1711 (последовательность 1) точно соответствует последовательности кДНК клона, клона для PR-1a, выделенного Pfitzner U. M. et al., (см. выше). Возможные перестановки ДНК табака в процессе клонирования исключают путем предварительного анализа рестриктных фрагментов генома ДНК. На основании данной последовательности и рестриктной карты pBS-PR1013Cla, обработка генома табачной ДНК EcoRI, HindlII, XhoI+BglII или HindIII+PstI должна привести к образованию фрагментов размером 3,2 kb, 6,7 kb, 2,0 kb или 6,4 kb, соответственно, которые содержат PR-1a ген. Для того, чтобы проверить это предположение 3 мкг табачной хромосомной ДНК расщепляют соответствующими ферментами и подвергают электрофорезу на 0,7% геле агарозы. ДНК переносят на нейлоновую мембрану и зондируют меченым рестриктным фрагментом из гена PR-1a. Для контроля ДНК pBS- PR1013Cla обрабатывают и подвергают электрофорезу на том же самом геле. Как и предполагалось, продукты расщепления EcoRI, HindIII, XhoI+BglII и HindIII + PstI образуют полосы с ожидаемым молекулярным весом, которые одинаково мигрируют с контрольными полосами. Следовательно, ДНК, содержащаяся в клоне tobchrPR1013 представляет собой смежные участки ДНК генома табака.
Пример 13. Получение pBS-PR1013Eco.
A. Плазмиду pBS-PR1013Eco конструируют путем субклонирования фрагмента размером 3,6 kb EcoRI, содержащего ген PR-1a из tobchrPR1013 (пример 9) в определенный EcoRI сайт bluescript плазмиды. Bluescript плазмиду (каталог 21203) получают из Stratagene Cloning Systems, La Jolla, California. Структуру pBS-1013Eco подтверждают рестриктным картированием и определением последовательности ДНК. Эта конструкция плазмиды показана на фиг.3.
B. Альтернативно, плазмиду pBS-PR1013Cla расщепляют EcoRI и выделяют размером 3,6 kb фрагмент, содержащий PR-1a ген. pBluescript обрабатывают EcoRI, смешивают и присоединяют к предварительно выделенному EcoRI фрагменту размером 3,6 kb. Эта конструкция плазмиды показана на фиг.4.
Пример 14. Получение pBS-PR1013Eco Δ Pst.
Плазмиду pBS-PR1013Eco обрабатывают PstI и разделяют фрагменты ДНК на 2,5% легкоплавком геле агарозы. Большой фрагмент, содержащий вектор bluescript и фрагмент табачной ДНК размером 3,0 kb, точно вырезают и нагревают до 65oC для расплавления агарозы. 2 мкл добавляют к 15 мл воды и связывают ДНК в агарозе, как описано в примере 1. После инкубации в течение ночи агарозу, содержащую ДНК, расплавляют путем инкубации при 65oC в течение 10 минут и затем выделяют из агарозы в соответствии с тем, как описано в примере 2. Часть бактериальной культуры содержащей 6 предполагаемых положительных конструкций, вводят в 5 мл LB среды (Miller, см. выше), содержащей 100 мкг в мл ампициллина, и эту культуру инкубируют при 37oC в течение ночи. Клетки собирают центрифугированием в клинической центрифуге на полной скорости в течение 10 минут. Супернатант удаляют, а клетки ресуспендируют в 100 мкл 50 мМ глюкозы, 25 мМ Tris, pH 7,5, 10 мМ EDTA, и эту суспензию переносят в 1,5 мл центрифужную пробирку Эппендорфа. Добавляют 25 мкл свежеприготовленного 10 мг/мл раствора лизоцима и суспензию оставляют на льду на 10 мин. Затем добавляют 200 мкл 0,2 N гидроксида натрия, 1% додецилсульфата натрия, и эту суспензию перемешивают и оставляют на льду на 2 мин. Добавляют 200 мкл 2 М ацетата натрия (pH 4,8), раствор ставят на 15 минут на лед. Полученный раствор подвергают центрифугированию в центрифуге Эппендорфа в течение 10 мин. Супернатант переносят в чистую центрифужную пробирку, экстрагируют с помощью 400 мкл фенол/хлороформа (1:1). Водную фазу переносят в чистую пробирку и извлекают 400 мкл хлороформа. Водную фазу после экстракции переносят в чистую пробирку и осаждают ДНК путем добавления двух объемов этилового спирта и выдерживают при температуре -20oC в течение 30 минут. Преципитированную ДНК собирают центрифугированием в микрофуге Эппендорфа на полной скорости в течение 15 минут. Этиловый спирт удаляют, а гранулы отмывают 80% этиловым спиртом. Этиловый спирт вновь удаляют, а гранулы сушат на воздухе. ДНК ресуспендируют в 100 мкл ТЕ буфера. Конструкции верифицируют путем обработки PstI. Родительская плазмида pBS- PR1013Eco дает фрагменты размером от 6 kb до около ≈650 kb, меньшая из которых теряется в новых конструкциях. Одну из плазмид обозначают как pBS- PR1013Eco Δ Pst. Структуру этого клона определяют с помощью анализа последовательности. Конструкция этой плазмиды показана на фиг.5.
Пример 15. Получение pBS-PR1013EcoΔPstXho
Определяют рестриктную карту pBS-PR1013Eco. Сайт рестрикции XhoI локализуется примерно на 1200 bp выше
PstI сайта. Плазмиду pBS-PR1013EcoΔPst обрабатывают XhoI и фрагменты разделяют на 0,9% легкоплавком геле агарозы, визуализируют два фрагмента с размерами 3,9 kb и 1,7 kb. Полосу, содержащую
фрагмент размером 3,9 kb, аккуратно вырезают из геля и связывают в агарозе в соответствии с описанным выше. Агарозу расплавляют, а ДНК трансформируют в компетентные клетки E. coli штамма HB101, как
описано выше. Клетки высевают на LB-amp чашки и инкубируют, как описано выше. Одну из предположительно положительных колоний вводят в LB-amp среду, а ДНК выделяют в соответствии с описанным. Структуру
этого нового субклона pBS-PR1013EcoΔPstΔXho определяют путем рестриктного анализа и секвенирования ДНК. Фиг.6 показывает конструкцию этой плазмиды.
Пример 16. Получение
pCIB270
Плазмида pBI101.3 (каталог N 6024.1) получена из Clonetech Labs, Palo Alto, California. Эту плазмиду сначала расщепляют BamHI и затем SalI. Плазмиду pBS-PR1013EcoΔPstΔ
Xho расщепляют PstI. PstI/BamHI адаптор, имеющий последовательность
5'-GGGATCCCTGCA-3'
приготавливают, как описано в примере 4, и присоединяют к обработанной PstIpBS-PR1013EcoΔ
PstΔXho. Полученный в результате продукт расщепляют сначала BamHI, а затем XhoI. BamHI/XhoI фрагмент выделяют, смешивают и лигируют к обработанному pBI101.3, и трансформируют. Предположительно
положительный клон pCIB270 выделяют и определяют путем рестриктного анализа и анализа последовательности ДНК. Получение плазмиды показано на фиг.7.
Пример 17. Получение M13mp18- или mpl9-PR1013Eco Δ Pst Δ Xho.
Плазмиду pBS-PR1013EcoΔPstΔXho расщепляют PstI и Asp718.
Asp718/PstI фрагмент размером 1,1 kb выделяют после электрофореза на 1% ТАЕ легкоплавком геле агарозы. Репликативную форму (RF) coli фага M13mp18 или M13mp19 приготавливают по Messing J., Meth. Enzymol. 101, 20 (1983). Аналогично, эти векторы могут быть получены из Bethesda Research Labs, Gaithersburg, Maryland. Каждый вектор сначала обрабатывают Asp718, а затем PstI. После удаления полилинкерных участков путем электрофореза на 0,7% TAE легкоплавком геле агарозы; полученный в результате вектор RF смешивают и лигируют в агарозе с фрагментом размером 1,1 kb, приготовленным ранее. ДНК трансформируют, предположительно положительные бляшки выделяют и их структуру определяют путем анализа RF ДНК. Конструкции M13mp18- и mp19-PR1013EcoΔPstΔXho показаны фиг.8.
Пример 18. Получение M13mp18- или mp19-PR1013EcoΔPstΔXho.Nco pCIB268.
Однонитевую ДНК фага M13mp18-PR1013EcoΔPstΔXho выделяют по Messing, (см. выше). Олигонуклеотидный праймер размером 18
bp с последовательностью
5'-AATCCCATGGCTATAGGA-3'
синтезируют, как описано выше. Праймер фосфорилируют с T4 полинуклеотидкиназой (Maniatis T. et al., см. выше, на стр.125), используя
немеченый АТФ. После инкубации при 37oC в течение 60 минут реакционную массу нагревают до 68oC в течение 15 минут и затем помещают на лед. Этот праймер и M13-40 праймер,
используемый для определения последовательности, (New England Biolabs #1212) легируют с однонитевой ДНК M13mp18-PR1013EcoΔPstΔXho после смешивания в молярной пропорции 1:1:1, и медленно
охлаждая после прогрева в течение 10 минут при температуре 68oC. Легированную смесь помещают на лед и добавляют 1/10 объема 10 X буфера для элонгации (20 мМ Трис Буфера, pH 7,5, 6 мМ
хлорида магния, 1 мМ ДТТ, 1 мМ dATP, 1 мМ dCTP, 1 мМ dGTP и 1 мМ dTTP). Добавляют 10 единиц большого фрагмента ДНК полимеразы (фрагмент Кленова, New England Biolabs # 210) и 0,1 единицы T4 ДНК лигазы
(NEB #202) и реакцию продолжают в течение 14 часов при температуре 15oC. В этот момент добавляют дополнительные аликвоты каждого фермента и реакцию проводят еще в течение дополнительных 2
часов при температуре 25oC перед тем, как смесь используют для трансформации компетентных клеток E. coli JM101. Общая дополнительная схема этой методики представлена на фиг.9.
Для идентификации мутантного фага бляшки анализируют методом Gene Screen Plus (DuPont), процесс проводят в соответствии с рекомендациями производителя. Фильтры предгибридизуют в течение 4 часов и гибридизуют в течение ночи при температуре 42oC в фабричном гибридизирующем растворе, содержащем 0,9 М хлорида натрия. Затем фильтры последовательно промывают хлоридом натрия в концентрации 0,9 М и контролируют с помощью авторадиографии, увеличивая температуру воды, которую используют для промывки, на 5oC на каждом этапе. Фаги, идентифицированные в процессе гибридизации как мутантные, подвергают сиквенсу для выявления изменений.
Репликативную форму одного такого кандидата M13mp18-PR1013EcoΔPstΔXho.Nco выделяют и расщепляют PstI и BrnEII для получения фрагмента длиной 394 bp, который используют для замещения соответствующего немутантного 394 bp фрагмента в pBS-PR1013EcoΔPstΔXho, как показано на фиг.10. В результате получают плазмиду pCIB268, которая имеет NcoI сайт в позиции 930, за которым следует кодирующая последовательность размером 217 bp для PR-1a гена. Структуру этой плазмиды подтверждают анализом последовательности.
Пример 19. Получение химерных генов, содержащих HUS и PR-промоторную последовательность различной длины
A. Конструкция pCIB269.
Фрагмент 930 bp выделяют после электрофореза pCIB268, расщепленной XhoI и NcoI в 1% легкоплавком агарозном TAE геле. Этот фрагмент затем лигируют с XhoI и NcoI фрагментом pBS-GUS1.2 (см. пример 19B).
Трансформанты выделяют и анализируют с помощью рестриктного анализа и анализа последовательности ДНК. Выбирают одну положительную плазмиду и называют pCIB269. Конструкция этой плазмиды показана на фиг.11.
B.Конструкция pBS-GUS1.2.
pBS-GUS1.2 создают путем тройного лигирования SalI/SnabI фрагмента размером 391 bp из pRAJ265 (Jefferson R.A. et al., EMBO J. 6, 3091-3907 (1987) и GUS User Manual, Clonetech Labs., Palo Alto, Ca.) с SnabI/EcoRI фрагментом размером 1707 bp из pB1221 (Jefferson R.A., et al., EMBO J., см. выше) и с pBS, расщепленной с SalI и EcoRI, см. фиг.12. Трансформанты анализируют с помощью рестриктного анализа и анализа ДНК-последовательности. Один отобранный клон называют pBS-GUS1.2.
C. Конструкция pCIB200.
Сначала TJS75Kan получают путем расщепления pTJS75 (Schmidhauser и Helinski, J. Bacteriol. 164, 446-455 (1985)) с помощью NarI для извлечения тетрациклинового гена с последующей вставкой AccI фрагмента из pUC4K (Messing T. и Vierra J. , Gene 19, 259-268 (1982)), несущего NptI ген. Затем создают pCIB200 путем лигирования XhoI линкеров с EcoRV фрагментом pCIB7 (содержащим левую и правую T-ДНК границы, растительный селективный химерный nos/nptII ген и pUC полилинкер, Rothstein S.J. et al., Gene 53, 153-161 (1987)) и клонирования XhoI расщепленного фрагмента в TJS75Kan, расщепленную SalI.
D. Конструкция pCIB271.
Плазмиду pCIB269 (пример 19A) расщепляют XhoI и EcoRI и фрагмент размером 3023 bp, несущий PR-1a промотор, связанный с GUS геном с nos 3' конца последовательности, затем выделяют последующим электрофорезом на 1,0% легкоплавком агарозном TAE геле. Этот фрагмент затем встраивают в вектор pCIB200, который был расщеплен SalI и EcoRI. Трансформанты выделяют и анализируют путем рестриктного анализа. Один из отобранных клонов называют pCIB271. Конструкция этого клона показана на фиг.13.
E. Конструирование pCIB272.
pCIB268 (пример 18) расщепляют AluI и NcoI и выделяют фрагмент размером 833 bp после электрофореза на 1 кратном TAE 0,7% геле агарозы. Этот фрагмент лигируют геном β-/ глюкуронидазы с nos 3'-конца последовательности pBS-GUS1.2 (пример 19B). Промотор и GUS затем вырезают из этой плазмиды, названной pCIB282, в виде Asp7181/BamHI фрагмента и встраивают в pCIB200, которая была расщеплена с Asp7181 и BamI перед трансформацией в E. coli, штамма DH5α. Трансформанты выделяют и анализируют путем рестриктного анализа. Один отобранный клон называют pCIB272.
F. Конструкция pCIB273.
pCIB268 расщепляют HaeIII плюс NcoI и выделяют фрагмент размером 603 bp после электрофореза на 1 X TAE 0,7% геле агарозы. Этот фрагмент встраивают перед геном β- глюкуронидазы с 3'-конца последовательности pBS-GUS1.2. Промотор и GUS затем вырезают из этой плазмиды pCIB283, в виде Asp7181/BamHI фрагмента и встраивают в pCIB200, которая была расщеплена Asp7181 и BamHI перед трансформацией в E. coli штамма DH5 α . Трансформанты выделяют и анализируют путем рестриктного анализа. Один отобранный клон называют pCIB273.
Пример 20. Получение химерного гена в гигромициновом векторе.
pCIB269 расщепляют XhoI и EcoRI и фрагмент размером 3023 bp, несущий
PR-1a промотор, связанный с GUS геном с nos 3'-конца последовательности, выделяют последующим электрофорезом на 1% легкоплавком геле агарозы. Этот фрагмент затем превращают в XhoI/SalI фрагмент путем
лигирования с EcoRI/SalI адаптером, имеющим последовательность
5'-AATTCGTCGACG-3'.
XhoI/SalI фрагмент встраивают в pCIB712, расщепленный SalI (Rothstein S. J. et al., см. выше), для получения pCIB219, см. фиг.14.
Пример 21. Приготовление pCIB200/PR1-BT.
A. Лигирование с pCIB200.
Плазмиду pCIB1004 (см. ниже) расщепляют
SphI, экстрагируют фенолом, осаждают этанолом и ресуспендируют. Олигонуклеотид с последовательностью
5'-CCGGTACCGGCATG-3'
синтезируют, очищают, обрабатывают киназой и встраивают в
плазмиду pCIB1004, расщепленную SphI. После лигирования лигазу инактивируют и ДНК расщепляют KpnI. Эту ДНК выделяют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB200 (пример 19C) расщепляют KpnI и
обрабатывают телячьей кишечной щелочной фосфатазой и обрабатывают на 0,8% легкоплавком геле агарозы. Полосу, содержащую pCIB200 вектор, и полосу, содержащую PR-1 с 5'-фланкирующим участком
последовательности BT, смешивают, и ДНК лигируют до образования плазмиды pCIB200/PR1-BT.
B. Получение pCIB1004.
Плазмиду pCIB10/35Bt (607) расщепляют NcoI и BamHI и оюрабатывают на 0,8% легкоплавком геле агарозы. Плазмиду pCIB269 (Пример 19A) расщепляют NcoI и XhoI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB710 (Rothstein S.J. et al., см. выше) расщепляют SalI и BamHI и обрабатывают на 0,8% легкоплавком геле агарозы. Полосу с SalI и BamHI фрагментом вектора, содержащим 3'-концевую последовательность промотора CaMV 35S, клонируют в pUCl9. Полосу, содержащую BT ген и полосу, содержащую 5'-фланкирующий участок последовательности PR-1, вырезают, смешивают и ДНК лигируют до образования плазмиды pCIB1004.
C. Получение pCIB10/35Bt (607).
pCIB10/35Bt (607), с делецией гена протоксина, содержащая последовательность, кодирующую приблизительно 607 аминокислот, приготавливают из плазмиды pCIB10/35Sbt, плазмиды, содержащей ген эндотоксина Bacillus thurigiensis. E. coli MC1061, содержащая pCIB10/35Sbt, передана на хранение в Коллекцию культур американского типа, ATCC N 67329, 27 февраля 1987 года. Ген протоксина с делецией получают путем вставки BamHI сайта расщепления (GGATCC) после нуклеотида 1976 в последовательности гена BT. Это делают путем клонирования BamHI фрагмента, содержащего последовательность протоксина из pCIB10/35Sbt в mp18, используя стандартные методики мутагенеза с использованием олигонуклеотидов. После мутагенеза готовят двунитевую репликативную форму ДНК из клона M13, которую затем расщепляют BamHI. Фрагмент размером приблизительно 1,9 kb, содержащий ген протоксина с делецией, встраивают в BamHI, расщепленную pCIB10/710. Полученную плазмиду отбирают на канамицине. Детальное описание представлено в заявке на патент США 122109, поданной 18 ноября 1987 года.
Пример 22. Приготовление pCIB1233 (pCIB200/PR1-AHAS).
A. Лигирование с pCIB200.
Плазмиду pCIB200 расщепляют KpnI и XbaI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB1216 расщепляют KpnI и XbaI и разгоняют на 0,8% легкоплавком геле агарозы. Полосу размером приблизительно 4,3 kb, содержащую 5'-фланкирующий участок последовательности PR-1, сливают с AHAS кодирующей последовательностью, и полосу, содержащую pCIB200 вектор вырезают, смешивают и ДНК лигируют с образованием pCIB1233.
B. Получение pCIB1216.
Плазмиду pCIB269 (пример 19a) расщепляют XbaI и NcoI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB1207 (см. ниже) расщепляют XbaI и NcoI и разгоняют на 0,8% легкоплавком геле агарозы. Полосу, содержащую bluescript вектор с 5'-фланкирующим участком последовательности PR-1 и полосу размером 3,3 kb, содержащую AHAS кодирующую последовательность, вырезают, смешивают с ДНК и лигируют до образования плазмиды pCIB1216.
C.
Приготовление плазмиды pCIB1207, содержащей ген Arabidopsis AHAS
Общую растительную ДНК выделяют из 5-недельной Arabidopsis thaliana колумбийского экотипа. 250 мкг этой ДНК расщепляют 4000
единицами рестриктазы XbaI в течение 4 часов. Продукты расщепления фракционируют путем электрофореза на 0,8% геле агарозы. Фрагменты ДНК размером 6,5 kb - 4,36 kb (на основе HindIII - расщепленных ДНК
фага лямбда в качестве маркеров размера), выделяют из геля, используя NA-45 DEAE мембрану (Schleicher и Schuell, Keene, NH, USA) в соответствии с методикой, рекомендуемой изготовителем. Lambda ongC
(longC), расщепленную XbaI и обработанную фосфотазой, получают из Stratagene Cloning Systems (La Jolla, CA, USA). 0,1 мкг XbaI фрагмента ДНК Arabidopsis лигируют с 1,0 мкг longC в соответствии с
методикой, рекомендованной Stratagene. 2,5 мкл продукта лигирования упаковывают в головки фага lambda, используя набор Gigapack Plus kit (Stratagene Cloning Systems) в соответствии с методикой,
рекомендованной изготовителем. Активность библиотеки определяют на E. coli VCS257 (Stratagene Cloning Systems).
50 мкг ДНК плазмиды pE16/8-c4 (J. Polaina, Carlsberg Res. Comm. 49, 577-584) расщепляют EcoRI и продукты расщепления выделяют на 0,8% геле агарозы. Фрагмент EcoRI размером 2 kb, содержащий кодирующую последовательность дрожжевого AHAS гена, выделяют из геля, используя NA45 DEAE мембрану в соответствии с методиками, рекомендуемыми изготовителем. Радиоактивномеченые зонды фрагмента размером 2 kb синтезируют в день реакции гибридизации методом случайного праймирования, используя набор Prime Time kit (International Biotechnologies Inc., New Haven, CT, USA) в соответствии с методиками, рекомендуемыми изготовителем.
250000 рекомбинантных фагов высевают на VCS257. Дубликат мембраны для выращивания фаговых бляшек изготавливают с использованием Colony/Plaque Screen мембран (NEN Research Products, Du Pont, Boston, MA, USA) в соответствии с методиками, рекомендуемыми изготовителем. Мембраны предгибридизируют в LS гибридизационном буфере, затем переносят в 150 мл свежего LS гибридизационного буфера, содержащего в качестве зонда 0,25 мкг меченного32P дрожжевого AHAS гена, приготовленного, как описано выше. Мембраны инкубируют в течение 16 часов при температуре 42oC при легком встряхивании, дважды отмывают 2XSSC при комнатной температуре в течение 15 минут на каждую промывку, отмывают 3 раза при температуре 42oC в LS промывочном буфере (25% формальдегида, 5XSSC, 1% SDS) в течение 2 часов на каждую промывку и дважды промывают в промывочном буфере (O.IXSSC, 0,1% SDS) в течение 30 минут на каждую промывку. Мембраны монтируют и флюорографируют с Cronex Lightening Plus Sceens (Du Pont, Wilmington, DE, USA) и XAR-5 пленкой (Kodak). Бляшки из участков пластин, которые дают положительные засветки на пленке обеих мембран проращивания, собирают и пересевают при низкой плотности: 300 бляшек на 150 мм пластины, и процесс скринирования повторяют до тех пор, пока не будут выделены гибридизированные бляшки.
Минипрепарат ДНК фага, выделенного из бляшки - очищенный фаг, выделяют по следующей методике с помощью набора LambdaSorb Phage Adsorbent kit (Promega, Madison, WI, USA). Фаговую ДНК разрезают с помощью рестриктазы XbaI и фрагмент размером в 5,8 kb клонируют в XbaI сайт pBS(-) плазмиды (Stratagene Cloning Systems). Идентификацию клонируемого фрагмента XbaI фрагментом, содержащим AHAS ген Arabidopsis, осуществляют путем сравнения его рестриктной карты и ДНК последовательности с теми, что были опубликованы для гена Haughn et al., Mol. Gen. Genet. 211, 266 (1988), и Mazur et al., Plant Physiol. 85, 1110 (1987). Плазмиду обозначают pCIB1207.
Пример 23. Получение pCIB1232 (pCIB200/PRI-AHAS-SuR).
A. Лигирование с pCIB200.
Плазмиду pCIB200 (пример 19C) расщепляют KpnI и XbaI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB1230 расщепляют KpnI и XbaI и разгоняют на 0,8% легкоплавком геле агарозы. Приблизительно полосу с фрагментом размером 4,3 kb, содержащим 5'-фланкирующий участок последовательности, слитый с AHAS-SuR последовательностью, кодирующей PR-1, и полосу, содержащую вектор pCIB200, вырезают, смешивают и ДНК лигируют до образования pCIB1232.
B. Получение pCIB1230.
Плазмиду pCIB1208 (см. ниже) расщепляют XbaI и NcoI и фрагменты разделяют электрофорезом на 1 X TAE 0,8% легкоплавком геле агарозы. Плазмиду pCIB269 (пример 19A) расщепляют NcoI и XbaI и разгоняют на одно кратном ТАЕ 0,8% легкоплавком геле агарозы. pCIB269 фрагмент, содержащий bluescript вектор и PR-1 промотор и фрагмент размером 3,3 kb, содержащий мутантный AHAS ген (идентифицированный перекрестной гомологией и рестриктным анализом гена, описанных Mazur et al., Plant. Pjysiol. 85, 1110-117 (1987), вырезают, расплавляют и лигируют друг с другом для создания клона, названного pCIB1230.
C. Получение pCIB1208.
Геномный банк ДНК конструируют, как описано в примере 22C, используя ДНК, выделенную из растений Arabidopsis, отбираемых по резистентности к сульфонилмочевинному гербициду, как описано Haughn и Somerville, Mol. Gen. Genet. 204, 430-434 (1986). Образцы, содержащие гены, кодирующие ацетоксикислую синтетазу (AHAS), идентифицируют путем перекрестной гибридизации с использованием в качестве зонда гена дрожжевой ацетогидроксикислой синтазы (см. пример 22C). Рекомбинантную ДНК субклонируют в bluescript (Stratagene), создавая клон, называемый pCIB1208. Эта плазмиды содержит ген, кодирующий мутантную ацетогидроксикислую синтазу, который обеспечивает резистентность к подавляющему воздействию сульфонилмочевинных гербицидов.
Пример 24. Выделение генома клона, кодирующего основную форму β-1,3- глюканазы (глюкан эндо 1,3-β- глюкозидазы) из Nicotiana Tabacum
Высокомолекулярную ДНК получают из листьев Nicotiana tabacum cv. Havana 425 с использованием CETAB методики (Murray и Thompson, Nucleic Acid Res. 8, 4321 (1980)). 100 мкг ДНК расщепляют SacI до
конечных продуктов. Эту ДНК разделяют электрофорезом на 0,8% геле агарозы. Область геля, соответствующую молекулярному весу от 3 до7 kb, разрезают на 6 полосок одинакового размера и ДНК
электроэлюируют из этих полосок и осаждают как отдельные фракции. ДНК ресуспендируют и аликвоты каждой фракции разгоняют на геле агарозы и анализируют с помощью блотт анализа по Саузерну. Фракцию,
содержащую ДНК, которая гибридизуется с зондом, который представляет собой кДНК β-1,3- глюканазы (Shinshi Н. et al., Proc. Natl. Acad. Sci. USA 85, 5541-5545 (1988)) объединяют и используют при
конструировании библиотеки.
Клонирующий вектор lambda OngC, закупленный у Stratagene Corp., расщепляют SacI. 1 мкг этой ДНК смешивают с 0,1 мкг табачной ДНК, расщепленной SacI, и ДНК лигируют T4 ДНК лигазой в соответствии с рекомендациями изготовителя. Лигированную ДНК затем упаковывают в фаговые частицы, используя in vitro методику упаковки по Stratagene. Фагами инфицируют бактерии, как предложено в lambda руководстве. Около 75000 бляшек скринируют, используя в качестве зонда кДНК β-1,3- глюканазы, меченную32P. Идентифицируют 11 положительных бляшек. Эти бляшки очищают путем многократного инплантирования и скринирования.
ДНК выделяют из очищенных клонов и клоны анализируют путем рестриктного гидролиза с использованием HindIII, EcoRI, SacI. Имеют место два типа клонов - один представлен клоном 39.1, другой клоном 39.3. Вставки с размером 4,5 и 4,7 kb в клоне 39.1 и 39.3, соответственно, субклонируют в bluescript плазмиду, расщепленную Sacl и выделяют субклон pBSGluc39.3 (SacI фрагмент получают из lambda клона 39.1) и субклон pBSGluc39.3 (SacI фрагмент получают из lambda клона 39.3). Последовательность ДНК во фрагментах SacI, содержащихся в субклонах pBSGluc39.1 и pBSGluc39.3, представлена на последовательностях 5 и последовательностях 6, соответственно. Находят кодирующую последовательность, а большую промежуточную последовательность размещают около 5'-фланкирующего участка кодирующей последовательности.
Пример 25. Идентификация участка показала транскрипции гена β-1,3- глюканазы.
A. Картирование с помощью метода удлиненного праймера.
Синтетический праймер ДНК, который комплементарен основаниям 2399-2416, синтезируют и используют в экспериментах по удлинению праймера, как описано в примере 5. Для этих экспериментов РНК выделяют из табака, зараженного Phytophthora parasitica var. nicotiana. Продукты удлинения праймера прогоняют против стандартного молекулярного веса, причем меченый праймер используют в дидеокси-ДНК реакциях секвенирования, субклон pBSGluc39.1 используют в качестве контроля. Продукты удлинения идентифицируют после гель-электрофореза и авторадиографии, как описано в примере 5, что соответствует позициям 1432, 1446, 1447 β-1,3- глюканазы 39.1 последовательности 5. Так как существует большой интрон между позициями 1554 и 2345 в pBSGluc39.1 молекулярный вес ледерной последовательности возможно не совпадает с молекулярным весом продукта удлинения. Поэтому осуществляют второй эксперимент картирования с помощью метода удлинения праймера, используя праймер, который комплементарен позициям от 1530 до 1547. Используя этот праймер, три 5'-конца последовательности глюканазы иРНК картируют к A остаткам в позициях 1434, 1448 и 1449.
B. S1 нуклеазное картирование.
Синтетический олигонуклеотид, комплементарный к позициям от 1415 до 1514, синтезируют для использования в качестве зонда в S1 нуклеазном картировании. Олигонуклеотид обрабатывают с 5'-конца последовательности, используя32P-ATP и T4 полинуклеотидкиназу, в соответствии с рекомендациями поставщика. После экстракции фенолом и приципитации этанолом меченый олигонуклеотид ресуспендируют в формамид-гибридизационном буфере (см. пример 6) при концентрации около 2 нМ. РНК, используемую в этих экспериментах, выделяют из табака, инфицированного Phytophthora parasitica. как в предыдущем примере. S1 картирование проводят на этой РНК, используя меченый олигонуклеотид, как описано в примере 6. После гель-электрофореза определяются три полоски, которые соответствуют позициям 1434, 1448 и 1449 pBSGluc39.1 последовательности ДНК.
C. Определение участка начала транскрипции.
Обе методики удлинения праймеры и S1 нуклеазного картирования имели место 5'на конце иРНК в позиции 1434, 1448 и 1449. Таким образом, эти участки, которые являются остатком аденина, соответствуют стартовым участкам начала транскрипции β-1,3- глюканазного гена.
Пример 26. Получение pBSGluc39.1/GUS.
Олигонуклеотиды с
последовательностями
A) 5'-GTTTATGTGAGGTAGCCATGGTGGGAAGACTTGTTGGG-3'
B) 5'-GATCGCGGTACCGAGCTCCTCTAGGGGGCCAAGG-3'
синтезируют, очищают и используют в реакциях катализируемых
полимеразой (PCR), в соответствии с указаниями поставщика (Perkin Elmer Cetus, DNA thermal cycler; и Perkin Elmer Cetus GeneAmp) для амплификации фрагмента ДНК размером 1494 bp из pBSGluc39.1.
Олигонуклеотиды служат для введения KpnI сайта непосредственно 5' к концу SacI сайта у первой пары оснований 39.1 глюканазной последовательности и для образования нового NcoI сайта у пары оснований
1462. ДНК, полученную по PCR амплификации, экстрагируют фенол/хлороформом и преципитируют этанолом. ДНК ресуспендируют, расщепляют NcoI и KpnI и разгоняют на 0,8% легкоплавком геле агарозы. 1462 bp
полосу вырезают и используют в последующем лигировании. Плазмиду pBS-GUS1.2 (пример 19B) расщепляют NcoI и KpnI и разгоняют на 0,8% геле агарозы, и полосу, содержащую вектор, вырезают. Полосу,
содержащую pBS-GUS1.2 вектор и полосу размером 1462 bp из PCR реакции, лигируют и используют для трансформации E. coil. Положительные полосы собирают и скринируют для отбора тех, которые содержат
вставки размером 1462 bp. Плазмиды, содержащие вставки, являются предполагаемыми клонами pBSGluc39.1/GUS, однако, так как скорость мутации в этом процессе относительно высока (≈1/1000
оснований), нужно секвенсировать фрагмент с размером 1462 bp нескольких клонов. Один из клонов, который имеет ожидаемую последовательность, выбирают в качестве клона pBSGluc39.1/GUS.
Пример 27. Получение плазмиды pBSGluc39.3/GUS.
Олигонуклеотиды с последовательностями:
A) 5'-GTTTATCTGAGGTAGCCATGGTGAGAAGACTTGTTGGA-3'
B)
5'-GATCGCGGTACCGAGCTCCCTTGGGGGGCAAG-3'
синтезируют, очищают и используют в PCR реакции для амплификации 1677 bp фрагмента из pBSGluc39.3. Олигонуклеотиды расщепляют для включения нового сайта
KpnI, непосредственно прилегающего к сайту SacI, в позицию 1 глюканазной 39.3 последовательности и нового сайта NcoI в позицию 1646. ДНК после PCR амплификации экстрагируют фенол/хлороформом,
преципитируют этанолом, ресуспендируют, расщепляют NcoI и KpnI и разгоняют на 0,8% легкоплавком геле агарозы. Полосу размером 1646 bp вырезают и используют в последующем лигировании. pBS-GUS1.2
расщепляют NcoI и KpnI и разгоняют на 0,8% легкоплавком геле агарозы. Полосу, содержащую вектор, вырезают, перемешивают с полосой размером 1646 bp из PCR реакции и лигируют до образования плазмиды
pBSGluc39.3/GUS. Как и ранее, несколько предполагаемых плазмид выделяют, секвенируют и одну из ожидаемых последовательностей выбирают как плазмиду pBSGluc39.3/GUS.
Пример 28. Получение pCIB200/Gluc39.1-GUS и pCIB200/Gluc39.3-GUS.
A. pCIB200 (пример 19C) расщепляют KpnI и XbaI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pBSGluc39.1/GUS (пример 26) расщепляют KpnI и XbaI, и фрагменты разделяют на 0,8% легкоплавком геле. Полосы, содержащие pCIB200 вектор, и полосу KpnI-XbaI, содержащую 5'-фланкирующий участок последовательности глюканазы 39.1 гена, сплавляют с GUS геном, вырезают и ДНК лигируют до образования плазмиды pCIB200/Gluc39.1-GUS.
B. Подобным образом плазмиду pBSGluc39.3/GUS (пример 27) расщепляют и лигируют с расщепленной pCIB200 до образования плазмиды pCIB200/Gluc39.3-GUS.
Пример 29. Получение pCIB200/Gluc39.1-BT и pCIB200/Gluc39.3-BT
A. pCIB200/Gluc39.1-BT.
Плазмиду pBSGIuc39.1/GUS расщепляют с KpnI и NcoI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB1004 (пример 21B) расщепляют KpnI и NcoI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB200 (пример 19C) расщепляют с KpnI, дефосфорилируют, используя телячью кишечную щелочную фосфотазу, и разгоняют на 0,8% легкоплавком геле агарозы. Полосу, содержащую, pCIB200 вектор, полосу, содержащую 5'-фланкирующий участок глюконазы, и полосу, содержащую BT ген, вырезают, смешивают друг с другом и лигируют до образования плазмиды pCIB200/Gluc39.1-BT.
B. pCIB200/Gluc39.3-BT.
Подобным образом плазмиду pBSGluc39.3/GUS расщепляют и лигируют с расщепленной pCIB1004 и расщепленной pCIB200 до образования плазмиды pCIB200/Gluc39.3-BT.
Пример 30. Получение pCIB200/Gluc39.1-AHAS и pCIB200/Gluc39.3-AHAS
A. Лигирование с pCIB200 Плазмиду pBSGluc39.1/AHAS расщепляют с помощью KpnI и XbaI и разгоняют путем
электрофореза на 0,8% легкоплавком геле агарозы. Плазмиду pCIB200 (пример 19C) обрабатывают KpnI и XbaI и разгоняют на 0,8% легкоплавком агарозном геле. Полосу, содержащую смесь глюканазы/AHAS, и
полосу, содержащую вектор экспрессии pCIB200, вырезают, смешивают и ДНК лигируют до образования плазмиды pCIB200/Gluc39.1-AHAS.
Таким образом, плазмиду pBSGluc39.3/AHAS расщепляют и лигируют с расщепленной pCIB200 с образованием плазмиды pCIB200/Gluc39.3-AHAS.
B. Получение плазмид pBSGluc39.1/AHAS и pBSGluc39.3/AHAS.
Плазмиду pBSGluc39.1/GUS (пример 26) расщепляют с помощью NcoI и XbaI и разгоняют на 0,8% агарозном геле. Плазмиду pCIB1207 (пример 22C) расщепляют с помощью NcoI и XbaI и разгоняют на 0,8% агарозном геле. Полосу, содержащую 5'-фланкирующую последовательность глюконазы и вектор и полосу, содержащую AHAS кодирующую последовательность, вырезают, смешивают и ДНК лигируют с тем, чтобы получить плазмиду pBSGluc39.1/AHAS.
Таким же образом, плазмиду pBSGluc39.3/GUS (пример 27) расщепляют и лигируют с расщепленной pCIB1207 для того, чтобы получить плазмиду pBSGluc39.3/AHAS.
Пример 31. Получение pCIB200/Gluc39.1-AHAS-SuR и pCIB200/Gluc39.3-AHAS-SuR.
A. Лигирование с pCIB200.
Плазмиду pBSGIuc39.1/AHAS-SuR расщепляют с помощью KpnI и XbaI и разгоняют на 0,8% легкоплавком геле агарозы. Плазмиду pCIB200 (пример 19C) расщепляют с помощью KpnI и XbaI и разгоняют на 0,8% низкоплавком геле агарозы. Полосу, содержащую продукт слияния глюканаза/AHAS-SuR, и полосу, содержащую pCIB200 вектор экспрессии, вырезают, смешивают и ДНК лигируют с целью получения плазмиды pCIB200/Gluc39.1-AHAS-SuR.
Таким же образом плазмиду pBSGluc39.3/AHAS-SuR расщепляют и лигируют с расщепленной pCIB200 с целью образования плазмиды pCIB200-/Gluc39.3- AHAS-SuR.
B. Получение плазмиды pBSGuc39.1/AHAS-SuR и pBSGluc39.3/AHAS-SuR.
Плазмиду pBSGluc39.1/AHAS-SuR (пример 26) и pBSGIuc39.3/AHAS-SuR (пример 27) расщепляют с помощью ферментов NcoI и XbaI и вырезанные фрагменты разделяют в 1 X TAE 0,8% низкоплавком агарозном геле. pCIB1208 (пример 23C) расщепляют с помощью XbaI и NcoI и фрагмент размером 3,3 kb, содержащий мутированный AHAS ген (резистентный к сульфонилмочевинному гербициду, SuR) выделяют электрофорезом в агарозном геле. Фрагменты, содержащие промотор глюкуронидазы и pBS вектор, вырезают расплавляют и лигируют с AHAS фрагментом, чтобы получить клоны, обозначенные как pBSGluc39.1/AHAS- SuR и pBSGluc39.3/AHAS-SuR, соответственно.
4. Идентификация новых клонов.
Следующий пример показывает как выделять и определять структуру новых генов PR белка в этом изобретении.
Пример 32. Выделение других геномных и кДНК клонов.
A. Выделение геномного клона, кодирующего PR-1'.
Геномный банк конструируют и скринируют с помощью использования в качестве зонда кДНК PR-1, как описано в примере 11. Клон выделяют и обозначают lambdatobchrPR1019. Определяют предварительную рестриктную карту. Фрагмент ClaI субклонируют в bluescript и затем определяют рестриктную карту плазмиды pBS-PR1019Cla. Большой фрагмент Xhol вырезают из pBS- PR1019Cla и получают плазмиду pBS-PR1019Cla Xho. Эта плазмида содержит фрагмент табачной ДНК размером около 2,7 kb, содержащий PR1019 ген. Делеции проводят в этой плазмиде и серия делении используется для секвенирования ДНК.
Последовательность ДНК фрагмента размером порядка 2100 bp этого гена показана на последовательности 2 - белок, закодированным в PR1019. Обнаружено 65% гомологии с PR-1a, PR-1b или PR-1c, поэтому этот новый ген обозначен PR-1'.
B. Выделение кДНК клона, кодирующего огуречную хитиназу.
Патоген-индуцированный хитиназный белок выделен из инфицированных огуречных
листьев, как описано (Metraux J.P. et al., Physiological and Molecular Plant Pathology, 33, 1-9 (1988)). Пептиды получают из препарата этого гомогенного белка в основном, как описано в известном
уровне техники и в примерах 9 и 10. Выбирают два участка белка и синтезируют олигонуклеотидные зонды, которые являются комплементарными ко всем возможным комбинациям информационной РНК, кодирующей
пептиды. Зонды имеют следующую последовательность:
G T A
Probe 1: 5'-CCATTCTGNCCCCAGTA-3'
G G G G C
Probe 2: 5'-GGATTATTATAAAATTGNACCCA-3'.
Листья огурца инфицируют Вирусом Некроза Табака (ВНТ) и РНК выделяют через 5 дней после инфицирования, как описано в примере 5. Поли A + РНК выделяют по стандартной методике и кДНК библиотеку конструируют в lambda Zap в качестве клонирующего вектора (Stratagene), в основном как описано (Gubler U. и Hoffman B.J., Gene 25, 263 (1983)). 300000 бляшек высевают в чашки и выросшие дубликатные бляшки зондируют либо меченной32P олигонуклеотидной смесью (зонд 1) или смесью 2 (зонд 2). Бляшки, оказавшиеся положительными при скрининге с помощью одного из зондов, выделяют. Выделение фага и автоматическую эксцизию проводят, как описано в руководстве Stratagene Lambda Zap лаборатории.
Когда выделяют клоны кДНК хитиназа в bluescript плазмиде, их секвенируют путем дидеоксисеквенирования. Последовательность хитиназного гена представлена последовательностью 3.
C. Выделение кДНК клона, кодирующего основную форму PR-R.
Nicotiana
tabaccum cv. Xanthi-nc листья инфицируют вирусом табачной мозаики и сбор производят через 5 дней после инфицирования. Общую РНК получают, как описано в примере 5, а поли A+ РНК выделяют с
использованием стандартной методики. Банк кДНК конструируют с использованием этой поли A + РНК в lambda ongC клонирующем векторе (Stratagene). Около 300000 бляшек скринируют олигонуклеотидным зондом,
имеющим последовательность
5'- GAACTTCCTAAAAGCTTCCCCTTTTATGCC-3'.
Положительные бляшки очищают по стандартной методике и ДНК получают из фага. Фрагмент рекомбинантного фага, который содержит кДНК, субклонируют в bluescript плазмиду. ДНК последовательность кДНК определяют секвенированием ДНК. Последовательность одного клона, который кодирует основную форму PR-R (Pierpoint W.S. et al., Physiol. Plant Pathol. 31, 291 (1987)) представлена в последовательности 4. Этот кодируемый белок имеет очень большую гомологию с известным трипсин/альфа-амилазным ингибитором, выделенным из кукурузы (Richardson M. et al., Nature 327, 432 (1987)). Клонированный PR-R может быть ингибитором либо протеаз, либо альфа-амилазы, и в этом случае обуславливают инсектицидную, вирицидную или фунгицидную активность растений при трансгенной экспрессии.
D. Выделение кДНК, кодирующей PR-Q.
Nicotiana tabacum cv. Xanthi-nc листья инфицируют вирусом табачной мозаики, и сбор производят через 5 дней после инфекции. Общую РНК получают, как описано в примере 5, а полиA + РНК выделяют по стандартной методике. Банк кДНК конструируют с помощью этой полиA + РНК в LambdaOngC клонирующем векторе (Stratagene). Около 300000 бляшек скринируют, используя меченный кДНК зонд, кодирующий ген табачной основной хитиназы (Shinshi et al., Proc. Nail. Acad. Sci. USA 84, 89-93, (1987)) и промывают фильтры при 50oC в 0,125 мМ NaCl, 1% SDS, 40 мМ фосфата натрия (pH 7,2), 1 мМ EDTA. 24 положительные бляшки очищают и определяют последовательность ДНК одного клона, обозначенного pBScht15. Эта последовательность представлена в последовательности 7.
PR-Q белок частично очищают от внутриклеточной жидкости листьев, инфицированных ВТМ, как
описано в примере 8. Фракции, содержащие PR-O, PR-P, PR-Q и PR-R, после хроматографии объединяют и концентрируют лиофилизацией. Белки в дальнейшем очищают электрофорезом в полиакриламидном геле.
Вырезают полосу, содержащую PR-Q, и белки элюируют согласно Applied Biosystems User Bulletin No. 35, 21 марта 1988 года. Белок обрабатывают пироглютаматаминопептидазой и секвенируют путем
автоматизированной деградации по Edman, как описано в примере 9. Последовательность аминоконца PR-Q белка определена так: (Xxx - не определено):
GlnGlyIleGlySerIleValThrXxxAspLeuPheAsnGluMetLeu
Белок, кодируемый клоном последовательности 7, определен как обусловливающий патогенез белок Q, что базируется на: 1) частичной структуральной
гомологии к основной табачной хитиназе и 2) идентичности амино-концевой последовательности белка PR-Q, определенной секвенированием белка.
E. Выделение кДНК, кодирующей кислотную форму β-1,3- глюканазы.
Около 300000 бляшек банка кДНК, описанного в примере 32D (выше), скринируют с помощью меченного кДНК зонда, кодирующего основную форму β-1, 3- глюканазы (Shinshi H. et al., см. выше) и фильтры промывают при 50oC 0,125 М NaCl, 1% SDS < 40 мМ фосфата натрия (pH 7,2), 1 мМ 1 EDTA. 15 положительных бляшек выделяют и вставку субклонируют в bluescript плазмиду. Частичное секвенирование ДНК обнаруживает, что клоны 5 и 6 кодируют идентичные кДНК, которые имеют 55% гомологии к известной последовательности ДНК основной формы β-1,3- глюканазы. Последовательность кДНК в клонах 5 и 6 определена и показана в последовательности 8. Сделан вывод, что эта кДНК кодирует кислотную форму β-1,3- глюканазы, что обусловлено частичной гомологией аминокислотной последовательности и более кислой изоэлектрической точке кодируемого белка.
F. Выделение геномного клона, кодирующего ген огуречной
хитиназы
Ядра выделяют из Cucumis sativus cv. Длинный Маркер и ДНК выделяют, как описано в примере 11. 3 мкг этой ДНК расщепляют либо EcoRV, EcoRI, BamHI, либо HindIII и фрагменты разделяют в
0,5% геле агарозы. Блот-анализ по Саузерну с использованием меченного зонда кДНК огуречной хитиназы (последовательность 3) обнаруживает одну полосу размером около 12 kb в продукте расщепления EcoRI
рестриктазой. Поэтому решили выделять ген огуречной хитиназы, используя весь фрагмент, расщепленный EcoRI рестриктазой и лигирование в lambda клонирующий вектор.
10 мкг ДНК, выделенных выше, окончательно расщепляют, используя EcoRI. Эту ДНК затем экстрагируют фенолом, преципитируют этанолом и лигируют в EcoRI сайт EMBL 4. Около 100000 бляшек скринируют с использованием в качестве зонда меченной кДНК огуречной хитиназы, последовательность 3. Собирают 10 положительных бляшек, очищают и вставку ДНК анализируют предварительным рестриктным картированием. Все клоны дают одинаковый результат и поэтому один берут для дальнейшего анализа. Вставку этого клона размер 12 kb субклонируют в bluescript плазмиду, чтобы получить плазмиду pBScucchi/chitinase. Для этой клонированной ДНК определена рестриктная карта. Фрагменты субклонированы и определена последовательность ДНК.
G. Выделение геномного клона, кодирующего кислую β-1, 3- глюканазу.
Геномную библиотеку конструируют, как описано выше в примере 11, и скринируют с помощью кДНК клона кислой β-1,3- глюканазы (пример 32E). Лямбда клон изолируют, EcoRI и фрагмент размером 1 kb этого лямбда клона субклонируют в bluescript, как описано выше в примере 32A. Bluescript клон обозначен pBSGL6e.
5. Стабильная трансформация и регенерация растений.
Растительную ткань трансформируют описанными выше векторами с использованием любой методики, известной по руководству. Методы, используемые для переноса ДНК в растительные клетки включают, например, прямое инфицирование или сокультивирование растений, растительной ткани или клеток с A. tumefaciens (Horsch R.B. et al., Science 225, 1229 (1985); Marton L., Cell Culture and Somatic Cell Genetics of Plants, т.1, 514-521, 1984), обработка протопластов экзогенной ДНК методами, которые описаны в следующих публикациях: Paszkowski J. et al., EMBO J. 3, 2717 (1984); EP-A 0164575; Shillito R.D. et al. , Bio/Technology 3, 1099 (1985); Potrykus I. et al., см. выше ; Loerz H. et al. , Mol. Gen. Genet. 199, 178 (1985); Fromm M. et al., см. выше ; GB 2140822; и Negrutiu 1. et al., Plant Mol. Biol. 8, 363 (1987); инкубация с полиэтиленгликолем (PEG) (Negrutiu I. et al. , см. выше); микроинъекция (Reich T. J. et al., Bio/Technology 4, 1001-1004 (1986); Reich T.J. et al., Can. J. Bot. 64, 1259-1267 (1986)), микроснарядная бомбардировка (Klein Т.М. et al., Nature 327,70 (1987)).
Пример 33. Трансформация Agrobacterium.
pCIB270 (пример 16)б pCIB271, pCIB272 и pCIB273 (примеры 19D, E и F) плазмидную ДНК очищают на градиенте цезийхлоридэтидиябромида и используют для трансформации A. tumefaciens штамма A136, содержащего хелперную плазмиду pCIB542, по методике Holsters M. et al., Mol. Gen. Genet. 163, 181-187 (1978) с получением штаммов CIB270, CIB271, CIB272 и CIB273.
Используя эту же методику, плазмиды pCIB271, pCIB272 и pCIB273 трансформируют в вирулентные A. tumefaciens штаммы 159556 A208, A281 и в A. rhizogenes штамм A4, создают штаммы, обозначенные как pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955, pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273 X 15955, pCIB273 X A208, pCIB273 X A281, pCIB273 X A4.
Agrobacterium штамм CIB542 является штаммом EHA101 (Hood et al., J. Bacteriol. 168, 1291-1301 (1986)), в котором канамициновый маркер плазмиды замещен спектиномицин/стрептомициновым участком Tn7.
Пример 34. Трансформация табака в дисках листьев.
Штаммы Agrobacterium CIB270, CIB272 и CIB273 выращивают в течение 18-24 часов в среде с солями глютамата с pH 5,6 с добавлением 0,15% маннитола, 50 мкг/мл канамицина, 50 мкг/мл спектомицина и 1 мг/мл стрептомицина, потом их разводят до OD600 0,2 в такой же среде без антибиотиков. Затем бактерии выращивают в течение 3-5 часов, разводят до OD600 0,2-0,4 для инокуляции в 5-7 мм диски, полученные пробойником из листьев Nicotiana tabacum cv. xanthi. которые асептически выращивают в GA7 контейнерах по модифицированному методу Horsch R. et al., Science 227, 1229-1232 (1985).
Диски из листьев выдерживают на 0,7% агаре, содержащем микросоли и микроэлементы по Murashige и Skoogs (MS), 1 мг/л бензиладенина и 1 мг/мл α нафталинуксусной кислоты в течение 2 дней, затем переносят в такую же среду, содержащую 50 мкг/мл канамицина, 100 мкг/мл карбеницилина и 100 мкг/мл мефоксина. Ростки, которые формируются на дисках, вырезают и размножают субкультивированием кусочков до получения 6 ростков в MS среде, содержащей 50 мкг/мл канамицина в GA7 контейнерах.
Ростки пускают корни на среде, без гормонов и с 50 мкг/мл канамицина, переносят в почву и укрепляют в фитотроне, затем переносят в теплицу для индукционной обработки химическими регуляторами. Во время цветения у цветков индуцируют самоопыление. Семена собирают после вызревания.
Индукционные опыты и результаты описаны в примерах 63, 66 и таблице 11.
Пример 35. Получение трансгенного табачного каллюса и растений.
Штамм Agrobacterium pCIB270 или pCIB271 используют для трансформации каллюса, полученного из дисков листьев (пример 34). Каллюс, полученный на селективной среде MSBN с канамицином, поддерживают на каллюсной ростовой среде, содержащей MS макро- и микросоли и Fe-EDTA (Gibco # 500-1117; 4,3 г/л), MS витамины, 100 мг/л миоинозитола, 20 г/л сахарозы, 2 мг/л нафталинуксусной кислоты и 0,3 мг/л кинетина.
Каллюс можно использовать для регенерации трансгенных растений путем переноса кусочков каллюса в MSBN среду по методам, описанным в примере 34. Каллюс также используют для оценки генной индукции после воздействия индуцирующих препаратов и для отбора гениндуцирующих препаратов.
Пример 36. Трансформация моркови.
Штаммы Agrobacterium CIB270, CIB271, CIB272, CIB273, pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955, pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273 X 15955, pCIB273 X A208, pCIB273 X A281, pCIB273 X A4 выращивают, как описано в примере 34. Бактерии, разведенные до OD600 0,2-0,4, используют для инокуляции в диски, вырезанные из поверхностно стерилизованной моркови.
Для поверхностной стерилизации моркови ее очищают и погружают на 20 минут в 10% раствор хлорокса. Морковь отмывают стерильной водой, разрезают на 5-мм кусочки и помещают широкой стороной на водяной агар. 20-50 мл бактериальной взвеси наслаивают на наружную поверхность дисков. Через 7 дней диски переносят на 0,7% агар, содержащий MS соли, 3% сахарозы, 0,1 мг/л 2,4-D, 50 мкг/мл канамицина, 100 мкг/мл карбеницилина и 100 мкг/мл мефоксина. Каллюс, образующийся вокруг камбиального кольца, вырезают и помещают на 0, 7% MS агар с добавлением 3% сахарозы, 0,1 мг/л 2,4-D, 50 мкг/мл канамицина, 100 мкг/мл карбеницилина и 100 мкг/мл мефоксина. После подрастания каллюс разрезают на мелкие кусочки и случайным образом помещают в четыре чашки с той же средой. Когда каллюс заполняет чашку, 3 чашки опрыскивают водой с 50 мМ салицилата натрия, pH 5,6, или с 250 мкг/мл метил-бензо-1,2,3-тиадиазол-7- карбоксилата, для того, чтобы вызвать экспрессию химерного PR-la/GUS гена.
Эксперименты по индукции и результаты описаны в примерах 63 и 66.
Пример 37. Трансформация подсолнечника.
Штаммы Agrobacterium CIB270, CIB271, CIB272, CIB273, pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955, pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273
X 15955, pCIB273 X A208, pCIB273 X A281, pCIB273 X A4 выращивают, как описано в примере 34. Бактерии, разведенные до OD600 0,2-0,4, используют для инокуляции в стебли подсолнечника,
полученных следующим образом:
Семена подсолнечника погружают на 10 минут в 10% каптан, затем на 10 минут в 10% хлорокс и отмывают стерильной водой. С семян удаляют оболочку и проращивают на 0,
7% водяном агаре в темноте в течение 3 дней, после чего их помещают в лабораторный инкубатор, установленный на 23oC с 12-часовым днем и ночью. Ростки выращивают неделю, затем декапитируют и
бактерии инокулируют в надрезанную поверхность стебля.
Через неделю стебли, инокулированные CIB270, CIB271, CIB272 или CIB273, режут и помещают на 0,7% агар с MS солями, 3% сахарозы, 2 мг/мл α -нафталинуксусной кислоты, 1 мг/мл 6-бензиламинопурина, 100 мг/мл карбенициллина, 100 мг/мл мефоксина и 50 мг/мл канамицина. Стебли, инокулированные pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955, pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273 X 15955, pCIB273 X A208, pCIB273 X A281, pCIB273 X A4, режут и помещают на 0,7% агар, содержащий MS соли, 3% сахарозы, 100 мг/мл карбенициллина и 100 мг/мл мефоксина. Каллюс переносится на свежую среду каждые две недели до тех пор, пока не получают количество, достаточное для 4 чашек. Половину каллюса, выращенного из вирулентных штаммов Agrobacterium, переносят в среду без гормонов с 50 мг/мл канамицина. После того, как выращено достаточное количество каллюса в присутствии или отсутствии канамицина, он обрабатывается для индукции, как описано выше при трансформации каллюса из моркови.
Пример 38. Трансформация помидора.
Штаммы Agrobacterium CIB270,
CIB271, CIB272, CIB273, pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955, pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273 X 15955, pCIB273 X A208, pCIB273 X A281,
pCIB273 X A4 выращивают, как описано в примере 34. Бактерии, разведенные до OD600 0,2-0,4, используют для инокуляции в стебли ростков томата, полученных следующим образом:
Семена
томата замачивают 20 минут в 10% хлорокса и отмывают стерильной водой. Семена проращивают на 0,7% водяном агаре в темноте в течение 3 дней, после чего их помещают в лабораторный инкубатор,
установленный на 23oC 12-часовой продолжительностью дня и ночи. Саженцы вращивают в течение недели, декапитируют и бактерии инокулируют в обрезанную поверхность стебля.
Через неделю стебли, инокулированные CIB270, CIB271, CIB272 или CIB273, нарезают и помещают на 0,7% агар с MS солями, 3% сахарозы, 2 мг/мл α- нафталинуксусной кислоты, 1 мг/мл 6-бензиламинопурина, 100 мг/мл карбенициллина, 100 мг/мл мефоксина и 50 мг/мл канамицина. Стебли, инокулированные pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955, pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273 X 15955, pCIB273 X A208, pCIB273 X A281, pCIB273 X A4, нарезают и помещают на 0,7% агар с MS солями, 3% сахарозы, 100 мг/мл карбенициллина и 100 мг/мл мефоксина. Каллюс переносят на свежую среду каждые две недели до получения количества, достаточного для 4 чашек. Половину каллюса, выращенного из вирулентных штаммов Agrobacterium, переносят в среду без гормонов с 50 мг/мл канамицина. После выращивания достаточного количества каллюса в присутствии или отсутствии канамицина, его обрабатывают для индукции, как описано выше при трансформации каллюса из моркови.
Пример 39. Трансформация хлопка.
Штаммы Agrobacterium CIB273, pCIB271 X 15955, pCIB271 X A208, pCIB271 X A281, pCIB271 X A4, pCIB272 X 15955,
pCIB272 X A208, pCIB272 X A281, pCIB272 X A4, pCIB273 X 15955, pCIB273 X A208, pCIB273 X A281, pCIB273 X A4 выращивают, как описано в примере 34. Бактерии, разведенные до OD600 0,2-0,4,
используют для инокуляции семядолей хлопка, полученных следующим образом:
Семена хлопка замачивают 20 минут в 10% хлороксе и отмывают стерильной водой. Семена проращивают на 0,7% водном агаре
в темноте. Ростки выращивают в течение недели, затем бактерии инокулируют в поверхность семядоли.
После инокуляции ждут, когда из семядоли формируется каллюс, затем их нарезают и помещают на 0,7% агар, содержащий MS соли, 3% сахарозу, 100 мг/мл карбенициллина и 100 мг/мл мефоксина. Каллюс переносят в свежую среду каждые три недели для получения количества, достаточного для 4 чашек. Половину каллюса, выращенного из вирулентных штаммов Agrobacterium. переносят в среду без гормонов, содержащую 50 мкг/мл канамицина. После получения достаточного количества каллюса в присутствии или отсутствии канамицина, его обрабатывают для индукции, как описано выше для трансформации каллюса из моркови.
Пример 40. Получение специального вида каллюса из Zea mays, элитной инбредной линии Funk 2717.
Саженцы Zea mays инбредной линии Funk 2717 выращивают в теплице и во время цветения самоопыляют. Собирают незрелые колосья с эмбрионами длиной примерно 2,0-2,5 мм и стерилизуют в 10% хлороксе 20 минут. Эмбрионы, асептически выделенные из зерен осью вниз, помещают на OMS среду, содержащую 0,1 мг/л 2,4-D, 6% (в/о) сахарозы и 25 мМ L-пролина, в качестве отвердителя используют 0,24% (в/о) GelriteR. После 2 недель культивирования в темноте при 27oC каллюс, образующийся на щитке, отделяют от эмбриона и помещают в B5 среду (Gamborg O.L. et al., Experimental Cell Research 50, 151-158 (1968)), содержащую 0,5 г/л 2,4-D и 0,24% (в/о) GelriteR в качестве отвердителя. Каллюс субклонируют каждые 2 недели в свежей среде. Через 8 недель после помещения эмбрионов в инициирующую среду, специальный вид каллюса идентифицируют по его характерной морфологии. Этот каллюс субкультивируют в дальнейшем на этой среде. Через 2 месяца каллюс переносят и последовательно субклонируют на среде N6, содержащей 2 мг/л 2,4-D и GelriteR в качестве отвердителя.
Пример 41. Получение суспензионной культуры Zea mays, элитной инбредной линии Funk 2717.
Каллюс, описанный в примере 40, субкультивируют по меньшей мере 6 месяцев. Вид каллюса, который выбирают для субкультивирования, должен быть относительно неклейкий, гранулярный и очень рыхлый с тем, чтобы при помещении в жидкую среду он разделялся на мелкие клеточные агрегаты. Культуры, содержащие агрегаты из увеличенных в объеме клеток, отбрасывают. Аликвоты приблизительно по 500 мкг специального каллюса Zea mays элитной инбредной линии Funk 2717 помещают в 30 мл среды N 6, содержащей 2 мг/л 2,4-D во флаконах Delong на 125 мл. После недельного культивирования при 26oC в темноте на вращающемся шейкере (130 об/мин, размах 2,5 см) среду меняют на свежую. Суспензии субкультивируют также и в последующую неделю. К этому времени культуры изучают, и те из них, которые не содержат большого количества увеличенных клеток, оставляют. Суспензионные культуры, содержащие агрегаты больших раздутых клеток, отбрасывают. Предпочтительными являются ткани, состоящие из плотных агрегатов делящихся клеток, которые имеют характерную более гладкую поверхность, чем обычный тип клеточных агрегатов. Оставляют культуры, у которых по меньшей мере 50% клеток находятся в таких небольших агрегатах. Такая морфология является желаемой. Такие суспензии имеют также высокую скорость роста, увеличиваясь в два раза, менее чем за одну неделю. Суспензионные клеточные культуры субкультивируют еженедельно перенося 0,5 мл PCV (ограниченный клеточный объем: установленный клеточный объем в пипетке) в 25 мл свежей среды. Через 4-6 месяцев такого субкультивирования культуры увеличиваются в 2-3 раза за неделю. Культуры, в которых более 75% клеток желаемой морфологии, оставляют для дальнейшего культивирования. Для поддержания линий всегда выбирают флакон, который содержит клетки с лучшей морфологией. Периодическую фильтрацию через сито из нержавеющей стали с диаметром пор 630 мкм каждые две недели используют в некоторых случаях для увеличения дисперсии культур, но это необязательно.
Пример 42. Получение протопластов из суспензионных культур Zea mays.
1-1,5 мл PCV суспензионной культуры клеток, приготовленной, как в примере 41, инкубируют в 10-15 мл стерилизованной через фильтр смеси, состоящей из 4% (в/о) целлюлозы RS с 1% (в/о) рибозимом в KMC (8,65 г/л KCl, 16,47 г/л MgCl2•6H2O и 12,5 г/л CaCl•2H2O, 5 г/л MES, pH 5,6) в солевом растворе. Расщепление проводят при 30oC на медленно вращающемся столе в течение 3-4 часов. Под инвертированным микроскопом контролируют высвобождение протопластов. Освободившиеся протопласты собирают следующим образом: препарат фильтруют через сито с ячейками 100 мкм, затем через сито с ячейками 50 мкм. Протопласты промывают через сито объемом KMC солевого раствора, равного первоначальному объему ферментного раствора. По 10 мл препарата протопластов помещают в несколько одноразовых пластиковых центрифужных пробирок, а 1,5-2 мл 0,6 М раствора сахарозы (забуференного до pH 5,6 0,1% (в/о) морфолинэтансульфоновой кислоты (MES и KOH) наслоенного снизу. Пробирки центрифугируют при 60-100 • g 10 минут, и слой протопластов на разделе фаз собирают пипеткой и помещают в новую пробирку. Препарат протопластов ресуспендируют в 10 мл свежего KMC солевого раствора и центрифугируют 5 минут при 60-100 • g. Супернатант удаляют и отбрасывают, протопласты осторожно ресуспендируют в остаточной жидкости, а затем постепенно добавляют раствор KMC осмолярностью 13/14. Снова центрифугируют 5 минут, удаляют супернатант и ресуспендируют протопласты в растворе KMC с осмолярностью 6/7. Берут аликвоту для подсчета, а протопласты ресуспендируют в концентрации 107 на мл в KM-8p среде (таблица 1) или в 0,5 М маннитоле, содержащем 6 мМ MgCl2 или в другой подходящей среде, используемой для трансформации, как описано в следующих примерах. Такую суспензию протопластов используют для трансформации и культивируют, как описано в примерах 43 и 44.
Пример 43. Трансформация Zea mays протопластов электропорацией.
A. Все этапы, за исключением теплового шока, проводят при комнатной температуре (22-28oC). Протопласты ресуспендируют на последнем этапе примера 42 в 0,5 М маннитоле, содержащем 0,1% (в/о) ME и 6 мМ MgCl2. Осмолярность этой суспензии измеряют в камере Dialog Electroporator (DIALOG GmbH, D-4000 Dusseldorf 13, Federal Republic of Germany) и доводят до 1-1,2 kOm, используя раствор 300 мМ MgCl2. Протопласты подвергают воздействию теплового шока, погружая пробирку с образцом в водяную баню при 45oC на 5 минут, затем охлаждают до комнатной температуры на льду. 4 мкг линеаризованной плазмиды, содержащей ген избирательной резистентности растений к гигромицину, такой как описано Rothstein S.J. et al., (см.выше), или химерный ген, конструкция которого описана в примерах 19-31, и 20 мкг носителя ДНК из тимуса теленка добавляют к 0,25 мл аликвотам этой суспензии. К протопластам добавляют 0,125 мл 24% (в/о) раствора полиэтиленгликоля (ПЭГ) (молекулярный вес 8000) в 0,5 М маннитоле с содержанием 30 мМ MgCl2. Смесь тщательно, но осторожно, перемешивают и инкубируют 10 минут. Образец переносят в камеру электропоратора и подвергают импульсному воздействию 3 раза с интервалами в 10 секунд, при начальном напряжении 1500, 1800, 2300 или 2800 Vcm-1 и временем экспоненциального спада 10 мсек.
Протопласты культивируют следующим образом. Образцы сеют в 6-см чашки Петри при комнатной температуре. Через 5-15 минут добавляют 3 мл среды KM-8p (таблица 1, см. выше), содержащей 1,2% (в/о) (SeaPlaque) агарозы с малой степенью эндоосмоса и пониженными температурами плавления и затвердевания и 1 мг/л 2,4-D. Агароза и протопласты хорошо перемешивают и дают среде образовать гель.
B. Пример 43A повторяют с одной или более из следующих модификаций:
(1) Сопротивление препарата протопластов доводят до 0,5-0,7 кОм.
(2) Используют ПЭГ с молекулярной массой 4000.
(3) ПЭГ не добавляют или добавляют половинный объем 12% (вес/объем) ПЭГ.
(4) Импульсы производят с интервалом в 3 секунды.
(5) Протопласты сеют после электропорации в чашки, которые стоят на плите, охлажденной до 16oC.
(6) Протопласты после электропорации помещают в пробирки, отмывают 10 мл раствора KMC концентрацией 6/7 или раствором W5 (состав: 380 мг/л KCl, 18,375 г/л CaCl2•2H2O, 9 г/л NaCl, 9 г/л глюкозы, pH 6,0), затем собирают центрифугированием при 60 g 10 минут, ресуспендируют в 0,3 мл среды КМ и сеют, как в A.
(7) Носитель ДНК из телячьего тимуса не добавляют.
Пример 44. Трансформация Zea mays протопластов
обработкой полиэтиленгликолем (ПЭГ)
A. Протопласты ресуспендируют на последнем этапе примера 42 в 0,5 М растворе маннитола, содержащем 12-30 мМ MgCl2. Тепловой шок при 45oC в течение 5 минут производят, как описано в примере 43. Для трансформации протопласты распределяют по аликвотам в центрифужные пробирки, по 0,3 мл суспензии протопластов на пробирку. В
течение последующих 10 минут добавляют следующее: ДНК (как в примере 43) и раствор полиэтиленгликоля (ПЭГ) (MW 6000, 40% (вес/объем); содержащий 0,1 М Ca(NO3)2 и 0,4 М маннита;
pH 8-9 с KOH) так, чтобы конечная концентрация ПЭГ составила 20%. Аликвоты инкубируют 30 минут с периодическим осторожным встряхиванием, затем протопласты помещают в чашки Петри (0,3 мл исходной
суспензии протопласта на чашку с диаметром 6 см) и культивируют, как описано в примере 43.
B. Повторяют пример 44A и после 30 минут инкубации в растворе ПЭГ (пример 44A) протопласты отмывают, добавляя 0,3 мл раствора W5 пять раз с интервалами 2-3 минуты. Суспензию протопластов центрифугируют, супернатант удаляют, а протопласты культивируют, как в примере 44A.
C. Примеры 44A и 44B повторяют с той разницей, что конечная концентрация ПЭГ находится между 13 и 25% (вес/объем).
Пример 45. Регенерация каллюса из протопластов.
Плашки с протопластами в агарозе помещают в темноту при 26oC. Через 14 дней протопласты образуют колонии. Агарозу, содержащую колонии, переносят на поверхность чашек Петри с диаметром 9 см, содержащих 30 мл среды N6 (таблица 1, см. выше) с 2 мг/л 2,4-D и 0,24% вес/объем GelriteR в качестве отвердителя. Эту среду обозначают 2N6. В дальнейшем каллюс культивируют в темноте при 26oC, а кусочки каллюса субкультивируют каждые 2 недели в новой твердой среде 2N6.
Пример 46. Селекция трансформированного каллюса Zea mays.
Повторяют пример 45 с тем изменением, что добавляют 100 мг/л или 200 мг/л гигромицина B к среде 2N6 для селекции трансформированных клеток.
Пример 47. Регенерация зерновых растений.
A. Для поддержания каллюс помещают на среды 2N6, ON6 (среда N6 без 2,4-D) и на N61 (среда N6, содержащую 0,25 мг/л 2,4-D и 10 мг/л кинетина) для инициации регенерации. Каллюс на средах ON6 и N61 выращивают при свете (16 часов в день с 10-100 мк Einsteins/м2•сек от белых флюоресцентных ламп). Каллюс, выращиваемый на среде N61, переносят на среду ON6 через 2 недели, так как культивирование на среде N61 более длительный срок вредно. Каллюс субкультивируют каждые 2 недели, даже если он снова переносится на среду того же состава. Ростки появляются приблизительно через 4-8 недель. Когда ростки достигают по меньшей мере 2 см в высоту, их переносят на среду ON6 в контейнерах GA7. Корни формируются через 2-4 недели, и когда корни выглядят достаточно оформленными, для поддержания роста ростки переносят в торфяные горшочки, защищают от света первые 4-7 дней. Часто бывает полезным установить чистый пластиковый колпак над саженцами на 2-3 дня для того, чтобы облегчить прививание. Когда растения привились, с ними обращаются как с обычными зерновыми и выращивают до созревания в теплице. Для получения потомства растения самоопыляют или скрещивают с диким видом.
B. Пример 47A повторяют с тем изменением, что добавляют 100 мг/л или 200 мг/л гигромицина В к среде для поддержания каллюса.
Пример 48. Получение эмбриогенной суспензии из ткани Dactylis Glomerata L. (садовая трава).
A. Эмбриогенный каллюс получают из базальных сегментов самых молодых листьев растений (Dactylis glomerata L.), выращенных в теплице, как описано Hanning G.E. et al., Theor. Appl. Genet., 63, 155-159, (1982). Поверхностную стерилизацию листьев производят погружением в раствор хлорокса 1:10 [5,25% (вес/объем) гипохлорита натрия; The Clorox Company, Oakland, Ca.] приблизительно на 10 минут, затем асептически нарезают на маленькие сегменты от 1 до 5 мм в длину или в диаметре. Эти сегменты помещают в стерильную среду SH-30, содержащую 0,8% (вес/об.) агарозы для гелеобразования. Каллюс и/или эмбриогенные структуры появляются через 2-6 недель после посева, когда температура при культивировании составляет около 25oC.
Эмбриогенный каллюс поддерживается субкультивированием в свежей среде SH-30 каждые 2-4 недели и культивируется в темноте при 25oC.
B. Эмбриогенные суспензионные культуры инициируют, помещая приблизительно 0,5 г свежего эмбрионального каллюса в 50 мл жидкой среды, описанной Gray D. J. et al., Plant Cell Tissue Organ Cult., 4, 123-133 (1985), содержащей 45 мкМ дикамба и 4 г/л гидролизата казеина. Суспензионные культуры выращивают при 27oC при 16-часовом свете (40 мкЕ/м2• сек), 8-часовой темноте на вращающемся шейкере при скорости 130 об/мин в 125 мл флаконах Delong, закрытых металлическим колпачком и парафильмом. Приблизительно через 4 недели в течение 30 секунд дают осесть большим клампам, собирают аликвоты по 10 мл супернатанта среды, содержащей небольшие кластеры клеток, и переносят в 50 мл свежей среды. Эту процедуру повторяют каждые 3-4 недели, перенося наиболее удачные культуры, что оценивается по более мелким размерам клампов и лучшему качеству, определяемому присутствием малых цитоплазматических клеток. После 5-8 переносов суспензии в основном освобождаются от эмбриогенных клеток и большинство кластеров эмбриогеных клеток являются небольшими (150-2000 мкм).
Пример 49. Выделение и очистка протопластов Dactylis Glomerata L.
Протопласты получают из эмбриональных суспензионных культур, описанных в примере 48, асептической фильтрацией клеток на 0,2 мкм фильтрационной установке Nalgene2 с последующим добавлением по 0,5 г (свежего веса) клеток в 12,5 мл ферментативной смеси для протопластов в чашки Петри. Ферментативная смесь состоит из 2% (вес/об. ) Cellulase RS, 7 мМ CaCl2• H2O, 0,7 мМ NaH2PO4•H2O, 3 мМ MES (pH 5,6), глюкозы (550 mOs/кг H2O с pH 5,6) и стерилизуются фильтрованием. Смесь крутят на орбитальном шейкере со скоростью около 50 об/мин в тусклом свете (< 5мкЕ/м2•сек) в течение 4-5 часов. Продукт ферментации пропускают через сито из нержавеющей стали (ячейки 100 мкм) и распределяют в 12-мл центрифужные пробирки, которые центрифугируют при 60-100 g около 5 минут. Осадок, содержащий протопласты, промывают 3 раза средой для протопластов KM-8p, дополненной до 550 mOs/кг H2O глюкозой. На этом этапе можно сделать флотацию для дальнейшей очистки протопластов. В этом случае отмытые протопласты наслаиваются на 10 мл культуральной среды KM-8p, дополненной до 700 mOs/кг H2O сахарозой. После центрифугирования при 60-100 • g в течение приблизительно 10 минут слой протопластов на разделе фаз собирают тонкой пипеткой. Наконец, протопласты ресуспендируют в 1-2 мл культуральной среды KM-8p и пропускают через сетку из нержавеющей стали (ячейки 20 мкм). Освободившиеся протопласты собирают, отмывают и ресуспендируют в среде KM-8p для культивирования или в осмотически доведенной среде, предназначенной для трансформации согласно примерам 51-53.
Пример 50. Культура протопластов Dactylis Glomerata L. и выращивание каллюса.
A. Очищенные протопласты высевают при плотности около 5•105 протопластов/мл в культуральной среде KM-8p, содержащей 1,3% (вес/об.) SeaPlaqueR агарозы (FMC Corp., Marine Colloids Division, Rockland, Maine, USA) и 30-40% (вес/об.) кондиционированной среды, полученной из 3-4 недельной эмбриогенной суспензионной культуры Dactylis glomerata L. фильтрующей среды через стерильный 0,2 мкм фильтр NalgeneR, среду доводят до 550 mOsm/кг H2O добавлением глюкозы, и снова помещают в темноту при постоянной температуре 28oC. Через 10-14 дней агарозу нарезают в форме клиньев и помещают в "гранулярную культуру", как описано Shillito R.D. et al., Plant Cell Reports, 2, 244-247 (1983), используя 20 мл культуральной суспензионной среды SH-45 с 3% (вес/об. ) сахарозы на 3 мл исходной агарозной культуры. Чашки помещают на платформу шейкера и встряхивают со скоростью около 50 об/мин при свете 8 мкЕ/м2•сек. Новые суспензионные культуры образуются по мере роста колоний на агаре и высвобождения клеток в жидкую среду. Полученные в суспензии культивируемые клетки высевают на агаризованную среду SH-30 и помещают в темноту при температуре 25oC до формирования каллюса.
B. Протопласты культивируют, как описано в примере 50A, за исключением того, что культуральная среда не содержит кондиционированной среды.
Пример 51. Трансформация протопластов Dactylis Glomerata L. посредством электропорации.
A. Сразу же после очистки протопластов производят электропорацию по Shillito R. D. et al., Bio/Technology 3, 1099-1103 (1985), используя линеаризованную плазмиду, как описано в примере 20. Протопласты ресуспендируют после последней отмывки в концентрации около 7 • 106 протопластов/мл в буфере для электропорации (0,4 М маннитол, 6 мМ MgCl2). Протопласты распределяют аликвотами по 0,7 мл в 10-мл пластиковые центрифужные пробирки. В пробирки добавляют плазмидную ДНК, описанную в примере 20, и обработанную ультразвуком телячью тимусную ДНК (Sigma) до конечных концентраций 10 мкг/мл и 50 мкг/мл, соответственно. Затем добавляют 0,38 мл раствора полиэтиленгликоля (ПЭГ) (24% (вес/об.) ПЭГ 6000 в 0,4 М маннитоле 30 мМ MgCl2, 0,1% (вес/об.) MES (pH 5,6)) и раствор осторожно перемешивают. Суспензию протопластов переносят в камеру DialogR электропоратора и производят 10 импульсов с инициальным напряжением 3250 В/см и экспоненциальным спадом в 10 мксек с 30-секундными интервалами. Образец достают из камеры и помещают в чашку Петри диаметром 10 см. Добавляют 10 мл среды KM-8p, содержащей 1,2% (вес/об.) SeaPlaqueR агарозы, протопласты распределяют равномерно по среде, и агарозе дают образовать гель.
B. Пример 51A повторяют, за исключением того, что начальное напряжение составляет 3500 В/см, 4000 В/см, 5000 В/см, 3000 В/см или 2500 В/см.
C. Примеры 51A и B повторяют, за исключением того, что используют ПЭГ с молекулярным весом 4000 или 8000.
D. Примеры 51A-C повторяют, за исключением того, что конечная концентрация ПЭГ находится между 10% и 30% (вес/об.).
Пример 52. Трансформация протопластов Dactylis Glomerata L. обработкой полиэтиленгликолем (ПЭГ).
A. ПЭГ-опосредственный прямой перенос гена производят согласно Negrutiu 1. et al., (см. выше). В качестве ДНК используют линеаризованную плазмиду, описанную в примере 20.
Протопласты суспендируют после последней отмывки в 0,5 М маннитоле, содержащем 15 мМ MgCl2, в концентрации около 2 • 106 на мл. Суспензию протопластов разносят по 1 мл аликвотам в 10 мл пластиковые центрифужные пробирки. Добавляют ДНК, как описано в примере 51, затем добавляют 0,5 мл раствора ПЭГ (40% (вес/об.) ПЭГ 4000 в 0,4 М маннитоле, 0,1 М Ca(NO3)2, pH 7,0). Растворы осторожно перемешивают и инкубируют 30 минут при комнатной температуре (около 24oC) с эпизодическим встряхиванием. Затем добавляют 1,4 мл моющего раствора и содержимое пробирки осторожно перемешивают. Моющий раствор состоит из 87 мМ маннитола, 115 мМ CaCl2, 27 мМ MgCl2 39 мМ KCl, 7 мМ Трис-HCI и 1,7 г/л миоинозитола, pH 9, 0. В дальнейшем 4 аликвоты промывающего раствора добавляют по 1,4 мл с интервалами в 4 минуты с перемешиванием после каждого добавления. Пробирку центрифугируют при 60 • g в течение около 10 минут, супернатант удаляют. К осажденным протопластам добавляют 1 мл культуральной среды KM-8p и переносят в чашку Петри с диаметром 10 см. Добавляют 10 мл среды KM-8p, содержащей 1,2% (вес/об. ) SeaPlaqueR агарозы. Протопласты равномерно распределяют по среде и агарозе дают образовать гель.
B. Пример 52A повторяют с одной или более из следующих модификаций:
(1) pH промывающего раствора доводят до 5,6 или 7,0.
(2) Используют ПЭГ с молекулярным весом 6000, 2000 или 8000.
(3) Среда для отмывки состоит из 154 мМ NaCl, 125 мМ CaCl2 5 мМ KCl, 5 мМ глюкозы, pH доводят до 6,0 KOH, или 0,2 М CaCl2, 0,1% (вес/об.) MES, pH доводят до pH 6,0 KOH, или из 0,2 М CaCl2 7 мМ Трис/HCl, pH 9,0 с KOH.
Пример 53. Трансформация протопластов Dactylis Glomerata L. электропорацией или обработкой ПЭГ.
Трансформацию производят, как описано в примерах 51 или 52, за исключением того, что протопласты выдерживают при 45oC около 5 минут перед распределением по аликвотам в пробирки для трансформации, или после распределения по аликвотам, или перед добавлением ПЭГ.
Пример 54. Селекция трансформированных колоний.
A. Культуральные чашки Петри, содержащие протопласты из примеров 51-53, инкубируют 10 дней в темноте при 25oC и затем нарезают на 5 равных частей для "гранулярных культур" (Shillito R. D. et al., Plant Cell Reports 2, 244-247 (1983)). Каждую из четырех частей помещают в 20 мл культуральной среды SH-15 45 с 4 г/л гидролизата казеина и 20 мкг/мл гигромицина B. Пятую часть помещают в 20 мл той же среды без гигромицина В, для неселективного контроля. Через 4-5 недель клеточные колонии, которые, как предполагают, произошли из трансформированных протопластов, растущие на гигромицине B, вырезают из агарозы и помещают в 19-мм чашки Петри с 2 мл жидкой среды SH- 45, содержащей 20 мкг/мл гигромицина B, которые встряхиваются на орбитальном шейкере со скоростью около 50 об/мин. Последующие 4-5 недель все колонии, которые дают рост новых клеток, переносят в 125-мл флаконы Erienmeyer и выращивают так же, как и родительскую суспензионную культуру, за исключением того, что в среду включают 20 мг/мл гигромицина B.
Новые суспензии субкультивируют каждые 1-3 недели, используя среду SH-45, содержащую 4 г/л гидролизата казеина и 20 мкг/мл гигромицина B. Клетки из этих суспензий высевают также на плотную среду SH-30, содержащую 20 мкг/мл гигромицина B, и инкубируют при 25oC в темноте. Каллюсы, которые вырастают из посеянных клеток, субкультивируют каждые 2 недели на свежей среде. Предполагается, что клетки, которые растут в присутствии гигромицина B, являются трансформантами.
B. Селекция проводится, как описано в примере 54A, за исключением того, что колонии клеток из протопластов, растущие на среде с гигромицином B, помещают в чашки с агаром, содержащим среду SH-30 с 20 мкг/мл гигромицина B и инкубируют при 25oC в темноте.
Пример 55. Регенерация растений из трансформированных Dacivlis Glomeraia L.
A. Каллюс Dactylis Glomerata L. (полученный, как описано в примере 54 из протопластов) выращивают на твердой среде SH-30 и субкультивируют каждые 2 недели. Каждый формирующийся эмбрион переносят в герминативную среду (SH-O) и помещают на свет (45-55 мкЕ/м2• сек). Развитие этих эмбрионов происходит за 1-4 недели и получающиеся ростки помещают в среду SH-O на свету для того, чтобы сформировалась корневая система. Их переносят в теплицу на стадии от 6 до 12 листьев и постепенно закаливают.
B. Каллюс (полученный, как описано в примере 54) из протопластов выращивают на среде SH-0 с 0,24% (вес/об.) GelriteR в качестве отвердителя на свету (45-55 мкЕ/м2•сек), и субкультивируют каждые 2 недели. Полученные ростки помещают в смесь 1: 1 среды SH-O и OMS с добавлением смеси 0,12% (вес/об. ) GelriteR и 0,4% (вес/об.) агара в качестве отвердителя и выращивают на свету для формирования корневой системы. Их переносят в теплицу на стадии от 6 до 12 листьев и постепенно закаливают.
C. Маленькие ростки, полученные как описано в примерах 44A и 44B выше, помещают в среду OMS с 0,8% (вес/об.) агара как отвердителя и выращивают на свету для формирования корневой системы. Их переносят в теплицу на стадии от 6 до 12 листьев и постепенно закаливают.
D. Маленькие ростки, полученные как описано выше в примере 44A, помещают в смесь 1:1 сред SH-O и OMS с 0,12% (вес/об.) GelriteR и 0,4% агара как отвердителя и выращивают на свету для формирования корневой системы. Их переносят в теплицу на стадии от 6 до 12 листьев и постепенно закаливают.
6. Транзиторная генная экспрессия.
Следующие примеры описывают, как химерный ген можно вводить и использовать без необходимости стабильного включения гена в геном растения.
Пример 56. Введение ДНК в протопласты N. Tabacum обработкой ПЭГ
A.
Получение протопластов N. tabacum можно проводить в соответствии с методами, описанными в следующих публикациях: Paszkowski J. et al., EMBO J. 3, 2717 (1984); заявка на патент Великобритании 2159173,
EP 0129668; Shillito R. D. и Potrykus 1. в: Methods in Enzymology, далее Wu R. и Grossman L., Academic Press, Oriando, Florida, т.153, 313-306 (1987) или другими методами, известными по
руководствам.
B. ДНК вводят в протопласты модифицированным методом Negrutiu 1. et al., Plant Mol. Biol. 8, 363 (1987). Протопласты, полученные, как описано в примере 56A, ресуспендируют после последней отмывки в растворе, содержащем 0,4 М маннитола, 15-30 мМ CaCl2, 0,1% вес/об. MES в концентрации 1,6-2 • 106 на мл. Суспензию протопластов распределяют по 0,5 мл аликвотам в 10-мл центрифужные пробирки. Добавляют ДНК, очищенную в примерах 19-31, в 10 мл стерильной дистиллированной воды, стерилизованной, как описано Paszkowski J. et al. , EMBO J. 3, 2717 (1984), затем добавляют 0,5 мл раствора ПЭГ (40% (вес/об. ) ПЭГ мол. вес 8000 в 0,4 М маннитоле, 0,1 М Ca(NO3)2, pH 7,0). Растворы осторожно перемешивают и инкубируют при комнатной температуре 30 минут (около 24oC) с эпизодическим встряхиванием. Затем добавляют 1 мл отмывающего раствора, содержимое пробирки тщательно перемешивают. Отмывающий раствор состоит из 154 мМ NaCl, 125 мМ CaCl2, 5 мМ KCl, 5 мМ глюкозы, pH доводят до 6,0 с помощью KOH. Затем аликвоты по 2 мл, 3 мл, 4 мл отмывающего раствора добавляют последовательно с 5-минутными интервалами, мешая после каждого добавления. Затем пробирку центрифугируют при 10-100 • g около 10 минут, и супернатант удаляют. К осажденным протопластам добавляют необходимое количество среды K3 с 0,3 М глюкозы для осмолярности, сахарозу не используют, до конечной концентрации 100000 на мл и культивируют в чашках Петри диаметром 10 см.
C. Пример 56B
повторяют с одной или несколькими модификациями:
(1) pH отмывающего раствора доводят до 5,6 или 7,0.
(2) Используют ПЭГ с молекулярным весом 4000.
(3) Отмывающая среда состоит из 0,2 М CaCl2, 0,1% вес/об. MES, pH 6,0 с KOH, или из 0,2 М CaCl2, 7 мМ Трис/HCl, pH 9.0 с KOH.
(4) 50 мкг расщепленной ДНК тимуса теленка в 25 мкл стерильной воды добавляют вместе с плазмидой ДНК.
(5) Плазмидную ДНК линеаризуют обработкой соответствующей рес-триктазой (e.g. BamHI).
Пример 57. Введение ДНК в протопласты N. tabacum электропорацией.
A. Введение ДНК в протопласты N. tabacum производят обработкой протопластов электрическим импульсом в присутствии соответствующей ДНК, модифицированной методом Fromm M.E. в: Methods in Enzymology, далее Wu R. и Grossman L., Academic Press, Orlando, Florida, T.153, 307 (1987); и Shillito R. D. и Potrykus 1., там же, стр.283-306.
Протопласты выделяют, как описано в примере 56A. Протопласты ресуспендируют после последней отмывки в следующем растворе: 0,2 М маннитола, 0,1% вес/об. MES, 72 мМ NaCl, 70 мМ CaCl2 2,5 мМ KCl, 2,5 мМ глюкозы, pH доводят до 5,8 KOH, в концентрации 1,6-2,0 • 10 на мл. Суспензию протопластов распределяют по 1 мл аликвотам в пластиковые однообразные кюветы и добавляют 10 мкг ДНК, как описано в примерах 56B и C. Сопротивление раствора на этом этапе при измерении между электродами из 471 комплекта электродов аппарата для электропорации, описанного ниже, должно быть в пределах 6 Ом.
ДНК, описанную в примерах 19-31, добавляют в 10 мл стерильной воды, стерилизованной, как описано Paszkowski J. et al., EMBO J. 3, 2717 (1984). Раствор осторожно перемешивают при комнатной температуре (24-28oC), подвергают воздействию импульса в 400 В/см с константой экспоненциального спада 10 мсек с помощью аппарата для электропорации BTX-Transfector 300, используя набор электродов 471. Протопласты выдерживают 5 минут, а затем переносят в чашки Петри и добавляют среду K3, как описано в примере 56A так, чтобы концентрация протопластов составляла 100000 на мл.
B. Пример 57A повторяют с одной или несколькими из следующих модификаций:
(1) Используют напряжение 200 В/см или от 100
В/см до 800 В/см.
(2) Константа экспоненциального спада составляет 5 ms, 15 ms или 20 ms.
(3) 50 мг расщепленной ДНК тимуса теленка в 25 мл стерильной воды добавляют вместе с плазмидной ДНК.
(4) Плазмидную ДНК линеанизируют обработкой соответствующей растриктазой (например, BamHI).
Пример 58. Введение ДНК в протопласты Zea Mays Линии 2717.
Протопласты маиса инбредной линии Funk 2717, приготовленные как описано в примерах 40-47 и суспендированные в эфирных растворах, описанных для ресуспендирования протопластов N.tabacum в примерах 56 и 57 как это описана выше в концентрации 10 на мл. Трансформацию проводят аналогично описанной в примерах 56-57. Протопласты культивировали после трансформации до концентрации 2•106 на мл. в культуральной среде KM-8p без добавления отвердителя при содержании 1 мг/л 2,4-D.
Пример 59. Введение ДНК в протопласты Sorghum Bicolor.
Суспензию протопластов sorghum FS 562 приготавливают аналогично описанной для Zea mays в примере 40 и ресуспендируют в любом растворе, описанном для ресуспендирования протопластов N.tabacum в примерах 56 и 57 до концентрации 107 на мл. Трансформацию осуществляют как описано в примере 58. Протопласты культивировали после трансформации до концентрации 2 • 106 на мл в KM-8p без добавления агента отверждения.
Пример 60. Введение ДНК в протопласты Nicotiana Plumbaginifolia. Petunia Hybrida и Lolium Multiflorium.
Протопласты N. plumbaginifolia, P.hydrida или L.multiflorum приготавливали как описано в примерах 56 и 57.
Их культивируют на среде, описанной Shillito и Potrykus, см. выше, без добавления агарозы или какого-либо другого желатинирующего агента.
Пример 61. Введение ДНК в протопласты Glycine Мах.
Готовят протопласты Glycine Мах по методикам, описанным Tricoli D.M. et al. , Plant Cell Reports, 5, 334-337 (1986), или Chowhury V.K. и Windholm J. M., Plant Cell Reports 4, 289-292 (1985), или Klein A.S. et al., Planta 152, 105-114 (1981). ДНК вводят в эти протопласты по существу, как описано в примерах 56 и 57. Протопласты культивируют, как описано Klein A.S. et al., см. выше, Chowhury V. К. и Windholm J.M., (см. выше), или Tricoli D.M. et al., (см. выше), без добавления альгината для отверждения среды.
7. Химическое регулирование в ткани трансгенного растения.
Следующие примеры описывают процедуры для химического регулирования химически регулируемых генов в рассматриваемых тканях трансгенных растений. Хотя следующие примеры относятся к индукции, подобные процедуры могут быть применимы для систем, функционально связанных с репрессией.
Разнообразные методики пригодны для обработки трансгенных клеток химическим регулятором. Например, клетки могут быть суспендированы в жидкой среде, содержащей регулятор. Каллюс может быть выращен или перенесен на среду, содержащую регулятор, или регулятор может быть нанесен на каллюс стерильной кисточкой для окрашивания, или предпочтительно растительной метелкой (a plant mister). Подобным образом растения или части растений обрабатывают суспензией или раствором регулятора с помощью кисточки или предпочтительно растительной метелкой.
Экспрессия фенотипического признака в трансгенных растениях, содержащих химически регулируемый химерный ген, пропорциональна количеству регулятора, нанесенного на растение или растительную ткань.
Пример 62. Химическая индукция в культурах трансгенных каллюсов.
A. Каллюс, полученный согласно ранее описанным процедурам, проверяют на химическую индукцию путем нанесения стерильной кисточкой или растительной метелкой стерилизованного через фильтр раствора 0,1-50 мМ салициловой кислоты, pH которой был установлен равным 6,0-8,0 путем добавления NaOH.
После индукции каллюс инкубируют 2 дня и затем собирают урожай, замораживают в жидком азоте и хранят при -80oC до тех пор, пока не будет проанализирована индукция гена, как описано в примере 65 и/или примере 66.
B. Аналогично используют для индукции следующие растворы:
(1) 0,1-50 мМ
бензойной кислоты, pH которого был установлен между 6,0 и 8,0 добавлением NaOH.
(2) 0,1-50 мМ полиакриловой кислоты, pH которой был установлен между 6,0 и 8,0 добавлением NaOH.
(3) Метил-бензо-1,2,3-тиадиазол-7-карбоксилат. Готовят раствор, повторно суспендируя смачивающийся порошок, содержащий химикат, в стерильной воде, в течение нескольких минут при концентрации 1 мг/мл. Удаляют нерастворимый твердый продукт из раствора с помощью стерилизующего фильтра.
(4) 0,1-50 мМ бензо-1,2,3-тиадиазол-7-карбоновой кислоты, pH между 6,0 и 8,0. Соединение растворяют в минимальном количестве диметилсульфоксида (ДМСО), затем разбавляют стерильной водой до желаемой концентрации. Полученную суспензию наносят без фильтрования.
(5) 0,1-50 мМ н-пропил-бензо-1,2,3-тиадиазол-7-карбоксилат, приготовлен, как в (4).
(6) 0,1-50 мМ бензил-бензо-1,2,3-тиадиазол-7-карбоксилат, приготовлен, как в (4).
(7) 0,1- 50 мМ бензо-1,2,3-тиадиазол-7-карбоновой кислоты N-втор.- бутилгидразид, приготовлен, как в (4).
(8) 0,1-50 мМ 2,6-дихлоризоникотиновой кислоты, pH между 6,0 и 8,0, приготовлен, как в (4).
(9) 0,1-50 мМ метил-2,6-дихлоризоникотината, приготовлен, как в (4).
Пример 63. Химическая индукция в трансгенных растениях.
A. Экспрессия гена индуцируется в растениях, полученных согласно ранее описанным процедурам, путем нанесения тонко распыляемого раствора 0,1- 50 мМ салициловой кислоты, pH которого был установлен между 6,0 и 8,0 с помощью NaOH, на листья, используя растительную метелку.
Растениям дают продолжать расти в течение 2 дней, а затем собирают урожай, замораживают в жидком азоте и хранят при -80oC до тех пор, пока они не будут проанализированы, как описано в примере 65 и/или в примере 66.
B. Аналогично используют следующие растворы для индукции:
(1) 0,1- 50 мМ бензойной кислоты, pH которого был установлен между 6,0 и 8,0 путем добавления NaOH.
(2) 0,1-50 мМ полиакриловой кислоты, pH которого был установлен между 6,0 и 8, 0 добавлением NaOH.
(3) Метил-бензо-1,2,3-тиадиазол-7-карбоксилат. Раствор готовят ресуспендированием смачивающегося порошка, содержащего химикат, в стерильной воде в течение нескольких минут при концентрации 1 мг/мл. Нерастворимый твердый продукт удаляют из раствора стерильным фильтрованием.
(4) 0,1-50 мМ бензо-1,2,3-тиадиазол-7-карбоновой кислоты, pH между 6,0 и 8,0. Соединение растворяют в минимальном количестве диметилсульфоксида (ДМСО), затем разбавляют стерильной водой до желаемой концентрации. Полученную суспензию наносят без фильтрования.
(5) 0,1-50 мМ н-пропил-бензо-1,2,3-тиадиазол-7-карбоксилат, приготовлен, как в (4).
(6) 0,1-50 мМ бензил-бензо-1,2,3-тиадиазол-7-карбоксилат, приготовлен, как в (4).
(7) 0,1-50 мМ бензо-1,2,3-тиадиазол-7-карбоновой кислоты N-втор.-бутилгидразид, приготовлен, как в (4).
(8) 0,1-50 мМ 2,6-дихлоризоникотиновой кислоты, pH между 6,0 и 8, 0, приготовлен, как в (4).
(9) 0,1-50 мМ метил-2,6-дихлоризоникотината, приготовлен, как в (4).
Пример 64. Индукция экспрессии встроенной ДНК в протопластах N. tabacum, Zea mays, N. Plumbaginifolia. P. Hybrida. L.Multiflorum и Sorghum Bicolor.
A. Протопласты, обработанные, как описано в примерах 56-61 выше, культивируют при 26oC в темноте в течение 2 дней. Затем добавляют салициловую кислоту до концентрации между 0,1 и 50 мМ в виде нейтрального раствора, pH между 6,0 и 8,0. Протопласты культивируют еще 2 дня, собирают центрифугированием, быстро замораживают и анализируют, как описано в следующих примерах.
B. Аналогично могут быть добавлены нейтрализованные растворы или суспензии следующих
соединений к протопластам с получением конечной концентрации между 0,1 и 50 мМ:
(1) бензойная кислота
(2) полиакриловая кислота
(3) метил-бензо-1,2,
3-тиадиазол-7-карбоксилат
(4) н-пропил-бензо-1,2,3-тиадиазол-7-карбоксилат
(5) бензо-1,2,3-тиадиазол-7-карбоновая кислота
(6) бензил-бензо-1,2,3-тиадиазол-7-карбоксилат
(7) бензо-1,2,3-тиадиазол-7-карбоновой кислоты N-втор.-бутилгидразид
(8) 2,6-дихлоризоникотиновая кислота
(9) метил-2,6-дихлоризоникотинат.
C. Аналогично проводят индукцию, как описано в примерах 64A и B, за исключением того, что протопласты культивируют в течение 1 дня, 3 дней или 5 дней перед индукцией.
D. Индукцию проводят, как описано в примерах 64A, B или C, за исключением того, что протопласты культивируют в течение 1 дня, 3 дней или 5 дней после индукции и перед сбором урожая.
Пример 65. Анализ химически индуцируемой последовательности ДНК: продуцирование иРНК.
Индуцируют растительный материал, собирают урожай, как в примерах 62-64, и анализируют его на индукцию видов иРНК путем выделения РНК и анализа его с помощью метода удлинения праймера, как описано в примере 5.
Каллюс или регенерированный растительный материал, происходящий из трансгенных растений, содержащих химически регулируемые химерные гены, кодирующие GUS, AHAS или BT, и индуцированные салициловой кислотой, метил-бензо-1,2,3-бензотиадиазол-7-карбоксилатом, бензо-1,2, 3-тиадиазол-7- карбоновой кислотой, н-пропил-бензо-1,2,3-тиадиазол-7-карбоксилатом, бензил-бензо-1,2,3-тиадиазол-7-карбоксилатом, N-втор. -бутилгидразидом бензо-1,2,3-тиадиазол-7-карбоновой кислоты, 2, 6-дихлоризоникотиновой кислотой, метил-2,6-дихлоризоникотинатом или TMV, показывают повышенные уровни иРНК при анализе GUS, AHAS или BT праймера соответственно, при анализе с помощью метода удлинения праймера. Уровень иРНК пропорционален количеству нанесенного регулятора.
Пример 66. Анализ химически индуцируемой последовательности ДНК: Ферментативная активность β
- глюкуронидазы
A. Анализ методом твердофазного иммуноферментного анализа (ELISA).
Ткань замороженного листа измельчают в ступке с пестиком в присутствии жидкого азота для получения тонкого порошка. Готовят экстракт листа при смешивании заданного веса (г) с эквивалентным объемом (мл) GUS экстрагирующего буфера (50 мМ натрийфосфатного буфера pH 7,0, 0,1% Тритон-X 100, 0, 1% саркозила, 10 мМ β меркаптоэтанола), как описано Jefferson R.A. et al., Proc. Natl. Acad. Sci. USA 83, 8447-8451 (1986).
Проводят реакции в ячейках планшетов для анализа методом тверд офазного иммуноферментного анализа при смешивании 5-25 мкл экстракта с 120-100 мкл GUS аналитического буфера (50 мМ натрийфосфатного буфера, pH 7,0, 0,1% Тритон-X 100, 10 мМ β - меркаптоэтанола), содержащего 4-метилумбеллиферилглюкуронид (MU) при конечной концентрации 2 мМ в общем объеме 125 мкл. Планшеты инкубируют при 37oC в течение 1-5 часов и прекращают реакцию добавлением 150 мкл 3 М Na2CO2. Определяют концентрацию выделившегося флюоресцентного индикатора при считывании планшетов на считывающем устройстве Flow Labs Fluoroskan II ELISA.
B. Результаты. (См. табл. II).
Трансформированный каллюс табака (пример 23): Следующие GUS активности были получены из образцов трансформированных каллюсов, которые были собраны через 21 час после обработки. Трансформирован CIB271: Опрыскивание H2O: 1,8 nKat MU/мг белка; Опрыскивание 50 мМ салицилата натрия: 3,8 nKat MU/мг белка. Трансформирован CIB271 (другой эксперимент): опрыскивание H2O: 2,8 nKat MU/мг белка; опрыскивание 250 мкг метил-бензо-1,2,3-тиадиазол-7-карбоксилата: 13,7 nKat MU/мг белка. Трансформирован CIB273: опрыскивание H2O: 0,46 nKat MU/мг белка; опрыскивание 250 мкг/л метил-бензо-1,2,3-тиадиазол-7- карбоксилата: 31,2 nKat MU/мг белка.
Трансформированная морковь (пример 36): Следующие GUS активности были получены из образцов каллюса, трансформированного рCIB271, который был собран через 21 день после обработки. Опрыскивание водой: 5,2 pKat MU/мг белка. Опрыскивание 50 мМ салицилата натрия: 11,6 pKat MU/мг белка. Опрыскивание 250 мкг/л метил-бензо-1,2,3-тиадиазол-7-карбоксилата: 22,1 pKat MU/мг белка.
Трансформированные томаты (пример 38): Следующие GUS активности были получены из образцов трансформированных каллюсов, которые были собраны через 21 день после обработки. Трансформирован CIB271: Опрыскивание водой: 17,2 pKat MU/мг белка. Опрыскивание 250 мкг/л метил-бензо-1,2,3-тиадиазол-7- карбоксилата: 56,1 pKat MU/мг белка. Трансформирован CIB273 X A4: Опрыскивание водой: 4,6 pKat MU/мг белка. Опрыскивание 250 мкг/л метил-бензо-1,2,3-тиадиазол-7-карбоксилата: 22,1 pKat MU/мг белка.
Нестабильная экспрессия в протопластах табака (пример 56), обработанных рCIB269: вода: 30,6 ± 13 pKat MU/мг белка; метил-бензо-1,2,3-тиадиазол-7-карбоксилат: 66,6 ± 20 pKat MU/мг белка.
Пример 67. Анализ химической индукции эндогенного гена.
B качестве контрольной процедуры материал растений табака, индуцированный, как описано в примерах 62-64, салициловой кислотой и метилбен-зо-1,2,3-тиадиазол-7-карбоксилатом и TMV, был проанализирован на транскрипцию иРНК из эндогенного PR-1a гена по методикам, описанным в примере 5. Повышенные уровни иРНК были зарегистрированы после индукции всеми тремя индукторами.
Пример 68. Анализ химически индуцированных последовательностей ДНК: Ферментативная активность ацетоксикислотной синтазы (AHAS).
A. Приготовление образца для AHAS анализа.
Были определены три веса листового и/или корневого материала, подлежащего анализу, ткань помещают в жидкий азот и мацерируют в тонкий порошок. Добавляют один объем (в мл) холодного буфера для гомогенизации (50 мМ NaH2PO4, буфер pH 7,0, 0,5 мМ EDTA pH 7,0, 0,5 мМ MgCl2 мМ пирувата натрия, pH 7,0, 10 мкМ флавин-аденин-динуклеотида, 1 мМ фенилметилсульфонилфторида, 10% глицерина), равный двукратному весу (г) ткани, и переносят смесь клеток в пресс Френча (French pressure). Все последующие стадии проводят, сохраняя материал холодным (около 4oC). Клетки разрушают при 16000 фунт/дюйм2 = кг/см2, собирают клеточный эксудат в контейнер на льду. Альтернативно ткань измельчают в буфере для гомогенизации в ступке с пестиком вместо обработки в прессе Френча (French pressure). Эксудат центрифугируют 5 минут при 10000 об/мин для очистки клеточного дебриса. Измеряют объем надосадочного слоя и добавляют сульфат аммония сорта для ферментов до 25% насыщения (144 мг (NH4)2SO4/мл надосадочного слоя). Смесь перемешивают на льду в течение 15 минут, затем центрифугируют в течение 5 минут при 10000 об/мин. Осадок отбрасывают и устанавливают 50% насыщение надосадочного слоя сульфатом аммония (158 мг NH4)2SO4/мл надосадочного слоя). После перемешивания на льду в течение 15 минут осадок собирают центрифугированием при 1000 об/мин в течение 5 минут. Полученный осадок растворяют в 1 мл колоночного буфера на каждые 2 г листового или 5 г корневого материала. Экстракт обессоливают путем нанесения на колонку с Сефадексом G50, уравновешенную колоночным буфером (50 мМ NaH2PO4, буфер pH 7,0, 0,1 мМ EDTA pH 7,0, 0,5 мМ MgCl2 10 мкМ флавин-аденин-динуклеотида, 1 мМ фенилметилсульфонилхлорида, 10% глицерина). Образец элюируют колоночным буфером, собирают 2 мл образца на каждый мл образца, нанесенного на колонку.
B. Анализ в трубке.
5-50 мкл экстракта, полученного согласно примеру 68A, растворяют в общем объеме 0,5 мл реакционной смеси (20 мМ NaH2PO4 буфера pH 7,0, 20 мМ пирувата натрия pH 7,0, 0,5 мМ тиаминпирофосфата, 5 мМ MgCl2, 10 мкМ флавин-аденин- динуклеотида). Смесь инкубируют 30 минут при 37oC. Реакцию прекращают добавлением 50 мкл 6н H2SO4. Смесь инкубируют в течение 15 минут при 60oC, затем обрабатывают 625 мкл α- нафтольного реагента (500 мкл 5% α- нафтола в 2,5 М NaOH и 125 мкл 25 мг/мл креатина) и инкубируют еще 15 минут при 60oC. Если образуется осадок, его удаляют и измеряют поглощение при 520 нм. Вычисляют количество рМолей ацетоина на стандартной кривой, составленной с использованием 0,4-10 мкг ацетоина. Удельная активность выражена в pKat/мг белка.
C. Исследование планшет для твердофазного иммуноферментного анализа. Помещают 1-20 мкл образца в ячейку планшеты для твердофазного иммуноферментного анализа при общем объеме реакционной смеси 0,15 мл. Смесь реагирует в течение 30 минут при 37oC. Реакцию прекращают добавлением 50 мкл 2,4 М H2SO4, содержащей 1% креатина. Смесь инкубируют в течение 30 минут при 60oC. Любой имеющийся осадок отделяют центрифугированием. Переносят 150 мкл анализируемой смеси в новую плашету для твердофазного иммуноферментного анализа, обрабатывают 100 мкл 10% α-нафтола в 5 М NaOH и инкубируют еще 20 минут при 60oC. Измеряют поглощение при 520 нм, удельная активность выражена, как в примере 68B.
Пример 69. Анализ химически индуцируемых последовательностей ДНК: Эндотоксин Bacillus thuringiensis.
A. Процедура экстракции растения.
Около 100 мг ткани растения гомогенизируют в 0,1 мл буфера для экстракции (50 мМ Na2CO3 pH 9,5, 10 мМ EDTA, 0,05% Тритона-X 100, 0, 05% Твина, 100 мМ NaCl, 1 мМ фенилметилсульфонилфторида (добавляется непосредственно перед использованием) и 1 мМ Leu-пептина (добавляется непосредственно перед использованием)). После экстракции добавляют 2 М Трис pH 7,0 до установления pH 8,0-8,5. Затем экстракт 10 минут центрифугируют в микрофуге Бекмана и надосадочный слой используют для твердофазного иммуноферментного анализа.
B. Твердофазный иммуноферментный анализ.
Планшеты для твердофазного иммуноферментного анализа предварительно обрабатывают этанолом. Добавляют в планшеты 50 мкл антисыворотки кролика kBt, очищенной методом аффинной хроматографии, при концентрации 3 мкг/мл в борат-буферном солевом растворе (100 мМ борной кислоты, 25 мМ бората натрия, 75 мМ NaCl, pH 8,4-8,5) и оставляют инкубироваться в течение ночи при 4oC. Антисыворотку получают в результате иммунизации кроликов градиент-очищенными Bt-кристаллами (эндотоксин Bacillus thuringiensis [Ang B.J. и Nickerson K.W. , Appl. Environ. Microbiol. 36, 625-626 (1978)], солюбилизованными додецилсульфатом натрия. Планшеты промывают свежим буфером (10 мМ Трис-HCl, pH 8,0, 0,05% Твина 20, 0,02% азида натрия), затем обрабатывают 1 час при комнатной температуре блокирующим буфером (10 мМ натрийфосфатного буфера, pH 7,4, 140 мМ NaCl, 1% бычьего сывороточного альбумина, 0,02% азида натрия), и промывают снова. Добавляют растительный экстракт в таком количестве, чтобы ввести 50 мкг белка (обычно примерно 5 мкл экстракта; белок определяют по методу Bradford М. , Anal. Biochem. 72, 248 (1976), используя коммерчески доступный набор из Био-Рад) и инкубируют всю ночь при 4oC. После промывки добавляют 50 мкл козлиной антисыворотки kBt, очищенной методом аффинной хроматографии, при концентрации 3 мкг/мл белка в разбавителе для твердофазного иммуноферментного анализа (10 мМ натрийфосфатного буфера, pH 7,4, 140 мМ NaCl, 0,05% Твина 20, 1% бычьего сывороточного альбумина, 0,02% азида натрия), затем оставляют инкубироваться в течение 1 часа при 37oC. После промывки добавляют 50 мкл кроличьих антител к козлиным антителам, связанным со щелочной фосфатазой (Sigma Chemicals, St. Louis, Mo., USA), разбавленным 1:500 в разбавителе для твердофазного иммуноферментного анализа, и оставляют инкубироваться в течение 1 часа при 37oC. После промывки добавляют 50 мкл субстрата (0,6 мг/мл пара-нитрофенилфосфата, 0,05 мг/мл MgCl2, 10% диэтаноламина, pH 9,8 устанавливают HCl) и оставляют инкубироваться в течение 30 минут при комнатной температуре. Реакцию заканчивают добавлением 50 мкл 3 М NaOH. Поглощение проверяют при 405 нм в модифицированном разбавителем для твердофазного иммуноферментного анализа в считывающем устройстве (Hewlett Packard, Stanford, Ca., USA).
Пример 70. Получение огуречной геномной ДНК.
Клеточные ядра выделяют из листьев Cucumis Sativus (Long Marketer) посредством того, что 35 г ткани листьев вначале замораживают в жидком азоте, а затем измельчают до тонкого порошка с помощью ступки и пестика.
Порошок вносят в 250 мл специального буфера, состоящего из 0,3 М сахарозы, 50 мM Tris, pH 8, 5 мM хлорида магния, 5 мM бисульфита натрия, 0,5% NP40, и перемешивают на льду в течение 10 минут. Эту смесь фильтруют через шесть слоев марли и жидкость центрифугируют при 700 • g в течение 10 минут. Осадок ресуспендируют в вышеуказанном буфере и эту суспензию наносят слоем на 20 мл холодной сахарозной подложки, содержащей 10 мM Tris, pH 8, 1,5 мM хлорида магния, 140 мM хлорида натрия, 24% сахарозы, 1% NP40. Пробирки центрифугируют при 17000 • g в течение 10 минут. Осадок на этой стадии содержит главным образом ядра и крахмальные зерна. ДНК высокого молекулярного веса выделяют из ядер в основном согласно Maniatis et al., (1982) с использованием градиентов хлорида цезия и бромэтила.
Пример 71. Получение геномной библиотеки.
3 μг очищенной ДНК переваривают EcoRI, BamHI и фрагменты разделяют на 0,5% агарозном геле. Этот гель подвергают блоттингу на нейлоновой мембране (производитель NEN Research Products, Boston, MA, изделие "GeneScreen Plus") в 0.4 М NAOH, как описано Reed et al., (см. Nucleic Acids Res. 13:7207-7221,1985). Гелевый блот гибридизируют к зонду кДНК огуречной хитиназы, меченной32P случайным праймированием, о использованием набора "Prime Time" (International Biotechnologies, New Haven, CT).
В переваренном EcoRI материале обнаружена единственная полоса; таким образом, можно заключить, что получен ген огуречной хитиназы с использованием общего переваривания посредством EcoRI и лигирования в клонирующий вектор лямбда - заместительного типа.
10 мкг этой же ДНК полностью переваривают с использованием EcoRI, и затем ДНК экстрагируют фенолом, осаждают этанолом и лигируют в EMBL, в сайт расщепления EcoRI. С кДНК-зондом огуречной хитиназы, меченным32P, подвергают скринингу примерно 100 000 пятен. Собирают десяток пятен, давших положительную реакцию, очищают и приготавливают из них ДНК для инсерции, с использование "Lambda Sorb Immunoaffinity Adsorbent" иммуноаффинного адсорбента согласно указаниям производителя (Peomega, Madison, WI). Инсертную ДНК анализируют посредством предварительного картирования рестрикционным перевариванием, которое показывает идентичность инсертов. Для дальнейшего анализа выбирают один из клонов, инсерт размером 12 Kb субклонируют в вектор Bluescript (Stratagene, Lazolla, CA) с получением плазмиды pBScucchrcht 5. Плазмида pBScucchrcht 5 депонирована в ATCC и получила депозитарный номер ATCU 40941.
Пример 72. Получение клонов для секвенирования.
Устанавливают рестрикционную карту для pBScucchrcht 5 и фрагменты инсерта геномной ДНК субклонируют pBluescript. Генерированные клоны обозначили D 1-3, D-Cla1, D-Cla2, D-BamCla и D-XbaI. Клон D 1-3 создан из гель-очищенного EcoRI-фрагмента pBScucchrcht5. Этот фрагмент переваривают EcoRV, и инсерт EcoRV очищают на геле от векторной части. Агароза с низкой температурой плавления для гелевой очистки получена от BRL (Gaithersburg, MD ). EcoRI линкеры (BRL, )обрабатывают киназой и лигируют с EcoRV-частью, а затем эту часть переваривают EcoRI и снова подвергают гель-очистке. Очищенный фрагмент лигируют к pBluescript, который был переварен EcoRI, и обрабатывают щелочной фосфатазой из кишечника теленка (Boсhringer Mannheim Biochemical, Indianapolis, IN).
pBScucchrcht 5 переваривают ClaI с целью генерировать два ClaI-фрагмента, содержащих инсертную ДНК. Эти части очищают на геле и раздельно клонируют в Bluescript, который был переварен ClaI и обработан щелочной фосфатазой из кишечника теленка. Полученные плазмиды названы D-ClaI и D-Cla2. Плазмида D-BamCla изготовлена посредством выделения BamHI/ClaI фрагмента pBScucchrcht 5 и клонирования его в pBluescript, переваренный BamHI и ClaI. Плазмида D-XbaI изготовлена посредством выделения инсертного XbaI фрагмента pBScucchrcht 5 и клонирования его в pBluescript, переваренный XbaI и обработанный щелочной фосфатазой из кишечника теленка. Реакции лигирования для каждой из конструкций осуществляют инкубированием при 65oC в течение 10 минут. 10 μл этого раствора добавляют к 30 мкл TE буфера (10 мM Tris, pH 7,5 мкМ EDTA), перемешивают и оставляют при комнатной температуре. Разведенный раствор ДНК добавляют к 200 мкл размороженных клеток штамма E.coli DH5 и оставляют на льду на 20 минут. Эти клетки затем подвергают тепловому шоку в течение 90 секунд при 42oC, с последующей выдержкой в течение 10 минут при комнатной температуре. К культуре добавляют 0,8 мл среды SOC (Hanahan, 1983) и культуру инкубируют при 37oC в течение одного часа. 100 мкл культуры помещают на LB-чашки (Miller, 1972), содержащие 100 мкл/мл ампициллина (L-amp), и эти чашки инкубируют до утра при 37oC. Собирают колонии с положительной реакцией, наносят на вторую L-amp чашку, и эти чашки инкубируют до утра при 37oC.
Плазмидную ДНК для каждого из клонов приготавливают в основном по Маниатису (1982). ДНК-последовательности плазмидных инсертов определяют дидезокси-методом с использованием набора Sequenase (United States Biological, Cleveland, OH). -20 и обратный праймеры для вектора Bluescript используют в реакциях секвенирования, так же как и внутренние праймеры, полученные автоматизированным фосфорамидитным синтезом на Applied Biosystems Syntesizer (Foster City, CA). Для составления последовательностей субклонов использовалась программа Star (Madison, WI) компилирования ДНК-последовательностей.
Компилированная последовательность обнаруживает существование открытых рамок считывания с геномным клоном общего размера 12 kb (pBScucchrcht 5). Открытая рамка считывания, включенная в плазмиду D-ClaI, потенциально кодирует протеин размером 31000 Дальтон с pI = 4,69. Последовательность, обнаруживаемая в плазмиде D-BamCla соответствует к ДНК-последовательности, выделенной Metraux et al. (PHAS USA 86 : 896 - 900, 1989). Эта открытая рамка считывания кодирует протеин примерно в 28000 Дальтон с pI около 4.13. Последняя открытая рамка считывания включена в плазмиду D-ClaZ и потенциально кодирует протеин примерно в 29000 Дальтон и с pI около 3.88. Эти три открытые рамки считывания разделяют примерно 90% гомологии ДНК-последовательности, но их концевые области отличаются.
Пример 73. Получение конструкций, содержащих ген огуречной хитиназы.
A. Конструирование pCIB2001.
С начала создают TgS75K перевариванием pTjS75 (Schnudhauser Helinsky, 1985) с помощью NapI, с тем, чтобы вырезать тетрациклиновый ген, с последующей инсерцией AccI-фрагмента из pUC4K (Messing и Vieira, 1984) несущего ген NptI. Затем изготавливают рCIB200 посредством лигирования XhoI линкеров к ЕсоRV-фрагменту рСТВ7 (содержащему левую и правую границы т-ДНК, пригодный для селекции химерный ген растений nos/NptII и полилинкер pUC / Rothstein et al, 1987/) и клонирования XhoI-переваренного фрагмента в SalI-переваренного TjS75Kan. pCIB2001 изготавливают посредством клонирования нового полилинкера в множественный клонирующий сайт рCIB200 с получением более уникальных сайтов ферментной рестрикции.
B. Конструирование pClB2001/BamChit.
Плазмиду pCIB2001/BamChit конструируют посредством переваривания плазмиды D-BamCla (см. пример 68) с помощью BamHI и KpnI и клонирования в рCIB2001, которая была переварена с помощью BglII и KpnI. pC.B2001/BamChit содержит 2613 bp промоторной области из геномного клона огуречной хитиназы, хитиназный ген и примерно 2.1 kb 3'-концевой последовательности.
C. Конструирование рCIB2001/5aICnI.
Плазмиду pCIB2001/SaIChit конструируют путем переваривания D-BamCla ферментом SaIl и кдонирования в pCIB2001, которая была переварена SaIl и обработана щелочной фосфатазой из кишечника теленка. pCIBS2001/SaIChit содержит 1338 bp промоторной области из геномного клона огуречной хитиназы, ген хитиназы и примерно 2.1 ко 3-концевой последовательности.
D. Конструирование pCIB2001/HcoChit.
Плазмиду pCIB2001/HcoChit конструируют путем переваривания D-BamCla с помощью NcoI, лигирования к NcoI/BamHI адаптеру, а затем перевариванием с BamHI и KpnI, и клонированием в рCIB2001, которая была переварена BgIll и Kpnl. pCIB2001/HcoChit содержит 22 bp промоторной области геномного клона огуречной хитиназы, хитиназный ген и примерно 2.1 kb 3'-концевой последовательности.
E. Верификация клонов.
Плазмидную ДНК для каддой из конструкций приготавливают в основном согласно Maniatis et al. (1982). Очищенную ДНК используют в рестрикционном анализе и секвенировании ДНК через сайты клонирования для верификации клонов. Инсерт pCIB2001/SaIChit находится в той же ориентации, что и pCIB2001/BamChit, pCIB2001/NcoChit, чья ориентация была насильственно изменена посредством использованного метода клонирования.
Пример 74. Трансформирование Agrobacterium.
Очищенные pCIB2001/BamChit, рCIB2001/SaIChit и pCIB2001/ /NcoChit ДНК использовали для трансформирования Agrobacterium tumefaciens штамма CIB542 согласно методу Holsters et al. (1978). CIB542 является штаммом EHAIOI (Hood et al, 1986), в котором канамициновый маркер плазмиды был заменен спектиномицин-стрептомициновой частью Tn7.
Пример 75. Трансформирование лиственных дисков табака.
Трансформированные штаммы Agrobacterium выращивают в течение 18 - 24 часов в глютаматно-солевой среде, содержащей 50 мкг/мл канамицина, 50 мкг/мл спектиномицина и 500 мкг/мл стрептомицина, перед тем, как их разводят до OD - 600 0.2 в той же среде без антибиотиков. Бактерии затем выращивают от трех до пяти часов до OD - 600 0.2 - 0.4 для инокуляции дисков диаметром 5 - 7 мм, вырезанных из листьев Nicotiana tabacum cy xahti, которые асептически выращивали в GA7 контейнерах с последующей их модифицированием по методу Horsch et al. (Science 227 : 1229 - 1232, 1985). Диски содержат в течение двух дней на 0.7% агаре, содержащем соли и железо согласно Murashige & Scood (MS), 1 мг/л бензиладенина и 1 мг/мл α -нафталенуксусной кислоты. Диски затем переносят на MS-чашки, содержащие 50 μг/мл канамицина, 100 μг/мл карбенициллина и 100 мкг/мл мефоксина. Образующиеся на листьях побеги отрезают и разводят, пока не будет получено восемь ростков, посредством субкультивирования кончиков побегов на MS-среде, содержащей 50 мкг/мл канамицина и 100 мкг/мл мефокcина в GA7 контейнерах.
Ростки высаживают на не содержащую гормонов среду с 50 мкг/мл канамицина, переносят на почву и отверждают в фитотроне перед их переносом в теплицу.
Пример 76. Обработка трансгенных растений.
Принесенные на почву трансгенные растения выращивают 4 - 5 недель перед обработкой.
На листья стерильной кистью для краски наносят следующие растворы:
1. Стерильную dH2O.
2. 50 мM салициловой кислоты.
3. Метил бензо-1,2, 3-тиадиазол-7-карбоксилат. Этот раствор приготавливают посредством ресуспендирования увлажняемого порошка, имеющего химический состав с 25% активного ингридиента, в стерильной воде с концентрацией 1 мг/мл.
4. Метил 2,6-дихлоризоникотинат, приготовленный как выше.
Альтернативно, листья обрызгивали, вместе с карборундом, 30 мкл 10 мM натрий-фосфатного буфера с pH 7, 0 или тем же буфером, но содержащим вирус табачной мозаики (50 - 100 pfu/30 мкл). Эти буферы распределяли по всей поверхности обработанного листа поглаживанием. Растения оставляли расти дальше еще в течение семи дней. Затем обработанные листья собирали, замораживали в жидком азоте и хранили при - 80oC до их использования в экспериментах.
Пример 77. EL ISA
- эксперимент
Замороженную ткань листьев измельчают в ступке пестиком в присутствии жидкого азота с получением тонкого порошка. 0,33 г каждого образца ткани добавляют к 1 мл экстракционного
буфера (50 мM Tris-HCl, pH 8,5, 0,2 М 2-меркаптоэтанола, 2 мM фенил-метил-сульфонил-фторида, 2 мM бензамидина, 10 мM G-аминокапроновой кислоты, 1 мM лейкопептина) и образец гомогенизируют в течение
одной минуты на мешалке Ultra Turrax Mixer (# S25N-8G, Tekmar Co. Cincinnati, OH). Образцы затем центрифугируют при 48000 • g в течение 15 минут при 4oC, и супернатант удаляют от
осадочного материала. Экстракты разбавляют по меньшей мере 1 : 50 в ELISA (10 мM фосфата натрия, pH 7.4, 140 мM хлорида натрия, 0.05% Tween 20, 0.02% азида натрия и 1% BSA).
Микротитровальную пластину покрывают моноклональным антителом, специфичным к протеину огуречной хитиназы в концентрации 2 мкг/мл в борат-буферном физиологическом растворе (100 мM борной кислоты, 25 М бората натрия, 75 мM хлорида натрия; pH 8.5) с использованием на лунку по 50 мкл. Эту пластину инкубируют да утра при 4oC. Пластину промывают ELISA буфером (10 мM Tris-HCl, pH 8.0, 0.05% Tween 20, 3 мM азида натрия) и добавляют блокирующий раствор BSA (10 мM фосфата натрия, pH 7.4, 140 мM хлорида натрия, 0.02% азида натрия, 1% BSA), чтобы полностью покрыть каждую лунку. Инкубируют по меньшей мере 30 минут при комнатной температуре.
Микротитровальную пластину промывают ELISA-буфером и в соответствующую лунку добавляют 50 мкл экстракта. По 50 мкл каждого из 10 стандартов хитиназного протеина (в пределах от 0 нг/мл до 31.64 нг/мл) также добавляют в соответствующую лунку и пластину инкубируют в течение двух часов при 4oC. Пластину промывают ELISA-буфером, и к каждой лунке добавляют по 50 мкл поликлональных антител кролика к протеину огуречной хитиназы (в разведении 1 : 15,000 в разбавителе ELISA) и инкубируют в течение одного часа при 37oC. После промывки буфером ELISA, к каждой лунке добавляют по 50 мкл козиной антикроличьей сыворотки, конъюгированной к щелочной фосфатазе (1 : 500 в разбавителе ELISA) и инкубируют при 37oC в течение одного часа. Пластину затем промывают и к каждой лунке добавляют по 50 мкл субстратного раствора щелочной фосфатазы (0.6 мг/мл p-нитрофенилфосфата в 0,5 мM хлорида магния и 10% диэтаноламина). После 30 минут инкубирования при комнатной температуре, к каждой лунке добавляют по 50 мкл 3 N гидроксида натрия, чтобы остановить реакцию.
Результат считывают при 405 и 492 нм на считывателе пластин ELISA "HP Genenchem". Значения выхода выражены в виде A (405 нм)-A(492 нм)- 0.092 чтобы позволить коррекцию p-нитрофенилфосфата в качестве субстрата. Хитиназные стандарты для каждой пластины изображены на логарифмическом графике. Количество хитиназного протеина в каждом образце определяется из стандартной кривой. Если количество хитиназы в любом из образцов близко к верхнему пределу кривой, то образец исследуют снова в большем разведении. Конечные результаты выражены в μг хитиназы на грамм ткани (см. табл. 1).
Пример 78. Получение химерной конструкции.
A. Конструирование pBSGuSI.2.
pBSGuSI.2 создают путем лигирования трех частей: 391 bp SalI/SnaBI фрагмента из pRA1265 (Jefferson et al., 1987 и GUS User Manual) с 1707 bp фрагментом SnaBI/EcoRI из pBl221 (jefferson et al., 1987) и pBS, переваренной SalI и EcoRI. Транформанты выделяют и анализируют рестрикционным перевариванием и ДНК секвенированием. Один верифицированный клон назван pBSGuSI.2.
B. Конструирование pBSGhit/GUS.
2613 bp промоторной, области огуречной хитиназы в pCIB2001/BamChit
выделяют с использованием PCR с набором GeneAmp фирмы Rerkin-Elmer/Cetus (Normalk, CT) согласно инструкциям производителя и с использованием следующих праймеров:
5'-GCCTCGAGGATCCTATTGAAAAAG-3' и
5'-GCCTCGAGTGCTTAAAGAGCTTTC-3'.
Продукт PCR-реакции состоит из 2613 bp промотора с сайтами рестрикции фермента XnolI на обоих концах последовательности вследствие конструкции праймеров. Этот амплифицированный продукт затем переваривают XholI и эту часть подвергают гель-очистке. Очищенный фрагмент лигируют к pBSGUS1.2, которую затем переваривают XholI и обрабатывают щелочной фосфатазой из кишечника теленка. Трансформанты выделяют и анализируют путем ДНК-секвенирования. Один верифицированный клон, содержащий огуречный промотор в его правильной ориентации перед GUS геном, назван pBSChit/GUS.
C. Конструирование pCIB2001/Chit/GUS.
Плазмиду pBSChit/GUS переваривают KpnI и XbaI и подвергают гель-очистке инсертную часть, содержащую хитиназный промотор и ген GUS с его 3'-концевыми последовательностями. Очищенный фрагмент лигируют к рCIB2001 (пример 69), которую переварили с помощью KpnI и XoaI. Трансформанты выделяли на чашках I-kan, и плазмиды анализируют посредством рестрикционного переваривания и ДНК-секвенирования по клонирующим сайтам. Один верифицированный клон назван pCIB2001/Chit/GUS.
Пример 79. Анализ химерных конструкций.
A. Трансформирование химерной конструкции.
Плазмиду pGIB2001/Chit/GUS трансформируют Agrobacterium, как описано в примере 70. Трансформированные штаммы Agrobacterium приготавливают и переносят в диски табачного листа как описано выше (см. пример 71). Обработку растений и их сбор проводили таким же образом (пример 72).
B. Исследование на β-глюкуронидазу.
Замороженную ткань листьев измельчают в ступке пестиком в присутствии жидкого азота с получением тонкого порошка. Лиственные экстракты приготавливают в GUS экстракционном буфере (50 мM фосфата натрия pH 7.0, 0.1% Triton X-100, 10 мM B-меркаптоэтанола), как описано Jefferson et al., (1986).
Эти реакции проводят в лунках микротитровальных пластин смешивания 5 - 25 μл экстракта с 120 - 100 μл буфера для GUS-исследований (50 мM фосфата натрия pH 7.0, 0.1% Triton X-100, 10 мM B-меркаптоэтанола), содержащего 4-метил-умбеллиферил-глюкуронида (MU) при конечной концентрации 2 мM в общем объеме 125 мкл. Пластину затем инкубируют при 37oC в течение 1 - 5 часов и реакцию останавливают путем добавления 150 мкл 3 М карбоната натрия. Концентрацию освобожденного флуоресцентного индикатора определяют посредством считывания с пластины на считывателе ELISA Flow Labs Fluroskan.
Количество протеина в каждом образце экстракта определяют с использованием BCA-исследования белка (Pierce, Rockford, IL) согласно указаниям производителя. Специфическую активность определяют для каждого образца и выражают в nKat MU/мг протеина.
Реферат
Фрагменты ДНК последовательностей 1-8, получаемые из генов, кодирующих растительные белки, обеспечивают индукцию регулирования экспрессии указанных белков в присутствии ряда химических соединений. Для получения трансгенного растения конструируют рекомбинантную плазмиду с использованием фрагментов ДНК и структурного гена, трансформируют растительный материал этой плазмидой, отбирают трансформированные клетки, которые затем обрабатывают химическим индуктором, и выращивают из клеток регенеранты. 10 с.п.ф-лы и 16 з.п. ф-лы, 38 ил., 2 табл.

Формула
08.03.88 - по пп.1 - 4 и 9 - 26;
06.02.89 - по пп.5 - 8 и 9 - 26.

Комментарии