Способ получения кветиапина и промежуточные соединения - RU2258067C2
Код документа: RU2258067C2
Описание
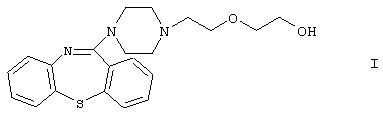
Изобретение касается нового способа получения 11-[4-/2-(2-гидроксиэтокси)этил/-1-пиперазинил]дибензо[b,f]-1,4-тиазепина формулы
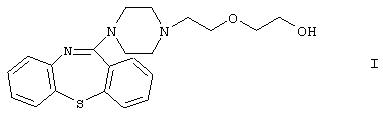
известного под международным непатентованным названием кветиапин. Соединение обладает антидофаминэргической активностью и/или активностью антагониста серотониновых рецепторов и используется в клинической практике в качестве антипсихотического или нейролептического средства.
Кроме того, изобретение касается новых промежуточных соединений, используемых в новом способе изобретения.
Предпосылки изобретения
Согласно способу, известному из ЕР 240228, соединение формулы I получают путем реакции иминохлорида формулы

с 1-(2-гидроэтокси)этилпиперазином. Полученный грубый маслянистый продукт подвергают очистке посредством хроматографии с использованием колонки с силикагелем, получая выход 77,7% в расчете на приблизительно 0,5 моль.
Иминохлорид формулы XI, используемый в качестве исходного соединения, получают путем циклизации производного уретана формулы
и галогенирования полученного дибензо[b,f]-1,4-тиазепин-11(10Н)-она формулы
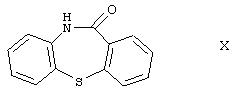
оксихлоридом фосфора согласно ЕР 282236. Выход реакции циклизации составляет 87%, а реакции галогенирования - 92,6%. Таким образом, в случае описанного выше известного способа общий выход, рассчитанный для производного уретана формулы IV, составляет 62,6%.
Тот факт, что кристаллический продукт приемлемой чистоты можно получить только после очистки посредством колоночной хроматографии, делает производство в промышленных масштабах с использованием известного способа трудным и чрезвычайно неэкономичным. Иминохлорид формулы XI является довольно нестабильным соединением и гидролизуется атмосферной влагой. При работе с большими количествами соединения, эта побочная реакция уменьшает выход, а продукт гидролиза загрязняет конечный продукт. Еще один недостаток состоит в том, что получение 1-(2-гидроэтокси)этилпиперазина может осуществляться в несколько стадий, что делает известный способ еще менее экономичным.
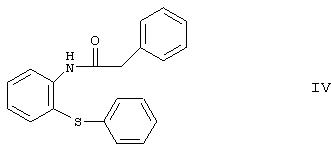
Согласно другому способу, известному из ЕР 282236, производное пиперазина формулы
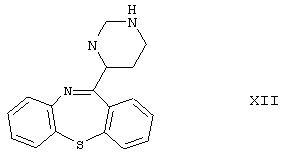
подвергают реакции с 2-галогенэтоксиэтанолом, получая продукт формулы I с выходом 78%. Производное пиперазина формулы XII получают путем реакции иминохлорида формулы XI с пиперазином с выходом 88%; таким образом, общий выход реакции синтеза, рассчитанный для производного уретана формулы IV, составляет лишь 55,3%.
Целью данного изобретения является создание экономичного способа получения кветиапина.
Краткое описание изобретения
Было обнаружено, что описанная выше цель достигается благодаря способу получения 11-[4-/2-(2-гидроксиэтокси)этил/-1-пиперазинил]дибензо[b,f]-1, 4-тиазепина формулы I или его фармацевтически приемлемой кислотной аддитивной соли посредством
a1) реакции производного галогенэтилпиперазинилтиазепина формулы
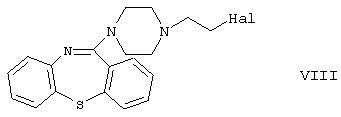
где Hal обозначает атом галогена, с этиленгликолем; или
а2) циклизации производного галогенэтилпиперазина формулы

где Hal обозначает атом галогена, в присутствии дегидратирующего агента и реакции полученного производного галогенэтилпиперазинилтиазепина формулы VIII, где Hal определен выше, с этиленгликолем; или
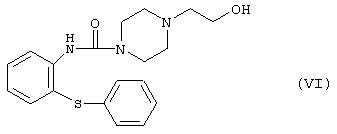
а3) реакции производного гидроксиэтилпиперазина формулы
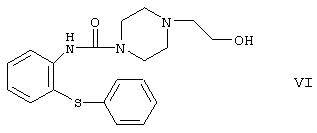
с галогенирующим агентом, циклизации полученного производного галогенэтилпиперазина формулы VII, где Hal обозначает атом галогена, в присутствии дегидратирующего агента, и реакции полученного производного галогенэтилпиперазинилтиазепина формулы VIII, где Hal определен выше, с этиленгликолем; или
а4) реакции производного гидроксиэтилпиперазина формулы VI одновременно с галогенирующим агентом и дегидратирующим агентом, и реакции полученного производного галогенэтилпиперазинилтиазепина формулы VIII, где Hal обозначает атом галогена, с этиленгликолем; или
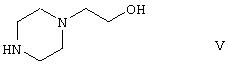
a5) реакции производного уретана формулы IV с 1-(2-гидроксиэтил)пиперазином формулы
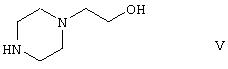
и последующей реакции полученного производного гидроксиэтилпиперазина формулы VI одновременно с галогенирующим агентом и дегидратирующим агентом, и реакции полученного производного галогенэтилпиперазинилтиазепина формулы VIII, где Hal представляет собой атом галогена, с этиленгликолем; и, при необходимости, превращения полученного продукта в кислотную аддитивную соль с использованием фармацевтически приемлемой неорганической или органической кислоты.
Кроме того, изобретение включает новые производные пиперазина формулы
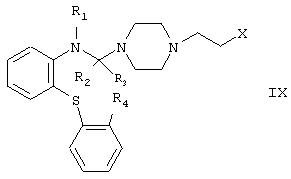
где либо
R1 обозначает атом водорода,
R2 вместе с R3 обозначают атом кислорода и
R4 обозначает атом водорода; либо
R1 образует вместе с R2 валентную связь между соседними атомами азота и углерода,
R3 образует вместе с R4 валентную связь между соседними атомами углерода, и Х обозначает гидроксильную группу или атом галогена, и их кислотные аддитивные соли, образуемые с неорганическими или органическими кислотами.
Новые производные пиперазина являются промежуточными соединениями в новом способе изобретения.
Описание предпочтительных воплощений
В способе a1) изобретения соблюдаются обычные условия реакции Вильямсона. Во-первых, этиленгликоль превращают в алкоголят, используя металлический натрий или любые другие подходящие неорганические основания. Обычно и натрий, и этиленгликоль используют в избытке; в пересчете на 1 моль производного галогенэтилпиперазинилтиазепина формулы VIII, берут предпочтительно 1,5-1,7 моль натрия и 20-30 моль, предпочтительнее 25-27 моль этиленгликоля. Температура реакции составляет обычно 50-150°С, предпочтительно около 100°С. Как правило, реакция длится 5-15 часов, обычно около 9 часов.
В способе а2) изобретения предпочтительным исходным соединением является производное галогенэтилпиперазина формулы VII, где Hal обозначает атом хлора, а подходящим дегидратирующим агентом является пятиокись фосфора. В реакционную смесь предпочтительно добавляют также оксихлорид фосфора, а замыкание кольца осуществляют предпочтительно при точке кипения реакционной смеси. Полученное производное галогенэтилпиперазинил-тиазепина формулы VIII превращают в продукт формулы I согласно методу, описанному в способе a1).
В способе а3) изобретения в качестве галогенирующего агента предпочтительно используют тионилхлорид или оксихлорид фосфора, предпочтительнее последний. Реакцию галогенирования проводят в нейтральном органическом растворителе, или в качестве растворителя могут использовать также избыток галогенирующего агента. Обычно галогенирование осуществляют при точке кипения реакционной смеси. Полученное производное галогенэтилпиперазина формулы VII превращают в продукт формулы I согласно методу, описанному в способе а2).
В способе а4) изобретения галогенирование производного гидроксиэтилпиперазина формулы VI и последующее замыкание кольца осуществляют в одну стадию без выделения производного галогенэтилпиперазина формулы VII, которое образуется во время галогенирования. Подходящим галогенирующим агентом является оксихлорид фосфора, предпочтиельным дегидратирующим агентом - пятиокись фосфора. В реакционную смесь можно добавлять нейтральный органический растворитель или в качестве растворителя используют избыток галогенирующего агента. Температура реакции предпочтительно равна точке кипения реакционной смеси. В большинстве случаев время реакции составляет 6-10 часов, предпочтительно - 7-8 часов. После окончания реакции реакционную смесь вливают в воду, подщелачивают и экстрагируют несмешивающимся с водой органическим растворителем, например дихлорметаном. Затем выполняют процедуру, описанную в способе a1) изобретения для получения продукта формулы I.
В способе a5) изобретения реакцию производного уретана формулы IV с 1-(2-гидроксиэтил)пиперазином осуществляют в нейтральном органическом растворителе, обычно в неполярном органическом растворителе, предпочтительно толуоле. Как правило, температура реакции выше комнатной температуры, предпочтительней реакцию осуществляют при точке кипения растворителя. Время реакции относительно невелико, обычно реакция протекает за 2 часа. Сначала реакционную смесь промывают водной щелочью, затем водой, для того чтобы удалить образующийся фенол, органическую фазу высушивают и упаривают. Осадок кристаллизуют из органического растворителя. Полученное производное гидроксиэтилпиперазина формулы VI превращают в продукт формулы I способом, описанным в способе а4) изобретения.
Продукт формулы I может быть преобразован в фармацевтически приемлемую кислотную аддитивную соль способом, известным per se. Предпочтительно получают гемифумарат. При необходимости, основание формулы I можно высвободить из его кислотной аддитивной соли способом, известным per se.
Производное уретана формулы IV можно получить известным из литературы способом, путем реакции 2-аминодифенилсульфида формулы

с фенилхлорформиатом формулы
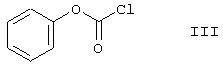
Соединение формулы I получают способом изобретения с общим выходом 66-67%, рассчитанным для производного уретана формулы IV. Стадии способа изобретения могут быть легко осуществлены, исходные соединения и реагенты легко доступны. Способ изобретения не включает ни одной процедуры, которая могла бы вызвать трудности или понизить выход. Полученный кветиапин формулы I имеет высокую чистоту.
Производное гидроксиэтилпиперазина формулы VI, производные галоген-этилпиперазина формулы VII и производные галогенэтилпиперазинилтиазепина формулы VIII, которые все являются промежуточными соединениями в способе изобретения, представляют собой новые соединения.
Новые промежуточные соединения, перечисленные выше, имеют формулу IX. Таким образом, предпочтительными новыми производными пиперазина формулы IX являются следующие соединения:
- производное гидроксиэтилпиперазина формулы VI и его кислотные аддитивные соли;
- производное галогенэтилпиперазина формулы VII, где Hal определен выше, и его кислотные аддитивные соли; и
- производное галогенэтилпиперазинилтиазепина формулы VIII, где Hal определен выше, и его кислотные аддитивные соли.
Особенно предпочтительным производным галогенэтилпиперазина формулы VII является N-[4-(2-хлорэтил)пиперазин-1-карбонил]-2-аминодифенилсульфид и его кислотные аддитивные соли.
Особенно предпочтительным производным галогенэтилпиперазинилтиазепина формулы VIII является 11-[4-(2-хлорэтил)пиперазин-1-ил]-дибензо[b,f]-1,4-тиазепин и его кислотные аддитивные соли.
Новые промежуточные соединения могут быть получены способами, описанными выше.
Далее изобретение поясняется следующими Примерами. Получение исходного соединения формулы IV
Фенил-2-фенилтиофенилкарбамат
20,13 г (0,1 моль) 2-аминодифенилсульфида растворяют в 250 мл дихлорметана и полученный раствор охлаждают до 5°С. Половину раствора 18,79 г (15,1 мл, 0,2 моль) фенилхлорформиата в 26 мл дихлорметана медленно прибавляют к перемешиваемому раствору 2-аминодифенилсульфида, затем прибавляют другую половину раствора фенилхлорформиата, а также раствор 3,0 г (0,075 моль) гидроксида натрия и 9,2 г (0,0875 моль) карбоната натрия в 50 мл воды, одновременно следя за тем, чтобы внутренняя температура реакционной смеси не превышала 10°С. После прекращения добавления реакционную смесь перемешивают при комнатной температуре в течение 3 часов, органическую фазу отделяют, промывают 3 раза разбавленной соляной кислотой, используя общий объем 250 мл, высушивают над безводным сульфатом магния и упаривают. Осадок кристаллизуют из н-гексана.
Таким образом получают 29 г (90,2%) названного соединения. Т.пл. 90-91° С.
Анализ: для C19H15NO2S (321.401)
вычислено: С 71,01 %; Н 4,70 %; N 4,36 %; S 9,98 %;
найдено: С 71,19 %; Н 4,69 %; N 4, 33 %; S 9,84 %.
Пример 1
N-[4-(2-Гидроксиэтил)пиперазин-1-карбонил]-2-аминодифенилсульфид - соединение формулы VI
32,1 г (0,1 моль) фенил-2-фенилтиофенилкарбамата растворяют в 600 мл толуола и к перемешиваемому раствору добавляют 13,0 г (0,1 моль) 1-(2-гидроксиэтил)пиперазина. Реакционную смесь перемешивают при температуре кипения в течение 2 часов, затем охлаждают до комнатной температуры и промывают 600 мл 1н. раствора гидроксида натрия, затем дважды по 200 мл воды. Органическую фазу высушивают над безводным сульфатом магния и упаривают. Осадок кристаллизуют из смеси н-гексана и этилацетата (10:1), фильтруют, промывают н-гексаном и высушивают.
Таким образом получают 33,9 г (94,8%) названного соединения в виде белых кристаллов. Т.пл. 96-98°С.
Анализ: для C19H23N3O2S (357.478)
вычислено: С 63,84 %; Н 6,49 %; N 11,75 %; S 8, 97 %;
найдено: С 63,57 %; Н 6,52 %; N 11,71 %; S 9,02 %.
Пример 2
N-[4-(2-Хлорэтил)пиперазин-1-карбонил]-2-аминодифенилсульфид - соединение формулы VII
18,8 г (0,05 моль) N-[4-(2-гидроксиэтил)пиперазин-1-карбонил]-2-аминодифенил-сульфида кипятят в 65 мл тионилхлорида в течение 15 минут, затем упаривают и остаток кристаллизуют из н-гексана. Получают 18,5 г (89,7 %) продукта, который представляет собой гидрохлорид названного соединения. Т.пл. 180-183°С.
Получение основания:
К суспензии 10,31 г (0,025 моль) гидрохлорида в 250 мл изопропанола прибавляют 2,78 г (0,0275 моль) триэтиламина, реакционную смесь перемешивают при комнатной температуре в течение 1 часа, добавляют воду, экстрагируют дихлорметаном, высушивают над безводным сульфатом магния и упаривают. Таким образом получают 8,0 г (85,1 %) названного соединения.
Получение соли с бензолсульфокислотой:
К раствору 7,5 г (0,02 моль) названного основания в 15 мл этанола прибавляют раствор 3,48 г (0,022 моль) бензолсульфокислоты в 10 мл этанола. Раствор перемешивают при комнатной температуре в течение 1 часа, затем охлаждают ледяной водой, фильтруют и высушивают. Таким образом получают 6,6 г (60,8%) продукта, который представляет собой бензолсульфонат названного соединения.
Т.пл. 110-112°С.
Анализ: для С25Н28CIN3O4S2 (534.101)
вычислено: С 56,22 %; Н 5,28 %; N 7,87 %; Cl 6,64 % S 12,01 %;
найдено: С 55,96 %; Н 5,35 %; N 7,73 %; Cl 6,50 % S 12,05 %.
Пример 3
11-[4-(2-Хлорэтил)-1-пиперазинил]-дибензо[b,f]-1,4-тиазепин - соединение формулы VIII
Метод А)
Смесь 8,2 г (0,02 моль) гидрохлорида N-[4-(2-хлорэтил)-пиперазин-1-карбонил]-2-аминодифенилсульфида, 84 мл оксихлорида фосфора и 8,5 г (0,06 моль) пятиокиси фосфора выдерживают при температуре кипения в течение 15 часов. Раствор охлаждают, затем тщательно упаривают, остаток вливают в ледяную воду, раствор подщелачивают добавлением водного раствора аммиака и экстрагируют дихлорметаном. Органическую фазу упаривают, остаток кристаллизуют из диизопропилового эфира, фильтруют и высушивают.
Таким образом получают 5,4 г (75,4%) названного соединения. Т.пл. 113-115°С.
Метод В)
Смесь 35,7 г (0,1 моль) N-[4-(2-гидроксиэтил)-пиперазин-1-карбонил]-2-аминодифенилсульфида, 200 мл оксихлорида фосфора и 31,2 г (0,22 моль) пятиокиси фосфора кипятят в течение 7 часов. Раствор охлаждают, упаривают, остаток обрабатывают ледяной водой, подщелачивают водным раствором аммиака, экстрагируют дихлорметаном, высушивают над безводным сульфатом магния и снова упаривают. Остаток кристаллизуют из диизопропилового эфира, кристаллы отфильтровывают и высушивают.
Таким образом получают 28,6 г (80%) названного соединения Т.пл. 114-116°С.
Анализ: для С19Н20CIN3S (357.908)
вычислено: С 63,76%; Н 5,63%; N 11,74%; Cl 9,91% S 8,96%;
найдено: С 63,70%; Н 5,57%; N 11,68%; Cl 9,89% S 9,07%.
Пример 4
Гемифумарат 11-[4-/2-(2-гидроксиэтокси)этил/-1-пиперазинил]дибензо[b,f]-1,4-тиазепина - соединение формулы I
1,17 г металлического натрия растворяют в 50 мл этиленгликоля и к полученному раствору прибавляют раствор 10,7 г (0,03 моль) 11-[4-(2-хлорэтил)-1-пиперазинил]-дибензо[b,f]-1,4-тиазепина в 60 мл толуола. Реакционную смесь перемешивают при 100°С в течение 9 часов, затем после охлаждения добавляют 210 мл воды. После разделения толуольную фазу экстрагируют разбавленной соляной кислотой, раствор подщелачивают добавлением водного раствора аммиака, экстрагируют дихлорметаном, органический раствор высушивают над безводным сульфатом магния и упаривают при пониженном давлении.
Таким образом получают 11,27 г (98%) названного основания.
Получение соли:
10 г (0.026 моль) полученного основания растворяют в 130 мл этанола и прибавляют к раствору 3,13 г (0,027) фумаровой кислоты. Смесь перемешивают при температуре кипения в течение 25 минут, затем охлаждают до комнатной температуры. Смесь выдерживают в холодильнике в течение ночи, затем кристаллы отфильтровывают, промывают холодным этанолом и высушивают.
Таким образом получают 9,8 г (85,4%) названного соединения Т.пл. 172-174°С.
Анализ: для С46Н54N5O8S2(883.107)
вычислено: С 62,56%; Н 6,16%; N 9,52%; S 7,26%;
найдено: С 62,19%; Н 6,19%; N 9,57%; S 7,24%.
Реферат
Изобретение относится к органической химии и может найти применение в медицине. Описывается способ получения 11-[4-/2-(2-гидроксиэтокси)этил/-1-пиперазинил]-дибензо[b,f]-1,4-тиазепина формулы
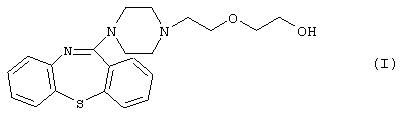
или его фармацевтически приемлемой кислотной аддитивной соли, включающий: a1) реакцию производного галогенэтилпиперазинилтиазепина формулы

где Hal обозначает атом галогена, с этиленгликолем; или а2) циклизацию производного галогенэтилпиперазина формулы

где Hal представляет собой атом галогена, в присутствии дегидратирующего агента, и реакцию полученного производного галогенэтилпиперазинилтиазепина формулы VIII, где Hal определен выше, с этиленгликолем; или а3) реакцию производного гидроксиэтилпиперазина формулы
с галогенирующим агентом, циклизацию полученного производного галогенэтилпиперазина формулы VII, где Hal обозначает атом галогена, в присутствии дегидратирующего агента, и реакцию полученного производного галогенэтилпиперазинилтиазепина формулы VII, где Hal определен выше, с этиленгликолем; или a4) реакцию производного гидроксиэтилпиперазина формулы VI одновременно с галогенирующим агентом и дегидратирующим агентом, и реакцию полученного производного галогенэтилпиперазинилтиазепина формулы VII, где Hal обозначает атом галогена, с этиленгликолем; или a5) реакцию производного уретана формулы IV

с 1-(2-гидроксиэтил)-пиперазином формулы

последующую реакцию образовавшегося производного гидроксиэтилпиперазина формулы VI одновременно с галогенирующим агентом и дегидратирующим агентом, и реакцию полученного производного галогенэтилпиперазинилтиазепина формулы VIII, где Hal обозначает атом галогена, с этиленгликолем; и, при необходимости, превращение полученного продукта в кислотную аддитивную соль с использованием фармацевтически приемлемой неорганической или органической кислоты. Также описывается производное пиперазина формулы IX. Технический результат - создание экономичного способа получения кветиапина. 2 н.п. и 8 з.п. ф-лы.
Формула






Комментарии