То же
Гидрохлорид Пример 6. 90 г (0,6 моль)
бензиламингидрохлорида и 50 г 1(0,66 моль) тиоцианата аммония в 130 мл бромбензола подвергают вь(держ
ке при в течение 20 мин с получением желто-белой суспензии. Посл охлаждения отфильтрованный твердый
материал трижды промьюают водой и трижды изопропиловым спиртом. В результате
перекристаллизации из изопропилового спирта и сушки над пятиокисью.фосфора получают 38,26 г
149-150,5
Метил
201-205 Фенил
156-158
Атом водорода ( 38%) Н-бензилтиомоченины с т.пл. 160-1630С.
Пример 7. 2,0г N-бензилтиомоЧевины (0,012 моль) и 2,07 г (0,012 моль) о /-хлор-п-фторацетофенона
в 15 мл абсолютного этанола подвергают кипячению с обратным холодильником в течение 2 ч в токе азота.
После охлаждения отфильтрованный твердый матёрисш промывают диэтиловым
эфиром и высушившот нгщ пятиокисью фосфора с получением 3,47 г
(91%) 2-бензиламино-4-(п-фторфенил)-тиаЭОЛгидрохлорида с т.пл. 1921950с .
Найдено,%: С 59,64; Н 4,38; N 8,62.
C.fc Н,,, NnSF. HCI
Вычислено,%: С 59,90; Н 4,40; N 8,73.
Пример 9. 30 г (0,265 моль)
2-тйениламина растворяют в 400 мл диэтилового эфира и охлаждают до Ос на ледяной бане. Через этот
раствор в течение 5 мин пропускают борботированием сухой газообразный хлористый водород. Образовавшийся
твердый материал отфильтровывают и высушивают над пятиокисью фосфора
с получением 26,7 г (61%) 2-тиениламингндрохлорида с т.пл. 186-190®С.
13,35 г (0,089 моль) 2-тиениламингидрохлорида и 7,4 г (0,089 моль тиоцианата аммония в 20 мл бромбензола
выдерживают при температуре кипения d обратным холодильником в течение 90 мин. Затем реакционную
смесь охлаждают и отфиль- рованный твердай материал трижды промывают
водой. В результате перекристаллизации 3 хлороформа и сушки над пятиокисью фосфора получают 5,0 г (33%)
М-тиенилтномочевины с т.пл 99-101 С
Найдено,%: С 41,56; Н 4,58; N 16,07.
Ч й 1S
Вычислено,%: С 41,83; Н 4,68;
16,26.
N
Пример 10. 2,0 г
(0,0116 моль) М-тиенилтиомочевины и
Пример 8, Аналогично примерам
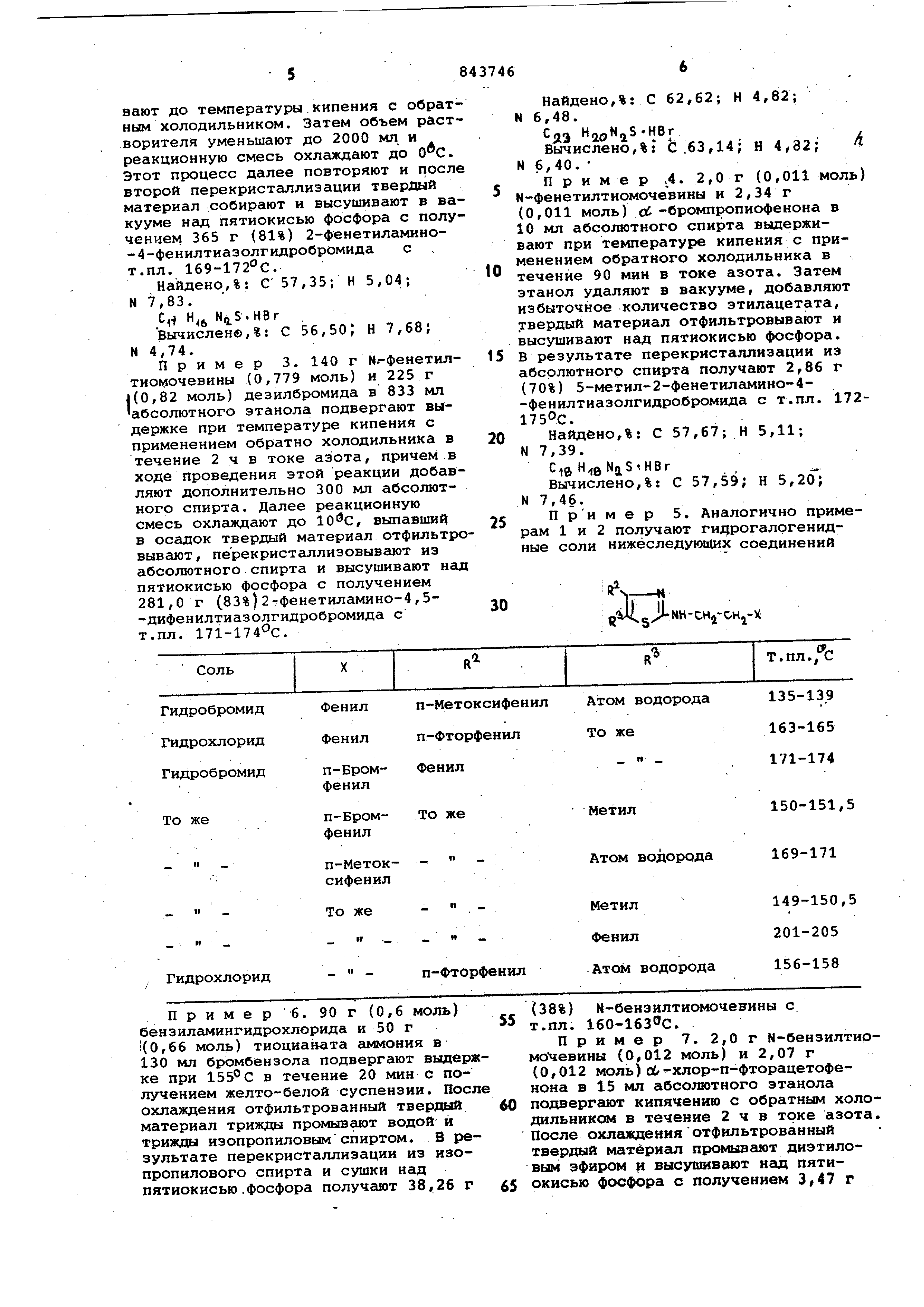
6 и 7 получают гидрогалогенидные соли нижеследующих соединений .
П
Л
J NH-CHj-X
сифенил
2,3 г (0,0116 моль) cvi -бромацетофенона в 15 мл абсолютного этанола
выдерживают при температуре кипения с обратным холодильником в течение
90 мин в токе азота. Реакционную смесь охлаждают и этанол удаляют
в вакууме. После растворения остатка в горячем изопррпиловом спирте и
разбавления раствора диэтиловым эфиром образуется маслоподобный продукт
Затем диэтиловый эфир декантируют, масло растворяют в небольшом количестве
этанола и охлаждают. Образовавшийся твердый материал отфильтровывают и высушивают над пятиокисью
фосфора с получением 3,20 г (78%) 2-тиениламино-4-фенилтиазолгидробромида с т.пл. 115-118с.
Найдено,%: С 47,75; Н 3,74; N 7,90.
11
Вычислено,%: С 47,58; Н 3,71;
7,93.
N
П р и м е р 11. 0,80 г (0,0046 моль) N-тиенилтиомочевины и
О,80 г (0,0046 моль) сХ- - лор-п-фторацетофенона- в 11 мл абсолютного этанола
выдерживают при температуре кипения с обратным холодильником в токе азота в течение 90 мин. После
охлаждения этанол удаляют в вакууме
а твердый материал растирают в порошок в этаноле, профильтровывают и высушивают в вакууме над пятиокисью
фосфора с получением 0,848 г (56%) 2-тиениламино-4-(п-фторфенил)-тиазолгидрохлорида с т.пл. 184-187 С.
Наацено,%: С 51,41; Н 3,63; N 8,39,
С,. Н , NASgF-.HCI
, В ислено,%: С 51,45; Н 3,70; N 8,57. Пример 13.25,0г
(0,257 моль) ФУРфуриламина растворяют в 1300 мл диэтилового эфира и охлаждают раствор до на ледя ной
бане. Через этот раствор пропускают барботированием сухой гаэо фбразный хлористый водород до тех
rtop, пЬка не прекратится полностью образование осадка. Твердый матери отфильтровывают и высушивают в
вакууме над пятиокисью фосфора с получением 33,46 г (97%) фурфуриламингидрохлорида с т.пл. 147-149с
33,46 г (0,250 моль) фурфуриламиногидрохлорида и 38,14 г (0,501 моль) тиоцианата аммония в
71 мл бромбензола выдерживают при температуре кипения с обратным холодильником в токе азота в.течение
20 мин,а затем охлаждают до комнат ной температуры. Эту реакционную смесь смешивают с раствором 125 мл
воды и 100 мл этилацетата и оставляют при комнатной температуре на ночь. Затем эту смесь разбавляют с
получением 500 мл этилацетата и 350 мл воды и водный слой отделяют . Органический слой промывают
водой и .высушивают над сульфатом натрия. После фильтрования органический слой выпаривают досуха, а б
бензол удаляют в вакууме. Полученный твердый материал измельчают в
ступке, затем тbлкyJ: и тонкодисперсные частицы перемешивают в ди;этиловом эфире для удаления остато
ного бромбензола. Далее твердый ма териал отфильтровывают, промывают диэтиловым эфиром и высушивают в
вакууме над пятиокисью фосфора с получением 12,06 г (30%) N-фурфури тиомочевины с т.пл. 80-91 С.
Найдено,%: С 46 , 91; Н 4,90; N 17,57. Вычислено,%: С 46,14; Н 5,16; .N 17,93. Пример 14. 0,82 г
(р,005 моль) N -фурфурилтиомочевиПример 12. Аналогично примерам
10 и 11 получают гидрогалргенидные соли нижеследующих соединений
ДГ5-мн-снгО
to ны с 1,.07 г (0,005 моль) oL -бромпропиофенона в 11 мл абсолютного
этанола вг держивают при температуре кипения с обратным холодильником
в токе азота в течение 3 ч. После охлаждения до комнатной температуры
растворитель удаляют в вакууме с получением густого коричневого масла
, которое растирают с использованием пяти порций по 35 мл этилацетата
, предназначенного для кипячения с обратным холодильником. Объем
этилацетата далее уменьшают приблизительно до 25 мл и охлаждают смесь
до комнатной температуры. Выпавший в осадок твердый материал отфильтровывают
, промывают этилацетатом и высушивают в вакууме над пятиокисью фосфора с получением 0,585 г (33%)
2-фурфуриламино-5-метил-4-фенилтиазолгидробромида с т.пл. 150-15З С. Найдено,%: С 51,97; Н 4,47;
N 8,42.- С,5 Н,/, Вычислено,%: С 51,29, Н 4,30;
N7,97. Пример 15. Аналогично примерам 13 и 14 получают гидрогалогенидные
соли нижеследующих соединений 192-194
Гидро- Фенил бромид Пример 16. 25,0 г
(0,136 моль) дифенилметилс1мина растворяют в 660 мл диэтилового эфира и
раствор охлаждают до . Затем в течение 10 мин через этот раствор пропускают барботирозанием сухой
газообразный хлористый водород, при чем за этот промежуток времени в смесь добавляют дополнительно 30 мл
диэтилового эфира. Образовавшийся осадок отфильтровывают, промывают дЫэТИЛОВЫМ эфиром и ВЫСУ.ШИВсЦОТ в
вакууме над пятиокисью фосфора с по лучением 28,3 г (95%) дифенилметил амингидрохлорида ст..пл. ЗОЗ-ЗЮ С
(с разложением). 28,3 г (0,129 моль) дифенилметил амингидрохлорида и 9,81 г
(0,129 моль) тиоцианата аммония в 37 мл бромбензола выдерживают при кипячении с обратным холодильником
в токе азота, в течение 3,5 ч, а затем охлаждают до комнатной температуры
. Твердый материал отфильтровывают и дважды растирают с использованием порций воды по 200 мл. Далее
твердый материал растворяют в 850 мл этанола, раствор профильтровывают и выпаривают в вакууме до
объема приблизительно 350 мл. После охлаждения твердый материал отфиль
ровывают, промывают этанолом и выпаривают в вакууме над пятиокисью фосфора с получением 14,72 г (56%)
N,М -бис-(дифенилметил)-тиомочевины с т.пл. 216-217,. Найдено,%: С 79,84, Н 6,05;
М 6,93. Cg7 NfjS Вычислено,%: С 79,37; Н 5,92; N 6,86.
П р и м е р I 17. 1,21 г (0,05 моль) N,К-бис-(дифенилметил) -тиомочевины и 1,21 г (0,005 моль)
дезилхлорида в 11 мл абсолютного этанола выдерживают при температур кипения с обратным холодипьником в
токе азота в течение 3ч. После охлаждения реакционную смесь выпаривают досуха, а образовавшееся
масло смешивают приблизительно с 40 мл диэтилового эфира. Твердый материал отфильтровывают, охлаждаю
диэтиловым эфиром и высушивают в вакууме над пятиокисью фосфора с п
лучением 1,01 г (75%) 4,5-дифенил-2-дифёнилметиламинотиазолгидрохло рида с т.пл. 195-198с.
Найдено,%: С 73,12; Н 5,28; N . HciieHO,%: С 73,91; Н 5,09; N 6,16. Пример 18. Аналогично при
рам 16 и 17 получают 4-фенил-2-дифенилметиламинотиазолгидробромид с т.пл. 166-168С.
Пример 19. 25 г (0,184 мо N-фенилэтилендиамина растворяют в диэтиловом эфире, раствор охлаждаю
до и через него пропускают бар ботированием сухой газообразный хлористый
водород до тех пор, пока не прекращается образование осадка. Отфильтрованный сухой материал высушивают
над пятиокисью фосфора с получением 31,2.г (98%) N-фенилэтилендиамингидрохлорида .
31,2 г (0,149 моль) N-фенилэтилендиамингидрохлорида и 11,3 г (0,149 моль) тиоцианата аммония в
31 мл бромбензола выдерживают при температуре кипениЯ с обратным холодильником в токе азота в течение
2 ч. После охлаждения образовавшийся твердый материал отфильтровывают и бромбензол удаляют из фильтрата
в вакууме. Затем твердый материал перемешивгиот в 250 мл воды, отфильтровывают
и растворяют в горячем изопропиловом спирте. После охлаждения твердый материал, выпавший в
осадок, отфильтровывают, промывают и высушивают над пятиокисью фосфора
с получением 2,8. г (8%) N-(2 -анилиноэтил )-тиомочевины с т.пл. 137140°С .
Найдено,%: С 55,64; Н 6,75; 21,03. 1ъ NO,S
Вычис зено,% : С 55,35; Н 6,71; 21,52. При мер 20. 0,90 г
(0,0046 моль) N-(2 -анилиноэтил)-тиомочевины и 0,92 г (0,0046 моль)
л-бромацет6фенона в 6 мл абсолютного этанола выдерживают при температуре
кипения с обратным холодильником в токе азота в течение 2 ч. После
охлаждения реакционной смеси растворитель удаляют в вакууме. Образовавшееся
масло растворяют в горячем изопропиловом спирте, профильтровывают раствор и охлаждают. Твердый
материал отфильтровывают и высушивают над пятиокисью фосфора с получением
1,25 г (73,5%) 2-(2-анилиноэтиламино )-4-фенилтиазола с т.пл. 161-165с.
Найдено,%: С 54,51; Н 4,59; 11,02. С„ N-S. НВг
Вычислено,%: С 54,24; Н 4,82; 11,16. Пример 21. Аналогично примерам
19 и 20 получают гидрогалогенидные соли нижеследующих соединений V-N
. CHj-CHj-NH Гидрохло- Фенил Фенил 139-143
Гидробро- Фенил Метил 133-136 , П р и м е р 22, Иммунорегулянтную активность аминотиазолов, котор описаны в примерах 2-5,7/8,11,12,14
15, 17,18,20 и 21, оценивают путем определения их способности стимулировать ин витро лимфоцитную проли
ферацию клеток вилочковой железы мышей, культивированных в присутствии Конканавалина А (Кон.А), путем
осуществления процедуры В.Дж. Мерлу ци и др. Эти клетки взяты у самца взрослой мыши С57В1/6 в возрасте
6-8 недель. Каждая клеточная культу ра, состоящая из 0,10 мл исходного раствора клеток вилочковой железы,
0,05 мл исходного раствора Кон.А и 0,05 мл лекарственного раствора, пр готовлена учетверенно, а клеточную
пролиферацию измеряют по истечении 48 ч инкубационного периода при посредством пульсации
культуры с использованием дина 10,01мл удельной активности. 1,9 С/тМ). Затем определяют внедрение
Н-тимидина в клеточную дезоксирибонуклеиновую кислоту (ДНК)
путем оценки радиоактивности с йспользованием жидкостного сцинтилляционного счетчика. Полученные таким
образом результаты выражают количественно в виде среднегЬ числа еди ниц в минуту (евм) Н-тимидина,
внедренного при данном уровне лекар ственного средства с максимгшьной
активностью, путем учетверения клеточных культур. Эти определения учетверением осуществляют при восьм
различных концентрациях лекарственных .средств в интервале 0,0250 мкг/мл. Полученные максимальные
значения используют в оценочной сис теме. Основываясь на этом, в данном
.испытании, по лимфоцитному стимулированию (иле) получают четыре различных уровня активности, причем
каждой Н-тимипоследние определены в соответствии
с нижеследующими, а именно, те уровни , которые соответствуют уровню
только одного Кон.А (6000 t300 евм), обозначены как отрицательная величина или нулевой оценкой, которые
превосходят по активности (10000 i +,700 евм) Кон.А, но уступают левамизолу , обозначены как +, которые
соответствуют активности левамизола (22000 i 900 евм) ,обозначены ++,
тогда как те уровни, которые превосходят по активности левамизол, обозначены +++. Активность ИЛС для
соединений, описанных в вышеприведенных примерах, в каждом случае соответствует оценке +++.
Пример 23. Противовоспалительную активность аминотиазолов формулы 1 определяют с использованием
стандартного испытания с отеком лапки крысы, вызванным каррагенином
. Эти соединения вводят в организм животных через рот в форме их выше описанных гидрогалогенидных
солей в дозировке 33 мг/кг. Полученные при этом результаты выражены в виде степени ингибирования в
процентах процесса образования отека , достигаемой с использованием
каждого из испытываелслх соединений, в сравнении с тем отеком, который
возникает У контрольной особи, не получившей лекарственного препарата,
т.е. получившей водный раствор, не содержащий никакого из указанных соединений.
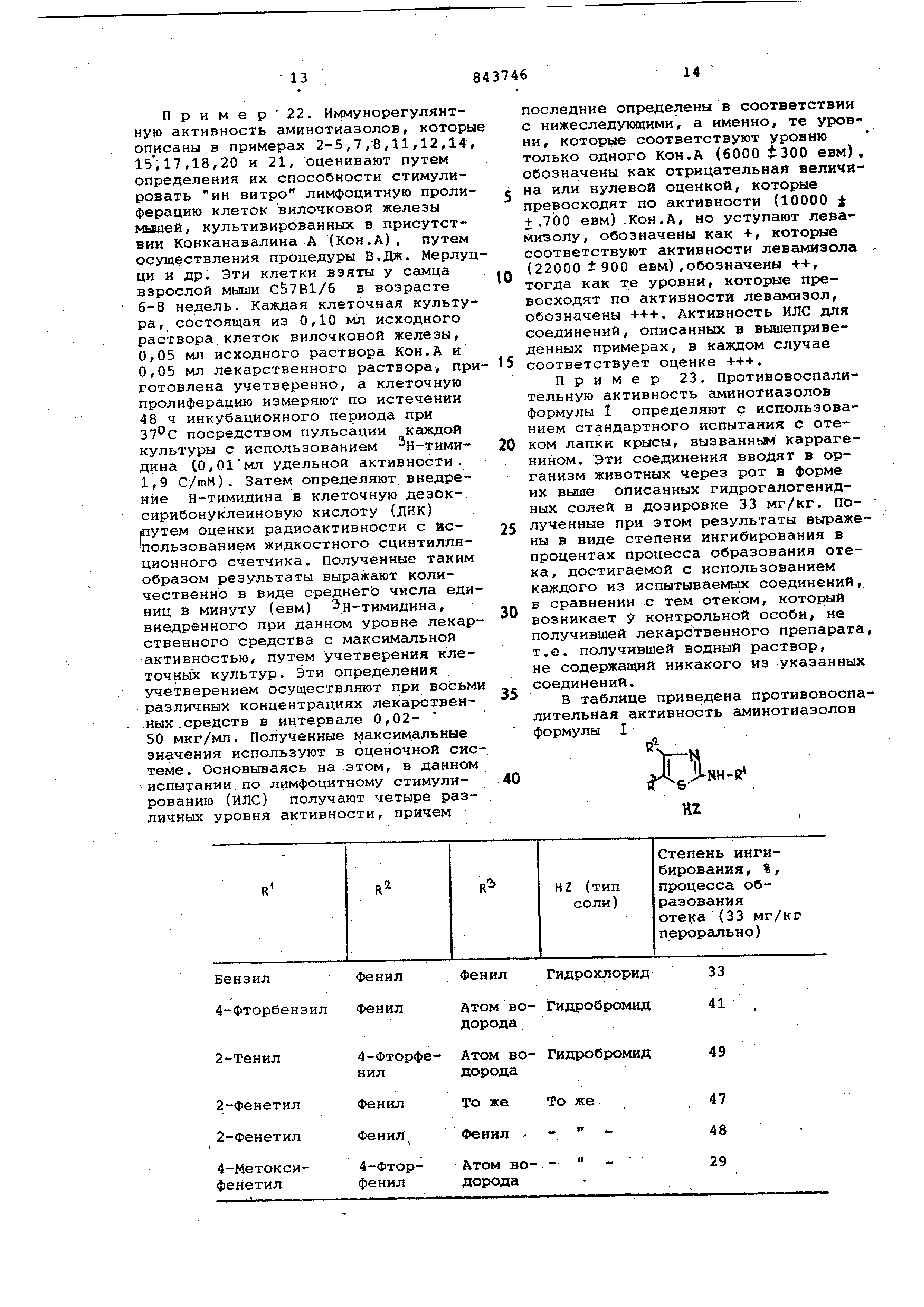
В таблице приведена противовоспалительная активность аминотиазолов формулы 1
У:
Аминотиаэолы формулы 1 и их
кислотно-аддитивные соли могут быть таким образом использованы в качеств противовоспалительных агентов и
с едств регулирования иммунной реакции в организме теплокровных животных . Сочетание противовоспалительно
активности и иммунорегулирующей активности особенно ценно при лечении таких заболеваний как ревматоидные
артриты, а также других болезней, связанных с иммунной недостаточностью и сопровождающихся воспалением
.
Соединения 1 можно вводить в организм больного, нуждающегося
в лечении, обычным путем, в частности через рот или параитерально , причем приемлемые дозировки находятся
в интервале приблизительно 0,10-50 мг/кг живого веса больного, предпочтительнее примерно 0,1515мг/кг
живого веса в день. Однако оп1А1мальная дозировка для индивидуального больногр находящегося на
лечении, определяется лицом, ответственным за лечение, причем обычно для определения наиболее приемлемой
дозы начинают с уменьшенных дозировок которые затем постепенно увеличивают
. Сама же по себе доза изменяется в зависимости от того, какое используют соединение, и
от больного, находящегося на лечени
Соединения формулы I могут быть
использованы в составе фармацевтических препаратов, содержащих эти соединения или их кислотно-аддитивные
соли в сочетании с фармацевтически приемлемым наполнителем или разбавителем.. Класс фармацевтически
приемлемых наполнителей включает в себя тверда е инертные наполнители
или разбавители и стерильные водные или органические растворы. Активнодействующее соединение входит в
состав таких фармацевтических композиций в количествах, достаточных
для достижения дозировки, находящейся в вышеуказанных пределах. Так,
например, для приема через рот соединения формулы I могут быть использованы в сочетании с подходящим
твердым или жидким наполнителем или разбавителем при изготовлении капсул f таблеток, порошков, сиропов,
растворов, суспензий и т .п. Фармацевтические композиции могут включать IB себя, также дополнительные
компоненты, в частности ароматизирующие добавки, подсластители, основы для приготовления лекарств и
т.п. Для парентерального введения в организм соединения формулы I могут быть использованы в сочетании
со стерильными водными или органическими средами, позволяюц)имй готовить растворы или суспензии для
инъекций. Так, например, с этой
целью могут быть использованы сезамовое
и арахисовое масла, водный раствор пропиленгликоля и т.п. а также :водные растворы водорастворимых
кислотно-аддитивных солей соединений формулы I. Растворы для инъекций, приготовленные таким образом
, можно вводить внутривенно, внутрибрюшинно,подкожно или внутри/Машечно , причем пр.едпочтительно их
вводить внутривенно и внутрибрюшинIHO . Для лечения местных воспале:1ний соединения формулы I могут
быть использованы нанесением на место воспаления в форме мазей, кремов
паст и т.п. в соответствии с обычно фармацевтической практикой.
Активность предлагаемых соединений в качестве противовоспалительных
агентов можно определять фармаклогическими испытаниями, например
стандартным испытанием путем введения каррагенина,вызывающего отек лапок
крысы, в соответствии с обычной .процедурой, описанной К.А, Уинтером
и др. В ходе проведения такого испытания противовоспалительную активность
определяют по степени ингибирования в процентах образования отека на задней лапке самцов белых
крыс (вес которых обычно составляет приблизительно 150-190 г), вызываемого
подподошвенной инъекцией каррагенина . Инъекцию каррагенина производят
с использованием 1%-ой водной спензии по истечении 1 ч после введения через рот в организм животных;.
лекарственного препарата, который обычно дают животным в форме водного раствора или суспензии. Затем
степень отечности определяют по истечении 3 .ч после инъекции каррагенина
путем сопоставления первоначального объема, лапки, в которую вводят карраге.нин, с ее объемом гю
истечении 3 ч. Увеличение объема лапки по истечении 3 ч после инъекции
каррагенина составляет индивидуальную реакцию. То или иное соединение является активным в том случае
, если разница меисду реакциями животных, которым дают лекарственный препарат (6 особей на каждую
группу), и животных контрольной группы, т.е. животных, в организм которых вводя: только одну основу
|для приготовления лекарства, оказывется значительной в сравнении с
теми результатами, которые достигнуты с использованием стандартных
соединений, аналогичных ацетилсалициловой кислоте в дозировке 100 мг/кг
или фенилбутазону при дозировке 33 мг/кг (дозировка для .обоих соединений
указана для случая их введения через рот).
Иммунорегулирующую активность
предлагаемых соединений можно определять с помощью таких фармакологических тестов, как стимулирование ин витро лимфоцитной .пролиферации клеток мьпииной вилочковой желеЭы
, культивированных в присутстви Конканавалина А (Кон.А) с осуществлением обычной процедуры оценки,
описанной В Дж. Мерлуцци и др. В процессе такого исследования проводят .испытание по оценке на четыре
различных уровнях лимфоцитного стимулирования (иле) для определения активности соединений формулы 1,
причем более конкретно устанавливаю соединения, активность которых равна активности только одного Кон.А,
превышает активность Кон.А, но меньше активности левамизола,ра на активности левамиэола, а также
те соединения, активность котораос превышает активность левамизола. Те
соединения, активность которых превышает активностьКонканавалина А, рассматриваются как активные для да
ных целей (пример 22).
Формула изобретения
1. Способ получения аминотиазолов общей формулы (I) . „ .
Tj2ги
X
ын-р
„9г
де R - -СН
-(СН2)2Х,
X
:сн. NHX или
CHj CH(j
а
де X - фенил или моно()aлкoкcифeнил; тиенил или фурил,
Y целое число, равное 1 или 2
m R фенил, тиенил или монозамещенный фенил, причем указанный
заместитель предста1вляет собой алкил с 13 атомами углерода, оксигруппу
, алкоксигруппу с 1-3 атомами углерода, атом хлора, брома или фтора;
Rb атом водорода, алкил с 13 атомами углерода или фенил
.
25
где fC - группа -СН С где X имеет вышеуказанные значения, в среде
инертного органического растворителя при повышенной температуре и выде0 ляют целевой продукт в свободном виде или в виде кислотно-аддитивной соли. .
2.Способ ПОП.1, отличающийся тем, что, в качестве
5
инертного органического растворителя используют н-алканол с 1-6 атомами
углерода и нагревание ведут до 501750с .
3.Способ по п.2, отличаю0
щийся тем, что в.качестве н-алканола используют этанол.
Источники информации, принятые во внимание при экспертизе
1.Гетероциклические соединения. Под ред. П. Эльдерфильда.М., Иност5 ранная литература, 1961, т.5,
с. 456-457.
2.Патент Великобритании
1505020, кл. С 07 D 277/42, опублик. 22.03.78.
0 или их кислотно-аддитивных солей, отличающийся тем, что
6-галоидкарбоиильное соединение формулы (I I) (Z)R
где Z - атом галогена,, а R и Rимеют вышеуказанные значения,подвергают
взаимодействию с N-аралкилтиомочевиной формулы (III) B -NH-C-11H|
где R - -(СЮ„Х, -CHqCH-NHX или ( CHa)Y, где X, Y и m имеют вышеуказанные
значения, или с дизамещеиной N-аралкилтиомочевиной формулы (IV) S
R --8H-C-HH-R lV










Комментарии