Производные дибенз(b, f) (1,4)оксазепин-11-она и их фармацевтически приемлемые кислотно-аддитивные соли, фармацевтическая композиция и способ уменьшения мультилекарственной резистентности раковых клеток к цитотоксическому лекарству - RU2086545C1
Код документа: RU2086545C1
Чертежи

Описание
Изобретение относится к замещенным дибенз-/b, f/ /1,4/ оксазепин-11(1OH)-онам, которые можно использовать для снятия мультилекарственной резистентности раковых клеток по отношению к сложным цитотоксичным лекарствам. Таким образом, соединения по данному изобретению могут быть использованы для вспомогательной хемотерапии неоплазий, резистентных по отношению к сложным лекарствам.
Лечение опухолей человека с помощью цитотоксичных лекарств являются важным компонентом современной клинической раковой терапии. Основным препятствием для эффективной хемотерапии рака являются резистентность опухолевых клеток по отношению к антинеопластическим агентам. Лекарственная резистентность у злокачественных опухолей человека может возникать по различным механизмам. Особенно важной является перекрестная резистентность раковых клеток по отношению к группе разнообразных липофильных лекарств, имеющих неродственные структуры и функции; это явление известно как мультилекарственная резистенность /МДР/.
На ранних стадиях исследований был выявлен общий признак для всех МДР-клеток, а именно снижение внутриклеточного стандартного накопления лекарства по сравнению с чувствительными клетками. Позднее было обнаружено, что подобный фенотип часто связан с повышенной экспрессией гликопротеина плазменной мембраны /P-gp/ /170 кДа/. Участие этого белка в МДР было подтверждено его способностью придавать лекарственную резистентность при трансфекции клонированного p-gp гена /МДР-1/ в чувствительные клетки. Смотри: Jcace Bradley, Peter F.Juranka Victor Ling Mechanisms of multidrug resisfance, Bioch Biophys. Acfa, 948 p.p 87-128 (1988); Jane A. Endicoff Victor Ling. The biochemisfoy of P-glycopnofeui mediafed mulfcdnio resisfance, Ann. Rev. Biochem. 58, p. p 137-171 (1989); James M. Tord William N.Haif- Pharmacology of alregs fhat alter multidreg resistauce in cancel, Pharmacolgical Reviws, 42, p.p. 155-199 (1990).
Ген P-gp состоит из двух симметричных половин, каждая из которых содержит домен связывания АТФ. Имеющиеся доказательства предполагают, что он функционирует как энергетически зависимый насос с широким диапазоном субстратоспецифичности. Относительно высокие уровни P-gp найдены также в некоторых нормальных тканях человека, таких как надпочечники, почки, ободочная кишка и плацента. Однако, его физиологическая роль и его природный субстрат пока еще не ясны. P-gp может служить для выведения встречающихся в природе токсинов или ксенобиотиков, как механизм детоксификации. Исследование клинических проб выявило повышенный уровень P-gp в опухолях, полученных на тканях, в нормальном состоянии обладающих повышенной экспрессией МДР-1. Кроме того, совершенно очевидно имеет место корреляция между экспрессией МДР-1 с некоторыми устойчивыми к действию лекарств гематологическими злокачественными образованиями и саркомами детских мягких тканей, которые в нормальном состоянии не экспрессируют P-gp. Смотри: Mace Rothenberg Victor Ling-Multidrug Resisfance: Molecular Biology and Clinical Relevance, J. Nat. Cancerjust. 81, pp 907910 (1989)$ Helen L. Chan, Paul S Thorner, Jeorge Haddad and Victor Ling-Immunohisfochemical Defectcion of P-glycoprotein: Prognostic Correlatioum Soft Tissue sarcoma of Childhood, J. Clin. Oncol. 8, p.p. 689-704 (1990).
Эти обнаруженные факты подтверждают вероятную клиническую роль, которую играет P-gp и в собственной и в благоприобретенной МДР, которая в конечном счете приводит к неэффективности некоторых случаев лечения рака.
Для того, чтобы "обойти" клиническую МДР, предложено несколько вариантов стратегии. Один, многообещающий подход заключается в использовании агентов, придающих хемочувствительность, которые могут подавлять активное истечение лекарства в резистентных клетках. Различную способность снятия МДР показали многочисленные соединения, включая антагонисты кальция, ингибиторы кальмодулина, а также некоторые лекарственные аналоги. Большая часть этих агентов липофильны и могут действовать как субстраты для P-gp, тем самым конкурирующе подавляя вызываемый им эффект истечения лекарства. В последнее время были опубликованы великолепные обзоры по агентам, которые могут менять мультилекарственную резистентность раковых клеток. Смотри: James M. Ford William N. Hait-Pharmacology of Drugs that alter Multidrug Resistance m Cancer, Pharmacological Reviews, 42, p.p. 155-199 (1990); David J. Stewart William K, Evause-non-chemotherapeutic Agents That Potentiate Chemotherapy Efficacy, Cancer Treatment Reviews, 16, p.p. 1-40 (1989).
В настоящее время основным фактором, ограничивающим применение некоторых агентов, изменяющих МДР у пациентов с раковыми заболеваниями, является их токсичность, которая не позволяет достигать эффективных концентраций в процессе лечения. Таким образом, существует необходимость в поиске идеальных агентов изменения МДР, более мощных, но менее токсичных и фармакологически приемлемых для клинического применения.
Нами недавно открыта группа замещенных дибенз /b,f/-/1,
4/оксазепин-11/10H/-онов /далее часто обозначаются аббревиатурой оксазепины/ с мощной способностью изменения МДР. Оксазепины со структурой, в некоторой степени родственной оксазепинам по данному
изобретению, можно найти, например, в патенте Великобритании N 1 164 579, опубл. 17 сентября 1969 г. в котором раскрываются оксазепины формулы (II)

где R8 это водород или галоген, R7 это водород или C1-6 алкил, а одна из групп R9 и R10 представляет собой свободную амино-группу, в то время как другие представляют собой атом водорода. Как сообщают, оксазепины формулы (II) обладают анальгетическими, антипиретическими и седативными свойствами. Далее, Nagarajan et al. b Journal of Experimental Biology 12, pp 217-224, на с. 229 описывает оксазепин формулы (III). Соединение формулы (III) получено внутримолекулярной циклизацией соединения формулы (IV) в горячем ДМФ.

Аналогичными методами пользовались для получения оксазепинов вышеприведенной формулы (II).
Не было выявлено активности изменения МДР ни для оксазепинов формулы (II), ни для оксазепинов формулы (III).
Данное изобретение относится к дибенз /b,f//1,4/оксазепин-11/10H/-онам формулы (I) или к его фармацевтически приемлемой соли

где p равно от 1 до 3;
R1 и R2 -это каждая независимо атом водорода или ацильная группа R6CO-, в которой R6 это C1-6 алкил, C3-7 циклоалкил, C2-7 алкенил, арил или радикал формулы

R3 это водород или хлор;
R4 и R5- каждая независимо это C1-6 алкил.
Соединения формулы (I) могут быть использованы для измерения мультилекарственной резистентности противораковых лекарств. Таким образом, в другом аспекте данное изобретение относится к использованию соединения формулы (I) в качестве агента для вспомогательной хемотерапии неоплазий, резистентных по отношению к сложным лекарствам.
Данное изобретение относится к дибенз/b,f//1,4/оксазепин-11/10H/-онам формулы (I) или к его
фармакологически приемлемой соли

где p равно от 1 до 3;
R1 и R2 это каждая независимо атом водорода или ацильная группа R6CO-, в которой R6 это C1-6 алкил, C3-7 циклоалкил, C2-7 алкенил, арил или радикал формулы

R3 это водород или хлор;
R4 и R5 это каждая независимо C1-6 алкил.
Предпочтительными соединениями формулы (I) являются такие, у которых р равно 1, -COR6 представляет собой радикал, выбранный из

где n равно от 1 до 4.
Соединение формулы I', /Схема А/, которые образуют подкласс соединений формулы (I), где R1 и R2 представляют собой атом водорода, а R3 это CI, могут быть получены многими способами. Предпочтительный процесс представлен Схемой А.
На стадии 1 Схемы А происходит замена фенольного водорода формулы (V) на катион M с образованием соединения формулы (VI). Примеры катиона включают натрий, калий, тетрабутиламмоний, бензилтриэталаммоний и многие другие. Эта замена может быть вызвана основанием, таким как карбонат калия, гидроксид калия, гидрид калия, гидрид натрия, гидроксид натрия, карбонат натрия или гидроксид четвертичного аммония, например, как гидроксид тетрабутиламмония или гидроксид бензилтриэтиламмония. Реакцию обычно проводят в инертном органическом растворителе, таком как ацетон, ацетонитрил, метиленхлорид, диметилформамид /ДМФ/, диметилацетамид, метанол, 2-метоксиэтанол, изопропанол или диглим.
Стадия 2 Схемы А осуществляется взаимодействием полученной фенольной соли формулы (VI) с соединением формулы (VII), в которой y это галоген предпочтительно хлор или фтор. Присоединение проводят в присутствии основания, такого как карбонат калия, и в среде инертного органического растворителя, такого как ацетонитрил, ДМФ, диметилацетамид, 2-метоксиэтанол, этанол, изопропанол или диглим. Предпочтительным растворителем является н-пропанол, 2-метоксиэтанол или ДМФ. Еще большее предпочтение отдается 2-метоксиэтанолу в качестве растворителя. Реакция протекает при повышенной температуре и даже более предпочтительно при температуре образования флегмы используемого растворителя.
В случае необходимости, в положении свободной 3-аминогруппы с замещением одного или двух атомов водорода на одинаковые или различные радикалы R5CO- значение которых определено выше. Методика ацилирования свободного ароматического амина хорошо известна. Например, в целях моно-ацилирования соединение формулы I' сочетают с эквимолярным количеством кислоты R6COOH в присутствии дегидратирующего агента, такого как дициклогексилкарбодиимид или 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин /EEDQ/. Могут подойти также другие дегидратирующие агенты, какие как описанные в Synthesis pp 453-463 /1972/. В другом варианте, карбокси-группа кислоты R6COOH можно превратить в реакционноспособное производное, которое можно использовать при N-ацилировании. Реакционноспособное производное по карбокси-группе, которое можно использовать, представляет собой галогенид кислоты; имидазолид кислоты; азид кислоты; смешанный ангидрид кислоты; активный сложный эфир, такой как образуются с этилхлорформиатом или изобутилхлорформиатом; фенилкарбанат; N-гидроксамид, такой как образуются с N-гидроксисукцинимидом или N-гидроксифталимодом, а также как образуются с гидроксибензотриазолом /ГБТ/ или 4-метилтетразол-5-тионом; или другие аналогичные активные карбокси-производные. Чтобы получить соединение формулы (I), в которой R1 и R2 представляют собой те же самые ацильные группы, необходимо использовать по крайней мере два аквивалента тех же самых ацилирующих реагентов. С другой стороны, если требуется ввести две различные группы, ацилирование предпочтительно проводят ступенчато, с использованием различных ацилирующих агентов.
Чтобы получить соединение формулы (I), в котором R3 это водород, можно подвергнуть гидрогенолизу 2-хлоро-группу соединения формулы I', и при желании, ацилировать свободную 3-амино-группу по описанной выше методике. Можно наоборот сначала ацилировать соединение формулы I', а затем подвергнуть гидрогенолизу 2-хлоро-группу.
Синтез класса соединений формулы (V) хорошо описан в нескольких патентных источниках и публикациях. Более удобны способы, использованные для получения исходных материалов синтеза соединений, запатентованных в патенте США N 4.808.624. Другие способы, которые могут быть приспособлены для получения соединений формулы (V), кратко рассмотрены в разделе Полное Описание указанного патента США.
Согласно другому варианту исполнения данного изобретения, для получения соединения формулы I" можно использовать последовательность стадии, показанную на Схеме В. На схеме R1 и R2 соединения формулы (IX) имеют ранее определенные значения. Так, когда R1 И R2 каждая представляют собой водород, Стадию 1 не проводят. Предпочтительно, однако, чтобы по крайне мере R1 или R2 представляла собой ацильную группу R6 CO-, значения которой определены ранее. Даже более предпочтительно, чтобы любая из групп R1 или R2 представляла собой ацетильную группу, в то время как группа была бы атомом водорода. Ацетильная группа может служить защитной группой, которую легко можно удалить на более поздней стадии основным гидролизом. Моно-или ди-ацелирование на стадии 1 можно осуществлять по методикам, аналогичным описанным для соединения формулы I'.
Карбоксильная группа в соединении формулы (IX) защищают на Стадии 2 обычной карбокси-защитной группой. Защитные группы, применяемые обычно в данном изобретении для блокировании или защиты функциональной карбоксильной группы, представляют собой хорошо известные специалистам в данной области группы, и указанные группы предпочтительно удаляют при необходимости методами, которые не приводят к значительному разрушению остальной части молекулы, например, путем химического или ферментативного гидролиза, обработкой химическими восстановителями в мягких условиях, облучением ультрафиолетовым светом или каталитическим гидрированием. Примеры таких легко удаляемых карбокси-защитных групп включают такие остатки, как C1-6 алки, дифенилметил /бензигидрил/, 2-нафтилметил, 4-пиридидметил, фенацил, ацетонил, 2,2,2-трихлорэтил, силил в форме триметилсилила и трет-бутилдиметилсилил, фенил, замещенный по кольцу фенил, например, 4-хлорфенил, толил и т-бутилфенил, фенил-C1-6 алкил, /замещенный по кольцу фенил/-C1-6 алкил, например, бензил, 4-метоксибензил, 4-нитробензил /р-нитробензил/, 2-нитробензил /о-нитробензил/ и трифинилметил /тритил/, метоксиметил, 2,2,2-трихлорэтоксикарбонил, бензилоксиметил, C1-6 алканоилокси- C1-6 алкил, такой как ацетосиметил, пропионилоксиметил, C2-6 алкенил, такой как винил и алкил. Другие хорошо известные подходящие карбоксизащитные группы, не раскрытые выше, можно найти в "Protector Yroups in Organic Syuthesis", Theodora W. Greene (Johu Wiley and Sons, 1981) chapter 5 включена здесь для ссылки. Для использования в данном изобретении, особенно предпочтительной карбокси-защитной группой является аллил.
На стадии 3 происходит обмен свободного фенольного водорода на катион М, по методике, аналогичной Стадии 1 Схема А. Полученной таким образом соединение формулы (XI)
взаимодействует с соединением формулы (VII) на Стадии 4 с образованием соединения формулы (XII), где радикал W обозначает

Условия проведения Стадии 4 аналогичны условиям,используемым для проведения Стадии 2 Схемы А.
Стадия 5 включает удаление традиционной карбокси-защитной группы. Если R11 представляет собой аллил, то его можно удалить с помощью трис/дибензилиденацетон/дипалладия (О) и трифенилфосфина.
Стадия 6 включает конденсацию амина H2NCH2(CH2)pNR4R5 с производным бензойной кислоты формулы (XIII) с получением бензамида формулы (XIV) и с последующей перегруппировкой, инициируемой основания, в соединение формулы (XV). Известно несколько способов получения бензамидов из первичных аминов и производных бензойной кислоты типа формулы (XIII). Например, несколько типичных методик описано в разделе Полное Описание Изобретения патента США N 4 808 624. Обычно бензамиды формулы (XIV) не выделяют, а немедленно превращают действием основания, такого как карбонат калия, в соединение формулы (XV).
После нагревания, предпочтительно при температуре образования флегмы используемого растворителя, на Стадии 7 получают бенз /b, f/ /1, 4/ оксазепин формулы I". Предпочтительным растворителем является такой, который не препятствует внутримолекулярной циклизации; примеры включают ацетонитрил, 2-метоксиэтанол, диметилацетамид, метанол, изопропанол или диглим. Особенно предпочтительным растворителем является 2-метоксиэтанол.
При необходимости можно хлорировать соединение формулы I" в 2-положении, что осуществляется на стадии 8. Хлорирование можно произвести по стандартной методике хлорирования ароматического кольца, например, действием сульфурил-хлорида в хлористом метилене, хлором в уксусной кислоте, N-хлорсукцинимидом или другими подходящими методами хлорирования.
В тех случаях, когда R1 и R2 представляют собой водород и ацетильную группу,можно удалить основным гидролизом, что дает соединение формулы I" или I''', где N-R1R2 это свободная амино-группа, которая может быть моно- или диацилирована R6 CO- радикалами, если требуется получить далее соединения, входящие в объем данного изобретения.
В данной заявке цифры в подстрочнике у символа "C" означают число атомов углерода, которое может содержаться в конкретной группе. Например, C1-6 алкил относится к алкильным группам с прямой или разветвленной алкильной группе с одним-шестью атомами углерода, и такие группы включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, н-гексил, 3-метилпентил и т. п. алкильные группы; C2-6 алкенил относится к алкенильным группам с прямой или разветвленной цепью, таким как винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, металлил, 1,1-диметил-аллил, 1-гексинил, 2-гексенил и т. п. группы; циклический C3-7 алкил относится к таким группам, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопропилметил, циклопропилэтил, циклопропилпропил, циклобутилметил, циклобутилэтил, циклопентилментил и аналогичные группы; арильная группа относится к незамещенному фенилу или к фенилу, независимо замещенному от одного до трех атомов галогена, C1-6 алкилом, C1-6 алкокси или C1-6 алкилтио, к такому как 4-метилфенил, 2,3-диметоксифенил, 2-метил-3-этоксифенил, 4-трет-бутоксифенил, 4-метилтио-3-фторфенил, 2,4-дихлорфенил, 2-хлор-4-бромфенил и аналогичные группы; C1-6 алкилокси /алкокси/ относится к алкилокси-группам с прямой или разветвленной цепью, таким как метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, н-пентилокси, н-гексилокси, 3-метилпентилокси /в качестве примеров/; C1-6 алкилтио относится к алкилтио-группам с прямой или разветвленной целью, таким как метилтио, н-пропилтио, н-бутилтио, трет-бутилтио, н-пентилтио, н-гексилтио, 3-метилпентилтио, и к аналогичным группам; атом галогена относится к фтору, хлору брому или иоду.
Предполагается, что структурные формулы, в том виде как они здесь приводятся, лучше всего представляет структуру соединений по данному изобретению. Однако, некоторые соединения, входящие в объем данного изобретения, могут существовать в виде других таутомерных форм, в которых атомы водорода перемещаются в другие части молекул, и, следовательно, меняется конфигурация химических связей между атомами в молекуле. Следует понимать, что структурные формулы представляют все таутомерные формы, если они могут существовать.
Нижеследующие конкретные примеры иллюстрируют синтез представителей соединений по данному изобретению и не предназначены для ограничения области и объема изобретения. Возможны модификации способов с целью получения соединения, которые охватываются данным изобретением, но специально не описаны. Кроме того, модификации способов, обеспечивающие получение тех же соединений, но несколько отличным образом, также будут очевидны для специалистов.
Должно быть понятно, что температура, помимо специально оговоренных случаев, дается в градусах шкалы Цельсия /C/. Спектральные характеристики ядерного магнитного резонанса /ЯМР/ относятся к химическим сдвигам δ, выраженным в частях на миллион /ррм/ по отношению к тетраметилсилану /ТМС/, который используется как стандарт. Соответствующая область, сообщаемая для различных сдвигов в данных протонного ЯМР, соответствует числу атомов водорода функциональной группы определенного типа, присутствующей в молекуле. Характер сдвига в смысле мультиплетности приводится в виде: уширенный синглет /bs/, уширенный дублет /bd/, уширенный триплет /bt/, уширенный квартет /bg/, синглет /s/, мультиплет /m/, дублет /d/, квартет /g/, триплет /t/, дублет дублета /dd/, дублет триплет /dt/ и дублет квартета /dg/. Для снятия спектров ЯМР используется DMСО-d6 /пердейтеродиметилсульфоксид/, D2O /дейтерированная вода/, CDCI3 /дейтерохлороформ/ и другие традиционно используемые дейтерированные растворители. Описание спектров ИК (инфра-красных) включает только величины длин волн поглощения /см-1/, соответствующие функциональным группам.
"Целит" это зарегистрированный торговый знак Johus Manville Product Corporation, по которым поставляется инфузорная земля.
Здесь используются традиционные сокращения, широко применяемых в данной
области. Некоторые из них приводятся ниже:
MS: масс-спектрометрия
HRMS: масс-спектрометрия высокого разрешения
DMF: диметилформамид
Ac: ацетил
ADR:
адриамицин
ActD: актиномицин D
DMSO: диметилсульфоксид
Ph: фенил
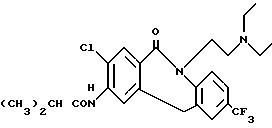
Пример 1. 3-Амино-2-хлор-10-[2-(диэтиламино)этил]-7-(трифторметил)дибенз/bf/ /1,
4/оксазепин-11(10H)-он /1а/

Суспензию 60%-ного гидрида натрия в минеральном масле /1,76 г, 44 моля, промыт н-пентаном/ обработали в атмосфере азота н-пропанолом /80 мл/. Затем добавили 4-амино-5-хлор-N-[2-(диэтиламино)этил] -2-гидроксибензамина гидрохлорид /6,44 г, 20 моль/ и 4-хлор-3-нитробензотрифторид /4,51 г, 20 моль/. Смесь нагревали с обратным холодильником в течение 6 ч, а затем сконцентрировали в вакууме. Остаток распределили между водным раствором NaHCO3 и смесью дихлорметана, эфира и н-гексана состава 1:1:1. Органическую фазу промыли 1 н. NaOH, водой, а затем обработали 20 мл 1 н. HCl. Осадившееся твердое вещество собрали фильтрованием и промыли ацетоном, получив 1,65 г сырого 3-Амино-2-хлор-10-[2-(диэтиламино)этил] -7-(трифторметил)дибенз/bf/ /1,4/оксазепин-11(10H)-он /1а/ дигидрохлорида в виде светло-желтого твердого вещества. Маточники соединили, нейтрализовали водным раствором NaHCO3 и экстрагировали в CH2Cl2. Экстракт высушили и сконцентрировали, остаток элюента CH2Cl2 с 2-8% MeOH, и получили следующие три фракции.
Первая фракция: 430 мг 4-амино-5-хлор-N-[2-(диэтиламино)этил]-N-[2-нитро-4- (трифторметил)фенокси]бензамида, который был получен в виде желтого аморфного твердого вещества с т.пл. > 60oC.
1H ЯМР /CDCl3/ δ 8,0-8,3 /мультиплет, 3H/, 7,7-7,9 /м, 4H/, 7.02 /с, 1H/, 6,11 /с, 1H/, 4,26
/м, 2H/, 2,2-2,8 /м, 6H/, 0,80 /м, 6H/;
MC (m/e) 663;
Анализ: C27H24ClF6N5O6
Вычислено: C 48,84, H 3,64, N 10,55
Найдено: C 50,75, H 4,00 N 9,85
Вторая фракция: 359 мг 3-амино-2-хлор-10[2-(диэтиламино)этил] -7-(трифторметил)-дибенз /bf//1,4/оксазепин-11/10H/-она /1а/, полученного в виде свободного
основания.
1H ЯМР /CDCl3/ d 7,72 /с, 1H/, 7,63 /д, 1H/, 7.42 /д, 1H/, 4,42 /с, 1H/, 6,52 /с, 1H/, 4,45 /с, 2H/, 4.09 /+2H/, 2,77 /т, 3H/, 2,52 /к, 4H/, 6,96 /т,
6H/;
MC (m/e) 428 соответствует M+H+.
Образцы обработали безводной HCl в MeOH и полученный продукт соединили с полученным ранее твердым веществом /1,65 г/ и перекристаллизовали из смеси MeOH-Et2O, получив 1,85 г светло-бежевого твердого вещества с т.пл. > 130oC.
Анализ: C20H21ClF3N3O2. 2HCl
Вычислено: C 47,97, H 4,63 N 8,39
Найдено: C 47,74, H 4,58 N 8,33
Третья фракция: 68 мг
4-амино-5-хлор-N-[2-(диэтиламино)этил]-2-гидрокси-N-[2-нитро-4- (трифторметил)фенил] бензамида, полученного в виде желтого твердого вещества, т.пл.>100oC.
1 H ЯМР /CDCl3/ d 8,10 /с, 1H/, 7,96 /с, 2H/, 6,38 /с, 1H/, 6,21 /с, 1H/, 4,39 /с, 2H/, 4,2-4,4 /м, 2H/, 4,7-3,2 /м, 6H/, 1,2 /м, 6H/.
MC (m/e) 474.
В другом эксперименте 3-амино-2-хлор-10-[2-(диэтиламино)-этил[-7-(трифторметил)-дибенз /bf//1,4/оксазепин-11/10H/-она дигидрохлорид получили следующим способом: смесь тетрабутиламмониевой соли 4-амино-5-хлор-N-2[-(диэтиламино)этил] -2-гидроксибензамина /13,182 г, 25 ммол/, K2CO3 /1,73 г, 12,5 ммол/ и 4-хлор-3-нитробензотрифторида /5,63 г, 25 ммол/ в 100 мл н-пропанола нагревали с обратным холодильником в течение 14 ч, а затем сконцентрировали in vacuo. Остаток распределили между Na2CO3 и этилацетатом /300 мл/. Органическую фазу промыли 3х200 мл воды, 0,5 н. водной NaOH /50 мл/, водой, а затем обработали н-пентаном до отделения темно-коричневых капелек. Декантировали верхний слой и обработали его 30 мл 2 н. хлористоводородной кислоты, чтобы вызвать осаждение. Твердое вещество собрали фильтрацией и промыли этилацетатом, получив 5,84 г /46,6%/ указанного в названии соединения в виде дигидрохлорида.
В другом эксперименте смесь тетрабутиламмониевой соли 4-амино-5-хлор-N-[2-(диэтиламино)этил] -2-гидроксибензамида /52,73 г/, 4-хлор-3-нитробензотрифторида /22,56 г, 0,1 моль/ и K2CO3 /6, 92 г, 50 ммоль/ в 300 мл 2-метоксиэтаноле перемешивали и нагревали с обратным холодильником в течение 17 ч. Смесь сконцентрировали in vacuo, а остаток распределили между водой и этилацетатом. Органическую фазу промыли 2х50 мл 1 н. NaOH, 2х100 мл воды, а затем обработали 50 мл 2 н. HCl. Твердый осадок собрали фильтрацией и промыли CH2Cl2 и этилацетатом, что дало после сушки на воздухе 29,44 г /58,9%/ дигидрохлорида указанного соединения.
Пример 2. N-[2-хлор-10,11-дигидро-10-[2-(диэтиламино)этил] -11-оксо-7- трифторметил)дибенз/b, f//1, 4/оксазепин-3-ил]ацетамид /10/ и N-ацетил-N-[2-хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7- трифторметил)дибенз/b,f//1,4/оксазепин-3-ил]ацетамид /1c/.

Раствор соединения 1a в 10 мл уксусного ангидрида нагревали до появления флегмы в течение 12 мин, а затем сконцентрировали in vacuo. Остаток подвергли хроматографии на силикагеле, используя в качестве элюента дихлорметан содержащий 1-5% метанола, что первые дало 295 мг соединения 1c в виде желтого аморфного твердого вещества.
1H ЯМР /CDCl3/ δ 7,97 /с, 1H/, 7.72 /д, 1H/, 7,49 /д, 1H/, 7.45 /с, 1H/, 7,13 /с, 1H/, 4,2 /т, 2H/, 2,89 /т, 2H/;
MC (m/e) 511.
Далее получили 820 мг моноацетилированного продукта 1b в виде бежевого твердого вещества, т.пл. 143-4oC.
Анализ: C22H23ClF3N3O3•0,5H2O• 0,5CH3CO2H
ВычисленоC 54,31, H 5,06, N 8,27
Найдено: C 54,68, H 5,11 N 7,93.
1H
ЯМР /CDCl3/d 8,43 /с, 1H/, 7,82 /с, 1H/, 7,74 /с, 1H/, 7,63 /д, 1H/, 7,52 /с, 1H/, 7,44 /д, 2H/, 4,18 /т, 2H/, 2,87 /т, 3H/, 2,63 /к, 4H/, 2,26 /с, 3H/, 2,02 /с, 2H/, 1,02 /т, 6H/;
MC (m/e) 469.
Пример 3 N-[10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил-дибенз /b,f/ /1,4/оксазепин-3-ил]ацетамид /Id/.

К смеси соединения Ib /270 мг/ и формиата аммония /220 мг/ в 8 мл метанола добавили 10 мг 10 Pd на угле. Все это перемешивали в течение 5 ч, после чего отфильтровали катализатор. Фильтрат сконцентрировали in vacuo а остаток распределили между водным NaHCO3 и дихлорметаном. Органическую фазу сушили и сконцентрировали in vacuo, получив 190 мг названного соединения в виде белого твердого вещества, т.пл. 75-85oC.
IH ЯМР /CDCl3/ δ 8,34 /синглет,
IH/, 7,75 /дублет, IH/, 7,65 /триплет, 2Н/, 7.46 /синглет, IH/, 7,40 /дублет дублета, IH/, 4,10 /триплет 2H/, 2.76 /триплет, 2Н/, 2,49 /квартет, 4Н/, 2,14 /синглет, 3Н/, 0,95 /триплет, 6Н/;
MC (м/е) 434;
HRMS: Вычислено:C22H24F3N3O3: 436, 1848.
Найдено: 436, 1846.
Пример 4. N-[2-Хлор-10, 11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(Трифторметил) дибенз /b,f/ /1,4/ оксазепин-3-ил]бензамид /1е/.

К перемешиваемому раствору соединения 1а /250 мг, 0,5 ммоль/ и триэтиламина /102 мг, 1 ммоль/ в 2 мл безводного CH2Cl2 добавили бензоилхлорид /141 мг, 1 ммоль/. Смесь перемешивали в течение 1 ч, а затем распределили между водным карбонатом натрия и CH2Cl2. Органическую фазу высушивали, сконцентрировали in vacuo а остаток подвергали хроматографии на силикагеле, использовав в качестве элюента смесь CH2Cl2 с 5-10 MeOH, что дало 182 мг /68,3 / названного соединения в виде желтого твердого вещества с т.пл. 67-69oC.
IH ЯМР /CDCl3/ δ 8,55/ синглет, IH/, 7,90 /дублет, IH/, 7,55 /мультиплет, 8H/, 4,05 /мультиплет, 2Н/, 2,72
/квартет, 2Н/, 2,50 /мультиплет, 5Н/, 0,96 /мультиплет, 6Н/;
HRMS: Вычислено: C27H25CIF3N3O3 532, 1615
Найдено: 532, 1627
Пример 5. N-[2-Хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил) дибенз /b,f/ /1,4/оксазепин-3-ил]кротонамид /1f/.

Повторили общую методику получения соединения 1е, за исключением того, что использованный там хлористый метилен заменили эквимолярным количество хлористого кротонила. Выход указанного соединения, в виде твердого вещества желтого цвета, составили 61,3% т. пл. 106-107oC.
IH ЯМР /CDCl3 / δ 8,50/ синглет, IH/, 7,87 /дублет, IH/, 7,55 /мультиплет, 2Н/, 7,00 /мультиплет, 2Н/, 5,82 /дублет дублета, 2Н/, 4,25 /мультиплет, 3Н/, 2,95 /мультиплет, 1Н/, 2,75 /мультиплет, 1Н/, 1,85 /квартет, 6Н/, 1,10 /мультиплет, 6Н/.
HRMS: Вычислено: C24H26N3O3F3Cl 496, 1615.
Найдено: 496, 1605.
Пример 6. N-[2-Хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил) дибенз /b,f,/ /1,4/ оксазепин-3-ил] пропионамид /Ig/.

Повторили общую методику получения соединения 1е, за исключением того, что бензоилхлорид заменили эквимолярным количеством пропионилхлорида, а продолжительность реакции составили 12 ч. Получили названное соединение с 75,0 выходом в виде желтого масла.
IH ЯМР /CDCl3/ δ 8,42 /синглет, 1Н/, 7,78 /синглет, 1Н/, 7.75 /синглет, 1Н/, 7,60 /дублет, 1Н/, 7,45 /дублет, 1Н/, 7,45 /дублет, 1Н/, 7.35 /дублет дублета, 1Н/, 4,10 /триплет, 2Н/, 2,80 /триплет, 2Н/, 2,45 /мультиплет, 6Н/, 1,25 /триплет, 3Н/, 0,95 /триплет, 6Н/.
HRMS.Вычислено: C23H26P3N3O3: 484, 1615;
Найдено: 484, 1612.
Пример 7. N-[2-Хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил) дибенз /b, f/ /1,4/ оксазепин-3-ил]циклопропанкарбоксамид /Ih/.

Повторили общую методику получения соединения 1е, за тем исключением, что используемый там хлористый бензоил заменили эквимолярным количеством хлористого циклопропанкарбонила, а время реакции составило 12 ч. Получили названное соединение в виде желтого твердого продукта с т. пл. 115-116oC.
IH ЯМР /CDCl3/ δ 8,39/синглет, 1Н/, 7,80 /синглет, 1Н/, 7,75 /синглет, 1Н/, 7,58 /дублет, 1Н/, 7,42 /синглет, 1Н/, 7,25 /квартет, 1Н/, 4,10 /триплет, 2Н/, 2,70 /триплет, 2Н/, 2,50 /квартет, 3Н/, 1,55 /мультиплет, 3Н/, 1,07 /синглет, 1Н/, 1,05 /мультиплет, 2Н/, 0,95 /триплет, 6Н/.
HRMS.Вычислено: C24H26ClF3N3O3: 496, 1615;
Найдено: 496, 1605.
Пример 8. N-[2-Хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил) дибенз /b,f/ /1, 4/ оксазепин-3-ил]-2-метилпропионамид /Ii/.
Повторили общую методику получения соединения 1е, с тем исключением, что вместо используемого согласно этой методике бензоилхлорида взяли эквимолярное количество изобутирилхлорида, а продолжительность реакции составила 2 ч. Получили названное соединение с 81,6% выходом в виде твердого вещества желтого цвета, т. пл. 73-75oC.
IH ЯМР /CDCl3/ δ 8,42 /синглет, 1Н/, 7,77 /синглет, 1Н/, 7,57 /мультиплет, 3Н/, 7,35 /синглет, 1Н/, 4,0 /мультиплет, 2Н/, 2,70 /синглет, 1Н/, 0,95 /мультиплет, 6Н/.
HRMS.Вычислено: C24H28ClF3N3
N3O3: 498, 1771
Найдено: 498, 1761.
Пример 9. N-[2-Хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил) дибенз /b,f/ /1, 4/ оксазепин-3-ил]циклобутанкарбоксамид /Ij/.

Повторили общую методику получения соединения /1e/, за исключением того, что используемый в ней бензоилхлорид заменили эквимолярным количеством циклобутанкарбонилхлорида, а время реакции составило 2 час. Получили названное соединение с 54,3% выходом в виде желтого масла.
1H ЯМР /CDCI3/ δ 8,48 /синглет, 1H/, 7,60 /мультиплет, ЗН/, 7,40 /мультиплет, 1Н/, 4,04 /мультиплет, ЗН/, 3,18 /мультиплет, 1H/, 2,70 /триплет, ЗН/, 2,48 /квартет, 4Н/, 2,30 /мультиплет, ЗН/, 1,98 /мультиплет, 1Н/, 0,97 /мультиплет, 6Н/.
HRMS. Вычислено: C25H28CIF3N3O3 510, 1771.
Найдено: 510, 1760.
Пример 10. N -[2-Хлор-10,11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7- (трифторметил)дибенз/b, f1 /1, 4/оксазепин-3-ил] циклогексакарбоксиамид /1k/.

Была повторена общая методика получения соединения 1е с тем исключением, что используемый согласно ей бензоилхлорид заменили на эквимолярное количество циклогексакарбоновой кислоты хлорида, а продолжительность реакции составила 20 час. Получили названное соединение с 83% выходом в виде твердого белого вещества, т.пл. 137-138oC.
1H ЯМР /CDCI3/ δ 8,50 /синглет, 1Н/, 7,87 /синглет, 1Н/, 7,86 /синглет, 1Н/, 7,68 /дублет, 1Н/, 7,55 /синглет, 1Н/, 7,47 /дублет, 1Н/, 4,15 /триплет, 2Н/, 2,82 /триплет, 2Н/, 2,56 /квартет, 4Н/, 2,35 /мультиплет, 1Н/, 1,2-2,1 /мультиплет, 1OH/, 1,00 /триплет, 6Н/.
HRMS.Вычислено:C27H31CIF3N3O3 538, 2-84.
Найдено: 538,2076.
Пример 11 N-[2-Хлор-10, 11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7- (трифторметил)дибенз /b, f/ /1,4/оксазепин-3-ил]-N-(циклогептилкарбонил)циклогептанкарбоксамида циклогептанкарбоксилат /1м/ и N-/2-хлор-10, 11-дигидро-10-[2-(диэтиламино)этил] -11-оксо-7-(трифторметил) дибенз /b,f/ /1,4/оксазепин-3-ил]-циклогептанкарбоксамид /1n/.

Получили in situ циклогептанкарбонилхлорид по реакции между циклогептанкарбоновой кислотой и оксалилхлоридом в CH2CI2 в течение 30 мин. Избыток оксалилхлорида удалили ni vacuo. Затем повторили общую методику получения соединения 1е с тем исключением, что заменили бензоилхлорид на циклогептанкарбонилхлорид, а продолжительность реакции составила 3 дня. Продукт очистили на колонке с силикагелем, используя в качестве элюента CH2CI2 c 0,4% MeOH, и получили первое соединение 1м /30%/ в виде полутвердого продукта желтого цвета.
1H ЯМР /CDCI3/ δ 7,90 /синглет, 1Н/, 7,74 /дублет, 1Н/, 7,42 /дублет, 1Н/, 7,41 /синглет, 1Н/, 7,01 /синглет, 1Н/, 4,08 /триплет, 2Н/, 2,75 /триплет, 3Н/, 2,48 /квартет, 4Н/, 1,1-2,0 /мультиплет, 36Н/, 0,91 /триплет, 6Н/.
HRMS.Вычислено:C36H45CIF3N3O4 676, 3129.
Найдено: 676, 3115.
Длительное элюирование колонки CH2CI2, содержащим от 1 до 4% MeOH, дало вторую фракцию, содержащую соединение 1n с 43,9% выходом в виде твердого белого продукта, т.пл. 120-125oC.
1 ЯМР /CDCI3/ d 8,40 /синглет, 1Н/, 7,78 /синглет, 1Н/, 7,72 /синглет, 1Н/, 7,59 /дублет, 1Н/, 7,47 /синглет, 1Н/, 7,30 /дублет, 2Н/, 4,08 /триплет, 2Н/, 2,75 /триплет, 2Н/, 2,47 /квартет, 4Н/, 2,41 /мультиплет, 1Н/, 1,4-2,1 /мультиплет, 12Н/, 0,93 /триплет, 6Н/.
HRMS.Вычислено: C28H33CIF3N3O3 552, 2241.
Найдено: 552, 22413.
Пример 12. N-[2-Хлор-10-11-дигидро-10-[2-(диэтиламино)этил]-11-оксо-7-(трифторметил) дибенз /b, f/ /1,4/оксазепин-3-ил]этакриниламид/1o/.

Этакриновую кислоту /303 кг, 1 моль/ в 5 мл CH2CI2 активировали по реакции с 0,5 ч. раствором хлористого хлорметилендиметиламмония в хлороформе /реактив Арнольдса/ /2 мл, получен по реакции оксалилхлорида и ДМФ в хлороформе/ в течение 30 мин. Затем к ней добавили амин 1а /250 кг, 0,585 ммол/ и триэтиламин /153 мг, 1,5 ммол/, и перемешивали смесь в течение 14 ч. Реакционную смесь распределили между водным NaHCO3 и CH2CI2. Органический слой промыли водой, высушили и сконцентрировали in vacuo. Остаток подвергли хроматографии на препаративной пластинке с силикагелем, используя в качестве подвижной фазы CH2CI2 c 20% MeOH, и получили 250 мг /69,8%/ названного соединения в виде твердого желтого продукта, т.пл. 173-175oC.
1H ЯМР /CDCI3/ δ 8,46 /синглет, 1Н/, 7,80 /синглет, 1Н/, 7,62 /дублет, 1Н/, 7,50 /синглет, 1Н/, 7,40 /дублет, 1Н/, 7,10 /дублет, 2Н/, 6,85 /дублет, 1Н/, 5,90 /синглет 1Н/, 5,55 /синглет, 1Н/, 4,70 /синглет, 2Н/, 4,07 /мультиплет, 2Н/, 2,85 /мультиплет, 1Н/, 2,60 /мультиплет, 3Н/, 2,40 /триплет, 2Н/, 1,10 /триплет, 3Н/, 1,0 /триплет, 6Н/.
HRMS. Вычислено: C33H32CIF3N3O3 712, 1360.
Найдено: 712, 1346.
Пример 13. N-[2-Хлор-10,11-дигидро-10, [2-(диэтиламино)этил]-11-оксо- 7-(трифторметил)дибенз /b, f/ /1,4/оксазепин-3-ил] циклопентан-карбоксамид /1p/.

Повторили общую методику получения соединения 1о, за исключением того, что этакриновую кислоту заменили на циклопентанкарбоновую кислоту, взятую в эквимолярном количестве. Получили названное соединение с 58,3%-ным выходом в виде желтого масла.
1H ЯМР /CDCl3/ δ 8, 45 /синглет, 1H/, 7,81 /дублет, 2H/, 7.7 /дублет, 1H/, 7,50 /дублет, 1H/, 7,42 /квартет, 1H/, 4,15 /триплет, 2H/, 2,80 /мультиплет, 4H/, 2,55 /квартет, 5H/, 1,85 /мультиплет, 5H/, 1,65 /мультиплет, 1H/, 0,95 /триплет, 6H/.
HRMS. Вычислено: C26H30N3O3F3Cl: 524,1928.
Найдено: 524,1922.
Пример 14. 4-Ацетамидсалициловая кислота /IXa/. К перемешиваемой, нагреваемой с обратным холодильником суспензии 4-аминосалициловой кислоты /76,57 г, 0,5 ммол/ в 250 мл абсолютного этанола добавляли по каплям, в течение 30 мин уксусный ангидрид /83,2 г, 0,815 ммоль/. После завершения добавления смесь нагревали с обратным холодильником еще в течение 15 мин, а затем охладили. Полученный продукт собрали фильтрацией, промыли небольшим количеством этанола и высушили на воздухе, что дало 72,3 г /74,15%/ названного соединения в виде твердого вещества серого цвета с т.пл. 242-4oC. Ранее сообщалось относительно т.пл. 234-5oC /P. Barraclough et al. Eur. J. Chem. 25, p 467, 1990/.
Пример 15. 4-Ацетамидсалициловой кислоты аллиловый эфир /Xa/. К перемешиваемой суспензии гидрида натрия /4,0 г 60% 0,1 ммол/ в 25 мл ДМФ добавляли по каплям раствор 4-ацетамидсалициловой кислоты /19,5 г, 0,1 ммол/ в 50 мл ДМФ. После того как прекратилось выделение водорода, добавили аллилбромид /12,1 г, 0,1 ммоль/, и смесь перемешивали в течение 8,6 ч. ДМФ удалили in vacuo, а остаток кристаллизовали из смеси метанол/вода, получив 14,76 г /62,76%/ названного соединения в виде твердого белого вещества, т. пл. 156-8oC.
1H ЯМР /CDCl3/ d 7,80 /дублет, 1H/, 7,42 /синглет, 1H/, 7,16 /синглет, 1H/, 7,07 /дублет, 1H/, 5,95-6,08 /мультиплет, 1H/, 5,29-5,44 /мультиплет, 2H/, 4,80-4,83 /мультиплет, 2H/, 2,19 /синглет, 3H/.
MC (m/e) 236 соответствует M+H+.
Пример 16. N-[4-(Аллилоксикарбонил)-3-(2-нитро-4-трифторметилфенокси)]- фенилацетамид /XIIа/. К перемешиваемой суспензии гидрида натрия /1,69 60% 42 ммол/ в 16 мл ДМФ добавили 4-ацетамидсалициловой кислоты аллиловый эфир /10,0 г, 42 ммоль/. После того, как закончилось выделение водорода, к смеси добавили 4-хлор-3-нитробензотрифторид /9,46 г, 42 ммоль/ и нагревали с обратным холодильником в течение 45 мин. ДМФ удалили in vacu, а остаток подвергли хроматографии на окиси кремния, использовав в качестве элюирующей системы дихлорметан с 3% метанола, что дало 13,0 г /72,95%/ названного соединения в виде твердого белого вещества, т.пл. 160-163oC.
1H ЯМР /CDCl3/ d 8,22 /синглет, 1H/, 8,03 /дублет, 1H/, 7,68 /синглет, 1H/, 7,61-7,65 /мультиплет, 3H/, 7,36 /дублет, 1H/, 6,83 /дублет, 1H/, 5,65-5,78 /мультиплет, 1H/, 5,10-5,21 /мультиплет, 2H/, 4,57-4,60 /мультиплет, 2H/, 2,18 /синглет, 3H/.
MC (m/e) 385 соответствует M+H+.
Пример 17. N-[4-(гидроксикарбонил)-3-(2-нитро-4-трифторметилфенокси)]- фенилацетамид /XIIa/. К смеси трис/дибензилиденацетон/палладия /O/ /550 мг/ и трифенилфосфина /660 мг/ добавили безводный дихлорметан /20 мл/ и перемешивали смесь в течение 30 минут. Затем к ней добавили N-/4-(аллилоксикарбонил)-3-(2-нитро-4-трифторметилфенокси)фенилацетамид /20,0 г, 47 ммол/ в 200 мл дихлорметана, после чего добавили раствор калиевой соли 2-этилкапроновой кислоты /9,61 г, 57 ммоль/ в 50 мл смеси этилацетата и дихлорметана /3: 1/. Смесь перемешивали в течение 16 ч и подкислили 75 мл 1 н. водной HCl. Отделили водный слой. Органический слой промыли водой, высушили и сконцентрировали in vacuo. Остаток растерли с эфиром, получив 14,91 г /82,6%/ названного соединения в виде твердого белого вещества. Перекристаллизация из эфира дала образец с точкой плавления 196-200oC.
1H ЯМР /CDCl3/ d 8,06 /синглет, 1H/, 7,86 /дублет, 1H/, 7,61 /синглет, 1H/, 7,49 /дублет, 1H/, 7,36 /дублет, 1H/, 6,75 /дублет, 1H/, 2,01 /синглет, 3H/.
MC (m/e) 385 соответствует M+H+.
Пример 18. 4-Ацетиламидо-N-/2-(диэтиламино)этил/-2-(2-нитро-4-трифторметилфенокси) бензамид /XIVa/.
К холодному дихлорметану /20 мл/ добавили оксасилхлорид /432 мг, 3,4 ммоль/. К этому раствору добавили по каплям, при перемешивании, раствор ДМФ /0,3 мл/ в 5 мл дихлорметана. После перемешивания еще в течение 15 минут добавили N-/4-(гидроксикарбонил)-3-(2-нитро-4-трифторметилфенокси)/-фенилацетамид /1,153 мг, 3,0 ммол/ и перемешивали смесь в течение 30 минут. Далее добавили N,N-диэтилэтилендиамин /415 мг, 3,57 ммол/ и триэтиламин /460 мг, 4,55 ммол/. Смесь перемешивали в течение 1,5 ч при комнатной температуре, промыли водным бикарбонатом натрия, высушили и сконцентрировали в вакууме, получив названное соединение в виде твердого продукта оранжевого цвета.
IH-ЯМР /CDCI3/ d 8,11 /синглет, IH/, 7,87 /дублет, IH/, 7,82 /дублет, IH/, 7,63 /синглет, IH/, 7,03 /синглет, IH/, 6,72 /дублет, IH/, 6,64 /дублет, IH/, 2,60-2,80 /мультиплет, 2H/, 2,35-2,55 /мультиплет, 6H/, 2,08 /синглет, 3H/, 0,89 /триплет, 6H/.
MC (м/е) 483 соответствует M + H+.
Пример 19.Биологические испытания.Клеточная культура: клетки HCT116/YM46 отобрали из клеток карциномы ободочной кишки человека линии HCT116 на устойчивость по отношению к YM26; клетки MCF-7/ADR отобрали из линии MCF-6 клеток карциномы груди человека на устойчивость против Адриамицина. Клетки обоих типов проявляют фенотип MDR и сверхэкспрессию высоких уровней MDR-1 и MPHK. Клеточные линии вырастили в колбах культуры тканей, в которых содержалась среда McCoy' 5A и 10% сыворотки бычьего плода. Клетки выдерживали при 37oC во влажной атмосфере, содержащей 5% CO2, и пересеивали каждые 5 дней.
Цитотоксические испытания: Клетки посеяли на микротитровальном планшете с 96 лунками /5•103 клеток на лунку/ и выращивали в течение 24 ч при 37oC. Затем клетки термостатировали с уменьшающимися количествами противоопухолевых агентов: адриамицин /100 мкМ, максимальная концентрация/ или актиномицин D /17,6 нг/мл/, соответственно для клеток MCF-7 и HCT-116. Добавляли хемосенсибилизаторы в различных концентрациях, в интервале от 0,08 до 40 мкМ. Параллельно использовали верапимил в качестве положительного контроля, в тех же концентрациях. После термостатирования в течение 48 ч клетки промыли, фиксировали и окрасили кристаллическим фиолетовым. Поглощение определяли по аппарату для прочтения микротитровальных планшетов фирмы MoIecuIar Deuices на длине волны 595 нм. Величину IC50/50 подавление роста клеток/ определяли из относительных степеней выживания, полученных в двух-трех независимых экспериментах. Термин "сложенная резистентность" определяли как отношение IC50 противоопухолевого лекарства в присутствии или в отсутствие хемосенсибилизатора в резистентных клетках, поделенное на IC50 противоопухолевого лекарства в его чувствительной копии. Эта величина обеспечивает вычисление кажущейся мощности каждого агента при увеличении эффективности лекарства.
Таблицы 1 и 2 показывают несколько типичных хемосенсибилизаторов по данному изобретению, которые демонстрируют более высокую активность изменения MDR по сравнению с верапамилом в резистентных клетках HCT-116 карциномы оболочной кишки человека и в MCF-7 резистентных карциномы груди человека соответственно.
Вышеописанные испытания выявили, что соединения по данному изобретению могут быть использованы для изменения MDR по отношению к противораковым лекарствам. Таким образом, данное изобретение относится также к применению соединения формулы (I) в качестве агента вспомогательной терапии неоплазии, резистентных по отношению к сложным лекарствам.
Соединения формулы (I) могут образоваться фармацевтически приемлемые соли присоединения с кислотами. Указанными солями являются такие, где анион не вносит существенно вклада в токсичность соли и которые совместимы с традиционными фармацевтическими носителями и приемлемы для перорального или парентерального введения. Фармацевтически приемлемые соли присоединения с кислотами включают соли соединения формулы (I) с минеральными кислотами, такими как хлористоводородная, бромистоводородная кислота, фосфорная кислота и серная кислота; с органическими карбоновыми кислотами, такими как уксусная кислота, лимонная кислота, малеиновая кислота, янтарная кислота, бензойная кислота, фумаровая кислота, миндальная кислота, аскорбиновая кислота, щавелевая кислота, яблочная кислота, метансульфоновая кислота, изэтионовая кислота, р-толуолсульфоновая кислота и другие кислоты, известные и применяемые в фармации галеновых препаратов. Таким образом, данное изобретение далее относится к фармацевтически приемлемой соли соединения формулы (I).
Способ систематического употребления, дозировка и режим дозировки следует в каждом случае тщательно контролировать за счет здравого профессионального приговора и рассмотрения возраста, веса и состояния реципиента. Как правило, дневная доза будет составлять от примерно 0,1 г до примерно 10 г, предпочтительно 0,5-5 г, если вводить перорально. В некоторых случаях достаточный терапевтический эффект можно получить при более низких дозах, тогда как в других требуются большие дозы. Как понятно специалисту в клинической фармакологии, количество соединения формулы (I), составляющее дневную дозу, можно давать в виде одной дозы или отдельных нескольких доз, с учетом принципов, понятных для опытного практикующего специалиста и необходимых в данной области.
Термин "систематическое выделение" в том смысле, как он здесь употребляется, относительно к пероральному, подъязычному, внутриносовому, внутривенному, внутримышечному, подкожному пути введения, к введению ректально и через кожу. Как правило, оказывается, что если соединение по настоящему изобретению приходится вводить перорально, то может оказаться необходимым несколько большее количество активного лекарства для достижения эффекта, который получается при использовании несколько меньшего количества, вводимого парентерально. В соответствии с хорошей клинической практикой предпочтительно вводить данные соединения с таким уровнем концентрация, который обеспечивает благоприятный эффект, не вызывая каких-либо вредных или неблагоприятных побочных эффектов.
Терапевтические данные соединения даются, как правило, в виде фармацевтических композиций, состоящих из количества соединения формулы (I), обеспечивающего эффект изменения MDR, или из фармацевтически приемлемой соли присоединения с кислотами и из фармацевтически приемлемого носителя. Фармацевтические композиции для такого лечения будут содержать большие или меньшие количества /напри. от 95% до 0,5%/ одного по крайне мере соединения по данному изобретению в сочетании с фармацевтическим носителем, причем носитель, один или более, может быть твердым, полутвердым или жидким разбавителем, наполнителем или вспомогательным компонентом композиции, нетоксичным, инертным и фармацевтическими приемлемым. Такие фармацевтические композиции предпочтительно представляют собой формы единичных дозировок; т. е. физически дискретные единицы, имеющие заданное количество лекарства, соответствующее доле или кратному числу дозы, которое по вычислениям вызывает желаемый терапевтически ответ. В обычной практике единичные дозировки содержат 1, 1/2, 1/3 или менее единичной дозы. Единичная доза предпочтительно содержит количество, достаточное для обеспечения желаемого терапевтического эффекта после введения за один прием одной или более единичных дозировок в соответствии с заданным режимом дозировки, обычно это вся половина, треть или менее дневной дозировки, которая вводится один, два, три или более раз в день. Очевидно, что в такой композиции могут также присутствовать другие терапевтические агенты. Предпочтительными являются композиции, обеспечивающие от 0,1 до 1 г активного ингредиента на единичную дозу, и их обычно готовят в виде таблеток, лепешек, капсул, порошков, водных или масляных суспензий, сиропов, эликсиров, водных растворов. Предпочтительные пероральные композиции готовят в виде таблеток, капсул, и они могут содержать обычные эксципиенты, такие как связующие /например, сироп, желатин, сорбит, трагакант, поливинилпирролидон или аравийская камедь/, наполнители /например, лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин/, смазки /например, стеарат магния, тальт, полиэтиленгликоль или кремнезем/, дезинтегранты /например, крахмал/ и смачивающие агенты /например, лаурилсульфат натрия/. Растворы или суспензии соединения формулы (I) с традиционными фармацевтическими носителями применяют для парентеральных композиций, таких как водный раствор для внутривенных инъекций или масляная суспензия для внутримышечных инъекций. Такие композиции, обладающие требуемой прозрачностью, стабильностью и пригодные для патентерального применения, получают растворением в воде активного соединения в количестве приблизительно от 0,1 до 10 мас. или носителе, состоящем из многоатомного алифатического спирта, такого как глицерин. пропиленгликоли и полиэтиленгликоль или их смеси. Полиэтиленгликоли представляют собой смесь нелетучих, обычно жидких полиэтиленгликолей, растворимых и в воде, и в органических жидкостях, с молекулярным весом в диапазоне приблизительно от 200 до 1500.
Капсулы, содержащие 100 мг соединения Примера 2
Ингридиент Количество мг на капсулу
Соединение 100
Лактоза 146
Стеарат магния 4
Капсула (No/1) 250
Соединения с нейтральными компонентами измельчают в порошок перемешивают и помещают в сухие желатиновые капсулы.
Таблетки
Ингредиент Количество мг на таблетку
Соединение Примера 2 150
Прежелатинизированный кукурузный крахмал 60
Поливинилпирролидон 36
Стеарат магния 4
Соединение тонко измельчают и смешивают с также
измельченными инертными ингредиентами согласно рецептуре, а затем прессуют в таблетки на стандартном оборудовании.
Реферат
Сущность изобретения: предложены производные дибенз [b, f] [1, 4] -оксазепин-11 -она общей формулы (I), где P - целое число от 1 до 3; R1 и R2 каждый независимо друг от друга означают атом водорода или ацильную группу R6 CO-; R3- атом водорода или хлора; R4 и R5 независимо друг от друга представляют собой (C1-C6) алкил; и их фармацевтически приемлемые кислотно-аддитивные соли. Соединения могут быть использованы для изменения мультилекарственно резистентности противораковых лекарств и в составе фармацевтической композиции.Структурная формула (I).

3 с.п. и 14 з.п. ф-лы, 2 табл.
Формула
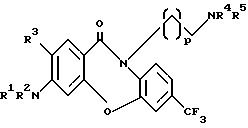
где p 1 3 целое число;
R1 и R2, каждый независимо друг от друга водород или ацильная группа R6CO-, где R6 С1 С7-алкил, С3 С7-циклоалкил, С2 С7-алкенил, фенил или группа формулы

R3 водород или хлор;
R4 и R5 каждый независимо друг от друга С1 - С6-алкил,
и их фармацевтически приемлемые кислотно-аддитивные соли.




где n 1 4.

Комментарии