Бета-арил-альфа-оксизамещенные алкилкарбоновые кислоты, способы их получения, промежуточные соединения, способы их получения, фармацевтическая композиция, способы лечения или предупреждения заболеваний на основе новых соединений - RU2235094C2
Код документа: RU2235094C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым гиполипидемическим и антигепергликемическим соединениям, их производным, их аналогам, их таутомерным формам, их стереоизомерам, их полиморфным формам, их фармацевтически приемлемым солям, их фармацевтически приемлемым сольватам и фармацевтически приемлемым композициям, содержащим такие соединения. Конкретнее, настоящее изобретение относится к новым β -арил-α-оксизамещенным алкилкарбоновым кислотам общей формулы (I), их производным, их аналогам, их таутомерным формам, их стереоизомерам, их полиморфным формам, их фармацевтически приемлемым солям, их фармацевтически приемлемым сольватам и фармацевтически приемлемым композициям, содержащим такие соединения.
Настоящее изобретение также относится к способу получения указанных выше новых соединений, их производных, их аналогов, их таутомерных форм, их полиморфных форм, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов, новых промежуточных соединений и фармацевтических композиций, содержащих указанные соединения.
Соединения общей формулы (I) полезны для лечения и/или профилактики инсулинорезистентности (диабета типа 2), сниженной толерантности к глюкозе, дислипидемии, расстройств, связанных с синдромом X, таких как гипертензия, ожирение, инсулинорезистентность, атеросклероз, гиперлипидемия, коронарная артериальная болезнь, и других сердечно-сосудистых расстройств. Соединения настоящего изобретения также полезны для лечения некоторых болезней почек, включая гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз. Эти соединения также могут быть полезны в качестве ингибиторов альдозоредуктазы, для улучшения когнитивных функций при деменции, лечения осложнений при диабете, псориаза, поликистоза яичников (PCOS) и остеопороза.
Уровень техники
Гиперлипидемия является первопричиной сердечнососудистого заболевания (CVD) и других болезней периферических сосудов. Высокий риск CVD связан с повышенным содержанием LDL (липопротеина низкой плотности) и VLDL (липопротеина очень низкой плотности), наблюдаемыми при гиперлипидемии. Пациенты, имеющие кроме гиперлипидемии толерантность к глюкозе и инсулинорезистентность, имеют повышенный риск CVD. Ранее выполненные многочисленные исследования показали, что снижение содержания в плазме триглицеридов и общего холестерина, в частности LDL и VLDL, и повышение содержания холестерина HDL (липопротеина высокой плотности) способствует предупреждению сердечно-сосудистых заболеваний.
Диабет является заболеванием, которое серьезно воздействует на качество жизни большого числа людей. Инсулинорезистентность представляет собой ослабленную способность инсулина проявлять биологическое действие в широком интервале концентраций. При инсулинорезистентности организм выделяет аномально высокое количество инсулина, чтобы компенсировать этот недостаток, причем испытывает недостаток, при котором неизбежно повышается содержание глюкозы в плазме, что приводит к явному диабету. В развитых странах сахарный диабет является общей проблемой и ассоциируется с различными отклонениями, включая ожирение, гипертензию, гиперлипидемию (J. Clin. Invest. (1985), 75: 809-817; N. Engl. J. Med. (1987), 317: 350-357; J. Clin. Endocrinol. Metab. (1988), 66: 580-583; J. Clin. Invest. (1975), 68: 957-969) и осложнения на почки (см. заявку на патент № WO 95/21608). Все более выясняется, что инсулинорезистентность и относительная гиперинсулинемия играют роль пособников при ожирении, гипертензии, атеросклерозе и сахарном диабете типа 2. Связь инсульнорезистентности с ожирением, гипертензией и стенокардией описана как синдром с инсулинорезистентностью в качестве центрального патогенного звена синдром X.
Таким образом, лечебные средства, улучшающие такие показатели, как инсулинорезистентность, низкое содержание триглицеридов в плазме, общее содержание холестерина, LDL и VLDL, и повышенный HDL, будут иметь большое значение при предупреждении распространения сердечно-сосудистых заболеваний и улучшения качества жизни.
Рецепторы, активированные пероксисомальными пролифераторами (PPAR), являются членами суперсемейства ядерных рецепторов. Гамма(γ)-изоформа PPAR (PPARγ) участвует в регулирующей дифференциации адипоцитов (Endocrinology (1994), 135: 798-800) и энергетическом гомеостазе (Cell (1995), 83: 803-812), в то время как альфа(α)-изоформа PPAR (PPARα) опосредует окисление жирных кислот (Trend. Endocrin. Metab. (1993), 4: 291-296), что проявляется в снижении содержания свободных жирных кислот в плазме (Current Biol. (1995), 5: 618-621). Обнаружено, что агонисты PPARα полезны в случае лечения ожирения (WO 97/36579). Недавно обнаружено, что существует синергизм в случае молекул, которые являются агонистами как для PPARα, так и для PPARγ, и предполагается, что они полезны для лечения синдрома Х (WO 97/25042). Подобный синергизм наблюдают между сенсибилизатором инсулина (агонистом PPARγ) и ингибитором HMG СоА-редуктазы, что может быть полезно в случае лечения атеросклероза и ксантомы (ЕР 0753298).
Сообщается, что некоторые β -арил-α-гидроксипропионовые кислоты, их производные и их аналоги полезны при лечении гипергликемии, гиперлипидемии и гиперхолестеринемии. Некоторые такие соединения, описанные в известном уровне техники, перечислены ниже.
i) В патенте США 5306726; WO 91/19702, описываются производные 3-арил-2-гидроксипропионовой кислоты общих формул (IIа) и (IIb) в качестве гиполипидемических и гипогликемических средств.
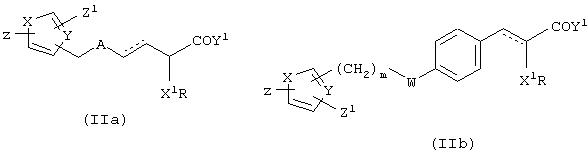
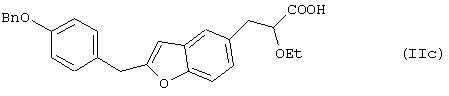
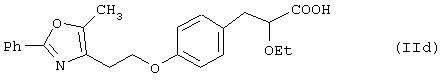
Примерами таких соединений являются соединения формул (IIc) и (IId)
ii) В международных заявках на патент WO 95/03038 и WO 96/04260 описываются соединения формулы (IIе)
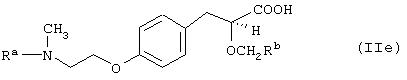
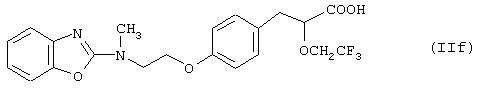
где Ra представляет 2-бензоксазолил или 2-пиридил и Rbпредставляет СF3, СН2ОСН3 или СН3. Типичным примером является (S)-3-[4-[2-[N-(2-бензоксазолил)]-N-метиламино]этокси]фенил]-2-(2,2,2-трифторэтокси)пропановая кислота (IIf).
iii) В международных заявках на патент № WO 94/136050, WO 94/01420 и WO 95/17394 описываются соединения общей формулы (IIg)
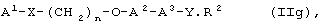
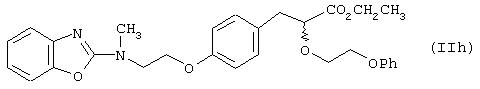
где А1 представляет ароматический гетероцикл, А2представляет замещенное бензольное кольцо и А3 представляет группу формулы (СН2)m-СН-(OR1), где R1 представляет алкильные группы и m равен целому числу; Х представляет замещенный или незамещенный N; Y представляет С=O или C=S, R2представляет ОR3, где R3 может представлять собой алкил, аралкил или арильную группу. Пример таких соединений показан формулой (IIh)
Сущность изобретения
С целью разработки новых соединений для более эффективного, сильного и менее токсичного лечения и/или профилактики болезней, связанных с повышенным содержанием липидов, в особенности для лечения гипергликемии и для снижения содержания свободных жирных кислот, для лечения и/или профилактики болезней, описываемых как синдром X, к которым относятся гиперлипидемия, гиперинсулинемия, ожирение, инсулинорезистентность, инсулинорезистентность, ведущая к диабету типа 2 и осложнениям при таком диабете, для лечения заболеваний, при которых инсулинорезистентность является патофизиологическим механизмом, для лечения гипертензии, атеросклероза и болезней коронарной артерии, авторы сосредоточили свои исследования на разработке новых соединений, эффективных при лечении вышеуказанных болезней. Усилия в этом направлении привели к соединениям общей формулы (I).
Основной целью настоящего изобретения являются, следовательно, новые β-арил-α-оксизамещенные алкилкарбоновые кислоты и их производные, их аналоги, их таутомерные формы, их стереоизомеры, их полиморфные формы, их фармацевтически приемлемые соли, их фармацевтически приемлемые сольваты и фармацевтические композиции, содержащие такие соединения или их смеси.
Другой целью настоящего изобретения являются новые β-арил-α-оксизамещенные алкилкарбоновые кислоты и их производные, их аналоги, их таутомерные формы, их стереоизомеры, их полиморфные формы, их фармацевтически приемлемые соли, их фармацевтически приемлемые сольваты и фармацевтические композиции, содержащие такие соединения или их смеси, которые могут обладать антагонистической активностью против PPARα и/или PPARγ, и, кроме антагонистической активности против PPARα и/или PPARγ, могут ингибировать необязательно HMG СоА-редуктазу.
Другой целью настоящего изобретения являются новые β-арил-α-оксизамещенные алкилкарбоновые кислоты и их производные, их аналоги, их таутомерные формы, их стереоизомеры, их полиморфные формы, их фармацевтически приемлемые соли, их фармацевтически приемлемые сольваты и фармацевтические композиции, содержащие такие соединения или их смеси, обладающие повышенной активностью в отсутствие токсического действия или с уменьшенным токсическим действием.
Еще одной целью настоящего изобретения является способ получения новых β-арил-α-оксизамещенных алкилкарбоновых кислот и их производных указанной выше формулы (I), их аналогов, их таутомерных форм, их стереоизомеров, их полиморфных форм, их фармацевтически приемлемых солей и их фармацевтически приемлемых сольватов.
И еще одной целью настоящего изобретения являются фармацевтические композиции, содержащие соединения общей формулы (I), их аналоги, их производные, их таутомерные формы, их стереоизомеры, их полиморфные формы, их соли, сольваты или их смеси в сочетании с подходящими носителями, растворителями, разбавителями и другими средами, обычно используемыми при получении таких композиций.
Подробное описание изобретения
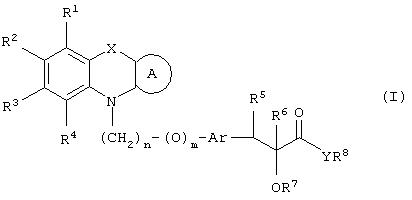
Настоящее изобретение относится к соединениям общей формулы (I)
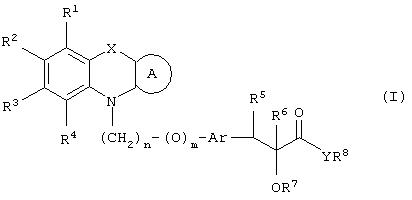
где R1, R2, R3 и R4 могут быть одинаковыми или различными и представляют водород, галоген, гидрокси, нитро, циано, формил или необязательно замещенные группы, выбранные среди алкила, циклоалкила, алкокси, циклоалкокси, арила, арилокси, аралкила, аралкокси, гетероциклила, гетероарила, гетероаралкила, гетероарилокси, гетероаралкокси, ацила, ацилокси, гидроксиалкила, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкила, алкоксикарбонила, арилоксикарбонила, аралкоксикарбонила, алкоксиалкила, арилоксиалкила, аралкоксиалкила, алкилтио, тиоалкила, алкоксикарбониламино, арилоксикарбониламино, аралкоксикарбониламино, групп, образованных карбоновой кислотой или ее производными или сульфоновой кислотой или ее производными; цикл А, сконденсированный с циклом, содержащим Х и N, представляет 5-6-членную циклическую структуру, содержащую атомы углерода, которая может содержать необязательно один или несколько гетероатомов, выбранных среди атомов кислорода, серы или азота, которая необязательно может быть замещенной; цикл А может быть насыщенным или содержать одну или несколько двойных связей, или может быть ароматическим; Х представляет гетероатом, выбранный среди атомов кислорода, серы, или NR9, где R9представляет собой водород, алкил, арил, аралкил, ацил, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил и подобную группу; Аr представляет необязательно замещенную двухвалентную отдельную или сконденсированную ароматическую или гетероциклическую группу; R5 представляет атом водорода, гидрокси, алкокси, галоген, низший алкил, необязательно замещенную аралкильную группу, или образует связь вместе с соседней группой R6; R6 представляет водород, гидрокси, алкокси, галоген, низшую алкильную группу, ацил, необязательно замещенный аралкил или R6 образует связь вместе с R5; R7 представляет водород или необязательно замещенную группу, выбранную среди алкила, циклоалкила, арила, аралкила, алкоксиалкила, алкоксикарбонила, арилоксикарбонила, алкиламинокарбонила, ариламинокарбонила, ацила, гетероциклила, гетероарила или гетероаралкильных групп; R8 может представлять собой водород или необязательно замещенные группы, выбранные среди алкила, циклоалкила, арила, аралкила, гетероциклила, гетероарила или гетероаралкильных групп; Y представляет кислород или NR10, где R10 представляет водород, алкил, арил, гидроксиалкил или аралкильные группы; R8 и R10 вместе могут образовывать 5- или 6-членную циклическую структуру, содержащую атомы углерода, которая необязательно может содержать один или несколько гетероатомов, выбранных среди атомов кислорода, серы или азота; n равен целому числу в интервале 1-4 и m равен 0 или 1.
Подходящими группами, представленными R1 -R4, являются водород, атом галогена, такого как фтор, хлор, бром или йод; гидрокси, циано, нитро, формил; замещенная или незамещенная (C1-C12)-алкильная группа, в особенности линейная или разветвленная (С1-С6)-алкильная группа, такая как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, гексил и подобные группы; цикло-(С3-С6)-алкильная группа, такая как циклопропил, циклобутил, циклопентил, циклогексил и подобные группы, и циклоалкильная группа может быть замещенной; цикло-(С3-С6)-алкилоксигруппа, такая как циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и подобные группы, и циклоалкоксигруппа может быть замещенной; арильная группа, такая как фенил, нафтил и подобные группы, и арильная группа может быть замещенной; аралкил, такой как бензил или фенетил, С6Н5СН2СН2СН2, нафтилметил и подобные группы, и аралкильная группа может быть замещенной, и замещенный аралкил представляет собой такую группу, как СН3С6Н4СН2, Hal-C6H4CH2, СН3ОС6Н4СН2, СН3ОС6Н4СН2СН2 и подобные группы; гетероарильная группа, такая как пиридил, тиенил, фурил, пирролил, оксазолил, тиазолил, имидазолил, оксадиазолил, тетразолил, бензопиранил, бензофуранил и т.п., и гетероарильная группа может быть замещенной; гетероциклильная группа, такая как азиридинил, пирролидинил, морфолинил, пиперидинил, пиперазинил и подобные группы, и гетероциклильная группа может быть замещенной; аралкоксигруппа, такая как бензилокси, фенетилокси, нафтилметилокси, фенилпропилокси и подобные группы, и аралкоксигруппа может быть замещенной; гетероаралкильная группа, такая как фуранметил, пиридинметил, оксазолметил, оксазолэтил и подобные группы, и гетероаралкильная группа может быть замещенной; аралкиламиногруппа, такая как C6H5CH2NH, C6H5CH2 CH2NH, C6H5CH2NCH3 и подобные группы, которые могут быть замещенными; аралкоксикарбонильная группа, такая как бензилоксикарбонил, фенетилоксикарбонил, нафтилметоксикарбонил и подобные группы, которые могут быть замещенными; (C1-С6)-алкиламиногруппа, такая как NНСН3, N(СН3)2, NСН3(С2Н5), NHC2H5, NНС3Н7, NНС6H13 и подобные группы; алкоксиалкильная группа, такая как метоксиметил, этоксиметил, метоксиэтил, этоксиэтил и подобные группы; арилоксиалкильная группа, такая как С6Н5OСН2, C6H5OCH2CH2, нафтилоксиметил и подобные группы, которые могут быть замещенными; аралкоксиалкильная группа, такая как С6Н5СН2OСН2, С6Н5 СН2OСН2СН2 и подобные группы, которые могут быть замещенными; гетероарилокси и гетероаралкокси, где гетероарильная составляющая имеет значения, указанные ранее, и может быть замещенной; арилоксигруппа, такая как фенокси, нафтилокси и подобные группы; арилоксигруппа может быть замещенной; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил и т.п.; арилоксикарбонильная группа, такая как необязательно замещенный феноксикарбонил, нафтилоксикарбонил и т.п.; ариламиногруппа, такая как HNC6H5, NСН3(С6Н5), NHC6H4CH3, NHC6H4-Hal и подобные группы; аминогруппа; амино-(C1-C6)-алкил; гидрокси-(C1-C6 )-алкил; (C1-C6)-алкокси, такой как метокси, этокси, пропилокси, бутилокси, изопропилокси и т.п.; тио-(C1-C6)-алкил; (C1-C6)-алкилтио; ацильная группа, такая как ацетил, пропаноил, бензоил и подобные группы, и ацильная группа может быть замещенной; ациламиногруппы, такие как NHCOCH3, NHCOC2H5, NНСОС3Н7, NHCOC6H5 и подобные группы; аралкоксикарбониламиногруппа, такая как NНСООСН2С6Н5, NНСООСН2СН2С6Н5, NCH3COOCH2C2H5, NC2H5COOCH2C6H5, NHCOOCH2C6 H4CH3, NHCOOCH2C6H4OCH3 и подобные группы; арилоксикарбониламиногруппа, такая как NHCOOC6H5, NCH3 COOC6H5, NC2H5COOC6H5, NHCOOC6H4CH3, NНСООС6Н4OСН3 и подобные группы; алкоксикарбониламиногруппа, такая как NHCOOC2H5, NНСООСН3 и т.п.; остатки карбоновой кислоты или ее производных, таких как амиды, подобные CONH2, CONHMe, CONMe2, CONHEt, CONEt2, CONHPh и т.п., карбоновая кислота и ее производные могут быть замещенными; ацилоксигруппа, такая как ООСМе, OOCEt, OOCPh и подобные группы, которые необязательно могут быть замещенными; остатки сульфоновой кислоты и ее производных, такие как SO2NH2, SO2NHMe, SO2NMe2, SO2NHCF3 и т.п., сульфоновая кислота и ее производные могут быть замещенными.
Когда группы, представленные R1-R4, являются замещенными, заместители могут быть выбраны среди галогена, гидрокси- или нитро- или необязательно замещенных групп, выбранных среди алкила, циклоалкила, алкокси, циклоалкокси, арила, аралкила, аралкоксиалкила, гетероциклила, гетероарила, гетероаралкила, ацила, ацилокси, гидроксиалкила, амино, ациламино, ариламино, аминоалкила, арилокси, алкоксикарбонила, алкиламино, алкоксиалкила, алкилтио, тиоалкила, групп, образованных карбоновой кислотой или ее производными или сульфоновой кислотой или ее производными.
Подходящим циклом А являются фенил, нафтил, циклогексил, циклогексенил, тиенил, фурил, пирролил, оксазолил, оксадиазолил, тиазолил, имидазолил, изоксазолил, пиридил, пиранил, дигидропиранил, пиридазинил, пиримидинил и подобные циклы, которые необязательно могут быть замещенными, и заместители выбирают из той же группы, что в случае R1-R4, и имеют значения, указанные в случае R1-R4. Предпочтительными заместителями являются галоген, гидрокси, амино, формил, необязательно галогенированный (C1-C6)-алкил, (C1-C6)-алкокси, цикло-(C3-C6)-алкил, цикло-(C3-C6 )-алкокси, арил, аралкил, аралкокси, гетероциклил, ацил, ацилокси, карбоксил, алкоксикарбонил, аралкоксикарбонил, алкиламино, ациламино, аралкоксикарбониламино, аминокарбонил и подобные группы.
Предпочтительно, чтобы циклическая структура, представленная циклом А, представляла собой фенильное или пиридильное кольцо.
Еще более предпочтительно, чтобы циклическая структура, представленная циклом А, представляла собой фенильное кольцо.
Подходящим Х являются кислород, сера или группа NR9, предпочтительно кислород и сера. Подходящий R9 представляет водород, (C1-C6)-алкил, (C3-C6) -циклоалкил, аралкильную группу, такую как бензил, фенетил; ацильную группу, такую как ацетил, пропаноил, бутаноил, бензоил и т.п.; (C1-C6)-алкоксикарбонил; арилоксикарбонил, такой как феноксикарбонил, CH3OC6H4OCO, Hal-C6H4OCO, CH3C6H4OCO, нафтилоксикарбонил и т.п.; аралкоксикарбонил, такой как бензилоксикарбонил, фенетилоксикарбонил и т.п.; группы, представленные R9, могут быть замещенными или незамещенными. Когда группы, представленные R9, являются замещенными, заместители можно выбрать среди галогена, необязательно галогенированного низшего алкила, гидрокси и необязательно галогенированных (C1-C3)-алкоксигрупп.
Группы, представленные Аr, включают двухвалентный фенилен, нафтилен, пиридил, хинолинил, бензофуранил, бензоксазолил, бензотиазолил, индолил, индолинил, азаиндолил, азаиндолинил, инденил, дигидробензофурил, бензопиранил, дигидробензопиранил, пиразолил и подобные группы. Заместителями в группе, представленной Аr, являются линейный или разветвленный необязательно галогенированный (C1-C6)-алкил, необязательно галогенированный (C1-C3)-алкокси, галоген, ацил, амино, ациламино, тио, остатки карбоновой и сульфоновой кислот и их производных. Заместители имеют значения, указанные в случае R1-R4.
Более предпочтительно, когда Аr представляет замещенный или незамещенный двухвалентный фенилен, нафтилен, бензофуранил, индолил, индолинил, хинолинил, азаиндолил, азаиндолинил, бензотиазолил или бензоксазолильную группу.
Еще предпочтительнее, когда Аr представляет двухвалентный фенилен или бензофуранил, который необязательно может быть замещен метильной, галогенметильной, метокси- или галогенметоксигруппами.
Подходящими R5 являются водород, низшие алкильные группы, такие как метил, этил или пропил; гидрокси, (C1-C3 )-алкокси; атом галогена, такого как фтор, хлор, бром или йод; аралкил, такой как бензил, фенетил, который необязательно может быть замещенным, или R5 вместе с R6 представляет связь.
Подходящими R6 могут быть водород, низшие алкильные группы, такие как метил, этил или пропил; гидрокси, (C1-C3)-алкокси; атом галогена, такого как фтор, хлор, бром, йод; ацильная группа, такая как линейная или разветвленная (C1-C9)-ацильная группа, такая как ацетил, пропаноил, бутаноил, пентаноил, бензоил и т.п.; аралкил, такой как бензил и фенетил, который необязательно может быть замещенным, или R6 вместе с R5 образует связь.
Предпочтительно, чтобы R5 и R6 представляли атомы водорода, или чтобы R5 и R6 вместе представляли связь.
Подходящие группы, представленные R7, можно выбрать среди водорода, линейного или разветвленного (C1-C16)-алкила, предпочтительно (C1-C12)-алкильной группы, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, пентил, гексил, октил и т.п.; (C3-C7)-циклоалкильной группы, такой как циклопропил, циклобутил, циклопентил, циклогексил и т.п., и циклоалкильная группа может быть замещенной; арильной группы, такой как фенил, нафтил и т.п., и арильная группа может быть замещенной; гетероарильной группы, такой как пиридил, тиенил, фурил и т.п., и гетероарильная группа может быть замещенной; гетероаралкильной группы, такой как фуранметил, пиридинметил, оксазолметил, оксазолэтил и т.п., и гетероаралкильная группа может быть замещенной; аралкильной группы, где алкильная часть может содержать 1-6 атомов, такой как бензил и фенетил и т.п., где арильная составляющая может быть замещенной; гетероциклильной группы, такой как азиридинил, пирролидинил, пиперидинил и т.п., и гетероциклильная группа может быть замещенной; (C1-C6)-алкокси-(C1-C6)-алкильной группы, такой как метоксиметил, этоксиметил, метоксиэтил, этоксипропил и т.п., и алкоксиалкильная группа может быть замещенной; ацильной группы, такой как ацетил, пропаноил, бутаноил, бензоил и т.п.; (C1-C6)-алкоксикарбонила, где алкильная группа может быть замещенной; арилоксикарбонила, такого как феноксикарбонил, нафтилоксикарбонил и т.п., где арильная группа может быть замещенной; (C1-C6)-алкиламинокарбонила, где алкильная группа может быть замещенной; ариламинокарбонила, такого как PhNHCO, нафтиламинокарбонил и т.п., где арильная группа может быть замещенной. Заместители для R7 можно выбрать из той же группы, что в случае R1-R4, и они имеют такие же значения.
Подходящие группы, представленные R8, можно выбрать среди водорода, линейного или разветвленного (C1-C16)-алкила, предпочтительно (C1-C12)-алкильной группы, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, пентил, гексил, октил и т.п.; (C3-C7)-циклоалкила, такого как циклопропил, циклопентил, циклогексил и т.п., и циклоалкильная группа может быть замещенной; арильной группы, такой как фенил, нафтил и т.п., и арильная группа может быть замещенной; гетероарильной группы, такой как пиридил, тиенил, фурил и т.п., и гетероарильная группа может быть замещенной; гетероаралкильной группы, такой как фуранметил, пиридинметил, оксазолметил, оксазолэтил и т.п., и гетероаралкильная группа может быть замещенной; аралкильной группы, такой как бензил, фенетил и т.п., и аралкильная группа может быть замещенной; гетероциклильной группы, такой как азиридинил, пирролидинил, пиперидинил и т.п., и гетероциклильная группа может быть замещенной. Заместители для R8 можно выбрать из той же группы, что в случае R1-R4.
Подходящие группы, представленные R10, можно выбрать среди водорода, линейного или разветвленного (C1-C16)-алкила, предпочтительно (C1-C12)-алкила; гидрокси-(C1-C6)-алкила; арильной группы, такой как фенил, нафтил; аралкильной группы, такой как бензил и фенетил.
Подходящие циклические структуры, образованные вместе R8 и R10, можно выбрать среди пирролидинила, пиперидинила, морфолинила, пиперазинила и подобных групп.
Походящим m является целое число 0 или 1. Предпочтительно, когда m=0, Аr представляет бензофуранил, бензоксазолил, бензотиазолил, индолил, индолинил, дигидробензофуранил или дигидробензопиранильную группу, предпочтительно бензофуранильную группу, и когда m=1, Аr представляет двухвалентный фенилен, нафтилен, пиридил, хинолинил, бензофуранил, бензоксазолил, бензотиазолил, индолил, индолинил, азаиндолил, азаиндолинил, дигидробензофуранил, дигидробензопиранил или пиразолильную группу.
Предпочтительно, когда m=0, Аr представляет двухвалентную бензофуранильную группу, предпочтительнее бензофуран-2,5-диильную группу, и когда m=1, Аr представляет фениленовую группу.
Подходящим n является целое число в интервале от 1 до 4, предпочтительно n представляет число 1 или 2.
Предпочтительно, когда m=1, n равно 2.
Также предпочтительно, когда m=0, n равно 1.
Фармацевтически приемлемые соли, составляющие часть данного изобретения, включают соли по группе карбоновой кислоты, такие как соли металлов, например соли Li, Na и К, соли щелочноземельных металлов, например, соли Са и Мg, соли органических оснований, таких как лизин, аргинин, гуанидин, диэтаноламин, холин и подобных оснований, соли аммония или замещенного аммония, соли алюминия. Соли могут являться солями присоединения кислот, подходящими из которых являются сульфаты, нитраты, фосфаты, перхлораты, бораты, гидрогалогениды, ацетаты, тартраты, малеаты, цитраты, сукцинаты, пальмитаты, метансульфонаты, бензоаты, салицилаты, гидроксинафтоаты, бензолсульфонаты, аскорбаты, глицерофосфаты, кетоглутараты и т.п. Фармацевтически приемлемыми сольватами могут являться гидраты или соединения, содержащие другие кристаллизационные растворители, такие как спирты.
Особенно полезными соединениями в соответствии с настоящим изобретением являются
этил-(Е/Z)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксиакрилат;
этил-(Е)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксиакрилат;
этил-(Z)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксиакрилат;
этил-(E/Z)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксиакрилат;
этил-(Е)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксиакрилат;
этил-(Z)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксиакрилат;
этил-(E/Z)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксиакрилат;
этил-(Е)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксиакрилат;
этил-(Z)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксиакрилат;
(±)-метил-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(+)-метил-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(-)-метил-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(± )-метил-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(+)-метил-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(-)-метил-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(±)-метил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(+)-метил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(-)-метил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(± )-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(+)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(-)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат;
(±)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропаноат;
(+)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропаноат;
(-)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропаноат;
(± )-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропаноат;
(+)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропаноат;
(-)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропаноат;
(±)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропаноат;
(+)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропаноат;
(-)-этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропаноат;
(± )-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропановая кислота и ее соли;
(+)-3-(4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропановая кислота и ее соли;
(-)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропановая кислота и ее соли;
(±)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этокси-2-метилпропановая кислота и ее соли;
(+)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этокси-2-метилпропановая кислота и ее соли;
(-)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этокси-2-метилпропановая кислота и ее соли;
(±)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-феноксипропановая кислота и ее соли;
(+)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-феноксипропановая кислота и ее соли;
(-)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-феноксипропановая кислота и ее соли;
(±)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-фенокси-2-метилпропановая кислота и ее соли;
(+)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-фенокси-2-метилпропановая кислота и ее соли;
(-)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-фенокси-2-метилпропановая кислота и ее соли;
(±)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропановая кислота и ее соли;
(+)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропановая кислота и ее соли;
(-)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропановая кислота и ее соли;
(±)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропановая кислота и ее соли;
(+)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропановая кислота и ее соли;
(±)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-2-метилпропановая кислота и ее соли;
(+)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-2-метилпропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-2-метилпропановая кислота и ее соли;
(±)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-феноксипропановая кислота и ее соли;
(+)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-феноксипропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-феноксипропановая кислота и ее соли;
(±)-3-[4-(2-(феноксазин-10-ил)этокси]фенил]-2-фенокси-2-метилпропановая кислота и ее соли;
(+)-3-[4-(2-(феноксазин-10-ил)этокси]фенил]-2-фенокси-2-метилпропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-фенокси-2-метилпропановая кислота и ее соли;
(± )-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропановая кислота и ее соли;
(+)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропановая кислота и ее соли;
(±)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропановая кислота и ее соли;
(+)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропановая кислота и ее соли;
(±)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропановая кислота и ее соли;
(+)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропановая кислота и ее соли;
(-)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропановая кислота и ее соли;
[(2R)-N(1S)]-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид;
[(2S)-N(1S)]-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид;
[(2S)-N(1S)]-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид и
[(2R)-N(1S)]-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид.
В соответствии с отличительным признаком настоящего изобретения соединение общей формулы (III), где R1, R2, R3, R4, R7, R8, X, A, n, m, Аr имеют значения, указанные ранее, и R5 и R6 вместе представляют связь, можно получить любым из способов, показанных далее на схеме I. Соединение общей формулы (III) представляет соединение общей формулы (I), где все символы имеют значения, указанные ранее, и R5 и R6вместе представляют связь, и Y представляет атом водорода.
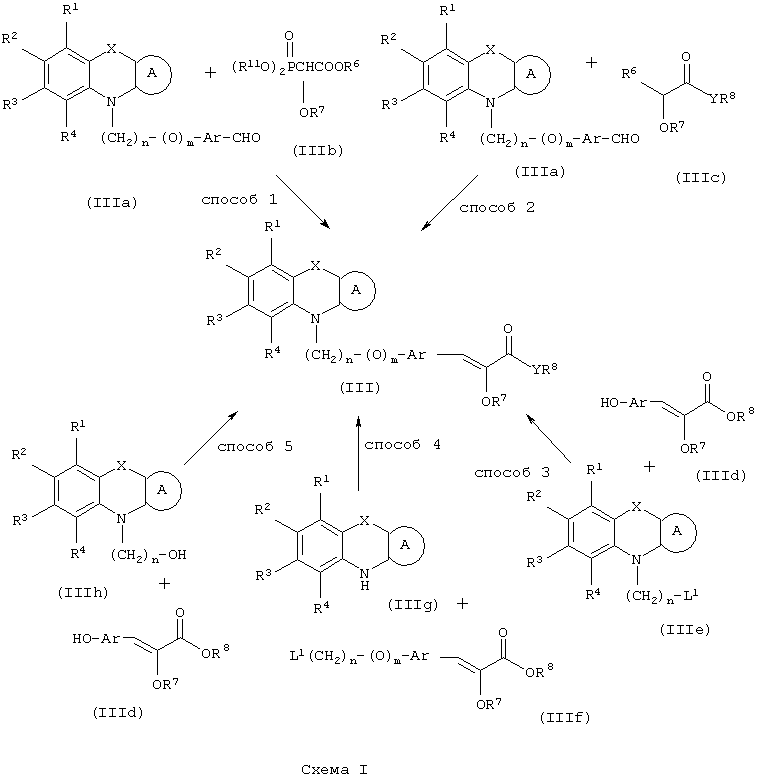
Способ (1). Взаимодействие соединения общей формулы (IIIa), где все символы имеют значения, указанные ранее, с соединением формулы (IIIb), где R11 может представлять собой низшую алкильную группу, и R7 и R8 имеют значения, указанные ранее, с образованием соединения общей формулы (III) можно осуществить в присутствии основания, такого как гидрид щелочного металла, например NaH, КН, или литийорганического соединения, например CH3Li, BuLi и т.п., или алкоксида, такого как NaOMe, NaOEt, K+BuO-, или их смеси. Реакцию можно осуществить в присутствии растворителя, такого как ТГФ, диоксан, ДМФА, ДМСО, DME и т.п., или их смеси. В качестве сорастворителя можно использовать НМРА. Температура реакции может колебаться от -78 до 50°С, предпочтительно температура реакции находится в интервале от -10 до 30°С. Соединение общей формулы (IIIb) можно получить в соответствии с методом, описанным в литературе (Annalen. Chemie (1996), 53, 699).
Способ (2). Взаимодействие соединения общей формулы (IIIa), где все символы имеют значения, указанные ранее, с соединением формулы (IIIс), где R6 представляет атом водорода и R7 и R8 имеют значения, указанные ранее, можно осуществить в обычных условиях. Основание не является критическим параметром. Можно использовать любое основание, обычно применяемое в случае реакции альдольной конденсации; можно использовать основание, такое как гидрид щелочного металла, например NaH или КН, алкоксид металла, такой как NaOMe, K+BuO-, NaOEt; амид металла, такой как LiNH2; LiN-(ipr)2. Можно использовать апротонный растворитель, такой как ТГФ, эфир, диоксан. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, используя инертные газы, такие как N2, Аr или Не, и реакция более эффективна в условиях отсутствия воды. Можно использовать температуру реакции в интервале от -80 до 35°С. β-Гидроксилированный продукт реакции можно дегидратировать в обычных условиях дегидратации, таких как обработка PTSA в растворителе, таком как бензол или толуол. Природа растворителя и дегидратирующего агента не являются критическими параметрами. Можно использовать температуру в интервале от 20°С до температуры кипения растворителя, причем предпочтительна температуре кипения растворителя, при которой можно непрерывно удалять воду с использованием водоотделителя Дина-Старка.
Способ (3). Взаимодействие соединения формулы (IIIе), где L1 представляет собой отщепляющуюся группу, такую как атом галогена, п-толуолосульфонатная, метансульфонатная, трифторметансульфонатная и подобная группа, и все символы имеют значения, указанные ранее, с соединением формулы (IIId), где R7, R8 и Аr имеют значения, указанные ранее, с образованием соединения формулы (III) можно осуществить в присутствии растворителя, такого как ТГФ, ДМФА, ДМСО, DME и т.п., или их смеси. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществить в присутствии основания, такого как К2СО3, Nа2СО3 или NaH, или их смеси. Когда в качестве основания используют Na2CO3 или K2CO3, в качестве растворителя можно использовать ацетон. Температура реакции может находиться в интервале 0-120°С, предпочтительно в интервале 30-100°С. Время реакции может составлять от 1 до 24 часов, предпочтительно от 2 до 12 часов. Соединение формулы (IIId) можно получить в соответствии с известным методом по реакции Виттига-Хорнера посредством взаимодействия между гидроксиарилальдегидом с защищенной гидроксильной группой, таким как бензилоксиарилальдегид, и соединением формулы (IIIb) с последующим отщеплением защитной группы.
Способ (4). Взаимодействие соединения общей формулы (IIIg), где все символы имеют значения, указанные ранее, с соединением формулы (IIIf), где все символы имеют значения, указанные ранее, и L1 представляет собой отщепляющуюся группу, такую как атом галогена, п-толуолосульфонатная, метансульфонатная, трифторметансульфонатная и подобная группа, а предпочтительно представляет собой атом галогена, с образованием соединения общей формулы (III) можно осуществить в присутствии растворителя, такого как ДМСО, ДМФА, DME, ТГФ, диоксан, эфир и т.п., или их сочетания.
Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществить в присутствии основания, такого как щелочь, такая как гидроксид натрия, гидроксид калия, карбонат щелочного металла, такой как карбонат натрия и карбонат калия; гидрид щелочного металла, такой как гидрид натрия или гидрид калия; металлоорганическое основание, такое как н-бутиллитий, амид щелочного металла, такой как амид натрия, или смеси оснований. Количество основания может составлять от 1 до 5 эквивалентов относительно количества соединения формулы (IIIg) и предпочтительно количество основания составляет от 1 до 3 эквивалентов. Реакцию можно осуществить при температуре в интервале от 0 до 150°С, предпочтительно при температуре в интервале от 15 до 100°С. Время реакции может составлять от 0,25 до 48 часов, предпочтительно от 0,25 до 12 часов.
Способ (5). Взаимодействие соединения общей формулы (IIIh), где все символы имеют значения, указанные ранее, с соединением формулы (IIId) можно осуществить с использованием подходящего агента сочетания, такого как дициклогексилмочевина, триарилфосфин/диалкилазадикарбоксилат, такой как РРh3/DEAD и т.п. Реакцию можно осуществить в присутствии растворителя, такого как ТГФ, DME, CH2Cl2, СНСl3, толуол, ацетонитрил, тетрахлорид углерода и т.п. Инертную атмосферу можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществить в присутствии DMAP, HOBT, их можно использовать в количестве в интервале от 0,05 до 2 эквивалентов, предпочтительно от 0,25 до 1 эквивалента. Температура реакции может находиться в интервале от 0 до 100°С, предпочтительно в интервале от 20 до 80°С. Время реакции может составлять от 0,5 до 24 часов, предпочтительно от 6 до 12 часов.
В соответствии с другим вариантом воплощения изобретения соединение общей формулы (I), где R1, R2, R3, R4, R5, R6, R7, R8, X, A, n, m и Ar имеют указанные ранее значения и Y представляет атом кислорода, можно получить с помощью одного или нескольких способов, показанных на схеме II.
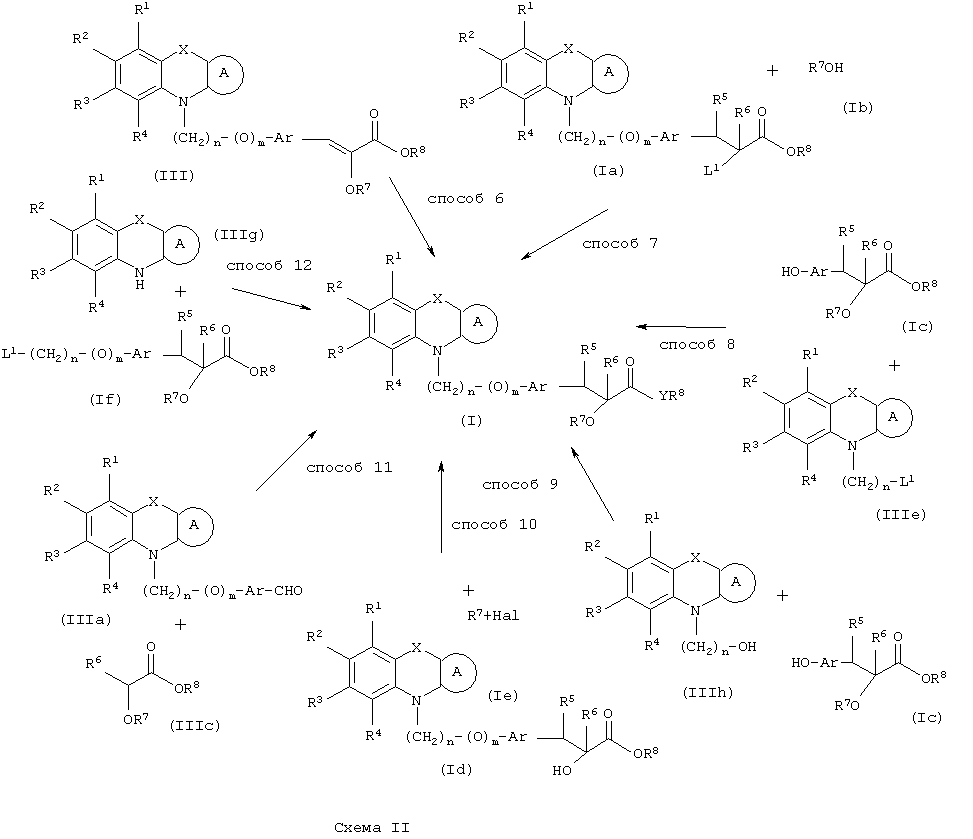
Способ (6). Восстановление соединения формулы (III), полученного так, как описано ранее на схеме I, с образованием соединения общей формулы (I), где каждый из R5и R6 представляет атом водорода и все символы имеют значения, указанные ранее, можно осуществить в присутствии газообразного водорода и катализатора, такого как Pd/C, Rh/C, Pt/C и т.п. Можно использовать смесь катализаторов. Реакцию также можно проводить в присутствии растворителя, такого как диоксан, уксусная кислота, этилацетат, этанол и т.п. Природа растворителя не является критическим параметром. Можно применять давление от атмосферного до ~550 кПа (80 ф/д2). С целью сокращения времени реакции можно использовать более высокое давление. Катализатором может быть предпочтительно 5-10% Pd/C, и количество используемого катализатора может составлять 1-100% (м/м). Реакцию также можно осуществлять с использованием восстановления с раствором металла, такого как магний в спирте или амальгама натрия в спирте.
Способ (7). Взаимодействие соединения формулы (Iа), где все символы имеют значения, указанные ранее, и L3представляет собой отщепляющуюся группу, такую как атом галогена, со спиртом общей формулы (Ib), где R7 имеет значения, указанные ранее, с образованием соединения формулы (I) можно осуществить в присутствии растворителя, такого как ТГФ, ДМФА, ДМСО, DME и т.п., или их смесей. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществить в присутствии основания, такого как КОН, NaOH, NaOMe, NaOEt, K+BuO- или NaH, или их смеси. Можно использовать межфазный катализатор, такой как галогенид или гидроксид тетраалкиламмония. Температура реакции может находиться в интервале от 20 до 120°С, предпочтительно температура реакции составляет от 30 до 100°С. Время реакции может составлять от 1 до 12 часов, предпочтительно от 2 до 6 часов. Соединение формулы (Iа) можно получить в соответствии со способом, описанным в одновременно рассматриваемой заявке 08/982910 (реестр поверенного №U 011410-0).
Способ (8). Взаимодействие соединения формулы (IIIе), описанного ранее, с соединением формулы (Iс), где все символы имеют значения, указанные ранее, с образованием соединения формулы (I) можно осуществить в присутствии растворителя, такого как ТГФ, ДМФА, ДМСО, DME и т.п., или их смесей. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществить в присутствии основания, такого как К2СО3, Nа2СО3 или NaH, или их смеси. Когда в качестве основания используют К2СО3 или Na2CO3 , в качестве растворителя можно использовать ацетон. Температура реакции может находиться в интервале от 20 до 120°С, предпочтительно температура реакции находится в интервале от 30 до 80°С. Время реакции может составлять от 1 до 24 часов, предпочтительно от 2 до 12 часов. Соединение формулы (Iс) можно получить по реакции Виттига-Хорнера между гидроксиарилальдегидом с защищенной гидроксильной группой и соединением формулы (IIIb) с последующим восстановлением двойной связи и отщеплением защитной группы. С другой стороны, соединение формулы (Iс) можно получить в соответствии с методом, описанным в WO 94/01420.
Способ (9). Взаимодействие соединения общей формулы (IIIh), описанного ранее, с соединением общей формулы (Iс), где все символы имеют значения, указанные ранее, можно осуществить с использованием подходящего агента сочетания, такого как дициклогексилмочевина, триарилфосфин/диалкилазадикарбоксилат, такой как PPh3/DEAD, и т.п. Реакцию можно осуществить в присутствии растворителя, такого как ТГФ, DME, CH2Cl2, СНСl3, толуол, ацетонитрил, тетрахлорид углерода и т.п. Инертную атмосферу можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществлять в присутствии DMAP, НОВТ, и их можно использовать в количестве в интервале 0,05-2 эквивалента, предпочтительно 0,25-1 эквивалент. Температура реакции может находиться в интервале от 0 до 100°С, предпочтительно температура реакции находится в интервале от 20 до 80°С. Время реакции может составлять от 0,5 до 24 часов, предпочтительно от 6 до 12 часов.
Способ (10). Взаимодействие соединения формулы (Id), где все символы имеют значения, указанные ранее, с соединением формулы (Iе), где R7 имеет значения, указанные ранее, и Hal представляет Сl, Вr или I, с образованием соединения формулы (I) можно осуществить в присутствии растворителя, такого как ТГФ, ДМФА, ДМСО, DME и т.п. Инертную атмосферу можно поддерживать, применяя инертные газы, такие как N2, Аr или Не. Реакцию можно осуществить в присутствии основания, такого как КОН, NaOH, NaOMe, K+BuO-, NaH и т.п. Можно использовать межфазный катализатор, такой как галогенид или гидроксид тетраалкиламмония. Температура реакции может находиться в интервале от 20 до 150°С, предпочтительно температура реакции находится в интервале от 30 до 100°С. Время реакции может составлять от 1 до 24 часов, предпочтительно от 2 до 12 часов. Соединение формулы (Id) представляет соединение формулы (I), где R7представляет Н и Y представляет атом кислорода.
Способ (11). Взаимодействие соединения общей формулы (IIIa), описанного ранее, с соединением формулы (IIIc), где R6, R7 и R8 имеют значения, указанные ранее, можно осуществить в обычных условиях. Основание не является критическим параметром. Можно использовать любое основание, обычно используемое для реакции альдольной конденсации, такое как гидрид металла, например NaH или КН; алкоксид металла, например NaOMe, K+BuO- или NaOEt, амид металла, например LiNH2 или LiN(ipr)2. Можно использовать апротонный растворитель, такой как ТГФ, эфир или диоксан. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Ar или Не, и реакция является более эффективной в условиях отсутствия воды. Можно использовать температуру реакции в интервале от -80 до 25°С. β-Гидроксиальдольный продукт реакции можно дегидроксилировать с использованием удобных методов, обычно метода ионного гидрирования, например, путем обработки триалкилсиланом в присутствии кислоты, такой как трифторуксусная кислота. Можно использовать растворитель, такой как СН2Сl2. Реакция хорошо протекает при 25°С. Если реакция идет медленно, можно использовать более высокую температуру.
Способ (12). Взаимодействие соединения общей формулы (IIIg), где все символы имеют значения, указанные ранее, с соединением формулы (If), где L1представляет собой отщепляющуюся группу, такую как атом галогена, п-толуолсульфонатная, метансульфонатная, трифторметансульфонатная группа и т.п., предпочтительно атом галогена, и все другие символы имеют значения, указанные ранее, с образованием соединения общей формулы (I) можно осуществить в присутствии растворителя, такого как ДМСО, ДМФА, DME, ТГФ, диоксан, эфир и т.п., или их сочетания. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Аr или Не. Реакцию можно осуществить в присутствии основания, такого как щелочь, например гидроксид натрия или гидроксид калия; карбонат щелочного металла, например карбонат натрия или карбонат калия; гидрид щелочного металла, например гидрид натрия или гидрид калия; металлоорганическое основание, например н-бутиллитий, амид щелочного металла, например амид натрия, или их смеси. Количество основания может колебаться от 1 до 5 эквивалентов относительно количества соединения формулы (IIIg), предпочтительно количество основания составляет от 1 до 3 эквивалентов. Реакцию можно осуществить в присутствии межфазного катализатора, такого как галогенид или гидроксид тетраалкиламмония. Реакцию можно осуществить при температуре в интервале от 0 до 150°С, предпочтительно при температуре в интервале от 15 до 100°С. Время реакции может составлять от 0,25 до 24 часов, предпочтительно от 0,25 до 12 часов.
Соединение общей формулы (I), где Y представляет кислород и R8 имеет значения, указанные ранее, можно превратить в соединение формулы (I), где Y представляет NR10, посредством взаимодействия с соответствующим амином. Соответственно соединение формулы (I), где Y представляет ОН, можно превратить в галогеноангидрид, предпочтительно YR8=Сl, посредством взаимодействия с соответствующими реагентами, такими как оксалилхлорид, тионилхлорид и т.п., с последующей обработкой амином. С другой стороны, можно получить смешанный ангидрид из соединения формулы (I), где YR8 представляет ОН, а все другие символы имеют значения, указанные ранее, посредством обработки галогеноангидридом, таким как ацетилхлорид, ацетилбромид, пивалоилхлорид, дихлорбензоилхлорид и т.п. Реакцию можно осуществить в присутствии подходящего основания, такого как пиридин, триэтиламин, диизопропилэтиламин и т.п. Можно использовать такие растворители, как галогенсодержащие углеводороды, например СНСl3 или CH2Cl2; углеводороды, например бензол, толуол, ксилол и т.п. Реакцию можно осуществить при температуре в интервале от -40 до 40°С, предпочтительно от 0 до 20°С. Затем полученный таким образом галогеноангидрид или смешанный ангидрид можно обработать соответствующим амином.
Способы получения соединений общей формулы (IIIa) описаны в одновременно рассматриваемой заявке №08/982910 (реестр поверенного №U 011410-0).
В другом варианте своего воплощения настоящее изобретение относится к новым промежуточным соединениям формулы (If)
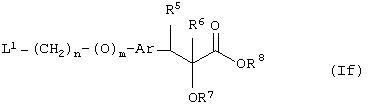
где Аr представляет необязательно замещенную двухвалентную отдельную или конденсированную ароматическую или гетероциклическую группу; R5 представляет атом водорода, гидрокси, алкокси, галоген, низший алкил, необязательно замещенную аралкильную группу или вместе с соседней группой R6 образует связь; R6 представляет водород, гидрокси, алкокси, галоген, низшую алкильную группу, ацил, необязательно замещенный аралкил или вместе с R5 образует связь; R7 представляет водород или необязательно замещенную группу, выбранную среди алкильных, циклоалкильных, арильных, аралкильных, алкоксиалкильных, алкоксикарбонильных, арилоксикарбонильных, алкиламинокарбонильных, ариламинокарбонильных, ацильных, гетероциклильных, гетероарильных или гетероаралкильных групп; R6 может представлять собой водород или необязательно замещенную группу, выбранную среди алкильных, циклоалкильных, арильных, аралкильных, гетероциклильных, гетероарильных или гетероаралкильных групп; n равен целому числу в интервале 1-4; m равен 0 или 1 и L1 представляет собой отщепляющуюся группу, такую как атом галогена, п-толуолсульфонатная, метансульфонатная, трифторметансульфонатная группа и т.п., предпочтительно атом галогена, и к способу их получения и их применения при получении β-арил-α-замещенных гидроксиалкановых кислот.
Соединение формулы (If), где m=0, и все другие символы имеют значения, указанные ранее, можно получить посредством взаимодействия соединения формулы (Iс)
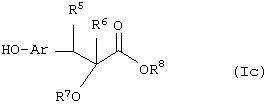
где R5,R6, R7, R8 и Аr имеют значения, указанные ранее, с соединением формулы (IV)
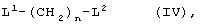
где L1 и L2 могут быть одинаковыми или разными и представляют отщепляющиеся группы, такие как Сl, Вr, I, метансульфонатная, трифторметансульфонатная, п-толуолсульфонатная группа и т.п., или L2 также может представлять гидроксильную или защищенную гидроксильную группу, которую в дальнейшем можно превратить в отщепляющуюся группу, и n равен целому числу в интервале 1-4.
Взаимодействие соединения формулы (Iс) с соединением формулы (IV) с образованием соединения формулы (If) можно осуществить в присутствии растворителя, такого как ТГФ, ДМФА, ДМСО, DME и т.п., или их смеси. Реакцию можно осуществить в инертной атмосфере, которую можно поддерживать, применяя инертные газы, такие как N2, Ar или Не. Реакцию можно осуществить в присутствии основания, такого как К2СО3, Na2CO3 или NaH, или их смеси. Когда в качестве основания используют Na2CO3 или К2СО3, в качестве растворителя можно применять ацетон. Температура реакции может колебаться от 20 до 120°С, предпочтительно проводить реакцию при температуре в интервале 30-80°С. Время реакции может находиться в интервале от 1 до 24 часов, предпочтительно от 2 до 12 часов.
С другой стороны, промежуточное соединение формулы (If) можно получить посредством взаимодействия соединения формулы (V)
L1-(CH2)n-(O)m-Ar-CHO (V),
где L1 представляет отщепляющуюся группу, такую как Сl, Вr, I, метансульфонатная, трифторметансульфонатная, п-толуолсульфонатная группа и т.п., и все другие символы имеют значения, указанные ранее, с соединением формулы (IIIb)
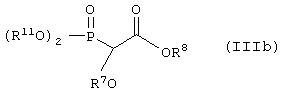
где все символы имеют значения, указанные ранее, с образованием соединения формулы (IIIf), которое затем восстанавливают с образованием соединения формулы (If). Соединение формулы (IIIf) представляет соединение формулы (If), где R5 и R6 вместе представляют связь, а все другие символы имеют значения, указанные ранее.
Взаимодействие соединения формулы (V) с соединением формулы (IIIb) можно осуществить в присутствии основания, такого как гидрид щелочного металла, например NaH или КН, или литийорганическое соединение, такое как CH3Li, BuLi и т.п., или алкоксид, такой как NaOMe, NaOEt, K+BuO-, или их смеси. Реакцию можно осуществить в присутствии растворителя, такого как ТГФ, диоксан, ДМФА, ДМСО, DME и т.п., или их смеси. В качестве сорастворителя можно применять НМРА. Температура реакции может колебаться от -78 до 50°С, предпочтительно проводить реакцию при температуре в интервале от -10 до 30°С. Восстановление соединения формулы (IIIf) можно осуществить в присутствии газообразного водорода и катализатора, такого как Pd/C, Rh/C, Pt/C и т.п. Можно использовать смесь катализаторов. Реакцию также можно проводить в присутствии растворителя, такого как диоксан, уксусная кислота, этилацетат, этанол и т.п. Природа растворителя не является критическим параметром. Можно применять давление от атмосферного до ~550 кПа (80 ф/д2). С целью сокращения времени реакции можно использовать более высокое давление. Катализатором может быть предпочтительно 5-10% Pd/C, и количество используемого катализатора может составлять 1-100% (м/м). Реакцию также можно осуществлять с использованием восстановления с раствором металла, такого как магний в спирте или амальгама натрия в спирте.
Фармацевтически приемлемые соли получают посредством взаимодействия соединения формулы (I) с 1-4-эквивалентами основания, такого как гидроксид натрия, метоксид натрия, гидрид натрия, трет-бутоксид калия, гидроксид кальция, гидроксид магния и подобного основания, в растворителе, таком как эфир, ТГФ, метанол, трет-бутанол, диоксан, изопропанол, этанол и т.п. Можно использовать смеси растворителей. Также можно использовать органические основания, такие как лизин, аргинин, диэтаноламин, холин, гуанидин, их производные и т.п. С другой стороны, любые приемлемые соли присоединения кислот получают посредством обработки кислотами, такими как хлороводородная кислота, бромоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, уксусная кислота, лимонная кислота, малеиновая кислота, салициловая кислота, гидроксинафтойная кислота, аскорбиновая кислота, пальмитиновая кислота, янтарная кислота, бензойная кислота, бензолсульфоновая кислота, винная кислота и т.п., в растворителе, таком как этилацетат, эфир, спирты, ацетон, ТГФ, диоксан и т.п. Можно также использовать смеси растворителей.
Стереоизомеры соединений, составляющие часть данного изобретения, можно получить любым возможным способом с использованием реагентов в их отдельной энантиомерной форме или посредством осуществления взаимодействия в присутствии реагентов или катализаторов в их отдельной энантиомерной форме, или посредством расщепления смеси стереоизомеров обычными методами. К некоторым из предпочтительных методов относятся расщепление с помощью микроорганизмов, расщепление диастереомерных солей, образованных хиральными кислотами, такими как миндальная кислота, камфорсульфоновая кислота, винная кислота, молочная кислота, и подобными кислотами, когда они приемлемы, или образованных хиральными основаниями, такими как бруцин, алкалоиды хинной коры и их производные и т.п. Обычно используемые способы собраны в издании Jackes и др., "Enantiomers, Racemates and Resolution" (Wiley Interscience, 1981). Например, соединение формулы (I), где YR8 представляет ОН, можно превратить в смесь 1:1 диастереомерных амидов посредством обработки хиральными аминами, аминокислотами, аминоспиртами, полученными из аминокислот; можно использовать обычные условия реакции превращения кислоты в амид; диастереомеры можно разделить или посредством фракционной кристаллизации или посредством хроматографии, и стереоизомеры соединения формулы (I) можно получить посредством гидролиза чистого диастереомера амида.
Различные полиморфные формы соединения общей формулы (I), составляющие часть данного изобретения, можно получить посредством кристаллизации соединения формулы (I) в различных условиях, например с использованием различных растворителей, обычно используемых для перекристаллизации, или их смесей; кристаллизации при разных температурах; различных способов охлаждения во время кристаллизации - от очень быстрого охлаждения до очень медленного. Полиморфы также можно получить посредством нагревания или плавления соединения с последующим постепенным или быстрым охлаждением. Наличие полиморфных форм можно определить с помощью ЯМР-спектроскопии твердого образца, ИК-спектроскопии, дифференциальной сканирующей калориметрии, дифракции рентгеновских лучей на порошках или другими такими методами.
Настоящее изобретение также относится к фармацевтической композиции, содержащей одно или несколько соединений общей формулы (I), описанных выше, их таутомерных форм, их стереоизомеров, их полиморфных форм, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов, в сочетании с обычно используемыми в фармации носителями, разбавителями и т.п., полезным для лечения и/или профилактики инсульнорезистентности (диабета типа 2), сниженной толерантности к глюкозе, дислипидемии, расстройств, связанных с синдромом X, таких как гипертензия, ожирение, инсулинорезистентность, атеросклероз, гиперлипидемия, ишемическая болезнь сердца, и других сердечно-сосудистых нарушений. Соединения настоящего изобретения также полезны для лечения некоторых болезней почек, включая гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз, для лечения псориаза и поликистоза яичников (PCOS). Эти соединения также могут быть полезны в качестве ингибиторов альдозоредуктазы, для улучшения когнитивных (познавательных) функций при деменции и лечения осложнений при диабете и остеопороза.
Фармацевтическая композиция может находиться в обычно используемой форме, такой как таблетки, капсулы, порошки, сиропы, растворы, суспензии и т.п., может содержать корригенты, подслащиватели и т.п., в подходящих твердых или жидких носителях или растворителях, или в подходящих стерильных средах для образования растворов или суспензий для инъекций. Такие композиции, как правило, содержат от 1 до 20 мас.%, предпочтительно от 1 до 10 мас.%, активного соединения, причем остальную часть композиции составляют фармацевтически приемлемые носители, разбавители или растворители.
Соединение формулы (I), описанное выше, вводят млекопитающим, в том числе человеку, или пероральным, или парентеральным способом. Предпочтительно введение пероральным способом, являющееся более удобным и позволяющим избежать возможной боли и раздражения от инъекции. Однако в условиях, когда пациент не может проглотить лекарственное средство или ухудшено поглощение после перорального введения вследствие болезни или другого отклонения, необходимо вводить лекарственное средство парентерально. При любом способе введения дозировка находится в интервале от примерно 0,01 до примерно 100 мг на 1 кг массы тела субъекта в сутки или предпочтительно от примерно 0,01 до примерно 30 мг на 1 кг массы тела в сутки, в виде однократной дозы или разделенной дозы. Однако оптимальная дозировка для отдельного субъекта, которого лечат, будет определяться лечащим врачом, причем, как правило, сначала вводят меньшую дозу, а затем дозу увеличивают, и определяют наиболее подходящую дозу.
Подходящими фармацевтически приемлемыми носителями являются твердые носители или разбавители и стерильные водные или органические растворы. Активное соединение в такой фармацевтической композиции будет присутствовать в эффективном количестве, достаточном для обеспечения нужной дозировки в указанном выше интервале. Так, в случае перорального введения соединения можно соединить с подходящим твердым или жидким носителем или разбавителем с образованием капсул, таблеток, порошков, сиропов, растворов, суспензий и т.п. Фармацевтические композиции при необходимости могут содержать дополнительные компоненты, такие как корригенты, подслащиватели, эксципиенты и т.п. В случае парентерального введения соединения можно соединить со стерильной водной или органической средой с образованием растворов или суспензий для инъекций. Например, можно использовать растворы в сезамовом или арахисовом масле, водном пропиленгликоле и т.п., а также водные растворы водорастворимых фармацевтически приемлемых солей присоединения или солей соединений, образованных с основаниями. Растворы для инъекций, полученные таким способом, затем можно вводить внутривенно, интраперитонеально, подкожно или внутримышечно, причем для людей предпочтительно внутримышечное введение.
Сведения, подтверждающие возможность осуществления изобретения.
Изобретение подробно поясняется с помощью примеров, приведенных ниже, которые даются только в качестве иллюстрации и поэтому не должны рассматриваться как ограничение объема изобретения.
Препаративный пример 1
Этил-(E/Z)-3-[4-бензилоксифенил]-2-этоксиакрилат
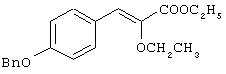
Раствор триэтил-2-этоксифосфоноацетата, полученного по способу Grell and Machleidt, Annalen. Chemie, 1996, 699, 53, (3,53 г, 13,2 ммоль), в сухом тетрагидрофуране (10 мл) в атмосфере азота при перемешивании постепенно добавляют к охлаждаемой льдом суспензии гидрида натрия (60% дисперсия в масле) (0,62 г, 25,94 ммоль) в сухом тетрагидрофуране (5 мл). Смесь перемешивают при 0°С в течение 30 мин перед добавлением 4-бензилоксибензальдегида (2,5 г, 11,79 ммоль) в сухом тетрагидрофуране (20 мл). Смесь нагревают до комнатной температуры и перемешивают при этой температуре в течение 20 час. Растворитель испаряют, добавляют воду (100 мл) и смесь экстрагируют этилацетатом (2×75 мл). Объединенные органические экстракты промывают водой (50 мл), рассолом (50 мл), сушат (Na2SO4), фильтруют и испаряют растворитель при пониженном давлении. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира (2:8) и получают названное в заголовке соединение (3,84 г, выход количественный) в виде масла.1H ЯМР продукта реакции предполагает смесь геометрических изомеров (76:24=Z:E) (R.A. Aitken and G.L. Thom, Synthesis, 1989, 958).
1H ЯМР (СDСl3, 200 МГц): δ 1,25-1,50 (комплекс, 6Н), 3,85-4, 03 (комплекс, 2Н), 4,28 (к, J=7,0 Гц, 2Н), 5,05, 5,09 (2с, 2Н, бензилокси-СН2), 6,08 (с, 0,24Н, Е-изомер олефинового протона), 6,85-6,90 (комплекс, 2Н), 6,99 (с, 0,76Н, Z-изомер), 7,33-7,45 (комплекс, 5Н), 7,75 (д, J=8,72 Гц, 2Н).
Препаративный пример 2
Метил-3-[4-бензилоксифенил]-2-этоксипропаноат
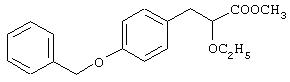
Смесь этил-(E/Z)-3-[4-бензилоксифенил]-2-этоксиакрилата (3,84 г, 11,79 ммоль, получен в препаративном примере 1) и магниевой стружки (5, 09 г, 0,21 ммоль) в сухом метаноле (40 мл) перемешивают при 25°С в течение 1 часа. Добавляют воду (80 мл) и доводят рН раствора до 6,5-7,5 с помощью 2 н. соляной кислоты. Раствор экстрагируют этилацетатом (3×75 мл). Органические слои промывают водой (50 мл), рассолом (50 мл), сушат (Na2SO4) и фильтруют. Растворитель испаряют при пониженном давлении и получают названное в заголовке соединение (3,7 г, выход количественный) в виде масла.
1H ЯМР (СDСl3, 200 МГц): δ 1,16 (т, J=6,97 Гц, 3Н), 2,95 (д, J=6,55 Гц, 2Н), 3,30-3,38 (комплекс, 1Н), 3,55-3,67 (комплекс, 1Н), 3,69 (с, 3Н), 3,99 (т, J=6,64 Гц, 1Н), 5,04 (с, 2Н), 6,89 (д, J=8,63 Гц, 2Н), 7,15 (д, J=8,62 Гц, 2Н), 7,31-7,41 (комплекс, 5Н).
Препаративный пример 3
Метил-3-[4-гидроксифенил]-2-этоксипропаноат
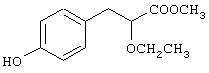
Суспензию метил-3-[4-бензилоксифенил]-2-этоксипропаноата (3,7 г, 11,78 ммоль, препаративный пример 2) и 10% Pd/C (0,37 г) в этилацетате (50 мл) перемешивают при 25°С и давлении водорода ~414 кПа (60 ф/д2) в течение 24 час. Катализатор отфильтровывают и растворитель испаряют при пониженном давлении. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира (2:8) и получают названное в заголовке соединение (2,2 г, 84%) в виде масла.
1Н ЯМР (CDCl3, 200 МГц): δ 1,21 (т, J=6,97 Гц, 3Н), 2,99 (д, J=6,37 Гц, 2Н), 3,32-3,49 (комплекс, 1Н), 3,57-3,65 (комплекс, 1Н), 3,76 (с, 3Н), 4,05 (т, J=6,64 Гц, 1Н), 5,19-5,40 (ушс, 1Н, способен к обмену с D2O), 6,80 (д, J=8,44 Гц, 2Н), 7,14 (д, J= 8,39 Гц, 2Н).
Препаративный пример 4
Этил-3-[4-гидроксифенил]-2-этоксипропаноат

Названное в заголовке соединение (1,73 г, 61%) получают в виде бесцветного масла из этил-(E/Z)-3-[4-бензилоксифенил]-2-этоксиакрилата (3,85 г, 11,80 ммоль), полученного в препаративном примере 1, посредством гидрирования, описанного в препаративном примере 3.
1H ЯМР (CDCl3, 200 МГц): δ 1,12-1,29 (комплекс, 6Н), 2,93 (д, J=6,55 Гц, 2Н), 3,28-3,45 (комплекс, 1Н), 3,51-3,68 (комплекс, 1Н), 3,98 (т, J=6,55 Гц, 1Н), 4,16 (к, J=7,15 Гц, 2Н), 5,40 (с, 1Н, способен к обмену с D2O), 6,73 (д, J=8,39 Гц, 2Н), 7,08 (д, J=8,53 Гц, 2Н).
Препаративный пример 5
Этил-3-[4-бензилоксифенил]-2-бутоксипропаноат
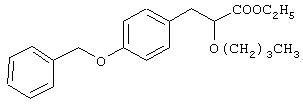
Раствор этил-3-[4-бензилоксифенил]-2-гидроксипропаноата (5,0 г, 16,6 ммоль) (полученного способом, подобным способу, описанному в ссылке WO 95/18125), в сухом диметилформамиде (5 мл) при 0°С добавляют к суспензии гидрида натрия (0,1 г, 41,6 ммоль) (60% дисперсия в масле) в сухом диметилформамиде (3 мл) и продолжают перемешивание в течение 1 часа. К вышеуказанной реакционной смеси при 0°С добавляют н-бутилбромид (3,4 г, 24,0 ммоль) и продолжают перемешивание в течение 10 час примерно при 25°С. Добавляют воду (30 мл) и смесь экстрагируют этилацетатом (2×50 мл). Объединенные этилацетатные слои промывают водой (50 мл), рассолом (25 мл), сушат (Na2SO4), фильтруют и испаряют растворитель.
Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира (1:9) и получают названное в заголовке соединение (0,7 г, 20%) в виде масла.
1H ЯМР (СDСl3, 200 МГц): δ 0,85 (т, J=7,38 Гц, 3Н), 1,18-1,40 (комплекс, 5Н), 1,49-1,58 (комплекс, 2Н), 2,94 (д, J=6,74 Гц, 2Н), 3,20-3,33 (комплекс, 1Н), 3,46-3,61 (комплекс, 1Н), 3,94 (т, J=6,37 Гц, 1Н), 4,16 (к, J=7,0 Гц, 2Н), 5,04 (с, 2Н), 6,89 (д, J=8,5 Гц, 2Н), 7,15 (д, J=8,48 Гц, 2Н), 7,30-7,44 (комплекс, 5Н).
Препаративный пример 6
Этил-3-[4-гидроксифенил]-2-бутоксипропаноат
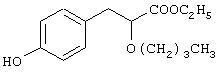
Названное в заголовке соединение (0,475 г, 75%) получают в виде масла из этил-3-[4-бензилоксифенил]-2-бутоксипропаноата (0,85 г, 2,38 ммоль), полученного в препаративном примере 5, посредством процедуры, аналогичной описанной в препаративном примере 3.
1H ЯМР (СDСl3, 200 МГц): δ 0,85 (т, J=7,24 Гц, 3Н), 1,19-1,38 (комплекс, 5Н), 1,44-1,58 (комплекс, 2Н), 2,94 (д, J=6,55 Гц, 2Н), 3,21-3,32 (комплекс, 1Н), 3,49-3,62 (комплекс, 1Н), 3,94 (т, J=6,88 Гц, 1Н), 4,16 (к, J=7,1 Гц, 2Н), 4,99 (с, 1Н, способен к обмену с D2O), 6,73 (д, J=8,53 Гц, 2Н), 7,09 (д, J=8,44 Гц, 2Н).
Препаративный пример 7
Этил-3-[4-бензилоксифенил]-2-гексилоксипропаноат
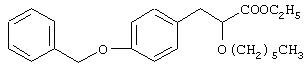
Названное в заголовке соединение (1,2 г, 22%) получают в виде масла из этил-3-(4-бензилоксифенил)-2-гидроксипропаноата (4,2 г, 14,0 ммоль) и 1-бромгексана (3,4 г, 21,0 ммоль) посредством процедуры, аналогичной описанной в препаративном примере 5.
1Н ЯМР (CDCl3, 200 МГц): δ 0,86 (т, J=5, 9 Гц, 3Н), 1,18-1,37 (комплекс, 7Н), 1,45-1,66 (комплекс, 4Н), 2,94 (д, J=6,55 Гц, 2Н), 3,22-3,33 (комплекс, 1Н), 3,52-3,64 (комплекс, 1Н), 3,94 (т, J=6,9 Гц, 1Н), 4,16 (к, J=7,06 Гц, 2Н), 5,03 (с, 2Н), 6,89 (д, J=8, 63 Гц, 2Н), 7,15 (д, J=8,63 Гц, 2Н), 7,31-7,44 (комплекс, 5Н).
Препаративный пример 8
Этил-3-[4-гидроксифенил]-2-гексилоксипропаноат
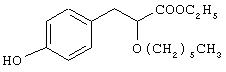
Названное в заголовке соединение (0,7 г, 76%) получают в виде масла из этил-3-[4-бензилоксифенил]-2-гексилоксипропаноата (1,2 г, 3,1 ммоль), полученного в препаративном примере 7, посредством процедуры, аналогичной описанной в препаративном примере 3.
1Н ЯМР (CDCl3, 200 МГц): δ 0,85 (т, J=5,81 Гц, 3Н), 1,19-1,39 (комплекс, 7Н), 1,48-1,68 (комплекс, 4Н), 2,92 (д, J=6,74 Гц, 2Н), 3,18-3,39 (комплекс, 1Н), 3,48-3, 62 (комплекс, 1Н), 3,93 (т, J=7,0 Гц, 1Н), 4,16 (к, J=7,06 Гц, 2Н), 4,85 (с, 1Н, способен к обмену с D2O), 6,73 (д, J=8,53 Гц, 2Н), 7,10 (д, J=8,31 Гц, 2Н).
Препаративный пример 9
Этил-(E/Z)-3-[4-(2-бромэтокси)фенил]-2-этоксиакрилат

Названное в заголовке соединение (4,0 г, 66%) получают в виде масла при соотношении изомеров E:Z, равном 45:55 (при измерении методом1H ЯМР), из 4-(2-бромэтокси)бензальдегида (4,0 г, 17,4 ммоль) и триэтил-2-этоксифосфоноацетата (5,61 г, 20,89 ммоль) посредством процедуры, аналогичной описанной в препаративном примере 1.
1H ЯМР (СDСl3, 200 МГц): δ 1,17 и 1,42 (6Н, Е- и Z-триплеты, изомерные ОСН2СН3 и ОСН2-СН3), 3,62-3,72 (комплекс, 2Н), 3,90-4,28 (комплекс, 2Н), 4,30-4,37 (комплекс, 4Н), 6,09 (с, 0,45Н, олефиновый протон Е-изомеров), 6,85 и 6,92 (2Н, д и д, J=8,67 Гц и 8,7 Гц), 6,98 (с, 0,55Н, Z-изомер олефинового протона), 7,16 и 7,78 (д и д, комбинированный 2Н, J=8,63 Гц и 8,72 Гц).
Препаративный пример 10
Этил-3-[4-(2-бромэтокси)фенил]-2-этоксипропаноат
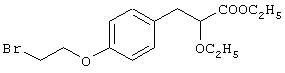
Названное в заголовке соединение (4,0 г, 80%) получают в виде бесцветного масла из этил-(E/Z)-3-[4-(2-бромэтокси)фенил]-2-этоксиакрилата (5,0 г, 14,5 ммоль), полученного в препаративном примере 9, с использованием Н2/10% Pd/C (4 г) в диоксане в качестве растворителя посредством процедуры, аналогичной описанной в препаративном примере 3.
1H ЯМР (CDCl3, 200 МГц): δ 1,12-1,30 (комплекс, 6Н), 2,95 (д, J=6,64 Гц, 2Н), 3,25-3,45 (комплекс, 1Н), 3,56-3,68 (комплекс, 3Н), 3,96 (т, J=6, 65 Гц, 1Н), 4,16 (к, J=7,1 Гц, 2Н), 4,27 (т, J=6,3 Гц, 2Н), 6,81 (д, J=8,67 Гц, 2Н), 7,16 (д, J=8,63 Гц, 2Н).
Пример 1
Этил-(E/Z)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксиакрилат

Названное в заголовке соединение получают как смесь изомеров (E:Z, 1:1) (1,46 г, выход количественный) в виде сиропообразной жидкости из 4-[2-(фенотиазин-10-ил)этокси]бензальдегида (1,08 г, 3,11 ммоль) и триэтил-2-этоксифосфоноацетата (W.Grell & Н.Machleidt, Annalen chemie, 1966, 699, 53) (1,0 г, 3,73 ммоль) посредством процедуры, аналогичной описанной в препаративном примере 1.
1Н ЯМР (CDCl3, 200 МГц): δ 1,15-1,43 (комплекс, 6Н), 3,89-4,03 (комплекс, 2Н), 4,11-4,17 (комплекс, 2Н), 4,30, 4,33 (комбинированные, 4Н, -СН2СН2-синглеты), 6,07 (с, 0,5Н, олефиновый протон Е-изомера), 6,80-7,10 (комплекс, 6,5Н), 7,14-7,20 (комплекс, 4Н), 7,73 (д, J=8,39 Гц, 2Н).
Пример 2
Этил-(E/Z)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксиакрилат
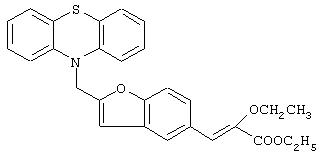
Названное в заголовке соединение получают как смесь изомеров E:Z (38:62) (при измерении методом1Н ЯМР) (1,5 г, 100%) в виде бесцветной жидкости из 5-формил-2-(фенотиазин-10-ил)метилбензофурана (1,14 г, 3,2 ммоль) посредством процедуры, подобной описанной в препаративном примере 1.
1Н ЯМР (CDCl3, 200 МГц): δ 1,23-1,45 (комплекс, 6Н), 3,55-3,78 (комплекс, 1Н), 3,88-4,19 (комплекс, 1Н), 4,22-4,35 (комплекс, 2Н), 5,14 (с, 2Н), 6,18 (с, 0,38Н, олефиновый протон Е-изомера), 6,47 и 6,54 (комбинированные, 1Н), 6,78-7,12 (комплекс, 8,62Н), 7,37-7,48 (комплекс, 1Н), 7,71 (д, J=7,57 Гц, 1Н), 7,95 (с, 1Н).
Пример 3
Этил-(E/Z)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксиакрилат
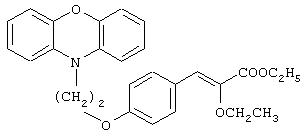
Названное в заголовке соединение получают как смесь изомеров (E:Z, 36:64) (при измерении методом1H ЯМР) (14,4 г, 76%) в виде белого твердого вещества из 4-[2-(феноксазин-10-ил)этокси]бензальдегида (14, 0 г, 42,3 ммоль) посредством процедуры, аналогичной описанной в препаративном примере 1. Т.пл. 110-112°С.
1Н ЯМР (СDСl3, 200 МГц): δ 1,16 и 1,38 (комбинированные, 6Н, триплетные сигналы изомерных -ОСН2СН3), 3,89-4,05 (комплекс, 4Н), 4,14-4,31 (комплекс, 4Н), 6,06 (с, 0,36Н, олефиновый протон Е-изомера), 6,66-6,95 (комплекс, 10,64Н), 7,75 (д, J=8,76 Гц, 2Н).
Пример 4
Метил-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропаноат
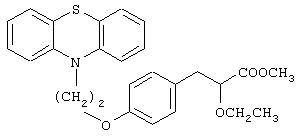
Названное в заголовке соединение (1,3 г, 94%) получают в виде смолообразной жидкости из этил-(E/Z)-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксиакрилата (1,43 г, 3,10 ммоль), полученного в примере 1, посредством процедуры, аналогичной описанной в препаративном примере 2.
1Н ЯМР (CDCl3, 200 МГц): δ 1,15 (т, J=7,0 Гц, 3Н), 2,93 (д, J=6,64 Гц, 2Н), 3,33-3,42 (комплекс, 1Н), 3,52-3,63 (комплекс, 1Н), 3,69 (с, 3Н), 3,97 (т, J=6,2 Гц, 1Н), 4,29 (с, 4Н), 6,81 (д, J=8,62 Гц, 2Н), 6,92-6,96 (комплекс, 4Н), 7,12-7,22 (комплекс, 6Н).
Пример 5
Метил-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропаноат
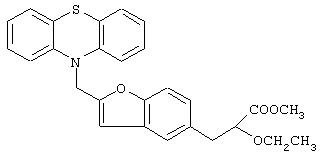
Названное в заголовке соединение (1,0 г, 68%) получают в виде смолы из этил-(E/Z)-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксиакрилата (1,5 г, 3,0 ммоль), полученного в примере 2, посредством процедуры, аналогичной описанной в препаративном примере 2.
1Н ЯМР (СDСl3, 200 МГц): δ 1,16 (т, J=7,0 Гц, 3Н), 3,07 (д, J=6,55 Гц, 2Н), 3,30-3,49 (комплекс, 1Н), 3,56-3,68 (комплекс, 1Н), 3,70 (с, 3Н), 4,05 (т, J=6,3 Гц, 1Н), 5,13 (с, 2Н), 6,48 (с, 2Н), 6,79-7,48 (комплекс, 11Н).
Пример 6
Метил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат

Способ А
Названное в заголовке соединение (0,68 г, 52%) получают в виде белого твердого вещества из этил-(E/Z)-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксиакрилата (1,3 г, 2,9 ммоль), полученного в примере 3, посредством процедуры, подобной описанной в препаративном примере 2. Т.пл. 88-90°С.
Способ В
Смесь 2-(феноксазин-10-ил)этилметансульфоната (1,75 г, 5,0 ммоль), метил-3-(4-гидроксифенил)-2-этоксипропаноата (1,5 г, 0,68 ммоль) и карбоната калия (3,16 г) в сухом диметилформамиде (20 мл) перемешивают при 80°С в течение 12 час. Реакционную смесь охлаждают до комнатной температуры (прибл. 25°С). Добавляют воду (30 мл) и смесь экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают водой (50 мл), сушат (Na2SO4) и упаривают. Остаток хроматографируют с использованием смеси этилацетата и петролейного эфира (1:9) и получают названное в заголовке соединение (1,15 г, 47%) в виде белого твердого вещества. Т.пл. 89-90°С. Данные1H ЯМР соответствуют требуемому продукту (см. выше).
1H ЯМР (СDСl3, 200 МГц): δ 1,16 (т, J=6,92 Гц, 3Н), 2,96 (д, J=6,64 Гц, 2Н), 3,22-3,40 (комплекс, 1Н), 3,51-3,66 (комплекс, 1Н), 3,68 (с, 3Н), 4,00 (т, J=7,0 Гц, 1Н), 4,18 (комплекс, 4Н), 6,55-6,89 (комплекс, 10Н), 7, 12 (д, J=8,63 Гц, 2Н).
Пример 7
Этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноат

Способ А
К раствору полученного в примере 3 этил-(E/Z)-3-[4-2-(феноксазин-10-ил)этокси]фенил]-2-этоксиакрилата (1,0 г, 2,24 ммоль) в диоксане (50 мл) добавляют 10% Pd/C (0,25 г) и смесь перемешивают при 25°С при давлении водорода ~414 кПа в течение 24 час. По окончании этого времени реакционную смесь фильтруют и испаряют растворитель при пониженном давлении. Остаток обрабатывают петролейным эфиром и получают названное в заголовке соединение (0,96 г, 96%) в виде белого твердого вещества. Т.пл. 51-53° С.
1H ЯМР (CDCl3, 200 МГц): δ 1,12-1,27 (комплекс, 6Н), 2,94 (д, J=6,31 Гц, 2Н), 3,26-3,41 (комплекс, 1Н), 3,52-3,75 (комплекс, 1Н), 3,96 (т, J=6, 64 Гц, 2Н), 4,10-4,28 (комплекс, 5Н), 6,55-6,92 (комплекс, 10Н), 7,16 (д, J=8,39 Гц, 2Н).
Способ В
Названное в заголовке соединение (0,55 г, 75%) получают в виде белого твердого вещества из 2-(феноксазин-10-ил)этилметансульфоната (0,5 г, 1,63 ммоль) и этил-3-(4-гидроксифенил)-2-этоксипропаноата (0,46 г, 1,9 ммоль), полученного в препаративном примере 4, посредством процедуры, подобной описанной в примере 6 (способ В). Т.пл. 52-53°С. Данные1Н ЯМР соответствуют требуемому продукту (см. выше).
Способ С
К суспензии гидрида натрия (60% дисперсия в масле) (0,098 г, 4,0 ммоль) в сухом диметилформамиде (3 мл) в атмосфере азота при 0°С добавляют раствор феноксазина (0,3 г, 1,6 ммоль) в сухом диметилформамиде (5 мл) и перемешивание продолжают еще в течение 30 мин приблизительно при 25°С. К полученной реакционной смеси при 0°С добавляют раствор полученного в препаративном примере 10 этил-3-[4-(2-бромэтокси)фенил]-2-этоксипропаноата (0,85 г, 2,4 ммоль) в сухом диметилформамиде (5 мл) и перемешивание продолжают еще в течение 10 час приблизительно при 25°С. Добавляют воду (40 мл) и смесь экстрагируют этилацетатом (2×30 мл). Объединенные органические экстракты промывают водой (25 мл), рассолом (25 мл), сушат (Na2SO4), фильтруют и упаривают. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира (1:9) и получают названное в заголовке соединение (0,3 г, 40%) в виде бесцветного твердого вещества. Т.пл. 52-53°С. Данные1Н ЯМР соответствуют требуемому продукту (см. выше).
Пример 8
Этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропаноат
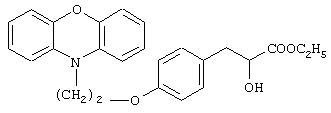
Названное в заголовке соединение (1,06 г, 43%) получают в виде бледно-желтой жидкости из 2-(феноксазин-10-ил)этилметансульфоната (1,8 г, 5,9 ммоль) и этил-2-гидрокси-3-(4-гидроксифенил)пропаноата (1,36 г, 6,49 ммоль) посредством процедуры, аналогичной описанной в примере 6 (способ В).
1H ЯМР (CDCl3, 200 МГц): δ 1,29 (т, J=6, 96 Гц, 3Н), 2,85-3,12 (комплекс, 2Н), 3,92 (ушс, 2Н), 4,10-4,27 (комплекс, 4Н), 4,39 (т, J=6,1 Гц, 1Н), 6,68-6,89 (комплекс, 10Н), 7,13 (д, J=8,39 Гц, 2Н), протон ОН слишком уширен для наблюдения.
Пример 9
Этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропаноат
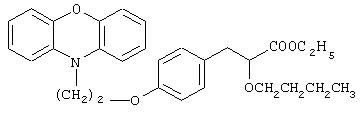
Названное в заголовке соединение (0,25 г, 53%) получают в виде бесцветной жидкости из 2-(феноксазин-10-ил)этилметансульфоната (0,3 г, 0,98 ммоль) и этил-2-бутокси-3-(4-гидроксифенил)пропаноата (0,26 г, 0,97 ммоль), полученного в препаративном примере 6, посредством процедуры, аналогичной описанной в примере 6 (способ В).
1H ЯМР (CDCl3, 200 МГц): δ 0,92 (т, J=6,4 Гц, 3Н), 1,21-1,39 (комплекс, 5Н), 1,45-1,58 (комплекс, 2Н), 2,94 (д, J=6,32 Гц, 2Н), 3,24-3,31 (комплекс, 1Н), 3,50-3,57 (комплекс, 1Н), 3,94 (т, J=6,13 Гц, 1Н), 4,13-4,23 (комплекс, 6Н), 6,61-6,84 (комплекс, 10Н), 7,16 (д, J=8,3 Гц, 2Н).
Пример 10
Этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропаноат
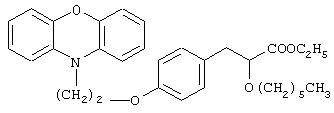
Названное в заголовке соединение (0,52 г, 53%) получают в виде бледно-желтого масла из 2-(феноксазин-10-ил)этилметансульфоната (0,6 г, 1,97 ммоль) и этил-3-(4-гидроксифенил)-2-гексилпропаноата (0,70 г, 2,4 ммоль), полученного в препаративном примере 8, посредством процедуры, аналогичной описанной в примере 6 (способ В).
1H ЯМР (CDCl3, 200 МГц): δ 0,85 (т, J=6,0 Гц, 3Н), 1,20-1,27 (комплекс, 7Н), 1,48-1,57 (комплекс, 4Н), 2,94 (д, J=6,0 Гц, 2Н), 3,21-3,30 (комплекс, 1Н), 3,52-3,56 (комплекс, 1Н), 3,90-3,99 (комплекс, 3Н), 4,13-4,22 (комплекс, 4Н), 6, 60-6,83 (комплекс, 10Н), 7,15 (д, J=8,62 Гц, 2Н).
Пример 11
3-[4-[2-(Фенотиазин-10-ил)этокси]фенил]-2-этоксипропановая кислота
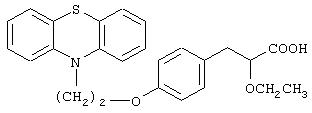
К раствору полученного в примере 4 метил-3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропаноата (7,5 г, 16,70 ммоль) в метаноле (50 мл) добавляют водный 10% раствор гидроксида натрия (20 мл). Реакционную смесь перемешивают приблизительно при 25°С в течение 3 час. Растворитель удаляют при пониженном давлении, остаток подкисляют 2 н. соляной кислотой и экстрагируют этилацетатом (2×100 мл). Объединенный этилацетатный экстракт промывают водой (50 мл), рассолом (50 мл), сушат (Na2 SO4), фильтруют и испаряют растворитель при пониженном давлении. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси дихлорметана и метанола (9:1) и получают названное в заголовке соединение (6,0 г, 83%) в виде белого твердого вещества. Т.пл. 79-82°С.
1H ЯМР (CDCl3, 200 МГц): δ 1,18 (т, J=6,8 Гц, 3Н), 2,88-3,11 (комплекс, 2Н), 3,39-3,64 (комплекс, 2Н), 4,06 (дд, J=9,2 и 4,3 Гц, 1Н), 4,30 (с, 4Н), 5,30-5,98 (ушс, 1Н, способен к обмену с D2O), 6,80-7,02 (комплекс, 6Н), 7,12-7,21 (комплекс, 6Н).
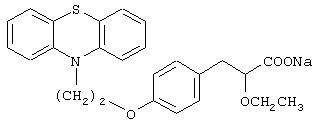
Пример 12
Натриевая соль 3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропановой кислоты
Смесь 3-[4-[2-(фенотиазин-10-ил)этокси]фенил]-2-этоксипропановой кислоты (0,3 г, 0,689 ммоль) и метоксида натрия (0,041 г, 0,758 ммоль) в метаноле (5 мл) перемешивают приблизительно при 25°С в течение 2 час. Растворитель удаляют при пониженном давлении и остаток обрабатывают сухим диэтиловым эфиром (3×10 мл). Выпавшее в осадок твердое вещество отфильтровывают, промывают сухим диэтиловым эфиром (2×5 мл) и сушат при пониженном давлении над Р2О5, получают названное в заголовке соединение (0, 25 г, 89%) в виде белого твердого вещества. Т.пл. 188-191°С.
1Н ЯМР (ДМСО-d6, 200 МГц): δ 1,04 (т, J=6, 9 Гц, 3Н), 2,71-2,89 (комплекс, 1Н), 2,90-3,06 (комплекс, 1Н), 3,16-3,30 (комплекс, 1Н), 3,36-3,54 (комплекс, 1Н), 3,88-3,91 (комплекс, 1Н), 4,21 (с, 4Н), 6,72 (д, J=8,3 Гц, 2Н), 6,89-6,99 (комплекс, 4Н), 7,05-7,21 (комплекс, 6Н).
Пример 13
3-[2-(Фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропановая кислота
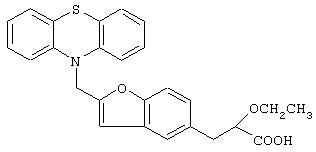
Названное в заголовке соединение (0,8 г, 83%) получают в виде белого твердого вещества из метил-3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропаноата (1,0 г, 2,0 ммоль), полученного в примере 5, посредством процедуры, аналогичной описанной в примере 11. Т.пл. 120-121°С. Протон СООН слишком уширен для наблюдения.
1H ЯМР (CDCl3, 200 МГц): δ 1,15 (т, J=6, 95 Гц, 3Н), 3,00-3,26 (комплекс, 2Н), 3,40-3,68 (комплекс, 2Н), 4,08 (т, J=4,47 Гц, 1Н), 5,11 (с, 2Н), 6,46 (с, 1Н), 6,77-7,40 (комплекс, 11Н).
Пример 14
Натриевая соль 3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропановой кислоты
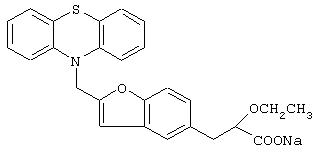
Названное в заголовке соединение (0,12 г, 67%) получают в виде белого твердого вещества из 3-[2-(фенотиазин-10-ил)метилбензофуран-5-ил]-2-этоксипропановой кислоты (0,16 г, 0,38 ммоль), полученной в примере 13, посредством процедуры, аналогичной описанной в примере 12. Т.пл. 258-261°С.
1H ЯМР (СDСl3, 200 МГц): δ 2,89-3,02 (комплекс, 1Н), 3,06-3,18 (комплекс, 1Н), 3,22-3,31 (комплекс, 1Н), 3,50-3,61 (комплекс, 1Н), 5,25 (с, 2Н), 6,64 (с, 1Н), 6,90-7,39 (комплекс, 11Н).
Пример 15
3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-этоксипропановая кислота
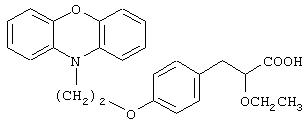
Названное в заголовке соединение (5,4 г, 77%) получают в виде белого твердого вещества из метил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропаноата (7,5 г, 16,8 ммоль), полученного в примере 6, посредством процедуры, подобной описанной в примере 11. Т.пл. 90-92°С.
1H ЯМР (СDСl3, 200 МГц): δ 1,19 (т, J=7,0 Гц, 3Н), 2,90-3,18 (комплекс, 2Н), 3,41-3,62 (комплекс, 2Н), 3,90-4,10 (комплекс, 3Н), 4,18 (т, J=6,2 Гц, 2Н), 6,58-6,89 (комплекс, 10Н), 7,16 (д, J=8,4 Гц, 2Н), протон СООН слишком уширен для наблюдения.
Пример 16
Натриевая соль 3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропановой кислоты
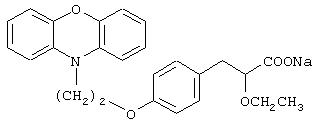
Названное в заголовке соединение (0,27 г, 85%) получают в виде белого твердого вещества из 3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропановой кислоты (0,3 г, 0,72 ммоль), полученной в примере 15, посредством процедуры, аналогичной описанной в примере 12. Т.пл. 194-202°C.
1H ЯМР (СDСl3, 200 МГц): δ 0,92 (т, J=6, 97 Гц, 3Н), 2,65-2,82 (комплекс, 1Н), 2,96-3,14 (комплекс, 2Н), 3,31-3,41 (комплекс, 1Н), 3,70-3,90 (комплекс, 3Н), 3,94-4,04 (комплекс, 2Н), 6,47-6,74 (комплекс, 10Н), 7,05 (д, J=8,3 Гц, 2Н).
Пример 17
3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-гидроксипропановая кислота

Названное в заголовке соединение (0,40 г, 72%) получают в виде коричневой жидкости из этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гидроксипропаноата (0,6 г, 1,43 ммоль), полученного в примере 8, посредством процедуры, аналогичной описанной в примере 11.
1Н ЯМР (CDCl3, 200 МГц): δ 2,75 (ушс, 1Н, способен к обмену с D2O), 2,86-3,23 (комплекс, 2Н), 3,85 (т, J=6,0 Гц, 2Н), 4,18 (т, J=5,9 Гц, 2Н), 4,47 (комплекс, 1Н), 6,58-6,89 (комплекс, 10Н), 7,17 (д, J=8,63 Гц, 2Н), протон СООН слишком уширен для наблюдения.
Пример 18
3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-бутоксипропановая кислота

Названное в заголовке соединение (0,13 г, 69%) получают в виде твердого вещества кремового цвета из этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропаноата (0,2 г, 0,42 ммоль), полученного в примере 9, посредством процедуры, аналогичной описанной в примере 11. Т.пл. 84-88°С.
1H ЯМР (СDСl3, 200 МГц): δ 0,88 (т, J=7,5 Гц, 3Н), 1,26-1,47 (комплекс, 2Н), 1,47-1,66 (комплекс, 2Н), 2,87-3,16 (комплекс, 2Н), 3,35-3,58 (комплекс, 2Н), 3,88-4,08 (комплекс, 3Н), 4,15 (т, J=6,4 Гц, 2Н), 6,65-6,86 (комплекс, 10Н), 7,15 (д, J=8,63 Гц, 2Н), протон СООН слишком уширен для наблюдения.
Пример 19
Натриевая соль 3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропановой кислоты
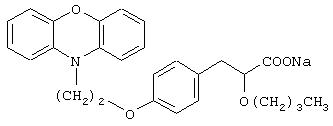
Названное в заголовке соединение (0,07 г, 83%) получают в виде гигроскопического твердого вещества кремового цвета из 3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-бутоксипропановой кислоты (0,08 г, 0,178 ммоль), полученной в примере 18, посредством процедуры, аналогичной описанной в примере 12.
1H ЯМР (ДМСО-d6, 200 МГц): δ 0,78 (т, J=7,28 Гц, 3Н), 1, 19-1,52 (комплекс, 4Н), 2,72-3,02 (комплекс, 2Н), 3,45-3,67 (комплекс, 2Н), 4,01 (ушс, 3Н), 4,18 (ушс, 2Н), 6,61-6,89 (комплекс, 8Н), 7,10-7,24 (комплекс, 4Н).
Пример 20
3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-гексилоксипропановая кислота
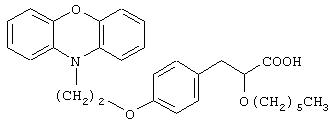
Названное в заголовке соединение (0,10 г, 23%) получают в виде сиропообразной жидкости из этил-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-гексилоксипропаноата (0,46 г, 0,96 ммоль), полученного в примере 10, посредством процедуры, аналогичной описанной в примере 11.
1H ЯМР (СDСl3, 200 МГц): δ 0,86 (т, J=6,0 Гц, 3Н), 1,18-1,30 (комплекс, 4Н), 1,42-1,80 (комплекс, 4Н), 2,88-3,18 (комплекс, 2Н), 3,32-3,60 (комплекс, 2Н), 3,89-4,09 (комплекс, 3Н), 4,16 (т, J=6,0 Гц, 2Н), 6,58-6,89 (комплекс, 10Н), 7,14 (д, J=8,63 Гц, 2Н), СООН слишком уширен для наблюдения.
Пример 21
[(2R)-N(1S)]-3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид (21a)
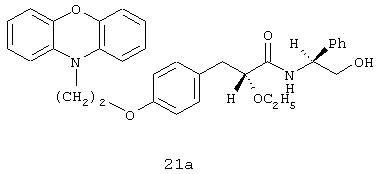
[(2S)-N(1S)]-3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид (21b)
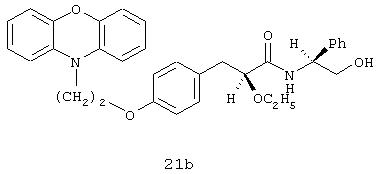
При охлаждении льдом к раствору полученной в примере 15 3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этоксипропановой кислоты (1,2 г, 2,9 ммоль) и триэтиламина (0,48 г, 5,8 ммоль) в сухом дихлорметане (25 мл) добавляют пивалоилхлорид (0,38 г, 3,19 ммоль) и перемешивание продолжают при 0°С еще в течение 30 мин. К полученной реакционной смеси при 0°С добавляют смесь (S)-2-фенилглицинола (0,39 г, 2,9 ммоль) и триэтиламина (0,58 г, 5,8 ммоль) в дихлорметане (20 мл) и продолжают перемешивание в течение 2 час при 25°С. Добавляют воду (50 мл) и смесь экстрагируют дихлорметаном (2×50 мл). Органические экстракты промывают водой (2×25 мл) и рассолом (25 мл), сушат (Na2SO4) и упаривают. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира с градиентом этилацетата от 40 до 60% и получают сначала диастереомер, предварительно обозначенный как [2R, N(1S)]-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид (0,55 г, 35%) (21а), а затем [2S-N(1S)]-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамид (0,5 г, 32%) (21b).
21а: т.пл. 126-128°С;
[α]=+24,6 (с=1,0%, СНСl3).
1Н ЯМР (CDCl3, 200 МГц): δ 1,16 (т, J=7,20 Гц, 3Н), 2,50 (ушс, 1Н, способен к обмену с D2O), 2,92-3,20 (комплекс, 2Н), 3,52 (к, J=7,05 Гц, 2Н), 3,72 (ушс, 2Н), 3,99 (комплекс, 3Н), 4,21 (т, J=6,64 Гц, 2Н), 4,98-5,01 (комплекс, 1Н), 6,64-6,70 (комплекс, 5Н), 6,73-6,89 (комплекс, 4Н), 7,03 (д, J=7,15 Гц, 1Н), 7,18-7,29 (комплекс, 4Н), 7,32-7,39 (комплекс, 3Н), CONH слишком уширен для наблюдения.
21b: т.пл. 139-141°С;
[α]
1H ЯМР (CDCl3, 200 МГц): δ 1,18 (т, J=6,96 Гц, 3Н), 2,05 (ушс, 1Н, способен к обмену с D2O), 2,80-3, 14 (комплекс, 2Н), 3,54 (к, J=7,0 Гц, 2Н), 3,85 (ушс, 2Н), 3,97 (комплекс, 3Н), 4,14 (т, J=6,23 Гц, 2Н), 4,92-5,01 (комплекс, 1Н), 6,62-6,85 (комплекс, 9Н), 7,02-7,20 (комплекс, 5Н), 7,26-7,30 (комплекс, 3Н), CONH слишком уширен для наблюдения.
Пример 22
(R)-3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-этоксипропановая кислота
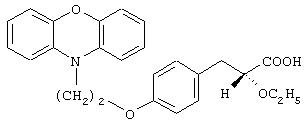
Раствор полученного в примере 21а диастереомера [(2R)-N(1S)]-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамида (0,45 г, 0,84 ммоль) в смеси 1 М серной кислоты (17 мл) и смеси диоксана и воды (1:1, 39 мл) греют на масляной бане при 100°С в течение 60-68 час. Доводят рН смеси до 3,0 посредством добавления водного раствора гидрокарбоната натрия. Смесь экстрагируют этилацетатом (2×25 мл), органический экстракт промывают водой (50 мл), рассолом (25 мл), сушат (Na2SO4) и упаривают. Остаток хроматографируют на силикагеле с использованием градиента этилацетата в петролейном эфире от 50 до 75% и получают названное в заголовке соединение (0,2 г, 57%) в виде белого твердого вещества. Т.пл. 77-78°С.
[α]
1H ЯМР (CDCl3, 200 МГц): δ 1,16 (т, J=7,0 Гц, 3Н), 1,43-1,85 (ушс, 1Н, способен к обмену с D2O), 2,86-3,14 (комплекс, 2Н), 3,40-3,67 (комплекс, 2Н), 3,90-4,08 (комплекс, 3Н), 4,15 (т, J=6,65 Гц, 2Н), 6,59-6,83 (комплекс, 10Н), 7,13 (д, J=8,4 Гц, 2Н).
Пример 23
(S)-3-[4-[2-(Феноксазин-10-ил)этокси]фенил]-2-этоксипропановая кислота

Названное в заголовке соединение (0,19 г, 54%) получают в виде белого твердого вещества из диастереомера [(2S-N(1S)]-3-[4-[2-(феноксазин-10-ил)этокси]фенил]-2-этокси-N-(2-гидрокси-1-фенилэтил)пропанамида (0,45 г, 0,84 ммоль), полученного в примере 21b, посредством процедуры, аналогичной описанной в примере 22. Т.пл. 89-90°С.
[α]
1H ЯМР (СDСl3, 200 МГц): δ 1,16 (т, J=7,02 Гц, 3Н), 1,42-1,91 (ушс, 1Н, способен к обмену с D2O), 2,94-3,15 (комплекс, 2Н), 3,40-3,65 (комплекс, 2Н), 3,86-4,06 (комплекс, 3Н), 4,15 (т, J=6,65 Гц, 2Н), 6,63-6,83 (комплекс, 10Н), 7,13 (д, J=8,54 Гц, 2Н).
Соединения настоящего изобретения снижают рандомизированные содержания в крови сахара, триглицеридов, общий холестерин, LDL, VLDL и повышают HDL. Это демонстрируется экспериментами in vitro, а также in vivo на животных.
Демонстрация эффективности соединений
A) in vitro
а) Определение hPPARα-активности
Область связывания лиганда hPPARα сливают с областью связывания ДНК фактора транскрипции дрожжей GAL4 в эукариотном экспрессирующем векторе. С использованием суперфекта (Qiagen, Германия) в качестве реагента трансфекции клетки НЕК-393 трансфектируют указанной плазмидой и репортерной плазмидой, содержащей ген люциферазы, управляемый специфическим промотором GAL4. Соединение добавляют в разных концентрациях через 42 часа после трансфекции и проводят инкубацию в течение ночи. Люциферазную активность как функцию связывающей/активирующей способности hPPARα измеряют с использованием набора Packard Luclite (Packard, США) в Top Count (Ivan Sadowski, Brendan Bell, Peter Broag and Melvyn Hollis, Gene, 1992, 118: 137-141; Superfect Transfection Reagent Handbook, February, 1997, Qiagen, Germany).
б) Определение hPPARγ -активности
Область связывания лиганда hPPARγ сливают с областью связывания ДНК фактора транскрипции дрожжей GAL4 в эукариотном экспрессирующем векторе. С использованием липофектамина (Gibco BRL, США) в качестве реагента трансфекции клетки НЕК-393 трансфектируют указанной плазмидой и репортерной плазмидой, содержащей ген люциферазы, управляемый специфическим промотором GAL4. Соединение добавляют в концентрации 1 мкМ через 48 часов после трансфекции и проводят инкубацию в течение ночи. Люциферазную активность как функцию связывающей/активирующей способности hPPARy измеряют с использованием набора Packard Luclite (Packard, США) в Packard Top Count (Ivan Sadowski, Brendan Bell, Peter Broag and Melvyn Hollis, Gene, 1992, 118: 137-141; Guide to Eukaryotic Transfections with Cationic Lipid Reagents, Life Technologies, GIBCO BRL, USA), см. табл.1.

в) Определение ингибирующей активности в отношении HMG СоА-редуктазы. Редуктазу, связанную микросомами печени, получают от крыс, которых кормили с добавлением 2% холестирамина, при 12-часовом цикле чередования освещения и темноты. Спектрофотометрические анализы осуществляют в смеси, содержащей 100 мМ КН2РO4, 4 мМ DTT, 0,2 мМ NaDPH, 0,3 мМ HMG CoA и 125 мкг микросомального фермента печени. Общий объем реакционной смеси составляет 1 мл. Реакцию начинают посредством добавления HMG CoA. Реакционную смесь инкубируют при 37°С в течение 30 мин и регистрируют снижение поглощения при 340 нм. В качестве "пустышки" используют реакционную смесь без субстрата (Goldstein J.L. and Brown M.S., Progress in understanding the LDL receptor and HMG CoA reductase, two membrane proteins that regulate the plasma cholesterol, J. Lipid Res., 1984, 25: 1450-1461). Испытываемые соединения ингибируют фермент HMG СоА-редуктазу.
В) In vivo
а) Эффективность на генетических моделях
С помощью мутации колоний экспериментальных животных и различной чувствительности к режимам кормления разработаны животные модели с инсулиннезависимым диабетом и гиперлипидемией, связанными с ожирением и возможной инсулинорезистентностыо. Генетические модели, такие как мыши db/db и ob/ob (Diabets (1982), 31(1): 1-6) и крысы zuker fa/fa, разработаны различными лабораториями для понимания патофизиологии болезни и испытания эффективности новых противодиабетических соединений (Diabets (1983), 32: 830-838; Annu. Rep. Sankyo Res. Lab. (1994), 46: 1-57). Гомозиготные животные мыши С57 BL/KsJ-db/db, выведенные Jackson Laboratory, США, страдают ожирением, являются гипергликемичными, гиперинсулинемичными и инсулинорезистентными (J. Clin. Invest. (1990), 85: 962-967), в то время как гетерозиготные животные не страдают ожирением и являются нормогликемичными. На модели db/db у мышей с возрастом прогрессивно развивается инсулинопения - признак, обычно наблюдаемый на поздних стадиях диабета типа II у человека, когда содержание сахара в крови регулируется в недостаточной мере. Состояние поджелудочной железы и его развитие изменяются в соответствии с моделями. Так как данная модель походит на модель сахарного диабета типа II, соединения настоящего изобретения испытывают на активность снижения содержание в крови сахара и триглицеридов.
В этом эксперименте используют самцов мышей C57BL/KsJ-db/db в возрасте 8-14 недель с массой тела в интервале 35-60 г, разводимых в помещении для животных исследовательской организации д-ра Редди (DRF). Мышам дают стандартный корм (National Institute of Nutrition (NIN), Хайдарабад, Индия) и подкисленную воду ad libitum. Для испытаний используют животных с содержанием сахара в крови свыше 350 мг/дл. Число животных в каждой группе равно 4.
Испытываемые соединения суспендируют в 0,25% растворе карбоксиметилцеллюлозы и вводят испытываемой группе при дозе от 0,1 до 30 мг/кг перорально через желудочный зонд в течение 6 дней. Контрольная группа получает носитель (доза 10 мл/кг). На 6 день для оценки биологической активности берут образцы крови через час после введения испытываемых соединений или носителя.
Рандомизированное содержание в крови сахара и триглицеридов измеряют посредством забора крови (100 мкл) из глазничной полости с использованием гепаринизированного капилляра в пробирки, содержащие ЭДТК, затем подвергают их центрифугированию и получают плазму. Содержание в плазме глюкозы и триглицеридов измеряют спекрометрически глюкозооксидазным методом и методом с глицерол-3-РO4-оксидазой/пероксидазой соответственно (Dr. Reddy’s Lab. Diagnostic Division Kits, Хайдарабад, Индия).
Снижающую активность испытываемых соединений в отношении содержания в крови сахара и триглицеридов рассчитывают в соответствии с формулой.
При описанном выше испытании не наблюдается какого-либо вредного действия указанных соединений изобретения (см. табл.2).

Мышей ob/ob получают в возрасте 5 недель от Bomholtgard, Дания, и используют их в возрасте 8 недель. Жирных крыс zucker fa/fa получают от IffaCredo, Франция, в возрасте 10 недель, и используют их в возрасте 13 недель. Животных содержат при 12-часовом цикле смены освещения и темноты при 25±1°С. Животным дают стандартный корм (NIN, Хайдарабад, Индия) и воду ad libitum (Fujiwara Т., Yoshioka S., Yoshioka Т., Ushiyama I. and Horikoshi H., Characterization of new oral antidiabetic agent CS-045. Studies in KK and ob/ob mice and Zucker fatty rats, Diabetes, 1988, 37: 1549-1558).
Испытываемые соединения вводят при дозе 0,1-30 мг/кг в сутки в течение 9 дней. Контрольные животные получают носитель (0,25% раствор карбоксиметилцеллюлозы, доза 10 мл/кг) перорально через желудочный зонд.
Образцы крови берут в сытом состоянии через 1 час после введения лекарственного средства в 0 и 9 день обработки. Кровь отбирают из заглазничной полости через гепаринизированный капилляр в пробирки, содержащие ЭДТК. После центрифугирования образец плазмы разделяют для оценки содержания триглицеридов, глюкозы, свободных жирных кислот, общего холестерина и инсулина. Измерения содержания в плазме триглицеридов, глюкозы и общего холестерина проводят с использованием коммерческих наборов (Dr. Reddy’s Laboratory, Diagnostic Division, Индия). Содержание свободных жирных кислот в плазме измеряют с использованием коммерческого набора от Boehringer Mannheim, Германия. Содержание инсулина в плазме измеряют с использованием набора RIA (BARC, Индия). Снижение различных проверяемых параметров вычисляют по формуле.
Испытание на пероральную толерантность к глюкозе мышей ob/ob проводят через 9 дней после обработки. Мышей не кормят в течение 5 час и вводят им перорально 3 мг/кг глюкозы. Образцы крови для оценки содержания глюкозы в плазме берут через 0, 15, 30, 60 и 120 мин.
Экспериментальные результаты, полученные на мышах db/db, ob/ob и крысах Zucker fa/fa приводят к мысли, что новые соединения настоящего изобретения также обладают терапевтической полезностью в качестве профилактического или регулярно применяемого лечебного средства в случае диабета, ожирения, сердечно-сосудистых нарушений, таких как гипертензия, гиперлипидемия, и других заболеваний, так как из литературы известно, что такие болезни взаимосвязаны.
При дозах свыше 10 мг/кг также снижается содержание в крови глюкозы и триглицеридов. Как правило, степень снижения зависит от дозы и при определенной дозе выходит на постоянный уровень.
b) Холестеринснижающая активность на крысиной модели гиперхолестеринемии
Самцов крыс Sprague Dawley (линия NIN) разводят в помещении для животных DRF. Животных содержат при 12-часовом цикле чередования освещения и темноты при 25±1°С. Для эксперимента используют крыс с массой тела 180-200 г. Животных делают гиперхолестеринемичными посредством скармливания 2% холестерина и 1% холата натрия, смешанных со стандартным лабораторным кормом [National Institute of Nutrition (NIN), Хайдарабад, Индия], в течение 6 дней. Во время всего периода эксперимента животных держат на этой же диете (Petit D., Bonnefis М.Т., Rey С. and Infante R., Effects of ciprofibrate on liver lipids and lipoprotein synthesis in normo- and hyperlipidemic rats. Atherosclerosis, 1988, 74: 215-225).
Испытываемые соединения вводят перорально при дозе 0,1-30 мг/кг в сутки в течение 3 дней. Контрольную группу обрабатывают одним носителем (0,25% раствор карбоксиметилцеллюлозы; доза 10 мл/кг).
Образцы крови берут в сытом состоянии через 1 час после введения лекарственного средства в 0 и 3 день обработки соединением. Кровь отбирают из заглазничной полости через гепаринизированный капилляр в пробирки, содержащие ЭДТК. После центрифугирования образец плазмы разделяют для оценки содержания общего холестерина, HDL и триглицеридов. Измерения содержания в плазме триглицеридов, общего холестерина и HDL проводят с использованием коммерческих наборов (Dr. Reddy’s Laboratory, Diagnostic Division, Индия). LDL- и VLDL-холестерин вычисляют из данных, полученных для общего холестерина, HDL и триглицеридов. Снижение различных проверяемых параметров вычисляют по формуле.
с) Снижающая активность в отношении содержания в плазме триглицеридов и общего холестерина на мышах Swiss albino и морских свинках
Самцов мышей Swiss albino (SAM) и морских свинок получают от NIN и содержат в помещении для животных DRF. Всех этих животных содержат при 12-часовом цикле чередования освещения и темноты при 25±1°С. Животным дают стандартный корм (NIN, Хайдарабад, Индия) и воду ad libitum. Используют SAM с массой тела 20-25 г и морских свинок с массой тела 500-700 г (Oliver P., Plancke M.O., Marzin D., Clavey V., Sauzieres J. and Fruchart J.C., Effects of fenofibrate, gemfibrozil and nicotinic acid on plasma lipoprotein levels in normal and hyperlipidemic mice, Atherosclerosis, 1988, 70: 107-114.
Испытываемые соединения вводят перорально мытам Swiss albino при дозе 0,3-30 мг/кг в сутки в течение 6 дней. Контрольных мышей обрабатывают носителем (0,25% раствор карбоксиметилцеллюлозы; доза 10 мл/кг). Морским свинкам испытываемые соединения вводят перорально при дозе 0,3-30 мг/кг в сутки в течение 6 дней. Контрольных животных обрабатывают носителем (0,25% раствор карбоксиметилцеллюлозы; доза 5 мл/кг).
Образцы крови берут в сытом состоянии через 1 час после введения лекарственного средства в 0 и 6 день обработки. Кровь отбирают из заглазничной полости через гепаринизированный капилляр в пробирки, содержащие ЭДТК. После центрифугирования образец плазмы разделяют для оценки содержания триглицеридов и общего холестерина (Wieland О., Methods of Enzymatic analysis, Bergermeyer, H.О., Ed., 1963, 211-214; Trinder P., Ann. Clin. Biochem., 1969, 6: 24-27). Измерения содержания в плазме триглицеридов, общего холестерина и HDL проводят с использованием коммерческих наборов (Dr. Reddy’s Laboratory, Diagnostic Division, Индия).
Формулы для вычислений
1. Процент снижения содержания в крови сахара, триглицеридов и общего холестерина вычисляют по формуле
ОС = величина в контрольной группе в день 0,
ОТ = величина в обработанной группе в день 0,
ТС = величина в контрольной группе в день испытаний,
ТТ = величина в обработанной группе в день испытаний.
2. Содержание LDL- и VLDL-холестерина вычисляют по формулам
LDL-холестерин, мг/дл = Общий холестерин - HDL-холестерин -

VLDL-холестерин, мг/дл = Общий холестерин - HDL-холестерин - LDL-холестерин.
Реферат
Изобретение относится к новым соединениям, которые могут быть использованы в медицине в качестве гиполипидемических или антигепергликемических средств. Описывается β-арил-α-оксизамещенная алкилкарбоновая кислота формулы (I)
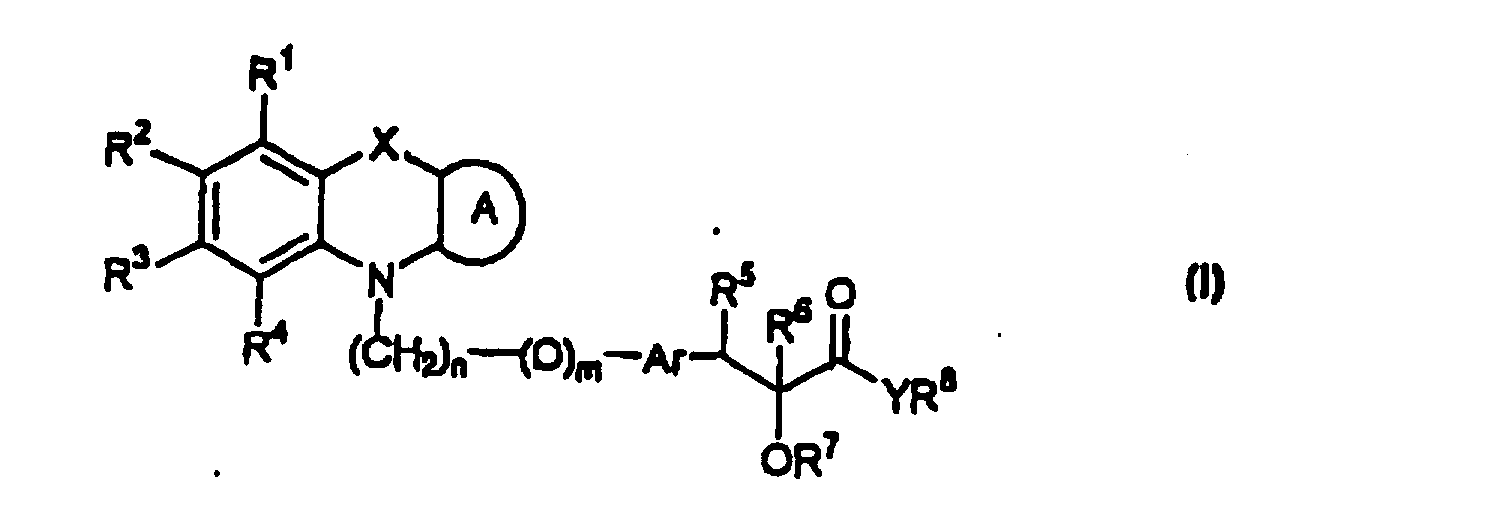
где R1, R2, R3 и R4 могут быть одинаковыми или различными и представляют водород, гидрокси, (C1-С3)-алкил; цикл А, сконденсированный с циклом, содержащим Х и N, представляет собой 6-членную ароматическую циклическую структуру, содержащую атомы углерода; Х представляет гетероатом, выбранный среди атомов кислорода и серы; Ar представляет двухвалентный фенилен, нафтилен или бензофуранил; R5 представляет водород; R6 представляет водород или R6 образует связь вместе с R5 ; R7 представляет водород или необязательно замещенный линейный или разветвленный (С1 -С16)-алкил; R8 представляет водород или необязательно замещенный линейный или разветвленный (С1-С16)-алкил; Y представляет кислород или NR10, где R10представляет водород, фенил, гидрокси-(С1-С16)-алкил; n равен целому числу в интервале 1-4 и m равен 0 или 1, или ее фармацевтически приемлемые соли или фармацевтически приемлемые сольваты. Также описываются промежуточные соединения, способы их получения, способы получения соединений формулы (I), фармацевтическая композиция на основе соединений формулы (I), способы лечения и предупреждения заболеваний на основе новых соединений. Технический результат – получены новые соединения, обладающие полезными биологическими свойствами. 22 н. и 9 з.п. ф-лы, 2 табл.
Формула
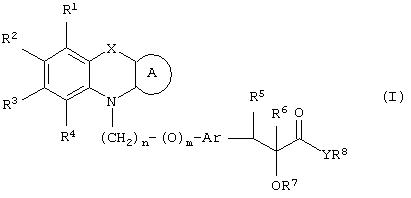
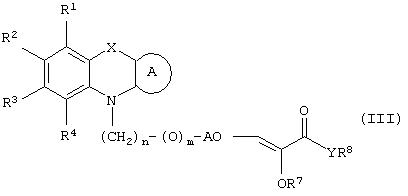
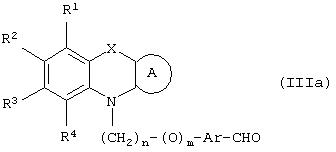
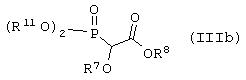
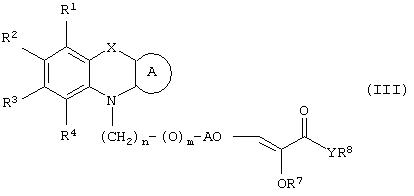
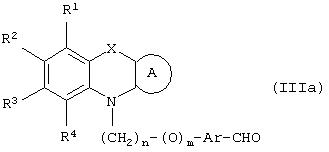
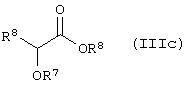
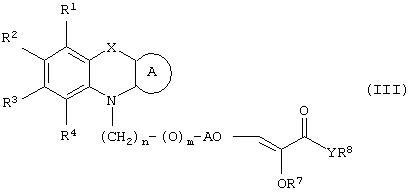
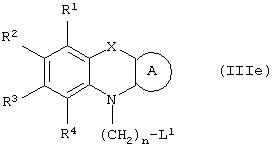
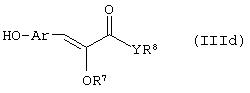
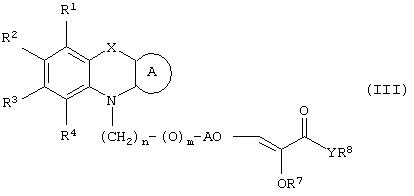
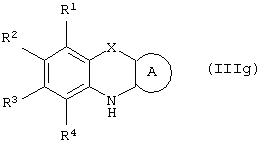
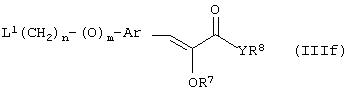
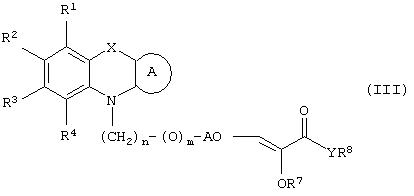
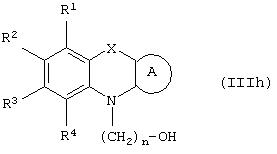
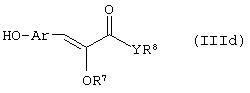
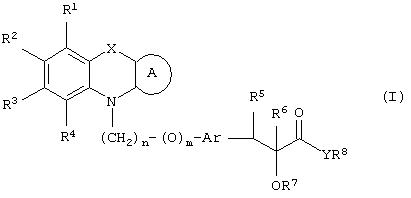
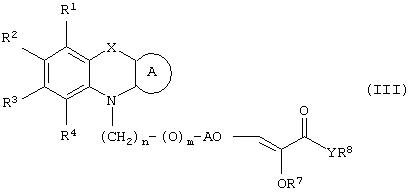
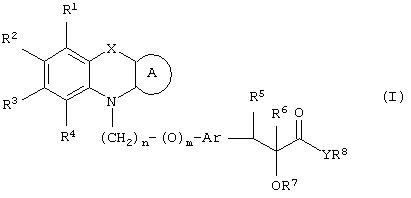

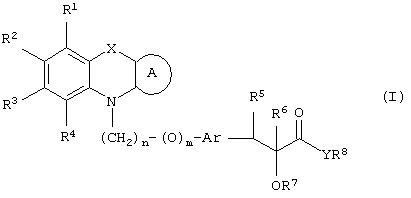
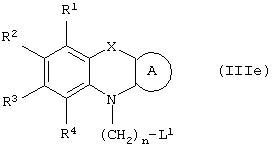
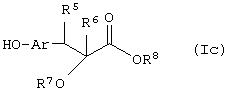
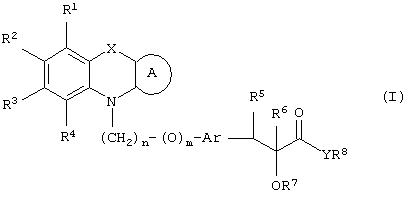


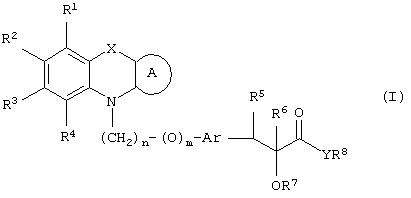

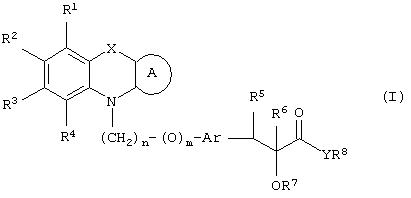
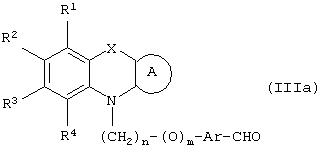
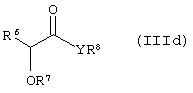
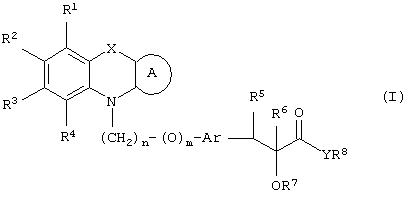
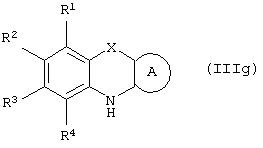
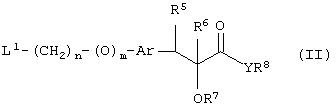
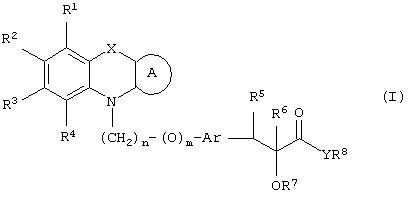
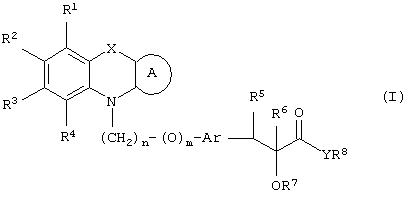

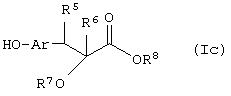
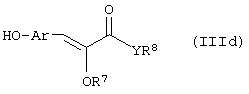


Комментарии