Бензоксазиновые или пиридооксазиновые соединения, способы их получения, промежуточные соединения, фармацевтические композиции, обладающие антибактериальной активностью, способы лечения бактериальных инфекций - RU2191179C2
Код документа: RU2191179C2
Чертежи





Описание
Изобретение относится к бензоксазиновым и пиридооксазиновым антибактериальным соединениям, фармацевтическим композициям, содержащим эти соединения, и способам их получения и применения. Эти соединения эффективны при ингибировании действия бактериальной гистидинпротеинкиназы и, следовательно, полезны в качестве антиинфекционных средств против ряда бактериальных организмов, включая организмы, которые устойчивы к другим известным антибиотикам.
Прокариоты регулируют транскрипцию многих их генов в ответ на изменения в окружающей среде организмов (J. В. Stock, A.M. Stock and J.M. Mottonen, Nature, 344, 395-400 (1990)). Такая регуляция существенна, если организм должен сам адаптироваться к выживанию в изменяемой окружающей среде, и патогенные бактерии используют такие системы регуляции, которые дают возможность им выживать в организме хозяина (J.F. Miller, J.J. Mekalanos, S. Falkow, Science, 243, 1059 (1989)). Можно предположить, что химические соединения, которые препятствуют механизмам регуляции, являются полезными противоинфекционными лекарственными средствами, так как они могут мешать бактериям обеспечивать необходимые адаптивные изменения в характере экспрессии генов.
Вирулентность, хемотаксис, продуцирование токсина, споруляция и репродукция являются примерами бактериальных процессов, которые находятся под контролем регуляции и которые могли бы ингибироваться такими соединениями. Предполагается, что ингибирование одного или нескольких этих процессов ведет к снижению вирулентности, замедлению или остановке бактериального роста и репродукции и даже к гибели бактериальных клеток, если прерываются жизненные функции.
Было показано, например, что виды Salmonella экспрессируют определенные белки при контроле регуляции и в ответ на присутствие кишечных эпителиальных клеток, которые дают возможность им прикрепляться к клеткам и заселять эти клетки. Бактерии, неспособные синтезировать эти белки, авирулентны: они не могут вызвать инфекцию у мышей (В.В. Finlay, F. Heffron, S. Falkow, Science, 243, 940-943 (1989)). Подобный эффект можно было бы ожидать, если бы гены, кодирующие эти белки, были интактными, но оставались неэкспрессированными.
Для выполнения адаптивных ответов на окружающую среду бактерии используют фосфорзависимые механизмы, называемые в данной области как "двухкомпонентные переключения". Эти переключения имеют в качестве общего эффекта передачу информации от окружающей среды к ядру клетки, где на эту информацию появляется ответ путем включения или выключения транскрипции соответствующих генов. Первая стадия этой схемы фосфорзависимого механизма основывается на действии различных ферментов гистидинпротеинкиназ (НРК). Большинство этих ферментов НРК являются сенсорными молекулами и реагируют на стимуляцию определенными сигналами окружающей среды путем переноса фосфата от АТФ к остатку гистидина НРК-белка. Некоторые ферменты НРК стимулируются присутствием рецепторных белков (описываются ниже), концентрация которых модулируется сигналами окружающей среды. В любом случае за этим автофосфорилированием следует перенос фосфата к остатку аспартила одного или нескольких акцепторных белков (вторые компоненты двухкомпонентного переключения), которые либо являются регуляторами экспрессии генов (путем связывания с регуляторными областями ДНК или с комплексом РНК-полимеразы), либо сами являются киназами для других акцепторных молекул. Эти вторичные акцепторы, в свою очередь, могут быть регуляторными белками или киназами еще для другого белка. Этот каскад переноса фосфата от белка к белку в конце концов приводит к фосфорилированию одного или нескольких регуляторных белков, которые затем регулируют экспрессию генов.
Клетки млекопитающих не используют или, по меньшей мере, в настоящее время неизвестно, что они используют НРК-управляемые системы фосфопередачи для регуляции гена. Таким образом, нельзя было бы ожидать, что соединения, которые селективно ингибируют либо автофосфорилирование РНК-белка, либо стадию(и) фосфопереноса, или то и другое, обладают нежелательным действием на организм хозяина и являются перспективными кандидатами на противоинфекционные лекарственные средства. Возникновение устойчивых к лекарственным средствам патогенных организмов, которые устойчивы к одному или нескольким доступным в настоящее время лекарственным средствам, создавало потребность в новых антибиотиках, которые действуют по механизмам, не связанным с механизмами доступных в настоящее время средств, и ингибиторы НРК могли бы удовлетворить эту потребность. Присутствие многочисленных РНК-управляемых систем (в настоящее известно свыше пятидесяти) в бактериях придает ингибиторам НРК потенциальное преимущество по сравнению с принятыми в настоящее время антибиотиками в том, что маловероятно, что мутация одного фермента НРК придаст организму устойчивость к лекарственному средству.
Недавно исследователи в этой области описали способ обнаружения генов бактериальной "вирулентности", которые селективно экспрессируются, когда бактерии инфицируют хозяина (M.J. Mahan, J.M. Slauch and J.J. Mekalanos, Science, 259, 686-688 (1993)). Упоминалось возможное использование этой информации в разработке новых антибиотиков, но фактические методы снижения экспрессии этих генов не были описаны. В предварительном сообщении другой группы исследователей описываются ингибиторы двухкомпонентного переключения, регулирующего активацию гена альгината в Pseudomonas aeruginosa в системе in vitro (S. Roychoudhury et al., Proc. Nat. Acad. Sci., 90, 965-969 (1993)), но не сообщается о антибактериальной активности этих соединений.
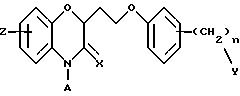
Изобретение представляет соединения общей структуры I

где часть Q - конденсированный фенил или конденсированный пиридил;
Z1 - водород, галоген, C1-C6-алкил, C1-C6-алкокси, фенил, гидрокси, амино, нитро, сульфониламино или трифторметил;
Z2 - водород или галоген;
Х - водород или кислород;
А - C1-C6-алкил, C1-C6-лкиларил или C1-C6-алкилгетероциклил, где арил представляет бифенил, нафтил или фенил и гетероциклил представляет 5- или 6-членную насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 атома азота, атом кислорода или серы; где эта арильная или гетероциклильная группа необязательно замещена (C1-C6) алкилом, бензилом, оксибензилом, фенокси, гидрокси, алкокси, галогеном, двумя атомами галогена, нитро, амино, карбоксилом, кapбo(C1-C6)алкокси или метилсульфониламино;
n = 0 - 3;
Y выбирают из
(а) NHR1R2, N+R1R2R3,
(б)
(в) CO2H, CHO;
(г) СН(R6)СО2Н, СН(R6)СO2СН3, CH=CHR7, CH=C(CO2H)2;
(д) остатка формулы
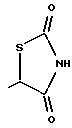
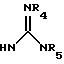
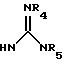
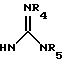
(е) 5-тетразолила; где R1, R2 и R3 независимо - водород, C1-C6-алкил или трет-бутоксикарбонил; R4 и R5 независимо - трет-бутоксикарбонил или водород или R4 и R5 могут быть соединены вместе с образованием кольца имидазолина, имидазолила или пиримидина; R6 - водород, гидрокси или хлор; R7 - СO2Н или С (О)NH(CH2)pOH, где р = 1 - 4,
и их фармацевтически приемлемые соли, эфиры и пролекарственные формы.
Данное изобретение касается способа лечения бактериальных инфекций у млекопитающих путем введения млекопитающему, страдающему такой инфекцией, терапевтически эффективного количества соединения, выбранного из соединений формулы I, эффективных в ингибировании действия бактериальной гистидинпротеинкиназы.
Соединения настоящего изобретения ингибируют автофосфорилирование бактериальных гистидинкиназ; они ингибируют также перенос фосфата от фосфорилированных гистидинкиназ к остаткам аспартилам белков-акцепторов фосфата, принимающих участие в регуляции бактериальной экспрессии генов. Стандартным способом, измерением минимальных ингибирующих концентраций (величины MIC), обнаружено, что соединения настоящего изобретения ингибируют рост бактерий. Соединения полезны в качестве бактериостатических и бактерицидных средств и в качестве противоинфекционных средств при лечении инфекционных болезней. Их можно также использовать для повышения восприимчивости бактерий к общепринятым антибиотикам.
Некоторые соединения формулы I предпочтительны.
Предпочтительными осуществлениями изобретения являются те соединения, где Q представляет конденсированный фенил.
Предпочтительные группы для А представляют C1-C5-алкил, СН2-фенил, СН2-тиенил, CH2-пиридил, СН2-фурил или этилпиперидин.
Предпочтительные группы для Y представляют
(a) NHR1R2, N+R1R2R3;
(б)
(в) СO2Н;
(г) СН(R6)СО2Н;
(д) остаток формулы

где R1, R2 и R3 независимо - водород, C1-C6-алкил или трет-бутоксикарбонил, R4 и R5 независимо - трет-бутоксикарбонил или водород; R6 - водород или гидрокси,
и их фармацевтически приемлемые соли, эфиры и пролекарственные формы.
Наиболее предпочтительны те соединения формулы I, где часть Q - конденсированный фенил; Z1
- водород, галоген, C1-C6-алкил, C1-C6-алкокси, фенил, гидрокси, амино, нитро, сульфониламино или трифторметил; Z2 - водород или, когда Z1 - галоген, Z2 - также галоген; Х - кислород;
А - C1-C5-алкил, CH2-фенил, СН2-тиенил, СН2-пиридил, СН2
-фурил или этилпиперидин, где этот фенил, тиенил, пиридил, фурил или пиперидиновая часть необязательно замещена (C1-C6) алкилом, бензилом, оксибензилом, фенокси, гидрокси,
алкокси, галогеном, двумя атомами галогена, нитро, амино, карбоксилом или карбометокси; n = 0 - 3;
Y - часть, выбранная из
(a) NHR1R2, N+R1
R2R3;
(б)
(в) СO2Н;
(г) СН(R6 )СO2Н;
(д) остатка формулы

где R1, R2 и R3 независимо - водород, C1-C6алкил или трет-бутоксикарбонил; R4 и R5 независимо - трет-бутоксикарбонил или водород; R6 - водород или гидрокси,
и их фармацевтически приемлемые соли, эфиры и пролекарственные формы.
Настоящее изобретение касается также некоторых новых промежуточных продуктов, пригодных для
получения конечных соединений. Таким образом, изобретение содержит промежуточные продукты следующей формулы
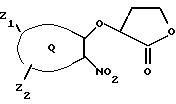
где часть Q - фенил или пиридил; Z1 - водород, галоген, C1-C6-алкил, C1-C6-алкокси, фенил, гидрокси, амино, нитро, сульфониламино или трифторметил и Z2 - водород или галоген.
Включены также промежуточные продукты общей формулы

где часть Q - фенил или пиридил и Z1 представляет водород, галоген, C1-C6-алкил, C1-C6-алкокси, фенил, гидрокси, амино, нитро, сульфониламино или трифторметил; Z2 представляет водород или галоген, А представляет C1-C6-алкиларил или C1-C6 -алкилгетероциклил, где арил представляет бифенил, нафтил или фенил и гетероциклил представляет 5- или 6-членную насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 атома азота, атом кислорода или серы; где эта арильная или гетероциклильная группа необязательно замещена (C1-C6)алкилом, бензилом, оксибензилом, фенокси, гидрокси, алкокси, галогеном, двумя атомами галогена, нитро, амино, карбоксилом, карбо(C1-C4)алкокси или метилсульфониламино; и R8 представляет водород или гидроксизащитную группу. Подходящие гидроксизащитные группы включают любые общепринятые защитные группы для гидроксигрупп, которые обычно используют специалисты данной области, такие как группы, указанные в Т. Greene, "Protecting Groups in Organic Synthesis", J. Wiley and Sons, 1981. Они включают силиловые сложные эфиры, алифатические сложные эфиры и ароматические сложные эфиры, такие как триметилсилил, трет-бутилдиметилсилил, ацетил, бензоил и тому подобное.
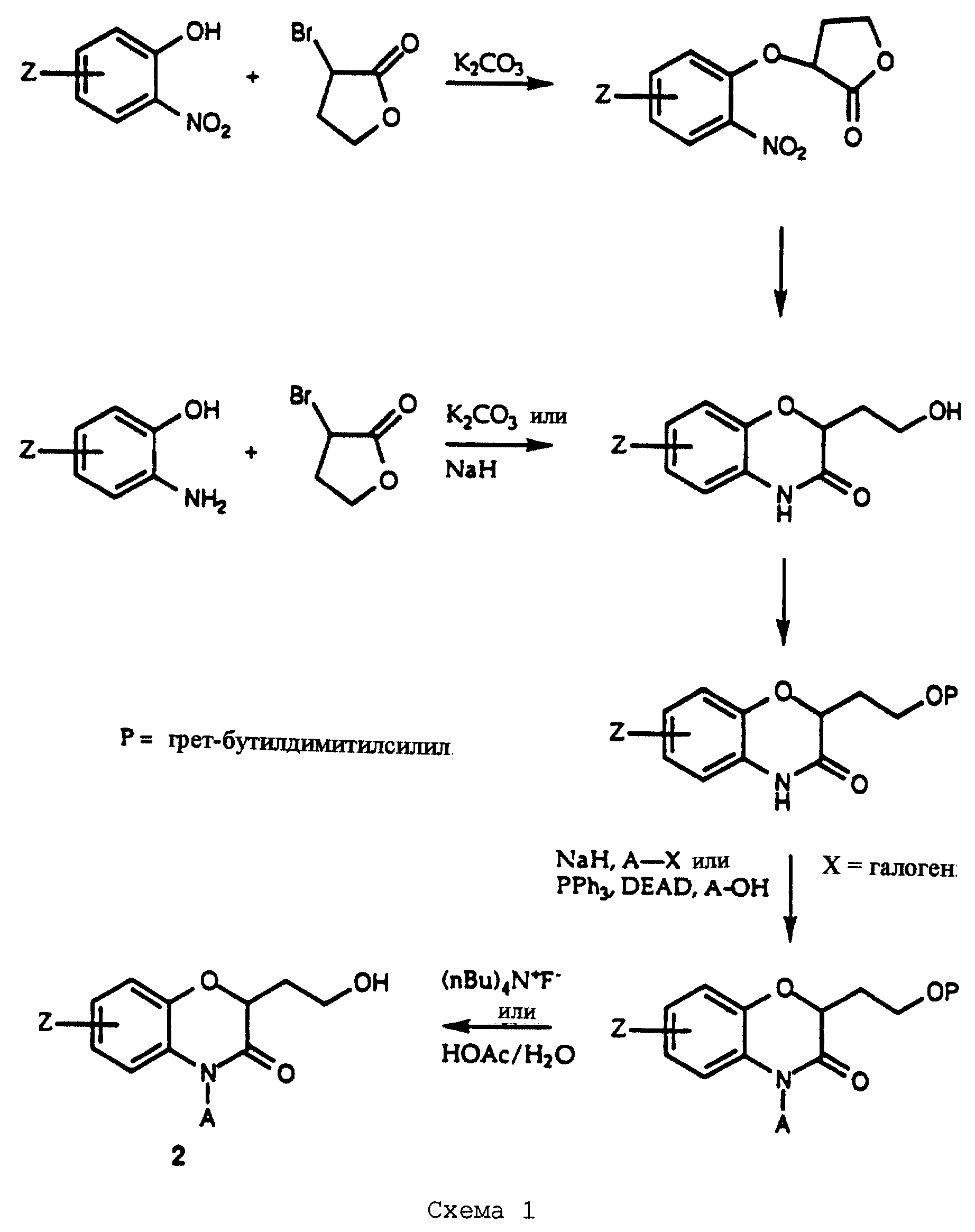
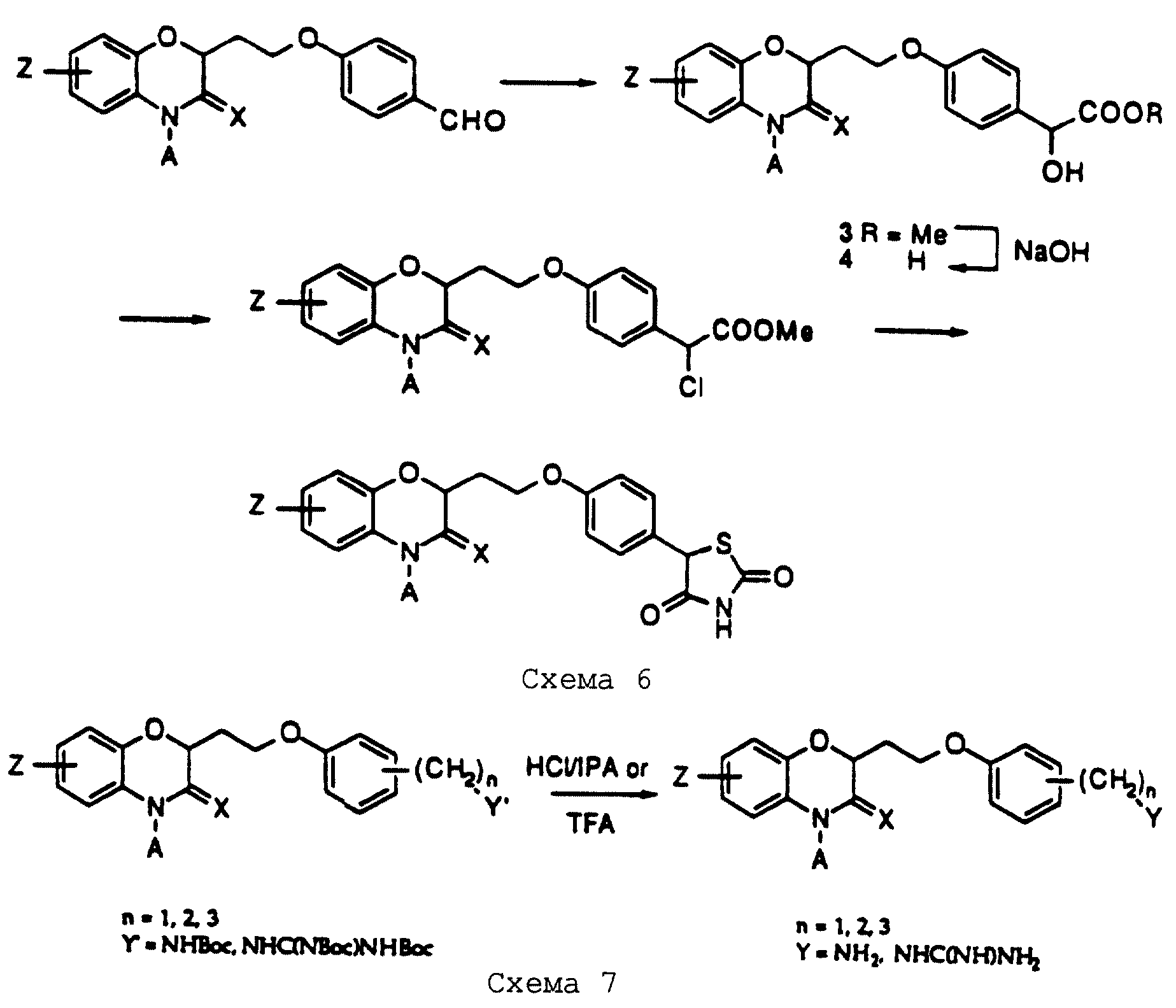
Соединения настоящего изобретения получают в соответствии со способами, описанными ниже и иллюстрированными в следующих схемах. Первая стадия синтеза включает новую реакцию присоединения и циклизации α-бром-γ-бутиролактона, показанного на схеме 1 (см. в конце описания), с подходящим образом замещенным 2-нитро- или 2-аминофенолом. Реакцию можно проводить в две отдельные стадии, начиная с известных, обычно коммерчески доступных нитрофенолов, имеющих большинство определений для Z, перечисленных в описании изобретения. Растворитель обычно представляет собой ДМФ, и для завершения реакции требуется основный (щелочной) реагент, такой как К2СО3. Стадия циклизации протекает при восстановлении нитрогруппы любыми системами реагентов, которые, как известно, пригодны для этого восстановления, включая катализируемое палладием гидрирование, никель и борогидрид натрия и железоуксусная кислота. В альтернативном случае, особенно в случаях, когда Z представляет нитрогруппу или Q представляет конденсированный пиридил, обе стадии, присоединения и циклизации, можно проводить в одну операцию, используя основание, такое как К2СО3 или NaH, в ДМФ с нагреванием или без него.
Имея образованную таким образом систему бензоксазинового гетероциклического кольца, промежуточный спирт 2 можно получить трехстадийной последовательностью реакций. За стадией защиты спиртовой группы известной защитной группой, такой как трет-бутилдиметилсилилпроизводное или его эквиваленты, следует реакция в положении 4, включающая нуклеофильное замещение с участием алкил- или арилгалогенида в основных условиях: например, очень эффективен NaH в ДМФ. В альтернативном случае превращение азота в положении 4 в производное можно проводить путем реакции Mitsunobu подходящим образом замещенного спирта. Удаление защитной группы спирта при помощи любых обычных реагентов с фторид-анионом или в кислотных условиях дает соединение 2.
Как очевидно, схема 1 изображает получение бензоксазиновых соединений, где часть "Q" представляет конденсированный фенил. Пиридооксазиновые соединения, где часть "Q" представляет конденсированный пиридил, можно получить в соответствии с тем же способом путем замены фенольного исходного материала, изображенного на схеме 1, на подходящим образом замещенную 2-нитро- или 2-аминопиридоксильную часть. В остальных синтезах, изображенных на схемах 2-10 ниже, бензоксазиновые соединения, показанные на схемах, можно таким же образом заменить на пиридооксазиновые соединения.
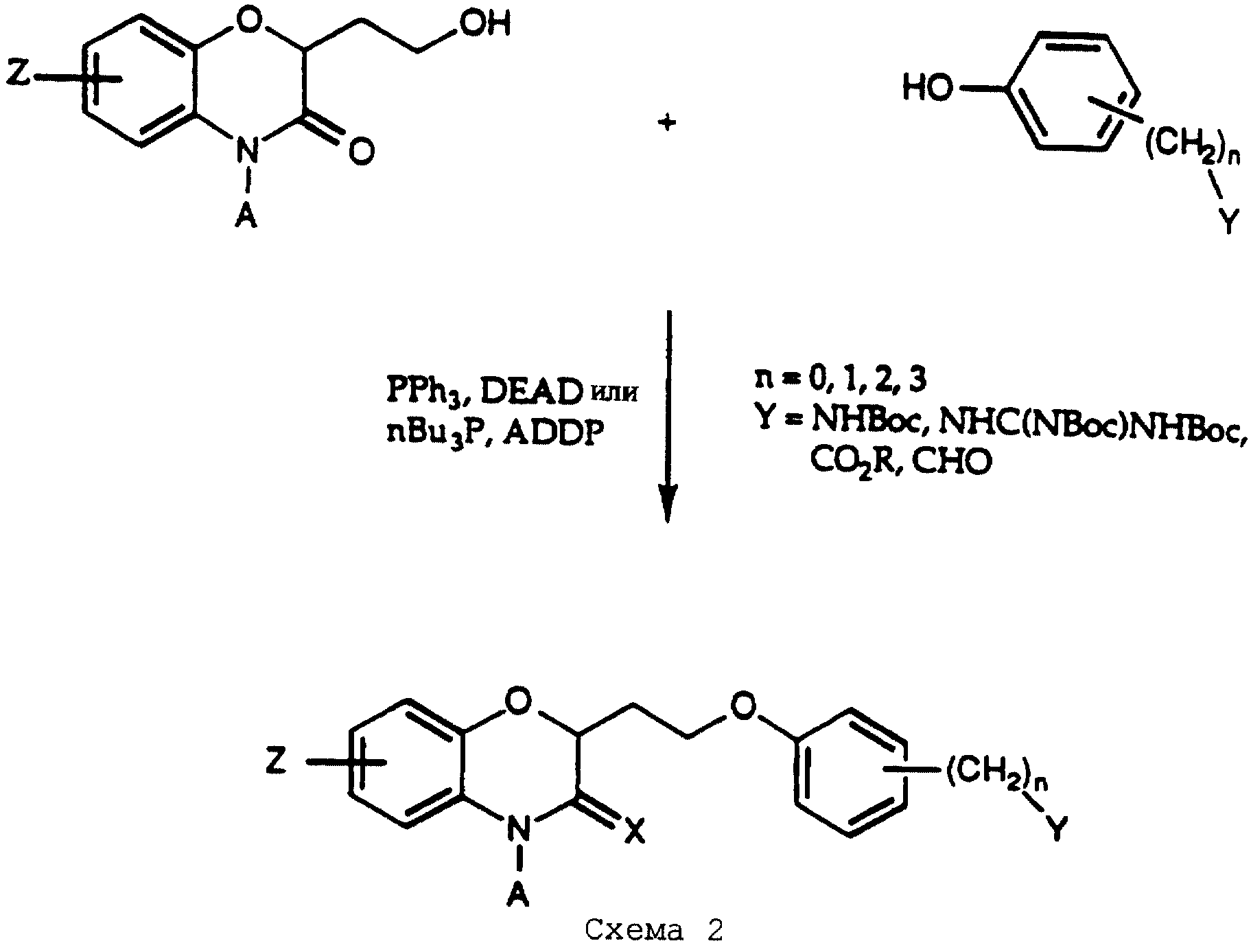
Ключевой стадией синтеза является реакция сочетания спирта 2 с замещенным фенолом путем реакции Mitsunobu, как показано на схеме 2 (см. в конце описания). Реакция Mitsunobu может быть одним из нескольких вариантов, известных в данной области; выбор подходящего фосфина, азодикарбонильного реагента и растворителя будет предоставлен на усмотрение исследователя, основанное на опубликованных прецедентах и на эмпирических результатах с определенной комбинацией субстратов, которые нужно сочетать. Руководство для этого можно найти в обзорной статье D.L. Hughes в Organic Reactions, 42, 335-656 (1992), и в приведенных ниже подробных примерах. В большинстве случаев будет достаточным применение трифенилфосфина (Рh3Р) и диэтилазодикарбоксилата (DEAD) или, альтернативно, трибутилфосфина (Вu3Р) и (азодикарбонил)дипиперидина (ADDP).
Во время реакции Mitsunobu группа Y в большинстве случаев должна быть в защищенной форме более реакционноспособного соединения или же (например, когда целевым соединением является гетероцикл) группа Y должна быть предшествующей функциональной группой, превращаемой в целевой гетероцикл. После того как образована связь между двумя частями, группу Y превращают, если необходимо, в предпочтительную функциональную группу, как показано на схемах в конце описания. Подходящие защитные группы для гуанидинов и аминов включают, но не ограничиваются ими, трифторацетил, трет-бутоксикарбонил (Воc) и бензилоксикарбонил. Подходящие защитные группы для карбоновых кислот включают, но не ограничиваются ими, низшие алкиловые эфиры или бензиловые эфиры; подходящие предшествующие группы включают олефин, нитрил или оксазолидин. Химические процессы, представленные на схеме, в общем применимы для всех определений Y.
Для получения тех соединений, где Х=водород, реакцию сочетания Mitsunobu проводят с восстановленным производным соединения 2. Восстановление очень легко проводят с защищенным предшественником соединения 2, как показано на схеме 3 (см. в конце описания), путем использования коммерчески доступного боранового реагента, такого как комплекс боран-ТГФ. После реакции восстановления удаление защитной группы, как показано на схеме 1, дает спирт, который претерпевает реакцию Mitsunobu, как указано ранее.
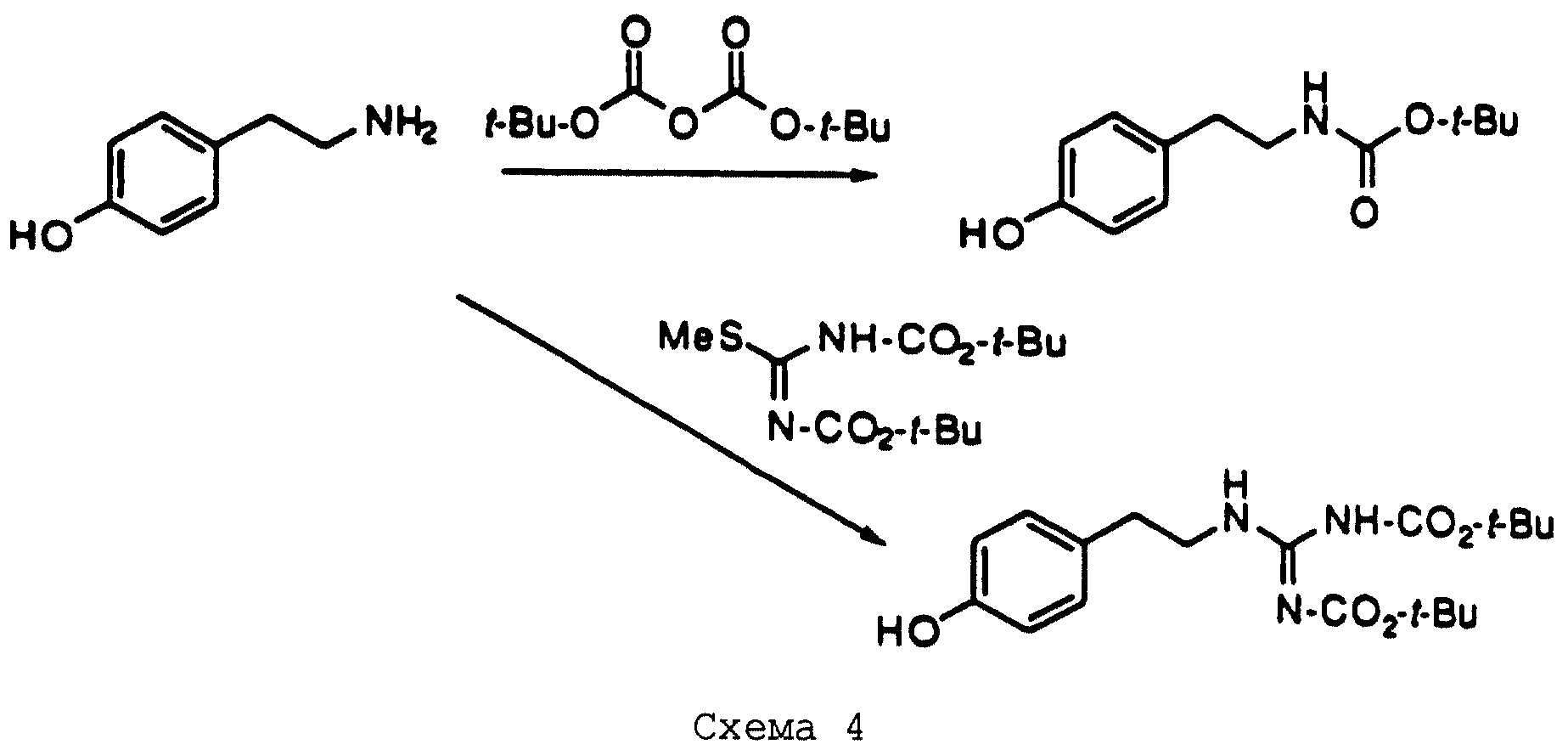
В схеме 4 (см. в конце описания) показана реакция 2 (4-гидроксифенил)этиламина с дитрет-бутилдикарбонатом для получения защищенного фенольного сочетающего компонента для реакции Mitsunobu. Коммерчески доступны или являются известными соединениями различные (гидроксифенил)алкиламины; их можно синтезировать обычными способами, такими как восстановительное аминирование бензальдегидов, гидрирование арилацетонитрилов или арилоксиацетонитрилов, восстановление циннамидов или циннамиламинов и т.д. Способы их получения можно выбрать, но не ограничиваться ими, из представленных здесь примеров.
Кроме того, на схеме 4 иллюстрируется получение защищенного гуанидина из соответствующего амина, снова обеспечивающее фенольный компонент для сочетания Mitsunobu. Показанное использование N,N'-бис(трет-бутоксикарбонил)-S-метилизотиомо-чевины для этой цели является известной методикой (R.J. Веrgеron, J. S. McManis, J. Org. Chem., 52, 1700-1703 (1987)); в некоторых случаях ее улучшают добавлением к реакционной смеси ацетата серебра (см. также M. S. Bernatowicz, Y. Wu, G. R. Matsueda, Tetrahedron Letters, 34, 3389 (1993)). Эти методы обычно пригодны для всех аминов с различными определениями Ar, X, W и n.
В альтернативном случае можно получить 1 (см. описание изобретения) с Y= NH2 и затем превратить его аминогруппу в гуанидиногруппу указанным выше или другими известными методами (например, M.S. Bernatowicz, Y. Wu, G.R. Matsueda, J. Org. Chem., 57, 2497-2502 (1992) и ссылки в ней).
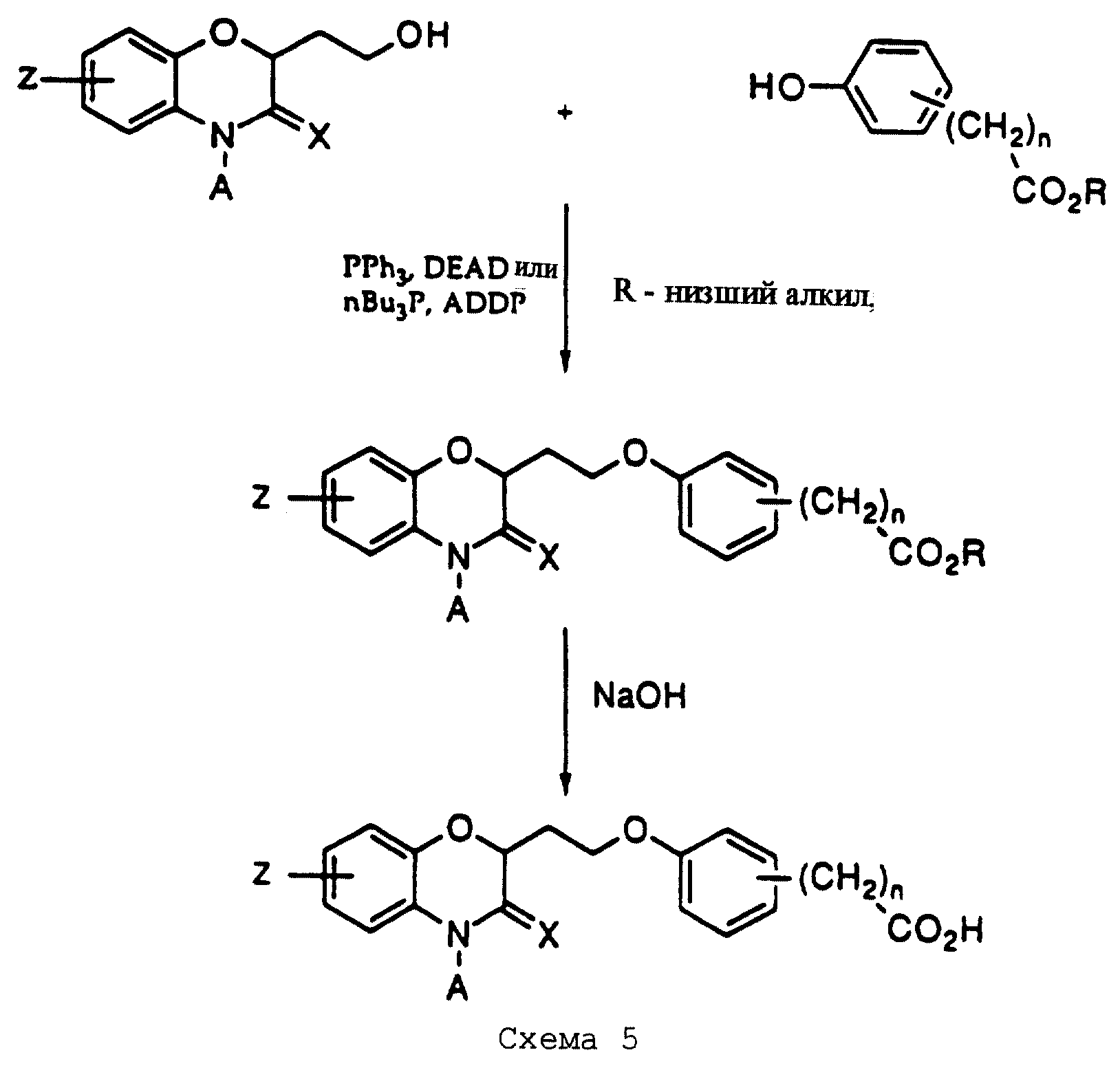
Для соединений, где Y представляет карбоновую кислоту (см. определение), исходные фонолы с подходящим замещением являются известными соединениями и коммерчески доступными соединениями либо в виде карбоновых кислот, либо соответствующих алкановых эфиров. Кислоты до сочетания по реакции Mitsunobu сначала защищают превращением в алкановые эфиры обычным образом, как показано на схеме 5 (см. в конце описания). После реакции сочетания, омылением NaOH получают конечные продукты.
Когда n равно O и Y представляет СНО (схема 6), реакция с бромофором и КОН с последующим метилированием сырого продукта дает гидроксиэфир 3. Гидролиз таким образом образованного эфира дает соответствующую гидроксикислоту 4. Кислоту 4 можно обработать реагентами, такими как тионилхлорид, для образования хлорпроизводного и затем реакцией с тиомочевиной получить тиазолидиндион, как показано на схеме 6 (см. в конце описания).
Для соединений, где Y в действительности представляет защищенный амин или гуанидин (схема 7 в конце описания), реакция в кислотных условиях, например в среде трифторуксусной кислоты или соляной кислоты в изопропаноле, дает соли амина и гуанидина соответственно.
В случаях, где А (см. описание изобретения) представляет бензильную группу, замещенную карбоновой кислотой, спирт, показанный на схеме 8, можно получить способом, изображенным на схеме 1, с использованием известных бензиловых галогенидов, имеющих в качестве заместителя эфир карбоновой кислоты. Ранее описанные превращения проводят с эфиром in situ с последующим гидролизом эфира до образования кислоты, обычно на последней стадии реакции.
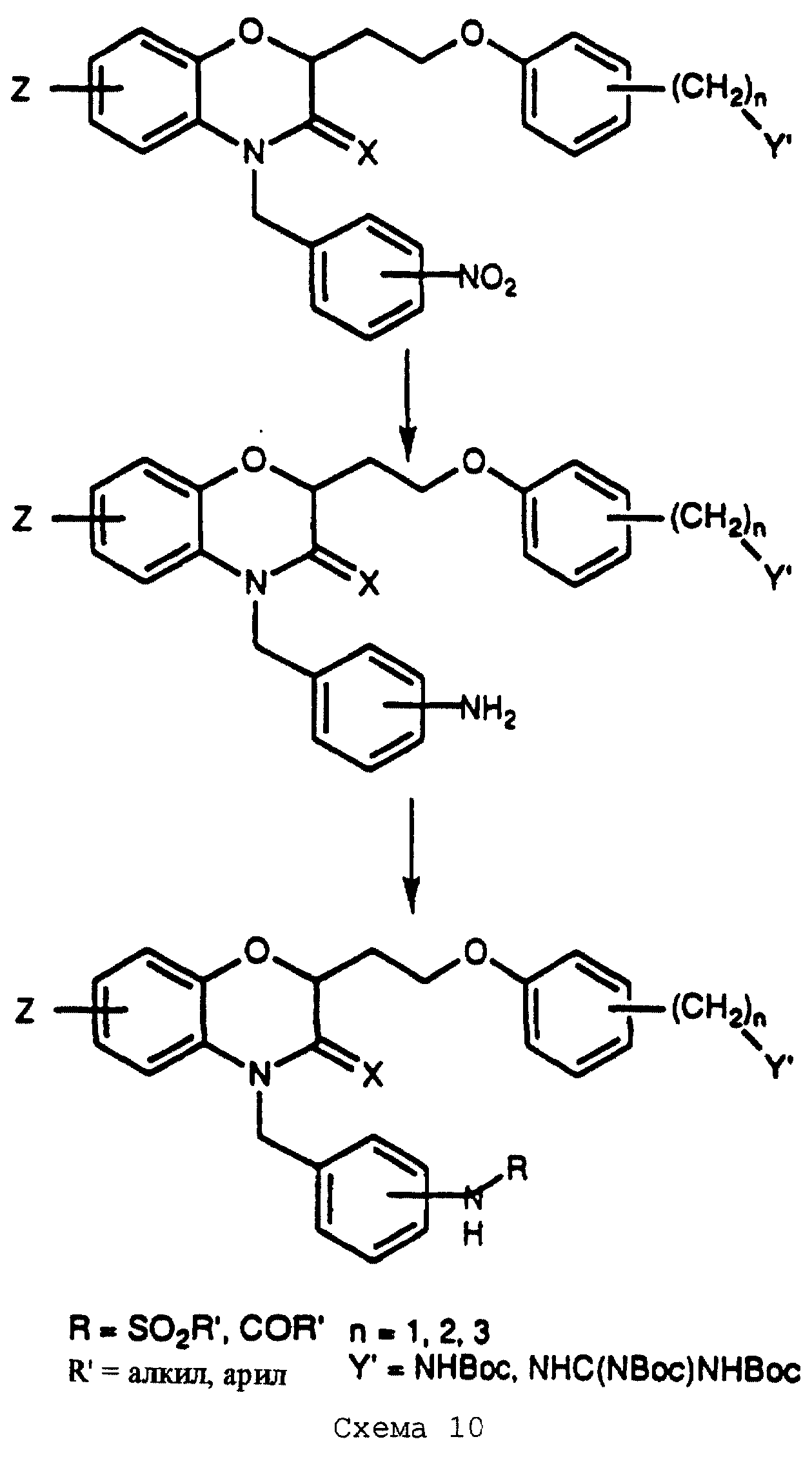
Превращения, показанные на схеме 1, для получения спирта 2 и реакцию сочетания, описанную в схеме 2, можно проводить с нитрозамещенными исходными материалами для получения продуктов, показанных на схеме 9 (см. в конце описания). Восстановление нитрогруппы реагентами, такими как железо/уксусная кислота или катализируемое палладием гидрирование, можно проводить, например, на соединениях, полученных из защищенных амино- или гуанидинофенолов, показанных на схеме 2. В альтернативном случае восстановление можно проводить на незащищенных соединениях при условии, что не требуются их дальнейшие превращения. В случае защищенного соединения получаемый амин можно далее функционализировать электрофильными реагентами для получения продуктов, показанных на схеме 9. Подобные превращения можно проводить с соединениями, полученными из соединения 2, имеющего нитробензильный заместитель, как показано на схеме 10 (см. в конце описания).
Вышеупомянутые реакции проводят в растворителе, подходящем для этих реагентов и материалов, используемых и пригодных для осуществления. Специалистам в области органического синтеза должно быть понятно, что различные функциональные группы, присутствующие в молекуле, должны быть совместимы с предполагаемыми химическими превращениями. От этого будет зависеть порядок стадий синтеза, защиты реакционноспособных групп и выбора условий реакции. Условия реакции, совместимые с используемыми заместителями, должны быть известны специалисту в данной области, так же как выбор защитных групп в тех случаях, когда они требуются.
Из формулы I очевидно, что некоторые соединения изобретения в их структуре могут иметь один или несколько асимметричных атомов углерода. Предполагается, что настоящее изобретение включает в свой объем стереохимически чистые изомерные формы соединений, а также их рацематы. Стереохимически чистые изомерные формы можно получить путем известных в данной области приемов. Диастереоизомеры можно разделить физическими способами разделения, такими как фракционная кристаллизация и хроматографические методы, и энантиомеры можно разделить друг от друга селективной кристаллизацией диастереомерных солей с оптически активными кислотами или основаниями или хиральной хроматографией. Чистые стереоизомеры можно также получить синтетически из подходящих стереохимически чистых исходных материалов или с использованием стереоспецифических реакций.
Подходящими фармацевтическими солями являются соли неорганических или органических кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота, уксусная кислота, янтарная кислота, щавелевая кислота, яблочная кислота и тому подобное. Подходящими солями являются также соли неорганических и органических оснований, таких как КОН, NaOH, Са(ОН)2, Аl(ОН)3, пиперидин, морфолин, этиламин, триэтиламин и тому подобное.
В объем изобретения включаются также гидратированные формы соединений, которые содержат различные количества воды, например гидратные, полугидратные и полуторагидратные формы.
Способность бактерий быстро реагировать на изменения в окружающей среде имеет самое большое значение для их выживания. Бактерии способны быстро отвечать и адаптироваться к таким разнообразным стимулам, как изменения питательных веществ, осмолярности, температуры, света или среды хозяина. Эти ответы могут быть кратковременными, такими как ответы, требуемые для изменений в подвижности или для вхождения в клетку хозяина. В альтернативном случае ответы могут требовать большие изменения в экспрессии генов и клеточной морфологии, такие как изменения, требуемые для споруляции или для выживания в макрофаге. Механизм, которым бактерии способны чувствовать стимулы из физического окружения (или из цитоплазмы) и преобразовывать эти сигналы в подходящие ответы, часто включает так называемые "двухкомпонентные" системы.
Как утверждалось выше, способ лечения по настоящему изобретению основывается на ингибировании этой системы "двухкомпонентного включения". Все бактерии используют этот механизм для регуляции различных адаптивных/вирулентных факторов для облегчения приживаемости бактериальной популяции в окружающей среде (например, бактериальной инфекции в хозяине). Система неизменно состоит из сенсора, который либо активирует киназу, либо является частью киназы, и который при стимуляции автофосфорилируется. Эта фосфорилированная молекула является очень активным фосфодонором, который сразу переносит свой фосфат в "регуляторный" компонент, который, в свою очередь, инициирует биологический ответ, такой как транскрипция или дальнейший фосфоперенос в каскаде, который в конце концов заканчиваться регуляцией бактериальной экспрессии генов. Несмотря на то что каждая из киназ и регуляторов ответов имеют уникальную последовательность (фактически, даже функционально идентичные белки имеют несколько различные последовательности в различных видах), они разделяют гомологический биохимический механизм и обладают значительной гомологией в активном сайте.
Как указано, настоящее изобретение представляет соединения, которые проявляют антибиотическую активность путем ингибирования автофосфорилирования бактериальных гистидинкиназ. Они ингибируют также перенос фосфата от фосфорилированных гистидинкиназ к остаткам аспартилам белков-акцепторов фосфата, принимающих участие в регуляции бактериальной экспрессии генов.
Это изобретение представляет далее способ лечения бактериальных инфекций или повышения или потенцирования активности других антибактериальных средств у теплокровных животных, который заключается во введении животным соединения по изобретению, отдельно или в смеси с другим антибактериальным средством, в форме лекарственного препарата по настоящему изобретению.
Когда соединения используют для указанного выше использования, их можно комбинировать с одним или несколькими фармацевтически приемлемыми носителями, например растворителями, разбавителями и тому подобное, и их можно вводить перорально в таких формах, как таблетки, капсулы, диспергируемые порошки, гранулы или суспензии, содержащие, например, от около 0,5 до 5% суспендирующего агента, сиропы, содержащие, например, от около 10 до 50% сахара, и эликсиры, содержащие, например, от около 20 до 50% этанола, и тому подобное, или парентерально в форме стерильных инъецируемых растворов или суспензий, содержащих от около 0,5 до 5% суспендирующего агента в изотонической среде. Эти фармацевтические препараты могут содержать, например, от около 0,5 до около 90% активного ингредиента в комбинации с носителем, более обычно от 5 до 60% по массе.
Композиции для местного применения могут принимать форму жидкостей, кремов или гелей, содержащих терапевтически эффективную концентрацию соединения по изобретению в смеси с дерматологически приемлемым носителем.
При получении композиций в пероральной лекарственной форме можно применять любую обычную фармацевтическую среду. Твердые носители включают крахмал, лактозу, дикальцийфосфат, микрокристаллическую целлюлозу, сахарозу и каолин, тогда как жидкие носители включают стерильную воду, полиэтиленгликоли, неионогенные поверхностно-активные вещества и съедобные масла, такие как кукурузное, арахисовое и кунжутное масла, когда они подходят для природы активного ингредиента и определенной формы желаемого введения. Может быть полезно включение вспомогательных средств, обычно применяемых при получении фармацевтических композиций, таких как корригенты, красящие агенты, консерванты и антиокислители, например витамин Е, аскорбиновая кислота, ВНТ и ВНА.
Предпочтительными фармацевтическими композициями с точки зрения легкости получения и введения являются твердые композиции, особенно таблетки и наполненные твердой или жидкой композицией капсулы. Предпочтительно пероральное введение соединений.
Эти активные соединения можно также вводить парентеральным или внутрибрюшинным способом. Растворы или суспензии этих активных соединений в виде свободного основания или фармакологически приемлемой соли можно получить в воде, подходящим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Можно также получить дисперсии в глицерине, жидких полиэтиленгликолях и их смесях в маслах. При хранении и использовании в обычных условиях эти препараты могут содержать консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, подходящие для инъецируемого использования, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий для немедленного приема. Во всех случаях форма должна быть стерильной и должна быть текучей до степени, которая позволяет легко вводить ее с помощью шприца. Она должна быть стабильной в условиях приготовления и хранения и должна быть предохранена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носителем может быть растворитель или дисперсная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла.
Эффективная доза применяемого активного ингредиента может изменяться в зависимости от конкретного используемого соединения, способа введения и тяжести состояния, которое лечат. Однако в общем удовлетворительные результаты получают, когда соединения по изобретению вводят при суточной дозе от около 0,1 до около 400 мг/кг массы тела животного, предпочтительно в разделенных дозах, вводимых от двух до четырех раз в день, или в форме с пролонгированным действием. Для большинства больших млекопитающих общая суточная доза составляет от около 0,07 до 7,0 г, предпочтительно от около 100 до 1000 мг. Лекарственные формы, подходящие для внутреннего применения, содержат от около 100 до 500 мг активного соединения в тесной смеси с твердым или жидким фармацевтически приемлемым носителем. Эту схему приема лекарственного средства можно регулировать для обеспечения оптимальной терапевтической восприимчивости. Например, ежедневно можно вводить несколько разделенных доз или дозу можно пропорционально снизить, что определяется необходимостью терапевтической ситуации.
Получение вышеуказанных фармацевтических композиций и лекарственных препаратов проводят любым способом, известным в данной области, например смешиванием активного ингредиента(ов) с разбавителем(ями) для образования фармацевтической композиции (например, гранулята) и затем превращением композиции в лекарственный препарат (например, таблетки).
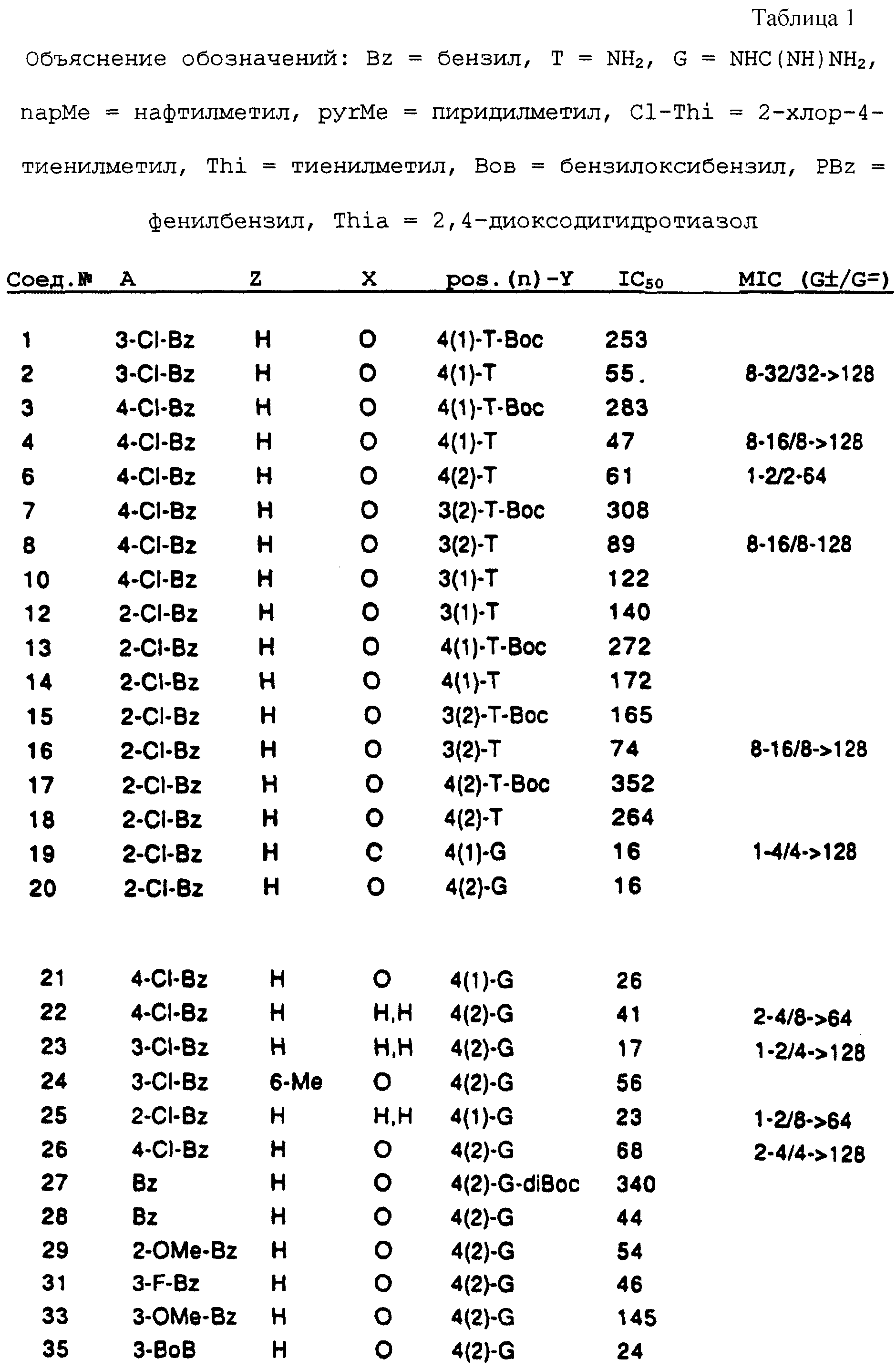
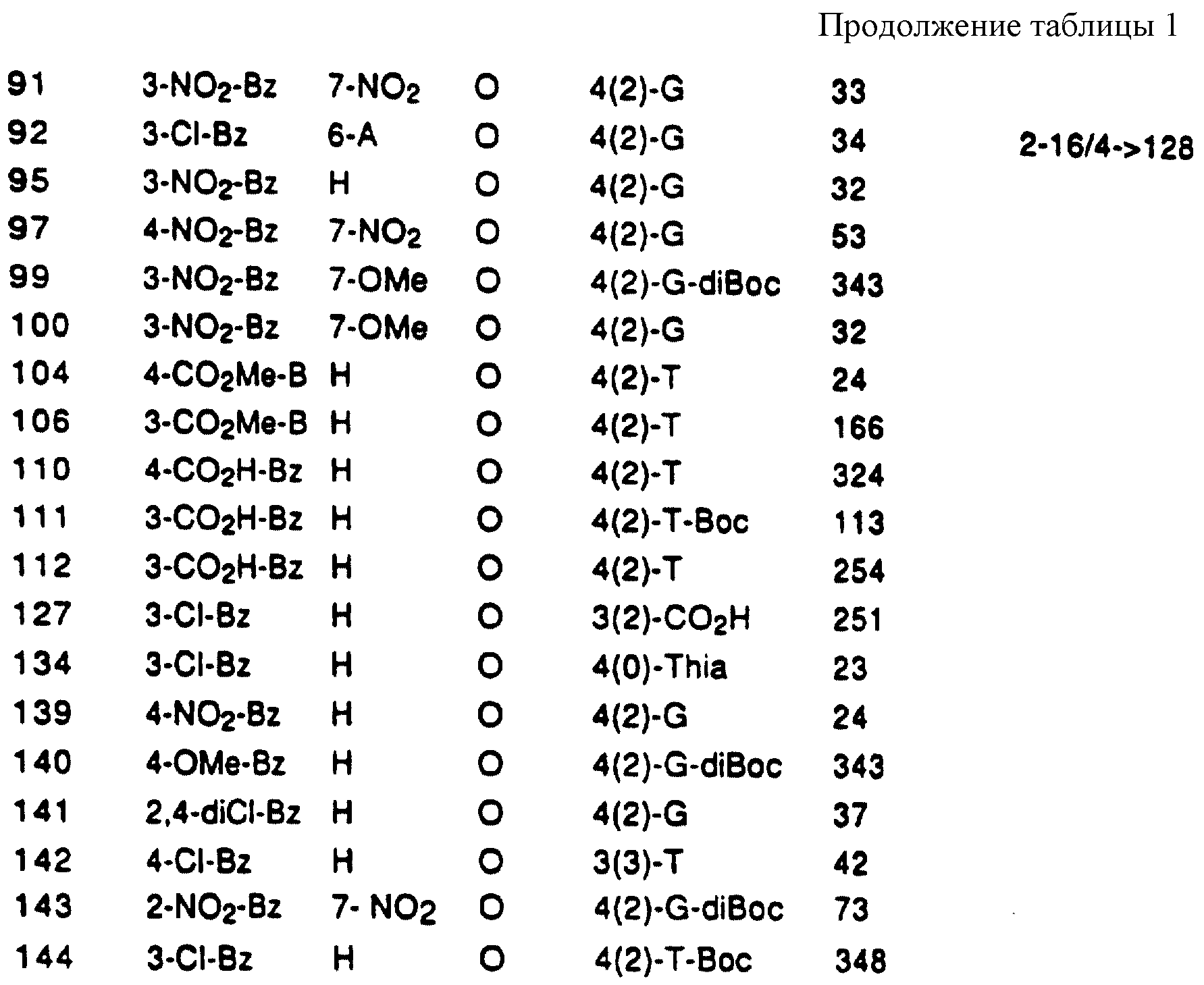
Соединения по настоящему изобретению обладают антибактериальной активностью, как определено следующими испытаниями. Сначала соединения испытывали на их способность ингибировать автофосфорилирование киназы А и перефосфорилирования SpoOF, двух белков, принимающих участие в одной из описанных выше систем трансдукции сигналов, регулирующих экспрессию генов в бактериях. Представленные соединения затем испытывали на антибактериальную активность против выбранных организмов стандартным способом MIC. Результаты приводятся ниже.
В таблице 1
перечислены примеры соединений изобретения вместе с их величинами IC50 в анализе НРК in vitro, описанном ниже, и диапазон величин MIC для выбранных микроорганизмов, идентифицированных ниже.
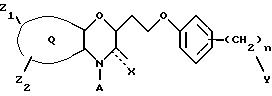
Эти примеры только иллюстрируют изобретение и не предназначены никоим образом для ограничения объема притязания. В таблице 1 бензоксазиновые соединения перечисляются в соответствии с формулой
В таблице 2 перечислены активности для пиридооксазиновых соединений следующей формулы, где Q представляет конденсированный пиридил:
Получены следующие протоколы вышеупомянутых анализов.
1. Анализ автофосфорилирования киназы А и перефосфорилирования SpoOF
Для изучения влияния соединений по настоящему изобретению на процесс трансдукции сигналов в
бактериях исследовали ингибирующее действие соединений на белки киназы А и SpoOF оперона споруляции. Конкретно, ингибирование автофосфорилирования киназы А и перефосфорилирования SpoOF определяли в
следующих анализах. Регулятором ответной реакции SpoOF является основной субстрат для фосфорилирования протеинкиназой, кинА, принимающей участие в процессе споруляции в бактериях (см. D. Burbulys,
К.A. Trach, J.A. Hoch, Cell, 64, 545-552 (1991)). SpoOF и кинА получали из рекомбинантного E.coli, сверхэкспрессирующего эти белки (J. Cavanagh et al., Amino Acids, 6, 131-140 (1994) и ссылки в
ней).
Следующие исходные реагенты либо получали и сразу использовали, либо сохраняли при указанной температуре:
Соли 8Х: 2 М КСl (5 мл), 1 М MgCl2 (800 мл), 1 М
CaCl2 (100 мл), 10 мг/мл фенилметилсульфонилфторида (200 мл), 1 М дитиотреит (50 мл), 0,25 М Na2EDTA (32 мл) и 3,82 мл Н2О (-20oС).
Загружаемый краситель 5Х: 0,5 М Трис-HCl, рН 6,8 (7,5 мл), 10% додецилсульфат натрия (SDS) (2 мл), 0,1%
бромфенол голубой (0,5 мл), 100% глицерин (3 мл) и 12,5 М 2 меркаптоэтанол (0,3 мл).
1-1,3 мг/мл кинА: 15 мМ Трис-HCl, рН 8,0; 0,6 мМ КСl; 4 мМ 2-меркаптоэтанол; 40% глицерин (-20oС).
1 мг/мл SpoOF: 17,5 мМ Трис НСl, рН 8,0; 0,7 мМ КСl; 0,7 мМ MgCl2; 0,7 мМ CaCl2; 5 мМ 2-меркаптоэтанол; 30% глицерин (-20oС).
5% Концентрирующий гель: 40% смесь акриламид:бисакриламид, 29:1 (1,25 мл), 0,5 М Трис-HCl, рН 6,8 (2,5 мл), 10% SDS (0,1 мл), D-H2O (6,15 мл); 10% персульфат аммония (100 мл) и TEMED (25 мл).
SDS-Рабочий буфер: Трис-основание (3,02 г), глицин (14,4 г), SDS (1 г), D-H2O (до 1 л).
Реакционную смесь получали из солей 8Х (87 мкл), 1 М Трис, рН 8 (118 мкл), 50% глицерина (63 мкл), SpoOF (14,1 мкл) и кинА (7,0 мкл). В пробирки микроцентрифуги загружали реакционную смесь (18,5 мкл) и 1,0 мМ раствор испытуемого соединения в 5% ДМСО (18,5 мкл) и инкубировали в течение 15 мин на льду. Добавляли 100 мМ раствор АТФ (3,0 мкл, содержащий 625 мкКи [32P]-АТФ) и смесь оставляли на 10 минут при комнатной температуре. Реакцию гасили наполняющим красителем 5Х (10 мкл на пробирку) и образцы загружали на приготовленный 5% концентрирующий гель или хранили на сухом льду до тех пор, пока они не будут готовы для использования. В приготовленные лунки помещали SDS-рабочий буфер, в лунки загружали образцы и в гель подавали ток с напряжением 80 В до тех пор, пока фронт красителя не достигал нижней части концентрирующего геля. Вольтаж затем повышали до 250 В до тех пор, пока не завершался электрофорез. Изображение радиоактивных полос в геле, соответствующих фосфорилированным кинА и SpoOF, визуализировали и количественно определяли фосфовизуализатором.
Если любой фермент был ингибирован (что доказывается отсутствием меченого белка в проявленном геле), IC50 вычисляли путем проведения анализа с диапазоном концентраций ингибитора от 1 до 500 мкМ. После проведения электрофореза реакционных смесей процент ингибирования определяли путем измерения концентрации радиоактивного фосфора фосфовизуализатором и вычисления величин с использованием программного обеспечения (BioRad Molecular Analyst). Соединения с величинами IC50 менее 500 мкМ считаются активными.
2. Антимикробный анализ MIC
Антимикробную активность соединений in vitro
определяли методом микроразбавления бульона по способу испытания National Committee for Laboratory Standards (NCCLS). Этот способ описывается в NCCLS Document M7-A2, Vol. 10, No 8 "Metods for Dilution
Antimicrobial Susceptibility Test for Bacteria that Grow Aerobically - Second Edition".
В этом способе лекарственное средство с двукратными сериальными разбавлениями в бульоне Mueller-Hinton, снабженном катионами, добавляют в лунки микропланшетов для микроразбавления. Организмы для испытания получают регуляцией мутности активно растущих бульонных культур так, чтобы конечная концентрация организма для испытания после того, как его добавляют в лунки, была приблизительно 5х104 колониеобразующих единиц/лунка.
После инокуляции микропланшетов для
микроразбавления их инкубируют при 35oС в течение 16-20 часов и затем считывают. MIC представляет самую низкую концентрацию испытуемого соединения, которая полностью ингибирует рост
организма для испытания. Степень роста в лунках, содержащих испытуемое соединение, сравнивают со степенью роста в лунках с контрольным ростом (без испытуемого соединения), используемых в каждом
микропланшете. Как показано в таблицах 1 и 2, соединения по настоящему изобретению испытывали против ряда грамположительных и грамотрицательных бактерий, получая диапазон активности от 1 до >
128 мкг/мл в зависимости от организма для испытания. В анализе для испытания использовали следующие организмы:
Грамположительные бактрии
Enterococcus faecalis ATCC 29212
Enterococcus faecalis ос 3041
Enterococcus faecium ос 2993
устойчивый к метициллину Staphylococcus aureus ос 2089
устойчивый к метициллину Staphylococcus aureus ос 667
Staphylococcus aureus ATCC 29213
Staphylococcus aureus ATCC 6538
Staphylococcus epidermidis oc 2603
Грамотрицательные бактерии
Escherichia coli oc 2605
Escherichia coli oc 2530 ss
Klebsiella pneumoniae oc 1943
Pseudomonas aeroginosa oc 161
Pseudomonas aeroginosa ATCC 27853
Следующие примеры подробно описывают
химический синтез представленных соединений настоящею изобретения. Методики являются лишь иллюстрациями, и изобретение не должно истолковываться как ограниченное химическими реакциями и условиями,
которые они представляют. Не предпринимались попытки оптимизации выходов, полученных в этих реакциях, и специалисту данной области должно быть очевидно, что изменения во времени реакции, температурах,
растворителях и/или реагентов могут повысить выходы.
Способы получения приведенных примеров соединений изобретения представлены ниже. Эти примеры предназначены для иллюстрации способов синтеза и никоим образом не предназначены для ограничения объема притязания. Используемые аббревиатуры: DEAD - диэтилазодикарбоксилат; Рh3Р - трифенилфосфин; Вu3Р -три-н-бутилфосфин; ТГФ - тетрагидрофуран; ДМФ - N,N-диметил-формамид; ADDP - 1,1'-(азодикарбонил)дипиперидин.
Ссылочный пример 1
Промежуточный продукт 9086-181-1
Дигидро-3-(2 -нитрофенокси)-2(3Н) -фуранон
Способ А: 2-Нитрофенол (20,2 г, 1 экв) растворяли в ДМФ (250 мл) и обрабатывали К2СО3 (30 г, 1,3 экв), затем при комнатной
температуре в атмосфере азота добавляли α-бром-γ-бутиролактон (14,4 мл, 1,2 экв). После перемешивания в течение 18 ч добавляли дополнительное количество К2СО3 (5 г,
0,25 экв). После общего времени реакции 48 ч реакционную смесь охлаждали на ледяной бане и добавляли уксусную кислоту (13,7 мл, 1,65 экв). Сырую реакционную смесь выливали в воду и экстрагировали
этилацетатом (EtOAc). Объединенный экстракт концентрировали в вакууме и кристаллизовали из смеси этанол/вода, получая белые иглы (выход 22,4 г, 70%), т.пл. 112-113oС. ИК (КВг) 2939, 1771,
1607, 1586, 1524, 1481, 1356, 1275, 1221, 1194, 1019, 745 см-1;1H ЯМР (CDCl3) δ 7,84 (дд, J=8,1, 1,6 Гц, 1Н), 7,62-7,48 (м, 2Н), 7,16 (м, 1Н), 5,02 (кажущийся
т, J=7,4 Гц, 1Н), 4,62-4,52 (м, 1H), 4,45-4,35 (м, 1Н), 2,83-2,55 (м, 3Н).
Анализ: Вычислено для C10H9NO5: С 53,82, Н 4,06, N 6,28. Найдено: С 53,65, Н 3,84, N 6,05.
Ссылочный пример 2
Промежуточный продукт 10353-186-А
Дигидро-3-(4-метил -2-нитрофенокси)- 2(3Н)-фуранон
Получен из 4-метил-2-нитрофенола
способом А с выходом 33% в виде белого твердого продукта. MS (CI) 238 (MH+); ИК (КВr) 3523, 3072, 3005, 1770, 1623, 1577, 1530, 1496, 1463, 1392, 1357, 1282, 1270, 1225, 1194, 1184, 1095,
1020, 992, 804 см-1;1H ЯМР (СDСl3) δ 7,66 (с, 1H), 7,38 (м, 2Н), 4,93 (кажущийся т, J= 7,4 Гц, 1H), 4,59 (м, 1H), 4,39 (кажущийся кв, J=7,3 Гц, 1Н), 2,78-2,61
(м, 2Н), 2,38 (с, 3Н).
Анализ: Вычислено для C11H11NO5: С 55,70, Н 4,67, N 5,90. Найдено: С 55,62, Н 4,66, N 5,82.
Ссылочный пример
3
Промежуточный продукт 12168-2-1
Дигидро-3-(4-метокси -2-нитрофенокси)- 2(3Н)-фуранон
Получен из 4-метокси-2-нитрофенола способом А в виде желтых игл с выходом 52%. MS (CI)
254 (МН+); ИК (КВr) 3519, 3102, 3023, 2984, 1765, 1726, 1581, 1532, 1496, 1463, 1442, 1274, 1265, 1229, 1218, 1178, 1145, 1092, 1068, 1018, 992, 942, 859, 839, 806, 791, 755 см-1;1H ЯМР (СОСl3) δ 7,52 (d, J= 9,1 Гц, 1H), 7,39 (д, J=3,1 Гц, 1Н), 7,31 (дд, J=9,1, 3,0 Гц, 1Н), 4,87 (кажущийся т, J=7,5 Гц, 1H), 4,55 (м, 1H), 4,36 (м, 1H), 3,87 (с, 3Н),
2,82-2,69 (м, 1H), 2,68-2,53 (м, 1H).
Анализ: Вычислено для С11Н11NО6: С 52,18, Н 4,38, N 5,53. Найдено: С 52,19, Н 4,50, N 5,43.
Ссылочный пример 4
Промежуточный продукт 11653-187
Дигидро-3-(5- метокси-2-нитрофенокси) -2(3Н)-фуранон
Получен из 5-метокси-2-нитрофенола способом А с выходом 53%, т.пл.
109-110oС; MS (CI) MH+ 254; ИК (КВr) 3517, 3100, 3075, 2994, 2955, 2931, 2852, 1484, 1258, 1079, 714 см-1;1H ЯМР (DMSO-d6) δ 7,98 (д, 1H,
J=9,1 Гц), 7,02 (д, 1H, J= 2,5 Гц), 6,76 (дд, 1H, J=2,5, 9,2 Гц), 5,62 (т, 1H, J=8,7 Гц), 4,48 (дт, 1H, J=2,4, 8,8 Гц), 4,28 (м, 1H), 3,88 (с, 3Н), 2,89-2,73 (м, 1H), 2,38-2,29 (м, 1H).
Анализ: Вычислено для С11Н11NО6: С 52,18, Н 4,38, N 5,53. Найдено: С 51,97, Н 4,18, N 5,45.
Ссылочный пример 5
Промежуточный продукт
11578-25
Дигидро-3-(3-метил -2-нитрофенокси)-2(3Н) -фуранон
Получен из 3-метил-2-нитрофенола способом А с выходом 41%. Часть этого материала кристаллизовали из смеси СН2
Сl2/эфир, получая белый твердый продукт, т. пл. 82-84oС. ИК (KBr) 2946, 1792, 1530, 1294, 1275, 1182, 1118, 1014, 994, 777, 638 см-1;1H ЯМР (CDCl3) δ 2,32 (с, 3Н), 2,45-2,57 (м, 1Н), 2,63-2,74 (м, 1Н), 4,32-4,40 (м, 1Н), 4,48-4,55 (м, 1Н), 4,96 (т, J=7,4 Гц, 1Н), 6,97 (дд, J=7,1, 0,6 Гц, 1Н), 7,24-7,36 (м, 2Н); МН+ при
m/z=238.
Анализ: Вычислено для C11H11NO5: С 55,70, Н 4,67, N 5,90. Найдено: С 55,61, Н 4,62, N 5,87.
Ссылочный пример 6
Промежуточный продукт 11578-61
Дигидро-3-(4- хлор-2-нитрофенокси)- 2(3Н)-фуранон
Получен из 4-хлор-2-нитрофенола способом А с выходом 60% и выделен в виде желтого твердого продукта,
т.пл. 136-140oС; ИК (KBr) 3110, 1786, 1771, 1608, 1527, 1488, 1359, 1276, 1193, 1180, 1020, 825, 734 см-1;1H ЯМР (CDCl3) δ 2,57-2,83 (м, 2Н), 4,35-4,
45 (м, 1Н), 4,54-4,63 (м, 1H), 4,98 (т, J=7,4 Гц, 1Н), 7,48-7,56 (м, 2Н), 7,85 (д, J=2,3 Гц, 1H); MH+ при m/z=258.
Анализ: Вычислено для C10H8ClNO5: С 46,62, Н 3,13, N 5,44. Найдено: С 46,61, Н 3,11, N 5,20.
Ссылочный пример 7
Промежуточный продукт 11578-62
Дигидро-3-(4- карбометокси-2-нитрофенокси)- 2(3Н)-фуранон
Получен из 4-карбометокси-2-нитрофенола способом А с выходом 30% с использованием равных частей реагентов. Этот материал выделяли
непосредственно из водного продукта обработки в виде твердого продукта, т.пл. 99-101oС. ИК (KBr) 2958, 1780, 1726, 1618, 1531, 1348, 1300, 1270, 1179, 1127, 756 см-1;1
H ЯМР (CDCl3) δ 2,62-2,85 (м, 2Н), 3,95 (с, 3Н), 4,44 (дт, J=9,3, 7,2 Гц, 1Н), 4,58-4,65 (м, 1Н), 5,14 (т, J=7,3 Гц, 1Н), 7,53 (д, J=8,8 Гц, 1Н), 8,24 (дд, J=8,8, 2,1 Гц, 1Н), 8,52
(д, J=2,1 Гц, 1Н); МН+ при m/z=282.
Анализ: Вычислено для C12H11NO7 • 0,3H2O: С 50,29, Н 4,08, N 4,89. Найдено: С 50,03, Н 3,85, N 4,68.
Ссылочный пример 8
Промежуточный продукт 11578-32
Дигидро-3 (4-бензил-2-нитрофенокси) -2(3Н)-фуранон
Получен из 4-бензил-2-нитрофенола способом
А с выходом 54% в виде желтого кристаллического твердого продукта, т.пл. 117-119oС. ИК (КВr) 2931, 1785, 1625, 1535, 1346, 1334, 1279, 1261, 1156, 1022, 756 см-1;1H
ЯМР (CDCl3) δ 2,64-2,85 (м, 2Н), 4,42 (кв, J=7,3 Гц, 1Н), 4,57-4,65 (м, 1Н), 5,05 (т, J= 7,3 Гц, 1Н), 7,40-7,59 (м, 6Н), 7,78 (дд, J=8,7, 2,4 Гц, 1Н), 8,07 (д, J=2,4 Гц, 1Н).
Анализ: Вычислено для C16H13NO5: С 64,21, Н 4,38, N 4,68. Найдено: С 64,00, Н 4,20, N 4,59.
Ссылочный пример 9
Промежуточный продукт
11578-50
Дигидро-3-(4- трифторметил-2-нитрофенокси) -2(3Н)-фуранон
Получен из 4-трифторметил-2-нитрофенола способом А с выходом 51% с использованием равных частей реагентов. Этот
материал был выделен в виде белого твердого продукта, т.пл. 128-129oС. ИК (КВr) 3100, 2995, 1782, 1626, 1537, 1358, 1329, 1283, 1159, 1131, 1098, 998, 822 см-1;1H ЯМР
(СDСl3) δ 2,63-2,86 (м, 2Н), 4,40-4,48 (м, 1Н), 4,58-4,65 (м, 1Н), 5,14 (т, J=7,4 Гц, 1H), 7,63 (д, J=8,8 Гц, 1Н), 7,83 (дд, J=8,8, 1,9 Гц, 1H), 8,14 (д, J=1,9 Гц, 1Н); МН+
при m/z=292.
Анализ: Вычислено для C11H8F3NO5: С 45,22, Н 3,10, N 4,79. Найдено: С 45,37, Н 2,77, N 4,81.
Ссылочный пример
10
Промежуточный продукт 11578-40
Дигидро-3-(5 -фтор-2-нитрофенокси)- 2(3Н)-фуранон
Получен из 5-фтор-2-нитрофенола способом А с выходом 65% с использованием равных частей
реагентов. Этот материал был выделен в виде не совсем белого твердого продукта после кристаллизации из смеси СН2Сl2/эфир, т.пл. 98-100oС; ИК (КВr) 3055, 1773, 1619,
1591, 1508, 1350, 1284, 1024, 750 см-1;1H ЯМР (CDCl3) δ 2,62-2,85 (м, 2Н), 4,38-4,46 (м, 1H), 4,57-4,65 (м, 1H), 5,01 (т, J=7,3 Гц, 1H), 7,23-7,27 (м, 1H плюс
СНСl3), 7,96 (дд, J=9,1, 5,8 Гц, 1H); МН+при m/z=242.
Анализ: Вычислено для C10H8FNO5: С 49,80, Н 3,34, N 5,81. Найдено: С 49,85, Н 3,24, N 5,78.
Ссылочный пример 11
Промежуточный продукт 11578-38
Дигидро-3-(5- метил-2-нитрофенокси)-2(3Н) -фуранон
Получен из 5-метил-2-нитрофенола
способом А с выходом 22% с использованием равных частей реагентов. Этот материал кристаллизовали из смеси СН2Сl2/эфир, получая белый твердый продукт, т.пл. 68-70oС; ИК
(КВr) 3003, 2950, 2928, 1774, 1516, 1355, 1189, 1023, 947 см-1;1H ЯМР (CDCl3) δ 2,43 (с, 3Н), 2,58-2,81 (м, 2Н), 4,35-4,43 (м, 1H), 4,55-4,62 (м, 1H), 4,99 (т,
J=7,4 Гц, 1H), 6,95 (д, J=8,4 Гц, 1H), 7,28 (с, 1H), 7,79 (д, J=8,3 Гц, 1H); МН+ при m/z=238.
Анализ: Вычислено для C11H11NO5: С 55,70, Н 4, 67, N 5,90. Найдено: С 55,68, Н 4,62, N 5,85.
Ссылочный пример 12
Промежуточный продукт 11578-22-предшественник
Дигидро-3-(4,6 -дихлор-2-нитрофенокси)
-2(3Н)-фуранон
Получен из 4,6-дихлор-2-нитрофенола способом А с выходом 20% в виде оранжевого твердого продукта и использован без дальнейшей очистки. ИК (КВr) 3086, 1779, 1542, 1457, 1353,
1250, 1222, 1152, 1066, 995, 877 см-1;1H ЯМР (СDСl3) δ 2,62-2,81 (м, 2Н), 4,35-4,42 (м, 1Н), 4,59-4,66 (м, 1Н), 5,02 (т, J=6,6 Гц, 1H), 7,67 (д, J=2,6 Гц, 1Н),
7,86 (д, J=2,6 Гц); MH+ при m/z=292.
Ссылочный пример 13
Промежуточный продукт 9086-183-1
3,4-Дигидро-2-(2 -гидроксиэтил)-3-оксо-2Н -1,4-бензоксазин
Способ В: Промежуточный продукт 9086-181-1 (11,9 г, 1 экв, ссылочный пример 1) подвергали реакции с Н2 при 3,515 атм в склянке вибратора Парра, содержащей 10% Pd/C (1,8 г, 15%
мас./мас.) в этаноле (200 мл) в течение 13 ч. Катализатор удаляли фильтрованием и фильтрат концентрировали в вакууме. Сырой продукт растирали с горячим диэтиловым эфиром, получая бензоксазинон с
выходом 87% в виде белого порошка, т.пл. 65-69oС; ИК (КВr) 3298, 3076, 2993, 2917, 1677, 1613, 1505, 1439, 1410, 1312, 1275, 1231, 1119, 1104, 1059, 805, 745, 689 см-1;1H ЯМР (СDСl3) δ 8,29 (шир.с, 1H), 7,01-6,95 (м, 3Н), 6,82 (м, 1H), 4,76 (дд, J=7,6, 5,5 Гц, 1H), 3,91 (м, 2Н), 2,35-2,13 (м, 3Н).
Анализ: Вычислено для С10Н11NО3: С 62,17, Н 5,74, N 7,25. Найдено: С 62,01, Н 5,48, N 6,95.
Ссылочный пример 14
Промежуточный продукт 11653-189А
3,4-Дигидро-2-(2
-гидроксиэтил)-7-метокси-3- оксо-2Н-1,4-бензоксазин
Способ С: NaBH4 (2,7 г, 6 экв) постепенно добавляли в перемешиваемую смесь промежуточного продукта 11653-187 (3,0 г, 11,8 ммоль,
ссылочный пример 4) и NiCl2•6H2O (11,2 г, 4 экв) в метаноле (75 мл) при 0oС. Получаемую темную реакционную смесь оставляли для медленного нагревания до
комнатной температуры. Через 2 дня к реакционной смеси осторожно добавляли 2 н. НСl до прекращения выделения газа. Получаемую смесь разбавляли водой и экстрагировали этилацетатом. Объединенные слои
этилацетата промывали насыщенным NаНСО3, затем концентрировали в вакууме, получая бледно-желтый твердый продукт с выходом 66%, т.пл. 123-126o; MS (CI) МH+ 224; ИК
(KBr) 3475, 3307, 3188, 3066, 2931, 2892, 2835, 1769, 1664, 1450, 1327, 1258, 1224, 925 см-1;1Н ЯМР (DMSO-d6) δ 10,15 (шир.с, 1Н), 6,80 (д, 1Н, J=8,5 Гц), 6,52
(д, 1H, J= 2,6 Гц), 6,46 (дд, 1Н, J=2,6, 8,5 Гц), 4,67 (дд, 1Н, J=4,6, 8,8 Гц), 4,05 (т, 1H, J=5,4 Гц), 3,79 (м, 2Н), 3,74 (с, 3Н), 2,16 (м, 1H), 2,01 (м, 1H).
Анализ: Вычислено для C11H13NO4: С 59,19, Н 5,87, N 6,27. Найдено: С 58,87, Н 5,80, N 6,09.
Ссылочный пример 15
Промежуточный продукт 11653-29А
3,
4-Дигидро-2-(2 -гидроксиэтил)-7-нитро-3-оксо-2Н- 1,4-бензоксазин
Метод D: 2-Амино-5-нитрофенол (13,5 г, 87,6 ммоль, 1 экв) и α-бром-γ-бутиролактон (8,0 мл, 96,3 ммоль, 1,1 экв)
добавляли к перемешиваемой смеси ДМФ (80 мл) и карбоната калия (12,1 г, 87,6 ммоль). После кипячения с обратным холодильником в течение 5 часов и возвращения к комнатной температуре реакционную смесь
выливали в равный объем ледяной воды и перемешивали 15 минут до фильтрования. Образуемый коричневый твердый продукт сушили в вакууме при 65oС, получая продукт с выходом 45%, т.пл.
177-178oС. MS (FAB) MH+ 239; ИК (KBr) 3541, 3204, 3095, 3037, 2929, 2888, 1699, 1599, 1508, 1480, 1417, 1389, 1342, 1299, 1136, 1034, 798, 617, 499 см-1;1H
ЯМР (DMSO-d6) δ 11,32 (шир.с, 1Н), 7,91 (дд, 1Н, J=2,4, 8,7 Гц), 7,79 (с, 1H), 7,05 (д, 1Н, J=8,7 Гц), 4,82 (дд, 1Н, J=3,8, 9,0 Гц), 4,70 (шир.с, 1H), 3,59 (м, 2Н), 1,98 (м, 1H), 1,
90 (м, 1H).
Анализ: Вычислено для С10Н10N2O5: С 50,42, Н 4,23, N 11,76. Найдено: С 50,37, Н 4,20, N 11,43.
Ссылочный пример
16
Промежуточный продукт 12168-6-1
3,4-Дигидро-2-(2 -гидроксиэтил)-6-метокси-3-оксо -2Н-1,4-бензоксазин
Получен из промежуточного продукта 12168-2-1 (ссылочный пример 3) в
виде бледно-серого твердого продукта с выходом 76% способом В, т. пл.111-113oС; MS (CI) 224 (МН+); ИК (KBr) 3472, 3337, 3196, 3113, 3055, 2996, 2898, 2832, 1684, 1626, 1611, 1520,
1501, 1466, 1403, 1312, 1292, 1264, 1229, 1192, 1162, 1082, 796, 785 см-1;1H ЯМР (CDCl3) δ 7,99 (шир.с, 1H), 6,91 (д, J=8,8 Гц, 1Н), 6,52 (дд, J=8,8, 2,8 Гц,
1Н), 6,37 (д, J=2,8 Гц, 1Н), 4,70 (дд, J= 7,5, 5,4 Гц, 1Н), 3,90 (м, 2Н), 3,77 (с, 3Н), 2,21 (м, 2Н).
Анализ: Вычислено для C11H13NO4: (МН+ ): 224,0922. Найдено: 224,0974.
Ссылочный пример 17
Промежуточный продукт 10353-189-1
3,4-Дигидро-2-(2 -гидроксиэтил)-6-метил-3 -оксо-2Н-1,4-бензоксазин
Получен способом В из промежуточного продукта 10353-186-А (ссылочный пример 2) и выделен в виде белого твердого продукта с выходом 70%; MS (CI) 208 (МH+); ИК (KBr) 3337, 3196, 3099, 2919,
1681, 1609, 1523, 1498, 1409, 1365, 1232, 1058, 806 см-1;1Н ЯМР (CDCl3) δ 7,96 (шир.с, 1Н), 6,90 (д, J= 9,1 Гц, 1H), 6,80 (д, J=9,1 Гц, 1H), 6,61 (с, 1Н), 4,72
(кажущийся т, J=7,3 Гц, 1H), 3,90 (кажущийся кв, J=5,4 Гц, 2H), 2,32-2,15 (м, 3Н), 2,30 (с, 3Н).
Анализ: Вычислено для C11H13NO3: С 63,76, Н 6,32, N 6, 76. Найдено: С 63,54, Н 6,20, N 6,76.
Ссылочный пример 18
Промежуточный продукт 10353-184-В
3,4-Дигидро-2-(2 -гидроксиэтил)-3-оксо-6-трифторметил -2Н-1,
4-бензоксазин
Получен из промежуточного продукта 11578-50 (ссылочный пример 9) способом В и выделен с выходом 54% в виде пушистого белого твердого продукта, MS (CI) 262 (МН+); ИК
(KBr) 3468, 3202, 3113, 3044, 2962, 2888, 1696, 1622, 1496, 1402, 1336, 1215, 1159, 1124, 1111, 1058, 878, 827, 807 см-1;1H ЯМР (CDCl3) δ 8,01 (шир.с, 1H), 7,
28 (м, 1H), 7,09 (д, J=8,4 Гц, 1H), 7,05 (с, 1Н), 4,86 (дд, J=8,2, 5,2 Гц, 1Н), 3,92 (кажущийся дд, J=12,7, 5,6 Гц, 2Н), 2,38-2,17 (м, 1Н), 1,92 (т, J=5,6 Гц, 1Н).
Анализ: Вычислено для С11Н10F3NО3: С 50,58, Н 3,86, N 5,36. HRMS: Вычислено для С11Н10F3NО3: (MH+): 262,0691. Найдено: 262,0740. Найдено: С 50,52, Н 3,86, N 5,28.
Ссылочный пример 19
Промежуточный продукт 11578-28
3,4-Дигидро-2-(2- гидроксиэтил)-5-метил-3-оксо -2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-25 (ссылочный пример 5) способом С с использованием 3 экв NiCl2•6H2O и 6 экв NaBH4 и выделен флэш-хроматографией
(элюирование эфиром) с выходом 39% в виде белого твердого продукта, т. пл. 147-149oС; ИК (КВr) 3221, 1683, 1502, 1480, 1266, 1225, 1099, 1057, 770, 723 см-1;1H ЯМР
(СDСl3) δ 2,14-2,32 (м, 3Н), 2,27 (с, 3Н), 4,71 (кв, J= 5,3 Гц, 2Н), 4,71 (дд, J=5,5, 7,4 Гц, 1Н), 6,82-6,94 (м, 3Н), 8,01 (шир.с, 1Н); MH+ при m/z=208.
Анализ: Вычислено для С11Н13NО3: С 63,76, Н 6,32, N 6,76. Найдено: С 63,38, Н 6,24, N 6,72.
Ссылочный пример 20
Промежуточный продукт
11578-68
6-Хлор-3,4-дигидро-2-(2 -гидроксиэтил)-3-оксо-2Н -1,4-бензоксазин
Получен способом С из промежуточного продукта 11578-61 (ссылочный пример 6) с использованием 3 экв NiC2•6H2O и 6 экв NaBH4. Выделен в виде белого твердого продукта с выходом 66%, т.пл. 135-138oС; ИК (КВr) 3475, 2956, 1690, 1498, 1385, 1059, 809 см-1;1H ЯМР (DMSO-d6) δ 1,95-2,08 (м, 1Н), 2,12-2,23 (м, 1Н), 3,33 (шир.с, 1H плюс DHO), 3,77-3,82 (м, 2Н), 4,69 (дд, J=8,9, 4,4 Гц, 1H), 6,87 (с, 2Н), 6,92 (с, 1H),
10,5 (шир.с, 1H); МН+ при m/z=228.
Анализ: Вычислено для С10Н10СlNО3: С 52,76, Н 4,43, N 6,15. Найдено: С 53,15, Н 4,50, N 6,16.
Ссылочный пример 21
Промежуточный продукт 11578-72
6-Карбометокси-3,4
-дигидро-2-(2-гидроксиэтил)-3- оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта
11578-62 (ссылочный пример 7) способом С с использованием 3 экв NiCl2•6H2O и 6 экв NaBH4 и выделен экстракцией этилацетатом с выходом 51% в виде белого твердого
продукта, т.пл. 167-169oС; ИК (КВr) 3428, 1729, 1688, 1494, 1400, 1305, 1214, 1049, 764 см-1;1H ЯМР (DMSO-d6) δ 1,93-2,05 (м, 1H), 2,10-2,16 (м, 1H),
3,34 (оч.шир. с, 1H), 3,75-3,78 (м, 2Н), 3,86 (с, 3Н), 4,77 (дд, J=9,1, 4,1 Гц, 1H), 7,00 (д, J=8,2 Гц, 1H), 7,57-7,62 (м, 2Н), 10,65 (шир.с, 1H).
Анализ: Вычислено для C12 H13NO5•0,2H2О: С 56,56, Н 5,30, N 5,50. Найдено: С 56,71, Н 5,18, N 5,35.
Ссылочный пример 22
Промежуточный продукт 11578-36
3,4-Дигидро-2-(2- гидроксиэтил)-6-фенил-3-оксо -2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-32 (ссылочный пример 8) способом С с выходом 55% и выделен в виде белого,
кристаллического твердого продукта, т. пл. 170-171oС; ИК (КВr) 3428, 1682, 1605, 1489, 1403, 1237, 1030, 863, 762 см-1;1Н ЯМР (DMSO-d6) δ 1,81-1,90
(м, 1H), 1,92-2,01 (м, 1Н), 3,53-3,63 (м, 2Н), 4,69 (дд, J=9,2, 3,9 Гц, 1H), 7,04 (д, J=8,3 Гц, 1H), 7,13 (д, J= 2,0 Гц, 1H), 7,21 (дд, J=8,4, 2,1 Гц, 1H), 7,31-7,36 (м, 1H), 7,45 (т, J=7,5 Гц, 2Н), 7,
54 (д, J=7,3 Гц, 2Н), 10,78 (с, 1H); МН+ при m/z=270.
Анализ: Вычислено для С16Н15NО3: С 71,36, Н 5,61, N 5,20. Найдено: С 71,06, Н 5,53, N 5,16.
Ссылочный пример 23
Промежуточный продукт 11578-42
3,4-Дигидро-7-фтор-2-(2 -гидроксиэтил)-3-оксо- 2Н-1,4-бензоксазин
Получен из промежуточного
продукта 11578-40 (ссылочный пример 10) способом С (время реакции 3 дня) с выходом 43% в виде белого, твердого продукта, т. пл. 136-138oС; ИК (КВr) 3474, 3199, 3087, 1676, 1514, 1425, 1150,
1113, 1054, 845 см-1;1H ЯМР (DMSO-d6) δ 1,95-2,07 (м, 1H), 2,12-2,23 (м, 1H), 3,79 (кв, J=5,2 Гц, 2Н), 4,01 (т, J=5,4 Гц, 1H), 4,71 (дд, J=8,8, 4,5 Гц, 1H), 6,
59-6,70 (м, 2Н), 6,85 (дд, J=8,6, 5,5 Гц, 1H), 10,34 (шир.с, 1H); МН+ при m/z=121.
Анализ: Вычислено для С10Н10FNO3: С 56,87, Н 4,77, N 6, 63. Найдено: С 56,75, Н 4,74, N 6,56.
Ссылочный пример 24
Промежуточный продукт 11578-45
3,4-Дигидро-2-(2- гидроксиэтил)-7-метил-3-оксо -2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-38 (ссылочный пример 11) способом С и выделен в виде белого кристаллического твердого продукта с выходом 49% после кристаллизации из этил ацетата, т.пл.
143-144oС; ИК (КВr) 3468, 3069, 1664, 1520, 1421, 1260, 1154, 1135, 1057, 931, 802 см-1;1H ЯМР (DMSO-d6) δ 1,72-1,86 (м, 1Н), 1,87-2,00 (м, 1Н), 2,
21 (с, 3Н), 3,54-3,60 (м, 2Н), 4,59 (дд, J=9,4, 3,9 Гц, 1Н), 4,65 (т, J=5,3 Гц, 1H), 6,72-6,78 (м, 3Н), 10,58 (с, 1Н); МН+ при m/z=208.
Анализ: Вычислено для С11Н13NО3: С 63,76, Н 6,32, N 6,76. Найдено: С 63,73, Н 6,30, N 6,67.
Ссылочный пример 25
Промежуточный продукт 11578-22
6,8-Дихлор-3,4-дигидро
-2-(2-гидроксиэтил)-3-оксо -2Н-1,4-бензоксазин
Получен из дигидро-3-(3,5-дихлор-2-нитрофенокси)-2(3Н)-фуранона способом С и выделен и виде белого твердого продукта с выходом 72%, т.пл.
174-176oС; ИК (КВr) 3056, 1702, 1598, 1478, 1386, 1227, 1055, 853 см-1;1H ЯМР (DMSO-d6) δ 1,77-1,87 (м, 1H), 1,89-1,95 (м, 1H), 3,55-3,63 (м, 2Н), 4,
72 (т, J= 5,2 Гц, 1H), 4,82 (дд, J=9,6, 3,7 Гц, 1H), 6,86 (д, J=2,3 Гц, 1H), 7,22 (д, J=2,5 Гц, 1H), 11,00 (шир.с, 1H); МН+ при m/z=262.
Анализ: Вычислено для C10 H9Cl2NO3: С 45,83, Н 3,46, N 5,34. Найдено: С 45,82, Н 3,49, N 5,29.
Ссылочный пример 26
Промежуточный продукт 11653-20А
3,
4-Дигидро-2-(2- гидроксиэтил)-6-нитро-3-оксо -2Н-1,4-бензоксазин
Получен из 2-амино-4-нитрофенола способом D с выходом 35%, т.пл. 173,5-175oC; MS (FAB) MH+ 239; ИК (KBr)
3401, 3092, 2932, 1595, 1536, 1499, 1323, 1213, 1144, 1100, 945, 474 см-1;1H ЯМР (DMSO-d6) δ 11,06 (шир.с, 1Н), 7,85 (дд, 1Н, J=2,59, 8,90 Гц), 7,74 (д, 1Н,
J=2,54 Гц), 7,17 (д, 1Н, J=8,90 Гц), 4,88 (дд, 1Н, J=3,88, 8,90 Гц), 4,71 (м, 1Н), 3,56 (м, 2Н), 2,03 (м, 1Н), 1,90 (м, 1Н).
Анализ: Вычислено для C10H10N2O5: С 50,42, Н 4,23, N 11,76. Найдено: С 50,48, Н 4,21, N 11,44.
Ссылочный пример 27
Промежуточный продукт 11653-156-А
3,4-Дигидро-6-фтор-2-(2
-гидроксиэтил)-3-оксо-2Н- 1,4-бензоксазин
Получен из 2-амино-4-фторфенола способом D с выходом 22%, т.пл. 126-129,5oС; MS (CI) MH+ 212; ИК (KBr) 3349, 3199, 3109, 3054,
2981, 2893, 1621, 1517, 1500, 1364, 1105, 1009, 946 см-1;1H ЯМР (DMSO-d6) δ 10,78 (шир.с, 1H), 6,98 (дд, 1Н, J=5,1, 8,8 Гц), 6,77 (д, 0,5Н, J=3,0 Гц), 6,74 (д,
0,5Н, J= 3,0 Гц), 6,70 (м, 0,5Н), 6,67 (д, 0,5Н, J=3,0 Гц), 4,65 (м, 2Н), 3,59 (м, 2Н), 1,96 (м, 1H), 1,79 (м, 1H).
Анализ: Вычислено для C10H10FNO3: С 56,87, Н 4,77, N 6,63. Найдено: С 56,55, Н 4,91, N 6,54.
Ссылочный пример 28
Промежуточный продукт 12168-5-1
3,4-Дигидро-2-(2-трет
-бутилдиметилсилоксиэтил)-6- метил-3-оксо 2Н-1,4-бензоксазин
Способ Е: промежуточный продукт 10353 189-1 (1,6 г, 1 экв, ссылочный пример 17) растворяли в ДМФ (4 мл) и обрабатывали
последовательно хлор-трет-бутилдиметилсиланом (1,4 г, 1,2 экв) и имидазолом (1,3 г, 2,5 экв) при перемешивании в атмосфере азота. Через 18 ч реакционную смесь разбавляли СН2Cl2 и
промывают водой. Органический слой концентрировали и продукт выделяли с выходом 93% в виде белого порошка путем кристаллизации из смеси МеОН/вода, MS (CI) 322 (МН+); ИК (КВr) 2953, 2927,
2883, 2856, 1698, 1609, 1523, 1496, 1360, 1234, 1119, 1093, 842, 832, 811, 778 см-1;1H ЯМР (CDCl3) δ 8,27 (шир. с, 1H), 6,86 (д, J=8,1 Гц, 1Н), 6,76 (дд, J=8,1,
1,7 Гц, 1Н), 6,61 (д, J= 1,7 Гц, 1H), 4,72 (дд, J=9,7, 3,7 Гц, 1H), 3,95-3,78 (м, 2Н), 2,28 (с, 3Н), 2,20 (м, 1H), 2,00 (м, 1H), 0,90 (с, 9Н), 0,70 (с, 3Н).
Анализ: Вычислено для C17H27NO3Si: С 63,51, Н 8,47, N 4,36. Найдено: С 63,90, Н 8,44, N 4,28.
Ссылочный пример 29
Промежуточный продукт 12168-8-1
3,
4-Дигидро-2-(2-трет -бутилдиметилсилоксиэтил)-3-оксо -6-трифторметил-2Н- 1,4-бензоксазин
Получен из промежуточного продукта 10353-184-В (ссылочный пример 18) способом Е в виде белого твердого
продукта с выходом 90%, MS (CI) 376 (МН+); ИК (КВr) 3027, 3076, 2956, 2931, 2883, 2859, 1698, 1615, 1495, 1390, 1335, 1257, 1222, 1164, 1125, 1095, 1069, 956, 833, 777 см-1;1H ЯМР (CDCl3) δ 8,59 (шир.с, 1H), 7,25 (м, 1H), 7,06 (м, 2Н), 4,85 (дд, J=9,2, 3,8 Гц, 1H), 3,85 (м, 2Н), 2,23 (м, 1H), 2,02 (м, 1H), 0,89 (с, 9Н), 0,07 (с, 3Н), 0,06 (с,
3Н).
Анализ: Вычислено для C17H24F3NO3Si: С 54,38, Н 6,44, N 3,73. Найдено: С 54,34, Н 6,45, N 3,73. HRMS: Вычислено для C17 H24F3NO3Si (MH+): 376,1556. Найдено: 376,1570.
Ссылочный пример 30
Промежуточный продукт 10353-188-А
3,
4-Дигидро-2-(2-трет- бутилдиметилсилоксиэтил)-3-оксо -2Н-пиридо[2,3-b] -1,4-оксазин
Получен из 3,4-дигидро-2-(2-гидроксиэтил)-3-оксо-2Н-пиридо[2,3-b]-1,4-оксазина способом F с выходом 91% в
виде не совсем белых хлопьев, MS (CI) 309 (МН+); ИК (КВr) 3053, 2955, 2884, 2857, 1699, 1610, 1510, 1463, 1375, 1357, 1278, 1256, 1092, 836, 775 см-1;1H ЯМР (CDCl3) δ 10,40 (шир.с, 1Н), 8,04 (дд, J=5,4, 1,4 Гц, 1H), 7,26 (д, J=7,7 Гц, 1Н), 7,00 (дд, J=7,7, 5,4 Гц, 1H), 4,83 (дд, J=9,5, 4,1 Гц, 1H), 3,84 (м, 2Н), 2,25 (м, 1H), 2,03 (м, 1H), 0,89 (с,
9Н), 0,07 (с, 3Н), 0,06 (с, 3Н).
HRMS Вычислено для C15H24N2O3Si (MH+): 309,1634. Найдено: 309,1608.
Ссылочный
пример 31
Промежуточный продукт 11653-23
2-(2-трет-Бутилдиметилсилоксиэтил) -3,4-дигидро-7-нитро-3- оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11653-29А
(ссылочный пример 15) способом Е и выделен перекристаллизацией из смеси диэтиловый эфир/гексан, т. пл. 152-157oС; MS (FAB) MH+ 353; ИК (КВr) 3548, 3209, 3094, 2936, 2889, 1702,
1600, 1529, 1509, 1483, 1418, 1390, 1344, 1229, 1133, 1035 см-1;1H ЯМР (CDCl3) δ 9,45 (шир.с, 1H), 7,95 (дд, 1H, J=2,4, 8,6 Гц), 7,91 (д, 1H, J= 2,3 Гц), 6,98
(д, 1H, J=8,6 Гц), 4,93 (дд, 1H, J=3,9, 9,0 Гц), 3,90 (м, 2Н), 2,28 (м, 1H), 2,04 (м, 1H), 0,93 (с, 9Н), 0,12 (с, 3Н), 0,10 (с, 3Н).
Анализ: Вычислено для C16H24 N2O5Si: С 54,52, Н 6,86, N 7,95. Найдено: С 54,14, Н 6,64, N 8,18.
Ссылочный пример 32
Промежуточный продукт 11653-33А
2-(2-трет-Бутилдиметилсилоксиэтил) -3,4-дигидро-6-нитро-3 -оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11653-20А (ссылочный пример 26) способом Е с выходом 92%, т.пл. 121,5-124,
5oС; MS (FAB) MH+ 353; ИК (KBr) 3190, 3125, 3055, 2952, 2884, 2426, 1921, 1623, 1446, 1296, 1281, 1209, 1004, 925, 682, 512 см-1;1H ЯМР (CDCl3)
δ 7,10 (дд, 1H, J=2,65, 8,79 Гц), 7,75 (д, 1Н, J= 2,56 Гц), 6,96 (дд, 1H, J=4,99, 8,68 Гц), 4,80 (дд, 1H, J=3,88, 9,30 Гц), 3,78 (м, 2Н), 2,18 (м, 1H), 1,95 (м, 1H), 0,82 (с, 9Н), 0,01 (д, 6Н,
J=3,51 Гц).
Анализ: Вычислено для C16H24N2O5: С 54,52, Н 6,86, N 7,95. Найдено: С 54,18, Н 6,51, N 8,29.
Ссылочный пример
33
Промежуточный продукт 11653-163-A1
2-(2-трет- Бутилдиметилсилоксиэтил)-3,4- дигидро-6-фтор-3-оксо- 2Н-1,4-бензоксазин
Получен из промежуточного продукта 11653-156-А
(ссылочный пример 27) способом Е с выходом 77%, т.пл. 84-86oС; MS (CI) МН+ 326; ИК (KBr) 3101, 3066, 2951, 2931, 2893, 2857, 1692, 1622, 1518, 1499, 1469, 1386, 1292, 1248, 1108,
1006, 812 см-1;1H ЯМР (CDCl3) δ 8,86 (шир.с, 1H), 6,92 (дд, 1H, J=4,9, 8,8 Гц), 6,67 (м, 1H), 6,60 (дд, 1H, J=2,9, 8,5 Гц), 4,73 (дд, 1H, J= 3,7, 9,5 Гц), 3,
91-3,78 (м, 2Н), 2,26 (м, 1H), 1,98 (м, 1H), 0,89 (с, 9Н), 0,08 (с, 3Н), 0,07 (с, 3Н).
Анализ: Вычислено для C16H24FNO3Si: С 59,05, Н 7,43, N 4,30. Найдено: С 59,01, Н 7,54, N 4,16.
Ссылочный пример 34
Промежуточный продукт 11578-31
2(2-трет- Бутилдиметилсилоксиэтил)-3,4 -дигидро-5-метил-3-оксо -2Н-1,
4-бензоксазин
Получен из промежуточного продукта 11578-28 (ссылочный пример 19) способом Е и выделен непосредственно из реакционной смеси с выходом 24% в виде белого твердого продукта путем
добавления воды и сбора осадка, т.пл. 90-92oС; ИК (КВr) 2953, 2927, 2855, 1693, 1502, 1482, 1390, 1360, 1250, 1119, 1093, 959, 837, 780, 769 см-1;1H ЯМР (CDCl3) δ 0,07 (с, 3Н), 0,08 (с, 3Н), 0,90 (с, 9Н), 1,92-2,03 (м, 1Н), 2,17-2,26 (м, 1Н), 2,26 (с, 3Н), 3,78-3,93 (м, 2Н), 4,72 (дд, J=3,7, 9,7 Гц, 1Н), 6,81-6,92 (м, 3Н), 8,04 (шир.с, 1Н).
Анализ: Вычислено для C17H27NO3Si: С 63,51, Н 8,47, N 4,36. Найдено: С 63,50, Н 8,53, N 4,24.
Ссылочный пример 35
Промежуточный
продукт 11578-70
2-(2-трет-Бутилдиметилсилоксиэтил) -6-хлор-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин
Получен из 11578-68 (ссылочный пример 20) способом Е с использованием 1 экв
имидазола и трет-бутилдиметилсилилхлорида и выделен с выходом 44% в виде белого твердого продукта после растирания с гексаном, т.пл. 86-89oС; МН+ при m/z= 342; ИК (КВr) 2955,
2928, 2881, 2857, 1700, 1496, 1400, 1360, 1231, 1124, 1094, 954, 834 см-1;1H ЯМР (СОСl3) δ 0,07 (с, 3Н), 0,08 (с, 3Н), 0,89 (с, 9Н), 1,96-2,05 (м, 1Н), 2,16-2,
24 (м, 1Н), 3,81-3,89 (м, 2Н), 4,76 (дд, J= 9,4, 3,7 Гц, 1Н), 6,83 (д, J=2 Гц, 1Н), 6,89-6,98 (м, 3Н), 8,80 (шир.с, 1Н).
Анализ: Вычислено для С16Н24СlNО3Si: С 56,21, Н 7,08, N 4,10. Найдено: С 56,59, Н 7,17, N 4,04.
Ссылочный пример 36
Промежуточный продукт 11578-44
2-(2-трет- Бутилдиметилсилоксиэтил)-3,4
-дигидро-7-фтор-3-оксо- 2Н-1,4-бензоксазин
Получен из 11578-42 (ссылочный пример 23) способом Е и выделен непосредственно из реакционной смеси с выходом 80% в виде белого твердого продукта
путем добавления воды и сбора осадка, т.пл. 100-102oС; ИК (КВr) 2958, 2928, 2888, 2854, 1697, 1667, 1517, 1428, 1367, 1252, 1150, 1112, 1084, 833, 779 см-1;1H ЯМР
(CDCl3) δ 0,07 (с, 3Н), 0,08 (с, 3Н), 0,90 (с, 9Н), 1,96-2,05 (м, 1Н), 2,16-2,27 (м, 1Н), 3,80-3,91 (м, 2Н), 4,77 (дд, J=9,5, 3,8 Гц), 6,64-6,80 (м, 3Н), 9,05 (шир.с, 1Н).
Анализ: Вычислено для C16H24FNO3Si: С 59,05, Н 7,43, N 4,30. Найдено: С 58,98, Н 7,39, N 4,27.
Ссылочный пример 37
Промежуточный
продукт 11578-30
2-(2-трет- Бутилдиметилсилоксиэтил)-6,8-дихлор -3,4-дигидро-3-оксо- 2Н-1,4-бензоксазин
Получен из 11578-22 (ссылочный пример 25) способом Е и выделен непосредственно
из реакционной смеси с выходом 90% в виде белого твердого продукта путем добавления воды и сбора осадка, т.пл. 118-120oС; ИК (КВr) 2954, 2931, 2885, 2857, 1702, 1480, 1404, 1254, 1085, 838,
778 см-1;1H ЯМР (СОСl3) δ 0,07 (с, 3Н), 0,08 (с, 3Н), 0,90 (с, 9Н), 1,94-2,03 (м, 1Н), 2,15-2,21 (м, 1Н), 3,77-3,89 (м, 1Н), 3,93 (тд, J=9,7, 4,4 Гц, 1Н), 4,89
(дд, J= 9,8, 3,5 Гц, 1Н), 6,78 (д, J=2,3 Гц, 1Н), 7,05 (д, J=2,3 Гц, 1Н), 9,39 (шир.с, 1Н).
Анализ: Вычислено для C16H23Cl2NO3Si: С 51,06, Н 6,16, N 3,72. Найдено: С 50,72, Н 5,87, N 3,82.
Ссылочный пример 38
Промежуточный продукт 11578-77-предшественник
2-(2-трет- Бутилдиметилсилоксиэтил)-6- карбометокси-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-72 (ссылочный пример 21) способом Е с выходом 80%. Сырой
продукт использовали без дальнейшей очистки. МН+ при m/z 366.
Ссылочный пример 39
Промежуточный продукт 12168-10-1
4-(3-Хлорбензил)-3,4
-дигидро-2-(2-гидроксиэтил) -3-оксо-6-метил-2Н- 1,4-бензоксазин
Получен в две стадии, начиная с промежуточного продукта 12168-51 (ссылочный пример 28).
Способ F: Раствор силилированного спирта (2,17 г, 1 экв) в ДМФ (20 мл) обрабатывали NaH (60% масляная дисперсия, 0,27 мг, 1 экв) в виде одной порции и перемешивали при комнатной температуре в атмосфере азота в течение 20 мин с последующим добавлением 3-хлорбензилбромида (0,89 мл, 1 экв). Через 14 ч сырую реакционную смесь выливали в холодную воду и экстрагировали этилацетатом. Объединенный органический экстракт промывали солевым раствором и концентрировали в вакууме. Сырой продукт использовали в следующей стадии без дальнейшей очистки.
Способ G: Продукт из способа F растворяли в ТГФ (15 мл) и добавляли фторид тетрабутиламмония (1 М раствор в ТГФ, 13 мл, 2 экв). После перемешивания при комнатной температуре в течение 8 ч реакционную смесь концентрировали в вакууме. Сырой продукт очищали флэш-хроматографией, элюируя этилацетатом, и дополнительно очищали растиранием с горячим гексаном, получая продукт с общим выходом 93% в виде белого твердого вещества, т.пл. 75-78oС; MS (CI) 322 (МН+); ИК (КВr) 3501, 3451, 3062, 1969, 2937, 2874, 1660, 1610, 1598, 1575, 1513, 1473, 1432, 1387, 1321, 1280, 1258, 1106, 1067, 1061, 934, 775, 698 см-1;1H ЯМР (CDCl3) δ 7,27 (м, 3Н), 7,17 (м, 1Н), 6,90 (д, J=8,1 Гц, 1H), 6,79 (д, J=7,0 Гц, 1Н), 6,63 (с, 1H), 5,17 (д, J=16,3 Гц, 1H), 5,08 (д, J= 16,3 Гц, 1H), 4,80 (дд, J=7,6, 5,5 Гц, 1H), 3,92 (кажущийся кв, J=5,8 Гц, 2Н), 2,29-2,17 (м, 3Н), 2,23 (с, 3Н).
HRMS: Вычислено для C18H18ClNO3 (MH+): 332,1053. Найдено: 332, 1041.
Ссылочный пример 40
Промежуточный продукт 10353-191-1
4-(3-Хлорбензил) -3,4-дигидро-2-(2- гидроксиэтил)-3-оксо-6-метил -2Н-пиридо[2,3-b]-1,4-оксазин
Получен из промежуточного продукта 10353-188-А (ссылочный пример 40) способами F и G с алкилированием 3-хлорбензилбромидом с общим выходом 69% в виде не совсем белого порошка, т.пл. 80-81oС;
MS (CI) 319 (МН+); ИК (КВr) 3525, 3446, 2928, 2874, 1667, 1600, 1574, 1465, 1411, 1362, 1325, 1285, 1230, 1205, 1121, 1096, 1064, 797, 750 см-1;1H ЯМР (CDCl3) δ 8,04 (дд, J= 4,8, 1,5 Гц, 1Н), 7,42 (с, 1Н), 7,37-7,18 (м, 4Н), 6,96 (дд, J=7,9, 4,8 Гц, 1Н), 5,31 (с, 2Н), 4,85 (дд, J=7,5, 5,4 Гц, 1H), 3,90 (м, 2Н), 2,35-2,16 (м, 2Н), 2,04 (т, 5,
6 Гц, 1Н).
HRMS: Вычислено для C16H15ClN2O3 (МН+): 319,0849. Найдено: 319,0857.
Ссылочный пример 41
Промежуточный продукт 10353-28-1
4-(4-Хлорбензил)-3,4 -дигидро-2-(2-гидроксиэтил) -3-оксо-2Н- 1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро -3-оксо-2Н-1,
4-бензоксазина способами F и G с алкилированием 4-хлорбензилхлоридом с общим выходом 63% в виде белого твердого продукта, т.пл. 86-88oС; MS (CI) 300 (МН+-Н2О); ИК
(КВr) 3496, 2977, 2890, 1656, 1607, 1501, 1466, 1401, 1297, 1250, 1088, 1061, 1018, 795, 747 см-1;1H ЯМР (CDCl3) δ 7,28 (д, J=8,5 Гц, 2Н), 7,18 (д, J=8,5 Гц,
2Н), 7,05-6,87 (м, 3Н), 6,83 (д, J=8,0 Гц, 1H), 5,12 (с, 2Н), 4,83 (дд, J=7,5, 5,5 Гц, 1H), 3,92 (кажущийся т, J=5,7 Гц, 2Н), 2,38-2,15 (м, 3Н).
Анализ: Вычислено для C17 H16ClNO3: С 64,26, Н 5,08, N 4,41. Найдено: С 64,01, Н 5,08, N 4,37.
Ссылочный пример 42
Промежуточный продукт 9086-189-1
4-(2-Хлорбензил)-3,4
-дигидро-2-(2-гидроксиэтил)-3- оксо-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазина способами F и G с алкилированием
2-хлорбензилхлоридом с общим выходом 65% в виде белого порошка, т. пл. 90-91,5oС; MS (CI) 318 (МН+-Н2О); ИК (КВr) 3482, 2935, 2881, 1663, 1607, 1594, 1505, 1466, 1443,
1407, 1320, 1306, 1283, 1252, 1063, 749 см-1;1H ЯМР (CDCl3) δ 7,42 (дд, J= 7,6, 1,5 Гц, 1Н), 7,30-7,13 (м, 2Н), 7,08-9,88 (м, 4Н), 6,73 (дд, J=7,9, 1,3 Гц, 1Н),
5,25 (д, J=17,2 Гц, 1Н), 5,23 (д, J=17,3 Гц, 1Н), 4,88 (дд, J=7,5, 5,5 Гц, 1Н), 3,95 (кажущийся кв, J=5,9 Гц, 2Н), 2,40-2,20 (м, 2Н), 2,19 (т, J=5,9 Гц, 1Н).
Анализ: Вычислено для C17H16ClNO3: С 64,26, Н 5,08, N 4,41. Найдено: С 64,41, Н 5,00, N 4,47.
Ссылочный пример 43
Промежуточный продукт 12168-25-1
4-(3-Хлорбензил)-3,4 -дигидро-2-(2-гидроксиэтил)-3- оксо-6-метокси-2Н -1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил)-3,4 -дигидро-6-метокси-3- оксо-2Н-1,4-бензоксазина
способами F и G с алкилированием 3-хлорбензилбромидом с общим выходом 80%. Выделен кристаллизацией из смеси этанол/вода в виде белого порошка; MS (CI) 348 (МН+); ИК (КВr) 3501, 3053, 3021,
2959, 2933, 2876, 2838, 1664, 1618, 1600, 1575, 1512, 1466, 1445, 1435, 1390, 1361, 1337, 1313, 1272, 1237, 1201, 1173, 1107, 1078, 1049, 1030 см-1;1H ЯМР (CDCl3)
δ 7,27-7,20 (м, 3Н), 7,13 (м, 1Н), 6,94 (д, J=8,8 Гц, 1H), 6,52 (дд, J= 9,1, 2,7 Гц, 1Н), 6,41 (д, J=2,7 Гц, 1H), 5,12 (д, J=16,2 Гц, 1H), 4,79 (дд, J=8,2, 5,4 Гц, 1H), 3,92 (м, 2Н), 3,68 (с,
3Н), 3,39-2,16 (м, 2Н), 2,17 (т, J=5,9 Гц, 1H).
Анализ: Вычислено для C18H18ClNO4 • 0,25Н2О: С 61,37, Н 5,29, N 3,98. Найдено: С 61, 35, Н 5,14, N 3,95.
Ссылочный пример 44
Промежуточный продукт 11578-41
4-(3-Хлорбензил)-3,4-дигидро -2-(2-гидроксиэтил)-3-оксо -6-фенил-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-6-фенил -2Н-1,4-бензоксазина способами F и G с алкилированием 3-хлорбензилбромидом и вьщелен в виде белого кристаллического твердого
продукта с общим выходом 27%, т.пл. 119-121oС; ИК (КВr) 3517, 1659, 1487, 1435, 1387, 1282, 1260, 1060, 760 см-1;1H ЯМР (СDС13) δ 2,22-2,38 (м, 3Н),
3,95 (оч.шир.с, 2Н), 4,90 (дд, J=7,6, 5,5 Гц, 1Н), 5,18 (ABq, JAB=17,1 Гц, 2H), 7,04 (д, J= 1,9 Гц, 1Н), 7,08 (д, J=8,3 Гц, 1Н), 7,15-7,42 (м, 10Н); МН+ при m/z=394.
Анализ: Вычислено для С23Н20СlNО3: С 70,14, Н 5,12, N 3,56. Найдено: С 70,10, Н 5,11, N 3,51.
Ссылочный пример 45
Промежуточный
продукт 10508-24-А
4-(3-Фторбензил)-3,4-дигидро -2-(2-гидроксиэтил)-3-оксо -2Н-1,4-бензоксазин
Получен из 2-(2-трет- бутилдиметилсилоксиэтил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазина
способами F и G с алкилированием 3-фторбензилхлоридом с общим выходом 49% и выделен в виде смолистого твердого продукта; ИК (КВг) 3425, 1683, 1501, 1401, 1252, 1061, 751 см-1;1H
ЯМР (СDСl3) δ 2,16-2,38 (м, 3Н), 3,92 (т, J= 5,8 Гц, 2Н), 4,85 (дд, J=7,6, 5,5 Гц, 1Н), 5,14 (с, 2Н), 6,82-6,85 (м, 1Н), 6,90-7,08 (м, 6Н), 7,26-7,33 (м, 1Н); MH+ при
m/z=302.
Анализ: Вычислено для C17H16FNO3: С 67,76, Н 5,35, N 4,65. Найдено: С 67,48, Н 5,34, N 4,57.
Ссылочный пример 46
Промежуточный продукт 10840-33
3,4-Дигидро-2-(2- гидроксиэтил)-4-(4- метилбензил)-3-оксо-2Н -1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н -1,
4-бензоксазина способами F и G с алкилированием 4-метилбензилхлоридом с общим выходом 50%. Этот материал кристаллизовали из эфира, получая белый твердый продукт, т.пл. 92-94oС; ИК (КВr)
3496, 1659, 1503, 1405, 1304, 1283, 1248, 1063, 801 см-1;1H ЯМР (СDС13) δ 2,18-2,36 (м, 5Н), 3,91 (кв, J=5,7 Гц, 2Н), 4,83 (дд, J=7,4, 5,7 Гц, 1Н), 5,12 (с,
2Н), 6,90-7,00 (м, 4Н), 7,13 (с, 4Н); MH+ при m/z=298.
Анализ: Вычислено для C18H19NO3: С 72,71, Н 6,44, N 4,71. Найдено: С 72,71, Н 6,48, N 4,65.
Ссылочный пример 47
Промежуточный продукт 10508-19
3,4-Дигидро-2-(2-гидроксиэтил) -4-(4-метоксибензил)-3-оксо -2Н-1,4-бензоксазин
Получен из
2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3 -оксо-2Н-1,4-бензоксазина способами F и G с алкилированием 4-метоксибензилхлоридом с общим выходом 48% после флэшхроматографии с элюированием смесью
этилацетат/гексан, т. пл. 80-82oС; ИК (КВг) 3496, 1660, 1515, 1501, 1412, 1250, 1057, 754 см-1;1H ЯМР (CDCl3) δ 2,00 (оч.шир.с, 1Н), 2,16-2,37 (м,
2Н), 3,77 (с, 3Н), 3,91 (т, J=6,1 Гц, 2Н), 4,82 (дд, J=7,5, 5,6 Гц, 1Н), 5,09 (с, 2Н), 6,85 (д, J=8,7 Гц, 2Н), 6,91-7,00 (м, 4Н), 7,18 (д, J=8,7 Гц, 2Н); МН+ при m/z=314.
Анализ: Вычислено для C18H19NO4: С 68,99, Н 6,11, N 4,47. Найдено: С 69,22, Н 6,10, N 4,35.
Ссылочный пример 48
Промежуточный продукт
10005-181-1
4-(3,5-Дихлорбензил)-3,4 -дигидро-2-(2-гидроксиэтил) -3-оксо-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазина
способами F и G с алкилированием 3,5-дихлорбензилхлоридом с общим выходом 89%. Образец кристаллизовали из смеси СН2Сl2/гексан/эфир, получая белый твердый продукт, т.пл.
104-106oС; ИК (КВr) 3525, 1680, 1570, 1505, 1398, 1063, 760 см-1;1H ЯМР (CDCl3) δ 1,92 (шир.с, 1Н), 2,17-2,37 (м, 2Н), 3,93 (т, J=5,7 Гц, 2Н), 4,87
(кв, J=5,4 Гц, 1Н), 5,13 (ABq, JAB=16,3 Гц, 2Н), 6,78 (д, J=7,3 Гц, 1Н), 6,93-7,05 (м, 2Н), 7,12 (шир.д, J=1,7 Гц, 2Н), 7,26-7,28 (м, 2Н).
Анализ: Вычислено для C17H15Cl2NO3: С 57,97, Н 4,29, N 3,98. Найдено: С 57,96, Н 4,17, N 3,87.
Ссылочный пример 49
Промежуточный продукт 11578-71
6-Хлор-4-(3-хлорбензил) -3,4-дигидро-2-(2-гидроксиэтил) -3-оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-70 (ссылочный пример 35) способами F и G с алкилированием
3-хлорбензилбромидом
и выделен с общим выходом 43% в виде белого твердого продукта, т.пл. 90-92oС; ИК (КВr) 3499, 1663, 1601, 1497, 1433, 1386, 1324, 1267, 1091, 1050, 933, 783
см-1;1H ЯМР (CDCl3) δ 2,05 (шир.с, 1H), 2,18-2,30 (м, 2Н), 3,89-3,97 (м, 2Н), 4,86 (дд, J=7,7, 5,5 Гц, 1H), 5,1 (с, 2Н), 6,81 (с, 1H), 6,96 (д, J=1,4 Гц, 2Н),
7,12-7,30 (м, 4Н); МН+ при m/z=352.
Анализ: Вычислено для C17H15Cl2NO3: С 57,95, H 4,29, N 3,98. Найдено: С 58,26, H 4,32, N 3, 89.
Ссылочный пример 50
Промежуточный продукт 11578-56
0,2 Гидрата 4-(3-хлорбензил)-6 -трифторметил-3,4-дигидро -2-(2-гидроксиэтил)-3- оксо-2Н-1,4-бензоксазина
Получен из промежуточного продукта 12168-8-1 (ссылочный пример 29) способами F и G с алкилированием 3-хлорбензилбромидом с общим выходом 96% в виде белого кристаллического твердого продукта,
т.пл. 92-94oС; ИК (КВr) 3520, 1671, 1454, 1330, 1299, 1269, 1120, 868, 712 см-1;1H ЯМР (CDCl3) δ 2,20-2,40 (м, 2Н), 3,92 (т, J=6,3 Гц, 2Н), 4,93 (т,
J=7,6 Гц, 1H), 5,14 (с, 2Н), 7,07-7,16 (м, 3Н), 7,23-7,30 (м, 4Н); MH+ при m/z=386.
Анализ: Вычислено для C18H15ClF3NO3 • 0,2H2O: С 55,52, H 3,99, N 3,60. Найдено: С 55,49, H 3,77, N 3,53.
Ссылочный пример 51
Промежуточный продукт 11578-77
6-Карбометокси-4-(3- хлорбензил)-3,
4-дигидро-2-(2 -гидроксиэтил)-3-оксо-2Н -1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил)-6-карбометокси-3,4-дигидро-3-оксо-2Н-1,4-бензоксазина способами F и G с алкилированием
3-хлорбензилбромидом и выделен в виде белого твердого продукта после растирания с гексаном с общим выходом 70%, ИК (КВr) 3468, 2952, 1688, 1452, 1285, 1260, 765 см-1;1H ЯМР
(COCl3) δ 1,61 (шир.с, 1Н плюс HDO), 2,17-2,39 (м, 2Н), 3,86 (с, 3Н), 3,93 (т, J=5,7 Гц, 2Н), 4,94 (дд, J=7,6, 5,5 Гц, 1Н), 5,16 (с, 2Н), 7,04 (д, J=8,4 Гц, 1H), 7,15-7,33 (м, 4Н), 7,
59 (д, J=1,8 Гц, 1Н), 7,71 (дд, J=8,4, 1,8 Гц, 1Н); MH+ при m/z=376.
Анализ: Вычислено для C19H18ClNO5 • 0,1H2O: С 60,44, H 4,86, N 3,71. Найдено: С 60,26, H 4,60, N 3,58.
Ссылочный пример 52
Промежуточный продукт 11578-47
4-(3-Хлорбензил)-3,4
-дигидро-7-фтор-2-(2- гидроксиэтил)-3-оксо- 2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-44 (ссылочный пример 36) способами F и G с алкилированием 3-хлорбензилбромидом с общим
выходом 76%. Этот материал выделяли в виде не совсем белого твердого продукта, т.пл. 79-82oС; ИК (КВr) 3487, 1662, 1508, 1412, 1320, 1155, 1115, 1053, 854, 799 см-1;1
H ЯМР (CDCl3) δ 2,10 (т, J=4,3 Гц, 1H), 2,18-2,40 (м, 2Н), 3,92 (кв, J=6,0 Гц, 2Н), 4,88 (т, J=5,5 Гц, 1H), 5,10 (ABq, JAB=15,4 Гц, 2Н), 6,64 (тд, J=7,9, 2,7 Гц, 1H), 6,
72-6,79 (м, 2Н), 7,11 (шир.с, 1H), 7,22-7,28 (м, 3Н плюс СНCl3); MH+ при m/z=336.
Анализ: Вычислено для C17H15ClFNO3: С 60,81, H 4,50, N 4,17. Найдено: С 60,74, H 4,69, N 4,28.
Ссылочный пример 53
Промежуточный продукт 11578-113
7-Фтор-3,4-дигидро-4-(3 -фторбензил)-2-(2- гидроксиэтил)-3-оксо
-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11578-44 (ссылочный пример 36) способами F и G с алкилированием 3-фторбензилхлоридом и выделен в виде белого твердого продукта с выходом
67%, т.пл. 78-79oС; ИК (КВr) 3497, 1661, 1509, 1415, 1252, 1159, 1119, 1057, 937, 857, 801 см-1;1H ЯМР (CDCl3) δ 2,11 (т, J= 5,1 Гц, 1H), 2,17-2,39
(м, 2Н), 3,92 (кв, J=5,5 Гц, 2Н), 4,87 (дд, J=7,6, 5,5 Гц, 1H), 5,13 (с, 2Н), 6,64 (тд, J=8,0, 2,7 Гц, 1H), 6,73-6,79 (м, 2Н), 6,94 (т, J=8,5 Гц, 2Н), 7,01 (с, J=7,7 Гц, 1H), 7,27-7,35 (м, 1H); МН+ при m/z=320.
Анализ: Вычислено для C17H15F2NO3: С 63,95, H 4,74, N 4,39. Найдено: С 63,91, H 4,70, N 4,30.
Ссылочный пример 54
Промежуточный продукт 11578-114
7-Фтор-3,4-дигидро-2-(2- гидроксиэтил)-4-(2- нитробензил)-3-оксо-2Н -1,4-бензоксазин
Получен из промежуточного продукта
11578-44 (ссылочный пример 36) способами F и G с алкилированием 2-нитробензилхлоридом и выделен в виде белого твердого продукта после колоночной хроматографии при элюировании эфиром с выходом 76%.
Часть этого материала кристаллизовали из гексана, т.пл. 123-124oС; ИК (КВr) 3510, 1655, 1527, 1509, 1357, 1157, 1127, 1063, 801 см-1;1H ЯМР (CDCl3) δ
2,01 (т, J=5,1 Гц, 1H), 2,22-2,38 (м, 2Н), 3,93 (кв, J=5,6 Гц,
2Н), 4,92 (дд, J=7,54, 5,63 Гц, 1H), 5,23 (ABq, JAB=16,5 Гц, 2Н), 6,63-6,75 (м, 2Н), 6,80 (дд, J=8,7, 2,6 Гц, 1H), 7,51-7,
60 (м, 2Н), 8,12 (с, 1Н), 8,15 (д, J=7,1 Гц, 1H); МН+ при m/z=347.
Анализ: Вычислено для C17H15FN2O5: С 58,96, H 4,37, N 8,09. Найдено: С 58,81, H 4,37, N 8,01.
Ссылочный пример 55
Промежуточный продукт 11578-52
4-(3-Хлорбензил)-3,4-дигидро -2-(2-гидроксиэтил)-7 -метил-3-оксо-2Н- 1,
4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-7-метил-3-оксо -2Н-1,4-бензоксазина способами F и G с алкилированием 3-хлорбензилбромидом и выделен с выходом 76% в
виде белого твердого продукта после кристаллизации из смеси эфир/гексан, т.пл. 72-74oС; ИК (КВr) 3418, 1679, 1512, 1402, 1292, 1061, 763 см-1;1H ЯМР (CDCl3
) δ 2,20-2,36 (м, 3Н), 2,27 (с, 3Н), 3,92 (кв, J=5,6 Гц, 2Н), 4,83 (дд, J=7,6, 5,5 Гц, 1H), 5,10 (ABq, JAB= 17,0 Гц, 2Н), 6,68-6,75 (м, 2Н), 6,84 (с, 1H), 7,10-7,14 (м, 1H), 7,22-7,
29 (м, 3Н); МН+ при m/z=332.
Анализ: Вычислено для C18H18ClNO3 • 0,2Н2О: С 64,46, H 5,53, N 4,18. Найдено: С 64,48, H 5, 51, N 4,06.
Ссылочный пример 56
Промежуточный продукт 11578-33
4-(3-Хлорбензил)-6,8- дихлор-3,4-дигидро-2-(2- гидроксиэтил)-3-оксо-2Н -1,4-бензоксазин
Получен из промежуточного продукта 11578-30 (ссылочный пример 37) способами F и G с алкилированием 3-хлорбензилбромидом с выходом 80%. Этот материал выделяли в виде белой пены после флэш-хроматографии
с использованием смеси эфир/CH2Cl2 (1/4); ИК (KBr) 3430, 1694, 1592, 1480, 1434, 1380, 1285, 1059, 933, 843, 755 см-1;1H ЯМР (CDCl3) δ 2,
00 (т, J=5,4 Гц, 1H), 2,15-2,40 (м, 2Н), 3,92-4,03 (м, 2Н), 4,97 (дд, J=8,8, 4,7 Гц, 1H), 5,09 (с, 2Н), 6,72 (д, J= 2,3 Гц, 1H), 7,08 (д, J=2,2 Гц, 1H), 7,20 (с, 1H), 7,26-7,30 (м, 2Н плюс СНCl3).
Анализ: Вычислено для C17H14Cl3NO3: С 52,81, H 3,65, N 3,62. Найдено: С 52,90, H 3,73, N 3,46.
Ссылочный пример
57
Промежуточный продукт 10840-18
3,4-Дигидро-2-(2- гидроксиэтил)-3-оксо-4-(2 -пиколил)-2Н-1,4-бензоксазин
2-(2-трет-Бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н-1,
4-бензоксазин алкилировали 2-хлорметилпиридином способом F и сырой продукт освобождали от защитной группы способом H без очистки.
Способ Н: трет-Бутилдиметилсилоксипромежуточный продукт растворяли в метаноле и избытке 6 н. HCl. Раствор перемешивали при комнатной температуре в течение 1 ч и затем концентрировали в вакууме. Водный остаток экстрагировали дихлорметаном и объединенный экстракт промывали солевым раствором и сушили над Na2SO4. Удаление растворителя давало сырой продукт, который очищали флэш-хроматографией и выделяли с выходом 42% в виде белого твердого вещества после кристаллизации из смеси эфир/гексан, т.пл. 108-111oС; ИК (KBr) 2881, 1675, 1505, 1401, 1279, 1115, 1070, 749 см-1;1H ЯМР (CDCl3) δ 2,18-2,38 (м, 2Н), 2,44 (шир.с, 1H), 3,92 (шир.д, J=3,8 Гц, 2Н), 4,86 (дд, J=7,2, 5,8 Гц, 1H), 5,27 (ABq, JAB=16,3 Гц, 2Н), 6,89-7,03 (м, 4Н), 7,17-7,24 (м, 2Н), 7,64 (тд, J=7,7, 1,7 Гц, 1Н), 8,56 (шир.д, J=4,3 Гц, 1Н); MH+ при m/z=285.
Анализ: Вычислено для C16H16N2O3: С 67,59, H 5,67, N 9,85. Найдено: С 67,55, H 5,83, N 9,83.
Ссылочный пример 58
Промежуточный продукт 10840-22
3,4-Дигидро-2-(2- гидроксиэтил)-3-оксо-4-(4- пиколил)-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н-1,4-бензоксазина способами F и H с алкилированием 4-хлорметилпиридином с выходом 12% и выделен в виде твердого продукта, т.пл.
153-154oС; ИК (КВr) 3204, 1679, 1505, 1407, 1283, 1256, 1077, 1065, 750 см-1;1H ЯМР (СОCl3) δ 2,18-2,38 (м, 3Н), 3,93 (шир.кв, J=3,9 Гц, 2Н), 4,88
(дд, J=7,7, 5,4 Гц, 1Н), 5,15 (с, 2Н), 6,73 (д, J=7,6 Гц, 1Н), 6,92 (тд, J=6,7, 3,2 Гц, 1Н), 6,98-7,06 (м, 2Н), 7,15 (д, J=5, 9 Гц, 2Н), 8,56 (дд, J=4,5, 1,5 Гц, 2Н); MH+ при m/z=285.
Анализ: Вычислено для C16H16N2O3: С 67,59, H 5,67, N 9,85. Найдено: С 67, 67, H 5,78, N 9,79.
Ссылочный пример 59
Промежуточный продукт 11578-99
3,4-Дигидро-2-(2-гидроксиэтил) -4-(4-фенилбензил)-3-оксо- 2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н- 1,
4-бензоксазина способами F и G с алкилированием 4-фенилбензилхлоридом с выходом 98% в виде желтого кристаллического твердого продукта, т.пл. 110-113oС; ИК (КВr) 3350, 1683, 1500, 1400, 1304,
1275, 1247, 1051, 908, 758 см-1;1H ЯМР (CDCl3) δ 2,21-2,38 (м, 2Н), 3,94 (кв, J=5,48 Гц, 2Н), 4,87 (дд, J= 7,5, 5,61 Гц, 1Н), 5,20 (ABq, JAB=17,1
Гц, 2Н), 6,93-7,04 (м, 4Н), 7,30-7,40 (м, 3Н), 7,43 (т, J=7,0 Гц, 2Н), 7,55 (д, J=8,1 Гц, 4Н); МН+ при m/z=360.
Анализ: Вычислено для C23H21NO3: С 76,86, H 5,89, N 3,90. Найдено: С 76,61, H 5,88, N 3,74.
4-Фенилбензилхлорид получали обработкой раствора соответствующего спирта (1 экв) в CH2Cl2 метансульфонилхлоридом (1,1 экв) и триэтаноламином (TEA) (1,1 экв) при 0oС. Этот раствор перемешивали в течение 16 ч, обрабатывали 3 н. HCl и органический слой отделяли. После сушки растворитель выпаривали, получая 4-фенилбензилхлорид с выходом 64%, МН+ при m/z=202.
Ссылочный пример 60
Промежуточный продукт 10840-185
3,
4-Дигидро-2-(2-гидроксиэтил) -3-оксо-4-пентил-2Н -1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазина способами F и G с алкилированием
1-хлорпентаном с выходом 32% и выделен в виде бесцветного масла; ИК (КВr) 3424, 2956, 2932, 1680, 1500, 1272, 1062, 749 см-1;1H ЯМР (CDCl3) δ 0,91 (т, J=6,8 Гц,
3Н), 1,31-1,38 (м, 4Н), 1,66 (шир.т, J=5,5 Гц, 2Н), 2,08-2,29 (м, 2Н), 2,59 (шир.с, 1Н), 3,87-3,94 (м, 2Н), 4,69 (дд, J=7,3, 5,8 Гц, 1Н), 6,92-7,08 (м, 4Н).
Анализ: Вычислено для C15H21NO3: С 68,42, H 8,04, N 5,32. Найдено: С 68,10, H 7,88, N 5,32.
Ссылочный пример 61
Промежуточный продукт 11653-180
3,
4-Дигидро-2-(2- гидроксиэтил)-4-(3- нитробензил)-3-оксо-2Н -1,4-бензоксазин
Промежуточный силилзащищенный спирт получали из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н-1,4
-бензоксазина способом F с алкилированием 3-нитробензилхлоридом. Удаление защитной группы для получения указанного продукта проводили способом I.
Способ I: TBDMS-Защищенный бензоксазин (3,1 ммоль) перемешивали в молочной смеси с АсОН (12 мл), ТГФ (2 мл) и Н2О (5 мл). Эту смесь перемешивали в течение 18 ч, получая светлый раствор. Добавление воды давало белый твердый осадок, который отделяли фильтрованием и сушили в вакууме при 80oС: т. пл. 103-104oС; MS (CI) MH+ 329; ИК (KBr) 3490, 3087, 2947, 2879, 1685, 1663, 1607, 1593, 1466, 1280, 1168, 976 см-1;1H ЯМР (CDCl3) δ 8,15 (с, 1H), 8,13 (с, 1Н), 7,54 (м, 2Н), 7,04 (м, 2Н), 6,95 (м, 1H), 6,79 (д, 1H, J=7,6 Гц), 5,28 (д, 1H, J=16,5 Гц), 5,21 (д, 1H, J=16,5 Гц), 4,90 (дд, 1H, J=5,5, 7,6 Гц), 3,93 (м, 2Н), 2,29 (м, 2Н), 2,13 (т, 1H, J=5,6 Гц).
Анализ: Вычислено для C17H16N2O5: С 62,19, H 4,91, N 8,53. Найдено: С 61,99, H 4,91, N 8,43.
Ссылочный пример 62
Промежуточный продукт 12279-11
3,4-Дигидро-2-(2-гидроксиэтил)
-7-нитро-4-(4-нитробензил)-3 -оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11653-23 (ссылочный пример 31) способами F и I и выделен в виде желто-оранжевого твердого продукта с
выходом 42%, т. пл. 100-104oС; MS (CI) MH+ 374; ИК (KBr) 3395, 3113, 3089, 2939, 1683, 1598, 1432, 1395, 1142, 991, 914, 800, 544, 455 см-1;1H ЯМР
(CDCl3) δ 8,23 (д, 2Н, J=8,70 Гц), 7,92 (д, 1Н, J=2,42 Гц), 7,85 (дд, 1Н, J=8,85, 2,54 Гц), 7,41 (д, 2Н, J=8,60 Гц), 6,85 (д, 1Н, J=8,93 Гц), 5,30 (д, 2Н, J=4,56 Гц), 5,01 (дд, 1Н,
J=7,76, 5,11 Гц), 3,96 (т, 2Н, J=6,45 Гц), 2,30 (м, 2Н), 1,79 (шир.с, 1Н).
Анализ: Вычислено для C17H15N3O7 • 0,7H2O: С 52,91, H 4,28, N 10,89. Найдено: С 53,17, H 4,36, N 10,53.
Ссылочный пример 63
Промежуточный продукт 12279-18-А
3,
4-Дигидро-2-(2- гидроксиэтил)-7-метокси-4-(3- нитробензил)-3-оксо- 2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-7-метокси-3- оксо-2Н-1,4-бензоксазина
способами F и I с алкилированием 3-нитробензилхлоридом с выходом 30%, т.пл. 116-118o; MS (CI) MH+ 359; ИК (KBr) 3306, 3086, 2926, 2872, 1628, 1595, 1476, 1309, 1290, 1255, 1087,
999, 713, 458 см-1;1H ЯМР (DMSO-d6) δ 8,14 (с, 1H), 8,11 (с, 1Н), 7,63 (м, 2Н), 6,97 (д, 1Н, J= 8,93 Гц), 6,66 (д, 1H, J=2,42 Гц), 6,53 (д, 1H, J=8,87 Гц), 5,
26 (с, 2Н), 4,87 (дд, 1H, J=8,98, 3,78 Гц), 4,72 (т, 1H, J=5,23 Гц), 3,68 (с, 3Н), 3,61 (м, 2Н), 2,01 (м, 1H), 1,90 (м, 1H).
Анализ: Вычислено для С18Н18N2O6: С 60,33, H 5,06, N 7,82. Найдено: С 59,96, H 5,08, N 7,62.
Ссылочный пример 64
Промежуточный продукт 12279-21
3,4-Дигидро-6-фтор-2-(2
-гидроксиэтил)-4-(3- нитробензил)-3-оксо-2Н -1,4-бензоксазин
Получен из промежуточного продукта 11653-163-А1 (ссылочный пример 33) способами F и I с алкилированием 3-нитробензилхлоридом с
выходом 35%, т.пл. 110-112oС; MS (CI) МН+ 347; ИК (КВr) 3483, 3077, 2945, 2872, 1620, 1603, 1453, 1297, 1210, 1098, 979, 791, 742, 685, 470 см-1;1H ЯМР
(СDCl3) δ 8,16 (д, 1H, J=6,87 Гц), 8,10 (с, 1Н), 7,54 (м, 2Н), 6,90 (дд, 1Н, J=3,73, 5,12 Гц), 6,71 (м, 1H), 6,51 (дд, 1H, J=9,35, 2,76 Гц), 5,20 (д, 2Н, J=5,46 Гц), 4,87 (дд, 1H,
J=7,60, 5,41 Гц), 3,93 (т, 2Н, J=5,78 Гц), 2,29 (м, 2Н), 2,00 (м, 1H).
Анализ: Вычислено для C17H15FN2O5: С 58,96, H 4,37, N 8,09. Найдено: С 58,57, H 4,43, N 7,89.
Ссылочный пример 65
Промежуточный продукт 12279-13-А
4-(3-Аминобензил)-3,4 -дигидро-2-(2-гидроксиэтил) -3-оксо-2Н-1,4 -бензоксазин
Получен растворением промежуточного 1 бутилдиметилсил-оксисоединения из примера 11653-180 (1,58 г, ссылочный пример 61) в этаноле (25 мл). При перемешивании добавляли порошок Fe (1,3 г), затем
концентрированную HCl (12 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали непосредственно в ледяную воду и экстрагировали этилацетатом.
Экстракт промывали солевым раствором и концентрировали в вакууме. Получаемое коричневое масло промывали эфиром. После декантации эфира стенки колбы царапали для превращения масла в бледно-коричневый
твердый продукт с выходом 50%, т.пл. 79oС (темнеет), 85-90oС (плавится); MS (CI) MH+ 299; ИК (KBr) 3470, 3373, 3215, 3031, 2930, 2877, 1657, 1605, 1590, 1465, 1441,
1356, 1251, 1183, 1165, 1101, 1016, 995, 898, 688, 560 см-1;1H ЯМР (CDCl3) δ 7,10 (т, 1H, J=7,70 Гц), 7,10-6,20 (оч.шир.с, 2Н), 6,98 (м, 2Н), 6,93 (м, 2Н), 6,
63 (д, 1H, J=7,8 Гц), 6,56 (д, с, 2Н, J=8,6 Гц), 5,10 (д, 1H, J=16,0 Гц), 5,00 (д, 1H, J=16,0 Гц), 4,83 (дд, 1H, J=5,61, 7,45 Гц), 3,91 (кв, 2Н, J=5,4 Гц), 3,85-3,20 (оч.шир.с, 1H), 2,23 (м, 2Н).
Анализ: Вычислено для C17H18N2O3 • 0,1Н2O: С 68,03, H 6,11, N 9,33. Найдено: С 67,93, H 6,05, N 9,05.
Ссылочный пример 66
Промежуточный продукт 10488-22
4-(3-Хлорбензил)-3,4 -дигидро-2-(2-гидроксиэтил) -3-оксо-2Н-1,4-бензоксазин
Получен способами F и G с алкилированием
3-нитробензилбромидом с выходом 55%. Продукт выделяли в виде масло, которое могло кристаллизоваться из смеси диэтиловый эфир/гексан, т.пл. 63-67oС; MS (CI) MH+ 318; ИК (KBr) 3477,
2927, 2863, 1688, 1599, 1576, 1503, 1466, 1217, 1109, 931, 903 см-1;1H ЯМР (СDCl3) δ 7,26 (м, 3Н), 7,12 (м, 1H), 7,01 (м, 2Н), 6,94 (м, 1H), 6,82 (м, 1H), 5,
15 (д, 1H, J=16,3 Гц), 5,08 (д, 1H, J=16,2 Гц), 4,85 (дд, 1H, J=5,5, 7,6 Гц), 3,92 (д, 2Н, J=4,9 Гц), 2,39-2,14 (шир.м, 3Н).
Анализ: Вычислено для C17H16ClNO3: С 64,26, H 5,08, N 4,44. Найдено: С 63,89, H 5,00, N 4,13.
Ссылочный пример 67
Промежуточный продукт 11653-85-В-1
3,4-Дигидро-2-(2-гидроксиэтил)
-7-нитро-4-(3-нитробензил) -3-оксо-2Н-1,4-бензоксазин
Получен из промежуточного продукта 11653-23 (ссылочный пример 31) способами F и G с алкилированием 3-нитробензилхлоридом с выходом 66%,
т.пл. 157-160oС; MS (CI) МН+ 374; ИК (КВr) 3592, 3433, 3087, 2926, 2892, 1671, 1598, 1525, 1482, 1433, 1219, 1168, 1097, 838 см-1;1H ЯМР (DMSO-d6
) δ 8,17 (с, 1H), 8,13 (с, 1Н), 7,86 (с, 1Н), 7,83 (д, 1Н, J=2,5 Гц), 7,65 (д, 1H, J= 7,8 Гц), 7,58 (т, 1H, J=7,8 Гц), 7,08 (д, 1H, J=9,2 Гц), 5,40 (д, 1H, J=16,5 Гц), 5,31 (д, 1H, J=16,6 Гц),
5,07 (дд, 1H, J=4,0, 9,0 Гц), 4,57 (т, 1H, J= 5,2 Гц), 3,80 (м, 2Н), 2,23 (м, 1H), 2,10 (м, 1H).
Анализ: Вычислено для C17H15N3O7: С 54,69, H 4,05, N 11,26. Найдено: С 54,57, H 4,04, N 11,08.
Ссылочный пример 68
Промежуточный продукт 11653-58С
4-(3-Хлорбензил)-3,
4- дигидро-2-(2-гидроксиэтил)-6- нитро-3-оксо-2Н -1,4-бензоксазин
Получен из промежуточного продукта 11653-33А (ссылочный пример 32) способами F и G с алкилированием 3-хлорбензилбромидом с
выходом 77%, т.пл. >38oС (разложение); MS (CI) MH+ 363; ИК (КВr) 3855, 3745, 3423, 1686, 1590, 1522, 1448, 1389, 1343, 1267, 1056, 875, 778, 680 см-1;1H ЯМР (CDCl3) δ 7,93 (дд, 1H, J=2,5, 8,8 Гц), 7,78 (д, 1H, J=2,5 Гц), 7,30 (м, 3Н), 7,19 (м, 1H), 7,10 (д, 1H, J=8,8 Гц), 5,20 (д, 1H, J=16,3 Гц), 5,14 (д, 1H, J=16,2 Гц), 5,
03 (дд, 1H, J=5,3, 7,6 Гц), 3,93 (т, 2Н, J=6,2 Гц), 2,41-2,19 (м, 2Н), 1,71 (шир.с, 1H).
Анализ: Вычислено для C17H15ClN2O5: С 56,29, H 4, 17, N 7,72. Найдено: С 56,19, H 4,22, N 7,55.
Ссылочный пример 69
Промежуточный продукт 11653-142
3,4-Дигидро-2-(2- гидроксиэтил)-7-нитро-4-(2
-нитробензил)-3-оксо- 2Н-1,4-бензоксазин
Получен из промежуточного продукта 11653-23 (ссылочный пример 31) способами F и G с алкилированием 2-нитробензилхлоридом с выходом 52%, т.пл.
139-143oС; MS (CI) МН+ 374; ИК (КВr) 3569, 3122, 3088, 2942, 2892, 1693, 1600, 1530, 1501, 1420, 1390, 1254, 1059, 888, 727 см-1;1H ЯМР (DMSO-d6
) δ 8,24 (дд, 1H, J=1,2, 8,0 Гц), 7,90 (д, 1H, J=2,5 Гц), 7,83 (дд, 1Н, J=2,6, 8,9 Гц), 7,62 (м, 2Н), 7,20 (д, 2Н, J=8,9 Гц), 5,59 (д, 1H, J=18,2 Гц), 5,49 (д, 1H, J= 18,2 Гц), 5,16 (дд, 1H,
J=4,4, 8,5 Гц), 4,79 (т, 1H, J=5,2 Гц), 3,66 (м, 2Н), 2,05 (м, 2Н).
Анализ: Вычислено для C17H15N3O7: С 54,69, H 4,05, N 11,26. Найдено: С 54,81, H 4,03, N 11,07.
Ссылочный пример 70
Промежуточный продукт 11653-44А
4-(2-Хлорбензил)-3,4- дигидро-2-(2-гидроксиэтил)-6- нитро-3-оксо-2Н -1,4-бензоксазин
Получен из промежуточного продукта 11653-33А (ссылочный пример 32) способами F и G с алкилированием 2-хлорбензилхлоридом с выходом 23%, т.пл. 108-110oС; MS (CI) MH+ 363; ИК
(КВr) 3520, 3092, 2984, 2938, 2889, 1906, 1775, 1588, 1474, 1446, 1316, 1253, 1185, 1127, 1112, 926, 680 см-1;1H ЯМР (DMSO-d6) δ 7,94 (дд, 1H, J=2,5, 8,8 Гц),
7,62 (д, 1H, J=2,5 Гц), 7,56 (д, 1Н, J=7,6 Гц), 7,31 (м, 3Н), 7,15 (д, 1Н, J=7,3 Гц), 5,25 (с, 2Н), 5,16 (дд, 1Н, J=4,2, 8,5 Гц), 4,78 (т, 1Н, J=5,2 Гц), 3,63 (м, 2Н), 2,09 (м, 2Н).
Анализ: Вычислено для C17H15ClN2O5: С 56,29, H 4,17, N 7,72. Найдено: С 56,19, H 4,10, N 7,58.
Ссылочный пример 71
Промежуточный
продукт 11653-173
3,4-Дигидро-2-(2-гидроксиэтил) -4-(4-нитробензил)-3-оксо -2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазина
способами F и I с алкилированием 4-нитробензилхлоридом с выходом 89%, т. пл. 124-127oС; MS (CI) MH+ 329; ИК (КВr) 3498, 3076, 2930, 2863, 1656, 1605, 1500, 1466, 1302, 1279, 1184,
1126, 982, 613 см-1;1H ЯМР (СDCl3) δ 8,20 (дд, 2Н, J=2,0, 6,9 Гц), 7,40 (д, 2Н, J=8,8 Гц), 7,03 (м, 2Н), 6,93 (м, 1Н), 6,75 (д, 1Н, J=7,6 Гц), 5,25 (с, 2Н), 4,
88 (дд, 1Н, J= 5,4, 7,6 Гц), 3,93 (м, 2Н), 2,38-2,17 (м, 2Н), 2,10 (м, 1Н).
Анализ: Вычислено для C17H16N2O5: С 62,19, H 4,91, N 8,54. Найдено: С 62,05, H 4,87, N 8,39.
Ссылочный пример 72
Промежуточный продукт 11653-170-А2
4-Бензил-3,4-дигидро-2-(2 -гидроксиэтил)-7-нитро-3-оксо -2Н-1,
4-бензоксазин
Получен из промежуточного продукта 11653-23 (ссылочный пример 31) способами F и G с алкилированием бензилбромидом с выходом 98%, т.пл. 102-105oС; MS (CI) MH+ 329; ИК (КВг) 3561, 3086, 3062, 2970, 2932, 2873, 1698, 1598, 1500, 1452, 1075, 985 см-1;1H ЯМР (СDСl3) δ 7,88 (д, 1H, J=2,5 Гц), 7,82 (дд, 1Н, J=2,5,
8,9 Гц), 7,34 (м, 3Н), 7,23 (м, 2Н), 6,96 (д, 1H, J=8,9 Гц), 5,23 (д, 1Н, J=16,4 Гц), 5,17 (д, 1Н, J=16,4 Гц), 4,80 (дд, 1Н, J=5,1, 7,9 Гц), 3,94 (м, 2Н), 2,34 (м, 1Н), 2,28 (м, 1Н), 1,98 (т, 1Н, J=5,
5 Гц).
Анализ: Вычислено для C17H16N2O5: С 62,19, H 4,91, N 8,53. Найдено: С 61,81, H 4,63, N 8,36.
Ссылочный пример 73
Промежуточный продукт 11653-174-А
3,4-Дигидро-2-(2-гидроксиэтил) -4-(3-нитробензил)-3-оксо -2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,
4-дигидро-3-оксо-2Н -1,4-бензоксазина способами F и I с алкилированием 2-нитробензилхлоридом с выходом 43%, т.пл. 128,5-130oС; MS (CI) MH+ 329; ИК (KBr) 3850, 3495, 3074, 2974,
2949, 2896, 1658, 1605, 1576, 1515, 1503, 1468, 1426, 1362, 1218, 1163, 902 см-1;1H ЯМР (DMSO-d6) δ 8,20 (дд, 1Н, J=1,3, 8,1 Гц), 7,67 (т, 1Н, J=7,6 Гц), 7,56
(т, 1H, J=7,0 Гц), 7,15 (д, 1Н, J=7,0 Гц), 7,08 (д, 1H, J= 7,7 Гц), 6,99 (м, 1H), 6,92 (д, 2Н, J=3,7 Гц), 5,49 (д, 1H, J=18,2 Гц), 5,42 (д, 1H, J=18,1 Гц), 4,94 (дд, 1H, J=4,1, 9,0 Гц), 4,72 (т, 1H,
J=5,2 Гц), 3,63 (м, 2Н), 2,00 (м, 2Н).
Анализ: Вычислено для C17H16N2O5: С 62,19, H 4,91, N 8,53. Найдено: С 61,85, H 4,89, N 8,37.
Ссылочный пример 74
Промежуточный продукт 10508-23-А
4-Бензил-3,4-дигидро -2-(2-гидроксиэтил)-3-оксо -2Н-1,4-бензоксазин
Получен из
2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазина способами F и G с алкилированием бензилхлоридом с общим выходом 49% и кристаллизован из смеси эфир/гексан с образованием
белого твердого продукта, т.пл. 83-85,5oС; ИК (КВr) 3213, 1680, 1505, 1399, 1250, 1050, 753 см-1;1H ЯМР (СDCl3) δ 2,17-2,38 (м, 3Н), 3,92 (кв, J=5,7
Гц, 2Н), 4,84 (дд, J=7,5, 5,6 Гц, 1Н), 5,16 (с, 2Н), 6,86-7,03 (м, 4Н), 7,21-7,37 (м, 5Н); MH+ при m/z=284.
Анализ: Вычислено для C17H17NO3 : С 72,07, H 6,05, N 4,94. Найдено: С 72,08, H 6,20, N 4,87.
Ссылочный пример 75
Промежуточный продукт 10508-25-А
3,4-Дигидро-2-(2- гидроксиэтил)-4-(2-метоксибензил)
-3-оксо-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазина способами F и G с алкилированием метансульфонатным эфиром
2-метоксибензилового спирта с общим выходом 47% в виде светло-желтого смолистого продукта после флэш-хроматографии с элюированием смесью этилацетат/гексан, ИК (чистый) 3436, 2941, 1583, 1683, 1501,
1466, 1403, 1281, 1246, 1113, 1052, 751 см-1;1H ЯМР (CDCl3) δ 2,18-2,36 (м, 2Н), 2,39 (шир.т, J= 6,0 Гц, 1Н), 3,90 (с, 3Н), 3,92 (шир.кв, J=5,5 Гц, 2Н), 4,85
(дд, J=7,4, 5,7 Гц, 1Н), 5,15 (с, 2Н), 6,81-7,03 (м, 7Н), 7,23 (тд, J=8,3, 1,7 Гц, 1Н); MH+ при m/z=314.
Анализ: Вычислено для C18H19NO4 • 0,2H2O: С 68,21, H 6,17, N 4,42. Найдено: С 68,36, H 6,18, N 4,36.
Ссылочный пример 76
Промежуточный продукт 10508-22-А
3,
4-Дигидро-2-(2- гидроксиэтил)-4-(3-метоксибензил) -3-оксо-2Н-1,4-бензоксазин
Получен способами F и G с алкилированием 2-метоксибензилхлоридом с общим выходом 49% в виде светлой вязкой смолы
после флэш-хроматографии с элюированием 25-50% этилацетатом в гексане, ИК (чистый) 3433, 2941, 1683, 1583, 1501, 1466, 1403, 1262, 1152, 1052, 753 см-1;1H ЯМР (CDCl3)
δ 2,17-2,37 (м, 3Н), 3,77 (с, 3Н), 3,91 (шир.кв, J=5,3 Гц, 2Н), 4,84 (дд, J=7,5, 5,6 Гц, 1Н), 5,12 (ABq, JAB=17 Гц, 2Н), 6,76-7,03 (м, 7Н), 7,24 (тд, J=7,6, 0,98 Гц, 1Н); MH+ при m/z=314.
Анализ: Вычислено для C18H19NO4: С 68,99, H 6,11, N 4,47. Найдено: С 68,54, H 6,14, N 4,33.
Ссылочный пример
77
Промежуточный продукт 10508-82-А
4-(3-Бензилоксибензил) -3,4-дигидро-2-(2-гидроксиэтил) -3-оксо-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,
4-дигидро-3-оксо-2Н- 1,4-бензоксазина способами F и О с алкилированием метансульфонатным эфиром 3-бензилоксибензилового спирта с общим выходом 67% в виде вязкой жидкости после флэш-хроматографии с
элюированием 30-100% этилацетатом в гексане; ИК (СНCl3) 3434, 2933, 1681, 1500, 1401, 1256, 1054, 751 см-1;1H ЯМР (CDCl3) δ 1,77 (шир. с, 1Н плюс
HDO), 2,20-2,34 (м, 2Н), 3,91 (т, J=5,5 Гц, 2Н), 4,82 (дд, J= 7,5, 5,7 Гц, 1Н), 5,02 (с, 2Н), 5,11 (ABq, JAB=16,0 Гц, 2Н), 6,85-7,01 (м, 7Н), 7,22-7,41 (м, 6Н); МН+ при
m/z=390.
Анализ: Вычислено для С24H23NО4: С 74,02, H 5,95, N 3,60. Найдено: С 73,61, H 6,03, N 3,55.
Ссылочный пример 78
Промежуточный продукт 10508-84-A1
3,4-Дигидро-2-(2-гидроксиэтил) -4-(1-нафтилметил)-3-оксо -2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил)-3,4 -дигидро-3-оксо-2Н-1,
4 -бензоксазина способами F и G с алкилированием 1-хлорметилнафталином с общим выходом 42%. Сырой продукт кристаллизовали из смеси эфир/этилацетат/гексан, получая белый твердый продукт, т.пл.
100-104oС; ИК (КВr) 3435, 2896, 1668, 1504, 1414, 1253, 1132, 1068, 768, 758 см-1;1H ЯМР (CDCl3) δ 1,92 (шир.с, 1Н плюс HDO), 2,26-2,44 (м, 2Н), 3,
96 (т, J=5,6 Гц, 2Н), 4,94 (дд, J=7,5, 5,6 Гц, 1Н), 5,62 (ABq, JAB=16,9 Гц, 2Н), 6,72 (дд, J=8,0, 1,1 Гц, 1Н), 6,84 (тд, J= 8,1, 1,5 Гц, 1Н), 6,96-7,11 (м, 3Н), 7,36 (т, J=7,4 Гц, 1Н), 7,
54-7,64 (м, 2Н), 7,78 (д, J=8,2 Гц, 1Н), 7,92 (д, J=7,8 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H); МН+ при m/z=334.
Анализ: Вычислено для C21H19NO3:
С 75,66, H 5,74, N 4,20. Найдено: С 75,56, H 5,80, N 4,14
Ссылочный пример 79
Промежуточный продукт 10508-80-1
3,4-Дигидро-2-(2- гидроксиэтил)-4-(2-нафтилметил) -3-оксо-2Н-1,
4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н-1,4 -бензоксазина способами F и G с алкилированием 2-хлорметилнафталином с общим выходом 81%. Сырой продукт
кристаллизовали из смеси эфир/гексан, получая белое твердое вещество, т. пл. 81-87oС; ИК (КВr) 3459, 2940, 1665, 1500, 1403, 1277, 1242, 1066, 746 см-1;1H ЯМР
(CDCl3) δ 2,23-2,40 (м, 3Н), 3,95 (т, J= 5,4 Гц, 2Н), 4,90 (дд, J=7,6, 5,6 Гц, 1Н), 5,32 (ABq, JAB=16,1 Гц, 2Н), 6,87-7,03 (м, 4Н), 7,38 (д, J=8,5 Гц, 1Н), 7,43-7,48 (м,
2Н), 7,67 (с, 1Н), 7,75-7,84 (м, 3Н); МН+ при m/z=334.
Анализ: Вычислено для C21H19NO3: С 75,66, H 5,74, N 4,20. Найдено: С 75,65, H 5,71, N 4,02.
Ссылочный пример 80
Промежуточный продукт 10508-79
4-(5-Хлор-2-тиенилметил) -3,4-дигидро-2-(2-гидроксиэтил) -3-оксо-2Н-1,4-бензоксазин
Получен из
2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н-1,4 -бензоксазина способами F и G с алкилированием 5-хлор-2-(хлорметил)тиофеном и выделен с общим выходом 83% в виде светло-желтого вязкого
масла после флэш-хроматографии с использованием 30-50% этилацетата в гексане; ИК (СНCl3) 3418, 2943, 1677, 1500, 1400, 1278, 1062, 750 см-1;1H ЯМР (СDCl3)
δ 2,11-2,32 (м, 3Н), 3,89 (кв, J=5,4 Гц, 2Н), 4,78 (дд, J=7,6, 5,5 Гц, 1Н), 5,15 (ABq, JAB= 16,0 Гц, 2Н), 6,74 (д, J=3,7 Гц, 1Н), 6,84 (д, J=3,7 Гц, 1Н), 7,01-7,08 (м, 4Н); МН+ при m/z=324.
Анализ: Вычислено для C15H14ClNO3S • 0,25H2O: С 54,88, H 4,45, N 4,27, S 9,77. Найдено: С 54,86, H 4,41, N 4,04, S 9,87.
Ссылочный пример 81
Промежуточный продукт 11758-71-2
Метил-4-[3,4-дигидро-2 -(2-гидроксиэтил)-3-оксо-2Н -1,4-бензоксазин-4 -ил]метилбензоат
Из
2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н-1,4 -бензоксазина способами F и G с алкилированием 4-(метоксикарбонил)бензилхлоридом получали спирт в виде белого твердого продукта с выходом
65%, т.пл.=94-95oС;1H ЯМР (СDСl3) δ 8,00 (д, J=8,4 Гц, 2Н), 7,30 (д, J=8,4 Гц, 2Н), 6,95-7,04 (м, 2Н), 6,89 (дт, J=2,1, 8,0 Гц, 1Н), 6,77 (дд, J=7,8, 1,5 Гц,
1Н), 5,20 (с, 2Н), 4,86 (дд, J=5,4, 7,7 Гц, 1Н), 3,82-3,96 (м, 5Н с 3Н синглет при δ 3,89), 2,16-2,37 (м, 3Н, один из которых обменный).13С ЯМР (CDCl3) δ 166,8,
166,5, 144,1, 141,1, 130,1 (СН), 129,4, 128,4, 126,3 (СН), 124,2 (СН), 122,8 (СН), 117,3 (СН), 115,2 (СН), 75,1 (СН), 58,7 (СН2), 52,0 (СН3), 45,1 (СН2), 33,1 (CH2). ИК 3450-3500 (шир.), 1719, 1660 см-1. MS 342 (МН+), 324 (М-ОН)+, 310 (М-OМе)+.
Анализ: Вычислено для C19H19 NO5: С 66,85, H 5,61, N 4,10. Найдено: С 66,48, H 5,47, N 3,97.
Ссылочный пример 82
Промежуточный продукт 11758-93-2А
Метил-3-[3,4-дигидро-2
-(2-гидроксиэтил)-3-оксо- 2Н-1,4-бензоксазин-4 -ил]метилбензоат
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазина способами F и G с алкилированием
3-(метоксикарбонил)бензилхлоридом и выделен в виде белого порошка с выходом 87%, т. пл. 73-75oС;1H ЯМР (CDCl3) δ 7,92-7,95 (м, 2Н), 7,38-7,43 (м, 2Н), 6,96-7,
03 (м, 2Н), 6,91 (дт, J=2,3, 7,3 Гц, 1Н), 6,81 (дд, J=1,4, 7,7 Гц, 1Н), 5,23 (д, J=16,3 Гц, 1Н), 5,16 (д, J=16,3 Гц, 1Н), 4,87 (дд, J=5,7, 7,4 Гц, 1Н), 3,92-3,95 (м, 2Н), 3,91 (с, 3Н), 2,21-2,37 (м,
3Н содержащий один обменный водород).13С ЯМР (CDCl3) δ 166,9, 166,7, 144,2, 136,5, 130,9 (СН), 130,7, 129,1 (СН), 128,7 (СН), 128,5, 127,7 (СН), 124,3 (СН), 122,9 (СН),
117,4 (СН), 115,4 (СН), 75,3 (СН), 58,9 (CH2), 52,2 (CH2), 45,1 (CH2), 33,3 (СН2). ИК 3569, 2948, 1709, 1676, 1502 см-1. MS 342 (МН+
).
Анализ: Вычислено для C19H19NO5: С 66,85, H 5,61, N 4,10. Найдено: С 66,37, H 5,62, N 3,97.
Ссылочный пример 83
Промежуточный продукт 11758-82-2
Этил-2-[3,4-дигидро-2 -(2-гидроксиэтил)-3-оксо -2Н-1,4-бензоксазин-4 -ил]метилбензоат
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,
4-дигидро-3-оксо-2Н- 1,4-бензоксазина способами F и G с алкилированием 2-(метоксикарбонил)бензилхлоридом и выделен в виде белого твердого продукта с общим выходом 38%, т.пл. 114-115,5oС
(этилацетат/гексан).1H ЯМР (CDCl3) δ 8,08 (дд, J=1,4, 7,8 Гц, 1H), 7,40 (дт, J=1,3, 7,5 Гц, 1Н), 7,33 (шир.т, J= 7,6 Гц, 1Н), 6,97-7,06 (м, 3Н), 6,89 (дт, J=1,9, 7,5 Гц,
1H), 6,74 (д, J=8,0 Гц, 1H), 5,63 (д, J=18,0 Гц, 1H), 5,54 (д, J=18,0 Гц, 1H), 4,88 (дд, J=5,7, 7,4 Гц, 1H), 4,41 (кв, J=7,1 Гц, 2Н), 3,90-3,95 (м, 2Н), 2,23-2,35 (м, 2Н), 1,43 (т, J=7,1 Гц, 3Н). ИК
3450-3550 (шир.), 1675, 1502 см-1. MS 356 (МН+).
Анализ: Вычислено для C20H21NO5: С 67,59, H 5,96, N 3,94. Найдено: С 67,29, H 5, 97, N 3,83.
Ссылочный пример 84
Промежуточный продукт 11758-190
4-(3-Хлорбензил)-3,4- дигидро-2-(2-гидроксиэтил)-3 -оксо-2Н-пиридо[4,3-b] -1,4-оксазин
Свежеполученный нитрат 4-гидроксипиридина нитровали методикой D. Rasala and R. Gawinecki, Org. Prep. Proc. Int., 1985, 17, 409-423. Раствор в этаноле этого нитропиридина (1 экв) и NaOAc (1 экв)
восстанавливали с 10% Pd/C (10% мас./мас.) в атмосфере водорода при 3,515 атм (50 psig) в течение 4 ч. Сырой 3-амино-4-гидроксипиридин растворяли в ДМФ (5 мл) и обрабатывали NaH (1,2 экв). Эту смесь
затем обрабатывали α--бром-γ-бутиролактоном (1,2 экв) при комнатной температуре в
атмосфере азота. После перемешивания при комнатной температуре в течение 24 ч раствор в ДМФ
обрабатывали имидазолом (1,2 экв) и трет-бутилдиметилсилилхлоридом (1,2 экв). Этот раствор перемешивали в течение 16 ч и затем гасили Н2О. Водный раствор экстрагировали этилацетатом и
объединенный экстракт промывали H2O и сушили над MgSO4. Раствор в этилацетате фильтровали через SiO2 и концентрировали в вакууме, получая промежуточное
силилоксисоединение с выходом 14%. Этот материал алкилировали по способу F 3-хлорбензилбромидом и затем обрабатывали трифторуксусной кислотой (ТФУ) (20% об. /об.) в СНСl3 для удаления
защитной группы, получая спирт с выходом 41% в виде белого кристаллического твердого продукта; ИК (КВr) 3519, 1664, 1393, 1320, 1192, 1082, 1054, 868 см-1;1H ЯМР (DMSO-d6)1,97-2,09 (м, 2Н), 3,58-3,62 (м, 2Н), 4,75 (т, J=5,0 Гц, 1Н), 5,10 (дд, J=8,5, 4,2 Гц, 1Н), 5,21 (с, 2Н), 7,07 (д, J=5,3 Гц, 1Н), 7,25 (шир.д, J=6,8 Гц, 1Н), 7,35-7,43 (м, 3Н), 8,13 (д, J=5,8
Гц, 1Н), 8,20 (с, 1Н); MH+ при m/z=319.
Ссылочный пример 85
Промежуточный продукт 11721-108-1
3,4-Дигидро-2- (2-гидроксиэтил)
- [4- (3-тиенилметил)]-3-оксо-2Н-1,4-бензоксазин
Трибутилфосфин (1,5 экв) и 1,1'-(азодикарбонил)дипиперидин (1,5 экв) добавляли к раствору 2-(2-трет-бутилдиметилсилоксиэтил) -3,
4-дигидро-3-оксо-2Н-бензоксазина (1 экв) в СН2Cl2 при комнатной температуре. По каплям добавляли 3-тиофенметанол (1,5 экв) и смесь перемешивали в течение 16 часов при комнатной
температуре. Добавляли гексан и эту смесь фильтровали и концентрировали в вакууме. Масляный остаток очищали колоночной хроматографией с использованием 1-2% смеси этилацетат/СН2Сl2
в качестве элюента, получая алкилированный промежуточный продукт в виде желтого масла: МН+ при m/z=404. Алкилированный промежуточный продукт обрабатывали по методике G, получая указанное в
заголовке соединение в виде светлого масла. ИК (чистый) 3427, 3101, 1681, 1500, 1060, 750 см-1;1H ЯМР (CDCl3) 2,1-2,4 (м, 2Н), 3,8-4,0 (м, 2Н), 4,15 (кв, 1Н), 4,80 (т,
1Н), 5,21 (с, 2Н), 7,07 (м, 5Н), 7,1 (м, 1Н), 7,25-7,3 (м, 1Н); MH+ при m/z=289.
Ссылочный пример 86
Промежуточный продукт 11653-24А
4-(2-Хлорбензил)-3,
4-дигидро -2-(2-гидроксиэтил)-3-оксо -7-нитро-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазина способами F и G с алкилированием
2-хлорбензилбромидом в виде желтого твердого продукта; т.пл. 106-108oС; MS (CI) 363 (МН+); ИК (КВr) 3268, 3122, 3088, 3068, 2969, 2937, 2881, 1888, 1794, 1571, 1478, 1210, 1148,
1135, 1116, 972, 926, 864, 705, 626, 475 см-1;1H ЯМР (CDCl3/TMS) δ 7,90 (д, 1Н, J=2,42 Гц), 7,84 (дд, 1Н, J=2,51, 8,91 Гц), 7,45 (д, 1Н, J=7,77 Гц), 7,20 (м,
2Н), 6,95 (д, 1Н, J=7,52 Гц), 6,81 (д, 1H, J=8,90 Гц), 5,29 (с, 2Н), 5,00 (дд, 1Н, J=5,13, 7,90 Гц), 3,95 (кв, 2Н, J=5,51 Гц), 2,30 (шир.м, 2Н), 1,86 (т, 1H, J=5,47 Гц).
Анализ: Вычислено для C17H15ClN2O5: С 56,29, H 4,17, N 7,72. Найдено: С 56,25, H 4,24, N 7,60.
Ссылочный пример 87
Промежуточный продукт
11653-35В
4-(3-хлорбензил)-3,4-дигидро -2-(2-гидроксиэтил)-3-оксо -7-нитро-2Н-1,4-бензоксазин
Получен из 2-(2-трет-бутилдиметилсилоксиэтил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазина
способами F и G с алкилированием 3-хлорбензилбромидом в виде желтого твердого продукта; т.пл. 100-102,5oС; MS (CI) 363 (МН+); ИК (КВr) 3512, 3090, 3058, 2980, 2939, 2886, 1888,
1600, 1518, 1498, 1475, 1443, 1431, 1278, 1204, 1107, 1080, 1020, 863, 681, 602, 452 см-1;1H ЯМР (CDCl3/TMS) δ 7,89 (д, 1H, J=2,46 Гц), 7,84 (дд, 1H, J=2,53, 8,
84 Гц), 7,27 (м, 3Н), 7,10 (м, 1H), 6,90 (д, 1H, J=8,85 Гц), 5,17 (с, 2Н), 4,99 (дд, 1H, J= 5,13, 7,85 Гц), 3,94 (м, 2Н), 2,35 (м, 1H), 2,24 (м, 1H), 1,92 (т, 1H, J= 5,40 Гц).
Анализ: Вычислено для C17H15ClN2O5: С 56,29, H 4,17, N 7,72. Найдено: С 56,25, H 4,09, N 7,63.
Ссылочный пример 88
Промежуточный продукт
10840-117-1
3,4-Дигидро-2-(2-гидроксиэтил) -4-метил-7-нитро-3-оксо -2Н-1,4-бензоксазин
Получен в виде масла из промежуточного продукта 11653-23 (ссылочный пример 31) способами F и G
с алкилированием метил-йодидом.
Анализ: Вычислено для C11H13NO3 • 0,9Н2O: С 62,14, H 6,41, N 6,59. Найдено: С 62,21, H 6,27, N 6, 42.
Соединение 1
2-[2-[4-(трет-Бутоксикарбониламинометил) фенокси]этил]-4-(3-хлорбензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин
Способ J: Промежуточный продукт 10488-22 (7,65 г, 1 экв, ссылочный пример 66) растворяли в ТГФ. Добавляли трифенилфосфин (0,5 г, 1,1 экв) и 4-(N-трет-бутоксикарбонил)аминометилфенол (0,38 г, 1 экв), затем по каплям добавляли диэтилазодикарбоксилат (0,303 мл, 1,1 экв). Реакционную смесь перемешивали при температуре кипения в течение 48 ч и концентрировали в вакууме. Остаток растирали с диэтиловым эфиром и осадок удаляли фильтрованием. Продукт выделяли из фильтрата флэш-хроматографией, элюируя смесью этилацетат/гексан. Фракции, содержащие продукт, кристаллизовали из смеси этилацетат/гексан, получая белый порошок с выходом 50%, т.пл. 99-100oС; ИК (КВr) 3386, 2981, 1692, 1613, 1501, 1393, 1366, 1248, 1171, 1053, 862, 752, 388 см-1;1H ЯМР (СDСl3) δ 7,29-7,2 (м, 3Н), 7,21 (д, J=8,6 Гц, 2Н) 7,13 (м, 1Н), 7,04-6,91 (м, 3Н), 6,88 (д, J=8,6 Гц, 2Н), 6,82 (дд, J=8, 1,4 Гц), 5,17 (д, J=16 Гц, 1Н,) 5,08 (д, J=16 Гц, 1H), 4,94 (дд, J=9,2, 4,0 Гц, 1Н), 4,75 (шир.с, 1Н), 4,24 (м, 4Н), 2,56 (м, 1Н), 2,34 (м, 1Н), 1,46 (с, 9Н).
Анализ: Вычислено для С29 Н31ClN2О5: С 66,60, H 5,97, N 5,36. Найдено: С 66,41, H 6,00, N 5,34.
Соединение 2
2-[2-[4-(Аминометил)фенокси] этил] -4-(3-хлорбензил) -3,
4-дигидро-3-оксо-2Н -1,4-бензоксазин
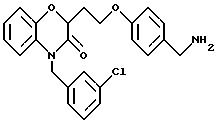
Способ К: Соединение 1 растворяли в изопропиловом спирте, содержащем избыток НСl (газообразный) (0,2-0,3 г/мл) и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и твердый продукт промывали диэтиловым эфиром, получая белое твердое вещество с выходом 87%, т. пл. 194-200oC (разложение); MS (CI) MH+ 422; ИК (KBr) 2930, 1609, 1503, 1404, 1306, 1283, 1248, 1182, 1111, 1051, 833 см-1;1H ЯМР (DMSO-d6) δ 8,45-8,24 (шир.с, 2Н), 7,42 (д, 2Н, J=8,6 Гц), 7,35 (м, 2Н), 7,22 (д, 1Н, J= 6,8 Гц), 7,05 (м, 5Н), 5,23 (д, 1Н, J=16,5 Гц), 5,13 (д, 1Н, J=16,5 Гц), 5,00 (дд, 1Н, J=4,2, 8,6 Гц), 4,22 (м, 2Н), 3,94 (шир.т, 2Н, J=2,5 Гц), 3,39 (шир.с, 2Н), 2,40 (м, 1Н), 2,25 (м, 1Н).
Анализ: Вычислено для С24Н22СlN2O3 • НСl: С 62,89, H 5,06, N 6,11. Найдено: С 62,49, H 5,21, N 6,03.
Соединение 3
2-[2-[4-(трет-Бутоксикарбониламинометил) фенокси] этил] -4-(4- хлорбензил)-3,
4-дигидро-3 -оксо-2Н-1,4-бензоксазин
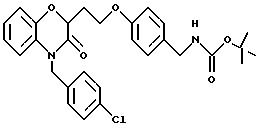
Получен способом J с использованием промежуточного продукта 10353-28-1 (ссылочный пример 41), модифицированным перемешиванием при комнатной температуре в течение 48 ч. Продукт в виде белого твердого вещества получен с выходом 54%, т.пл. 121-122,5oС; ИК (КВr) 3400, 2977, 2931, 1690, 1613, 1516, 1503, 1468, 1436, 1395, 1366, 1301, 1277, 1248, 1171, 1094, 1053, 1014, 753 см-1;1H ЯМР (CDCl3) δ 7,33-7, 22 (м, 2Н), 7,22-7,15 (м, 4Н), 7,03-6,8 (м, 6Н), 5,16 (д, J=16,6 Гц, 1Н), 5,08 (д, J=16,6 Гц, 1Н), 4,92 (дд, J=9,4, 4,1 Гц, 1Н), 4,76 (шир.с, 1Н), 4,25 (м, 4Н), 2,57 (м, 1Н), 2,33 (м, 1Н), 1,47 (с, 9Н).
Анализ: Вычислено для C29H31ClN2O5: С 66,60, H 5,97, N 5,36. Найдено: С 66,48, H 5,86, N 5,32.
Соединение 4
2-[2-[4-(Аминометил)фенокси] этил]-4-(4-хлорбензил) -3,4-дигидро-3-оксо- 2Н-1,4-бензоксазин
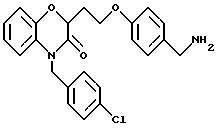
Получен способом К с использованием соединения 3. Раствор в смеси HCl/изопропанол выпаривали в вакууме и белый твердый продукт выделяли кристаллизацией из смеси СН2Сl2/диэтиловый эфир с выходом 76%, т.пл. 200-201oС; ИК (КВr) 3480, 3360, 3235, 2910, 2878, 1681, 1609, 1519, 1503, 1465, 1401, 1281, 1243, 1183, 1110, 1023, 913, 830, 797, 749, 569, 529, 530 см-1;1H ЯМР (DMSO-d6) δ 8,18 (шир.с, 3Н), 7,40 (м, 4Н), 7,30 (д, J=8,6 Гц, 2Н), 7,02 (м, 6Н), 5,21 (д, J=16,8 Гц, 1Н), 5,12 (д, J=16,8 Гц, 1Н), 4,98 (дд, J= 9,2, 4,4 Гц, 1Н), 4,23 (м, 2Н), 3,96 (м, 2Н), 2,39 (м, 1Н), 2,25 (м, 1Н).
Анализ: Вычислено для C24H23ClN2O3 • HCl • 0,5H2 O: С 61,54, H 5,38, N 5,98. Найдено: С 61,30, H 5,33, N 5,90.
Соединение 5
2-[2-[4-(2-(трет- Бутоксикарбониламино)этил) фенокси]этил]-4-(4- хлорбензил)-3,4-дигидро-3
-оксо-2Н-1,4-бензоксазин

Способ L: Промежуточный спирт 10353-28-1 (0,6 г, 1 экв, ссылочный пример 41) растворяли в сухом бензоле (6 мл) и обрабатывали трибутилфосфином (0,63 мл, 1,5 экв) и Вос-защищенным 4-(2-аминоэтил)фенолом (0,66 г, 1,5 экв). Получаемый раствор охлаждали на ледяной бане и в виде одной порции добавляли 1,1'-(азодикарбонил)дипиперидин (ADDP, 0,71 г, 1,5 экв). Через 10 мин реакционную смесь нагревали до комнатной температуры. Через 20 ч реакционную смесь разбавляли диэтиловым эфиром и белый осадок отделяли фильтрованием. Фильтрат промывали 2 н. NaOH и концентрировали. Продукт выделяли флэш-хроматографией, элюируя смесью ацетон/гексан. Перекристаллизация из смеси этилацетат/гексан давала продукт в виде белого твердого вещества с выходом 72%, т. пл. 108-109oС; MS (CI) 537 (МН+); ИК (КВr) 3378, 2979, 1798, 1609, 1515, 1500, 1395, 1368, 1246, 1171, 1061, 816, 749 см-1;1H ЯМР (CDCl3) δ 7,39 (д, J= 8,5 Гц, 2Н), 7,18 (д, J=8,5 Гц, 2Н), 7,11 (д, J=8,7 Гц, 2Н), 7,04-6,80 (м, 4Н), 6,86 (д, J=8,7 Гц, 2Н), 5,14 (д, J=16,4 Гц, 1Н), 5,11 (д, J= 16,4 Гц, 1Н), 4,93 (дд, J=9,5, 4,1 Гц, 1Н), 4,52 (шир.с, 1Н), 4,23 (м, 2Н), 3,34 (м, 2Н), 2,74 (кажущийся т, J=7,1 Гц, 2Н), 2,56 (м, 1Н), 2,33 (м, 1Н), 1,44 (с, 9Н).
Анализ: Вычислено для С30Н33СlN2О5: С 67,09, H 6,19, N 5,22. Найдено: С 66,88, H 6,07, N 5,22.
Соединение 6
2-[2-[4-(2-Аминоэтил) фенокси] этил] -4-(4-хлорбензил) -3,4-дигидро-3-оксо- 2Н-1,4-бензоксазин
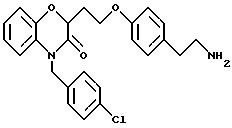
Получен способом К с использованием соединения 5. Через 18 ч раствор в смеси HCl/изопропанол выпаривали в вакууме и продукт выделяли в виде белого твердого вещества кристаллизацией из смеси СН2Сl2/диэтиловый эфир с выходом 43%, т. пл. 174-176oС; ИК (KBr) 3415, 2933, 1681, 1609, 1503, 1465, 1401, 1279, 1241, 1065, 824, 789, 488, 428, 415 см-1;1H ЯМР (DMSO-d6) δ 7,74 (шир. с, 3Н), 7,39 (д, J=8,5 Гц, 2Н), 7,30 (д, J=8,5 Гц, 2Н), 7,28 (д, J=8,8 Гц, 2Н), 7,1 (м, 4Н), 6,93 (д, J=8,8 Гц, 2Н), 5,20 (д, J=16,8 Гц, 1Н), 5,13 (д, J= 16,8 Гц, 1Н), 4,97 (дд, J=9,2, 4,1 Гц, 1Н), 4,19 (м, 2Н), 2,99 (м, 2Н), 2,80 (м, 2Н), 2,38 (м, 1Н), 2,24 (м, 1Н).
Анализ: Вычислено для C25H25ClN2O3 • HCl: С 63,43, H 5,54, N 5,92. Найдено: С 63,17, H 5,47, N 5,82.
Соединение 7
2-(2-[3-(2-трет- Бутоксикарбониламинометил)фенокси] этил}
-4-(4-хлорбензил) -3,4-Дигидро-3-оксо-2Н- 1,4-бензоксазин
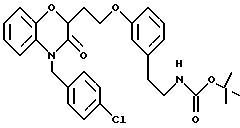
Получен способом J с использованием промежуточного продукта 10353-28-1 (ссылочный пример 41), модифицированным перемешиванием при комнатной температуре в течение 20 ч. Продукт получен в виде белого твердого вещества с выходом 30%; т.пл. 97-98,5oС; ИК (KBr) 3368, 3066, 3050, 2981, 2940, 1680, 1602, 1594, 1522, 1503, 1466, 1447, 1399, 1364, 1267, 1175, 1113, 1052, 1013 см-1;1H ЯМР (CDCl3) δ 7,32-7,16 (м, 5Н), 7,05-6,89 (м, 3Н), 6,86-6,73 (м, 4Н), 5,16 (д, J= 17,6 Гц), 5,09 (д, J=17,6 Гц), 4,93 (дд, J=6,7, 5,0 Гц), 4,55 (м, 1Н), 4,23 (м,
2Н), 3,38 (м, 2Н), 2,78 (кажущийся т, J=7,2 Гц, 2Н), 2,58 (м, 1Н), 2,33 (м, 1Н), 1,43 (с, 9Н).
Анализ: Вычислено для С30Н33СlN2О5: С 67,09, H 6,19, N 5,22. Найдено: С 67,14, H 6,21, N 5,16.
Соединение 8
2-[2-[3-(2-Аминоэтил) фенокси] этил] -4-(4-хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин
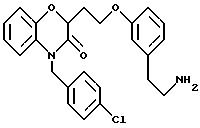
Получен способом К с использованием соединения 7. Раствор в смеси HCl/изопропанол выпаривали в вакууме через 2,5 ч и продукт выделяли кристаллизацией из смеси СН2Сl2/диэтиловый эфир в виде белого твердого вещества с выходом приблизительно 72%, т.пл. 155-156oС; ИК (КВr) 3400, 3052, 2940, 1683, 1605, 1501, 1399, 1301, 1248, 1162, 1094, 1053, 751 см-1;1H ЯМР (DMSO-d6) δ 7,40 (д, J=8,4 Гц, 2Н), 7,35-7,23 (м, 3Н), 7,02 (м, 4Н), 6,86 (м, 3Н), 5,2 (д, J=17,0 Гц, 1Н), 5,14 (д, J=17 Гц, 1Н), 5,15-3,30 (оч.шир.с, 4Н), 4,22 (м, 2Н), 3,05 (м, 2Н), 2,83 (м, 2Н), 2,40 (м, 1Н), 2,25 (м, 1Н).
Анализ: Вычислено для C25H25ClN2O3 • С2Н2O4 • 0.75Н2O: С 60,00, H 5,32, N 5,18. Найдено: С 60,11, H 5,08, N 5,06.
Соединение 9
2-[2-[3-(трет- Бутоксикарбониламинометил)фенокси] этил]-4-(4-хлорбензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин
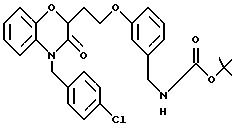
Получен способом J с использованием промежуточного продукта 10353-28-1 (ссылочный пример 41), модифицированным перемешиванием при комнатной температуре в течение 24 ч. Продукт получен с выходом 50%. Растирание с горячим диэтиловым эфиром давало белый твердый продукт, т.пл. 114-116oС; ИК (КВr) 3365, 2985, 1686, 1600, 1526, 1503, 1451, 1395, 1366, 1268, 1173, 1129, 1067, 1052, 843, 787, 760 см-1;1H ЯМР (CDCl3) δ 7,29 (д, J=8,9 Гц, 2Н), 7,23 (д, J=8,4 Гц, 1Н), 7,19 (д, J=8,9 Гц, 2Н), 7, 15-6,78 (м, 7Н), 5,15 (д, J= 16,8 Гц, 1Н), 5,1 (д, J=16,8 Гц, 1Н), 4,93 (дд, J=9,2, 4,2 Гц, 1Н), 4,82 (шир.с, 1Н), 4,37-4,13 (м, 4Н), 2,57 (м, 1Н), 2,34 (м, 1Н), 1,46 (с, 9Н).
Анализ: Вычислено для C29H31ClN2O5: С 66,60, H 5,97, N 5,36. Найдено: С 66,62, H 5,90, N 5,33.
Соединение 10
2-[2-[3-(Аминометил) фенокси]
этил]-4-(4-хлорбензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин
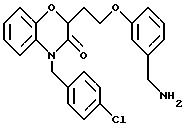
Получен способом К с использованием соединения 9. Раствор в смеси HCl/изопропанол выпаривали в вакууме через 24 ч и продукт выделяли с выходом 30% превращением в оксалатную соль с последующим растиранием с горячим CH2Cl2, т. пл. 127-129oС; ИК (КВr) 3446, 3053, 1501, 1466, 1401, 1248, 797, 747, 700, 486, 428 см-1;1H ЯМР (DMSO-d6) δ 8,20 (шир.с, 1Н), 7,40 (д, J=8,4 Гц, 2Н), 7,36 (д, J=8,0 Гц, 1Н), 7,31 (д, J=8,4 Гц, 2Н), 5,21 (д, J=17,2 Гц, 1Н), 5,13 (д, J=17,2 Гц, 1Н), 4,98 (дд, J=9,2, 4,2 Гц, 1Н), 5,15-4,10 (оч. шир.с, 3Н), 4,22 (м, 2Н), 4, 01 (с, 2Н), 2,45 (м, 1Н), 2,27 (м, 1Н).
Анализ: Вычислено для С24Н23ClN2O3 • С2Н2O4 • 1, 5Н2O: С 57,83, H 5,23, N 5,19. Найдено: С 58,06, H 4,85, N 5,20.
Соединение 11
2-[2-[3-(трет- Бутоксикарбониламинометил)фенокси] этил]-4-(2-хлорбензил)-3,4
-дигидро-3-оксо-2Н- 1,4-бензоксазин
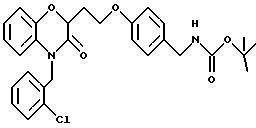
Получен способом J с использованием промежуточного продукта 9086-189-1 (ссылочный пример 42), но без хроматографии. Продукт выделяли осаждением из водного метанола и подщелачивали добавлением по каплям 2 н. NaOH и затем перекристаллизовали из смеси МеОН/вода, выход 84%, т.пл. 115-116oС; MS (CI) 523 (МН+); ИК (КВr) 3357, 2979, 1686, 1611, 1586, 1526, 1505, 1466, 1449, 1395, 1368, 1285, 1252, 1165, 1052, 749 см-1;1Н ЯМР (СDCl3) δ 7,43 (дд, J= 7,6, 1,7 Гц, 1Н), 7,27-7,13 (м, 4Н), 7,16-6,96 (м, 3Н), 6,95-6,81 (м, 3Н), 6,73 (дд, J=8,4, 1,3 Гц, 1Н), 5,28 (д, J=17,8 Гц, 1H), 5,21 (д, J=17,8 Гц, 1Н), 4,97 (дд, J=9,4, 4,2 Гц, 1H), 4,82 (шир.с, 1H), 4,35-4,17 (м, 4Н), 2,59 (м, 1H), 2,37 (м, 1H), 1,47 (с, 9Н).
Анализ: Вычислено для C29H31ClN2O5: С 66,60, H 5,97, N 5,36. Найдено: С 66,59, H 5,87, N 5,30.
Соединение 12
2-[2-[3-(Аминометил) фенокси] этил]-4-(2-хлорбензил) -3,4-дигидро-3-оксо-2Н -1,
4-бензоксазин
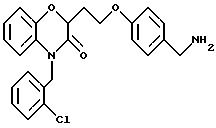
Получен способом К с использованием соединения 11. Раствор в смеси HCl/изопропанол выпаривали в вакууме через 24 ч и продукт выделяли кристаллизацией из CH2Cl2 с выходом 50% в виде белого порошка, т.пл. 191-193oС; МС (CI) 423 (МН+); ИК (КВr) 3419, 2889, 2624, 1683, 1605, 1505, 1466, 1443, 1403, 1324, 1279, 1181, 1110, 1086, 1038, 951, 930, 893, 791, 749, 695, 627, 567, 452 см-1;1H ЯМР (DMSO-d6) δ 8,35 (шир.с, 3Н), 7,53 (дд, J=7,7, 1,2 Гц, 1H), 7,32 (м, 3Н), 7,17 (с, 1H), 7,13-6,95 (м, 6Н), 6,85 (дд, J=7,7, 1,2 Гц, 1H), 5,22 (д, J=17,3 Гц, 1H), 5,13 (д, J=17,3 Гц, 1H), 5,04 (дд, J=8,8, 4,2 Гц, 1H), 4,25 (м, 2Н), 4,0 (с, 2Н), 2,44 (м, 1Н), 2,30 (м, 1Н).
Анализ: Вычислено для С24Н23СlN2O3 • HCl • 0, 5Н2О: С 61,54, H 5,38, N 5,98. Найдено: С 61,35, H 5,08, N 5,87.
Соединение 13
2-[2-[4-(трет- Бутоксикарбониламинометил)фенокси] этил]-4-(2-хлорбензил)-3,4
-дигидро-3-оксо-2Н- 1,4-бензоксазин
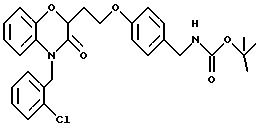
Получен способом J с использованием промежуточного продукта 9086-189-1 (ссылочный пример 42), с выходом 50% в виде белого твердого продукта, т.пл. 121-123oС; ИК (КВr) 3345, 2979, 2925, 1683, 1611, 1503, 1466, 1401, 1248, 1171, 749 см-1;1H ЯМР (CDCl3) δ 7,42 (дд, J=7,8, 1,4 Гц, 1Н), 7,27-7,12 (м, 2Н), 7,21 (д, J=8,4 Гц, 2Н), 7,05-6,87 (м, 4Н), 6,88 (д, J=8,4 Гц, 2Н), 6,71 (д, J= 7,8 Гц, 1Н), 5, 27 (д, J=17,6 Гц, 1Н), 5,21 (д, J=17,6 Гц, 1Н), 4,96 (дд, J=9,4, 4,1 Гц, 1Н), 4,76 (шир.с, 1Н), 4,25 (м, 4Н), 2,58 (м, 1Н), 2,36 (м, 1Н), 1,46 (с, 9Н).
Анализ: Вычислено для C29H31ClN2O5: С 66,60, H 5,97, N 5,36. Найдено: С 66,35, H 5,82, N 5,72.
Соединение 14
2-[2-[4-(Аминометил) фенокси] этил]
-4-(2- хлорбензил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин
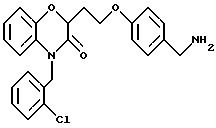
Получен способом К из соединения 13. Изопропанол удаляли в вакууме и продукт выделяли кристаллизацией из смеси СНCl3/этилацетат с выходом 69% в виде белого твердого вещества; т.пл. 200-205oС; MS (CI) 423 (МН+); ИК (КВr) 3430, 2960, 2890, 2600, 1690, 1611, 1517, 1501, 1468, 1401, 1279, 1250, 1183, 1050, 749, 407 см-1;1H ЯМР (DMSO-d6) δ 8,22 (шир. с, 3Н), 7,53 (дд, J=7,6, 1,3 Гц, 1Н), 7,40 (д, J=8,7 Гц, 2Н), 7,37-7,23 (м, 3Н), 7,12-6,95 (м, 4Н), 7,02 (д, J=8,7 Гц, 2Н), 6,83 (дд, J=7,9, 1,6 Гц, 1Н), 5,2 (д, J=17,2 Гц, 1Н), 5,13 (д, J=17,2 Гц, 1Н), 5,04 (дд, 8,4, 4,2 Гц, 1Н), 4,25 (м, 2Н), 3,95 (с, 2Н), 2,42 (м, 1Н), 2,39 (м, 1Н).
Анализ: Вычислено для С24Н23ClH2O3 • HCl • 0,3Н2O: С 62,02, H 5,34, N 6,03. Найдено: С 61,99, H 5,20, N 5,87.
Соединение 15
2-[2-[3-(2-(трет- Бутоксикарбониламино)этил) фенокси]этил]-4- (2-хлорбензил)-3,4-дигидро
-3-оксо-2Н-1,4-бензоксазин
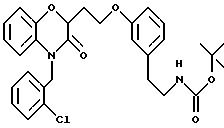
Получен способом J с использованием промежуточного продукта 9086-189-1 (ссылочный пример 42) с выходом 48% в виде белого порошка, т.пл. 61-65oС (размягчается), 68-70oС; MS (CI) 537 (МН+); ИК (КВr) 3365, 2998, 2935, 1690, 1607, 1503, 1447, 1401, 1366, 1254, 1171, 1050, 751 см-1;1H ЯМР (СDCl3) δ 7,42 (дд, J=7,6, 1,2 Гц, 1Н), 7,35-7,13 (м, 3Н), 7,08-6,87 (м, 4Н), 6,85-6,68 (м, 4Н), 5,28 (д, J=17, 6 Гц, 1Н), 5,21 (д, J=1H), 4,97 (дд, J=9,2, 4,1 Гц, 1Н), 4,54 (шир.с, 1Н), 4,25 (м, 2Н), 3,37 (м, 2Н), 2,66 (м, 2Н), 2,59 (м, 1Н), 2,38 (м, 1Н), 1,44 (с, 9Н).
Анализ: Вычислено для C30H33ClN2O5: С 67,09, H 6,19, N 5,22. Найдено: С 67,08, H 6,15, N 5,17.
Соединение 16
2-[2-[3-(2-Аминоэтил)
фенокси] этил]-4-(2- хлорбензил)-3,4-дигидро-3 -оксо-2Н-1,4-бензоксазин

Получен способом К с использованием соединения 15. Изопропанол удаляли в вакууме через 3 ч и продукт выделяли кристаллизацией из смеси CHCl3/этилацетат с выходом 91% в виде белого твердого вещества, т.пл. 173-175oС; MS (CI) 437 (МН+); ИК (КВг) 3420, 2932, 1687, 1603, 1501, 1466, 1445, 1401, 1326, 1252, 1160, 1050, 748, 695 см-1;1H ЯМР (DMSO-d6) δ 7,94 (шир.с, 3Н), 7,53 (д, J=7,9 Гц, 1Н), 7,37-7,23 (м, 3Н), 7,15-6,95 (м, 5Н), 6,86 (м, 3Н), 5,22 (д, J=17,5 Гц, 1Н), 5,13 (д, J=17,5 Гц, 1Н), 5,04 (дд, J=9,2, 2,2 Гц, 1Н), 4,23 (и, 2Н), 3, 04 (м, 2Н), 2,35 (м, 2Н), 2,4 (м, 1Н), 2,29 (м, 1Н).
Анализ: Вычислено для С25Н25СlN2O3 • HCl • 0,2Н2O: С 62,95, H 5,58, N 5,87. Найдено: С 62,83, H 5,29, N 5,62.
Соединение 17
2-[2-[4-(2-(трет- Бутоксикарбониламино)этил) фенокси]этил]-4- (2-хлорбензил)-3,4-дигидро -3-оксо-2Н-1,
4-бензоксазин
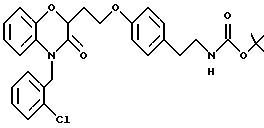
Получен способом J с использованием промежуточного продукта 9086-189-1 (ссылочный пример 42), с выходом 33% в виде белого порошка, т.пл. 108-111oС; ИК (КВr) 3378, 2978, 2920, 1692, 1611, 1515, 1503, 1397, 1366, 1248, 1175, 1056, 751 см-1;1H ЯМР (CDCl3) δ 7,43 (дд, J=8,0, 1,3 Гц, 1Н), 7,26-7,13 (м, 2Н), 7,11 (д, J=8,5 Гц, 2Н), 7,06-6,88 (м, 4Н), 6,88 (д, J=8,5 Гц, 2Н), 6,71 (д, J= 8,0 Гц, 1Н), 5,28 (д, J=17,8 Гц, 1Н), 5,22 (д, J=17,9 Гц, 1Н), 4,97 (дд, J=9,7, 4,2 Гц, 1Н), 4,52 (шир.с, 1Н), 4,25 (м, 2Н), 3,35 (м, 2Н), 2,74 (кажущийся т, J=7,1 Гц, 2Н), 2,05 (м, 1Н), 2,36 (м, 1Н), 1,44 (с, 9Н).
Анализ: Вычислено для С30Н33СlN2О5: С 67,09, H 6,19, N 5,22. Найдено: С 66,71, H 6,00, N 5,58.
Соединение 18
2-[2-[4-(2-Аминоэтил)фенокси] этил] -4-(2-хлорбензил)- 3,4-дигидро-3-оксо- 2Н-1,4-бензоксазин

Получен способом К с использованием соединения 18. Изопропанол удаляли в вакууме через 1 ч и продукт выделяли растиранием с диэтиловым эфиром с выходом 49% в виде не совсем белого порошка; т.пл.143-148oС; MS (CI) 437 (MH+-H2O); ИК (KBr) 3365, 2930, 1686, 1609, 1515, 1503, 1468, 1445, 1401, 1252, 1111, 1050, 826, 747 см-1;1H ЯМР (DMSO-d6) δ 7,97 (шир.с, 3Н), 7,54 (дд, J= 7,7, 1,4 Гц, 1H), 7,37-7,22 (м, 2Н), 7,19 (д, J=8,6 Гц, 2Н), 7,12-6,95 (м, 4Н), 6,94 (д, J=8,6 Гц, 2Н), 6,83 (дд, J=7,6, 1,5 Гц, 1H), 5,20 (д, J=17,3 Гц, 1H), 5,13 (д, J=17,3 Гц, 1H), 5,04 (дд, J=9, 1, 4,0 Гц, 1H), 4,21 (м, 2Н), 2,99 (м, 2Н), 2,82 (м, 2Н), 2,40 (м, 1H), 2,27 (м, 1H).
Анализ: Вычислено для С25 Н25ClN2O3 • HCl • 0,5Н2O: С 62,24, H 5,64, N 5,81. Найдено: С 62,17, H 5,31, N 6,13.
Соединение 19
4-(2-Хлорбензил)-2-[2-[4- (гуанидинометил)фенокси] этил] -3,4-дигидро-3-оксо -2Н-1,4-бензоксазин

Получен способом L с использованием промежуточного продукта 9086-189-1 (ссылочный пример 42) и N, N'-ди-трет-бутоксикарбонил-(4 -гидроксифенил)метилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли растворением остатка, представляющего собой сырой продукт, в водном метаноле и обработкой добавляемым по каплям 2 н. NaOH до достижения основности раствора. Продукт выделялся из раствора в виде масляного слоя. После удаления растворителя декантацией получали вязкое масло, которое сушили в вакууме и использовали без дальнейшей очистки. После стадии удаления защитной группы получали продукт, который кристаллизовали в CH2Cl2, получая белый порошок с общим выходом 71%, т.пл. 180-182o С; MS (CI) 465 (МН+); ИК (КВr) 3320, 3162, 1685, 1665, 1611, 1515, 1503, 1468, 1447, 1401, 1333, 1302, 1281, 1243, 1181, 1113, 1048, 824, 749, 687, 565, 428, 401 см-1;1H ЯМР (DMSO-d6) δ 8,07 (шир.т, J=5,9 Гц, 1Н), 7,53 (дд, J= 8,0 Гц, 1Н), 7,8-6,7 (оч.шир.с, 4Н), 7,35-7,15 (м, 3Н), 7,26 (д, J= 9,0 Гц, 2Н), 7,1-6,93 (м, 3Н), 6,99 (д, J=9,0 Гц, 2Н), 5,22 (д, J=17,9 Гц, 1Н), 5,11 (д, J=17,9 Гц, 1Н), 5,04 (дд, J=8,8, 4,2 Гц, 1Н), 4,3 (кажущийся д, J=6 Гц, 2Н), 4,23 (м, 2Н), 2,41 (м, 1Н), 2,28 (м, 1Н).
Анализ: Вычислено для С25Н25ClN4O3 • HCl: С 59,89, H 5,23, N 11,17. Найдено: С 59,57, H 5,13, N 10,99.
Соединение 20
4-(2-Хлорбензил)-2-[2-[4- (2-гуанидиноэтил)фенокси] этил]-3,4-дигидро-3 -оксо-2Н-1,4-бензоксазин
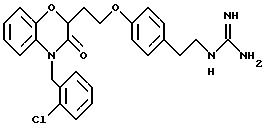
Получен способом L с использованием промежуточного продукта 9086-189-1 (ссылочный пример 42) и N, N'-ди-трет-бутокси-карбонил-2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли после флэш-хроматографии и кристаллизации с выходом 36%. Продукт с удаленной защитной группой выделяли в виде карбонатной соли (рыжевато-коричневое твердое вещество) с выходом 88%; т. пл. 90oС (разлож.); MS (CI) 479 (МН+); ИК (КВr) 3600, 3350, 2939, 1688, 1515, 1501, 1401, 1243, 1111, 1050, 834, 749, 522 см-1;1H ЯМР (DMSO-d6) δ 7,53 (дд, J= 7,8, 1,6 Гц, 1Н), 7,33 (дд, J=7,8, 1,6 Гц, 1Н), 7,29 (м, 1Н), 7,25 (дд, 7,4, 1,6 Гц, 1H), 7,18 (д, J=8,2 Гц, 2Н), 7,12-6, 93 (м, 4Н), 6,9 (д, J= 8,2 Гц, 2Н), 6,82 (дд, J=7,4, 1,6 Гц, 1H), 5,21 (д, J=17,2 Гц, 1H), 5,11 (д, J= 17,2 Гц, 1H) 5,2 (дд, J=8,5, 4,1 Гц, 1H), 4,2 (м, 2Н), 3,7-2,8 (шир.с, 5Н), 2,69 (м, 2Н), 2,4 (м, 1H), 2,25 (м, 1H).
Анализ: Вычислено для С26Н27N4O3Cl • H2CO3 • 0,3Н2О: С 59,35, H 5,46, N 10,25, Cl 6,49. Найдено: С 59,37, H 5,29, N 10,25, Cl 6,86.
Соединение 21
4-(4-Хлорбензил)-2-[2- [4-(гуанидинометил)фенокси] этил]-3,4-дигидро-3-оксо -2Н-1,4-бензоксазин

Получен способом L с использованием промежуточного продукта 10353-28-1 (ссылочный пример 41) и N, N'-ди-трет-бутоксикарбонил -(4-гидроксифенил)метилгуанидина и способа К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли растворением остатка, представляющего собой сырой продукт, в водном метаноле и обработкой добавляемым по каплям 2 н. NaOH до достижения основности раствора. Продукт осаждался из раствора, его собирали фильтрованием. Получаемый белый твердый продукт сушили на воздухе и использовали без дальнейшей очистки. Продукт после удаления защитной группы выделяли в виде карбонатной соли (рыжевато-коричневое твердое вещество) с общим выходом 24%, т.пл. 90oС (разлож.); MS (CI) 465 (МН+); ИК (КВr) 3330, 2940, 1685, 1708, 1650, 1600, 1513, 1501, 1466, 1399, 1302, 1279, 1245, 1177, 1094, 1052, 799, 751 см-1;1H ЯМР (DMSO-d6) δ 7,5-3,0 (оч. шир. с, 5Н), 7,40 (д, J=8,4 Гц, 2Н), 7,30 (д, J=8,4 Гц, 2Н), 7,12 (д, J=8,8 Гц, 2Н), 7,1-6,95 (м, 4Н), 6,91 (д, J=8,8 Гц, 2Н), 5,21 (д, J=17,4 Гц, 1Н), 5,13 (д, J= 17,4 Гц, 1Н), 4,97 (дд, J=9,0, 4,2 Гц, 1Н), 4,28 (м, 2Н), 2,37 (м, 1Н), 2,23 (м, 1Н).
Анализ: Вычислено для C25H25ClN4 O3 • CH2O3 • 0,3H2O: С 58,66, H 5,23, N 10,52. Найдено: С 58,38, H 4,86, N 10,61.
Ссылочный пример 89
Промежуточный
продукт 10353-76
4-(2-Хлорбензил) -3,4-дигидро-2-(2- гидроксиэтил)-2Н-1,4-бензоксазин
Способ М: Промежуточный продукт 9086-189-1 (1 г, 1 экв, ссылочный пример 42) растворяли в ТГФ (5
мл) и обрабатывали 1 М раствором боран/ТГФ (6,3 мл, 3 экв) и нагревали для кипячения с обратным холодильником. Через 3 ч реакционную смесь концентрировали в вакууме и остаток распределяли между
диэтиловым эфиром и 1 н. НСl. Органический слой промывали насыщенным Na2CO3, солевым раствором, сушили над Na2SO4 и концентрировали в вакууме. Продукт
выделяли в виде бесцветного масла флэш-хроматографией, элюируя смесью этилацетат/гексан, с выходом 96%.
Ссылочный пример 90
Промежуточный продукт 10353-82
4-(3-Хлорбензил)-3,4- дигидро-2-(2-гидроксиэтил)-2Н -1,4-бензоксазин
Получен способом М из промежуточного продукта 10488-22 (ссылочный пример 66) и выделен с выходом 99%.
Ссылочный
пример 91
Промежуточный продукт 10353-83
4-(4-Хлорбензил)-3,4- дигидро-2-(2-гидроксиэтил) -2Н-1,4-бензоксазин
Получен способом М из промежуточного продукта
10353-28-1 (ссылочный пример 41) и выделен с количественным выходом в виде бесцветного масла.
Ссылочный пример 92
Промежуточный продукт 10840-45
3,
4-Дигидро-2-(2- гидроксиэтил)-4-(4- метилбензил)-2Н- 1,4-бензоксазин
Получен способом М из промежуточного продукта 10840-33 (ссылочный пример 46) с выходом 80% и выделен в виде зеленого масла,
ИК (чистый) 3371, 2921, 1607, 1500, 1247, 1221, 1052, 743 см-1;1H ЯМР (CDCl3) δ 1,77-2,00 (м, 3Н), 2,33 (с, 3Н), 3,19 (дд, J=11,8, 7,7 Гц, 1Н), 3,27 (дд, J=11,
7, 2,6 Гц, 1Н), 3,86-3,94 (м, 2Н), 4,33-4,40 (м, 1Н), 4,40 (с, 2Н), 6,60-6,71 (м, 2Н), 6,76-6,84 (м, 2Н), 7,15 (шир.кв, JAB=8,2 Гц, 4Н).
Анализ: Вычислено для C18 H21NO2 • 0,6Н2О: С 73,49, H 7,61, N 4,76. Найдено: С 73,33, H 7,22, N 4,84.
Ссылочный пример 93
Промежуточный продукт 10840-46
3,4-Дигидро-2-(2- гидроксиэтил)-4-(3- метоксибензил)-2Н -1,4-бензоксазин
Получен способом М из промежуточного продукта 10508-22-А (ссылочный пример 76) с количественным выходом и выделен в
виде зеленого масла, ИК 3350, 2948, 1605, 1505, 1283, 1262, 1050, 743 см-1;1H ЯМР (СDCl3) δ 1,50-2,10 (оч.шир.с, 1Н), 1,78-2,01 (м, 2Н), 3,20 (дд, J=11,7, 7,8
Гц, 1H), 3,28 (дд, J=11,7, 2,6 Гц, 1H), 3,78 (с, 3Н), 3,88 (т, J=5,6 Гц, 2Н), 4,34-4,43(м, 1H), 4,40 (с, 2Н), 6,62-6,79 (м, 2Н), 6,76-6,89 (м, 5Н), 7,24 (т, J=7,7 Гц, 1Н); МН+ при
m/z=300.
Анализ: Вычислено для C18H21NO3 • 0,2H2O: С 71,36, H 7,12, N 4,62. Найдено: С 71,25, H 7,00, N 4,62.
Ссылочный пример 94
Промежуточный продукт 10840-8
4-(2,4-Дихлорбензил) -3,4-дигидро-2-(2-гидроксиэтил) -2Н-1,4-бензоксазин
Получен способом М из промежуточного продукта
10005-181-1 (ссылочный пример 48) с выходом 87% и выделен в виде бесцветного масла. ИК (чистый) 3348, 1607, 1501, 1247, 1221, 1046, 743 см-1;1H ЯМР (СDCl3) δ 1,
80-2,03 (м, 3Н), 3,27-3,37 (м, 2Н), 3,85-3,98 (м, 2Н), 4,38-4,45 (м, 1H), 4,45 (с, 2Н), 6,44 (дд, J=8,0, 1,4 Гц, 1H), 6,65 (тд, J=7,6, 1,5 Гц, 1H), 6,77 (тд, J=7,8, 1,6 Гц, 1H), 6,83 (дд, J=7,8, 1,6
Гц, 1H), 7,15-7,25 (м, 2Н), 7,42 (д, J=1,8 Гц); МН+ при m/z=338.
Анализ: Вычислено для C17H17Cl2NO2: С 60,37, H 5,07, N 4,14. Найдено: С 60,04, H 4,98, N 4,05.
Соединение 22
4-(4-Хлорбензил)-2-[2- [4-(2-гуанидиноэтил)фенокси] этил]-3,4-дигидро- 2Н-1,4-бензоксазин
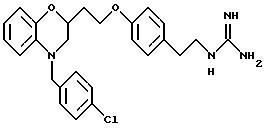
Получен способом L с использованием промежуточного продукта 10353-83 (ссылочный пример 91) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли с удовлетворительной чистотой флэш-хроматографией (элюирование смесью этилацетат/гексан) с выходом 58%. Продукт с удаленной защитной группой выделяли как карбонатную соль с выходом 50% в виде рыжевато-коричневого твердого вещества, которое давало один однородный пик при ВЭЖХ (PDA-детектирование) на С18-колонке 15 см при элюировании смесью Н2О (5% NH4OH, 5% HOAc)/CH3CN, 55/45; MS (CI) 466 (MH+); ИК (KBr) 3475, 3321, 3064, 2931, 2875, 1698, 1638, 1608, 1581, 1513, 1502, 1467, 1696, 1358, 1303, 1288, 1244, 1178, 1116, 1047, 1013, 833, 743 см-1;1H ЯМР (DMSO-d6) δ 8,30-7,50 (шир.с, 2Н), 7,40 (д, J=8,2 Гц, 2Н), 7,35 (д, J=8,2 Гц, 2Н), 7,19 (д, J=8,2 Гц, 2Н), 6,90 (д, J=8,2 Гц, 2Н), 6,77-6,60 (м, 3Н), 6,55 (м, 1Н), 4,53 (д, J=16,8 Гц, 1Н), 4,45 (д, J=16,8 Гц, 1Н), 4,35 (м, 1Н), 4,12 (шир.д, J=11,4 Гц, 2Н), 3,60-3,10 (шир.с, 5Н), 3,49 (м, 2Н), 2,73 (м, 2Н), 2,05 (м, 2Н).
Соединение 23
4-(3-Хлорбензил)-2-[2-[4- (2-гуанидиноэтил)фенокси] этил]-3,
4-дигидро- 2Н-1,4-бензоксазин

Получен способом L с использованием промежуточного продукта 10353-82 (ссылочный пример 90) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли флэш-хроматографией (элюирование смесью этилацетат/гексан) с выходом 94%. Продукт с удаленной защитной группой выделяли как карбонатную соль с выходом 59% в виде рыжевато-коричневого твердого вещества, которое давало один однородный пик при ВЭЖХ (PDA-детектирование) на С18-колонке 15 см при элюировании смесью Н2O (5% NH4OH, 5% НОАс)/СН3СN, 55/45; MS (CI) 466 (MH+); ИК (KBr) 3473, 3316, 3064, 2931, 2876, 1698, 1638, 1608, 1580, 1512, 1503, 1468, 1431, 1393, 1359, 1303, 1243, 1221, 1178, 833, 742 см-1;1H ЯМР (DMSO-d6) δ 8,50-7,60 (шир.с, 2Н), 7,42-7,20 (м, 4Н), 7,19 (д, J=7,7 Гц, 2Н), 6,90 (д, J=7,7 Гц, 2Н), 6,78-6,70 (м, 3Н), 6,58 (м, 1Н), 4,55 (д, J=17,3 Гц, 1Н), 4,48 (д, J=17,3 Гц, 1Н), 4,15 (м, 2Н), 3, 80-3,10 (шир.с, 4Н), 3,52 (шир.д, J=11,8 Гц, 2Н), 3,25 (м, 2Н), 2,73 (м, 2Н), 2,08 (м, 2Н).
Соединение 24
4-(3-Хлорбензил)-3,4-дигидро -2-[2-[4-(2-гуанидиноэтил)
-фенокси]этил] -6-метил -3-оксо-2Н-1,4-бензоксазин
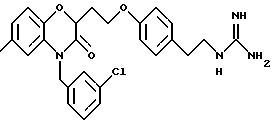
Получен способом L с использованием промежуточного продукта 12168-10-1 (ссылочный пример 39) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способа К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли флэш-хроматографией (элюирование смесью этилацетат/гексан) с выходом около 70%. Продукт с удаленной защитной группой растирали в диэтиловом эфире, растворенном в CH2 Cl2, и растворитель удаляли в вакууме, получая продукт с выходом 92% в виде бледно-желтого твердого вещества; MS (CI) 493 (МН+); ИК (КВr) 3148, 1666, 1610, 1511, 1433, 1384, 1302, 1244, 1178, 1112, 1052, 817, 772, 680, 527 см-1;1H ЯМР (DMSO-d6) δ 7,50 (шир.т, J=5,7 Гц, 1H), 7,40-6,85 (оч.шир.с, 5Н), 7,35 (м, 3Н), 7,20 (м, 3Н), 6,94 (м, 4Н), 6,81 (д, J=8,9 Гц, 1H), 5,20 (д, J=17,3 Гц, 1H), 5,12 (д, J= 17,3 Гц, 1H), 4,94 (дд, J=9,1, 4,3 Гц, 1H), 4,18 (м, 2Н), 3,31 (м, 2Н), 2,72 (кажущийся т, J=7,3 Гц, 2Н), 2,37 (м, 1H), 2,30-2,13 (м, 1H), 2,19 (с, 3Н).
Анализ: Вычислено для С27Н29СlN4О3 • HCl •1,0H2O: С 59,23, H 5,89, N 10,23. Найдено: С 59,47, H 5,60, N 10,11.
Соединение 25
4-(3-Хлорбензил)-3,4-дигидро -2-[2-[4-(2-гуанидиноэтил)-фенокси] этил] -3-оксо-2Н-пиридо [3,2-b]-1,4-оксазин
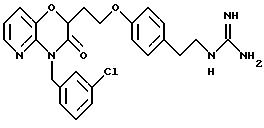
Получен способом L с использованием промежуточного продукта 10353-191-1 (ссылочный пример 40) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищснный продукт сочетания Mitsunobu выделяли флэш-хроматографией (элюирование смесью этилацетат/гексан) с выходом 77%. Продукт с удаленной защитной группой выделяли с выходом 50% после растирания с диэтиловым эфиром, т.пл. 47-54oС (размягчается), 54-56oС; MS (CI) 480 (МН+); ИК (КВr) 3326, 3150, 1666, 1599, 1513, 1459, 1398, 1331, 1278, 1229 см-1;1H ЯМР (DMSO-d6) δ 8,0 (дд, J= 4,9, 1,4 Гц, 1Н), 7,53 (шир.т, J=7,3 Гц, 1Н), 7,47 (дд, J=7,9, 1,2 Гц, 1H), 7,37 (с, 1Н), 7,35-7,22 (м, 2Н), 7,17 (д, J=8,6 Гц, 2Н), 7,09 (дд, J= 7,9, 4,8 Гц, 1H), 6,87 (д, J=8,6 Гц, 2Н), 5,24 (д, J=16,3, Гц, 1H), 5,23 (д, J= 16,3 Гц, 1H), 5,12 (дд, J=8,2, 4,2 Гц, 1H), 4,15 (м, 2Н), 6,32 (м, 2Н), 2,71 (м, 2Н), 2,39 (м, 1H), 2,29 (м, 1H).
Анализ: Вычислено для C25H26ClN5O3 • 2HCl • 0,8H2O: С 56,57, H 5,43, N 13,19. Найдено: С 56,84, H 5,65, N 13,04.
Соединение 25
4-(3-Хлорбензил)-3,4- дигидро-2-[2-[4-(2- гуанидиноэтил) фенокси]этил]
-6-метил-2Н-1,4-бензоксазин
Получен способом L с использованием промежуточного продукта 10353-191-1 (ссылочный пример 40) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли путем растворения остатка, представляющего собой сырой продукт, в водном метаноле и обработки добавляемым по каплям 2 н. NaOH до достижения основности раствора. Остаток собирали фильтрованием. Получаемый продукт растворяли в эфире, промывали последовательно 1 н. HCl, насыщенным раствором NaHCO3 и солевым раствором, сушили над Na2SO4 и концентрировали в вакууме и использовали без дальнейшей очистки. Продукт с удаленной защитной группой выделяли как карбонатную соль с выходом 22% в виде рыжевато-коричневого вещества, которое давало один однородный пик при ВЭЖХ (PDA-детектирование) на C18-колонке 15 см при элюировании смесью Н2O (5% NH4OH, 5% НОАс)/СН3СN, 55/45; MS (CI) 451 (MH+); ИК (KBr) 3314, 3036, 2923, 1682, 1608, 1581, 1511, 1468, 1443, 1392, 1352, 1302, 1244, 1223, 1175, 1046, 742 см-1.
Соединение 26
4-(4-Хлорбензил)-3,
4- дигидро-2-[2-[4-(2- гуанидиноэтил)-фенокси]этил]-3 -оксо-2Н-1,4-бензоксазин
Получен способом L с использованием промежуточного продукта 10353-28-1 (ссылочный пример 41) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли путем растворения остатка, представляющего собой сырой продукт, в водном метаноле и обработки 2 н. NaOH до достижения основности раствора. Продукт осаждался из раствора в виде смолистого полутвердого вещества. Растворитель удаляли декантацией, продукт сушили на воздухе и использовали без дальнейшей очистки. Продукт с удаленной защитной группой выделяли как карбонатную соль (рыжевато-коричневое твердое вещество) с выходом 60%, которая давала один однородный пик при ВЭЖХ (PDA-детектирование) на C18-колонке 15 см при элюировании смесью H2O (5% NH4OH, 5% НОАс)/СН3СN, 55/45; MS (CI) 479 (МН+); ИК (КВr) 3337, 3050, 2930, 2875, 1683, 1609, 1512, 1500, 1466, 1439, 1397, 1327, 1301, 1278, 1242, 1177, 1093, 750 см-1.
Соединение 27
4-Бензил-2-{ 2-[4-[2-(N, N -бис-трет-бутоксикарбонилгуанидино -этил]фенокси]этил}-3,4 -дигидро-3-оксо-2Н- 1,4-бензоксазин

Получен способом L с использованием промежуточного продукта 10508-23-А (ссылочный пример 74) и выделен в виде белого порошка с выходом 28% после колоночной хроматографии (10% эфир в гексане); ИК (КВг) 3334, 2978, 1638, 1616, 1330, 1132, 750 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,25-2,39 (м, 1Н), 2,50-2,63 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,63 (кв, J= 7,9 Гц, 2Н), 4,18-4,29 (м, 2Н), 4,94 (дд, J=9,3, 3,8 Гц, 1Н), 5,16 (с, 2Н), 6,84-7,01 (м, 6Н), 7,13 (д, J=8,4 Гц, 2Н), 7,23-7,34 (м, 5Н), 8,38 (шир.т, J=3,8 Гц, 1Н), 11,49 (шир.с, 1Н).
Анализ: Вычислено для С36Н44N4O7: С 67,06, H 6,88, N 8,69. Найдено: С 66,80, H 6,90, N 8,63.
Соединение 28
0,7-Гидрат гидрохлорида 4-бензил-3,4-дигидро- 2-{2-[4-[2-гуанидиноэтил] фенокси] этил}-3-оксо-2Н-1,
4-бензоксазина

Получен способом К с использованием соединения 27 и выделен в виде белого порошка с выходом 9,1%; ИК (КВr) 3326, 3146, 1664, 1500, 1401, 1243, 827, 751 см-1.
Анализ: Вычислено для С26Н28N4O3 • HCl • 0,7Н2O: С 63,27, H 6,21, N 11,35. Найдено: С 63,37, H 5,98, N 11,06.
Соединение 29
3,4-Дигидро-2-{ 2-[4-[2- гуанидиноэтил] фенокси]этил}
-4-(2-метоксибензил)-3- оксо-2Н-1,4-бензоксазин
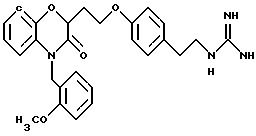
Получен из 2-{ 2-[4-[2-(N, N-бис- трет-бутоксикарбонил-гуанидино)этил] фенокси] этил}-3,4-дигидро-4-(2- метоксибензил)-3-оксо -2Н-1,4-бензоксазина способами L и К в виде не совсем белого порошка с выходом 25%; ИК (КВr) 3164, 1663, 1501, 1405, 1245, 751 см-1;1H ЯМР (CDCl3) δ 2,20-2,33 (м, 1Н), 2,37-2,52 (м, 1Н), 2,76 (шир.с, 2Н), 3,33 (шир.с, 2Н), 3,87 (с, 3Н), 4,08-4,21 (м, 2Н), 4, 87 (дд, J=8,6, 4,3 Гц, 1Н), 5,09 (ABq, JAB=18,0 Гц, 2Н), 6,73-7,25 (оч. шир. с, 4Н), 6,73-6,99 (м, 9Н), 7,11 (д, J=7,7 Гц, 2Н), 7,21 (т, J=7,2 Гц, 1Н), 7,67 (шир.с. 1Н); MH+ при m/z=475.
Анализ: Вычислено для С27Н30N4O4 • HCl • 0.75Н2O: С 61,83, H 6,25, N 10,68. Найдено: С 61,82, H 6,26, N 10,61.
Соединение 30
2-{ 2-[4-[2-(N,N-Бис-трет -бутоксикарбонилгуанидино) этил] фенокси]этил} -3,4-дигидро -4-(3-фторбензил)-3-оксо -2Н-1,4-бензоксазин

Получен из 10508-24-А (ссылочный пример 45) способом L и выделен в виде белой пены с выходом 17% после хроматографии с использованием 20% этилацетата в гексане; ИК (КВг) 3330, 2979, 1723, 1688, 1638, 1132, 1059, 751 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,50 (с, 9Н), 2,27-2,38 (м, 1Н), 2,53-2,64 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,64 (кв, J=6,8 Гц, 2Н), 4,15-4,29 (м, 2Н), 4,94 (дд, J= 9,0, 4,0 Гц, 1Н), 5,15 (ABq, JAB=15,2 Гц, 2Н), 6,81-7,04 (м, 8Н), 7,13 (д, J= 8,6 Гц, 2Н), 7,28-7,92 (м, 2Н), 8,36 (т, J=4,8 Гц, 1Н), 11,47 (с, 1Н).
Анализ: Вычислено для С36Н43FN4O7: С 65,24, H 6,54, N 8, 45. Найдено: С 65,03, H 6,43, N 8,31.
Соединение 31
3,4-Дигидро-4-(3- фторбензил)-2-{ 2-[4-(2- гуанидиноэтил)-фенокси]этил} -3-оксо -2Н-1,4-бензоксазин

Получен из соединения 30 способом К и выделен в виде белой пены с выходом 97%; ИК (КВr) 3153, 1654, 1501, 753 см-1;1H ЯМР (СDCl3) δ 2,18-2,33 (м, 1Н), 2,37-2,52 (м, 1Н), 2,78 (шир.с, 2Н), 3,34 (оч.шир.с, 2Н), 4,05-4,22 (м, 2Н), 4,86 (дд, J=8,7, 4,2 Гц, 1Н), 5,07 (с, 2Н), 6,75-7,25 (шир.с, 4Н), 6,80 (д, J=7,6 Гц, 2Н), 6,84-7,00 (м, 6Н), 7,12 (д, J=7,7 Гц, 2Н), 7,22-7,30 (м, 2Н), 7,71 (шир.с, 1Н).
Анализ: Вычислено для С26Н27 FN4O3 • HCl • Н2O • 0,1C3H8O: С 60,40, H 5,94, N 10,71. Найдено: С 60,11, H 5,86, N 10,42.
Соединение 32
2-{2-[4-[2-(N,N-Бис-трет- бутоксикарбонилгуанидино) этил] -фенокси]этил} -3,4 -дигидро-4-(3-метоксибензил) -3-оксо-2Н-1,4-бензоксазин

Получен из промежуточного продукта 10508-22-А (ссылочный пример 76) способом L и выделен в виде белой пены с выходом 30%; ИК (КВr) 3334, 2979, 1723, 1686, 1645, 1615, 1329, 1246, 1156, 1132, 1059, 751 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,26-2,38 (м, 1Н), 2,51-2,63 (м, 1Н), 2,81 (т, J= 7, 2 Гц, 2Н), 3,64 (кв, J=6,79 Гц, 2Н), 3,77 (с, 3Н), 4,15-4,29 (м, 2Н), 4,94 (дд, J=9,2, 4,0 Гц, 1Н), 5,13 (с, 2Н), 6,76-7,02 (м, 8Н), 7,12 (д, J=8,6 Гц, 2Н), 7,21-7,26 (м, 2Н), 8,37 (т, J=4,8 Гц, 1Н), 11,47 (с, 1Н).
Анализ: Вычислено для С37Н46N4O8 • 0,1Н2O: С 65,68, H 6,88, N 8,28. Найдено: С 65,40, H 6,83, N 8,10.
Соединение 33
3,4-Дигидро-2-{ 2-[4-(2-гуанидиноэтил)фенокси] этил} -4-(3-метоксибензил)-3-оксо-2Н-1,4-бензоксазин
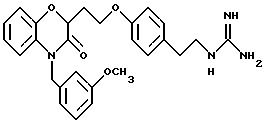
Получен из соединения 32 способом К и выделен в виде растворимой в СНCl3 белой пены с выходом 21%; ИК (чистый) 3020, 1671, 1513, 1501, 1407, 1217, 758 см-1;1H ЯМР (СDCl3) δ 2,15-2,28 (м, 1Н), 2,35-2,48 (м, 1Н), 2,70-2,87 (м, 3Н), 3,34 (шир.с, 2Н), 3,71 (с, 3Н), 4,02-4,17 (м, 2Н), 4,85 (дд, J=8,8, 4,0 Гц, 1Н), 5,03 (ABq, JAB=16,8 Гц, 2Н), 6,72-7,23 (м, 16Н), 7,64 (шир.с, 1Н).
Анализ: Вычислено для C27H30N4O4 • HCl • H2O: С 61,30, H 6,29, N 10,59. Найдено: С 61,20, H 6,04, N 10,45.
Соединение 34
4-(3-Бензилоксибензил) -2{ 2-[4-[2-(N,N-бис
-трет-бутоксикарбонилгуанидино) этил]фенокси]этил}-3,4 -дигидро-3-оксо -2Н-1,4-бензоксазин

Получен из 10508-82-А (ссылочный пример 77) способом L и выделен в виде белой пены с выходом 35% после хроматографии (элюирование CH2Cl2); ИК (КВr) 3331, 2977, 1722, 1687, 1638, 1613, 1501, 1410, 1329, 1245, 1156, 1131, 749 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,24-2,37 (м, 1Н), 2,50-2,63 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3, 63 (кв, J=7,1 Гц, 2Н), 4,15-4,30 (м, 2Н), 4,92 (дд, J=9,4, 3,9 Гц, 1Н), 5,02 (с, 2Н), 5,12 (ABq, JAB= 15,4 Гц, 2Н), 6,84-7,00 (м, 9Н), 7,12 (д, J=8,6 Гц, 2Н), 7,23-7,27 (м, 1Н), 7,32-7,42 (м, 5Н), 8,37 (шир.т, J=4,3 Гц, 1Н), 11,5 (с, 1Н).
Анализ: Вычислено для С43Н50N4О8: С 68,78, H 6,71, N 7,46. Найдено: С 68,50, H 6,78, N 7, 41.
Соединение 35
4-(3-Бензилоксибензил) -3,4-дигидро-2-(2-[4-(2- гуанидино-этил)фенокси] этил}-3 -оксо-2Н-1,4-бензоксазин
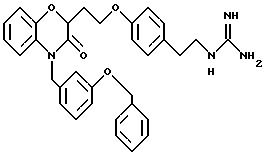
Получен из соединения 34 способом К и выделен в виде белой пены с выходом 53% после многократных растираний с эфиром, т.пл 100-105o С. ИК (КВr) 3338, 3155, 1676, 1610, 1513, 1500, 1400, 1243, 751 см-1;1H ЯМР (CDCl3) δ 2,10-2,23 (м, 1Н), 2,30-2,44 (м, 1Н), 2,74 (шир.с, 2Н), 3,32 (шир.с, 2Н), 3,97-4,15 (м, 2Н), 4,81 (дд, J=8,7, 4,1 Гц, 1Н), 4,96 (с, 2Н), 5,01 (с, 2Н), 6,75-7,33 (м, 23Н), 7,63 (шир.с, 1Н).
Анализ: Вычислено для С33Н34O4 • НСl • H2О: С 65,50, H 6,16, N 9,26. Найдено: С 65,77, H 5,98, N 9,06.
Соединение 36
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси]
этил}-4-(3-гидроксибензил) -3-оксо-2Н-1,4-бензоксазин
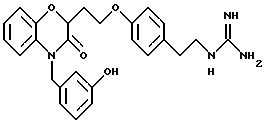
Соединение 35 (0,5 г, 0,83 ммоль) подвергали реакции с H2 при 3,515 атм в вибраторе Парра, содержащем 10% Pd/C (200 мг) в МеОН. Через 2 ч катализатор удаляли и фильтрат концентрировали в вакууме. Продукт выделяли в виде белого порошка с выходом 40% после растирания с эфиром; ИК (КВr) 3159, 1661, 1613, 1512, 1500, 1242, 752 см-1;1H ЯМР (DMSO-d6 плюс СDCl3) δ 2,28-2, 38 (м, 1 Н), 2,45-2,58 (м, 1Н), 2,82 (т, J=7,4 Гц, 2Н), 3,01 (с, HDO), 3,40 (кв, J= 6,8 Гц, 2Н), 4,15-4,30 (м, 2Н), 4,91 (дд, J=9,1, 4,3 Гц, 1Н), 5,08 (с, 2Н), 6,69-6,75 (м, 3Н), 6,87-7,02 (м, 8Н), 7, 11-7,30 (м, 5Н), 7,54 (шир. т, J=5,1 Гц, 1Н), 9,05 (с, 1Н); МН+ при m/z=461.
Анализ: Вычислено для С26Н28N4O4 • 2HCl • Н2O: С 56,63, H 5,85, N 10,16. Найдено: С 56,46, H 5,61, N 9,85.
Соединение 37
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси]
этил}-4- (4-метоксибензил)-3 -оксо-2Н-1,4-бензоксазин

Получен в виде белой пены с выходом 53% способом L с использованием промежуточного продукта 10508-19 (ссылочный пример 47) и N,N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)-этилгуанидина и способа К: ИК (КВr) 3411, 1654, 1617, 1515, 1501, 1248, 750 см-1;1H ЯМР (CDCl3) δ 2,20 (м, 1Н), 2,31-2,44 (м, 1Н), 2,72 (шир.т, J=6,4 Гц, 2Н), 3,29 (шир.т, J=6,4 Гц, 2Н), 3,68 (с, 3Н), 3,96-4,12 (м, 2Н), 4,79 (дд, J=8,8, 4,0 Гц, 1Н), 4,97 (с, 2Н), 6,70-7,30 (оч.шир.с, 4Н), 6,71-6,93 (м, 8Н), 7,05-7,13 (м, 4Н), 7,70 (шир.с, 1Н); MH+ при m/z=475.
Анализ: Вычислено для C27H30N4O4 • HCl • H2O: С 61,30, H 6,29, N 10,59. Найдено: С 61,17, H 6,10, N 10,25.
Соединение 38
3,
4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -3-оксо-4-(4-фенилбензил) -2Н-1,4-бензоксазин
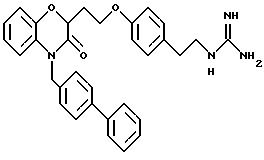
Получен в виде белой пены с общим выходом 18% способом L с использованием промежуточного продукта 11578-99 (ссылочный пример 59) и N,N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)-этилгуанидина и способа К; ИК (КВr) 3157, 1681, 1500, 1398, 1243, 759 см-1;1H ЯМР (CDCl3) δ 2,20-2,33 (м, 1Н), 2,38-2,54 (м, 1Н), 2,73-2,82 (м, 2Н), 3,27-3,39 (м, 2Н), 4, 05-4,22 (м, 2Н), 4,88 (дд, J=8,9, 4,4 Гц, 1Н), 5,12 (с, 2Н), 6,65-7,57 (оч.шир.с, 4Н), 6,80 (д, J=8,4 Гц, 2Н), 6,88-6,97 (м, 3Н), 7,11 (д, J=8,3 Гц, 2Н), 7,25-7,32 (м, 4Н), 7,39 (т, J=7,1 Гц, 2Н), 7, 51 (д, J=8,0 Гц, 4Н), 7,71 (шир.с, 1Н); МН+ при m/z=521.
Анализ: Вычислено для С32Н32N4О3 • HCl • Н2O: С 66,83, H 6,13, N 9,74. Найдено: С 67,01, H 5,99, N 9,53.
Соединение 39
2-{ 2-[4-(2-Аминометил) фенокси]этил}-4-(3,5- дихлорбензил)-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин
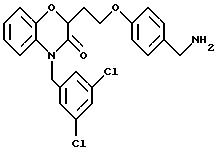
Получен в виде белого твердого продукта с выходом 73% способом L с использованием промежуточного продукта 10005-181-1 (ссылочный пример 48) и N-трет-бутоксикарбонил-(4 -гидроксифенил)бензиламина и способа К непосредственно из реакционной смеси; т.пл. 228,5-230oС; ИК (КВr) 2927, 1680, 1517, 1503, 1402, 1254, 752 см-1;1H ЯМР (DMSO-d6) δ 2,20-2,31 (м, 1Н), 2,36-2,48 (м, 1Н), 3,94 (с, 2Н), 4,20-4,28 (м, 2Н), 5,05 (дд, J=8,5, 3,8 Гц, 1Н), 5,18 (ABq, JAB=16,7 Гц, 2Н), 6,96-7,10 (м, 6Н), 7,35 (д, J=1,8 Гц, 2Н), 7,43 (д, J=8,6 Гц, 2Н), 7,52 (т, J=1,8 Гц, 1Н), 8,37 (шир.с, 3Н).
Анализ: Вычислено для С24Н22 Сl2N2O3 • HCl • 0,5Н2O: С 57,33, H 4,81, N 5,57. Найдено: С 57,33, H 4,77, N 5,37.
Соединение 40
4-(3,
5-Дихлорбензил)-3,4 -дигидро-2-{ 2-[4-(2- гуанидино-этил)фенокси] этил} -3-оксо-2Н-1,4-бензоксазин

Получен в виде окрашенного в кремовый цвет твердого продукта с общим выходом 48% способом L с использованием промежуточного продукта 10005-181-1 (ссылочный пример 48) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина способом К, т.пл. 115,5-117oС; ИК (КВr) 3328, 1665, 1515, 1501, 1399, 1245, 751 см-1;1H ЯМР (DMSO-d6) δ 2,17-2,30 (м, 1H), 2,33-2,47 (м, 1Н), 2,72 (т, J= 7,2 Гц, 2Н), 3,28-3,48 (м, 3Н), 4,15, 4,24 (м, 2Н), 5,02-5,06 (м, 1H), 5,18 (ABq, JAB=16,7 Гц, 2Н), 6,8-7,6 (оч.шир.с, 4Н), 6,91 (д, J=8,5 Гц, 1H), 6,99-7,10 (м, 4Н), 7,20 (д, J=8,5 Гц, 2Н), 7,35 (с, 2Н), 7,52 (с, 1H), 7,66 (т, J=5,5 Гц, 1H).
Анализ: Вычислено для С26Н26Сl2N4O3 • HCl • 0,25Н2O: С 56,33, H 5,00, N 10,11. Найдено: С 56,18, H 5,26, N 9,90.
Соединение 41
2-{ 2-[4-[2-(N,
N-Бис-трет- бутоксикарбонилгуанидино)этил]-фенокси] этил} -3,4-дигидро-4-(3- метоксибензил)-3-оксо-4- (4-пиколил)-2Н-1,4-бензоксазин
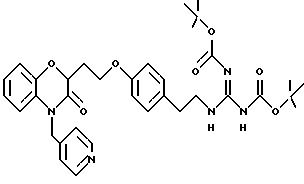
Получен в виде не совсем белого порошка с выходом 20% способом L с использованием промежуточного продукта 10840-22 (ссылочный пример 58) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина; ИК (КВr) 2979, 1723, 1690, 1638, 1501, 1416, 1368, 1333, 1246, 1158, 751 см-1;1H ЯМР (CDCl3) δ 1, 48 (с, 9Н), 1,50 (с, 9Н), 2,28-2,40 (м, 1Н), 2,53-2,64 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,63 (шир.кв, J=7,2 Гц, 2Н), 4,16-4,30 (м, 2Н), 4,96 (дд, J=9,2, 4,0 Гц, 1Н), 5,16 (ABq, JAB=14 Гц, 2Н), 6,73 (дд, J=8,4, 1,5 Гц, 1Н), 6,85 (д, J= 8,6 Гц, 2Н), 6,93 (тд, J=7,2, 2,0 Гц, 1Н), 6,97-7,06 (м, 2Н), 7,12-7,17 (м, 4Н), 8,36 (шир.т, J=4,8 Гц, 1H), 8,56 (дд, J=4,5, 1,6 Гц, 2Н), 11,47 (с, 1H).
Анализ: Вычислено для C35H43N5O7: С 65,10, H 6,71, N 10,85. Найдено: С 64,73, H 6,69, N 10,46.
Соединение 42
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси]этил} -3-оксо-4-(4-пиколил) -2Н-1,4-бензоксазин
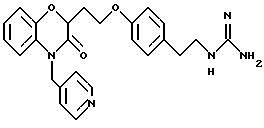
Получен из соединения 41 способом К и выделен в виде белого твердого продукта с выходом 30% после растирания с эфиром, т.пл. 244-248oС; ИК (КВr) 3184, 1673, 1640, 1499, 1403, 1248, 760 см-1;1H ЯМР (DMSO-d6) δ 2,20-2,35 (м, 1H), 2,35-2,48 (м, 1H), 2,72 (т, J=7,2 Гц, 2Н), 3,32 (кв, J=6,6 Гц, 2Н), 3,50-4,50 (оч. шир.с, 1H), 4,15-4,26 (м, 2Н), 5, 07 (дд, J=8,8, 4,1 Гц, 1H), 5,40 (ABq, JAB= 18,1 Гц, 2Н), 6,80-7,55 (оч.шир.с, 4Н), 6,87-7,13 (м, 6Н), 7,21 (д, J=8,6 Гц, 2Н), 7,66 (т, J=5,6 Гц, 1H), 7,78 (д, J=6,3 Гц, 2Н), 8,78 (д, J=6,4 Гц, 2Н); МН+ при m/z=446.
Анализ: Вычислено для C25H27N5O3 • 2HCl • 0,5H2O: С 56,93, H 5,73, N 13,28. Найдено: С 56,87, H 5,60, N 13,06.
Соединение 43
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -4-(1-нафтилметил)-3-оксо -2Н-1,4-бензоксазин
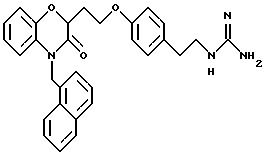
Получен способом L с использованием промежуточного продукта 10508-84-А1 (ссылочный пример 78) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HC1. Сырой продукт обрабатывали смесью СН2Cl2/эфир, получая указанное в заголовке соединение в виде кремового твердого продукта с выходом 72%; т.пл. 75-80oС; ИК (КВr) 3360, 1671, 1501, 1405, 1204, 1136, 799, 723 см-1;1H ЯМР (DMSO-d6) δ 2,29-2,37 (м, 1H), 2,37-2,50 (м, 1H), 2,72 (т, J=7,4 Гц, 2Н), 3,28-3,48 (м, 2Н), 3,31-3,39 (м, 2Н), 3,48 (оч.шир.с, 1H), 4,16-4,29 (м, 2Н), 5,08 (дд, J=8,8, 4,2 Гц, 1H), 5,62 (ABq, JAB= 17,4 Гц, 2Н), 6,86-7,66 (оч.шир.с, 4Н), 6,86-7,06 (м, 4Н), 7,11 (д, J= 8,1 Гц, 2Н), 7,20 (д, J=8,6 Гц, 2Н), 7,40 (т, J=7,7 Гц, 1H), 7,48-7, 55 (м, 1Н), 7,58-7,68 (м, 2Н), 7,85 (д, J=8,2 Гц, 1Н), 8,00 (д, J=9,1 Гц), 8,21 (д, J=8,1 Гц): MH+ при m/z=495.
Анализ: Вычислено для C30H30N4O3 • C2HF3O2: С 62,38, H 5,06, N 9,04. Найдено: С 62,38, H 5,06, N 9,04.
Соединение 44
2-{ 2-[4-[2-(N,
N-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -3,4-дигидро -4-(2-нафтилметил)-3-оксо-2Н -1,4-бензоксазин
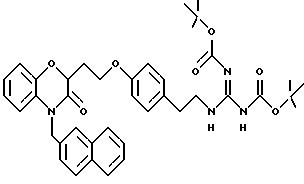
Получен способом L с использованием промежуточного продукта 10508-80-1 (ссылочный пример 79) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина. Сырой материал очищали флэш-хроматографией при элюировании смесью этилацетат/гексан, получая продукт в виде белой пены с выходом 24%; ИК (КВr) 3330, 3053, 2977, 2931, 1722, 1638, 1614, 1512, 1501, 1366, 1330, 1244, 1156, 1131, 748 см-1;1H ЯМР (СDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,31-2,44 (м, 1Н), 2,55-2,68 (м, 1Н), 2,82 (т, J=7,1 Гц, 2Н), 3,65 (кв, J= 6 Гц, 2Н), 4,20-4,33 (м, 2Н), 5,00 (дд, J=9,4, 3,4 Гц, 1Н), 5,32 (ABq, JAB= 15,4 Гц, 2Н), 6,84-6,96 (м, 5Н), 7,00 (т, J=6,8 Гц, 1Н), 7,14 (д, J=8,5 Гц, 2Н), 7,38 (д, J=8,4 Гц, 1Н), 7,45-7, 48 (м, 2Н), 7,68 (с, 1H), 7,75-7,83 (м, 3Н), 8,20 (шир.с, 1Н), 11,48 (с, 1Н).
Анализ: Вычислено для С40Н46N4O7: С 69,14, H 6,67, N 8,06. Найдено: С 69,16, H 6,88, N 7,63.
Соединение 45
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -4-(2-нафтилметил)-3-оксо -2Н-1,4-бензоксазин
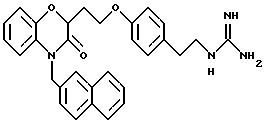
Получали из соединения 44 способом К и растиранием с эфиром. Указанное в заголовке соединение получено в виде белого твердого продукта с выходом 80%, т. пл. 173-178oС; ИК (КВr) 3154, 1680, 1501, 1400, 1241, 752 см-1;1H ЯМР (DMSO-d6) δ 2,22-2,35 (м, 1H), 2,38-2,48 (м, 1Н), 2,72 (т, J=7,3 Гц, 2Н), 3,28-3,38 (м, 2Н), 4,17-4,26 (м, 2Н), 5,05 (дд, J=8,7, 4,0 Гц, 1H), 5,34 (ABq, JAB= 16,2 Гц, 2Н), 6,80-7,80 (оч.шир.с, 4Н), 6,92-7,01 (м, 4Н), 7, 08 (т, J=7,3 Гц, 2Н), 7,20 (д, J=8,4 Гц, 2Н), 7,43 (д, J=8,4 Гц, 1H), 7,48-7,51 (м, 2Н), 7,59 (шир.т, J=5,1 Гц, 1H), 7,78 (с, 1H), 7,83-7,91 (м, 3Н); МН+ при m/z=495.
Анализ: Вычислено для С30Н30N4О3 • HCl • 0,7Н2O: С 66,28, H 6,01, N 10,31. Найдено: С 66,30, H 5,88, N 10,06.
Соединение 46
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -3-оксо-2Н-4-(3- тиенилметил)-1,4-бензоксазин
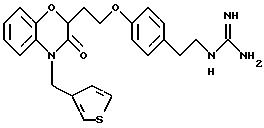
Получен способом L с использованием промежуточного продукта 11721-108-1 (ссылочный пример 85) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl. Сырой продукт очищали флэш-хроматографией с использованием градиента от 1% МеОН в СН2Cl2 до 6% МеОН/1% NH4OH в CH2Cl2 и выделяли с выходом 48% в виде рыжевато-коричневой пены, т.пл. 66-71oС; ИК (КВr) 3364, 1655, 1500, 1246, 1203, 1136, 751 см-1;1H ЯМР (DMSO-d6) δ 2,11-2,26 (м, 1Н), 2,3-2,43 (м, 1H), 2,73 (т, J=6,9 Гц, 2Н), 3,28-3,39 (м, 1H), 4,13-4,22 (м, 2Н), 4,93 (дд, J=8,8, 4,1 Гц, 1H), 5, 12 (ABq, JAB= 17,2 Гц, 2Н), 6,91 (д, J=8,6 Гц, 3Н), 6,99-7,04 (м, 5Н), 7,12-7,22 (м, 2Н), 7,19 (д, J= 8,6 Гц, 2Н), 7,40 (д, J=2,3 Гц, 1H), 7,52 (дд, J=4,6, 2,3 Гц, 1H), 7,62 (т, J=5,75 Гц, 1H); МН+ при m/z=451.
Анализ: Вычислено для С24Н26N4O3S • С2НF3O2: С 51,61, H 4,39, N 8,85. Найдено: С 51,34, H 4,60, N 8,85.
Соединение 47
2-{ 2-[4-[2-(N,N-Бис-трет- бутоксикарбонилгуанидино)этил]-фенокси] этил} -4-(2-хлор-4-тиенилметил) -3,4-дигидро-3-оксо -2Н-1,
4-бензоксазин
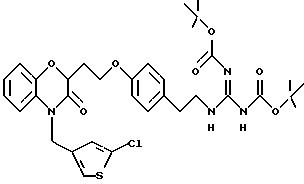
Получен из 10508-79 (ссылочный пример 80) способом L с использованием равных эквивалентов реагентов относительно исходного материала и выделен в виде белой пены с выходом 24%; ИК (КВr) 3330, 2978, 1722, 1686, 1638, 1615, 1500, 1413, 1331, 1247, 1130, 1058, 748 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,20-2,32 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,60-3,66 (м, 2Н), 4,12-4,28 (м, 2Н), 4,78 (дд, J=9,3, 4,0 Гц, 1Н), 5,16 (ABq, JAB=15,8 Гц, 2Н), 6,75 (д, J=3,8 Гц, 1Н), 6,82-6,85 (м, 3Н), 7,00-7,08 (м, 4Н), 7,12 (д, J=8,6 Гц, 2Н), 8,37 (т, J=3,5 Гц, 1Н), 11,47 (с, 1Н).
Анализ: Вычислено для C34H41ClN4O7S: С 59,60, H 6,03, N 8,18. Найдено: С 59,27, H 6,02, N 8,01.
Соединение 48
4-(2-Хлор-4-тиенилметил)- 3,
4-дигидро-2-{2-[4-(2- гуанидино-этил)фенокси] этил}-3-оксо-2Н-1,4-бензоксазин
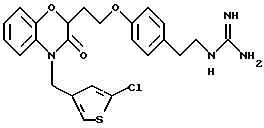
Получен из соединения 47 способом К с выходом сырого продукта 88%. Этот сырой материал выщелачивали при помощи этилацетата для удаления примесей, получая продукт в виде белой пены; ИК (КВr) 3148, 1667, 1500, 1450, 1399, 1243, 1058, 749 см-1;1H ЯМР (CDCl3) δ 2,04-2,23 (м, 3Н), 2,30-2,41 (м, 1Н), 2,72-2,83 (м, 2Н), 3,28-3,40 (м, 2Н), 3,97-4,15 (м, 2Н), 4,77 (дд, J=7, 7, 3,4 Гц, 1Н), 5,06 (ABq, JAB=14,5 Гц, 2Н), 6,69-7,20 (оч.шир.с, 4Н), 6,69-6,80 (м, 3Н), 6,92-7,06 (м, 5Н), 7,11 (д, J=8,1 Гц, 2Н), 7,64 (шир.с, 1Н).
Анализ: Вычислено для С24Н25ClN4OзS • НCl • Н2O: С 53,43, H 5,23, N 10,39. Найдено: С 53,08, H 5,27, N 10,32.
Соединение 49
2-{
2-[4-[2-(N,N-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -6-хлор-4-(3- хлорбензил)-3,4-дигидро-3-оксо -2Н-1,4-бензоксазин

Получен из 11578-71 (ссылочный пример 49) способом L с использованием равных эквивалентов реагентов относительно исходного материала и выделен в виде бесцветного масла с выходом 34% после хроматографии (элюирование CH2Cl2); ИК (чистый) 3332, 2978, 1721, 1694, 1638, 1615, 1498, 1415, 1367, 1132, 811, 777 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,25-2,37 (м, 1Н), 2,54-2,66 (м, 1Н), 2,82 (т, J=7,2 Гц, 2Н), 3,63 (кв, J=5,6 Гц, 2Н), 4,16-4,25 (м, 2Н), 4,94 (дд, J=9,3, 3,9 Гц, 1H), 5,09 (ABq, JAB=16,1 Гц, 2Н), 6,80 (с, 1Н), 6,85 (д, J=8,5 Гц, 2Н), 6,95 (с, 2Н), 7,13 (д, J=8,5 Гц, 3Н), 7,23-7,31 (м, 3Н), 8,37 (шир.т, J=2 Гц, 1H), 11,47 (с, 1H).
Анализ: Вычислено для С36Н42Сl2N4O7: С 60,59, H 5,93, N 7,85. Найдено: С 60,65, H 6,04, N 7,65.
Соединение 50
6-Хлор-4-(3-хлорбензил) -2-{2-[4-(2-гуанидиноэтил) фенокси]-этил}-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин

Получен из соединения 49 способом К, где продукт был выделен в виде белой пены из CH2Cl2 с выходом 28%; ИК (КВr) 3154, 1684, 1668, 1496, 1376, 1264, 1243, 1092 см-1;1H ЯМР (CDCl3) δ 2,13-2,27 (м, 1H), 2,35-2,50 (м, 1H), 2,74 (шир.с, 2Н), 3,31 (шир.с, 2Н), 4,00-4,14 (м, 2Н), 4,84 (дд, J=9,0, 4,2 Гц, 1H), 4,98 (ABq, JAB=17,5 Гц, 2Н), 6,73-7,29 (м, 15Н), 7,61 (шир.с, 1H); МН+ при m/z=513.
Анализ: Вычислено для С26Н26Сl2N4О3 • НСl • 0,7Н2O: С 55,61, H 5,26, N 9,75. Найдено: С 55,83, H 5,01, N 9,51.
Соединение 51
2-{ 2-[4-[2-(N,
N-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -4-(3-хлорбензил) -3,4-дигидро-3-оксо-6-фенил -2Н-1,4-бензоксазин

Получен из 11578-41 (ссылочный пример 44) способом L и выделен в виде масла с выходом 46%. Этот материал кристаллизовали из смеси эфир/гексан, получая белый кристаллический твердый продукт, т.пл. 115-116oС; ИК (КВr) 2976, 2931, 1724, 1689, 1642, 1614, 1430, 1336, 1135, 766 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,50 (с, 9Н), 2,30-2,43 (м, 1Н), 2,35-2,46 (м, 1Н), 2,81 (т, J= 7,3 Гц, 2Н), 3,63 (кв, J=7,1 Гц, 2Н), 4,17-4,32 (м, 2Н), 4,99 (дд, J= 9,3, 3,9 Гц, 1Н), 5,18 (ABq, JAB=25,7 Гц, 2Н), 6, 87 (д, J=8,5 Гц, 2Н), 7,04-7,40 (м, 14Н), 8,38 (т, J=4,3 Гц, 1Н), 11,47 (шир.с, 1Н).
Анализ: Вычислено для C42H47ClN4O7: С 66,79, H 6,27, N 7,42. Найдено: С 66,49, H 6,20, N 7,34.
Соединение 52
4-(3-Хлорбензил)-3,4-дигидро-2-{ 2-[4-(2-гуанидиноэтил) -фенокси]этил}-3-оксо- 6-фенил-2Н-1,4-бензоксазин

Получен из соединения 51 способом К и выделен в виде желтого порошка с выходом 20%; ИК (КВr) 3149, 1666, 1609, 1512, 1241, 1076, 1051, 761 см-1;1H ЯМР (CD3OD) δ 2,31-2,40 (м, 1H), 2,43-2,54 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,41 (т, J= 7,0 Гц, 2Н), 4,20-4,31 (м, 2Н), 4,85 (с, 5Н плюс СD3ОН), 4,99 (дд, J=11,1, 4,5 Гц, 1H), 5,28 (с, 2Н), 6,91 (д, J=8,6 Гц, 2Н), 7,08 (д, J= 8,3 Гц, 1H), 7,12-7,43 (м, 13Н).
Анализ: Вычислено для С32Н31ClN4O3 • НCl • 1,4Н2O: С 62,32, H 5,69, N 9,08. Найдено: С 61,95, H 5,51, N 9,27.
Соединение 53
2-{2-[4-[2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -4-(3 -хлорбензил)-3,4-дигидро -3-оксо-6-трифторметил -2Н-1,4-бензоксазин
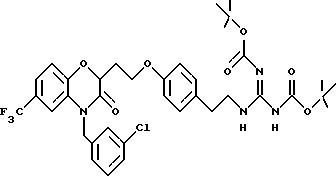
Получен из 11578-56 (ссылочный пример 50) способом L с использованием равных эквивалентов реагентов и выделен в виде бесцветного масла с выходом 18% после колоночной хроматографии на SiO2 (CH2Cl2); ИК (КВr) 3333, 2979, 1723, 1696, 1639, 1617, 1453, 1330, 1303, 1165, 1129, 824 см-1:1H ЯМР (СDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,26-2,40 (м, 1H), 2,55-2,67 (м, 1H), 2,82 (т, J= 7,1 Гц, 2Н), 3,63 (кв, J=5,4 Гц, 2Н), 4,06-4,27 (м, 2Н), 5,02 (дд, J= 9,2, 3,9 Гц, 1H), 5,14 (ABq, JAB=16,1 Гц, 2Н), 6,84 (д, J=8,5 Гц, 2Н), 7,05-7,17 (м, 3Н), 7,13 (д, J=8,5 Гц, 2Н), 7,23-7,30 (м, 4Н), 8,37 (шир.т, J=4,3 Гц, 1H), 11,48 (с, 1Н).
Анализ: Вычислено для C37H42ClF3N4O3: С 59,48, H 5,67, N 7,50. Найдено: С 59,60, H 5,67, N 7,39.
Соединение 54
4-(3-Хлорбензил)-3,4 -дигидро-2-{ 2-[4-(2- гуанидиноэтил)-фенокси]этил} -3- оксо-6-трифторметил-2Н -1,4-бензоксазин
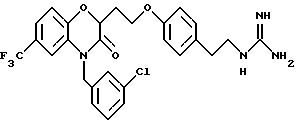
Получен из соединения 53 способом К и выделен в виде белой пены с выходом 27%; ИК (КВr) 3336, 3159, 1667, 1453, 1304, 827 см-1;1H ЯМР (СDCl3) δ 2,20-2,39 (м, 1Н), 2,48 (шир.с, 3Н), 2,77 (шир.с, 2Н), 3,35 (шир.с, 2Н), 4,08 (шир.с, 2Н), 4,93 (дд, J=8,6, 4,0 Гц, 1Н), 5,06 (ABq, JAB=16,8 Гц, 2Н), 6,75-7,30 (оч. шир. с, 4Н), 6,77 (д, J=7,7 Гц, 2Н), 7,01-7,26 (м, 7Н), 7,25 (д, J=7,1 Гц, 2Н), 7,64 (оч.шир.с, 1Н); МН+ при m/z=547.
Анализ: Вычислено для С27Н26 ClF3N4О3 • HCl • 0,7Н2O: С 54,41, H 4,80, N 9,40. Найдено: С 54,49, H 4,74, N 9,32.
Соединение 55
4-(3-Хлорбензил)-3,
4-дигидро -7-фтор-2-{2[4-(2- гуанидиноэтил)-фенокси] этил}-3-оксо-2Н- 1,4-бензоксазин
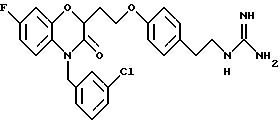
Получен из 11578-47 (ссылочный пример 52) и N,N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина способом L с использованием равных эквивалентов реагентов и способом К. Продукт был выделен в виде белой пены с общим выходом 17%; ИК (КВr) 2877, 1664, 1509, 1405, 1243, 1154, 852 см-1;1H ЯМР (CD3OD) 2,26-2,37 (м, 1Н), 2,42-2,53 (м, 1Н), 2,83 (т, J=6,8 Гц, 2Н), 3, 42 (т, J=6,8 Гц, 2Н), 4,17-4,29 (м, 2Н), 4,84 (с, 6,4Н плюс СD3ОН), δ 4,98 (дд, J= 8,4, 4,4 Гц, 1Н), 5,18 (с, 2Н), 6,73 (тд, J=8,8, 2,6 Гц, 1Н), 6,83 (дд, J= 9,2, 2,8 Гц, 1Н), 6,92 (д, J=8,0 Гц, 2Н), 6,97 (дд, J=8,8, 5,2 Гц, 1Н), 7,17 (д, J= 8 Гц, 2Н), 7,17-7,22 (м, 1Н), 7,25-7,35 (м, 3Н); MH+ при m/z=497.
Анализ: Вычислено для С26Н26ClFN4O3 • НCl • 0,7H2O: С 57,19, H 5,24, N 10,26. Найдено: С 56,81, H 5,36, N 10,26.
Соединение 56
2-{2-[4-[2-(N,
N'-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -4-(3- хлорбензил)-6,8-дихлор-3,4 -дигидро-3-оксо-2Н-1,4 -бензоксазин
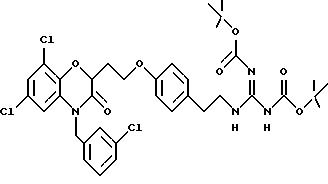
Получен из 11578-33 (ссылочный пример 56) и N,N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина способом L с использованием равных эквивалентов реагентов относительно исходного материала и выделен в виде белого твердого продукта с выходом 27% после колоночной хроматографии на SiO2 с элюированием СН2Cl2, т.пл. 115-117oС; ИК (КВr) 2977, 1699, 1639, 1615, 1593, 1367, 1131, 1058, 810, 776 см-1:1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,51 (с, 9Н), 2,25-2,37 (м, 1Н), 2, 52-2,67 (м, 1Н), 2,82 (т, J=7,2 Гц, 2Н), 3,63 (кв, J= 7,1 Гц, 2Н), 4,13-4,24 (м, 1Н), 4,27-4,35 (м, 1Н), 5,05 (дд, J=9,7, 3,5 Гц, 1Н), 5,10 (с, 2Н), 6,71 (д, J=2,2 Гц, 1Н), 6,86 (д, J=8,6 Гц, 2Н), 7, 05 (д, J=2,2 Гц, 1Н), 7,13 (д, J=8,6 Гц, 2Н), 7,13 (с, 1Н), 7,26-7,29 (м, 3Н), 8,37 (т, J=2,6 Гц, 1Н), 11,48 (с, 1Н).
Анализ: Вычислено для С36Н41Cl3 N4O7: С 57,80, H 5,52, N 7,49. Найдено: С 57,64, H 5,39, N 7,77.
Соединение 57
4-(3-Хлорбензил)-6,8-дихлор -2-{2-[4-(2-гуанидиноэтил) -фенокси]этил}-3,
4-дигидро -3-оксо-2Н-1,4-бензоксазин

Получен из соединения 56 способом К и выделен в виде белой пены с выходом 75%; ИК (КВr) 3150, 1666, 1591, 1479, 1242, 743 см-1;1H ЯМР (DMSO-d6) δ 2,23-2,37 (м, 1Н), 2,50-2,61 (м, 1Н), 2,84 (т, J=7,1 Гц, 2Н), 3,39 (кв, J= 5,9 Гц, 2Н), 4,15-4,23 (м, 1Н), 4,25-4,35 (м, 1Н), 5,04 (дд, J=9,8, 3,8 Гц, 1H), 5,11 (ABq, JAB=16,3 Гц, 2Н), 6,75 (д, J=2,2 Гц, 1Н), 6,87 (д, J=8,4 Гц, 2Н), 7,07-7,21 (м, 9Н), 7, 26-7,35 (м, 2Н), 7,67 (шир.т, J=5,1 Гц, 1Н); MH+ при m/z=547.
Анализ: Вычислено для С26Н25Cl3Н4O3 • НСl • 0,7Н2O: С 52,31, H 4,63, N 9,39. Найдено: С 52,37, H 4,59, N 9,37.
Соединение 58
4-(3-Хлорбензил)-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил}-3,
4-дигидро-7-метил -3-оксо-2Н-1,4-бензоксазин
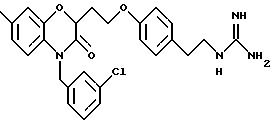
Получен способом L с использованием промежуточного продукта 11578-52 (ссылочный пример 55) и N, N'-ди-трет-бутокси-карбонил-2-(4-гидроксифенил)этилгуанидина и способом К в виде белой пены с общим выходом 2,5%; ИК (КВr) 3340, 3161, 1668, 1402, 1244, 1178, 1146, 1107, 1056 см-1;1H ЯМР (СDCl3) δ 2,15-2,28 (м, 1Н), 2,20 (с, 3Н), 2,34-2,47 (м, 3Н), 2,76 (т, J=6,4 Гц, 2Н), 3,30-3,40 (м, 2Н), 4,00-4, 18 (м, 2Н), 4,83 (дд, J=8,9, 4,3 Гц, 1Н), 5,01 (с, 2Н), 6,63-7,27 (оч.шир.с, 4Н), 6,63-6,70 (м, 2Н), 6,75-6,83 (м, 2Н), 7,03-7,23 (м, 7Н), 7,63 (шир.с, 1Н); МН+ при m/z=493.
Анализ: Вычислено для C27H29Cl3N4O3 • HCl • H2O: С 59,23, H 5,89, N 10,23. Найдено: С 58,84, H 5,60, N 10,07.
Соединение 59
2-{2-[4-[2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)этил]-фенокси] этил} -3,4-дигидро-4-метил-3- оксо-2Н-1,4-бензоксазин
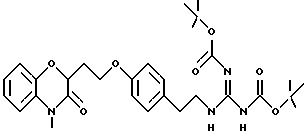
Получен из 10840-117-1 (ссылочный пример 88) способом L и выделен в виде белой пены с выходом 13%; ИК (KBr) 3334, 2978, 2933, 1722, 1686, 1639, 1614, 1513, 1504, 1417, 1131, 750 см-1:1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,50 (с, 9Н), 2,19-2,31 (м, 1Н), 2,45-2,56 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,38 (с, 3Н), 3,63 (кв, J=5,3 Гц, 2Н), 4,10-4,26 (м, 2Н), 4,83 (дд, J=8,8, 4,0 Гц, 1Н), 6,84 (д, J= 6,84 Гц, 2Н), 6,95-7,07 (м, 4Н), 7,12 (д, J=8,6 Гц, 2Н), 8,36 (шир.т, J=4,0 Гц, 1Н), 11,47 (с, 1Н).
Анализ: Вычислено для С30Н40N4О7 • 0,2H2O: С 62,96, H 7,12, N 9,79. Найдено: С 62,88, H 7,20, N 9,71.
Соединение 60
3, 4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил}-4-метил-3-оксо- 2Н-1,4-бензоксазин

Получен растворением соединения 59 в СН2Cl2 и обработкой трифторуксусной кислотой (ТФУ). Растворитель удаляли и остаток очищали хроматографией на SiO2 (26% МеОН в СН2Cl2) с последующей кристаллизацией из смеси МеОН/СН2Cl2/эфир, получая продукт с выходом 82% в виде кремового твердого вещества, т.пл. 80oС (сжимается), 82-85oС; ИК (КВr) 3339, 3176, 1682, 1515, 1505, 1383, 1249, 1137, 755 см-1;1H ЯМР (DMSO-d6) δ 2,08-2,16 (м, 1Н), 2,27-2,33 (м, 1Н), 2,71 (т, J=7,5 Гц, 2Н), 3,27-3,35 (м, 2Н), 3,30 (с, 3Н), 4,10-4,18 (м, 2Н), 4,81 (дд, J=8,8, 4,2 Гц, 1Н), 6,83-7,50 (оч.шир.с, 4Н), 6,90 (д, J= 8,6 Гц, 2Н), 7,00-7,12 (м, 4Н), 7,18 (д, J=8,7 Гц, 2Н), 7,56 (шир.т, J=5,7 Гц, 1Н); МН+ при m/z=369.
Соединение 61
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил}
-3-оксо-4-пентил- 2Н-1,4-бензоксазин

Получен из промежуточного продукта 10840-185 (ссылочный пример 60) способом К и выделен в виде бесцветного стеклообразного продукта с выходом 98%; ИК (КВr) 3154, 1661, 1513, 1500, 1244, 751 см-1;1H ЯМР (CDCl3) δ 0, 88 (т, J= 6,5 Гц, 3Н), 1,19 (д, изопропанол), 1,25-1,37 (м, 4Н), 1,52-1,68 (м, 2Н), 2,09-2,21 (м, 1Н), 2,30-2,40 (м, 1Н), 2,79 (шир.с, 2Н), 3,38 (шир.с, 2Н), 3,84 (т, J=6,7 Гц, 2Н), 4,00-4,15 (м, 2Н плюс изопропанол), 4,71 (дд, J= 8,7, 4,0 Гц, 1Н), 6,70-7,17 (оч. шир.с, 4Н), 6,78 (д, J=7,5 Гц, 2Н), 6,93-7,07 (м, 4Н), 7,13 (д, J=7,4, 2Н), 7,67 (шир.д, 1Н); МН+ при m/z=425.
Анализ: Вычислено для C24H32N4O3 • HCl • 0,1С3Н8О • 0,6Н2О: С 61,00, H 7,38, N 11,73. Найдено: С 61,04, H 7,27, N 11,67.
Соединение 62
4-(3-Хлорбензил)-3,4-дигидро -2-[2-[4-(2-гуанидиноэтил) фенокси] этил] -3-оксо-2Н-пиридо [4,3-b]-1, 4-оксазин
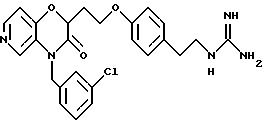
Получен способом L с использованием промежуточного продукта 11578-190 (ссылочный пример 84) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К в виде не совсем белой пены с выходом 35%; ИК (КВr) 3134, 1701, 1669, 1642, 1508, 1240, 1178, 1161, 1055, 824 см-1;1H ЯМР (DMSO-d6) δ 2,50 (м, 1Н плюс DMSO-d5), 2,71 (т, J=7,5 Гц, 2Н), 3,28-3,35 (м, 3Н), 4,17 (т, J=5,6 Гц, 2Н), 5,25 (ABq, JAB=16,5 Гц, 2Н), 5,52 (т, J=6,9, 1H), 6,70-7,60 (оч. шир.с, 5Н), 6,83 (д, J=8,4 Гц, 2Н), 7,18 (д, J=8,4 Гц, 2Н), 7,28-7,40 (м, 3Н), 7,48 (с, 1Н), 7,50 (с, 1 Н), 7,67 (т, J=5,4 Гц, 1H), 8,39 (с, 1H), 8,40 (с, 1H); МН+ при m/z=480.
Анализ: Вычислено для C25H26ClN5O3 • 2HCl • 1,5H2O: С 51,78, H 5,39, N 12,08. Найдено: С 51, 78, H 5,39, N 12,08.
Соединение 63
2-{ 2-[3-[2-(N,N-Бис-трет- бутоксикарбонилгуанидино)этил]-фенокси] этил} -4-(3,5-дихлорбензил)-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин
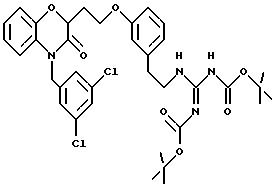
Получен из 10005-181-1 (ссылочный пример 48) способом L и выделен с выходом 84% в виде белого твердого продукта после флэш-хроматографии с элюированием 2,5 10% этилацетата в CH2Cl2 и кристаллизации из смеси СН2Сl2/эфир/гексан, т.пл. 116-118oС; ИК (КВr) 3359, 1688, 1505, 1256, 1171, 752 см-1;1H ЯМР (CDCl3) δ 1,44 (с, 9Н), 2,28-2,39 (м, 1Н), 2,52-2,62 (м, 1Н), 2,77 (т, J=9 Гц, 2Н), 3,33-3,41 (м, 2Н), 4,16-4,30 (м, 2Н), 4,54 (шир. с, 1Н), 4,94 (дд, J=10,5, 3 Гц, 1Н), 5,09 (ABq, JAB=18 Гц, 2Н), 6,75-6,83 (м, 4Н), 6,93-7,06 (м, 3Н), 7,13 (д, J=1,8 Гц, 2Н), 7,20-7,27 (м, 2Н).
Анализ: Вычислено для C30H32Cl2N2O5: С 63,05, H 5,64, N 4,90. Найдено: С 63,24, H 5,60, N 4,71.
Соединение 64
2-{ 2-[3-(2-Аминоэтил) фенокси] этил}-4-(3,5- дихлорбензил)-3,4-дигидро -3-оксо-2Н-бензоксазин

Получен способом J с использованием промежуточного продукта 10005-181-1 (ссылочный пример 48) и 4-[2-(N-трет- бутоксикарбониламино)этил]фенола, а также способом К. Продукт получен в виде белого твердого вещества с выходом 58%, т. пл. 173,5-176oС; ИК (КВr) 2942, 1684, 1592, 1501, 1399, 1265, 752 см-1;1H ЯМР (DMSO-d6) δ 2,19-2,32 (м, 1Н), 2, 35-2,47 (м, 1Н), 3,84-3,89 (м, 2Н), 3,01-3,06 (м, 2Н), 4,19-4,24 (м, 2Н), 5,03-5,08 (м, 1Н), 5,18 (ABq, JAB= 16,1 Гц, 2Н), 6,83-6,87 (м, 3Н), 6,99-7,09 (м, 4Н), 7,25 (т, J=7,6 Гц, 1Н), 7,35 (д, J=1,8 Гц, 2Н), 7,52 (т, J=1,8 Гц, 1Н), 8,06 (шир.с, 3Н).
Анализ: Вычислено для C25H24Cl2N2O3 • HCl • 0,25H2O: С 58,61, H 5,02, N 5,47. Найдено: С 58,47, H 4,88, N 5,33.
Соединение 65
2-{ 2-[4-[2-(N, N'-Бис-трет- бутоксикарбонилгуанидино) этил] -фенокси] этил}-3,
4-дигидро-4-(4- метилбензил)-2Н-1,4-бензоксазин
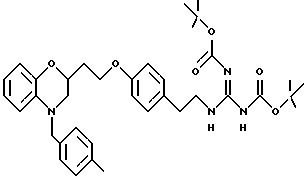
Промежуточный продукт 10840-45 (1 экв, ссылочный пример 92) растворяли в 7 мл смеси СН2Сl2/эфир (3/1) в атмосфере азота и обрабатывали триэтиламином (1,2 экв), затем метансульфонилхлоридом (1,2 экв). Смесь перемешивали в течение 0,5 ч и фильтровали. Фильтрат концентрировали в вакууме и остаток снова растворяли в эфире и промывали Н2О и сушили над MgSO4. После удаления эфира получали целевой метансульфонатный продукт. Этот сырой материал (1 экв) растворяли в ДМСО (1,7 мл) и обрабатывали соответствующим фенолом (1 экв) плюс гранулами NaOH (3 экв). Этот раствор перемешивали при 50oС в течение 24 ч в атмосфере азота и затем разбавляли водой. Раствор осадка в смеси СН2Cl2/этилацетат промывали водой и сушили над MgSO4. После удаления растворителя получали сырой материал, который очищали флэш-хроматографией, получая продукт с общим выходом 16% в виде белого порошка; ИК (КВr) 2979, 1723, 1650, 1625, 1513, 1246, 1156, 1133, 743 см-1;1H ЯМР (CDCl3) δ 1,47 (с, 9Н), 1,50 (с, 9Н), 2,03-2,17 (м, 2Н), 2,33 (с, 3Н), 2,81 (т, J=7,2 Гц, 2Н), 3,18 (дд, J=11,9, 7,2 Гц, 1Н), 3,34 (дд, J=11,9, 2,5 Гц, 1H), 3,63 (кв, J= 6,8 Гц, 2Н), 4,08-4,23 (м, 2Н), 4,38-4,45 (м, 3Н), 6,62 (дт, J=7,5, 1,5 Гц, 1H), 6,69 (дд, J=7,5, 1,5 Гц, 1H), 6,75-6,84 (м, 2Н), 6,82 (д, J=8,7 Гц, 2Н), 7,12 (д, J=8,7 Гц, 2Н), 7,16 (шир.кв, JAB=8,1 Гц, 4Н), 8,36 (шир.т, J= 4,8 Гц, 1H), 11,46 (с, 1H).
Анализ: Вычислено для C37H48N4O6: С 68,92, H 7, 50, N 8,69. Найдено: С 68,65, H 7,24, N 8,56.
Соединение 66
3,4-Дигидро-2-{ 2-[4-[2- гуанидиноэтил] фенокси] этил} -4-(4-метилбензил)-2Н -1,4-бензоксазин
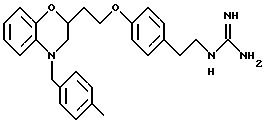
Получен из соединения 65 способом К с выходом 3% и выделен в виде зеленого порошка после растирания с СНCl3; ИК (КВr) 3157, 1663, 1611, 1513, 1300, 1241, 743 см-1;1H ЯМР (CD3OD) δ 2,04-2,14 (м, 2Н), 2,30 (с, 3Н), 2,81 (т, J=7,2 Гц, 2Н), 3,18 (дд, J=12,0, 8,0 Гц, 1Н), 3,36-3,49 (м, 3Н), 4,07-4,2 (м, 2Н), 4,37-4,46 (м, 1Н), 4,50 (с, 2Н), 6,70-6,95 (м, 7Н), 7,05-7,40 (м, 9Н).
Анализ: Вычислено для C27H32 N4O2 • HCl • 1,75Н2O: С 63,37, H 7,31, N 11,26. Найдено: С 63,40, H 7,14, N 11,21.
Соединение 67
2-{2-[4-[2-(N,
N'-Бис-трет- бутоксикарбонилгуанидино)этил]-фенокси] этил} -4-(2,4-дихлорбензил) -3,4-дигидро-2Н-1,4-бензоксазин
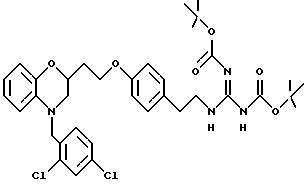
Получен из 10840-8 (ссылочный пример 94) способом L с выходом 20% и выделен в виде белой пены; ИК (КВr) 3336, 2979, 2932, 1723, 1640, 1617, 1366, 1133 см-1;1H ЯМР (CDCl3) δ 1,48 (с, 9Н), 1,50 (с, 9Н), 2,08-2,20 (м, 2Н), 2,81 (т, J= 7,2 Гц, 2Н), 3,31 (дд, J=11,7, 7,5 Гц, 1Н), 3,41 (дд, J= 11,6, 2,6 Гц, 1Н), 3,64 (кв, J=6,5 Гц, 2Н), 4,10-4,27 (м, 2Н), 4,44-4,53 (м, 1Н), 4,46 (с, 2Н), 6,45 (дд, J=8,0, 1,3 Гц, 1Н), 6,65 (тд, J=7,6, 1,4 Гц, 1Н), 6,76 (тд, J= 7,8, 1,6 Гц, 1Н), 6,80-6,87 (м, 3Н), 7,10-7,24 (м, 4Н), 7,42 (д, J=1,9 Гц, 1Н), 8,35 (т, J=4,1 Гц, 1Н), 11,46 (с, 1Н).
Анализ: Вычислено для С36Н44Cl2N4O6 • 0,5Н2О: С 61, 01, H 6,40, N 7,91. Найдено: С 61,14, H 6,37, N 7,83.
Соединение 68
(2,4-Дихлорбензил)-3,4 -дигидро-2-{ 2-[4-(2- гуанидиноэтил)-фенокси] этил}-2Н-1,4-бензоксазин

Получен из соединения 67 способом К с выходом 4,5% и выделен в виде зеленого стеклообразного продукта; ИК (чистый) 3334, 3166, 1665, 1611, 1513, 1246, 1219, 1046, 830 см-1;1H ЯМР (СDCl3) δ 1,74 (шир.с, 2Н), 1,94-2,15 (м, 2Н), 2,80 (шир. т, J= 5,6 Гц, 2Н), 3,20-3,38 (м, 4Н), 4,02-4,18 (м, 2Н), 4,32-4,47 (м, 1Н), 4,42 (с, 2Н), 6,35-7,40 (оч.шир.с, 4Н), 6,41 (дд, J=8,0, 1,1 Гц, 1Н), 6,61 (тд, J=7,6, 1,2 Гц, 1Н), 6,73 (тд, J=7,9, 1,5 Гц, 1Н), 6,80 (д, J= 7,9 Гц, 2Н), 7,10-7,20 (м, 5Н), 7,39 (д, J=1,8 Гц, 1Н), 7,80 (шир.с, 1Н); МН+ при m/z=499.
Анализ: Вычислено для С26Н28Cl2N4O2 • НCl • Н2O: С 56,38, H 5,64, N 10,11. Найдено: С 56,68, H 5,41, N 9,97.
Соединение 69
2-{ 2-[3-(2-(трет- Бутоксикарбониламино)этил)фенокси]
этил}-4-(3-хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин
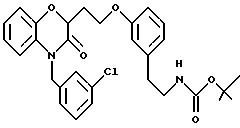
Получен из промежуточного продукта 10488-22 (ссылочный пример 66) и 3-[2-(N-трет-бутоксикарбониламино) этил]фенола способом J. Продукт выделяли с выходом 82% после хроматографии в виде масла, которое кристаллизовалось при стоянии, т. пл. 107-108oС; MS (CI) МН+ пик не найден; ИК (КВr) 3319, 2986, 1597, 1532, 1505, 1468, 1445, 1402, 1368, 1323, 1271, 1171, 1061, 787, 752 см-1;1 H ЯМР (СDCl3) δ 7,23 (м, 5Н), 7,13 (м, 1Н), 7,00 (м, 2Н), 6,94 (м, 1Н), 6,78 (м, 3Н), 5,18 (д, 1Н, J=16,0 Гц), 5,08 (д, 1Н, J=16,0 Гц), 4,94 (дд, 1Н, J=3,9, 9,2 Гц), 4,55 (шир.с, 1H), 4,24 (м, 2Н), 3,38 (м, 2Н), 2,76 (т, 2Н, J=6,9 Гц), 2,58 (м, 1H), 2,34 (м, 1H), 1,43 (с, 9Н).
Анализ: Вычислено для С30Н33СlN2О5 • 0,4Н2О: С 66,21, H 6,26, N 5,15. Найдено: С 66,28, H 6,13, N 5,02.
Соединение 70
2-{ 2-[3-(2-Аминоэтил) фенокси]этил}-4-(3- хлорбензил)-3,4-дигидро-3
-оксо-2Н-бензоксазин
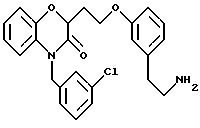
Получен из соединения 69 способом К с количественным выходом, т.пл. 163oС (темнеет), 169-171oС (плавится); MS (CI) MH+ 437; ИК (KBr) 2948, 1678, 1599, 1503, 1468, 1447, 1402, 1321, 1265, 1171, 1115, 1051, 939, 866 см-1;1H ЯМР (DMSO-d6) δ 8,80-8,00 (оч.шир.с, 2Н), 7,22 (м, 4Н), 7,10 (м, 1Н), 6,95 (м, 3Н), 6,80 (м, 4Н), 5,13 (д, 1Н, J=16,3 Гц), 5,05 (д, 1Н, J=16,3 Гц), 4,89 (дд, 1Н, J= 3,8, 8,8 Гц), 4,19 (м, 2Н), 3,28 (шир.с, 2Н), 3,08 (шир.с, 2Н), 2,49 (м, 1Н), 2,27 (м, 1Н), 2,52-1,50 (оч.шир.с, 1Н).
Анализ: Вычислено для C25H25ClN2O3 • HCl: С 63,43, H 5,54, N 5,92. Найдено: С 63,16, H 5,40, N 5,73.
Соединение 71
2-{ 2-[4-[2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)этил]-фенокси]этил}
-4-(3-хлорбензил)-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин
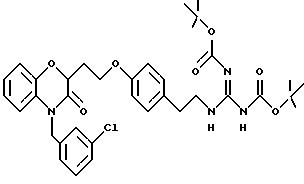
Получен из 10488-22 (ссылочный пример 66) и N,N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина способом J с выходом 31%; т.пл. 74-78oС; MS (FAB) MH+ 679; ИК (KBr) 3332, 2979, 1723, 1688, 1501, 1414, 1368, 1329, 1246, 1132, 1059, 750 см-1;1H ЯМР (СDCl3) δ 11,47 (шир.с, 1Н), 8,36 (шир. т, 1Н), 7,25 (с, 2Н), 7,14 (д, 2Н, J=3,7 Гц), 7,06 (м, 2Н), 6,92 (м, 4Н), 6,84 (м, 2Н), 5,19 (д, 1H, J=16,0 Гц), 5,08 (д, 1Н, J=16,0 Гц), 4,94 (дд, 1Н, J=3,9, 9,3 Гц), 4,22 (м, 2Н), 3,63 (м, 2Н), 2,81 (т, 2Н, J=7,2 Гц), 2,58 (м, 1Н), 2,34 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для С36Н43ClN4O7 • 0,4H2O: С 62,99, H 6,43, N 8,16. Найдено: С 62,96, H 6,37, N 8,09.
Соединение 72
4-(3-Хлорбензил)-3,4-дигидро -2-{ 2-[4-(2-гуанидиноэтил)-фенокси] этил} -2Н-1,4-бензоксазин
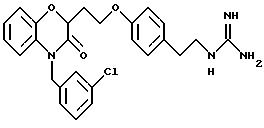
Получен из соединения 71 способом К с выходом 34%, т.пл. 90-101oС; ИК (КВr) 3355, 1501, 1468, 1402, 1244, 750 см-1;1H ЯМР (DMSO-d6) δ 7,68 (шир. т, 1Н), 7,50-6,80 (оч.шир.с, 1Н), 7,35 (д, 1H, J=7,3 Гц), 7,20 (м, 4Н), 7,03 (м, 4Н), 6,92 (д, 2Н, J=8,4 Гц), 5,22 (д, 1H, J=16,5 Гц), 5,13 (д, 1H, J= 16,5 Гц), 5,00 (дд, 1H, J=4,2, 8,7 Гц), 4,21 (м, 2Н), 2,72 (шир.т, 2Н), 2,51 (м, 2Н), 2,38 (шир.с, 1H), 2,24 (шир.с, 1H).
Анализ: Вычислено для С26Н27СlN4О3 • 2,5НCl: С 54,77, H 5,22, N 9,83. Найдено: С 54,99, H 5,34, N 9,79.
Соединение 73
2-{2-[3-(трет-Бутоксикарбониламинометил) фенокси]этил}-4-(3-хлорбензил)- 3,
4-дигидро-3-оксо-2Н-1,4-бензоксазин
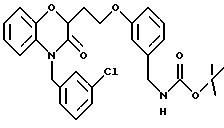
Получен из 10488-22 (ссылочный пример 66) способом J с выходом 48%, т. пл. 98-100oС; MS (CI) М+ 522 присутствует один Cl; ИК (КВr) 3351, 2927, 1599, 1530, 1505, 1447, 1402, 1279, 1175, 1111, 1055, 939, 864 см-1;1H ЯМР (CDCl3) δ 7,24 (м, 5Н), 7,13 (м, 1Н), 7,00 (м, 2Н), 6,92 (м, 1Н), 6,83 (м, 3Н), 5,18 (д, 1Н, J=16,0 Гц), 5,07 (д, 1H, J=16,0 Гц), 4,93 (дд, 1Н, J=3,9, 9,2 Гц), 4,83 (шир. с, 1H), 4,37-4,14 (шир.м, 4Н), 2,58 (м, 1H), 2,34 (м, 1H), 1,46 (с, 9Н).
Анализ: Вычислено для С29Н31ClN2O5 • 0,3Н2 O: С 65,92, H 6,03, N 5,30. Найдено: С 65,95, H 5,99, N 5,22.
Соединение 74
2-{ 2-[3-(Аминометил)фенокси]этил}-4-(3-хлорбензил)-3,4 дигидро-3-оксо-2Н-бензоксазин

Получен из соединения 73 способом К с количественным выходом, т.пл. 124-129oС; MS (CI) MH+ 423; ИК (КВr) 2886, 1599, 1501, 1402, 1265, 1171, 1080, 1051, 885, 470 см-1;1H ЯМР (DMSO-d6) δ 7,27 (м, 5Н), 7,13 (м, 1H), 7,00 (м, 2Н), 6,95 (м, 2Н), 6,90 (м, 2Н), 6,83 (м, 2Н), 5,17 (д, 1H, J=16,2 Гц), 5,08 (д, 1H, J=16,2 Гц), 4,94 (дд, 1H, J=4,0, 9,2 Гц), 4,26 (м, 2Н), 3,82 (с, 2Н), 2,59 (м, 1H), 2,34 (м, 1H).
Анализ: Вычислено для С24Н23ClN2O3 • НCl • 0,4Н2О: С 61,78, H 5,36, N 6,00. Найдено: С 61,78, H 5,36, N 5,83.
Соединение 75
2-{ 2-[4-(3-(трет- Бутоксикарбониламино)пропил] фенокси] этил} -4-(3- хлорбензил)-3,4-дигидро-3-оксо -2Н-1,4-бензоксазин

Получен из 10488-22 (ссылочный пример 66) и 4-[3-(N-трет-бутоксикарбониламино)пропил] фенола способом L с выходом 58%, т.пл.75-81oС; MS (FAB) MH+ 551; 3365, 2979, 2934, 1611, 1512, 1503, 1468, 1398, 1366, 1302, 1279, 1242, 1022, 997, 922 см-1:1Н ЯМР (CDCl3) δ 7,24 (д, 4Н, J=6,4 Гц), 7,12 (м, 2Н), 7,08 (д, 1H, J=8,6 Гц), 7,00 (м, 2Н), 6,92 (м, 1 Н), 6,84 (м, 2Н), 5,17 (д, 1H, J=16,0 Гц), 5,08 (д, 1H, J=16,0 Гц), 4,94 (дд, 1H, J=3,9, 9,2 Гц), 4,21 (м, 2Н), 3,14 (м, 2Н), 2,59 (м, 2Н), 2,32 (м, 1H), 1,78 (м, 2Н), 1,44 (с, 9Н).
Анализ: Вычислено для С30Н33ClN2O5: С 67,09, H 6,19, N 5,22. Найдено: С 67,46, H 6,54, N 4,93.
Соединение 76
2-{ 2-[4-(3-Аминопропил) фенокси]этил}-4-(3- хлорбензил)-3, 4-дигидро-3-оксо-2Н-бензоксазин
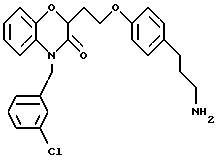
Получен из соединения 75 способом К, т.пл. 109-111oС; MS (CI) MH+ 451; ИК (KBr) 2936, 1674, 1609, 1514, 1466, 1400, 1302, 1111, 1049, 800, 681 см-1;1H ЯМР (DMSO-d6) δ 7,95 (шир.с, 2Н), 7,36 (м, 4Н), 7,21 (д, 1Н, J=6,8 Гц), 7,13 (д, 2Н, J=8,5 Гц), 7,02 (м, 4Н), 6,90 (д, 2Н, J=8,5 Гц), 5,19 (д, 1Н, J=16,2 Гц), 5,13 (д, 1Н, J=16,2 Гц), 5,00 (дд, 1Н, J=4,2, 8,7 Гц), 4,19 (м, 2Н), 2,75 (шир.с, 2Н), 2,58 (шир.т, 2Н, J=7,4 Гц), 2,39 (м, 1Н), 2,23 (м, 1Н), 1,82 (м, 2Н).
Анализ: Вычислено для С26Н27ClN2O3 • НCl • Н2O: С 61,78, H 5,98, N 5,54. Найдено: С 61,91, H 6,07, N 5,62.
Соединение
77
2-{ 2-[4-[(N,N'-Бис-трет- бутоксикарбонил)гуанидинометил] -фенокси]этил} -4-(3- хлорбензил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин
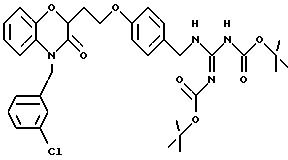
Получен способом L с использованием промежуточного продукта 10488-22 (ссылочный пример 66) и N, N-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)метилгуанидина с выходом 52%, т.пл. 74oС (сжимается), 89-95oС (плавится); MS (FAB) MH+ 665; ИК (КВr) 3334, 2979, 1723, 1690, 1501, 1396, 1368, 1325, 1248, 1057, 810 см-1;1H ЯМР (CDCl3) δ 11,52 (с, 1Н), 8,49 (шир. т, 1Н), 7,24 (м, 4Н), 7,13 (м, 1Н), 6,99 (м, 3Н), 6,92 (м, 2Н), 6,89 (д, 1Н, J= 8,5 Гц), 6,82 (д, 1Н, J=7,5 Гц), 5,18 (д, 1Н, J=16,0 Гц), 5,08 (д, 1Н, J= 16,0 Гц), 4,93 (дд, 1Н, J=3,9, 9,3 Гц), 4,54 (д, 2Н, J=4,9 Гц), 4,25 (м, 2Н), 2,59 (м, 1Н), 2,34 (м, 1Н), 1,52 (с, 9Н), 1,47 (с, 9Н).
Анализ: Вычислено для C35H41ClN4O7 • H2O: С 61,53, H 6,34, N 8,20. Найдено: С 61,50, H 6,26, N 8,03.
Соединение 78
4-(3-Хлорбензил)-3,4 -дигидро-2-{ 2-[4-(гуанидинилметил) -фенокси]этил} -2Н-1,4-бензоксазин

Получен из соединения 77 способом К с выходом 37%, т.пл.
(разлагается при >61oС); MS (CI) MH+ 465; ИК (KBr) 3338, 1501, 1398, 1246, 1051, 750 см-1;1H ЯМР (DMSO-d6) δ 8,03 (шир.т, 1Н, J=5,9 Гц), 7,35 (м, 5Н), 7,23 (м, 5Н), 7,02 (м, 6Н), 5,23 (д, 1Н, J=16,5 Гц), 5,12 (д, 1Н, J= 16,5 Гц), 5,00 (дд, 1Н, J=4,2, 8,7 Гц), 4,29 (д, 2Н, J=5,9 Гц), 4,22 (м, 2Н), 2,40 (м, 1Н), 2,25 (м, 1Н).
Анализ: Вычислено для С25Н25СlN4O3 • HCl • Н2O • 0,1C6H14 : С 58,23, H 5,61, N 10,61. Найдено: С 58,51, H 5,40, N 10,81.
Соединение 79
2-{
2-[4-(2-Аминоэтил)фенокси] этил} -4-(3-хлорбензил)-3,4 -дигидро-3-оксо-2Н-бензоксазин

Получен из 10488-22 (ссылочный пример 66) и 4-[2-(N-трет-бутоксикарбониламино)этил]фенола способом J и затем способом К с количественным выходом, т. пл. 140,5-143oС; MS (CI) MH+ 437; ИК (KBr) 2930, 1885, 1591, 1503, 1466, 1437, 1398, 1323, 1182, 1138, 991, 879 см-1;1 ЯМР (DMSO-d6) δ 8,00 (шир.с, 3Н), 7,35 (м, 3Н), 7,20 (м, 3Н), 7,03 (м, 4Н), 6, 92 (д, 2Н, J=8,6 Гц), 5,23 (д, 1Н, J=16,5 Гц), 5,13 (д, 1Н, J=16,4 Гц), 5,00 (дд, 1Н, J=4,2, 8,7 Гц), 4,19 (м, 2Н), 2,98 (м, 2Н), 2,82 (м, 2Н), 2,39 (м, 1Н), 2,22 (м, 1Н).
Анализ: Вычислено для C25H25ClN2O3 • HCl: С 63,43, H 5,54, N 5,92. Найдено: С 63,26, H 5,46, N 5,86.
Соединение 80
2-{2-[4-(2- (N,
N'-Бис-трет-бутоксикарбонилгуанидино) этил] фенокси]этил} -4-(3-хлорбензил)-3,4-дигидро -7-нитро-3-оксо-2Н-1,4-бензоксазин
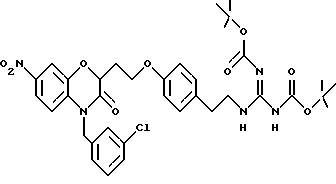
Получен из промежуточного продукта 11653-35В (ссылочный пример 87) и N, N'-ди-трет-бутоксикарбонил-2- (4-гидроксифенил)-этилгуанидина способом J с выходом 57%, т.пл. (разлож.) >69oС; MS (FAB) MH+ 724; ИК (KBr) 3329, 3119, 3090, 2977, 2933, 2420, 2287, 1575, 1475, 1080, 1057, 927, 855, 701, 576, 490 см-1;1H ЯМР (CDCl3) δ 11,50 (шир.с, 1H), 8,37 (шир.с, 1Н), 7,88 (д, 1Н, J= 2,4 Гц), 7,82 (дд, 1H, J=2,6, 8,8 Гц), 7,28 (д, 2Н, J=5,1 Гц), 7,22 (с, 1H), 7,12 (м, 3Н), 6,90 (д, 1H, J=8,8 Гц), 6,84 (д, 2Н, J=8,5 Гц), 5,23 (д, 1H, J=16,4 Гц), 5,13 (д, 1H, J=16,3 Гц), 5,06 (дд, 1H, J=3,4, 9,1 Гц), 4,23 (м, 2Н), 3,63 (кв, 2Н, J=5,4 Гц), 2,82 (т, 2Н, J=7,2 Гц), 2,65 (м, 1H), 2,37 (м, 1H), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C36H42ClN5O9 • 0,5H2O: С 58,97, H 5,91, N 9,55. Найдено: С 58,97, H 6,00, N 9,25.
Соединение 81
2-{ 2-[4-[2-(трет- Бутоксикарбониламино)этил] фенокси] этил}-4-(3-хлорбензил)-3,4- дигидро-7-нитро-3-оксо-2Н -1,4-бензоксазин

Получен из промежуточного продукта 11653-35В (ссылочный пример 87) и N, N'-ди-трет-бутоксикарбонил-2- (4-гидроксифенил)-этилгуанидина способом J с выходом 20%, т. пл. 82-85oС; MS (CI) МН+ 582; ИК (KBr) 3366, 3085, 2975, 2935, 1882, 1695, 1600, 1526, 1512, 1477, 1442, 1389, 1365, 1301, 1114, 999, 853, 665 см-1;1H ЯМР (CDCl3) δ 7,88 (д, 1H, J=2,42 Гц), 7,84 (дд, 1Н, J= 8,82, 2,55 Гц), 7,28 (м, 4Н), 7,22 (с, 1H), 7,12 (д, 2Н, J=8,57 Гц), 6,90 (д, 1H, J=8,84 Гц), 6,85 (д, 1H, J=8,60 Гц), 5,23 (д, 1H, J=16,2 Гц), 5,13 (д, 1H, J=16,3 Гц), 5,06 (дд, 1H, J=9,03, 3,94 Гц), 4,53 (шир.с, 1H), 4,24 (м, 2Н), 3,33 (м, 2Н), 2,74 (т, 2Н, J=6,86 Гц), 2,62 (м, 1H), 2,37 (м, 1H), 1,44 (с, 9Н).
Анализ: Вычислено для С30Н34ClN3O7: С 61,91, H 5,54, N 7,22. Найдено: С 61,58, H 5,80, N 7,36.
Соединение 82
Моногидрохлорид 2-{ 2-[4-(2-аминоэтил) фенокси]этил}-4-(3-хлорбензил)- 3,4-дигидро-7-нитро-3- оксо-2Н-бензоксазина

Получен из соединения 81 способом К с выходом 46%, т.пл. 79oС (сжимается), 92-96oС (плавится); MS (CI) MH+ 482; ИК (КВr) 3392, 2933, 2021, 1474, 1441, 1146, 1118, 928, 852, 701, 528 см-1;1Н ЯМР (DMSO-d6) δ 7,95 (шир. с, 2Н), 7,92 (д, 1Н, J=2,5 Гц), 7,87 (м, 1H), 7,42 (с, 1Н), 7,36 (м, 2Н), 7,24 (д, 2Н, J=8,8 Гц), 7,16 (д, 2Н, J=8,5 Гц), 6,92 (д, 2Н, J=8,5 Гц), 5,30 (д, 1H, J=16,8 Гц), 5,18 (м, 2Н), 4,22 (м, 2Н), 2,98 (т, 2Н, J=8,6 Гц), 2,80 (т, 2Н, J=8,6 Гц), 2,38 (м, 1H), 2,26 (м, 1H).
Анализ: Вычислено для C25H24ClN3O5 • HCl • H2O: С 55,98, H 5,07, N 7,83. Найдено: С 55,92, H 4,80, N 7,82.
Соединение 83
2-{ 2-[4-(N,N'-Бис-трет- бутоксикарбонилгуанидинометил) -фенокси]этил}-4-(3-хлорбензил)-3,
4- дигидро-7-нитро-3-оксо- 2Н-1,4-бензоксазин

Получен из промежуточного продукта 11653-35В (ссылочный пример 87) и N, N'-ди-трет-бутоксикарбонил -(4-гидроксифенил)метилгуанидина способом J с выходом 65%, т.пл. 67,5oС (сжимается), 84-88oС (плавится); MS (FAB) MH+ 710; ИК (КВr) 3730, 3326, 3122, 3089, 2978, 2932, 2413, 1720, 1640, 1615, 1503, 1476, 1081, 931, 558 см-1;1H ЯМР (CDCl3) δ 11,55 (шир.с, 1H), 8,59 (шир.с, 1H), 7,90 (д, 1H, J=2,5 Гц), 7,84 (дд, J=2,5, 8,8 Гц), 7,25 (м, 4Н), 7,10 (м, 1H), 6,86 (м, 4Н), 5,22 (д, 1H, J=16,3 Гц), 5,30 (д, 1Н, J=16,3 Гц), 5,10 (дд, 1Н, J=3,4, 9,1 Гц), 4,60 (м, 2Н), 4, 23 (м, 2Н), 2,66 (м, 1Н), 2,38 (м, 1Н), 1,51 (с, 9Н), 1,47 (с, 9Н).
Анализ: Вычислено для C35H40ClN5O9: С 59,19, H 5,68, N 9,86. Найдено: С 59,10, H 6,07, N 9,74.
Соединение 84
Моногидрохлорид 3,4-дигидро -4-(3-хлорбензил)-2-{2-[4-(2-гуанидиноэтил] фенокси]этил}-7-нитро-3-оксо-2Н- 1,4-бензоксазина
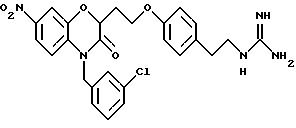
Получен из соединения 83 способом К с количественным выходом, т.пл. (разлагается) >101oC; MS (FAB) МН+ 524; ИК (KBr) 3326, 3156, 2968, 2878, 1695, 1665, 1599, 1513, 1473, 1441, 1389, 1178, 1148, 1022, 852, 472 см-1;1H ЯМР (DMSO-d6) δ 7, 93 (д, 0,5H, J=2,6 Гц), 7,89 (м, 1,5Н), 7,62 (шир.т, 1Н), 7,43 (с, 1Н), 7,40-6,65 (оч.шир.с, 3Н), 7,35 (м, 2Н), 7,27 (д, 2Н, J= 8,6 Гц), 7,21 (д, 2Н, J=8,6 Гц), 6,92 (д, 2Н, J=8,6 Гц), 5,33 (д, 1Н, J=16,7 Гц), 5,20 (д, м, 2Н, J=16,5 Гц), 4,22 (м, 2Н), 3,32 (м, 2Н), 2,73 (т, 2Н, J= 7,3 Гц), 2,41 (м, 1Н), 2,32 (м, 1Н).
Анализ: Вычислено для С26Н26ClN5O5 • HCl • Н2O: С 53,99, H 5,05, N 12,11. Найдено: С 54,11, H 4,95, N 12,01.
Соединение 85
2-{ 2-[4-(2-(N,
N-Бис-трет- бутоксикарбонил)гуанидиноэтил) -фенокси]этил} -4-(2-хлорбензил) -3,4-дигидро-7-нитро-3-оксо -2Н-1,4-бензоксазин
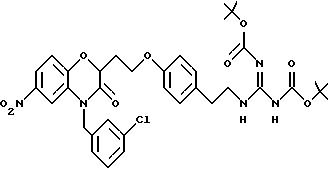
Получен из промежуточного продукта 11653-58С (ссылочный пример 68) и N, N'-ди-трет-бутоксикарбонил-2- (4-гидроксифенил) -этилгуанидина с выходом 85%, т.пл. 69oС (сжимается), 90-92oС (плавится); MS (FAB) МН+ 724; ИК (KBr) 3329, 3128, 2978, 2934, 1722, 1697, 1638, 1524, 1474, 1414, 1364, 1021, 933 см-1;1H ЯМР (СDCl3) δ 11,47 (шир.с, 1H), 8,37 (шир.с, 1Н), 7,91 (дд, 1Н, J= 2,4, 8,8 Гц), 7,77 (д, 1H, J=2,5 Гц), 7,27 (м, 2Н), 7,19 (шир.с, 1H), 7,10 (м, 4Н), 6,83 (д, 2Н, J=8,6 Гц), 5,23 (д, 1H, J=17,9 Гц), 5,14 (д, 1H, J= 17,9 Гц), 5,09 (дд, 1H, J=4,1, 9,1 Гц), 4,20 (м, 2Н), 3,63 (м, 2Н), 2,82 (т, 2Н, J=7,1 Гц), 2,62 (м, 1H), 2,37 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для С36Н42СlN5О9: С 59,71, H 5,85, N 9,67. Найдено: С 59,38, H 6,04, N 9,63.
Соединение 86
2-{2-[4-[2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -4-(2- хлорбензил)-3,4-дигидро-7-нитро -3-оксо-2Н-1,4-бензоксазин
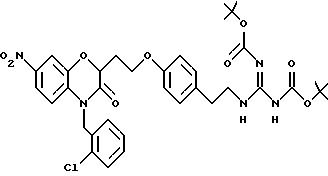
Получен из промежуточного продукта 11653-24А (ссылочный пример 86) и N, N'-ди-трет-бутоксикарбонил-2-(4-(гидроксифенил)этилгуанидина способом L с выходом 52% в виде желтой пены, т.пл. (разложение) >85oС; MS (FAB) MH+ 724; ИК (КВr) 3335, 2979, 1637, 1527, 1390, 1341, 1156, 1059 см-1;1H ЯМР (CDCl3) δ 11,48 (шир.с, 1H), 7,90 (д, 1Н, J=2,50), 7,83 (дд, 1Н, J=2,52, 8,85), 7,45 (д, 1H, J=7,90), 7,26 (м, 1H), 7,19 (м, 2Н), 7,14 (д, 1H, J=8,52), 6,94 (д, 1H, J= 7,68), 6,85 (д, 2Н, J=8,50), 6,80 (д, 1H, J=8,90), 5,30 (д, 2Н, J= 5,54), 5,08 (дд, 1H, J=5,02), 4,23 (м, 2Н), 3,65 (м, 2Н), 2,82 (т, 2Н, J= 7,2), 2,65 (м, 1H), 2,39 (м, 1H), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C36H42ClN5O9: С 59,71, H 5,85, N 9,67. Найдено: С 59,48, H 5,89, N 9,52.
Соединение 87
Моногидрохлорид 4-(2-хлорбензил)-3,4- дигидро-2-{2-[4-(2-гуанидиноэтил) фенокси]этил}-7-нитро-3- оксо-2Н-1,4-бензоксазина
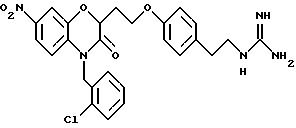
Получен из соединения 86 способом К с выходом 79%, т.пл. 120-125oС; MS (CI) MH+ 524; ИК (КВr) 3368, 3322, 3168, 2932, 2878, 1694, 1502, 1334, 1234, 1028, 806 см-1;1H ЯМР (DMSO-d6) δ 7,92 (м, 1,5Н), 7,90 (д, 0,5Н, J=7,9 Гц), 7,55 (м, 2Н), 7,40-6,50 (оч.шир.с, 3Н), 7,34 (т, 1H, J=7,5 Гц), 7,26 (т, 1H, J= 7,5 Гц), 7,20 (д, 2Н, J=8,6 Гц), 7,08 (м, 2Н), 6,92 (д, 2Н, J=8,6 Гц), 5,28 (д, 1H, J= 17,4 Гц), 5,22 (м, 1Н), 5,16 (д, 1Н, J=17,4 Гц), 4,22 (м, 2Н), 3,34 (м, 2Н), 2,71 (т, 2Н, J=7,6 Гц), 2,41 (м, 1H), 2,35 (м, 1H).
Анализ: Вычислено для С26Н26СlN5O5 • HCl • Н2O: С 53,99, H 5,05, N 12,11. Найдено: С 53,75, H 5,23, N 12,09.
Соединение 88
2-{2-[4-(2-(N,N'-Бис- трет-бутоксикарбонилгуанидино)-этил) фенокси]этил} -4-(2-хлорбензил) -3,4-дигидро-6-нитро-3 -оксо-2Н-1,4-бензоксазин
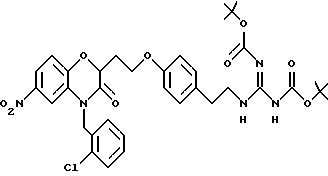
Получен из промежуточного продукта 11653-44А (ссылочный пример 70) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)-этилгуанидина способом L с выходом 50%, т.пл. 155oС (сжимается), 160-163oС (плавится). ИК (КВr) 3345, 3108, 2980, 2934, 1723, 1701, 1529, 1338, 1126, 878 см-1;1H ЯМР (CDCl3) δ 11,48 (шир.с, 1H), 8,38 (шир.с, 1H), 7,91 (дд, 1H, J=2,5, 8,8 Гц), 7,69 (д, 1H, J= 2,5 Гц), 7,46 (дд, 1H, J=1,3, 9, 1 Гц), 7,20 (м, 1H), 7,12 (м, 4Н), 7,01 (д, 1H, J=7,6 Гц), 6,83 (д, 2Н, J=8,6 Гц), 5,31 (с, 2Н), 5,11 (дд, 1H, J=4,0, 8,9 Гц), 4,22 (м, 2Н), 3,63 (м, 2Н), 2,82 (т, 2Н, J=7,2 Гц), 2,65 (м, 1H), 2,39 (м, 1H), 1,50 (с, 9Н), 1,48 (с, 1H).
Анализ: Вычислено для С36Н42ClN5O9: С 59,71, H 5,85, N 9,67. Найдено: С 59,89, H 5,84, N 9,61.
Соединение 89
3,4-Дигидро-2-{ 2-[4-(2 -гуанидиноэтил)фенокси] этил} - 6-нитро-4-(2-хлорбензил) -3 оксо-2Н-1,4-бензоксазин
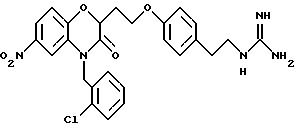
Получен из соединения 88 способом К с выходом 90%, т.пл. (разлож.) >85oС; MS (CI) MH+ 524; ИК (КВr) 3335, 3156, 1651, 1524, 1515, 1446, 1343, 1269, 1243, 1108, 746 см-1;1H ЯМР (DMSO-d6) δ 7,94 (дд, 1Н, J=2,5, 8,9 Гц), 7,64 (д, 2Н, J=2,6 Гц), 7,56 (д, 1Н, J=7,8 Гц), 7, 50-6,55 (оч.шир., с, 3Н), 7,30 (м, 4Н), 7,19 (м, 3Н), 6,90 (д, 2Н, J=8,6 Гц), 5,31 (м, 2Н), 5,21 (д, 1Н, J=17,2 Гц), 4,19 (м, 2Н), 3,29 (м, 2Н), 2,71 (т, 2Н, J=7,7 Гц), 2,44 (м, 1Н), 2,35 (м, 1Н).
Анализ: Вычислено для С26Н26СlN5O5 • HCl • 0,5Н2O: С 54,87, H 4,94, N 12,02.
Соединение 90
3,4-Дигидро-2-{ 2- [4-(2-(N,N'-бис -трет-бутоксикарбонил-гуанидино)этил) фенокси]этил)-4 -(3-нитробензил)-7-нитро-3-оксо-2Н- 1,4-бензоксазин
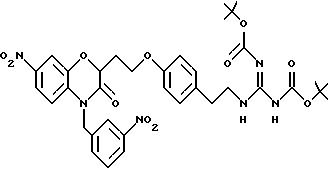
Получен из промежуточного продукта 11653-85-В-1 (ссылочный пример 67) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина способом L с выходом 41%, т. пл. (разлож.) >84oС; MS (CI) MH+ 735; ИК (КВr) 3331, 2979, 2934, 1719, 1638, 1533, 1512, 1477, 1343, 1132, 812 см-1;1H ЯМР (CDCl3) δ 11,48 (с, 1Н), 8,37 (шир.т, 1Н), 8,16 (м, 1Н), 8,12 (с, 1Н), 7,91 (д, 1H, J= 2,4 Гц), 7,85 (дд, 1Н, J=2,5, 8,9 Гц), 7,54 (м, 2Н), 7,13 (д, 2Н, J=8,5 Гц), 6,89 (д, 1H, J= 8,9 Гц), 6,83 (д, 1H, J=8,6 Гц), 5,34 (д, 1H, J=16,6 Гц), 5,27 (д, 1H, J=16,7 Гц), 5,10 (дд, 1H, J=4,0, 8,9 Гц), 4,24 (м, 2Н), 3,63 (кв, 2Н, J=7,0 Гц), 2,82 (т, 2Н, J=7,2 Гц), 2,63 (м, 1H), 2,38 (м, 1H), 1,62 (шир.с, 1H), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для С36Н42СlN6О11: С 58,85, H 5,76, N 11,44. Найдено: С 58,73, H 5,77, N 11,34.
Соединение 91
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -7-нитро-4-(3- нитробензил)-3-оксо-2Н -1,4-бензоксазин
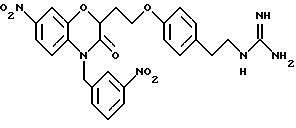
Получен из соединения 90 способом К, т.пл. (разлож.) >90oС; MS (CI) MH+ 535; ИК (КВг) 3336, 3155, 1696, 1602, 1528, 1390, 1343, 1244, 1179, 927, 743 см-1;1H ЯМР (DMSO-d6) δ 8,23 (с, 1H), 8,15 (д, 1H, J=8,1 Гц), 7,89 (м, 2Н), 7,72 (д, 1H, J=7,7 Гц), 7,63 (т, 1H, J=7,9 Гц), 7,55 (шир.т, 1H), 7,51-6,65 (оч. шир. с, 3Н), 7,31 (д, 1H, J=7,31 Гц), 7,20 (д, 2Н, J=8,6 Гц), 6,91 (д, 2Н, J= 8,6 Гц), 5,43 (д, 1Н, J=16,6 Гц), 5,34 (д, 1Н, J=17,3 Гц), 5,23 (дд, 1Н, J=4,1, 8,7 Гц), 4,21 (м, 2Н), 3,30 (м, 2Н), 2,71 (т, 2Н, J=7,3 Гц), 2,41 (м, 1Н), 2,30 (м, 1Н).
Анализ: Вычислено для C26H26N6O7 • HCl • 0,7Н2O: С 53,51, H 4,91, N 14,40. Найдено: С 53,87, H 4,77, N 14,72.
Соединение 92
6-Амино-4-(3-хлорбензил) -3,
4-дигидро-2-{2-[4-(2- гуанидино-этил)фенокси] этил}-3-оксо-2Н- 1,4-бензоксазин
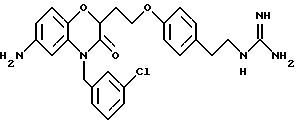
4-(3-Хлорбензил)-3,4-дигидро -2-{ 2-[4-(2-гуанидиноэтил) -фенокси]этил} -6- нитро-3-оксо-2Н-1,4-бензоксазин (0,3 г) нагревали в этаноле (5 мл) и Н2О (4 мл) до завершения растворения. При перемешивании добавляли порошок железа (0,19 г, 6,8 экв), затем NH4Cl (0,02 г, 0,7 экв) и реакцию продолжали при кипячении с обратным холодильником в течение 5 ч. В горячем состоянии смесь фильтровали через целит и желтый фильтрат концентрировали до образования желтого масла. После сушки в вакууме при 80oС продукт собирали в виде желтого твердого вещества с выходом 85%, т.пл. (разлож.) >94oС; MS (CI) МН+ 494; ИК (КВr) 3332, 1667, 1614, 1512, 1467, 1396, 1243, 830, 774, 680 см-1;1H ЯМР (DMSO-d6) δ 7,66 (шир.с, 1Н), 7,58-6,50 (оч.шир.с, 3Н), 7,36 (м, 4Н), 7,20 (м, 3Н), 6,91 (д, 2Н, J=8,6 Гц), 6,74 (д, 1Н, J=8,4 Гц), 6,26 (д, 1Н, J= 2,2 Гц), 6,21 (дд, 1Н, J=2,2, 8,4 Гц), 5,08 (д, 1Н, J=16,7 Гц), 4,99 (д, 1Н, J=16,5 Гц), 5,12-4,78 (оч.шир.с, 1Н), 4,79 (дд, 1Н, J=4,0, 8,9 Гц), 4,15 (м, 2Н), 3,33 (м, 2Н), 2,71 (т, 2Н, J=7,5 Гц), 2,30 (м, 1Н), 2,18 (м, 1Н).
Анализ: Вычислено для C26H28ClN5O3 • HCl • 0,5H2O: С 57,89, H 5,61, N 12,98. Найдено: С 57,64, H 5,48, N 12,63.
Соединение 93
2-{2-[4-(2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)-этил] фенокси]этил} -4-(4- нитробензил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин
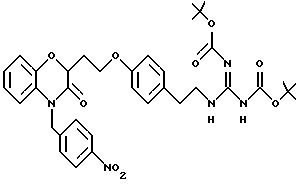
Получен из промежуточного продукта 11653-173 (ссылочный пример 71) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)-этилгуанидина способом L с выходом 61%, т.пл. (разлож.) >78oС; ИК (КВr) 3331, 2977, 1722, 1689, 1638, 1513, 1500, 1467, 1278, 922, 859 см-1;1H ЯМР (CDCl3) δ 11,48 (шир.с, 1Н), 8,37 (шир. т, 1Н), 8,19 (д, 2Н, J=8,8 Гц), 7,41 (д, 2Н, J=8,8 Гц), 7,13 (д, 2Н, J=8,6 Гц), 7,03 (м, 2Н), 6,92 (м, 1Н), 6,85 (д, 2Н, J=8,6 Гц), 6,75 (д, 1Н, J= 7,9 Гц), 5,29 (д, 1Н, J=16,7 Гц), 5,18 (д, 1Н, J=16,7 Гц), 4,95 (дд, 1Н, J=3,9, 9,3 Гц), 4,22 (м, 2Н), 3,64 (м, 2Н), 2,81 (т, 2Н, J=7,3 Гц), 2,58 (м, 1Н), 2,35 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C36H43N5O9 • 0,5H2O: С 61,88, H 6,35, N 10,02. Найдено: С 62,07, H 6,32, N 9,85.
Соединение 94
2-{2-[4-(2-(N,
N'-Бис-трет- бутоксикарбонилгуанидино) -этил]фенокси]этил} -3,4-дигидро -4-(3-нитробензил)-3-оксо -2Н-1,4-бензоксазин
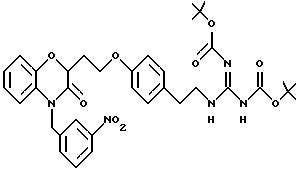
Получен из промежуточного продукта 11653-180 (ссылочный пример 61) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)-этилгуанидина способом L с выходом 64%, т.пл. (разлож.) >144oС; MS (FAB) MH+ 690; ИК (КВr) 3333, 2979, 1769, 1720, 1684, 1641, 1613, 1582, 1526, 1512, 1501, 1467, 1403, 1303, 1279, 1208, 1020 см-1;1H ЯМР (CDCl3) δ 11,50 (шир.с, 1Н), 8,37 (шир.т, 1Н), 8,15 (с, 1Н), 8,13 (с, 1Н), 7,58 (д, 1Н, J=7,7 Гц), 7,54 (м, 1Н), 7,12 (д, 2Н, J=8,6 Гц), 7,02 (м, 2Н), 6,91 (м, 2Н), 6,85 (д, 1Н, J=8,6 Гц), 6,79 (д, 1Н, J= 7,7 Гц), 5,25 (с, 2Н), 4,98 (дд, 1Н, J=3,9, 9,4 Гц), 4,22 (м, 2Н), 3,63 (м, 2Н), 2,81 (т, 2Н, J=7,3 Гц), 2,58 (м, 1Н), 2,34 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C36H43N5O9 • H2O: С 61,09, H 6,41, N 9,89. Найдено: С 61,40, H 6,47, N 9,55.
Соединение 95
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -4-(3-нитробензил)-3- оксо-2Н-1,4-бензоксазин
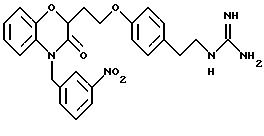
Получен из соединения 94 способом К с выходом 58%, т.пл. (разлож.) >79oС; MS (FAB) МН+ 490; ИК (KBr) 3321, 3146, 1665, 1529, 1500, 1466, 1399, 1349, 1322, 1279, 1249, 1154, 1097, 1063, 1022, 924, 810, 687, 468 см-1;1H ЯМР (DMSO-d6) δ 8,18 (с, 1H), 8,13 (д, 1Н, J=7,9 Гц), 7,68 (м, 1Н), 7, 60-6,40 (оч.шир.с, 3Н), 7,39 (с, 1H), 7,20 (м, 2Н), 7,08 (м, 3Н), 6,98 (м, 3Н), 6,92 (д, 1H, J=8,4 Гц), 5,36 (д, 1H, J=18,7 Гц), 5,28 (д, 1H, J=17,0 Гц), 5,02 (м, 1H), 4,28 (т, 1H, J=6,6 Гц), 4,18 (м, 1H), 3,35 (м, 3Н), 2,72 (т, 2Н, J=6,3 Гц), 2,40 (м, 1H), 2,27 (м, 1H).
Анализ: Вычислено для C26H27N5O5 • 2,1HCl: С 55,16, H 5,18, N 12,37. Найдено: С 55,08, H 5,23, N 12,21.
Соединение 96
2-{2-[4-(2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)-этил) фенокси]этил} -7-нитро-4-(4- нитробензил)-3,4-дигидро
-3-оксо-2Н-1,4-бензоксазин
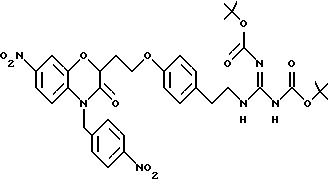
Получен из 12279-11 (ссылочный пример 62) с выходом 43% и выделен в виде желтого твердого продукта, т.пл. (разложение) >77oC; MS (FAB) MH+ 735; ИК (KBr) 3329, 3087, 2976, 2932, 2871, 1720, 1639, 1610, 1474, 1390, 1155, 1022, 882, 577, 461 см-1;1H ЯМР (CDCl3) δ 11,49 (шир.с, 1Н), 8,37 (шир.т, 1Н), 8,21 (д, 2Н, J=8,7 Гц), 7,91 (д, 1Н, J=2,5 Гц), 7,84 (дд, 1Н, J=2,5, 8,9 Гц), 7,40 (д, 2Н, J=8,6 Гц), 7,14 (д, 2Н, J=8,6 Гц), 6,83 (дд, 3Н, J= 2,5, 9,0 Гц), 5,35 (д, 1Н, J=15,4 Гц), 5,25 (д, 1Н, J=15,4 Гц), 5,08 (дд, 1Н, J=4,0, 8,9 Гц), 4,22 (м, 2Н), 3,63 (м, 2Н), 2,82 (т, 2Н, J=7,4 Гц), 2,63 (м, 1Н), 2,38 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C36H42N6O11 • С3Н6О: С 59,03, H 6,10, N 10,60. Найдено: С 58,96, H 6,17, N 10,54.
Соединение 97
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -7-нитро-4-(4- нитробензил)-3-оксо-2Н -1,4-бензоксазин

Получен из соединения 96 способом К с количественным выходом, т.пл. (разлож. ) >141o С; MS (FAB) МН+ 535; ИК (KBr) 3323, 3158, 2948, 1702, 1667, 1598, 1470, 1434, 1396, 1182, 1144, 1107, 1012, 995, 898, 860, 826 см-1;1H ЯМР (DMSO-d6) δ 8,22 (д, 2Н, J=8,8 Гц), 7,92 (с, 1Н), 7,89 (д, 1Н, J=2,6 Гц), 7,61 (м, 3Н), 7,60-6,65 (оч.шир.с, 2Н), 7,23 (м, 4Н), 6,94 (д, 2Н, J= 8,6 Гц), 5,47 (д, 1Н, J=17,3 Гц), 5,36 (д, 1Н, J=17,3 Гц), 5,27 (дд, 1Н, J= 8,8, 4,2 Гц), 4,23 (м, 2Н), 3,35 (м, 2Н), 2,74 (т, 2Н, J=7,4 Гц), 2,45 (м, 1Н), 2,38 (м, 1Н).
Анализ: Вычислено для С26H26N6O7 • HCl • 0,9Н2O • 0,2IРА: С 53,32, H 5,11, N 14,02. Найдено: С 53,07, H 4,84, N 13,74.
Соединение 98
2-{2-[4-(2-(N,
N'-Бис-трет- бутоксикарбонилгуанидино)-этил) фенокси]этил} -4-(2-нитробензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин
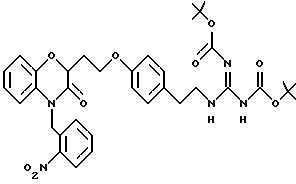
Получен способом L с использованием промежуточного продукта 11653-174-А (ссылочный пример 73) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина с выходом 40% в виде желтого твердого продукта, т.пл. (разлож. ) >65oС; MS (CI) МН+ 690; ИК (KBr) 3330, 3151, 2978, 2934, 1723, 1694, 1616, 1528, 1502, 1302, 1277, 1228, 1087, 1022, 933, 880, 562, 464 см-1;1H ЯМР (CDCl3) δ 11,40 (шир.с, 1Н), 8,36 (шир.с, 1Н), 8,18 (д, 1H, J= 8,12 Гц), 7,42 (м, 2Н), 7,10 (м, 2Н), 6,96 (м, 4Н), 6, 85 (м, 1H), 6,73 (д, 2Н, J= 8,27 Гц), 5,50 (д, 2Н, J=17,95 Гц), 4,95 (дд, 1H, J=9,59, 4,21 Гц), 4,16 (м, 2Н), 3,56 (м, 2Н), 2,77 (м, 2Н), 2,57 (м, 1H), 2,35 (м, 1H), 1,46 (с, 9Н), 1,45 (с, 9Н).
Анализ: Вычислено для C36H43N5O9 • 0,9H2O: С 61,25, H 6,40, N 9,92. Найдено: С 60,79, H 6,76, N 10,39.
Соединение 99
2-{2-[4-(2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)-этил] фенокси]этил} -3,4-дигидро -7-метокси-4-(3-нитробензил) -3-оксо-2Н-1,4-бензоксазин

Получен способом L из промежуточного продукта 12279-18-2 (ссылочный пример 63) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина с выходом 83%, т.пл. (разлож.) >71oС; MS (FAB) MH+ 720; ИК (KBr) 3329, 2977, 2934, 1722, 1683, 1639, 1532, 1413, 1350, 1330, 1247, 1164, 1057, 916, 729, 529 см-1;1H ЯМР (CDCl3) δ 11,48 (с, 1Н), 8,37 (шир.с, 1Н), 8,15 (с, 1H), 8,12 (с, 1Н), 7,53 (м, 2Н), 7,13 (д, 2Н, J=8, 62 Гц), 6,86 (д, 2Н, J=8,62 Гц), 6,68 (д, 1H, J=8,88 Гц), 6,61 (д, 1H, J=2,72 Гц), 6,47 (дд, 1H, J=8,85, 2,70 Гц), 5,21 (с, 2Н), 4,96 (дд, 1H, J=9,36, 3,95 Гц), 4,23 (м, 2Н), 3,74 (с, 3Н), 3,63 (м, 2Н), 2,81 (т, 2Н, J=7,22 Гц), 2,57 (м, 1H), 2,33 (м, 1H), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C37H45N5O10: С 61,74, H 6,30, N 9,73. Найдено: С 61,24, H 6,43, N 9,76.
Соединение 100
3,4-Дигидро-2-{ 2-[4-(2- гуанидиноэтил)фенокси] этил} -7-метокси-4-(3- нитробензил)-3-оксо- 2Н-1,4-бензоксазин
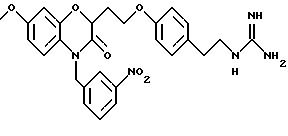
Получен из соединения 99 способом К с выходом 87%, т.пл. (разлож.) >68oС; MS (CI) MH+ 520; ИК (КВr) 3317, 3147, 2930, 1466, 1407, 1357, 1324, 1309, 1163, 1135, 922, 798, 669, 530 см-1;1H ЯМР (DMSO-d6) δ 8,16 (с, 1Н), 8,13 (д, 1Н, J=8,28 Гц), 7,66 (м, 2Н), 7,60 (т, 2Н, J=7,30 Гц), 7,53-6,70 (оч. шир. с, 2Н), 7,20 (д, 2Н, J=8,48 Гц), 7,01 (д, 1Н, J=8,92 Гц), 6,92 (д, 2Н, J= 8,48 Гц), 6,69 (д, 1Н, J=2,79 Гц), 6,55 (дд, 1Н, J=2,70, 8,88 Гц), 5,28 (д, 2Н, J=2,72 Гц), 4,98 (дд, 1Н, J=4,05, 8,81 Гц), 4,20 (м, 2Н), 3,68 (с, 3Н), 3,32 (м, 2Н), 2,71 (т, 2Н, J=7,16 Гц), 2,37 (м, 1Н), 2,23 (м, 1Н).
Анализ: Вычислено для C27H29N5O6 • HCl • 0,5Н2O: С 57,39, H 5,53, N 12,39. Найдено: С 57,71, H 5,90, N 11,99.
Соединение 101
4-(3-Аминобензил)-2-(2-[4-(2- (N,N'-бис-трет-бутокси-карбонилгуанидино) этил)фенокси]этил}-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин

Получен способом L из промежуточного продукта 12279-13-А (ссылочный пример 65) и N,N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина и выделен флэш-хроматографией с элюированием смесью ацетон/гексан с выходом 55% в виде белого твердого продукта, т.пл. (разлож.) >68oС; MS (FAB) MH+ 660; ИК (КВr) 3335, 2977, 1722, 1685, 1638, 1512, 1500, 1466, 1408, 1366, 1329, 1244, 1155, 1131, 1057, 809, 749, 688 см-1;1H ЯМР (CDCl3) δ 11,48 (с, 1Н), 8,37 (шир. т, 1Н), 7,12 (м, 3Н), 6, 95 (м, 2Н), 6,87 (м, 4Н), 6,85 (д, 1Н, J=8,48 Гц), 6,64 (д, 1Н, J=7,54 ГЦ), 6,56 (д, 1Н, J=11,1 Гц), 5,07 (дд, 2Н, J= 15,97, 24,50 Гц), 4,93 (дд, 1Н, J=3,83, 5,49 Гц), 4,23 (м, 2Н), 3,62 (м, 4Н), 2,81 (т, 2Н, J=7,16 Гц), 2,56 (м, 1Н), 2,33 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для C36H45N5O7: С 65,54, H 6,87, N 10,61. Найдено: С 65,43, H 6,92, N 10,38.
Соединение 102
2-{2-[4-(2-(N,N'-Бис-трет -бутоксикарбонилгуанидино)-этил] фенокси]этил} -3,4-дигидро -6-фтор-4-(3-нитробензил) -3-оксо-2Н-1,
4-бензоксазин
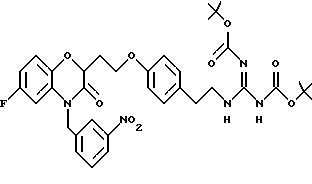
Получен способом L с использованием промежуточного продукта 12279-21 (ссылочный пример 64) и N,N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил) этилгуанидина с выходом 77%, т.пл. (разложение) >69oС; MS (FAB) MH+ 708; ИК (КВr) 3330, 2978, 1696, 1638, 1533, 1507, 1453, 1415, 1350, 1249, 1155, 948, 670 см-1;1H ЯМР (СDСlз) δ 11,47 (шир.с, 1Н), 8,37 (шир.т, 1Н), 8,16 (д, 1Н, J=7,1 Гц), 8,11 (шир.с, 1Н), 7,53 (м, 2Н), 7,14 (д, 2Н, J=8,6 Гц), 6,98 (дд, 1Н, J= 5,1, 8,9 Гц), 6,85 (д, 2Н, J=8,6 Гц), 6,70 (м, 1Н), 6,51 (дд, 1Н, J= 2,8, 9,4 Гц), 5,21 (д, 1Н, J=16,4 Гц), 5,20 (д, 1Н, J=16,4 Гц), 4,95 (дд, 1Н, J=4,0, 9,3 Гц), 4,22 (м, 2Н), 3,64 (м, 2Н), 2,81 (т, 2Н, J=7,1 Гц), 2,63 (м, 1Н), 2,34 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для С36Н42FN5 О9 • 1,5Н2О: С 60,41, H 6,34, N 9,78. Найдено: С 60,36, H 6,17, N 10,06.
Соединение 103
2-[2-{ 4-[2-(трет-Бутоксикарбониламино) этил]
фенокси}этил]-4-(4-карбометоксибензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин

Получен из промежуточного продукта 11758-71-2 (ссылочный пример 81) и 4-[2-(N-трет-бутоксикарбониламино) этил] фенола способом L в виде белого твердого продукта с выходом 69%, т.пл. 110-112oС;1H ЯМР (CDCl3) δ 8,00 (д, J=8,2 Гц, 2Н), 7,30 (д, J=8,2 Гц, 2Н), 7,10 (д, J=8,4 Гц, 2Н), 6,98-7,04 (м, 2Н), 6,89-6,95 (м, 3Н), 6,78 (дд, J=1,3, 8,5 Гц, 1Н), 5,21 (шир.с, 2Н), 4,96 (дд, J= 4,0, 9,5 Гц, 1Н), 4,54 (шир.с с уступами, 1Н), 4,15-4,30 (м, 2Н), 3,90 (с, 3Н), 3,31-3,36 (м, 2Н), 2,74 (т, J=6,7 Гц, 2Н), 2,53-2,63 (м, 1Н), 2,33 (ддт, J=14,1, 9,5, 4,8 Гц, 1Н), 1,44 (с, 9Н).13С ЯМР (CDCl3) δ 166,7, 166,4, 157,3, 155,9, 144,2, 141,3, 131,3, 130,2 (СН), 129,8 (СН), 129,5, 128,7, 126,5 (СН), 124,3 (СН), 122,9 (СН), 117,5 (СН), 115,3 (СН), 114,7 (СН), 76,6, 73,9 (СН), 63,1 (СН2), 52,1 (СН3), 45,2 (CH2), 41,9 (CH2), 35,3 (CH2), 30,4 (CH2), 28,4 (СН3). ИК 3376, 1713, 1684 см-1. MS (FAB) 561 (МН+), 461, 324 (основание).
Анализ: Вычислено для C32H36N2O7: С 68,56, H 6,47, N 5,00. Найдено: С 68,16, H 6,45, N 4,90.
Соединение 104
2-{ 2-[4-(2-Аминоэтил) фенокси] этил}-4-(4-карбометоксибензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин
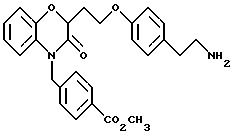
Получен из соединения 103 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl. Получаемый твердый продукт растирали с эфиром, получая продукт в виде белого порошка (182 мг; выход 88%, т. пл.=164-165oС).1H ЯМР (DMSO-d6) δ 8, 40 (шир.с, 3Н), 7,98 (д, J=8,2 Гц, 2Н), 7,32 (д, J=8,2 Гц, 2Н), 7,13 (д, J=8,5 Гц, 2Н), 6,77-7,01 (м, 6Н), 5,21 (с, 2Н), 4,94 (дд, J=4,0, 9,3 Гц, 1Н), 4,19-4,27 (м, 2Н), 3,90 (с, 3Н), 3,06-3,12 (м, 2Н), 2,90-2,96 (м, 2Н), 2,51-2,60 (м, 1Н), 2,29-2,37 (м, 1Н).13С ЯМР (DMSO-d6) δ 165,9, 165,6, 157,0, 143,4, 140,7, 129,5 (СН), 129,2 (СН), 128,8, 128,5, 127,9, 125,8 (СН), 123,7 (СН), 122,3 (СН), 116,8 (СН), 114,7 (СН), 114,2 (СН), 73,1 (СН), 62,5 (СН2), 51,5 (СН3), 44,4 (CH2), 40,4 (СН2), 32,2 (CH2), 29,6 (СН2). ИК 2700-3200 (шир.), 1722, 1705, 1680 см-1. MS 461 (МН+).
Анализ: Вычислено для C27H28N2O5 • C2HF3O2: С 60,62, H 5,09, N 4,88. Найдено: С 60,31, H 5,07, N 4,78.
Соединение 105
2-[2-{ 4-[2-(трет-Бутоксикарбониламино )этил]
фенокси}этил]-4-(3-карбометоксибензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин

Получен из промежуточного продукта 11758-93-2А (ссылочный пример 82) и 4-[2-(N-трет-бутоксикарбониламино)этил] фенола способом L и выделен в виде белого твердого продукта с выходом 66,2%, т.пл. 112-113oС;1Н ЯМР (CDC13) δ 7,93-7,95 (м, 2Н), 7,38-7,41 (м, 2Н), 7,10 (д, J=8,5 Гц, 2Н), 6,88-7,02 (м, 3Н), 6,86 (д, J= 8,5 Гц, 2Н), 6,81 (дд, J=1,5, 7,7 Гц, 1Н), 5,20 (с, 2Н), 4,96 (дд, J=4,0, 9,4 Гц, 1Н), 4,51 (шир.с, 1Н), 4,18-4,26 (м, 2Н), 3,90 (с, 3Н), 3,32-3,35 (шир. м, 2Н), 2,73 (т, J=6,5 Гц, 2Н), 2,55-2,60 (м, 1Н), 2,32-2,38 (м, 1Н), 1,43 (с, 9Н). ИК 3370, 1724, 1888 см-1. MS (FAB) 561 (МН+), 324.
Анализ: Вычислено для C32H36N2O7: С 68,56, H 6,47, N 5,00. Найдено: С 68,37, H 6, 63, N 4,88.
Соединение 106
2-{ 2-[4-(2-Аминоэтил )фенокси] этил}-4-(3-карбометоксибензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин
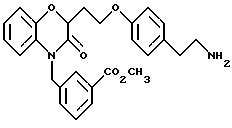
Получен из соединения 105 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl и выделен в виде кремового твердого продукта с выходом 92%, т.пл.=112-114,5oС;1H ЯМР (DMSO-d6) δ 7,90 (шир. с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,77 (шир.с, 3Н), 7,47-7,54 (м, 2Н), 7,19 (д, J=8,5 Гц, 2Н), 7,00-7,08 (м, 4Н), 6,95 (д, J=8,5 Гц, 2Н), 5,26 (с, 2Н), 5,00 (дд, J=4,0, 8,9 Гц, 1H), 4,19-4,23 (м, 2Н), 3,84 (с, 3Н), 3,02 (т, J=7,8 Гц, 2Н), 2,79 (т, J=7,8 Гц, 2Н), 2, 35-2,40 (м, 1H), 2,23-2,28 (м, 1H). ИК 2900-3100 (шир.), 1717, 1683 см-1; MS 461 (МН+).
Анализ: Вычислено для С27Н28N2O5 • С2НFзO2: С 60,62, H 5,09, N 4,88. Найдено: С 60,27, H 5,31, N 4,68.
Соединение 107
2-[2-{ 4-[2-(трет-Бутоксикарбониламино)
этил]фенокси}этил]-4-(2- карбоэтоксибензил)-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин

Получен из промежуточного продукта 11758 82-2 (ссылочный пример 83) и 4-[2-(N-трет-бутоксикарбониламино) этил] фенола способом L и выделен в виде белого твердого продукта с выходом 76,9%, т.пл. 103-105oС;1H ЯМР (CDCl3) δ 8,07 (дд, J=1,5, 7,6 Гц, 1H), 7,41 (дт, J=1,5, 7,6 Гц, 1Н), 7,32 (дт, J=0,9, 7,6 Гц, 1H), 7,10 (д, J=8,6 Гц, 2Н), 6,95-7,07 (м, 3Н), 6,85-6,92 (м, 3Н с 2Н дублет (J=8,6 Гц) при δ 6,87), 6,72 (дд, J=1,4, 8,0 Гц, 1H), 5,63 (д, J= 17,9 Гц, 1H), 5,54 (д, J=17,9 Гц, 1H), 4,97 (дд, J=3,9, 9,4 Гц, 1H), 4,52 (шир. с, 1H), 4,41 (кв, J=7,1 Гц, 2Н), 4,20-4,28 (м, 2Н), 3,32-3,36 (шир. м, 2Н), 2,74 (т, J=6,8 Гц, 2Н), 2,56-2,69 (м, 1H), 2,36 (ддт, J=14,4, 9,3, 4,8 Гц, 1H), 1,43 (т, J= 7,1 Гц, 3Н), 1,42 (с, 9Н).13С ЯМР (СDClз) δ 166,9, 166,4, 157,4, 155,9, 144,2, 137,7, 132,8 (СН), 131,5 (СН), 131,3, 129,8 (СН), 129,0, 128,5, 127,1 (СН), 125,6 (СН), 124,1 (СН), 122,9 (СН), 117,3 (СН), 115,6 (СН), 114,7 (СН), 73,7 (СН), 63,3 (СН2), 61,2 (СН2), 50,9, 44,5 (СН2), 41,9 (СН2), 35,3 (СН2), 30,4 (СН2), 28,4 (СН3), 14,4 (СН3 ).
Соединение 108
2-{ 2-[4-(2-Аминоэтил) фенокси] этил} -4-(2-карбоэтоксибензил) -3,4-дигидро-3-оксо -2Н-1,4-бинзоксазин
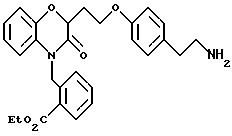
Получен из соединения 107 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl и выделен в виде белого порошка с выходом 94,5%, т.пл. 107,5-109oС;1Н ЯМР (DMSO-d6) δ 7,99 (дд, J= 1,5, 6,2 Гц, 1Н), 7,75 (шир.с, 3Н), 7,39-7,53 (м, 2Н), 7,18 (д, J=8,6 Гц, 2Н), 7, 02-7,10 (м, 3Н), 6,92-6,99 (м, 3Н с 2Н дублет при δ 6,94), 6,81 (д, J= 8,0 Гц, 1Н), 5,51 (д, J=17,5 Гц, 1H), 5,39 (д, J=17,5 Гц, 1H), 5,04 (дд, J= 4,1, 8,7 Гц, 1H), 4,36 (кв, J=7,1 Гц, 2Н), 4, 18-4,23 (м, 2Н), 2,90-3,02 (м, 2Н), 2,75-2,81 (м, 2Н), 2,28-2,45 (м, 2Н), 1,37 (т, J=7,1 Гц, 3Н). ИК 2975-3100 (шир.), 1690 (sh), 1680 см-1. MS 475 (MH+).
Анализ: Вычислено для C28H30N2O5 • 1,0C2HF3O2 • 1,5H2O: С 58,53, H 5,57, N 4,55. Найдено: С 58,48, H 5,44, N 4,55.
Соединение 109
4-{ 2-[2-(4-(2-(трет- Бутоксикарбониламино)этил)фенокси)] -этил]-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин-4 -ил}метилбензойная кислота
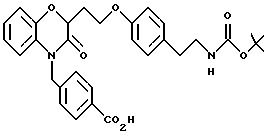
Способ О: Соединение 103 (150 мг, 1 экв) и 1 н. NaOH (2,5 экв) в метаноле (10 мл) нагревали на масляной бане при 50oС в течение 26 ч. После выпаривания метанола остаток разбавляли водой (20 мл), охлаждали до 0oС и подкисляли 1 н. лимонной кислотой (1 мл). Осадок собирали, промывали водой и сушили, получая продукт в виде белого твердого вещества с выходом 89%, т.пл. = 147-148oС;1H ЯМР (DMSO-d6) δ 8,04 (д, J=8,1 Гц, 2Н), 7,34 (д, J=8,3 Гц, 2Н), 7,10 (д, J=8,3 Гц, 2Н), 6,75-7,04 (м, 6Н), 5,22 (шир.с, 2Н), 4,96 (дд, J= 3,8, 9,0 Гц, 1Н), 4,55 (шир.с, 1Н), 4,10-4,28 (м, 2Н), 3,31-3,36 (м, 2Н), 2,73 (т, J=6,3 Гц, 2Н), 2,55-2,61 (м, 1 Н), 2,34 (ддт, J=14,1, 9,8, 5,1 Гц, 1Н), 1,43 (с, 9Н). ИК 3300-3350 (шир.), 1688 (шир.) см-1. MS (FAB) 547 (МН+), 447 (М-Вос)+ 310 (основание).
Анализ: Вычислено для C31H34N2O7: С 68,12, H 6,27, N 5,12. Найдено: С 67,71, H 6,47, N 5,00.
Соединение 110
4-{ 3,
4-Дигидро-2-[2-(4- (2-аминоэтил)фенокси)] этил-3-оксо-2Н-1,4- бензоксазин-4-ил} метилбензойная кислота

Получен из соединения 109 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl и выделен в виде белого порошка с выходом 98%, т.пл. 195-197o С;1H ЯМР (DMSO-d6) δ 12,97 (шир.с, 1Н), 7,90 (д, J=8,2 Гц, 2Н), 7,77 (шир.с, 3Н), 7,38 (д, J=8,2 Гц, 2Н), 7,19 (д, J= 8,3 Гц, 2Н), 6,97-7,05 (м, 4Н), 6,95 (д, J=8,3 Гц, 2Н), 5,28 (д, J= 16,3 Гц, 1Н), 5,20 (д, J=16,3 Гц, 1Н), 5,00 (дд, J=4,0, 8,7 Гц, 1Н), 4,18-4,22 (м, 2Н), 2,98-3,02 (м, 2Н), 2,78 (т, J=7,8 Гц, 2Н), 2,35-2,40 (м, 1Н), 2,23-2,28 (м, 1Н).13С ЯМР δ 166,9, 165,8, 157,2, 143,6, 141,6, 129,8 (СН), 129,7 (СН), 129,3, 128,3, 126,6 (СН), 123,9 (СН), 122,8 (СН), 117,0 (СН), 115,7 (СН), 114,7 (СН), 73,0 (СН), 63,1 (СН2), 43,7 (СН2), 39,9 (CH2), 31,9 (CH2), 29,4 (СН2). ИК 3000-3200 (шир.), 1681, 1503 см-1. MS 447 (МН+), 429 (М-ОН)+.
Анализ: Вычислено для C26H26N2O5 • C2HF3O2 • 0,5H2O: С 59,05, H 4,96, N 4,92. Найдено: С 58,96 H 4,71, N 4,76.
Соединение 111
3-{ 3,4-Дигидро-2-[2-(4-(2-(трет- бутоксикарбониламино)-этил) фенокси)] этил-3-оксо- 2Н-1,4-бензоксазин-4- ил}метилбензойная кислота
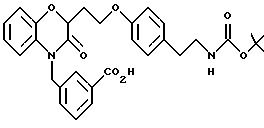
Получена из соединения 105 способом О и выделена в виде белого стеклообразного продукта с выходом 92%, т.пл. 76-78oС;1H ЯМР (DMSO-d6) δ 7,87 (шир. с, 1Н), 7,82 (д, J=7,3 Гц, 1Н), 7,51 (д, J=8,8 Гц, 1Н), 7,47 (кв, J= 7,4 Гц, 1Н), 7,10 (д, J=8,5 Гц, 2Н), 6,97-7,07 (м, 4Н), 6,87 (д, J=8,5 Гц, 2Н), 6,85 (шир.с, 1Н), 5,24 (с, 2Н), 4,98 (дд, J=4,1, 8,8 Гц, 1Н), 4,15-4,19 (м, 2Н), 3,06-3,10 (шир.кв, J=7,6 Гц, 2Н), 2,61 (т, J=7,6 Гц, 2Н), 2,32-2,37 (м, 1Н), 2,20-2,25 (м, 1Н), 1,36 (с, 9Н). ИК 2800-3100 (шир.), 1704, 1700 (sh) см-1. MS 547 (МН+), 473 (основание).
Анализ: Вычислено для С31Н34N2 О7 • 0,5Н2O: С 67,01, H 6,35, N 5,04. Найдено: С 67,03, H 6,44, N 4,95.
Соединение 112
3-{ 3,4-Дигидро-2-[2-(4-(2 -аминоэтил)фенокси)]этил
-3-оксо-2Н-1,4-бензоксазин -4-ил}метилбензойная кислота

Получена из соединения 111 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl и выделена в виде белых кристаллов с выходом 92%, т.пл. 193-195oС;1H ЯМР (DMSO-d6) δ 13,03 (шир.с, 1Н), 7,87 (шир.с, 1H), 7,83 (д, J=7,4 Гц, 1Н), 7,77 (шир.с, 3Н), 7,51 (д, J= 7,9 Гц, 1H), 7,47 (кв, J=7,5 Гц, 1H), 7,18 (д, J=8,5 Гц, 2Н), 7,04-7,07 (м, 2Н), 6,98-7,01 (м, 2Н), 6,94 (д, J=8,5 Гц, 2Н), 5,24 (с, 2Н), 4,98 (дд, J= 4,2, 8,8 Гц, 1H), 4,17-4,20 (м, 2Н), 2,98-3,03 (м, 2Н), 2,78 (т, J=7,8 Гц, 2Н), 2,36-2,43 (м, 1H), 2,21-2,34 (м, 1H). ИК 2800-3200 (шир.), 1677, 1636 см-1. MS 447 (МН+), 429, 194 (основание).
Анализ: Вычислено для C26H26N2O5 • C2HF3O2 • 0,5H2O: С 59,05, H 4,96, N 4,92. Найдено: С 58,74 H 4,87, N 4,69.
Соединение 113
2-{ 2-[2-(4-(2-(трет- Бутоксикарбониламино)этил) фенокси)]-этил-3,
4-дигидро -3-оксо-2Н-1,4-бензоксазин -4-ил}метилбензойная кислота

Получена из соединения 107 способом О и выделена в виде белого порошка с выходом 93,5%, т.пл. 156-159oС;1H ЯМР (CDCl3/ DMSO-d6) δ 8,13 (д, J=7,4 Гц, 1H), 7,32-7,40 (м, 3Н с 1Н обменный), 7,11 (д, J=8,0 Гц, 2Н), 6,97-7,05 (м, 3Н), 6,86 (д, J= 8,0 Гц, 2Н), 6,72-6,85 (м, 2Н), 5,61 (д, J=18,1 Гц, 1H), 5,53 (д, J= 18,1 Гц, 1H), 4,91 (дд, J=3,7, 9,3 Гц, 1H), 4,65 (шир.с, 1H), 4, 14-4,22 (м, 2Н), 3,23-3,28 (шир. м, 2Н), 2,68 (т, J=7,0 Гц, 2Н), 2,47-2,51 (м, 1H), 2,25-2,33 (м, 1H), 1,38 (с, 9Н). ИК 3350-3500 (шир.), 2950, 1687, 1512 см-1. MS (FAB) 547 (МН+ ), 447 (основание), 310.
Анализ: Вычислено для C31H34N2O7 • 0,5H2O: С 67,01, H 6,35, N 5,04. Найдено: С 67,24 H 6,56, N 5, 02.
Соединение 114
2-{ 2-[2-(4-(2-Аминоэтил) фенокси)]этил-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин -4-ил}метилбензойная кислота
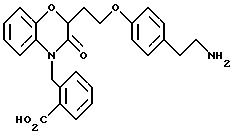
Получена из соединения 113 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl и выделена в виде белого твердого продукта с выходом 76,8%, т.пл. 132-133oС;1H ЯМР (DMSO-d6) δ 8,00 (д, J=6,4 Гц, 1H), 7,74 (шир.с, 3Н), 7,47 (т, J=6,5 Гц, 1H), 7,39 (т, J=7,7 Гц, 1H), 7,18 (д, J=8,5 Гц, 2Н), 6,91-7,09 (м, 6Н с 2Н дублет (J=8,5 Гц) при δ 6,95), 6,79 (д, J=7,3 Гц, 1H), 5,53 (д, J=18,4 Гц, 1H), 5,42 (д, J=18,4 Гц, 1Н), 5,04 (дд, J=4,0, 8,5 Гц, 1Н), 4,18-4,24 (м, 2Н), 2,95-3,09 (м, 2Н), 2,75-2,81 (м, 2Н), 2,23-2,42 (м, 2Н). ИК 2950-3200 (шир.), 1683, 1514 см-1. MS 447 (МН+), 138 (основание).
Анализ: Вычислено для C26H26N2O5 • 1,0С2НFзО2 • 0,25Н2О: С 59,52, H 4,91, N 4,96. Найдено: С 59,43 H 4,91, N 4,80.
Соединение 115
2-{ 2-[4-[2-(N,N'-Бис-трет- бутоксикарбонилгуанидино)-этил]фенокси]этил} -4-(4-карбометоксибензил)-3,4- дигидро-3-оксо-2Н-1,4-бензоксазин
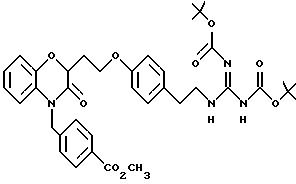
Получен способом L с использованием промежуточного продукта 11758-71-2 (ссылочный пример 81) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и выделен после хроматографии (элюирование смесью этилацетат/гексан) в виде белого стеклообразного продукта, т.пл. 68-71oС;1H ЯМР (СDCl3) δ 11,45 (шир.с, 1Н), 8,37 (шир.с, 1Н), 7,99 (д, J=8,4 Гц, 2Н), 7,30 (д, J=8,4 Гц, 2Н), 7,13 (д, J=8,6 Гц, 2Н), 6,74-7,01 (м, 6Н с 2Н дублет (J= 8,6 Гц) при δ 6,85), 5,23 (д, J=16,1 Гц, 1Н), 5,16 (д, J=16,1 Гц, 1Н), 4,95 (дд, J=3,8, 9,5 Гц, 1Н), 4,19-4,28 (м, 2Н), 3,90 (с, 3Н), 3,61-3,65 (м, 2Н), 2,81 (т, J=7,2 Гц, 2Н), 2,55-2,63 (м, 1Н), 2,31-2,38 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н). ИК 2950-3300 (шир. ), 1724, 1688, 1639 см-1. MS (FAB) 703 (МН+), 503 (основание).
Анализ: Вычислено для C38H46N4O9 • 0,5H2O: С 64,12, H 6,66, N 7,87. Найдено: С 63,73 H 6,87, N 8,31.
Соединение 116
2-{
2-[4-[2-(трет- Бутоксикарбонилгуанидино)этил] фенокси]-этил}-4-(4- карбоксибензил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин
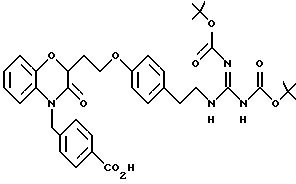
Получен из соединения 115 способом О. Получаемый белый полутвердый продукт собирали, промывали водой и сушили. Анализ ЯМР показал присутствие около 10% метилового эфира.1H ЯМР (DMSO-d6) δ 7,89 (д, J=8,2 Гц, 2Н), 7,37 (д, J=8,2 Гц, 2Н), 6,88-7,08 (м, 8Н), 5,27 (д, J=16, 6 Гц, 1Н), 5,19 (д, J= 16,6 Гц, 1Н), 5,00 (дд, J=4,0, 8,7 Гц, 1Н), 3,50-3,61 (м, 2Н), 2,65-2,69 (м, 2Н), 2,35-2,45 (м, 1Н), 2,21-2,30 (м, 1Н), 1,37 (с, 9Н). MS (FAB) 589 (МН+), 489 (основание).
Соединение 117
4-(4-Карбоксибензил)-2-{ 2-[4- [2-(гуанидино)этил]фенокси]-этил}-3,4 -дигидро-3-оксо-2Н-1,4-бензоксазин
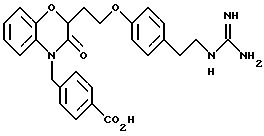
Получен из соединения 116 способом К с использованием трифторуксусной кислоты с присутствующим анизолом вместо IPA/HCl и выделен в виде не совсем белого твердого продукта с выходом 67%, т.пл. 197-199oС;1H ЯМР (DMSO-d6) δ 7,91 (д, J=8,3 Гц, 2Н), 7,76 (шир.с, 1Н), 7,51 (шир.т, J=5 Гц, 1Н), 7,40 (д, J= 8,3 Гц, 2Н), 7,19 (д, J=8,5 Гц, 2Н), 6,92-7, 09 (м, 9Н), 5,29 (д, J=17,0 Гц, 1Н), 5,23 (д, J=17,0 Гц, 1Н), 5,01 (дд, J=4,1, 8,6 Гц, 1Н), 4,18-4,23 (м, 2Н), 3,30-3,39 (м, 2Н), 3,01 (шир.с, 1Н), 2,62-2,81 (м, 2Н), 2,35-2,43 (м, 1Н), 2,20-2,31 (м, 1Н). ИК 3000-3400 (шир.), 1676, 1501 см-1. MS (FAB) 489 (МН+).
Анализ: Вычислено для C27H28N4O5 • 1,0С2НF3О2 • 0,5Н2O: С 56,95, H 4,94, N 9,16. Найдено: С 57,32, H 4,96, N 8,78.
Соединение 118
Метил-4-{ 2-[4-(3-хлорбензил) -3,
4-дигидро-3-оксо-2Н- 1,4-бензоксазин-2-ил] этокси}фенилацетат

Получен способом L, который был модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с метил-4-гидроксифенилацетатом при кипячении с обратным холодильником в течение ночи и выделен в виде белого твердого продукта с выходом 38%, т.пл. 94-95oС;1H ЯМР (CDCl3) δ 7,13-7,25 (м, 5Н), 7,03-7,11 (м, 1Н), 6,81-7,01 (м, 6Н), 5,17 (д, J=16,2 Гц, 1Н), 5,08 (д, J=16, 2 Гц, 1Н), 4,94 (дд, J=3,9, 9,4 Гц, 1Н), 4,16-4,30 (м, 2Н), 3,67 (с, 3Н), 3,57 (с, 2Н), 2,53-2,64 (м, 1Н), 2,33 (ддт, J=9,6, 14,5, 4,8 Гц, 1Н). ИК 1736, 1673, 1502 см-1. MS 466 (МН+), 300 (основание).
Анализ: Вычислено для С26Н24ClNO5: С 67,02, H 5,19, N 3,01. Найдено: С 66,78, H 5,20, N 2,94.
Соединение
119
4-{2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин-2-ил] этокси}фенилуксусная кислота
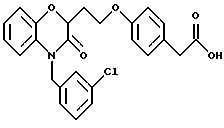
Получена из соединения 118 способом О, но продукт был подкислен концентрированной НCl. Кислота получена в виде белого твердого продукта с выходом 95%, т. пл. 144-145oС;1H ЯМР (DMSO-d6) δ 7,19-7,24 (м, 5Н), 7,11-7,13 (м, 1Н), 6,88-7,01 (м, 5Н), 6,83 (д, J=7,3 Гц, 1Н), 5,16 (д, J=16,3 Гц, 1Н), 5,07 (д, J= 16,3 Гц, 1Н), 4,93 (дд, J=5,4, 9,4 Гц, 1Н), 4,19-4,23 (м, 2Н), 3,61 (с, 2Н), 2,51-2,58 (м, 1Н), 2,31-2,34 (м, 1Н). ИК 3000-3200 (шир.), 1714, 1609 см-1. MS 452 (МН+).
Анализ: Вычислено для C25H22ClNO5: С 66,45, H 4,91, N 3,10. Найдено: С 66,15, H 4,66, N 3,03.
Соединение 120
Метил-3-{ 4-{ 2-[4-(3- хлорбензил)-3,
4-дигидро -3-оксо-2Н-1,4-бензоксазин-2- ил]этокси}фенил}пропионат
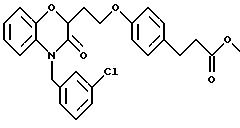
Получен способом L, который был модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с метил-3-(4-гидроксифенил)пропионатом при кипячении с обратным холодильником в течение ночи и выделен в виде белого твердого продукта с выходом 45%, т.пл. 88-89oС;1H ЯМР (CDCl3) δ 7,14-7,25 (м, 3Н), 7,10 (д, J=8,6 Гц, 2Н), 6,93-7,00 (м, 4Н), 6,80-6,86 (м, 3Н), 5,15 (д, J=16,3 Гц, 1Н), 5,09 (д, J=16,3 Гц, 1Н), 4,94 (дд, J=4,0, 9,8 Гц, 1Н), 4,18-4,23 (м, 2Н), 3,67 (с, 3Н), 2,89 (т, J=7,8 Гц, 2Н), 2,52-2,62 (м, 3Н), 2,21-2,28 (м, 1Н). ИК 1734, 1677, 1502 см-1. MS 480 (МН+).
Анализ: Вычислено для C27H26ClNO5 • 0,25Н2O: С 66,94, H 5,51, N 2,89. Найдено: С 66,75, H 5,36, N 2,82.
Соединение 121
3-{ 4-{2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин-2-ил] этокси}фенил}пропионовая кислота
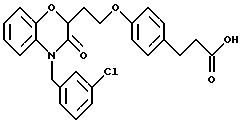
Получена из соединения 120 способом О, но продукт был подкислен концентрированной НCl, и выделена в виде белого твердого продукта с выходом 90%, т. пл. 141-143oС;1H ЯМР (DMSO-d6) δ 7,30-7,41 (м, 3Н), 7,20-7,23 (м, 1Н), 7,16 (д, J=8,1 Гц, 2Н), 3,93-7,10 (м, 4Н), 6,87 (д, J=8,1 Гц, 2Н), 5,23 (д, J= 16,0 Гц, 1Н), 5,15 (д, J=16,0 Гц, 1Н), 5,00 (дд, J=4,2, 8,9 Гц, 1Н), 4,10-4,21 (м, 2Н), 2,68-2,75 (м, 3Н), 2,30-2,52 (м, 3Н), 2,12-2,27 (м, 1Н). ИК 2900-3100 (шир.), 1721, 1686, 1502 см-1. MS 466 (MH+), 300 (основание).
Анализ: Вычислено для C26H24ClNO5 • 0,5H2O: С 65,75, H 5,31, N 2,95. Найдено: С 65,97, H 5,05, N 2,89.
Соединение 122
Метил-3-{ 2-[4-(3-хлорбензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин-2- ил]этокси}фенилацетат
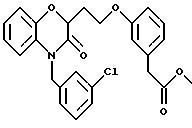
Получен способом L, который был модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с метил-3-гидроксифенилацетатом при кипячении с обратным холодильником в течение ночи, и выделен в виде белого твердого продукта с выходом 48%, т.пл. 80-82oС;1H ЯМР (CDCl3) δ 7,13-7,24 (м, 6Н), 6,81-7,01 (м, 6Н), 5,17 (д, J=16,2 Гц, 1Н), 5,08 (д, J= 16,2 Гц, 1Н), 4,94 (дд, J=3,8, 9,3 Гц, 1Н), 4,20-4,28 (м, 2Н), 3,70 (с, 3Н), 3,60 (с, 2Н), 2,57-2,61 (м, 1Н), 2,29-2,37 (м, 1Н). ИК 1735, 1680, 1503 см-1. MS 466 (МН+).
Анализ: Вычислено для C26H24ClNO5: С 67,02, H 5,19, N 3,01. Найдено: С 66,66, H 5,31, N 2,90.
Соединение 123
3-{ 2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н-1,4 -бензоксазин-2-ил] этокси} фенилуксусная кислота

Получена из соединения 122 способом О, но продукт был подкислен концентрированной НCl, и выделена в виде бледно-розового аморфного твердого продукта с выходом 87%;1H ЯМР (DMSO-d6) δ 7,22-7,29 (м, 4Н), 7,10-7,13 (м, 1Н), 6,80-7,03 (м, 7Н), 5,17 (д, J=16,3 Гц, 1Н), 5,07 (д, J=16,3 Гц, 1Н), 4,94 (дд, J=3,9, 9,3 Гц, 1Н), 4,20-4,28 (м, 2Н), 3,63 (с, 2Н), 2,53-2,59 (м, 1Н), 2,33 (ддт, J=14,5, 9,5, 4,8 Гц, 1Н). ИК 2950-3100 (шир.), 1728, 1659, 1502 см-1. MS 452 (МН+).
Анализ: Вычислено для C25H22ClNO5 • 0,6H2O: С 64,89, H 5,05, N 3,03. Найдено: С 64,62, H 4,91, N 2,95.
Соединение 124
Метил-4-{ 4-{2-[4-(3- хлорбензил)-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин -2-ил]этокси}фенил}бутират
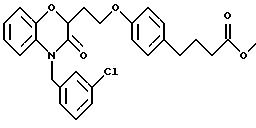
Получен способом L, который был модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с метил-3-(4-гидроксифенил)бутиратом при кипячении с обратным холодильником в течение ночи, и выделен в виде светлого аморфного твердого продукта с выходом 46%;1H ЯМР (CDCl3) δ 7,10-7,20 (м, 3Н), 6,99-7,08 (м, 3Н с 2Н дублет (J=8,5 Гц) при δ 7,03), 6,83-6,94 (м, 3Н), 6,75-6,80 (м, 3Н с 2Н дублет (J=8,5 Гц) при δ 6,78), 5,09 (д, J=16,4 Гц, 1Н), 5,00 (д, J=16,4 Гц, 1Н), 4,94 (дд, J=3,9, 9,2 Гц, 1Н), 4,10-4,25 (м, 2Н), 3,60 (с, 3Н), 2,41-2,52 (м, 3Н), 2,20-2,35 (м, 3Н), 1,89 (квинтет, J= 7,5 Гц, 2Н). ИК 1732, 1681, 1502 см-1. MS 494 (МН+).
Соединение 125
4-{ 4-{2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин-2-ил] этокси}фенил}масляная кислота
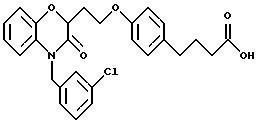
Получена из соединения 124 способом О, но продукт был подкислен концентрированной НCl, и выделена в виде белого твердого продукта с выходом 83%, т.пл. 129-130oС;1H ЯМР (DMSO-d6) δ 6,99-7,25 (м, 7Н с 2Н дублет (J=8,5 Гц) при δ 7,10), 6,91-6,96 (м, 3Н), 6,81-6,87 (м, 3Н, с, 2Н, дублет (J=8,5 Гц) при δ 6,84), 5,16 (д, J=16,3 Гц, 1Н), 5,08 (д, J=16,3 Гц, 1H), 4,94 (дд, J=3,8, 9,4 Гц, 1H), 4,18-4,26 (м, 2Н), 2,58-2,64 (м, 3Н), 2,25-2,39 (м, 3Н), 1,94 (квинтет, J=7,5 Гц, 2Н). ИК 2900-3050 (шир.), 1697, 1678, 1503 см-1. MS 480 (МН+), 422 (основание).
Анализ: Вычислено для C27H26ClNO5: С 67,57, H 5,46, N 2, 92. Найдено: С 67,19, H 5,39, N 2,78.
Соединение 126
Метил-3-[3-[2-{ 4-(3- хлорбензил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин-2 -ил}этокси]фенил]пропионат

Получен способом L, который был модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с метил-3-(3-гидроксифенил)пропионатом при кипячении с обратным холодильником в течение ночи, и выделен в виде белого твердого продукта с выходом 51%, т.пл. 92-94oС;1 H ЯМР (CDCl3) δ 6,91-7,24 (м, 8Н), 6,76-6,83 (м, 4Н), 5,18 (д, J=16,1 Гц, 1H), 5,08 (д, J= 16,1 Гц, 1H), 4,94 (дд, J=3,9, 9,4 Гц, 1H), 4,21-4,28 (м, 2Н), 3,68 (с, 3Н), 2,93 (т, J=7,8 Гц, 2H), 2,63 (т, J=7,8 Гц, 2H), 2,53-2,59 (м, 1H), 2,33 (ддт, J=9,4, 14,2, 4,7 Гц, 1H). ИК 1724, 1677, 1503 см-1. MS 480 (МН+).
Анализ: Вычислено для C27H26ClNO5: С 67,57, H 5,46, N 2,92. Найдено: С 67,38, H 5,51, N 2,71.
Соединение 127
3-[3-[2-{ 4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,
4-бензоксазин-2-ил} этокси] фенил]пропионовая кислота
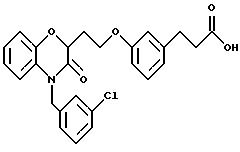
Получена из соединения 126 способом О, но продукт был подкислен концентрированной НCl, и выделена в виде белого твердого продукта с выходом 93%, т. пл. 118-119oС;1H ЯМР (DMSO-dб) δ 7,18-7,24 (м, 4Н), 7,10-7,12 (м, 1Н), 6,90-7,04 (м, 3Н), 6,77-6,83 (м, 4Н), 5,16 (д, J=16,0 Гц, 1Н), 5,07 (д, J=16,0 Гц, 1Н), 4,95 (дд, J=3,8, 9,6 Гц, 1Н), 4,21-4,29 (м, 2Н), 2,94 (т, J= 7,5 Гц, 2Н), 2,67 (т, J=7,5 Гц, 2Н), 2,53-2,57 (м, 1Н), 2,32 (ддт, J=9,8, 14,5, 4,7 Гц, 1Н). ИК 3000-3200 (шир.), 1691, 1679, 1501 см-1. MS 466 (МН+).
Анализ: Вычислено для C26H24ClNO5: С 67,02, H 5,19, N 3,01. Найдено: С 66,63, H 5,17, N 2,87.
Соединение 128
Метил-2-{ 2-[4-(3-хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,
4-бензоксазин-2-ил] этокси}фенилацетат
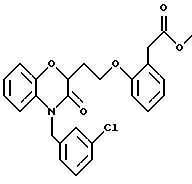
Получен способом L, который модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с метил-2-гидроксифенилацетатом при кипячении с обратным холодильником в течение ночи, и выделен в виде желтого масла.1H ЯМР (CDCl3) δ 7,09-7,39 (м, 6Н), 6,81-7,04 (м, 6Н), 5,18 (д, J= 16,3 Гц, 1Н), 5,07 (д, J=16,3 Гц, 1Н), 4,92 (дд, J=3,8, 9,6 Гц, 1Н), 4,21-4,32 (м, 2Н), 3,60 (с, 2Н), 2,54-2,62 (м, 2Н), 2,33 (ддт, J=14,4, 9,6, 4,9 Гц, 1Н).
Соединение 129
2-{ 2-[4-(3-Хлорбензил)-3,4 -дигидро-3-оксо-2Н-1,4 -бензоксазин-2-ил] этокси}фенилуксусная кислота
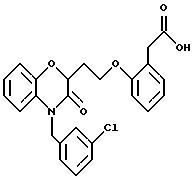
Получена из соединения 128 способом О, но продукт был подкислен концентрированной НCl, и выделена в виде белого твердого продукта с выходом 89%, т. пл. 140-142oС;1H ЯМР (DMSO-d6) δ 7,07-7,25 (м, 6Н), 6,84-7,00 (м, 6Н), 5,13 (с, 2Н), 5,01 (дд, J=4,0, 9,2 Гц, 1Н), 4, 20-4,34 (м, 2Н), 3,68 (д, J= 16,0 Гц, 1Н), 3,59 (д, J=16,0 Гц, 1H), 2,40-2,59 (м, 1Н), 2,28-2,38 (м, 1H). ИК 3000-3200 (шир.), 1722, 1677, 1498 см-1. MS 452 (МН+), 300 (основание).
Анализ: Вычислено для C25H22ClNO5 • 0,2Н2О: С 65,92, H 4,96, N 3,07. Найдено: С 65,75, H 4,99, N 2,88.
Соединение 130
4-{ 2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин-2- ил] этокси}бензальдегид

Получен способом L, который был модифицирован путем сочетания промежуточного продукта 10488-22 (ссылочный пример 66) с 4-гидроксибензальдегидом при кипячении с обратным холодильником в течение ночи. Продукт был выделен в виде белого твердого продукта после хроматографии с выходом 30%, т.пл. 130-131oС;1Н ЯМР (CDCl3) δ 9,89 (с, 1H), 7,85 (д, J=8,8 Гц, 2Н), 7,23-7,30 (м, 3Н), 7,10-7,15 (м, 1H), 6,92-7,05 (м, 5Н), 6,83 (дд, J=1,4, 8,7 Гц, 1H), 5,20 (д, J=16,2 Гц, 1H), 5,07 (д, J=16,2 Гц, 1H), 4,93 (дд, J=4,1, 9,1 Гц, 1H), 4,25-4,42 (м, 2Н), 2,58-2,70 (м, 1H), 2,40 (ддт, J=10,0, 14,2, 5,0 Гц, 1H). ИК 1700, 1674, 1598 см-1. MS 422 (МН+).
Анализ: Вычислено для C24 H20ClNO4: С 68,33, H 4,78, N 3,32. Найдено: С 68,01, H 4,82, N 3,27.
Соединение 131
Метил-2-[4-{ 2-[4-(3- хлорбензил)-3,4-дигидро -3-оксо-2Н-1,
4-бензоксазин-2 -ил]этокси)фенил]гликолят
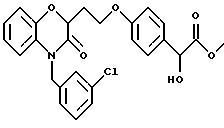
Бромоформ (0,31 мл, 3,54 ммоль) добавляли по каплям в атмосфере азота к соединению 130 (1,15 г, 2,73 ммоль), хлориду лития (0,231 г, 5,45 ммоль), гидроксиду калия (0,611 г, 10,9 ммоль) и воде (4 мл) в диоксане (4 мл). После нагревания на масляной бане при 40oС в течение ночи реакционную смесь подкисляли до рН 1 при помощи НCl (1 н.) и экстрагировали этилацетатом (2х100 мл). Объединенные органические слои промывали водой (2 х 50 мл), сушили (МgSO4), фильтровали и выпаривали, получая неочищенную гидроксикислоту в виде желтого масла. К сырой кислоте добавляли раствор ацетилхлорида (0,4 мл) в метаноле (10 мл) и реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Метанол выпаривали и остаток растворяли в эфире (200 мл). Раствор промывали насыщенным NаНСО3 (2 х 50 мл), сушили (MgSO4), фильтровали и выпаривали. α-Гидроксиэфир получали после хроматографии на силикагеле (элюирование смесью этилацетат/CH2Cl2) с общим выходом 52%.1H ЯМР (СDCl3) δ 7,32 (д, J=8,7 Гц, 2Н), 7,23-7,26 (м, 3Н), 7,10-7,15 (м, 1Н), 6,93-7,03 (м, 3Н), 6,91 (д, J=8,7 Гц, 2Н), 6,81-6,89 (м, 1Н), 5,18 (д, J=16,2 Гц, 1Н), 5,13 (д, J=5,6 Гц, 1Н), 5,07 (д, J=16,2 Гц, 1H), 4,93 (дд, J=3,9, 9,4 Гц, 1Н), 4,17-4,32 (м, 2Н), 3,76 (с, 3Н), 3,40 (д, J= 5,6 Гц, 1Н, обменный), 2,53-2,64 (м, 1Н), 2,33 (ддт, J=14,4, 9,4, 4,8 Гц, 1Н).
Соединение 132
2-[4-{ 2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н- 1,4-бензоксазин-2-ил] этокси} фенил]гликолевая кислота

Получена из соединения 131 способом О, но продукт был подкислен концентрированной НCl, и выделена в виде бледно-желтого твердого продукта с выходом 85%, т. пл. 54-56oС;1H ЯМР (DMSO-d6) δ 7,36 (д, J=8,6 Гц, 2Н), 7,23-7,26 (м, 4Н), 7,09-7,12 (м, 1Н), 6,81-7,01 (м, 5Н), 5,20 (с, 1Н), 5,16 (д, J= 16,6 Гц, 1Н), 5,07 (д, J=16,6 Гц, 1Н), 4,93 (дд, J=4,0, 9,2 Гц, 1Н), 4,20-4,27 (м, 2Н), 3,20 (шир.с, 1Н, обменный), 2,53-2,62 (м, 1Н), 2,30-2,38 (м, 1Н). ИК 3300-3400 (шир. ), 2800-3150 (шир.), 2800-3150 (шир.), 1731, 1671, 1512 см-1. MS (FAB) 468 (МН+), 300 (основание).
Анализ: Вычислено для C25H22ClNO6 • 0,5H2 O: С 62,96, H 4,86, N 2,94. Найдено: С 62,80, H 4,99, N 2,92.
Соединение 133
Метил-2-хлор-2-[4-{ 2-[4-(3- хлорбензил)-3,4-дигидро -3-оксо-2Н-1,4-бензоксазин-2
-ил]этокси}фенил]ацетат
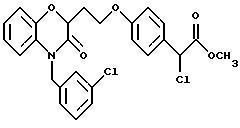
Тионилхлорид (0,091 мл, 1,24 ммоль), затем пиридин (0,093 мл, 1,15 ммоль) добавляли к соединению 130 (0,460 г, 0,95 ммоль) в бензоле (10 мл) в атмосфере азота при комнатной температуре. После перемешивания в течение ночи растворитель выпаривали и остаток выливали в воду (50 мл). Эту смесь экстрагировали этилацетатом (2 х 50 мл). Объединенные органические слои промывали водой (3 х 50 мл), сушили (МgSO4), фильтровали и выпаривали, получая соответствующий хлорид в виде прозрачного геля с выходом 82%;1H ЯМР (DMSO-d6) δ 7,42 (д, J=8,7 Гц, 2Н), 7,23-7,29 (м, 3Н), 7,11-7,15 (м, 1Н), 6,99-7,03 (м, 2Н), 6,90-6,97 (м, 3Н с 2Н дублет (J=8,7 Гц) при δ 6,92), 6,82 (д, J= 7,4 Гц, 1Н), 5,34 (с, 1H), 5,18 (д, J=16,2 Гц, 1Н), 5,08 (д, J=16,2 Гц, 1H), 4,93 (дд, J= 4,0, 9,4 Гц, 1H), 4,19-4,33 (м, 2Н), 3,78 (с, 3Н), 2,54-2,65 (м, 1H), 2,34 (ддт, J=14,3, 9,4, 4,8 Гц, 1H).
Соединение 134
5-[4-{ 2-[4-(3-Хлорбензил) -3,4-дигидро-3-оксо-2Н -1,4-бензоксазин-2-ил] этокси}фенил]тиазолидин
-2,4-дион

Тиомочевину (56 мг, 0,74 ммоль) добавляли к соединению 133 (0,185 г, 0,37 ммоль) в 2-метоксиэтаноле (3 мл). Реакционную смесь нагревали на масляной бане при 110oС в течение 3 ч. После охлаждения добавляли НCl (1 н., 2,5 мл) и реакционную смесь нагревали при 100o С в течение ночи. Охлажденную реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (2 х 50 мл). Органические слои промывали водой (3 х 50 мл), сушили (МgSO4), фильтровали и выпаривали, получая тиазолидиндион в виде бледно-желтой пены с выходом 64%, т.пл. 70-72oС;1H ЯМР (DMSO-d6) δ 8,05 (шир.с, 1Н), 7,35 (д, J= 8,7 Гц, 2Н), 7,23-7,25 (м, 3Н), 7,11-7,15 (м, 1Н), 6,81-7,02 (м, 5Н с 2Н дублет (J= 8,7 Гц) при δ 6,96), 6,83 (д, J=8,6 Гц, 1Н), 5,36 (с, 1Н), 5,19 (д, J= 16,2 Гц, 1Н), 5,07 (д, J=16,2 Гц, 1Н), 4,94 (дд, J=4,0, 9,1 Гц, 1Н), 4,22-4,30 (м, 2Н), 2,54-2,62 (м, 1Н), 2,32-2,40 (м, 1Н). ИК 1756, 1698, 1500 см-1. MS 509 (MH+).
Соединение 135
3,4-Дигидро-2-{
2-[4-(2- гуанидиноэтил)фенокси] этил}-6-метилсульфонамидо-4-(3- хлорбензил)-3-оксо -2Н-1,4-бензоксазин
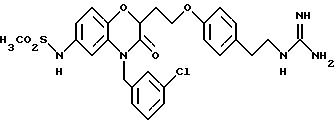
Способ Р: Соединение 92 нагревали при кипячении с обратным холодильником с метансульфонилхлоридом (1 экв) и DMAP (1,1 экв) в CH2Cl2 (10 мл) в течение 10 часов. Получаемую смесь разбавляли водой и указанное в заголовке соединение выделяли фильтрованием, т. пл. (разложение) >121oС; ИК (КВr) 3240, 1667, 1613, 1512, 1475, 1349, 1245, 1178, 865 см-1;1H ЯМР (DMSO-d6) δ 9,63 (шир.с, 1H), 8,07 (шир.с, 1Н), 7,43 (шир.с, 2Н), 7,35 (м, 4Н), 7,20 (м, 3Н), 7,01 (д, 1H, J=8,6 Гц), 6,89 (м, 2Н), 6,82 (дд, 2Н, J=2,2, 8,5 Гц), 5,16 (д, 1H, J=16,5 Гц), 5,03 (д, 1H, J=16,5 Гц), 4,97 (дд, 1H, J=4,2, 8,8 Гц), 4,16 (м, 2Н), 3,25 (м, 2Н), 2,79 (с, 3Н), 2,70 (т, 2Н, J=7,2 Гц), 2,35 (м, 1H), 2,22 (м, 1H).
Анализ: Вычислено для С27Н30СlN5O5S • 1,7НCl: С 51,15, H 5,04, N 11,05. Найдено: С 51,47, H 5,14, N 10,78.
Соединение
136
2-{ 2-[4-(2-(N,N-Бис-трет- бутоксикарбонилгуанидино) этил)-фенокси]этил} -3,4-дигидро -4-(3-метилсульфонамидобензил)-3- оксо-2Н-1,4-бензоксазин
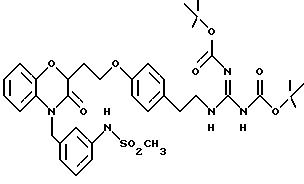
Получен из соединения 101 способом Р в виде рыжевато-коричневого твердого продукта (разлож.) >79oС; MS (FAB) MH+ 738; ИК (КВr) 3325, 2977, 1723, 1687, 1612, 1501, 1410, 1330, 1245, 1151, 1057, 971, 688 см-1;1H ЯМР (СDCl3) δ 11,47 (шир.с, 1H), 8,37 (шир.т, 1H), 7, 31 (м, 1H), 7,11 (м, 4Н), 7,05-6,89 (м, 3Н), 6,83 (м, 3Н), 6,45 (шир.с, 1H), 5,14 (д, 2Н, J=7,2 Гц), 4,94 (дд, 1H, J=4,0, 9,3 Гц), 4,20 (м, 2Н), 3,62 (м, 2Н), 2,94 (с, 3Н), 2,81 (т, 2Н, J= 7,2 Гц), 2, 55 (м, 1Н), 2,34 (м, 1H), 1,60 (шир.с, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Анализ: Вычислено для С37Н47N5О9S • 0,9Н2O: С 58, 93, H 6,52, N 9,29. Найдено: С 59,19, H 6,58, N 9,00.
Соединение 137
2-{ 2-[4-(2-Гуанидиноэтил)фенокси] этил}-3,4-дигидро-4-(3- метилсульфонамидобензил)-3 -оксо-2Н-1,
4-бензоксазин

Получен из соединения 136 способом К с выходом 94%, т.пл. (разложение) > 95oС; MS (FAB) MH+ 538; ИК (KBr) 3156, 1664, 1500, 1468, 1402, 1327, 1243, 1147, 1052, 978, 751, 690, 514 см-1;1H ЯМР (DMSO-d6) δ 9,82 (шир.с, 1H), 7,64 (шир. т, 1H), 7,55-6,85 (шир.с, 3Н), 7,28 (т, 1H, J=7,8 Гц), 7,20 (д, 2Н, J=8,5 Гц), 7,09 (с, 1H), 7,05 (м, 2Н), 6,99 (м, 4Н), 6,92 (д, 2Н, J=8,5 Гц), 5,19 (д, 1H, J=16,6 Гц), 5,09 (д, 1H, J=16,6 Гц), 4,94 (дд, 1H, J=4,11, 9,0 Гц), 4,19 (м, 2Н), 3,33 (м, 2Н), 2,93 (с, 3Н), 2,72 (т, 2Н, J=7,4 Гц), 2,32 (м, 1H), 2,22 (м, 1H).
Анализ: Вычислено для C27 H31N5O5S: С 55,32, H 5,93, N 11,32. Найдено: С 55,34, H 5,86, N 11,34.
Соединение 138
2-{ 2-[4-[2-(N,
N-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -3,4-дигидро-3 -оксо-4-пентил-2Н-1,4-бензоксазин
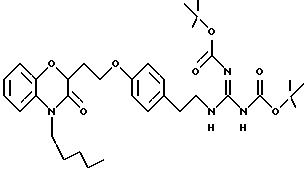
Получен из 10840-185 (ссылочный пример 60) способом L с использованием равных эквивалентов реагентов и был выделен с выходом 42% в виде белой пены после хроматографии на SiO2 (гексан/CH2Cl2, 1/3); ИК (КВr) 3334, 2977, 2932, 2872, 1685, 1639, 1615, 1501, 1409, 1366, 1331, 1131, 1058, 748 см-1;1H ЯМР (CDCl3) δ 0, 91 (т, J=6,8 Гц, 3Н), 1,32-1,40 (м, 4Н), 1,48 (с, 9Н), 1,51 (с, 9Н), 1,61-1,72 (м, 2Н), 2,17-2,30 (м, 1Н), 2,43-2,55 (м, 1Н), 2,81 (т, J=7,2 Гц, 2Н), 3,63 (кв, J=7,1 Гц, 2Н), 3,92 (т, J=6,8 Гц, 2Н), 4, 13-4,25 (м, 2Н), 4,79 (дд, J= 9,20, 4,0 Гц, 1Н), 6,84 (д, J=8,5 Гц, 2Н), 6,96-7,07 (м, 4Н), 7,12 (д, J=8,6 Гц, 2Н), 8,37 (шир.т, J=4,3 Гц, 1Н), 11,48 (шир.с, 1Н).
Анализ: Вычислено для C34H48N4O7: С 65,36, H 7,74, N 8,97. Найдено: С 65,23, H 7,70, N 8,98.
Соединение 139
3,4-Дигидро-2-{
2-[4-(2- гуанидиноэтил)фенокси] этил} -4-(4-нитробензил)-3- оксо-2Н-1,4-бензоксазин

Получен из соединения 93 способом К в виде твердого продукта с выходом 68%, т. пл.: разлож. при >101oС; MS (FAB) MH+ при 525; ИК (КВr) 3433, 1671, 1600, 1525, 1501, 1468, 1398, 1344, 1253, 1065, 894, 810 см-1;1H ЯМР (DMSO-d6/TMS) δ 8,20 (д, 2Н, J=8,2 Гц), 7,54 (д, 2Н, J=8,5 Гц), 7,45-6,60 (оч.шир.с, 4Н), 7,38 (с, 1Н), 7,29 (с, 1Н), 7, 18 (м, 2Н), 7,05 (м, 2Н), 6,97 (м, 3Н), 5,36 (д, 1Н, J=18,0 Гц), 5,22 (1Н, J=18,0 Гц), 4,99 (м, 1Н), 4,26 (м, 2Н), 3,35 (м, 2Н), 2,68 (т, 2Н, J=6,3 Гц), 2,40 (м, 1Н), 2,28 (м, 1Н).
Соединение 140
2-{ 2-[4-[2-(N,N-Бис-трет- бутоксикарбонилгуанидино)-этил] фенокси]этил} -3,4-дигидро -4-(4-метоксибензил)-3-оксо -2Н-1,4-бензоксазин
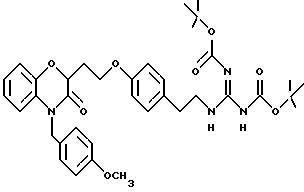
Получен способом L с использованием промежуточного продукта 10508-19 (ссылочный пример 47) и N, N'-ди-трет-бутоксикарбонил-2-(4-гидроксифенил)этилгуанидина. Указанное в заголовке соединение получено в виде белой пены.
Анализ: Вычислено для С27Н46N4O8: С 65,86, H 6,87, N 8,3. Найдено: С 65,51, H 7,02, N 8,27.
Соединение 141
3,4-Дигидро-4-(2,4- дихлорбензил)-2-{ 2-[4-(2- гуанидиноэтил)-фенокси] этил}-3
-оксо-2Н-1,4-бензоксазин
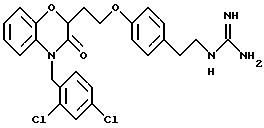
Получен способом L с использованием промежуточного продукта 10005-181-1 (ссылочный пример 48) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)эгилгуанидина и способом К и выделен в виде твердого продукта.
Анализ: Вычислено для С26Н426Сl2N4O3 • НCl • 0,75Н2O: С 55,43, H 5,10, N 9,94. Найдено: С 55,43, H 5,05, N 9,75.
Соединение 142
2-[2-[4-(3-Аминопропил) фенокси]этил]4-(4- хлорбензил)-3,4-дигидро-3 -оксо-2Н-1,4-бензоксазин
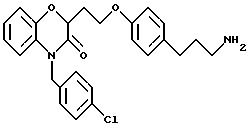
Получен из промежуточного продукта 10353-28-1 (ссылочный пример 41) и 4-[3-(N-трет-бутоксикарбониламино) пропил]фенола способами J и К. Указанное в заголовке соединение получали в виде желтого твердого продукта (выход 11%), т. пл. = 95-97oС; MS (FAB) МН+ 451; ИК (KBr) 1250, 1400, 1500, 1590, 1680, 2040, 2950, 3400 см-1;1H (ЯМР) 7,40 (д, J=8,47 Гц, 2Н), 7,30 (д, J= 8,48 Гц, 2Н), 2,62 (т, J=7,54 Гц, 2Н), 2,76 (т, J=7,52 Гц, 2Н), 7,23 (т, J= 8,12 Гц, 1Н), 6,81 (д, J=7,37 Гц, 3Н), 7,91 (шир.с, 2Н), 6,99-7,08 (м, 4Н), 4,19-4,20 (м, 2Н), 2,33-2,49 (м, 1H), 2,19-2,30 (м, 1Н), 1,82-1,87 (м, 2Н), 5,18 (дд, J=16,48 и 23,23 Гц, 2Н), 4,98 (дд, J=4,15 и 8,75 Гц, 1Н).
Анализ: Вычислено для С26Н28N2O3Сl2: С 62,68, H 5,91, N 5,62. Найдено: С 62,97, H 5,78, N 5,37.
Соединение 143
2-{ 2-[4-(2-(N,N-Бис-трет- бутоксикарбонилгуанидино) этил)-фенокси]этил} -3,4
-дигидро-7-нитро-4-(2- нитробензил)-3-оксо- 2Н-1,4-бензоксазин
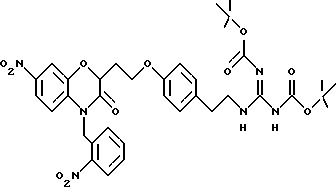
Получен способом L с использованием промежуточного продукта 11653-142 (ссылочный пример 69) и N, N'-ди-трет-бутоксикарбонил -2-(4-гидроксифенил)этилгуанидина и способом К. Указанное в заголовке соединение получено в виде белого твердого продукта с выходом 13%, т.пл.: разложение при >128oС; MS (FAB) MH+ 735; ИК (KBr) 3323, 3087, 2977, 1723, 1690, 1641, 1613, 1530, 1513, 1476, 1418, 1395, 1240, 1154, 941 см-1;1H ЯМР (CDCl3/TMS) δ 11,43 (с, 1H), 8,37 (шир.т, 1Н), 8,24 (дд, 1Н, J=2,1, 7,4 Гц), 7,94 (д, 1H, J=2,5 Гц), 7,84 (дд, 1H, J=2,5, 8,9 Гц), 7,52 (м, 2Н), 7,14 (д, 2Н, J=8,6 Гц), 7,08 (д, 1H, J=9,1 Гц), 6,84 (д, 2Н, J=8,6 Гц), 6,77 (д, 1H, J=8,9 Гц), 5,68 (д, 1H, J= 18,1 Гц), 5,56 (д, 1H, J=18,1 Гц), 5,10 (дд, 1Н, J=4,0, 8,9 Гц), 4,23 (м, 2Н), 3,64 (м, 2Н), 2,82 (т, 2Н, J=7,3 Гц), 2,63 (м, 1Н), 2,40 (м, 1Н), 1,50 (с, 9Н), 1,48 (с, 9Н).
Соединение 144
2-[2-[4-[2-(трет- Бутоксикарбониламино)этил)
фенокси]этил}-4-(3- хлорбензил)-3,4-дигидро-3- оксо-2Н-1,4-бензоксазин
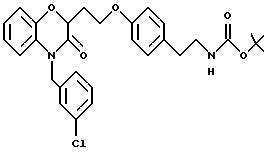
Метансульфонилхлорид (0,8 мл, 1,5 экв) добавляли в виде одной порции к раствору промежуточного продукта 10353-191-1 (2,0 г, 1 экв, ссылочный пример 40), DMAP (0,33 г, 0,4 экв) и триэтиламина (1,2 мл, 1,5 экв) в 30 мл CH2Cl2. Эту смесь перемешивали в течение 15 мин и разбавляли равной частью воды. Образуемый органический слой промывали солевым раствором, сушили (MgSO4) и концентрировали в вакууме, получая мезилат. Этот мезилат обрабатывали 4-[2-(N-трет-бутоксикарбониламино) -этил] фенолом по процедурам способа L, получая указанное в заголовке соединение в виде твердого продукта, т.пл. 91-92oС.
Соединение 145
2-[2-[4-(2-Гуанидиноэтил) фенокси]этил]-4-(2- хлорбензил)-6-метил-3,4-дигидро -2Н-1,4-бензоксазин

Получен способом L с использованием промежуточного продукта 10353-76 (ссылочный пример 89) и N, N'-ди-трет-бутоксикарбонил- 2-(4-гидроксифенил)этилгуанидина и способом К со следующими модификациями. Бис-Вос-защищенный продукт сочетания Mitsunobu выделяли растворением остатка, являющегося сырым продуктом, в водном метаноле и обработкой раствора добавляемым по каплям 2 н. NaOH до достижения основности раствора. Осадок собирали фильтрованием. Получаемый продукт растворяли в эфире, промывали последовательно 1 н. НCl, насыщенным NаНСО3 и солевым раствором, сушили над Na2SO4, концентрировали в вакууме и использовали без дальнейшей очистки. Продукт с удаленной защитной группой выделяли в виде бикарбонатной соли (бледно-коричневый твердый продукт) с выходом 22%. Продукт давал один гомогенный пик при анализе ВЭЖХ на C18-колонке 15 см при элюировании смесью Н2O (5% NH4OH, 5% НОАс)/СН3СN, 55/45; MS (CI) 451 (MH+); ИК (KBr) 3314, 3036, 2923, 1682, 1608, 1581, 1511, 14658, 1443, 1392, 1352, 1302, 1244, 1223, 1175, 1046, 742 см-1.
Соединение 146
2-{ 2-[4-[2-(N,N-Бис-трет- бутоксикарбонилгуанидино)этил] -фенокси]этил} -4-(3- хлорбензил)-3,4-дигидро-6-метокси
-3-оксо-2Н-1,4-бензоксазин
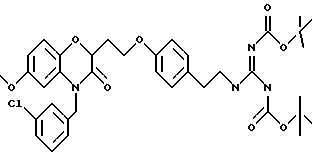
Получен из промежуточного продукта 12168-25-1 (ссылочный пример 43) и N, N'-ди-трет-бутоксикарбонил-2- (4-гидроксифенил)-этилгуанидина способом L с выходом 92%. Кристаллизация из смеси этанол/Н2О давала чистый продукт в виде белого твердого вещества. ЯМР (CDCl3) δ 11,28 (с, 1Н), 7,23 (м, 3Н), 7,12 (м, 1Н), 7,12 (д, J=9,0 Гц, 2Н), 6,94 (д, J=8,9 Гц, 1Н), 6,86 (д, J=9,0 Гц, 2Н), 6,51 (дд, J=8,4, 2,9 Гц, 1H), 6,41 (д, J=2,1 Гц, 1H), 5,15 (д, J=16,9 Гц, 1H), 5,05 (д, J=16,9 Гц, 1H), 4,89 (дд, J=10,0, 4,1 Гц, 1H), 4,20 (м, 2Н), 3,64 (м, 2Н), 2,82 (кажущийся т, J=7,3 Гц, 2Н), 2,55 (м, 1H), 2,32 (м, 1H), 1,52 (с, 9Н), 1,50 (с, 9Н).
Соединение 147
4-{ 3-Хлорбензил)-3,4-дигидро -2-{2-[4-(2-гуанидиноэтил) -фенокси]этил} -6-метокси-3 -оксо-2Н-1,4-бензоксазин
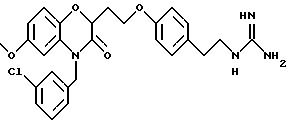
Получен из соединения 146 способом К и выделен растиранием с диэтиловым эфиром в виде гигроскопичного рыжевато-коричневого твердого продукта с выходом 76%; ЯМР (DMSO-d6) δ 7,43 (шир.с, 1H), 7,4-6,5 (оч.шир.с, 4Н), 7,35 (м, 3Н), 7,22 (м, 1H), 7,19 (д, J=8,5 Гц, 2H), 6,98 (д, J=8,6 Гц, 1H), 6,96 (д, J= 8,5 Гц, 2H), 6,61 (д, J=2,5 Гц, 1H), 2,58 (дд, J=9,0, 3,1 Гц, 1H), 5,21 (д, J=17,0 Гц, 1H), 5,18 (д, J=17,0 Гц, 1H), 4,96 (дд, J=8,8, 4,1 Гц, 1H), 4,19 (м, 2H), 3,64 (с, 3Н), 3,30 (м, 2Н), 2,40 (кажущийся т, J=6,8 Гц, 2Н), 2,39 (м, 1Н), 2,23 (м, 1Н).
Соединение 148
2-{ 2-[4-(2-Гуанидиноэтил) фенокси] этил}-3,4-дигидро -6-фтор-4-(3-нитробензил)-3 -оксо-2Н-1,4-бензоксазин
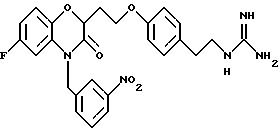
Получен из соединения 102 способом К. Указанное в заголовке соединение получали в виде твердого продукта: т.пл.: разложение при >76oС; MS (FAB) МН+ 508; ИК (КВr) 3349, 3180, 2932, 2872, 1621, 1531, 1506, 1469, 1296, 948, 838 см-1;1H (ЯМР) δ 8,20 (с, 1Н), 8,13 (д, 1Н, J=7,9 Гц), 7,66 (м, 2Н), 7,53 (шир.с, 1Н), 7,50-6,60 (оч.шир.с, 3Н), 7,19 (д, 2Н, J=8,4 Гц), 7,09 (м, 2Н), 6,90 (д, 2Н, J=8,4 Гц), 6,85 (м, 1Н), 5,32 (с, 2Н), 5,01 (дд, 1Н, J=4,3, 8,7 Гц), 4,18 (м, 2Н), 3,28 (м, 2Н), 2,71 (т, 2Н, J=7,2 Гц), 2,39 (м, 1Н), 2,25 (м, 1Н).
Реферат
Изобретение относится к новым бензоксазиновым и пиридооксазиновым соединениям формулы I, где часть Q - конденсированный фенил или конденсированный пиридил; Z1 - водород, галоген, C1-С6 алкил, фенил, нитро, сульфониламино или трифторметил; Z2 - водород или галоген; Х - водород или кислород; А - C1-С6-алкил, С1-С6-алкиларил или C1-С6 -алкилгетероциклил, где арил и гетероциклил описаны в формуле изобретения, n = 0 - 3; Y - часть, описанная в формуле изобретения, и их фармацевтически приемлемым солям, эфирам и пролекарственным формам. Также раскрыты способы их получения, промежуточные соединения, фармацевтические композиции на их основе, обладающие антибактериальной активностью, и способы лечения бактериальных инфекций. Изобретение может быть использовано в медицине в качестве антиинфекционных средств. 10 с. и 22 з.п.ф-лы, 2 табл.

Формула

где часть Q - конденсированный фенил или конденсированный пиридил;
Z1 - водород, галоген, C1-С6 алкил, фенил, нитро, сульфониламино или трифторметил;
Z2 - водород или галоген;
Х - водород или кислород;
А - C1-C6алкил, C1-C6алкиларил или C1-С6алкилгетероциклил, где арил представляет бифенил, нафтил или фенил и гетероциклил представляет 5-членную насыщенную гетероциклическую группу, содержащую атом серы, или 6-членную насыщенную гетероциклическую группу, содержащую атом азота, где эта арильная или гетероциклильная группа необязательно замещена (C1-C6) алкилом, оксибензилом, фенокси, гидрокси, алкокси, галогеном, двумя атомами галогена, нитро, карбоксилом, карбо (C1-C4) алкокси или метилсульфониламино;
n = 0-3;
Y - часть, выбранная из
(a) NHR1R2, N+R1R2R3
(б)

(г) CH(R6)CO2H, СН(Rб)СO2СН3;
(д) остатка формулы
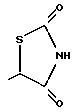
где R1, R2 и R3, независимо - водород, C1-C6 алкил или трет-бутоксикарбонил; R4 и R5, независимо - трет-бутоксикарбонил или водород; R6 - водород, гидрокси или хлор;
и их фармацевтически приемлемых солей, эфиров и пролекарственных форм.
a) NHR1R2, N+R1R2R3;
б)

(г) CH(R6)CO2H;
(д) остатка формулы
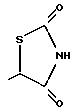
где R1, R2 и R3 независимо - водород, C1-C6алкил или трет-бутоксикарбонил; R4 и R5 независимо - трет-бутоксикарбонил или водород; R6 - водород или гидрокси,
и его фармацевтически приемлемые соли, эфиры и пролекарственные формы.
(a) NHR1R2, N+R1R2R3;
б)
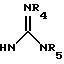
(г) СН(Rб)СO2Н;
(д) остатка формулы
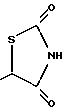
где R1, R2 и R3 независимо - водород, C1 -С6алкил или трет-бутоксикарбонил; R4 и R5 независимо - трет-бутоксикарбонил или водород; R6 - водород или гидрокси;
и его фармацевтически приемлемые соли, эфиры и пролекарственные формы.

где часть Q - конденсированный фенил или конденсированный пиридил;
Z1 - водород, галоген, C1-C6алкил, фенил, нитро, сульфониламино или трифторметил;
Z2 - водород или галоген;
Х - водород или кислород;
А - C1 -C6алкил, C1-C6алкиларил или C1-C6алкилгетероциклил, где арил представляет бифенил, нафтил или фенил и гетероциклил представляет 5-членную насыщенную гетероциклическую группу, содержащую атом серы, 6-членную насыщенную гетероциклическую группу, содержащую атом азота, где эта арильная или гетероциклильная группа необязательно замещена C1-С6алкилом, оксибензилом, фенокси, гидрокси, алкокси, галогеном, двумя атомами галогена, нитро, карбоксилом, карбо(C1-C4)алкокси или метилсульфониламино;
n = 0-3;
Y - часть, выбранную из
(а) NHR1R2, N+R1R2Rз;
(б)
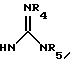
(г) СН(R6)СO2Н; СН(R6)СO2СН3;
(д) остатка формулы

где R1, R2 и R3 независимо - водород, C1-C6алкил или трет-бутоксикарбонил; R4 и R5 независимо - трет-бутоксикарбонил или водород; R6 - водород, гидрокси или хлор,
и их фармацевтически приемлемых солей, эфиров и пролекарственных форм, который заключается в реакции соединения формулы

с соединением формулы

где остаток Y защищен или незащищен,
в подходящем растворителе в присутствии подходящего фосфина и азодикарбонильного реагента и, когда Y защищен, удалении защитной группы и выделении соединения формулы I.
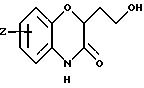
который заключается во взаимодействии соединения формулы
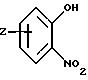
с соединением формулы
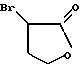
в присутствии подходящего основания для получения соединения формулы

и затем циклизации этого соединения подходящим восстановителем для получения соединения формулы

29. Способ получения соединения формулы
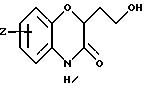
который заключается во взаимодействии соединения формулы

с соединением формулы

в подходящем основании.

где часть Q - фенил или пиридил;
Z1 - водород, галоген, C1-C6 алкил, фенил, нитро, сульфониламино или трифторметил;
Z2 - водород или галоген.
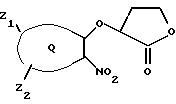
где часть Q - фенил или пиридил;
Z1 - водород, галоген, C1-С6алкил, фенил, нитро, сульфониламино или трифторметил;
Z2 - водород или галоген;
А - C1-C6алкиларил или C1-С6алкилгетероциклил, где арил - бифенил, нафтил или фенил и гетероциклил представляет 5-членную насыщенную гетероциклическую группу, содержащую атом серы, или 6-членную насыщенную гетероциклическую группу, содержащую атом азота, где эта арильная или гетероциклильная группа необязательно замещена (C1-С6)алкилом, оксибензилом, фенокси, гидрокси, алкокси, галогеном, двумя атомами галогена, нитро или карбоксилом, кapбo(C1-С4)алкокси или метилсульфониламино.
Документы, цитированные в отчёте о поиске
Оптически активные производные пиридобензоксазина или их соли
Патенты аналоги
Оптически активные производные пиридобензоксазина или их соли

Комментарии