Производные 2,4-оксазолидиндиона или их фармацевтически приемлемая соль, способы их получения, лекарственная композиция, оказывающая гипогликемическое и гиполипидемическое действие, способ снижения содержания сахара и липидов в крови при лечении млекопит - RU2126797C1
Код документа: RU2126797C1
Чертежи








Описание
Изобретение касается новых производных оксазолидиндионов, снижающих содержание сахара и липидов в крови, метода их получения и применения в качестве лекарственных препаратов для лечения диабета.
В качестве препаратов для лечения диабета до сих пор используются соединения на основе бигуанида и сульфонилмочевины. Однако соединения на основе бигуанида вряд ли используются в настоящее время, так как они вызывают молочный ацидоз, сульфонилмочевины, обладающие сильным снижающим уровень сахара в крови действием, часто вызывают резкую гипогликемию и требуют поэтому особого внимания при применении.
С другой стороны, производные тиазолидиндиона и оксазолидиндиона, снижающие уровень сахара и липидов в крови, лишены этих недостатков.
Например, JPA H3 (1991)-170478 и W09202520-A1 описывают производные 2,4-оксазолидиндиона, содержащие заместители в 5-положении, серию производных 5-(замещенный бензил)-2,4-оксазолидиндиона, JPb S62(1987)-30993 описывает производные 2, 4-оксазолидиндиона, замещенные в 5-положении алициклической группой, и JPB S63(1988)-35632 описывает производные 2,4-оксазолидиндиона, замещенные в 5-положении замещенным ароматическим кольцом.
Авторы настоящего изобретения широко изучали производные 2,4-оксазолидиндиона и нашли, что новые производные, содержащие в 5-положении 2,4-оксазолидиндионового кольца прямой или разветвленный углеводородный остаток, замещенный фенилом или пиридилом, например 2-(замещенный фенил или замещенный пиридил)этил группа, 3-(замещенный фенил или замещенный пиридил)пропил группа, 4-(замещенный фенил или замещенный придил)бутил группа, 5-(замещенный фенил или замещенный пиридил)пентил группа и т.д., обладают действием, снижающим уровень сахара и липидов в крови, таким образом настоящее изобретение заполняется.
Настоящее изобретение касается:
1. Производных 2,4-оксазолидиндиона общей формулы:

где R - углеводородный остаток или гетероциклическая группа, каждый из которых может быть замещенным;
Y является -CO-CH(OH) или -NR3- (где R3 - алкил, который может быть замещенным);
m - 0 или 1;
n - 0, 1 или 2;
X - CH или N;
A - двухвалентный прямой или разветвленный углеводородный остаток, имеющий от 1 до 7 атомов углерода;
R1 и R2 каждый является водородом или алкилом, или R1 и R2 комбинируются друг с другом с образованием 5- 6-членного гетероциклического остатка, возможно содержащего азот; L и M каждый является водородом, или L и M вместе образуют связь, или их фармацевтически приемлемые соли.
2. Медицинских препаратов, содержащих в качестве эффективного компонента производные 2,4-оксазолидиндиона, выраженные общей формулой (I) или их фармацевтически приемлемые соли.
3. Методa лечения млекопитающих, страдающих диабетом и гиперлипидемией, состоящего во введении им эффективного количества соединения формулы (I) или его фармацевтически пригодной соли.
4. Использования соединения формулы (I) или его фармацевтически пригодной соли для производства лекарственного препарата для лечения млекопитающих, страдающих диабетом или гиперлипидемией.
5. Методов получения производных 2,4-оксазолидиндиона общей формулы (I).
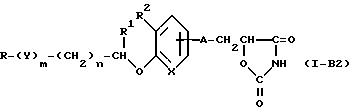
Соединения, выраженные общей формулой (I), включают соединения, показанные следующими формулами - (1-A1), (1-A2) и (1-A3).



где каждый символ имеет значение, приведенное выше. Среди соединений (1-A1), (1-A2) и (1-A3), соединения (1-A1) и (1-A2) - предпочтительны и соединения (1-A1) - наиболее предпочтительны с точки зрения фармакологической активности, токсичности и побочного действия. Соединения формулы (I), где L и M образуют вместе связь, выражаются следующей формулой:

где каждый символ имеет значение, приведенное выше. Соединения формулы (I), где L и M каждый является водородом, выражаются следующей формулой:
где каждый символ имеет значение, приведенное выше.
Заместители R1 и R2 в формуле (I), представляющие собой алкил группы, имеют от 1 до 4 атомов углерода, это - метил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил и т.д.
Приведенная выше общая формула (1-B1) представляет собой как (E) так и (Z)-изомеры относительно двойной связи в 5-положении 2,4-оксазолидиндионового кольца.
В соответствии с приведенной выше общей формулой (I) для случая, когда R1 и R2 вместе образуют 5-или 6-членное гетероциклическое кольцо возможно содержащее N, такие соединения выражаются следующими общими формулами.
(I) R1 и R2 вместе образуют 5-членное гетероциклическое кольцо.


(2) R1 и R2 вместе образуют 6-членное гетероциклическое кольцо.



(3) R1 и R2 вместе образуют 5-членное гетероциклическое кольцо, содержащее азот.
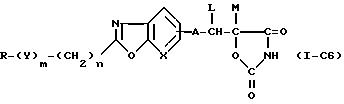
(4) R1 и R2 вместе образуют 6-членное кольцо, содержащее азот.


где D - водород или низший алкил, а другие символы имеют значения, приведенные выше.
Среди приведенных выше соединений от (1-C1) до (1-C8), наиболее предпочтительны соединения, выраженное формулами (1-C1), (1-C2), (1-CЗ) и (1-C6).
В приведенной выше общей формуле (I) в качестве углеводородного заместителя в углеводородном остатке, который может быть замещенным, выраженного символом R, выступает алифатический углеводородный остаток, алициклический углеводородный остаток, алициклический-алифатический углеводородный остаток, ароматический алифатический остаток, ароматический углеводородный остаток и ароматические алифатические углеводороды.
В качестве алифатических углеводородных остатков применяют остатки, имеющие от 1 до 8 атомов углерода, включая насыщенные алифатические углеводородные остатки, имеющие от 1 до 8 атомов углерода, например метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, октил и ненасыщенные алифатические углеводородные остатки, имеющие от 2 до 8 атомов углерода, например этенил, 1-пропенил, 2-пропенил, 3-бутенил, 2-метил-1-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 3-метил-2-бутенил, 1-гексенил, 3-гексенил, 3,4-гексадиенил, 5-гексенил, 1-гептенил, 1-октенил, этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2 бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4- пентинил, 1-гексинил, 3-гексинил, 2,4-гексадиинил, 5-гексинил, 1-гептинил, 1-октинил.
В качестве алициклических углеводородных остатков применяют остатки, имеющие от 3 до 7 атомов углерода, включая насыщенные алициклические углеводородные остатки, содержащие от 3 до 7 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и ненасыщенные алициклические углеводородные остатки, содержащие от 5 до 7 атомов углерода, например 1-циклопентил, 2-циклопентенил, 3-циклопентенил, 1-циклогексенил, 2-циклогексенил, 3-циклогексенил, 1-циклогептенил, 2-циклогептенил, 3-циклогептенил, 2,4-циклогептадиенил.
В качестве алициклических-алифатических углеводородных остатков применяют остатки, которые образуются при комбинации приведенных выше алициклических углеводородных групп с алифатическими углеводородными остатками, такие остатки включают от 4 до 9 атомов углерода, примерами служат циклопропилметил, циклопропилэтил, циклобутиметил, циклопентилметил, 2-циклопентенилметил, 3-циклопентенилметил, циклогексилметил, 2-циклогексенилметил, 3-циклогексенилметил, циклогексенилэтил, циклогексилэтил, циклогексилпропил, циклогептилметил и циклогептилэтил.
В качестве ароматических алифатических остатков применяют фенилалкилы, имеющие от 7 до 9 атомов углерода, например бензил, фенэтил, 1-фенилэтил, 3-фенилпропил, 2-фенилпропил и 1-фенилпропил, и нафтилалкилы, содержащие от 7 до 9 атомов углерода, например α- нафтилметил, α - нафтилэтил, β- нафтилметил, β- нафтилэтил. В качестве ароматических углеводородных остатков применяют, например фенил, нафтил (α-нафтил,β- нафтил) и другие.
В качестве ароматических гетероциклических-алифатических углеводородных остатков, которые образуются при комбинации гетероциклической группы, приведенной ниже, с выше названными алифатическими углеводородными остатками, применяют остатки, указанные как следует ниже.
В приведенной выше общей формуле (I) в качестве гетероциклического остатка в замещенной гетероциклической группе, который может быть замещенным, выраженного символом R, выступает, например 5- -7-членная гетероциклическая группа, содержащая один атом серы, атом азота или атом кислорода, 5- -6-членная гетероциклическая группа, содержащая 2-4 атомов азота, 5- -6-членная гетероциклическая группа, содержащая 1-2 атомов азота и атом серы или атом кислорода.
Эти гетероциклические группы могут быть сконденсированы с 6-членным кольцом, содержащим один или два атомов азота, бензольным кольцом или 5-членным кольцом, содержащим один атом серы.
Примерами таких гетероциклических групп являются 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 3-пиридазинил, 4-пиридазинил, 2-пиразинил, 2-пирролил, 3-пирролил, 2-имидазолил, 4-имидизолил, 5-имидазолил, 3-пиразолил, 4-пиразолил, изотиазолил, изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1,2,4- триазол-3-ил, 1,3,4-триазол-2-ил, 1,2,4-триазол-4-ил, тетразол-5-ил, бензимидазол-2-ил, индол-3-ил, бензпиразол-3-ил, 1H-пирроло[2,3-b]пиразин-6-ил, 1H-имидазо[4,5-b]пиридин-2-ил, 1H-имидазо[4,5-c]пиридин-2-ил, 1H-имидазо[4,5-b]пиразин-2-ил и т.д.
В приведенной выше общей формуле (I) углеводородный остаток и гетероциклический остаток, выраженные символом R, возможно имеют 1-3 заместителя в положениях, способных замещаться.
В качестве таких заместителей упоминаются алифатическая углеводородная группа, алициклическая углеводородная группа, арильная группа, ароматическая гетероциклическая группа, неароматическая гетероциклическая группа, атом галогена, нитрогруппа, возможно замещенная аминогруппа, возможно замещенная ацилгруппа, возможно замещенная гидроксилгруппа, возможно замещенная тиолгруппа и возможно этерифицированная карбоксильная группа.
В качестве алифатической углеводородной группы упоминаются прямые цепочки или разветвленные алифатические углеводородные группы, содержащие 1-15 атомов углерода, например алкилгруппа, предпочтительно алкилгруппа, имеющая 1- 20 атомов углерода, алкенилгруппа, предпочтительно алкенилгруппа, имеющая 2-10 атомов углерода, и алкинилгруппа, предпочтительно алкинилгруппа, имеющая 2-10 атомов углерода.
Предпочтительные примеры алкильной группы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 2-этилбутил, пентил, октил, нонил, децил.
Предпочтительные примеры алкенил группы включают винил, аллил, изопентил, 1-пропенил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-этил-1-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 2-гексенил, 3- гексенил, 5-гексенил.
Предпочтительные примеры алкинил группы включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3- бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил.
В качестве алициклической углеводородной группы упоминаются насыщенные и ненасыщенные углеводородные алициклические группы, содержащие 3-12 атомов углерода, например циклоалкилгруппы, циклоалкенилгруппы, циклоалкадиенилгруппы.
Предпочтительными примерами циклоалкил группы являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, бицикло [2.2.1] гептил, бицикло [2.2.2] октил, бицикло [3.2.1] октил, бицикло [3.2.1] нонил, бицикло [3.3.1] нонил, бицикло [4.2.1] нонил, бицикло [4.3.1] децил и т.д.
Предпочтительные примеры циклоалкенил групп включают 2-циклопентен-1-ил, 3-циклопентен-1-ил, 2-циклогексен-1-ил и 3-циклогексен-1-ил.
Предпочтительные примеры циклоалкадиенил групп включают 2,4-циклопентадиен-1-ил, 2, 4-циклогексадиен-1-ил, 2,5-циклогексадиен-1-ил. Вышеназванная арильная группа означает моноциклическую или конденсированную полициклическую ароматическую углеводородную группу.
Предпочтительными примерами арильных групп являются группы, содержащие 6-14 атомов углерода, такие как фенил, нафтил, фенантрил, антрил, аценафтиленил. Среди них наиболее предпочтительны фенил, 1-нафтил и 2-нафтил.
Предпочтительные примеры ароматических гетероциклических групп включают ароматические моноциклические гетероциклические группы, такие как фурил, тиенил, пирролил, оксазолил, изооксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, фуразанил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1, 2,3-триазолил, 1,2,4-триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил; ароматические конденсированные гетероциклические группы, такие как бензофуранил, изобензофуранил, бензо [b] тиенил, индолил, изоиндолил, IH-индазолил, бензоимидазолил, бензоксазолил, 1,2-бензоксазолил, бензотиазолил, 1,2-бензоизотиазолил, IH-бензотриазолил, хинолил, изохинолил, циннолинил, хинизолинил, хиноксалинил, фталазинил, нафтилидинил, пуринил, птеридинил, карбазолил, α-карболинил,β- карболинил, γ-/ карболинил, акридинил, феноксазинил, фенотиазинил, феназинил, феноксатиинил, тиантренил, фенантридинил, фенантролинил, индолизинил, пирроло [1,2-b] пиридазинил, пиразоло [1,5-a] пиридил, имидазо [1,2-a] пиридил, имидазо [1,5-a] пиридил, имидазо [1,2-b] пиридазинил, имидазо [1,2-b] пиримидинил, 1,2,4-триазоло [4,3-a] пиридил и 1,2,4-триазоло [4,3-b] пиридазинил и т.д.
Предпочтительными примерами неароматических гетероциклических групп являются оксиранил, азетидинил, оксетанил, тиетанил, пирролидинил, тетрагидрофуранил, тиоланил, пиперидил, тетрагидропиранил, морфолинил, тиомофолинил, пирролидино, пиперидино, морфолино и пиперазинил.
Примеры галогена включают фтор, хлор, бром и иод. Среди них фтор и хлор особенно предпочтительны. Понятие возможно замещенные группы включает незамещенную аминогруппу и замещенную аминогруппу.
В качестве замещенной аминогруппы упоминается аминогруппа (-NH2), в которой один или два алкила, имеющих 1-10 атомов углерода, алкенила, имеющих 1-10 атомов углерода, одна или две ароматических групп или ацилгрупп, имеющих 2-10 атомов углерода (например метиламино, диметиламино, этиламино, диэтиламино, дибутиламино, диаллиламино, циклогексиламино, фениламино, N-метил-N-фениламино, ацетиламино, пропиониламино, бензоиламино и т.д.) являются замещенными. Понятие возможно замещенной ацилгруппы включает незамещенную ацилгруппу и замещенную ацилгруппу.
В качестве незамещенной аминогруппы упоминается формил и группы, образованные из (C1-C10) алкил, (C6-C12) алкенил или (C6-C12) ароматической группы с карбонилгруппой (например ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, гептаноил, октаноил, циклобутаноил, циклопентаноил, циклогексаноил, циклогептаноил, кротонил, 2-циклогексенкарбонил, бензоил, никотиноил).
Замещенная ацилгруппа включает ацилгруппы, упомянутые при описании незамещенной аминогруппы, которые имеют заместитель(ли), такие как алкил, содержащий 1-3 атомов углерода, алкоксил, содержащий 1-3 атомов углерода, галоген (например хлор, бром и т.д.) нитро, гидрокси, амино и т.д. Понятие возможно замещенная гидроксил группа включает незамещенную гидроксильную группу и замещенные гидроксилгруппы.
В качестве замещенной гидроксильной группы упоминаются такие группы, которые имеют по гидроксилу заместитель, особенно приемлемы защитные группы гидроксила, как например алкокси, алкенилокси, аралкилокси, ацилокси и арилокси.
Предпочтительные примеры алкоксила включают группы, имеющие 1-10 атомов углерода (например метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентокси, изопентокси, неопентокси, гексилокси, гептилокси, нонилокси, циклобутокси, циклопентокси и циклогексилокси).
В качестве алкенилокси упоминаются группы, имеющие 1-10 атомов углерода, включая например аллилокси, кротилокси, 2-пентенилокси, 3-гексенилокси, 2-циклопентенилметокси и 2-циклогексенилметокси, и в качестве аралкилокси упоминаются, например фенил-(C1-C4)алкилокси (например бензилокси и фенэтилокси).
Предпочтительные примеры ацилокси включают алканоилокси, имеющие 2-4 атомов углерода (например ацетилокси, пропионилокси, бутирилокси и изобутирилокси). В качестве арилокси среди других упоминается 4-лорфенокси.
В понятие возможно замещенная тиолгруппа включается, кроме тиолгруппы, также тиол, замещенный приемлемым заместителем, особенно предпочтительны защитные группы тиола, как например алкилтио, аралкилтио и ацилтио.
Предпочтительные примеры алкилтио включают алкилтио группы, имеющие 1-10 атомов углерода (например метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, вторбутиотио, трет-бутилтио, пентилтио, изопентилтио, неопентилтио, гексилтио, гептилтио, нонилтио, циклобутилтио, циклопентилтио, циклогексилтио.
В качестве аралкилтио упоминаются, например фенил(C1-C4) алкилтио (например бензилтио и фенэтилтио). Предпочтительные примеры ацилтио включают алканоилтио, имеющие 2-4 атомов углерода(например ацетилтио, пропионилтио, н-бутирилтио и изо-бутирилтио).
В качестве возможно этерифицированной карбоксильной группы упоминается, например алкоксикарбонил (например группы, имеющие 2-5 атомов углерода, такие как метоксикарбонил, этоксикарбонил, пропоксикарбонил и бутоксикарбонил), аралкилоксикарбонил (например бензилоксикарбонил) и арилоксикарбонил (например феноксикарбонил и п-толилоксикарбонил).
В приведенной выше общей формуле (I) заместители на углеводородном остатке и гетероциклической группе, обозначенных символом R, где они являются алициклической углеводородной группой, арильной группой, ароматической гетероциклической группой или неароматической гетероциклической группой, могут иметь предпочтительно 1-3 подходящих заместителя.
Примерами таких заместителей являются низший алкил, содержащий 1-4 атомов углерода, низший алкенил, имеющий 2-5 атомов углерода, низший алкинил, имеющий 2-5 атомов углерода, циклоалкилгруппа, содержащая 3-5 атомов углерода, арилгруппа (например фенил, нафтил и т.д.), ароматическая гетероциклическая группа (например тиенил, фурил, пиридил, оксазолил, тиазолил и т. д. ), неароматическая гетероциклическая группа (например тетрагидрофуранил, морфолинил, пиперидино, пирролидино, пиперазино и т.д.), аралкилгруппа, имеющая 7-9 атомов углерода, н-моно(C1-C4)-алкиламиногруппа, N,N-ди(C1-C4)-алкил аминогруппа, амидиногруппа, ацилгруппа, имеющая 2-5 атомов углерода, карбамоилгруппа, N-моно-(C1-C4)-алкил карбамоилгруппа, N,N-ди(C1-C4)-алкил карабамоилгруппа, сульфамоилгруппа, N-моно(C1-C4)-алкил сульфамоилгруппа, N, N-ди(C1-C4)алкилсульфамоил группа, карбоксилгруппа, низший алкоксикарбонилгруппы, имеющие 2-5 атомов углерода, гидроксилгруппа, низший алкоксигруппа, имеющая 1-4 атомов углерода, низший алкенилоксигруппа, имеющая 2-5 атомов углерода, циклоалкилоксигруппы, имеющие 3-7 атомов углерода, аралкилоксигруппы, имеющие 7-9 атомов углерода, арилоксигруппы (например фенилокси, нафтилокси и т.д.), меркаптогруппа, низший алкилтиогруппы, имеющие 1-4 атомов углерода, аралкилтиогруппы, имеющие 7-9 атомов углерода, арилитиогруппы (например фенилтио, нафтилтио, и т.д.), сульфогруппа, цианогруппа, азидогруппа, нитрогруппа, нитрозогруппа и галоген (например фтор, хлор, бром, иод).
В приведенной выше формуле (I), когда каждый m и n = 0, то углерод с заместителем R1 прямо связан с R; когда m - 0 и n - 1 или 2, то R прямо связан с (CH2)n-; когда m - 1 и n - О, то Y прямо связан с углеродом заместителя R1.
Y = -CO-, -CH(OH)- или -N(R3)-, предпочтительно -CH(OH) или -N(R3)-. Алкилгруппа, обозначенная R3, имеет 1-4 атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и т.д.
В качестве заместителя алкила указывается атом галогена (например фтор, хлор, бром, иод), алкоксигруппа, имеющая 1-4 атомов углерода, (например метокси, этокси, пропокси, н-бутокси, трет-бутокси и т.д.), гидроксил, нитро, ацилгруппа, имеющая 1-4 атомов углерода (например формил, ацетил, пропионил и т.д.).
Двухвалентный прямой или разветвленный углеводородный линейный остаток, обозначенный символом А, включает насыщенный остаток (например -CH2-, -(CH2)2-, -CH(CH3)-, (CH2 )3, -CH(C2H5)-, (CH2)4-, (CH2)5-, (CH2)6- и (CH2)7-) и ненасыщенный остаток (например -CH=CH-, -C(CH3)=CH-, -CH=CH-CH2-, -C(C2H5)= CH-, -CH2-CH=CH-CH2-, -CH2-CH2-CH=CH-CH2-, -CH=CH-CH=CH=-CH2-, -CH=CH-CH=CHCH=CH-CH2-.
В формуле (1-C8)алкилгруппа, обозначенная символом D, имеет 1-4 атомов углерода, например метил, этил, н-пропил, изо-пропил, н-бутил.
В качестве солей соединения (I) этого изобретения предпочтительны фармацевтически приемлемые соли, например соли с неорганическими основаниями, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами и соли с основными кислотными аминокислотами.
Предпочтительные примеры солей с неорганическими основаниями включают соли щелочных металлов, такие как соли натрия и соли калия; соли щелочноземельных металлов, такие как соли кальция и соли магния; соли алюминия, соли аммония и другие подобные.
Предпочтительными примерами солей с органическими основаниями являются, например соли с триэтиламином, триметиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином и N,N-дибензилэтилендиамином.
Предпочтительные примеры солей с неорганическими кислотами включают соли, например с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой и фосфорной кислотой.
Предпочтительными примерами солей с органическими кислотами являются соли, например с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой и п-толуолсульфоновой кислотой.
Предпочтительными примерами солей с основными аминокислотами являются соли например с аргинином, лизином, орнитином, с кислыми аминокислотами - соли с аспарагиновой кислотой и глутаминовой кислотой. Среди них наиболее предпочтительны соли натрия и калия.
Соединение (I) или его фармацевтически пригодные соли настоящего изобретения обладают действием, снижающим содержание сахара в крови, имеют низкую токсичность и могут использоваться в составах с, например, известными фармацевтически приемлемыми носителем, эксципиентом и наполнителем, в качестве лекарственного препарата для лечения диабета у млекопитающих, включая человека.
Соединение (I) или его фармацевтически приемлемая соль настоящего изобретения проявляют также улучшенную активность инсулиновой устойчивости и могут использоваться в качестве средства, снижающего давление.
Соединение (I) настоящего изобретения имеет низкую токсичность. Например, оральное введение мышам соединения примера 18 в дозе 15 мг/кг/день в течение 4 дней не вызывало изменения веса тела и веса печени в сравнении с контрольной группой.
Оральное введение соединения, полученного в примере 18 в дозе 100 мг/кг или внутрибрюшинно в дозе 50 мг/кг не вызывало смертельного исхода у тестируемых животных.
Введение обычно проводится орально в виде, например таблеток, капсул (включая мягкие капсулы и микрокапсулы), порошков и гранул, и в зависимости от случая, неорально в виде инъекций, суппозиториев и пиллет. Дозы для взрослых при оральном введении составляют от 0,05 до 10 мг/кг в день, желательно принимать три раза в день.
Соединение (I) этого изобретения, смешанное с фармацевтически приемлемыми носителями, может вводиться орально и неорально в виде твердых препаративных форм, таких как таблетки, капсулы, гранулы, порошки; или в виде жидких препаративных форм, таких как сиропы и инъекции.
В качестве фармацевтически приемлемых носителей используют обычные органические или неорганические носители для фармацевтических препаратов, точные, например эксципиенты, смазывающие вещества, связующие вещества и дезинтеграторы для твердых препаративных форм; растворители, разбавители, суспендирующие агенты, изотонические вещества, буферные агенты и местные анестезирующие агенты. И при необходимости, такие добавки как антисептики, антиоксиданты, красители и осветляющие агенты используются.
Предпочтительные эксципиенты включают лактозу, сахарозу, D-маннит, крахмал, кристаллическую целлюлозу и легкую двуокись кремния. Предпочтительными примерами смазывающих веществ являются стеарат магния, стеарат кальция, тальк и коллоидальный кремний.
Предпочтительные примеры связующих веществ включают кристаллическую целлюлозу, сахар, D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон.
Предпочтительными примерами дезинтеграторов являются крахмал, карбоксиметилцеллюлоза, карбоксиметилцеллюлоза кальция, кросскармелоза натрия и карбоксиметилкрахмал натрия.
В качестве предпочтительных растворителей применяют дистиллированную воду для инъекций, спирт, пропиленгликоль, макроголь, кунжутное масло, кукурузное масло.
В качестве предпочтительных примеров разбавителей используют полиэтиленгликоль, пропиленгликоль, D-маннит, бензиловый эфир бензойной кислоты, этанол, трис-аминометан, холестерол, триэтаноламин, карбонат натрия и цитрат натрия.
Предпочтительные примеры суспендирующих агентов включают поверхностно-активные вещества, такие как стеарилтриэтаноламина, лаурилсульфат натрия, лауриламинопропионат, лецитин, бензалконий хлорид, бензетоний хлорид, моностеарат глицерина; гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза.
Предпочтительными примерами изотонических веществ являются хлорид натрия, глицерин, D-маннит. Предпочтительными примерами буферных растворов являются фосфаты, ацетаты, карбонаты и цитраты. В качестве предпочтительных веществ для местной анестезии используют бензиловый спирт. В качестве антисептиков - эфиры параоксибензойной кислоты, хлорбутанол, бензиловый спирт, фенэтиловый спирт, дегидроуксусная кислота, сорбиновая кислота. Предпочтительными примерами антиоксидантов являются сульфиты и аскорбиновая кислота.
Далее следует описание методов получения соединения (I) этого изобретения.
Метод A

где каждый символ имеет значения, представленные выше.
Соединение (1-B1) может быть получено конденсацией соединения (II) с 2,4-оксазолидиндионом. Эта реакция выполняется в растворители в присутствии основания.
В качестве растворителя упоминаются спирты, такие как метанол, этанол, пропанол, изопропанол и 2-метоксиэтанол; ароматические углеводороды, такие как бензол, толуол и ксилол; эфиры, такие как эфир, изопропиловый эфир, диоксан и тетрагидрофуран; N,N-диметилформамид, диметилсульфоксид и уксусная кислота.
В качестве основания используются алкоксиды натрия (например метилат натрия, этоксилат натрия и т.д.), карбонат калия, карбонат натрия, гидрид натрия, ацетат натрия или вторичные амины, такие как пиперидин, пиперазин, пирролидин, морфолин, диэтиламин, диизопропиламин и другие.
Количество 2,4-оксазолидиндион составляет до 10 моль, преимущественно от 1 до 5 моль относительно соединения (II). Количество основания составляет от 0,01 до 5 моль, предпочтительно от 0,05 до 2 моль относительно соединения (II).
Эта реакция выполняется при температурах от 0 до 150oC, преимущественно от 20 до 100oC в течение периода от 0,5 до 30 ч.
Соединение (1-B1), полученное по приведенному выше методу, в некоторых случаях образовывало смесь (E)-соединения и (Z)- соединения относительной двойной связи в 5-положении 2,4-оксазолидиндионового кольца.
Метод B

где Z - водород, низший алкил или аралкил группа, а другие символы описаны выше.
В приведенной выше общей формуле (III) в качестве низшего алкила, обозначенного символом Z, упоминается алкил, имеющий 1-4 атомов углерода (например метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил). Аралкильная группа, обозначенная символом Z, представляет собой алкилгруппу, содержащую в качестве заместителя арилгруппу.
Примеры арилгруппы включают фенил, нафтил, которые возможно замещены приведенными выше алкилгруппами, имеющими 1-4 атомов углерода, галоген атомами (например фтор, хлор, бром, иод), гидроксилгруппой и нитрогруппой.
В качестве алкильной части аралкильной группы применяют алкилы, содержащие 1-4 атомов углерода, такие как метил, этил, пропил и т.д. Предпочтительными примерами аралкильной группы являются бензил, фенэтил, 3-фенилпропил, (1- нафтил)метил и (2--нафтил)метил и т.д. Среди них наиболее предпочтительны бензил и фенэтил группы.
Соль щелочного металла соединения (1-B2) может быть получена с помощью реакции соединения (III) с цианатом щелочного металла, например цианатом калия или цианатом натрия. Затем соль щелочного металла обрабатывают кислотой до образования соединения (1-B2). Реакцию соединения (III) с цианатом щелочного металла проводят в пригодном растворителе.
В качестве растворителя используют обычно спирты, такие как метанол, этанол, пропанол, изопропанол, 2-метоксиэтанол и бутанол, N,N-диметилформамид, диметилсульфоксид, ацетонитрил или подходящая смесь их. Цианат щелочного металла применяется в молярном соотношении от 1 до 10, предпочтительно от 1 до 5. Температура реакции изменяется в пределах от 0 до 150oC, предпочтительно 10 до 120oC, и реакция продолжается от 0,5 до 50 ч.
Полученная таким образом соль щелочного металла соединения (1-B2) обрабатывается кислотой с помощью обычных методов до образования соединения (1-B2). Обработка кислотой выполняется в присутствии или в отсутствии подходящего растворителя.
Примеры растворителя включают спирты, такие как метанол, этанол, пропанол, изопропанол, 2-метоксиэтанол и бутанол; ароматические углеводороды, такие как бензол, толуол и ксилол; эфиры, такие как этиловый эфир, изопропиловый эфир, диоксан и тетрагидрофуран; галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,1,2,2-тетрахлорэтан; этилацетат, ацетонитрил или их смесь.
В качестве кислоты используется предпочтительно избыточное количество неорганической кислоты, такой как хлористоводородная кислота, серная кислота, азотная кислота и бромистоводородная кислота, могут использоваться также органические кислоты, такие как уксусная кислота, лимонная кислота, винная кислота и другие подобные.
Полученное таким образом 2,4-оксазолидиндионовое производное (1-B2) может выделяться и очищаться с помощью обычных способов выделения и очистки, таких как концентрирование, концентрирование в вакууме, экстракция растворителем, перекристаллизация, фазовый переход, хроматография и другие.
Метод C

где A1 - насыщенный двухвалентный прямой или разветвленный углеводородный остаток, имеющий от 1 до 7 атомов углерода, а другие символы имеют значения, приведенные выше.
Насыщенный двухвалентный прямой или разветвленный остаток углеводородной цепочки, имеющий от 1 до 7 атомов, и обозначенный символом A является насыщенным, имеющий значения как определено для A.
При восстановлении соединения (1-B1) может быть получено соединение (1-B2a). Такое восстановление выполняют в соответствии с обычными методами, в присутствии катализатора в атмосфере водорода при 1-150 атм.
В качестве растворителя используют спирты, такие как метанол, этанол, пропанол, изопропанол и 2-метоксиэтанол, ароматические углеводороды, такие как бензол, толуол и ксилол, эфиры, такие как этиловый эфир, изопропиловый эфир, диоксан, тетрагидрофуран, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,1,2,2-тетрахлорэтан, этилацетат, N,N-диметилформамид, или их подходящая смесь.
Примеры предпочтительных катализаторов включают металлы, такие как соединения никеля и переходных металлов, таких как палладий, платина и родий. Температура реакции изменяется в пределах от 0 до 100oC, предпочтительно от 10 до 80oC. Время реакции изменяется от 0,5 до 50 ч.
Полученное таким образом производное 2,4-оксазолидиндиона (1-B2a) может выделяться и очищаться обычными методами выделения и очистки, такими как концентрирование, концентрирование в вакууме, экстракция растворителем, кристаллизация, перекристаллизация, фазовый переход и хроматография.
Метод D

где B представляет собой низший алкоксил, низший алкилтио или низший ацилокси; а другие символы описаны выше).
В качестве низшего алкокси, низшего алкилтио и низшего ацилокси, соответствующих обозначению B, упоминаются, например алкокси группы, имеющие 1-4 атомов углерода, такие как метокси, этокси, пропокси, изопропокси и бутокси; алкилтио, имеющие 1-4 атомов углерода, такие как метилтио, этилтио, пропилтио, изопропилтио, бутилтио; ацилтио группы, имеющие от 1 до 4 атомов углерода, такие как ацетилокси и пропионилокси.
Кроме того, два B заместителя могут комбинироваться друг с другом с образованием, например этилендиокси, пропилендиокси или дитиотриметилен. Другими словами, -CH(B)2 в формуле (IV) означает защитную альдегидную группу.
Соединение (IV) конденсируется с 2,4-оксазолидиндионом с образованием соединения (1-B1). Эта реакция конденсации выполняется по существу тем же способом, что и реакция соединения (II) с 2,4-оксазолидиндионом по методу A.
Метод E

где Q - уходящая группа и другие символы приведены выше.
В качестве уходящей группы, обозначенной символом Q, используется галоген (например хлор, бром, иод), метансульфонилокси, бензолсульфонилокси, п-толуолсульфонилокси.
Соединение (V) конденсируется с соединением (VI) с образованием соединения (1-D1). Эта реакция проводится обычным способом в подходящем растворителе в присутствии основания.
Примером растворителя являются ароматические углеводороды, такие как бензол, толуол, ксилол; эфиры, такие как диоксан, тетрагидрофуран и диметоксиэтан; кетоны, такие как ацетон и 2-бутанон; N,N-диметилформамид, диметилсульфоксид, хлороформ, дихлорметан, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан; подходящие смеси этих растворителей.
В качестве основания применяют соли щелочных металлов, такие как гидроокись натрия, гидроокись калия, карбонат калия и бикарбонат натрия, амины, такие как пиридин, триэтиламин, N,N-диметилформамид; гидроокиси металлов, такие как гидроокись натрия, гидроокись калия; этилат натрия, метилат натрия и трет-бутилат калия и другие.
Количество основания изменяется преимущественно в пределах от 1 до 5 молей относительно соединения (V). Эта реакция проводится обычно при температуре от -50oC до 150oC, предпочтительно от -10oC до 100oC. Время реакции изменяется от 0,5 до 30 часов.
Исходное соединение для метода A может быть получено по методу F.
Метод F
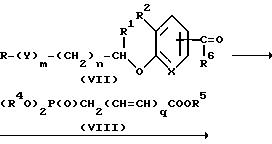



R4 и R5 независимо друг от друга представляют собой низший алкил; R6 - водород или низший алкил; q - 0, 1 или 2; другие символы приведены выше.
Примерами низших алкилов, обозначенных символами R4, R5 и R6, являются заместители, имеющие 1-4 атомов углерода, такие как метил, этил, пропил, изопропил и бутил.
Согласно этому методу, во-первых, формил или ацил производные (VII) реагируют с производными фосфоноуксусной кислоты или ω-/ фосфонокарбоновых кислот с образованием производных ненасыщенных эфиров (IX). Реакция (VII) с (VIII) выполняется обычным методом в подходящем растворителе в присутствии основания.
Примеры растворителя включают ароматические углеводороды, такие как бензол, толуол и ксилол; эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан; спирты, такие как метанол, этанол, пропанол; N,N-диметилформамид, диметилсульфоксид, хлороформ, дихлорметан, 1,2-дихлорэтан, 1,1,2, 2-тетрахлорэтан, также как подходящие их смеси.
Примерами оснований являются соли щелочных металлов, такие как гидроокись натрия, гидроокись калия, карбонат натрия и бикарбонат натрия; амины, такие как пиридин, триэтиламин и N,N-диметиланилин; гидриды металлов, такие как гидрид натрия, гидрид калия; этилат натрия, метилат натрия и трет-бутилат калия. Количество используемого основания составляет предпочтительно от 1 до 5 моль относительно соединения (VIII).
Количество используемого соединения (VIII) составляет от 1 до 5 моль, преимущественно от 1 до 3 относительно соединения (VII). Эта реакция обычно проводится при температурах от -50oC до 150oC, преимущественно от -10oC до 100oC. Время реакции изменяется от 0,5 до 30 часов.
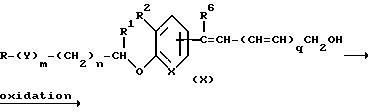
Затем соединение (IX) подвергается восстановлению для образования спиртового производного (X). Эта реакция может выполняться известными методами, например восстановлением гидридами металлов, восстановлением комплексом гидрида металла, восстановлением дибораном и замещенным бораном.
Другими словами, эта реакция может проводиться обработкой соединения (IX) восстановителем. Примерами восстановителя являются боргидриды металла (например борогидрид натрия и борогидрид лития); комплексы гидридов металлов, такие как алюмогидрид лития; дибораны, и использование диизобутилалюминий гидрида благоприятно для проведения реакции.
Эта реакция проводится в органическом растворителе, инертном к реакции. Примерами таких растворителей являются ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод, дихлорметан, 1,2-дихлорэтан и 1,1,2,2-тетрахлорэтан; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол, пропанол, изопропанол и 2-метоксиэтанол; амиды, такие как N,N-диметилформамид, или их пригодные смеси и среди этих растворителей выбирается для использования растворитель в зависимости от природы восстановителя.
Температура реакции изменяется от -20oC до 150oC, особенно предпочтительно 0oC до 100oC, время реакции изменяется от приблизительно 1 до 24 часов.
Затем соединение (X) подвергается окислению с образованием ненасыщенных производных альдегида (II-I). Эта реакция окисления проводится известными методами, например окисление с двуокисью марганца, окислением хромовой кислотой, окисление диметилсульфоксидом и другие.
Другими словами, эта реакция выполняется взаимодействием соединения (X) с окислителем. В качестве окислителей используют двуокись марганца или хромовый ангидрид.
Использование этих соединений предпочтительно для благоприятного проведения реакции. Эта реакция выполняется в органическом растворителе, инертном к реакции.
В качестве растворителя используются, например, ароматические углеводороды, такие как бензол, толуол или ксилол, галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод, дихлорметан, 1,2-дихлорэтан или 1,1,2,2-тетрахлорэтан, эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан, диметилсульфоксид или стабильная смесь этих растворителей, среди растворителей выбирают один в зависимости от природы окислителя.
Температура реакции меняется в ряду от -20oC до 150oC, особенно в ряду от 0oC до 100oC, и время реакции изменяется от 1 до 24 часов.
Затем соединение (II-1) подвергается реакции восстановления до получения соединения (II-2). Эта реакция восстановления выполняется тем же способом, что в методе C.
Таким образом, полученное производное альдегида (II-1), (II-2) выделяют и очищают обычными способами, такими как концентрирование, концентрирование в вакууме, экстракция растворителем, перекристаллизация, фазовый переход, хроматография и т.д.
Соединение (VII), которое является исходным соединением в для метода F, может быть синтезировано в соответствии с методом, описанным, например, в Chemical Pharmaceutical Bulletin, Vol. 39, p. 1440(1990), JPA H4 (1992)-225978, HPA S61(1986)-85372, HPA S61 (1986)-271287, HPA S63(1988)-139182, HPA H3(1191)-170478, W09119496-A1, EP-428312-A, HPA H1(1989)-299289 и HPA S63(1988)-230689.
Альдегидное производное пиридина (VII-I) может быть получено, например, по методу G.
Метод G

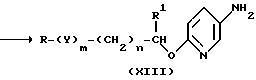
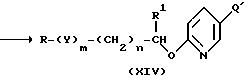
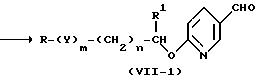
где Q'- галоген, а другие символы приведены выше.
В качестве атома галогена, обозначенного символом Q1, упоминаются хлор, бром и иод.
По этому методу на первой стадии 2-хлор-5-нитропиридин реагирует со спиртовым производным до образования соединения (XII). Реакция 2-хлор-5-нитропиридина с соединением (XI) выполняется в подходящем растворителе в присутствии основания в соответствии с обычным способом.
В качестве растворителя используются, например, ароматические углеводороды, такие как бензол, толуол или ксилол, эфиры, такие как диоксан, тетрагидрофуран или диметоксиэтан, N,N-диметилформамид, диметилсульфоксид, хлороформ, дихлорметан, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан, а также пригодные смеси этих растворителей.
В качестве основания применяют соли щелочных металлов, такие как гидроокись натрия, гидроокись калия, карбонат калия, карбонат натрия или бикарбонат натрия; амины, такие как пиридин, триэтиламин или N,N-диметиланилин; гидриды металлов, такие как гидриднатрия или гидрид калия; этилат натрия, метилат натрия и трет-бутилат калия.
Количество такого основания предпочтительно составляет 1-5 ммоль относительно соединения (XI). Эта реакция выполняется обычно при температуре от -50 до 150oC, предпочтительно от -10 до 100oC. Время реакции варьирует от 0,5 до 30 ч.
Затем соединение (XII) восстанавливают до амино производного (XIII). Хотя реакция восстановления может проводиться по известным методам, наиболее благоприятно проведение каталитического восстановления с использованием металлического катализатора. Такое восстановление проводится по известной методике в присутствии катализатора в атмосфере водорода при 1-150 атм.
В качестве примеров растворителей могут быть указаны спирты, такие как метанол, этанол, пропанол, изопропанол и 2-метоксиэтанол; ароматические углеводороды, такие как бензол, толуол и ксилол; эфиры, такие как этиловый эфир, изопропиловый эфир, диоксан и тетрагидрофуран; галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,1,2,2-тетрахлорэтан; этилацетат, уксусная кислота, N,N-диметилформамид или пригодные смеси этих растворителей.
Для благоприятного проведения реакции используют в качестве катализаторов соединения металлов, например соединения никеля, переходные металлы, например палладий, платина или родий. Температура реакции изменяется в пределах от 0 до 100oC, преимущественно от 10 до 80oC, время реакции - от 0,5 до 50 часов.
Затем соединение (XIII) подвергается известной реакции Зандмейера с образованием галоген производного (XIV). По этой реакции соединение (XIII), во-первых, диазотируется при добавлении к нему по каплям водного раствора нитрита натрия; реакцию проводят в растворителе в присутствии хлористоводородной кислоты, бромистоводородной кислоты или йодистоводородной кислоты. Затем смесь обрабатывают водным раствором галогенированного натрия или галогенированного калия до образования соединения (XIV).
В качестве растворителей используют спирты, такие как метанол, этанол, пропанол, изопропанол и 2-метокиэтанол; эфиры, такие как ацетон, 2-бутанон, диоксан, тетрагидрофуран; или подходящие смеси этих растворителей. Температуру реакции варьируют от -50oC до 100oC, преимущественно от -20o до 60oC. Время реакции от 0,5 до 50 часов.
Затем соединение (XIV) взаимодействует с бутиллитием, вторбутиллитием, трет-буиллитием, метиллитием, фениллитием или фенилмагнийбромидом, после чего обрабатывают N,N-диметилформамидом до образования соединения (VII-I).
Часть промежуточного соединения (IX) в методе F может быть получена также, например, методом H.
Метод H

где каждый из символов описан выше.
Эта реакция может проводиться в растворителе в присутствии основания. В качестве растворителя используют ароматические углеводороды, такие как бензол, толуол и ксилол; эфиры, такие как диоксан, тетрагидрофуран и диметоксиэтан; спирты, такие как метанол, этанол и пропанол; этилацетат, ацетонитрил, пиридин, N,N-диметилформамид, диметилсульфоксид, хлороформ, дихлорметан, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан, ацетон, 2-бутанон, а также подходящие их смеси.
В качестве оснований упоминаются неорганические основания, включая, например гидроксиды щелочных металлов (например гидроокись натрия, гидроокись калия), гидроксиды щелочноземельных металлов (например гидроокись магния и гидроокись кальция), карбонаты щелочных металлов (например карбонат натрия и карбонат калия), карбонаты щелочноземельных металлов (например карбонат магния и карбонат кальция), бикарбонаты щелочных металлов (например бикарбонат натрия и бикарбонат калия) и ацетаты щелочных металлов (например ацетат натрия и ацетат калия); органические основания, включая триалкиламины (например триэтиламин и триметиламин), пиколин, N-метилпирролидин, N-метилморфолин, 1,5-диазабицикло[4,3,0] нон-5-ен, 1,4-диазабицикло[2,2,2]нон-5-ен и 1, 8 5-диазабицикло[5,4,0]-7-ундецен.
Количество этого основания изменяется от 1 до 5 моль относительно соединения (XV). Эта реакция обычно проводится при температурах от -20 до 150oC, предпочтительно от -10 до 100oC.
Методы синтеза исходного соединения (XV) в методе H описаны, например, в Chemical & Pharmaceutical Bulletin, 30, p. 3563 (1982), Chemical & Pharmaceutical Bulletin, 30, p. 3580 (1982), Chemical Pharmaceutical Bulletin, 30, p. 2267 (1984), Arzneimittel - For -schung/Drug Research, 40, p, 37 (1990), Journal of Medicinal Chemistry, 35, p. 2617 (1992), JPA S61 (1986)-267580, JPA S61(1986)-286376, JPA S61(1986)-85372, JPA H2(1990)-31079 и JPA S62(1987)-5981.
Соединение (III), использованное в методе B, получают по методу I.
Метод I

где A2 представляет собой связь или двухвалентный прямой или разветвленный остаток углеводородной цепочки, имеющей 1-5 атомов углерода; A3 - связь или бивалентный насыщенный прямой или разветвленный остаток углеводородной цепочки, имеющей 1-5 атомов углерода; другие символы аналогичны приведенным выше.
Двухвалентный прямой или разветвленный остаток углеводородной цепочки, обозначенный символом A2, является остатком, имеющим 1-5 атомов углерода, среди двухвалентных прямых или разветвленных остатков углеводородных цепочек, обозначенных символом A, и двухвалентный насыщенный прямой или разветвленный остаток углеводородной цепочки, обозначенной символом A3, является насыщенным остатком среди двухвалентных прямых или разветвленных остатков углеводородных цепочек, выраженных символом A2.
По этому методу, во-первых, соединение (II-3) конденсируется с пировиноградной кислотой с образованием соединения (XVI). Реакция конденсации соединения (II-3) с пировиноградной кислотой проводится в смеси спирта с водой с использованием того же основания, что и в реакции соединения (II) с 2,4-оксазолидиндионом по методу A.
Затем соединение (XVI) этерифицируют с образованием соединения (XVII). Эта реакция этерификации может проводиться по известному методу, например, методу, который заключается во взаимодействии соединения (XVII) со спиртом (R4OH) в присутствии кислоты, или методу, который состоит во взаимодействии реакционноспособного производного соединения (XVI), например ангидрида кислоты, галогенангидрида кислоты (хлорангидрид кислоты, бромангидрид кислоты), имидазолида или смешанного ангидрида кислоты (например ангидрид с метилкарбонатом, ангидрид с этилкарбонатом, ангидрид с изобутилкарбонатом и другие) со спиртом (R4OH).
Затем соединение (XVII) подвергается каталитическому восстановлению до образования соединения (XVIII). Такое каталитическое восстановление проводится в основном тем же способом, что и в методе C.
Затем соединение (XVIII) подвергается восстановлению до образования соединения (III-I). Эта реакция восстановления может проводиться с помощью известного метода, например, восстановление с использованием гидрида металла, восстановление с использованием комплексных соединений гидридов металла, восстановление с использованием диборана или замещенного диборана, каталитическое гидрирование и другие. Другими словами, такое восстановление проводится при взаимодействии соединения (XVIII) с восстановителем.
В качестве восстановителя применяют боргидриды щелочных металлов (например, боргидрид натрия, боргидрид лития и т.д.), комплексные соединения гидридов металлов, такие как алюмогидрид лития, гидриды металлов, такие как гидрид натрия, оловоорганические соединения (трифенилово гидрид и т.д.), металлы и соли металлов, включая соединения никеля, соединения цинка и другие подобные катализаторы из переходных металлов, включая палладий, платину, родий и другие, используемые вместе с водородом, дибораном.
Наиболее благоприятны для использования боргидриды щелочных металлов (например боргидрид натрия, боргидрид лития и т.д.). Эта реакция проводится в органическом растворителе, который не оказывает влияния на реакцию.
Примеры растворителей включают ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод, дихлорметан, 1,2-дихлорэтан и 1,1,2, 2-тетрахлорэтан; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол, пропанол, изопропанол и 2-метоксиэтанол; амиды, такие как N,N-диметилформамид; или подходящая смесь таких растворителей.
Подходящий растворитель выбирают в зависимости от типа восстановителя. Температура реакции изменяется в пределах от -20oC до 150oC, особенно от 0oC до 100oC. Время реакции варьирует от 1 до 24 часов.
Исходное соединение (IV) из метода D и исходное соединение (II) из метода A могут быть получены, например по методу J.
Метод J
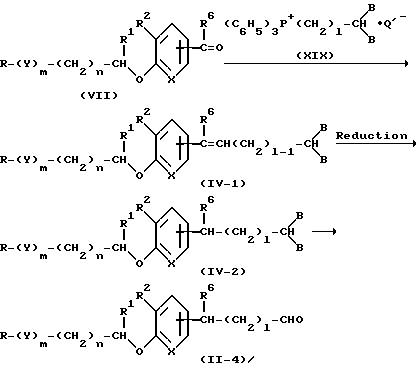
где l - целое число от 1 до 6, а другие символы аналогичны приведенным выше.
По этому методу, во-первых, соединение (VII) конденсируется с соединением (XIX) до образования соединения (IV-1). Эта реакция конденсации проводится по существу тем же способом, что и реакция соединения (VII) с соединением (VIII) в методе F.
Затем соединение (IV-1) подвергается реакции восстановления с образованием (IV-2). Такая реакция восстановления проводится по существу тем же способом, что и каталитическое восстановление соединения (I-BI) в методе C. Соединение (IV-2) может превращаться в альдегидное производное с помощью снятия защитной группы при обработке кислотой в одном растворителе.
В качестве водного растворителя упоминается смесь спирта, такого как метанол, этанол и пропанол; эфира, такого как тетрагидрофуран и диоксан; ацетонитрила, ацетона, 2-бутанона, уксусной кислоты и других подобных с водой.
В качестве кислоты используют п-толуолсульфоновую кислоту, кроме того неорганические кислоты, такие как хлористоводородная кислота, серная кислота, азотная кислота и бромистоводородная кислота.
Часть соединений (II) и (IV) могут быть получены по методу K.
Метод K

где W - -CHB2, B имеет значения аналогичные представленным выше, а другие символы аналогичны представленным выше.
Эта реакция выполняется аналогично способу, представленному в методе E.
Часть соединений, полученных методом Е. может быть восстановлена до соединений (I-B2a2).
Метод L

где каждый символ имеет значения, аналогичные представленным выше. Эта реакция выполняется аналогично способу восстановления, представленному в методе I, в котором соединение (XVIII) превращается в соединение (III-1).
Соединения (II-2) и (II-4) могут также быть получены методом M.
Метод M
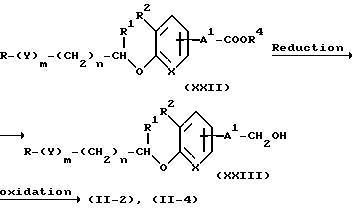
где каждый символ имеет значения аналогичные представленным выше.
Соединение (XXII), которое получают каталитическим гидрированием соединения (XI), может превращаться в соединение (XXIII).
Реакция выполняется способом, аналогичным реакции из метода F, в которой соединение (IX) превращается в соединение (X). Соединение (XXIII) может окисляться до соединений (II-2) и (II-4).
Эта реакция окисления выполняется известным обычным способом, таким как окисление Джонса с использованием смеси серная кислота пиридин, окисление Коллина с использованием комплекса окись хромапиридин, окисление с использованием хлорхромата пиридиния, дихромата пиридиния, окисление с использованием активированного диметилоксида, окисление с использованием солей оксоаммония и т.д.
Если окислению подвергаются оптически активные соединения, то предпочтительно использовать активированный ДМСО. Окисление с использованием активированного ДМСО выполняется в растворителе в присутствии ДМСО и электрофильного реагента.
В качестве растворителя упоминаются эфиры (например этиловый эфир, изопропиловый эфир, тетрагидрофуран, диоксан и т.д.), ароматические углеводороды (например бензол, толуол, ксилол и т.д.), N,N-диметилфомамид, галогенированные углеводороды (например хлороформ, дихлорметан и т.д.), пиридин, диметилсульфоксид. Из этих растворителей выбирают растворитель, соответствующий природе электрофильного реагента.
Дициклогексилкарбодиимид-метод, метод с уксусным ангидридом, метод с пятиокисью фосфора, хлор-метод, метод с трехокисью серы-пиридином, кетенимин-енамин-метод, метод с ацетатом ртути (II) и т.д. применяются при окислении с использованием ДМСО.
Среди них преимущественно используется метод с трехокисью серы-пиридином. Этот метод выполняется с использованием комплекса трехокись серы-пиридин в качестве активатора ДМСО в присутствии триэтиламина.
Этот метод проводится при использовании избыточного количества ДМСО в качестве растворителя. Триэтиламин и комплекс трехокись серы-пиридин, каждый, применяются в количестве от 1 до 10 мол. эквивалентов, преимущественно 2-5 мол. эквивалентов относительно одного мол эквивалента соединения (XXIII).
Температура реакции изменяется в пределах от -70 до 80oC, преимущественно от -20 до 40oC. Время реакции варьирует от 0,5 до 10 ч.
Производные альдегида (II-2), (II-4), полученные таким образом, выделяют и очищают с использованием обычных способов очистки, например, концентрированием, концентрированием в вакууме, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переходом, хроматографией или другими подобными.
Соединения (II-2) и (II-4) превращаются в соединение (IV-2) ацетилированием дитиоацетилированием.
Среди соединений (XXII), бензоксазольное производное (XII-1) может быть получено методом N.
Метод N

где каждый символ аналогичен приведенному выше.
Эта реакция проводится в органическом растворителе, инертном к реакции. Примеры растворителей включают ароматические углеводороды, такие как ксилол, толуол, бензол и т. д., эфиры, такие как тетрагидрофуран, диоксан и т.д., галогенированные углеводороды, такие как дихлорбензол, хлорбензол, метиленхлорид и т.д. Может использоваться один растворитель, смесь двух и более растворителей.
Эта реакция обычно проводится при нагревании смеси соединения (XXIV) и (XXV) в подходящем растворителе. Температура обычно составляет 30-200oC, преимущественно 50-180oC.
Эта реакция может проводиться в присутствии дегидратирующего агента. В качестве дегидратирующего агента применяют соединения фосфора, такие как пятиокись фосфора и хлорокись фосфора. Дегидратирующий агент применяется в количестве от 1 до 10 мол. эквивалентов, преимущественно от 1 до 4 мол. эквивалентов, относительно соединения (XXIV).
В случае применения хлорокиси фосфора, она может использоваться с большим избытком в качестве растворителя. В случае применения пятиокиси фосфора благоприятно при проведении реакции добавлять гексаметилдисилоксан { [(CH3)3Si]O}.
В этом случае гексаметилдисилоксан используют в количестве от 2 до 4 мол. эквивалентов относительно пятиокиси фосфора. Время реакции обычно составляет от 1 до 30 часов, преимущественно от 1 до 10 часов.
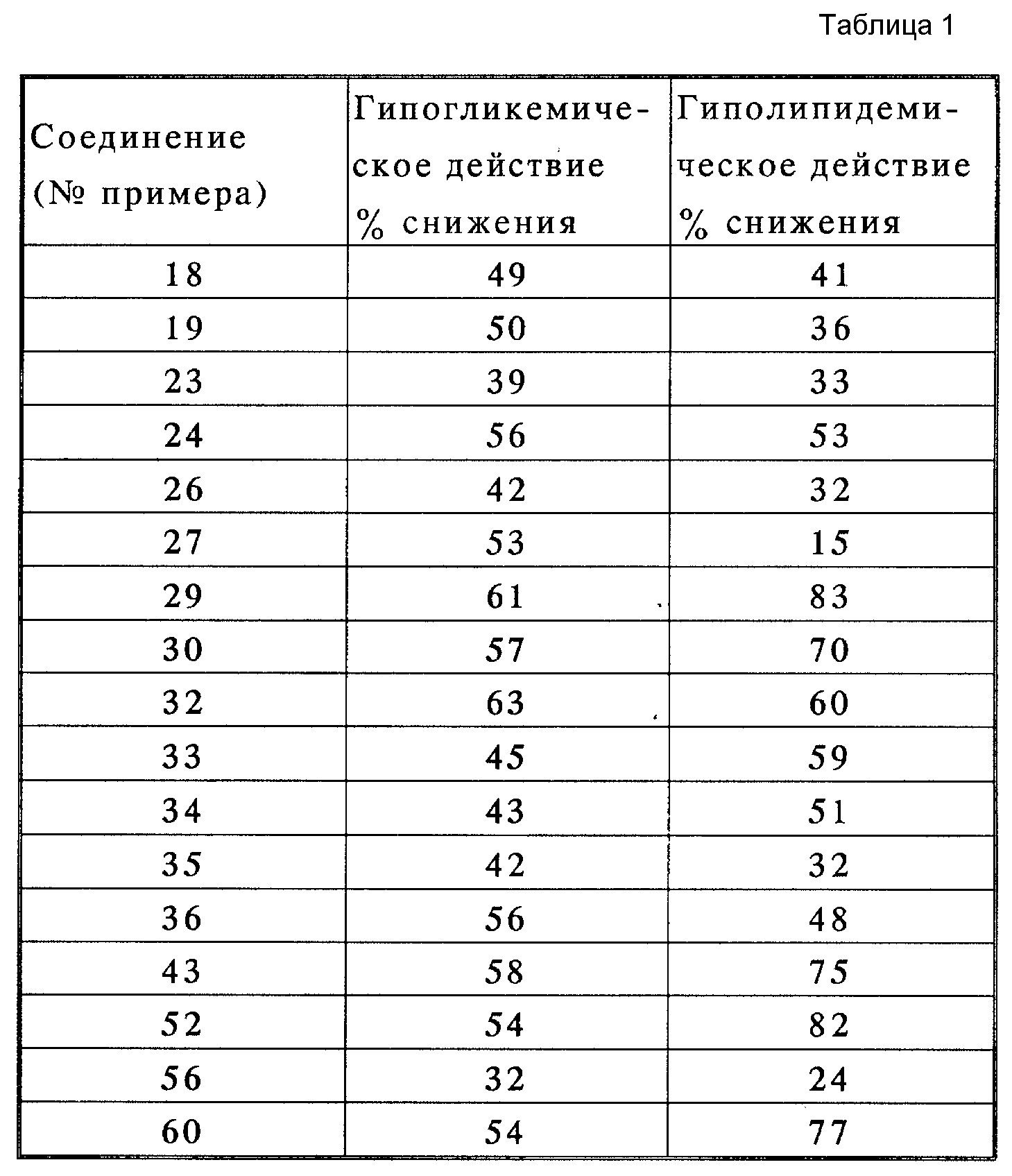
Соединения (I) этого изобретения обладают прекрасной гипогликемической и гиполипидемической активностью.
Описание эксперимента
Гипогликемическое и
гликолипидемическое действие на мышах.
Мыши линии KKAY (в возрасте 9-14 недель) получали тестируемое соединение, смешанное с твердой пищей (CE-2, Japan Clea) в дозе 0,005%, в течение 4 дней в неограниченном количестве. В течение этого периода животные имели свободный доступ к воде. Кровь собирали из глазничного венозного сплетения.
С помощью приборов Latrochem-GLU(A) и Latro-MA701 TG (Latron Inc.) количественно ферментативно определяли плазму, глюкозу и триглицерид.
Соответствующие величины представляют собой процент уменьшения (%), найденный у группы животных, получавших препарат, в сравнении с контрольной группой, препарат не получавшей. Данные показаны в таблице 1.
Как показано выше, производные 2, 4-оксазолидиндиона (1) настоящего изобретения проявляют прекрасную гипогликемическую и гиполипидемическую активность и являются фармацевтически пригодными для применения в качестве лекарственных препаратов для лечения диабета, гиперлипемии и гипертонии.
Пример 1
Смесь (E)-4-[2-[5-метил-2-(3-метилфенил)-4-оксазолил] этокси] коричного альдегида (1,2 г), 2,
4-оксазолидиндиона (0,525 г), пиперидина (0,09 г) и этанола (20 мл) кипятили 5 часов, выливали в воду, подкисляли 2N HCl, экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили (MgSO4) и упаривали. Остаток очищали на колонке с силикагелем. Собирали фракцию, элюированную хлороформ-метанолом (50: 1), и получали 5-[4-[2-[5-метил-2--(3-метилфенил)-4-оксазолил] этокси]циннамилиден]-2,4-оксазолидиндион (0,51 г, 34%).
Продукт перекристаллизовывали из дихлорметан-метанола и получали бледно-желтые призматические кристаллы, т.пл. 213-214oC.
Примеры 2-7
Аналогично методике примера 1 получали соединения, приведенные в таблице 2.
Пример 8
По методике примера 1 получали 5-[3-[2-[2-(-5-метил-2-фенил-4-оксазолил)этокси] -5-пиридил] -2- пропенилиден]-2,4-оксазолидиндион, перекристаллизовывали из смеси этанол-хлороформ-изопропиловый
эфир и выделяли бледно-желтые кристаллы, т.пл. 204-205oC.
Пример 9
Смесь 2-[3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] пропил] -1,3-диоксана (2,0 г), 2,
4-оксазолидиндиона (0,99 г), пиперидина (0,21 г) и уксусной кислоты (50 мл) кипятили 24 часа, упаривали в вакууме, добавляли этилацетат.
Этилацетатный слой промывали водным раствором бикарбоната натрия, 2N HCl и водой, стушили (MgSO4), упаривали. Остаток хроматографировали на колонке с силикагелем.
Из фракции, элюированной смесью хлороформ - этилацетат (5:1), выделяли 5-[4-[4-[2-(5-метил-2-фенил-4- оксазолил)этокси]фенил]бутилиден]-2,4-оксазолидиндион (0,55 г, 26%), перекристаллизовывали из смеси этиловый эфир - метанол и получали бесцветные иглообразные кристаллы, т.пл. 152-153oC.
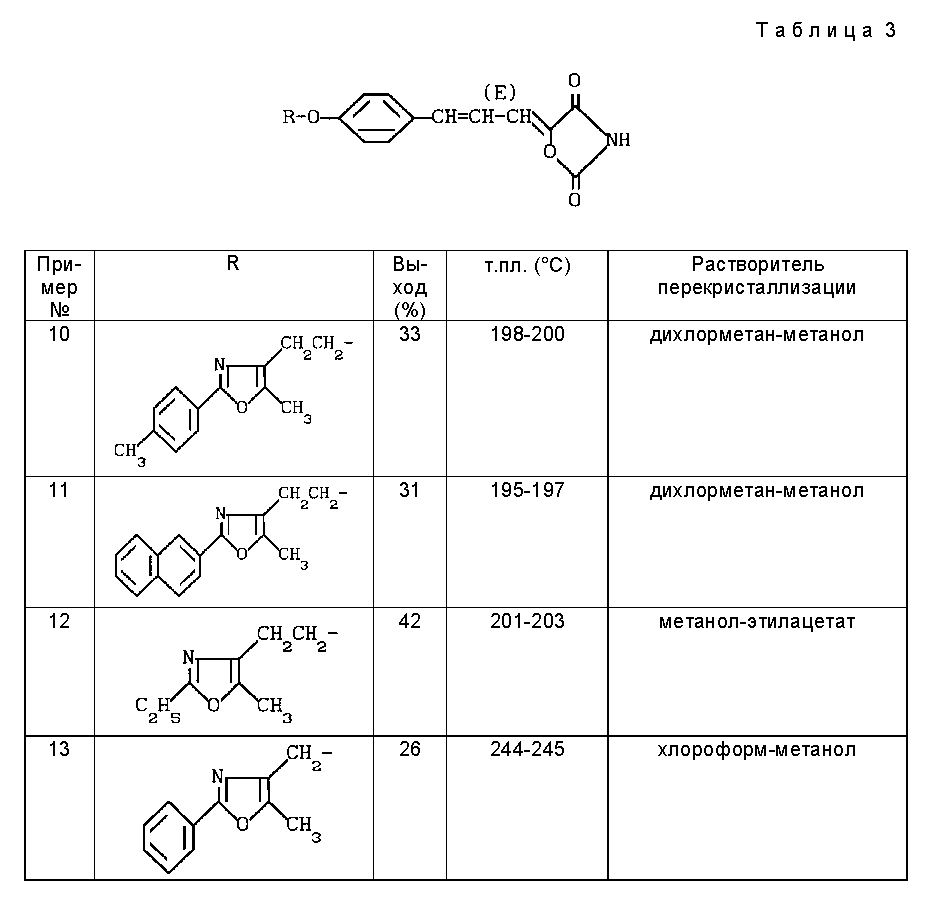
Примеры 10-13
По методике примера 1 получали соединения, представленные в таблице 3.
Пример 14
По методике примера 1 (E)-3-[2-(5-метил-2-фенил-4-оксазолилметил)бензфан-5-ил] акролеин реагировал с 2,4-оксазолидиндионом с образованием 5-[3-[2-(5-метил-2-фенил-4-оксазолилметил)бензфуран-5-ил]
-2- пропенилиден] -2,4-оксазолидиндиона. Выход составлял 44%. При перекристаллизации из смеси дихлорметан-метанол получали светло-желтые иглообразные кристаллы, т.пл. 237-239oC.
Пример 15
По методике примера 1 (E,E)-5-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] -2, 4-пентадиен-1-аль реагировал с 2,4-оксазолидиндионом с образованием
5-[5-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] -2,4-пентадиенилиден] -2,4-оксазолидиндиона. Выход составлял 31%. При перекристаллизации из смеси дихлорметан-метанол получали желтые
иглообразные кристаллы, т.пл. 209-211oC.
Пример 16
Смесь 5-[4-[2-[5-метил-2-(3-метилфенил)-4-оксазолил]этокси]циннамилиден] - -2,4-оксазолидиндиона (0,29 г),
палладия на углероде (10%, 0,1 г) и диоксана (50 мл) гидрировали при комнатной температуре и атмосферном давлении, фильтровали. Фильтрат упаривали при уменьшенном давлении.
Остаток хроматографировали на колонке с силикагелем. Из фракции, элюированной смесью хлороформ-метанол (100:3), выделяли 5-[3-[4-[2-[5-метил-2-(3-метилфенил)-4-оксазолил] этокси] фенил]пропил] -2, 4-оксазолидиндион (0,28 г, 96%), перекристаллизовывали из смеси дихлорметан-метанол и получали бесцветные призмообразные кристаллы, т.пл. 149 - 150oC.
Элементный анализ для
C25H26N2O5:
Вычислено,%: C 69,11; H 6,03; N 6,45
Найдено,%: C 69,18; H 6,01; N 6,46
Примеры 17-22
По методике примера 16
получали соединения, приведенные в таблице 4.
Пример 23
По методике примера 16 каталитическим гидрированием 5-[3-[2-[2-(5-метил-2-фенил-4-оксазолил)этокси]-5-пиридил]
-2-пропенилиден]-2,4-оксазолидиндиона получали 5-[3-[2-[2-(5-метил-2-фенил-4-оксазолил)этокси] -5-пиридил] пропил] - 2,4-оксазолидиндион, который перекристаллизовывали из смеси
хлороформ-метанол-изопропиловый эфир и получали бесцветные кристаллы, т.пл. 169-171oC.
Элементный анализ для CH23H23N3O5 •
1/2H2O:
Вычислено,%: C 64,18; H 5,62; N 9,76
Найдено,%: C 64,31; H 5,70; N 9,48
Пример 24
Смесь этилового эфира
2-гидрокси-4-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] масляной кислоты (0,45 г), порошкообразного цианата калия (0,24 г) и бутанола (20 мл) кипятили 4 дня, растворитель упаривали в вакууме,
остаток подкисляли 2N HCl и экстрагировали этилацетатом. Экстракт промывали водой, сушили (MgSO4) и упаривали.
Остаток хроматографировали на колонке с силикагелем. Из фракции, элюированной смесью хлороформ-метанол (100:3), выделяли 5-[2-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] этил] -2,4-оксазолидиндион (0,28 г, 63%), который перекристаллизовывали из смеси дихлорметан-этанол, и поучали бесцветные призмообразные кристаллы, т.пл. 193-194oC.
Элементный анализ для CH23H23N2O5:
Вычислено,%: C 67,97; H 5,46; N 6,89
Найдено,%: C 67,92; H 5,61; N 6,64
Пример 25
Смесь 5-[4-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] бутилиден] -2,
4-оксазолидиндиона (0,38 г), палладия на углероде (10%, 0,2 г) и тетрагидрофурана (40 мл) гидрировали при комнатной температуре и 3 атмосферах. Катализатор отфильтровывали, фильтрат упаривали в
вакууме, остаток хроматографировали на колонке с силикагелем. Из фракции, элюированной смесью хлороформ-метанол (100: 3) выделяли 5-[4-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] бутил] -2,
4-оксазолидиндион (0,25 г, 65%). Этот продукт перекристаллизовывали из смеси дихлорметан-метанол и получали бесцветные кристаллы формы призм, т.пл. 136-137oC.
Примеры
26-29
По методике примера 16 получали соединения, приведенные в таблице 5.
Пример 30
По методике примера 16 получали
5-[3-[2-(5-метил-2-фенил-4-оксазолилметил)бензофуран-5-ил] пропил] - 2,4-оксазолидиндион, выход - 80%. Этот продукт перекристаллизовывали из смеси дихлорметан-метанол в виде бесцветных иглообразных
кристаллов, т.пл. 184-184oC.
Пример 31
По методике примера 16 5-[5-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] -2,4-пентадиенилиден]-2,4 -оксазолидиндион
каталитически гидрировали с образованием 5-[5-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси]фенил]пентил] -2,4-оксазолидиндиона, выход 77%. При перекристаллизации этого продукта из смеси
дихлорметан-метанол получали бесцветные иглообразные кристаллы, т.пл. 157-158oC.
Пример 32
По методике примера 24 получали
5-[2-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] этил] -2,4-оксазолидиндион, выход 35%, при перекристаллизации которого из смеси этилацетат-гексан выделяли бесцветные призмообразные кристаллы,
т.пл.158-159oC.
Пример 33
К раствору 5-[5-(4-гидроксифенил)пентил]-2,4-оксазолидиндиона (0,9 г) в N,N-диметилформамиде (40 мл) прибавляли гидрид натрия (60% в
масле, 0,28 г), перемешивали 15 минут при комнатной температуре, добавляли 4-хлорметил-5-метил-2-фенилоксазол (0,85 г), перемешивали 2 часа при 70oC, выливали в воду, подкисляли 2N HCl,
экстрагировали этилацетатом.
Экстракт промывали водой, сушили (MgSO4), растворитель упаривали, маслообразный остаток хроматографировали на колонке с силикагелем. Из фракции, элюированной смесью этилацетат-хлороформ (1:5, об/об) выделяли 5-[5-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил]пентил]-2, 4-оксазолидиндион (0,86 г, 58%), который перекристаллизовыали из смеси дихлорметан-изопропиловый эфир, и получали бесцветные кристаллы в форме призм, т.пл. 120-121oC.
Пример 34
По методике примера 33 получали
5-[4-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил]бутил]-2,4 -оксазолидиндион, выход 32%, который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и получали бесцветные кристаллы в форме
призм, т.пл. 186-187oC.
Пример 35
Смесь 4-[4-[2-(1,3-диоксолан-2-ил)этил]феноксиацетил]-5-метил -2-фенилоксазола (1,8 г), 2,4-оксазолидиндиона (0,925 г),
пиперидина (0,12 г) и уксусной кислоты (30 мл) кипятили 15 часов, упаривали при уменьшенном давлении, остаток обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали
хлороформом.
Хлороформенный слой промывали водой, сушили (MgSO4), упаривали растворитель. Маслообразный остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью метанолхлороформ (1:30, об/об), выделяли 5-[3-[4-[2-(5-метил-2-фенил-4-оксазолил)-2-оксоэтокси] фенил] пропилиден]-2,4-оксазолидиндион.
Соединение растворяли в тетрагидрофуране (30 мл), прибавляли палладий на углероде (5%, 0.3 г), каталитически гидрировали, катализатор отфильтровывали, фильтрат упаривали в вакууме, маслообразный остаток хроматографировали на колонке с силикагелем, из фракции, элюированной смесью этилацетатгексан (1: 2, об/об), выделяли 5-[3-[4-[2-(5-метил-2-фенил-4-оксазолил)-2-оксоэтокси]фенил]пропил] -2,4-оксазолидиндион (0,32 г, 16%) в виде масла.
ЯМР (δppm в CDCl3): 1,7-2,1 (4H, м), 2,63 (2H, т, J = 7 Гц), 2,74 (3H, с), 4,84 (1H, дд, J = 7 и 4,5 Гц), 5,37 (2H,. с), 6,92 (2H, д, J = 9 Гц), 7,09 (2H, д, J = 9 Гц), 7,45-7,55 (3H, м), 7,95-8,1 (3H, м).
Пример 36
К раствору 5-[3-[4-[2-(5-метил-2-фенил-оксазолил)-2-оксоэтокси] фенил] пропил] -2,4-оксазолидиндиона (0,2 г) в
тетрагидрофуране (5 мл) - этаноле (5 мл) прибавляли боргидрид натрия (0,03 г), перемешивали 1 час при комнатной температуре, прибавляли 2N HCl и воду, экстрагировали этилацетатом.
Экстракт промывали водой, сушили (MgSO4), растворитель упаривали, маслообразный остаток хроматографировали на колонке с силикагелем, из фракции, элюированной смесью хлорофор-метанол (50:1, об/об), выделяли 5-[3-[4-[2-гидрокси-2-(5-метил-2-фенил-4-оксазолил)этокси]фенил]пропил]- 2,4-оксазолидиндион (0,16 г, 80%), который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и получали бесцветные кристаллы в виде иголок, т.пл. 146-147oC.
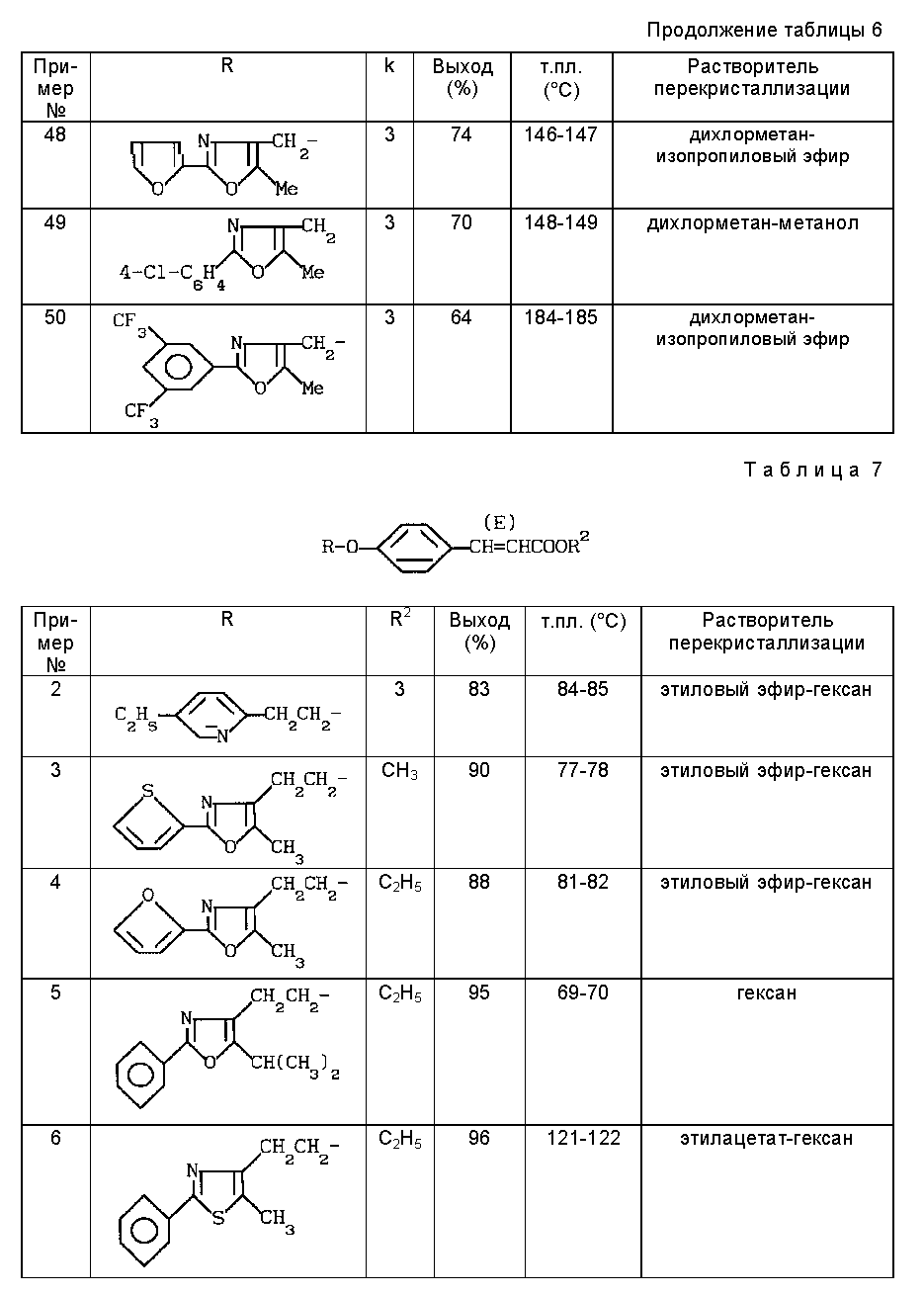
Примеры 37 - 50
По методике примера 33 получали соединения, приведенные в таблице 6.
Сноска к таблице 6: 1) ЯМР (δppm в CDCl3): 1,7-2,1 (4H, м), 2,50 (3H, с), 2,62 (2H, т, J = 7 Гц), 4,79 (1H, дд, J = 6,5 и 4,5 Гц), 6,99 (2H, д, J = 8,5 Гц), 7,10 (2H, д, J = 8,5 Гц),
7,45-7,7 (3H, м), 7,85- 8,0 (2H, м), 8,15 (1H, дд, J = 7 и 1 Гц), 9,21 (1H, д, J = 8,5 Гц). Me: метил, 2-naph: 2-нафтил, 1-naph: 1-нафтил
Пример 51
Смесь
4-[2-[N-метил-N-(2-пиридил)амино]этокси]коричного альдегида (4,00 г), 2,4-оксазолидиндиона (2,86 г), пиперидина (0,50 г), этанола (50 мл) кипятили 2 часа, упаривали и остаток хроматографировали на
колонке с силикагелем, из фракции, элюированной смесью этилацетат-хлороформ (1:4), выделяли кристаллы, которые растворяли в тетрагидрофуране (100 мл).
К раствору прибавляли палладий на углерода (5%, 1,40 г), гидрировали при комнатной температуре и атмосферном давлении, катализатор отфильтровывали, фильтрат упаривали при уменьшенном давлении, остаток хроматографировали на колонке с силикагелем, из фракции, элюированной смесью хлороформ-метанол (100: 2), выделяли 5-[3-4-[2-[N-метил-N(2-пиридил)амино]этокси]фенил]-2,4- оксазолидиндион (1,17 г, 21%), который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и получали бесцветные кристаллы в виде призм, т. пл. 126-127oC.
Пример 52
По методике примера 51 получали
5-[3-[2-(5-метил-2-фенил-4-оксазолилметокси)-5-пиридил]пропил] -2,4-оксазолидиндион в виде масла, выход 22%.
ЯМР (δppm в CDCl3): 1,7-2,15 (4H, м), 2,48 (3H, с), 2,61 (H, т, J = 7 Гц), 4,84 (1H, дд, J = 6,5 и 4,5 Гц), 5,27 (2H, с), 6,76 (H, д, J = 8,5 Гц), 7,3-7,5 (4H, м), 7,95-8,1 (3H, м), 8,84 (1H, шир с).
Пример 53
По методике примера
35 получали 5-[4-[4-[5- метил-2-(2-нафтил)-4-оксазолилметокси] фенил] бутил] -2,4-оксазолидиндион, выход 22%, который перекристаллизовывали из смеси дихлорметан-метанол и получали бесцветные кристаллы
в виде призм, т.пл. 163-164oC.
Пример 54
По методике примера 35 получали 5-[3-[2-(2-нафтилметил)бензоксазол-5-ил] пропил] -2,4-оксазолидиндион, выход 13%, который
перекристаллизовывали из смеси дихлорметан-метанол и выделяли в виде бесцветных, призмообразных кристаллов, т.пл. 151-152oC.
Пример 55
По методике примера 1
получали 5-[3-[3-(5-метил-2-фенил-4-оксазолилметокси)фенил] -2-пропилиден] -2,4-оксазолидиндион, который перекристаллизовывали из смеси хлороформ-метанол и выделяли бесцветные иглообразные кристаллы,
т.пл. 229-230oC.
Пример 56
По методике примера 16 получали 5-[3-[3-(5-метил2-фенил-4-оксазолилметокси)фенил] пропил] -2,4- оксазолидиндион, который
перекристаллизовывали из этилацетатагексана, и выделяли в виде бесцветных иглообразных кристаллов, т. пл. 134-135oC.
Пример 57
По методике примера 51 получали
5-[3-(4-изопропоксифенил)пропил]-2,4-оксазолидиндион в виде масла.
ЯМР (δppm в CDCl3: 1,32 (6H, д, J = 6 гц), 1,65-2,15 (4H, м), 2,62 (2H, т, J = 7 Гц), 4,4-4,6 (1H, м), 4,84 (1H, дд, J = 7 и 4,5 Гц), 6,81 (2H, д, J = 8,5 Гц), 7,06 (2H, д, J = 8,5 Гц), 8,00 (1H, шир с).
Пример 58
По методике примера 51 получали
5-[4-(4-изопропоксифенил)пентил]-2,4-оксазолидиндион в виде масла.
ЯМР (δppm в CDCl3: 1,32 (6H, д, J = 6 гц), 1,3-2,1 (8H, м), 2,54 (2H, т, J = 7,5 Гц), 4,4-4,6 (1H, м), 4,84 (1H, дд, J = 7,5 и 4,5 Гц), 6,80 (2H, д, J = 8,5 Гц), 7,05 (2H, д, J = 8,5 Гц), 7,98 (1H, шир с).
Пример 59
По методике примера 35 получали
5-[4-(4-изопропоксифенил)бутил]-2,4-оксазолидиндион реакцией 2-[3-(4-изопропоксифенил)пропил]-1,3-диоксолана с 2,4-оксазолидиндионом с последующим каталитическим гидрированием продукта реакции.
Образовавшийся продукт перекристаллизовывали из смеси дихлорметан-изопропиловый и выделяли в виде бесцветных призмообразных кристаллов, т.пл. 81-82oC.
Пример
60
По методике примера 51 получали 5-[3-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] бутил] -2,4-оксазолидиндион в виде бледно-желтого аморфного порошка.
ЯМР (δppm в CDCl3: 1,25 (3H, д, J = 6,8 гц), 1,30-2,00 (4H, м), 2,43 (3H, с), 2,55-2,80 (1H, м), 4,67-4,83 (1H, м), 4,97 (2H, с), 6,95 (2H, д, J = 8,8 Гц), 7,09 (2H, д, J = 8,8 Гц), 7,35- 7,53 (3H, м), 7,92-8,10 (2H, м).
Пример 61
По методике примера 33 получали 5-[3-[4-[2-(2-бензо[в]тиенил)- 5-метил-4-оксазолиметокси] фенил]пропил]- -2,4-оксазолидиндион, выход 76%, т.пл.
154-155oC (перекристаллизовывали из дихлорметана-изопропилового спирта).
Пример 62
По методике примера 33 получали
5-[3-[4-[2-(2-бензо[в]фуранил)-5-метил-4-оксазолиметокси]фенил]пропил]- 2,4-оксазолидиндион, выход 70%, который перекристаллизовывали из смеси дихлорметан-изопропиловый спирт, и выделяли бесцветные
иглообразные кристаллы т.пл. 165-166oC.
Получение препаративной формы. Пример 1
(Получение таблеток)
(1) 5-[3-[2-[2-(5-метил-2-фенил-4-оксазолил)этокси]
-5пиридил]пропил]-2,4-оксазолидиндион - 10 г
(2) лактоза - 50 г
(3) кукурузный крахмал - 15 г
(4) карбоксиметилцеллюлоза кальция - 44 г
(5) стеарат магния - 1 г
- 1000 таблеток 120 г
Полные количества (1), (2) и (3) и 33 г (4) замешивали с водой, сушили в вакууме и гранулировали. Таким образом гранулированный порошок смешивали с 14 г (4) и 1 г (5),
формовали таблетки с помощью специальной машины и получали 1000 таблеток, каждая из которых содержала по 10 мг (1).
Получение препаративной формы. Пример 2
(Получение
таблеток)
(1) 5-[2-[4-[2-(5--метил-2-фенил-4-оксазолил)этокси] фенил]этил]-2,4-оксазолидиндион - 30 г
(2) лактоза - 50 г
(3) кукурузный крахмал - 15 г
(4)
карбоксиметилцеллюлоза кальция - 44 г
(5) стеарат магния - 1 г - 1000 таблеток 140 г
Полные количества (1), (2), (3) и 30 г (4) замешивали с водой, сушили в вакууме, гранулировали.
Таким образом гранулированный порошок смешивали с 14 г (4) и 1 г (5), формовали с помощью специальной машины в таблетки и получали 1000 таблеток, каждая из которых содержала 30 мг (1).
Исходные. Пример 1
К раствору триэтилфосфоноацетата (1,79 г) в N,N-диметил-формамиде (40 мл) прибавляли постепенно при 0oC гидрид натрия (60% в масле, 0,32 г), перемешивали 15
минут при этой температуре, добавляли 4-[2-[5-метил-2-(3-метилфенил)- 4-оксазолил]этокси]бензальдегид (2,44 г), перемешивали 1 час при комнатной температуре, выливали в воду со льдом, подкисляли 2N
HCl и отфильтровывали кристаллы, которые перекристаллизовывали из смеси этилацетат-гексан, и получали этиловый эфир (E)-4-[2-[5-метил-2-)-метилфенил)-4-оксазолил] этоксикоричной кислоты (2,52 г, 85%)
в виде бесцветных иглообразных кристаллов, т.пл. 90-91oC.
Исходные. Примеры 2-6
Аналогично методике, приведенной в Примере 1, получали соединения, приведенные в
таблице 7.
Исходные. Пример 7
Раствор диизобутиллитий гидрида (1,5M, 9,3 мл) в толуоле прибавляли по каплям при 0oC к суспензии этилового эфира
(E)-4-[2-[5-метил-2-(3-метилфенил)-4-оксазоли] этокси] коричной кислоты (2,48 г) в дихлорметане (50 мл), перемешивали 2 часа при комнатной температуре, затем добавляли при охлаждении льдом метанол (3
мл) и воду (30 мл), фильтровали через слой целита. Органический слой промывали водой, сушили (MgSO4) и упаривали.
Остаток хроматографировали на колонке и из фракции, элюированной смесью этилацетат - гексан (1: 1), выделяли (E)-3--[4-[2-[5-метил-2-(3-метилфенил)-4-оксазолил] этокси] фенил] -2-пропен-1-ол (1,44 г, 65%), который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир, и получали бесцветные кристаллы в форме призм, т.пл. 116-117oC.
Исходные. Примеры 8-13
Аналогично методике, приведенной в примере 7,
получали соединения, приведенные в таблице 8.
Сноска к таблице 8: 1) ЯМР (δppm в CDCl3: 1,24 (3H, д, J = 7,5 гц), 2,63 (2H, д, J = 7.5 Гц), 3,23 (2H, т, J = 7 Гц), 4,25-4,4 (4H, м), 6,23 (1H, дт, J = 16 и 6 Гц), 6,55 (1H, д, J = 16 Гц), 6,86 (2H, д, J = 9 Гц), 7,19 (1H, д, J = 8 Гц), 7,30 (2H, д, J = 9 Гц), 7,46 (1H, дд, J = 8 и 2 Гц), 8,40 (1H, д, J = 2 Гц).
Исходные. Пример 14
К раствору (E)-3-[4-[2-[5-метил-2-(3-метилфенил)-4-оксазолил] этокси] фенил] -2-пропен-1-ола (1,4 г) в дихлорметане (50 мл) прибавляли активированную
двуокись магния (2,8 г), перемешивали 2 часа при комнатной температуре, фильтровали через целит.
Фильтрат упаривали и получали (E)-4-[2-[5-метил-2- (3-метилфенил)-4-оксазолил] этокси] коричный альдегид (1,27 г, 91%), который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир, и выделяли бесцветные иглообразные кристаллы, т.пл. 110-111oC.
Исходные. Примеры 15-20
По методике из Исходные. Пример 14 получали соединения, приведенные в таблице 9.
Исходные. Пример 21
К раствору
4-[2-(5-метил-2-фенил-4-оксазолил)этокси]бензальдегида (3,0 г) и пировиноградной кислоты (3,44 г) в метаноле (80 мл) прибавляли по каплям раствор карбоната натрия (4,14 г) в воде (80 мл), перемешивали
24 часа при температуре 70-80oC, выливали в воду, промывали этилацетатом. Водный слой подкисляли концентрированной HCl и отфильтровывали осадок, который добавляли к этанолу, содержащему
хлористый водород (5%, 15 мл), кипятили 30 минут, упаривали. Остаток растворяли в хлороформе, промывали водой, сушили (MgSO4) и упаривали.
Остаток хроматографировали на колонке с силикагелем, из фракции, элюированной смесью этилацета - хлороформ (1:9), выделяли этиловый эфир (E)-4-[2-(5-метил-2-фенил-4-оксазолил)этокси] бензалиден пировиноградной кислоты (1,0 г, 25%), который перекристаллизовывали из смеси дихлорметанэтанол, и получали светло-желтые кристаллы в форме игл, т.пл. 99-100oC.
Исходные. Пример 22
Смесь этилового
эфира (E)-4-[2-(5-метил-2-фенил-4-оксазолил)этокси] бензилиден пировиноградной кислоты (0,85 г), палладия на углероде (10%, 0.1 г) и диоксана (80 мл) гидрировали при комнатной температуре и
атмосферном давлении, катализатор отфильтровывали, фильтрат упаривали при уменьшенном давлении.
Остаток растворяли в этаноле (20 мл), к раствору добавляли при охлаждении льдом боргидрат натрия (0,08 г), смесь перемешивали 1 час при комнатной температуре. Реакционную массу выливали в воду, нейтрализовали IN HCl, экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили (MgSO4), затем упаривали и остаток хроматографировали на колонке с силикагелем, из фракции, элюированной смесью хлороформ-этилацетат (9:1), выделяли этиловый эфир 2-гидрокси-4-[4-[2- (5-метил-2-фенил-4-оксазолил]этокси]фенил масляной кислоты (0,55 г, 64%), который перекристаллизовывали из смеси этиловый эфир-гексан в виде бесцветных игл, т.пл. 67- 68oC.
Исходные. Пример 23
К раствору 2-хлор-5-нитропиридина (25 г), 2-(5-метил-2-фенил-4-оксазолил)этанола (32,1 г) в ТГФ (250 мл) прибавляли порциями при охлаждении
льдом гидрид натрия (60% в масле, 6,92 г), перемешивали 15 часов при комнатной температуре, выливали в воду и экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили (MgSO4), упаривали растворитель при уменьшенном давлении и оставшиеся кристаллы отфильтровывали и перекристаллизовывали из этанола- и выделяли 2-[2-(5-метил-2-фенил-4-оксазолил)этокси]-5-нитропиридин (25,4 г, 49%) в виде желто-коричневых кристаллов, т.пл. 110,5-111,5oC.
Элементный анализ для C17H15N3O4:
Вычислено,%: C 62,76; H 4,65; N 12,92
Найдено,%: C 62,80; H 4,58; N 12,96
Исходные. Пример 24
Смесь
2-[2-(5-метил-2-фенил-4-оксазолил)этокси] -5-нитропиридина (13,4 г), палладия на углероде (5%, 1,5 г) и этилацетата (200 мл), метанола (150 мл) гидрировали при комнатной температуре при атмосферном
давлении, катализатор отфильтровывали, фильтрат упаривали в вакууме.
Оставшиеся кристаллы отфильтровывали и получали 5-амино-2-[2-(5-метил-2-фенил-4-оксазолил)этокси] пиридин (11,4 г, 93%), который перекристаллизовывали из смеси этилацетат-гексан, и получали коричневые кристаллы, т.пл. 107,0-108,0oC.
Элементный анализ для C17H17
N3O42:
Вычислено,%: C 69,14; H 5,80; N 14,23
Найдено,%: C 69,01; H 5,94; N 13,99
Исходные. Пример 25
К смеси
5-амино-2-[2-(5-метил-2-фенил-4-оксазолил)этокси]пиридина (10.0 г), концентрированной HCl (8,47 мл) и ацетона (100 мл) прибавляли по каплям раствор нитрата натрия (NaNO2) (2,46 г) в воде
(10 мл) при температуре ниже 10oC, перемешивали 30 минут при 10oC, добавляли по каплям раствор иодида калия (KI) (2,46 г) в воде (10 мл) при 10oC, перемешивали 1 час
при температуре 30-35oC, 1 час при температуре 35-40oC, упаривали при уменьшенном давлении.
Концентрат выливали в воду, экстрагировали этилацетатом. Этилацетатный слой промывали водой, сушили (MgSO4), растворитель отгоняли при уменьшенном давлении. Маслообразный остаток хроматографировали на силикагеле, из фракции, элюированной смесью этилацетат-гексан (1:3, об/об), выделяли 5-иод-2-[2-(5-метил-2-фенил-4-оксазолил)этокси] пиридин (7,22 г, 52%), который перекристаллизовывали из смеси этилацетат-гексан, и получали бесцветные кристаллы, т.пл. 105-106oC.
Элементный анализ для C17H15N2O2I:
Вычислено,%: C 50,26; H 3,72; N 6,90
Найдено,%:
C 50,22; H 3,89; N 6,78
Исходные. Пример 26
К раствору 5-иод-2-[2-(5-метил-2-фенил-4-оксазолил) этокси]пиридина (2,5 г) в тетрагидрофуране (40 мл) при температуре -65oC в
атмосфере азота прибавляли по каплям раствор н-бутил-лития (1,6M, 4,61 мл), перемешивали 15 минут при температуре, добавляли по каплям N,N-диметилформамид (0,71 мл), удаляли баню с охлаждением,
перемешивали 30 минут, вносили насыщенный водный раствор хлорида аммония (6 мл), выливали в воду и экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили (MgSO4), растворитель отняли при уменьшенном давлении и выделяли 5-формил-2-[2-(5-метил-2-фенил-4-оксазолил)этокси] пиридин (1,5 г, 79%), который перекристаллизовывали из смеси этилацетат-гексан и получали бесцветные кристаллы, т.пл. 99-100oC.
Элементный анализ для C18H16N2O3:
Вычислено,%: C 70,12; H 5,23; N 9,
09
Найдено,%: C 69,94; H 5,38; N 8,94
Исходные. Пример 27
По методике из Исходные. Пример 1 получали 3-[2-[2- (5-метил-2-фенил-4-оксазолил)этокси]-5-пиридил]акрилат, который
перекристаллизовывали из этилацетата, и выделяли бесцветные кристаллы, т.пл. 138-139oC.
Исходные. Пример 28
По методике из Исходные. Пример 7 получали
(E)-3-[2-(5-метил-2-фенил-4-оксазолил)этокси]-5-пиридил] -2-пропен-1-ол, который перекристаллизовывали из смеси этилацетат-изопропиловый эфир, и выделяли бесцветные кристаллы, т. пл. 115-116oC.
Исходные. Пример 29
По методике из Исходные. Пример 14 получали (E)-3-[2-[2-(5-метил-2-фенил-4-оксазолил)этокси]-5-пиридил]акролеин, который перекристаллизовывали
из смеси этилацетат-гексан, и выделяли бесцветные кристаллы, т.пл. 138-139oC.
Исходные. Пример 30
Смесь метилового эфира
2-бром-3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] пропионовой кислоты (5,0 г), 1,8-диазабицикло[5,4,0]-7-ундецена (6,2 г) и толуола (200 мл) перемешивали 2 часа при 70oC, выливали
в этилацетат (200 мл), промывали 2N HCl, насыщенным водным солевым раствором, сушили (MgSO4), упаривали растворитель при уменьшенном давлении и получали метиловый эфир
4-[2-(5-метил-2-фенил-4-оксазолил)этокси] коричной кислоты (10,8 г, 88%), который перекристаллизовывали из смеси этил-ацетат-гексан, и выделяли бесцветные кристаллы, т.пл. 114- 115oC.
Исходные. Пример 31
К раствору [2-(1,3-диокса-2-ил)этил]трифенилфосфоний бромида (8,9 г) в N, N-диметилформамиде (100 мл) прибавляли при комнатной температуре порциями гидрид
натрия (60% в масле, 0,78 г), перемешивали 30 минут при этой температуре, вносили 4-[2-(5-метил-2-фенил-4-оксазолил)этокси]бензальдегида (5,0 г), перемешивали 15 минут при комнатной температуре, затем
5 часов при 70oC, выливали в воду со льдом, подкисляли 2N HCl и экстрагировали этил-ацетатом.
Этилацетатный слой промывали водой, сушили (MgSO4), остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1: 3), выделяли (Z)-2-[3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] -2-пропенил] -1,3-диоксан (5, 1 г, 77%) в виде маслообразного продукта.
ЯМР (δppm в CDCl3): 1,25-1,4 (1H, м), 1,95-2,25 (1H, м), 2,37 (3H, с), 2,66 (1H, ддд, J = 7 и 5 и 2 Гц), 2,98 (2H, т, J = 6, 5 Гц). 3,7-3,85 (2H, м), 4,0-4,3 (4H, м), 4,63 (1H, т, J = 5 Гц), 5,64 (1H, дт, J = 11,5 и 7 Гц), 6,48 (1H, шир д, J = 11,5 Гц), 6,85 (2H, д, J = 9 Гц), 7,22 (2H, д, J = 9 Гц), 7,35-7,5 (3H, м), 7,9-8, 0 (2H, м).
Исходные. Пример 32
Смесь (Z)-2-[3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси]фенил] -2-пропенил] -1,3-диоксана (5,0 г), палладия на углероде (5%, 0,1 г), и этанол
(100 мл) гидрировали при комнатной температуре и атмосферном давлении, катализатор отфильтровывали, фильтрат упаривали при уменьшенном давлении, остаток хроматографировали на колонке с силикагелем, из
фракции, элюированной смесью гексан-этилацетат (1: 1), выделяли 2-[3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси]фенил]пропил] -1,3-диоксан (4,8 г, 96%).
ЯМР (δppm в CDCl3): 1,25-1,4 (1H, м), 1,5-1,8 (4H, м), 1,9-2,2 (1H, м), 2,37 (3H, с), 2,54 (2H, т, J = 7 Гц), 2,96 (2H, т, J = 6,5 Гц), 3,65-3,85 (2H, м), 4,0-4,15 (2H, м), 4,21 (2H, т, J = 6,5 Гц), 4,50 (1H, т, J = 5 Гц), 6,80 (2H, д, J = 9 Гц), 7,06 (2H, д, J = 9 Гц), 7,35-7,5 (3H, м), 7,92-8,0 (2H, м).
Исходные. Примеры 33-36
По методике из Исходные. Пример 1 получали соединения,
приведенные в таблице 10.
Сноска к таблице 10: 1) ЯМР (δppm в CDCl3): 1,30 (3H, т, J = 7,5 Гц), 1,33 (3H, т, J = 7 Гц), 2,25 (3H, с), 2,70 (2H, кв, J = 7,5 Гц), 2,88 (1H, т, J = 7 Гц), 4,20 (2H, т, J = 7 Гц), 4,25 (2H, кв, J = 7,5 Гц), 6,29 (1H, д, J = 16 Гц), 6,88 (2H, д, J = 9 Гц), 7,45 (2H, д, J = 9 Гц), 7,63 (1H, д, J = 16 Гц).
Исходные.
Пример 37
По методике из Исходные. Пример 1 реакцией 5-формил-2-(5-метил-2-фенил-4-оксазолилметил)бензфурана с триэтилфосфоноацетатом получали этиловый эфир
(E)-3-[2-(5-метил-2-фенил-4-оксазолил-метил)бензофуран-5 -ил]акриловой кислоты. Выход 74%. Продукт перекристаллизовывали из смеси эфир-гексан и поучали бесцветные призмообразные кристаллы, т.пл.
150-151oC.
Исходные. Пример 38
По методике из Исходные. Пример 1 реакцией (E)-4-[2-(5-метил-2-фенил-4-оксазолил)этокси] коричного альдегида с
триэтилфосфоноацетатом получали этил (E)-5-[4-[2-(5- метил-2-фенил-4-оксазолил)этокси]фенил]-2,4-пентадиенат. Выход 56%. Продукт перекристаллизовывали из смеси эфир-гексан и получали бесцветные
иглообразные кристаллы, т.пл. 102-103oC.
Исходные. Пример
39
Смесь 4-(5-метил-2-фенил-4-оксазолилметокси)бензальдегида (2,9 г), пирувата натрия (3,3 г), карбоната
натрия (3,2 г), воды (80 мл) и метанола (80 мл) кипятили 6 часов, концентрировали при кипении до 1/3 начального объема и остаток экстрагировали этилацетатом.
Водный слой подкисляли концентрированной HCl, выпавший кристаллический осадок отфильтровывали и получали (E)-4-(5-метил-2-фенил-4-оксазолилметокси)бензилиденпировиноградную кислоту (1,6 г, 44%), которую перекристаллизовывали из смеси хлороформ-метанол, и выделяли бесцветные кристаллы в виде игл, т.пл. 197-198oC.
Исходные. Пример 40
К смеси
(E)-4-(5-метил-2-фенил-4-оксазолилметокси)бензилиденпировиноградной кислоты (1,3 г) и этанола (50 мл) прибавляли концентрированную серную кислоту (0,1 мл), кипятили 8 часов, выливали в воду,
экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили (MgSO4), упаривали растворитель, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1: 3, об/об), выделяли этиловый эфир (E)-4-(5-метил-2-фенил-4-оксазолилметокси)бензилиденпировиноградной кислоты (1,2 г, 86%) который перекристаллизовывали из смеси этилацетат-гексан, и получали светло-желтые призмообразные кристаллы, т.пл. 110-111oC.
Исходные. Пример 41
По методике из Исходные. Пример 22 из этилового
эфира (E)-4-(5-метил-2- фенил-4-оксазолилметокси)бензилиденпировиноградной кислоты получали этиловый эфир 2-гидрокси-4-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] масляной кислоты. Выход 89%.
ЯМР (δppm в CDCl3): 1,28 (3H, т, J = 7 Гц), 1,8-2,2 (2H, м), 2,43 (3H, с), 2,71 (2H, т, J = 7 Гц), 2,84 (1H, д, J = 5,2 Гц), 4,1-4,3 (1H, м), 4,21 (2H, кв, J == 7 Гц), 4, 97 (2H, с), 6,94 (2H, д, J = 9 Гц), 7,4-7,5 (3H, м), 7,95-8,1(2H, м).
Исходные. Примеры 42-45
По методике из Исходные. Пример 7 получали соединения, приведенные в таблице
11.
Сноска к таблице 11: 1) ЯМР (δppm в CDCl3): 1,30 (3H, т, J = 7,5 Гц), 1,3-1,5 (1H, м), 2,45 (3H, с), 2,70 (2H, кв, J = 7,5 Гц), 2,87 (2H, т, J = 7 Гц), 4,17 (2H, т, J = 7 Гц), 4,25-4,35 (2H, м), 6,23 (1H, дт, J = 16 и 6 Гц), 6,55 (1H, д, J = 16 Гц), 6,83 (2H, д, J = 9 Гц), 7,30 (2H, д, J = 9 Гц).
Исходные. Пример 46
По методике из
Исходные. Пример 7 при восстановлении этилового эфира (E)-3-[2-(5-метил-2-фенил-4-оксазолилметил)бензофуран-5-ил]акриловой кислоты получали (E)-3-[2-(5-метил-2-фенил-4-оксазолилметил)
бензофуран-5-ил]-2 -пропен-1-ол, выход 57%, при перекристаллизации которого из смеси дихлорметан-гексан получали бесцветные кристаллы в форме игл, т.пл. 156-157oC.
Исходные. Пример 47
По методике из Исходные. Пример 7 восстановлением этил (E,E)-5-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] -2,4- пентадиеноата получали (E,
E)-5-[4-[2- (5-метил-2-фенил-4-оксазол-ил)этокси]фенил]-2,4- пентадиен-1-ол, выход 63%, после перекристаллизации которого из смеси дихлорметан-гексан получали бесцветный продукт в виде чешуек, т.пл.
132-133oC.
Исходные. Примеры 48-51
По методике из Исходные. Пример 14 получали соединения, приведенные в таблице 12.
Сноска к таблице 12: 1) ЯМР (δppm в CDCl3): 1,30 (3H, т, J = 7,5 Гц), 2,2,5 (3H, с), 2,71 (2H, кв, J = 7,5 Гц), 2,90 (2H, т, J = 6,5 Гц), 4,23 (2H, т, J = 6,5 Гц), 6,60 (1H, дд, J = 16 и 7,5 Гц), 6,93 (2H, д, J = 9 Гц), 7,41 (1H, д, J = 16 Гц), 7,50 (2H, д, J = 9 Гц), 9,66 (1H, д, J = 7,5 Гц).
Исходные. Пример 52
По методике из Исходные. Пример 14 из
(E)-3-[2-(5-метил-2-фенил-4-оксазолилметил)бензофуран-5-ил] -2- пропен-1-ола получали (E)-3-[2-(5-метил-2-фенил-4-оксазолилметил)бензофуран-5-ил] акролеин, выход 93%, который перекристаллизовывали из
смеси дихлорметан-гексан и выделяли бесцветные кристаллы в виде игл, т.пл. 136-137oC.
Исходные. Пример 53
По методике из Исходные. Пример 14 из (E,
E)-5-[4-[2- (5-метил-2-фенил-4-оксазолил)этокси] фенил] -2,4-пентадиен-1-ола получали (E,E)-5-[4-[2-(5-метил-2-фенил4-оксазолил)этокси] фенил] -2,4-пентадиен-1-аль, выход 82%, который
перекристаллизовывали из смеси дихлорметангексан и получали желтые призмообразные кристаллы, т.пл. 133-134oC.
Исходные. Пример 54
Смесь
4-бромацетил-5-метил-2-фенилоксазола (2,60 г), 4-[2-(1,3-диоксолан-2-ил)этил]фенола (1,82 г), карбоната калия (1,28 г) и 2-бутанона (60 мл) перемешивали 20 часов при температуре 70-80oC,
выливали в воду.
Выпавший кристаллический осадок отфильтровывали, хроматографировали на колонке с силикагелем и из фракции, элюированной смесью хлороформ-метанол (100: 1, об/об), выделяли 4-[4-[2-(1,3-диосолан-2-ил)этил]феноксиацетил]-5-метил-2-фенил -оксазол (2,08 г. 57%), который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и выделяли бесцветные призмообразные кристаллы, т.пл. 119-120oC.
Исходные. Пример 55
По методике из Исходные. Пример 1 получали этиловый эфир
4-[2-[N-метил-N-(2-пиридил)амино]-эткси]коричной кислоты, выход 97%, перекристаллизовывали из дихлорметана-изопропилового эфира и выделяли бесцветные кристаллы в форме призм, т.пл. 80-81o
C.
Исходные. Пример 56
По методике из Исходные Пример 1 получали этиловый эфир (E)-3-[2--(5-метил-2--фенил-4-оксазолилметокси)- 5-пиридил]акриловой кислоты, выход 86%,
перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и выделяли бесцветные призмообразные кристаллы, т.пл. 109-110oC.
Исходные. Пример 57
По методике из
Исходные. Пример 7 получали (E)-3-[4-[2-[N-метил-N-(2-пиридил)амино]этокси]фенил-2-пропен-1-ол в виде масла, выход: 87%.
ЯМР (δppm в CDCl3): 3,14 (3H, с), 3,98 (2H, т, J = 5,5 Гц), 4,19 (2H, т, J = 5,5 Гц), 4,29 (2H, шир д, J = 5,5 Гц), 6,22 (1H, дт, J = 16 и б Гц), 6,45-6,6 (3H, м), 6,85 (2H, д, J = 9 Гц), 7,30 (2H, д, J = 9 Гц), 7,45 (1H, ддд, J = 8,5 Гц), 8, 1-8,2 (1H, м).
Исходные. Пример 58
По методике из Исходные. Пример 7 получали (E)-3-[2-(5-метил-2-фенил-4-оксазолилметокси)-5-пиридил] -2-пропен-1-ол, выход: 57%,
перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и выделяли бесцветные кристаллы в виде призм, т.пл. 116-117oС.
Исходные. Пример 59
По методике из
Исходные. Пример получали 4-[2-[N-метил-N-(2-пиридил)амино]этокси]коричный альдегид в виде масла, выход: 100%.
ЯМР (δppm в CDCl3): 3,15 (3H, с), 4,01 (2H, т, J = 5,5 Гц), 4,25 (2H, т, -J = 5,5 Гц), 6,5-6,7 (3H, м), 6,95 (2H, д, J = 9 Гц), 7,41 (1H, д, J = 16 Гц), 7,4-7,55 (3H, м), 8,16 (1H, дд, J = 5 и 2 и 1 Гц), 9,65 (1H, д, J = 8 Гц).
Исходные.
Пример 60
По методике из Исходные. Пример 14 получали (E)-3-[2-(5-метил-2-фенил-4-оксазолилметокси)-5-пиридил акролеин, выход: 92%, перекристаллизовывали из смеси дихлорметан-изопропиловый
эфир, выделяли бесцветные кристаллы в форме призм, т.пл. 147-148oC.
Исходные. Пример 61
К суспензии [2-(1,3-диоксолан-2-ил)этил]трифенилфосфоний бромида (18,6 г) в
тетрагидрофуране (180 мл) при -20oC прибавляли по каплям раствор н-бутиллития в гексане (1,62 м, 25,9 мл), перемешивали 2 часа, добавляли 4-[2-(2-нафтил) -5-метил-4-оксазолилметокси]
бензальдегид (12,0 г), перемешивали 4 часа при 50-55oC, выливали вводу со льдом и экстрагировали этилацетатом.
Этилацетатный слой промывали O.IN хлористоводородной кислотой и водой, сушили над сульфатом магния, отгоняли растворитель, остаток хроматографировали на колонке с силикагелем, из фракции, элюированной смесью хлороформ-метанол (100:5), выделяли кристаллы (14,8 г), которые растворяли в тетрагидрофуране (250 мл).
К раствору добавляли палладий на углероде (5%, 3,0 г), гидрировали при комнатной температуре и атмосферном давлении, катализатор отфильтровывали, фильтрат упаривали и получали 4-[4-[3-(1,3-диоксолан-2-ил)пропил]феноксиметил] -5-метил-2-(2 -нафтил)оксазол (12,1 г, 81%), который перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и выделяли бесцветные кристаллы в форме призм, т.пл. 141-142oC.
Исходные. Пример 62
По методике из Исходные, пример 1 реакцией
4-гидрокси-3-нитробензальдегида с триэтилфосфоноацетатом получали этилоый эфир (E)-4-гидрокси-3-нитрокоричной кислоты, перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и выделяли
светло-желтые кристаллы в форме игл, т.пл. 114-115oC.
Исходные. Пример 63
По методике из Исходные. Пример 23 каталитическим восстановлением этилового эфира
(E)-4-гидрокси-3-нитрокоричной кислоты получали этиловый эфир 3-(3-амино-4-гидроксифенил)пропионовой кислоты в виде масла.
ЯМР (δppm/ в CDCl3): 1,24 (3H, т, J =7 Гц), 2,5-2,9 (4H, м), 4,12 (2H, д, J = 7 Гц), 6,49 (1H, дд, J = 8 и 2 Гц), 6,60 (1H, д, J = 2 Гц), 6,64 (1H, д, J = 8 Гц).
Исходные. Пример 64
Смесь пятиокиси фосфора (P2O5) (12,9 г), гексаметилдисилоксана (29,5 г) и 1,2-дихлорбензола кипятили 10 минут, вносили этиловый эфир 3-(3-амино-4-гидроксифенил)пропионовой кислоты (4,75 г) и 2-нафтилуксусной
кислоты (4,23 г), кипятили 3 часа, выливали в воду и экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили над сульфатом магния, упаривали растворитель, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1:4, об/об), выделяли этиловый эфир 3-[2-(2-нафтилметил)бензоксазол-5-ил]пропионовой кислоты (5,95 г, 73%), перекристаллизовывали из смеси эфиризопропиловый эфир и получали бесцветные кристаллы в форме игл, т.пл. 81-82oC.
Исходные. Пример 65
К раствору этилового
эфира 3-[2-(2-нафтилметил)- бензоксазол-5-ил]пропионовой кислоты (5,8 г) в эфире (100 мл)-тетрагидрофуране (100 мл) прибавляли алюмогидрид лития (0,73 г), перемешивали 1 час при комнатной температуре,
вносили воду (4 мл), отфильтровывали нерастворимые компоненты, фильтрат упаривали при уменьшенном давлении.
Остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1:1, об/об), выделяли 3-[2-(2-нафтилметил)-бензоксазол-5-ил] пропанол (2,1 г, 41%), перекристаллизовывали из смеси дихлорметан-изопропиловый эфир и получали бесцветные кристаллы в форме призм, т.пл. 102-103oC.
Исходные. Пример 66
К раствору диметилсульфоксида (1,0 г) в дихлорметане (30 мл) при -30oC
прибавляли по каплям оксалил хлорид [(COCl)2] (0,88 г), вносили 3-2-(2-нафтилметил)бензоксазол-5-ил-пропанол (2,0 г), перемешивали 30 минут при этой температуре, прибавляли триэтиламин (3,
19 г), перемешивали 30 минут, нагревали до 0oC и выливали в 2N HCl.
Органический слой отделяли, промывали водой, сушили над сульфатом магния (MgSO4), растворитель упаривали, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1:2, об/об), выделяли 3-[2-(2-нафтилметил)-бензоксазол-5-ил]пропионовый альдегид (1,54 г, 77%), перекристаллизовывали из смеси эфиризопропиловый эфир и получали бесцветные кристаллы в форме игл, т.пл. 81-82oC.
Исходные. Пример 67
Смесь
3-[2-(2-нафтилметил)-бензоксазол-5-ил] пропанового альдегида (2,9 г), этиленгликоля (0,685 г), п-толуолсульфоновой кислоты моногидрата (0,175 г) и бензола (50 мл) кипятили 3 часа, последовательно
промывали водным раствором бикарбоната натрия, водой, сушили над сульфатом магния (MgSO4), растворитель упаривали, выделяли 5-[2-(1,3-диоксолан-2-ил)этил]-2-(2-нафтилметил)-бензоксазол (2,
95 г, 89%), перекристаллизовывали из смеси дихлорметана-изопропилового эфира и получали бесцветные кристаллы в виде призм, т.пл. 85-86oC.
Исходные. Пример 68
Смесь
2-хлорметил-5-метил-2-фенилоксазола (20,8 г), 3-гидроксибензальдегида (12,2 г), карбоната калия (27,6 г) и N,N-диметилформамида (200 мл) нагревали 2 часа при 90oC, выливали в воду и
экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили над сульфатом магния (MgSO4), упаривали растворитель и выделяли 3- (5-метил-2-фенил-4-оксазолилметокси)бензальдегид (26,5 г, 90%), перекристаллизовывали из этанола и получали бесцветные кристаллы в виде призм, т.пл. 67-68oC.
Исходные.
Пример 69
По методике из Исходные. Пример 1 получали этиловый эфир (E)-3-(5-метил-2-фенил-4-оксазолилметокси) коричной кислоты, перекристаллизовывали из этанола и получали кристаллы
бесцветные в форме призм, т.пл. 91-92oC.
Исходные. Пример 70
К раствору этилового эфира (E)-3-(5-метил-2-фенил-4-оксазолилметокси)коричной кислоты (14,0 г) в
дихлорметане (200 мл) прибавляли по каплям при охлаждении льдом раствор диизобутиллитий гидрида в толуоле (1,5M, 51 мл), перемешивали 30 минут при этой температуре, прибавляли по каплям 2N HCl (150
мл).
Органический слой отделяли, промывали водой, сушили над сульфатом магния (MgSO4), растворитель упаривали, выделяли (E)-3-(5-метил-2-фенил--4-оксазолилметокси)фенил] -2-пропен-1-ол (11,5 г, 92%), перекристаллизовывали из этилацетата и получали бесцветные кристаллы в виде призм, т.пл. 120-121oC.
Исходные. Пример 71
По методике
из Исходные. Пример 14 получали (E)-3- (5-метил-2-фенил-4-оксазолилметокси)коричный альдегид, перекристаллизовывали из смеси этилацетат-гексан и выделяли бесцветные кристаллы в виде стержней, т.пл.
103-104oC.
Исходные. Пример 72
По методике из Исходные. Пример 23 получали 2-(5-метил-2-фенил-4-оксазолилметокси)-5-нитропиридин, перекристаллизовывали из смеси
дихлорметан-изопропиловй эфир и выделяли светло-желтые кристаллы в виде призм, т.пл. 142-143oC.
Исходные. Пример 73
По методике из Исходные. Пример 24 получали
5-амино-2-(5-метил-2-фенил-4-оксазолилметокси)пиридин, перекристаллизовывали из смеси метанол-изопропиловый эфир и выделяли бесцветные кристаллы в виде призм, т.пл. 106-107oC.
Исходные. Пример 74
По методике из Исходные. Пример 25 получали 5-иод-2-(5-метил-2-фенил-4-оксазолилметокси)пиридин, перекристаллизовывали из этилацетата и выделяли бесцветные
кристаллы в виде призм, т.пл. 129-130oC.
Исходные. Пример 75
По методике из Исходные. Пример 26 получали 5-формил-2-(5-метил-2-фенил-4-оксазолилметокси)пиридин,
перекристаллизовывали из смеси этилацетат-гексан и выделяли бесцветные кристаллы в виде призм, т.пл. 116-117oC.
Исходные. Пример 76
К смеси
4-бензилоксибензальдегида (4,5 г), (1,3-диоксолан-2-илметил)трифенилфосфоний бромида и N, N-диметилформамида (50 мл) прибавляли гидрид натрия (60% в масле, 0,935 г), перемешивали 3 часа при 60oC, выливали в воду со льдом, нейтрализовали 2N HCl и экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили над сульфатом магния (MgSO4), упаривали растворитель, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной хлороформом выделяли 2-винил-1,3-диоксолановое производное (5,7 г) в виде маслообразного вещества.
Масло растворяли в этаноле (150 мл), прибавляли палладий на углероде (5%, 2,0 г), гидрировали при комнатной температуре и атмосферном давлении, катализатор отфильтровывали, фильтрат упаривали. Остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью хлороформэтилацетат (50: 1, об/об), выделяли 2-[2-(4-гидроксифенил)этил]-1,3-диоксолан в виде масла.
ЯМР (δppm в CDCl3): 1,85-2,0 (2H, м), 2,6-2,75 (2H, м), 3,8-4,15 (4H, м), 4,82 (1H, шир с), 4,88 (1H, т, J = 4,5 Гц), 6,75 (2H, д, J = 8,5 Гц), 7,07 (2H, д, J = 8,5 Гц).
Исходные. Пример 77
По методике из Исходные. Пример 1 получали сырой этиловый эфир (E)-4-изопропоксикоричной кислоты, который хроматографировали на колонке с силикагелем
при элюировании смесью эфир-гексан (1:5, об/об).
ЯМР (δppm в CDCl3): 1,33 (3H, т, J = 7 Гц), 1,35 (6H, д, J = 6 Гц), 4,25 (2H, кв, J = 7 Гц), 4,5-4,7 (1H, м), 6,30 (1H, д, J = 16 Гц), 6,87 (2H, д, J = 9 Гц), 7,46 (2H, д, J = 9 Гц), 7,63 (1H, д, J = 16 Гц).
Исходные. Пример 78
По методике из Исходные. Пример 1 получали
(E)-3-(4- изопроксифенил)-2-пропен-1-ол, который очищали хроматографией на колонке с силикагелем при элюировании смесью этилацетат-гексан (1:4, об/об).
ЯМР (δppm в CDCl3): 1,33 (6H, д, J = 6 Гц), 1,38 (1H, т, J = 6 Гц), 4,30 (2H, дт, J = 6 и 1,5 Гц), 4,45-4,65 (1H, м), 6,23 (1H, дт, J = 16 и 6 Гц), 6,56 (1H, д, J = 16 Гц), 6,84 (2H, д, J = 8,5 Гц), 7,31 (2H,n, J = 8,5 Гц).
Исходные. Пример 79
По методике из Исходные. Пример 14 получали (E)-4- изопропоксикоричный альдегид в виде масла.
ЯМР (δppm в CDCl3): 1,37 (6H, д, J = 6 Гц), 4,5-4,7 (1H, м), 6,61 (1H, дд,J = 16 и 8 Гц) 6,92 (2H, д, J = 9 Гц), 7,42 (1H, д, J = 16 Гц), 7,51 (2H, д. J = 9 Гц).
Исходные. Пример 80
К
раствору 5-[3-(4-изопропоксифенил)пропил]-2,4- оксазолидиндиона (1,5 г) в дихлорметане (70 мл) прибавляли по каплям при 0oC четыреххлористый, титан (TiCl4) (4,1 г), перемешивали
1 час при этой температуре, выливали в воду со льдом и экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили над сульфатом магния (MgSO4), упаривали растворитель, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1:4, об/об), выделяли 5-[3-(4-гидроксифенил)пропил] -2,4-оксазолидиндион (0,755 г, 59%), перекристаллизовывали из смеси ацетон-гексан и получали бесцветные кристаллы в виде призм, т.пл. 132-133oC.
Исходные. Пример 81
К смеси
4-изопропоксибензальдегиду (15,0 г), триэтил 4-фосфонокротонату (27,3 г) и N,N-диметилформамиду (100 мл) прибавляли гидрид натрия (60% в масле, 4,38 г), перемешивали 16 часов при комнатной температуре,
выливали в воду со льдом, нейтрализовали 2N HCl и экстрагировали этилацетатом.
Этилацетатный слой промывали водой, сушили над сульфатом магния (MgSO4), растворитель упаривали, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной эфиром-гексаном, выделяли этил (E,E)-5-(4-изопропоксифенил)-2,4-пентадиеноат (13,7 г, 58%), перекристаллизовывали из смеси эфир-гексан и получали бесцветные кристаллы в виде призм, т.пл. 64-65oC.
Исходные. Пример 82
По методике из Исходные. Пример 7
восстановлением этил (E,E)-5-(4-изопропоксифенил)-2,4-пентадиеноата с диизобутилалюминий гидридом получали (E, E)-5-(4-изопропоксифенил)-2,4-пентадиен-1-ол, перекристаллизовывали из изопропилового
эфира и выделяли бесцветные кристаллы в виде игл, т.пл. 91-92oC.
Исходные. Пример 83
По методике из Исходные. Пример 14 окислением (E,E)- 5-(4-изопропоксифенил)-2,
4-пентадиен-1-ола с двуокисью марганца получали (E,E)-5-(4-изопропоксифенил)-2,4-пентадиен-1-аль в виде масла.
ЯМР (δppm в CDCl3): 1,36 (6H, д, J = 6 Гц), 4,5-4,7
(1H, м), 6,22 (1H, дд, J = 15 и 8 Гц), 6,8-7,05 (4H, м), 7,26 (1H, дд, J = 15 и 10 Гц), 7,44 (2H, д, J = 9 Гц), 9,59 (1H, д, J = 8 Гц),
Исходные. Пример 84
По методике из Исходные.
Пример 80 получали 5-[5-(4-гидроксифенил]-2,4-оксазолидиндион, перекристаллизовывали из смеси эфиризопропиловый эфир и выделяли бесцветные кристаллы в виде призм, т.пл. 96-97oC.
Исходные. Пример 85
К раствору 2-(1,3-диоксолан-2-ил)этил трифенил фосфоний бромида (51,0 г) в М. М-диметилформамиде (200 мл) прибавляли порциями при охлаждении льдом гидрид натрия
(60% в масле, 4,6 г), перемешивали 15 минут, вносили 4-изопропоксибензальдегид (18,0 г), перемешивали 5 часов при 80-85oC, выливали в ледяную воду, нейтрализовали 2N HCl и экстрагировали
эфиром.
Эфирный слой промывали водой, сушили сульфатом магния, упаривали растворитель, остаток хроматографировали на колонке с силикагелем и из фракции, элюированной смесью этилацетат-гексан (1:4, об/об), выделяли 1,3-диоксолановое производное (14,5 г) в виде масла.
Полученное маслообразное вещество растворяли в этаноле (250 мл), добавляли палладий на углероде (5%, 5,0 г) в качестве катализатора, гидрировали при комнатной температуре и атмосферном давлении, катализатор отфильтровывали, фильтрат упаривали при уменьшенном давлении.
Остаток хроматографировали на колонке с силикагелем, выделяли из фракции, элюированной смесью этилацетат-гексан (1:5, об/об), 2-[3-(4-изопропоксифенил)пропил]-1,3- диоксолан (6,7 г, 24%) в виде масла.
ЯМР (δppm в CDCl3): 1,32 (6H, д, J = 6 Гц), 1,6-1,8 (4H, м), 2,5-2,65 (2H, м), 3,8-4,0 (4H, м), 4,4-4,6 (1H, м), 4,8-43 (1H, м), 6,8 (2H, д, J = 8,5 Гц), 7,07 (2H, д, J = 8,5 Гц).
Исходные. Пример 86
По методике из Исходные. Пример 80 получали 5-[4-(4-гидроксифенил)бутил] -2,4-оксазолидиндион, перекристаллизовывали из смеси
дихлорметан-метанол и выделяли бесцветные призмообразные кристаллы, т.пл. 151-152oC.
Исходные. Пример 87
По методике из Исходные. Пример 68 реакцией
4-хлорметил-5-метил-2-фенилоксазола с п-гидроксиацетофеноном получали 4-(5-метил-2-фенил-4-оксазолилметокси)ацетофенон, перекристаллизовывали из этилацетата-гексана и выделяли бесцветные кристаллы,
т.пл. 126-127oC.
Исходные. Пример 88
По методике из Исходные. Пример 88 реакцией 4-(5-метил-2-фенил-4-оксазолилметокси)ацетофенона с триметилфосфоноацетатом
получали метиловый эфир (E)-3-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] -2-бутеновой кислоты, перекристаллизовывали из этилацетата-эфира и выделяли бесцветные кристаллы, т.пл. 125-126o
C.
Исходные. Пример 89
По методике из Исходные. Пример 7 восстановлением метилового эфира (E)-3-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] -2-бутеновой кислоты с
диизобутилалюминий гидридом получали метил (E)-3-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил]-2-бутен-1-ол, перекристаллизовывали из этилацетата-эфира, т.пл. 126-127oC.
Исходные. Примеры 90
По методике из Исходные. Пример 14 окислением (E)-3-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] -2-бутен-1-ола с двуокисью марганца получали метил
(E)-3-[4-(5-метил-2-фенил-4-оксазолилметокси)фенил] -2-бутен-1-аль, перекристаллизовывали из этилацетата-эфира и получали бесцветные кристаллы, т.пл. 94-95oC.
Реферат
Производные
2,4-оксазолидиндиона общей формулы I

Формула

где R представляет собой насыщенный алифатический углеводородный остаток, имеющий от 1 до 8 атомов углерода; нафтил; пиридил, который может быть сконденсирован с бензольным кольцом, или 5-членную ароматическую гетероциклическую группу, содержащую один атом азота и один атом кислорода или один атом серы, либо три атома азота; причем указанные группы могут быть замещены прямым или разветвленным алкилом, содержащим 1 - 15 атомов углерода, возможно замещенным галоидом; алкенильной группой, имеющей 2 - 10 атомов углерода, замещенной фенилом; фенилом, возможно замещенным галоидом или низшим алкилом, содержащим 1 - 4 атома углерода, который необязательно замещен галогеном; нафтилом; фурилом; тиенилом; бензофуранилом; бензо[b]тиенилом;
Y представляет собой -CO-, -CH(OH))- или -NR3-, где R3 представляет собой алкильную группу, имеющую 1 - 4 атома углерода;
m = 0 или 1;
n = 0, 1 или 2;
Х - CH или N;
А - двухвалентный прямой или разветвленный остаток углеводородной цепи, содержащей 1 - 7 атомов углерода;
R1 и R2 каждый является водородом или алкильной группой, имеющей от 1 до 4 атомов углерода, или R1 и R2 вместе образуют 5 - 6-членную гетероциклическую систему, необязательно содержащую азот;
L и M каждый является водородом или L и M соединяются друг с другом с образованием связи,
или их фармацевтически приемлемая соль.

представляет собой группу

3. Производные по п.1, где n равно 0 или 1, R представляет собой пиридил, который может быть сконденсирован с бензольным кольцом или 5-членную ароматическую гетероциклическую группу, содержащую один атом азота и один атом кислорода или один атом серы, либо три атома азота, причем указанные группы могут быть замещены прямым или разветвленным алкилом, содержащим 1 - 15 атомов углерода, возможно замещенным галоидом; алкенильной группой, имеющей 2 - 10 атомов углерода, замещенной фенилом; фенилом, возможно замещенным галоидом или низшим алкилом, имеющим 1 - 4 атомов углерода, который необязательно замещен галогеном, нафтилом; фурилом; тиенилом; бензофуранилом; бензо[b]тиенилом; А представляет собой насыщенный двухвалентный прямой или разветвленный остаток углеводородной цепи, имеющей 1 - 4 атома углерода; L и M каждый является водородом; R1 и R2 каждый является водородом или R1 и R2 соединяются друг с другом с образованием 5-членной гетероциклической группы, содержащей азот.

представляет собой группу

14. Производное по п. 1, представляющее собой 5-(3-(4-(2-(5-метил-2-нафтил-4-оксазолил)этокси)фенил)пропил)-2,4-оксазолидиндион или его фармацевтически приемлемую соль.

представляет группу
26. Лекарственная композиция по п.24, отличающаяся тем, что является средством, снижающим содержание сахара в крови при лечении диабетов.

где R представляет собой насыщенный алифатический углеводородный остаток, имеющий от 1 до 8 атомов углерода; нафтил; пиридил, который может быть сконденсирован с бензольным кольцом, или 5-членную ароматическую гетероциклическую группу, содержащую один атом азота и один атом кислорода или один атом серы, либо три атома азота, причем указанные группы могут быть замещены прямым или разветвленным алкилом, содержащим 1 - 15 атомов углерода, возможно замещенным галоидом; алкенильной группой, имеющей 2 -10 атомов углерода, замещенной фенилом; фенилом, возможно замещенным галоидом или низшим алкилом, содержащим 1 - 4 атома углерода, который необязательно замещен галогеном; нафтилом; фурилом; тиенилом; бензофуранилом; бензо[b]тиенилом;
Y представляет собой -CO-, -C(OH)- или -NR3-, где R3 представляет собой алкильную группу, имеющую 1 - 4 атома углерода;
m = 0 или 1;
n = 0, 1 или 2;
Х - CH или N;
А - двухвалентный прямой или разветвленный остаток углеводородной цепи, содержащей 1 - 7 атомов углерода;
R1 и R2 каждый является водородом или алкильной группой, имеющей от 1 до 4 атомов углерода, или R1 и R2 вместе образуют 5 - 6-членную гетероциклическую систему, необязательно содержащую азот, который включает взаимодействие соединения общей формулы

где Z - водород, низший алкил или аралкил, а другие радикалы имеют значения, представленные выше,
с цианатом щелочного металла с последующим выделением продукта реакции в кислых условиях.
где R представляет собой насыщенный алифатический углеводородный остаток, имеющий от 1 до 8 атомов углерода; нафтил; пиридил, который может быть сконденсирован с бензольным кольцом, или 5-членную ароматическую гетероциклическую группу, содержащую один атом азота и один атом кислорода или один атом серы, либо три атома азота, причем указанные группы могут быть замещены прямым или разветвленным алкилом, содержащим 1 - 15 атомов углерода, возможно замещенным галоидом; алкенильной группой, имеющей 2 - 10 атомов углерода, замещенной фенилом; фенилом, возможно замещенным галоидом или низшим алкилом, содержащим 1 - 4 атома углерода, который необязательно замещен галогеном; нафтилом; фурилом; тиенилом; бензофуранилом; бензо[b]тиенилом;
Y представляет собой -CO-, -CH(OH)- или -NR3-, где R3 представляет собой алкильную группу, имеющую 1 - 4 атома углерода;
m = 0 или 1;
n = 0, 1 или 2;
Х - CH или N;
А1 - двухвалентный прямой или разветвленный остаток углеводородной цепи, содержащей 1 - 7 атомов углерода;
R1 и R2 каждый является водородом или алкильной группой, имеющей от 1 до 4 атомов углерода, или R1 и R2 вместе образуют 5 - 6-членную гетероциклическую систему, необязательно содержащую азот, который включает восстановление соединения общей формулы

где А является двухвалентным прямым или разветвленным остатком углеводородной цепи, содержащей 1 - 7 атомов углерода, а другие радикалы имеют значения, приведенные выше.

где R представляет собой насыщенный алифатический углеводородный остаток, имеющий от 1 до 8 атомов углерода; нафтил; пиридил, который может быть сконденсирован с бензольным кольцом, или 5-членную ароматическую гетероциклическую группу, содержащую один атом азота и один атом кислорода или один атом серы, либо три атома азота; причем указанные группы могут быть замещены прямым или разветвленным алкилом, содержащим 1 - 15 атомов углерода, возможно замещенным галоидом; алкенильной группой, имеющей 2 - 10 атомов углерода, замещенной фенилом; фенилом, возможно замещенным галоидом или низшим алкилом, содержащим 1 - 4 атома углерода, который необязательно замещен галогеном; нафтилом; фурилом; тиенилом; бензофуранилом; бензо[b]тиенилом;
m = 0 или 1;
А - двухвалентный прямой или разветвленный остаток углеводородной цепи, содержащей 1 - 7 атомов углерода; L и M каждый является водородом, или L и M соединяются друг с другом с образованием связи, который включает взаимодействие соединения, соответствующего общей формуле

где значения радикалов приведены выше,
с соединением общей формулы
R - (CO)m-CH2-Q,
где Q является уходящей группой и другие радикалы имеют значения, приведенные выше.

где R представляет собой насыщенный алифатический углеводородный остаток, имеющий от 1 до 8 атомов углерода; нафтил; пиридил, который может быть сконденсирован с бензольным кольцом, или 5-членную ароматическую гетероциклическую группу, содержащую один атом азота и один атом кислорода или один атом серы, либо три атома азота; причем указанные группы могут быть замещены прямым или разветвленным алкилом, содержащим 1 - 15 атомов углерода, возможно замещенным галоидом; алкенильной группой, имеющей 2 - 10 атомов углерода, замещенной фенилом; фенилом, возможно замещенным галоидом или низшим алкилом, содержащим 1 - 4 атома углерода, который необязательно замещен галогеном; нафтилом; фурилом; тиенилом; бензофуранилом; бензо[b]тиенилом;
Y представляет собой -CO-, -CH(OH)- или -NR3-, где R3 представляет собой алкильную группу, имеющую 1 - 4 атома углерода;
m = 0 или 1;
n = 0, 1 или 2;
Х - CH или N;
А - двухвалентный прямой или разветвленный остаток углеводородной цепи, содержащей 1 - 7 атомов углерода;
R1 и R2 каждый является водородом или алкильной группой, имеющей от 1 до 4 атомов углерода, или R1 и R2 вместе образуют 5 - 6-членную гетероциклическую систему, необязательно содержащую азот, который включает взаимодействие соединения общей формулы

где Т является формильным остатком или -CH(В)2, где В является низшим алкоксилом, низшим алкилтио или низшим ацилокси или два В соединяются с образованием этилендиокси, триметилендиокси или дитиотриметиленового кольца, а другие радикалы имеют значения, приведенные выше,
с 2,4-оксалидиндионом.
26.02.93 - по признакам п.1: соединение, где Y - CO-, n равно 0; L и M - водород; А - (СН2), (СН2)2, (СН2)3 или (СН2)4; и положение заместителя А - пара-положение по отношению к атому кислорода; п.29: соединения, где Y- -CO-; n равно 0; A - (СН2), (СН2)2, (СН2)3 или (СН2)4; и положение заместителя А - пара-положение по отношению к атому кислорода; Z - низший алкил или аралкил; п.30: соединения, где Y- -CO-; n равно 0; A - (CH2), (СН2)2, (СН2)3 или (СН2)4; положение заместителя А - пара-положение по отношению к атому кислорода; п. 32: соединения, где Y- -CO-; n равно 0; A - (СН2)2, (СН2 )3, (СН2)4, (СН2)5; (CH=CH) или (CH=CH)2; положение заместителя А - пара-положение по отношению к атому кислорода и Т - формил; соединения, где Y- -CO-; n равно 0; A - (СН2)2, (СН2)3 или (СН2)4 и положение заместителя А - пара-положение по отношению к атому кислорода и Т - CH(B)2;
09.08.93 - по признакам п.31: соединения, где L и M - атом водорода; Q - галоген; A - (СН2), (СН2)2, (СН2)3 или (СН2)4; положение заместителя А - пара-положение по отношению к атому кислорода.

Комментарии