Фенилсульфонамидные производные изоксазола и способ лечения - RU2133742C1
Код документа: RU2133742C1
Чертежи

Описание
Данная заявка является частичным продолжением заявки США N 08/021410, поданной 23 февраля 1993 года.
Данное изобретение относится к антагонистам эндотелина, полезным наряду с другими областями для лечения гипертензии.
Соединения формулы

и их фармацевтически приемлемые соли являются антагонистами эндотелиновых рецепторов, полезными в качестве противогипертензивных агентов. На протяжении данного описания приведенные выше символы определяются следующим образом:
Один из X и Y представляет азот, а другой - кислород;
R1, R2 и R3 каждый независимо представляет собой
(a) водород, за исключением того, что R1 является иным, чем водород;
(b) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкилалкенил, циклоалкенилалкил, арил, арилокси, аралкил, или аралкокси, каждый из которых может быть замещен заместителем Z1, Z2 и Z3;
(c) галоид;
(d) гидроксил;
(e) циано;
(f) нитро;
(g)-C(O)H или -C(O)R6;
(h) - CO2H или -CO2R6;
(i) - SH, -S(O)nR6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH, или -O-S(O)m-OR6;
(j) -Z4-NR7R8; или
(k) -Z4 -N(R11)-Z5-NR9R10;
R4 и R5 каждый независимо представляет собой:
(a) водород;
(b) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, арилокси, аралкил, или аралкокси, каждый из которых может быть замещен заместителем Z1, Z2 и Z3;
(c) галоид;
(d) гидроксил;
(e) циано;
(f) нитро;
(g) -C(O)H или -C(O)R6;
(h) -CO2H или -CO2R6;
(i) -SH, -S(O)nR6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH, или -O-S(O)m -OR6;
(j) -Z4-NR7R8;
(k) -Z4-N(R11 )-Z5-NR9R10; или
(l) R4 и R5 вместе представляют алкилен или алкенилен (любой из которых может быть замещен заместителями Z1, Z2 и Z3), завершающий 4 - 8-членное насыщенное или ненасыщенное или ароматическое кольцо вместе с атомами углерода, к которым они присоединены;
R6 представляет алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен заместителями Z1, Z2 и Z3;
R7 представляет собой:
(a) водород;
(b) алкил, алкенил, аклинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен заместителем Z1, Z2 и Z3;
(c) циано;
(d) гидроксил;
(e) -C(O)H или -C(O)R6;
(f) -CO2R6;
(g) -SH, -S(O)nR6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)m-R6, -O-S(O)mOH или -O-S(O)m-OR6, за исключением случая, когда Z4 представляет -S(O)n-;
R8 представляет собой:
(a) водород;
(b) -C(O)H или -C(O)R6, за исключением случая, когда Z4 представляет -C(O)- и R7 представляет -C(O)H, -C(O)R6, или -CO2R6;
(c) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен заместителями Z1, Z2 и Z3; или
R7 и R8 вместе представляют алкилен или алкенилен (любой из которых может быть замещен заместителями Z1, Z2 и Z3), завершающий 3 - 8-членное насыщенное, ненасыщенное или ароматическое кольцо вместе с атомом азота, к которому они присоединены;
R9 представляет собой:
(a) водород;
(b) гидроксил;
(c) -C(O)H или -C(O)R6;
(d) -CO2R6;
(e) -SH, -S(O)nR6 , -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH или -O-S(O)m -OR6;
(f) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен заместителем Z1, Z2 и Z3;
R10 представляет собой:
(a) водород;
(b) -C(O)H или -C(O)R6, за исключением случая, когда Z5 представляет -C(O)- и R9 представляет -C(O)H, -C(O)R6, или -CO2R6; или
(c) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен заместителем Z1, Z2 и Z3;
R11 представляет собой:
(a) водород;
(b) гидроксил;
(c) -C(O)H, -C(O)R6 или -CO2R6; или
(d) алкил, алкенил, алкинил, алкокси, циклоалкил, цилоалкилалкил, циклоалкенил, циаклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен заместителями Z1, Z2 и Z3;
или любые два из R9, R10 и R11 вместе представляют алкилен или алкенилен (любой из которых может быть замещен заместителями Z1, Z2 и Z3), завершающий 3 - 8-членное, насыщенное, ненасыщенное или ароматическое кольцо вместе с атомами, к которым они присоединены;
Z1, Z2 и Z3 каждый независимо представляет:
(a) водород;
(b) галоид;
(c) гидрокси;
(d) алкил;
(e) алкенил;
(f) аралкил;
(g) алкокси;
(h) арилокси;
(i) аралкокси;
(j) -SH, -S(O)nZ6, -S(O)m-OH, -S(O)m-OZ6, -O-S(O)m-Z6, -O-S(O)mOH или -O-S(O)m-OZ6;
(l) оксо;
(k) нитро;
(m) циано;
(n) -C(O)H или -C(O)Z6;
(o) -CO2H или -CO2Z6;
(p) -Z4NZ7 Z8;
(q) -Z4-N(Z11)-Z5-Z6; или
(r) -Z4-N(Z11)-Z5-NZ7Z8;
Z4 и Z5 каждый независимо представляет собой:
(a) одинарную связь;
(b) - Z9-S(O)n-Z10-;
(c) -Z9-C(O)-Z10-;
(d) -Z9-C(S)-Z10-;
(e) -Z9-O-Z10-;
(f) -Z9-S-Z10-; или
(g) -Z9-OC(O)-Z10-;
Z6, Z7 и Z8 каждый независимо представляет водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкениалкил, арил или аралкил, или Z7 и Z8 вместе представляют алкилен или алкенилен, завершающий 3 - 8-членное насыщенное, ненасыщенное или ароматическое кольцо вместе с атомом азота, к которому они присоединены;
Z9 и Z10 каждый независимо представляет одинарную связь, алкилен, алкенилен или алкинилен;
Z11 представляет собой:
(a) водород;
(b) гидроксил;
(c) -C(O)H, -C(O)Z6 или -CO2Z6;
(d) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил;
или любые два из Z7, Z8 и Z11 вместе представляют алкилен или алкенилен, завершающий 3 - 8-членное насыщенное, ненасыщенное или ароматические кольцо вместе с атомами, к которым они присоединены;
m составляет 1 или 2;
n представляет 0, 1 или 2.
Для соединений I предпочтительным
является следующее:
R1 представляет фенил или фенокси,
необязательно замещенный алкилом, алкокси, -NZ7Z8, галоидом или гидроксигруппой;
R2
и R3 каждый независимо представляет водород, алкил или -NR7R8;
R4 и R5 представляет алкил; и
R7, R8,
Z7 и Z8 каждый независимо представляет водород, алкил,
или -C(O) алкил.
Наиболее предпочтительными являются соединения, в которых:
R1
представляет фенил или фенокси, необязательно замещенный алкилом, алкокси, амино,
алкиламино, диалкиламино, алканоиламино или гидроксигруппой;
R2 и R3 каждый независимо
представляет собой водород, алкил с 1-4 атомами углерода, амино, алкиламино,
диалкиламино или алканоиламиногруппу; и
R4 и R5 представляют алкил с 1-4 атомами углерода,
особенно метил.
Ниже приводятся определения терминов, используемых в данном описании. Эти определения относятся к терминам, используемым по всему данному описанию, в отдельности или в виде части какой-либо иной группы, если нет иных ограничений в конкретных случаях.
Термины "алкил" и "алкокси" относятся к углеводородным группам с прямой или разветвленной цепью, имеющим 1 - 10 атомов углерода. Термин "низший алкил" и "низший алкокси" относятся к группам с числом атомов углерода 1 - 4, которые являются предпочтительными.
Термин "арил" или "ар-" относится к фенилу, нафтилу и бифенилу.
Термин "алкенил" относится к углеводородным группам с прямой или разветвленной цепью, имеющим от 2 до 10 атомов углерода и имеющим по крайней мере одну двойную связь. Предпочтительными являются группы с двумя - четырьмя атомами углерода.
Термин "алкинил" относится к группам с прямой или разветвленной цепью с 2 - 10 атомами углерода, имеющим по крайней мере одну тройную связь. Предпочитаются группы с двумя - четырьмя атомами углерода.
Термин "алкилен" относится к мостику с прямой цепью из 1 - 5 атомов углерода, соединенных одинарными связями (например, -(CH2)x-, где x составляет от 1 до 5), которые могут быть замещены 1 - 3 низшими алкильными группами.
Термин "алкенилен" относится к мостику с прямой цепью из 2 - 5 атомов углерода, имеющему одну или две двойные связи, то есть который соединяется одинарными связями и может быть замещен 1 -3 алкильными группами. Примерами алкениленовых групп являются -CH=CH-CH=CH, -CH2-CH=CH-, -CH2-CH=CH-CH2-, -C(CH3)2CH=CH- и -CH(C2H5 )-CH=CH.
Термин "алкинилен" относится
к мостику с прямой цепью из 2 - 5 углеродных атомов, который содержит в себе тройную связь, соединяется одинарными связями и может быть замещен 1
- 3 низшими алкильными группами. Примерами
алкиниленовых групп являются -C≡C-, -CH2-C≡C-, -CH(CH3)-C≡C- и -C≡C-CH(C2H5)CH2-.
Термин "алканоил"
относится к группам формулы -C(O) алкил.
Термины "циклоалкил" и "циклоалкенил" относятся к циклическим углеводородным группам с 3 - 8 атомами углерода.
Термины "галоген" и "галоид" относятся к фтору, хлору, брому и иоду.
Соединения формулы I образуют соли, которые также включены в объем данного изобретения. Предпочтительными являются фармацевтически приемлемые (т.е. нетоксичные, физиологически приемлемые) соли, хотя полезны также и другие соли, например, при отделении или очистке соединений данного изобретения.
Соединения формулы I могут образовывать соли с щелочными металлами, такими как натрий, калий и литий, с щелочно-земельными металлами, такими как кальций и магний, и органическими основаниями, такими как дициклогексиламин, бензатин, N-метил-D-глюкамид и гидрабамин, и с аминокислотами, такими как аргинин, лизин и аналогичные. Такие соли могут получаться с помощью реакции соединения I с желаемым ионом в среде, в которой соль осаждается, или в водной среде с последующей лиофилизацией.
Когда R1 - R5 заместителя включают основной фрагмент, такой как амино или замещенный амино, соединение I может образовывать соли с разнообразными органическими и неорганическими кислотами. Такие соли включают соли, образуемые с соляной кислотой, бромистым водородом, метансульфокислотой, серной, уксусной, малеиновой кислотой, бензолсульфонатом, толуолсульфонатом и различными другими сульфонатами, нитратами, фосфатами, боратами, ацетатами, тартратами, малеатами, цитратами, сукцинатами, бензоатами, аскорбатами, салицилатами и аналогичными. Такие соли могут образовываться с помощью взаимодействия соединения I в эквивалентном количестве кислоты в среде, в которой соль выпадает в осадок, или в водной среде с последующей лиофилизацией.
В дополнение к сказанному, когда R1 - R5 заместители включают основной фрагмент, такой как амино, могут образовываться цвиттерионы ("внутренние соли").
Некоторые из R1 - R5 заместителей соединения I могут содержать асимметричные атомы углерода. Такие соединения формулы I могут существовать, следовательно, в энантиомерной и диастереомерной формах и в виде их рацемических смесей. Все они охватываются объемом данного изобретения.
Соединения формулы I являются антагонистами ET-1, ET-2 и/или ET-3 и полезны при лечении всех эндотелинзависимых нарушений. Таким образом, они полезны в качестве антигипертензивных агентов. При назначении для введения композиции, имеющей одно (или сочетание) из соединений данного изобретения, понижается кровяное давление гипертензивных млекопитающих (например, человека).
Соединения настоящего изобретения также полезны при лечении расстройств, связанных с функцией ренальных, гломерулярных и мезангиальных клеток, включающих хроническую ренальную недостаточность, гломерулярные повреждения, ренальные повреждения, вторичные для старческого возраста, нефросклероз (особенно гипертензивный нефросклероз), нефротоксичность (включая нефротоксичность, связанную с визуализующими и контрастными агентами), и аналогичные. Соединения данного изобретения могут быть также полезными при лечении нарушений, связанных с паракринной и эндокринной функцией.
Соединения настоящего изобретения полезны также при лечении эндотоксемии или эндотоксинового шока.
Соединения настоящего изобретения полезны также в качестве противоишемических агентов для лечения, например, сердечной, ренальной и церебральной ишемии и аналогичных.
Кроме того, соединения данного изобретения могут быть также полезными в качестве противоаритмических агентов; противоангинных агентов; антифибрилляторных агентов; противоастматических агентов; для лечения инфаркта миокарда; лечения периферийных сосудистых заболеваний (например, болезни Рэйнод'а); противоатеросклеротических агентов; для лечения сердечной гипертрофии (например, гипертрофической кардиомиопатии); для лечения легочной гипертензии; в качестве добавок к кардиоплегическим растворам для аппаратов искусственного экстракорпорального кровообращения; вспомогательных средств для тромболитического лечения; для лечения сосудистых расстройств центральной нервной системы, таких как внезапные приступы, мигрень и субарахноидальное кровоизлияние; лечения нарушений центральной нервной системы, связанных с поведением; для лечения желудочно-кишечных заболеваний, таких как язвенный колит и болезнь Крон'а; противодиарейных агентов; для регулирования роста клеток; и для лечения гепатотоксичности и внезапной смерти (остановки сердца).
Соединения данного изобретения могут также формулироваться в сочетании с ингибиторами эндотелинпревращающих ферментов (ECE), такими как фосфорамидон; антагонистами фактора активации тромбоцитов (PAF); антагонистами рецептора ангиотензина II (АП); ингибиторами ренина; ингибиторами агниотензинпревращающих ферментов (ACE), такими как каптоприл, зофеноприл, фосиноприл, церанаприл, алацеприл, эналаприл, делаприл, пентоприл, хинаприл, рамиприл, лизиноприл, и соли этих соединений; ингибиторами нейтральной эндопептидазы (NEP); блокаторами кальциевых каналов, активаторами калиевых каналов; бета-адренэргическими агентами; противоаритмическими агентами; диуретиками, такими как хлоротиазид, гидрохлортиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид или бензотиазид, а также этакриновая кислота, трикринафен, хлорталидон, фуросемид, музолимин, буметанид, триамтерен, амилорид и спиронолактон и соли этих соединений; тромболитическими агентами такими, как активатора тканевого плазминогена (тРА), рекомбинантный тРА, стрептокиназа, урокиназа, проурокиназа и комплекс анизоилированного плазминоген-стрептокиназного активатора (APSAC). При формулировании в виде фиксированной дозировочной формы в таких комбинированных продуктах соединения данного изобретения применяются в интервале дозировок, описанных ниже, а другие фармацевтически активные агенты - в пределах принятых дозировок. Соединения данного изобретения могут также формулироваться с полезными противогрибковыми и иммуноподавляющими агентами такими, как амфотерицин B, циклоспорины и аналогичные, для противодействия гломерулярному сокращению и нефротоксичности, вторичной по отношению к таким соединениям. Соединения данного изобретения могут также использоваться в сочетании с гемодиализом.
Соединения данного изобретения могут вводиться орально или парентерально разнообразным млекопитающим, которые известны как подверженные таким заболеваниям, например людям, в эффективном количестве в интервале доз примерно от 0.1 до 100 мг/кг, предпочтительно примерно от 0.2 до 50 мг/кг и более предпочтительно примерно от 0.5 до 25 мг/кг (или примерно от 1 до 2500 мг, предпочтительно примерно от 5 до 2000 мг) в виде единственной или 2 - 4-кратных раздельных суточных доз.
Активное вещество может использоваться в такой композиции, как таблетки, капсулы, растворы или суспензии, содержащей примерно от 5 до 500 мг на единичную дозу соединения или смеси соединений формулы I, или в топической или местной форме для заживления ран (0.01 - 5% по весу соединения формулы I, для обработки 1 - 5 раз в день). Они могут компаундироваться обычным образом с физиологически приемлемым носителем, эксципиентом, связующим, предохраняющим агентом, стабилизатором, вкусовым или ароматизирующим агентом и др., или с топическим носителем таким, как Пластибаз (минеральное масло, желированное полиэтиленом), как это принято в обычной фармацевтической практике.
Соединения данного изобретения могут также назначаться для топического или локального применения для лечения заболеваний периферических сосудов, и являясь таковыми, они могут формироваться в виде крема или мази.
Соединения формулы I могут также формироваться в виде таких композиций, как стерильные растворы или суспензии для парентерального применения. Примерно от 0.1 до 500 мг соединения формулы I компаундируется с физиологически приемлемым носителем, эксципиентом, связующим, предохраняющим агентом, стабилизатором и др., в форме дозированных единиц, как это принято в фармацевтической практике. Количество активного вещества в этих композициях или препаратах является таким, чтобы получалась подходящая дозировочная форма с дозой в указанном интервале.
Соединения настоящего изобретения могут быть получены следующим образом.
Амин формулы II

обрабатывается кислотой (например, соляной кислотой) и нитритом натрия в растворителе (например, воде, уксусной кислоте) при температуре примерно -20 - 0oC, с последующей обработкой двуокисью серы и солью меди (I) (например, хлоридом меди (I)) в растворителе (например, уксусной кислоте) при температуре примерно 5 - 30oC с образованием сульфонилгалогенида III

Сульфонилгалогенид III сочетается с изоксазоламином IV

в безводном органическом растворителе (например, пиридина) с образованием соединения I.
Соединение I, в котором R1, R2 или R3 представляет арил, может получаться с помощью катализируемого металлом (например, палладием (0)) сочетания ассоциированного галоидного соединения (в котором R1, R2 или R3 представляет галоген) с арилметаллоидами (т.е. арильными производными олова, кремния, бора и аналогичных, такими как фенилбороновая кислота). Смотрите, например, процедуры примера 4. Фенилбороновая кислота может получаться с помощью обработки арилгалогенида н-бутиллитием или магниевой стружкой в тетрагидрофуране и добавления триметилбората и наконец соляной кислоты. Альтернативно фенилбороновая кислота может быть получена с помощью добавления фенилмагнийбромида к раствору триметилбората и гашения водной соляной кислотой. В зависимости от желаемого результата, некоторые фенилбороновые кислоты могут получаться с помощью смешения арилдигалогенида с палладием (0) и добавления реактива Гриньяра с получением желаемого арилгалогенида перед обработкой арилгалогенида, описанной выше.
Также в зависимости от желаемого результата некоторые фенилбороновые кислоты могут получаться с помощью ортолитиирования замещенного бензола. Обработка замещенного бензола, например, н-бутиллитием, удаляет ортопротон. Последующая обработка B(OCH3)3 и HCl дает в результате ортозамещенную фенилбороновую (борную) кислоту.
Имеются также несколько других альтернативных методов получения соединения формулы I, в котором, в частности, R1 представляет арил. Например, соединение формулы I может получаться с помощью катализируемого металлом (например, палладием (0)) сочетания галоидбензолсульфонамида с фенилбороновой кислотой. Получающийся в результате бифенилсульфонамид вводится в реакцию с галоидизоксазолом и основанием (например, карбонатом цезия Cs2CO3).
Альтернативно галоидбензолсульфонилхлорид может подвергаться взаимодействию с пирролом. Продукт присоединяется с использованием металлического (например, палладиевого (0)) катализатора к замещенной фенилборной кислоте, обрабатывается основанием (например, гидроокисью натрия), а затем пятихлористым фосфором, и, наконец, обрабатывается изоксазоламином формулы IV.
Соединения формулы I могут также получаться с помощью обработки галоидбензола, замещенного в метаположении, ClSO3H. Получающийся в результате замещенный галоидбензолсульфонилхлорид затем обрабатывается, как описано выше.
Для соединений, в которых любой из R1-R5 включает реакционноспособные функциональные группы, реагенты могут обрабатываться защитными агентами перед реакцией присоединения. Аминовая часть сульфорамидного ядра также может нуждаться в защите, когда добавляются различные R1, R2 и R3 группы. Подходящие защищающие агенты и процедуры их использования обычно известны в технике. Примерами защитных групп являются бензил, галоидкарбобензилокси, тозил и аналогичные для гидроксила; карбобензилокси, галоидкарбобензилокси, ацетил, бензоил, метоксиэтоксиметил и аналогичные - для амино. Азот сульфонамида может защищаться метоксиэтоксиметилом, триметилсилилэтоксиметилом, третбутилом и аналогичными. Защитные группы могут удаляться из получающихся в результате защищенных аналогов соединения I с помощью обработки одним или большим числом деблокирующих агентов. Подходящие деблокирующие агенты и процедуры для их использования обычно известны в технике.
Для образования соединения I, в котором одна или
более из групп R1-R3 представляет - NR7R8 и R7 и/или R8 представляет - C(O)R6, ассоциированная нонацилсульфоновая
кислота

обрабатывается водой и гидроокисью щелочного металла (например, гидроокисью натрия) с образованием соли сульфоновой кислоты VI

где M+ представляет ион лития, натрия или калия.
Соль VI обрабатывается ацилирующим агентом (например, уксусным ангидридом) при температуре около 90 - 110oC или в ацилирующем агенте в качестве растворителя, или в безводном органическом растворителе (например, пиридина) с образованием ациламина формулы VI, в которой одна или более из групп R1, R2 и R3 представляет -NR7R8 и по крайней мере один из R7 и R8 представляет -C(O)R6. Ациламин VI затем обрабатывается раствором галоидсульфоновой кислоты (например, хлорсульфоновой кислоты) или каким-либо другим галоидирующим агентом (например, пятихлористым фосфором, тионилхлоридом) при температуре примерно 0oC - 80oC с образованием ацилсульфонового галогенида III, который сочетается с изооксазоламином IV, как описано выше, образуя соединение I, в котором по крайней мере один из R1, R2 и R3 представляет -NR7R8 и по крайней мере один из R7 и R8 представляет собой -C(O)R6 .
Для образования соединения I, в котором одни или более из R1 - R3 представляет алкокси, сульфокислота V, в которой один или более из R1 - R3 представляет гидрокси, может обрабатываться алкилирующим агентом (например, диметилсульфатом) и гидроокисью щелочного металла (например, гидроокисью натрия) в водно-органической смеси растворителей (например, вода/этанол). Получающаяся в результате соль VI алкоксисульфоновой кислоты может использоваться, как описано выше, для получения соединения I.
Моноамины формулы I (например, имеющие -NR7R8, где один из R7 и R8 представляет водород) получаются из свободного амина (например, в котором R7 и R8 оба представляют водород). Свободный амин обрабатывается (1) кетоном или альдегидом (например, ацетоном), (2) восстанавливающим агентом (например, цианоборгидридом натрия) или газообразным водородом (H2) и катализатором (например, палладием на угле) и (3) кислотой (например, уксусной кислотой, соляной кислотой) в органическом растворителе (например, метаноле) с образованием моноаминового соединения I. Диамины формулы I, конечно, могут получаться аналогичным образом.
Моноамины формулы I (например, имеющие -NR7R8, где один из R7 и R8 представляет водород) могут также получаться из ациламина с помощью обработки восстанавливающим агентом, например боратом.
Изобретение ниже будет описано с помощью следующих рабочих примеров, которые представляют предпочтительное воплощение данного изобретения. Эти примеры предназначены для иллюстрации, но не для ограничения объема изобретения.
Пример 1.
N-(3,4-Диметил-5-изоксазолил)[1, 1'-бифенил]-2-сульфонамид.
А. 2-Фенилбензолсульфонил хлорид.
2-Аминобифенил (5.08 г, 30 моль) добавлялся в виде одной порции к смеси концентрированной соляной кислоты (10 мл) и ледяной уксусной кислоты (3 мл) в химическом стакане, снабженном механической мешалкой. Мутная розовая хлоргидратная соль охлаждалась на сухой бане лед - этанол до -10oC. Добавлялся раствор нитрита натрия (2.24 г, 32.5 ммоль) в воде (3.5 мл) по каплям с такой скоростью, чтобы температура не превышала -5oC. Смесь перемешивалась в течение 45 минут при поддержании температуры в интервале между -10o и -5oC. В отдельном химическом стакане газообразная двуокись серы барботировалась через 30 мл ледяной уксусной кислоты при энергичном перемешивании в течение 20 минут. К раствору добавлялся хлорид меди (I) (0.75 г), и барботаж двуокиси серы в виде газа продолжался до тех пор, пока желто-зеленая суспензия не становилась голубовато-зеленой, и большая часть твердых веществ не растворялась (около 30 минут). Данная смесь охлаждалась до 10oC на ледяной бане при перемешивании, и к ней добавлялась диазотирующая смесь порциями в течение 30 минут, после чего ледяная баня удалялась, и смесь оставлялась нагреваться до комнатной температуры. Зеленая смесь перемешивалась в течение дополнительных 30 минут и выливалась в ледяную воду (100 мл, 1:1) и камедеобразное (липкое) твердое вещество, выпавшее в осадок, экстрагировалось эфиром (3х75 мл). Объединенные экстракты промывались насыщенным раствором бикарбоната натрия до тех пор, пока они не становились нейтральными и промывались водой (2х50 мл), сушились (сульфат магния) и концентрировались в вакууме, давая 5.0 г (66%) соединения A в виде светло-коричневого твердого вещества.
B. N-(3,4-Диметил-5-изоксазолил)[1,1'-бифенил]-2-сульфонамид.
К раствору 3, 4-диметил-5-изоксазоламина (1.32 г, 11.8 ммоль) в сухом пиридине (5 мл) добавлялось соединение A (2.5 г, 9.8 ммоль) порциями на протяжении 15 минут.
Дополнительно добавлялся пиридин для доведения общего объема до приблизительно 10 мл. Полученный в результате темный красно-коричневый раствор перемешивался в течение ночи при комнатной температуре. Реакционная смесь добавлялась по каплям к ледяной воде (100 мл, 1:1), и полученный в результате дегтеобразный осадок фильтровался через Целит®, и фильтрат подкислялся 6н. соляной кислотой до pH 2. Коричневое твердое вещество фильтровалось, промывалось водой и сушилось. Это твердое вещество очищалось мгновенной хроматографией на силикагеле смесью этилацетат:гексан (1:1), давая 1.1 г (34%) соединения примера 1 в виде желтого твердого вещества.
Т.пл. 171-173oC.
Анализ для C17H16N6O3S (328.4).
Вычислено: C 62.18; H 4.91; N 8.53; S 9.76.
Найдено: C 62.27; H 4.92; N 8.39; S 10.02.
Пример 2.
N-(3,4-Диметил-5-изоксазолил)-2-бромбензолсульфонамид.
К раствору 3.0 г (11.74 ммоль) 2-бромбензолсульфонилхлорида в 10 мл пиридина добавлялось 1.32 г (11.74 ммоль) 3,4-диметил-5-изоксазоламина. Смесь перемешивалась при комнатной температуре в атмосфере аргона в течение ночи, добавлялись 150 мл ледяной воды и смесь фильтровалась. Фильтрат подкислялся до pH 2 с использованием 6н. водной соляной кислоты, и серое вещество фильтровалось и сушилось. Твердое вещество кристаллизовалось из смеси метанол/вода, при этом получалось 4.0 г (более, чем 100%) соединения примера 2 в виде рыжевато-коричневых кристаллических игл.
Т.пл. 125-126o C.
Анализ для C11H11BrN2O3S.
Вычислено: C 39.89, H 3.35, N 8.46, S 9.68, Br 24.13.
Найдено: C 39.32, H 3.35, N 8.21, S 9.52, Br 24.08.
Пример 3.
N-(3,4-Диметил-5-изоксазолил)-2-феноксибензолсульфонамид.
A. 2-Феноксибензолсульфонихлорид.
К раствору 6.0 г (32.4 ммоль) 2-феноксианилина в 15 мл концентрированной соляной кислоты и 5 мл ледяной уксусной кислоты при -5oC добавлялся раствор нитрата натрия (2.35 г, 34 ммоль) в 5 мл воды по каплям в течение 15 минут. Раствор перемешивался в течение дополнительного часа при -5oC. Во время деазотирования барботировалась двуокись серы в виде газа через 30 мл ледяной уксусной кислоты до тех пор, пока не произойдет насыщение (около 10 минут). Затем добавлялся хлорид меди (1.5 г) и введение двуокиси серы продолжалось (около 20 минут) до тех пор, пока желто-зеленая суспензия не превращалась в голубовато-зеленую. Смесь охлаждалась до -10oC и раствор, содержащий диазониевую соль, добавлялся порциями в течение 15 минут. Зеленая реакционная смесь нагревалась до комнатной температуры и перемешивалась еще в течение дополнительного часа. Добавлялась вода (150 мл), и раствор экстрагировался эфиром (3х100 мл). Объединенные эфирные экстракты промывались повторно 5%-ным водным бикарбонатом натрия (5х150 мл) до тех пор, пока не станут нейтральными, а затем водой (150 мл) и сушились и упаривались, давая 2.75 г соединения A в виде коричневого сиропа.
B. N-(3,4-Диметил-5-изоксазолил)-2-фенокси-бензолсульфонамид.
К раствору 2.7 г неочищенного соединения A (10 ммоль) в 15 мл пиридина добавлялось 0.79 г (7 ммоль) 3,4-диметил-5-изоксазоламина, и раствор перемешивался при комнатной температуре в течение ночи. Раствор разбавлялся 150 мл ледяной воды, и остаток в виде смолы (2.5 г) отфильтровывался. Фильтрат подкислялся до pH с использованием 6н. водной соляной кислоты, и твердое вещество отфильтровывалось (0.23 г) и хроматографировалось на 10 г двуокиси кремния с использованием 1: 1 смеси гексаны/этилацетат, давая 0.16 г (7%) соединения примера 3 в виде белого кристаллического твердого вещества.
Точка плавления: 181-182oC.
Анализ для C17H16N2O4S.
Вычислено: C 59.29, H 4.68, N 8.13, S 9.31.
Найдено: C 59.15, H 4,57, N 8.08, S 9.35.
Пример 4.
3'-Амино-N-(3,4-диметил-5-изоксазолил)[1,1-бифенил]-2- сульфонамид.
A. 2-Бром-N-(3, 4-диметил-5-изоксазолил)-N'-(метоксиэтоксиметил)- бензолсульфонамид.
К раствору 1.1 г (3.33 ммоль) 2-бром-N-(3,4-диметил-5-изоксазолил) бензолсульфонамида (пример 2) в 15 мл тетрагидрофурана при комнатной температуре в атмосфере аргона добавлялось 0.19 г (4.8 ммоль) гидрида натрия (60% суспензия в минеральном масле) порциями, и раствор перемешивался при комнатной температуре в течение 10 минут. Затем добавлялся метоксиэтоксиметилхлорид (0.55 г, 4.4 ммоль), и раствор перемешивался на протяжении ночи. Смесь концентрировалась и разбавлялась 30 мл воды и экстрагировалась 3х40 мл этилацетатом. Объединенные органические экстракты промывались 50 мл солевого раствора, сушились и выпаривались; давая 1.2 г (87%) соединения A в виде коричневой смолы.
B. 3'-Амино-N-(3,4-диметил-5-изоксазолил)-N'- (метоксиэтоксиметил)-[1,1'-бифенил]-2-сульфонамид.
К раствору 1.12 г (2.67 ммоль) соединения A и 0.15 г (0.13 ммоль) тетракис (трифенилфосфин) палладия (0) в 15 мл бензола в атмосфере аргона, добавлялось 7.6 мл 2 М водного карбоната натрия с последующим добавлением 0.46 г (2.93 ммоль) 3-аминофенилбороновой кислоты в 5 мл 95% этанола. Смесь нагревалась с обратным холодильником на протяжении ночи, разбавлялась 35 мл воды, и экстрагировалась 3х35 мл этилацетатом. Объединенные органические экстракты промывались один раз 35 мл солевого раствора, сушились и выпаривались. Остаток хроматографировался на 120 г силикагеля с использованием смеси гексаны/этилацетат (1: 2), давая 0.75 г (65%) соединения B в виде смолы.
C. 3'-Амино-N-(3,4-диметил-5-изоксазолил)[1,1'-бифенил]-2- сульфонамид.
К раствору 0.72 г (1.7 ммоль) соединения B в 10 мл 95% этанола, 10 мл 3н. водной соляной кислоты добавлялось, и раствор нагревался с обратным холодильником в течение 7 часов. Смесь концентрировалась, разбавлялась 40 мл воды и нейтрализовалась до pH 7 с использованием водного бикарбоната натрия. Смесь экстрагировалась этилацетатом 4х50 мл, и объединенные органические экстракты промывались один раз 50 мл солевого раствора, сушились и выпаривались. Остаток хроматографировался на 25 г двуокиси кремния с использованием смеси метиленхлорид:метанол (97:3) и растирался со смесью эфир/гексаны, давая 86 мг соединения примера 4 в виде рыжевато-коричневого твердого вещества.
Точка плавления: 157-160oC.
Анализ для C17H17N3O3S - 0.1 C6H14.
Вычислено: C 60.05, H 5.27, N 11.94, S 9.11.
Найдено: C 59.83, H 5.11, N 11.55, S 8.69.
Пример 5.
2-Фтор-N-(3,4-диметил-5-изоксазолил)бензолсульфонамид.
К раствору 2.88 г (25.7 ммоль) 3,4-диметил-5-изоксазоламина в 15 мл пиридина добавлялось 5.0 г (25.7 ммоль) 2-фторбензолсульфонилхлорида. Смесь перемешивалась при комнатной температуре на протяжении ночи, выливалась в 100 мл ледяной воды, и получающаяся смесь фильтровалась. Фильтрат подкислялся до pH 2 с использованием 6н. водной соляной кислоты, и твердое вещество отфильтровывалось и сушилось, давая 3.2 г (46%) соединения примера 5 в виде рыжевато-коричневого твердого веществ.
Точка плавления: 122-124oC.
Анализ для C11H11FN2O3S.
Вычислено: C 48.88, H 4.10, N 10.36, S 11.86, F 7.03.
Найдено: C 48.93, H 3.77, N 10.38, S 12.10, F 6.70.
Пример 6.
N-[3-[[3,4-Диметил-5-изоксазолил)амино]сульфонил]-4-метилфенил]- ацетамид.
A. 5-Амино-2-метилбензолсульфоновая кислота, натриевая соль.
К суспензии 5-амино-2-метилбензолсульфоновой кислоты (25 г, 134 ммоль) в воде (100 мл) добавлялась 4н. гидроокись натрия (34 мл). Получающийся чистый коричневый раствор выпаривался, и остающееся коричневое твердое вещество промывалось несколько раз эфиром и сушилось, давая 31.3 г соединения A в виде коричневого твердого вещества (более, чем 100%).
B.
5-Ацетиламино-2-метилбензолсульфоновая кислота, натриевая сол.ь
Суспензия сырого соединения A (25 г, примерно 107 ммоль) в уксусном ангидриде (100 мл) нагревалась при 100oC в
течение 3 часов, оставлялась стоять на протяжении ночи при комнатной температуре и выпаривалась. Остаточное коричневое твердое вещество суспендировалось в эфире, суспензия фильтровалась, и твердое
вещество промывалось дважды эфиром, давая 32.3 г соединения B в виде рыжевато-коричневого твердого вещества (более, чем 100%), которое оказывалось гигроскопичным.
C. 5-Ацетиламино-2-метилбензолсульфонилхлорид.
Смесь соединения B (18 г, примерно 71.6 ммоль) и пятихлористого фосфора (30 г, 143 ммоль) нагревалась при 75oC при перемешивании в течение 2.25 часов, в течение которых твердые вещества ожижались до коричневой смолы. Смесь охлаждалась, и темно-коричневое полутвердое вещество выливалось в ледяную воду (400 мл). Коричневое твердое вещество, которое образовывалось, отфильтровывалось, промывалось водой и растворялось в метиленхлориде. Органический раствор промывался водой и сушился (сульфатом магния) и выпаривался, давая 14.4 г коричневой пенистой смолы. Данное вещество растворялось в метиленхлориде и пропускалось через слой двуокиси кремния с использованием 50% этилацетат/гексановой смеси, давая 10.2 г коричневой камеди (смолы). Мгновенная хроматография (флеш-хроматография) на двуокиси кремния с использованием смеси 60% этиленацетат/гексаны давала 2.01 г соединения C (11%) в виде светло-желтого масла, которое кристаллизовалось при стоянии.
D. N-[3-[[(3.4-Диметил-5-изоксазолил) амино] сульфонил]-4-метилфенил] ацетамид.
Раствор соединения C (1.02 г, 4.12 ммоль), 3, 4-диметил-5-изоксазоламина (0.55 г, 4.94 ммоль) и диметиламинопиридина (0.10 г, 0.82 ммоль) в 4 мл пиридина нагревалась при 70oC в течение 2.25 часов, охлаждался и выливался на ледяную разбавленную соляную кислоту. Получающееся в результате рыжевато-коричневого твердое вещество отфильтровывалось, прополаскивалось водой и растворялось в 10% смеси изопропанол/метиленхлорид. Раствор сушился (сульфатом магния) и выпаривался, давая 1.09 г коричневой пенистой смолы, которая подвергалась мгновенной хроматографии на двуокиси кремния (2%, затем 3%, затем 5%, затем 10% метанол/метиленхлорид), давая 0.37 г чистого соединения примера 6 в виде белой пены. Получалось также 0.43 г нечистого соединения примера 6. Кристаллизация чистого вещества из водного этанола давала 0.25 г соединения примера 6 (19%) в виде легких рыжевато-коричневых кристаллов.
Точка плавления: 203-204oC.
Анализ для C14H17N3O4S.
Вычислено: C 52.00, H 5.30, N 12.99, S 9.91.
Найдено: C 51.81, H 5.31, N 12.86, S 9.94.
Пример 7.
5-Амино-N-(3,4-диметил-5- изоксазолил)- 2-метилбензолсульфонамид.
Раствор неочищенного соединения примера 6 (0.40 г, 1.24 ммоль) в 4н. гидроокиси натрия (4 мл, 16 ммоль) и метанола (1 мл) нагревался при 65oC в течение 4.5 часов, охлаждался, и метанол выпаривался. Остаток экстрагировался эфиром, и водный раствор подкислялся до pH 2.5 концентрированной соляной кислотой и экстрагировался дважды 10% изопропанол/метиленхлорид. Органическая фаза сушилась (сульфатом магния) и выпаривалась, давая 0,37 г желтого масла, которое кристаллизовалось при стоянии. Перекристаллизация из водного состояния этанола давала 0.24 г соединения примера 7 (69%) в виде светлых рыжевато-коричневых игл.
Точка плавления: 204-205oC.
Анализ для C12H15N3O3S.
Вычислено: C 51.23, H 5.37, N 14.94, S 11.40.
Найдено: C 51.52, H 5,37, H 14.92, S 11.57.
Пример 8.
N-(3,4-Диметил-5-изоксазолил)-2-(1-метилэтил)-бензолсульфонамид.
A. 2-Изопропилбензолсульфонат, натриевая соль.
К раствору 30% перекиси водорода (10 мл) в ледяной уксусной кислоте (10 мл) при 50oC добавлялся раствор 2-изопропилтиофенола (1 г, 6.58 ммоль) в 5 мл ледяной уксусной кислоты на протяжении 1 часа. После того, как добавление завершалось, реакционная смесь нагревалась до 60oC в течение 1 часа. Реакционная смесь концентрировалась в вакууме, и остаток лиофилизовался из воды, давая 1.3 г белого твердого вещества. Твердое вещество (теоретически 6.5 ммоль) растворялось в 5 мл воды, и добавлялась 4н. водная гидроокись натрия (1.62 мл, 6.5 ммоль). Раствор лиофилизовался, давая 1.4 г (100%) соединения A в виде белого твердого вещества.
MC (M+NH4)+218; (M - H)- 199.
B. 2-Изопропилбензолсульфонилхлорид.
К суспензии соединения A (600 мг, 2.50 ммоль) в хлороформе (20 мл) добавлялась хлорсульфоновая кислота (0.33 мл, 5.0 ммоль) по каплям для поддержания температуры реакции ниже 50o C. Реакционная смесь нагревалась до 60oC на протяжении ночи, охлаждалась до комнатной температуры и выливалась в смесь лед - вода. Водный раствор экстрагировался из хлороформа (три раза). Объединенные органические фазы сушились над сульфатом натрия. Растворитель удалялся в вакууме, давая 410 мг (74.5%) соединения B.
C. N-(3, 4-Диметил-5-изоксазолил)-2-(1-метилэтил)-бензолсульфонамид.
Раствор соединения B (410 мг, 1.88 ммоль), диметиламинопиридина (60 мг, 0.49 ммоль) и 3,4-диметил-5-изоксазоламина (230 мг, 2.06 ммоль) в пиридине (8 мл) нагревался на масляной бане при 70oC в течение 2 часов. Реакционная смесь выливалась на ледяную 10% соляную кислоту. Смесь экстрагировалась этилацетатом (три раза), и объединенные органические фазы экстрагировались 10% водным бикарбонатом натрия. Водный раствор подкислялся до pH 3 и экстрагировался этилацетатом (три раза). Объединенные органические фазы промывались насыщенным хлоридом натрия, сушились над сульфатом натрия и выпаривались. Остаток наносился на силикагельную колонку (20х130 мм) и элюировался смесью этилацетат: гексаны (1: 1). Фракции, обогащенные продуктом, объединялись и выпаривались. Остаток наносился на три 20х20 хроматографические толстые пластины. Пластины элюировались смесью 1:1 эфир:гексаны. Желаемые полосы вырезались и экстрагировались этилацетатом. Силикагель отфильтровывался, и органический растворитель выпаривался, давая 192.2 г (35%) соединения примера 8 в виде желтого полутвердого вещества.
MC: (M + H)+295.
Анализ для C14H18N2O3S - 0.58 H2O.
Вычислено: C 55.15, H 6.34, N 9.19, S 10.52.
Найдено: C 55.22, H 6.42, N 9.12, S 10.72.
Пример 9.
N-(3,4-Диметил-5-изоксазолил)-2-нитро-бензолсульфонамид.
К раствору 4.04 г (36 ммоль) 3,4-диметил-5-изоксазолина в 15 мл пиридина добавлялось 8.0 г (36 ммоль) 2-нитробензолсульфонилхлорида и раствор перемешивался при комнатной температуре всю ночь. Смесь выливалась в 100 мл ледяной воды и фильтровалась. Фильтрат подкислялся до pH 2 с использованием 6N водной соляной кислоты и смесь экстрагировалась 4 х 125 мл этилацетатом. Объединенные органические экстракты промывались 75 мл солевого раствора, сушились и упаривались, давая 9.1 г темно-коричневого остатка. Это вещество хроматографировалось на силикагеле с использованием смеси гексаны/этилацетат (2: 1) для получения 0.5 г соединения примера 9 в виде светло-желтого твердого вещества.
Точка плавления: 91-94oC.
Анализ для C11H11N3O5
S
Вычислено: C 44.44, H 3.73, N 14.13, S 10.78.
Найдено: C 44.75, H 3.69, N 14.01, S 11.06.
Пример 10.
2-Амино-N-(3, 4-диметил-5-изоксазолил)бензолсульфонамид.
К суспензии 135 мг 10% палладия на угле в 20 мл метанола в атмосфере аргона добавлялось 0.9 г (3.03 ммоль) N-(3, 4-диметил-5-изоксазолил)-2-нитробензолсульфонамида (примера 9) в 20 мл метанола. Раствор гидрировался из шара, заполненного водородом, в течение 90 минут. Смесь фильтровалась через целит, и фильтрат концентрировался, давая 0.9 г смолы. Данное вещество хроматографировалось на двуокиси кремния сначала с использованием смеси 9:1 метиленхлорид/метанол, а затем 1:1 гексаны:этилацетат, давая 0.2 г (24%) соединения примера 10 в виде белого твердого вещества.
Точка плавления: 116-118oC.
Анализ для C11H13N3O3 S.
Вычислено: C 49.43, H 4.90, N 15.72, S 11.99.
Найдено: C 49.56, H 4,80, N 15.62, S 11.89.
Пример 11.
N-(3, 4-Диметил-5-изоксазолил)-4'-метил[1,1'-бифенил]-2-сульфонамид.
A. 4'-Метил-N-(3,4-диметил-5-изоксазолил)-N-(метоксиэтоксиметил)-[1,1'- бифенил]-2-сульфонамид.
К раствору 0.78 г (1.86 ммоль) соединения A из примера 4 и 0.096 г (0.08 ммоль) тетракис(трифенилфосфин)палладия(O) в 15 мл бензола в атмосфере аргона добавлялось 8.0 мл 2 М водного карбоната натрия с последующим добавлением 0.38 г (2.79 ммоль) 4-метилфенилбороновой кислоты в 10 мл 95% этанола. Смесь нагревалась с обратным холодильником на протяжении ночи и разбавлялась 50 мл воды и экстрагировалась 3 х 100 мл этилацетата. Объединенные органические экстракты промывались один раз 100 мл солевого раствора, сушились и выпаривались. Остаток хроматографировался на 100 г силикагеля с использованием смеси гексаны : этилацетат (2 : 1), давая 0.65 г (81%) соединения A в виде бесцветной смолы.
B. N-(3,4-Диметил-5-изоксазолил)-4'-метил[1,1'-бифенил]-2-сульфонамид.
К раствору 0.56 г (1.3 ммоль) соединения A в 10 мл 95% этанола добавлялось 10 мл 3н. водной соляной кислоты, и раствор нагревался с обратным холодильником в течение 18 часов. Смесь концентрировалась и разбавлялась 25 мл воды. Смесь экстрагировалась 3 х 50 мл этилацетата, и объединенные органические экстракты промывались один раз 50 мл солевого раствора, сушились и выпаривались. Кристаллизация остатка (0.41 г) из смеси гексаны : этилацетат давала 0.37 г (83%) соединения примера 11 в виде двух сборов.
Точка плавления: 126 - 127oC.
Анализ для C18H18N2O3S.
Вычислено: C 63.14, H 5.30, N 8.18, S 9.36.
Найдено: C 63.03, H 5.29, N 8.07, S 9.34.
Пример 12.
2'-Амино-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
A. 2'-Амино-N-(3,4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)- метил] [1, 1'-бифенил]-2-сульфонамид.
К раствору соединения A из примера 4 (0.5 г, 1.19 ммоль) и тетракис(трифенилфосфин)палладия(O) (0.062 г, 0.05 ммоль) в 10 мл бензола в атмосфере аргона добавлялось 4.0 мл 2 М водного карбоната натрия, а затем 2-амино-фенилбороновая кислота (0.245 г, 1.79 ммоль) в 5 мл 95% этанола. Смесь нагревалась с обратным холодильником в течение 10 часов, разбавлялась 50 мл воды и экстрагировалась этилацетатом (3 х 50 мл). Объединенные органические экстракты промывались один раз 50 мл солевого раствора, сушились и выпаривались. Остаток хроматографировался на 75 г силикагеля с использованием смеси гексаны : этилацетат (2 : 1), давая 0.39 г (76%) соединения A в виде бесцветной смолы.
B. 2'-Амино-N-(3, 4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
К раствору соединения A (0.35 г, 0.81 ммоль) в 10 мл 95% этанола, 10 мл 3н. водной соляной кислоты добавлялось, и раствор нагревался с обратным холодильником в течение 6 часов. Смесь концентрировалась, разбавлялась 10 мл воды, нейтрализовалась насыщенным водным бикарбонатом натрия и подкислялась до pH 4 с использованием ледяной уксусной кислоты. Смесь экстрагировалась этилацетатом (3 х 25 мл), и объединенные органические экстракты промывались один раз 50 мл солевого раствора, сушились и выпаривались. Хроматография остатка на 50 г силикагеля с использованием смеси гексаны : этилацетат (1 : 1) давала 0.087 г смолы. Повторные кристаллизации из смеси этилацетат : метанол : гексаны (1 : 1: 20) давали соединение примера 12 в виде светло-коричневого твердого вещества.
Температура плавления: 182 - 183oC.
Анализ для C17H17N3O3S.
Вычислено: C 59.46, H 4.99, N 12.24, S 9.34.
Найдено: C 59.17, H 5.04, N 11.87, S 9.73.
Пример 13.
3'-(Диметиламино)-N-(3, 4-диметил-5-оксазолил)[1,1'-бифенил] -2- сульфонамид.
К раствору соединения примера 4 (0.46 г, 1.34 ммоль) в метаноле (15 мл) добавлялся 37% водный формальдегид (0.44 мл, 5.36 ммоль) и ледяная уксусная кислота (0.49 г) при перемешивании. Добавлялся цианоборгидрид натрия (0.34 г, 5.36 ммоль) на протяжении 10 минут, и раствор перемешивался на протяжении ночи. Смесь концентрировалась до около 10 мл, разбавлялась водой (40 мл) и экстрагировалась этилацетатом (3 х 35 мл). Объединенные органические экстракты промывались солевым раствором (50 мл), сушились (сульфат магния) и выпаривались. Смола (0.45 г), полученная таким образом, хроматографировалась на 100 г силикагеля с использованием смеси гексаны : этилацетат (3 : 1), давая 0.21 г (42%) соединения примера 13 в виде не совсем белого твердого вещества.
Температура плавления: 67 - 70oC.
Анализ для C19H21N3O3 S-0.25H2 O.
Вычислено: C 60.69, H 5.79, N 11.18, S 8.53.
Найдено: C 60.92, H 5.74, N 10.95, S 8.33.
Пример 14.
N-(3, 4-Диметил-5-изоксазолил)-2-(трифторметил)бензолсульфонамид.
К раствору 1.38 г (12.26 ммоль) 3,4-диметил-5-изоксазоламина в 10 мл пиридина добавлялась 3.0 г (12.26 ммоль) 2-трифторметилбензолсульфонилхлорида, и раствор перемешивался при комнатной температуре в атмосфере аргона на протяжении ночи. Смесь добавлялась к 100 мл ледяной воды и фильтровалась. Фильтрат подкислялся до pH 2 и использованием 6н. водной соляной кислоты, и полученная в результате смола фильтровалась и хроматографировалась на силикагеле (200 г) с использованием 3% метанола в метиленхлориде, давая бесцветную смолу. Данное вещество кристаллизовалось из смеси гексаны : этилацетат, давая 2.0 г (51%) соединения примера 14 в виде белых кристаллических игл.
Температура плавления: 99 - 100oC.
Анализ для C12H11F3N2O3S.
Вычислено: C 45.00, H 3.46, N 8.75, S 10.01, F 17.80.
Найдено: C 44.67, H 3.55, N 8.74, S 10.51, F 18.19.
Пример 15.
2-Хлор-N-(3,4-диметил-5-изоксазолил)-6-метил-бензолсульфонамид.
Соединение примера 15 получалось из 3,4-диметил-5-изоксазоламина и 2-хлор-6-метилбензолсульфонилхлорида, как описано для соединения примера 14. Кристаллизация из смеси метанол/вода давала соединение примера 15 в виде белых кристаллических призм.
Температура плавления: 181 - 182oC.
Анализ для C12H13ClN2O3S.
Вычислено: C 47.92, H 4.36, N 9.31, S 10.66, Cl 10.66.
Найдено: C 47.61, H 4.25, N 9.07, S 10.67, Cl 10.67.
Пример 16.
4'-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)[1,1'-бифенил] -2- сульфонамид.
A. 4'-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)-N-[(2- метоксиэтокси)метил][1, 1'-бифенил]-2-сульфонамид.
Соединение A получалось из 4-диметиламинофенилборной кислоты и соединения A из примера 4, как описано для соединений A из примера 12. Хроматография на силикагеле с использованием смеси 3 : 1 гексаны : этилацетат давала соединение A в виде бесцветной смолы.
B. 4'-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)[1, 1'-бифенил]-2- сульфонамид.
Соединение примера 16 получалось из соединения A, как описано для примера 12, при нагревании с обратным холодильником в течение 8 часов. Перед экстрагированием этилацетатом водная фаза доводилась до pH 6 с использованием ледяной уксусной кислоты. Хроматография на силикагеле с использованием смеси 2 : 1 гексаны/этилацетат давала соединение примера 16 в виде бесцветных призм.
Температура плавления: 135 - 136oC.
Анализ для C19H21N3O3S.
Вычислено: C 61.44, H 5.70, N 11.31, S 8.63.
Найдено: C 61.26, H 5.55, N 11.15, S 8.99.
Пример 17.
N-[2'-[[(3, 4-Диметил-5-изоксазолил)амино]сульфонил][1,1'-бифенил]- 3-ил] ацетамид.
К раствору соединения примера 4 (0.3 г, 0.87 ммоль) в пиридине (5 мл), добавлялся уксусный ангидрид (0.13 г), и смесь перемешивалась при комнатной температуре на протяжении ночи. Смесь концентрировалась и разбавлялась водой (30 мл) и экстрагировалась этилацетатом (3 х 25 мл). Объединенные органические экстракты промывались солевым раствором (30 мл), сушились (сульфатом магния) и выпаривались. Белое твердое вещество (0.31 г), полученное таким образом, хроматографировалось на 75 г силикагеля с использованием смеси гексаны: этилацетат (2:1), давая 0.18 г (54%) соединения примера 17 в виде белого твердого вещества.
Т.пл. 168-171oC.
Анализ для C19H19N3O4S.
Вычислено: C 59.21, H 4.97, N 10.90, S 8.32.
Найдено: C 59.33, H 4.86, N 10.57, S 8.47.
Пример 18.
N-(3,4-Диметил-5-изоксазолил)-4'-пропил[1,1'-бифенил]-2-сульфонамид.
A. 4-Пропилфенилборная кислота.
К раствору триметилбората (2.6 г, 25 ммоль) в 10 мл эфира при -78oC в атмосфере аргона на протяжении 15 минут добавлялся 4-пропилфенилмагнийбромид (1.7 М раствор в эфире, 14.7 мл, 25 ммоль). Спустя 30 минут нахождения при -78oC раствор подогревался до комнатной температуры и перемешивался на протяжении 90 минут. Реакционная смесь гасилась добавлением 10% водной соляной кислоты (75 мл), и после 10 минут раствор экстрагировался эфиром (3 х 100 мл). Объединенные эфирные экстракты экстрагировались 1 М гидроокисью натрия (2 х 100 мл), и водные экстракты подкислялись разбавленной соляной кислотой до pH 2 и экстрагировались эфиром (2 х 100 мл). Объединенные эфирные экстракты промывались один раз водой (100 мл), сушились и выпаривались, давая 1.85 г (45%) соединения A в виде рыжевато-коричневого твердого вещества.
Т.пл. 95-96oC.
B. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] - 4'-пропил[1,1'-бифенил]-2-сульфонамид.
Соединение B получалось из соединения A и соединения A из примера 4, как описано для соединения A примера 12. Хроматография на силикагеле с использованием смеси гексаны: этилацетат (3:1) давала соединение B в виде бесцветной смолы.
C. N-(3,4-Диметил-5-изоксазолил)-4'-пропил[1,1'-бифенил]-2-сульфонамид.
К раствору 0.70 г (1.53 ммоль) соединения B в 15 мл 95% этанола добавлялось 15 мл 3н. водной соляной кислоты. Раствор нагревался с обратным холодильником в течение 11 часов, концентрировался и разбавлялся 25 мл воды. Смесь экстрагировалась этилацетатом (3 х 50 мл), и объединенные органические экстракты промывались один раз 50 мл солевого раствора, сушились и выпаривались. Хроматография на 100 г силикагеле с использованием смеси 4:1, а затем 3:1 гексаны/этилацетат (1 л) давала 0.38 г (67%) соединения примера 18 в виде бесцветной смолы.
Анализ для C20H22N2O2S.
Вычислено: C 64.84, H 5.99, N 7.56, S 8.65.
Найдено: C 64.52, H 5.98, N 7.26, S 8.30.
Пример 19.
2-(Диметиламино)-N-(3, 4-димтеил-5-изоксазолил)бензолсульфонамид.
Соединение примера 19 получалось из соединения примера 10, как описано для примера 13. Хроматография на силикагеле с использованием смеси гексаны: этилацетат (4:1) давала соединение примера 19 в виде бесцветной смолы.
Анализ для C13H17N3O3S.
Вычислено; C 52.87, H 5.80, N 14.23, S 10.85.
Найдено: C 52.99, H 5.87, N 14.06, S 11.28.
Пример 20.
2'-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)-[1, 1'-бифенил] -2-сульфонамид.
А. 2'-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси-метил]- [1,1'-бифенил]-2-сульфонамид.
К раствору соединения А из примера 12 (0.45 г, 1.04 ммоль) в 15 мл метанола в атмосфере аргона добавлялись ледяная уксусная кислота (1 мл) и 37% водный формальдегид (0.25 мл, 3.13 ммоль). Раствор перемешивался в течение 15 минут, добавлялся по каплям на протяжении 15 минут цианоборгидрид натрия (0.20 г, 3.13 ммоль) в 5 мл метанола, и раствор перемешивался в течение 24 часов. Смесь выпаривалась, добавлялась вода (25 мл), и смесь экстрагировалась этилацетатом (2 х 50 мл). Объединенные органические экстракты сушились и выпаривались, давая 0.39 г (81%) соединения А в виде светло-коричневой смолы, которая затвердевала при стоянии.
В. 2'-(Диметиламино)-N- (3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
Соединение примера 20 получалось из соединения А, как описано для примера 12. Последующая хроматография на силикагеле с использованием смеси 3:1 гексаны: этилацетат, кристаллизация из смеси метиленхлорид (примерно 1:5) давали соединение примера 20 в виде бесцветных призм.
Т.пл. 148-150oC.
Анализ для C19H21N3O3S.
Вычислено: C 61.44, H 5.70, N 11.31, S 8.63.
Найдено: C 61.32, H 5.69, N 11.30, S 8.72.
Пример 21.
N-(3,4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил]-2-сульфонамид.
А. 4-Изобутил-фенилкарбоновая кислота.
У суспензии 0.68 г (28.15 ммоль) магниевые стружек в 50 мл тетрагидрофурана в атмосфере аргона добавлялся кристаллик иода, и добавлялся раствор 4-бром-изобутилбензола (6.0 г, 28.15 ммоль) в 25 мл тетрагидрофурана с такой скоростью, чтобы поддерживалось спокойное нагревание с обратным холодильником. Смесь нагревалась с обратным холодильником еще в течение 1 часа, охлаждалась до комнатной температуры и добавлялась порциями на протяжении 15 минут к раствору триметилбората (2.93 г, 28.15 ммоль) в 50 мл эфира при -78oC в атмосфере аргона. После 30 минут нахождения при -78oC раствор подогревался до комнатной температуры, перемешивался в течение 90 минут, и добавлялась 10% водная соляная кислота (100 мл). Спустя 10 минут раствор экстрагировался эфиром (3 х 100 мл), и объединенные эфирные экстракты экстрагировались 1 M гидроокисью натрия (3 х 100 мл). Водные экстракты подкислялись соляной кислотой до pH 2 и экстрагировались эфиром (3 х 100 мл), объединенные эфирные экстракты промывались один раз водой (100 мл), сушились и выпаривались, давая 3.5 г белого твердого вещества. Кристаллизация из смеси эфир/гексаны давала 2.3 г (46%) соединения А в виде белого твердого вещества в двух сборах.
Т. пл. 134-135oC.
В. N-(3, 4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил]-[4'-(2-метилпропил)] [1,1'-бифенил]-2-сульфонамид.
Соединение В получалось из соединения А и соединения А при примера 4, как описано для соединения А из примера 12. Хроматография на силикагеле с использованием смеси гексаны/этилацетат (3: 1) давала соединение В в виде бесцветной смолы.
С. N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'- бифенил]-2-сульфонамид.
Соединение примера 21 получалось из соединения В, как описано для примера 18. Хроматография на силикагеле с использованием смеси 3:1 гексаны/этилацетат с последующей кристаллизацией из смеси метиленхлорид/гексаны давала соединение примера 21 в виде бесцветных призм.
Т. пл. 126o C.
Анализ для C21H24N2O3S.
Вычислено: C 65.60, H 6.29, N 7.29, S 8.34.
Найдено: C 65.59, H 6.16, N 7.28, S 8.50.
Пример 22.
4'-Бутил-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
А. 4-Бутил-фенилборная кислота.
К раствору 1-бром-4-бутилбензола (6.24 г, 29.3 ммоль) в тетрагидрофуране (32 мл) и эфире (96 мл) при -78oC добавлялся по каплям н-бутиллитий (1.6 М в гексане, 21.9 мл, 35.1 ммоль). Смесь перемешивалась при - 78oC в течение 30 минут и добавлялась на протяжении 20 минут к раствору триметилбората (6.1 г, 58,6 ммоль) в эфире (64 мл) при -78oC. Смесь перемешивалась при -78oC в течение 30 минут и при комнатной температуре на протяжении ночи. Добавлялась 10% водная соляная кислота (150 мл), смесь встряхивалась в течение 10 минут, эфирный слой отделялся, а водный слой экстрагировался эфиром (100 мл). Объединенные органические фазы экстрагировались 1н. гидроокисью натрия (3 х 100 мл), и объединенные водные экстракты промывались один раз эфиром, подкислялись до pH 1 6н. соляной кислотой и экстрагировались эфиром (3 х 100 мл). Объединенные органические фазы промывались водой, сушились (сульфатом магния) и концентрировались, давая соединение А (2.0 г, 38%).
В. 4' -Бутил-N-(3,4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] [1,1'- бифенил]-2-сульфонамид.
Соединение В получалось из соединения А и соединения А из примера 4, как описано для соединения А примера 12. Хроматография на силикагеле с использованием смеси 40:1 метиленхлорид/этилацетат давала соединение В в виде бесцветной смолы.
С. 4'-Бутил-N-(3,4-диметил-5-изоксазол)[1,1'-бифенил]-2-сульфонамид.
Соединение С получалось из соединения В, как описано в примере 18, при нагревании с обратным холодильником в течение 8 часов. Хроматография на силикагеле с использованием смеси 3:1 гексаны/этилацетат с последующей кристаллизацией из смеси метиленхлорид/гексаны давала соединение примера 22 в виде бесцветных кристаллов.
Т.пл. 92-93oC.
Анализ для C21H24N2O3S.
Вычислено: C 65.60, H 6.29, N 7.29, S 8.34.
Найдено: C 65.35, H 6.23, N 7.29, S 8.68.
Пример 23.
N-(3,4- Диметил-5-изоксазолил)-2-(1-нафталенил)-бензолсульфонамид.
A. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил]2-(1-нафталенил)- бензолсульфонамид.
Соединение А получалось из 1-нафталинборной кислоты и соединения А примера 4, как описано для соединения А примера 12, при нагревании с обратным холодильником в течение 3.5 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат (3:1) давала соединение А в виде бесцветной смолы.
В. N-(3,4-Диметил-5-изоксазолил)-2-(1-нафталинил) бензолсульфонамид.
Соединение В получалось из соединения А, как описано в примере 18, с использованием 6н. соляной кислоты и нагревания с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием смеси 3:1 гексаны/этилацетат с последующей кристаллизацией из смеси метиленхлорид/гексаны давала соединение примера 23 в виде бесцветных призм.
Т. пл. 182 - 183oC.
Анализ для C21H18N2 O3S.
Вычислено: C 66.65, H 4.79, N 7.40, S 8.47.
Найдено: C 66.53, H 4.79, N 7.53 S 8.41.
Пример 24.
N-(3, 4-Диметил-5-изоксазолил)-3'-(2-метилпропил)-[1,1'-бифенил]-2-сульфонамид.
А. 3-Бром-изобутилбензол.
К раствору 1-иод-3-бромбензола (6.0 г, 21.2 ммоль) в 100 мл бензола при комнатной температуре в атмосфере аргона добавлялось 1.2 г (1.06 ммоль) тетракис(трифенилфосфин)палладия(0), и к данной смеси добавлялось по каплям на протяжении 15 минут 2 М раствор в тетрагидрофуране изобутилмагнийбромида (10.6 мл). Смесь перемешивалась в течение 2 часов, разбавлялась 100 мл воды, органический слой отделялся, и водный слой экстрагировался 2 х 100 мл эфиром. Объединенные органические экстракты сушились и выпаривались, давая 4.3 г бесцветной жидкости, которая после перегонки в вакууме давала 1.95 г (43%) соединения А в виде бесцветной жидкости.
Т. кип. 121-125oC (15-20 мм).
B. 3-Изобутил-фенилборная кислота.
Соединение В получалось из соединения А, как описано для соединения А примера 21, кристаллизации из смеси эфир/гексаны давала соединение В в виде бесцветного твердого вещества.
Т. пл. 84-86oC.
С. N-(3, 4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] -3'- (2-метилпропил)[1,1'-бифенил]-2-сульфонамид.
Соединение С приготавливалось из соединения В и соединения А из примера 4, как описано для соединения А примера 12, при нагревании с обратным холодильником в течение 6 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат (3:1) давала соединение С в виде бесцветной смолы.
D. N-(3,4-Диметил-5-изоксазолил)-3'-(2-метилпропил)-[1,1'- бифенил]-2-сульфонамид.
Соединение D получалось из соединения С, как описано в примере 18, при нагревании с обратным холодильником в течение 10 часов. Хроматография на силикагеле с использованием смеси 3:1 гексаны:этилацетат с последующей обратно-фазной препаративной жидкостной хроматографией высокого разрешения (30 х 500 мм ODS S10 колонка с использованием 85% растворителя А (90% MeOH, 10% вода, 0.1% TFA) и 15% растворителя В (10% MeOH, 90% вода, 0.1% TFA)) давала соединение примера 24 в виде бесцветной смолы.
1H ЯМР (CDCl3): d 1.04 (д., J = 6.4 Гц, 6H), 1.94 (с., 3H), 2.02 (м., 1H), 2.26 (с., 3H), 2.64 (Д., J =7.0 Гц, 2H), 6,66 (шир.с., 1H), 7.32 - 8.16 (м., 8H).
Анализ для C21H24N2O3S - 0.42 H2O.
Вычислено: C 64.33, H 6.39, N 7.14, D 8.18.
Найдено: C 64.31, H 6.16, N 7.16, S 7.99.
Пример 25.
N-(3,4-Диметил-5-изоксазолил)-4'-(2-метилпропокси)-[1, 1'- бифенил]-2-сульфонамид.
A. 4-(2-Метилпропокси)-фенилборная кислота.
Соединение А приготавливалось из 4-(2-метилпропокси)бромбензола и триметилбората, как описано для соединения А примера 21. Кристаллизация из смеси эфир/гексаны давала соединение А в виде белого твердого вещества.
В. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] -4'-(метилпропокси) [1, 1'-бифенил]-2-сульфонамид.
Соединение В получалось из соединения А и соединения А из примера 4, как описано для соединения А примера 12, при нагревании с обратным холодильником в течение 4 часов. Хроматография на силикагеле с использованием смеси 40:1 метиленхлорид/этилацетат давала соединение C в виде бесцветной смолы.
С. N-(3,4 -Диметил-5-изоксазолил)-4'-(2-метилпропокси)-[1,1'-бифенил]-2-сульфонамид.
Соединение С получалось из соединения В, как описано для соединения примера 18, при нагревании с обратным холодильником в течение 8 часов. Хроматография на силикагеле с использованием смеси 15: 1 метиленхлорид/этилацетат давала соединение примера 25 в виде бесцветного твердого вещества.
Т. пл. 50-53oC.
Анализ для C21H24N2O4S-0.7H2O.
Вычислено: C 61.06, H 6.20, N 6,78, S 7.76.
Найдено: C 61.28, H 5.96, N 6.66, S 8.11.
Пример 26.
N-(3,4-Диметил-5-изоксазолил)-4'-(1-метилэтокси)-[1,1'-бифенил] - 2-сульфонамид.
A. 4-(1-Метилэтокси)-фенилборная кислота.
Соединение A получалось из 4-(1-метилэтокси)бромбензола и триметил бората, как описано для соединения A примера 21. Кристаллизация из смеси эфир/гексаны давала соединение A в виде белого твердого вещества.
B. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил]- 4'-(1-метилэтокси)[1,1'-бифенил]-2-сульфонамид.
Соединение B получалось из соединения A и соединения A примера 4, как описано для соединения A из примера 12, при нагревании с обратным холодильником в течение 5 часов. Хроматография на силикагеле с использованием 4:1 смеси гексаны/этилацетат давала соединение B в виде бесцветной смолы.
C. N-(3,4-Диметил-5-изоксазолил)-4'-(1-метилэтокси)-[1, 1'-бифенил]- 2-сульфонамид.
Соединение C получалось из соединения B, как описано для соединения примера 18, при нагревании с обратным холодильником в течение 2 часов. Хроматография на силикагеле с использованием 4:1 смеси гексаны/этилацетат давала соединение примера 26 в виде бесцветного твердого вещества.
Т.пл. 49-52oC.
Анализ для C20H22N2O4S.
Вычислено: C 62.16, H 5.74, N 7.25, S 8.30.
Найдено: C 61.98, H 5.71, N 7.12, S 8.17.
Пример 27.
N-(3,4-Диметил-5-изоксазолил)-4'-(фенилметилокси)-[1,1'-бифенил] - 2-сульфонамид.
A. 4-Фенилметокси-фенилборная кислота.
К раствору 4-фенилметокси-бромбензола (6.0 г, 23 ммоль) в тетрагидрофуране (25 мл) и эфире (75 мл) при -78oC в атмосфере аргона добавлялся бутиллитий (1.6 М раствор в гексане, 14.25 мл) на протяжении 15 минут. Смесь перемешивалась 15 минут и переносилась с помощью трубочки (канюли) на протяжении 15 минут в раствор триметилбората (4.73 г, 45.6 ммоль) в 50 мл эфира при -78oC в атмосфере аргона. После нахождения в течение 30 минут при -78oC раствор подогревался до комнатной температуры и перемешивался в течение еще 60 минут. Добавлялся 10% водный раствор соляной кислоты (150 мл), и через 10 минут раствор экстрагировался эфиром (3 х 100 мл). Объединенные эфирные экстракты экстрагировались 1 М гидроокисью натрия (3 х 100 мл), и объединенные водные экстракты подкислялись разбавленной соляной кислотой до pH 2 и экстрагировались эфиром (3 х 100 мл). Объединенные эфирные экстракты промывались один раз водой (100 мл), сушились и выпаривались, давая белое твердое вещество, которое кристаллизовалось из смеси эфир/гексаны, давая 1,48 г (29%) чистого соединения A в виде белого твердого вещества в двух сборах.
Т.пл. 187-189o C.
B. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] - 4'-(фенилметилокси)[1,1'-бифенил]-2-сульфонамид.
Соединение B получалось из соединения A и соединения A из примера 4, как описано для соединения A примера 12. Хроматография на силикагеле с использованием 3:1 смеси гексаны/этилацетат давала соединение B в виде бесцветной смолы.
C. N-(3, 4-Диметил-5-изоксазолил)-4'-(фенилметилокси)-[1,1'- бифенил]-2-сульфонамид.
Соединение C получалось из соединения B, как описано для соединения примера 18, при нагревании с обратным холодильником в течение 18 часов. Хроматография на силикагеле с использованием 3:1 смеси гексаны/этилацетат с последующей обратно-фазной препаративной ВЭЖХ (30 х 500 мм) ODS S10 колонке с использованием 85% растворителя A (90% MeOH, 10% вода, 0.1% TFA) и 15% растворителя B (10% MeOH, 90% вода, 0.1 TFA) давала соединение примера 27 в виде бесцветной смолы.
1H ЯМР (CDCl3): d 1.93 (с., 3H), 2.20 (с., 3H), 5.20 (с., 2H), 6.32 (шир.с., 1H), 7.14-8.11 (м., 13H).
Анализ для C24H22N2O4S.
Вычислено: C 66.34, H 5.10, N 6.45, S 7.38.
Найдено: C 66.14, H 5.00, N 6.29, S 7.09.
Пример 28.
4'-(1,1-Диметилэтил)-N-(3, 4-диметил-5-изоксазолил)-[1,1'-бифенил] - 2-сульфонамид.
A. 4-Трет-бутил-фенилборная кислота.
Соединение A получалось из 4-трет-бутил-бромбензола и триметилбората, как описано для соединения A примера 21. Кристаллизация из смеси эфир/гексаны давала соединение A в виде белых кристаллов.
Т.пл. 201-203oC.
B. 4'-(1, 1-Диметилэтил)-N-(3,4-диметил-5-изоксазолил)-N-[(2- метоксиэтокси)метил][1,1'-бифенил]-2-сульфонамид.
Соединение B получалось из соединения A и соединения A из примера 4, как описано для соединения A из примера 12, при нагревании с обратным холодильником в течение 4 часов. Хроматография на силикагеле с использованием 6:1 смеси гексаны/этилацетат давала соединение B в виде бесцветной смолы.
C. 4'-(1,1-Диметилэтил)-N-(3,4-диметил-5-изоксазолил)-[1,1'- бифенил]-2-сульфонамид.
Соединение C получалось из соединения B, как описано для соединения примера 18, при нагревании с обратным холодильником в течение 5 часов. Хроматография на силикагеле с использованием смеси 4.5:1 гексаны/этилацетат с последующей кристаллизацией из смеси этилацетат/гексаны давала соединение примера 28 в виде бесцветных кристаллов.
Т.пл. 169-170oC.
Анализ для C21H24N2O3S.
Вычислено: C 65.60, H 6.29, N 7.29, S 8.34.
Найдено: C 65.44, H 6.24, N 7.26, S 8.21.
Пример 29.
N-(3, 4-Диметил-5-изоксазолил)-4'-метокси-[1,1'-бифенил]-2-сульфонамид.
A. N-(3,4-Диметил-5-изоксазолил)-4'-метокси-N-[(2-метоксиэтокси)- метил] [1,1'-бифенил]-2-сульфонамид.
Соединение A получалось из 4-метоксибензолборной кислоты и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола, а не бензола, и при нагревании при 95oC в течение 5 часов. Хроматография на силикагеле с использованием 3.5:1 смеси гексаны/этилацетат давала соединение A в виде бесцветной смолы.
B. N-(3, 4-Диметил-5-изоксазолил)-4'-метокси-[1,1'-бифенил] -2-сульфонамид.
Соединение B получалось из соединения A, как описано для соединения примера 18, при нагревании с обратным холодильником в течение 4 часов. Охлаждение реакционной смеси давало соединение примера 29 в виде бесцветных кристаллов.
Т.пл. 179-181oC.
Анализ для C18H18N2O4S.
Вычислено: C 60.32, H 5.06, N 7.82, S 8.95.
Найдено: C 60.14, H 5.08, N 7.86, S 9.24.
Пример 30.
N-(3,4-Диметил-5-изоксазолил)-4'-[(1-метилэтил)амино] [1,1'- бифенил]-2-сульфонамид.
A. 4'-Амино-N-(3,4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)- метил] [1, 1'-бифенил]-2-сульфонамид.
Соединение A получалось из 4-амино-фенилборной кислоты и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола, а не бензола, и при нагревании при 85oC в течение 4 часов. Хроматография на силикагеле с использованием смеси 1:1 гексаны/этилацетат давала соединение A в виде бесцветной смолы.
B. N-(3,4-Диметил-5-изоксазолил)-N'-(метоксиэтоксиметил)-4'- [(1-метилэтил)амино][1,1'-бифенил]-2-сульфонамид.
К соединению A (720 мг, 1.67 ммоль) и ацетону (0.16 мл, 2.17 ммоль) в 1,2-дихлорэтане (12 мл) при 0oC добавлялась уксусная кислота (0.14 мл) на протяжении 5 минут, а затем триацетоксиборгидрид натрия (460 мг, 2.17 ммоль) порциями. Смесь перемешивалась при комнатной температуре на протяжении ночи, добавлялись дополнительно ацетон (0.04 мл, 0.54 ммоль), уксусная кислота (0.04 мл) и триацетоксиборгидрид натрия (115 мг, 0.54 ммоль), и смесь перемешивалась 40 минут. Смесь выливалась в воду (50 мл), добавлялся этилацетат (150 мл), и органический слой отделялся, промывался солевым раствором, сушился и концентрировался. Остаток хроматографировался на силикагеле с использованием смеси 3: 1 гексаны/этилацетат, давая соединение B (590 мг, 75%) в виде бесцветной смолы.
C. N-(3, 4-Диметил-5-изоксазолил)-4'-[(1-метилэтил)амино][1,1'- бифенил] -2-сульфонамид.
К раствору соединения B (315 мг, 0.67 ммоль) в 95% этаноле (8 мл) добавлялась 6н. водная соляная кислота (8 мл). Смесь нагревалась с обратным холодильником в течение 3 часов и концентрировалась. Добавлялся насыщенный бикарбонат натрия до тех пор, пока величина pH не была выше 8. Смесь подкислялась до pH примерно 5 с помощью уксусной кислоты и экстрагировалась этилацетатом (3 х 30 мл). Объединенные органические экстракты промывались солевым раствором, сушились и концентрировались. Остаток хроматографировался на силикагеле с использованием смеси 2:1 гексаны/этилацетат, давая соединение примера 30 в виде бесцветного твердого вещества (225 мг, 88%).
Т.пл. 62-64oC.
Анализ для C20H23N3O3S.
Вычислено: C 62.32, H 6.01, N 10.90, S 8.32.
Найдено: C 62.32, H 6.16, N 10.44, S 7.86.
Пример 31.
2-[[[[2'-[[(3,4-Диметил-5-изоксазолил)амино] сульфонил][1, 1'- бифенил]-4-ил](1-метилэтил)амино]карбонил]-амино]-4-метилпентановая кислота, этиловый эфир.
A. 2-[[[[2'-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил][1,1'- бифенил] -4-ил](1-метилэтил)амино]карбонил]-амино]-4-метилпентановая кислота, этиловый эфир.
К раствору соединения примера 30 (145 мг, 0.38 ммоль) в метиленхлориде (4.4 мл) добавлялся этил 2-изоцианато-4-метилвалерат (163 мг, 0.88 ммоль). Смесь перемешивалась в течение двух дней, разбавлялась этилацетатом (25 мл) и промывалась водой (20 мл) и солевым раствором. Органическая фаза сушилась и концентрировалась, а остаток хроматографировался на силикагеле с использованием смеси 3:2 гексаны/этилацетат, давая соединение примера 31 в виде бесцветного твердого вещества (190 мг, 85%).
Т.пл. 58-61oC.
Анализ для C29H38N4O6S.
Вычислено: C 61.03, H 6.71, N 9.82, S 5.62.
Найдено: C 60.59, H 6,97, N 9.46, S 5.29.
Пример 32.
2'-Амино-N-(3,4-диметил-5-изоксазолил)-4'-(2-метилпропил)[1,1'- бифенил] -2-сульфонамид.
A. 4-Изобутил-2-нитро-фенилборная кислота.
К суспензии 4-изобутил-фенилборной кислоты (0.9 г, 5.05 ммоль) в уксусном ангидриде (9 мл) при -10oC добавлялась на протяжении 10 минут дымящая азотная кислота (0.4 мл). Смесь перемешивалась в течение 1 часа, подогревалась до комнатной температуры и перемешивалась в течение дополнительных 1.5 часов. Прозрачный оранжевый раствор добавлялся к 100 мл льда, перемешивался в течение 3 часов и азеотропно перегонялся с водой (4 х 100 мл). Остаток распределялся между 25 мл каждого из эфира и воды, и эфирный слой сушился и выпаривался, давая 0.75 г желтого твердого вещества. Твердое вещество растворялось в этилацетате (25 мл), и раствор экстрагировался 1н. водной гидроокисью натрия (2 х 25 мл). Объединенные водные экстракты подкислялись до pH 2 с использованием 2н. водной соляной кислоты и экстрагировались этилацетатом (2 х 25 мл). Объединенные органические экстракты промывались один раз водой, сушились и выпаривались, давая 0.63 г светло-желтого твердого вещества. Обратнофазная препаративная ВЭЖХ на 30 х 500 мл колонке ODS S10 с использованием 76% растворителя A (90% MeOH, 10% H2O, 0.1% TFA) и 24% растворителя B (10% MeOH, 90% вода, 0.1% TFA) давала 0.16 г соединения A в виде светло-желтого твердого вещества.
B. 4-Изобутил-2-амино-фенилборная кислота.
К суспензии 0.1 г 10% Pd/C в 10 мл метанола в атмосфере аргона добавлялось 0.32 г (1.4 ммоль) соединения A в 10 мл метанола, и смесь гидрировалась при 60 фунт./кв.дюйм (4.219 кг/кв.см) в течение 6 часов. Смесь фильтровалась, и фильтрат концентрировался, давая 0.3 г соединения B в виде коричневого остатка.
C. 2'-Амино-N-(3, 4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] - 4'-(2-метилпропил)[1,1'- бифенил]-2-сульфонамид.
Соединение C получалось из соединения B и соединения A из примера 4, как описано для соединения A из примера 12, при нагревании с обратным холодильником в течение 6 часов. Хроматография на силикагеле с использованием 3: 1 смеси гексаны/этилацетат давала соединение C в виде бесцветной смолы.
D. 2'-Амино-N-(3,4-диметил-5-изоксазолил)-4'-(2-метилпропил)[1, 1'- бифенил]-2-сульфонамид.
Соединение D получалось из соединения C, как описано для соединения примера 12, при нагревании с обратным холодильником в течение 3 часов. Препаративная жидкостная хроматография высокой разрешающей способности в обратной фазе (30 х 500 мм колонка ODS S10 с использованием 60% растворителя A (90% MeOH, 10% вода, 0.1% TFA) и 40% растворителя B (10% MeOH, 90% вода, 0.1% TFA)) с последующей хроматографией на силикагеле с использованием 2% метанола в метиленхлориде давала 0.05 г соединения примера 32 в виде светло-коричневой пены.
Т.пл. 60-70oC (аморфное).
Анализ для C21H25N3O3S-0.44H2O.
Вычислено: C 61.90, H 6.40, N 10.31, S 7.87.
Найдено: C 61.98, H 6.23, N 10.23, S 7.73.
Пример 33.
N-[2'-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил][1,1'- бифенил]-4-ил] ]-N-(1-метилэтил) -β-фенилбензолпропанамид.
A. N-(3, 4-Диметил-5-изоксазолил)-N'-(метоксиэтоксиметил)-4'-[(1- метилэтил)-(3,3-дифенил-1-оксопропил)-амино]-[1,1'-бифенил]-2-сульфонамид.
К соединению B из примера 30 (60 мг, 0.13 ммоль) в метиленхлориде (1.3 мл) добавлялись 3,3-дифенилпропионилхлорид (93 мг, 0.38 ммоль) и триэтиламин (0.07 мл). Смесь перемешивалась в течение 2.5 часов, разбавлялась этилацетатом (20 мл) и промывалась насыщенным хлористым аммонием (2 х 15 мл) и солевым раствором, сушилась и концентрировалась. Остаток хроматографировался на силикагеле с использованием 1:1 смеси гексаны:этилацетат, давая соединение A в виде бесцветной смолы (45 мг, 52%).
B. N-[2'-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил][1, 1'- бифенил]-4-ил]]-N-(1-метилэтил)- β -фенилбензолпропанамид.
Соединение примера 33 получалось из соединения A, как описано для соединения примера 18, при нагревании с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием 3:1 смеси метиленхлорид/этилацетат давала соединение примера 33 в виде светло-желтого твердого вещества.
Т.пл. 177oC.
Анализ для C35H36 N3O4S-0.4H2O.
Вычислено: C 69.96, H 6.00, N 6.99, S 5.34.
Найдено: C 70.13, H 6.10, N 6.82, S 5.21.
Пример 34.
2'-Нитро-N-(3,4-диметил-5-изоксазолил)-[1,1'-биифенил]-2-сульфонамид.
A. 2'-Нитро-N-(3,4-диметил-5-изоксазолил)-N-(метоксиэтоксиметил)- [1,1'-бифенил]-2-сульфонамид.
Соединение A получалось из 2-нитрофенилборной кислоты и соединения A из примера 4, как описано для соединения A примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 6 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны/этилацетат (2:1) давала соединение A в виде светло-желтой смолы.
B. 2'-Нитро-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифениил]-2-сульфонамид.
Соединение примера 34 получалось из соединения A, как описано для соединения примера 12, при нагревании с обратным холодильником в течение 4 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны/этилацетат (2:1) с последующей кристаллизацией из смеси гексаны/этилацетат давала соединение примера 34 в виде светло-коричневых игл.
Т.пл. 128-130oC.
Анализ для C17H15N3O5S.
Вычислено: C 54.69, H 4.05, N 11.25, S 8.59.
Найдено: C 54.67, H 3.88, N 11.17, S 8.59.
Пример 35.
5-[[[(2-Фенил)фенил] сульфонил]амино]-3-метил-4-изоксазолкарбоновая кислота, этиловый эфир.
A. [1,1'-бифениил]-2-сульфонамид.
К дегазированному раствору 2-бромбензолсульфонамида (0.7 г, 3.0 ммоль) и тетракис(трифенилфосфин)палладия(0) (0.21 г, 0.18 ммоль) в бензоле (25 мл) добавлялся 2 М водный карбонат натрия (15 мл) с последующим добавлением раствора фенилборной кислоты (0.44 г, 3.6 ммоль) в 95% этаноле (25 мл). Желтый двухфазный раствор нагревался с обратным холодильником в течение 18 часов, охлаждался до комнатной температуры и разбавлялся водой (100 мл). Раствор экстрагировался этилацетатом (2 х 100 мл), и объединенные органические фазы промывались солевым раствором, сушились (сульфатом магния), фильтровались и выпаривались. Остаток хроматографировался на силикагеле с использованием смеси гексаны/этилацетат (2:1), давая 250 мг (36%) соединения A в виде желтого твердого вещества.
B. 5-[[[(2-Фенил)фенил] сульфонил] амино]-3-метил-4-изоксазолкарбоновая кислота, этиловый эфир.
Раствор соединения A (187 мг, 0.82 ммоль), 3-метил-4-этоксикарбонил-5-бромизоксазола (197 мг, 0.42 ммоль) и карбоната цезия (274 мг, 0.42 ммоль) в сухом диметилформамиде (4 мл) нагревался при 55oC в течение 18 часов. Раствор охлаждался до комнатной температуры, разбавлялся водой (40 мл) и подкислялся до pH 4 6н. водным хлористым водородом. Рыжевато-коричневый осадок собирался с помощью фильтрования, прополаскивался водой и сушился, давая 110 мг (36%) соединения примера 35 в виде рыжевато-коричневого твердого вещества.
Т.пл. 126-128oC.
Анализ для C19H18 N2O5S-0.35H2O.
Вычислено: C 58.10, H 4.80, N 7.13, S 8.16.
Найдено: C 58.19, H 4.59, N 7.04, S 8.06.
Пример 36.
N-(3-Метил-4-фенилметил-5-изоксазолил)-4'-(2-метилпропил)[1, 1'- бифенил] -2-сульфонамид.
A. N-(2-Бромбензолсульфонил)-пиррол.
Гидрид калия (35% дисперсия в масле, 5.76 г, 50 ммоль; промытая три раза гексанами) покрывался сухим тетрагидрофураном (200 мл) и суспензия охлаждалась до 0oC. По каплям на протяжении 20 минут добавлялся пиррол (пропущенный через активированную основную окись алюминия, 4.16 мл, 60 ммоль) в тетрагидрофуране (60 мл). Ледяная баня удалялась, и раствор оставлялся перемешиваться при температуре окружающей среды до тех пор, пока не прекратится выделение газа (20 минут), после чего по каплям на протяжении 20 минут добавлялся 2-бромбензолсульфонилхлорид (10.22 г, 40 ммоль) в тетрагидрофуране (60 мл). После перемешивания в течение 1 часа смесь фильтровалась через Целит AFA, и фильтровальное средство прополаскивалось тетрагидрофураном (100 мл). Фильтрат выпаривался, и получающееся в результате белое твердое вещество перекристаллизовывалось из метанола, давая 7.47 г (65%) соединения A.
Т.пл. 85.0-87.0oC.
B. N-(4'-(2-Метилпропил)-1, 1'-бифенилсульфонил)пиррол.
Соединение B получалось из соединения A и соединения A из примера 21, как описано для соединения A из примера 12, с использованием толуола, а не бензола, и при нагревании при 80oC в течение 2 часов. Хроматография на силикагеле с использованием 1:1 смесь гексаны/метиленхлорид давала соединение B в виде масла.
C. 4'-(2-Метилпропил)-1,1'-бифенил-2-сульфоновая кислота, натриевая соль.
Раствор соединения B и 5н. гидроокиси натрия (53 мл) в метаноле (70 мл) нагревался с обратным холодильником в течение 6.5 часов. Выпаривание метанола давало белое твердое вещество, которое собиралось и сушилось под вакуумом. Перекристаллизация из воды (40 мл) давала 3.05 г (88%) соединения C в виде белого твердого вещества.
D. 4'-(2-Метилпропил)-1,1'-бифенил-2-сульфонилхлорид.
Соединение C (1.6 г, 5 ммоль) и пятихлористый фосфор (3.1 г, 15 ммоль) измельчались вместе стеклянной палочкой, и смесь нагревалась при 60oC в течение 2.5 часов. Добавлялась ледяная вода, и смесь экстрагировалась два раза этилацетатом. Объединенные органические слои промывались солевым раствором, сушились (сульфатом магния) и выпаривались, давая 1.45 г (94%) соединения D.
E. N-(3-Метил-4-фенилметил)-5-изоксазолил)-4'-(2-метилпропил)[1, 1'- бифенил]-2-сульфонамид.
Соединение D (0.15 г, 0.48 ммоль) в пиридине (0.1 мл) добавлялось к раствору 3-метил-4-фенилметил-5-изоксазоламина (0.12 г, 0.64 ммоль) и диметиламинопиридина (13 мг, 0.1 ммоль) в пиридине (0.2 мл). Раствор перемешивался при 75oC в течение 2.5 часов, охлаждался до комнатной температуры и разбавлялся водой. Раствор доводился до pH 3 с помощью 1н. соляной кислоты и экстрагировался эфиром (2 х 50 мл). Объединенные органические слои промывались солевым раствором, сушились (сульфатом магния) и выпаривались. Остаток подвергался мгновенной хроматографии (двуокись кремния, 7% этилацетат/метиленхлорид), и частично очищенное вещество подвергалось мгновенной хроматаографии (двуокись кремния, эфир), давая 30 мг (15%) чистого соединения примера 36 в виде масла, которое затвердевало после стояния.
Т.пл. 137.0-138.5o C.
Анализ для C27H28N2 O3S-0.86H2O.
Вычислено: C 68.12, H 6.29, N 5.88, S 6.73.
Найдено: C 68.38, H 6.04, N 6.23, S 6.31.
Пример 37.
N-(4,5-Диметил-3-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил] - 2-сульфонамид.
Соединение D примера 36 (0.56 г, 1.8 ммоль) в пиридине (0.8 мл) добавлялось к раствору 4, 5-диметил-3-изоксазоламина (0.25 г, 2.2 ммоль) и 4-диметиламинопиридина (44 мг, 0.4 ммоль) в пиридине (0.7 мл). Раствор перемешивался при 75oC в течение 2.5 часов, охлаждался до комнатной температуры и разбавлялся водой (10 мл). Раствор доводился до pH 3 с помощью 6н. соляной кислоты и экстрагировался эфиром (2 х 80 мл). Объединенные органические слои промывались солевым раствором, сушились (сульфатом магния) и выпаривались. Мгновенная хроматография (двуокись кремния, 20% этилацетат/гексаны) давала 0.33 г (48%) соединения примера 37. Перекристаллизация из смеси эфир/гексан давала аналитической образец в виде белого кристаллического твердого вещества.
Т.пл. 131.5-133.0oC.
Анализ для C21H24N2 O3S.
Вычислено: C 65.60, H 6.29, N 7.29, S 8.34.
Найдено: C 65.64, H 6.33, N 7.32, S 8.31.
Пример 38.
4'-(2-Метилпропил)-2'-метокси-N-(3,4-диметил-5-изоксазолил)-[1,1'- бифенил]-2-сульфонамид.
A. 4-Изобутил-2-метокси-фенилборная кислота.
К раствору 4-(2-метилпропил)-2-метоксибензола (4.0 г, 24 ммоль) в эфире (100 мл) в атмосфере аргона при -78oC добавлялся тетраметилэтилендиамин (11 мл, 73 ммоль) с последующим добавлением третбутиллития (1.7 М раствор в пентане, 43 мл) на протяжении 5 минут. Смесь подогревалась до комнатной температуры, перемешивалась в течение 5 часов, охлаждалась до -78oC, и добавлялся триэтилборат (7.6 г) в виде одной порции. Раствор подогревался до комнатной температуры, перемешивался на протяжении ночи, охлаждался до 0oC, и добавлялась 20% водная соляная кислота (250 мл). Раствор экстрагировался эфиром, и объединенные эфирные экстракты экстрагировались три раза 1 М гидроокисью натрия. Осадок, который образовывался, собирался и добавлялся к объединенным водным экстрактам. Данная смесь подкислялась разбавленной соляной кислотой до pH 2, и раствор экстрагировался дважды эфиром. Объединенные эфирные экстракты промывались один раз водой, сушились и выпаривались. Из гексанов в виде двух сборов кристаллизовалось белое твердое вещество, давая 2.1 г (42%) соединения A в виде белого твердого вещества.
Т.пл. 68-75oC.
B. 4'-(2-Метилпропил)-2'-метокси-N-(3,4-диметил-5-изоксазолил)- N-(метоксиэтоксиметил)-[1,1'-бифенил]-2-сульфонамид.
Соединение B получалось из соединения A и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 6 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны/этилацетат (3:1) давала соединение B в виде бесцветной смолы.
C. 4'-(2-Метилпропил)-2'-метокси-N-(3, 4-диметил-5-изоксазолил)- [1, 1'-бифенил]-2-сульфонамид.
Соединение примера 38 получалось из соединения B, как описано для примера 12, с использованием 6н. соляной кислоты и при нагревании с обратным холодильником в течение 3 часов. Кристаллизация из смеси гексаны/этилацетат давала соединение примера 38 в виде белого кристаллического твердого вещества.
Т.пл. 143-144oC.
Анализ для C22H26N2O4S-0.38H2O.
Вычислено: C 62.71, H 6.40, N 6.65, S 7.61.
Найдено: C 62.77, H 6.35, N 6.59, S 7.85.
Пример 39.
4'-(2-Метилпропил)-2'-гидрокси-N-(3,4-диметил-5-изоксазолил)- [1,1'-бифенил]-2-сульфонамид.
К раствору соединения примера 38 (0.3 г, 0.72 ммоль) в сухом метиленхлориде (25 мл) при -78oC в атмосфере аргона добавлялся трехбромистый бор (1.1 мл 1М раствора в метиленхлориде). Раствор перемешивался в течение 3 часов при -78oC и перемешивался на протяжении ночи, в течение которой он подогревался до комнатной температуры. Раствор разбавлялся метиленхлоридом, промывался дважды водой, сушился и выпаривался. Остаток хроматографировался на силикагеле с использованием смеси 1% метанол/метиленхлорид, и из смеси гексаны: этилацетат кристаллизовалось белое пенистое твердое вещество, давая 0.1 г соединения примера 39 в виде бесцветных призм.
Т.пл. 175oC.
Анализ для C21H24N2O4S-0.46H2O.
Вычислено: C 61.70, H 6.14, N 6.85, S 7.84.
Найдено: C 61.70, H 6.12, N 6.66, S 7.99.
Пример 40.
N-(3-Метил-4-нитро-5-изоксазолил)-4'-(2-метилпропил)-[1,1'- бифенил] -2-сульфонамид.
Соединение примера 40 получалось из соединения D примера 36 и 3-метил-4-нитро-5-изоксазоламина, как описано для соединения примера 37, при перемешивании при комнатной температуре в течение 5 дней. После мгновенной хроматографии (двуокись кремния, 50% этилацетат: метиленхлорид), неочищенный продукт распределялся между этилацетатом и водой, доведенной до pH 1 6н. соляной кислотой. Водная фаза экстрагировалась дважды этилацетатом, и объединенные органические фазы промывались солевым раствором, сушились (сульфатом магния) и выпаривались. Перекристаллизация из смеси метиленхлорид/гексаны давала соединение примера 40 в виде желтого кристаллического твердого вещества.
Т.пл. 124-126oC.
Анализ для C20H21N3O5S.
Вычислено: C 57.82, H 5.09, N 10.11, S 7.72.
Найдено: C 57.89, H 5.12, N 10.25, S 7.72.
Пример 41.
N-(4-Метил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил] -2- сульфонамид.
Соединение примера 41 получалось из соединения D примера 36 и 4-метил-5-изоксазоламина, как описано для примера 37, при перемешивании при комнатной температуре в течение 2.2 часа. Мгновенная хроматография (двуокись кремния, 10% этилацетат/метиленхлорид) с последующим растиранием с эфиром давала соединение примера 41 в виде кристаллического твердого вещества.
Т.пл. 153.0-155.5oC.
Анализ для C20H22N2O3S - 0.39 H2O.
Вычислено: C 63.65, H 6.08, N 7.42, S 8.49.
Найдено: C 63.39, H 5.09, N 7.68, S 8.40.
Пример 42.
4'-(2-Метилпропил)-N-(4,5,6,7-тетрагидро-2, 1-бензизоксазол-3-ил)- [1,1'-бифенил]-2-сульфонамид.
Соединение примера 42 получалось из соединения D примера 36 и 4,5,6,7-тетрагидро-2,1-безизоксазол-3-амина, как описано для соединения примера 37, при перемешивании при 75oC в течение 2 часов. Мгновенная хроматография (двуокись кремния, 30% этилацетат/метиленхлорид) с последующей еще одной мгновенной хроматографией (двуокись кремния, эфир) с последующей перекристаллизацией из смеси метиленхлорид/гексаны давали соединение примера 42 в виде не совсем белого кристаллического твердого вещества.
Т.пл. 111.0-114.5oC.
Анализ для C23H26N2O3S.
Вычислено: C 67.29, H 6.38, N 6.82, S 7.81.
Найдено: C 66.93, H 6.36, N 7.04, S 7.57.
Пример 43.
4-Амино-4'-(2-метилпропил)-N-(3,4-диметил)-5-изоксазолил)- [1,1'-бифенил]-2-сульфонамид.
A. 2-Бром-4-(1-оксоэтиламино)-бензолсульфонилхлорид.
К 2-бром-4-(1-оксоэтиламино)-бензолу (6.2 г, 29 ммоль) добавляют хлорсульфоновая кислота (20 мл). Раствор нагревался при 57oC в течение 3 часов, добавлялось дополнительно 10 мл хлорсульфоновой кислоты, и раствор нагревался при 67oC в течение 6 часов. Смесь добавлялась по каплям к ледяной воде, и гетерогенная смесь экстрагировалась этилацетатом. Органический экстракт промывался один раз солевым раствором, сушился (сульфатом магния) и выпаривался. Остаток растворялся в этилацетате (50 мл), и раствор фильтровался. Нерастворимое твердое вещество прополаскивалось дважды этилацетатом, и объединенные фильтраты выпаривались, давая 6.9 г (82%) неочищенного соединения A в виде коричневой пенистой смолы.
B. 2-Бром-4-(1-оксоэтиламино)-N-(3,4-диметил-5-изоксазол)- бензолсульфонамид.
Раствор сырого соединения A (6.9 г, 22 ммоль), 3, 4-диметил-5-изоксазоламина (3.96 г, 35.3 ммоль) и диметиламинопиридина (0.42 г, 3.5 ммоль) в пиридине (25 мл) нагревался при 78oC в течение 3.5 часов. Растворитель выпаривался, и остаток распределялся между этилацетатом и водным бисульфатом калия. Водный слой промывался этилацетатом, и объединенные органические слои промывались солевым раствором, сушились (сульфатом магния) и выпаривались. Коричневое твердое вещество подвергалось мгновенной хроматографии на двуокиси кремния с использованием смеси 90% этилацетат/гексаны, давая 3.72 г (43%) сырого соединения B в виде желтой пены.
C. 2-Бром-4-(1-оксоэтиламино)-N-(метоксиэтоксиметил)-N- (3,4-диметил-5-изоксазолил)-бензолсульфонамид.
К гидриду натрия (0.32 г, 80% масляной дисперсии, промытой три раза гексанами; 10.5 ммоль) добавлялось по каплям соединение A (3.72 г, 9.6 ммоль) в сухом тетрагидрофуране (75 мл). Получающаяся суспензия охлаждалась до 0oC, и добавлялся по каплям метоксиэтоксиметилхлорид (1.09 мл, 9.6 ммоль) в сухом тетрагидрофуране. Раствор оставлялся подогреваться до комнатной температуры на протяжении ночи, добавлялся этилацетат, и раствор экстрагировался водным бикарбонатом натрия и солевым раствором, сушился (сульфатом магния) и выпаривался, давая 3.82 г желтой пенистой смолы. Мгновенная хроматография на двуокиси кремния с использованием 80% этилацетат/гексаны давала 0.52 г (11%) чистого соединения C в виде желтой пенистой смолы, а также 0.92 г менее чистого вещества.
D. 4'-(2-Метилпропил)-4-(1-оксоэтиламино)-N-(метоксиэтоксиметил)-N- (3, 4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
Соединение D получалось из соединения C и 4-(2-метилпропил)- бензосульфоновой кислоты, как описано для соединения A примера 12, с использованием толуола, а не бензола, при нагревании при 84oC в течение 90 минут. Флэш-хроматография на силикагеле с использованием смеси гексаны/этилацетат (1:1) давала соединение D в виде бесцветной смолы.
E. 4-Амино-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)- [1, 1'-бифенил]-2-сульфонамид.
Раствор соединения D (0.40 г, 0.75 ммоль) в 1:1 смеси 6н. соляная кислота : 95% этанол (30 мл) нагревался в условиях дефлегмации в течение 4.5 часов. Этанол выпаривался, и водный раствор доводился до pH 3.5 с помощью водного бикарбоната натрия и экстрагировался три раза этилацетатом. Объединенные органические фазы промывались солевым раствором, сушились (сульфатом магния) и выпаривались. Мгновенная хроматография на двуокиси кремния с использованием 25%, затем 33% этилацетат/гексаны давала 40 мг соединения примера 43 в виде белого пенистого твердого вещества.
Т.пл. 69-79oC.
Анализ для C21H25N3O3S - 0.18 H20.
Вычислено: C 62.63, H 6.35, N 10.43, S 7.96.
Найдено: C 63.03, H 6.62, N 10.03, S 7.55.
Пример 44.
2'-Фтор-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)- [1, 1'-бифенил] -2-сульфонамид.
A. 3-Фтор-(2-метил-1-пропенил)-бензол.
К раствору изопропилтрифенилфосфонилиодида (32 г, 74 ммоль) в эфире (620 мл) при -15oC добавлялся по каплям н-бутиллитий (1.6 М в гексане, 55 мл, 88 ммоль). Смесь перемешивалась при комнатной температуре в течение 3 часов, охлаждалась до -78oC, и медленно добавлялась 3-фторбензальдегид (10.1 г, 841 ммоль). Смесь перемешивалась при комнатной температуре на протяжении ночи, добавлялась холодная вода, и смесь перемешивалась в течение нескольких минут и фильтровалась. Органическая фаза фильтрата отделялась и промывалась три раза водой, сушилась (сульфатом магния), фильтровалась и концентрировалась. Остаток хроматографировался на силикагеле с пентаном, давая 10 г соединения A (90%) в виде бесцветной жидкости.
B. 3-Фтор-(2-метилпропил)-бензол.
Смесь соединения A (8 г, 53 ммоль) и 10% палладия на угле (1.2 г) в этилацетате (80 мл) гидрировались при 60 фунт./кв. дюйм (4.219 кг/кв.см) в течение 1 часа. Смесь фильтровалась, фильтрат концентрировался, и остаток перегонялся под вакуумом, давая соединение B в виде бесцветной жидкости (5.9 г, 74%).
Т.кип. 113oC/150 мм рт.ст.
C. 2-Фтор-4-(2-метилпропил)-фенилборная кислота.
Соединение C получалось из соединения B, как описано для соединения A примера 38, со следующими изменениями. Раствор трет-бутиллития перемешивался при -78oC в течение 5 часов. Начальные экстракции проводились метиленхлоридом, и объединенные органические фазы концентрировались до 100 мл перед экстракцией основанием, в течение которой не наблюдалось осадка. Растирание с гексаном давало соединение C в виде белого твердого вещества.
Т.пл. 96-100oC.
D. 2'-Фтор-4'-(2-метилпропил)-N-(метоксиэтоксиметил)-N- (3,4-диметил-5-изоксазолил)-[1, 1'-бифенил]-2-сульфонамид.
Соединение D получалось из соединения C и соединения A из примера 4, как описано для соединения A примера 12, с использованием толуола вместо бензола, при нагревании при 80oC в течение 3 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны/этилацетат (4:1) давала соединение D в виде бесцветной смолы.
E. 2'-Фтор-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)- [1,1'-бифенил]-2-сульфонамид.
Соединение примера 44 получалось из соединения D, как описано для соединения примера 12, с использованием 6н. соляной кислоты и при нагревании с обратным холодильником в течение 3 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны/этилацетат (3: 1) с последующей кристаллизацией из смеси гексаны/этилацетат давала соединение примера 44 в виде бесцветных кристаллов.
Т.пл. 139-141oC.
Анализ для C21H23N2O3FS.
Вычислено: C 62.27, H 5.76, N 6.96, S 7.97, F 4.72.
Найдено: C 62.81, H 5.83, N 6.97, S 8.03, F 4.59.
Пример 45.
4-Метокси-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)- [1,1'-бифенил]-2-сульфониламид.
A. N-(3,
4-Диметил-5-изоксазолил)-2-бром-4-метокси- бензолсульфонамид
К хлорсульфоновой кислоте (10 мл) при 0oC добавлялось по каплям 3-броманизол (9.3 г, 50 ммоль) с
такой скоростью,
чтобы внутренняя температура оставалась ниже 5oC. Смесь перемешивалась при 0oC в течение 2 часов и добавлялась по каплям к измельченному льду. Смесь
экстрагировалась три раза
метиленхлоридом, и объединенные органические слои сушились (сульфатом натрия) и концентрировались, давая смесь 2-бром-4-метокси-бензолсулльонилхлорида и
4-бром-2-метоксибензолсуфльонилхлорида (756 мг,
5%) в виде бесцветного масла. Раствор данного материала (756 мг, 1 ммоль), 3,4-диметил-5-изоксазоламина (386 мг, 3.44 ммоль) и 4-диметиламинопиридина
(65 мг, 0.53 ммоль) в сухом пиридине (5 мл)
нагревался при 70oC в течение 2 часов. Смесь охлаждалась до комнатной температуры и выливалась в воду. Величина pH смеси доводилась до 8 с
помощью насыщенного раствора бикарбоната натрия,
и смесь экстрагировалась дважды эфиром. Водный слой доводился до pH 2 6н. соляной кислотой и экстрагировался три раза эфиром. Эти органические
экстракты объединялись, сушились (сульфатом натрия) и
концентрировались, давая смесь соединения A и региомерного N-(3,4-диметилд-5-изоксазолил)-4-бром-2-метокси-бензолсульфонамида в виде
рыжевато-коричневой пены (743 мг). Хроматография (мгновенная,
двуокись кремния, 2% метанол/хлороформ) давала чистое соединение A (288 мг, 30%).
B. 2-Бром-4-метокси-N-(метоксиэтоксиметил)-N-(3,4-диметил-5- изоксазолил)-бензолсульфонамид.
К 0oC суспензии гидрида натрия (60% масляная дисперсия, 33.5 мг, 0.837 ммоль) в сухом тетрагидрофуране (2 мл) добавлялся по каплям раствор соединения A (288 мг, 0.797 ммоль) в сухом тетрагидрофуране (4 мл). После перемешивания при 0oC в течение 30 минут добавлялся по каплям метоксиэтоксиметилхлорид (0.100 мл, 0.877 ммоль). Спустя 2 часа, добавлялась дополнительная порция метоксиэтоксиметилхлорида (0.015 мл). После дополнительного 1 часа смесь выливалась в насыщенный хлорид натрия, и добавлялась 1н. соляная кислота. Смесь экстрагировалась три раза этилацетатом, и объединенные органические слои сушились (сульфатом магния) и концентрировались. Хроматография (мгновенная, двуокись кремния, 30% этилацетат/гексаны) давала соединение B в виде прозрачного масла (293 мг, 88%).
С. 4-Метокси-4'-(2-метилпропил)-N-(метоксиэтоксиметил)-N-(3,4- диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
Соединение C получалось из соединения B и 4-(2-метоксипропил)-бензолборной кислоты, как описано для соединения A примера 12, при использовании толуола вместо бензола, и при нагревании в условиях дефлегмации в течение 30 минут. Мгновенная хроматография на силикагеле с использованием смеси гексаны: этилацетат (4:1) давала соединение D в виде бесцветной смолы. Хроматография (мгновенная, двуокись кремния, 30% этилацетат:гексаны) давала соединение C в виде бесцветного масла (292 мг, 81%).
D. 4-Метокси-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)- [1,1'-бифенил]-2-сульфонамид.
Соединение примера 45 получалось из соединения C, как описано для соединения примера 12, с использованием 6н. соляной кислоты, при нагревании при 80oC в течение 19 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны:этилацетат 2:1) давала соединение примера 45 в виде бесцветного стекловидного твердого вещества.
Анализ для C22H26N2O4S - 0.11 H2O.
Вычислено: C 63.44, H 6.35, N 6.76, S 7.97.
Найдено: C 63.52, H 6.34, N 6.65, S 8.03.
Пример 46.
2'-Амино-N-(3,4-диметил-5-изоксазолил)-4'-(2-метилпропил)- [1,1'-бифенил]-2-сульфонамид.
A. 3-(2-Метил-1-пропенил)-нитробензол.
К изопропилтрифенилфосфонийиодиду (74 мг, 170 ммоль) в смеси 1:1 эфир: тетрагидрофуран (850 мл) при -15oC добавлялся по каплям н-бутиллитий (1.6 М в гексане, 118 мл, 188 ммоль). Смесь перемешивалась при комнатной температуре в течение 3 часов, охлаждалась до -50oC, и медленно добавлялся раствор 3-нитробензальдегида (28.4 г, 188 ммоль) в тетрагидрофуране (60 мл). Смесь перемешивалась при комнатной температуре на протяжении ночи, добавлялись холодная вода и гексан, и смесь перемешивалась в течение нескольких минут и фильтровалась. Органическая фаза фильтрата отделялась, и промывалась три раза водой, сушилась (сульфатом магния) и концентрировалась. Остаток хроматографировался на силикагеле с использованием 50:1 смеси гексаны:этилацетат, давая соединение A (23 г, 76%) в виде светло-желтой жидкости.
B. 3-(2-Метил-1-пропенил)-анилин.
Смесь соединения A (4.0 г, 22 ммоль) и 5% Pt/C (400 мг) в метаноле (40 мл) гидрировалась при 45 фунт./кв.дюйм (3.164 кг/кв.см) на протяжении ночи. Смесь фильтровалась, и фильтрат концентрировался, давая соединение B (3.11 г, 92%).
C. N-(2, 2-Диметил-1-оксопропил)-3-(2-метил-1-пропенил)-анилин.
К соединению B (3.11 г, 21.1 ммоль) и триметилацетилхлориду (3.31 г, 27.5 ммоль) в метиленхлориде (53 мл) при 0oC медленно добавлялся триэтиламин (4.28 г, 42.2 ммоль). Смесь перемешивалась при 0oC в течение 1 часа, и при комнатной температуре в течение 15 минут и выливалась в ледяную воду. Водный слой экстрагировался дважды этилацетатом, и объединенные органические фазы промывались солевым раствором, сушились и концентрировались. Остаток хроматографировался на силикагеле с 25:2 гексаны:этилацетат, давая соединение C (3.81 г, 78%) в виде белого твердого вещества.
D. N-(2,2-Диметил-1-оксопропил)-3-(2-метил-1-пропил)-анилин.
Смесь соединения C (3.47 г, 15 ммоль) и 10% Pd/C (520 мг) в этилацетате (35 мл) гидрировалась при 60 фунт./кв.дюйм (4.219 кг/кв.см) в течение 1 часа. Смесь фильтровалась, и фильтрат концентрировался, давая соединение D (3.41 г, 98%).
E. 2-(2,2-Диметил-1-оксо-1-пропиламино)-4-(2-метил-1-пропил)- фенилборная кислота.
К соединению D (2.86 г, 12.3 ммоль) и тетраметилэтилендиамину (4.28 г, 36.8 ммоль) в эфире (25 мл) при -40oC добавлялся по каплям трет-бутиллитий (1.7 М в пентане, 21.6 мл, 36.8 ммоль). Раствор перемешивался при комнатной температуре в течение 2.5 часов, охлаждался до -20oC, и медленно добавлялся триметилборат (3.82 г, 36.8 ммоль). Смесь перемешивалась при -10oC до 0oC в течение 1 часа и при комнатной температуре в течение 3 часов, охлаждалась до 0oC, и добавлялась 10% водная соляная кислота. Водный слой экстрагировался три раза метиленхлоридом, и объединенные органические фазы промывались солевым раствором и концентрировались. Остаток растирался с эфиром, давая соединение E в виде белого твердого вещества (2.52 г, 74%).
Т.пл. более 250oC.
F. 2'-(2, 2-Диметил-1-оксо-1-пропиламино)-N-(3,4-диметил-5- изоксазолил)-N-[(2-метоксиэтокси)метил]-4'-(2-метил-пропил)- [1,1'-бифенил]-2-сульфонамид.
Соединение F получалось из соединения E и соединения A из примера 4, как описано для соединения A из примера 12 с использованием толуола вместо бензола и при нагревании при 75oC в течение 7 часов. Мгновенная хроматография на силикагеле с использованием смеси гексаны:этилацетат (4:1) давала соединение F в виде бесцветной смолы.
G. 2'-Амино-N-(3,4-диметил-5-изоксазолил)-4'-(2-метилпрпоил)- [1, 1'-бифенил]-2-сульфонамид.
К раствору соединения F (354 мг, 0.62 ммоль) в 95%-ном этаноле (20 мл) добавлялась 50%-ная серная кислота (20 мл) и смесь нагревалась при температуре дефлегмации в течение 3.5 часов. Смесь охлаждалась и выливалась в ледяную 30%-ную гидроокись аммония. Смесь подкислялась до pH 5 уксусной кислотой и экстрагировалась 4 раза этилацетатом. Объединенные органические экстракты промывались солевым раствором, сушились и концентрировались. Препаративная ВЭЖХ (30 Х 500 мм) ODS S10 колонка с использованием 65% растворителя A (90% метанола, 10% воды, 0.1% трифторуксусной кислоты), 35% растворителя B (10% метанола, 90% воды, 0.1% трифторуксусной кислоты) давала твердое вещество, которое затем очищалось хроматографией на двуокиси кремния с использованием 2% смеси метанол/метиленхлорид, давая соединение примера 46 в виде белого твердого вещества.
Т.пл. 60-70oC (аморфного).
Анализ для C21H25N3O3S - 0.25 H2O.
Вычислено: C 62.44, H 6.36, N 10.40, S 7.94.
Найдено: C 62.65, H 6.23, N 10.19, S 7.67.
В таблице (см. в конце описания) для предварительного образца соединений действительных примеров настоящей заявки показаны количества IC50 данных соединений, ингибирующих связывание эндотелина-1 при ETA рецепторе.
Пример 47.
N-(3,4-Диметил-5-изоксазолил)-4'-(3-метилбутил)-[1,1'-бифенил] - 2-сульфонамид.
A. 4-(3-Метилбутил)-бензобороновая кислота.
Соединение A было получено из 4-(3-метилбутил)бромбензола так, как описано для соединения A из примера 21. Кристаллизация из гексана привела к соединению А в виде белого кристаллического твердого вещества, т.пл. 142oC.
B. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)] метил] -4'- (3-метилбутил)][1, 1'-бифенил]-2-сульфонамид.
Соединение B было получено из соединения A и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании при 80oC в течение 3 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 6:1 привела к соединению B в виде бесцветной смолы.
C. N-(3,4-диметил-5-изоксазолил)-4-(3-метилбутил)] -[1,1'- бифенил]-2-сульфонамид.
Указанное в заголовке соединение получали из соединения B, как описано для примера 18, при кипячении с обратным холодильником в течение 4,5 часов. Смесь охладили и фильтровали с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества, т.пл. 125-127o C.
Анализ для C22H26N2O3S.
Вычислено: C 66.31, H 6.58, N 7.03, S 8.04.
Найдено: C 66.43, H 6.58, N 7.10, S 8.02.
Пример 48.
N-(3,4-диметил-5-изоксазолил)-2-((4-метилфенил)-окси)бензолсульфонамид.
A. N-(3,4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)] метил] -2- ((4-метилфенил)-окси)-бензолсульфонамид.
К п-крезолу (195 мг, 1.8 ммоль) в пиридине (2 мл) при 0oC добавили гидрид натрия (60% в минеральном масле, 72 мг, 1.8 ммоль). Смесь перемешивали при 0oC в течение 10 минут и добавили бромид меди (I)-диметилсульфид (432 мг, 2.1 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут и добавили раствор соединения A из примера 4 (630 мг, 1.5 ммоль) в пиридине (2 мл). Смесь кипятили с обратным холодильником в течение 2.5 часов, охладили, разбавили этилацетатом и фильтровали. Фильтрат дважды промыли насыщенным водным хлоридом аммония, осушали и концентрировали. Остаток хроматографировали на силикагеле смесью гексан/этилацетат 4:1 с получением соединения A в виде светло-желтой смолы.
B. N-(3,4-диметил-5-изоксазолил)-2-((4-метилфенил)-окси)-бензолсульфонамид.
Указанное в заголовке соединение было полученного из соединения A, как описано для примера 18, при кипячении с обратным холодильником в течение 2.5 часов. Хроматография на диоксиде кремния с использованием смеси гексаны: этилацетат 3:1 привела к указанному в заголовке соединению в виде светло-желтого твердого вещества, т.пл. 128-131oC.
Анализ при расчете для C18H18N2O4S.
Вычислено: C 60.32, H 5.06, N 7.82, S 8.95.
Найдено: C 60.59, H 5.06, N 7.86, S 9.16.
Пример 49.
2'-метиламино-N-(3,4-диметил-5-изоксазолил)-4'-(2-метилпропил)- [1, 1'-бифенил]-2-сульфонамид.
К раствору соединения из примера 46 (135 мг, 0.34 ммоль), ацетата натрия (28 мг, 0.34 ммоль) и уксусной кислоты (41 мг, 0.68 ммоль) в метаноле (3.4 мл), добавили формальдегид (37% в воде, 0.033 мл, 0.41 ммоль) и цианоборгидрид натрия (21 мг, 0.34 ммоль). Смесь перемешивали в течение 1 часа, концентрировали, разбавляли этилацетатом и промывали водой и соляным раствором, осушали и концентрировали. Остаток подвергали препаративной ВЭЖХ на колонке ODS S10 30 • 500 мм с применением 56% метанола, 44% воды и 0.1% трифторуксусной кислоты с получением 23 мг указанного в заголовке соединения (16%) в виде белого твердого вещества, т.пл. 125-128oC, а также 30 мг указанного в заголовке соединения из примера 50 (20%) в виде светло-желтого твердого вещества, т.пл. 127-129oC.
Анализ при расчете для C22H27N3O3S 0,2H2O.
Вычислено: C 63.35, H 6.62, N 10.07, S 7.69.
Найдено: C 63.45, H 6.54, N 9.97, S 7.35.
Пример 50.
2'-Диметиламино-N-(3, 4-диметил-5-изоксазолил)-4'-(2-метилпропил) [1,1'-бифенил]-2-сульфонамид.
Указанное в заголовке соединения получали из соединения примеру 46, как описано в примере 49.
Анализ при расчете для C23H29N3O3S.
Вычислено: C 64.61, H 6.84, N 9.83, S 7.50.
Найдено: C 64.57, H 6.90, N 9.65, S 7.49.
Пример 51.
3-Метил-5-[[[4'-(2-метилпропил)[1,1'-бифенил] -2-ил] сульфонил] амино-4- изоксазолкарбоновая кислота, этиловый эфир.
A. N-(1, 1-Диметилэтил)-4'-(2-метилпропил)-1,1'-бифенил-2-сульфонамид.
Соединение A было получено из N-(1,1-диметилэтил)-2-бромбензолсульфонамида и соединения A из примера 21, как описано для соединения A из примера 12, с применением толуола вместо бензола и при нагревании с обратным холодильником в течение 1 часа. Хроматография на силикагеле с использованием 10% смеси гексаны/этилацетат привела к соединению A в виде белого твердого вещества.
B. 4'-(2-метилпропил)-1,1'-бифенил-2-сульфонамид.
Соединение A (0.50 г, 1.7 ммоль) добавили к трифторуксусной кислоте (5 мл) при 0oC и раствор перемешивали при комнатной температуре с течение 5 часов. Растворитель выпарили и остаток пропустили через пробку силикагеля с использованием этилацетата. Элюат концентрировали с получением соединения B в виде масла (0.31 г, 100%).
C. 3-Метил-5-[[[4'-(2-метилпропил)[1,1'-бифенил]-2-ил]сульфонил] амино] -4-изоксазолкарбоновая кислота, этиловый эфир.
Смесь соединения B (306 мг, 1.01 ммоль), этил-5-бром-3-метил-4-изоксазолкарбоксилата (389 мг, содержащий 33% этил-4-бром-3-метил-5-изоксазолкарбоксилата, 1.11 ммоль нужного изомера) и карбоната цезия (658 мг, 2.02 ммоль) 30 нагревали при 80oC в диметилформамиде (4 мл) в течение 2 часов. Растворитель испарили, остаток разбавили соляным раствором (10 мл) и pH довели до 2 с помощью 1н. соляной кислоты. Смесь экстрагировали этилацетатом, соединенные органические слои промыли соляным раствором, сушили (сульфат натрия) и концентрировали. Хроматография (флеш, диоксид кремния, 25, затем 50% смесь этилацетат/гексаны) привела к желто-белому твердому веществу. Этот материал растворили в абсолютированном этаноле (10 мл) и добавили 1н. соляную кислоту, чтобы довести pH раствора до величины примерно 3. Этанол испарили, к остатку добавили эфир и раствор промыли водой, осушали (сульфат магния) и выпаривали. Перекристаллизация из этанола привела к указанному в заголовке соединению (137 мг, 31%) в виде мелких белых иголок, т. пл. 133-134oC.
Анализ при расчете для C23H26N2O5 S-0.13 H2O.
Вычислено: C 62.10, H 5.95, N 6.30.
Найдено: C 62.08, H 5.86, N 6,46.
Пример 52.
N-(3, 4-Диметил-5-изоксазол)-4'-(циклопентилметил)[1,1'-бифенил]-2- сульфонамид.
A. 4-Бром-4-(циклопентилиденметиленил)бензол.
К раствору бутиллития в пентане (2M, 24.3 мл, 48,6 ммоль) в 150 мл эфира при 0o в аргоне в течение 15 минут порциями добавляли циклопентилтрифенилфосфонийбромид (20 г, 48.6 ммоль). Смесь перемешивали 3 часа по мере того, как она нагревалась до комнатной температуры и охлаждали до -78oC, а затем в течение 30 минут по каплям добавляли раствор 4-бромбензальдегида (9.4 г, 51 ммоль) в 100 мл эфира. Смесь перемешивали в течение 18 часов по мере того, как она нагревалась до комнатной температуры и фильтровали, и твердый осадок на фильтре промывали 200 мл эфира. Соединенный фильтрат выпаривали и оставшееся твердое вещество хроматографировали на диоксиде кремния с применением гексанов, с получением 3.98 г (33%) соединения A.
B. 1-Бром-4-(циклопентилметил)бензол.
Смесь соединения A (3.8 г, 16 ммоль) и PtO2 (150 мг) в этаноле (150 мл) гидрировали при 35 фунт/кв.дюйм (2.461 кг/кв.см) в течение 12 минут. Смесь фильтровали и фильтрат концентрировали. Остаток хроматографировали на силикагеле гексанами с получением 3.22 г соединения B в виде бесцветной жидкости (80%).
C. 4- (Циклопентилметил)бензолбороновая кислота.
Соединение C было получено из соединения B и триметилбората, как описано для соединения A из примера 21. Кристаллизация из смеси эфир/гексаны привела к соединению C в виде белого твердого вещества, т.пл. 189-191oC.
D. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)] метил] -[4'- (циклопентилметил)][1,1'-бифенил]-2-сульфонамид.
Соединение D было получено из соединения C и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 3:1 привела к соединению D в виде бесцветной смолы.
E. N-(3,4-Диметил-5-изоксазолил)-4'-(циклопентилметил)[1, 1'-бифенил]-2- сульфонамид.
Указанное в заголовке соединение было получено из соединения D, как описано в примере 18, с использованием 6н. соляной кислоты и при кипячении с обратным холодильником в течение 3 часов. Кристаллизация из смеси гексаны/этилацетат привела к указанному в заголовке соединению в виде белого кристаллического твердого вещества, т.пл. 120 - 121o C.
Анализ при расчете для C23H26N2 O3S.
Вычислено: C 67.29, H 6.38, N 6.82, S 7.81.
Найдено: C 67.35, H 6.41, N 7.05, S 7.82.
Пример 53.
N-(3, 4-Диметил-5-изоксазолил)-2'-(формиламино)-4'-(2-метилпропил)] [1,1'-бифенил]-2-сульфонамид.
К раствору соединения по примеру 32 (0.20 г, 0.5 ммоль) в толуоле (2 мл) добавили муравьиную кислоту (0.21 г, 4.5 ммоль). Смесь нагревали с обратным холодильником в течение 3 часов, добавили дополнительное количество муравьиной кислоты (0.23 г, 5 ммоль), и нагревание продолжали 9 часов. Смесь концентрировали и остаток хроматографировали на силикагеле с получением указанного в заготовке соединения (127 мг, 59%) в виде не совсем белого твердого вещества, т.пл. 87 - 95oC.
Анализ при расчете для C22H25N3O4S.
Вычислено: C 61.81, H 5.89, N 9.83, S 7.50.
Найдено: C 61.68, H 6.03, N 9.66, S 7.45.
Пример 54.
N-(3,4-Диметил-5-изоксазолил)-4'-циклопропилметил)[1, 1'-бифенил]- 2-сульфонамид.
A. 4-Бром-4-(циклопропилиденметиленил)бензол.
Раствор 4-бромбензальдегида (5.36 г, 29.0 ммоль) и трис[2-(2-метоксиэтокси)этил] амина (1.22 г, 3.78 ммоль) в тетрагидрофуране (40 мл) добавили к суспензии гидрида натрия (60% в минеральном масле, 1.51 г, 37.7 ммоль) и цикропропилфосфонийбромида (14.4 г, 37.7 ммоль) в тетрагидрофуране (120 мл). Полученную суспензию нагревали при 62oC в течение 1.5 часов, охладили и разбавили гексанами (500 мл), и смесь пропустили через короткий слой силикагеля. Элюат концентрировали и остаток хроматографировали на силикагеле гексанами с получением 4.0 г соединения A (66%) в виде бесцветной жидкости.
B. 1-Бром-4-(циклопропилметил)бензол.
Соединение B было получено в виде бесцветной жидкости из соединения A, как описано для соединения B из примера 52.
C. 4-(Циклопропилметил) бензолбороновая кислота.
Соединение C было получено в виде белого твердого вещества из соединения B и триметилбората, как описано для соединения A из примера 21.
D. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)] метил] -[4'- (циклопропилметил)][1,1'-бифенил]-2-сульфонамид.
Соединение D было получено из соединения C и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании при 80oC в течении 2.5 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 5:1 привела к соединению D в виде бесцветной смолы.
E. N-(3,4-Диметил-5-изоксазолил)-4'-(циклопропилметил)[1,1'- бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения D, как описано в примере 18, с использованием 6н. соляной кислоты и при кипячении с обратным холодильником в течение 4.5 часов. Хроматография на силикагеле смесью гексаны/этилацетат 4:1 с последующей препаративной ВЭЖХ (колонка ODS S10 30 x 500 мм), с использованием 75% метанола, 25% воды и 0.1% ТФУК) привела к указанному в заголовке соединению в виде белого твердого вещества, т.пл. 50 - 54oC.
Анализ при расчете для C21H22N2O3S•0,35 H2O.
Вычислено: C 64.88, H 5.88, N 7.21, S 8.25.
Найдено: C 64.80, H 5.57, N 7.29, S 8.53.
Пример 55.
N-(3,4-Диметил-5-изоксазолил)-4-метокси-4'-(2-метилпропил)] [1,1'-бифенил] -2-сульфонамид.
A. 2-Бром-N-(3,4-диметил-5-изоксазолил)-5-метоксибензолсульфонамид.
Раствор 2-бром-5-метокси-бензолсульфонилхлорида (0.90 г, 3.15 ммоль), 3,4-диметил-5-изоксазоламина (0.46 г, 4.1 ммоль) и диметиламинопиридина (77 мг, 0.63 ммоль) в сухом пиридине (6 мл) нагревали при 70oC в течение 15 часов. Большую часть пиридина испарили, остаток вылили в насыщенный [раствор] бикарбоната натрия (50 мл) и добавили 0.5н. карбонат натрия, чтобы довести pH до 9.5. Смесь четыре раза промыли эфиром, подкислили 6н. соляной кислотой до pH 2, и три раза экстрагировали эфиром. Последние объединенные органические соли осушали (сульфат магния) и концентрировали в вакууме с получением соединения A.
B. 2-Бром-N-(3, 4-диметил-5-изоксазолил)-5-метокси-N-[(2-метоксиэтокси)метил] бензолсульфонамид.
При 0oC к суспензии обезжиренного гексанами гидрида натрия (132 мг 80% масляной дисперсии, 4.42 ммоль) в тетрагидрофуране (25 мл) по каплям прибавляли раствор соединения A (1.35 г, 3.74 ммоль) в тетрагидрофуране (20 мл), а затем по каплям добавляли метоксиэтоксиметилхлорид (0.50 мл, 4.4 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов, добавили воду, тетрагидрофуран испарили, и остаток распределили между эфиром и водой (100 мл, содержит 1 мл 1н. соляной кислоты). Эфирный слой промыли соляным раствором, осушали (сульфат магния) и выпаривали. Хроматография (диоксид кремния, 40% смесь этилацетат/гексаны (1 л), затем 60% смесь этилацетат/гексаны) привела к соединению B в виде бесцветного прозрачного масла.
C. N-(3,4-Диметил-5-изоксазолил)-4-метокси-N-[(2-метоксиэтокси) метил] -4'-(2-метилпропил)[1, 1'-бифенил]-2-сульфонамид.
Соединение C было получено из соединения B и соединения A из примера 21, как описано для соединения A из примера 12, с использованием обезгаженных аргоном растворов, с применением толуола вместо бензола, и при нагревании с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 3:1 привела к соединению C в виде стекла.
D. N-(3,4-Диметил-5-изоксазолил)-4-метокси -4'-(2-метилпропил)[1,1'- бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения C, как описано для примера 18, с использованием 6н. соляной кислоты и при кипячении с обратным холодильником в течение 24 часов. Хроматография на силикагеле смесью гексаны/этилацетат 3:2 с последующей перекристаллизацией из смеси этилацетат/гексаны привела к указанному в заголовке соединению в виде белого твердого вещества, т.пл. 132-134oC.
Анализ в расчете для C22H26N2O4S.
Вычислено: C 63.75, H 6.32, N 6.76, S 7.73.
Найдено: C 63.91, H 6.38, N 7.11, S, 7.76.
Пример 56.
N-(3,4-Диметил-5-изоксазолил)-4'-(2-метилбутил)-[1,1'-бифенил] -2-сульфонамид.
A. 1-Бром-4-(2-метил-бут-1-енил)бензол.
Соединение A было получено из изобутилтрифенилфосфонийбромида и 4-бромбензальдегида, как описано для соединения A из примера 52. Последующие хроматография на диоксиде кремния с использованием гексанов, перегонка (т. кип. 92-100oC при 25 мм) привели к соединению A в виде бесцветной жидкости.
B. 1-Бром-4-(2-метил-бутил)бензол.
Соединение B было получено в виде бесцветной жидкости из соединения A, как описано для соединения B из примера 52 путем гидрирования при 30 фунт/кв. дюйм (2.109 кг/кв. см) в течение 12 минут. После фильтрования фильтрат выпаривали и оставшуюся жидкость перегоняли (т.кип. 92 - 95oC при 25 мм) с получением соединения B в виде бесцветной жидкости.
C. 4-(2-метил-бутил)бензолбороновая кислота.
Соединение C было получено в виде белого твердого вещества из соединения B и триметилбората, как описано для соединения A из примера 21. Кристаллизация из смеси эфир/гексаны привела к соединению C в виде белого твердого вещества, т.пл. 136 - 138oC.
D. N-(3,4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)] метил]-[4'-(2 -метилбутил)][1,1'-бифенил]-2-сульфонамид.
Соединение D было получено из соединения C и соединения A из примера 4, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 3:1 привела к соединению D в виде бесцветной смолы.
E. N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилбутил)-[1,1'-бифенил[-2-сульфонамид.
Указанное в заготовке соединение было получено из соединения D, как описано для примера 18, с использованием 6н. соляной кислоты и при кипячении с обратным холодильником в течение 3 часов. Кристаллизация из смеси гексаны/этилацетат привела к указанному в заготовке соединению в виде белого твердого вещества, т.пл. 124 - 125oC.
Анализ в расчете для C22H26N2O3S-1.0H2O.
Вычислено: C 63.44, H 6.77, N 6.73, S 7.70.
Найдено: C 63.44, H 6.19, N 6.41, S 7.55.
Пример 57.
N-(3, 4-Диметил-5-изоксазолил)-4'-(1-метилэтил)[1,1'-бифенил]-2- сульфонамид.
A. 4-(1-Метил-этил)-бензолбороновая кислота.
Соединение A было получено в виде белого твердого вещества из 4-изопропилбромбензола и триметилбората, как описано для соединения A из примера 21. Кристаллизация из смеси эфир/гексаны привела к соединению A в виде белого твердого вещества, т.пл. 140-141oC.
B. N-(3, 4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)]метил- [4'-(1-метилэтил)][1,1'-бифенил]-2-сульфонамид.
Соединение B было получено из соединения A и соединение A из примера 4, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 3:1 привела к соединению в виде бесцветной смолы.
C. N-(3,4-Диметил-5-изоксазолил)-4'-(1-метилэтил)-[1, 1'- бифенил] -2-сульфонамид.
Указанное в заголовке соединение было получено из соединения B, как описано в примере 18, с использованием 6н. соляной кислоты и при кипячении с обратным холодильником в течение 3 часов. Кристаллизация из смеси гексаны/этилацетат привела к указанному в заголовке соединению в виде белого твердого вещества, т.пл. 162-163oC.
Анализ при расчете для C20H22N2O3S•0,30H2O.
Вычислено: C 63.92, H 6.06, N 7.45, S 8.53.
Найдено: C 63.93, H 5.80, N 7.44, S 8.69.
Пример 58.
N-(3,4-Диметил-5-изоксазолил)-2'-этиламсино-4-(2-метилпропил)- [1,1'-бифенил]-2-сульфонамид.
К раствору соединения из примера 32 (0.16 г, 0.4 ммоль) и уксусной кислоты (0.06 г, 1 ммоль) в дихлорэтане (2.5 мл) при 0oC добавили ацетальдегид (24 мг, 0.55 ммоль) и триацетоксиборгидрид натрия (212 мг, 1 ммоль). Смесь перемешивали при 0-15oC в течение 2 часов, разбавили этилацетатом, экстрагировали водой и соляным раствором, осушали и концентрировали. Остаток хроматографировали на силикагеле смесью гексаны/этилацетат 4:1 с получением указанного в заголовке соединения (90 мг, 53%) в виде светло-желтой смолы.
Анализ в расчете для C23H29 N3O3S•0,2H2O.
Вычислено: C 64.07, H 6.87, N 9.75, S 7.44.
Найдено: C 64.23, H 6.49, N 9.57, S 7.31.
Пример 59.
N-[2-[[(3,4-Диметил-5-изоксазолил)амино] сульфонил] -4'- (2-метилпропил)[1,1'-бифенил]-5-ил]бензамид.
К раствору соединения из примера 43 (0.4 г, 1.0 ммоль) и пиридина (0.082 мл, 1.0 ммоль) в ацетоне (3 мл) добавили бензоилхлорид (0.12 мл, 1.0 ммоль). Смесь перемешивали в течение 18 часов и концентрировали. Остаток растворили в метаноле (50 мл) и добавили 5% раствор гидрокарбоната натрия в воде (10 мл). Раствор перемешивали в течение 1 часа и метанол удалили в вакууме. Водный остаток подкислили до pH 3 с помощью 6н. водной соляной кислоты и три раза экстрагировали этилацетатом. Соединенные органические фазы промывали водой и соляным раствором, и осушали (сульфат магния). Остаток хроматографировали на диоксиде кремния смесью этилацетат:гексаны (1:1) и получили 98 мг (19%) указанного в заголовке соединения в виде желто-коричневого твердого вещества, т.пл. 207-211oC.
Анализ при расчете для C25H29N3O3S4•1.15H2O.
Вычислено: C 64.14, H 6.02, N 8.01, S 6.11.
Найдено: C 64.36, H 5.75, N 7.79, S 5.84.
Пример 60.
N-(3, 4-Диметил-5-изоксазолил)-4-гидрокси-4'-(2-метилпропил) [1,1'-бифенил]-2-сульфонамид.
При -78oC к раствору соединения из примера 55 (202 мг, 0.49 ммоль) в сухом хлористом метилене (5 мл) по каплям добавляли раствор трибромида бора (1 М в хлористом метилене, 3.9 мл, 3.9 ммоль). Раствор перемешивали в течение 18 часов при комнатной температуре и разбавили хлористым метиленом (50 мл). Добавили лед (5 г) и pH полученного водного слоя довели до 0-1 с помощью насыщенного раствора бикарбоната натрия. Органический слой отделили, водный слой экстрагировали хлористым метиленом, и объединенные органические слои осушали (сульфат магния) и выпаривали. Хроматография (диоксид кремния, 50% смесь этилацетат/гексаны) привела к белой пене, которую перекристаллизовывали из смеси этилацетат/гексаны с получением 167 мг (86%) указанного в заголовке соединения в виде белых кристаллов, т.пл. 159-160oC.
Анализ при расчете для C21H24N2O4S•0,62H2O.
Вычислено: C 56.09, H 5.37, N 12.26, S 9.36.
Найдено: C 56.23, H 5.34, N 12.12, S 9.27.
Пример 61.
N-[2'-[[(3,4-Диметил-5-изоксазолил)амино] сульфонил] -4- (2-метилпропил)[1,1'-бифенил]-2-ил]амино]уксусная кислота.
Указанное в заголовке соединение было получено из примера 32 и моногидрата глиоксиловой кислоты, как описано для примера 58, с использованием метанола в качестве растворителя и при перемешивании при комнатной температуре в течение 90 минут. После получения кристаллизация из смеси хлористый метилен/гексаны привела к указанному в заголовке соединению в виде белых кристаллов, т.пл. 147-150oC.
Анализ в расчете для C23H27N3O5S•0.8H2O.
Вычислено: C 58.53, H 6.11, N 8.90, S 6.79.
Найдено: C 58.52, H 5.94, N 8.94, S 6.57.
Пример 62.
N-[2'-[[(3,4-Диметил-5-изоксазолил)амино] сульфонил] -4'- (2-метилпропил)[1,1'-бифенил]-2-ил]ацетамид.
Указанное в заголовке соединение было получено из примера 43 и ацетилхлорида, как описано для примера 59, при перемешивании в течение 3.5 часов. Хроматография на диоксиде кремния (смесь этилацетат:гексаны 1:1) с последующим растиранием в горячих гексанах привела к указанному в заголовке соединению в виде желто-коричневого твердого вещества, т.пл. 150-154oC.
Анализ в расчете для C23H27N3O4S•0,95H2O.
Вычислено: C 60.24, H 6.35, N 9.16, S 6.99.
Найдено: C 60.57, H 5.94, N 8.8, S 6.68.
Пример 63.
N-(3,4-Диметил-5-изоксазолил)-4'-(2-метил-1-пропенил)[1, 1'- бифенил] -2-сульфонамид.
A. 4-(2-Метил-1-пропенил)бензолбороновая кислота.
н-Бутиллитий (2.5 М в гексане, 3.2 мл, 8.0 ммоль) в течение 5 минут добавляли к раствору 4-(2-метил-1-пропенил)бромбензола (1.7 г, 8.0 ммоль) в тетрагидрофуране (8.6 мл) и эфире (26 мл), перемешивая при -78oC в аргоне. После перемешивания при -78oC в течение 50 минут этот раствор в течение 5 минут перенесли через трубочку в раствор триизопропилбората (3.1 г, 16 ммоль) в эфире (17 мл), перемешивая при -78oC. После перемешивания при -78oC в течение 1.5 часов и при температуре окружающей среды в течение 25 минут реакцию гасили 1н. HCl (50 мл) и оставляли перемешиваться в течение 30 минут. Раствор дважды экстрагировали эфиром и объединенные органические слои три раза экстрагировали 1н. NaOH. Соединенные водные слои подкислили 6н. HCl до pH 1 и три раза экстрагировали эфиром. Промывание трех последних эфирных экстрактов соляным раствором и осушка над сульфатом магния привели после испарения растворителя к 1.2 г (79%) соединения A.
B. N-(3, 4-Диметил-5-изоксазолил)-N-[(2-метоксиэтокси)метил] -4'- (2-метил-1-пропенил)[1,1'-бифенил]-2-сульфонамид.
Соединение B получали из соединения A и соединения A из примера 4, как описано для соединения A из примера 12, используя обезгаженные аргоном растворы, применяя толуол вместо бензола и при нагревании с обратным холодильником в течение 1 часа. Флеш-хроматография на силикагеле с использованием смеси гексаны/этилацетат 4:1 привела к соединению B.
C. N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метил-1-пропенил)- [1,1'-бифенил] -2-сульфонамид.
Указанное в заголовке соединение получали из соединения B, как описано для примера 18, с использованием 6н. соляной кислоты и при нагревании при 80oC в течение 2 часов. Две флеш-хроматографии (10% смесь этилацетат/хлористый метилен, затем 10% смесь ацетон/гексан) с последующей препаративной ВЭЖХ (YMC SH 345-15 S-15 120 A, 20 мм х 500 мм, 25 мл/мин. A = H2O + 0.1% ТФУК, B = CH3CN + 0.1% ТФУК; от 43% A до 30% A в течение 45 мин; tR = 29 мин) привели к указанному в заголовке соединению в виде белого твердого вещества, т.пл. 58-63oC.
Анализ при расчете для C21H22N2O3 S•0,30H2O.
Вычислено: C 65.02, H 5.87, N 7.22, S 8.26.
Найдено: C 65.09, H 5.78, N 7.15, S 8.20.
Пример 64.
N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-2'- (пропиламино)-[1,1'-бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения из примера 32 и пропиональдегида, как описано для примера 58, при перемешивании при 0-5oC в течение 2 часов. После получения хроматография на силикагеле со смесью гексаны/этилацетат 4:1 привела к указанному в заголовке соединению в виде светло-желтой смолы.
1H ЯМР (CDCl3 ): δ5 0.86 (т, J = 6 Гц, 3H), 0.95 (д, J = 6 Гц, 6H), 1.50 (м, 2H), 1.92 (с, 3H), 1.93 (м, 1H), 2.17 (с, 3H), 2.49 (д, J = 7 Гц, 2H), 3.02 (т, J = 7 Гц, 2H), 6.61 - 7.90 (м, 7H).
Анализ при расчете для C24H31N3O3S•0,28H2O.
Вычислено: C 64.54, H 7.12, N 9.41, S 7.18.
Найдено: C 64.58, H 6.89, N 9.37, S 6.75.
Пример 65.
N-(3,4-Диметил-5-изоксазолил)-2'-(1-метил(этиламино))-4'-(2- метилпропил)-[1,1'-бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения из примера 32 и ацетона, как описано для примера 58, при перемешивании при комнатной температуре в течение 3 часов. Получение привело к указанному в заголовке соединению в виде светло-желтой смолы.
1H ЯМР (CDCl3): δ 0.93 (д, J = 6 Гц, 6H), 1.03 (д, J = 6 Гц, 3H), 1.10 (д, J = 6 Гц, 3H), 1.90 (м, 1H), 1.91 (с, 3H), 2.16 (с, 3H), 2.48 (д, J = 7 Гц, 2Н), 3.58 (м, 1H), 6.61 - 7.87 (м, 7H).
Анализ в расчете для C24H31N3O3 S•0,16H2O.
Вычислено: C 64.86, H 7.10, N 9.46, S 7.21.
Найдено: C 64.97, H 7.03, N 9.35, S 7.25.
Пример 66.
N-(3, 4-Диметил-5-изоксазолил)-2'-(2-гидрокси(этиламино))-4'-(2- метилпропил)-[1, 1'-бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения из примера 32 и димера гликольальдегида, как описано для примера 58, при перемешивании при комнатной температуре в течение 2 часов. После получения хроматография на силикагеле смесью хлористый метилен/этилацетат 4:1 привела к указанному в заголовке соединению в виде белого твердого вещества, т.пл. 45-53oC.
Анализ при расчете для C23H29N3O4 S•0,15H2O.
Вычислено: C 61.90, H 6.62, N 9.41, S 7.18.
Найдено: C 62.05, H 6.59, N 9.26, S 6.94.
Пример 67.
N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-5- [[(2-фенилэтил(амино)][1, 1'-бифенил]-2-сульфонамид.
A. N-[2-[[(3,4-диметил-5-изоксазолил)амино]сульфонил]- 4'-(2-метилпропил)[1, 1'-бифенил-5-ил]фенилацетамид.
Соединение A было получено из соединения по примеру 43 и фенилацетилхлорида, как описано для примера 59.
B. N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-5- [[(2-фенилэтил(амино)]-[1, 1'-бифенил]-2-сульфонамид.
К раствору соединения A (180 мг, 0.35 ммоль) в сухом тетрагидрофуране (4 мл) по каплям при 0oC добавили комплекс боран-метилсульфид (0.14 мл, 1.39 ммоль). Смесь перемешивали при 0oC в течение 15 минут, нагревали до комнатной температуры в течение 15 минут, нагревали с обратным холодильником в течение 3 часов и охладили до 0oC. Добавили метанол (3 мл), смесь перемешивали в течение 40 минут и добавили концентрированную соляную кислоту, чтобы довести pH до 2. Смесь нагревали с обратным холодильником в течение 40 минут, охладили до комнатной температуры и концентрировали. Остаток перевели в суспензию в воде и pH довели до 3 с помощью 5% бикарбоната натрия. Твердое вещество собрали, промыли водой и сушили с получением желто-коричневого твердого вещества. Смесь хроматографировали на диоксиде кремния смесью этилацетат/гексаны (1:1) и продукт растирали с гексанами с получением 34 мг (19%) указанного в заголовке соединения в виде белого аморфного твердого вещества, т.пл. 68-71oC.
Анализ при расчете для C29H33N3O3S•0, 59H2O.
Вычислено: C 67.74, H 6.70, N 8.17, S 6.23.
Найдено: C 67.77, H 6.58, N 8.14, S 6.27.
Пример 68.
N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-5-(2- метилпропил(амино)]-[1,1'-бифенил]-2-сульфонамид.
A. N-[2-[[(3, 4-Диметил-5-изоксазолил)амино]сульфонил]-4'- (2-метилпропил)[1, 1'-бифенил-5-ил]-(2-метилпропионамид).
Соединение A было получено из соединения из примера 43 и изобутилхлорида, как описано для примера 59, при перемешивании в течение 3 часов.
B. N-(3,4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-5-[(2- метилпропил(амино)]-[1,1'-бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения A, как описано для примера 67. Хроматография на диоксиде кремния смесью этилацетат/гексаны 1:1 с последующим растиранием с гексанами привела к указанному в заголовке соединению в виде желто-коричневого аморфного твердого вещества, т.пл. 74-78oC.
Анализ при расчете для C25H33N3O3S-0.45H2O - 0.1 CHCl3.
Вычислено: C 63.38, H 7.20, N 8.83, S 6.73.
Найдено: C 63.18, H 6.81, N 8.95, S 6.94.
Пример 69.
N-(3,4-Диметил-5-изоксазолил)-4'-(2, 2-диметилпропил)-[1,1'- бифенил] -2-сульфонамид.
A. 4'-Бромметил-N-(3, 4-диметил-5-изоксазолил)-N- (метоксиэтоксиметил)-[1,1'- бифенил]-2-сульфонамид.
К раствору соединения A из примера 11 (7.7 г, 18 ммоль) в четыреххлористом углероде (180 мл) добавили N-бромсукцинимид (4.14 г, 23.2 ммоль) и перекись бензола (385 мг, 1.59 ммоль). Смесь кипятили с обратным холодильником в течение 1.5 часов, охлаждали, разбавили 200 мл хлористого метилена, дважды экстрагировали водой, один раз экстрагировали соляным раствором, осушали и концентрировали. Остаток хроматографировали на силикагеле смесью гексаны/этилацетат 4:1 с получением соединения A (3.64 г, 40%) в виде бесцветной смолы.
B. N-(3,4-Диметил-5-изоксазолил)-N-[(2-(метоксиэтокси) метил)-[4'-(2,2-диметилпропил)-[1,1'-бифенил]-2-сульфонамид.
К раствору литиевого комплекса бензентиол-третбутилмеди (8.5 ммоль) в тетрагидрофуране (25 мл) (полученному как описано в Organic Syntheses, т. 6, стр. 248) при -65oC по каплям добавляли раствор соединения A (1.45 г, 2.84 ммоль) в тетрагидрофуране (5.7 мл). Смесь перемешивали при температуре от -60o C до -65oC в течение 30 минут и добавили насыщенный [раствор] хлорида аммония. Смесь разбавили этилацетатом, дважды промыли соляным раствором, осушали и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси гексаны/этилацетат 7:1 и получили соединение B (181 мг, 13%) в виде бесцветной смолы.
C. N-(3,4-Диметил-5-изоксазолил)-4'-(2, 2-диметилпропил)-[1,1'- бифенил] -2-сульфонамид.
Указанное в заголовке соединение было получено из соединения B, как описано для примера 18, с применением 3н. соляной кислоты и при кипячении с обратным холодильником в течение 5 часов. Хроматография на диоксиде кремния с использованием смеси гексаны/этилацетат 3:1 привела к указанному в заголовке соединению в виде белого твердого вещества, т.пл. 54-57oC.
Анализ при расчете для C22H26N2O3S - 0.3H2O.
Вычислено: C 65.43, H 6.64, N 6.94, S 7.94.
Найдено: C 65.47, H 6.53, N 6.90, S 8.05.
Пример 70.
N-(3,4-Диметил-5-изоксазолил)-4'-(2-диметилпропил)-4- [(фенилметокси)окси]-[1,
1'-бифенил]-2-сульфонамид
A. 3-(Фенилметокси)бензолсульфонат натрия
Раствор 3-гидроксибензолсульфоната (10.0 г, 57.4 ммоль) в воде (80 мл) довели до pH 12 с помощью 5н. NaOH. К
энергично перемешиваемому раствору по каплям добавили бензилбромид (7.2 мл, 60
ммоль). После перемешивания в течение 18 часов было выпарено примерно 50 мл воды. Остаток охладили до 4oC, и
осадок собрали фильтрованием, дважды промыли ледяной водой и осушали с
получением соединения A в виде белого твердого вещества (11.2 г, 68%).
B. 2-Бром-5-(фенилметокси)бензолсульфонилхлорид.
Раствор брома (2.24 г, 14.0 ммоль) в воде (60 мл) по каплям прибавляли к перемешиваемому раствору соединения A (4.0 г, 14 ммоль) в воде (25 мл) и тетрагидрофуране (15 мл) при 0oC. После перемешивания в течение 2 часов pH реакции довели до 8.5 с помощью 0.5н. карбоната натрия, избыток брома удалили с помощью бисульфита натрия, и реакционную смесь выпаривали до получения твердого вещества. К этому твердому веществу добавили пентахлорид фосфора (5.82 г, 27.9 ммоль). Далее следовало выделение тепла, смесь разжижалась и ее нагревали при 50oC в течение 1 часа и охладили до комнатной температуры. Полученную пасту смешивали с раздробленным льдом (20 г), смесь разбавили водой и дважды экстрагировали эфиром. Объединенные органические слои осушали (сульфат натрия) и концентрировали с получением коричневого твердого вещества (4 г).
C. N-(3, 4-Диметил-5-изоксазолил)-2-бром-5-(фенилметокси)- бензолсульфонамид.
Раствор соединения B, 3,4-диметилизоксазоламина (1.6 г, 14 ммоль) и диметиламинопиридина (0.27 г, 2.2 ммоль) в пиридине (10 мл) перемешивали в течение 2 часов и выпаривали. Остаток распределили между эфиром (250 мл) и 0.5н. HCl (250 мл). Образовалось темное масло. Водный слой экстрагировали эфиром (2 х 100 мл). Объединенные органические слои промывали 0.5н. HCl; (2 х 50 мл). Кислотные промывки и исходный кислотный слой соединили с темным маслом и все вместе экстрагировали хлористым метиленом (2 х 100 мл). Экстракты в хлористом метилене и в эфире осушали (сульфат натрия) и концентрировали. Хроматографией (диоксид кремния, 50% смесь этилацетат/гексаны) получено 361 мг (7%) соединения C в виде пены.
D. N-(3,4-Диметил-5-изоксазолил)-N-((2-метоксиэтокси)метил)-2- бром-5-(фенилметокси)-бензолсульфонамид.
Соединение D было получено в виде желтого масла из соединения C, как описано для соединения B из примера 55.
E. N-(3, 4-Диметил-5-изоксазолил)-N-((2-метоксиэтокси)метил)-4'- (2-метилпропил)-4-(фенилметокси)-[1, 1'-бифенил]-2-сульфонамид.
Соединение E было получено из соединения D и 4-изобутилбензолбороновой кислоты, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 3 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 3:1 привела к соединению E в виде прозрачного не совсем белого масла.
F. N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-4- (фенилметокси)-[1,1'-бифенил]-2-сульфонамид.
К теплому раствору соединения E в этаноле (15 мл) добавили концентрированную соляную кислоту (5 мл). Смесь нагревали до кипения с обратным холодильником в течение 7 часов и большую часть этанола выпарили. Остаток распределили между насыщенным [раствором] хлорида натрия и эфиром, водный слой экстрагировали эфиром и соединенные органические слои осушали (сульфат магния) и концентрировали. Хроматография (диоксид кремния, 25% смесь этилацетат/гексаны) и последующая перекристаллизация (гексаны (15 мл), содержащие следы эфира) привели к указанному в заголовке соединению в виде белого порошка, т.пл. 96-101oC.
Анализ при расчете для C28H30N2O4S•0.17H2O.
Вычислено: C 68.11, H 6.20, N 5.67, S 6.49.
Найдено: C 68.13, H 6.18, N 5.52, S 6.44.
Пример 71.
N-(3,4-Диметил-5-изоксазолил)-2'-[[(метиламино)карбонил)амино] - 4'-(2-метилпропил)-[1, 1'-бифенил]-2-сульфонамид.
К раствору соединения по примеру 32 (50 мг, 0.12 ммоль) в 1.3 мл хлористого метилена при 0oC добавили метилизоцианат (71 мг, 1.2 ммоль). Реакционную [смесь] перемешивали при комнатной температуре в течение 3 часов и концентрировали. Остаток кристаллизовали из смеси хлористый метилен/гексаны с получением 57 мг (100%) указанного в заголовке соединения в виде белого кристаллического твердого вещества, т.пл. 172-174oC.
Анализ при расчете для C23H28N4O4 S•0.49H2O.
Вычислено: C 59.36, H 6.28, N 12.04, S 6.89.
Найдено: C 59.44, H 6.02, N 11.96, S 6.98.
Пример 72.
N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-4-[(2-фенилэтил) окси] -[1, 1'-бифенил]-2-сульфонамид.
A. 3-(2-Фенилэтокси)бензолсульфоновая кислота.
Смесь 3-гидроксибензолсульфоновой кислоты (1.4 г, 8.3 ммоль), 2-фенилэтилбромида (2.4 мл, 17 ммоль) и 2н. гидроксида натрия (12 мл) в изопропаноле (40 мл) кипятили с обратным холодильником в течение 3 суток. Пропанол испарили и остаток промыли этилацетатом, подкислили HCl и экстрагировали этилацетатом. Последние экстракты осушали и выпаривали с получением соединения A (1.5 г, 64%).
B. 2-Бром-5-(2-фенилэтокси)бензолсульфонилхлорид.
Соединение B было получено из натриевой соли соединения A, как описано для соединения B из примера 70. Хроматография на силикагеле с использованием 10% смеси этилацетат/гексаны привела к чистому соединению B.
C. N-(3,4-Диметил-5-изоксазолил)-2-бром-5-(2-фенилэтокси)- бензолсульфонамид.
Раствор соединения B (1.4 г, 3.7 ммоль), 3,4-диметилизоксазоламина (0.54 г, 4.8 ммоль) и диметиламинопиридина (0.09 г, 0.7 ммоль) в пиридине (7 мл) перемешивали в течение 1 часа при 70oC. Смесь разбавили водой, подкислили 6н. HCl и дважды экстрагировали этилацетатом. Экстракты промывали насыщенным [раствором] хлорида натрия, осушали (сульфат магния) и концентрировали. Хроматографией (диоксид кремния, 10% смесь метанол/дихлорметан) получено 0.2 г (12%) соединения C.
D. N-(3,4-Диметил-5-изоксазолил)-N-((2-метоксиэтокси)метил)-2- бром-5-(2-фенилэтокси)бензолсульфонамид.
Соединение D было получено с выходом 76% из соединения C, как описано для соединения B из примера 55.
E. N-(3, 4-Диметил-5-изоксазолил)-N-((2-метоксиэтокси)метил)-4'- (2-метилпропил)-4-(2-фенилэтокси)-[1,1'-бифенил]-2-сульфонамид.
Соединение E было получено из соединения D и 4-изобутилбензолбороновой кислоты, как описано для соединения A из примера 12, с использованием толуола вместо бензола и при нагревании с обратным холодильником в течение 2 часов. Хроматография на силикагеле с использованием 5% смеси этилацетат/дихлорметан привела к соединению E с выходом 79%.
F. N-(3, 4-Диметил-5-изоксазолил)-4'-(2-метилпропил)-4- (2-фенилэтокси)-[1, 1'-бифенил]-2-сульфонамид.
Смесь соединения E в этаноле (2.5 мл) и 6н. HCl (2.5 мл) нагревали до кипения с обратным холодильником в течение 3 суток и большую часть этанола выпарили. Остаток распределили между водой и хлористым метиленом. Органический слой осушали (сульфат магния) и концентрировали. Хроматография (диоксид кремния, 30% смесь этилацетат/гексаны) привела к указанному в заголовке соединению в виде масла (Rf, диоксид кремния, 5% этилацетат/дихлорметан, 0.79).
Анализ при расчете для C29H32N2O4S• 0.8H2O.
Вычислено: C 67.11, H 6.52, N 5.40, S 6.18.
Найдено: C 67.48, H 6.18, N 5.03, S 6.07.
Пример 73.
5-[(Карбоксиметил)амино]-N-(3,4-диметил-5-изоксазолил)-4'- (2-метилпропил)-[1,1'-бифенил]-2-сульфонамид.
К раствору соединения из примера 43 (0.19 г, 0.47 ммоль) и моногидрата глиоксиловой кислоты (56.0 мг, 0.61 ммоль) в метаноле (5 мл) при 0oC добавили ледяную уксусную кислоту (0.054 мл, 0.94 моль) и триацетоксиборгидрид натрия (0.30 г, 1.4 ммоль). Смесь нагрели до комнатной температуры и перемешивали в течение 18 часов. Добавили дополнительные количества ледяной уксусной кислоты (0.054 мл, 0.94 ммоль) и триацетоксиборгидрида натрия (0.30 г, 1.4 ммоль), и реакционную смесь перемешивали в течение 48 часов и вылили в воду (50 мл). Осадок собрали, промыли водой и осушали в вакууме. Остаток растворили в 2 мл этилацетата и нанесли на четыре толстые пластины из силикагеля, которые элюировали смесью гексаны/этилацетат (2:1). Надлежащие полосы вырезали, экстрагировали этилацетатом, и обогащенный продукт три раза растирали с гексанами, после чего дважды проводили осаждение из этилацетата с помощью гексанов. Осушение при 160 торр при 35oC в течение трех дней привело к получению 3.5 мг указанного в заголовке соединения в виде желтого аморфного твердого вещества, т.пл. 73-78oC.
(M + H)- 458.
Анализ при расчете для C23H27N3O5S - 0.4 C6H14 - 0.6 CH3CO2H - 0.2 CHCl3.
Вычислено: C 59.13, H 6.66, N 7.38.
Найдено: C 59.11, H 6.52, N 6.96.
Пример 74.
5-[(Аминоацетил)амино] -N-(3,4-диметил-5-изоксазолил)-4'- (2-метилпропил)-[1, 1'-бифенил]-2-сульфонамид.
A. 5-[[2-(1, 1-Диметилэтоксикарбониламино)-1-оксоэтил] амино] -N- (3,4-диметил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил]-2- сульфонамид.
При 0oC к раствору Boc-глицина (0.14 г, 0.83 ммоль) и триэтиламина (0.12 мл, 0.83 ммоль) в сухом тетрагидрофуране (2.7 мл) добавили 2 М раствор оксалилхлорида в дихлорметане (0.43 мл, 0.87 ммоль), а затем диметилформамид (3 капли). Смесь перемешивали при 0oC в течение 1 часа, добавили раствор соединения из примера 43 (0.30 г, 0.75 ммоль) и пиридина (0.67 мл, 0.83 ммоль) в ацетоне (3 мл), и смесь перемешивали при комнатной температуре в течение 18 часов и концентрировали. Остаток растворили в метаноле (50 мл) и добавили 5% раствор гидрокарбоната натрия в воде (10 мл). Раствор перемешивали в течение 20 минут и концентрировали для удаления метанола, и водный слой подкислили до pH 3 с помощью 6н. водной HCl. Смесь экстрагировали этилацетатом и органическую фазу промывали соляным раствором, осушали (сульфат магния) и выпаривали. С помощью хроматографии на диоксиде кремния с применением смеси этилацетат/гексаны 1:1 получено 147 мг соединения A.
MC: (M + H)- = 557.
B. 5-[(Аминоацетил)амино] -N-(3,4-диметил-5-изоксазолил)-4'- (2-метилпропил)-[1,1'-бифенил]-2-сульфонамид.
Соединение A (0.15 г, 0.26 ммоль) растворили в 97% муравьиной кислоте (15 мл) при 0oC и добавили концентрированную HCl (1.5 мл). Смесь перемешивали при 0oC в течение 25 минут и концентрировали, а остаток три раза обработали метанолом. Полученное желто-коричневое твердое вещество растирали со смесью эфир/гексаны, растворили в метаноле и осаждали эфиром. Твердое вещество растворили в воде и подвергли ВЭЖХ на колонке YMC-S-343 S-10 ODS (30 х 500 мм) с использованием градиентной системы от 70% воды:30% ацетонитрила: 0.1% ТФУК до 60% воды:40% ацетонитрила:0.1% ТФУК в течение 45 минут при 40 мл/мин. Надлежащие фракции собирали и лиофилизировали от воды с получением 25 мг (14.5%) указанного в заголовке соединения в виде распушенного белого лиофилата, т.пл. 135-138oC.
Анализ при расчете для C23H28N4O4S•1.45H2O - 1.5 CF3CO2H.
Вычислено: C 47.77, H 4.99, N 8.57, S 4.90.
Найдено: C 47.77, H 4.91, N 8.26, S 4.97.
Пример 75.
N-(3, 4-диметил-5-изоксазолил)-2'-формил-4'-(2-метилпропил)- [1,1'-бифенил]-2-сульфонамид.
A. 3-(2-Метилпропил)бензиловый спирт.
К раствору изобутилена (4.4 г, 78 ммоль) в 11 мл тетрагидрофурана при -78oC добавили 9-BNN (0.5 М в тетрагидрофуране, 157 мл, 78 ммоль). Смесь перемешивали при -78oC в течение 3 часов, нагрели до комнатной температуры и перемешивали в течение ночи. В отдельную колбу, содержащую 3-бромбензиловый спирт (13.3 г, 71.3 ммоль) в 36 мл тетрагидрофурана, добавили тетракис(трифенилфосфин)палладий(0) (2.47 г, 2.14 ммоль) и 60 мл 3 М гидроксида натрия. 9-Изобутил-BBN быстро перенесли в колбу в атмосфере аргона и смесь кипятили с обратным холодильником в течение 21 часа. После охлаждения в ледяной бане медленно добавили 18 мл 30% перекиси водорода и смесь перемешивали в течение 30 минут, концентрировали до примерно 100 мл и распределили между водой и этилацетатом. Водную фазу экстрагировали этилацетатом. Объединенные органические экстракты промыли соляным раствором, осушали и концентрировали. Остаток хроматографировали на силикагеле с применением смеси гексаны/этилацетат 9:1 с получением соединения A (8.16 г, 70%) в виде жидкости.
B. 1,3-Дигидро-1-гидрокси-5-(2-метилпропил)-2.1-бензоксаборол.
Соединение B было получено в виде светло-желтого твердого вещества из соединения A, как описано для соединения A из примера 38, за исключением того, что добавление триметилбората осуществлялось при -40oC и экстракции проводили с использованием этилацетата, т.пл. 96-100oC.
C. N-(3, 4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)]метил- [2'-гидроксиметил-4'-(2-метилпропил)]-[1,1'-бифенил]-2-сульфонамид.
Соединение C было получено из соединения B и соединения A из примера 4, как описано для соединения A из примера 12, при использовании толуола вместо бензола и при нагревании при 80oC в течение 4 часов. Хроматография на силикагеле с использованием смести гексаны/этилацетат 2.5:1 привела к соединению C в виде бесцветной смолы.
D. N-(3, 4-диметил-5-изоксазолил)-N-[(2-метоксиэтокси)]метил]- [формил-4'-(2-метилпропил)]-[1, 1'-бифенил]-2-сульфонамид.
К оксалилхлориду (2 М в хлористом метилене, 9 мл, 18 ммоль) в 26 мл хлористого метилена при -78oC добавляли раствор диметилсульфоксида (2.8 г, 36 ммоль) в 39 мл хлористого метилена. Раствор перемешивали в течение 10 минут, добавили соединение C (2.4 г, 4.8 ммоль) в 39 мл хлористого метилена, и смесь перемешивали при -78oC в течение 2 часов. Добавили триэтиламин (6.1 г, 60 ммоль) и смесь перемешивали при -78oC в течение 5 минут и нагревали до комнатной температуры в течение 15 минут. Смесь распределили между 0.5н. HCl и хлористым метиленом, водную фазу экстрагировали хлористым метиленом, соединенные органические экстракты осушали и концентрировали, и остаток хломатографировали на силикагеле с использованием смеси гексаны/этилацетат 3.5:1 с получением соединения D (1.83 г, 77%).
E. N-(3, 4-диметил-5-изоксазолил)-2'-формил-4'-(2-метилпропил)- [1,1'-бифенил]-2-сульфонамид.
Указанное в заголовке соединение было получено из соединения D, как описано для примера 18, с использованием 6н. соляной кислоты и при кипячения с обратным холодильником в течение 1.5 часов. Хроматография на силикагеле с использованием смеси гексаны/этилацетат 2.5:1 привела к получению указанного в заголовке соединения в виде аморфного белого твердого вещества, т.пл. 60-66o C.
Анализ при расчете для C22H24N2O4 S•0.28 H2O.
Вычислено: C 63.28, H 5.93, N 6.71, S 7.68.
Найдено: C 63.26, H 6.09, N 6.73, S 7.49.
Пример 76.
2'-[[3,4-Диметил-5-изоксазолил)амино] сульфонил] -4-(2-метилпропил)- [1,1'-бифенил]-2-карбоновая кислота.
К раствору соединения из примера 75 (103 мг, 0.25 ммоль) и сульфаминовой кислоты (48 мг, 0.5 ммоль) в 2.5 мл ТГФ при -10oC добавили раствор хлорита натрия (45 мг, 0.5 ммоль) в 2.5 мл воды при 0oC. Смесь перемешивали в течение 5 минут, добавили 45 мл хлористого метилена, и органическую фазу отделили, промыли водой (1 мл), осушали и концентрировали. Остаток очищали препаративной ВЭЖХ на колонке 30 х 500 мм ODS S10 (68% метанола, 32% воды, 0.1% ТФУК) с получением указанного в заголовке соединения (32 мг, 30%) в виде белого твердого вещества, т.пл. > 185oC, разл.
Анализ при расчете для C22H24N2O5S•0.50 H2O.
Вычислено: C 60.39, H 5.76, N 6.40, S 7.33.
Найдено: C 60.49, H 5.64, N 6.30, S 7.38.
Реферат
Изобретение относится к новым фенилсульфонамидным производным общей формулы I, где значения R1, R2, R3, R4, R5 описаны в п.1 формулы изобретения. Соединения формулы I обладают ценными свойствами, которые могут быть использованы при лечении, связанном с эндотелином нарушений у млекопитающих при гипертонии, ренальных, гломерулярных расстройствах, нарушений мезангиальных клеток, эндотоксемии или ишемии. 3 с. и 13 з.п. ф-лы, 1 табл.
Формула

где один из X и Y представляет N, а другой - O;
R1, R2, R3 каждый независимо представляет собой водород, циклоалкил, циклоалкилалкил; низший алкил, низший алкенил, низший алкокси, фенил или нафтил, фенил(низший)алкокси, фенил(низший)алкил, фенилокси, любой из которых может быть замещен Z1, Z2, Z3; галоид; гидроксил; - C(O)H или -C(O)R6; - CO2H или - CO2 R6; - Z4-NR7R8 или - Z4-N(R11 )-Z5-NR9R10;
R4 и R5 каждый независимо представляет водород, циклоалкил; низший алкил, низший алкенил, фенил, фенил(низший)алкил, фенилокси, любой из которых может быть замещен группами Z1, Z2, Z3; гидроксил; - CO2H или - CO2R6; R4 и R5 вместе представляют собой алкилен, образующий 4 - 8-членное насыщенное кольцо вместе с атомами углерода, к которым они присоединены;
R6 представляет собой низший алкил, низший алкенил;
R7 представляет собой водород; низший алкил, низший алкенил, фенил, фенил(низший)алкил; - C(O)H или - C(O)R6; - CO2R6;
R8 представляет собой водород; - C(O)H или -C(O)R6; низший алкил, фенил(низший)алкил; R7 и R8 вместе представляют алкилен, образующий 3 - 8-членное насыщенное кольцо вместе с атомом азота, к которому они присоединены;
R9 представляет собой водород;
R10 представляет собой водород; - CO2R6; низший алкил, фенил;
R11 представляет собой водород;
Z1, Z2, Z3 - каждый независимо представляет водород, фенилокси; галоид; гидрокси; оксо; - CO2H или - CO2Z6;
Z4 и Z5 представляет собой каждый независимо одинарную связь; - Z9-C(O)-Z10-;
Z6, Z7, Z8 каждый независимо является водородом, низшим алкилом;
Z9, Z10 каждый независимо представляет одинарную связь, низший алкилен, низший алкенилен.
N-(3, 4-диметил-5-изоксазолил)[1,1'-бифенил]-2-сульфонамид,
N-(3,4-диметил-5-изоксазолил)-2-бромбензолсульфонамид,
N-(3, 4-диметил-5-изоксазолил)-2-феноксибензолсульфонамид,
3'-амино-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид,
2-фтор-N-(3,4-диметил-5-изоксазолил)-бензолсульфонамид,
N-[3-[[(3,4-диметил-5-изоксазолил)амино] сульфонил] -4-метилфенил] -ацетамид,
5-амино-N-(3,4-диметил-5-изоксазолил)-2-метил-бензолсульфонамид,
N-(3, 4-диметил-5-изоксазолил)-2-(1-метилэтил)-бензолсульфонамид,
N-(3, 4-диметил-5-изоксазолил)-2-нитро-бензолсульфонамид,
2-амино-N-(3,4-диметил-5-изоксазолил)бензолсульфонамид,
N-(3,4-диметил-5-изоксазолил)-4'-метил-[1,1'-бифенил]-2-сульфонамид,
2'-амино-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид,
3'-(диметиламино)-N-(3, 4-диметил-5-изоксазолил)-[1,1'-бифенил] -2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-2-(трифторметил)-бензолсульфонамид,
2-хлор-N-(3, 4-диметил-5-изоксазолил)-6-метилбензолсульфонамид,
4'-(диметиламино)-N-(3,4-диметил-5-изоксазолил)-[1, 1'-бифенил] -2-сульфонамид,
N-[2'-[[(3, 4-диметил-5-изоксазолил)амино]сульфонил]-[1,1'-бифенил]-3-ил] ацетамид,
N-(3,4-диметил-5-изоксазолил)-4'-пропил-[1,1'-бифенил]-2-сульфонамид,
2-(диметиламино)-N-(3, 4-диметил-5-изоксазолил)бензолсульфонамид,
2'-(диметиламино)-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил] -2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-4'-(2-метилпропил)-[1, 1'-бифенил] -2-сульфонамид,
4'-бутил-N-(3,4-диметил-5-изоксазолил)[1,1'-бифенил]-2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-2-(1-нафталенил)бензолсульфонамид,
N-(3, 4-диметил-5-изоксазолил)-3'-(2-метилпропил)-[1,1'-бифенил] -2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-4'-(2-метилпропокси)-[1,1'-бифенил] -2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-4'-(1-метилэтокси)-[1,1'-бифенил] -2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-4'-(фенилметилокси)-[1,1'-бифенил]-2-сульфонамид;
4'-(1,1-диметилэтил)-N-(3, 4-диметил-5-изоксазолил)-[1,1'-бифенил] -2-сульфонамид,
N-(3, 4-диметил-5-изоксазолил)-4'-метокси-[1,1'-бифенил]-2-сульфонамид,
N-(3,4-диметил-5-изоксазолил)-4'-[(1-метилэтил)амино] -[1,1'-бифенил] -2-сульфонамид,
2-[[[[2'-[[(3, 4-диметил-5-изоксазолил)амино] -сульфонил] -[1,1'-бифенил] -4-ил](1-метилэтил)амино]карбонил]-амино]-4-метилпентановая кислота, ее этиловый эфир,
2'-амино-N-(3, 4-диметил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил] -2-сульфонамид,
N-[2'-[[(3,4-диметил-5-изоксазолил)амино]сульфонил]-[1,1'-бифенил]-4-ил] ]-N-(1-метилэтил)-β -фенилбензолпропанамид,
2'-нитро-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид,
5-[[[(2-фенил)фенил] сульфонил] амино] -3-метил-4-изоксазолкарбоновая кислота, этиловый эфир,
N-(3-метил-4-фенилметил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил] -2-сульфонамид,
N-(4, 5-диметил-3-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил] -2-сульфонамид,
4'-(2-метилпропил)-2'-метокси-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид,
4'-(2-метилпропил)-2'-гидрокси-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид,
N-(3-метил-4-нитро-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил] -2-сульфонамид,
N-(4-метил-5-изоксазолил)-4'-(2-метилпропил)-[1,1'-бифенил]-2-сульфонамид,
4'-(2-метилпропил)-N-(4,5,6,7-тетрагидро-2,1-бензизоксазол-3-ил)-[1,1'-бифенил]-2-сульфонамид,
4-амино-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил] -2-сульфонамид,
2'-фтор-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил] -2-сульфонамид и
4-метокси-4'-(2-метилпропил)-N-(3,4-диметил-5-изоксазолил)-[1,1'-бифенил]-2-сульфонамид.
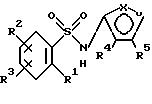
где один из X и Y представляет N, а другой - О;
R1, R2, R3 каждый независимо представляет собой водород, за исключением того, что R1 отличен от водорода, циклоалкил, циклоалкилалкил; низший алкил, низший алкенил, низший алкокси, фенил или нафтил, фенил(низший)алкокси, фенил(низший)алкил, фенилокси, любой из которых может быть замещен Z1, Z2, Z3; галоид; гидроксил; - C(O)H или -C(O)R6; - CO2H или - CO2R6; - Z4-NR7R8 или - Z4-N(R11)-Z5-NR9R10;
R4 и R5 каждый независимо представляет водород, циклоалкил; низший алкил, низший алкенил, фенил, фенил(низший)алкил, фенилокси, любой из которых может быть замещен группами Z1, Z2, Z3; гидроксил; - CO2H или - CO2R6; R4 и R5 вместе представляют собой алкилен, образующий 4 - 8-членное насыщенное кольцо вместе с атомами углерода, к которым они присоединены;
R6 представляет собой низший алкил, низший алкенил;
R7 представляет собой водород; низший алкил, низший алкенил, фенил, фенил(низший)алкил; - C(O)H или - C(O)R6; - CO2R6;
R8 представляет собой водород; - C(O)H или -C(O)R6; - низший алкил, фенил(низший)алкил; R7 и R8 вместе представляют алкилен, образующий 3 - 8-членное насыщенное кольцо вместе с атомом азота, к которому они присоединены;
R9 представляет собой водород;
R10 представляет собой водород; - CO2R6; низший алкил, фенил;
R11 представляет собой водород;
Z1, Z2, Z3 - каждый независимо представляет водород, фенилокси; галоид; гидрокси; оксо; - CO2H или CO2Z6;
Z4 и Z5 представляет собой каждый независимо одинарную связь; - Z9-C(O)-Z10-;
Z6, Z7, Z8 - каждый независимо является водородом, низшим алкилом;
Z9, Z10 каждый независимо представляет одинарную связь, низший алкилен, низший алкенилен.

Комментарии