Энантиоселективный способ получения производных хинолина - RU2383534C2
Код документа: RU2383534C2
Описание
Изобретение относится к экономичному и высокоэффективному способу получения в препаративном масштабе 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов в виде энантиомеров с высокой степенью очистки, которые являются ценными промежуточными соединениями для получения солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она.
Соли 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она являются β-селективными агонистами адреноцептора, обладающие высокой бронхорасширительной активностью. Например, малеат 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она прежде всего применяется для лечения астмы и хронического обструктивного заболевания легких (COPD).
Первым объектом настоящего изобретения является способ получения 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов или их приемлемых сольватов, который включает взаимодействие 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-(оксизамещенного)-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она, причем упомянутый хиральный агент характеризуется формулой I или II

где
M означает Ru, Rh, Ir, Fe, Co или Ni,
L означает С6-С24арил или С6-С24арил(С1-С10)алифатический остаток, в любом случае необязательно связанный с полимером,
Х означает водород или галоген,
R1 означает C1-С10алифатический, С3-С10циклоалифатический, С3-С10циклоалифатический(С1-С10)алифатический, С6-С24арильный или С6-С24арил(С1-С10)алифатический остаток или 4-12-членную гетероциклическую группу, которая в каждом случае необязательно связана с полимером, а
R2 и R3 означают фенил,
или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклогексан или циклопентан.
Указанный способ является эффективным для получения 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов, прежде всего 8-фенилметокси-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-она, в препаративном масштабе в виде энантиомера с высокой степенью очистки и высоким выходом.
Термины, использованные в тексте заявки, имеют следующие значения:
Термин "галоген" означает элемент группы 17 (прежнее обозначение - группа VII) Периодической таблицы элементов, например, фтор, хлор, бром или иод. Предпочтительный галоген означает хлор, бром или иод.
Термин "C1-С10алифатический остаток или группа" означает ациклическую, насыщенную или ненасыщенную, неароматическую углеводородную группу, которая содержит до 10 атомов углерода, например, С1-С10алкил, С2-С10алкенил или С2-С10алкинил. Предпочтительный C1-С18алифатический остаток или группа означает С1-С4алифатический остаток или группу, прежде всего этил, пропил или бутил.
Термин "С3-С10циклоалифатический остаток или группа" означает циклическую, насыщенную или ненасыщенную, неароматическую углеводородную группу, которая содержит от 3 до 10 атомов углерода, например, С3-С10циклоалкил или С3-С10циклоалкенил. Предпочтительный С3-С10циклоалифатический остаток или группа означает С3-С8циклоалифатический остаток или группу, прежде всего С3-С10циклоалкил или С3-С10циклоалкенил.
Термин "С3-С10циклоалифатический(С1-С10)алифатический остаток или группа" означает С1-С10алифатический остаток или группу, определенную выше, которая замещена С3-С10циклоалифатическим остатком или группой, определенной выше, например, С3-С10циклоалкил(С1-С10)алкил, С3-С10циклоалкил(С2-С10)алкенил, С3-С10циклоалкил(С3-С10)алкинил, С3-С10циклоалкенил(С1-С10)алкил, С3-С10циклоалкенил(С2-С10)алкенил, С3-С10циклоалкенил(С2-С10)алкинил, С3-С10циклоалкинил(С1-С10)алкил, С3-С10циклоалкинил(С2-С10)алкенил или С3-С10циклоалкинил(С3-С10)алкинил. Предпочтительный С3-С10циклоалифатический(С1-С10)алифатический остаток или группа означает С3-С8циклоалифатический(С1-С4)алифатический остаток или группу, прежде всего циклопропилметил.
Термин "С6-С24арил" означает арил, который содержит от 6 до 24 атомов углерода. С6-С24Арил предпочтительно незамещен, но может содержать, например, один или более заместителей, например, два или три, например, выбранные из группы, включающей: галоген, С1-С10алкил, галоген(С1-С10)алкил, С2-С10алкенил, C1-С10алкокси, гидрокси, -СНО, С1-С10замещенный окси, С2-С10алканоилокси, фенил, фенокси, галогензамещенный фенокси, амино, C1-С10алкиламино, ди(С1-С10алкил)амино, нитро, циано и CF3. Предпочтительный С6-С24арил означает С6-С20арил, прежде всего фенил, изопропилметилбензол (цимен), бензол, гексаметилбензол, мезитилен, 4-хлор-4-феноксифенил, 4-феноксифенил, 5-диметиламино-1-нафтил, 5-диэтиламино-1-нафтил, 5-нитро-1-нафтил, 2-нитрофенил, 3-нитрофенил, 4-нитрофенил, 4-винилфенил, 4-бифенилил, 9-антраценил, 2-гидроксифенил, 3-гидроксифенил, 4-гидроксифенил, толил, фенантрил, диметил(нафталин-1-ил)амин, моно- ди- или трис-трифторметилфенил, хризенил или периленил.
Термин "С6-С24арил(С1-С10)алифатический остаток или группа" означает С1-С10алифатический остаток или группу, определенную выше, которая замещена С6-С24арилом, определенным выше. Предпочтительный С6-С24арил(С1-С10)алифатический остаток или группа или группа арилалифатический остаток означает С6-С20арил(С1-С4)алифатический остаток или группу, прежде всего фенил(С1-С4)алкил, фенил(С2-С4)алкенил или фенил(С2-С4)алкинил.
Термин «C1-С10алкил» означает алкил с прямой или разветвленной цепью, который содержит от одного до десяти атомов углерода. Предпочтительный С1-С10алкил означает С1-С4алкил.
Термин «С2-С10алкенил» означает алкенил с прямой или разветвленной цепью, который содержит от двух до десяти атомов углерода. Предпочтительный С2-С10алкенил означает С2-С4алкенил.
Термин «С2-С10алкинил» означает алкинил с прямой или разветвленной цепью, который содержит от двух до десяти атомов углерода. Предпочтительный С2-С10алкинил означает С2-С4алкинил.
Термин «С2-С10циклоалкил» означает циклоалкил, который содержит от 3 до 10 атомов углерода в цикле, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, любой из которых замещен одной, двумя или более группами С1-С4алкил, прежде всего метил.
Предпочтительный С3-С10циклоалкил означает С3-С8циклоалкил, прежде всего С3-С6циклоалкил.
Термин «С3-С10циклоалкенил» означает циклоалкенил, который содержит от 3 до 10 атомов углерода в цикле, например, циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил или циклооктенил, любой из которых замещен одной, двумя или более группами С1-С4алкил, прежде всего метил. Предпочтительный С3-С10циклоалкенил означает С3-С8циклоалкенил, прежде всего С3-С6циклоалкенил, прежде всего, циклопент-2-енил, циклопент-3-енил, циклогекс-2-енил или циклогекс-3-енил.
Термин «бензо(С3-С10)циклоалкил» означает С3-С10циклоалкил, определенный выше, присоединенный к двум соседним атомам углерода в бензольном цикле. Предпочтительный бензо(С3-С10)циклоалкил означает бензо(С3-С8)циклоалкил, прежде всего бензоциклогексил (тетрагидронафтил).
Термин «С3-С10циклоалкил(С1-С10)алкил» означает (С1-С10)алкил, определенный выше, замещенный С3-С10циклоалкилом, определенным выше. Предпочтительный С3-С10циклоалкил(С1-С10)алкил (циклоалкилалкил) означает С3-С8циклоалкил(С1-С4)алкил.
Термин «С7-С34аралкил» означает С6-С24арил(С1-С10)алкил с прямой или разветвленной цепью, например, одну из групп C1-С10алкил, указанных выше, прежде всего одну из групп С1-С4алкил, замещенную группой: фенил, толил, ксилил или нафтил. Предпочтительный С7-С34аралкил означает С7-С14аралкил, прежде всего фенил(С1-С4)алкил, прежде всего бензил или 2-фенилэтил.
Термин «С1-С10алкокси» означает алкокси с прямой или разветвленной цепью, который содержит от 1 до 10 атомов углерода. Предпочтительный С1-С10алкокси означает С1-С4алкокси.
Термин «4-12-членная гетероциклическая группа» означает моновалентную гетероциклическую группу, которая содержит от 4 до 12 атомов углерода и один, два, три или четыре гетероатома, выбранных из азота, кислорода и серы. 4-12-Членная гетероциклическая группа означает, например, моноциклическую группу, которая содержит один атом азота, кислорода или серы, такую как азетидинил, пиррил, пиридил, пиперидил, пиранил, фурил, тетрагидрофурил или тиенил, или моноциклическую группу, которая содержит два гетероатома, выбранных из азота, кислорода и серы, такую как имидазолил, пиримидинил, пиперазинил, оксазолил, изоксазолил, тиазолил, морфолинил или тиоморфолинил, или бициклическую группу, такую как бензазол, индол, бензимидазол, индазол, бензотиофен, бензотиазол или бензодиоксол. 4-12-Членная гетероциклическая группа является незамещенной или замещенной. Предпочтительные заместители гетероциклической группы включают галоген, циано, гидрокси, карбокси, аминокарбонил, нитро, С1-С10алкил, гидрокси(С1-С4)алкил, C1-С10алкокси, С3-С10циклоалкил, С1-С4алкилкарбонил и фенил(С1-С4)алкил. Предпочтительная 4-12-членная гетероциклическая группа означает 5-8-членную гетероциклическую группу, прежде всего моноциклическую группу, которая содержит один или два атома азота или кислорода, такую как пиранил или 2-, 3- или 4-пиридил, или один атом азота и один атом кислорода в цикле, причем атом азота в цикле необязательно замещен следующими группами: C1-С4алкил, гидрокси(С1-С4)алкил, С1-С4алкилкарбонил или фенил(С1-С4)алкил, или бициклическую группу, такую как бензо[1,3]диоксол.
Термин «галоген(С1-С10)алкил» означает алкил с прямой или разветвленной цепью, как определено выше, который замещен одним или более, например, одним, двумя или тремя атомами галогена, как определено выше. Предпочтительный галоген(С1-С10)алкил означает галоген(С1-С4)алкил, в котором галоген прежде всего означает фтор или хлор.
Термин «замещенная силильная группа» означает предпочтительно силильную группу, замещенную по крайней мере одной группой С1-С10алкил, как определено в данном контексте.
Термин «включает» и его варианты, например, «включающий», используемые в описании заявки и пунктах формулы изобретения, если не указано иное, означает включение указанных целого числа или стадии или группы целых чисел или стадий, но при этом не исключены любые другие целые число или стадия или группы целых чисел или стадий.
В предпочтительном варианте способа получения 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов или их приемлемых сольватов хиральный агент характеризуется формулой I или II, как определено выше, где
М означает рутений,
L означает изопропилметилбензол, бензол, гексаметилбензол или мезитилен,
Х означает водород или галоген, предпочтительно хлор,
R1 означает фенил, 2- или 3- или 4-пиридил, 4'-хлор-4-феноксифенил, 4-феноксифенил, 5-диметиламино-1-нафтил, 5-нитро-1-нафтил, 2-, 3-, 4-нитрофенил, 4-винилфенил, 4-бифенилил, 9-антраценил, 2-, 3- или 4-гидроксифенил, толил, фенантрил, бензо[1,3]диоксол, диметил(нафталин-1-ил)амин, моно-, ди- или трис-трифторметилфенил, хризенил, периленил или пиранил, и
R2 и R3 оба означают фенил.
В наиболее предпочтительном варианте способа получения 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов или их приемлемых сольватов хиральный агент означает хиральный агент на основе рутения, прежде всего RuCl[(1S,2S)-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен).
Во втором объекте настоящего изобретения предлагается способ получения солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она, который включает:
(1) взаимодействие 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-замещенного окси-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она, причем хиральный агент характеризуется формулой I или II, как определено выше.
(2) обработка 8-замещенного окси-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она основанием в присутствии растворителя с образованием 8-замещенного окси-(R)-оксиранил-(1Н)-хинолин-2-она формулы III

где R означает защитную группу,
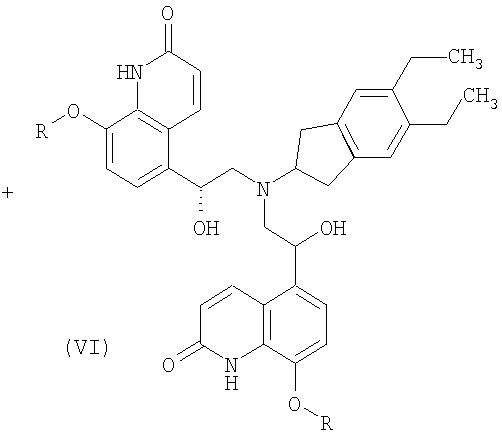
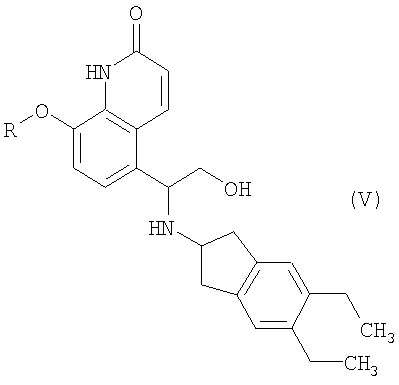
(3) взаимодействие 8-замещенного окси-5-(R)-оксиранил-(1Н)-хинолин-2-она формулы III, где R имеет значение, как определено выше, с 2-амино-(5,6-диэтил)инданом с образованием реакционной смеси, содержащей соединения формул IV, V и VI

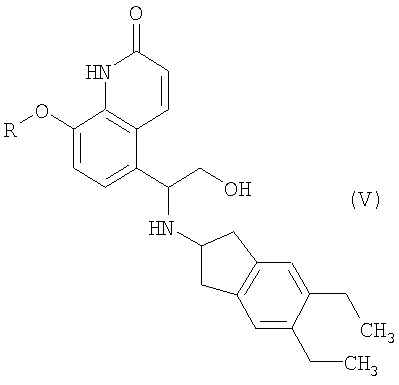

где R означает защитную группу,
(4) обработка реакционной смеси, полученной на стадии (3), кислотой в присутствии растворителя с образованием соответствующей соли,
(5) выделение и кристаллизация соли формулы VII
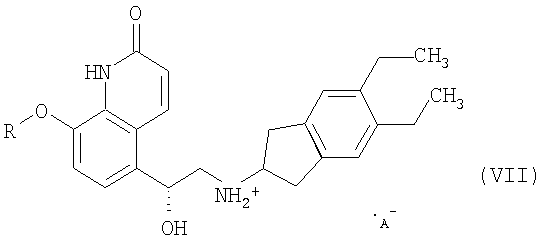
где R означает защитную группу, а А- означает анион,
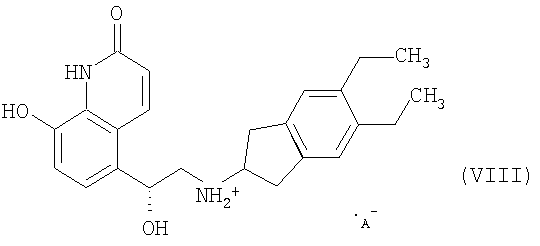
(6) удаление защитной группы в составе соли формулы VII в присутствии растворителя с образованием соли формулы VIII

где А- означает анион, и (7) обработка соли формулы VIII кислотой в присутствии растворителя с образованием соли
5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она формулы IX

где X- означает анион.
В третьем объекте настоящего изобретения предлагается способ получения солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она, который включает:
(а) взаимодействие
(1) 8-гидрокси-(1Н)-хинолин-2-она с ацилирующим агентом и кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она, или
(2) 8-гидрокси-(1Н)-хинолин-2-она с ацилирующим агентом с образованием 8-ацетокси-(1Н)-хинолин-2-она, и обработка in-situ 8-ацетокси-(1Н)-хинолин-2-она кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она, или
(3) 8-ацетокси-(1Н)-хинолин-2-она с кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она,
(b) взаимодействие 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она, полученного на стадии (а), с соединением формулы R-Q в присутствии основания и растворителя с образованием 5-ацетил-8-замещенного окси-(1Н)-хинолин-2-она, где R означает защитную группу, a Q означает уходящую группу,
(c) взаимодействие 5-ацетил-8-замещенного-(1Н)-хинолин-2-она с галогенирующим агентом в присутствии растворителя с образованием 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она,
(d) взаимодействие 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-замещенного окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она, причем указанный хиральный агент характеризуется формулами I или II, как определено выше,
(e) обработка 8-замещенного окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она с основанием в присутствии растворителя с образованием 8-замещенного окси-5-(R)-оксиранил-(1Н)-хинолин-2-она формулы III,

где R означает защитную группу,
(f) взаимодействие 8-замещенного окси-5-(R)-оксиранил-(1Н)-хинолин-2-она формулы III, где R имеет значение, определенное выше, с 2-амино-(5,6-диэтил)инданом с образованием реакционной смеси, содержащей соединения формул IV, V и VI



где R означает защитную группу,
(g) обработка реакционной смеси, полученной на стадии (f), кислотой в присутствии растворителя с образованием соответствующей соли,
(h) выделение и кристаллизация соли формулы VII

где R означает защитную группу, а А- означает анион,
(i) удаление защитной группы в составе соли формулы VII в присутствии растворителя с образованием соли формулы VIII

где А- означает анион, и
(j) обработка соли формулы VIII кислотой в присутствии растворителя с образованием соли 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она формулы IX

где X- означает анион.
В первом объекте настоящего изобретения предлагается способ получения 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов или их приемлемых сольватов, который включает взаимодействие 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента формулы I или II и основания с образованием 8-замещенного окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она.
5-(α-Галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он характеризуется формулой Х

где R означает защитную группу, а Х означает галоген. Галоген выбирают из брома, хлора, фтора и иода. Предпочтительный галоген означает хлор.
8-Замещенный окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-он характеризуется формулой XI

где R означает защитную группу, а X означает галоген. Галоген выбирают из брома, хлора, фтора и иода. Предпочтительный галоген означает хлор.
Хиральный агент означает соединение формулы I или II, как определено выше.
М означает рутений, родий, иридий, железо, кобальт или никель, предпочтительно рутений.
L предпочтительно означает изопропилметилбензол, бензол, гексаметилбензол или мезитилен, прежде всего изопропилметилбензол. L необязательно связан с полимером. Пригодные полимеры включают полистирол (ПС), сшитый ПС (J), полиэтиленгликоль (ПЭГ) или силикагель (Si). Примеры включают NH-R4, где R4 означает С(O)(СН2)n-ПС или С(O)NH(СН2)n-ПС, и -O-Si(R5)2(СН2)nR6, где n равно 1-7, R5 означает C1-С6алкил, например, этил, а R6 означает полистирол, сшитый полистирол, полиэтиленгликоль или силикагель.
Х означает водород или галоген, предпочтительно галоген, прежде всего хлор.
R1 означает фенил, 2- или 3- или 4-пиридил, 4'-хлор-4-феноксифенил, 4-феноксифенил, 5-диметиламино-1-нафтил, 5-нитро-1-нафтил, 2-, 3-, 4-нитрофенил, 4-винилфенил, 4-бифенилил, 9-антраценил, 2-, 3- или 4-гидроксифенил, толил, фенантрил, бензо[1,3]диоксол, диметил(нафталин-1-ил)амин, моно-, ди- или трис-трифторметилфенил, хризенил, периленил или пиренил.
R1 необязательно связан с полимером. Пригодные полимеры включают полистирол (ПС), сшитый ПС (J), полиэтиленгликоль (ПЭГ) или силикагель (Si). Примеры включают NH-R4, где R4 означает С(O)(СН2)n-ПС или C(O)NH(CH2)n-ПС, и -O-Si(R5)2(CH2)nR6, где n равно 1-7, R5 означает C1-С6алкил, например, этил, a R6 означает полистирол, сшитый полистирол, полиэтиленгликоль или силикагель.
R2 и R3 оба предпочтительно означают фенил.
Хиральные агенты формулы I и их применение в асимметричных реакциях переноса водорода между спиртами или муравьиной кислотой и кетонами описаны в работе K.Haack и др., Agnew. Chem. Int. Ed. Engl. т.36, №3, cc.285-288 (1997), которая включена в настоящее описание в качестве ссылки.
Хиральный агент формулы I взаимодействует с основанием, таким как гидроксид калия или триэтиламин, в растворителе, таком как CH2Cl2, метанол, диметилформамид или диметилацетамид, или смесь метанола и диметилформамида, или смесь метанола и диметилацетамида, и в результате элиминирования галогенводорода образуется соединение формулы XIII

где M, L, R1, R2 и R3 имеют значения, указанные выше. Соединение формулы XIII взаимодействует с восстанавливающим агентом с образованием соединения формулы I, где Х означает водород.
Способ по настоящему изобретению предпочтительно проводят при добавлении хирального агента формулы I, как определено выше, где Х означает галоген, к смеси 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она и восстанавливающего агента в присутствии основания, такого как гидроксид калия или триэтиламин, в растворителе, таком как смесь метанола и диметилформамида или смесь метанола и диметилацетамида. В присутствии основания происходит превращение хирального агента формулы I, где Х означает галоген, в соединение формулы XIII, которое взаимодействует с восстанавливающим агентом с образованием хирального агента формулы I, где Х означает водород. В другом варианте соединение формулы I, где Х означает галоген, образуется in situ при добавлении димера галогенида металла, такого как [RuCl2(пара-цимен)]2 и хирального лиганда, такого как (1S,2S)-(+)-N-пара-тозил-1,2-дифенилэтилендиамин, каждого в отдельности.
Способ по настоящему изобретению также проводят при добавлении хирального агента формулы II в смесь 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она и восстанавливающего агента в присутствии основания.
Хиральные агенты формулы II включают агенты, которые описаны в статье Puentener и др., Tetrahedron Letters, т.37, №45, сс.8165-8168 (1996), которая также включена в объем настоящего изобретения в качестве ссылки. Хиральный агент формулы II взаимодействует с основанием, таким как гидроксид калия или триэтиламин, в растворителе, таком как CH2Cl2, метанол, диметилформамид или диметилацетамид, или смесь метанола и диметилформамида, или смесь метанола и диметилацетамида, и в результате элиминирования галогенводорода образуется соединение формулы XV

где M, L, R2 и R3 имеют значения, указанные выше. Соединение формулы XV взаимодействует с восстанавливающим агентом с образованием соединения формулы II, где Х означает водород.
Способ по настоящему изобретению проводят при добавлении предварительно приготовленного хирального агента формулы II в смесь 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она и восстанавливающего агента в присутствии основания. Например, хиральный агент формулы II, где Х означает галоген, добавляют в смесь 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она и восстанавливающего агента в присутствии основания и раствора гидроксида калия в растворителе. В присутствии основания происходит превращение хирального агента формулы II, где Х означает галоген, в соединение формулы XV, которое взаимодействует с восстанавливающим агентом с образованием хирального агента формулы I, где Х означает водород. В другом варианте соединение формулы II, где Х означает галоген, образуется in situ при добавлении димера галогенида металла и хирального лиганда, каждого в отдельности.
Хиральный агент предпочтительно означает предварительно полученное соединение формулы I, прежде всего соединение формулы XVI.

где Х означает водород или галоген. Хиральный агент предпочтительно означает RuCl[1S,2S]-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен).
В другом варианте хиральный агент означает соединение формулы I, где Х означает галоген, которое образуется in situ при добавлении димера галогенида металла и хирального лиганда, каждого в отдельности. Например, RuCl[(1S,2S)-пара-TsN-СН(С6Н5)СН(С6Н5)-NH2](η6-пара-цимен) образуется при взаимодействии димера RuCl2, [Ru(η6 -пара-цимен)Cl2]2, с хиральным лигандом, S,S-TsDPEN ((1S,2S)-пара-TsNH-CH(C6H5)CH(C6H5)-NH2) in situ, при этом получают RuCl[(1S,2S)-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен) формулы XVII

по методике, описанной в работе K.Haack и др., Agnew. Chem. Int. Ed. Engl. т.36, №3, сс.285-288 (1997).
Пригодные восстанавливающие агенты включают муравьиную кислоту, первичные спирты и вторичные спирты. Предпочтительные восстанавливающие агенты включают муравьиную кислоту, 2-пропанол и 3-пентанол.
Если хиральный агент означает агент на основе рутения, то восстанавливающий агент предпочтительно означает 2-пропанол, 3-пентанол или муравьиную кислоту. Более предпочтительно муравьиную кислоту используют в присутствии амина, наиболее предпочтительно третичного амина, такого как триэтиламин, трибутиламин, 2,2,6,6-тетраметилпиперидин, 1,2,2,6,6-пентаметилпиперидин и N,N-диизопропилэтиламин. Восстанавливающий агент также используют в качестве растворителя, прежде всего используют 2-пропанол и наиболее предпочтительно муравьиную кислоту.
Количество хирального агента находится предпочтительно в интервале от приблизительно 0,1 до приблизительно 10 мол.%, прежде всего от приблизительно 0,8 до 1 мол.%, в расчете на количество соединения формулы X.
Реакцию проводят в присутствии основания. Температуру поддерживают в интервале предпочтительно от приблизительно -10°С до приблизительно 80°С, но прежде всего от приблизительно 0°С до приблизительно 50°С.
Если в качестве восстанавливающего агента используют муравьиную кислоту, то в качестве основания предпочтительно используют третичный амин, например, триэтиламин. Триэтиламин используют предпочтительно в молярном избытке по отношению к муравьиной кислоте, так как при этом указанная реакция значительно ускоряется, что позволяет проводить реакцию при более низкой температуре, например, от приблизительно 25°С до приблизительно 50°С, предпочтительно приблизительно при 30°С. При этом улучшается также энантиоселективность, т.е. в основном образуется R-изомер соединения формулы Х и незначительное количество S-изомера указанного соединения. Молярное соотношение триэтиламина к муравьиной кислоте составляет от 1:1 до 2:5, прежде всего приблизительно 1:2. Если в качестве восстанавливающего агента используют спирт, то в качестве основания используют предпочтительно гидроксид калия или гидроксид натрия.
Данную реакцию проводят предпочтительно в присутствии растворителя. В качестве растворителя предпочтительно используют алкилацетат, например, С1-С6алкилацетат, такой как этилацетат, изопропилацетат или бутилацетат, (низш.)алкиловый спирт, например, С1-С6алкиловый спирт, такой как метанол, этанол, пропанол, изопропанол, бутанол или пентанол, алифатический С1-С12углеводород, такой как изооктан, гептан, диметилформамид, диметилацетамид, ароматический углеводород, такой как толуол или бензол, ацетонитрил, гетероцикл, такой как тетрагидрофуран, диалкиловый эфир, такой как диизопропиловый эфир, 2-метоксиэтиловый эфир или диэтиловый эфир, водный растворитель, такой как вода, ионная жидкость или хлорированный растворитель, такой как хлористый метилен. Используют также комбинации растворителей. Если хиральный агент означает агент на основе рутения, в качестве растворителя предпочтительно используют метанол, хлористый метилен, диметилформамид или диметилацетамид. Прежде всего предпочтительными являются комбинация метанола и диметилформамида или комбинация метанола и диметилацетамида, например, 90 объемов метанола и 10 объемов диметилформамида/диметилацетамида.
5-(α-Галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он предпочтительно взаимодействует с муравьиной кислотой в присутствии хирального агента на основе рутения и третичного амина с образованием 8-замещенного окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она. 8-Замещенный окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-он формулы XI предпочтительно означает 8-фенилметокси-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он.
8-Замещенный окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-он необязательно очищают любым методом, известным специалисту в данной области, например, кристаллизацией, и необязательно в присутствии угля.
Как указано выше, 8-замещенные окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-оны, полученные из 5-(α-галогенацетил)-8-замещенных окси-(1Н)-хинолин-2-онов согласно первому объекту по настоящему изобретению, используют для получения солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она. Во втором объекте настоящего изобретения 5-(α-галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он взаимодействует с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-замещенного окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она (стадия 1) и затем его превращают в соль 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она (стадии 2-7).
Стадию (1) проводят, как описано выше согласно первому объекту по настоящему изобретению.
На стадии (2) 8-замещенный окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-он, полученный на стадии 1, превращают в 8-замещенный окси-5-(R)-оксиранил-(1Н)-хинолин-2-он.
В предпочтительном варианте осуществления настоящего изобретения 5-(α-галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он взаимодействует с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-замещенного окси-5-(R)-оксиранил-(1Н)-хинолин-2-она в одну стадию, т.е. стадии (1) и (2) объединяют. В качестве основания предпочтительно используют трет-бутоксид калия, гидроксид калия или изопропоксид калия.
В другом варианте хиральный агент получают in situ, например, при добавлении [Ru(η6-пара-цимен)Cl2]2 в смеси с хиральным лигандом, таким как S,S-TsDPEN ((1S,2S)-пара-TsNH-СН(С6Н5)СН(С6Н5)-NH2), при этом получают RuCl[(1S,2S)-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен), который превращают при добавлении основания, такого как гидроксид калия или триэтиламин, в RuH[(1S,2S)-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен).
В качестве основания на стадии (2) предпочтительно используют этоксид, гидроксид натрия, фосфат калия, карбонат калия, гидрокарбонат калия или карбонат цезия, прежде всего карбонат калия. Используют также комбинации оснований.
В качестве растворителя на стадии (2) предпочтительно используют алкилацетат, например, С1-С6алкилацетат, такой как этилацетат, изопропилацетат или бутилацетат, (низш.)алкиловый спирт, например, C1-С6алкиловый спирт, такой как метанол, этанол, пропанол, изопропанол, бутанол или пентанол, алифатический С1-С12углеводород, такой как изооктан, гептан, диметилформамид, ароматический углеводород, такой как толуол или бензол, диалкилкетон, такой как ацетон, этилметилкетон (2-бутанон) или метилизобутилкетон, ацетонитрил, гетероцикл, такой как тетрагидрофуран, диалкиловый эфир, такой как диизопропиловый эфир, 2-метоксиэтиловый эфир или диэтиловый эфир, водный растворитель, такой как вода, ионная жидкость или хлорированный растворитель, такой как хлористый метилен. Используют также комбинации растворителей. В качестве растворителя на стадии (2) предпочтительно используют комбинацию ацетона и воды, прежде всего комбинацию 2-бутанона и воды.
Температуру на стадии (2) поддерживают в интервале предпочтительно от приблизительно 10°С до приблизительно 160°С, более предпочтительно от приблизительно 30°С до приблизительно 90°С, прежде всего от приблизительно 50°С до приблизительно 80°С.
8-Замещенный окси-5-(R)-оксиранил-(1Н)-хинолин-2-он предпочтительно означает 8-фенилметокси-5-(R)-оксиранил-(1Н)-хинолин-2-он.
8-Замещенный окси-5-(R)-оксиранил-(1Н)-хинолин-2-он необязательно очищают любым методом, известным специалисту в данной области, например, кристаллизацией. Прежде всего предпочтительной является кристаллизация из толуола или ацетона, необязательно в присутствии угля.
На стадии (3) 8-замещенный окси-5-(R)-оксиранил-(1Н)-хинолин-2-он формулы III

где R означает защитную группу, взаимодействует с 2-амино(5,6-диэтил)инданом с образованием реакционной смеси, которая содержит соединения формул IV, V и VI



где R означает защитную группу.
Предпочтительные защитные группы означают группы для защиты фенольной группы, известные специалистам в данной области. Более предпочтительно защитные группы выбирают из группы, включающей алкил, арил, алкокси, алкенил, циклоалкил, бензоциклоалкил, циклоалкилалкил, аралкил, гетероциклил, гетероаралкил, галогеналкил и замещенную силильную группу. Наиболее предпочтительная защитная группа означает бензил- или трет-бутилдиметилсилил.
Стадию (3) предпочтительно проводят в присутствии растворителя. Предпочтительные растворители включают: спирты, например, C1-С6алкиловые спирты, такие как метанол, этанол, пропанол, бутанол и пентанол, алифатические С6-С12углеводороды, такие как изооктан, гептан, диметилформамид, диметилацетамид, ароматические углеводороды, такие как толуол и бензол, ацетонитрил, гетероциклы, такие как тетрагидрофуран, диалкиловые эфиры, такие как диизопропиловый эфир, 2-метоксиэтиловый эфир и диэтиловый эфир, диметилсульфоксид, 1,1-диоксид тетрагидротиофена, известный так же как тетраметиленсульфон или тетраметиленсульфолан, диалкилкарбонат, например, диметилкарбонат и диэтилкарбонат, водные растворители, такие как вода, ионные жидкости и хлорированные растворители, такие как хлористый метилен. Используют также комбинации растворителей. В качестве растворителя более предпочтительно используют 2-метоксиэтиловый эфир или бутанол.
Температуру на стадии (3) поддерживают в интервале предпочтительно от приблизительно 10°С до приблизительно 160°С, более предпочтительно от приблизительно 30°С до приблизительно 120°С, и наиболее предпочтительно от приблизительно 90°С до приблизительно 120°С.
Стадию (3) предпочтительно проводят в присутствии молярного избытка 2-амино(5,6-диэтил)индана по отношению к 8-замещенному окси-5-(R)-оксиранил-(1Н)-хинолин-2-ону. Предпочтительно используют от 1,05 мол. экв. до 3 мол. экв. 2-амино(5,6-диэтил)индана по отношению к 8-замещенному окси-5-(R)-оксиранил-(1Н)-хинолин-2-ону, наиболее предпочтительно от 1,1 мол. экв. до 1,5 мол. экв. 2-амино(5,6-диэтил)индана по отношению к 8-замещенному окси-5-(R)-оксиранил-(1Н)-хинолин-2-ону.
8-Замещенный окси-5-(R)-оксиранил-(1Н)-хинолин-2-он предпочтительно означает 8-фенилметокси-5-(R)-оксиранил-(1Н)-хинолин-2-он. 5-[(R)-2-(5,6-Диэтилиндан-2-иламино)-1-гидроксиэтил]-8-замещенный окси-(1Н)-хинолин-2-он предпочтительно означает 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-фенилметокси-(1Н)-хинолин-2-он.
На стадии (4) реакционную смесь, полученную на стадии (3), обрабатывают кислотой в присутствии растворителя с образованием соответствующей соли.
В качестве растворителей на стадии (4) предпочтительно используют спирты, например, C1-С6алкиловые спирты, такие как метанол, этанол, пропанол, бутанол и пентанол; алифатические С6-С12углеводороды, например, изооктан, гептан, диметилформамид, диметилацетамид, ароматические углеводороды, такие как толуол и бензол, ацетонитрил, гетероциклы, такие как тетрагидрофуран, диалкиловые эфиры, например, диизопропиловый эфир, 2-метоксиэтиловый эфир и диэтиловый эфир, диметилсульфоксид, 1,1-диоксид тетрагидротиофена, известный так же как тетраметиленсульфон или тетраметиленсульфолан, диалкилкарбонат, например, диметилкарбонат и диэтилкарбонат, водные растворители, такие как вода, ионные жидкости и хлорированные растворители, такие как хлористый метилен. Используют также комбинации растворителей. В качестве растворителя более предпочтительно используют этанол.
Температуру на стадии (4) поддерживают в интервале предпочтительно от приблизительно -10°С до приблизительно 160°С, более предпочтительно от приблизительно 0°С до приблизительно 120°С, и наиболее предпочтительно от приблизительно 0°С до приблизительно 75°С.
На стадии (5) соль формулы VII

выделяют и кристаллизуют, причем R означает защитную группу, а А-означает анион. Анион соответствует кислоте, использованной на стадии (4). В качестве указанной кислоты предпочтительно используют карбоновую кислоту, такую как бензойная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота или винная кислота, или неорганическую кислоту, такую как хлористоводородная кислота. В качестве кислоты на стадии (4) наиболее предпочтительно используют бензойную кислоту.
Соль формулы VII означает предпочтительно соль бензойной кислоты формулы XIX
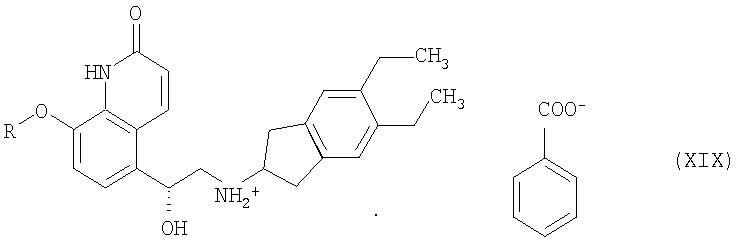
где R означает защитную группу.
В качестве соли бензойной кислоты формулы XIX более предпочтительно используют соль бензойной кислоты формулы XX

На стадии (6) в составе соли формулы VII удаляют защитную группу в присутствии растворителя с образованием соли формулы VIII

где А- означает анион.
Соль формулы VIII предпочтительно означает соль бензойной кислоты формулы XXI

Способы удаления защитной группы известны специалистам в данной области и зависят от типа защитной группы. В одном варианте, если защитная группа означает бензил, предпочтительный способ удаления бензильной группы в составе соли формулы VII заключается в обработке соли водородом в присутствии катализатора. Предпочтительные катализаторы включают палладий, гидроксид палладия, палладий на активированном угле, палладий на оксиде алюминия, порошкообразный палладий на угле, платину, платину на активированном угле и никель Ренея. Используют также комбинацию катализаторов. Наиболее предпочтительным катализатором является палладий на активированном угле.
В другом варианте, если защитная группа означает трет-бутилдиметилсилил, предпочтительный способ удаления трет-бутилдиметилсилильной группы в составе соли формулы VII заключается в обработке соли фторидом трет-бутиламмония или фторидом калия.
Предпочтительные растворители, используемые на стадии (6), включают: алкилацетат, например, C1-С6алкилацетат, такой как этилацетат, изопропилацетат и бутилацетат, (низш.)алкилалкиламины, например, C1-С6алкиламин, спирты, например, C1-С6алкиловые спирты, такие как метанол, этанол, пропанол, бутанол и пентанол, алифатические С6-С12углеводороды, например, изооктан, гептан, диметилформамид, диметилацетамид, ароматические углеводороды, такие как толуол и бензол, ацетонитрил, гетероциклы, такие как тетрагидрофуран, диалкиловые эфиры, например, диизопропиловый эфир, 2-метоксиэтиловый эфир и диэтиловый эфир, кислоту, например, уксусную кислоту, трифторуксусную кислоту и пропионовую кислоту, водные растворители, такие как вода, ионные жидкости и хлорированные растворители, такие как хлористый метилен. Используют также комбинации растворителей. Более предпочтительный растворитель включает уксусную кислоту или 2-пропанол.
Температуру на стадии (6) поддерживают в интервале предпочтительно от приблизительно 0°С до приблизительно 70°С, более предпочтительно от приблизительно 10°С до приблизительно 50°С, и наиболее предпочтительно от приблизительно 10°С до приблизительно 30°С.
Солью формулы VIII предпочтительно является бензоат 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она.
На стадии (7) соль формулы VIII обрабатывают кислотой в присутствии растворителя с образованием соли формулы IX

где X- означает анион. Анион соответствует кислоте, использованной на стадии (7). Указанной кислотой предпочтительно является карбоновая кислота, такая как бензойная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота или винная кислота. На стадии (7) наиболее предпочтительно используют малеиновую кислоту.
Солью формулы IX предпочтительно является малеат 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она формулы XXII.

Предпочтительные растворители, используемые на стадии (7), включают: алкилацетат, например, C1-С6алкилацетаты, такие как этилацетат, изопропилацетат и бутилацетат, спирты, например, C1-С6алкиловые спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол и пентанол, диметилформамид, диметилацетамид, ароматические углеводороды, такие как толуол и бензол, диалкилкетоны, например, ацетон и метилизобутилкетон, ацетонитрил, гетероциклы, такие как тетрагидрофуран, диалкиловые эфиры, например, диизопропиловый эфир, 2-метоксиэтиловый эфир и диэтиловый эфир, кислоту, например, уксусную кислоту и пропионовую кислоту, водные растворители, такие как вода, ионные жидкости и хлорированные растворители, такие как хлористый метилен. Используют также комбинации растворителей. Более предпочтительным растворителем является этанол.
Температуру на стадии (7) поддерживают в интервале предпочтительно от приблизительно 0°С до приблизительно 70°С, более предпочтительно от приблизительно 10°С до приблизительно 60°С, и наиболее предпочтительно от приблизительно 20°С до приблизительно 50°С.
Как указано выше, соли 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она получают из 8-гидрокси-(1Н)-хинолин-2-она или 8-ацетокси-(1Н)-хинолин-2-она. Третий объект настоящего изобретения включает получение 5-(α-галогенацетил)-8-замещенных окси-(1H)-хинолин-2-онов (стадии а-с), их взаимодействие с восстанавливающим агентом в присутствии хирального агента с образованием 8-замещенных окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов (стадия d) и их последующее превращение в соли 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она (стадии e-j).
На стадии (а) 8-гидрокси-(1Н)-хинолин-2-он или 8-ацетокси-(1Н)-хинолин-2-он превращают в 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он. Для указанной стадии существуют три варианта методики, а именно: стадия (а, 1), стадия (а, 2) и стадия (а, 3).
На стадии (а, 1) 8-гидрокси-(1Н)-хинолин-2-он взаимодействует с ацилирующим агентом и кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она.
На стадии (а, 2) 8-гидрокси-(1Н)-хинолин-2-он взаимодействует с ацилирующим агентом с образованием 8-ацетокси-(1Н)-хинолин-2-она, который затем обрабатывают in situ кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она.
На стадии (а, 3) 8-ацетокси-(1Н)-хинолин-2-он взаимодействует с кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она.
8-Гидрокси-(1Н)-хинолин-2-он характеризуется формулой XXIII

5-Ацетил-8-гидрокси-(1H)-хинолин-2-он характеризуется формулой XXIV

На стадии (а) ацилирующий агент, если он используется, означает предпочтительно уксусный ангидрид или ацетилхлорид. Ацилирующий агент присутствует предпочтительно в количестве от приблизительно 1 мол. экв. до приблизительно 1,5 мол. экв., более предпочтительно приблизительно 1,05 мол. экв., в расчете на мол. экв. 8-гидрокси-(1Н)-хинолин-2-она.
Кислоту Льюиса предпочтительно выбирают из следующей группы: трифторид бора (BF3), хлорид алюминия (AlCl3) и тетрахлорид титана (TiCl4). Более предпочтительно кислотой Льюиса является хлорид алюминия. Используют также комбинацию кислот Льюиса.
Кислота Льюиса присутствует в количестве более 2 мол. экв. в расчете на мол. экв. 8-гидрокси-(1Н)-хинолин-2-она или мол. экв. 8-ацетокси-(1Н)-хинолин-2-она. Предпочтительно кислота Льюиса присутствует в количестве от приблизительно 3 мол. экв. до приблизительно 5 мол. экв., более предпочтительно от приблизительно 3,2 мол. экв. до приблизительно 4 мол. экв.
В одном варианте воплощения настоящего изобретения стадию (а) проводят в присутствии растворителя. В другом варианте воплощения настоящего изобретения стадию (а) проводят в отсутствие растворителя и в присутствии ионного соединения. Ионным соединением является ионная жидкость или галогенид щелочного металла.
На стадии (а) предпочтительно используют растворитель, в качестве которого используют растворитель, используемый в условиях реакции Фриделя-Крафтса. Такие растворители хорошо известны и включают хлорбензол, орто-дихлорбензол,1,2-этилендихлорид, алифатические С6-С12углеводороды, например, изооктан, гептан и их комбинации. Используют также комбинации растворителей. Предпочтительный растворитель на стадии (а) включает орто-дихлорбензол.
Стадию (а) проводят в отсутствие растворителя и в присутствии ионного соединения, выбранного из галогенида щелочного металла и ионной жидкости. Галогенид щелочного металла предпочтительно выбирают из группы, включающей хлорид натрия, бромид натрия, хлорид лития и бромид лития, более предпочтительный галогенид щелочного металла включает хлорид натрия. Используют также комбинации галогенидов щелочного металла.
Ионные жидкости содержат положительно заряженные катионы и отрицательно заряженные анионы. Как правило, любая расплавленная соль или смесь расплавленных солей называется ионной жидкостью. Ионные жидкости характеризуются чрезвычайно низким давлением насыщенного пара, высокими характеристиками теплообмена, являются стабильными в широком диапазоне температур и растворяют множество материалов при высокой концентрации. Термин «чрезвычайно низкое давление насыщенного пара», использованный в данном контексте, означает, что давление насыщенного пара ионной жидкости составляет менее приблизительно 1 мм рт.ст. при 25°С, предпочтительно менее приблизительно 0,1 мм рт.ст. при 25°С.
Существует множество типов ионной жидкости, но предпочтительной ионной жидкостью называется жидкость с относительно низкой температурой плавления. Предпочтительно tпл ионной жидкости составляет менее 250°С, более предпочтительно менее 100°С. Наиболее предпочтительно tпл ионной жидкости составляет менее 30°С, т.е. соли являются жидкостью при комнатной температуре. Вязкость ионной жидкости составляет предпочтительно менее 500 сП, более предпочтительно менее 300 сП, и наиболее предпочтительно менее 100 сП при 25°С.
В ионной жидкости присутствуют катионы одного типа или множества различных типов. Если не указано иное, термин «катион» означает оба указанных варианта. Катионы ионной жидкости включают органические и неорганические катионы. Примеры катионов включают четвертичные азотсодержащие катионы, катионы фосфония и катионы сульфония.
Четвертичные азотсодержащие катионы, без ограничения перечисленным, прежде всего включают циклические, алифатические и ароматические четвертичные азотсодержащие катионы. Предпочтительные четвертичные азотсодержащие катионы включают н-алкилпиридиний, диалкилимидазолий или алкиламмоний формулы R'4-XNHX, где х равно 0-3, а каждый R' независимо означает алкильную группу, содержащую 1-18 атомов углерода. Несимметричные катионы обладают более низкой температурой плавления. Катионы фосфония, без ограничения перечисленным, прежде всего включают циклические, алифатические и ароматические катионы фосфония. Предпочтительные катионы фосфония включают катионы формулы R''4-XPHX, где х равно 0-3, а каждый R'' означает алкильную или арильную группу, такую как алкильная группа, содержащая 1-18 атомов углерода, или фенильную группу. Катионы сульфония, без ограничения перечисленным, прежде всего включают циклические, алифатические и ароматические катионы сульфония. Предпочтительные катионы сульфония включают катионы формулы R'''3-XSHX, где х равно 0-2, а каждый R''' означает алкильную или арильную группу, такую как алкильная группа, содержащая 1-18 атомов углерода, или фенильную группу. Катионы предпочтительно включают 1-гексилпиридиний, аммоний, имидазолий, 1-этил-3-метилимидазолий, 1-бутил-3-метилимидазолий, фосфоний и N-бутилпиридиний.
Анионы ионной жидкости, без ограничения перечисленным, прежде всего включают органические и неорганические анионы. Обычно анионы получают из кислоты, прежде всего из кислоты Льюиса. Анионы обычно присутствуют в составе галогенидов металлов, как подробно описано ниже, фторидов бора или фосфора, алкилсульфонатов, включая фторированные алкилсульфонаты, такие как нонафторбутансульфонат, и анионы карбоновой кислоты, такие как трифторацетат и гептафторбутаноат.Анион предпочтительно означает Cl-, Br-, NO2-, NO3-, AlCl4-, BF4-, PF6-, CF3COO-, CF3SO3-, (CF3SO2)2N-, ОАс-, CuCl3-, GaBr4-, GaCL4- и SbF6-.
Примеры ионных жидкостей включают, без ограничения перечисленным, соли имидазолия, соли пиридиния, соли аммония, соли фосфония и соли сульфония. Предпочтительные соли имидазолия характеризуются формулой XXV

где Ra и Rb независимо выбирают из группы, включающей С1-С18алифатическую группу и С4-С18ароматическую группу, а А- означает анион. Предпочтительные соли аммония характеризуются формулой XXVI

где Rc, Rd, Re и Rf независимо выбирают из группы, включающей С1-С18алифатическую группу и С4-С18ароматическую группу, а А- означает анион.
Предпочтительные Rc, Rd, Re и Rf независимо выбирают из группы, включающей этил, пропил и бутил.
Предпочтительные соли фосфония характеризуются формулой XXVII
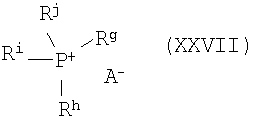
где Rg, Rh, Ri и Rj независимо выбирают из группы, включающей С1-С18алифатическую группу и С4-С18ароматическую группу, а А- означает анион. Предпочтительные Rg, Rh, Ri и Rj независимо выбирают из группы, включающей этил и бутил.
Предпочтительные соли пиридиния характеризуются формулой XXVIII

где Rk независимо выбирают из группы, включающей C1-С18алифатическую группу и С4-С18ароматическую группу, а А- означает анион.
Предпочтительный Rk означает этил или бутил.
Примеры ионных жидкостей включают, без ограничения перечисленным, гексафторфосфат 1-бутил-3-метилимидазолия, гексафторфосфат 1-гексил-3-метилимидазолия, гексафторфосфат 1-октил-3-метилимидазолия, гексафторфосфат 1-децил-3-метилимидазолия, гексафторфосфат 1-додецил-3-метилимидазолия, бис((трифторметил)сульфонил)имидат 1-этил-3-метилимидазолия, бис((трифторметил)сульфонил)амид 1-гексил-3-метилимидазолия, тетрафторборат 1-гексилпиридиния, тетрафторборат 1-октилпиридиния, тетрафторборат 1-бутил-3-метилимидазолия, хлорид 1-метил-3-этилимидазолия, хлорид 1-этил-3-бутилимидазолия, хлорид 1-метил-3-бутилимидазолия, бромид 1-метил-3-бутилимидазолия, хлорид 1-метил-3-пропилимидазолия, хлорид 1-метил-3-гексилимидазолия, хлорид 1-метил-3-октилимидазолия, хлорид 1-метил-3-децилимидазолия, хлорид 1-метил-3-додецилимидазолия, хлорид 1-метил-3-гексадецилимидазолия, хлорид 1-метил-3-октадецилимидазолия, хлорид 1-метил-3-октадецилимидазолия, бромид этилпиридиния, хлорид этилпиридиния, дибромид этиленпиридиния, дихлорид этиленпиридиния, хлорид бутилпиридиния и бромид бензилпиридиния.
Предпочтительные ионные жидкости включают трифторацетат 1-этил-3-метилимидазолия, трифторацетат 1-бутил-3-метилимидазолия, трифторацетат 1-этил-3-метилимидазолия, трифторацетат 1-этил-3-метилимидазолия, гексафторфосфат 1-бутил-3-метилимидазолия, гексафторфосфат 1-октил-3-метилимидазолия, гексафторфосфат 1-гексил-3-метилимидазолия, гексафторфосфат 1-бутил-3-метилимидазолия, тетрафторборат 1-бутил-3-метилимидазолия, тетрафторборат 1-этил-3-метилимидазолия, бромид 1-октил-3-метилимидазолия, трифторсульфонат 1-этил-3-метилимидазолия, трифторсульфонат 1-бутил-3-метилимидазолия, трифторметансульфонат 1-бутил-3-метилимидазолия, трифторметансульфонат 1-этил-3-метилимидазолия и бис-(трифторметансульфонил)имидат 1-этил-3-метилимидазолия. Наиболее предпочтительные ионные жидкости выбирают из группы, включающей трифторсульфонат 1-этил-3-метилимидазолия, хлорид 1-бутил-3-метилимидазолия, гексафторфосфат 1-октил-3-метилимидазолия и гексафторфосфат 1-гексил-3-метилимидазолия. Используют также комбинации ионных жидкостей.
Смеси ионных соединений и кислот Льюиса образуют реакционноспособные жидкости при низкой температуре (см. Wasserscheid и др., Angew. Chem. Int. Ed., т.39, сс.3772-3789 (2000)).
Массовое соотношение кислоты Льюиса и ионного соединения предпочтительно составляет от приблизительно 10 до приблизительно 0,1, соответственно, более предпочтительное массовое соотношение кислоты Льюиса и ионного соединения составляет от приблизительно 3 до приблизительно 1, соответственно.
Температуру на стадии (а) поддерживают в интервале предпочтительно от приблизительно 0°С до приблизительно 160°С, более предпочтительно от приблизительно 10°С до приблизительно 120°С, и наиболее предпочтительно от приблизительно 15°С до приблизительно 110°С.
На стадии (а) 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он можно заменить на 7-ацетил-8-гидрокси-(1Н)-хинолин-2-он формулы XXIX

Неожиданно было установлено, что 7-ацетил-8-гидрокси-(1Н)-хинолин-2-он характеризуется значительно большей растворимостью по сравнению с 5-ацетил-8-гидрокси-(1Н)-хинолин-2-оном. 5-Ацетил-8-гидрокси-(1Н)-хинолин-2-он можно выделять из реакционной смеси и очищать любым методом, хорошо известным специалистам в данной области, таким как кристаллизация или образование суспензии в растворителе. Предпочтительным растворителем для образования суспензии является уксусная кислота.
На второй стадии, стадии (b), 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он, полученный на стадии (a), взаимодействует с соединением формулы R-Q в присутствии основания и растворителя с образованием 5-ацетил-8-замещенного окси-(1Н)-хинолин-2-она, в котором R означает защитную группу, a Q означает уходящую группу.
5-Ацетил-8-замещенный окси-(1Н)-хинолин-2-он характеризуется формулой XXX

где R означает защитную группу.
Защитные группы, описанные в данном контексте, выбирают в зависимости от природы функциональной группы, например, как описано в книге Protective Groups in Organic Synthesis, T.W.Green и P.G.M.Wuts, John Wiley & Sons Inc, третье издание (1999), где также описаны методики, пригодные для удаления защитных групп.
Предпочтительные защитные группы включают защитные группы для фенольных групп, известные специалистам в данной области. Более предпочтительные защитные группы выбирают из группы, включающей алкил, алкенил, арил, (циклоалкил)алкил, арилалкил, циклоалкил и замещенную силильную группу. Алкил и арил содержат 1-24 атома углерода, более предпочтительно 6-12 атомов углерода. Замещенная силильная группа предпочтительно замещена по крайней мере одной алкильной группой. Наиболее предпочтительная защитная группа включает бензил или трет-бутилдиметилсилил.
Предпочтительное соединение формулы R-Q означает галогеналкил или замещенный галогеналкил, такой как α-метилбензилбромид, метилхлорид, бензилхлорид и бензилбромид. Предпочтительные основания включают этоксид натрия, гидроксид натрия, гидроксид калия, фосфат калия, карбонат калия, гидрокарбонат калия, карбонат цезия, пиридин и триалкиламины, такие как триэтиламин, трибутиламин и N,N-диизопропилэтиламин. Используются также комбинации оснований. Предпочтительные основания означают гидроксид калия, карбонат калия и гидрокарбонат калия. Наиболее предпочтительное основание включает N,N-диизопропилэтиламин.
Растворитель на стадии (b) предпочтительно выбирают из группы, включающей алкилацетат, например, С1-С6алкилацетат, такой как этилацетат, изопропилацетат и бутилацетат, (низш.) алкиловые спирты, например, C1-С6алкиловые спирты, такие как метанол, этанол, пропанол, бутанол и пентанол, диметилформамид, диметилацетамид, диалкилкетоны, например, ацетон и метилизобутилкетон, ацетонитрил, гетероциклы, такие как тетрагидрофуран, диалкиловые эфиры, например, диизопропиловый эфир, 2-метоксиэтиловый эфир и диэтиловый эфир, водные растворители, такие как вода, ионные жидкости и хлорированные растворители, такие как хлористый метилен. Используют также комбинации растворителей.
Предпочтительным растворителем на стадии (b) является смесь ацетон/вода. Предпочтительное объемное соотношение ацетона и воды составляет от 10:90 до 90:10, соответственно, более предпочтительно объемное соотношение ацетона и воды составляет от 20:80 до 80:20, соответственно, наиболее предпочтительно объемное соотношение ацетона и воды составляет приблизительно 75:25.
Температуру на стадии (b) поддерживают в интервале предпочтительно от приблизительно 20°С до приблизительно 90°С, более предпочтительно от приблизительно 30°С до приблизительно 80°С, и наиболее предпочтительно от приблизительно 50°С до приблизительно 70°С.
5-Ацетил-8-замещенный окси-(1Н)-хинолин-2-он предпочтительно означает 5-ацетил-8-бензилокси-(1Н)-хинолин-2-он.
5-Ацетил-8-замещенный окси-(1Н)-хинолин-2-он необязательно очищают любым методом, известным специалисту в данной области, например, кристаллизацией.
На третьей стадии (с) 5-ацетил-8-замещенный окси-(1Н)-хинолин-2-он, полученный на стадии (b), взаимодействует с галогенирующим агентом в присутствии растворителя с образованием 5-(α-галогенацетил)-8-замещенного окси-(1Н)-хинолин-2-она.
5-(α-Галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он характеризуется формулой X, как определено выше, где R означает защитную группу, а Х означает галоген.
Галогенирующий агент включает любое соединение или комбинацию соединений, в которой образуется атом галогена in situ. Предпочтительные галогенирующие агенты включают бромат натрия и бромистоводородную кислоту, бром, N-бромсукцинимид, N-хлорсукцинимид, иод, хлор, сульфурилхлорид, бензилтриметиламмонийдихлориодат, хлорид меди, трибромид пиридиния, трибромид тетраалкиламмония, хлористый иодид, хлористоводородную кислоту, и окисляющий агент, такой как оксон, перекись водорода и монопероксифталевую кислоту. Используют также комбинации галогенирующих агентов. Наиболее предпочтительный галогенирующий агент включает дихлориодат бензилтриметиламмония. В объем настоящего изобретения включено также использование смеси сульфурилхлорида и метанола.
Растворитель, использованный на стадии (с), предпочтительно выбирают из группы, включающей кислоту, например, карбоновые кислоты, такие как уксусная кислота, трифторуксусная кислота и пропионовая кислота, алкилацетат, например, C1-С6алкилацетаты, такие как этилацетат, изопропилацетат и бутилацетат, диметилформамид, диметилацетамид, ароматические углеводороды, такие как толуол и бензол, ацетонитрил, гетероциклы, такие как тетрагидрофуран, диалкиловые эфиры, например, диизопропиловый эфир, 2-метоксиэтиловый эфир и диэтиловый эфир, ионные жидкости и хлорированные растворители, такие как хлористый метилен. Используют также комбинации растворителей. Предпочтительный растворитель, использованный на стадии (с), включает уксусную кислоту.
Температуру на стадии (с) поддерживают в интервале предпочтительно от приблизительно 10°С до приблизительно 160°С, более предпочтительно от приблизительно 20°С до приблизительно 120°С, и наиболее предпочтительно от приблизительно 60°С до приблизительно 75°С.
5-(α-Галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он предпочтительно включает 5-(α-хлорацетил)-8-бензилокси-(1Н)-хинолин-2-он.
5-(α-Галогенацетил)-8-замещенный окси-(1Н)-хинолин-2-он необязательно очищают любым методом, известным специалисту в данной области, например, кристаллизацией.
Во втором объекте настоящего изобретения, в котором описана методика получения солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она, 8-замещенный окси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-он превращают в 8-замещенный окси-5-(R)-оксиранил-(1Н)-хинолин-2-он, как описано на стадиях (d) и (е). Указанные стадии соответствуют стадиям (1) и (2) для получения 8-замещенных окси-5-(R)-оксиранил-(1Н)-хинолин-2-онов или их приемлемых сольватов, которые подробно описаны выше.
Стадию (d) проводят согласно первому объекту способа по настоящему изобретению. Стадия также соответствует стадии (1) второго объекта способа по настоящему изобретению.
Стадии (e)-(j) проводят согласно стадиям (2)-(7), как описано во втором объекте настоящего изобретения.
Приведенные ниже примеры представлены для иллюстрации других объектов настоящего изобретения, но не ограничивают его объем.
Примеры
Пример 1
Получение 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она
Хлорид алюминия (93,3 г, 700 ммолей, 3,5 экв.) суспендировали в 1,2-дихлорбензоле (320 мл). Полученную суспензию выдерживали при 20-25°С и 5 порциями (40 мин, максимальная температура смеси 25°С) добавляли 8-гидрокси-(1Н)-хинолин-2-он (32,24 г, 200 ммолей, 1,0 экв.), затем медленно добавляли (30 мин, максимальная температура смеси 20°С) уксусный ангидрид (21,4 г, 210 ммолей, 1,05 экв.) и капельную воронку промывали небольшим количеством 1,2-дихлорбензола. Суспензию перемешивали при 20-25°С в течение 30 мин, затем по данным анализа ЖХВР происходило полное превращение исходного материала в 8-ацетокси-(1Н)-хинолин-2-он. Смесь нагревали до 80°С, при этом верхнюю часть колбы продували азотом. При достижении температуры смеси 40°С наблюдалось выделение HCl. Реакционную смесь перемешивали при температуре 80°С в течение 1 ч, затем по данным анализа ЖХВР происходило практически полное превращение исходного материала в 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он (3,1% промежуточного O-ацетилпроизводного, 10,8% орто-изомера). Горячую реакционную смесь (80°С) выливали в воду (800 мл), в смесь добавляли воду (100 мл) и доводили до кипения, выдерживали при указанной температуре в течение 15 мин и суспензию добавляли в полученную ранее суспензию. Смесь выдерживали при 80°С в течение 15 мин, затем фильтровали в горячем состоянии. Полученный продукт желтого цвета промывали водой (2×200 мл, 50°С), ацетоном (50 мл) и затем сушили в вакууме при 70°С в течение ночи (выход 33,32 г, 82,0%, чистота 95-97%).
Пример 2
Получение и очистка 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она
8-Гидрокси-(1Н)-хинолин-2-он (32,24 г, 200 ммолей, 1,0 экв.) суспендировали в 1,2-дихлорбензоле (300 мл). Полученную суспензию выдерживали при 20-25°С и порциями (30 мин, максимальная температура смеси 25°С) добавляли хлорид алюминия (93,3 г, 700 ммолей, 3,5 экв.), затем медленно добавляли (30 мин, максимальная температура смеси 20°С) уксусный ангидрид (21,4 г, 210 ммолей, 1,05 экв.) и капельную воронку промывали небольшим количеством 1,2-дихлорбензола. Суспензию перемешивали при 20-25°С в течение 30 мин, затем по данным анализа ЖХВР происходило полное превращение исходного материала в 8-ацетокси-(1Н)-хинолин-2-он. Смесь нагревали до температуры 80°С, при этом верхнюю часть колбы продували азотом. При достижении температуры смеси 40°С наблюдалось выделение HCl. Реакционную смесь перемешивали при температуре 80°С в течение 1 ч, затем по данным анализа ЖХВР происходило практически полное превращение исходного материала в 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он (1,8% промежуточного O-ацетилпроизводного, 7,2% орто-изомера). Горячую реакционную смесь нагревали до 90°С и выливали в воду (645 мл), в смесь добавляли воду (100 мл) и доводили до кипения, выдерживали в течение 15 мин и полученную суспензию добавляли в полученную ранее суспензию. Смесь выдерживали при 80°С в течение 15 мин, затем фильтровали в горячем состоянии. Полученный продукт желтого цвета промывали водой (2×200 мл, 50°С). Неочищенный продукт (70,1 г) суспендировали в уксусной кислоте (495 мл) и полученную суспензию нагревали при температуре кипения растворителя в течение 30 мин. Суспензию охлаждали до температуры смеси 20°С и затем фильтровали. Продукт промывали уксусной кислотой/водой (60 мл, 1:1) и водой (5×100 мл), сушили в вакууме при 70°С, при этом получали указанное в заголовке соединение (выход 31,48 г, 75%, чистота 99,9%).
Пример 3
Получение 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она
5-Ацетил-8-гидрокси-(1Н)-хинолин-2-он получали по методике, описанной в примере 1, но при использовании 3 экв. хлорида алюминия вместо 3,5 экв. Выход указанного в заголовке соединения составлял приблизительно 84%.
Пример 4
Получение 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она из 8-ацетокси-(1Н)-хинолин-2-она
8-Ацетокси-(1Н)-хинолин-2-он (6,1 г, 30 ммолей, 1,0 экв.) суспендировали в 1,2-дихлорбензоле (80 мл). Полученную суспензию нагревали до 80°С и порциями добавляли хлорид алюминия (12,0 г, 90 ммолей, 3,0 экв.). Реакционную смесь перемешивали при температуре 80°С в течение 1 ч, затем по данным анализа ЖХВР происходило практически полное превращение исходного материала в 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он. Горячую реакционную смесь (80°С) выливали в воду (100 мл). В колбу добавляли воду (30 мл) и доводили до кипения, выдерживали в течение 15 мин при указанной температуре и полученную ранее суспензию добавляли в колбу. Смесь выдерживали при 80°С в течение 15 мин, затем фильтровали в горячем состоянии. Полученный продукт желтого цвета промывали водой (2×50 мл, 50°С) и затем сушили в вакууме при 80°С в течение ночи (выход 4,32 г, 79,0%, чистота 95%).
Пример 5
Получение 5-ацетил-8-бензилокси-(1Н)-хинолин-2-она
Неочищенный 5-ацетил-8-гидрокси-(1Н)-хинолин-2-он (8,13 г, 40 ммолей, 1,0 экв.) добавляли в N,N-диизопропилэтиламин (6,46 г, 50 ммолей, 1,25 экв.) и ацетон (64 мл). Суспензию нагревали до температуры кипения растворителя и добавляли воду (8,2 мл). Затем по каплям добавляли бензилбромид (7,52 г, 44 ммоля, 1,10 экв.) и реакционную смесь выдерживали при температуре кипения растворителя в течение 6-7 ч до полного превращения исходного материала, затем добавляли воду (20 мл) при температуре смеси 58°С и смесь охлаждали до 20-25°С. Полученный продукт отфильтровывали, промывали ацетоном/водой (1:1, 2×8,5 мл), а затем водой (4×8 мл). Неочищенный продукт сушили в вакууме при 60°С в течение ночи (выход 10,77 г, 91,7%, чистота неочищенного продукта 99,5%). Продукт перекристаллизовывали из ацетона/воды.
Пример 6
Получение 5-(α-хлорацетил)-8-(фенилметокси)-(1Н)-хинолин-2-она
В четырехгорлую колбу объемом 3 л, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, в атмосфере азота добавляли 8-(фенилметокси)-5-ацетил-(1Н)-хинолин-2-он (40 г) и уксусную кислоту (400 мл). В полученный раствор желтого цвета добавляли бензилтриметиламмонийдихлориодат (94,93 г) и уксусную кислоту (200 мл). Полученную суспензию при перемешивании нагревали до температуры смеси 65-70°С. Смесь перемешивали при указанной температуре до полного превращения исходного материала в 5-хлорацетил-8-фенилметокси-(1Н)-хинолин-2-он. Затем смесь охлаждали до температуры 40-45°С, через 30-60 мин добвляли воду (400 мл). Полученную суспензию перемешивали при 20-25°С в течение 30-60 мин, а затем при температуре от 15 до 20°С в течение 30-60 мин добавляли 5% (об./об.) раствор NaHSO3 в воде (300 г). Завершение реакции определяли по отсутствию в смеси свободного иода (отрицательная реакция на иод). Неочищенный 5-(α-хлорацетил)-8-(фенилметокси)-(1Н)-хинолин-2-он отделяли фильтрованием и очищали кристаллизацией из уксусной кислоты, сушили в вакуум-сушильном шкафу при 50°С, при этом получали чистый 5-(α-хлорацетил)-8-(фенилметокси)-(1Н)-хинолин-2-он (39,3 г).
Пример 7
Получение 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-она
В трехгорлой колбе (1S,2S)-(+)-N-пара-тозил-1,2-дифенилэтилендиамин (11 мг) и [RuCl2(пара-цимен)]2 (9 мг) растворяли в метаноле/диметилформамиде (10 мл, 95:5, об./об.). В полученный раствор оранжевого цвета добавляли триэтиламин (9 мкл) и смесь нагревали при температуре кипения растворителя в течение 1 ч 30 мин. После охлаждения до 30°С добавляли 8-бензилокси-5-(2-хлорацетил)-1Н-хинолин-2-он (1 г) и метанол/диметилформамид (10 мл, 95:5, об./об.), затем добавляли смесь муравьиной кислоты (0,69 мл) и триэтиламина (5,1 мл). Полученную суспензию перемешивали до полного превращения исходного материала в 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он. Затем реакционную смесь концентрировали на роторном испарителе, остаток растворяли в тетрагидрофуране/метаноле (2,5 мл, 9:1) и продукт отделяли при добавлении 0,5н. HCl (7,2 мл), сушили в вакуум-сушильном шкафу в течение ночи, при этом получали 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он (993 мг).
В другом варианте в трехгорлую колбу в атмосфере азота добавляли 8-(фенилметокси)-5-хлорацетил-(1Н)-хинолин-2-он (5 г), RuCl[(1S,2S)-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен) (97 мг) и смесь метанол/диметилформамид (100 мл, 95:5). Затем при 30-34°С при встряхивании добавляли предварительно приготовленную смесь муравьиной кислоты (4,21 г) и триэтиламина (18,52 г). Реакционную смесь перемешивали при температуре 30°С до полного превращения исходного материала в 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он. Затем реакционную смесь концентрировали на роторном испарителе, остаток растворяли в тетрагидрофуране/метаноле (25 мл, 9:1) и продукт отделяли при добавлении 0,5н. HCl (72 мл), сушили в вакуум-сушильном шкафу в течение ночи, при этом получали 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он (4,76 г).
Еще в одном варианте, в трехгорлую колбу в атмосфере азота добавляли 8-(фенилметокси)-5-хлорацетил-(1Н)-хинолин-2-он (40 г), RuCl[(1S,2S)-napa-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен) (776 мг) и смесь метанол/диметилформамид (800 мл, 9:1). Затем при 10-30°С при встряхивании добавляли предварительно приготовленную смесь муравьиной кислоты (9,2 мл) и триэтиламина (68 мл). Реакционную смесь перемешивали при температуре 30°С до полного превращения исходного материала в 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он. Для удаления остатков муравьиной кислоты добавляли ацетон (180 мл) и температуру смеси повышали до 40°С. Реакционную смесь перемешивали при температуре 40°С до практически полного удаления муравьиной кислоты (<0,01 мас.%). Затем добавляли уксусную кислоту (31,4 мл) и реакционную смесь концентрировали на роторном испарителе до 300 мл, остаток растворяли в тетрагидрофуране (250 мл) и продукт отделяли при добавлении воды (720 мл), сушили в вакуум-сушильном шкафу в течение ночи, при этом получали 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он (37 г).
В другом варианте в трехгорлую колбу в атмосфере азота добавляли 8-(фенилметокси)-5-хлорацетил-(1Н)-хинолин-2-он (10 г), RuCl[(1S,2S)-пара-TsN-CH(C6H5)CH(C6H5)-NH2](η6-пара-цимен) (194,2 мг) и смесь метанол/диметилформамид (200 мл, 9:1). Затем при 10-30°С при встряхивании добавляли предварительно приготовленную смесь муравьиной кислоты (2,3 мл) и триэтиламина (17 мл). Реакционную смесь перемешивали при температуре 30°С до полного превращения исходного материала в 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он. В смесь добавляли ацетон (45 мл) и температуру смеси повышали до 40°С. Реакционную смесь перемешивали при температуре 40°С до практически полного удаления муравьиной кислоты (<0,01 мас.%). Затем добавляли уксусную кислоту (7,9 мл) и реакционную смесь концентрировали на роторном испарителе до 75 мл, остаток растворяли в тетрагидрофуране (62,5 мл) и продукт отделяли добавлением воды (150 мл) и фильтрованием, сушили в вакуум-сушильном шкафу в течение ночи, при этом получали 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он (9,34 г).
Пример 8
Получение 8-(фенилметокси)-5-(R)-оксиранил-(1Н)-хинолин-2-она
В четырехгорлую колбу, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, в атмосфере азота добавляли 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он (15 г), карбонат калия (15,72 г), 2-бутанон (375 мл) и воду (3,75 мл). Полученную смесь при перемешивании нагревали до температуры кипения растворителя. Указанную температуру поддерживали до полного превращения 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-она в 8-фенилметокси-5-(R)-оксиранил-(1Н)-хинолин-2-он. После завершения реакции горячую реакционную смесь фильтровали для удаления неорганических солей. Остаток промывали несколькими порциями 2-бутанона и объединенные маточный раствор и промывные растворы 2-бутанона концентрировали до объема приблизительно 180 мл. В полученную суспензию добавляли толуол (210 мл) и снова нагревали до температуры 70-80°С. 8-(Фенилметокси)-5-(R)-оксиранил-(1Н)-хинолин-2-он отделяли при охлаждении до 0°С, фильтровали и неочищенный продукт кристаллизовали из толуола, сушили при 50°С в течение ночи, при этом получали 8-(фенилметокси)-5-(R)-оксиранил-(1Н)-хинолин-2-он (11 г).
В другом варианте в четырехгорлую колбу, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, добавляли 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-он (50 г), карбонат калия (52,42 г), ацетон (2,5 л) и воду (25 мл). Полученную смесь при перемешивании нагревали до температуры кипения растворителя. Указанную температуру поддерживали до полного превращения 8-(фенилметокси)-5-((R)-2-хлор-1-гидроксиэтил)-(1Н)-хинолин-2-она в 8-(фенилметокси)-5-(R)-оксиранил-(1Н)-хинолин-2-он. После завершения реакции горячую реакционную смесь фильтровали для удаления неорганических солей. Остаток промывали несколькими порциями ацетона и объединенные маточный раствор и промывные растворы ацетона концентрировали до приблизительно 450 мл. В полученную суспензию добавляли гептан (235 мл) и перемешивали при 0-5°С в течение 2-3 ч. Неочищенный продукт отделяли фильтрованием и кристаллизовали из толуола, сушили при 50°С в течение ночи, при этом получали 8-(фенилметокси)-5-(R)-оксиранил-(1Н)-хинолин-2-он (37 г).
Пример 9
Получение бензоата 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-фенилметокси-(1Н)-хинолин-2-она
В четырехгорлую колбу объемом 1 л, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, добавляли 2-амино-5,6-диэтилиндан (30,89 г) и диметиловый эфир диэтиленгликоля (93 мл). В полученный раствор добавляли 8-(фенилметокси)-5-(R)-оксиранил-(1Н)-хинолин-2-он (36,4 г). Полученную суспензию нагревали до температуры 110°С и при указанной температуре перемешивали в течение 15 ч. Полученный раствор коричневого цвета охлаждали до 70°С, добавляли этанол (210 мл) и раствор бензойной кислоты (30,3 г) в этаноле (140 мл). Раствор охлаждали до 45-50°С и вносили затравку для кристаллизации. Суспензию охлаждали до 0-5°С. Неочищенный бензоат 8-фенилметокси-5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-(1Н)-хинолин-2-она отделяли фильтрованием и промывали тремя порциями этанола (150 мл). Влажный осадок отделяли фильтрованием и очищали перекристаллизацией из этанола (1400 мл), при этом получали очищенный бензоат 8-фенилметокси-5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-(1Н)-хинолин-2-она (50,08 г) в виде кристаллического порошка белого цвета.
Пример 10
Получение малеата 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она
В сосуд для гидрирования объемом 1 л добавляли бензоат 8-фенилметокси-5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-1Н-хинолин-2-она (40 г) и уксусную кислоту (400 мл), добавляли палладий на угле (5%, 5,44 г) и реакционную смесь гидрировали в течение 2-8 ч до полного превращения в 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-он. Смесь фильтровали, фильтрат концентрировали при 50-60°С в вакууме (100 мбар) до 70-90 мл. Остаток растворяли в этаноле (400 мл) и нагревали до 50-60°С, добавляли раствор малеиновой кислоты (11,6 г) в этаноле (24 мл) и в полученный прозрачный раствор при температуре смеси 50°С добавляли затравку в виде суспензии 350 мг тонкоизмельченного малеата 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она в изопропаноле (20 мл). Продукт кристаллизовали при медленном охлаждении до 0-5°С, фильтровали и промывали этанолом (50 мл), а затем изопропанолом (25 мл), при этом получали неочищенный малеат 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она (65 г), который очищали кристаллизацией из этанола (1,36 л) и при этом получали очищенный малеат 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она (24,3 г) в виде кристаллического порошка белого цвета.
Пример 11
Получение различных солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-замещенного окси-(1Н)-хинолин-2-она и их характеристика
В четырехгорлую колбу объемом 1 л, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, добавляли 2-амино-5,6-диэтилиндан (30,89 г) и диметиловый эфир диэтиленгликоля. В полученный раствор добавляли 8-фенилметокси-5-(R)-оксиранил-(1Н)-хинолин-2-он (36,4 г). Полученную суспензию нагревали до температуры 110°С и при указанной температуре перемешивали в течение 15 ч. Полученный раствор коричневого цвета охлаждали до 70°С.
Реакцию проводили по указанной ниже схеме:




где R означает Bn.
Состав реакционной смеси определяли методом ЖХВР: 68,7% соединения формулы IV, 7,8% соединения формулы V и 12,4% соединения формулы VI.
Реакционную смесь разделяли на равные порции и каждую порцию отдельно обрабатывали кислотой, которую выбирали из группы, включающей бензойную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту и хлористоводородную кислоту. Результаты приведены в таблице.
Процент содержания определяли в расчете на количество 8-замещенного окси-5-(R)-оксиранил-(1Н)-хинолин-2-она, а чистоту соли определяли методом ЖХВР в расчете на количество соли формулы IV.
Реферат
Изобретение относится к способу получения 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов или их приемлемых сольватов, включающему взаимодействие 5-(α-галогенацетил)-8-фенилметокси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она, причем указанный хиральный агент характеризуется формулой I или II, где М означает Ru, Rh, Ir, Fe, Co или Ni, L означает С6-С24арил или С6-С24арил(С1-С10)алифатический остаток, в любом случае необязательно связанный с полимером, Х означает водород или галоген, R1 означает C1-С10алифатический, С3-С10циклоалифатический, С3-С10циклоалифатический(С1-С10)алифатический, С6-С24арил или С6-С24арил(С1-С10)алифатический остаток или 4-12-членную гетероциклическую группу, которая в каждом случае необязательно связана с полимером, а R2 и R3 означают фенил, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклогексан или циклопентан. Также изобретение относится к способу получения солей 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она, одной из стадий которого является получение 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-онов. Технический результат: разработан новый экономичный и высокоэффективный энантиоселективный способ получения производных хинолина. 3 н. и 7 з.п. ф-лы, 1 табл.
Формула


где M означает Ru, Rh, Ir, Fe, Co или Ni,
L означает С6-С24арил или С6-С24арил(С1-С10)алифатический остаток, в любом случае необязательно связанный с полимером,
Х означает водород или галоген,
R1 означает C1-С10алифатический, С3-С10циклоалифатический, С3-С10циклоалифатический(С1-С10)алифатический, С6-С24арил или С6-С24арил(С1-С10)алифатический остаток или 4-12-членную гетероциклическую группу, которая в каждом случае необязательно связана с полимером, а
R2 и R3 означают фенил,
или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклогексан или циклопентан.
L означает изопропилметилбензол, бензол, гексаметилбензол или мезитилен,
Х означает водород или галоген,
R1 означает фенил, 2- или 3- или 4-пиридил, 4'-хлор-4-феноксифенил, 4-феноксифенил, 5-диметиламино-1-нафтил, 5-нитро-1-нафтил, 2-, 3-, 4-нитрофенил, 4-винилфенил, 4-бифенилил, 9-антраценил, 2-, 3- или 4-гидроксифенил, толил, фенантрил, бензо[1,3]диоксол, диметил(нафталин-1-ил)амин, моно-, ди- или трис-трифторметилфенил, хризенил, периленил или пиранил, и
R2 и R3 оба означают фенил.
(1) взаимодействие 5-(α-галогенацетил)-8-фенилметокси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она, причем хиральный агент характеризуется формулой I или II, как определено в п.1,
(2) обработка 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она основанием в присутствии растворителя с образованием 8-фенилметокси-5-(R)-оксиранил-(1Н)-хинолин-2-она формулы III

где R означает фенильную группу,
(3) взаимодействие 8-фенилметокси-5-оксиранил-(1Н)-((R)-хинолин-2-она формулы III, где R означает фенильную группу, с 2-амино-(5,6-диэтил)инданом с образованием реакционной смеси, содержащей соединения формул IV, V и VI


где R означает фенильную группу,
(4) обработка реакционной смеси, полученной на стадии (3), бензойной кислотой в присутствии растворителя с образованием соответствующей соли,
(5) выделение и кристаллизация соли формулы VII

где R означает фенильную группу, а А- означает бензоат,
(6) удаление фенильной группы в составе соли формулы VII в присутствии растворителя с образованием соли формулы VIII
где А- означает бензоат, и
(7) обработка соли формулы VIII кислотой, выбранной из группы, состоящей из малеиновой кислоты, янтарной кислоты, фумаровой кислоты и винной кислоты, в присутствии растворителя с образованием соли 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она формулы IX

где Х- означает анион, выбранный из группы, состоящей из малеата, сукцината, фумарата и тартрата.
(a) взаимодействие
(1) 8-гидрокси-(1Н)-хинолин-2-она с агитирующим агентом и кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она, или
(2) 8-гидрокси-(1Н)-хинолин-2-она с ацилирующим агентом с образованием 8-ацетокси-(1Н)-хинолин-2-она, и обработка in-situ 8-ацетокси-(1Н)-хинолин-2-она кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она, или
(3) 8-ацетокси-(1Н)-хинолин-2-она с кислотой Льюиса с образованием 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она,
(b) взаимодействие 5-ацетил-8-гидрокси-(1Н)-хинолин-2-она, полученного на стадии (а), с соединением формулы R-Q в присутствии основания и растворителя с образованием 5-ацетил-8-фенилметокси-(1Н)-хинолин-2-она, где R означает защитную группу, a Q означает уходящую группу,
(c) взаимодействие 5-ацетил-8-фенилметокси-(1Н)-хинолин-2-она с галогенирующим агентом в присутствии растворителя с образованием 5-(α-галогенацетил)-8-фенилметокси-(1Н)-хинолин-2-она,
(d) взаимодействие 5-(α-галогенацетил)-8-фенилметокси-(1Н)-хинолин-2-она с восстанавливающим агентом в присутствии хирального агента и основания с образованием 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она, причем указанный хиральный агент характеризуется формулами I или II, как определено в п.1,
(е) обработка 8-фенилметокси-5-((R)-2-галоген-1-гидроксиэтил)-(1Н)-хинолин-2-она основанием в присутствии растворителя с образованием 8-фенилметокси-5-(R)-оксиранил-(1Н)-хинолин-2-она формулы III,

где R означает фенильную группу,
(f) взаимодействие 8-фенилметокси-5-(R)-оксиранил-(1H)-хинолин-2-она формулы III, где R означает фенильную группу, с 2-амино-(5,6-диэтил)инданом с образованием реакционной смеси, содержащей соединения формул IV, V и VI



где R означает фенильную группу,
(g) обработка реакционной смеси, полученной на стадии (f), бензойной кислотой в присутствии растворителя с образованием соответствующей соли,
(h) выделение и кристаллизация соли формулы VII

где R означает фенильную группу, а А- означает бензоат,
(i) удаление фенильной группы в составе соли формулы VII в присутствии растворителя с образованием соли формулы VIII

где А- означает бензоат, и
(j) обработка соли формулы VIII кислотой, выбранной из группы, состоящей из малеиновой кислоты, янтарной кислоты, фумаровой кислоты и винной кислоты, в присутствии растворителя с образованием соли 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-(1Н)-хинолин-2-она формулы IX

где X- означает анион, выбранный из группы, состоящей из малеата, сукцината, фумарата и тартрата.
Документы, цитированные в отчёте о поиске
Хинолиновые карбоксамиды и фармацевтическая композиция на их основе

Комментарии