Способ получения производных бензодиазепина - SU526290A3
Код документа: SU526290A3
Описание
Предлагается способ получения новых производных бензодиазепина. Основанный на реакциях ацилирования аминов, циклиз ции образующихся ациламвдов и перегруп пировки бензодиазецинов в производные бензодиазепина. Предлагаемый способ позволяет получать соединения, которые обладают лучшими Свойствами, чем известные структурные аналоги подобного действия. Предлагается способ получения произв ных бензодиазепина обжей формулы X где TJ. означает водород или низший алкил (прямой, разветвленный или циклический ) ; означает галоген, свободную или этерифицкрованную оксигруппу. нктрильную группу, кар1.;кс1т.11ую rpyr- v илч ээ произвоцноа , тпоалкялькую тл:: Т5 О гн 1Ьную группу, группу .Яд где RJ и; Т одинаковь или разл1.1;ц и означают ацил, дрил, ар;злк1-;л, арллокси- апклл, которые при i-ioo6xo.aiiMocTH иметь дополнительные за 1естита;1и, пгямо;. или разветвленный лкил, isau алкон1:л, причем алкильные оадикалы бь/гь соединены M9/-: ;iy С .бой либо непосредствеяко , либо через гетероатом, котэрг тй в случае азота может содержать дoпoлviптeльный заместитель, кольца .Л п В могут бьпчзамещены иитро-, трнфто 1мет)льнои. ллкильиой , алкоксилыюй группой илп атомом галогепа , или их солей. Предлагаемые соедипекия образуются в результат - анилирэьаЮгя лцампка общей формулы II )- К (В jCHg СН (он) CHoNHg iv;,:- Т Ялэет указанные значения, соот .СТСТЕУ юл1км проЕЮВодным карбоновой кис .. г оакцию проводят в инертном раств .;О обычко В прксутствяи связьшаюшегг: кислоту срс-дства, иааример третичного i:.: iria; т8 :паратура реакции зависит от : .;:лило1;иой V :i :i-L 6;;Lx; ГГ1 .miJ;;f},vi)5ix р8- ;:;то;з. С.;бг:.я; э:1еЁ11Мйся ацилдиамин об.щзй фор- .. Г-ЛЬТ lii fА (Rl)CH2CH(R) нл-юет указо.:1;и;.1с зиачеккя; vaoT окск- vrn ацилокситрупii 3 :эгут быть замэ.щены, . V: к Эи ь , ля соединений общей форму; ,.;:; дэьышсмной температуре ьСТборптеле с использованием ;-.;, фзс(|;ора в производное :л оодцей формулы IV ,-LN ., -xS,. О ;i указанные значения; V, означает атом галогена или ivCv: руплу. ;;.io;;c:--irpyi::i соедмлония общей форм --i- ;арззо2ят в OKCKrpyraiy н затем ос .;яют нерегруппирОБху соединений .)са:ек фэр-лулы IV сопровождающуюся су . цикла, в производное бензодиазеп . ; бтцек формулы I. iipi; использовании зкви- ;олекулярньк ь.о.кччеств реагентов получают амиды общ формулы III j3 которых Т означает оксиriiynriy , тогда как избыток производниго и:рооновой кислоты приводит к образован :- или тркацилпроизводного. 2сл:1 L соединении общей формулы III :..ет оксягруппз то циклизацию осущ , -:;глот г.1эвнь;м образом с помощью POC&j ;-рч Зи-ЮО С в иитробзнзоле. Посколь Kf r;y;ii циклазални происходит одновремен :;.). замещение гидроксилььой группы на .. ;,ч1логена, получают с результате 3 .:,ггзабэнзодиазецины общей формулы IV Ц|)кпр:зацню соединен / оошей фоомулы -:. сушестьпт, ицк более высокой ;.::-:.р;-туг)а { J. 1О-1 ), ис опасаясь ; jL-;:i.,:bx зс;мд 1.й, если .:5ар;Т пьрп за 90 водные общей формулы IV могут быть обычным образом переведены в 3 оксипронзводЗ-Галогенбензодиазецяч обшей формулы IV или его соли подвергают термической обработке или ззаиг.годействию с Щклеофильиыми реагеятаха к -::0рт;.о:.: растворителе. В первом случае г,олучают 2-галогенметилбензодиазепнны общей формулы 1, которые превращают далее в производные общей формулы .1, : амещая галоген. Обработка нуклефильными реагентами позволяет недооредственно получать желаемые производные бензодказепина общей формулы 1. 3-Окнсбензодиазецин общей формулы 4 где г 2 означает окскгруппу, переводят в производные 2-галогеч ;ет:;лбонзод :зз5пина общей формулы I, где Р, означает галоген, путе .: OGpaooiKH кислота;/:. Льюиса в инертном растворителе. Пример 1. 128 г N -..:эт:л- N (2-окси-З-аминопропил)-4 -хлоракилина в 200 мл хлороформа сгу:еи:|;шают с 84 мл триэтнламина и 69,5 мл бензоилхлорида. Через 24 час раствор промывают водой, сухиат, хлороформ отгоняют в вакууме, а сырой продукт перекристаллизовывают из бензола. Получают 142,5 г N -метил- N - N -(2-окси-3-бензоиламинопрог1:);г1.4 -хлоранилина , т.пл. 13в-137 С. П р и мер 2. 59 г fv -метил- N - (2-окси 3-аминопро; ил)---1- хлоранилина в 1 л хлороформа сл ешивают с 85 мл триэтиламина и 70 .ч-л бензоилллорада. i aгревают 4 час и )Гвают, кал ог;кса о s 1. Сырой цpoдy :т ьэрэкристаллизовывают из -зопропилового сг;.ста . По тучаю 61 г N -л;еткл- jv -(2-бензоилокси-3-бзнзоила ;;;; опрэ:5:-л}- -4-;.)оранилина , т.пл. 14Б-148 с. П р и м е р 3. 45,4 г N -метил- М - 2-окси-3- ( 3,4,5 -триметоксибензол ) амкнопропкл анилина в 250 мл пиридина смешивают с 250 л:л уксусного ангидрида . Через 48 час раствор вьтнвают в воду и экстрагируют хлодооформ. Хлород)ормный раствор упаривают в вакууме, остаток кристаллизуют из простого эфира. Получают N -метил- N -{2-ацетокси-3-(3, 4-, 5гриметоксибензокл ) смпнопропкл анилин, т.пл. 90-92 С. Анало)ч-гчно синтезируют следующие соединения: N -метил- N - Г2-окси 3(3 , 4,диметоксибензокл ) амииопр01гил - 3, 4 - диметоксианилип , маслянистый продукт; N - метил- N - 2-окси-3-( 3 , 4- N метил- N Г2 -окси-3-(2- хлор6ензоил )аминопропил -З 4- этилендиоксианилин , т.пл. 105-107 С.
N - метил- N - (2-окси- 3-бензоиламинопропил )-4-метилтиоанилин, т. пл. 141-142 С .,
Ы - метил - N -окси-3 - (2 , 6 -дихлорбензоил)-аминопропщ1} - 4-хлоранилин , маслянистый продукт;
N -метил- N 2-окси-3-(2 , з- дихлорбензоил )-аминопропилЗ-4 -хлоранилин, т.пл. 91-95°С;
N- метил - N - 2-окси-3- (2 метилбензоил ) аминопропил - 4- хлоранилин, т.пл. 108-113°С; - N -метил - N - Г2-ОКСИ- 3-(2-бром бензоил) -аминопропипЗ -4 -хлораннлин, т.пл. 118-123°С
N -метил- N - 2-окси-3-(2 -ни-грсбензоил ) аминопропил -4-хлоранилин, т.пл. 132-133°С;
N -метил -N -(2-окси 3-бепзонламинопропил )- 4 -хлоранилин, т.пл. 121-123t
N р -метоксиэтил- N -(2-окск-З-бензоиламйнопропил ) - 4 - хлоранялкн, т.пл. 120-122 0:
N -метил-N .-3-(з : 4, sтриметоксибеизоил ) аминопропил аыялин, т.пл. 126-128°С;
М -метил- N - (2-окси-З-бензоиламккопропкл )4-фтораНИЛИН, т.пл. 115-118 С;
N -метил - N - (2-окси-3-(2 -фторбензоил ) аминопропил)- 4-хлоранилин. т,пл. lOS-lOT Cj
N -метил- N -(2-окси-З-бензоилами-нопропил ) анилин, т.пл. 100-103°С:
N -(2--ОКСИ-3-бензоиламйнопропил)-4хлоранилин , т.пл. 175-177 С;
N -циклопропилметил-N - {2-окси-3банзоиламинопропил ) -4-хлоранилин, т.лл. 110 112°С;
N -метил- М -(2-ацетокси-З-бензоиламинопропил )-анилин, маслянистый продукт
N -метил- N ацетокси-3-(2 -фторбензоил )-аминопропи/{1-4 -хлоракилин, маслянистый продукт;J
N -метил N - 2-окси-3-(2-хлорбензоил ) аминопропил -4-хлоранилин, т.пл.113-115°С:
J -метнл- N - 2-окси-З - (2-трифтэрметилбензоил ) аминопропил -4 -хлоранилин, т.пл. 107-109°С; ,
N -метил- N Г2-окси-3- (3, 4 - диме токсибензоил) -аминопропил -4-хлора 1цлин, т.пл. 118-121°С;
М -метил- N -окси-3 -(з, 4 дихлорбензоил ) аминопропил -4-хлоранилин, т.пл. 115-.117°С;
N -метил- N -(2-бензоилокси-З-бензоиламинопропил )-анилин, т.пл. 129-130 С;
N -метил- N -оксн-3-( 2, 4 днхлорбензоил )-аминопропил - 4 -.хлоранилин , т.пл. 98-99 С;
N -метил- N -(2-окси-З-бензоиламинопропил ) 4-метиленанилин, т.пл. 115 Cj
М-метил- N -{2-окси-З-бензоиламинопропил )-4-метоксианияин, т.пл. 120 С;
Пример 4. 61 г N -М9ТИЛ- N (2бензоилокси-3-бензоиламинопропил )-4-хлоранилина нагревают с 60 мл оксихлорида фосфора в течение 16 час до 12О С. Реакционную смесь выливают в воду, смешивают с раствором едкого натра до щелочной реакции и экстрагируют хлороформом. Экстракт упаривают и .usKvyA o, а эстаток кристаллизуют ri3 ацетсгта. Получают 8 -хлор1-метил--3-бензонлокси-6-фен;1л - 1,2,3,4тетраг1 дро-1 ,5 бенаодпазецпн. т.пл. 179-хао сП р и е р 5. 5,9 г полученного в примере 4 бэнзэдиазецйна нагревают 20 мин в 200 г. дноксана с 50 MSI 5Vo-ного раствэра едкого натра. Д 1оксан отгонйют в вакуума -: водный растБор экстрагирзтот хлороформол: . Экстракт упарлвают в вакууме, остаток красталл;1зуют пз простого эф1ира. Получают 8-.хлор-1-метил-3-окси-6-фен ш- 1,2, 3, 4-тетрагидро- 1,5-бензодиазедян, т.пл. 169-170°С.
32 г N -метил- N П р к ; е f ( 2-окси-З-бензоиламинопропил) -4-хлоранилина нагревают с 50 мл оксихлорида фосфора в 100 мл нитробензола 22 час при 95 С. Избыток оксихлорида фосфора и нитробензол отгоняют в вакууме, остаток растворяют в хлороформе, обрабатывают ледяной водой и разбавленным растворок; едког-о натра. Хлорофор ;ный раствор упар1шают в вакуума, остаток растворяют в эфире и эфирный раствор смешивают с изопропанольным раствором соляной кислоты. После перекристаплизации из Сл1еси эт 1ловый спирт/ простой эфир получают гидрохлорид 3,8- дихл ор-1 -метилфенил- 1,2,3,4-тетрагидро1 ,5-бензодиазец;1на, т.пл. 195-196 С,
Способом, приведенным в примерах 4-6, синтезируют следующие соединения:
1 -метил-3-апетокси-6-фенил-1,2,3,4тетрагидро-1 ,5-бензодиазецин, маслянистый продукт;
1-метил- З-оксв-6-фенил-1,2,3,4-тетрагидро-1 ,5-бензодиазецин, т.пл. малеината 135-137°С;
1-метил-3-адетокси-6-(3,4,5-триметоксифенил )-1,2,3,4-тетрагидро-1,5-бензодиазецин , т.пл. 191-192°С;
ffi
т. п.
lac
т 2G
;ркда :; 12 час
3 I
:i-:V.- T rnfiT-VV; .J
л ;о;)-:-фор; -,: .};;.-::o ;
. ce-V: 3O 1 -OX.
ь-,..фг.)11и.г: e.3ei;;-;H,
- -; И :-л 3 р 8.. 100 мг гидрохл.орида ),8- ,чДл4го::)--1--меткл-6--фенйл-1,2,3,4-тег- Iivr .C-o-i,6-6анзоди:азец лш Еа.гревают в
( :.л,; лкаеридкна Б течение 24 час. Реак ги:---,; Ki ::::м8сь рьт:тнвают в воду, экстрагн- ,, :;п pOi:cp, и экстракт упаривают в ,в;-:.::: &. Из гсостого эфира кристаллизуют . :, С J -Л №тw ;L-2 пипзpидинoмeтил 5-фeшffl ,, Г -д:1ГК.,:о.;0-.-Л И -Ii4-бензодиазепина, т.ал, }.43-145.
П п я ,;ч/; а р 10. 1 г 7 хлор-1-метил3 о;; ,уС-фя:Цяп--1,2,Э,4-тетрагвдро-1,5оейЗтТй аз1,;дйна Е 50 мл бензола нагрева- .-ог с 1 мл тночйлхлорида в течение 1 час :асгвог с;-лг 5лквают с нескольхнмн каплями 1;з;1ЭГ :л.а -д;1на, промывают водой и упарива- ; :: ; .уумз досрса. Остаток растворяют и кэп}фОлшловом спирте к смепшвают с эфиным растБОром соляной кислоты. Получают
,ОлЛОрУД--7-ХЛОр-1 М8ТШ1 2-ХЛОрМеТИЛ3-фяЕал- 2 ,5-яйГйаро-1 li -1,4-6ензодиазе ..мне j виде двух модификаций, т.пл. 100112С ц 178-180 С, Спектры ядерного .гагЯй/Ног-о резонаиса для обеих модифшш- /;ni; и.ла1гичкы.
.Q р а м 8 р 11. 200 мг гидрохлорида
:3,8 fiиxлol -l-мeтил-6 фeIfflл-l,2,3,4-тeтpaг:шp: is5-бeFзoдиaзeцинa нагревают в течен
1 V,ac Е: ЮС мл тетрахлорэтана. Раство- отгоняют в вакууме и остаток пер .йг.ристэллиаоЕывак т из изопропндового спирте.. Продукт идентичен полученному ПС: примеру 10 гиррохлорЕвду 7-хлор-1мет нл-2 хаорматкл-5 -фенил-2,3-дкгидро- -1 h 1,4-бензодиазенина.
r.TtN-,D6oM описанным в приведенных приT-Rpax получают соединения обшей формулы 1. прг;дставлеш1ые в таблшхе.
7-се
СН,
спирта)
151-152
7-СЕ
Н
СН,
206-209 (дт1Г1 дрохлорид,
NH. содержит 0,5 изопропалового спирта)
11
12
526290
Продолжение таблицы
Заместитель в фенильном кольце





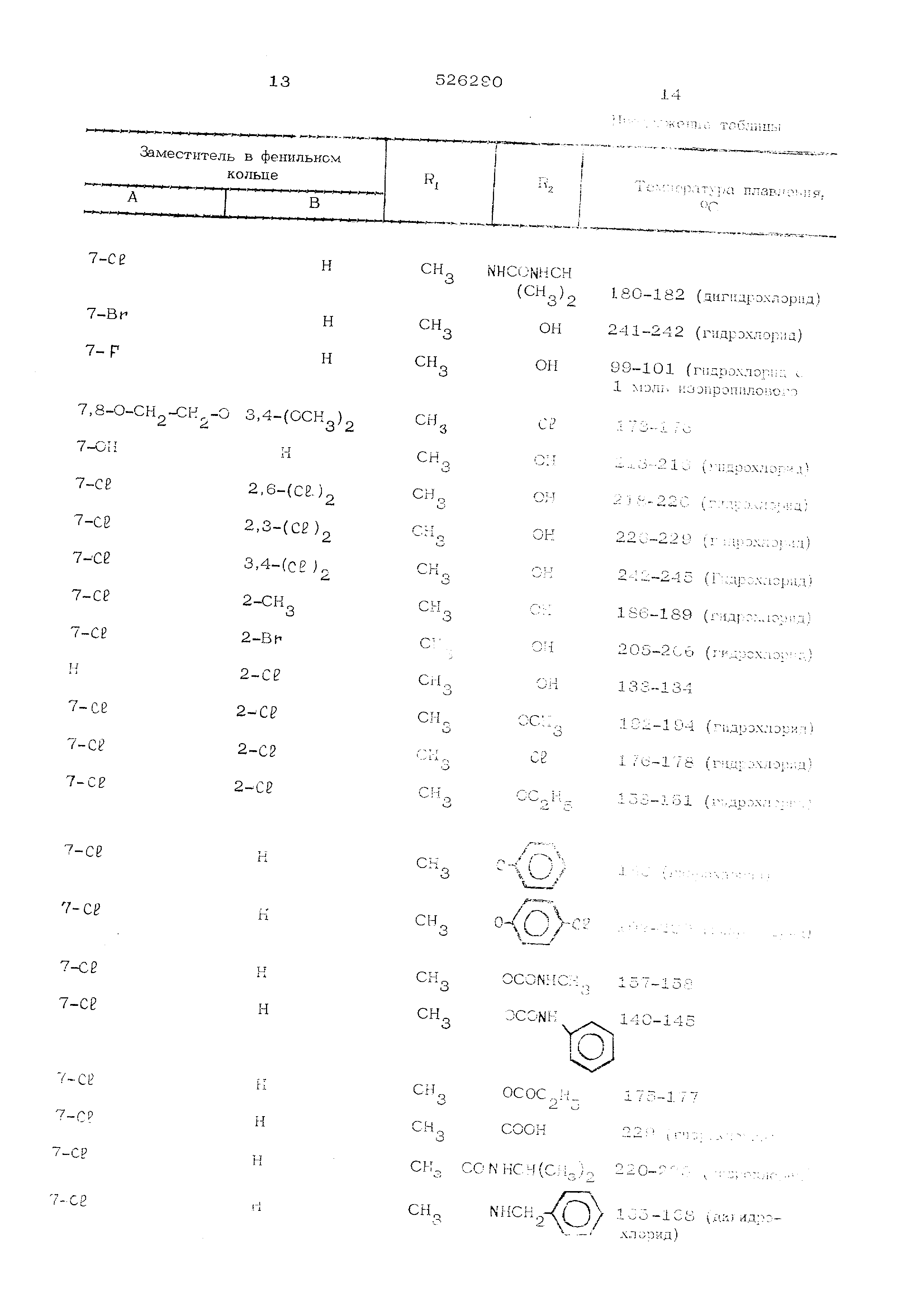


Реферат

Формула


Комментарии