Синтез полимерных конъюгатов индолокарбазольных соединений - RU2532341C2
Код документа: RU2532341C2
Чертежи



Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения полимерных конъюгатов индолокарбазольных соединений, в частности полимерных конъюгатов К-252а и их производных, путем синтеза, который приводит к продукту высокой чистоты и высокому выходу продукта.
В дополнительном замысле настоящее изобретение относится к новым полимерным конъюгатам К-252а и их производным, в которых химическая группа, связывающая полимерное звено с соединением К-252а или с производным соединения К-252а, характеризуется 5-членной оксазолидиндионовой циклической структурой. Эти новые полимерные конъюгаты получают путем синтеза с высокой чистотой и высоким выходом.
Уровень техники
В литературе описан терапевтический потенциал К-252а и его производных для предупреждения, облегчения и лечения патологий, связанных с киназой, в частности патологий, связанных с HMGB1, таких как неврологические нарушения, заболевания нервной системы и нейродегенеративные нарушения центральной и периферической нервной системы (например, из документа РСТ/ЕР2005/008258, Annual Rev. Pharmacol. Toxicol. 2004;44:451-74; Newochem. Int. 2001 Nov-Dec;39(5-6):459-68; Neuroport. 2000 Nov 9;11(16):3453-6; Neuroscience. 1998 Sep; 86(2):461-72; Brains Res. 1994 Jul 4;650(1): 170-4). Кроме того, в уровне техники раскрыта терапевтическая эффективность указанных индолокарбазольных соединений для предупреждения, облегчения и лечения кожной патологии, в особенности кожной патологии, связанной с пролиферацией избыточных кератиноцитов, такой как псориаз (например, из документа WO 2005/014003, Raychaudhuri и др., J. Invest. Dermatol. 122:812-819, 2004). Кроме того, из уровня техники также известно, что К-252а и его производные применяются в качестве активного средства против боли, связанной с NGF (см., например, Koizumi и др., J. Neurosci. 8:715-721, 1988; Doherty и др., Neurosci. Lett. 96:1-6, 1989; Matsuda и др., Neurosci. Lett. 87:11-17, 1988, Winston J.H. и др. J. Pain (2003) 4:329-337). Следовательно, биологическая значимость и терапевтическая активность индолокарбазольного соединения К-252а и его производных хорошо освещена в литературе (см., например, Kim и др., Biol. Pharm. Bull. 21:498-505, 1998, Schneider и др., Org. Lett. 7:1695-1698, 2005).
Полимерные конъюгаты К-252а и их производные, и их применение в качестве активных агентов в фармацевтических композициях, используемых для предупреждения, облегчения и лечения указанных выше патологий, раскрыты в заявке WO 2007/022999. Описание указанной заявки включено в настоящее изобретение как ссылка. Согласно документу WO 2007/022999 целью конъюгирования к полимеру и в особенности пегилирование (присоединение ПЭГа) активных индолокарбазольных производных соединения К-252а является разработка таких форм для введения указанных активных соединений, которые обеспечивают улучшенные фармакокинетические и токсилогические характеристики, чтобы добиться наилучшей биологической доступности К-252а или его производных в различных возможных способах применения.
Описанный в документе WO 2007/022999 синтетический подход для производства полимерных конъюгатов К-252а и его производных включает в себя ковалентное присоединение полимерного фрагмента к индолокарбазольной структуре соединения К-252а или его производных. В частности, в документе WO 2007/022999 описано взаимодействие активированного изоцианатом полимера с гидроксильной группой в положении СЗ тетрагидрофуранового фрагмента в К-252а или его производной в подходящих условиях реакции, в результате образуется карбамидная связь в виде ковалентного соединения между полимерным фрагментом и активным соединением.
Поскольку полимерные конъюгаты К-252а и их производные, имеющие высокую чистоту, весьма востребованы для использования в медицине, целью настоящего изобретения является разработка способа получения полимерных конъюгатов активных индолокарбазольных соединений, который приводит к продукту реакции высокой чистоты, полученному с высоким подходящим выходом. Более того, дополнительной целью изобретения является исключение сложных стадий очистки и обеспечение легкости очистки и извлечения целевых полимерных конъюгированных соединений для того, чтобы довести до максимума эффективность реакции полимерной конъюгации.
Неожиданно авторы изобретения обнаружили, что взаимодействие К-252а или его производного соединения с ω-1-Н-имидазол-карбоксамидным полимерным фрагментом, использованным в качестве исходного полимерного реагента реакции конъюгации, обеспечивает контролируемый процесс конъюгации, таким образом, индолокарбазол-полимерный конъюгат получается с желательным повышенным выходом и высокой чистотой.
Раскрытие изобретения
Поэтому настоящее изобретение относится к способу получения полимерного конъюгата индолокарбазольного соединения формулы (I)
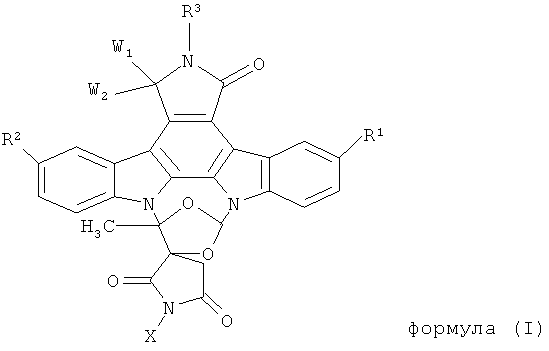
где
R1 и R2 являются одинаковыми или различными остатками, причем каждый независимо выбирают из группы, состоящей из:
(a) водорода, галогена, замещенного или незамещенного низшего алкила, замещенного или незамещенного низшего алкенила, замещенного или незамещенного низшего алкинил, гидрокси-, низшей алкокси-, карбокси-группы, низшего алкоксикарбонила, ацила, нитро, карбамоила, низшего алкиламинокарбонила, группы -NR5R6, в которой каждый R5 и R6независимо выбирают из водорода, замещенного или незамещенного низшего алкила, замещенного или незамещенного низшего алкенила, замещенного или незамещенного низшего алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного аралкила, замещенного или незамещенного низшего алкиламинокарбонила, замещенного или незамещенного низшего ариламинокарбонила, алкоксикарбонила, карбамоила, ацила, или R5 и R6 в сочетании с атомом азота образуют гетероциклическую группу,
(b) -CO(CH2)j R4, где j означает 1-6 и R4 выбирают из группы, состоящей из:
(i) водорода, галогена, -N3,
(ii) группы -NR5R6, где R5 и R6 являются такими, как указано выше,
(iii) группы -SR7, где R7 выбирают из группы, состоящей из водорода, замещенного или незамещенного низшего алкила, замещенного или незамещенного низшего алкенила, замещенного или незамещенного низшего алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного аралкила, группы -(CH2)aCO2R10 (в которой а означает 1 или 2 и где R10выбирают из группы, состоящей из водорода и замещенного или незамещенного низшего алкила) и -(CH2)aCO2NR5R6,
(iv) -OR8, -OCOR8, где R8 выбирают из водорода, замещенного или незамещенного низшего алкила, замещенного или незамещенного низшего алкенила, замещенного или незамещенного низшего алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила
(c) -CH(OH)(CH2)j R4, где j и R4 являются такими, как указано выше;
(d) -(CH2)dCHR11R12 или -(CH2)dCHR11CONR5R6, где d означает 0-5, R11является водородом, группой -CONR5R6 или -CO2R13, где R13 означает водород или замещенный или незамещенный низший алкил и R12 является водородом или замещенным или незамещенным низшим алкилом;
(e) -(CH2)kR14, где k означает 2-6 и R14 представляет собой галоген, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -COOR15, -OR15, (где R15 представляет собой водород, замещенный или незамещенный низший алкил, замещенный или незамещенный низший алкенил, замещенный или незамещенный низший алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или ацил), -SR7 (где R7 является таким, как указано выше), -CONR5R6, -NR5R6(где R5 и R6 являются такими, как указано выше) или группы -N3;
(f) -CH=CH(CH2)mR16, где m означает 0-4, и R16 представляет собой водород, замещенный или незамещенный низший алкил, замещенный или незамещенный низший алкенил, замещенный или незамещенный низший алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -COOR15, -OR15 (где R15является таким, как указано выше) -CONR5R6 или -NR5R6 (где R5 и R6 являются такими, как указано выше);
(g) -CH=C(CO2R12), где R12 является таким, как указано выше;
(h) -C=C(CH2)n R16, где n означает 0-4 и R16 является таким, как указано выше;
(i) -CH2OR22, где R22 представляет собой три(низший)алкилсилил, в котором три группы низшего алкила являются одинаковыми или различными или в котором R22имеет такое же значение, как R8.
(j) -CH(SR23)2 и -CH2-SR7, где R23 представляет собой низший алкил, низший алкенил или низший алкинил и где R7 является таким, как указано выше; и R3 означает водород, галоген, ацил, карбамоил, замещенный или незамещенный низший алкил, замещенный или незамещенный алкенил, замещенный или незамещенный низший алкинил или аминогруппу; и
W1 и W2 независимо означают водород, гидрокси-группу или W1 и W2 вместе представляют собой кислород;
и где Х является полимерным фрагментом,
который включает взаимодействие ω-1H-имидазол-карбоксамидного полимерного соединения общей формулы (II)
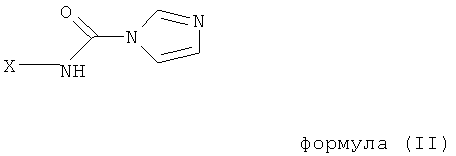
в которой Х имеет указанное выше значение,
с индолокарбазольным соединением общей формулы (III)
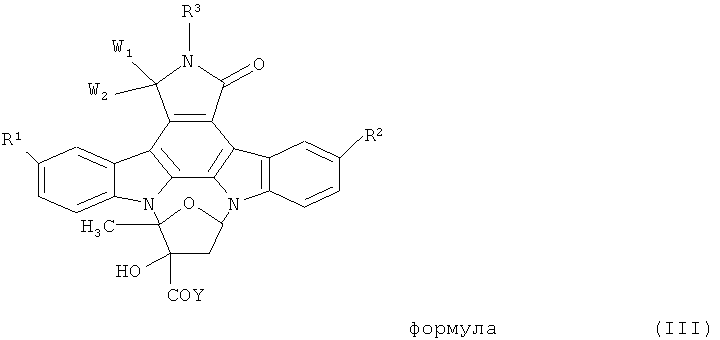
где заместители R1, R2, R3, W1 и W2 имеют указанные выше значения и которые необязательно защищены защитными группами и где Y означает отщепляемую группу и, кроме того, необязательно включает в себя удаление защитных групп из необязательно защищенных R1, R2, R3, W1 и W2 для того, чтобы получить соединение формулы (I).
Реакция конъюгации в способе согласно изобретению, с целью синтеза полимерного конъюгата соединения формулы (I) катализируется основанием в органическом растворителе. Предпочтительно указанное основание является сильным основанием. В предпочтительном варианте осуществления настоящего изобретения основание выбирают из группы гидридов щелочных металлов, третичных аминов и/или алкоксидов. В весьма предпочтительном варианте осуществления настоящего изобретения основание, катализирующее процесс полимерной конъюгации согласно изобретению, представляет собой гидрид натрия. Однако также могут быть использованы другие основания, такие как метоксид натрия или триэтиламин.
Предпочтительно молярное отношение основного катализатора к соединению формулы (III) приблизительно находится между 1:1 и 4:1, наиболее предпочтительно приблизительно от 1:1 до 1,5:1 и наиболее предпочтительно около 1:1.
Кроме того, реакция согласно изобретению осуществляется в органическом растворителе, предпочтительно в безводных условиях, то есть в осушенном органическом растворителе. Предпочтительно, содержание воды в смеси растворителей процесса конъюгации равно или меньше чем 200 частей на миллион (ч/млн). Органический растворитель может быть выбран из группы дихлорметана, хлороформа, N,N-диметилформамида. В весьма предпочтительном варианте осуществления настоящего изобретения органическим растворителем является дихлорметан, еще более предпочтительно безводный дихлорметан.
Кроме того, согласно изобретению предпочтительно, чтобы реакция конъюгации проводилась в атмосфере инертного газа, такой как атмосфера азота или аргона.
Более того, указанная реакция согласно изобретению предпочтительно проводится при температуре приблизительно от -10° до приблизительно 60°С, более предпочтительно приблизительно от 0° до 25°С и наиболее предпочтительно при комнатной температуре после начальной стадии при 0°С.
После получения целевого соединения формулы (I) по способу согласно изобретению полимерный конъюгат формулы (I) затем может быть выделен из реакционной смеси и очищен. Согласно предпочтительному варианту осуществления изобретения соединение формулы (I) получается путем очистки сырой смеси методом флеш-хроматографии. Предпочтительно применяется система автоматизированного градиента флеш-очистки, которая снабжается подходящей колонкой и растворителем. Предпочтительно метод очистки выбирают из колонок с обращенной фазой и прямой фазой, при этом растворитель кондиционирования/элюирования предпочтительно выбирают из дихлорметана, воды, метанола, ацетонитрила, буферного раствора формиата аммония при различных соотношениях в смеси. В весьма предпочтительном варианте осуществления изобретения индолокарбазол-полимерное соединение формулы (I) очищается методом флеш-хроматографии с обращенной фазой с использованием картриджа С 18, причем очистку проводят в условиях изократического элюирования смесью 40:60 ацетонитрил/буферный раствор формиата аммония (5 ммоль/л, рН 3,5) (как показано в примере 3). В дополнительно предпочтительном варианте осуществления изобретения индолокарбазол-полимерное соединение формулы (I) очищается методом флеш-хроматографии с обычной фазой (как описано в примерах 4 и 5.3).
Затем продукт может быть высушен, например, над сульфатом натрия и отфильтрован, при этом растворитель удаляется путем выпаривания при пониженном давлении, при 25°С. Очистка целевого продукта проводится с помощью обычных приемов, которые известны специалисту в этой области техники.
После стадии очистки полученное полимерное соединение формулы (I) обладает чистотой, по меньшей мере, приблизительно 95%. Более предпочтительно, после стадии очистки соединение формулы (I) имеет чистоту, по меньшей мере, около 98%. В еще более предпочтительном варианте осуществления полученное полимерное соединение имеет чистоту 98,5%, 99% или даже 99,5%.
Более того, способ настоящего изобретения приводит к выходу суммарной массы соединения формулы (I) приблизительно от 40% до 98% по массе, предпочтительно приблизительно от 50% до 95% по массе, в расчете на массу реагирующего соединения формулы (III).
Остаток Y формулы (III) является отщепляемой группой, то есть группой, которая в условиях реакции полимерной конъюгации настоящего изобретения, удаляется из структуры соединения формулы (III) для того, чтобы получить оксазолидиндионовый цикл соединения формулы (I), который ковалентно связывает полимерный фрагмент с индолокарбазольной структурой соединения К-252а или его производного. Согласно изобретению имидазольное кольцо соединения общей формулы (II) также удаляется в ходе реакции конъюгации из фрагмента полимерного реагента для того, чтобы получить соединение формулы (I).
В предпочтительном варианте осуществления настоящего изобретения отщепляемую группу Y формулы (III) выбирают из группы, состоящей из трифторметансульфоната (трифлат), тозилата, мезилата, сульфата, галогена, гидрокси- или низшей алкоксигруппы. В особо предпочтительном варианте осуществления отщепляемая группа Y формулы (III) представляет собой низшую алкоксигруппу или гидроксигруппу. Наиболее предпочтительно, отщепляемой группой Y является низшая алкоксигруппа, в особенности метоксигруппа.
Полимерный фрагмент, который ковалентно присоединяется к индолокарбазольному соединению по способу настоящего изобретения и который, например, представлен в общих формулах (I) и (II) группой X, должен быть биологически совместимым, может иметь природное, или полусинтетическое, или синтетическое происхождение, и может обладать линейной или разветвленной структурой. Предпочтительно, в настоящем изобретении полимер Х выбирают из поли(алкиленоксидов), в особенности из (полиэтилен)оксидов. Однако дополнительные примеры полимеров включают (без ограничений) полиакриловую кислоту, полиакрилаты, полиакриламид или его N-алкил производные, полиметакриловую кислоту, полиметакрилаты, полиэтилакриловую кислоту, полиэтилакрилаты, поливинилпирролидон, поли(виниловый спирт), полигликолевую кислоту, поли(молочную) кислот, поли(молочную-когликолевую) кислоту, декстран, хитозан, полиаминокислоты, гидроксиэтил-крахмал.
С целью предоставления вклада в способ настоящего изобретения в особенности с целью функционализации полученного полимера формулы (II) в способе согласно изобретению указанный выше полимерный фрагмент должен содержать концевую функциональную аминогруппу или должен быть функционализирован для того, чтобы содержать концевую функциональную амино-группу. Поэтому полимерный фрагмент должен быть амино-активированным полимером общей формулы X-NH2.
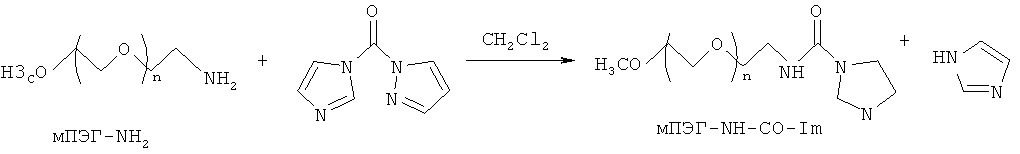
Фактически, исходный полимерный реагент формулы (II) получается путем взаимодействия аминогруппы полимерного фрагмента с 1,1-карбонилдиимидазольным соединением для того, чтобы получить ω-1H-имидазол-карбоксамидное полимерное соединение общей формулы (II).
Предпочтительно получение ω-1H-имидазол-карбоксамидного полимерного соединения формулы (II) проводят в органическом растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид. В весьма предпочтительном варианте осуществления органическим растворителем является дихлорметан, еще более предпочтительно - безводный дихлорметан.
Кроме того, согласно изобретению предпочтительно, чтобы активация ω-аминополимера проводилась в атмосфере инертного газа, такой как атмосфера азота или аргона.
Более того, предпочтительно, чтобы взаимодействие с образованием ω-1H-имидазол-карбоксамидного полимерного соединения настоящего изобретения проводилось при температуре приблизительно от 10° до 60°С, более предпочтительно приблизительно от 15° до 25°С и наиболее предпочтительно при комнатной температуре.
В весьма предпочтительном варианте осуществления настоящего изобретения полимерный фрагмент Х представляет собой полиэтиленгликолевый (ПЭГ) фрагмент, в котором концевая ОН-группа необязательно может быть модифицирована, например, C1-С6-алкильной или С1-С5-ацильной группами, предпочтительно C1-, С2- или С3-алкильными группами или С1-, С2- или С3 группами. Предпочтительно модифицированный полиэтиленгликоль представляет собой терминально алкокси-замещенный полиэтиленгликоль, более предпочтительно метокси-полиэтиленгликоль (мПЭГ).
Согласно настоящему изобретению используемый полимер имеет молекулярную массу в диапазоне приблизительно от 100 до 100000 ед. Дальтона (Да), предпочтительно приблизительно от 200 до 50000 Да и более предпочтительно приблизительно от 500 до 10000 Да. В соответствии с одним предпочтительным замыслом изобретения полимер представляет собой поли(этиленгликоль) с короткой цепочкой, предпочтительно терминально алкокси-замещенный ПЭГ, такой как метокси-замещенный поли(этиленгликоль) с молекулярной массой в диапазоне приблизительно от 200 до 1500 Да, предпочтительно приблизительно от 400 до 1200 Да и еще более предпочтительно приблизительно от 550 до 1100. В наиболее предпочтительном варианте осуществления ПЭГ с короткой цепочкой или мПЭГ имеет среднюю молекулярную массу приблизительно 550 Да или приблизительно 1100 Да. В соответствии со вторым предпочтительным замыслом изобретения полимер представляет собой с длинной цепочкой поли(этиленгликоль), предпочтительно терминально алкокси-замещенный ПЭГ, такой как метокси-замещенный поли(этиленгликоль), с молекулярной массой в диапазоне приблизительно от 4000 до 6000 Да и предпочтительно приблизительно от 4500 до 5500 Да. В наиболее предпочтительном варианте осуществления этого замысла изобретения, ПЭГ с длинной цепочкой или мПЭГ имеет среднюю молекулярную массу приблизительно 2000 Да или приблизительно 5000 Да.
Используемый выше термин "приблизительно" при обозначении величин и диапазонов молекулярной массы фрагмента полимера изобретения означает, что указанные величины и/или диапазоны могут изменяться в диапазоне ±20%, предпочтительно в диапазоне ±10%.
За исключением других кратко указанных случаев, каждый из следующих терминов, используемых в настоящем изобретении, будет иметь значение, изложенное ниже. Термин "низший алкил" при индивидуальном использовании или в комбинации с другими группами означает низшую алкильную группу с прямой цепью или разветвленную, которая содержит от 1 до 6 атомов углерода, предпочтительно от 1 до 5, более предпочтительно от 1 до 4 и особенно предпочтительно 1-3 или 1-2 атома углерода. Указанные группы включает в себя, в частности, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, амил, изоамил, неопентил, 1-этилпропил, гексил и тому подобное. Фрагмент низшего алкила в "низшей алкокси-", "низшей алкоксикарбонильной", "низшей алкиламинокарбонильной", "низшей гидроксиалкильной" и "три(низшей)алкилсилильной" группах имеет те же значения, что указаны выше для "низшего алкила".
Группы "низшего алкенила" определяются как С2-С6-алкенильные группы, которые могут иметь прямую или разветвленную цепь и могут находиться в Z- или Е-форме. Такие группы включают в себя винил, пропенил, 1-бутенил, изобутенил, 2-бутенил, 1-пентенил, (2)-2-пентенил, (Е)-2-пентенил, (7)-4-метил-2-пентенил, (Е)-4-метил-2-пентенил, пентадиенил, например 1,3- или 2,4-пентадиенил, и тому подобное. Более предпочтительными С1-С6-алкенильными группами являются С2-С5-, С2-С4-алкенильные группы и еще более предпочтительны С2-С3-алкенильные группы.
Термин "низшая алкинильная" группа относится к C2-С6-алкинильным группам, которые могут иметь прямую или разветвленную цепь и включают в себя этинил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-пентинил, 3-пентинил, 1-гексинил, 2-гексинил, 3-гексинил и тому подобное. Более предпочтительными С3-С6-алкинильными группами являются С2-С5-, С2-С4-алкинильные группы и еще более предпочтительными - С2-С3-алкинильные группы.
Термин "арильная" группа относится к С6-С14-арильным группам, которые содержат от 6 вплоть до 14 кольцевых атомов углерода. Указанные группы могут быть моно-, би- или трициклическими и представляют собой конденсированные кольца. Предпочтительные арильные группы включают фенил, бифенил, нафтил, антраценил, фенантренил и тому подобное. Арильный фрагмент "арилкарбонильной" и "ариламинокарбонильной" групп имеют такие же значения, как указано выше.
Термин "гетероарильная" относится к группе, которая может содержать от 1 до 3 гетероатомов, независимо выбранных из азота, серы или кислорода, и относится к С3-С13-гетероарильным группам. Эти группы могут быть моно-, би- или трициклическими. Гетероарильные группы С3-С13 настоящего изобретения включают в себя гетероароматические и насыщенные и частично насыщенные гетероциклические группы. Указанные гетероциклические группы могут быть моноциклическими, бициклическими, трициклическими. Предпочтительными 5 или 6-членными гетероциклическими группами являются тиенил, фурил, пирролил, пиридил, пиранил, морфолинил, пиразинил, метилпирролил и пиридазинил. Группа С3-С13-гетероарила может быть бициклической гетероциклической группой. Предпочтительными бициклическими гетероциклическими группами являются бензофурил, бензотиенил, индолил, имидазолил и пиримидинил. Наиболее предпочтительными С3-С13-гетероарильными группами являются фурил и пиридил.
Термин "низшая алкокси-" включает в себя алкоксигруппы, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 5, более предпочтительно от 1 до 4 и особенно предпочтительно от 1 до 3 или 1-2 атома углерода, и группы могут иметь прямую или разветвленную цепочку. Указанные группы включают в себя метокси-, этокси-, пропокси-, бутокси-, изопропокси-, трет-бутокси-, пентокси-, гексокси- и тому подобное.
Термин "ацил" включает в себя низший алканоил, который содержит от 1 до 6 атомов углерода, предпочтительно от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2 атомов углерода и может иметь прямую или разветвленную цепочку. Предпочтительно эти группы включают формил, ацетил, пропионил, бутирил, изобутирил, третичный бутирил, пентаноил и гексаноил. Ацильный фрагмент "ацилокси-"группы имеет такие же значения, которые указаны выше.
Термин "галоген" включает в себя фтор, хлор, бром, йод и тому подобное.
Термин "аралкильная" группа относится к С7-С15-аралкилу, в котором алкильная группа замещена арилом. Указанные алкильная группа и арил могут быть выбраны из C1-С6 алкильных групп и С6-С14-арильных групп, которые определены выше, в которых число атомов углерода составляет между 7 и 15. Предпочтительными C7-C15-аралкильными группами являются бензил, фенилэтил, фенилпропил, фенилизопропил, фенилбутил, дифенилметил, 1,1-дифенилэтил, 1,2-дифенилэтил. Аралкильный фрагмент "аралкилокси-" групп имеет такие же значения, которые указаны выше.
Замещенные низшие алкильные, алкенильные и алкинильные группы имеют от 1 до 3 заместителей, независимо выбранных из таких, как низший алкил, гидрокси-, низшая алкокси-, карбоксил, низший алкоксикарбонил, нитро-, галоген, амино-, моно- или ди-(низший)алкиламино-, диоксолан, диоксан, дитиолан и дитион. Замещающий фрагмент низшего алкила в замещенной низшей алкильной, алкенильной и алкинильной группах и фрагмент низшего алкила низшей алкокси-группы, низшего алкоксикарбонила и заместители моно- или ди-низшей алкиламино-группы в замещенной низшей алкильной, алкенильной и алкинильной группах имеют такие же значения, которые указаны выше для "низшего алкила".
Каждая замещенная арильная, замещенная гетероарильная и замещенная аралкильная группы имеет от 1 до 3 независимо выбранных заместителей, таких как низший алкил, гидрокси-, низшая алкокси-, карбокси-, низший алкоксикарбонил, нитро-, амино-, моно- или ди-(низший)алкиламино-, и галоген. Среди заместителей низший алкильный фрагмент низшего алкила, низшей алкокси-, низшего алкоксикарбонила, и моно- или ди-(низший) алкиламино-группы имеют такие же значения как низший алкил, указанный выше.
Гетероциклическая группа, которую образуют радикалы R5 и R6 в сочетании с атомом азота, включает в себя пирролидинил, пиперидинил, пиперидине, морфолинил, морфолино, тиоморфолино, N-метилпиперазинил, индолил и изоиндолил.
Предпочтительно, R1 и R2 независимо выбирают из группы, состоящей из водорода, галогена, нитро-, -СН2OН, -(CH2)kR14, -CH=CH(CH2)n,R16, -C=C(CH2)jR15, -CO(CH2)jR4, где R4 представляет собой -SR7, СН2O-(замещенный или незамещенный) низший алкил (где замещенный низший алкил предпочтительно означает метоксиметил, метоксиэтил или этоксиметил), -NR5R6.
В указанных выше предпочтительных значениях R1 и R2 остаток R14предпочтительно выбирают из группы, состоящей из фенила, пиридила, имидазолила, тиазолила, тетразолила, -COOR15, -OR15 (где R15 предпочтительно выбирают из водорода, метила, этила, фенила или ацила), -SR7 (где R7 предпочтительно выбирают из замещенного или незамещенного низшего алкила, 2-тиазолина и пиридила) и -NR5R6 (где R5 и R6 предпочтительно выбирают из водорода, метила, этила, фенила, карбамоила и низшего алкиламинокарбонила). Более того, остаток R16 предпочтительно выбирают из водорода, метила, этила, фенила, имидазола, тиазола, тетразола, -COOR15, -OR15 и -NR5R6 (где остатки R15, R5 и R6 имеют предпочтительные значения, которые указаны выше). В указанных выше предпочтительных значениях R1 и R2 остаток R7 предпочтительно выбирают из группы, состоящей из замещенного или незамещенного низшего алкила, замещенного или незамещенного фенила, пиридила, пиримидинила, тиазола и тетразола. Кроме того, k предпочтительно представляет собой 2, 3 или 4, j предпочтительно равно 1 или 2 и т и предпочтительно n независимо равны 0 или 1.
Предпочтительно R представляет собой водород или ацетил, наиболее предпочтительно водород. Кроме того, каждый W1 и W2 предпочтительно является водородом.
Предпочтительный вариант осуществления настоящего изобретения относится к соединению К-252а, конъюгированному с полимерным фрагментом. Еще более предпочтительный вариант осуществления относится к полимерным конъюгатам К-252а и их производным, где химическая группа, связывающая полимерное звено с соединением К-252а или с производным соединения К-252а, характеризуется 5-членной оксазолидиндионовой циклической структурой. Поэтому в весьма предпочтительном варианте осуществления настоящего изобретения полимерный конъюгат формулы (I) представлен соединением, в котором R1, R2, R3, W1 и W2 представляют собой водород и Х является полимерным фрагментом. В соответствии с этим весьма предпочтительным вариантом осуществления изобретения полимерный фрагмент представляет собой фрагмент полиэтиленгликоля (ПЭГ) или метокси-полиэтиленгликоля (мПЭГ). Еще более предпочтительно, полиэтиленгликоль или метокси-полиэтиленгликоль предпочтительного варианта осуществления изобретения представляет собой полимерный ПЭГ или мПЭГ с длинной цепочкой, со средней молекулярной массой приблизительно 2000 Да или приблизительно 5000 Да. Аналогично предпочтительным является полиэтиленгликоль или метокси-полиэтиленгликоль с короткой цепочкой, со средней молекулярной массой приблизительно 550 Да или приблизительно 1100 Да.
Способ настоящего изобретения включает в себя необязательную стадию защиты защитной группой одного, нескольких или всех заместителей R1, R2, R3, W1 и W2 индолокарбазольного соединения К-252а или производного соединения. В этом контексте термин "защитные группы" относится к любому производному заместителей R1, R2, R3, W1 и W2, известных из уровня техники, которые могут быть использованы в случае необходимости, чтобы маскировать R1, R2, R3, W1 и W2 в ходе процесса синтеза, и которые затем могут быть удалены в условиях, приводящих к обратному получению заместителей R1, R2, R3, W1 и W2 без нежелательных превращений в остальной части молекулы. В особенности, в случае необходимости, защитная группа вводится в один, несколько или во все заместители R1, R2, R3, W1 и W2 в ходе процесса конъюгации настоящего изобретения для того, чтобы осуществить химически селективную конъюгацию полимера в положении С3 индолокарбазольной структуры К-252а или производного соединения. По окончании реакции конъюгации одна или несколько защитных групп могут быть обратимо удалены для того, чтобы вновь получить исходную функциональную группу связанных заместителей R1, R2, R3, W1 и W2 с получением индолокарбазольного конъюгированного соединения формулы (I).
Согласно настоящему изобретению с этой целью может быть использована любая подходящая защитная группа, известная из уровня техники. Выбор подходящей защитной группы, а также любого подходящего средства и условий введения и удаления защиты в заместителях R1, R2, R3, W1 и W2 может быть осуществлен специалистом в этой области техники на основе общих знаний в области органического синтеза. Применяемые средства и условия введения и удаления защиты зависят от природы имеющихся функциональных групп R1, R2, R3, W1 и W2. Защитные группы для гидрокси-, амино-, и/или карбокси-остатков предпочтительно выбирают из ацетонида, этилиден-метоксиметила, 2-метоксиэтоксиметила, бензилоксиметила, тетрагидропиранила, метила, этила, изопропила, трет-бутила, бензила, трифенилметила, трет-бутилдиметилсилила, трифенилсилила, метоксикарбонила, трет-бутилоксикарбонила, бензилоксикарбонила, флуоренилметоксикарбонила, ацетила, бензоила, толуолсульфонила, диметоксибензила, нитрофенилоксикарбонила, нитробензилоксикарбонила, аллила, флуоренилметила, тетрагидрофуранила, фенацила, ацетола, фенила, триметилсилила, пирролидила, индолила, гидразино и других защитных групп, которые известны из уровня техники, например, такие, которые можно найти в книге Greene T.W. и др. «Защитные группы в органическом синтезе», 4-е изд., John Wiley и Son, New York, NY (2007). В частности, реагенты и условия реакций введения и удаления защиты выбирают по их пригодности при селективном присоединении и удалении защитной группы без нежелательного влияния на остальную часть соединения. Обычно подходящие условия и реагенты являются известными из практики специалиста в этой области техники.
Согласно настоящему изобретению соединения формулы (I) также могут быть получены в виде фармацевтически приемлемых солей, в том числе солей неорганических кислот, таких как хлористоводородная, йодистоводородная, бромистоводородная, фосфорная, метафосфорная, азотная кислота и серная кислота, а также солей органических кислот, таких как винная, уксусная, лимонная, молочная, бензойная, гликолевая, глюконовая, янтарная, арилсульфоновая (например, п-толуолсульфоновая, бензолсульфоновая кислоты), фосфорная, малоновая и тому подобные. Подходящие кислоты для образования фармацевтически приемлемых солей известны специалистам в этой области техники. Кроме того, фармацевтически приемлемые соли соединений формулы (I) могут образоваться с фармацевтически приемлемым катионом. Фармацевтически приемлемые катионы известны специалистам в этой области техники и включают щелочные катионы (Li+, Na+, K+), щелочноземельные катионы (Mg2+ Са2+, Ва2+), аммоний и органические катионы, такие как катионы четвертичного аммония.
Дополнительным аспектом настоящего изобретения являются новые полимерные конъюгаты К-252а и их производные, в которых химическая группа, связывающая полимерное звено с соединением К-252а или с производным соединения К-252а, характеризуется 5-членной оксазолидиндионовой циклической структурой. Указанные полимерные конъюгаты получаются с использованием нового синтетического способа, раскрытого в изобретении.
Поэтому, в частности, дополнительным аспектом настоящего изобретения является полимерный конъюгат индолокарбазольного соединения формулы (I)

в которой R1, R2, R3, W1 и W2, а также полимерный фрагмент Х являются такими, как подробно изложено выше, или их фармацевтически приемлемые соли.
В наиболее предпочтительном варианте осуществления изобретения относится к новому полимерному конъюгату соединения формулы (I), в котором R1, R2, R3, W1 и W2 представляют собой водород и полимерный фрагмент Х является полиэтиленгликолем (ПЭГ) или терминально алкокси-замещенный ПЭГ, например предпочтительно метокси-полиэтиленгликоль (м-ПЭГ). Указанное соединение соответствует полимерному конъюгированному соединению К-252а согласно настоящему изобретению. Предпочтительно полимерный фрагмент представляет собой полиэтиленгликоль с длинной цепочкой, еще более предпочтительно терминально алкокси-замещенный ПЭГ, такой как метокси-полиэтиленгликоль (м-ПЭГ), имеющий среднюю молекулярную массу приблизительно 2000 Да или приблизительно 5000 Да. Аналогично предпочтительно, когда полимерный фрагмент представляет собой полиэтиленгликоль с короткой цепочкой, еще более предпочтительно - терминально алкокси-замещенный ПЭГ, такой как метокси-полиэтиленгликоль (м-ПЭГ), имеющий среднюю молекулярную массу приблизительно 550 Да или приблизительно 1100 Да.
Неожиданно авторы настоящего изобретения обнаружили, что по сравнению с представителями индолокарбазольных соединений и в особенности по сравнению с самим К-252а или его производными, не содержащими полимера, соответствующие полимерные конъюгированные соединения формулы (I) обладают улучшенными фармакокинетическими и токсикологическими характеристиками, благодаря их повышенной растворимости, что приводит к улучшенной биологической доступности этих терапевтически и биологически активных соединений. В другом аспекте настоящего изобретения неожиданно было обнаружено, что полимерные конъюгированные индолокарбазольные соединения формулы (I) обладают ограниченной соматической абсорбцией при местном применении благодаря их большему размеру молекул и амфипатичности, и таким образом, усиливается их местная терапевтическая и биологическая эффективность, а также снижается системная токсичность и/или побочные эффекты, благодаря местному применению.
Кроме того, неожиданно авторы настоящего изобретения обнаружили, что индолокарбазол-полимерные конъюгаты формулы (I) демонстрируют значительное увеличение селективности для ингибирующей активности против тирозинкиназы TrkA по сравнению с неселективной ингибирующей киназу активностью для самих индолокарбазольных соединений и в особенности для К-252а и его производных, не содержащих полимера. Таким образом, конъюгация индолокарбазольного соединения, и в особенности К-252а, к полимерной молекуле согласно изобретению приводит к получению активных агентов, которые являются селективными в отношении терапевтической мишени с последовательным снижением нежелательных побочных эффектов.
Следовательно, дополнительным аспектом настоящего изобретения является применение соединений формулы (I) в качестве активных агентов в лекарственных средствах. В предпочтительном замысле изобретения соединения формулы (I) применяются в качестве активных агентов в лекарственном средстве для системного назначения и лечения. В подобном предпочтительном замысле настоящее изобретение относится к применению соединений формулы (I) в качестве активных агентов в местных лекарственных средствах.
В частности конъюгированные полимерные соединения настоящего изобретения применяются в качестве активных агентов в лекарственном средстве, пригодном для предупреждения, облегчения и лечения патологий, связанных с HMGB1. Патология, связанная с HMGB1, представляет собой состояние пациента, при котором в биологических флюидах и тканях присутствует повышенная концентрация ядерных протеинов HMGB1 и/или HMGB1-гомологичных протеинов в ацетилированной или неацетилированной форме, по сравнению с концентрацией в нормальных объектах, где указанные ядерные протеины HMGB1 практически невозможно детектировать. Внеклеточные HMGB1 действуют как сильные хемотаксические провоспалительные хемокины. Поэтому патологии, связанные с HMGB1, представляют собой патологии с сильной воспалительной основой, т.е. патологии, которые возникают от стимулирования цитокина, такого как TNF-альфа, IL-1, IL-6 и др., или патологии, которые возникают от токсических событий, таких как интоксикация, инфекция, ожог и др. В частности, высокие концентрации HMGB1 протеинов и гомологичных протеинов были найдены и определены в плазме пациентов с общим заражением крови, в плазме и синовиальном флюиде пациентов с ревматоидным артритом, мозгу пациентов с болезнью Альцгеймера, в плазме и тканях пациентов с меланомой, в плазме пациентов с системной красной волчанкой, в атеросклеротических тромбоцитах пациентов с атеросклерозом и др. Определение и доказательство наличия HMGB1 протеина и/или гомологичных протеинов в биологических флюидах и тканях могут быть получены обычными средствами диагностики, которые известны специалистам в этой области техники, например, включая иммуноферментный анализ в твердой фазе - ELISA и др.
Следовательно, множество заболеваний характеризуются соответствующим наличием внеклеточного HMGB1, которые, в частности, включают в себя (но не ограничиваются) воспалительные заболевания, стеноз, рестеноз, атеросклероз, ревматоидный артрит, аутоиммунные заболевания, опухоли, инфекционные заболевания, общее заражение крови, острое воспалительное повреждение легких, красная волчанка, нейродегенеративные заболевания, заболевания центральной и периферической нервной системы и рассеянный склероз. В особенно предпочтительном варианте осуществления конъюгированные полимерные соединения формулы (I) применяются для предупреждения, облегчения и лечения сердечно-сосудистых заболеваний, в особенности атеросклероза и/или рестеноза, возникающего в процессе или после реконструкции сосудов. Более предпочтительно, лекарственное средство используется для блокирования, торможения и/или ослабления регенерации соединительной ткани при рестенозе в процессе или после реконструкции сосудов.
В особенно предпочтительном аспекте изобретения конъюгированные полимерные соединения формулы (I) являются эффективными при использовании в качестве активного агента в лекарственном средстве для предупреждения, облегчения и лечения неврологических нарушений, заболеваний нервной системы и нейродегенеративных нарушений центральной и периферической нервной системы.
Кроме того, авторы изобретения продемонстрировали, что новые полимерные конъюгатные соединения способны уменьшать и/или ингибировать секрецию плазменного цитокина под действием системной терапии. Поэтому полимерные конъюгатные соединения применяются в качестве активных агентов в лекарственном средстве для системного введения, которое пригодно для предупреждения, облегчения и/или лечения патологий, в которые вовлечено увеличение секреции плазменного цитокина. Указанные патологии предпочтительно представляют собой патологии, в которых, главным образом, вовлечена секреция TNF-α, IFN-γ, MCP-1, MIP-1 и/или RANTES.
В частности, в контексте настоящего изобретения патологии, которые связаны с увеличенной секрецией плазменного цитокина, включают в себя (но не ограничиваются) воспалительные заболевания, аутоиммунные заболевания, системный синдром воспалительного отклика, реперфузионное повреждение после трансплантации органа, сердечно-сосудистые поражения, родовспомогательные и гинекологические осложнения, инфекционные заболевания, аллергические и атонические заболевания, патологии твердых и жидких опухолей, заболевания отторжения трансплантата, врожденные заболевания, дерматологические заболевания, неврологические заболевания, общая атрофия, почечные заболевания, состояния ятрогенной интоксикации, метаболические и идиопатические заболевания и офтальмологические заболевания.
В наиболее предпочтительном варианте осуществления соединения настоящего изобретения применяются в качестве активных агентов в лекарственном средстве для системной терапии, пригодной для предупреждения, облегчения и/или лечения болезни Бехчета, синдрома Шегрена, васкулита, увеита, ретинопатий.
В других конкретных замыслах изобретения является предпочтительным, чтобы конъюгированные полимерные соединения настоящего изобретения применялись в качестве активных агентов в местных лекарственных средствах, пригодных для предупреждения, облегчения и/или лечения кожной патологии. Авторы настоящего изобретения продемонстрировали, что описанные в изобретении конъюгированные полимерные соединения весьма выгодно применяются в качестве местных лекарственных средств, поскольку при введении через кожу для них не наблюдаются вредные или токсические эффекты (например, раздражение) или какие-либо фототоксические эффекты (например, фотомутагенность, фототоксичность или фотосенсибилизация) (как показали исследования, описанные в последующих примерах).
Кожные патологии, предпочтительные в контексте настоящего изобретения, представляют собой патологии, характеризующиеся гиперпролиферацией кератиноцитов, такие как псориаз, атопический дерматит, хроническая экзема, угревая сыпь, красный волосистый питириаз, келоиды, гипертрофические рубцы и кожные опухоли, такие как кератоакантома, плоскоклеточный рак, базально-клеточный рак. В более предпочтительном варианте осуществления соединения настоящего изобретения применяются в качестве активных агентов в местных лекарственных средствах, пригодных для предупреждения, облегчения и лечения псориаза.
Благодаря повышенной селективности соединений изобретения при ингибировании TrkA дополнительным замыслом изобретения является применение указанных конъюгированных соединений для предупреждения, облегчения и лечения патологий, в которых TrkA играет решающую роль в патофизиологическом механизме, который вызывает развитие указанных патологий. В этой связи в весьма предпочтительном варианте осуществления изобретения конъюгированные полимерные соединения К-252а формул (I), (II) и/или (III) применяются в качестве активного агента в лекарственном средстве для предупреждения, облегчения и лечения боли и повышенной болевой чувствительности, связанной с NGF.
Поэтому дополнительным аспектом настоящего изобретения является применение соединения формулы (I), которое определено выше, необязательно вместе с фармацевтически приемлемыми носителями, адъювантами, разбавителями и/или добавками для производства лекарственного средства для предупреждения, облегчения и/или лечения патологий, которые указаны выше.
Соединения формулы (I) или их фармацевтически приемлемые соли могут назначаться как таковые или в виде различных фармацевтических композиций согласно фармакологической активности и цели назначения. Еще одним аспектом настоящего изобретения является фармацевтическая композиция, которая содержит эффективное количество, по меньшей мере, одного соединения формулы (I), необязательно вместе с фармацевтически приемлемыми носителями, адъювантами, разбавителями и/или добавками. Фармацевтические носители, адъюванты, разбавители и/или добавки известны специалистам в этой области техники и поэтому могут быть использованы в рецептуре фармацевтической композиции, содержащей соединение настоящего изобретения.
Соединения настоящее изобретения могут быть использованы в качестве единственного активного агента в фармацевтической композиции. В качестве альтернативы, соединения формулы (I) могут быть использованы в комбинации с одним или несколькими активными агентами, например другими активными фармацевтическими агентами при лечении указанных выше патологий.
В частности, полимерные конъюгатные соединения изобретения могут быть использованы в сочетании, по меньшей мере, с одним стероидным противовоспалительным лекарственным препаратом и/или одним дополнительным агентом, который способен ингибировать ранний медиатор каскада воспалительного цитокина, например антагониста или ингибитора цитокина, который выбирают из группы, состоящей из TNF, IL-1α, IL-1β, IL-Rα, IL-8, MIP-1α, MIF-1β, MIP-2, MIF и IL-6. Особенно пригодные противовоспалительные лекарственные препараты выбирают из дипропионата клометазона, амцинонида, дипропионат беклометазона, бетаметазон, бензоат бетаметазона, дипропионат бетаметазона, бетаметазон фосфат натрия, бетаметазон фосфат и ацетат натрия, валерат бетаметазона, бутират клобетазола, пропионат клобетазола, пивалат клокортолона, кортизол (гидрокортизон), ацетат кортизола (гидрокортизон), бутират кортизола (гидрокортизон), кортизол (гидрокортизон) ципионат, кортизол (гидрокортизон) фосфат натрия, кортизол (гидрокортизон) сукцинат натрия, валерат кортизола (гидрокортизон), ацетат кортизона, дезонид, дезоксиметазон, дексаметазон, ацетат дексаметазон, дексаметазон фосфат натрия, диацетат дифлоразона, валерат дифлукортолона, ацетат флудрокортизона, флудроксикортид, пивалат флуметазона, флунизолид, ацетонид флуоцинолона, флуоцинонид, флуокортолон, фторметолон, флурандренолид, пропионат флутиказона, халцинонид, пропионат галобетазола, медризон, метилпреднизолон, ацетат метилпреднизолона, метилпреднизолон сукцинат натрия, мометазон фуроат, ацетат параметазона, преднизолон, ацетат преднизолона, преднизолон фосфат натрия, преднизолон тебутат, преднизон, триамцинолон, ацетат триамцинолона,триамцинолон ацетонид, триамцинолон диацетат, триамцинолон гексаацетонид. Подходящие антагонисты или ингибиторы цитокина выбирают из инфликсимаба, этанерцепта или адалимумаба.
Дополнительные агенты, которые могут быть использованы в сочетании с полимерными соединениями изобретения, представляют собой, например, антагонисты и/или ингибиторы RAGE, антагонисты и/или ингибиторы HMGB1, антагонисты и/или ингибиторы взаимодействия рецептора, подобного Toll (TCR), с HMGB1, функциональный N-концевой лектиноподобный домен (D1) тромбомодулина и/или синтетическая двунитевая нуклеиновая кислота или молекула-аналог нуклеиновой кислоты с изогнутой структурой, как описано в заявке на международный патент WO 2006/002971, которая включена в настоящее изобретение как ссылка.
Фармацевтическая композиция настоящего изобретения может быть введена удобным образом, как известно специалистам в этой области техники, например терапевтам. В частности, фармацевтическая композиция изобретения может быть введена с помощью инъекции или вливания, в частности путем внутривенной, внутримышечной, подкожной или внутрибрюшинной инъекции или вливания, или через слизистую оболочку, и/или путем ингаляции, перорального, местного, кожного, назального, аэрозольного и/или ректального применения, и др. Композиция может быть введена местно или системно. Предпочтительно, введение соединения и фармацевтической композиции изобретения может быть осуществлено путем парентерального назначения, особенно в виде жидких растворов или суспензий; или путем перорального назначения, особенно в виде таблеток или капсул, или через нос, особенно в виде порошков, назальных капель, или аэрозолей; или через кожу, например, с помощью мазей, кремов, масел, липосом или чрескожных пластырей.
Согласно одному аспекту изобретения фармацевтическая композиция назначается системно. В частности, полимерные конъюгатные соединения могут быть введены путем инъекции или вливания, в особенности внутривенно, внутримышечно, через слизистую оболочку, путем подкожной или внутрибрюшинной инъекции или вливания и/или путем перорального введения.
В еще более предпочтительном варианте осуществления фармацевтическая композиция настоящего изобретения вводится путем местного назначения, в особенности путем наложения на кожу. В случае наложения на кожу введение соединений настоящего изобретения может быть осуществлено в виде липосом.
Кроме того, в наиболее предпочтительном варианте осуществления изобретения фармацевтические композиции вводятся в обратимо фиксированном состоянии на поверхности лечебного устройства, в особенности с помощью связывания, покрытия и/или встраивание соединения и композици изобретения на лечебное устройство, такое как (но без ограничения указанным) эндопротез сосуда, катетер, хирургические инструменты, канюли, клапаны сердца или протезы сосудов. После контактирования лечебного устройства с флюидами организма или тканями организма происходит выделение обратимо фиксированного соединения. Следовательно, покрытое лечебное устройство функционирует как устройство подачи лекарственного препарата, причем лекарственное средство элюируется, и таким образом, может быть осуществлен контроль кинетики поступления лекарственного препарата, обеспечивая, например, немедленное выделение или регулируемую, замедленную или продолжительную подачу лекарственного препарата. Технологии покрытия лечебного устройства хорошо известны специалистам в этой области техники.
Фармацевтическая композиция настоящего изобретения может быть использована для диагностического или терапевтического применения. Для диагностического применения соединение формулы (I) может присутствовать как меченое соединение, например, в форме, содержащей изотоп, например радиоактивный изотоп или изотоп, который может быть обнаружен методом ядерного магнитного резонанса. В случае местного применения предпочтительным терапевтическим использованием является предупреждение, облегчение и лечение псориаза и дерматита, тогда как в случае системного применения - предупреждение, облегчение и лечение соединительной ткани, регенерированной при рестенозе.
Концентрация соединений настоящего изобретения в фармацевтической композиции может изменяться. Концентрация будет зависеть от таких факторов, как суммарная дозировка лекарственного препарата, который будет введен, химических характеристик (например, гидрофобности) применяемых соединений, способа приема препарата, возраста, веса тела и симптомов пациента. Обычно соединения настоящего изобретения предоставляются в водном физиологическом буферном растворе, содержащем приблизительно от 0,1 до 10% (вес/объем) соединения для парентерального приема. Типичный диапазон доз составляет приблизительно от 1 мкг до 1 г/кг веса тела в сутки; предпочтительный диапазон доз составляет приблизительно от 0,01 мг/кг до 100 мг/кг веса тела в сутки и предпочтительно приблизительно от 0,1 до 20 мг/кг, от одного до четырех раз в день. Предпочтительно дозировка принимаемого лекарственного препарата, вероятно, будет зависеть от таких переменных, как тип и степень развития заболевания или расстройства, общее состояние здоровья конкретного пациента, относительная биологическая эффективности выбранного соединения и рецептура соединения с наполнителем, и способ приема препарата.
Улучшенный способ синтеза согласно настоящему изобретению необходимо дополнительно пояснить с использованием следующих фигур и примера, которые тем не менее не должны ограничивать предмет настоящего изобретения.
Краткое описание чертежей
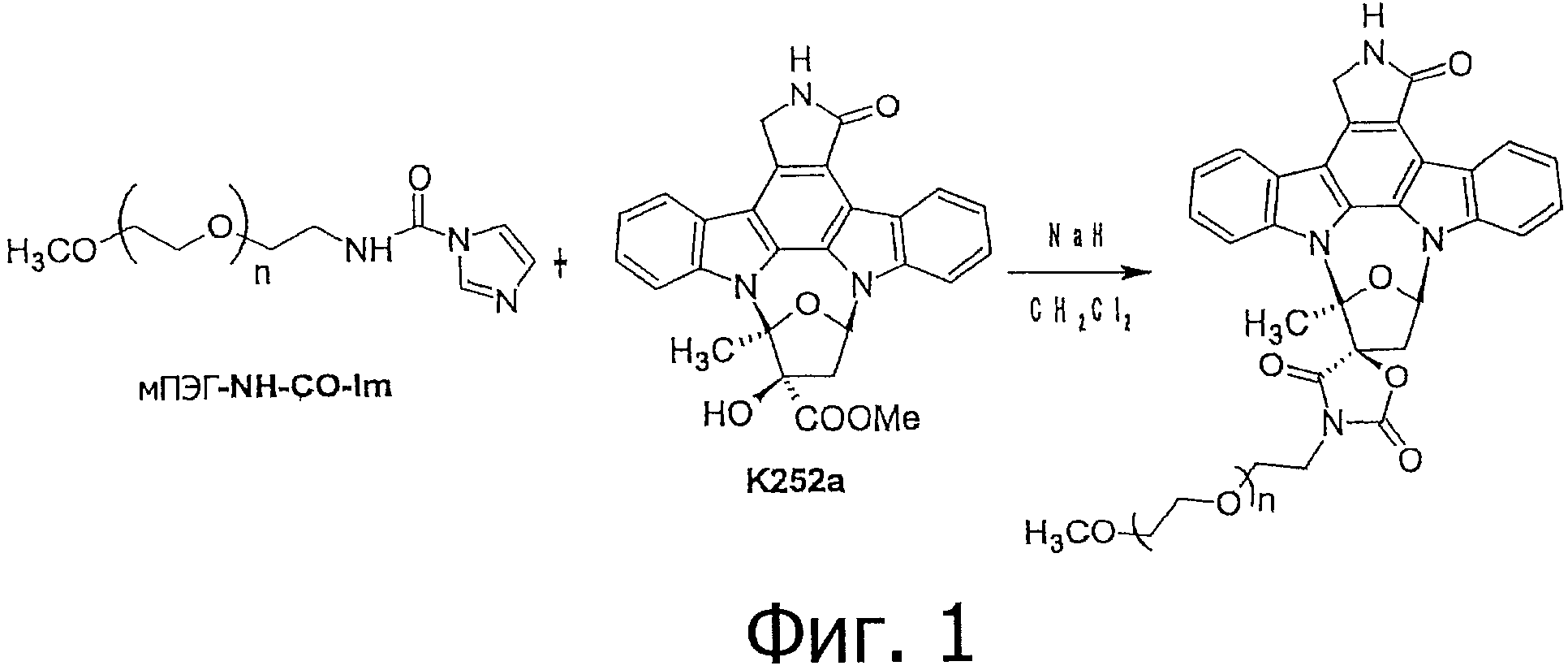
Фигура 1 демонстрирует предпочтительный вариант осуществления способа согласно настоящему изобретению. Индолокарбазольное соединение К-252а взаимодействует с α-метокси-ω-1H-имидазол-карбоксамид-полиэтиленгликолем (мПЭГ-NH-CO-Im) с целью получения метоксиполиэтиленгликолевого конъюгата соединения К-252а согласно изобретению. В этом предпочтительном соединении изобретения метокси-полиэтиленгликоль ковалентно присоединяется к активному соединению К-252а с помощью 5-членной оксазолидиндионовой циклической структуры.
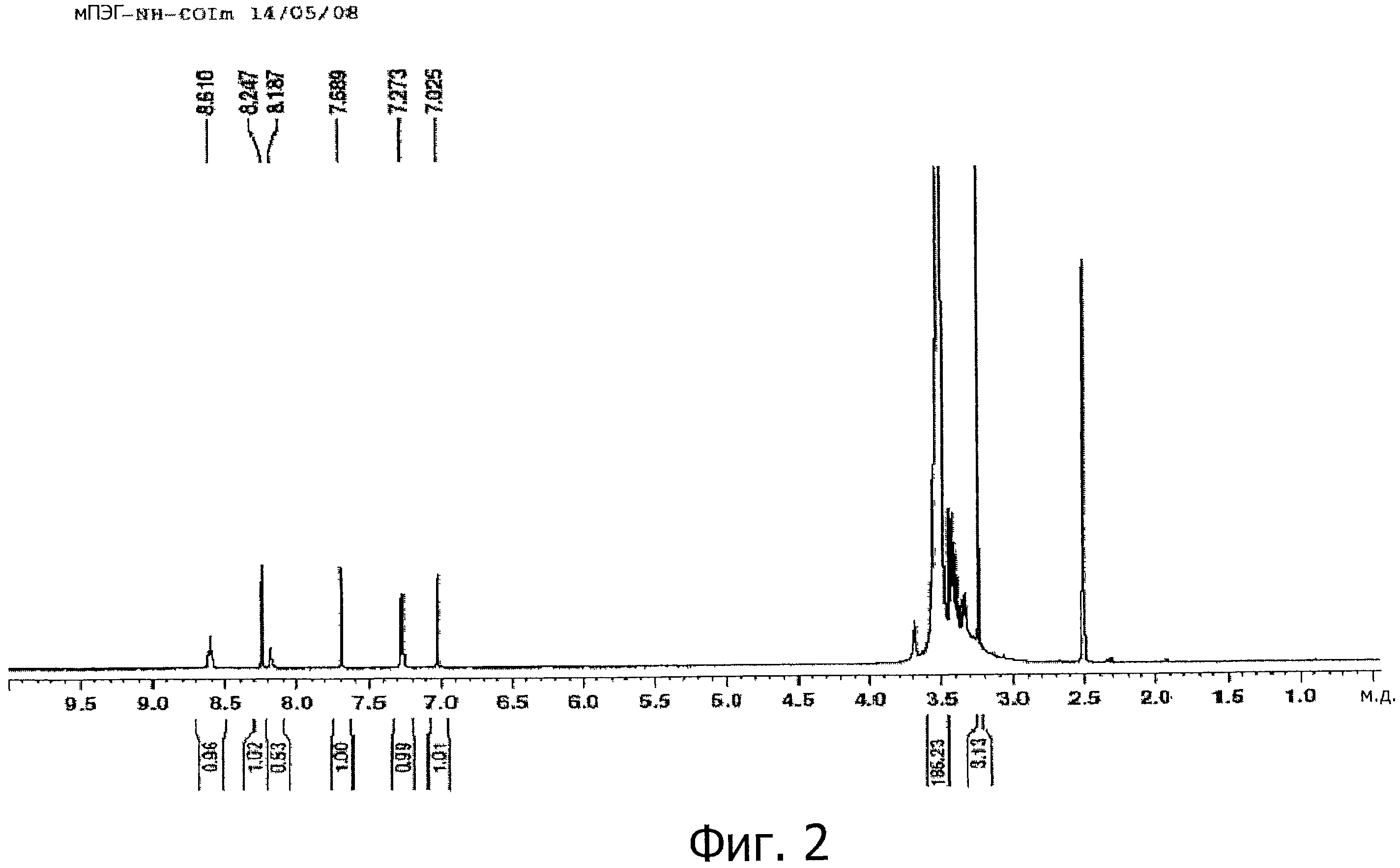
На фигуре 2 показан1Н-ЯМР спектр активированного полимера мПЭГ-NH-CO-Im в растворителе ДМСО-d6 при магнитном поле 400 МГц.
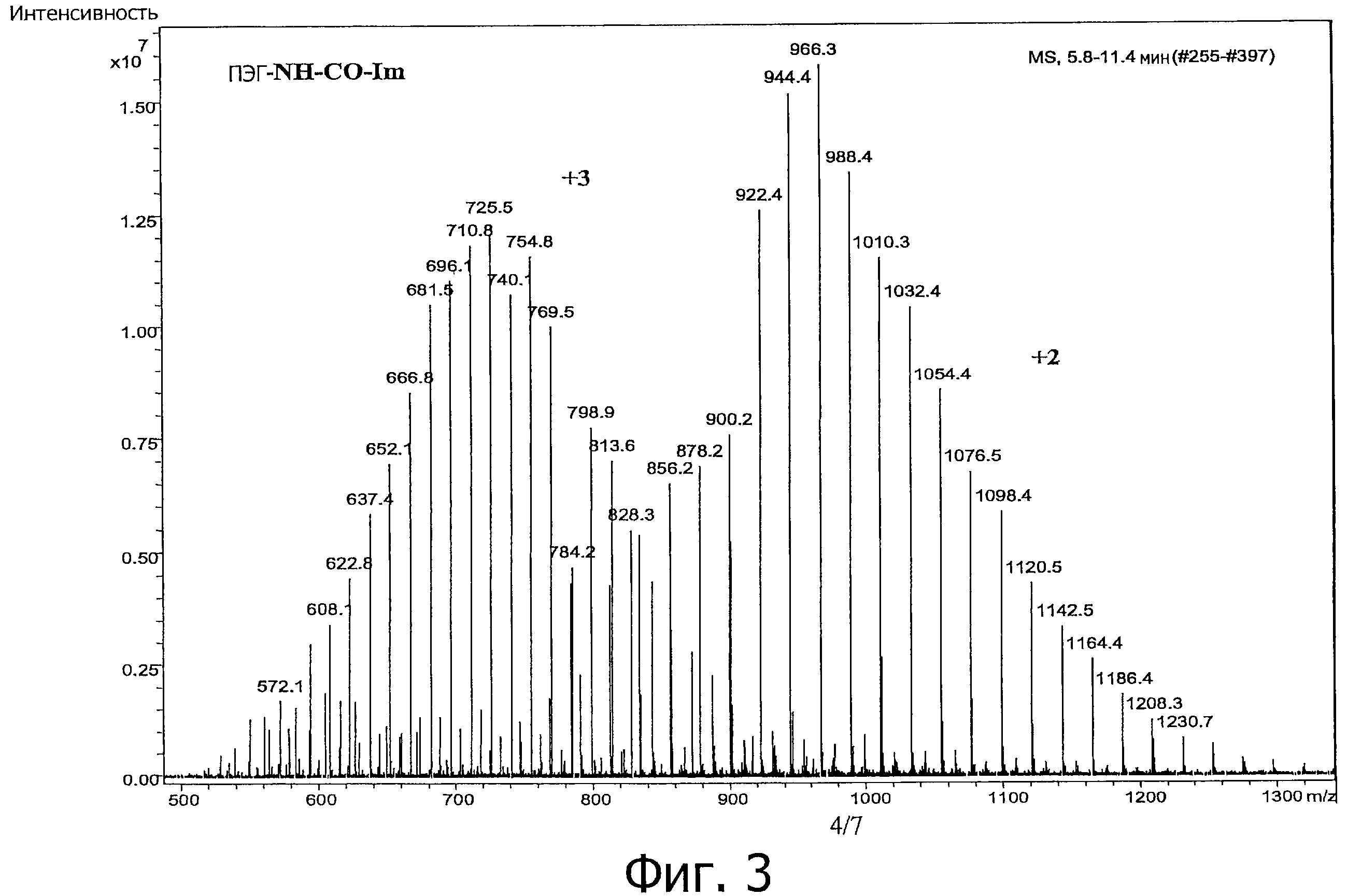
На фигуре 3 приведен ESI-MS спектр мПЭГ-NH-CO-Im в диапазоне масс 500-1400 m/z, с использованием ионизации электрораспылением с прямой инфузионной ионной ловушкой.
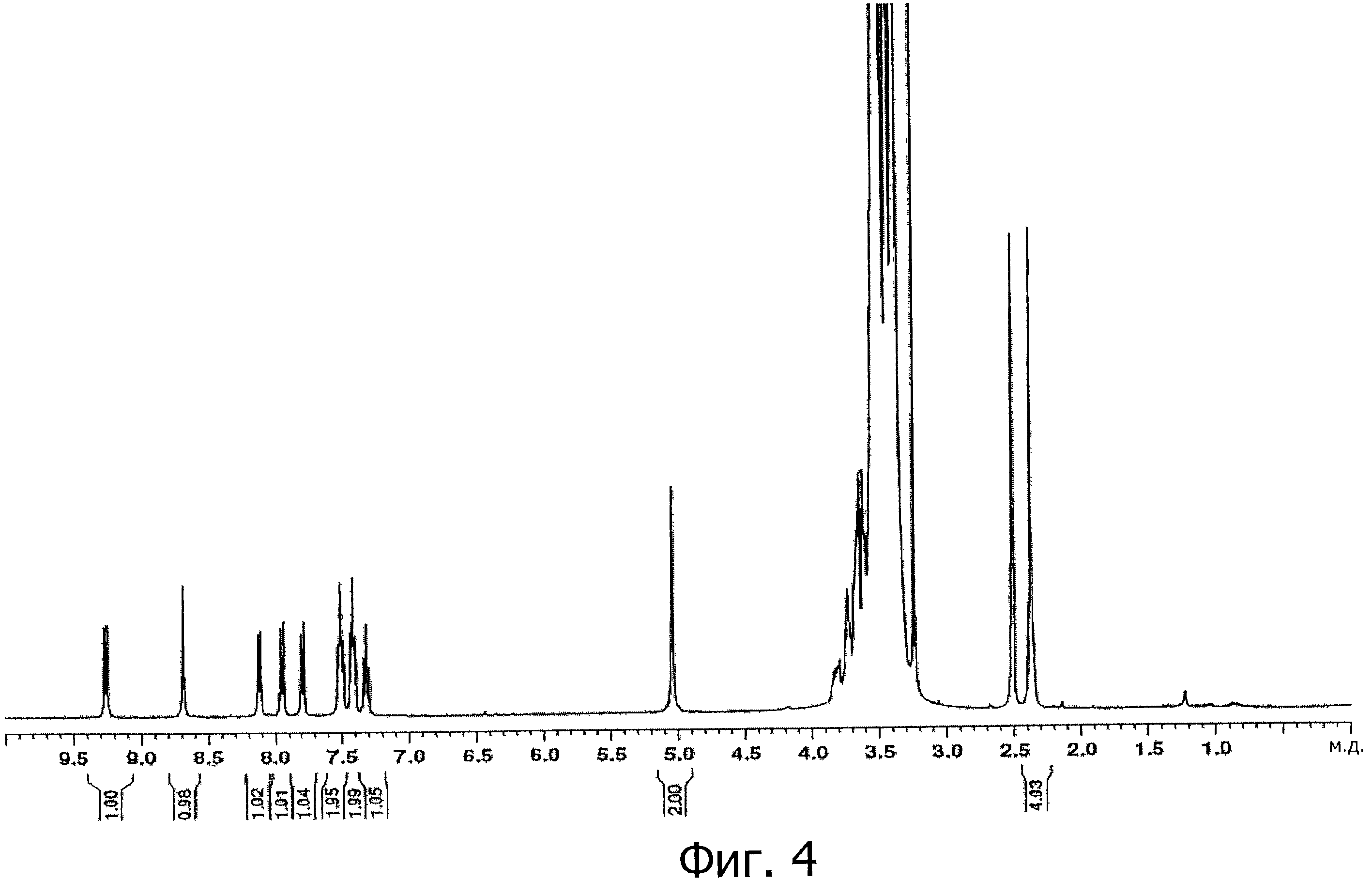
На фигуре 4 показан1Н-ЯМР спектр полимерного конъюгата К-252а фигуры 1 в растворителе ДМСО-d6 при 400 МГц.
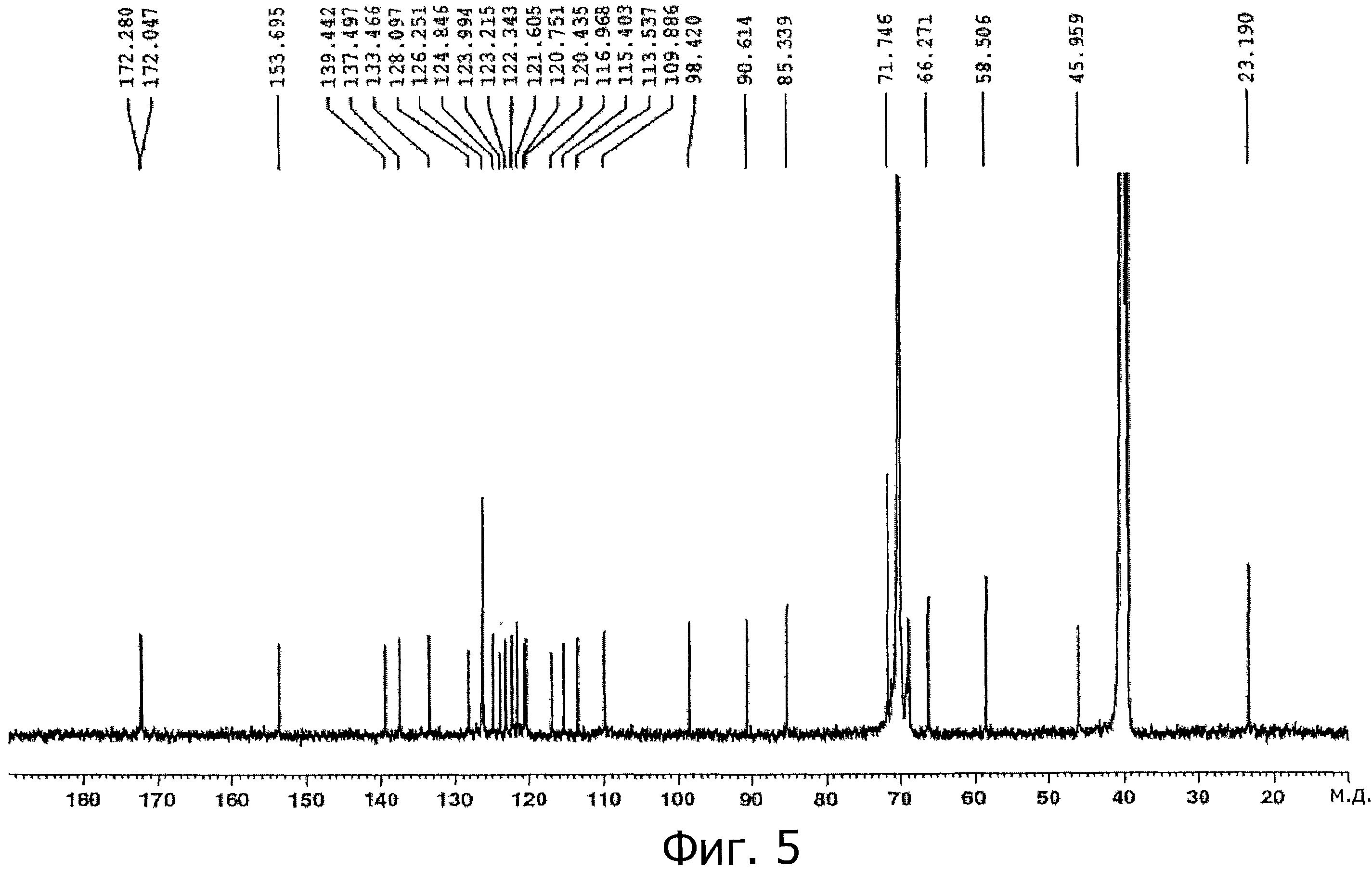
На фигуре 5 приведен13С-ЯМР спектр полимерного конъюгата К-252а фигуры 1 в растворителе ДМСО-d16 при 400 МГц.
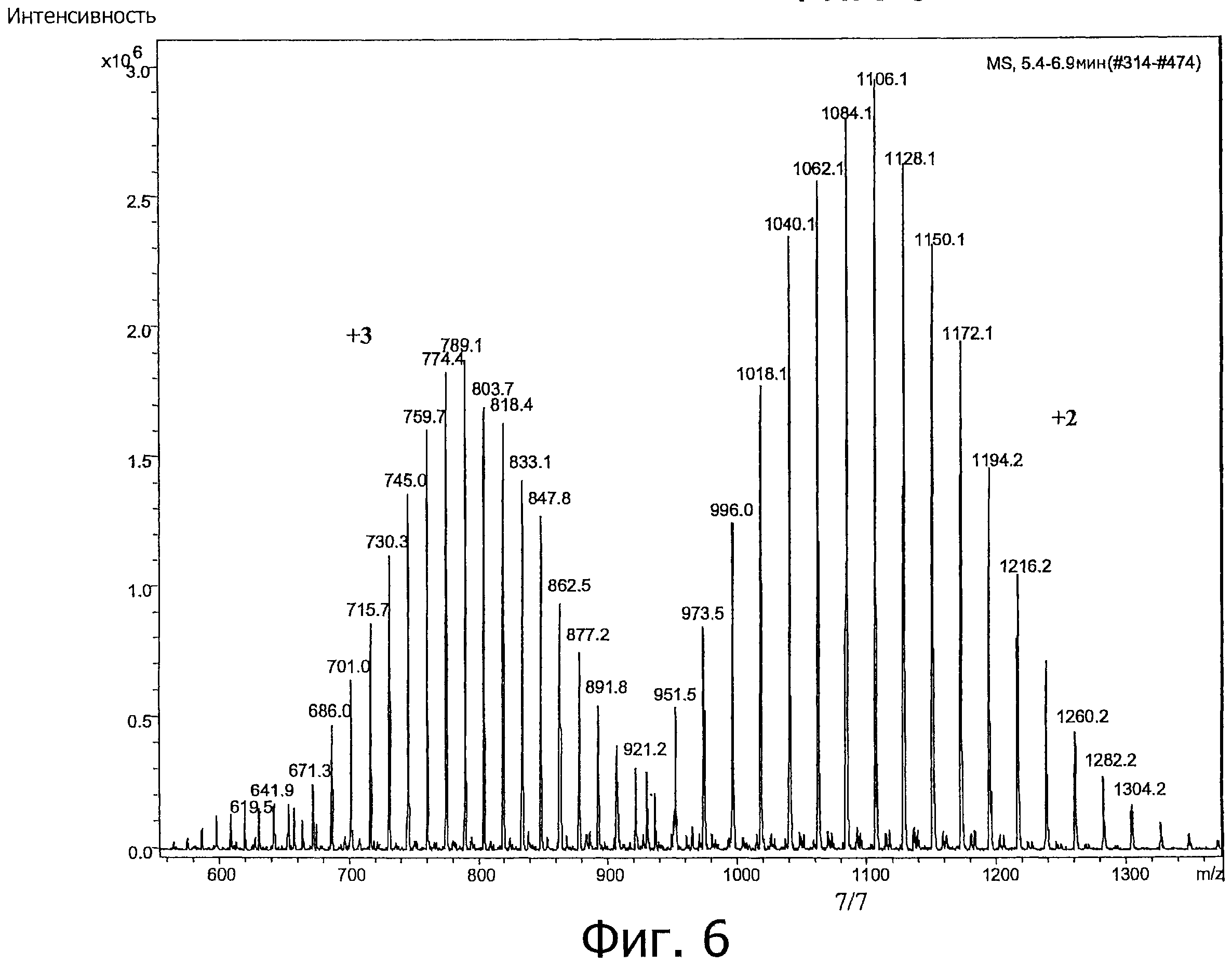
На фигуре 6 показан ESI-MS спектр полимерного конъюгата К-252а фигуры 1 в диапазоне масс 500-1400 m/z с использованием ионизации электрораспылением с прямой инфузионной ионной ловушкой.
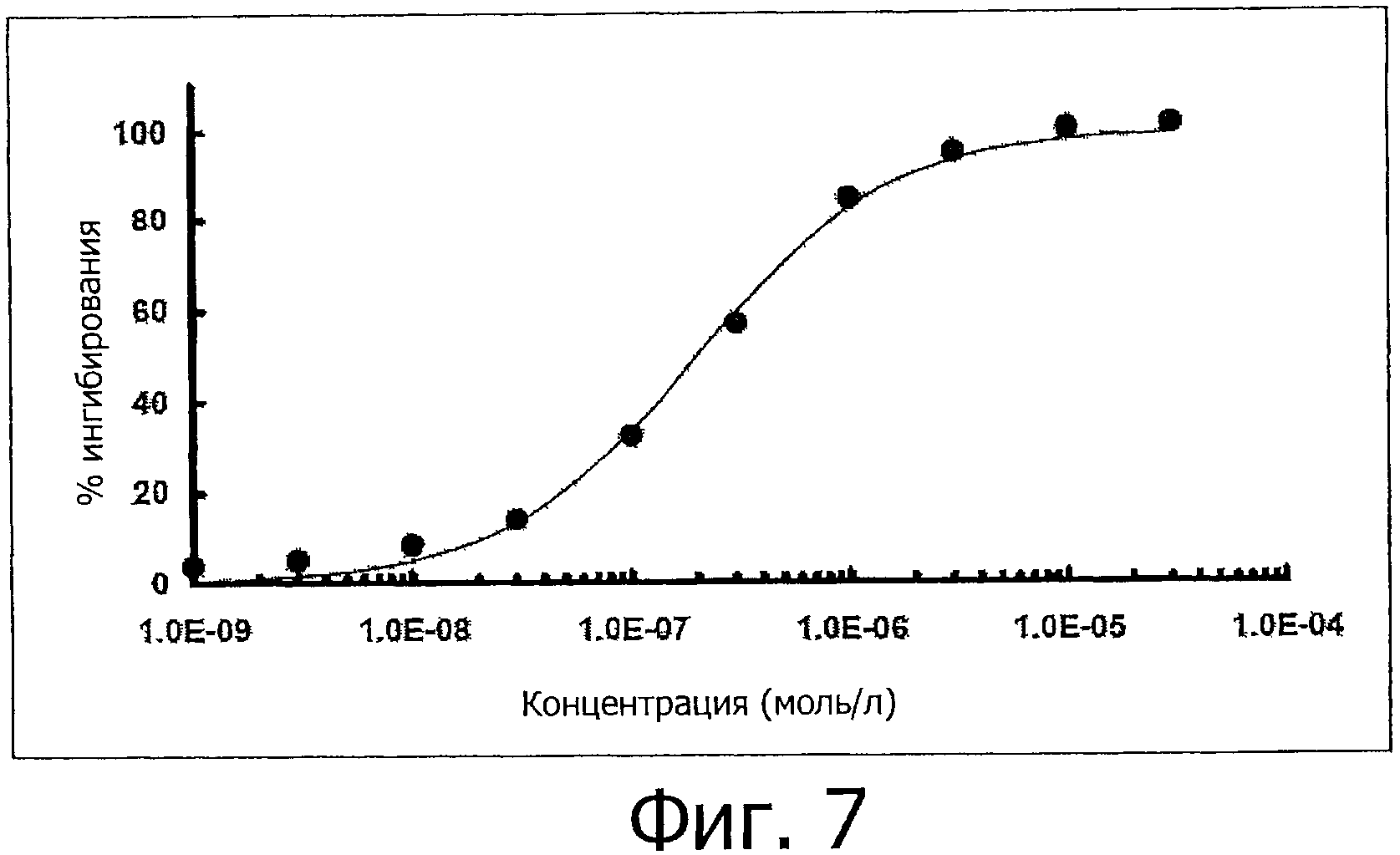
На фигуре 7 приведена кривая ингибирования TrkA полимерным конъюгатом К-252а фигуры 1.
Осуществление изобретения
Примеры
Пример 1. Синтез α-метокси-ω-1H-имидазол-карбоксамид-полиэтиленгликоля (мПЭГ-NH-CO-Im) (Im=имидазол)
В круглодонной колбе объемом 500 мл растворяют 35,0 г мПЭГ-NН2 (молекулярная масса 1892) (чистота по анализу 96%, 17,76 ммоль) в 85 мл дихлорметана в атмосфере азота. Растворитель удаляют при пониженном давлении и соединение высушивают с помощью механического насоса в течение двух часов. Затем субстрат растворяют в 150 мл дихлорметана в атмосфере азота и раствор переносят в круглодонную трехгорлую колбу объемом 2 л.
К раствору добавляют 4,80 г 1,1-карбонилдиимидазола (чистота по анализу 90%, 26,64 ммоль) при комнатной температуре. Смесь перемешивают при комнатной температуре в атмосфере азота и анализируют с помощью тонкослойной хроматографии (ТСХ, элюент СН2Сl2/метанол (МеОН) 90:10). Пластинку ТСХ обрабатывают раствором нингидрина для того, чтобы выявить наличие первичной аминогруппы (фиолетовое окрашивание).
Указанная реакция завершается в течение двух часов. Смесь охлаждают при 0°С, и твердый продукт осаждается при медленном добавлении диэтилового эфира (700 мл за 60 минут) при интенсивном перемешивании. Смесь перемешивают в течение 30 минут при 0°С и дополнительно добавляют 300 мл диэтилового эфира. Продукт фильтруют через фильтровальную воронку с диском из спеченного стекла, промывают диэтиловым эфиром (100 мл) и сушат в вакууме. Получают 34,0 г сухого твердого вещества белого цвета (выход 94%).
Этот продукт характеризуется методами1Н-ЯМР и ESI-MS.
1Н-ЯМР (ДМСО-d6) δ (м.д.): 8,24 (м, 1Н, СН), 7,69 (м, 1Н, СН), 7,27 (с, 1Н, NH), 7,02 (с, 1Н, СН), 3,55 (м, СН2 ПЭГ), 3,40 (м, 2Н, CH2NH), 3,22 (с, 3Н, ОСН3).
ESI-MS (кластер +2)…944,4, 966,4, 988,5, 1010,5, 1032,5… (увеличение массы +47 относительно кластера+2 мПЭГ-МН2…897,4, 919,4, 941,5, 963,5, 985,5).
Пример 2. Реакция конъюгации полимера с К-252а для получения оксазолидиндионового конъюгата
Схема способа показана на фигуре 1.
В круглодонной колбе объемом 500 мл растворяют 33,0 г мПЭГ-NH-CO-Im (16,00 ммоль) в 85 мл дихлорметана в атмосфере азота. Растворитель удаляют при пониженном давлении, и соединение высушивают с помощью механического насоса в течение двух часов.
В реакторе объемом 2 л, оборудованном блоком термокриостата, механической мешалкой и термометром, растворяют 6,21 г К-252а (чистота по анализу 98%, 13,29 ммоль) в 1,85 л дихлорметана в атмосфере азота и раствор охлаждают при 0°С. В атмосфере азота добавляют 0,53 г гидрида натрия (чистота по анализу 60%, 13,29 ммоль), и смесь перемешивают в течение 10 минут. Высушенный мПЭГ-NH-CO-Im растворяют в 90 мл дихлорметана, и раствор добавляют к смеси К-252а и NaH в дихлорметане при 0°С в атмосфере азота. Смесь перемешивают в течение 30 минут при 0°С, затем нагревают до 25°С и при этой температуре выдерживают при перемешивании в течение 10 минут.
Реакционную смесь анализируют методом жидкостной хроматографии высокого разрешения (ВЭЖХ) для того, чтобы определить степень превращения К-252а и соотношение соединений в смеси. Спустя 10 минут при 25°С к реакционной смеси добавляют 3,60 г 1,1-карбонилдиимидазола (чистота по анализу 90%, 19,93 ммоль) и раствор перемешивают при 25°С в течение 30 минут. Реакционную смесь анализируют методом ВЭЖХ для того, чтобы определить степень превращения побочного амидного продукта (конъюгат мПЭГ через карбоксильный фрагмент в положении 9 соединения К-252а) в желательный оксазолидиндионовый конъюгат. Реакционную смесь нейтрализуют муравьиной кислотой (чистота по анализу 98%) до конечного рН 6 (приблизительно 2 мл, 53 ммоль).
Растворитель удаляют при пониженном давлении при 25°С и получают 44,0 г светло-желтого неочищенного продукта.
По данным ВЭЖХ чистота конъюгата в неочищенном продукте превышает 90%. Содержание желательного продукта в неочищенной смеси составляет приблизительно 65-70 масс.%.
Пример 3. Очистка оксазолидиндионового конъюгата К-252а методом флеш-хроматографии на обращенной фазе
Неочищенную смесь, полученную на стадии конъюгации примера 2, очищают методом флеш-хроматографии на обращенной фазе. Используют систему Biotage Horizon, оборудованную флеш-картриджем 65iM KP-C18. Партию продукта делят на 15 аликвот по 3,0 г каждая. Эти аликвоты обрабатывают отдельно.
Колонку С 18 кондиционируют сначала 200 мл растворителя с использованием следующего градиента: от 100% ацетонитрила до смеси 40:60 ацетонитрил/вода и затем 200 мл смесью 40:60 ацетонитрил/формиат аммония (5 миллимоль/л (мМ)) рН 3,5, в изократических условиях.
Неочищенный продукт (3,0 г) растворяют в 3,0 мл N,N-диметилформамида (ДМФ) и раствор загружают в колонку. Очистку проводят путем изократического элюирования смесью 40:60 ацетонитрил/формиат аммония, 5 мМ, рН 3,5. Собранные индивидуальные фракции анализируют, используя ВЭЖХ, и объединяют чистые фракции. Растворитель удаляют при пониженном давлении при 25°С и получают приблизительно 2 г чистого влажного продукта.
Каждую аликвоту очищают, следуя первой методике и окончательно фракции каждого чистого влажного продукта растворяют в 10 мл дихлорметана и затем объединяют. Раствор сушат над сульфатом натрия. Твердое вещество отфильтровывают и растворитель удаляют при пониженном давлении при 25°С.
Полученный твердый продукт анализируют методом ЯМР-спектроскопии и обнаруживают приблизительно 1 моль-эквивалент формиата аммония. Для того чтобы удалить эту соль, продукт растворяют в 50 мл дихлорметана и элюируют через слой силикагеля, смоченный дихлорметаном. Продукт извлекают путем элюирования 700 мл смешанного растворителя дихлорметан/метанол 9:1. Элюат собирают и растворитель удаляют при пониженном давлении при 25°С. Продукт снова растворяют в 80 мл дихлорметана и осаждают при 0°С и интенсивном перемешивании за счет добавления 500 мл диэтилового эфира, чтобы получить твердый продукт. Этот продукт фильтруют через фильтровальную воронку с диском из спеченного стекла, промывают диэтиловым эфиром (100 мл) и сушат в вакууме в течение 16 часов.
Получают 16,0 г светло-желтого порошка с общим выходом (конъюгация + очистка) 51%.
Продукт характеризуют методами ЯМР, ESI-MS и ВЭЖХ. Степень чистоты? определенная методом ЯМР с использованием внутреннего стандарта, соответствует 101 масс.%.
1Н-ЯМР (ДМСО-d6) δ (м.д.): 9,25 (д, 1Н, СН), 8,70 (с, 1Н, NH), 8,11 (д, 1Н, СН), 7,95 (д, 1Н, СН), 7,70 (д, 1Н, СН), 7,51 (м, 2Н, СН), 7,42 (м, 2Н, СН), 7,31 (м, 1Н, СН), 5,05 (с, 1Н, NHCH2), 3,90-3,40 (м, СН2 ПЭГ), 3,25 (с, 3Н, ОСН3), 2,35 (м, 4Н, СН3+1Н CH2).
13С-ЯМР (ДМСО-d6) δ (м.д.): 172,3, 172,0, 153,7, 139,4, 137,5, 133,5, 128,1, 126,2, 124,9, 124,0, 123,2, 122,3, 121,6, 120,8, 120,4, 117,0, 115,4, 113,5, 109,9, 98,4, 90,6, 85,3, 71,8, 70,0, 68,9, 66,3, 58,5, 45,9, 40,0, 23,16.
ESI-MS (кластер +2)…1128,2, 1150,3, 1172,3, 1194,3, 1216,3… (увеличение массы +230,8 относительно кластера+2 мПЭГ-NН2, 897,4, 919,4, 941,5, 963,5, 985,5).
Точное значение молекулярной массы (ММ): расхождение значений MM между регистрируемым спектром и теоретическим спектром соответствует 2 м.д. Следовательно, полученное полимерное соединение имеет чистоту, по меньшей мере, приблизительно 98%.
Пример 4. Очистка оксазолидиндионового конъюгата К-252а методом флеш-хроматографии на обычной фазе
Способ синтеза проводят, как описано выше в примерах 1 и 2, и в этом режиме синтеза получают 21,7 г неочищенного продукта.
Неочищенную смесь, полученную на указанной стадии конъюгации, очищают методом флеш-хроматографии на обычной фазе с использованием системы Biotage Horizon, снабженной SNAP картриджем (размер 71×168 мм), заполненным силикагелем KP-SIL (340 г). Неочищенный продукт разделяют на две аликвоты, каждую из которых очищали отдельно один раз (в каждой аликвоте содержатся 10,86 г и 10,8 г неочищенного материала).
Картридж SNAP доводят до равновесия в смеси 940 мл дихлорметан/метанол 96:4 по объему. Скорость потока составляет 65 мл/мин/
Загрузку образца проводят с использованием предварительно заполненного образца SNAP картриджа (34 г) путем растворения неочищенного материала в 10 мл дихлорметана, используя раствор в образце картриджа и вставляя образец в SNAP картридж.
SNAP картридж элюируют при скорости потока 65 мл/мин следующими смесями:
- 705 мл дихлорметан/метанол, 96:4 по объему;
- 1881 мл дихлорметан/метанол, 93:7 по объему;
- 942 мл дихлорметан/метанол, 85:15 по объему.
Первые 999 мл элюированного растворителя выбрасывают, затем элюированный растворитель собирают в виде фракций объемом 111 мл.
Собранные индивидуальные фракции анализируют методом ВЭЖХ и объединяют фракции, содержащие соединение конъюгированного продукта с чистотой >98% (по ВЭЖХ, чистые фракции).
Оставшуюся аликвоту (10,8 г) смеси неочищенного материала со стадии конъюгации очищают аналогично.
Выбранные фракции со стадий очистки двух аликвот неочищенной смеси объединяют, растворитель удаляют досуха при пониженном давлении и 25°С, получая 8,11 г конъюгатного продукта, который снова растворяют в 29 мл дихлорметана, охлажденного до 2°С, и осаждают при интенсивном перемешивании за счет добавления 150 мл диэтилового эфира в течение 15 минут. Смесь перемешивают при 2°С в течение 15 минут, затем добавляют 225 мл диэтилового эфира. Осажденное твердое вещество выделяют путем фильтрации через фильтр из спеченного стекла (G4) и сушат в вакууме при 25°С в течение 16 часов, получая 6,95 г испытуемого образца в виде твердого вещества беловато-желтоватого цвета. Чистота по данным анализа ВЭЖХ составляет 99%.
Пример 5. Способ синтеза оксазолидиндионового конъюгата К-252а
1) Синтез МеО-ПЭГ-NH-CO-Im (Me - метил)
Растворяют МеО-ПЭГ-МНг (ММ1892, 8,06 г) в дихлорметане (25 мл) в атмосфере азота и растворитель удаляют путем отгонки при пониженном давлении, при 40°С. Затем остаток (МеО-ПЭГ-МНУ сушат в вакууме (<40 мбар=4 кПа) при 40°С более 2 часов.
Высушенный МеО-ПЭГ-МН2 (как указано выше) растворяют в дихлорметане (35 мл) при 25°С в атмосфере азота, добавляют в этот раствор 1,1'-карбонилдиимидазол (1,02 г) и смесь перемешивают при комнатной температуре более 2 часов (по данным ион-парной жидкостной хроматографии (ИПХ): степень превращения >95%).
Реакционную смесь охлаждают до 0°С, затем добавляют 230 мл диэтилового эфира в течение 1 часа при интенсивном перемешивании. Смесь перемешивают 30 минут при 0°С и добавляют дополнительно 69 мл диэтилового эфира в течение 25 минут. Остаток на фильтре промывают два раза диэтиловым эфиром (23 мл) и сушат в вакууме при температуре не выше 40°С до постоянного веса, чтобы получить 8,25 г МеО-ПЭГ-NH-CO-Im в виде белого твердого вещества.
2) Реакция конъюгации с полимером
Растворяют МеО-ПЭГ-NH-CO-Im (72,0 г) в дихлорметане (185 мл) в атмосфере азота и растворитель удаляют путем отгонки при пониженном давлении при 40°С. Затем остаток сушат в вакууме (<40 мбар=4 кПа) при 40°С более 2 часов.
Растворяют К252а (13,11 г) в дихлорметане (3920 мл) и затем раствор охлаждают до 0°С. Гидрид натрия (1,17 г, 60%) добавляют по частям.
Высушенный МеО-ПЭГ-NH-CO-Im растворяют в дихлорметане (140 мл), и раствор добавляют при температуре ниже 5°С в реакционную смесь К252а, и смесь перемешивают более 30 минут при 0°С. Затем раствор реакционной смеси нагревают до 25°С, сохраняя перемешивание при этой температуре в течение 10 минут (ИПХ 1: степень превращения К252а >96%).
Добавляют в реакционную смесь 1,1'-карбонилдиимидазол (7,11 г) и раствор перемешивают при 25°С более 30 минут (ИПХ 2: соотношение неочищенный продукт: амид >80/20).
Добавляют муравьиную кислоту (5 мл), чтобы довести реакционную смесь до рН 6. Растворитель удаляют путем дистилляции при 25°С при пониженном давлении и остаток сушат в вакууме при 25°С до постоянного веса.
3) Очистка и выделение полимерного конъюгата
Неочищенную смесь (81 г) растворяют в 325 мл дихлорметана (ДХМ) при температуре ниже 35°С в течение 15 минут и фильтруют через слой Целита (3 см). Указанный Целит был промыт дихлорметаном (81 мл). Растворитель удаляют путем отгонки при пониженном давлении и температуре ниже 35°С и сушат до постоянного веса при 35°С, получая 77,0 г твердого материала. Этот твердый материал растворяют в 770 мл дихлорметана.
Неочищенный материал из примера 5.2 очищают в препаративной системе Knauer ВЭЖХ, с использованием флеш-картриджей KP-SIL 75L (75×300 мм, 800 г силикагеля) от фирмы Biotage. До подачи исходного раствора картриджи промывают н-гептаном (1,5 л) и доводят до равновесия в 3 литрах смеси ДХМ:МеОН=96:4 (по объему). При каждой наработке вводят 200 мл указанного выше исходного раствора ДХМ:МеОН=96:4 (по объему) (загрузка 20 г) и начинают элюирование при потоке 185 мл/мин и указанном ниже градиенте.
Каждый картридж используется только для одной наработки. Продукт элюируется между 25 и 90 минутами. Фракции собирают, анализируют и объединяют в соответствии с их чистотой (ИПХ: >98% а/а).
Затем растворитель удаляют при пониженном давлении при 35°С. Твердые вещества сушат до постоянного веса в вакууме при 35°С для того, чтобы получить неочищенный материал (37,92 г). Указанный материал растворяют в 140 мл дихлорметана и охлаждают до 2°С. Добавляют 700 мл диэтилового эфира при 2°С и перемешивают более 15 минут. Добавляют 1050 мл диэтилового эфира при 2°С.
Суспензию фильтруют с помощью вакуум-фильтра. Остаток на фильтре промывают маточным раствором и сушат до постоянного веса, получая 32,6 г вещества - очищенного лекарственного препарата. Согласно анализу ВЭЖХ чистота полученного препарата составляет 98,99%.
В дополнительных примерах описаны некоторые исследования, выполненные с полимерным конъюгатом индолокарбазольного соединения согласно изобретению, в частности с полимерным конъюгатом, полученным с использованием способа синтеза настоящего изобретения, например, как описано в примерах 1-5. Испытуемое конъюгатное соединение (также называется "испытуемый образец") представляет собой оксазолидиндионовый конъюгат К252а с полиэтиленгликолем (ММ 1892).
Пример 6. Оценка in vitro ингибирующей на 50% концентрации (IC50) оксазолидиндионового конъюгата К-252а против TrkA
Целью указанного исследования является определение величины IC50 для конъюгата примера 3 против киназы TrkA. Испытуемое соединение растворяют в диметилсульфоксиде (ДМСО), и затем раствор дополнительно разбавляют в 25 раз аналитическим буферным раствором для того, чтобы получить окончательный раствор испытуемого соединения. Конъюгат испытывают при следующих концентрациях: 30000 наномоль/л (нМ), 10000 нМ, 3000 нМ, 1000 нМ, 300 нМ, 100 нМ, 30 нМ, 10 нМ, 3 нМ и 1 нМ.
Эталонное соединение (Стауроспорин) для аналитического контроля готовят таким же образом, как в методе, используемом для приготовления испытуемого соединения.
Методика анализа представлена внешним устройством Анализа по сдвигу пятна (MSA) и описана ниже:
1) Раствор соединения 5 мкл×4,5 мкл×4 субстрата (CSKtide 1000 нМ)/аденозин-трифосфат (АТР, 75 мкМ)/раствор металла (Mg 5 мМ) и раствор киназы 10 мкл×2 готовят в аналитическом буферном растворе [содержит 20 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты), 0,01% Тритон Х-100, 2 мМ DTT (1,2-дитиотреитола), рН 7,5], смешивают и культивируют в лунке из полипропилена в микропланшете с 384 лунками в течение 1 или 5 часов* (*в зависимости от киназы) при комнатной температуре.
2) В лунку добавляют 60 мкл завершающего буферного раствора (сортирующий раствор QuickScout, способствующий анализу MSA; фирма Cama Biosciences).
3) Реакционную смесь подают в систему анализа LabChip3000 (фирма Caliper Life Science), причем пептидные пики продукта и субстрата разделяются и количественно анализируются.
4) Взаимодействие киназы оценивают по соотношению продукта, рассчитанному по высоте пептидных пиков продукта (Р) и субстрата (S) (P/(P+S)).
Считываемое значение контроля взаимодействия (завершенной реакционной смеси) было принято за 0% ингибирования, и считываемое значение фона (Фермент(-)) было принято за 100% ингибирования, затем рассчитывают процент ингибирования для каждого испытуемого раствора. Значение IC50 рассчитывают по кривым зависимости процента ингибирования от концентрации, методом подбора логистической кривой с четырьмя параметрами. Взаимодействие киназы оценивают по соотношению продукта, рассчитанному по высоте пептидных пиков продукта (Р) и субстрата (S) (P/(P+S)).
Значение IC50 для конъюгата против TrkA составляет 202 нМ, соответствующее значение IC50 для эталонного соединения (Стауроспорин) против TrkA составляет 0,372 нМ. Эти результаты обобщены на фигуре 7.
Пример 7. Исследование острой кожной токсичности на крысах
Острую токсичность конъюгата из примера 3 исследуют после введения отдельной кожной дозы крысам.
Отдельную дозу 2000 мг/кг вводят группе из 5 животных мужского пола 5 животных женского пола в течение периода 24 часа. За сутки до планируемого дозирования удаляют шерсть со спинной поверхности туловища над оцениваемой площадью в 10% от всей поверхности организма. Необходимы меры предосторожности, чтобы избежать любого повреждения или истирания кожи. Испытуемый образец вводится локально с объемом дозы 4 мл/кг веса тела, сразу после приготовления образца. Требуемая аликвота рецептуры испытуемого образца равномерно распределяется поверх марли размером 2,5×2,5 см. Затем на шкуре животного помещают марлевый тампон, причем испытуемое вещество находится в непосредственном контакте с кожей. Сверху обработанного участка помещается лента синтетической пленки, и весь комплект удерживается на месте, охватывая туловище животного длинной эластичной пластырной повязкой.
Спустя период 24 часа ленточная перевязка может быть удалена. Затем обработанный участок кожи осторожно промывают, удаляя остатки испытуемого образца с использованием тепловатой воды. В ходе указанного исследования всех животных проверяют два раза в день. Животные обследуются на признаки реакции на дозируемую обработку приблизительно через 30 минут, 2 и 4 часа после ввода дозы в 1-й день, затем ежедневно, всего в течение 14 суток. Каждое животное взвешивают в назначенный день исследования, в день ввода дозы (1й день) и на 8й и 15й день. Спустя период 14 дней всех животных умерщвляют и подвергают аутопсическому исследованию.
В ходе указанного исследования случаи смертности не происходили и не наблюдались клинические признаки у животных мужского пола или животных женского пола. Изменения веса тела, наблюдаемые у животных в конце исследования, находились в ожидаемом диапазоне для указанного вида и возраста животных. При аутопсии у животных в конце исследования не наблюдались внутренние отклонения от нормы. Также отсутствовали отклонения от нормы на обработанном участке.
Эти результаты демонстрируют, что испытуемое соединение не обладает токсическим действием на крыс после воздействия на кожу в течение 24 часового периода на уровне 2000 мг/кг. Отсутствие смертности показывает, что летальная доза для 50% смертности (LD50) превышает 2000 мг/кг.
Пример 8. Исследование 13-недельной кожной токсичности на крысах после 4х недельного периода восстановления
Задача этого исследования состоит в оценке токсичности испытуемого образца на крысах после ежедневного кожного введения (выдержка 6 часов) в течение периода 13 недель и изучении возможного восстановления от любых возможных эффектов, связанных с обработкой, в течение периода 4-х последовательных недель. Кроме того, оценивался токсикокинетический профиль.
Три группы, в каждой 10 крыс мужского пола и 10 крыс женского пола Sprague Dawley (см. таблицу 1: животные мужского пола пронумерованы четными номерами, животные женского пола пронумерованы нечетными номерами), получали испытуемый образец путем наложения на кожу при дозировках 0,5, 2,5 и 5 мг/кг/день в течение 13 последовательных недель (таблица 1: номера групп 2-4). Четвертая группа аналогичного состава получала только носитель (очищенная вода) и играла роль контроля (таблица 1: номер группы 1). По пять дополнительных животных каждого пола были включены в группу высоких доз и контрольную группу (таблица 1: номера групп 4 и 1, соответственно) для оценки восстановления. Кроме того, в трех вспомогательных группах для токсикокинетических исследований, включающих 9 самцов и 9 самок (таблица 2: номера групп 5-8 соответственно), и 1 контрольная группа, включающая 3 самцов и 3 самок (таблица 2: номер группы 5), животных обрабатывали как в основных группах для токсикокинетических оценок.
Обозначение групп и количество животных, подлежащих обработке, указано ниже в таблицах 1 и 2:
Обработанные области обследуются каждый день, приблизительно 3 часа после начала дозирования. Раздражению в указанных областях, по сравнению с соседними областями необработанной шкуры, приписывали численные значения в соответствии с приведенной ниже таблицей:
Результаты
В ходе указанного исследования не происходили случаи смертности, связанные с обработкой (одна самка из группы высокой дозы умерла на 40-й день исследования), и не наблюдались клинические признаки, связанные с обработкой. Существенные различия в весе тела не зарегистрированы, причем потребление пищи у обработанных животных оставалось сопоставимым с контролем во все время исследования.
Не наблюдались какие-либо признаки раздражения в обработанных областях (коэффициент раздражения равен 0).
При офтальмологическом исследовании, проведенном в конце периода обработки, не зарегистрированы связанные с обработкой поражения.
С гематологической точки зрения, лейкопения, наблюдающаяся у животных в группе высокой дозы и у самок в группе средней дозы, оказалась частично обратимой в конце периода восстановления. Какие-либо другие изменения токсикологического значения не наблюдались.
Какие-либо изменения токсикологического значения не наблюдались по данным клинической химии и исследования мочи.
Конечный вес тела был сопоставимым между контрольной и обработанной группами.
Не наблюдались какие-либо изменения абсолютного и относительного веса органов, имеющие токсикологическое значение.
Не наблюдались изменения, связанные с обработкой, по данным макроскопического и микроскопического обследования.
Что касается токсикокинетических данных, в первый день уровни плазмы испытуемого образца обычно были ниже, чем НПКО (нижний предел количественного определения =49,9 нг/мл) у самцов и самок, получивших дозы 0,5, 2,5 и 5 мг/кг/день испытуемого образца, и только у одного животного время от времени зарегистрированы величины немного выше НПКО, между 2 и 8 часами после приема дозы. Регистрируемые величины не были пропорциональны уровню дозы.
Аналогичные результаты были получены на 4-й и 13-й неделе, когда обнаружена пониженная степень поглощения. Это становится особенно очевидно на 4-й неделе у самцов, у которых время от времени наблюдаются показатели немного больше НПКО между 6 и 8 часами после приема дозы только у животных, получивших 5 мг/кг/день испытуемого образца и на 13-й неделе у самок (показатели немного больше НПКО между 4 и 8 часами только после приема дозы 5 мг/кг/день).
Для животных в группе, обработанной только носителем, не обнаружены различимые уровни. На основе указанных выше результатов следует, что после ежедневного приема дозы в течение 13-недельного периода не происходит накопление.
Выводы
При любом исследованном уровне доз испытуемого образца (то есть 0,5, 2,5 и 5 мг/кг/день) не наблюдаются вредные эффекты. Считается, что слабая лейкопения, наблюдаемая у обработанных животных при сравнении с контрольными животными не имеет токсикологического значения, так как она имеет низкую значимость, обычно не зависит от дозы и не сопровождается какими-либо микроскопическими изменениями. Поэтому считается, что высокая доза 5 мг/кг/день представляет собой уровень, при котором не наблюдаются вредные эффекты (NOAEL) для испытуемого образца после ежедневного кожного введения крысам в течение периода 13 недель.
Результаты анализа образцов плазмы показали, что испытуемый образец только минимально поглощается чрескожным путем.
Пример 9. Исследование 13-недельной кожной токсичности на кроликах после 4-недельного периода восстановления
Токсичность испытуемого образца была исследована на кроликах после ежедневного кожного введения уровне доз 0,5, 2,5 и 5 мг/особь/день в течение 13-недельного периода и восстановление от любых возможных эффектов, связанных с обработкой, в течение периода 4-х последовательных недель.
Три группы, в каждой по 6 самцов и 6 самок белых новозеландских кроликов, не содержащих специфических патогенов (SPF) (сравните таблицу 3: животные мужского пола пронумерованы четными номерами, животные женского пола пронумерованы нечетными номерами), получали испытуемый образец путем наложения на кожу при дозировках 0,5, 2,5 и 5 мг/особь/день в течение 13 последовательных недель (таблица 3: номера групп 2-4 соответственно). Четвертая группа аналогичного состава получала только носитель (очищенная вода) и играла роль контроля (таблица 3: номер группы 1). По три дополнительных животных каждого пола были включены в группу высоких доз и контрольную группу (таблица 3: номера групп 4 и 1 соответственно) для оценки восстановления.
Обозначение групп и обработка указаны ниже в таблице 3:
Были проведены следующие исследования: ежедневные клинические признаки, вес тела, потребление пищи, макроскопическое обследование областей обработки, исследование клинической патологии, конечный вес тела, вес органа, посмертное макроскопическое обследование и гистопатологическое исследование.
Пробы крови брали у каждого животного в первый день 1-й и на 13-й и неделе для токсикокинетических оценок.
Области обработки обследуются каждый день, приблизительно 3 часа после начала ввода дозы. Раздражение в области обработки, при сопоставлении с соседней необработанной кожей, оценивали по числовой шкале, приведенной ниже в таблице:
Результаты
В ходе указанного исследования не происходили случаи смертности, связанные с обработкой (один самец из контрольной группы восстановления был гуманно умерщвлен на 29 день исследования), причем не наблюдались клинические признаки, связанные с обработкой.
При макроскопическом обследовании обработанных областей не наблюдались признаки раздражения.
В ходе указанного исследования не зарегистрированы существенные различия в весе тела, причем потребление пищи у обработанных животных оставалось сопоставимым с контролем.
При офтальмологическом исследовании, проведенном в конце периода обработки, не зарегистрированы поражения, связанные с обработкой.
По данным гематологии и клинической химии не зарегистрированы изменения, имеющие токсикологическое значение,
Что касается токсикокинетических данных, в первую неделю уровни плазмы испытуемого образца были немного выше, чем НПКО (нижний предел количественного определения =51,30 нг/мл) у большинства самцов, получивших дозу испытуемого образца 2,5 мг/кг/день, и у самок, получивших дозу 5 мг/кг/день. Только у одного самца, при дозах 0,5 и 5 мг/кг/день время от времени были зарегистрированы величины немного выше НПКО. Величина поглощения не была пропорциональна уровню дозы.
Весьма низкая степень поглощения наблюдается на 13-й неделе. Обычно показатели больше НПКО наблюдаются между 2 и 24 часами после приема дозы. Поглощение у самок было немного больше, чем у самцов.
Для животных в группе, обработанной только носителем, не обнаружены различимые уровни. На основе приведенных выше результатов следует, что после ежедневного приема дозы в течение 13-недельного периода не происходит накопление.
Конечный вес тела был сопоставимым между контрольной и обработанной группами, причем не наблюдались какие-либо изменения абсолютного и относительного веса органов, имеющие токсикологическое значение.
Не наблюдались изменения, связанные с обработкой, по данным макроскопического и микроскопического обследования.
Выводы
При любом исследованном уровне доз испытуемого образца (то есть 0,5, 2,5 и 5 мг/особь/день) не наблюдаются вредные эффекты. Поэтому считается, что высокая доза 5 мг/кг/день представляет собой уровень, при котором не наблюдаются вредные эффекты (NOAEL) для испытуемого образца после ежедневного кожного введения кроликам в течение периода 13 недель.
Результаты анализа образцов плазмы показали, что испытуемый образец только минимально поглощается чрескожным путем.
Пример 10. Исследование острой внутривенной токсичности на крысах
Острая токсичность конъюгата из примера 3 исследована после внутривенного введения (10 мл/кг в физиологическом растворе) отдельной дозы крысам Sprague Dawley с последующим 14-дневным периодом обследования.
Отдельной группе из 5 самцов и 5 самок вводили дозу 2000 мг/кг. Животных обрабатывали дозой рецептуры испытуемого образца при выбранном уровне сразу после приготовления образца путем инъекции в хвостовую вену с использованием гиподермальной иглы, прикрепленной к шприцу подходящей емкости, объем дозы составлял 10 мл/кг вес тела. На всем протяжении исследования животных проверяли дважды в день.
Животные обследуются на признаки реакции на обработку дозой приблизительно через 30 минут, 2 и 4 часа после ввода дозы в 1-й день, затем ежедневно в течение 14 дней. Каждое животное взвешивали в день назначенного исследования, в день ввода дозы (1й день) и на 2-й, 8-й и 15-й день. В конце периода обследования всех животных умерщвляли и подвергали аутопсическому исследованию.
Случаи смертности не происходили среди животных мужского пола и животных женского пола. У всех животных в день введения дозы наблюдаемыми клиническими признаками были пониженная активность и пилоэрекция. У одной самки отмечена потеря волос на спине в течение второй недели исследования.
Изменения веса тела, наблюдаемые у животных в конце исследования, находились в ожидаемом диапазоне для указанного вида и возраста животных. При аутопсическом исследовании всех животных не наблюдались внутренние отклонения от нормы. Также отсутствовали отклонения от нормы на месте инъекции.
Эти результаты демонстрируют, что конъюгат не обладает токсическим действием на крыс после отдельного внутривенного введения при уровне дозы 2000 мг/кг вес тела. У животных отмечены только незначительные клинические признаки. Испытуемый образец является локально толерантным при инъекции в хвостовую вену при испытанном уровне дозы.
Пример 11. Мутация в клетках мышиной лимфомы L5178Y ТК+/- (флуктуационный метод)
Мутагенная активность испытуемого образца исследована путем анализа на индуцирование стойких к 5-трифтортимидину мутантов в клетках мышиной лимфомы L5178Y после обработки in vitro при отсутствии и в присутствии S 9 метаболической активации, с использованием флуктуационного метода. Указанным методом можно детектировать генную мутацию, кластогенные и анеугенные эффекты.
Используемый в этом исследовании метод анализа мутации основан на идентификации колоний L5178Y, которые приобрели стойкость к токсическому аналогу тимидина - трифтортимидину (TFT). Указанный аналог может подвергаться метаболизму под действием фермента тимидинкиназы (ТК) в нуклеозиды, которые используются при синтезе нуклеиновой кислоты, что приводит к гибели ТК-компетентных клеток.
Клетки с дефицитом ТК, которые, предположительно, возникают в результате мутаций в гене ТК, не могут подвергать метаболизму трифтортимидин и, таким образом, выживают и растут в его присутствии.
В клетках мышиной лимфомы L5178Y ген, который кодирует ТК фермент, расположен на хромосоме 11. Клетки, которые являются гетерозиготными в местоположении ТК (ТК+/-), могут подвергаться на отдельной стадии прямой мутации в ТК-/- генотип, в котором имеется небольшая ТК активность или она отсутствует.
Используемые клетки, L5178Y ТК+/-, произведены из одного из двух клонов возникших из опухоли зобной железы, индуцированной в мышах DBA/2 под действием метилхолантрена. Применение системы мутации ТК в клетках мышиной лимфомы L5178Y хорошо охарактеризовано и обосновано (Clive D., Johnson K.O., Spector J.F., Batson A.G., Brown M.M. Validation и characterization of the L5178Y/TK+/- mouse lymphoma mutagen assay system. Mutat. Res. 1979 Jan.; 59(1):61-108) и принято большинством распорядительных органов.
При анализе мышиной лимфомы часто получается бимодальное распределение по размеру стойких к TFT колоний, обозначенных как малые или большие. Было установлено, что точечные мутации и делеции внутри активной аллели (внутригенное событие) продуцируют большие колонии. Малые колонии частично возникают от поражений, которые влияют не только на активные ТК аллели, но также на фланкирующий ген, экспрессия которого модулирует скорость роста клеток.
Обнаружено, что испытуемый образец растворяется в полной питательной среде RPMI 1640 при концентрации 50,0 мг/мл.
Был проведен предварительный анализ цитотоксичности. На основании результатов растворимости испытуемый образец анализировался при максимальном уровне дозы 5000 мкг/мл как при отсутствии, так и при наличии S9 метаболизма. В серию обработки был включен широкий диапазон доз пониженного уровня: 2500, 1250, 625, 313, 156, 78,1, 39,1 и 19,5 мкг/мл.
В отсутствии S9 метаболической активации с использованием кратковременной обработки отмечено небольшое снижение относительной выживаемости при нескольких концентрациях вне зависимости от дозы. При использовании длительной обработки токсичность наблюдается при двух повышенных концентрациях, причем относительная выживаемость снижается приблизительно на 60% от величины параллельного отрицательного контроля.
В присутствии S9 метаболической активации, при любой концентрации испытуемого образца не наблюдается существенная токсичность.
На основании результатов по токсичности, полученных в предварительном испытании, были осуществлены два независимых анализа мутации, стойкой к 5-трифтортимидину, с использованием уровней дозировки, указанных в следующей таблице 4:
Не наблюдается существенное увеличение частоты мутаций после обработки испытуемым образцом в отсутствии или в присутствии S9 метаболизма.
В каждый эксперимент мутации были включены обработки растворителем и положительным контролем в отсутствии и в присутствии S9 метаболизма. Частота мутаций в контрольных культурах с растворителем находится в обычном диапазоне. Заметное увеличение мутаций наблюдается при положительной контрольной обработке, что указывает на правильную работу системы анализа.
Сделан вывод, что испытуемый образец не вызывает мутации в клетках мышиной лимфомы L5178Y после обработки in vitro, при отсутствии или в присутствии S9 метаболической активации, в указанных условиях эксперимента.
Пример 12. Анализ фотомутагенности у бактерий (S. typhimurium и Е. coli)
Для испытуемого образца была исследована фотомутагенная активность по анализу обратной мутации в прототрофных в прокариотических организмах, Salmonella typhimurium и Escherichia coli, после облучения светом.
Были использованы три испытуемых штамма S. typhimurium - ТА1537, ТА98 и ТА100 и испытуемый штамм Е. coli - WP2. Бактерии в планшете вместе с испытуемым образцом в мягком агаре облучали различными дозами УФ-излучения.
Принятая методика была предложена Ames и др., 1975, и переработана Maron и Ames, 1983. Испытуемый образец применяется в виде раствора в стерильной дистиллированной воде.
Испытуемый образец анализируют в тесте токсичности при максимальном уровне дозы 5000 мкг/планшет и при четырех пониженных концентрациях, выбранных приблизительно в полулогарифмическом диапазоне: 1580, 500, 158 и 50,0 мкг/планшет. Были выбраны две далеко отстоящие друг от друга УФ-дозы для каждого испытуемого штамма бактерий на основании максимально допустимой основной дозы. Существенная токсичность не наблюдалась при любой концентрации испытуемого образца или при любой дозе УФ-излучения.
Были проведены два независимых эксперимента с использованием планшетного метода инкорпорации.
Испытуемый образец анализируют при максимальном уровне дозы 5000 мкг/планшет и при четырех пониженных уровнях дозы, выбранных с двукратными разбавлениями: 2500, 1250, 625 и 313 мкг/планшет. Подготовленные планшеты облучают следующими дозами УФА и УФВ (таблица 5):
Результаты
Испытуемый образец не вызывает двукратного увеличения числа ревертантных колоний по сравнению с фоновым УФ-эффектом при любом уровне дозы испытуемого образца, в любом испытуемом штамме, при любой дозе УФ-излучения. Выводы
Сделан вывод, что испытуемый образец не вызывает обратную мутацию в Salmonella typhimurium или Escherichia coli, когда обработка осуществляется в присутствии УФ-излучения.
Пример 13. Хромосомные аберрации в яйцеклетках китайского хомяка in vitro (анализ фотомутагенности)
Анализуют способность испытуемого образца вызывать хромосомное повреждение в яйцеклетках китайского хомяка после обработки in vitro в отсутствии и в присутствии УФА/УФВ излучения.
Один анализ хромосомного повреждения проводят при уровнях дозы 5000, 2500, 1250, 625, 313, 156, 78,1 и 39,1 мкг/мл, причем анализ осуществляют как в отсутствии, так и в присутствии ультрафиолетового излучения.
Препараты испытуемого образца были приготовлены в сбалансированном солевом растворе Хэнка (HBSS). Как в отсутствии, так и в присутствии УФ-излучения клетки обрабатывают в течение 3 часов и используют время сбора культуры 20 часов, что составляет приблизительно полтора клеточных цикла.
Эксперимент включает в себя соответствующий отрицательный и положительный контроль. Для каждой испытуемой точки готовят две клеточные культуры.
Уровни дозы для количественной оценки хромосомных аберраций были выбраны на основе цитотоксичности обработки испытуемым образцом, которую определяют по уменьшению числа клеток на момент сбора культуры.
Поскольку заметная токсичность не была отмечена во всем диапазоне дозировок, для количественной оценки были выбраны следующие уровни дозы: 5000, 2500 и 1250 мкг/мл как в отсутствии, так и в присутствие УФ-излучения.
Для хромосомных аберраций из каждой культуры количественно оценивают сто разрастаний метафазы.
Результаты
После обработки испытуемым образцом не наблюдается статистически значимое увеличение процента клеток, имеющих аберрации, включая или исключая промежутки, по сравнению с соответствующими контрольными значениями в отсутствии или в присутствии ультрафиолетового излучения.
Статистически значимое увеличение числа клеток, имеющих аберрации (включая или исключая промежутки), наблюдается после обработки положительными контрольными агентами - Митомицин-С и 8-Метоксипсорален, что указывает на правильную работу системы испытаний.
Выводы
На основе приведенных результатов сделан вывод, что в указанных экспериментальных условиях испытуемый образец не вызывает хромосомных аберраций в яйцеклетках китайского хомяка после обработки in vitro, при отсутствии или в присутствии УФ-излучения.
Пример 14. Анализ фототоксичности клеток Balb/C 3t3 (поглощение нейтрального красного)
Потенциальную фототоксичность in vitro испытуемого образца оценивают с помощью измерений поглощения нейтрального красного (краситель) для клеточной токсичности на культурах клеток Balb/c 3T3, которые обработаны различными дозами испытуемого образца и подвергнуты УФА облучению. Препараты испытуемого образца приготовлены с использованием сбалансированного солевого раствора Earle (EBSS).
Был выполнен предварительный поисковый эксперимент в диапазоне доз, в присутствии (+УФА) и в отсутствие (-УФА) облучения для того, чтобы выбрать подходящие уровни доз для основного анализа. Испытуемый образец анализировали при максимальном уровне дозы 1000 мкг/мл (верхний предел, указанный в протоколе исследования) и в широком диапазоне пониженного уровня дозы: 500, 250, 125, 62,5, 31,3, 15,6 и 7,81 мкг/мл. Поскольку значение IC50 нельзя рассчитать как в присутствии, так и в отсутствии УФА облучения, также нельзя рассчитать коэффициент фотораздражения (PIF). В этом случае полагают, что образец не является фототоксическим. Такой же диапазон доз используется для основного анализа.
Основной эксперимент осуществляют с использованием следующего уровня доз: 1000, 500, 250, 125, 62,5, 31,3, 15,6 и 7,81 мкг/мл. На кривых выживаемости в присутствии и при отсутствии УФ-излучения наблюдается аналогичный профиль, что подтверждает результаты, полученные в предварительном поисковом эксперименте в диапазоне доз. Значение коэффициента фотораздражения (PIF) нельзя рассчитать, так как отсутствуют значения IС50 для обоих кривых. Среднее значение фотоэффекта (МРЕ) составляет 0,089, что соответствует диапазону отсутствия фототоксичности.
Поскольку в этом эксперименте получены явно отрицательные результаты, дополнительные эксперименты не проводились.
Положительный контрольный агент Хлорпромазин вызывал приемлемый положительный отклик с величиной PIF 21,9, что указывает на правильную работу системы анализа.
В связи с невозможностью расчета PIF, или значение МРЕ<0,1 позволяет прогнозировать "отсутствие фототоксичности" на основе полученных результатов, сделан вывод, что испытуемый образец следует классифицировать как "нефототоксический" в указанных условиях эксперимента.
Пример 15. Исследование фотораздражения/фотосенсибилизации для испытуемого образца, 0,1%-й крем, на морских свинках
Потенциальную способность испытуемого образца (0,1%-й крем) вызывать фотоаллергические и/или фотораздражающие реакции после местного применения на коже, в связи с воздействием ультрафиолетового излучения, оценивают с использованием модели морской свинки.
Исследование подразделяется на две фазы.
На первой фазе проводится оценка фотораздражающих характеристик испытуемого образца в 6 группах животных. Эти характеристики используют как для обоснования подходящих концентраций испытуемого образца для применения в сенсибилизационном анализе, так и для получения информации о фотоиндуцированном раздражении. Животных обрабатывают следующим образом (таблица 6):
На второй фазе исследования проводится оценка сенсибилизации, где все 5 групп обрабатывают следующим образом (таблица 7):
Фотораздражение
Испытание фотораздражения проводят с использованием двух (облученных) групп, в каждой по 5 животных, обработанных контрольным кремом плацебо и кремом, содержащим 0,1% испытуемого образца (см. таблицу 6, группы 1 и 3) и двух групп аналогичного состава (см. таблицу 6, группы 2 и 4), в которых животных обрабатывают таким же образом, но не облучают. Аликвоты неразбавленного испытуемого или контрольного образца (100%) в двух концентрациях (20% и 50% очищенной воде) испытуемого и контрольного образцов и один носитель (очищенная вода) равномерно распределяют на определенных участках кожи, подготовленных на спине животных. В облученных группах (группы 1 и 3) животных подвергают облучению УФА (10 Дж/см2) и УФВ (0,1 Дж/см2) после введения дозы. Эталонное вещество положительного контроля, 8-метоксипсорален, исследуют, используя указанные методики в концентрациях 0,001%, 0,01% и 0,1%, на пяти испытуемых (облученных) и пяти контрольных (необлученных) животных (см. таблицу 6, группы 6 и 5 соответственно). Приблизительно через 1, 4, 24, 48 и 72 часа после воздействия на контрольный, испытуемый или эталонный образцы, обработанные участки обследуются на наличие реакции раздражения от обработки.
Результаты
Незначительное раздражение наблюдалось у одного из пяти животных на участках, обработанных кремом с 0,1% испытуемого образца и облученных УФ. У четырех из 5 животных на участках, обработанных испытуемым образцом, но не облученных УФ наблюдалось раздражение, от незначительного до вполне определенного.
Незначительная реакция наблюдалось также у одного из 5 животных, обработанных контрольным образцом (крем плацебо) не облученных УФ.
На участках, обработанных одним носителем, реакция не наблюдалась/
Реакция раздражения, наблюдаемая у животных, обработанных испытуемым образцом, не является фотоиндуцированной, так как она замечена у животных, облученных УФ, а также у необлученных животных (в большей степени).
Незначительная периодическая реакция наблюдалось также у необлученных животных, обработанных контрольным образцом.
У животных, обработанных веществом положительного контроля, 8-метоксипсораленом и затем подвергнутых ультрафиолетовому излучению, наблюдалась эритема, от вполне определенной до умеренной, и слабый отек на участках, обработанных двумя более высокими исследованными концентрациями, 0,01% и 0,1%. У животных, обработанных 8-метоксипсораленом без последующего воздействия ультрафиолетового излучения, реакция не наблюдалась, таким образом, продемонстрировано, что наблюдаемый отклик был фотоиндуцируемым.
Фотосенсибилизация
Испытание фотосенсибилизации проводили с использованием двух групп из 10 животных (см. таблицу 7, группы 8 и 9), индуцированных контрольным образцом и испытуемым образцом, и одной контрольной группы из 10 животных (см. таблицу 7, группа 7), индуцированных выбранным носителем (очищенная вода). При попытке индуцировать сенсибилизацию животным внутрикожно вводили эмульсию полного адъюванта Freund. Испытуемый и контрольный образцы в концентрации 100% локально наносили на поверхность вокруг места инъекции стимулятора, всего 6 раз в течение двухнедельного периода. После нанесения дозы животных облучали как УФА (10 Дж/см2), так и УФВ (0,1 Дж/см2) излучением. Контрольную группу животных обрабатывали таким же образом, но использовали выбранный носитель (очищенная вода) вместо испытуемого или контрольного образца. Приблизительно через 2 недели после окончательного индуцирующего воздействия животные были стимулированы путем нанесения носителя, а также испытуемого или контрольного образца в концентрациях 20% и 50% соответственно. Указанные концентрации были выбраны, поскольку считается, что они не раздражают кожу в сочетании с ультрафиолетовым облучением, на основе результатов, полученных при испытании фотораздражения. Животных из двух испытуемых групп и контрольную группу подвергают воздействию УФА (10 Дж/см2) и УФВ (0,1 Дж/см2) излучения после внесения дозы. Каждому животному локально обрабатывали дополнительные участки кожи носителем, а также испытуемым или контрольным образцом, однако после обработки животных не подвергали воздействию ультрафиолетового облучения. Приблизительно через 24, 48 и 72 часа после стимулирующего воздействия обработанные участки обследуются на наличие реакции раздражения от обработки.
Положительный контроль, эталонный образец, Musk Ambrette, был исследован с использованием такого же метода для того, чтобы доказать применимость системы испытаний. Одну группу из 5 животных (см. таблицу 7, группа 11) индуцировали указанным веществом в концентрации 15% в ацетоне. Контрольную группу из 3 животных (см. таблицу 7, группа 10) обрабатывали таким же образом, одним носителем (ацетон). Для стимулирования была выбрана концентрация 10% эталонного образца (Musk Ambrette) в ацетоне.
Результаты
Стимулирование контрольным образцом, кремом плацебо, при концентрации 50% с последующим ультрафиолетовым облучением приводит к отклику на контрольный образец у всех 10 животных группы (группа 8). Отклик на контрольный образец наблюдался у шести из 10 животных группы 8 на обработанных, но не облученных участках. Кроме того, наблюдалась реакция у 5 из 5 животных контрольной группы (группа 7) на участках, обработанных при стимулировании контрольным образцом, с последующим ультрафиолетовым облучением и у 4 из 5 животных контрольной группы на участках, обработанных контрольным образцом, но не облученных. Реакция на один носитель не наблюдалась.
Стимулирование испытуемым образцом (0,1%-ный крем при концентрации 20%) с последующим ультрафиолетовым облучением приводило к отклику на испытуемый образец у 8 из 10 животных этой группы (группа 9). Реакция на испытуемый образец не наблюдалась у животных из группы 9 на участках, обработанных, но не облученных. Кроме того, наблюдалась реакция у 5 из 5 животных контрольной группы (группа 7) на участках, обработанных при стимулировании испытуемым образцом, с последующим ультрафиолетовым облучением и у 1 из 5 животных контрольной группы на участках, обработанных испытуемым образцом, но не облученных. Реакция на один носитель не наблюдалась.
На основании приведенных выше результатов ясно, что отклик наблюдается у животных, обработанных или испытуемым, или контрольным образцом. Реакция, которая наблюдается у животных из контрольной группы (не индуцированных испытуемым образцом), скорее вызвана раздражающим действием вещества, чем сенсибилизацией. Кроме того, реакция также наблюдается на участках, не облученных УФ.
В результате проводят второе стимулирование (повторное стимулирование) испытуемым и контрольным образцом при пониженной концентрации 5%.
Отклик не наблюдается у любых животных из групп 8 и 9 при повторном стимулировании испытуемым и контрольным образцом при концентрации 5% с последующим ультрафиолетовым облучением. Отклик на испытуемый или контрольный образец не наблюдается у животных из групп 8 или 9 на обработанных, но не облученных участках. Реакция не наблюдается на любых участках у животных из контрольной группы (группа 7), обработанных при стимулировании испытуемым и контрольным образцом. Реакция на один носитель не наблюдалась.
Стимулирование животных положительного контроля эталонным образцом (Musk Ambrette) при концентрации 10% с последующим ультрафиолетовым облучением, дает отклик (эритема от очень слабой до незначительной) у 4 из 5 животных этой группы (группа 11). Отклик на эталонный образец не наблюдается у животных из группы 11 на обработанных, но не облученных участках. Отклик на эталонный образец не наблюдается у животных из группы 10, индуцированных носителем. Это показывает, что система испытаний способна детектировать фотоаллергические характеристики веществ.
Выводы
Из полученных результатов следует, что испытуемый образец - 0,1%-ный крем - не может вызывать фотораздражение или фотоаллергическую реакцию после воздействия на кожу в сочетании с ультрафиолетовым излучением.
Реферат
Изобретение относится к способу получения полимерного конъюгата индолокарбазольного соединения формулы (I), где R, R, R, Wи Wпредставляют собой водород, Х представляет собой метокси-полиэтиленгликоль. Способ включает взаимодействие полимерного соединения формулы (II) с индолокарбазольным соединением формулы (III), где Y означает метоксигруппу. Также изобретение относится к полимерному конъюгату формулы (I), фармацевтической композиции, содержащей в качестве активного ингредиента конъюгат формулы (I), и к применению полимерного конъюгата формулы (I). Технический результат - получение полимерного конъюгата формулы (I) с высоким выходом, полимерный конъюгат формулы (I) для лечения кожных патологий и патологий, связанных с HMGB1. 9 н. и 39 з.п. ф-лы, 7 ил., 7 табл., 15 пр.
Формула
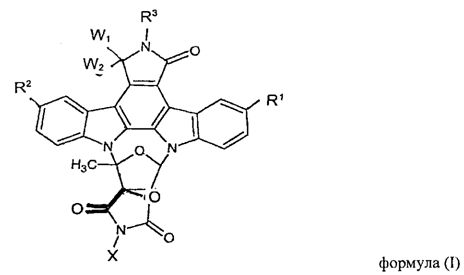
где
R1 и R2 являются одинаковыми и представляют собой атомы водорода, и
R3 означает водород, и
W1 и W2 означают водород, и
где X представляет собой метокси-полиэтиленгликоль (мПЭГ),
который включает взаимодействие ω-1H-имидазол-карбоксамидного полимерного соединения общей формулы (II)
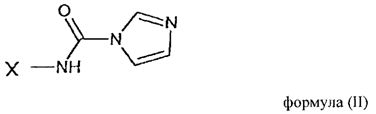
в которой X имеет указанное выше значение,
с индолокарбазольным соединением общей формулы (III)
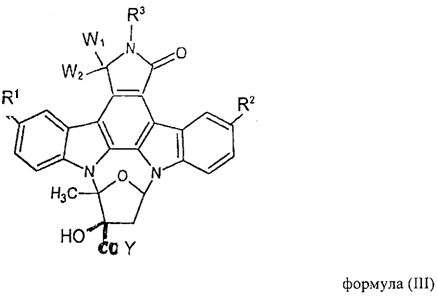
где R1, R2, R3, W1 и W2 имеют указанные выше значения и где Y означает отщепляемую группу, выбираемую из метоксигруппы.

где R1, R2, R3, W1, W2 и X являются такими, как определено в п.1 или пп.17-23, или его фармацевтически приемлемая соль.

Комментарии