Изобретение относится, к способу получения новых производных бензо иазепина
, обладающих ценными фармакологическими свойствами.
Цель изобретения - получение новых , полезных соединений, расширяющих арсенал средств воздействия на
живой организм путем синтеза последних , основанного иа известных реакциях
нитрозирования, восстановления ацилирования fl.
Поставленная цель достигается
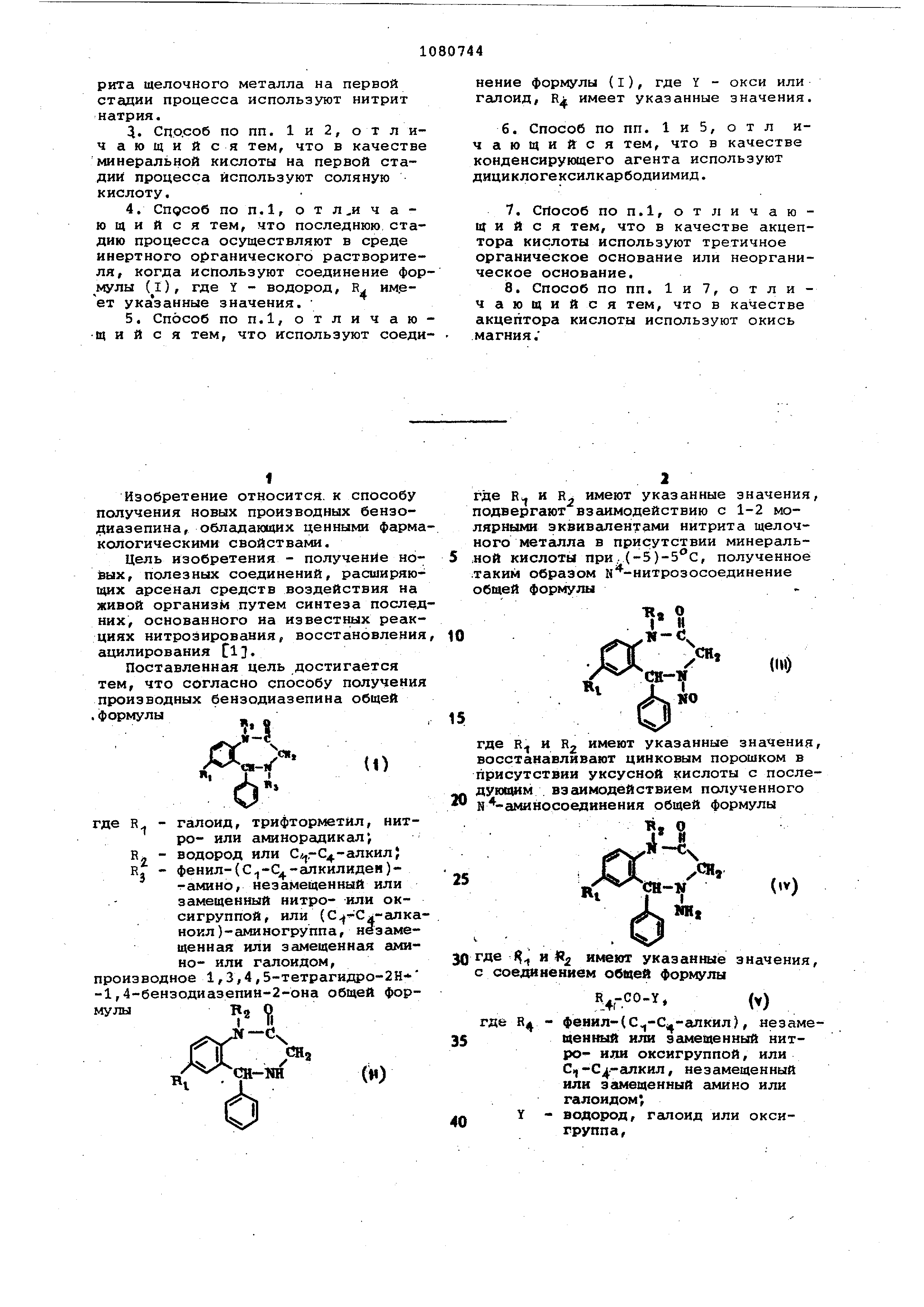
тем, что согласно способу получения производных бензодиазепина общей .формулы ж о
Л
U)
6
- галоид, трифторметйл, нитR ,
ро- или аминорадикал,
R - водород или Сл,,-С4-алкил; R. - фенил-СС -С -алкилиден)тамино , незамещенный или
замещенный нитро- или оксигруппой , или (С Сл-алканоил )-аминогруппа , не замещенная
или замещенная амино- или галоидом,
зводное 1,3,4,5-тетрагидро-2Н
-бензодиазепин-2-она общей форВ О I (1
-е
сн
3
(И)
CH-NH
где R и R имеют указанные значения, подвергают взаимодействию с 1-2 молярными
эквивалентами нитрита щелочного мет аипл а в присутствии минеральной кислоты при, (-5), полученное
таким образом к -нитрозосоединение общей формулы
((И)
где R и R2 имеют указанные значения, восстанавливают цинковым порошком в
присутствии уксусной кислоты с последующим взаимодействием полученного
Ы -аминосоединения общей формулы
-К,
(,у)
0 где f и « имеют указанные значения, с соединением общей формулы
.о.у. (V)
где R - фенил-((,-апкил), незамещенный или замещенный нитро-
или оксигруппой, или С,|-С -алкил, незамещенный или замещенный амино или
галоидом,
Y - водород, галоид или оксигруппа . в случае необходимости в присутствии конденсирующего агента или акцептора
кислоты. . Все соединения, полученные предлагаемым способом, являются новыми
Прямое нитрозирование соединений , Которые отвечают общей формуле (II), проводят обычно с использо
ванием нитрита натрия в присутствии минеральной кислоты. В качестве кислоты предпочтитель
но использование соляной кислоты. Согласно способу соединения общей формулы (II) суспендируют в
концентрированной соляной кислоте, по каплям добавляют в суспензию вод
ный раствор нитрита натрия при температуре приблизительно 0°С и после
завершения реакции смесь подщелачивают . Таким образом получают соотве ствующие соединения общей формулы
(III), где значения каждого из символов R и R идентичны изложенным
. Реакционную смесь можно подщелачивать любым сильным основанием, в частности водным раствором гидрата
окиси щелочного металла, напри мер гидрата окиси калия, однако для этого предпочтительно использовать
концентрированный раствор; амми ка. Нейтрализацию смесь предпочтительно проводить при интенсивном
охлаждении.. . Реакцию восстановления осуществляют следующим образом.
N -нитрозотетрагидро-1,4-бензодиазёпиновое производное общей формулы (III) суспендируют в уксусной
кислоте, а затем в перемешиваемую суспензию небольшими порциями добавляют порошкообразньлй цинк. В
ходе проведения этой операции смесь охлаждают водой. После завершения
реакции смесь подщелачивают с вьщелением полученного продукта общей (IV).
в соответствии с предпочтительным вариантом осуществления последней
стадии данного способа Н -аминотетрагидро-1 ,4-бензодиазепиновое производное общей формулы (IV) раст
воряют в инертном органическом раст ворителе, в частности в бензоле,
и в раствор добавляют альдегид общей формулы (v), где значения символа Rj( идентичны определенным выше
, после чего смесь перемеигаваюг при комнатной температуре в течение ночи. . . - ; ; -, . .
Если соединение общей форк1ул1Ы (V где символом Y обозначен гидрбксил
используют в качестве исходного вёщества , .для повьаиения скорости протекания
или полного завершения реак ции в реакционную смесь можно добавить обычный конденсирующий агент,
в частности дициклогексилкарбодиимид . Исходные вещества предпочтительно
использовать приблизительно в эквимолярных количествах. Конденсационный агент предпочтительно добавлять
в 5-15%-ном. избытке. Если в качестве .ацилирующего: агента исйользуют соё;Ьгинение общей
формулы- (V), где символом У обозначен атом галогена, для повышения скорости протекания или завершения
реакции в смесь можно добавлять связывающий кислоту агент, например окись щелочноземельного элемента,
в частности окись магния. Однако если индивидуальные компоненты оказываются, достаточно реакционными
, описанная реакция протекает с приемлемой скоростью даже без использования конденсирующего или
связывающего кислоту агента. Любое из соединений, которое отвечает общей формуле (I), где значения
каждого из символов R и R идентичны определенным, а символом R обозначен водородный атом, можно
алкилировать, если это желательно, с получением соответствующих гшкильных
производных. В ходе проведения этой реакции можно использовать обычные
алкилнрующие агенты, в частности алкилгалогеннды, предпочтительно алкилиодиды, или дналкилсульфаты.
Процесс можно проводить, в частности , вначале путем конверсии соедиг
нения общей формулы (I) в его производное щелочного металла, а затем
путем реакции полученного таким обраг зом производного щелочного металла
с соответствующим алкилирующим агентом . Произвсъаное щелочного металла
можно получить, например, реакцией соответствующего соединения общей формулы fl), где R - водородный
атом, а значения каждого из символов R, и Н,. идентичны определенным вьхае,
со щелочным металлом, гидридом щелочного металла или .гмидом щелочного
металла, в частности с натрием или С соединением натрия, при температуре от О до в среде инертного
растворителя, в частности диоксана дИметилформёЦхшда, , бензола или толуола .
Реакционные смеси можно подверг гать обработке способами, известными
в данной области технологии. Выбор конкретного спо.соба пррведения
процесса зависит art природы исходного вещества, конечного продукта и
растворителя. Когда продукт выделяют из реакционной смеси, ее .просто фильтруют, причем в этой случае
продукт остается в растворе, после чего продукт можно высадить соотвеТствукш|им
растворителем или .же выпарить раствор после удаления твердых побочных продуктов.
В .ходе проведения процесса обработки реакционной смеси конечный
продукт обычно получают в кристалли ческой форме. Однако если получают маслянистое вещество, его можно
подвергать кристаллизации обычно без каких- либо затруднений с использованием обычных .растворителей,
например алифатических или цикли- . ческих простых эфиров, в частности
диэтилового э.фира, диоксана, тетрагидрофурана и т.д. При необходимости соединения общей
формулы (I), где значения символов R, R и Rj идентичны определенным , можно подвергать дополнител
ной очистительной обработке, в част ности перекристаллизацией. 3 качест ве растворителя для перекристаллиза
ции можно использовать, например, алифатический спирт, в частности метанол или этанол, ароматический
углеводород, в частности бензол, кетон, в частности ацетон, сложныйалифатический эфир, в частности
алканкарбоксилат, в особенности этилацетат, алифатический углеводород , в особенности насыщенный алифа
тический углеводород с 5-10 углерод ными атомами, в частности н-гексан,
простой эфир, в особенности дигшкиловый эфир, в частности диэтиловый
эфир, насыщенный циклический простой эфир, в частности тетрагидрофуран , а также ацетонитрил и их смеси
(например, смесь тетparидрофурана с гексаном или смесь этилацетата с простым эфиром).
Осуществление предлагаемогоспотсоба позволяет получать соедщнения
общей формулы (I) с достижением высоког .о выхода конечного продукта и
в легко идентифицированном состоянии . Данные элементарного анализа
полученных веществ хорошо согласуются с расчетными величинами. Новые тетрагидро-1,4-бензодиаэепиновые производные общей формулы (1) показывают энзиминдицирующие
эффекты и оказывают лишь умеренное воздействие на центральную нервную. систему.;
Энзиминдуцирующее действие данных новых соединений проверяли в условиях ин виво путем определения
активности гексабарбиталоксидазы . Активнодействующие веществ общей формулы (I) вводили в организм
больных крыс Wistar, вес которых находился в интервале от 50 до 60 г,
через рот в дозировке 40 мг/кг живого веса. Эффективность проявлялась по истечении 24 ч после введения
энзиминдицирующйх веществ. В это время определили степень инактивации гексабарбитала путем внутреннего
введения в дозировке 40 мг/кг живого веса гексабарбитала натрия и определения времени, прошедшего
с момента введени и до вторичного появления рефлекса выпрямления.
Продолжительност сна, которую наблюдали у животных; использованных в опытах по введению в их организм
новых соединений, сопоставили с той, которую наблюдали у контрольной
группы животных (в организм животных этой контрольной группы ввели только вещество наполнителя или
носителя) . По истечении 24 ч после введения в организм энзиминдицирукяцих веществ
ииактивация ин виво гексабарбитала ускоряется, что подтверждается сокращением продолжительности
сна. Результаты были выргикены в процентной разнице по сравнению с контрольным опытом. На основании
предварительных экспериментов разницу , которая превьаиала 25%, рассмат{жвали
как биологически заметную. . Результаты испытаний сведены та табл. i.
Таблица 1 Биологический период полуинактивации
гексабарбитала определили путем УФ-спектрофотометрии . Результаты испытания, которое провели
с использованием соединения, полученного в соответствии с пряма ром 5 (самый активный представител
новых соединений в соответствии с изобретением) сведены в табл. 2. Из оценки данных табл. 2 совершенн
очевидно, что соединение, полученное в соответствии с примером 5,
эффективно сокращает период полуинактивации гексабарбитала в орга низме крыс.
Т а блиц а йериод полуинактив Вещество ции , мин
Контрольный опыт По примеру 5
Степень чистоты полученных веществ определяли путем тонкослойного хроматографического ангшиза.
Величины R определилис примене нием силикагелевой пластины типа , Шталь С (фирма Мерк), а в качестве
растворителя для элюирования использовали, одну из следующих систем: смесь и-гексана с уксусной кис
лотой и хлороформом в соотношении 1:1:8 (1), смесь бензола с метанолом в соотношении 95:5 (2), смесь
хлороформа с метанолом и уксусной кислотой в соотношении 75:20:5 (3) смесь н-гексана с этилацетатом и
хлороформом в соотношении 1:4:8 (4 смесь н-бутанола с уксусной кислотой и водой в соотношении 4:1:1 (5
Пятна проявляли путем осуществления хлортолидиновой технологии. Темпера
гуру плавления определяли в приборе типа д-ра Тотолли (температура плав
ления приведена в примерах в некорректированных величинах).В некоторых примерах строение молекул конеч
ных продуктов идентифицировали с помощью спектрометрии УФ, ЯМР или , масс-спектрометрии.
Пример 1. 1-Метил-4-нитрозо-5-фенил-7-хлор-1 ,3,5-тетрагидро-2Н-1 ,4-§ензодиазепин-2-он.
16,0 г (55,6 моль) 1-метил-5-феНШ1-7-ХЛОР-1 ,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепин-2-она суспендируют
в 56 мл концентрированной соля ной кислоты. Эту суспензию охлаждают до температуры и по каплям
добавляют в нее раствор 3,9 г (55,6 ммоль) нитрита натрия в 20 мл воды. Смесь перемешивают при ОС
в течение 2 ч, после чего по аналогии с вышеизложенным в нее добавляют
дополнительно 3,9 г (55,6 ммоль) нитрита натрия. После завершения
реакции суспензию нейтрализуют концентрированным водньгм раствором аммиака . При интенсивном охлаждении
осторожно добавляют щелочной раствор. Выделенный сырой продукт отфильтровывают
, промывают водой и перекристаллизовывают из этанола. Получают
15,6 г (88,6%) 1-метил-4-нитрозо-5-фенил-7-ХЛОР-1 ,3,4,5-тетрагидро-2Н-1 ,4-бензодйазепин-2-она.
Т.пл. 180-182 с, R/,8. Вычислено,%: С 60,8, Н 4,5, N 13,3..
С К ( MB 315,76) Найдено,: С 60,8, Н 4,7, N 13,3. Аналогичным образом из соответствующих
исходных продуктов получают соединение по примеру 2. Пример2. 4-Нитрозо-5-фенил-1
,3,4,5-тетрагидро-2Н-1,4-бензодиазепин-2-он . Выход 80,5%. Т.пл. 211-212 с
(после-151ерекристаллизации из эта.нола ), ,75. Вычислено,%: С57,7, Н3,9,
N 17,95 С.5 1 2N404 (MB 312,29) Найдено,%: С 57,6, Н 4,4, N 17,95
Пример 3. 1-Метил-4-амин-З-фенил-7-хлор 1,3,4,5-тетрагидро-2Н -1,4-бензодиазепин-2-он,
30 г цинковой пыли добавляют в суспензию 9,0 г (28,4 ммоль) 1-метил-4-нитрозо-5-фенил-7-хлор-1
,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепин-2-она в 60 мл уксусной кислоты при
охлаждении водой и перемешивании. В процессе этого добавления твердый
материал растворяют постепенно. По истечении 15 мин перемешивания цинковую
пыль отфильтровывают и .фильтрат нейтрализуют водным насыщенным
раствором бикарбоната натрия. Выделенное вещество, фильтрование которого
сопряжено со значительными затруднениями , экстрагируют несколькими порциями хлороформа. Хлороформный
раствор сушат и выпаривают до конечного объема приблизительно 16 мл. В концентрат добавляют 30 мл
2 н. раствбра соляной кислоты и смес оставляют на неЬколько минут.
Отделившиеся примеси отфТсльтровывают , а полученный двухфазный фильтрат
нейтрализуют насыщенным водным paci BopoM бикарбоната -натрия. Хлороформную
фазу отделяют, а водную фазу подвергают экстрагированию двумя
порциями по 100 мл хлороформа. Органические фазы объединяют, сушат и выпаривают до сухого состояния
при пониженном давлении. Маслянистый остаток кристаллизуют из изопропанола с получением 5,1 г (59,3%) 1-метил-4-амин-5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1,4-бензодиаэепин-2-она
. Т,пл. 147-148Ь, С П и , 1Э , . Вычислено,: С 63,6, Н 5,3,
N 13,9. С-,ьН :, ONj С1 (MB 301,79) Найдено,: С 63,7, Н 5,6, N 14,
Аналогичным образом из соответс вунадих исходных веществ получают следующее соединение.
Пример 4. 4,7-Диамин-5-фе нил-1,3,4,5-тетрагидро-2Н-1,4-бензоазепин-2-он .
Выход 56,6%.-Т.пл. 218-221 С (после перекристаллизации из ацето нитрила), , 4.
Вычислено,%: С 67,1, Н 6,0, N 20,9 (MB 268,33)
Найдено,%: С 66,8, Н 6,3, N 20, П р и м е р 5. 1-Метил-4-бенза
амин-5-фенил-7-хлор-1,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепин-2-он. 1 МП (9,1 ммоль) бензальдегида
добавляют в раствор 2,0 г (6,6 ммо 1-метил-4-с1МИн-5-фенил-7-хлор-1 3,4,5-тетрагидро-2Н-1,4-бензоди
азепин-2-она в 20 мл бензола и сме перемешивают при комнатной темпера
туре в течение ночи. В конце реакции смесь выпаривают до сухого состояния при пониженном давлении,
ост.аток растирают в порошок с испо зованием 20 мл серного эфира/ а твердое вещество отфильтровывают.
Получают 2,1 г (80,7%) 1-метил-4-бензальамино-5-фенил-7-хлор-1 ,3,4
-тетрагидро-2Н-1,4 бензодиазепин-2-она . Т.пл. 157-158 С (после перекристаллизации из этанола),
Вычислено,%: С 7078, Н 5,2, И 10,8. CgjH gONjCl (MB 389,89)
Найдено,: С 70,8, Н 5,35, N10 Аналогичным образом из соответствующих исходных веществ получают
следующие соединения. П р и м е р 6. 1-Метил-4-(о-хл бензиламино)-5-фенил-7-хлор-1 ,.3,4,
-тетрагидро-2Н-1,4-бензодиазепин-2-он .. Выход 91,2%, Т.пл. 185-187 С
(после перекристаллизации из этано ла), R,7. Вычислено,%: С 65,1, Н 4,5,
N . ,Cl2(MB 424,34) Найдено,: С 65,0, Н 4,9, N 9,8
Пример 7. 1-Метил-4-(н-ни робеН3альамин)-5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1,4-бензоди
азепин-2-он. . Выход 87,9%, Т.пл. 202-204 С (после перекристаллизации из этг1но
ла), К|0,65. Вычислено,%: С 63,6, Н 4,4, N 12,75
(MB 434,89) Найдено,%: С 63,3, Н 4,4, Н 12,3. П р и м е р 8. 1-Метил-4-(м-нитробензальамино
)-5-Фенил-7-хлор-1 ,3,4,5-тётрагидро-2Н-1,4-бензодиазепин-2-он .
Выход 93,5%, Т..ПЛ. 224-226 С (после перекристаллизации из этанола ), ,65.
Вычислено,%: С 63,6, Н 4,4, N 12,75 (MB 434,89)
Найдено,%: С 63,4, Н 4,4, N 12,6 - V ,., П р-и м е р 9. 1-Метил-1-(о-нитробензальамини
)5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1,4-бензодиазепин-2-он .
выход 90,2%, Т.пл. 187-188 С ( после перекристаллизации из этанола ), Rfp-0,7.
Вычислено,%: С 63,6, Н 4,4, Н 12,75 C2,H.O,N4.C1 (MB 434,89)
Найдено;%: С 63,6, Н 4,7, N 12,2 Пример 10. 1-Метил-4-(п-оксибензальамино )-5-фенил-7-хлор-1/3
,4,5-тетрагидрЬ-2Н-1,4-бензодиазепин-2-он . Выход 89,5%, Т.пл. 135-137 0
(после перекристёшлизации из бензола ), iff 0,5. Вычислено,%1 С 68,06, Н 4,95,
N 10,3 , CjjHjoOiNjCl (MB 405,89) Найдено,%: С 68,3, Н 5,0, N 10,2
Пример 11. 1-Метил-4-глициламино-5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепин-2-он
. 4,2 г (0,02 моль) бензилоксикарбоннлглицина и 4,0 г (0,02 моль)
дициклогексилкарбодиимида добавляют в раствор 6,0 г (0,02 моль) 1-метил-4-амин-5-фенил-7-хлор-1
,3,4,5-тетраг1адро-2Н-1 ,4-бензодиазепин-2-она в 200 мл этилацетата. Реакционную
смесь перемешивают при комнатной xeikBiepaxj pe в течение ночи,
после чего вьэделившуюся дициклогексилмоче 9ииу отфильтровывают и фильтрат выпаривают при пониженном
давлении. Остаток смешивают с ацетонитрилом , растдор кипятят, выделившуюся
дйцикяогексил14очевину отфильтровывают из горячего раствора и фильтрату дают остыть. Вьщелишаийся
СЕфой продукт отфил&тровывают и кристаллизуют ИЗ этанола. Получают
7,1 г (72%) 1-мвтил-4(н-бензилоксикарбонилглициламин )-5-феиил-7-хлор-1
,3,4,5-твтрагидро-2Н-1,4 бензодиазепин-2-она . Т.пл. 184-190 с, .З.
Вычислено,%: С 63,3, Н 5,1, N 11., 4
26 25 4Ч (MB 492,95) Найдено,%: С 63,6, Н 4,8, N 11,4 Смесь 4,6 г (9,35 ммоль) упомянутого
продукта с 25 мл. 3 н.бромистоводородной кислоты в ледяной уксусной кислоте перемешивают в течение
0,5 ч без доступа воздуха, после чего в этот раствор добавляют 100 МП сухого эфира. Зьщелившееся
вещество отфильтровывают и промывают сухим серным эфиром. 4,78 г полученного
таким образом 1 метил-4-глициламино-5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепина-2-он
гидробромида суспендируют в 20 мл воды, после чего величину рН этой смеси доводят до 9-10 добавлением
концентрированного водного раствора аммиака. Эту водную суспензию насыщают хлористым натрием и
подвергают экстрагированию 3 -порциями по 100 мл хлороформа. Хлороформный раствор сушат, выпаривают
до сухого состояния при пониженном давлении и остаток перекристаллизовывают из этилацетата. Получают
2,6 г (76,4%) 1-метил-4-глициламин-5-ф ,енил-7-хлор-1,3,4 ,5-тетрагидро-2Н-1
,4-бензодиазепин-2-она. Т.пл. .173-175«С, ,35.
Вычислено,%: С 60,2, Н 5,3,
N 15,6
C.AH.gO-N.Cl (МБ 358,82) Найдено,%: С 60,1, Н 5,6, N 15,6
Пример 12. 1-Метил-4-хлорацетамини-5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепин-2-он
.
3 г окиси магния добавляют в
раствор 3,0 г (0,01 моль) 1-метил-4-амино-5-фенил-7-хлор-1 ,3,4,5-тетрагид1 о-1
,4-бензодиазепин-2-она в 30 МП хлороформа и в перемещиваемую смесь по каплям добавляют раствор
0,82 мл хлорацетилхлорида в 4 мл хлороформа. По истечении 2 ч перемешивания добавляют раствор
0,3--мл хлорацетилхлорида в 2 мл хлороформа , после чего смесь перемешивают при комнатной температуре в
0 течение ночи. Соль магния отфильтровывают и промывают хлороформом.
Фильтрат и промывную жидкость ос ъединяют , промывают 20 мл воды, сушат
и выпаривают растворитель. Получают 3,5 г (92,5%) белого кристалличес5 кого остатка. Т.пл. 226-228 С. Этот сырой продукт перекристаллизовываиот
из ацетонитрила с получением очищенного 1-метил-4-хлорацетиламино0
5-фенил-7-хлор-1,3,4,5-тетрагидро-2Н-1 ,4-бензрдиазепин-2-она. Т.пл. 227-229 с., RfPo,3.
Зычислено,%: С 57,2, Н 4,5, N 11,1
5 С.дН.-02НзС1 (MB 378,25)
Найдено,%: С 57,1, Н 4,4, N 11,2
Аналогичным образом из соответствующих
исходных продуктов получают д следующее соединение.
Пример 13. 1-Метил-4-ацетиламино-5-фенил-7-хлор-1 ,3,4,5-тетрагидро-2Н-1 ,4-бензодиазепин-2-он
.
Выход 74,5%, Т.пл. 198-20бс (после перекристаллизации из ацетонитрила
), Кфо,25.
Вычислена,%; С 62,9, Н 5,3, N 12,2
C gH -O-N-Cl (MB. 343,81) 0 .Найдено;%: С 62,5, Н 4,6, N 11,65.







Комментарии