Способы получения 1,5,7-триазабицикло[4.4.0]-дец-5-eha по реакции дизамещённого карбодиимида и дипропилентриамина - RU2600741C2
Код документа: RU2600741C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена.
Уровень техники изобретения
Известно, что бициклические гуанидины, такие как 1,5,7-триазабицикло-[4.4.0]-дец-5-ен (ТБД), являются химически активными и могут использоваться для каталитического активирования широкого круга химических реакций. Важное соображение в отношении промышленного применения бициклических гуанидинов в качестве катализатора (для любой реакции) заключается в том, что бициклические гуанидины являются относительно недорогими в закупке и/или легкими для получения.
Однако опубликованные способы осуществления синтеза бициклических гуанидинов часто осложнены, например, применением многостадийного и/или времязатратного процесса синтеза. В других способах используют чрезмерно дорогостоящие и/или опасные исходные вещества. Кроме того, во многих из опубликованных способов не достигаются высокие выходы желаемых продуктов или образуются побочные продукты, такие как анилин, которые трудно отделять от бициклических гуанидинов и которые сами по себе могут быть опасными. К тому же во многих из указанных способов получаются бициклические гуанидины различных типов, которые может быть трудно отделять друг от друга, и/или образуются бициклические гуанидины в формах, с которыми трудно выполнять операции.
Следовательно, существует необходимость в безопасных и эффективных способах получения бициклических гуанидинов.
Раскрытие изобретения
Настоящее изобретение относится к способу получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена, включающему в себя следующее: формируют смесь, содержащую дизамещенный карбодиимид, дипропилентриамин, а также растворитель на основе простого эфира и/или спирт; и нагревают смесь с целью обеспечения условий для взаимодействия дизамещенного карбодиимида с дипропилентриамином.
Настоящее изобретение дополнительно относится к способам получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена, включающим в себя следующее: формируют смесь, содержащую дизамещенный карбодиимид и дипропилентриамин; и нагревают смесь с целью создания условий для взаимодействия дизамещенного карбодиимида с дипропилентриамином.
Осуществление изобретения
Настоящее изобретение относится к способам получения бициклических гуанидинов. Более конкретно, настоящее изобретение относится к способам получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена, включающим в себя взаимодействие дизамещенного карбодиимида с дипропилентриамином («ДПТА»), также известным как бис-(3-аминопропил)амин.
Используемый в настоящем документе термин «дизамещенные карбодиимиды» относится к соединению, имеющему формулу RN=C=NR1, в которой R и R1 независимо содержат алкильную группу, арильную группу или их смеси. R и R1 могут быть одинаковыми или различными. В некоторых вариантах осуществления изобретения дизамещенный карбодиимид заключает в себе диалкилкарбодиимид, а группа R/R1 представляет собой алифатическую и/или циклоалифатическую алкильную группу, имеющую, например, от 1 до 10 атомов углерода; конкретно, подходящие диалкилкарбодиимиды включают в себя, без ограничения, N,N'-диизопропилкарбодиимид (ДИК) (т.е. если R/R1 представляет собой изопропильную группу); N,N'-дициклогексилкарбодиимид (ДЦК) (т.е. если R/R1 представляет собой циклогексильную группу); N,N'-ди-трет-бутилкарбодиимид (в котором R/R1 представляет собой трет-бутильную группу) и их любые сочетания.
В определенных вариантах осуществления изобретения дизамещенный карбодиимид заключает в себе диарилкарбодиимид, а группа R/R1 является арильной группой. Особенно подходящим диарилкарбодиимидом является N,N'-ди-п-толилкарбодиимид (в котором R/R1 представляет собой толуольный остаток). В некоторых вариантах осуществления используют сочетания одного или нескольких диалкилкарбодиимидов и/или одного или нескольких диарилкарбодиимидов.
В некоторых вариантах осуществления изобретения способ получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена сначала включает в себя растворение дизамещенного карбодиимида в растворителе на основе простого эфира и/или в спирте до взаимодействия дизамещенного карбодиимида с ДПТА. Указанные варианты осуществления изобретения в настоящем документе иногда называют «способом с применением растворителя». В альтернативных вариантах осуществления, обсуждаемых далее ниже, в способах получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена не используют растворитель на основе простого эфира или спирт, и в настоящем документе их иногда называют «способом без применения растворителя».
В общем случае «способ с применением растворителя» начинается с растворения дизамещенного карбодиимида в растворителе на основе простого эфира и/или в спирте. Далее к растворенному дизамещенному карбодиимиду добавляют дипропилентриамин. В определенных вариантах осуществления изобретения смесь дизамещенного карбодиимида и растворителя и/или спирта нагревают, например, до температуры 60°С перед добавлением ДПТА, а в некоторых вариантах осуществления изобретения смесь нагревают примерно до 60°С после добавления ДПТА. После этого смесь дополнительно нагревают до повышенной температуры и выдерживают в течение периода времени, достаточного для взаимодействия дизамещенного карбодиимида и дипропилентриамина, вначале с образованием промежуточного продукта (в общем случае, N,N'-дизамещенного моноциклического гуанидина), а затем с образованием 1,5,7-триазабицикло-[4.4.0]дец-5-ена и амина. Строение амина, образующегося в результате осуществления взаимодействия дизамещенного карбодиимида и дипропилентриамина, зависит от групп R/R1. Например, амин будет изопропиламином, если R/R1 является изопропильной группой, или циклогексиламином, если R/R1 представляет собой циклогексильную группу. Данный побочный аминопродукт можно отгонять в ходе протекания реакции, так что все, что остается в реакционной емкости с 1,5,7-триазабицикло-[4.4.0]-дец-5-еном по завершении реакции, представляет собой растворитель на основе простого эфира и/или спирт. В качестве альтернативы, побочный аминовый продукт можно удалять по завершении реакции.
Подходящие растворители на основе простого эфира, которые можно использовать в способе с применением растворителя настоящего изобретения, включают в себя бутилкарбитолформаль, но не ограничиваются им.
Подходящие спирты (т.е. спиртовые растворители), которые можно использовать в способе с применением растворителя настоящего изобретения, включают в себя моноспирты или полиолы, такие как 2-бутоксиэтанол (т.е. бутилцеллозольв), монобутиловый эфир диэтиленгликоля (т.е. бутилкарбитол), полиол гексаэтоксилированный бисфенол А и их сочетания, но не ограничиваются ими. В некоторых вариантах осуществления изобретения используют 2-бутоксиэтанол.
В общем случае способ настоящего изобретения без применения растворителя начинается с введения дизамещенного карбодиимида в реакционную емкость. После этого дипропилентриамин медленно добавляют в реакционную емкость, в которой образовавшаяся смесь начинает реагировать и выделять тепло. Затем смесь нагревают до повышенной температуры и выдерживают в течение периода времени, достаточного для взаимодействия дизамещенного карбодиимида и дипропилентриамина, при этом сначала образуется промежуточный продукт, а затем 1,5,7-триазабицикло-[4.4.0]-дец-5-ен и амин. Указанный аминопобочный продукт можно отгонять в ходе протекания реакции или удалять по ее завершении. К образовавшемуся 1,5,7-триазабицикло-[4.4.0]-дец-5-ену в реакционной емкости можно добавлять разбавитель, такой как полиол гексаэтоксилированный бисфенол А.
Термин «повышенная температура» при использовании в связи с настоящими способами представляет температуру, при которой дизамещенный карбодиимид реагирует с дипропилентриамином с образованием 1,5,7-триазабицикло-[4.4.0]-дец-5-ена и амина. В некоторых вариантах осуществления изобретения повышенная температура составляет 160°С или выше, 170°С или выше либо 180°С или выше и может составлять до 220°С, 230°С, 240°С или даже выше. Как правило, более высокая температура приводит к достижению более короткого периода времени реакции. В определенных способах с применением растворителя повышенная температура соответствует температуре флегмы растворителя на основе простого эфира и/или спирта либо составленной смеси, которую используют. Например, если используют 2-бутоксиэтанол, повышенная температура соответствует температуре флегмы 2-бутоксиэтанола (около 170°С). В конкретном варианте осуществления изобретения дизамещенный карбодиимид заключает в себе диарилкарбодиимид и повышенная температура составляет 160°С или выше, 170°С или выше либо 180°С или выше.
Термин «достаточный период времени», при использовании в связи с настоящим способом, представляет промежуток времени, необходимый для обеспечения условий взаимодействия дизамещенного карбодиимида с дипропилентриамином в существенной степени или полностью. Под «взаимодействием в существенной степени» подразумевается конверсия, составляющая 70% или выше; под «полным взаимодействием» подразумевается конверсия, составляющая 85% или выше. Указанный период времени может изменяться в зависимости от конкретных условий реакции, а в случае способа с применением растворителя, в зависимости от используемого растворителя на основе простого эфира и/или спирта. Как правило, достаточный период времени будет составлять от 1 до 6 часов, как например, от 1 до 4 часов или от 2 до 4 часов. Степень взаимодействия можно определять путем проведения анализа содержимого реакционной емкости с использованием известных спектроскопических методов (ИК,13С ЯМР и т.д.) для подтверждения присутствия или отсутствия дизамещенного карбодиимида и дипропилентриамина, а также для подтверждения присутствия 1,5,7-триазабицикло-[4.4.0]-дец-5-ена.
В некоторых вариантах воплощения изобретения способы, описанные в настоящем документе, осуществляют без катализатора. Однако в других вариантах осуществления катализатор применяют. Согласно существующим в настоящее время способам можно использовать любой катализатор, который увеличивает скорость реакции между дизамещенным карбодиимидом и дипропилентриамином, как например, слабый кислотный катализатор. Подходящие слабые кислотные катализаторы включают в себя тиомочевину, трет-додецилмеркаптан, 2-меркаптоэтанол и бисфенол А, но не ограничиваются ими. В некоторых вариантах осуществления изобретения катализатор представляет собой добавку, а в других случаях катализатор можно вводить в виде примеси в карбодиимиде, возможно образующейся в качестве побочного продукта процесса получения. Даже упомянутые следовые количества катализатора могут увеличивать скорость реакции. Катализатор в случае его применения можно добавлять с карбодиимидом.
В определенных вариантах осуществления изобретения 1,5,7-триазабицикло-[4.4.0]-дец-5-ен отделяют от растворителя на основе простого эфира и/или спирта с помощью перегонки при атмосферном давлении. В некоторых вариантах осуществления изобретения после операции перегонки 1,5,7-триазабицикло-[4.4.0]-дец-5-ен можно выделять в форме порошка. В качестве альтернативы, 1,5,7-триазабицикло-[4.4.0]-дец-5-ен можно сохранять в растворе с растворителем на основе простого эфира и/или со спиртом для последующего использования. Как отмечено выше, и в способах с применением растворителя, и в способах без применения растворителя аминовый побочный продукт можно удалять из реакционной емкости при помощи перегонки. В определенных вариантах осуществления изобретения указанную перегонку осуществляют одновременно с протеканием реакции. Под термином «одновременно» подразумевают, что перегонку осуществляют в продолжение реакции, в которой образуется 1,5,7-триазабицикло-[4.4.0]-дец-5-ен. Несмотря на то, что авторы изобретения не желают быть связанными каким-либо механизмом, в некоторых вариантах осуществления отгонка аминового побочного продукта одновременно с протеканием реакции может приводить к достижению взаимодействия, протекающего более эффективно, то есть быстрее и/или с более высокой долей превращения.
Выделенный бициклический гуанидин (1,5,7-триазабицикло-[4.4.0]-дец-5-ен (ТБД)), образовавшийся в результате осуществления описанных выше способов либо с применением растворителя, либо без упомянутого применения, который находится в форме раствора или порошка, затем можно добавлять в любую композицию, в которой можно использовать бициклический гуанидин. Например, в некоторых вариантах осуществления изобретения бициклический гуанидин, образовавшийся в результате воплощения способа, описанного в настоящем документе, можно добавлять в композицию для электроосаждаемого покрытия, такую как композиция для электроосаждаемого покрытия, которая описана в патенте США №7842762, который включен в настоящий документ ссылкой во всей его совокупности.
Если определенно не указано иного, все используемые в настоящем документе числа, такие как числа, выражающие значения, диапазоны, количества или процентные соотношения, можно воспринимать так, как в случае предварения словом «около», даже если данный термин не представлен в явной форме. Подразумевается, что любой численный диапазон, изложенный в настоящем документе, заключает в себе все поддиапазоны, включенные в него. Множественное число охватывает единственное и наоборот. Например, несмотря на то, что изобретение описано в терминах «дизамещенный карбодиимид», «спирт», «R/R1-группа» и тому подобных, можно использовать смеси указанных и других компонентов. К тому же подразумевается, что употребляемый в настоящем документе термин «полимер» относится к форполимерам, олигомерам, а также и к гомополимерам, и к сополимерам; префикс «поли» относится к двум или более звеньям. При указании диапазонов любые граничные точки упомянутых диапазонов и/или числа внутри данных диапазонов можно сочетать с объемом настоящего изобретения. «Включающий в себя», «такой как», «например» и тому подобные термины означают «включающий в себя/такой как/например, но не ограниченный указанным».
Примеры
Следующие ниже примеры предназначены для подтверждения изобретения примерами осуществления, а не ограничения изобретения каким-либо образом.

4-горлую колбу снабжали датчиком температуры, механической мешалкой из нержавеющей стали и холодильником с ледяной водой. Сухой азот продували через колбу, отводили через холодильник, затем через присоединенную холодную ловушку, заключающую в себе сухой лед и этанол, используемую для улавливания отгона изопропиламина. В колбу загружали 2-бутоксиэтанол (220 мл) и N,N'-диизопропилкарбодиимид (151,4 г, 1,2 моль) и нагревали до 60°С. Затем медленно добавляли дипропилентриамин (131,2 г, 1,0 моль). После добавления дипропилентриамина наблюдали экзотермическое повышение температуры на 40°С (~60°С→100°С). Реакционную смесь медленно нагревали до 170°С и кипятили с обратным холодильником при данной температуре в течение 12 часов. Оранжевый гомогенный раствор затем охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (38,8% масс., конверсия 94,6%). Анализ методом13С ЯМР показал, что вещество состояло только из 1,5,7-триазабицикло-[4,4,0]-дец-5-ена в 2-бутоксиэтаноле. Анализ отгона методом13С ЯМР подтвердил улавливание побочного продукта изопропиламина (129 мл) как единственного соединения.
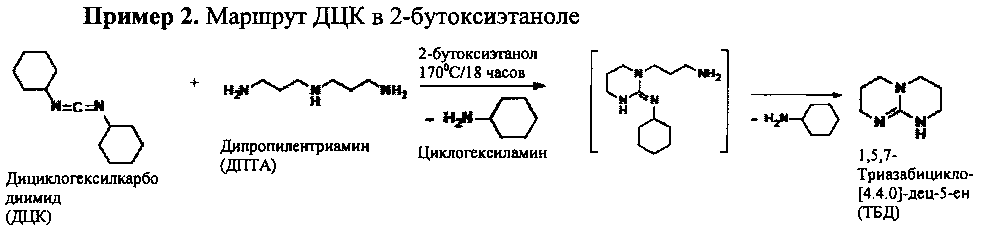
4-горлую колбу снабжали датчиком температуры, механической мешалкой из нержавеющей стали и холодильником с ледяной водой. Сухой азот продували через колбу и отводили через холодильник. В колбу загружали 2-бутоксиэтанол (220 мл) и N,N'-дициклогексилкарбодиимид (247,6 г; 1,2 моль) и нагревали до 60°С. Затем медленно добавляли дипропилентриамин (131,2 г; 1,0 моль). После добавления дипропилентриамина наблюдали экзотермическое повышение температуры на 14°С (~58°С→72°С). Реакционную смесь медленно нагревали до 170°С и кипятили с обратным холодильником при данной температуре в течение 18 часов. Оранжевый гомогенный раствор затем охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (32,9% масс.; конверсия 80,2%). Анализ методом13С ЯМР показал, что вещество состояло из 1,5,7-триазабицикло-[4.4.0]-дец-5-ена и циклогексиламина (2,5%) в 2-бутоксиэтаноле.
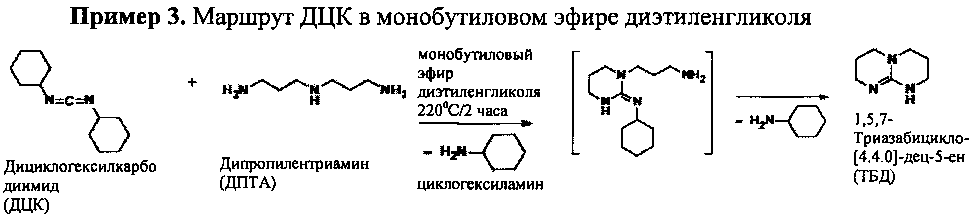
4-горлую колбу оснащали для полной перегонки, в комплексе с датчиком температуры и механической мешалкой из нержавеющей стали. Сухой азот продували через колбу и отводили через устройство для перегонки. В колбу загружали монобутиловый эфир диэтиленгликоля (210 мл) и N,N'-дициклогексилкарбодиимид (247,6 г; 1,2 моль) и нагревали до 60°С. Затем медленно добавляли дипропилентриамин (131,2 г; 1,0 моль). После добавления дипропилентриамина наблюдали экзотермическое повышение температуры на 41°С (~61°С→102°С). Реакционную смесь нагревали до 140°С и выдерживали в течение 1 часа, затем нагревали до 220°С и выдерживали в течение 2 часов. Оранжевый гомогенный раствор затем охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (35,4% масс.; конверсия 81,0%). Анализ методом13С ЯМР показал, что вещество состояло только из 1,5,7-триазабицикло-[4.4.0]-дец-5-ена в монобутиловом эфире диэтиленгликоля. Результаты анализов отгона методами13С ЯМР и ГХ/МС подтвердили улавливание циклогексиламина (199 мл).

4-горлую колбу снабжали датчиком температуры, стержнем магнитной мешалки и холодильником с ледяной водой. Сухой азот продували через колбу и отводили через холодильник. При температуре окружающей среды в колбу загружали 2-бутоксиэтанол (11 мл), N,N'-ди-п-толилкарбодиимид (13,5 г; 0,06 ммоль) и дипропилентриамин (6,64 г; 0,05 моль). Наблюдали экзотермическое повышение температуры на 34°С (~23°С→57°С). Реакционную смесь медленно нагревали до 170°С и кипятили с обратным холодильником при данной температуре в течение 15 часов. Оранжево-коричневый гомогенный раствор затем охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (19,9% масс.; конверсия 79,1%). Анализ методами13С ЯМР и ГХ показал, что вещество состояло из 1,5,7-триазабицикло-[4.4.0]-дец-5-ена и п-толуидина (36,8%) в 2-бутоксиэтаноле.

4-горлую колбу оснащали для полной перегонки, в комплексе с датчиком температуры и механической мешалкой из нержавеющей стали. Сухой азот продували через колбу и отводили через устройство для перегонки. В колбу загружали N,N'-дициклогексилкарбодиимид (247,6 г; 1,2 моль) с последующим медленным добавлением дипропилентриамина (131,2 г; 1,0 моль). После добавления дипропилентриамина наблюдали экзотермическое повышение температуры на 31°С (~24°С→55°С). Реакционную смесь нагревали до 170°С и выдерживали в течение 1 часа, затем нагревали до 220°С и выдерживали в течение 2 часов. После окончательного выдерживания добавляли полиол гексаэтоксилированный бисфенол А (417,0 г; 0,85 моль) в качестве разбавителя. Оранжевый гомогенный раствор затем перемешивали, охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (21,3% масс.; конверсия 94,4%). Анализ методом13С ЯМР показал, что вещество состояло только из 1,5,7-триазабицикло-[4.4.0]-дец-5-ена в полиоле гексаэтоксилированный бисфенол А. Результаты анализов отгона методами13С ЯМР и ГХ/МС подтвердили улавливание циклогексиламина (175 мл).

4-горлую колбу оснащали для полной перегонки, в комплексе с датчиком температуры и механической мешалкой из нержавеющей стали. Сухой азот продували через колбу и отводили через устройство для перегонки. В колбу загружали N,N'-дициклогексилкарбодиимид (210,5 г; 1,02 моль) с последующим медленным добавлением дипропилентриамина (131,2 г; 1,00 моль). После добавления дипропилентриамина наблюдали экзотермическое повышение температуры на 32°С (~23°С→55°С). Реакционную смесь нагревали до 170°С и выдерживали в течение 1 часа, затем нагревали до 220°С и выдерживали в течение 2 часов. После окончательного выдерживания добавляли полиол гексаэтоксилированный бисфенол А (319,8 г; 0,65 моль) в качестве разбавителя. Оранжевый гомогенный раствор затем перемешивали, охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (28,0% масс.; конверсия 93,7%). Анализ методом13С ЯМР показал, что вещество состояло только из 1,5,7-триазабицикло-[4.4.0]-дец-5-ена в полиоле гексаэтоксилированный бисфенол А. Результаты анализов отгона методами13С ЯМР и ГХ/МС подтвердили улавливание циклогексиламина (229 мл).
Пример 7. Маршрут ДЦК (100%-ные твердые вещества, последующее добавление полиола, 2%-ный избыток ДЦК, 98%-ная чистота ДЦК, слабый кислотный катализатор)
4-горлую колбу оснащали для полной перегонки, в комплексе с датчиком температуры и механической мешалкой из нержавеющей стали. Сухой азот продували через колбу и отводили через устройство для перегонки. В колбу последовательно загружали N,N'-дициклогексилкарбодиимид (210,5 г; 1,02 моль, 98%-ная чистота, фирма Dalian Harsou Chemical Co., Ltd), бисфенол A (0,570 г; 0,0025 моль) и дипропилентриамин (131,2 г; 1,00 моль). После добавления дипропилентриамина наблюдали экзотермическое повышение температуры на 30°С (24°С→54°С). Реакционную смесь нагревали до 140°С и выдерживали в течение 1 часа, затем медленно нагревали до 220°С и выдерживали в течение 2 часов. После окончательного выдерживания добавляли полиол гексаэтоксилированный бисфенол А (319,8 г; 0,65 моль) в качестве разбавителя. Оранжевый гомогенный раствор затем перемешивали, охлаждали, выливали из реакционной емкости и использовали без дополнительной очистки. Концентрацию ТБД в конечном растворе определяли методом ВЭЖХ (29,3% масс.; конверсия 96,7%). Анализ методом13С ЯМР показал, что вещество состояло только из 1,5,7-триазабицикло-[4.4.0]-дец-5-ена в полиоле гексаэтоксилированный бисфенол А. Следует отметить, что попытка осуществления указанной выше процедуры в отсутствие бисфенола А привела к достижению значительно более низкой конверсии в ТБД согласно результатам анализа методом ВЭЖХ (26,9% масс.; конверсия 88,7%). Это демонстрирует тот факт, что применение слабого кислотного катализатора, подобного бисфенолу А, повышает конверсию в ТБД в реакции ДПТА с ДЦК 98%-ной чистоты.
Хотя в целях пояснения выше изложены конкретные варианты осуществления данного изобретения, специалистам в данной области техники очевидно, что можно выполнять многочисленные изменения деталей настоящего изобретения в пределах данного изобретения, описанного в прилагаемой формуле изобретения.
Реферат
Изобретение относится к вариантам улучшенного способа получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена. Соединение используется для композиции электроосаждаемого покрытия и для изготовления подложки с покрытием путем электрофоретического осаждения на подложку указанной композиции. Способ получения включает стадии (a) формирования смеси, содержащей дизамещенный карбодиимид, дипропилентриамин, а также растворитель на основе простого эфира и/или спирта; и (b) нагревание указанной смеси при температуре от 160°С до 240°С для обеспечения условий взаимодействия упомянутого дизамещенного карбодиимида с упомянутым дипропилентриамином. При необходимости проводят стадию (c), на которой отгоняют побочный продукт из реакционной смеси стадии (b), при этом стадия (с) и стадия (b) являются одновременными. Преимущественно стадию а) осуществляют в спирте, например 2-бутоксиэтаноле, монобутиловом эфире диэтиленгликоля, полиоле гексаэтоксилированном бисфеноле А или их сочетании. Вариантом способа получения 1,5,7-триазабицикло-[4.4.0]-дец-5-ена является проведение стадий (a) формирования смеси, содержащей дизамещенный карбодиимид и дипропилентриамин; и (b) нагревание указанной смеси при температуре от 160°С до 240°С для обеспечения взаимодействия упомянутого дизамещенного карбодиимида с упомянутым дипропилентриамином. При необходимости проводят стадию с), где указанное нагревание осуществляют при добавлении разбавителя после стадии (b). Указанный способ осуществляют в отсутствие растворителя на основе простого эфира и/или спирта. Дизамещенный карбодиимид представляет собой диалкилкарбодиимид, например N,N′-диизопропилкарбодиимид, N,N′-дициклогексилкарбодиимид или их
Формула
(a) формируют смесь, содержащую дизамещенный карбодиимид, дипропилентриамин, а также растворитель на основе простого эфира и/или спирта; и
(b) нагревают указанную смесь с целью обеспечения условий для взаимодействия упомянутого дизамещенного карбодиимида с упомянутым дипропилентриамином, где указанное нагревание осуществляют при температуре от 160°С до 240°С.
(c) отгоняют побочный продукт из реакционной смеси стадии (b), при этом стадия (с) и стадия (b) являются одновременными.
(a) формируют смесь, содержащую дизамещенный карбодиимид и дипропилентриамин; и
(b) нагревают указанную смесь с целью обеспечения условий для взаимодействия упомянутого дизамещенного карбодиимида с упомянутым дипропилентриамином, где указанное нагревание осуществляют при температуре от 160°С до 240°С.

Комментарии