Способ получения производных 3,4-дигидро-5 @ -2,3-бензодиазепина - SU1151206A3
Код документа: SU1151206A3
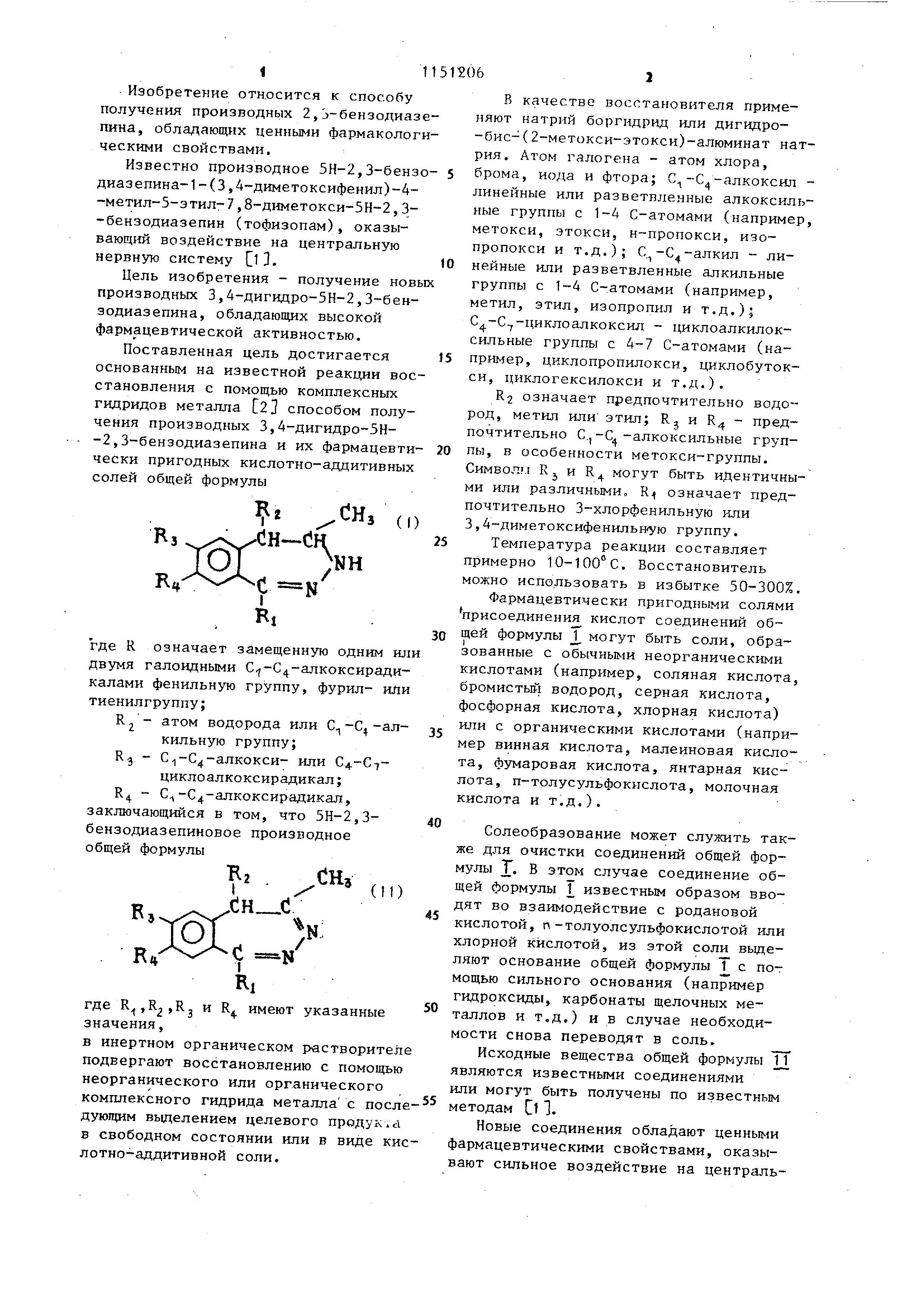
Описание
31 ную нервную систему, например подавляющее спонтанную моторную активност ( SMA), анальгетическое, потенциирующее наркоз действие. Соединения идентифицируют на осно ве элементного анализа (максимальное отклонение от рассчитанных значений составляет +0,3%), ИК-, ЯМР-Н- и/ил масс-спектров. ИК- и ЯМР-Н-спектры показывают, что при солеобразовании протон связан с N-3-атомом. Пример 1. Получение гидрохлорида 1-(3,4-диметоксифенш1)-4-меТИЛ-5-ЭТИЛ-7 ,8-диметокси-З,4-дигидро 5Н-2,3-бензодиазепина. Смесь 100 г (0,26 моль) 1-(3,3диметоксифенил )-4-метил-5-этил-7,8- -диметокси-5Н-2,3-бензодиазепина, 30 г (0,8 моль) боргидрида натрия и 150 мл пиридина в круглодонной колбе емкостью 5 л на водяной бане 80ЮО С перемешивают в течение часа. Образовавшийся раствор содержит минимальное количество гранул боргидрида натрия. Обогрев прекращают ив раствор спустя 20 мин добавляют, 150 мл воды; наблюдается сильное выделение водорода и температура внутр падает до . К реакционной смеси добавляют 1400 мл воды, после чего в течение часа при 8-15°С добавляют по каплям раствор 260 мл концентриро ванной соляной кислоты и 600 мл воды Кристаллизующуюся смесь медленно перемешивают в течение 2 ч, промывают 4 раза по 50 мл охлажденной льдом воды и выезживают. Получают 111,34 г .целевого соединения. Выход 99,4%. Сы рой продукт слабо желтого цвета разлагается при 216-220 С. Брутто-форму ла C22HjjgN204. НС1. После перекристаллизации из изопропанола или безводного этанола т.пл. повьш1ается до 222-224 С. Выход при перекристаллизации можно пов.ышать путем добавки этилацетата, ацетона или диэтилового эфира. Перекристаллизованное из вод соединение содержит 3 моль кристаллизационной воды; температура разложенин 222-224С. В слзгчае, если в качестве исходного В1ещества вместо 5Н-2,3-бензодиазепинового основания применяют соответствующее количествогидрохлорида ,, получают целевое соединение с аналогичным выходом. 064 Пример 2. Получение 1-(3,4диметоксифенил )-4-метил-5-этил-7,8-диметокси-3 ,4-дигидро-5Н-2,3-бензодиазепина . 42,1 г (0,1 моль) полученного по примеру 1 соединения суспендируют в 400 мл воды или растворяют в горячей воде. К полученной суспензии или раствору порциями добавляют 8 г карбоната калия. Целевое соединение выделяется при выделении двуокиси углерода; продукт содержит 1 моль кристаллизационной вода1. Выделившийся продукт отфильтровывают, промывают 5 раз по 15 мл воды для освобождения от хлоридов и сушат на воздухе. Получают 34 г целевого соединен1 Я. Выход 85%. Сырой продукт белого цвета подвергается усадке при 75С, при 105115с образуется содержащий пузырьки коагулят. Целесообразно осуществлять перекристаллизацию из спирта (метанола, безводного этанола, изопропанола) после удаления кристаллизационной воды. Чистое целевое соединение плавится при 120-122 С. 5рутто-форМула С22Н28 204. Выделение соединения можно также осуществлять с помощью других оснований , таких как карбойат натрия, бикарбонат натрия, гидроксид аммония , триэтиламин или пиридин. Выход продукта можно повышать благодаря тому, что полученный с помощью хлороформа или дихлорметана раствор полученного по примеру 1 соединения экстрагируют водным раствором одного из Bbmieуказанных оснований или осуществляют выделение из метанола, безводного этанола или изопропанола и в качестве среды с помощью органических оснований (например , триэтиламин, пиридин). Пример 3. Получение 1-(3-хлорфенш1 )-4-метил-7,8-диметокси 3 ,4-дигидро-5Н-2,3-бензодиазепина. В кр глодонную колбу емкостью 750 мл, снабженную мешалкой, капельНОЙ .воронкой и обратным холодильником , помещают 9,87 г (0,03 моль) 1 - (3-хлорфеншт) -4-метил-7,8-диметокси-5Н-2 ,3-бензодиазепина, 25 мл пиридина и 4,5 г (0,12 моль) боргидрида натрия. Реакционную смесь при Перемешивании в течение 4 ч нагревают на водяной бане при 95-100°С. Образовавшийся желтый раствор содержит часть
неизменного брргидрида натрия. К расвору при охлаждении водой в течение 30 мин прикапывают 25 мл воды. Реакционную смесь охлаждают охлажденной льдом водой. В течение часа прикапывают смесь 56 мл (0,7 моль) концентрированной соляной кислоты и 118 мл воды. После добавки 60 мл вышеуказанной смеси начинается вьщеление осадка , который позднее образует желтые комки. Охлаждение прекращают, смесь перемешивают еще 30 мин при комнатной температуре. Большая часть комкообразного мягкого осадка растворяется . К смеси в течение 15 мин прикапывают раствор 20 г (0,5 моль) гидроксида натрия в 60 мл воды. Выделившееся сырое целевое соединение сначала мягкое, позднее становится твердым. Комки отфильтровывают, промывают 4 раза по 20 мл воды и сушат при 50-60 С. Получают 9,6 г целевого соединения. Выход 96,5%, т.пл. 116120 0 . В случае, если реакционную смесь после подщелачивания обрабатывают путем экстракции (например, хло формом), получают целевой продукт с подобно высоким выходом. После перекристаллизации сырого продукта из 30 мл изопропанола получают 8,5 г чистого целевого продукта Выход 85,5% Продукт белого цвета, плавится при 121-123 0. Брутто-форму ла Н дСШгОгГидроксид (. НС1) плавится при 216-218°С (из изопропанола или смеси изопропанола с этилацетатом ) , В качестве реакционной среды вмес то пиридина можно применять другие растворители (например, метанол, пер вичные амины, уксусную кислоту или полученные с дихлорметаном или дихлорэтаном смеси). ч Пример 4, Получение 1-(3,4-диметоксифенил )-4-метил-5-7,8-димётокси-3 ,4-дигидро-5Н-2,3-бензодиазепина . 70%-ный бензольный раствор 90 мл (0,6 моль) NaAlH, (СОНjCH OCHj )2 растворяют в 90 мл бензола. Раствор при перемешивании в течение 20 мин добавляют к раствору 114,6 г (0,3 моль) 1-(3,4-диметоксифенил)-4-метш1-5-этил-7 ,8-дкметокси-5Н-2,3 -бензодиазепина в 1500 мл бензояВнутренняя температура повышается до 33-35 С. Температура реакционной
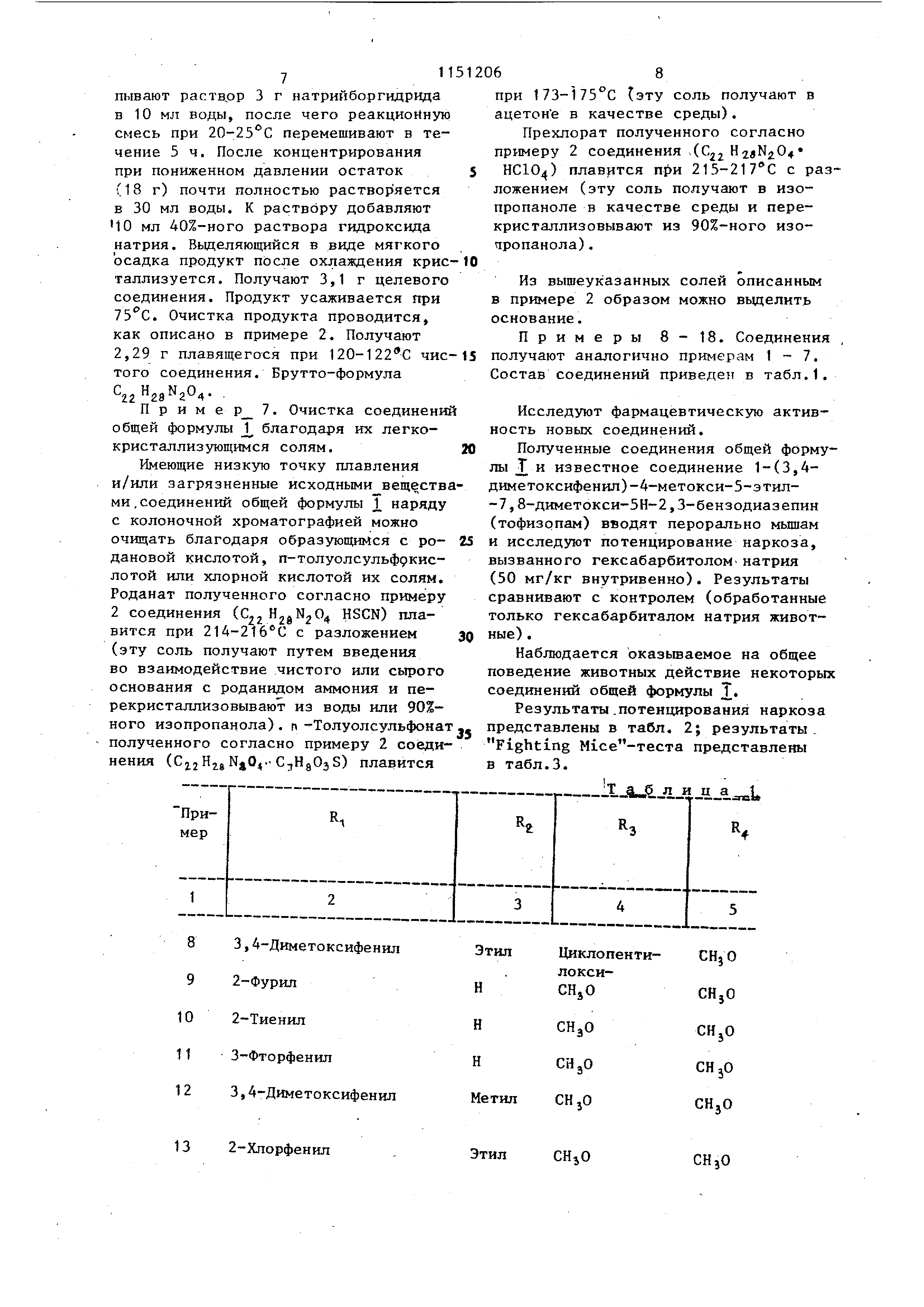
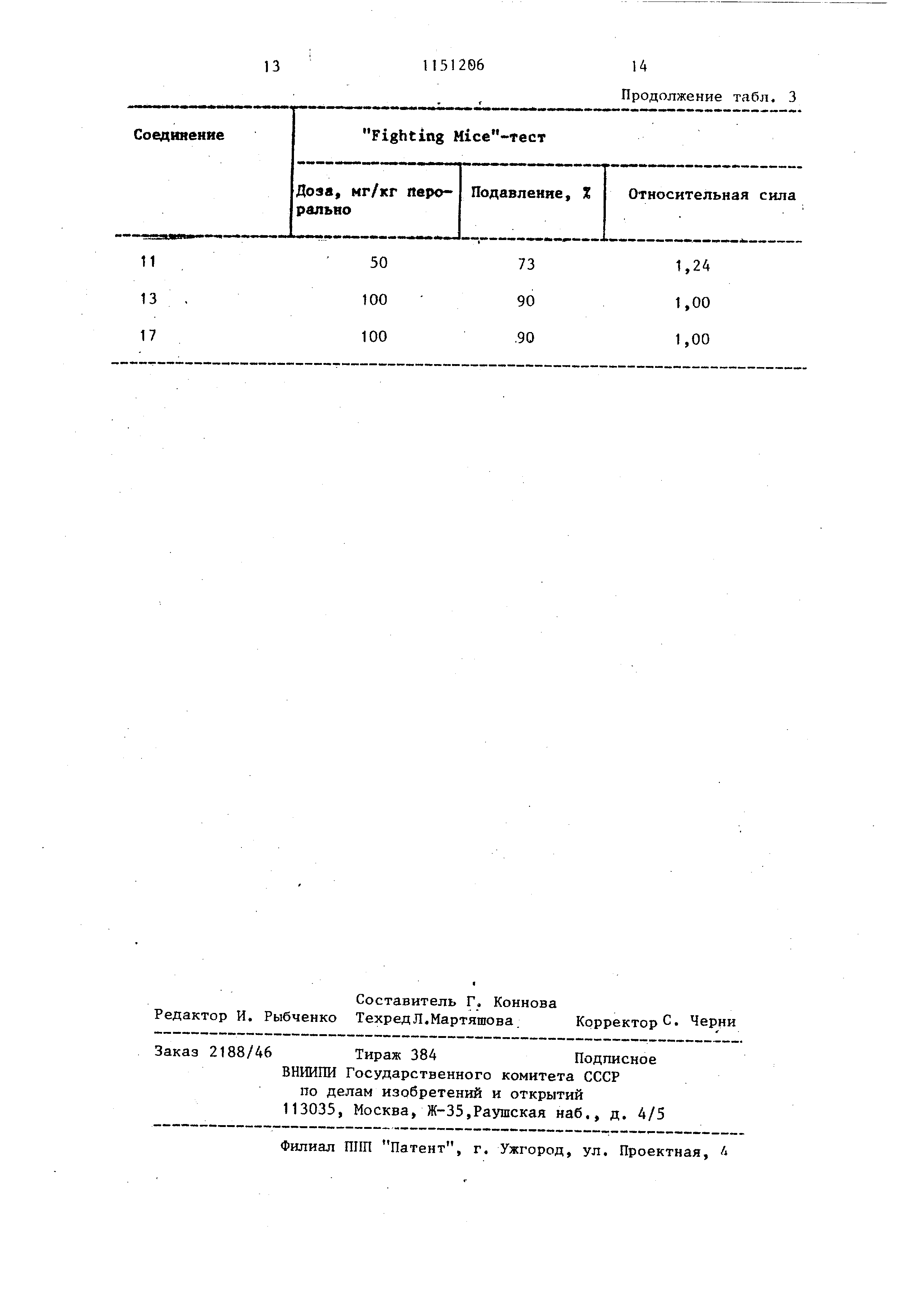
смеси р течение 30 мин повьш ается до температуры кипения бензола (прекрап1ается вьщеление газов). Смесь снова охлаждают до 20°С. Прикапывают 450 мл 20%-ного раствора гидроксида натрия (в случае применения содержащих фенольные гидроксильные группы соединений - водный раствор карбоната натрия). Получают светложелтую двухфазную смесь. Фазы отделяют друг от друга. Бензольный слой экстрагируют 4 раза по 350 мл воды, сушат над безводным сульфатом магния и концентрируют. Остаток (120 г) перекристаллизовывают.из 100 мл метанола . Получают 106,5 г целевого соединения, т.пл. 1 18-120 С. Бруттоформула C jIljjN O. Выход 91,5%. После перекристаллизации из изопропанола температура плавления повышается до 121-123°С. Пример 5. Получение гидробромида 1-(3,4-диметоксифенил)-4метил-5-этил-7 ,8-диМБтокси-2,4-диГИДРО-5Н-2 ,3-бензодиазепина. К раствору 3,84 г (0,01 моль) полученного по примеру 4 соединения в 25 мл изопропанола прикапывают 1,1 мл 48%-ного раствора бромистого водорода (или содержащего 0,01 моль бромистого водорода, насьщенного газообразным бромистым водородом изопропанола). Реакционную смесь охлаждают , выделившийся продукт отфильтровывают и промывают небольшим количеством изопропанола. Получают 4,15 г целевого соединения. Выход 90%. Брутто-формула . НВг, Продукт плавится при 210-213 С (с разложением). После перекристаллизации из изопропанола температура разложения повышается до 214-215с. Солеобразование можно осуществлять также при применении сырого основания. В качестве реакционной среды вместо изопропанола можно использовать также зтилацетат, смесь изопропанола с ацетоном или смесь изопропанола с диэтилрвым эфиром. Пример 6. Получение 1-(3,4-диметоксифенил )-4-метнп-5-зтил-7 ,8-диметокси-З,4-дигидро-5Н-2,3-бензодиазепина . К раствору 3,82 г (0,01 моль) 1-(3,4-диметоксифенил)-4-метш1-5-этнп-7 ,8-диметокси-5Н-2,3-бензодиазепина в 38 мл ледяной уксусной кислоты в течение 2 ч при 3-8°С прикапывают растврр 3 г натрийборгидрида в 10 мл воды, после чего реакционную смесь при 20-25 С перемешивают в течение 5 ч. После концентрирования при пониженном давлении остаток (18 г) почти полностью растворяется в 30 мл воды. К раствору добавляют 40 мл 40%-ного раствора гидроксида натрия. Вьщеляющийся в виде мягкого осадка продукт после охлаждения крис таллизуется. Получают 3,1 г целевого соединения. Продукт усаживается при . Очистка продукта проводится, как описано в примере 2. Получают 2,29 г плавящегося при 120-122 0 чис того соединения. Брутто-формула C.. . П р и м е р 7. Очистка соединени общей формулы J благодаря их легкокристаллизующимся солям. Имеющие низкую точку плавления и/или загрязненные исходными веществ ми .соединений общей формулы J наряду с колоночной хроматографией можно очищать благодаря образующимся с родановой кислотой, п-толуолсульффкислотой или хлорной кислотой их солям. Роданат полученного согласно примеру 2 соединения (€2 HSCN) плавится при 214-216 0 с разложением (эту соль получают путем введения во взаимодействие чистого или сьфого основания с роданидом аммония и перекристаллизовывают из воды или 90%- ного изопропанола). п-Толуолсульфона полученного согласно примеру 2 соединения ( NjO -C-iHgOjS) плавится 1 68 при {эту соль получают в ацетоне в качестве среды). Прехлорат полученного согласно примеру 2 соединения .(Cji H2eN204 НС104) 215-217 0 с разложением (эту соль получают в изопропаноле в качестве среды и перекристаллизовывают из 90%-ного изочсропанола ). Из вышеуказанных солей описанным в примере 2 образом можно вьщелить основание. Примеры 8-18. Ооединения , получают аналогично примерам 1-7. Состав соединений приведен в табл.1. Исследуют фармацевтическую активность новых соединений. Полученные соединения общей формулы j и известное соединение 1-(3,4диметоксифенил )-4-метокси-5-этил-7 ,8-диметокси-5Н-2,3-бензодиазепин (тофизопам) вводят перорально мышам и исследуют потенцирование наркоза, вызванного гексабарбитолом натрия (50 мг/кг внутривенно). Результаты сравнивают с контролем (обработанные только гексабарбиталом натрия животные ) . Наблюдается оказьюаемое на общее поведение животных действие некоторых соединений общей формулы Т. Результаты .потенцирования наркоза представлены в табл, 2; результаты , Fighting Mice-теста представлены в табл.3.




Реферат
1. СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3,4-ДИГИДРО-5Н-2,3-ВЕНЗОДИАЗЕПИНА общей формулы 1 сщ .СНСН В. NH / где R, означает замещенную одним или двумя галоидньми С2-С4-алкоксирадикалами фенильную группу, фурил- или тиенилгруппу; R - атом водорода или С,-С -алкильную группу; R2 .-алкокси- или С -С -циклоалкоксирадикал; Rj - С -С -алкоксирадикал; отличающийся тем, что 5Н-2,3-бензодиазепиновое производное общей формулы I1 XHi СЛ где R,R ,R, и R. имеют указанные С значения, в инертном органическом растворителе подвергают восстановление с помощью неорганического или органического комплексного гидрида металла с последующим вьщелением целевого продукта . в свободном состоянии или в виде фармацевтически - пригодной кислотноаддитивной соли. 2. Способ по п. 1,отлича ющ и и с я тем, что в качестве восстановителя применяют натрийборгидрид или дигидро-бис-


Комментарии