Способ получения производных 5н-2,3-бензодиазепина или их солей присоединения кислот - SU1402258A3
Код документа: SU1402258A3
Описание
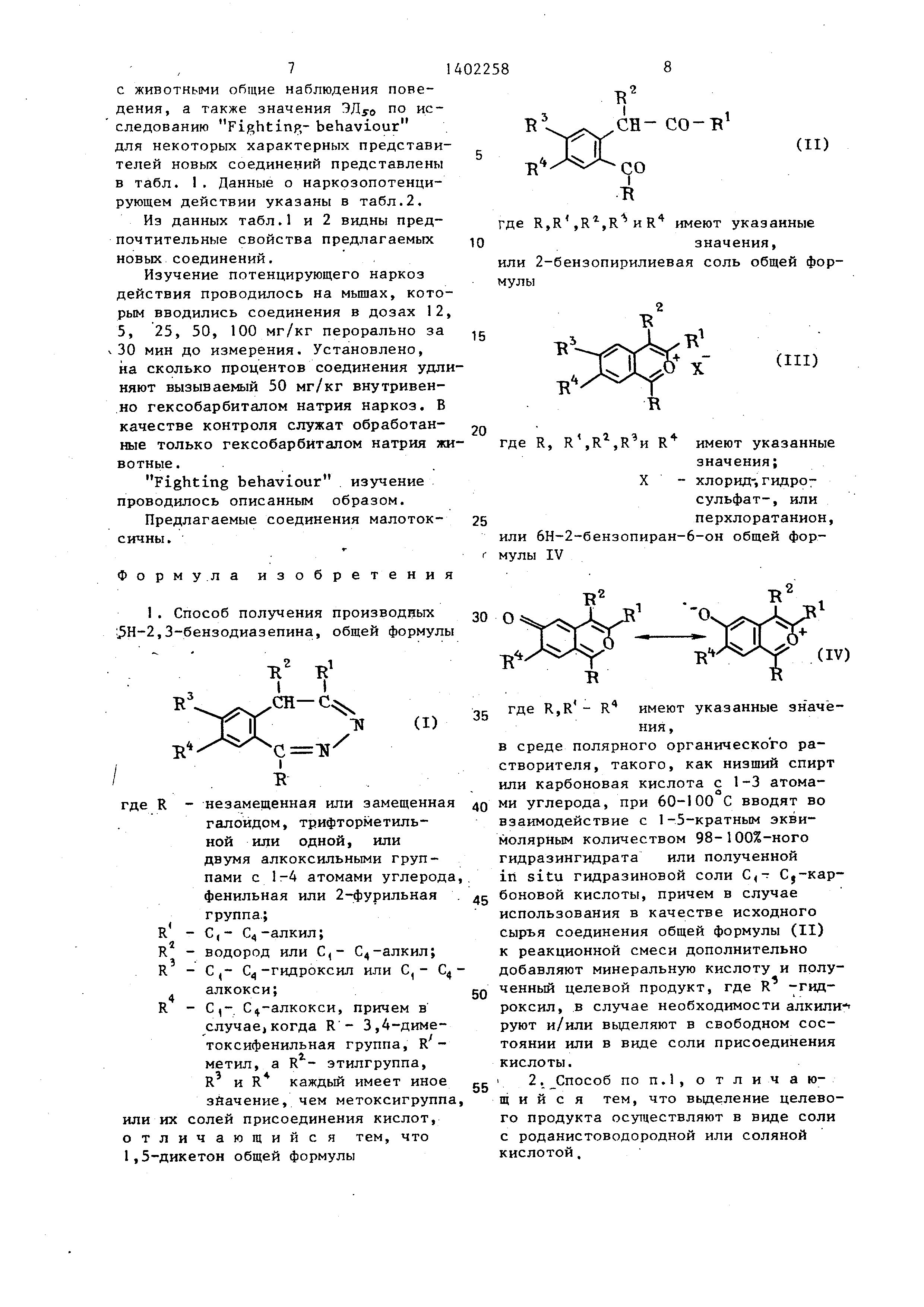
I Изобретение относится к способу получения новых производных 5Н-2,3- ;бенэодиазепина общей формулы
(I)
где R - -незамещенная или замещенная галоидом, трифторметильной, одной, или двумя алкоксиль- ной группами с 1-4 атомами углерода, фенильная или 2-фурильная группа; R - С,- С -алкил; R - водород или С -алкил; R - С,- С -гидроксил или
алкокси; R - С -алкокси, причем в
случае, когда R - 3,4-диме- токсифенильная группа, R - метил, а R - этильная группа, R и R каждый имеют другое значение, чем метоксильная группа, или их солей присоединения кислот, оказывающих воздействие на централь- ную нервную систему.
Цель изобретения - получение новых производных 5Н-2,3-бензодиазепи- на, обладающих более сильным действием на центральную нервную систему чем известные структурные аналоги.
Пример 1. 1-(4-Метоксифенил) А-метил-5-этил-7,8-диметокси-5Н-2, 3-бензодиазепин.
Ijl9 г (2,73 ммоль) 1-(4-метокси- фенил -3-метил-4-этил-6,7-диметокси- 2-бензопириний-перхлората суспендируют в 10 мл метанола, нагревают до кипения и смегаивают с 0,51 мл (10 ммоль) 98%-ного гидразингидрата Смесь вьтаривают и остаток водой промывают на фильтре. Получают 0,83 г (2,35 ммоль) высушенного продукта, который плавится при 153-156 С. Путем перекристаллизации из 20 мл этаиола получают 0,705 г (2,0 ммоль, 73,3%) белого кристаллического вещесва , которое плавится при 157-159°С. Cj,,, мол.м. 352,4.
П р и м е,р 2. 1-(2-Хлорфенил)- 4-метил-5-этил-7,8-диметокси-5Н-2,3- бензодиазепин.
Смесь 10,37 г (28,9 ммоль) 2-(1- этилацетонил -4,5-диметокси-2-хлор
0
5 0
5 о
,. г 5
0
бензофенона, 10,5 мл ледяной уксусной кислоты и 2,65 мл концентрированной соляной кислоты нагревают при перемешивании до 95°С. После охлаж- дения до 60 С добавляют порциями 2,14 мл 98%-ного гидразингидрата, К раствору, температура которого повышена -до 85 С, спустя 30 мин примешивают раствор 1,44 г гидроокиси натрия в 4,5 мл воды и затем 10 мл метанола . Затем раствор выливают в 130 мл воды, выделяют выделившееся производное 5Н-2,3-бензодиазепина. Получают 9,04 г (88% продукта, который плавится при 129-131 С. C H ClNjO,, мол. м. 356,9. Сырой продукт перекристаллизовывают из этанола и он плавится тогда при 147-1 49 С.
Перекристаллизованный из изопропа- нола роданид (,, мол.м. 425,92) плавится при 169-171 С.
П р и м е р 3. 1-Фенил-4-метил-5- этил-7,8-диметокси-5Н-2,3-бензодиазепин (очистка через роданид).
К 1,2 г (приблизительно 2,8 ммоль) сырого, полученного по методике примера 1,1-фенил-4-метил-5-этил-7,8-ди- метокси-5Н-2,3-бензодиазепина приливают 1,5 мл 15%-ного солянокислого абсолютного этанола (6 ммоль НС1).
Оранжевый раствор упаривают, остаток растворяют в 5 мл воды и смачивают с 0,5 г (6,6 ммоль) роданида аммония, при этом выделяется соль роданистоводородной кислоты. Ее отфильтровывают , промывают 6 X 2 мл воды и затем высушивают. Получают 1,33 г сырого продукта, который плавится при 170-1 73°С.После перекристаллизации из абсолютного этанола т.пл. 175-177 С. Из перекристаллизованного роданида можно выделить чистое производное 5Н-2,3-бензодиазепина с помощью щелочей или гидроокиси аммония. , мол.м. 340,4, температура плавления;начинает при сжижаться (этанол-вода).
П р и м е р 4. 1-(3,4-Диметоксифе- нил)-4-метил-5-этил-6-окси-8-меток- СИ-5Н-2,3-бензодиазепин.
А. К раствору 115 г (0,325 моль) 1 ,4-диметоксифенил -З-метил-4- эт ил-7-метокси-бН-2-бензопиран-6-она в 115 мл ледяной уксусной кислоты при 80-100°С в течение 5 мин и при перемешивании прикапывают 34,5 мл 97%-ного гидразингидрата. Раствор выдерживают на водяной бане в тече U02258
ние часа при 95-100 С, затем разбавля- нием фенольной THflpoKctuibHofi группы ют 140 мл 2%-ного раствора едкого получают следующие соединения: натра и охлаждают. Осаждается произ- П р и м е р 5. 1 - (3,4-Лиметокс 1- нодное 5Н-2,3-бензодиазепина в виде окрашенриях в кремовый цвет кристаллов . Их отфильтровывают, промывают 4x50 мл воды и затем высушивают. Получают 111,7 г сырого продукта, котофенил )-4-метил-5-этил-7-втор-бутокси 8-метокси-5Н-2,3-бензодиазепин.
Сг5-Н,гКа04,мол.м.425,5, т.пл. 130- 132 С (50%-ный этанол).
П р и м е р 6. 1-(3,4-Диме токе ирый плавится при 210-212 С. С целью ю фенил)-4-метил-5-этил-7-н-пропоксинием фенольной THflpoKctuibHofi группы получают следующие соединения: П р и м е р 5. 1 - (3,4-Лиметокс 1-
фенил )-4-метил-5-этил-7-втор-бутокси- 8-метокси-5Н-2,3-бензодиазепин.
Сг5-Н,гКа04,мол.м.425,5, т.пл. 130- 132 С (50%-ный этанол).
П р и м е р 6. 1-(3,4-Диме токе и



Реферат
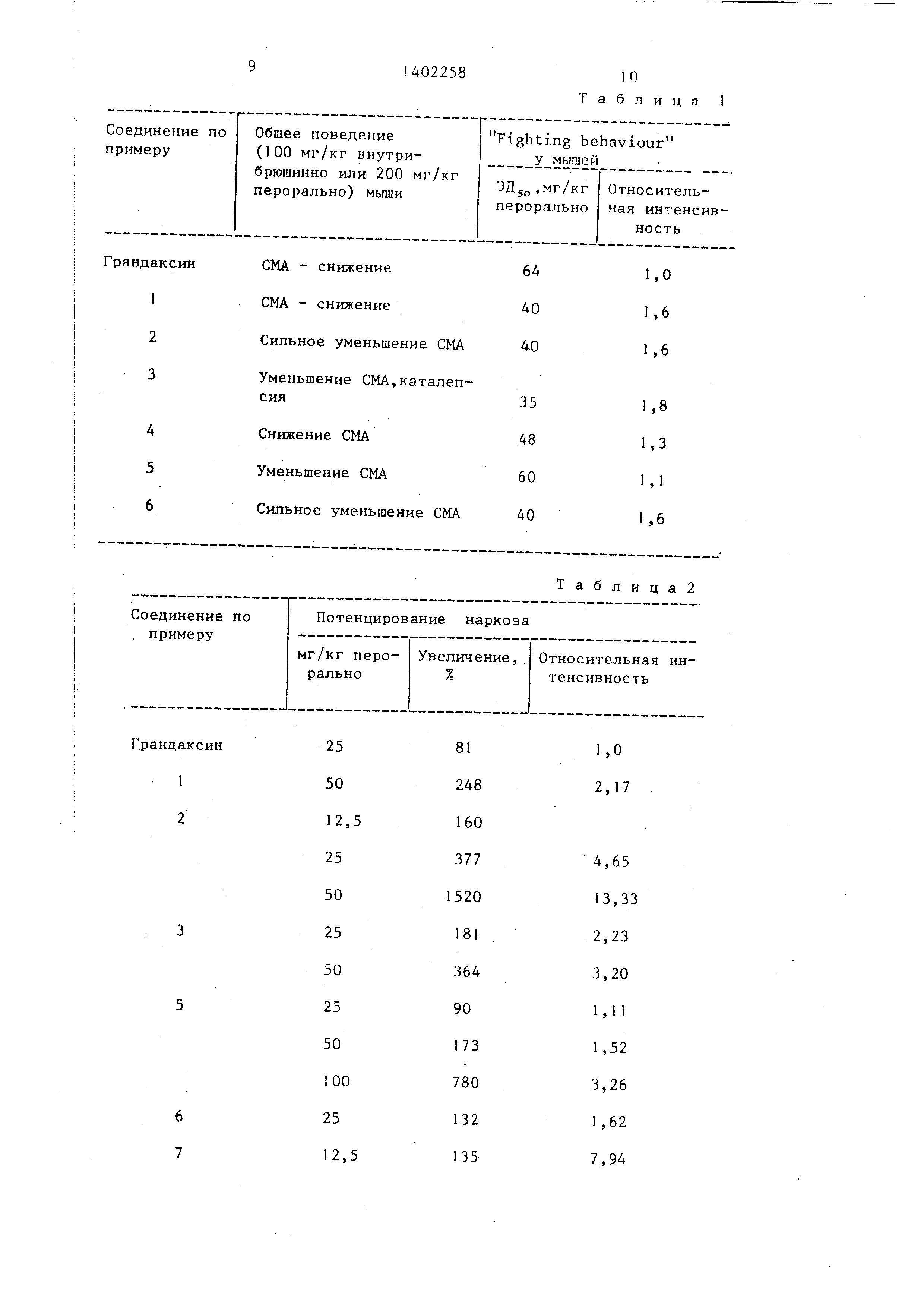
Изобретение относится к гетероциклическим соединениям, в частности к получению производных 5Н-2, 3-бензодиаэепина формулы где R - Незамещенная или замещенная галоидом, трифторметильной или одной или двумя алкоксигруппами с 1-4 атомами углерода фенольная или 2-фуриль- ная группа; R,- С,- С -алкил; R - водород или С,- С -алкил; R - гидро- ксильная или алкоксигруппа с 1-4 атомами углерода; R - алкоксигруппа с 1-4 атомами углерода, причем в случае , когда R-3,4-диметоксифенильная 4 2 4 группа, R -метил, а R -этил,R и R каждый имеет иное значение, чем ме- токсигруппа, или их солей присоединения кислот, оказывающих воздействие на центральную нервную систему. Цель - разработка способа получения новых более активных соединений. Получение целевых соединений ведут из соответствующих 1,5-дикетона, или 2-бензопирилиевой соли, или 6Н- 2-бензопиран-6-она в среде полярного органического растворителя, такого , как низший спирт или карбоновая кислота с Г-3 атомами углерода, которые при 60-100 С вводят во взаимодействие с 1-5гкратным зквимолярным количеством 98-100%-ного гидразин- гидрата или полученной in situ гид- разиновой соли С,- С -карбоновой кислоты. В случае использования 1,5-дикетона дополнительно добавляют минеральную кислоту и полученный целевой продукт, где R - гидроксил, в случае необходимости алкилируют .и/или выделяют в свободном состоянии или в виде соли роданистоводородной или соляной кислот. 2 табл. g СО см

Формула


Комментарии