Применение монозамещенных пиразинов, содержащих трифениламиновый заместитель, в качестве мономолекулярных сенсоров для обнаружения нитроароматических соединений - RU2723243C1
Код документа: RU2723243C1
Описание
Применение монозамещенных пиразинов, содержащих трифениламиновый заместитель, в качестве мономолекулярных сенсоров для обнаружения нитроароматических соединений.
Область техники, к которой относится изобретение
Настоящее изобретение относится к области органического синтеза сенсорных материалов и касается 2-монозамещенных пиразинов, обладающих сенсорными свойствами и предназначенных для обнаружения присутствия нитроароматических соединений на поверхностях, в растворах неполярных растворителей, воды и в воздухе в сверхмалых концентрациях на основании изменения оптических свойств – тушения фотолюминесценции – означенного сенсора при контакте с молекулами нитроароматических соединений. Изобретение может быть использовано для создания сенсоров на нитроароматические соединения, которые могут найти применение в силовых структурах (армия, полиция, охранные предприятия, и т.п.), таможенных службах, научно-исследовательских лабораториях, а также в быту и сельском хозяйстве.
Уровень техники:
Способы получения соединения формулы Ia, основанные на реакциях кросс-сочетания в различных условиях (за исключением применения активации под действием микроволнового излучения)
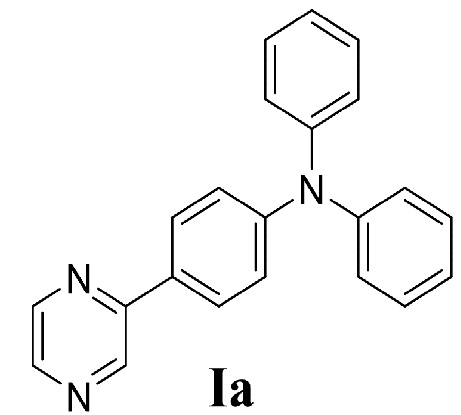
, а также его спектральные характеристики описаны в литературе [C. Liu, Q. Ni. Method for synthesizing 4-diphenylamino-biaryl compounds by Suzuki cross coupling reaction in aqueous phase. // Patent CN 101948366 A, 2011; C. Liu, Q. Ni, J. Qiu. Very Fast, Ligand-Free and Aerobic Protocol for the Synthesis of 4-Aryl-Substituted Triphenylamine Derivatives. // European Journal of Organic Chemistry 2011, Issue 16, P. 3009–3015; C. Liu, Y. Wu, N. Han, J. Qiu. Efficient synthesis of 4-heteroaryl-substituted triphenylamine derivatives via a ligand-free Suzuki reaction. // Applied Organometallic Chemistry 2011, Vol. 25, Issue 12, P. 862–866; C. Liu, X. Rao, X. Song, J. Qiu, Z. Jin. Palladium-catalyzed ligand-free and aqueous Suzuki reaction for the construction of (hetero)aryl-substituted triphenylamine derivatives. // RSC Advances 2013, Vol. 3, Issue 2, P. 526–531; C. Liu, X. Song. Metal ligand-platinum complex and manufacture. // Patent CN 103145763 A, 2013; K. Hoffert, R. J. Durand, S. Gauthier, F. Robin-le Guen, S. Achelle. Synthesis and Photophysical Properties of a Series of Pyrazine-Based Push-Pull Chromophores. // European Journal of Organic Chemistry 2017, Issue 3, P. 523–529].
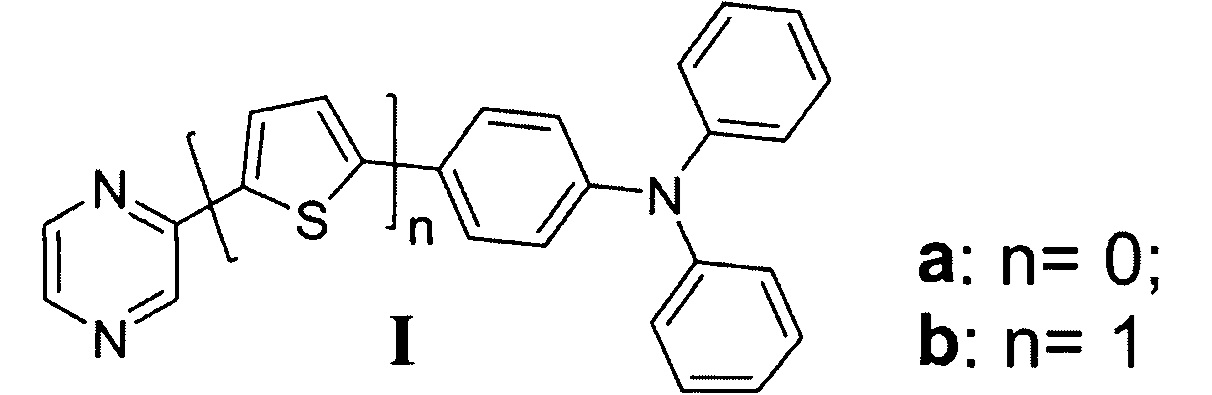
Сведения о способе синтеза, физико-химических свойствах и области применения 2-[5-(4-дифениламинофенил)-тиофени-2-ил]пиразина (Ib) в научно-технической и патентной литературе отсутствуют.
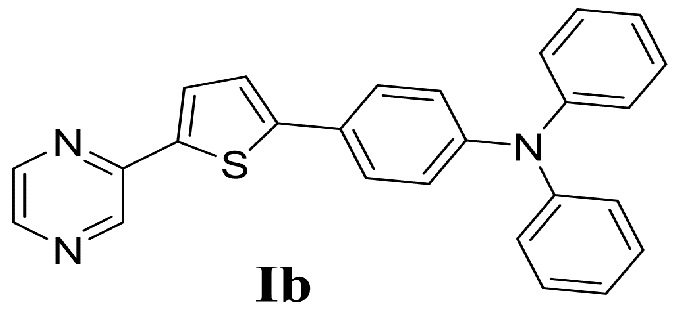
Наиболее близкими по структуре к соединению Ia является соединение 1 – 5- [4-(дифениламино)фенил]-2-пиразинкарбоновая кислота, а соединению Ib является соединение 2 – 5-{5-[4-(дифениламино)фенил]-тиофен-2-ил}-2-пиразинкарбоновая кислота, в структуре которых отсутствует дополнительная карбоксильная группу [H. Aihara, T. Shono. Preparation of pyrazine carboxylic acid compounds useful for dye-sensitized solar cells. // Patent JP 2015140319 A, 2015].
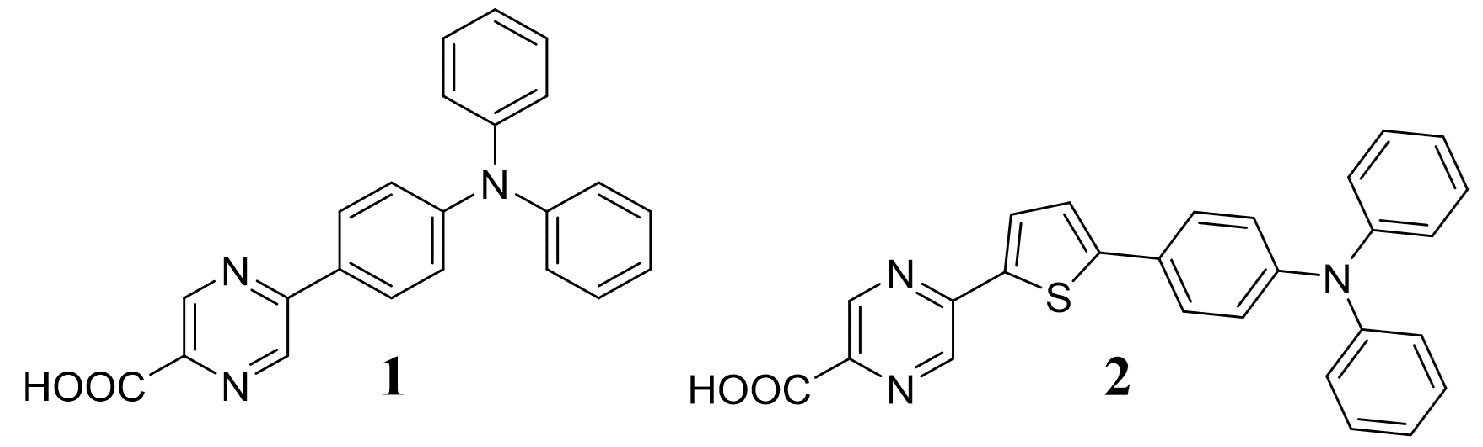
В литературе имеются данные об использовании соединений 1 и 2 в качестве красителя–сенсибилизатора для цветосенсибилизированных солнечных батарей [H. Aihara, T. Shono. Preparation of pyrazine carboxylic acid compounds useful for dye-sensitized solar cells. // Patent JP 2015140319 A, 2015].
Сведения о других свойствах и областях применения монозамещенных пиразинов, содержащих трифениламиновый заместитель общей формулы (I) отсутствуют.
В литературе описан способ получения соединения (2), который основан на использовании реакции кросс-сочетания по Сузуки 5-(5-бром- тиофен-2-ил)-пиразин-2-карбоновой кислоты (3) с пинаконовым эфиром 4-(дифениламино)фенилбороновой кислоты (4) в 1,4-диоксане в присутствии тетракис(трифенифосфин)палладием(0) и фосфата калия в виде 2М водного раствора при 100° С в течение 24 ч [H. Aihara, T. Shono. Preparation of pyrazine carboxylic acid compounds useful for dye-sensitized solar cells. // Patent JP 2015140319 A, 2015].
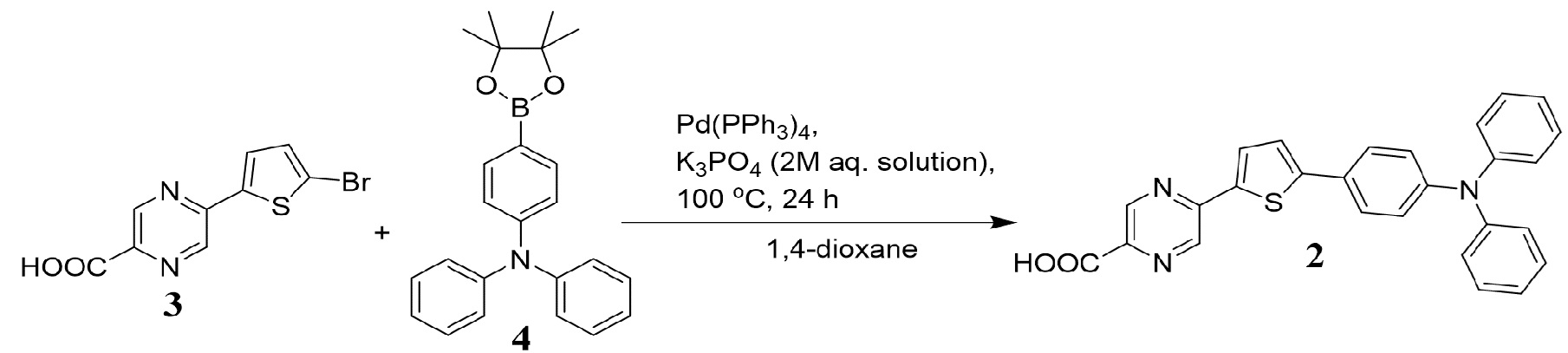
Соединения Ia и Ib получены аналогичным способом с использованием промотируемой микроволновым излучением реакции кросс-сочетания по Сузуки из 2-хлорпиразин (5) [или 2-(5-бромтиофен-2-ил)пиразин (6)] (1.0 ммоль) и пинаконового эфира 4-(дифениламино)фенилбороновой кислоты (4) (1.2 ммоль) в 1,4-диоксане при 160°С в течение 30 минут.
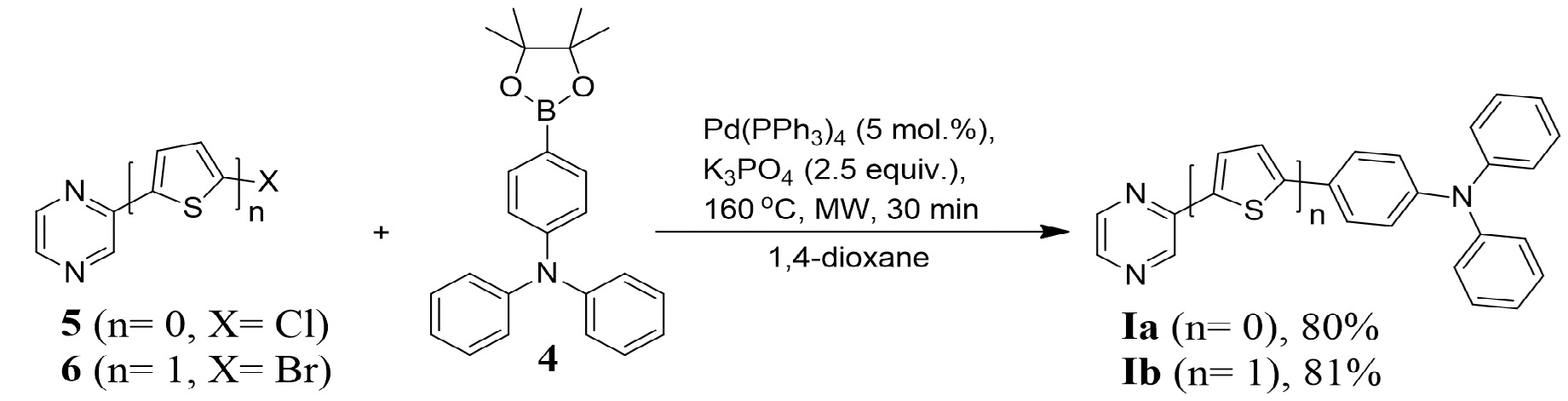
Времени 30 минут достаточно для протекания реакции, увеличение времени не приводит к существенному увеличению выхода 2-(4-дифениламинофенил)пиразина (Ia) [или 2-[5-(4-дифениламинофенил)-тиофен-2-ил]пиразина (Ib)], тогда как уменьшение времени менее 30 минут приводит к снижению выхода продукта (I).
Выделение продукта (I) осуществляют путем хроматографического разделения на силикагеле при соотношении в элюенте этилацетат – гексан, 1:4. Увеличение данного соотношения в пользу гексана приведет к необоснованному расходу растворителя, тогда как при увеличении доли этилацетата в элюенте не происходит селективного отделения целевого продукта общей формулы (I) от побочных примесей.
Анализ промежуточных и целевых соединений проводят с использованием ЯМР-спектроскопии (Спектры ЯМР1Н и13C измерены на спектрометре Bruker AVANCEIII-500 (500 и 126 МГц) в растворе ДМСО-d6, внутренний стандарт ТМС) и масс-спектры высокого разрешения зарегистрированы на спектрометре Bruker maXis Impact HD (ионизация электрораспылением). Температуры плавления определены на комбинированных столиках Boetius.
Пример 1.
2-Хлорпиразин (5) 115 мг (1.0 ммоль) смешивают с пинаконовым эфиром 4-(дифениламино)фенилбороновой кислоты (4) 446 мг (1.2 ммоль), тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль) и K3PO4 530 мг (2.5 ммоль). Полученную смесь растворяют в 15 мл дегазированного 1,4-диоксана. Полученную смесь облучают микроволновым излучением при 160°С (250 Вт) в течение 30 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат-гексан, 1:4). В результате получают 2-(4-дифениламинофенил)пиразин (Ia) в виде желтого порошка. Выход 259 мг (80 %).
Т.пл. 74–76°С.
Спектр ЯМР1Н (500 МГц, ДМСО-d6) δ (м.д.): 9.17 (д, J = 1.5 Гц, 1H), 8.65 (дд, J = 2.5, 1.5 Гц, 1H), 8.52 (д, J = 2.5 Гц, 1H), 8.07–8.04 (м, 2H), 7.39–7.34 (м, 4H), 7.16–7.10 (м, 6H), 7.05–7.01 (м, 2H).
Спектр ЯМР13С (126 МГц, ДМСО-d6) δ (м.д.): 151.1, 148.9, 146.5, 144.1, 142.4, 141.4, 129.7, 128.8, 127.8, 124.9, 124.0, 121.6.
Найдено, m/z: 324.1502 [М+Н]+. C22H18N3. Вычислено, m/z: 324.1495.
Пример 2.
2-(5-Бромтиофен-2-ил)пиразин 241 мг (1.0 ммоль) (6) смешивают с пинаконовым эфиром 4-(дифениламино)фенилбороновой кислоты (4) 446 мг (1.2 ммоль), тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль) и K3PO4 530 мг (2.5 ммоль). Полученную смесь растворяют в 15 мл дегазированного 1,4-диоксана. Полученную смесь облучают микроволновым излучением при 160°С (250 Вт) в течение 30 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат-гексан, 1:4). В результате получают 2-[5-(4-дифениламинофенил)-тиофен-2-ил]пиразин (Ib) в виде желтого порошка. Выход 251 мг (81 %).
Т.пл. 133–134°С.
Спектр ЯМР1Н (500 МГц, ДМСО-d6) δ (м.д.): 9.24 (д, J = 1.5 Гц, 1H), 8.57 (дд, J = 2.6, 1.5 Гц, 1H), 8.48 (д, J = 2.6 Гц, 1H), 7.97 (д, J = 3.9 Гц, 1H), 7.67–7.62 (м, 2H), 7.51 (д, J = 3.9 Гц, 1H), 7.37–7.31 (м, 4H), 7.13–7.06 (м, 6H), 7.01–6.97 (м, 2H).
Спектр ЯМР13С (126 МГц, ДМСО-d6) δ (м.д.): 147.6, 147.4, 146.7, 146.5, 144.0, 142.4, 140.4, 139.2, 129.6, 128.0, 127.0, 126.6, 124.5, 124.1, 123.6, 122.6.
Найдено, m/z: 406.1370 [М+Н]+. C26H20N3S. Вычислено, m/z: 406.1372.
Сведения, подтверждающие возможность осуществления изобретения.
Визуальное обнаружение нитроароматических соединений с использованием заявляемого соединения (I).
Для визуального обнаружения нитроароматических соединений с использованием 2-(4-дифениламинофенил)пиразина (Ia) и 2-[5-(4-дифениламинофенил)-тиофен-2-ил]пиразина (Ib) проведено изучение взаимодействия соединения общей формулы I с нитроароматическими соединениями (Таблица 1), которое проводят в растворе сухого дихлорметана в концентрации сенсора 5×10-7М.
В качестве соединения сравнения используют N,N-дифенил-4-[5- (пиримидин-4-ил)тиофен-2-ил]анилин (II)
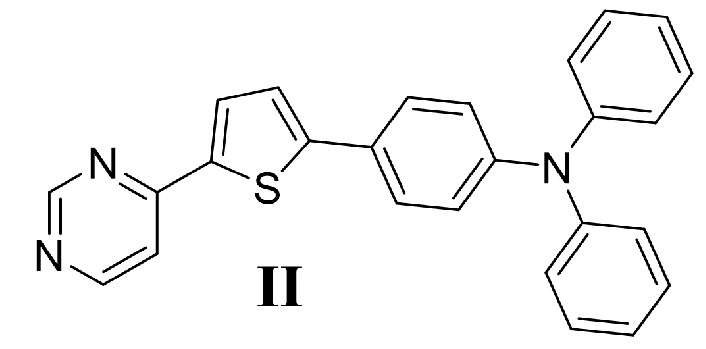
который имеет оптические характеристики (максимум возбуждения флуоресценции – Ex и максимум испускания флуоресценции – Em), близкие к соединению I (Таблица 2) и для которого описано применение в качестве мономолекулярного оптического сенсора для обнаружения присутствия нитроароматических соединений [E.V. Verbitskiy, A.A. Baranova, K.I. Lugovik, M.Z. Shafikov, K.O. Khokhlov, E.M. Cheprakova, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Detection of nitroaromatic explosives by new D–π–A sensing fluorophores on the basis of the pyrimidine scaffold. // Analytical and Bioanalytical Chemistry, 2016, Vol. 408, Issue 15, P. 4093-4101; Вербицкий Е.В., Чепракова Е.М., Баранова А.А., Хохлов К.О., Русинов Г.Л., Чарушин В.Н. Применение 4-(5-R-тиофен-2-ил)пиримидина в качестве мономолекулярного оптического сенсора для обнаружения нитроароматических соединений. // Патент РФ 2616296 C1, Бюллетень изобретений №11, 2017 от 14.04.2017].
Таблица 1. Перечень нитроароматических соединений, которые могут быть обнаружены с использованием сенсора на основе соединения I.
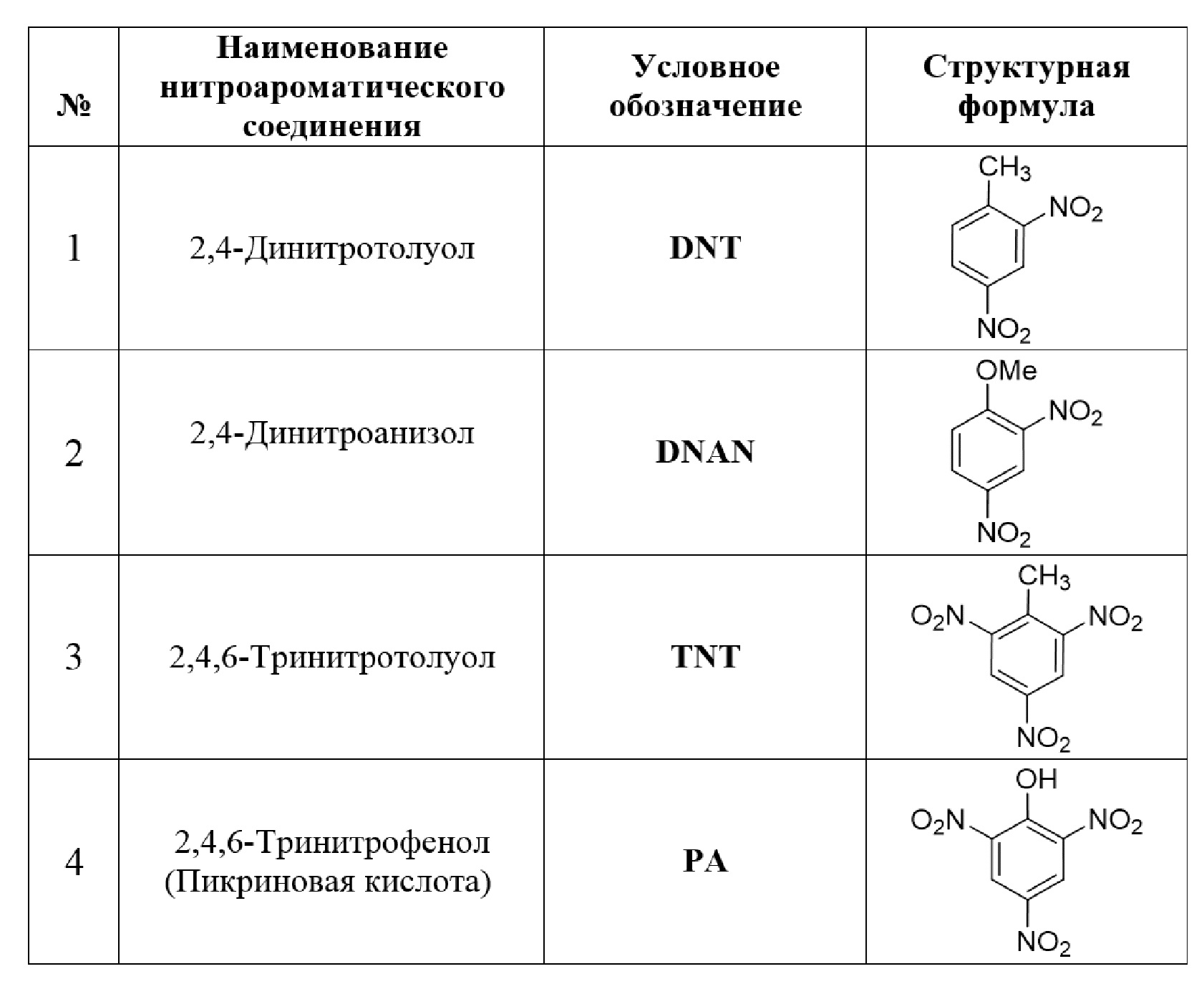
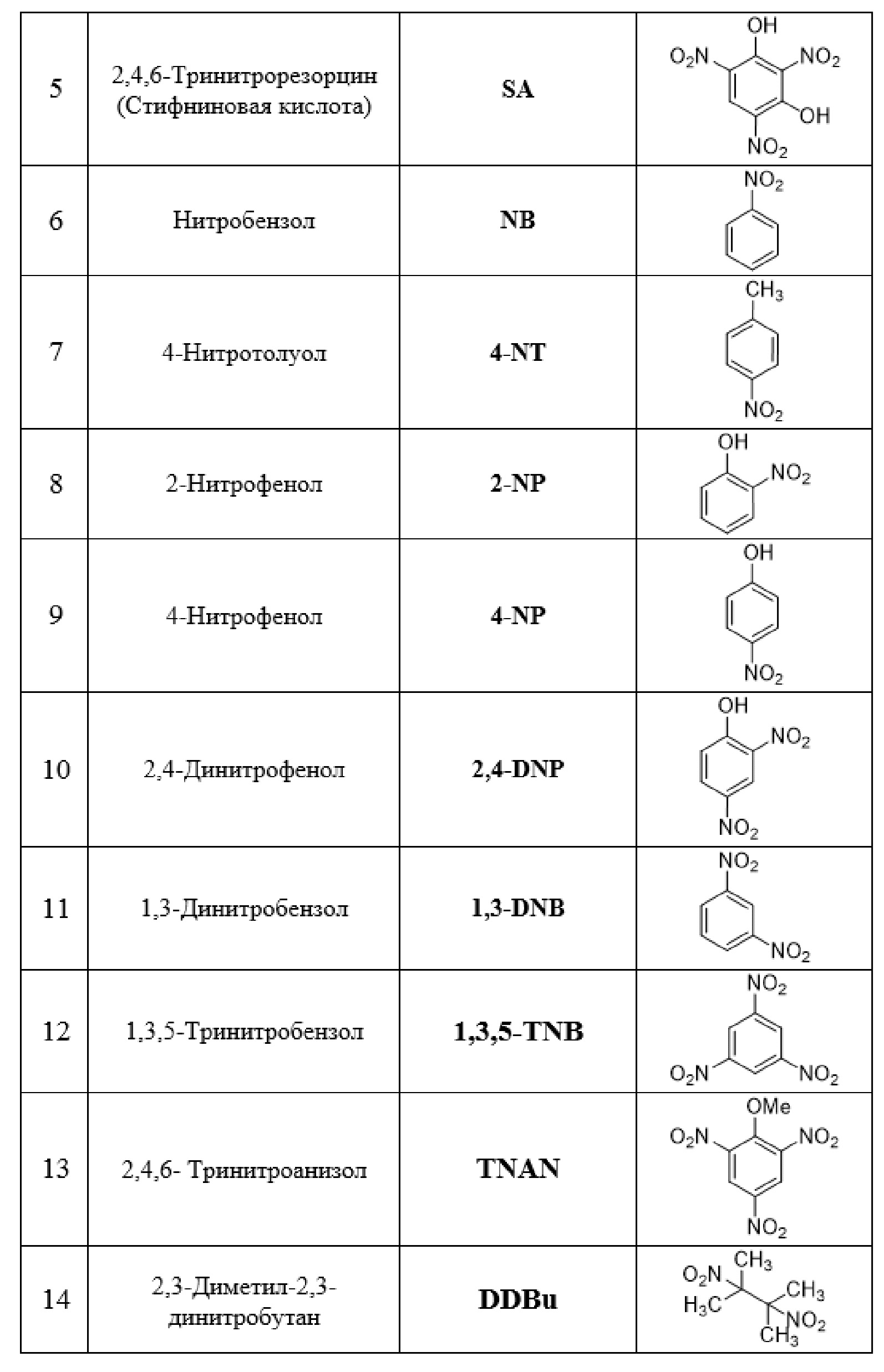
Флуоресцентное титрование проводят, используя растворы нитроароматических соединений, перечисленные в Таблице 1, в концентрациях от 5×10-7 М до 1×10-3 М.
Для оценки эффективности предлагаемого соединения I определяют значение константы Штерна-Фольмера (Stern-Volmer) – Ksv и пределов обнаружения нитроароматического соединения (detection limit) – DT.
Константа Штерна-Фольмера – константа тушения, она же константа ассоциации полученного комплекса предлагаемого соединения с нитроароматическим соединением, выражается уравнением:
I0/I = 1+Ksv[Q],
где I0 и I – интенсивность флуоресценции до и после добавления нитроароматического соединения (quencher);
Q – концентрация нитроароматического соединения, моль/л;
Ksv – значение константы, л/моль.
Предел обнаружения нитроароматического соединения в растворе ацетонитрила определяют и рассчитывают в соответствии со следующими формулами:
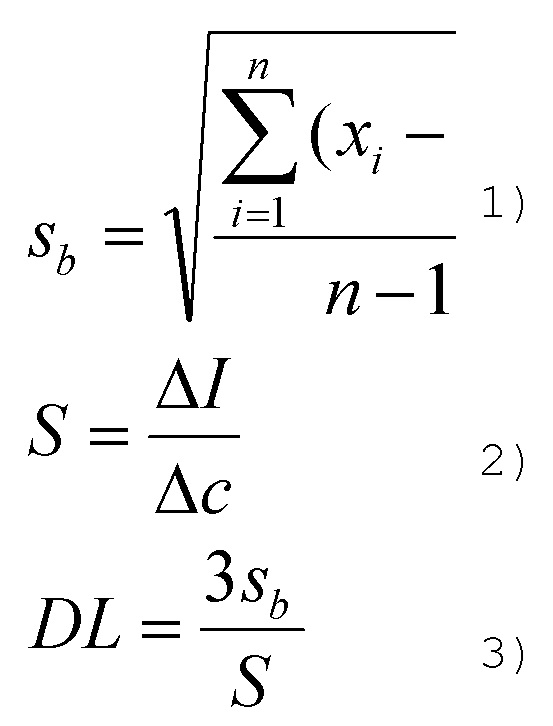
где Sb – стандартное отклонение путем измерения интенсивности растворов соединения I или соединения сравнения, в отсутствии нитроароматического соединения, более 10 раз;
xi – интенсивность флуоресценции (в каждом случае) для растворов соединения I или соединения сравнения, в отсутствии нитроароматического соединения;
- средняя интенсивность флуоресценции растворов соединения I или соединения сравнения, в отсутствие нитроароматического соединения;
S – величина, характеризующая изменение интенсивности флуоресценции для растворов соединения I или соединения сравнения, в отсутствие нитроароматического соединения и в присутствии раствора нитроароматического соединения с максимальной концентрацией.
ΔI – разность интенсивности флуоресценции для растворов соединения I или соединения сравнения в отсутствие нитроароматического соединения и в присутствии раствора нитроароматического соединения с максимальной концентрацией.
Δс – разность концентраций растворов соединения I или соединения сравнения в отсутствие нитроароматического соединения и в присутствии раствора нитроароматического соединения с максимальной концентрацией.
Предлагаемые соединения Ia и Ib превосходит соединение сравнения II как по значению предела обнаружения, так и по величине константы Штерна-Фольмера (Таблица 2).
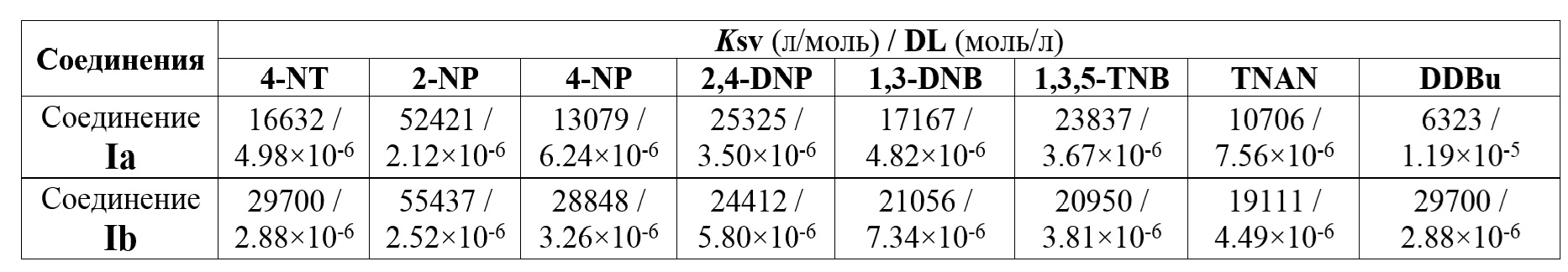
Так, предел обнаружения 2,4,6-тринитротолуола (TNT) при использовании в качестве сенсора соединений Ia и Ib превышает соответствующий предел обнаружения для соединения сравнения в 2 раза. Величина констант Штерна-Фольмера для предлагаемых соединений Ia и Ib также превышает соответствующие значения констант Штерна-Фольмера для соединения сравнения в большинстве случаев в несколько десятков раз. Кроме того, соединения Ia и Ib имеют значительно больший диапазон детектируемых нитросоединений – 18 соединений (Таблица 3), тогда как для соединения сравнения II описано применение лишь в отношении 6 нитроароматических соединений.
Таким образом, полученные результаты для предлагаемого соединения общей формулы (I) показывают высокую чувствительность и селективность для визуального обнаружения широкого ряда нитроароматических соединений.
Таблица 2. Значения констант тушения флуоресценции (констант Штерна-Фольмера) и пределов обнаружения различных нитроароматических соединений для соединения Ia, Ib и соединения сравнения – N,N-дифенил-4-[5- (пиримидин-4-ил)тиофен-2-ил]анилинa (II).
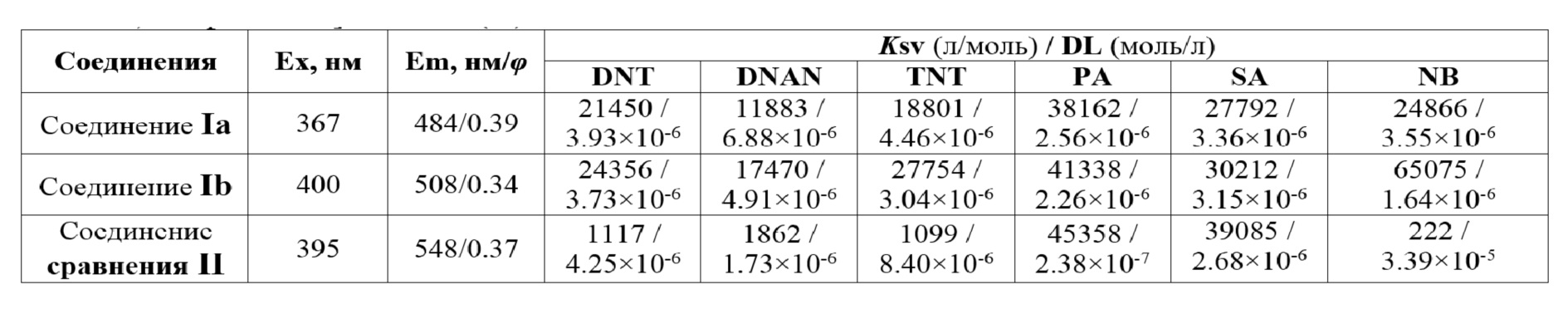
Измерения фотофизических свойств для соединений Ia и Ib проведены в дихлорметане, для соединения сравнения – N,N-дифенил-4-[5- (пиримидин-4-ил)тиофен-2-ил]анилинa (II) измерения проводили в растворе ацетонитрила.
Ex – Максимум возбуждения флуоресценции;
Em – Максимум испускания флуоресценции;
φ – Относительный квантовый выход. В качестве стандарта для измерения относительного квантового выхода использовали раствор хинин сульфата (φ = 0.55) в 0.1 Н H2SO4. Методика определения относительного квантового выполнена согласно процедуре, описанной в литературе [A. M. Brouwer. Standards for photoluminescence quantum yield measurements in solution (IUPAC Technical Report). // Pure Appl. Chem. 2011, 83, 2213-2228].
Таблица 3. Значения констант тушения флуоресценции (констант Штерна-Фольмера) и пределов обнаружения различных нитроароматических соединений для соединения Ia и Ib.
Реферат
Изобретение относится к применению 2-монозамещенных пиразинов, содержащих трифениламиновый заместитель, общей формулы (I) в качестве мономолекулярных сенсоров для обнаружения нитроароматических соединений. Технический результат: предложено применение соединений общей формулы (I), которые показывают высокую чувствительность и селективность для визуального обнаружения широкого ряда нитроароматических соединений. 2 пр., 3 табл.
Формула

Комментарии