Производные 2,8-дизамещенного хиназолинона или их соли, фармацевтическая композиция с воздействующей на уровень кгмп и камп активностью на их основе - RU2158733C2
Код документа: RU2158733C2
Чертежи

Описание
Изобретение относится к новым азотсодержащим гетероциклическим соединениям с ценными фармакологическими свойствами, в частности к производным 2,8-дизамещенного хиназолинона или их солям и фармацевтической композиции с воздействующей на уровень кГМП и кАМП активностью на их основе.
Из заявки WO 93/12095 известны производные хиназолинона, обладающие биологической активностью, в частности воздействующей на уровень кГМП и кАМП активностью.
Задачей изобретения является расширение ассортимента производных хиназолинона, обладающих биологической активностью, в частности воздействующей на уровень кГМП и кАМП активностью.
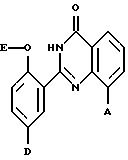
Поставленная задача решается производными 2,8-дизамещенного хиназолинона общей формулы (I)

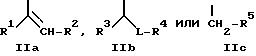
где A - оксиранил, незамещенный или замещенный линейным или разветвленным алкилом с 1-8 атомами углерода, незамещенным или замещенным фенилом, или радикал формулы
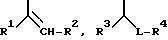
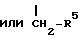
где R1 - водород или линейный или разветвленный алкил с 1-6 атомами углерода,
R2 - линейный или разветвленный алкил с 1-8 атомами углерода, незамещенный или замещенный фенилом,
R3 - линейный или разветвленный алкил с 1-5 атомами углерода или группа формулы -OR6, где R6 означает линейный или разветвленный алкил с 1-5 атомами углерода,
R4 - линейный или разветвленный алкил с 2-10 атомами углерода, незамещенный или замещенный фенилом,
L - радикал формул -CO-, -CH(OH), -CH2, -CH(N3) или -CH(OSO2R7), где R7 означает линейный или разветвленный алкил с 1-4 атомами углерода,
R5 - линейный или разветвленный алкил с 3-8 атомами углерода, незамещенный или замещенный фенилом, бензил или 2-фенилэтил,
D - водород или группа формулы - SO2-NR8R9, где R8 и R9 вместе с атомом азота образуют морфолиновое кольцо,
E - линейный или разветвленный алкил с 1-8 атомами углерода, или их солями.
Предпочтительными солями являются физиологически переносимые соли с органическими или неорганическими кислотами. Предпочтительно используют соли с неорганическими кислотами, такими как, например, соляная кислота, бромистоводородная кислота, фосфорная кислота или серная кислота, или соли с неорганическими карбоновыми кислотами или сульфокислотами, такими как, например, уксусная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, лимонная кислота, винная кислота, молочная кислота, бензойная кислота или метансульфокислота, этансульфокислота, фенилсульфокислота, толуолсульфокислота или нафталинсульфокислота.
Предпочтительными являются соединения общей формулы (I), где
A - оксиранил, незамещенный или замещенный линейным или
разветвленным алкилом с 1-7 атомами углерода, незамещенным или замещенным фенилом, или радикал формулы


где R1 - водород или линейный или разветвленный алкил с 1-5 атомами углерода,
R2 - линейный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный фенилом,
R3 - линейный или разветвленный алкил с 1-4 атомами углерода или группа формулы -OR6, где R6 означает линейный или разветвленный алкил с 1-4 атомами углерода,
R4 - линейный или разветвленный алкил с 2-8 атомами углерода, незамещенный или замещенный фенилом,
L - радикал формулы -CO-, -CH(OH), -CH2, -CH(N3) или -CH(OSO2R7), где
R7 означает линейный или разветвленный алкил с 1-3 атомами углерода,
R5 - линейный или разветвленный алкил с 3-7 атомами углерода, незамещенный или замещенный фенилом, или бензил или 2- фенилэтил,
D - водород или группа формулы -SO2-NR8R9, где R8 и R9 вместе с атомом азота означают морфолиновое кольцо,
E - линейный или разветвленный алкил с 1-6 атомами углерода, или их соли.
Особенно предпочтительными являются соединения общей формулы (I), где
A - оксиранил, незамещенный или замещенный
линейным или разветвленным алкилом с 1-6 атомами углерода, незамещенным или замещенным фенилом, или радикал формулы
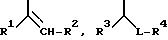

где R1 - водород или неразветвленный или разветвленный алкил с 1-3 атомами углерода,
R2 - неразветвленный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный фенилом,
R3 - неразветвленный или разветвленный алкил с 1-4 атомами углерода или группа формулы -OR6, где R6 означает неразветвленный или разветвленный алкил с 1-3 атомами углерода,
R4 - линейный или разветвленный алкил с 2-7 атомами углерода, незамещенный или замещенный фенилом,
L - радикал формул -CO-, -CH(OH), -CH2, -CH(N3) или -CH(OSO2R7), где R7 означает линейный или разветвленный алкил с 1-3 атомами углерода,
R5 - линейный или разветвленный алкил с 3-6 атомами углерода, незамещенный или замещенный фенилом, бензил или 2- фенилэтил,
D - водород или группа формулы -SO2-NR8R9, где R8 и R9 вместе с атомом азота означают морфолиновое кольцо,
E - линейный или разветвленный алкил с 1-4 атомами углерода, или их соли.
Предлагаемые соединения общей формулы (I) можно получать
известными способами, например за счет того, что соединения общей формулы (II)

где D имеет вышеуказанное значение,
T - алкил с 1-4 атомами углерода,
R10 - галоген, предпочтительно бром или йод, подвергают циклизации формамидом, получаемые при этом соединения общей формулы (III)

где D, E и R10 имеют вышеуказанные значения, подвергают взаимодействию с соединениями общей формулы (IV)
R1 - CH = CH - R2,
где R1 и R2 имеют вышеуказанные значения, в среде инертного растворителя в присутствии основания и системы три-о-толилфосфина и ацетата палладия II и получаемые при этом соединения общей формулы (Ia)

где - D, E, R1 и R2 имеют вышеуказанное значение, обрабатывают следующим образом: двойную связь можно подвергать гидрированию, если A означает замещенный оксиранил, то двойную связь подвергают окислению путем обработки окислителем известными приемами в среде инертного растворителя и получаемые при этом эпоксидные соединения переводят путем разрыва кольца в соответствующие гидроксильные соединения, которые, в случае необходимости после активации, подвергают реакции нуклеофильного замещения или же гидроксильные соединения окисляют до оксосоединений.
Вышеуказанный способ иллюстрируется следующей схемой:


1) ацетат палладия II
2) м-хлорнадбензойная кислота
Для осуществления вышеуказанного способа пригодны инертные органические растворители, которые не меняются в условиях реакции. К ним предпочтительно принадлежат простые эфиры, такие как, например, простой диэтиловый эфир, диоксан, тетрагидрофуран, простой гликольмоно- или гликольдиметиловый эфир, галогенированные углеводороды, такие как, например, ди-, три- или четыреххлористый метан, дихлорэтилен, трихлорэтилен, сложный этиловый эфир уксусной кислоты, ацетонитрил, диметилформамид, триамид гексаметилфосфорной кислоты и ацетон. Само собой разумеется, что можно также использовать смеси этих растворителей. Особенно предпочтительными являются дихлорметан и диметилформамид.
Температура реакции обычно может колебаться в широких пределах. Обычно работают в пределах от -20 до 200oC, предпочтительно от 0 до 25oC.
Циклизацию обычно проводят при температурах от 50 до 200oC, предпочтительно от 160 до 180oC.
Получение соединений общей формулы (Ia) обычно осуществляют в среде одного из вышеупомянутых растворителей, предпочтительно диметилформамида, и в присутствии основания.
В качестве основания можно использовать все неорганические или органические основания. К ним предпочтительно принадлежат карбонаты щелочного металла, такие как, например, карбонат натрия, карбонат калия или карбонат цезия, алкоголяты щелочных или щелочноземельных металлов или амиды щелочных или щелочноземельных металлов, такие как, например, метилат натрия или калия, этилат натрия или калия, трет.-бутилат калия или амид калия, или же органические амины (триалкиламины с 1 - атомами углерода в каждой алкильной группе), такие как, например, триэтиламин или трибутиламин. Особенно предпочтительно используют трибутиламин.
Обычно основание используют в количестве 0,05 моль - 10 моль, предпочтительно 1 - 2 моль, в пересчете на 1 моль соединения формулы (III).
Реакцию обычно осуществляют при температурах от 0oC до 180oC, предпочтительно от 30 до 150oC.
Все операции обычно проводят при атмосферном далении. Однако также возможно работать при повышенном или пониженном давлении (например, от 0,5 до 5 бар).
Эпоксидирование проводят в среде одного из вышеупомянутых растворителей, предпочтительно сухого трихлорметана, в присутствии окислителя, такого как, например, м-хлорнадбензойная кислота или перекись водорода. Предпочтительно используют м-хлорнадбензойную кислоту.
Эпоксидирование обычно проводят при температурах от -20 до +50oC, предпочтительно от 0 до 30oC.
Гидрирование обычно проводят в среде одного из вышеприведенных спиртов, предпочтительно метанола.
В качестве катализатора обычно пригодны палладиевые соединения. Предпочтительно используют палладий на угле.
Катализатор используют в количестве 0,01 - 0,4 моль, предпочтительно 0,05 - 0,2 моль, в пересчете на моль соответствующего спирта.
Гидрирование обычно осуществляют при температурах от -20 до +50oC, предпочтительно от 0 до 30oC.
Гидрирование обычно проводят при атмосферном давлении. Однако можно также работать при повышенном или пониженном давлении (например, в пределах от 0,5 до 5 бар).
Разрыв эпоксида осуществляют известными приемами (см. Такано и др. Heterocycles 29 (1989), стр. 249), а также в среде одного из вышеупомянутых спиртов, предпочтительно метанола в присутствии этерата бортрифторида.
Свободные гидроксильные соединения подвергают взаимодействию с хлорангидридами алкилсульфокислоты в среде одного из вышеупомянутых растворителей в присутствии одного из оснований, предпочтительно вышеуказанных дихлорметана и триэтиламина, при температурах от -20 до +20oC, предпочтительно 0oC, и атмосферном давлении.
Введение азида осуществляют обычно путем взаимодействия соответствующих замещенных алкилсульфонилоксилом соединений с азидом натрия в среде одного из вышеупомянутых растворителей, предпочтительно диметилформамида, при температурах от 50 до 120oC, предпочтительно 100oC, и атмосферном давлении.
Кетоны получают из соответствующих гидроксильных соединений известными приемами (например, окислением по Сверну).
Чистые энантиомерные соединения получают известными приемами, например путем хроматографии рацемических соединений обшей формулы (I) на хиральных фазах.
Соединения обшей формулы (II) частично известны. Их можно получать за
счет того, что соединения общей формулы (V)

где R10 и T имеют вышеуказанные значения, подвергают взаимодействию с хлорангидридом 2-н-алкилоксибензойной кислоты формулы (VI)

где D и E имеют вышеуказанные значения, в среде инертного растворителя в присутствии основания.
В качестве растворителя пригодны вышеупомянутые растворители, причем предпочтительно используют дихлорметан.
В качестве оснований пригодны все циклические амины, такие как, например, пиперидин, пиридин, пиримидин, диметиламинопиридин или алкиламины с 1 - 4 атомами углерода, как, например, триэтиламин. Предпочтительно используют триэтиламин и пиридин.
Основание обычно используют в количестве от 0,5 моль до 2 моль, предпочтительно от 1 до 1,2 моль, в пересчете на 1 моль соединений общей формулы (V).
Температура реакции может колебаться в широких пределах. Обычно работают при температурах от -20 до +200oC, предпочтительно от 0 до 25oC.
Соединения общей формулы (V) известны (см., например, J. Heterocyclic. Chem. , 26 (5), 1989, стр. 1405 - 1413), а соединения общей формулы (VI) известны, например, из заявки N ЕР 0526004 Al.
Соединения обшей формулы (III) являются новыми и их можно получать вышеописанным образом.
Соединения общей формулы (IV) известны.
Соединения общей формулы (Ia) являются новыми и их можно получать описанным выше образом.
Предлагаемые соединения общей формулы (I) и (Ia) проявляют неожидаемый, ценный фармакологический спектр действия.
Они ингибируют одну или несколько метаболизирующих кГМП фосфодиэстераз. Это приводит к различному повышению уровня кГМП. Повышение уровня кГМП может привести к антитромботическому, расширяющему сосуды, антиаритмическому и/или противоспалительному действию. Избирательность также определяется содержанием изоэнзимов в ткани.
Кроме того, предлагаемые соединения усиливают действие веществ, таких как, например, выделенный из эндотелия фактор релаксации и предсердный натриуретический пептид, которые повышают уровень кГМП.
Поэтому их можно использовать в лекарственных средствах для лечения воспалительных заболеваний, таких как, например, астма, воспалительные дерматозы, повышенное кровяное давление, стабильная и нестабильная ангина, заболевания периферических и сердечных сосудов, аритмии, тромбоэмболические заболевания и ишемии, такие как, например, инфаркт миокарда, мозговой инсульт, транзисторные и ишемические атаки, стенокардия, нарушения периферического кровообращения, предотвращение рестонозов, например, после тромболизов чрескожной транслуминальной ангиопластики и шунтирования, чрескожной транслуминальной ангиопластики коронарных сосудов, а также септический шок и заболевания мочеполовой системы, такие как, например, гипертрофия предстательной железы, импотенция и недержание мочи.
Активность фосфордиэстераз
Стимулируемую кГМП фосфордиэстеразу II (далее "ФДЭ II"), ингибируемую кГМП фосфор дизестеразу III (далее "ФДЭ III") и
специфичную относительно кАМП фосфордиэстеразу (далее "ФДЭ IV") выделяют из миокарда свиньи или крупного рогатого скота. Стимулируемую кальциевой солью калмодулина фосфордиэстеразу I (далее "ФДЭ I")
выделяют из аорты или мозга свиньи. Специфичную относительно кГМП фосфордиэстеразу V (далее "ФДЭ V") получают из тонкого кишечника или аорты свиньи и/или из человеческих тромбоцитов. Очистку проводят
путем анионообменной хроматографии на ионите марки MonoQ (зарегистрированный товарный знак шведской фирмы Pharmada) в основном по методу М. Хой и Майльс Д. Хауслей, Biochemical Pharmacology, том 40,
стр. 193 - 202 (1990).
Определение активности энзимов осуществляют с применением смеси 100 мкл исследуемого соединения в 20 ммоль буфера Tris/HCl (значение pH 7,5), содержащей 5 ммоль хлорида магния, 0,1 мг/мл альбумина сыворотки крупного рогатого скота и3НкАМП радиоактивностью 800 Бк или3НкГМП радиоактивностью 800 Бк. Конечная концентрация соответствующих нуклеотидов составляет 10-6 моль/л. Реакцию начинают путем добавления энзима, количество которого выбирают так, что во время 30-минутной инкубации прореагируют около 50% субстрата. Для исследования стимулируемой кГМП ФДЭ II используют в качестве субстрата3НкАМП и к исходной смеси добавляют 10-6 моль/л немеченого кГМП. Для исследования зависящей от кальциевой соли калмодулина ФДЭ I к реакционной смеси добавляют 1 мкмоль хлорида кальция и 0,1 мкмоль калмодулина. Реакцию прекращают путем добавления 100 мкл ацетонитрила, содержащего 1 ммоль кАМП и 1 ммоль АМП. По 100 мкл реакционной смеси разделяют высокопроизводительной жидкостной хроматографией и получаемые при этом продукты расщепления количественно определяют с помощью сцинтилляционного проточного счетчика. Измеряют концентрацию исследуемого соединения, при которой скорость реакции снижается на 50%. Результаты опыта сведены в таблице (см. в конце описания.
Вещества апплицировали в дозах 0,1 - 10 мг/кг или непосредственно в пещеристое тело, или интрадуоденально, ректально, орально, трансдермально или внутривенно.
Предлагаемая фармацевтическая композиция может представлять собой любой стандартный препарат, такой как, например, таблетки, драже, пилюли, гранулы, аэрозоли, сиропы, эмульсии, суспензии, растворы, которые приготовляют с применением инертных нетоксичных фармацевтически пригодных носителей или растворителей. При этом терапевтически активное соединение должно содержаться в препаратах в эффективном количестве, как правило, в концентрации около 0,5 - 90% от веса всей смеси, т.е. в количествах, которые достаточны для обеспечения нижеуказанных дозировок.
Препараты можно приготовлять, например, путем смешивания активного вещества с растворителями и/или носителями, в случае необходимости с применением эмульгаторов и/или диспергаторов, причем, например, в случае применения воды в качестве разбавителя можно применять еще органические растворители в качестве вспомогательного растворителя.
Аппликацию препаратов осуществляют известными приемами, предпочтительно орально, парентерально, трансдермально, чрезъязычно или внутривенно.
Для достижения эффективных результатов при внутренней аппликации обычно оказалось целесообразным применение предлагаемого активного вещества в количестве примерно 0,001 - 10 мг/кг, предпочтительно 0,01 - 10 мг/кг веса.
Однако в случае необходимости может быть целесообразным отклонение от указанного количества, а именно в зависимости от вида и веса подлежащего лечению пациента, от способа дачи, от индивидуального поведения пациента относительно лекарственного средства, вида и степени болезни, вида препарата и дачи и момента или промежутков дачи средства. В некоторых случаях дача в количестве, меньшем указанного минимального количества, может быть достаточной, в то время как в других случаях необходима большая указанного максимального количества доза. В случае дачи больших количеств может быть целесообразным распределение общего количества по нескольким индивидуальным дозам в сутки.
Нижеследующие примеры иллюстрируют получение исходных соединений.
Пример I
Сложный метиловый эфир 2-(2-н-пропоксибензамидо)-3-йод-бензойной кислоты
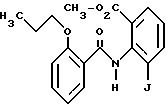
27,9 г (0,1 моль) сложного метилового эфира 2-амино-3-йод-бензойной кислоты и 15,4 мл (0,11 моль) триэтиламина растворяют в 170 мл абсолютного хлористого метилена. При температуре 0oC прикалывают раствор 20 г (0,1 моль) хлорангидрида 1-н-пропоксибензойной кислоты в 80 мл абсолютного хлористого метилена. Перемешивают при температуре 20oC в течение ночи, отфильтровывают осадок и последовательно экстрагируют 100 мл 1 н. соляной кислоты, 100 мл 1 н. гидроокиси натрия и 100 мл насыщенного раствора хлорида натрия. Органическую фазу сушат над сульфатом натрия, упаривают в вакууме и остаток очищают путем хроматографии на силикагеле (в качестве элюента используют смесь толуола и сложного этилового эфира в соотношении 95:5).
Выход: 36 г (81,4 % от теории).
Значение Rf: 0,25 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 10:1).
Пример II
Сложный метиловый эфир 2-(2-н-пропоксибензамидо)-3-бром- бензойной кислоты

Аналогично примеру I получают вышеуказанное соединение исходя из сложного метилового эфира 2-амино-3-бром-бензойной кислоты.
Выход: 60,4%.
Значение Rf: 0,19 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример III
2-(2-н-пропоксифенил)-8-йод-хиназолин-4-(3H)-он

19,4 г (44,17 ммоль) соединения примера I в 216 мл формамида перемешивают при температуре 180oC в течение 10 часов. После охлаждения добавляют 500 мл воды и экстрагируют 4 раза, каждый раз 300 мл хлористого метилена. Объединенные органические фазы сушат над сульфатом магния, растворитель упаривают в вакууме и остаток смешивают со смесью 100 мл диэтилового эфира и 50 мл петролейного эфира. Продукт отсасывают (17,8 г) и перекристаллизовывают из 250 мл абсолютного этанола.
Выход: 14,56 г (81,2 % от теории).
Точка плавления: 174oC.
Пример IV
2-(2-н-пропоксифенил)-8-бром-хиназолин-4-(3H)-он

Аналогично примеру III получают вышеуказанное соединение исходя из соединения примера II.
Выход: 60%.
Значение Rf: 0,7 (смесь толуола и сложного метилового эфира уксусной кислоты в соотношении 10:1).
Нижеследующие примеры иллюстрируют получение целевых продуктов формулы (I).
Пример 1
2-(2-н-пропоксифенил)-8-(1-гептен-1-ил)-хианазолин-4(3H)-он

5 г (12,31 ммоль) соединения примера III, 3,7 мл (15,4 ммоль) трибутиламина, 6,6 мл (46,2 ммоль) 1-гептена, 375 мг (1,23 ммоль) три-о-толилфосфина и 138 мг (0,6 ммоль) ацетата палладия-II перемешивают в 50 мл сухого диметилформамида при температуре 100oC в течение 2,5 часа. Охлаждают до комнатной температуры и после добавления 50 мл сложного этилового эфира уксусной кислоты промывают три раза, каждый раз 50 мл воды. После высушивания над сульфатом магния органическую фазу упаривают в вакууме и остаток хроматографируют на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 95:5. Содержащие продукт фракции объединяют и растворитель упаривают в вакууме. Получаемый маслянистый остаток выкристаллизовывают путем растирания вместе с 35 мл петролейного эфира.
Выход: 2,2 г (47,5%).
Точка плавления: 94oC.
Пример 2
2-(2-н-пропоксифенил)-8-(3-фенил-1-пропен-1-ил)-хиназолин- 4(3H)-он

Аналогично примеру 1 получают вышеуказанное соединение исходя из соединения примера III и 3-фенил-1-пропена.
Выход: 63,9%.
Точка плавления: 123 - 126oC (из диэтилового эфира).
Пример 3
2-(2-н-пропоксифенил)-8-(4-фенил-1-бутен- 1-ил)- хиназолин-4(3H)-он

Аналогично примеру 2 получают вышеуказанное соединение исходя из соединения примера III и 4-фенил-1-бутена.
Выход: 49,9%.
Значение Rf: 0,27 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 10:1).
Примеры 4 и 5
2-(2-н-пропоксифенил)-8-(5-фенил-2-пентен-2-ил)-хиназолин- 4(3H)-он и
2-(2-н-пропоксифенил)-8-(5-фенил-3-пентен-3-ил)-хиназолин- 4(3H)-он


Аналогично примеру 1 получают вышеуказанное соединение исходя из соединения примера III и 5-фенил-пентена-2.
Выход: 64,6 %.
Смесь обоих изомеров, которые гидрируют без разделения (см. пример 8).
Пример 6
2-(2-н-пропоксифенил)-8-(1-гептил)-хиназолин-4(3H)-он,

20 мг 10%-го палладия на угле предварительно гидрируют в среде 2 мл абсолютного метанола в течение 20 минут. Затем добавляют 200 мг (0,53 ммоль) соединения примера 1 в смеси 2 мл абсолютного метанола и 0,8 мл сложного этилового эфира уксусной кислоты и гидрируют при температуре 20oC в течение 1 часа. Катализатор отфильтровывают, и растворитель удаляют в вакууме. Остаток анализуют тонкослойной хроматографией и кристаллизуют в высоком вакууме. Выход: 180 мг (89,6% от теории). Точка плавления: 73oC.
Пример 7
2-(2-н-пропоксифенил)-8-(3-фенил-1-пропил)-хиназолин-4(3H)-он
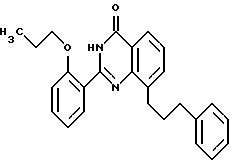
Аналогично примеру 6 получают вышеуказанное соединение исходя из соединения примера 2.
Выход: 79,7%.
Точка плавления: 89oC.
Пример 8
2-(2-н-пропоксифенил)-8-(4-фенил-1-бутил)-хиназолин-4(3H)-он

Аналогично примеру 6 получают вышеуказанное соединение исходя из соединения примера 3.
Выход: 86,2 %.
Точка плавления: 82oC.
Примеры 9 и 10
2-(2-н-пропоксифенил)-8-(5-фенил-2-пентил)-хиназолин-4(3H)-он и
2-(2-пропоксифенил)-8-(5-фенил-3-пентил)-хиназолин-4(3H)-он


Аналогично примеру 6 получают вышеприведенные соединения исходя из смеси изомеров примера 4. Разделение проводят путем работающей под средним давлением хроматографии на силикагеле с применением в качестве элюента смеси хлористого метилена и сложного этилового эфира уксусной кислоты в соотношении 20:5.
Выход соединения примера 9: 9%.
Выход соединения примера 10: 7,8%.
Значение Rf соединения примера 9: 0,49 (смесь хлористого метилена и сложного этилового эфира уксусной кислоты в соотношении 10 : 1).
Значение Rf соединения примера 10: 0,51 (смесь хлористого метилена и сложного этилового эфира уксусной кислоты в соотношении 10 : 1).
Пример 11
2-(2-н-пропоксифенил)-8-{1,2-эпокси-1-гептил)-хиназолин-4(3H)-он

1,5 г (3,98 ммоль) соединения примера 1 растворяют при температуре 0oC в 40 мл сухого хлороформа. Затем добавляют 0,98 г (3,98 ммоль) 70 %-ной м-хлорпербензойной кислоты. Реакционной смеси дают нагреваться до комнатной температуры, после чего перемешивают еще в течение 3 часов. Промывают три раза, каждый раз 30 мл 10 %-ного раствора бисульфита натрия и затем еще два раза, каждый раз 30 мл 1 н. раствора гидроокиси натрия, сушат над сульфатом магния и упаривают в вакууме. Остаток (1,6 г) хроматографируют на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 95:5.
Выход: 1,06 г (67,8%).
Точка плавления: 78oC.
Пример 12
2-(2-н-пропоксифенил)-8-(З-фенил-1,2-эпокси-1-пропил)- хиназолин-4(3H)-он

Аналогично примеру 11 получают вышеуказанное соединение исходя из соединения примера 2.
Выход: 47%.
Значение Rf: 0,27 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 10:1).
Пример 13
2-(2-н-пропоксифенил)-8-(4-фенил-1,
2-эпокси-1-бутил)-хиназолин-4(3H)-он

Аналогично примеру 11 получают вышеуказанное соединение исходя из соединения примера 3.
Выход: 61,4%.
Значение Rf: 0,29 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 1:1).
Пример 14
2-(2-н-пропоксифенил)-8-(1-метокси-2-окси-1-гептил)-хиназолин-4(3H)-он

К раствору 0,2 г (0,51 ммоль) соединения примера 11 в 6 мл метанола прикапывают при температуре 0oC 0,1 мл (0,76 ммоль) этерата бортрифторида. Через 20 минут добавляют при температуре 0oC 75 мл сложного этилового эфира уксусной кислоты и реакционную смесь экстрагируют три раза, каждый раз 50 мл воды. Органическую фазу хроматографируют на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1.
Выход: 160 мг (73,9% от теории).
Значение Rf: 0,19 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 15
2-(2-н-пропоксифенил)-8-(3-фенил-1-метокси-2-окси-1-пропил)- хиназолин-4(3H)-он

Аналогично примеру 14 получают вышеуказанное соединение исходя из соединения примера 12.
Выход: 32,5%.
Значение Rf: 0,20 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 16
2-(2-н-пропоксифенил)-8-(4-фенил-1-метокси-2-окси-1-бутил)- хиназолин-4(3H)-он
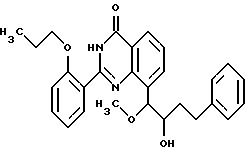
Аналогично примеру 14 получают вышеуказанное соединение исходя из соединения примера 10.
Выход: 74,4%.
Значение Rf: 0,17 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 17
2-(2-н-пропоксифенил)-8-(3-окси-2-октил)-хиназолин-4(3H)-он

К суспензии 0,14 г (1,53 ммоль) цианида меди-I в 3 мл абсолютного диэтилового эфира прикапывают при температуре -78oC 1,9 мл (3,06 ммоль) 1, 6-молярного раствора метиллития в диэтиловом эфире. Через час при температуре -78oC нагревают до температуры -45oC и прикапывают 200 мг (0,51 ммоль) соединения примера 11 в 2 мл абсолютного диэтилового эфира. Перемешивают в течение 1 часа при температуре 0oC и затем при температуре 20oC до окончания реакции (контроль путем тонкослойной хроматографии примерно через час). После добавления 50 мл сложного этилового эфира уксусной кислоты промывают три раза, каждый раз 30 мл воды. Органическую фазу сушат над сульфатом натрия и упаривают в вакууме на ротационном испарителе. Остаток хроматографируют на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 7:1.
Выход: 80 мг (38,4%).
Значение Rf: 0,22 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 18
2-(2-н-пропоксифенил)-8-(4-фенил-3-окси-2-бутил)-хиназолин- 4(3H)-он

Аналогично примеру 14 получают вышеуказанное соединение исходя из соединения примера 9.
Выход: 38,5%.
Значение Rf: 0,21 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 19
2-(2-н-пропоксифенил)-8-(5-фенил-3-окси-2-пентил)-хиназолин- 4(3H)-он

Аналогично примеру 17 получают вышеуказанное соединение примера исходя из соединения примера 13.
Выход: 51,4%.
Смесь диастереомеров со значениями Rf: 0,18 и 0,24 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 20
2-(2-н-пропоксифенил)-8-(4-окси-3-нонил)-хиназолин-4(3H)-он

1,02 мл 3 М раствора (3,05 ммоль) бромида этилмагния в диэтиловом эфире прикапывают при температуре -20oC к раствору 240 мг (0,61 ммоль) соединения примера 11 и перемешивают при температуре -20oC в течение 45 минут и затем при комнатной температуре в течение 20 минут. Путем добавления 4 мл абсолютного тетрагидрофурана растворяют маслянистый осадок и еще раз добавляют 1,02 мл 3 М раствора бромида этилмагния для завершения реакции. Через 15 минут добавляют при температуре 20oC 75 мл сложного этилового эфира уксусной кислоты и встряхивают три раза, каждый раз 50 мл воды. После высушивания органической фазы над сульфатом натрия растворитель упаривают в вакууме на ротационном испарителе и остаток хроматографируют на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 10:1.
Выход: 40 мг (15,5%).
Значение Rf: 0,24 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5 : 1).
Пример 21
2-(2-н-пропоксифенил)-8-(3-метансульфонилокси-2-октил)хиназолин-4(3H)-он

740 мг (1,81 ммоль) соединения примера 17 и 0,3 мл (2,17 ммоль) триэтиламина в 18 мл абсолютного хлористого метилена смешивают при температуре 0oC с 0,17 мл (2,17 ммоль) хлорангидрида метансульфокислоты. Реакционной смеси дают нагреваться до комнатной температуры и дополнительно перемешивают в течение 30 минут. Затем встряхивают два раза, каждый раз 1 н. гидроокисью натрия, и затем еще два раза, каждый раз 30 мл 1 н. соляной кислоты, органическую фазу сушат над сульфатом магния и растворитель отгоняют в вакууме путем упаривания на ротационном испарителе. Твердый остаток перешивают со смесью 30 мл сложного диэтилового эфира уксусной кислоты и 30 мл петролейного эфира и отфильтровывают продукт.
Выход: 650 мг (73,8% от теории).
Точка плавления: 195oC.
Пример 22
2-(2-н-пропоксифенил)-8-(3-азидо-2-октил)-хиназолин-4(3H)-он
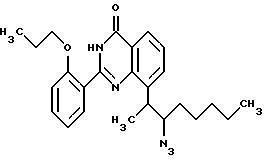
50 мг (0,103 ммоль) соединения примера 18 и 13,4 мл (0,206 ммоль) азида натрия перемешивают в 2 мл абсолютного диметилформамида при температуре 40oC в течение ночи. Затем добавляют 5 мл сложного этилового эфира уксусной кислоты и встряхивают три раза, каждый раз 50 мл воды. После высушивания органической фазы над сульфатом натрия растворитель удаляют в вакууме путем упаривания на ротационном испарителе и остаток очищают путем флэш-хроматографии на силикагеле (в качестве элюента используют смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Выход: 31 мг (67% от теории).
Значение Rf: 0,59 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 23
2-(2-н-пропоксифенил)-8-(1-метокси-2-оксо-1-гептил)-хиназолин-4(3H)-он

К 0,21 мл (2,46 ммоль) оксалилхлорида в 13 мл абсолютного хлористого метилена прикапывают при температуре -70oC 0,38 мл (5,41 ммоль) абсолютного диметилсульфоксида в 4 мл абсолютного хлористого метилена. Через 30 минут прикапывают 870 мг (2,05 моль) соединения примера 14 в 6 мл абсолютного хлористого метилена, а через дальнейшие 30 минут прикапывают 1,42 мл (10,24 ммоль) триэтиламина. Затем реакционной смеси дают нагреваться до комнатной температуры и через 10 минут смешивают с 100 мл воды. Водную фазу экстрагируют три раза, каждый раз 50 мл хлористого метилена, объединенные фазы хлористого метилена сушат над сульфатом магния и упаривают на ротационном испарителе. Остаток растворяют в 10 мл этанола и после добавления 3 мл 1 н. соляной кислоты перемешивают при комнатной температуре в течение 3 часов. Этанол упаривают в вакууме, остаток смешивают с 30 мл сложного этилового эфира уксусной кислоты и промывают два раза водой. После высушивания над сульфатом магния упаривают в вакууме на ротационном испарителе и остаток очищают хроматографией на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 98:2.
Выход: 510 мг (58,9% от теории).
Значение Rf: 0,26 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1).
Пример 24
2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-(1-гептен-1-ил)- хиназолин-4(3H)-он

Аналогично примеру 1 получают вышеуказанное соединение исходя из 2-(2-н-пропокси-5-морфолинсульфонилфенил)-8-бром- хиназолин-4(3H)-она и 1-гептена.
Выход: 53,2%.
Точка плавления: 112oC (из диэтилового эфира).
Пример 25
2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-(1,2-эпокси-1- гептил)-хиназолин-4(3H)-он

Аналогично примеру 11 получают вышеуказанное соединение исходя из соединения примера 24.
Выход: 90,7%.
Точка плавления: 96oC.
Пример 26
2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-(1-метокси-2- окси- 1-гептил)- хиназолин-4(3H)-он

Аналогично примеру 14 получают вышеуказанное соединение исходя из соединения примера 25.
Выход: 20,3%.
Значение Rf: 0,42 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 2:1).
Примеры 27 и 28
2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-(5-фенил-2- пентен-2-ил)- хиназолин-4(3H)-он и 2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-(5-фенил-3-пентен-3-ил)- хиназолин-4(3H)-он


Аналогично примеру 1 получают вышеуказанные соединения исходя из 2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-бром- хиназолин-4(3H)-она и 5-фенил-2-пентена.
Выход: 39%.
Смесь обоих изомеров, которые гидрируют без разделения.
Примеры 29 и 30
2-(2-н-пропокси-5-морфолиносульфонилфенил)-8-(5-фенил-1- пентил)-хиназолин-4(3H)-он и
2-(2-н-пропокси- 5-морфолиносульфонилфенил)-8-(5-фенил-3-пентил)-хиназолин-4(3H)-он

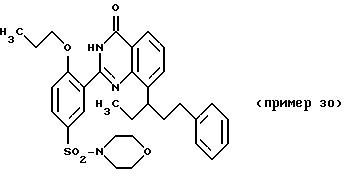
Аналогично примеру 6 получают вышеуказанные соединения исходя из смеси изомеров примера 27. Разделение проводят путем работающей под средним давлением хроматографии на силикагеле с применением в качестве элюента смеси хлористого метилена и сложного этилового эфира уксусной кислоты в соотношении 2 : 1. Выход соединения примера 29: 36,3%. Значение Rf: 0,44 (смесь хлористого метилена и сложного этилового эфира уксусной кислоты в соотношении 4 : 1). Выход соединения примера 30: 18,4%. Значение Rf: 0,49 (смесь хлористого метилена и сложного этилового эфира уксусной кислоты в соотношении 4 : 1).
Реферат
Предложены новые производные 2,8-дизамещенного хиназолинона общей формулы (I), где А - оксиранил, незамещенный или замещенный линейным или разветвленным алкилом с 1-8 атомами углерода, незамещенным или замещенным фенилом или радикал формулы Па-Пс, где R1 - водород или линейный или разветвленный алкил с 1-6 атомами углерода, R2 - линейный или разветвленный алкил с 1-8 атомами углерода, незамещенный или замещенный фенилом; R3 - линейный или разветвленный алкил с 1-5 атомами углерода или группа формулы OR6, где R6 - линейный или разветвленный алкил с 1-5 атомами углерода; R4 - линейный или разветвленный алкил с 2-10 атомами углерода, незамещенный или замещенный фенилом, L - радикал формулы -СО-, -СН(ОН)-, -СН2-, -CH(N3) или -CH(OSO2R7), где R7 - линейный или разветвленный алкил с 1-4 атомами углерода; R5 - линейный или разветвленный алкил с 3-8 атомами углерода, незамещенный или замещенный фенилом, бензил или 2-фенилэтил; D - водород или группа формулы - SO2-NR8R9, R8и R9 вместе с атомом азота образуют морфолиновое кольцо; Е - линейный или разветвленный алкил с 1-8 атомами углерода, или их соли, воздействующие на уровень кГМП и кАМП. Предложена также фармацевтическая композиция на их основе, обладающая вышеуказанной активностью. 2 с. и 2 з.п.ф-лы, 1 табл.

Формула
где А - оксиранил, незамещенный или замещенный линейным или разветвленным алкилом с 1 - 8 атомами углерода, незамещенным или замещенным фенилом, или радикал формулы


где R1 - водород или линейный или разветвленный алкил с 1 - 6 атомами углерода;
R2 - линейный или разветвленный алкил с 1 - 8 атомами углерода, незамещенный или замещенный фенилом;
R3 - линейный или разветвленный алкил с 1 - 5 атомами углерода или группа формулы -OR6, где R6 означает линейный или разветвленный алкил с 1 - 5 атомами углерода;
R4 - линейный или разветвленный алкил с 2 - 10 атомами углерода, незамещенный или замещенный фенилом;
L - радикал формул -СО-, -СН(ОН), -СН2, -СН(N3) или -СН(OSO2R7), где R7 означает линейный или разветвленный алкил с 1 - 4 атомами углерода;
R5 - линейный или разветвленный алкил с 3 - 8 атомами углерода, незамещенный или замещенный фенилом, бензил или 2-фенилэтил;
D - водород или группа формулы -SO2-NR8R9, где R8 и R9 вместе с атомом азота образуют морфолиновое кольцо;
Е - линейный или разветвленный алкил с 1 - 8 атомами углерода, или их соли.


где R1 - водород или линейный или разветвленный алкил с 1 - 5 атомами углерода;
R2 - линейный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный фенилом;
R3 - линейный или разветвленный алкил с 1 - 4 атомами углерода или группа формулы -OR6, где R6 означает линейный или разветвленный алкил с 1 - 4 атомами углерода;
R4 - линейный или разветвленный алкил с 2 - 8 атомами углерода, незамещенный или замещенный фенилом;
L - радикал формулы -СО-, -СН(ОН), -СН2, -СН(N3) или -СН(OSO2R7), где R7 означает линейный или разветвленный алкил с 1 - 3 атомами углерода;
R5 - линейный или разветвленный алкил с 3 - 7 атомами углерода, незамещенный или замещенный фенилом, или бензил или 2-фенилэтил;
D - водород или группа формулы -SO2-NR8R9, где R8 и R9 вместе с атомом азота означают морфолиновое кольцо;
Е - линейный или разветвленный алкил с 1 - 6 атомами углерода, или их соли.


где R1 - водород или неразветвленный или разветвленный алкил с 1 - 3 атомами углерода,
R2 - неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный фенилом;
R3 - неразветвленный или разветвленный алкил с 1 - 4 атомами углерода или группа формулы -OR6, где R6 означает неразветвленный или разветвленный алкил с 1 - 3 атомами углерода;
R4 - линейный или разветвленный алкил с 2 - 7 атомами углерода, незамещенный или замещенный фенилом;
L - радикал формул -СО-, -СН(ОН), -СН2, -СН(N3) или -СН(OSO2R7), где R7 означает линейный или разветвленный алкил с 1 - 3 атомами углерода;
R5 - линейный или разветвленный алкил с 3 - 6 атомами углерода, незамещенный или замещенный фенилом, бензил или 2-фенилэтил;
D - водород или группа формулы -SO2-NR8R9, где R8 и R9 вместе с атомом азота означают морфолиновое кольцо;
Е - линейный или разветвленный алкил с 1 - 4 атомами углерода или их соли.

где А - оксиранил, незамещенный или замещенный линейным или разветвленным алкилом с 1 - 8 атомами углерода, незамещенным или замещенным фенилом, или радикал формулы

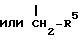
где R1 - водород или линейный или разветвленный алкил с 1 - 6 атомами углерода;
R2 - линейный или разветвленный алкил с 1 - 8 атомами углерода, незамещенный или замещенный фенилом;
R3 - линейный или разветвленный алкил с 1 - 5 атомами углерода или группа формулы -OR6, где R6 означает линейный или разветвленный алкил с 1 - 5 атомами углерода;
R4 - линейный или разветвленный алкил с 2 - 10 атомами углерода, незамещенный или замещенный фенилом;
L - радикал формул -СО- -СН(ОН), -СН2, -СН(N3) или -СН(OSO2R7), где R7 означает линейный или разветвленный алкил с 1 - 4 атомами углерода;
R5 - линейный или разветвленный алкил с 3 - 8 атомами углерода, незамещенный или замещенный фенилом, бензил или 2-фенилэтил;
D - водород или группа формулы -SO2-NR8R9, где R8 и R9 вместе с атомом азота образуют морфолиновое кольцо;
Е - линейный или разветвленный алкил с 1 - 8 атомами углерода, или его соль в эффективном количестве.

Комментарии