Арилпиримидиновые производные и фармацевтическая композиция - RU2189976C2
Код документа: RU2189976C2
Чертежи








Описание
Изобретение относится к арилпиримидиновым производным и к их фармацевтически приемлемым солям и N-оксидам, которые обладают полезными фармацевтическими свойствами, в частности они применимы в качестве селективных антагонистов 5-НТ2B-рецептора. Изобретение также относится к фармацевтическим композициям на их основе и к их применению для лечения болезней.
Серотонин, нейромедиатор со смешанными и сложными фармакологическими характеристиками, был открыт в 1948 г. и в дальнейшем являлся объектом обширных исследований. Серотонин, называемый также 5-гидрокситриптамином (5-НТ), действует на дискретные 5-НТ-рецепторы как в центральной, так и в периферической нервной системе. В настоящее время выявлено четырнадцать подтипов рецептора серотонина, и они относятся к семи семействам: 5-НТ1-5-НТ7. Известно, что внутри семейства 5-НТ2-рецептора существуют подтипы 5-НТ2А, 5-НТ2В и 5-НТ2С. Эти подтипы обладают гомологией последовательности и проявляют сходство с точки зрения их специфичности по отношению к широкому спектру лигандов. Номенклатура и классификация 5-НТ-рецепторов в настоящее время обобщена у Martin и Humphrey в Neuropharm., 33, 261-273 (1994), и у Hoyer и др. в Pharm. Rev. 46, 157-203 (1994). Согласно исследованиям Mokrozs и др. было выявлено сродство 5-НТ1А- и 5-НТ2А-рецептора к модельным производным 1-(2-пиримидинил)пиперазина (Mokrozs J. L. и др. , Pharmazie, (1994) 49, 801-810).
5-НТ2В-рецептор, который сначала называли 5-НТ2F- или серотонинподобным рецептором, первоначально был охарактеризован в выделенном дне желудка крысы [Clineschmidt и др. (1985), J. Pharmacol. Exp. Ther., 235, 696-708; Cohen и Wittenauer (1987), J. Cardiovasc. Pharmacol., 10, 176-181].
5-НТ2С-рецептор, который первоначально был отнесен к подтипу 5-НТ1С [Pazos и др. (1987), Eur. J. Pharmacol., 106, 539-546], а затем было установлено, что он принадлежит к семейству 5-НТ2-рецепторов [Pritchett и др. (1988), ЕМВО J., 7, 4135-4140], широко распространен в головном мозге человека [Pazos и др. (1984), Neuroscience, 21, 97-122]. Современные исследования убедительно доказали терапевтическую роль антагонистов 5-НТ2С-рецептора при лечении страха (например, нарушения, связанного с генерализованным состоянием страха, нарушения, связанного с состоянием паники, и обсессивно-компульсивного нарушения), алкоголизма и привыкания к злоупотреблению другими лекарствами, депрессии, мигрени, нарушений сна, нарушений питания (например, нервной анорексии) и приапизма [Kennett (1993), Curr. Opin. Invest. Drugs, 2, 317-362]. Вследствие фармакологических сходств взаимосвязей с лигандами 5-НТ2С- и 5-HT2В- рецепторов многие терапевтические мишени, которые были предложены для антагонистов 5-HT2С-рецептора, также являются мишенями для антагонистов 5-HT2В-рецептора. В частности, несколько клинических наблюдений позволяют предположить терапевтическую активность антагонистов 5-НТ2В-рецептора в отношении предупреждения мигрени, поскольку мобилизация 5-НТ в плазму может являться ускоряющим фактором при мигрени. Кроме того, неселективные агонисты 5-HT2В- рецептора провоцируют атаки мигрени у чувствительных людей, а неселективные антагонисты 5-HT2В-рецептора являются эффективными в отношении предупреждения начала мигрени [Kalkman (1994), Life Sciences, 54, 641-644)].
Таким образом, очевидно, что селективные антагонисты 5-НТ2В-рецептора могут обладать выраженными терапевтически активными свойствами, объединяющие в себе эффективность, быстроту действия и отсутствие побочных проявлений. Кроме того, такие агенты, вероятно, могут оказаться пригодными для лечения гипертензии [Watts и др., J. Pharm. Exp. Ther., 277, 1056-1059 (1995)].
Примеры многочисленных арилзамещенных пиримидиновых соединений известны из химической и патентной литературы. Например, у Budesinsky и др. в Collection Czechoslav. Chem. Commun., 26, 2865-2870 (1961) описан 2-амино-6-метил-4-(нафт-1-ил) пиримидин в качестве промежуточного продукта, пригодного для получения антибактериальных соединений.
Другие примеры таких соединений описаны в WO 85/00603, WO 85/00604, WO 86/04583, WO 89/07599, WO 89/11279, US 3965101, DE-A-1921049, DE-A-3029871, DE-A-2750288, DE-A-4237768, WO 96/32384, EP-A-0459830, DE-A-2255525 и ЕР-А-0114770. Кроме того, в WO 96/39400 описаны пиримидиновые производные, которые являются антагонистами CRF-рецептора.
Другие пиримидиновые производные описаны у Mariella и др. в J. Org. Chem. , 25, 647-648 (1960), у Загуляева и др., Известия Сибирского отделения Академии Наук СССР. Сер. хим. наук. 4, 27-31 (1990), у Essawy и др., Egypt. J. Chem. 37(4), 423-31 (1994), в патентах US 4543248, 4619933, 4665077, 5002951, 5147876 и 5223505, а также в ЕР 459830, ЕР-А-0210044 и ЕР-А-0521471.
Таким образом, одним из объектов настоящего изобретения являются соединения формулы I:

где R1 обозначает водород, алкил, гидроксиалкил, циклоалкил, циклоалкил(низш. )алкил, алкенил, (низш.)тиоалкокси, галоген, фторалкил, необязательно замещенный фенил(низш.)алкил, -NR6 R7, -CO2R8, -О(СН2)nR9, где
n равно 1, 2 или 3,
R6 и R7 независимо друг от друга обозначают водород или (низш.)алкил,
R8 обозначает водород или (низш.)алкил и
R9 обозначает водород, (низш. )алкил, гидрокси, гидрокси(низш.)алкил, (низш.)алкенил или (низш.)алкокси,
R2 обозначает водород, (низш.)алкил, (низш.)алкокси, галоген или (низш. )фторалкил,
R3 обозначает необязательно замещенный арил, отличный от пиридила, тиенила или фуранила,
R4 обозначает водород, (низш. )алкил, необязательно замещенный фенил(низш. )алкил, гидрокси(низш. )алкил, ацил или -(CH2)m NR6R7, где m равно целому числу от 1 до 6, и
R6 и R7 обозначают водород или (низш.)алкил, и
R5 обозначает водород или (низш.)алкил,
при условии, что
(I) когда R3 обозначает нафтил, индол-1-ил или 2,3-дигидроиндол-1-ил и R2, R4 и R5 все обозначают водород, R1 не обозначает метил,
(II) когда R3 обозначает фенил или нафтил, R1 не обозначает -NR6R7,
(III) когда R3 обозначает фенил, R2 не обозначает (низш.)алкокси и R1 и R2 не обозначают галоген,
(IV) когда R3 обозначает фенил и R1 обозначает Н, R2 не обозначает метил,
(V) когда R3 обозначает 1,2,3,4-тетрагидрохинолинил, R4 и R5 обозначают водород, или их фармацевтически приемлемые соли либо N-оксиды.
Другим объектом изобретения являются фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли либо N-оксида в смеси с одним или с несколькими фармацевтически приемлемыми нетоксичными носителями.
Еще одним объектом изобретения является способ лечения млекопитающего, имеющего болезненное состояние, облегчаемое при лечении с помощью антагониста 5-НТ2В-рецептора, путем введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли либо N-оксида.
Еще одним объектом настоящего изобретения является применение соединения формулы I, его фармацевтически приемлемой соли или N-оксида при изготовлении лекарственного средства, предназначенного для лечения болезненного состояния, облегчаемого при лечении с помощью антагониста 5-HT2В-рецептора.
В контексте описания настоящего изобретения используются следующие определения.
"Алкил" означает разветвленную или неразветвленную насыщенную углеводородную цепь, содержащую от 1 до 12 атомов углерода, такую как метил, этил, пропил, трет-бутил, н-гексил, н-октил н-додецил и т.п.
"Алкенил" означает ненасыщенный одновалентный углеводородный радикал, имеющий от 1 до 12 атомов углерода. Дополнительными примерами, подпадающими под это понятие, являются такие радикалы, как винил, проп-2-енил, пент-3-енил, гекс-5-енил, окт-2-енил и т.п.
"Циклоалкил" обозначает одновалентный насыщенный карбоциклический радикал, не имеющий ненасыщенных связей и имеющий от трех до восьми атомов углерода, например циклопропил, 2-метилциклопропил, циклобутил, 3-этилциклобутил, циклопентил, циклогексил, циклогептил, циклооктил.
"(Низш. )алкил" означает разветвленную или неразветвленную насыщенную углеводородную цепь, содержащую от 1 до 6 атомов углерода, такую как метил, этил, пропил, изопропил, трет-бутил, бутил, н-гексил и т.п., если не указано иное.
"(Низш.)алкенил" означает ненасыщенный одновалентный углеводородный радикал, имеющий от одного до шести атомов углерода. Дополнительными примерами, подпадающими под это понятие, являются такие радикалы, как винил, проп-2-енил, пент-3-енил и гекс-5-енил.
"Циклоалкил(низш. )алкил" в контексте настоящего описания обозначает циклоалкил, как определено выше, присоединенный к (низш.)алкильному радикалу, как определено выше, например циклопропилметил, циклопропилэтил, циклопропилпропил, циклобутилметил, циклобутилэтил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил и т.п.
"Фенил(низш.)алкил" обозначает фенил, присоединенный к (низш.)алкильному радикалу, как определено выше, например фенилметил(бензил), фенилэтил, фенилпропил и т.п.
"Фторалкил" обозначает алкил, как определено выше, замещенный в любом положении 1-5 атомами фтора, например трифторметил, пентафторэтил, 1,1,1-трифтор-н-пропил, 1-фтор-н-бутил, 1,2-дифтор-3-метилпентан, 1-фтороктан и т. п.
"(Низш. )фторалкил" обозначает (низш.)алкил, как определено выше, замещенный в любом положении 1-5 атомами фтора, например трифторметил, пентафторэтил, 1,1, 1-трифтор-н-пропил, 1-фтор-н-бутил, 1,2-дифтор-3-метилпентан и т. п.
"Ацил" обозначает группу -C(О)-R', где R' обозначает (низш.)алкил, как определено выше.
"(Низш. )алкокси" обозначает группу -О-R', где R' обозначает (низш. )алкил, как определено выше. Аналогично этому "(низш.)тиоалкокси" обозначает группу -S-R'.
"Гидроксиалкил" обозначает алкильную группу, как определено выше, замещенную 1, 2 или 3 гидроксигруппами, например гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1,2-дигидроксиэтил, 1-гидроксиизопропил, 2-гидроксиизопропил, 1, 2-дигидроксиизопропил, 1-гидроксибутил, 1,3-дигидроксибутил и т.п. Аналогично этому " гидрокси(низш)алкил" обозначает (низш.) алкильную группу, как определено выше, замещенную 1, 2 или 3 гидроксигруппами.
"Галоген" означает фтор, хлор, бром или йод, если не указано иное.
"Необязательный" или "необязательно" означает, что последовательно описываемое событие или обстоятельство может иметь место или его может не быть и что описание включает случаи, когда событие или обстоятельство имеет место, и случаи, когда его нет. Например, "необязательно замещенный фенил" или "необязательно замещенный арил" означает, что фенил или арил может быть замещен или может быть не замещен заместителем, выбранным из группы, включающей (низш.)алкил, (низш.)алкокси, гидрокси, нитро, (низш.)фторалкил и галоген, и также включает незамещенный фенил и незамещенный арил и все возможные изомерные фенильные и арильные радикалы, которые являются моно-, ди- или тризамещенными.
Понятие "арил" в контексте настоящего описания обозначает моноциклическое ароматическое кольцо или 9-14-членную бициклическую или трициклическую кольцевую
систему, в которой по крайней мере одно кольцо является ароматическим по своей природе, и включает карбоциклы и гетероциклы, имеющие один или два гетероатома, выбранных из группы, включающей азот,
кислород и серу. Примеры арильных групп включают фенил, тиофен, нафталин, антрацен, фенантрен, хинолин, изохинолин, 1,2,3,4-тетрагидрохинолин, индол, 2,3-дигидроиндол, 1Н-бензо[b]азепин, 2,3,4,
5-тетрагидро-1Н-бензо[b]азепин, 2Н-бензо[1,4] оксазин, 3,4-дигидро-2Н-бензо[1,4] оксазин, 1Н,3Н-бензо[де]изохромен, 6,7,8,9-тетрагидро-5-окса-9-бензоциклогептан, 2,3-дигидро-1,4-бензодиоксан и т. п.,
но не ограничены ими. Более конкретно понятие арил включает структуры формулы:

например, нафт-1-ил и нафт-2-ил и их производные;

например, хинолин-2-ил, хинолин-4-ил, хинолин-8-ил и т.п. и их 25 производные;

например, изохинолин-1-ил, изохинолин-4-ил, изохинолин-8-ил и т.п. и их производные;

например, 1,2,3,4-тетрагидрохинолин-1-ил, 1,2,3,4-тетрагидрохинолин-5-ил и их производные;

например, 3,4-дигидро-2Н-бензо[1,4] оксазин-1-ил, 3,4-дигидро-2Н-бензо[1, 4]оксазин-5-ил и их производные;

где пунктирная линия обозначает необязательную двойную связь, например индол-1-ил, 1Н-индол-4-ил, 2,3-дигидроиндол-1-ил и их производные;

например, 2,3,4, 5-тетрагидро-1Н-бензо[b]азепин и их производные;

например, 7, 8-дигидро-6Н-5-окса-9-аза-бензоциклогептен-9-ил, 7,8-дигидро-6Н-5-окса-9-аза-бензоциклогептен-4-ил и их производные;

например, бензо-1,4-диоксан и его производные.
Понятия "инертный органический растворитель" или "инертный растворитель" означают растворитель, инертный в условиях реакции, в описании которой он упоминается (и включает, например, бензол, толуол, ацетонитрил, тетрагидрофуран ("ТГФ"), диметилформамид ("ДМФ"), хлороформ "СНС13", метилендихлорид (или дихлорметан или "СН2Сl2"), диэтиловый эфир, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п.). Если не указано иное, растворители, применяемые в реакциях по настоящему изобретению, являются инертными.
Понятие "фармацевтически приемлемая кислотно-аддитивная соль" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований, не являются нежелательными ни с биологической, ни с какой-либо иной точки зрения и образованы с использованием неорганических кислот, таких как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и с использованием органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и т.п.
"N-оксид" относится к стабильному оксиду амина, образованному на одном из атомов азота пиримидина.
Понятие "лечение" в контексте настоящего описания обозначает
любое лечение болезненного состояния у млекопитающего, в частности у человека, и включает:
(I) предотвращение наступления заболевания у пациента, который может быть предрасположенным к
заболеванию, но у которого оно еще не диагностировано,
(II) ингибирование заболевания, т.е. задержка его развития, или
(III) облегчение заболевания, т.е. обеспечение регресса
заболевания.
Понятие "терапевтически эффективное количество" означает такое количество соединения формулы I, которое, будучи введенным млекопитающему, нуждающемуся в таком лечении, является достаточным для осуществления лечения, как определено выше. Терапевтически эффективное количество может изменяться в зависимости от пациента и болезненного состояния, подлежащего лечению, серьезности поражения и способа введения и может быть определено специалистом в данной области обычным способом.
Понятие "болезненное состояние, которое облегчается при лечении с помощью антагониста 5-НТ2В-рецептора", в контексте настоящего описания подразумевает все болезненные состояния, в отношении которых в данной области в целом известно, что они обычно успешно поддаются лечению с помощью соединений, в целом обладающих сродством к 5-НТ2В-рецепторам, и те болезненные состояния, в отношении которых было подтверждено, что они успешно поддаются лечению с помощью определенных соединений по настоящему изобретению, соединений формулы I. Такие болезненные состояния включают страх (например, нарушение, связанное с генерализованным состоянием страха, нарушение, связанное с паническим страхом, и обсессивно-компульсивное нарушение), алкоголизм и привыкание к злоупотреблению другими лекарствами, депрессию, мигрень, гипертензию, нарушение сна, нарушение питания (например, нервную анорексию) и приапизм, но не ограничены ими.
Приведенные ниже соединения формулы I называют с использованием указанной системы нумерации:

Соединение формулы I, в котором R1 обозначает изопропил, R2, R4 и R5 обозначают водород и R3 обозначает 1-нафтил, называют 2-амино-6-изопропил-4-(нафт-1-ил) пиримидином.
Соединение формулы I, в котором R1 обозначает изопропил, R2, R4 и R5 обозначают водород и R3 обозначает 1Н-индол-4-ил, называют 2-амино-4-(1Н-индол-4-ил)-6-изопропилпиримидином.
Соединение формулы I, в котором R1 обозначает метил, R2 и R4 обозначают водород, R5 обозначает метил и R3 обозначает 1,2,3, 4-тетрагидрохинолин-1-ил, называют 6-метил-2-(метиламино)-4-(1,2,3,4-тетрагидрохинолин-1-ил) пиримидином.
N-оксид соединения формулы I, в котором R1 обозначает хлор, R2 обозначает метил, R4 и R5 обозначают водород и R3 обозначает 4-метоксифенил, называют 2-амино-6-хлор-4-(4-метоксифенил)-5-метилпиримидин-1-N-оксидом.
Среди семейства соединений по настоящему изобретению предпочтительная категория включает соединения формулы 1, в которых R4 и R5 обозначают водород или (низш. )алкил. В этой категории предпочтительная группа включает соединения, в которых R1 обозначает (низш.)алкил, фторалкил или гидроксиалкил и R3 обозначает необязательно замещенный арил, в которых, в частности, R3 обозначает необязательно замещенный 1-нафтил или индол-4-ил, или их фармацевтически приемлемую соль либо N-оксид.
Особенно предпочтительными
соединениями являются следующие:
2-амино-4-(2-метилнафт-1-ил)-6-метилпиримидин,
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин,
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-1-N-оксид,
2-амино-4-(4-фторнафт-1-ил)-6-(2-метилпропил)пиримидин,
2-амино-4-(трет-бутил)-4-(4-фторнафт-1-ил) пиримидин,
2-амино-4-(1Н-индол-4-ил)-6-метилпиримидин,
2-амино-4-(4-фторнафт-1-ил)-6-(1-фтор-1-метилэтил) пиримидин и
2-амино-4-(4-фторнафт-1-ил)-6-(1-гидрокси-1-метилэтил) пиримидин,
2-амино-4-(4,6-дифторнафт-1-ил)-6-(1-фтор-1-метилэтил) пиримидин,
2-метиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин,
2-амино-4-(4-фторнафт-1-ил)-6-(2-метилпропил) пиримидин.
Также предпочтительной группой соединений по настоящему изобретению являются соединения формулы I, в которых R4 и R5 обозначают водород или (низш. )алкил, R1 обозначает (низш.)алкил и R3 обозначает необязательно замещенный индол, например 2-амино-4-(1Н-индол-4-ил)-6-метилпиримидин, или его фармацевтически приемлемая соль либо N-оксид.
Описанные ниже способы могут применяться для получения соединений формулы I.
В одном из таких способов в качестве исходных продуктов используют промежуточные продукты формулы (4), получение которых приведено ниже на реакционной схеме I (см. в конце описания).
Применяемый в качестве исходного вещества кетоэфир формулы (1) является коммерчески доступным, например, производится фирмой Aldrich Chemical Co., Inc. , или может быть получен методами, хорошо известными в данной области. Соединения формулы (2) являются коммерчески доступными или могут быть получены методами, хорошо известными в данной области.
Для получения соединений формулы (3) кетоэфир формулы (1) обрабатывают избыточным количеством производного гуанидина формулы (2) в протонном растворителе, предпочтительно в этаноле, при температуре дефлегмации в течение приблизительно 6-24 ч, предпочтительно в течение приблизительно 16 ч. Продукт формулы (3), 2-амино-4-гидроксипиримидиновое производное, выделяют общепринятыми методами и предпочтительно подвергают взаимодействию на следующей стадии без дополнительной очистки.
2-амино-4-гидроксипиримидиновое производное формулы (3) превращают в соответствующее 4-хлорсодержащее соединение формулы (4) взаимодействием соединения формулы (3) с хлорирующим агентом, предпочтительно с оксихлоридом фосфора, предпочтительно в отсутствии растворителя. Реакцию проводят при температуре дефлегмации в течение приблизительно от 30 мин до 8 ч, предпочтительно приблизительно в течение 2 ч. Продукт формулы (4), 2-амино-4-хлорпиримидиновое производное, выделяют общепринятыми методами и предпочтительно перекристаллизовывают перед следующим взаимодействием.
Один из способов превращения соединения формулы (4) в соединение формулы I приведен на реакционной схеме II (см. в конце описания).
2-амино-4-хлорпиримидиновое производное формулы (4) подвергают взаимодействию с производным бороновой кислоты формулы (5) в водном растворителе, предпочтительно в смеси этанола, воды и диметоксиэтана, содержащей палладиевый катализатор, предпочтительно тетракистрифенилфосфин палладия, и неорганическое основание, предпочтительно карбонат натрия. Реакцию предпочтительно проводят при температуре дефлегмации растворителя, предпочтительно приблизительно при 80-90oС, в течение приблизительно 5-30 ч, предпочтительно приблизительно в течение 14 ч. Продукт формулы I выделяют общепринятыми методами и предпочтительно очищают перекристаллизацией.
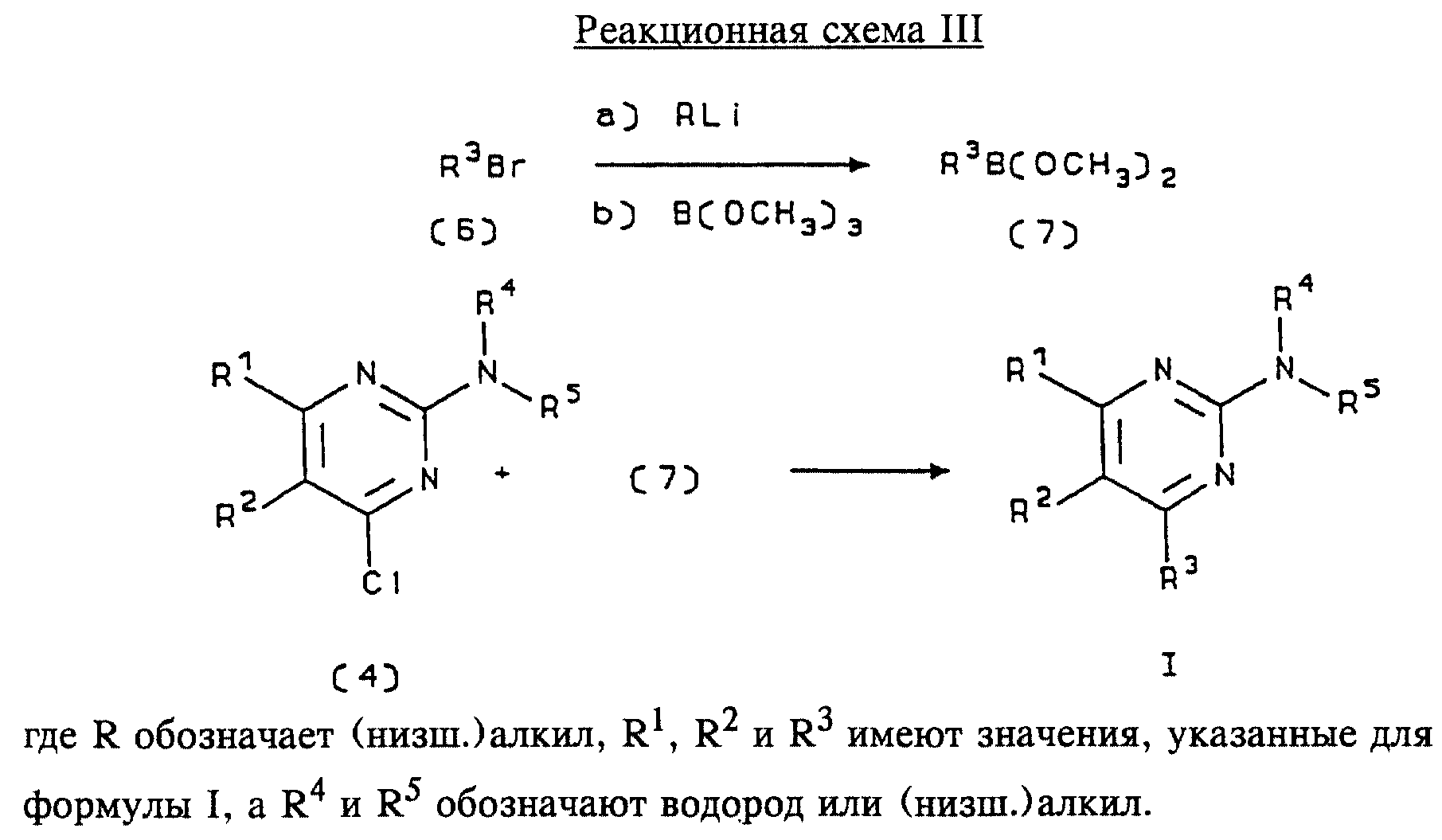
Альтернативный способ превращения соединения формулы (4) в соединение формулы I приведен на реакционной схеме III (см. в конце описания).
Бромарильное производное формулы (6) подвергают взаимодействию с сильным основанием, например с (низш.)алкиллитием, предпочтительно с н-бутиллитием. Реакцию проводят в растворителе, представляющем собой простой эфир (например, диэтиловый эфир, диметоксиэтан, диоксан или тетрагидрофуран, предпочтительно тетрагидрофуран), при температуре приблизительно от -50 до -150oС, предпочтительно приблизительно при -95oС, в течение приблизительно 5-30 мин, после этого добавляют приблизительно 1 эквивалент триалкоксиборана, предпочтительно триметоксиборана, и смеси дают нагреться до комнатной температуры. Продукт формулы (7), представляющий собой диметоксиборановый комплекс, выделяют путем удаления растворителя и используют в последующей реакции без дополнительной очистки.
2-амино-4-хлорпиримидиновое производное формулы (4) подвергают взаимодействию с полученным выше борсодержащим комплексом (7) в инертном растворителе, предпочтительно в ароматическом растворителе, наиболее предпочтительно в толуоле, содержащем палладиевый катализатор, предпочтительно тетракистрифенилфосфин палладия, и водное неорганическое основание, предпочтительно карбонат натрия/вода. Реакцию предпочтительно проводят при температуре дефлегмации растворителя, предпочтительно приблизительно при 80-90oС, а продолжительность реакции составляет приблизительно от 10 мин до 10 ч, предпочтительно приблизительно 1 ч. Продукт формулы I выделяют и очищают общепринятыми методами, предпочтительно хроматографией.
Для превращения соединения формулы (4)
в соединение формулы 1, в котором R3 обозначает бициклическую кольцевую систему, содержащую атом азота в качестве места присоединения пиримидинового ядра, т.е. в котором R3
представляет собой:

где n равно 0, 1 или 2, Y обозначает СН2, О, S или NH, а кольца необязательно замещены, как указано выше, также может применяться альтернативный способ. Этот способ приведен на реакционной схеме IV (см. в конце описания).
2-амино-4-хлорпиримидиновое производное формулы (4) подвергают взаимодействию с соединением формулы (8) в смеси воды и сильной кислоты, предпочтительно серной кислоты, в качестве растворителя. Реакцию предпочтительно проводят при температуре приблизительно 100oС, а продолжительность реакции составляет приблизительно от 20 мин до 10 ч, предпочтительно приблизительно 2 ч. Продукт формулы I выделяют общепринятыми методами и предпочтительно очищают перекристаллизацией.
В альтернативном варианте соединения формул (4) и (8) подвергают взаимодействию друг с другом в полярном растворителе, предпочтительно в диметилформамиде. Реакцию предпочтительно проводят при температуре приблизительно 70-90oС в течение приблизительно 12-72 ч, предпочтительно в течение приблизительно 24 ч. Продукт формулы I выделяют общепринятыми методами и предпочтительно очищают хроматографией.
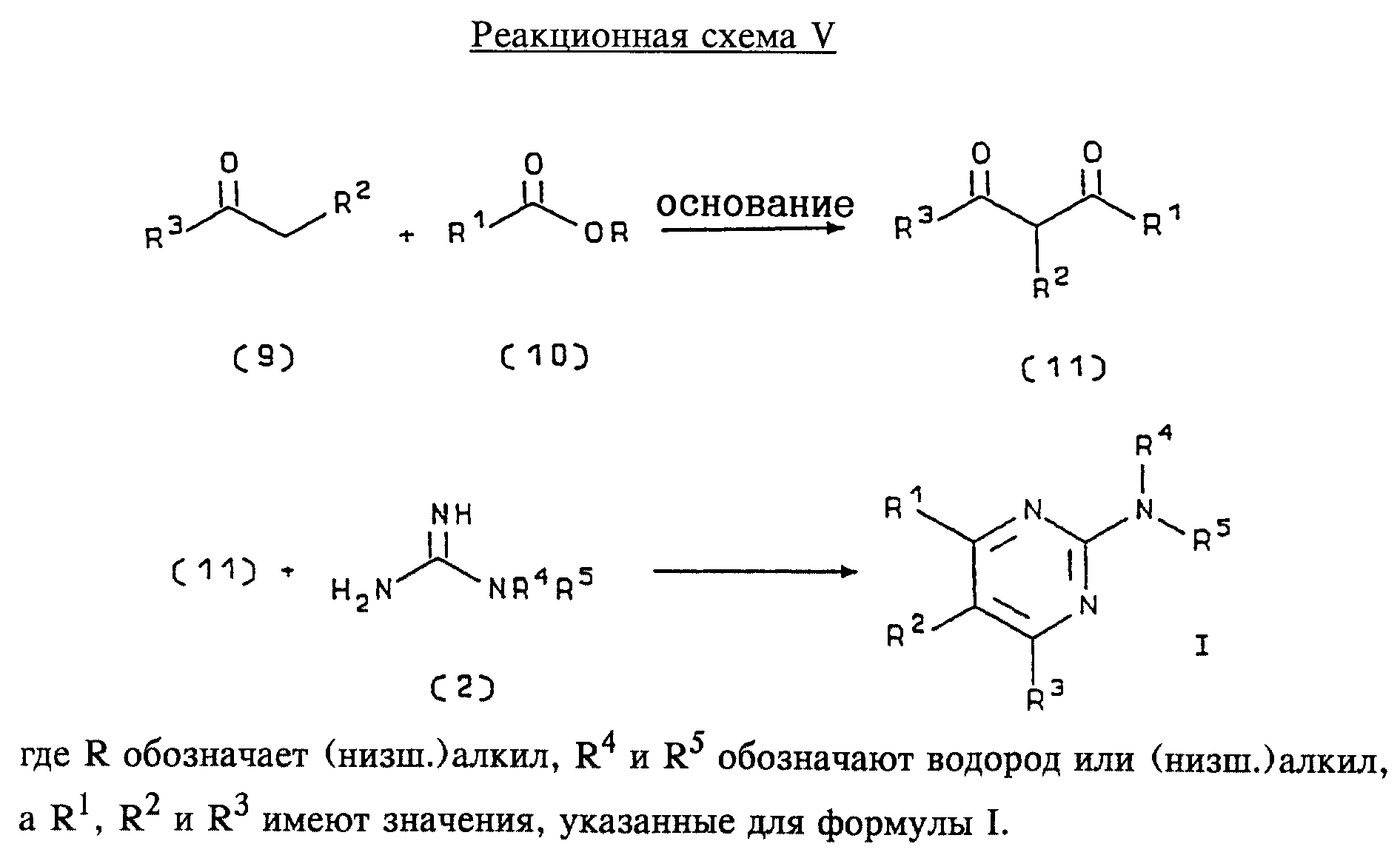
Соединения формулы I также могут быть получены с использованием в качестве исходных веществ ациларильных производных формулы (9), как показано на реакционной схеме V (см. в конце описания).
Ациларильное производное формулы (9) является коммерчески доступным, например производится фирмой Aldrich Chemical Co., Inc., или может быть получено по методам, хорошо известным в данной области, например, реакцией Фриделя-Крафтса. Обычно арильное производное формулы R3H подвергают взаимодействию с производным карбоновой кислоты, предпочтительно с уксусным ангидридом, в присутствии кислоты Льюиса, например хлорида алюминия. Реакцию проводят при температуре приблизительно от -20 до 20oС, предпочтительно при 0oС, а продолжительность реакции составляет приблизительно от 5 мин до 3 ч, предпочтительно 20 мин. Продукт в виде ациларильного производного формулы (9) выделяют общепринятыми методами и предпочтительно очищают хроматографией.
Ациларильное производное формулы (9) подвергают взаимодействию с большим избытком сложного эфира формулы (10) в присутствии сильного основания, предпочтительно гидрида натрия. Реакцию предпочтительно проводят при температуре приблизительно 80oС до полного вступления в реакцию соединения формулы (9). Дион формулы (11) выделяют общепринятыми методами и предпочтительно очищают хроматографией.
Получение соединений
формулы I
Дион формулы (11) подвергают взаимодействию с соединением формулы (2) предпочтительно в отсутствии растворителя. Реакцию проводят при температуре приблизительно 100-180oС,
предпочтительно приблизительно при 150oС, в течение приблизительно 1-10 ч, предпочтительно в течение приблизительно 5 ч. Продукт формулы I выделяют общепринятыми способами и
предпочтительно очищают хроматографией.
Альтернативный способ получения соединений формулы I, в которых R1 обозначает водород, из ациларильных производных формулы (9) приведен ниже на реакционной схеме VI (см. в конце описания).
Ациларильное производное формулы (9) подвергают взаимодействию с трет-бутилоксибис(диметиламино) метаном (реагент Бредерека) в протонном растворителе, предпочтительно в этаноле. Реакцию предпочтительно проводят при температуре приблизительно 80oС в течение приблизительно от 12 ч до 5 дней, предпочтительно приблизительно в течение 2 дней. Соединение формулы (13) выделяют общепринятыми способами и предпочтительно применяют в следующей реакции без дополнительной очистки.
Енон формулы (13) подвергают взаимодействию с соединением формулы (2) предпочтительно в отсутствии растворителя. Реакцию проводят при температуре приблизительно 100-180oС, предпочтительно приблизительно при 120oС, в течение приблизительно 5-24 ч, предпочтительно в течение приблизительно 14 ч. Продукт формулы I выделяют общепринятыми способами и предпочтительно очищают перекристаллизацией.
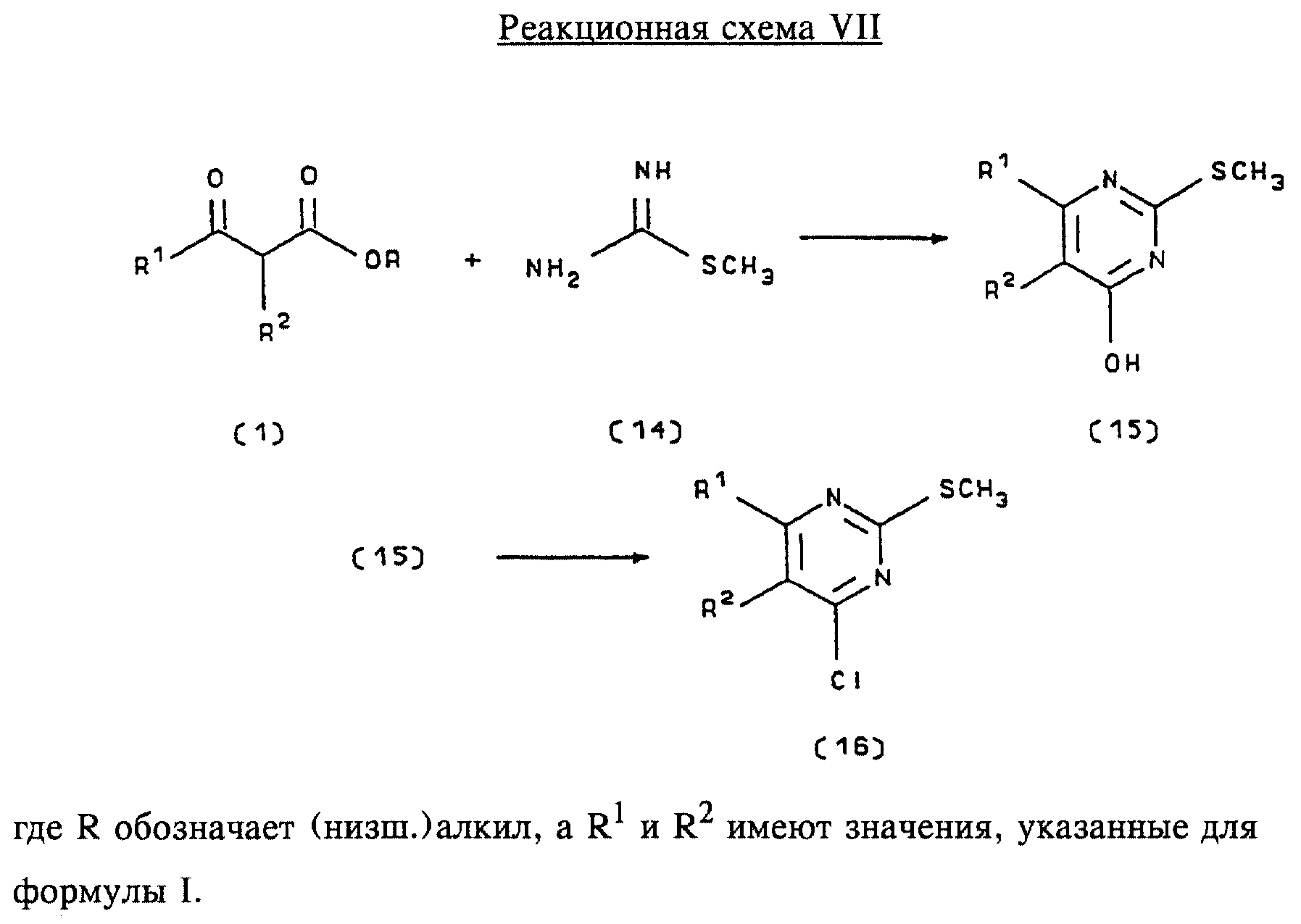
В другом способе получения соединений формулы I используются промежуточные продукты формулы (16), получение которых приведено на реакционной схеме VII (см. в конце описания).
Исходный кетоэфир формулы (1) имеется в продаже, например производится фирмой Aldrich Chemical Co., Inc., или может быть получен по методам, хорошо известным в данной области. Соединения формулы (14) являются коммерчески доступными или могут быть получены методами, хорошо известными в данной области.
Для получения соединений формулы (15) кетоэфир формулы (1) обрабатывают приблизительно 2 молярными эквивалентами производного изотиомочевины формулы (14) в водном растворе, содержащем избыточное количество неорганического основания, предпочтительно карбоната натрия. Реакцию проводят в интервале температур приблизительно от 5 до 60oС, предпочтительно приблизительно при 25oС, в течение приблизительно 10-100 ч, предпочтительно в течение 60 ч. Продукт формулы (15), 4-гидрокси-2-метилтиопиримидиновое производное, выделяют общепринятыми методами и предпочтительно подвергают взаимодействию на следующей стадии без дополнительной очистки.
4-гидрокси-2-метилтиопиримидиновое производное формулы (15) подвергают взаимодействию с соответствующим 4-хлорсодержащим соединением формулы (16) в условиях, аналогичных описанным выше для получения соединений формулы (4) на реакционной схеме I. Продукт формулы (16), 4-хлор-2-метилтиопиримидиновое производное, выделяют общепринятыми методами.
Один из методов превращения соединения формулы (16) в соединение формулы I приведен на реакционной схеме VIII (см. в конце описания).
На первой стадии соединения формулы (17) могут быть получены следующим образом.
6-[(низш.)алкил или (низш.)алкилокси]-2-метилтиопиримидиновое соединение формулы (16) в безводном растворителе, представляющем собой простой эфир, предпочтительно в тетрагидрофуране, подвергают взаимодействию с избыточным количеством замедляющего реакцию основания, предпочтительно диизопропиламида лития, в безводном растворителе, представляющем собой простой эфир, предпочтительно в тетрагидрофуране, в интервале температур приблизительно от -90 до 10oС, предпочтительно приблизительно при -70oС, в течение приблизительно 30 мин. Добавляют избыток бромарильного производного формулы (6) и реакционной смеси дают нагреться до температуры окружающей среды. Затем выделяют продукт формулы (17), 2-метилтиопиримидиновое соединение формулы (17), и очищают общепринятыми методами, предпочтительно хроматографией.
Альтернативно этому, используя способ, приведенный на реакционной схеме III, соединение формулы (16) может быть подвергнуто взаимодействию с соединением формулы (7) с получением соединения формулы (17).
На второй стадии соединения формулы (18) могут быть получены следующим образом.
2-метилтиопиримидиновое производное формулы (17) подвергают взаимодействию приблизительно с 1-4 молярными эквивалентами, предпочтительно приблизительно с 2 молярными эквивалентами, сильного окислителя, например мета-хлорпербензойной кислоты. Реакцию проводят в инертном растворителе, предпочтительно в метиленхлориде, в интервале температур приблизительно от 0 до 50oС, предпочтительно приблизительно при 25oС, в течение приблизительно 1-30 ч, предпочтительно в течение приблизительно 16 ч. Продукт формулы (18), 2-метилсульфонилпиримидиновое производное, выделяют общепринятыми методами.
На третьей стадии соединения формулы I могут быть получены следующим образом.
2-метилсульфонилпиримидиновое производное формулы (18) подвергают взаимодействию с избытком первичного или вторичного амина в приемлемом растворителе, например в этаноле. Реакцию проводят в интервале температур приблизительно от 10 до 100oС, предпочтительно при 45oС, в течение приблизительно 1-10 ч, предпочтительно в течение 6 ч. Продукт, соединение формулы I, выделяют и очищают общепринятыми методами.
Разнообразные пути получения соединений формулы I приведены на реакционной схеме IX (см. в конце описания).
Соединения формулы I, в которых R1 обозначает хлор, могут быть получены из соединений формулы I, в которых R1 обозначает гидроксигруппу, способом, аналогичным описанному выше для стадии 2 на реакционной схеме I.
Альтернативно этому соединения формулы I, в которых R1 обозначает хлор, могут быть получены из соединений формулы (4), в которых R1 обозначает хлор (т. е. 4,6-дихлорпиримидиновых производных), взаимодействием дихлорсодержащего производного способом, аналогичным приведенному выше на реакционных схемах II или III.
Соединение формулы I, в котором R1 обозначает хлор, подвергают взаимодействию с первичным или вторичным амином формулы R6R7NH, где R6 обозначает водород или (низш.)алкил, а R7 обозначает (низш.)алкил, в протонном растворителе с высокой температурой кипения, предпочтительно в этиленгликоле. Реакцию предпочтительно проводят при температуре приблизительно 100oС, а продолжительность реакции составляет приблизительно от 12 ч до 5 дней, предпочтительно приблизительно 2 дня. Соединение формулы I, в котором R1 обозначает -NR6R7, выделяют общепринятыми методами.
Соединение формулы I, в котором R1 обозначает хлор, подвергают каталитическому восстановлению водородом в присутствии палладиевого или платинового катализатора, предпочтительно палладия на угольном носителе. Реакцию проводят в протонном растворителе, предпочтительно в метаноле или этаноле, в присутствии сильного основания, предпочтительно водного гидроксида натрия. Реакцию предпочтительно проводят при температуре приблизительно 10-40oС, предпочтительно приблизительно при комнатной температуре, при давлении приблизительно 1 атм до завершения восстановления, в течение приблизительно 1 ч. Соединение формулы I, в котором R1 обозначает водород, выделяют общепринятыми методами.
Получение соединений формулы I, в которых R1 обозначает тиоалкоксигруппу, приведено на реакционной схеме X (см. в конце описания).
Ациларильное производное формулы (9), которое является коммерчески доступным, например производится фирмой Aldrich Chemical Co., Inc., или может быть получено по методам, хорошо известным в данной области, смешивают с сернистым углеродом в апротонном растворителе, например в диэтиловом эфире, бензоле, толуоле, предпочтительно в диэтиловом эфире, в присутствии сильного основания, предпочтительно трет-бутилоксида калия, при температуре приблизительно 10-12oС. Реакционной смеси дают нагреться до комнатной температуры, затем повторно охлаждают до приблизительно 10-12oС и в это время по каплям добавляют 2 молярных эквивалента метилйодида. Температуру смеси поддерживают на уровне 10-80oС, предпочтительно приблизительно на уровне комнатной температуры, в течение приблизительно 5-24 ч, предпочтительно в течение приблизительно 16 ч. Бисметилсульфанильное соединение формулы (19) выделяют общепринятыми методами и предпочтительно очищают кристаллизацией.
Соединение формулы (19) подвергают взаимодействию с соединением формулы (2) в присутствии сильного основания, предпочтительно гидрида натрия, в полярном растворителе, предпочтительно в диметилформамиде. Реакцию проводят при комнатной температуре приблизительно в течение 1 ч, затем приблизительно при 100-180oС, предпочтительно приблизительно при 150oС, в течение 1-10 ч, предпочтительно в течение приблизительно 5 ч. Продукт формулы I выделяют общепринятыми методами и предпочтительно очищают хроматографией.
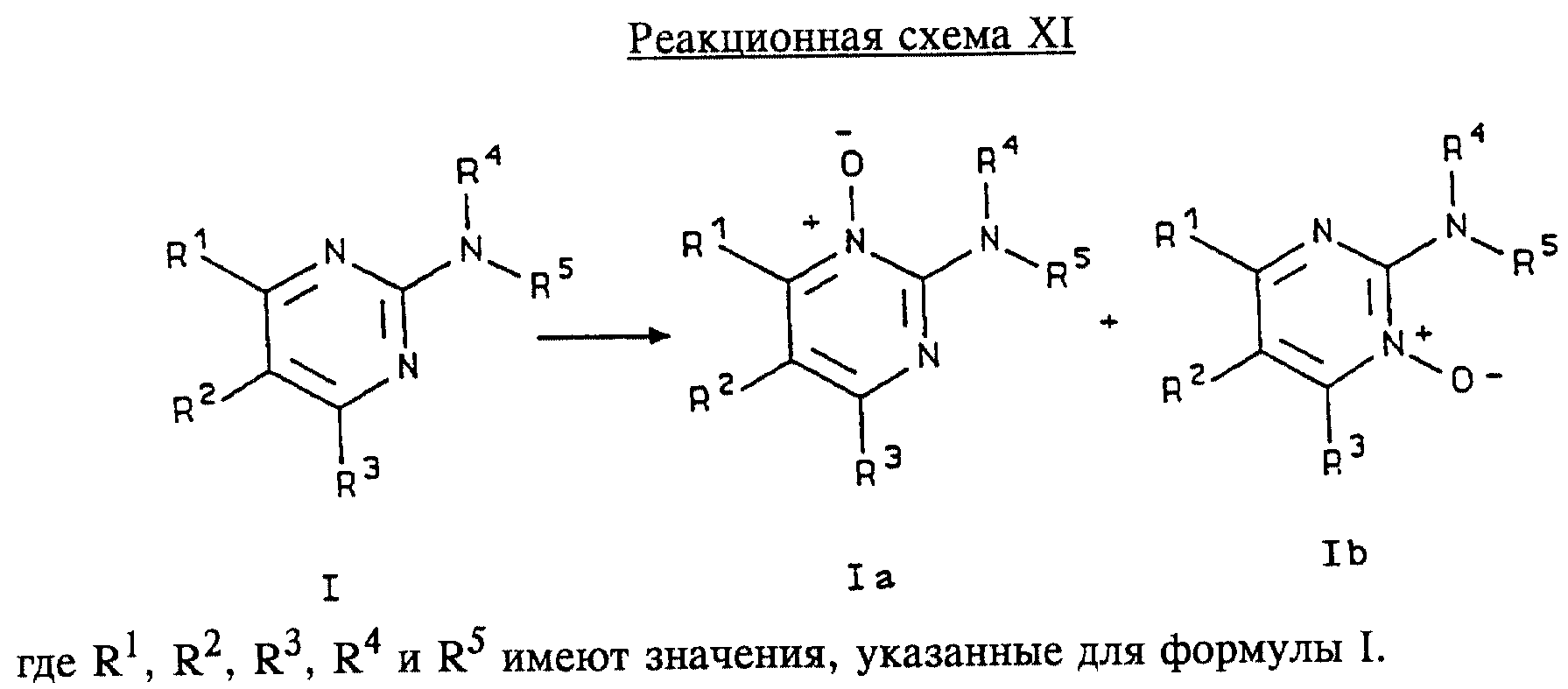
Получение N-оксидов соединений формулы I приведено на реакционной схеме XI (см. в конце описания).
Соединение формулы I подвергают взаимодействию с окислителем, предпочтительно с мета-хлорпербензойной кислотой, в инертном растворителе, предпочтительно в хлороформе или метилендихлориде. Реакцию предпочтительно проводят при температуре приблизительно 30-60oС, предпочтительно приблизительно при 40oС, а продолжительность реакции составляет от 10 мин до 2 ч, предпочтительно приблизительно 30 мин. N-оксид соединения формулы I выделяют общепринятыми методами.
Положение, в котором происходит N-окисление, изменяется в зависимости от пространственного затруднения группы R1. Например, если R1 обозначает метил, N-окисление происходит практически исключительно в положении 1 (формула Iа). Однако по мере того, как группа R увеличивается по размеру, заметно возрастание количества 3-N-оксида (формула Ib). Например, если R1 обозначает трет-бутил, большая часть окисления направлена к положению 3. При реакциях оксиления, в результате которых получают смесь N-оксидов, 1-N-оксиды и 3-N-оксиды могут быть разделены с помощью хроматографии или с помощью избирательной кристаллизации из приемлемого растворителя, например из смеси этанол/простой эфир.
Получение соединений формулы I, в которых R1 обозначает гидроксиалкил или алкенил, из N-оксидов формулы I приведено на реакционной схеме XII (см. в конце описания).
N-оксид формулы I, в котором R1 обозначает алкил, подвергают взаимодействию с избытком ангидрида карбоновой кислоты, предпочтительно с трифтоуксусным ангидридом, в инертном растворителе, предпочтительно в метиленхлориде. Реакцию проводят при температуре приблизительно 5-60oС, предпочтительно при приблизительно 25oС, в течение приблизительно 10-60 ч, предпочтительно в течение 48 ч. Получают смесь соединений формулы I, в которых R1 обозначает 6-гидроксиалкил или 6-алкенил, и ее разделяют, выделяют и очищают общепринятыми методами, предпочтительно хроматографией.
Соединения формулы I, в которых R1, R2 и R3 имеют указанные выше значения, а R4 и R5 обозначают водород, могут быть превращены в другие соединения формулы I путем замены одного или обоих атомов водорода радикалов R4 и R5 на другие группы.
А. Например, соединение формулы I, в котором R4 обозначает ацетил, может быть получено путем взаимодействия с ацилирующим агентом, предпочтительно с уксусным ангидридом, необязательно в присутствии 4-диметиламинопиридина. Реакционную смесь выдерживают при температуре от 0 до 100oС в течение приблизительно 4 ч. Диацетильный продукт выделяют общепринятыми методами, растворяют в протонном растворителе, таком как метанол, и обрабатывают бикарбонатом натрия в течение приблизительно 1-24 ч. Образовавшийся моноацетильный продукт, соединение формулы I, выделяют и очищают общепринятыми методами.
Б. Например, соединение формулы I, в котором R4 и R5 обозначают метансульфонил, может быть получено путем взаимодействия с триэтиламином и сульфонилирующим агентом, предпочтительно с метансульфонилхлоридом. Реакцию проводят в инертном органическом растворителе, таком как дихлорметан, при температуре приблизительно 0oС, а продолжительность реакции составляет приблизительно от 5 мин до 3 ч, предпочтительно приблизительно 30 мин. Образовавшийся бисметилсульфонильный продукт, соединение формулы I, выделяют и очищают общепринятыми методами.
В. Например, соединение формулы I, в котором R4 обозначает метансульфонил, а R5 обозначает водород, может быть получено из описанного выше в разделе (Б) бисметилсульфонильного продукта в щелочных условиях, предпочтительно в гидроксиде натрия. Реакцию проводят в протонном органическом растворителе, таком как метанол, приблизительно при комнатной температуре, а продолжительность реакции составляет приблизительно от 30 мин до 3 ч, предпочтительно 1 ч. Образовавшийся монометансульфонильный продукт, соединение формулы I, выделяют и очищают общепринятыми методами.
Г. Например, соединение формулы I, в котором R4 и R5 обозначают водород, может быть получено путем взаимодействия с фенилизоцианатом. Реакцию проводят в инертном органическом растворителе, предпочтительно в бензоле, при температуре дефлегмации в течение приблизительно 10-60 ч, предпочтительно в течение 48 ч. Образовавшийся продукт, являющийся производным мочевины, соединение формулы I, выделяют и очищают общепринятыми методами.
Д. Например, соединение формулы I, в котором R4 обозначает 2-(диметиламино)имино, а R5 обозначает водород, может быть получено путем взаимодействия производного гуанидина, такого как 1,1-диметилгуанидин, и далее в соответствии со способами, описанными для реакционной схемы I.
Выделение и очистку соединений и промежуточных продуктов, приведенных в настоящем описании, можно осуществлять с помощью любого пригодного метода разделения и очистки, такого как, например, фильтрация, экстракция, кристаллизация, хроматография на колонках, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография при низком или высоком давлении или с помощью комбинации этих методов. Конкретные иллюстративные примеры соответствующих методов разделения и выделения приведены ниже в описании способов получения и примеров. Однако, как очевидно, также можно использовать другие эквивалентные методы разделения или выделения.
Соединения формулы I являются основаниями и поэтому могут быть превращены в соответствующую кислотно-аддитивную соль.
Превращение проводят путем обработки по крайней мере стехиометрическим количеством приемлемой кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и т.п. Как правило, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают в интервале 0-50oС. Образовавшаяся соль самопроизвольно осаждается или может быть получена из раствора с помощью менее полярного растворителя.
Кислотно-аддитивные соли соединений формулы I могут быть превращены в соответствующие свободные основания обработкой по крайней мере стехиометрическим количеством пригодного основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п.
Соединения формулы I могут быть получены одним их следующих путей.
1. Соединения формулы I могут быть получены взаимодействием соединения формулы

где R1 и R2 имеют указанные выше значения, a R4 и R5 обозначают водород или (низш. )алкил, с производным бороновой кислоты формулы (5), т.е. R3 В(ОН)2, где R3 имеет значения, указанные для формулы I.
2. В альтернативном варианте способ получения соединений формулы I включает взаимодействие соединения
формулы

где R1 и R2 имеют значения, указанные для формулы I, a R4 и R5 обозначают водород или (низш.)алкил, с борсодержащим комплексом формулы (7), т.е. R3B(OCH3)2, где R3 имеет значения, указанные для формулы I.
3. В альтернативном варианте способ получения соединений формулы I включает взаимодействие соединения формулы

где R1 и R2 имеют значения, указанные для формулы I, a R4 и R5 обозначают водород или (низш.)алкил, с соединением формулы (8)

где Y и n имеют указанные выше значения.
4. В
альтернативном варианте способ получения соединений формулы I включает взаимодействие соединения формулы

где R1, R2 и R3 имеют значения, указанные для формулы I, с соединением формулы NH2C(:NH)NR4R5 (формула (2)), где R4 и R5 имеют значения, указанные для формулы I.
5. В альтернативном варианте способ получения соединений формулы I включает взаимодействие соединения формулы

где R2 и R3 имеют значения, указанные для формулы I, с соединением формулы NH2C(:NH)NR4R5 (формула (2)), где R4 и R5 имеют значения, указанные для формулы I.
6. В альтернативном варианте способ получения
соединений формулы I включает взаимодействие соединения формулы

где R3 имеет значения, указанные для формулы I, с соединением формулы NH2C(: NH)NR4R5 (формула (2)), где R3 имеет значения, указанные для формулы I.
7.
В альтернативном варианте способ получения соединений формулы I включает взаимодействие соединения формулы I, где R1 обозначает хлор

где R2 и R3 имеют значения, указанные для формулы I, a R4 и R5 обозначают водород или (низш.)алкил,
А) с восстановителем с получением соединения формулы I, где R1 обозначает водород, или
Б) со вторичным амином формулы HNR6R7, где R6 и R7 имеют значения, указанные для формулы I, с получением соединения формулы I, где R1 обозначает -NR6R7.
8. В альтернативном варианте
способ получения соединений формулы I включает взаимодействие соединения формулы

где R1, R2 и R3 имеют значения, указанные для формулы I, со вторичным амином формулы HNR4R5, где R4 и R5 имеют значения, указанные для формулы I, с получением соединения формулы I, где R4 и R5 имеют значения, указанные для формулы I.
9. В альтернативном варианте способ получения соединений формулы I, где R1 обозначает гидроксиалкил или алкенил, включает: взаимодействие N-оксида соединения формулы I, где R1 обозначает алкил, с ангидридом карбоновой кислоты с получением соединения формулы I.
10. В альтернативном варианте способ получения соединений формулы I включает взаимодействие соединения формулы I с окислителем с получением N-оксида соединения формулы I или взаимодействие соединения формулы I с сильной кислотой с получением фармацевтически приемлемой соли соединения формулы I.
Соединения по настоящему изобретению являются селективными антагонистами 5-НТ2B-рецептора. Сродство к 5-НТ2B-рецепторам было подтверждено с помощью метода связывания in vitro с использованием клонированных 5-НТ2B-рецепторов, радиоактивно меченных с помощью [3Н]-5НТ, как описано в примере 17, ниже. Селективность в отношении 5-HT2B-рецептора была продемонстрирована с помощью обратного скрининга с использованием 5-НТ2A- и 5 -НТ2C -рецепторов (более подробно см. пример 18, ниже). Антагонистические свойства определяли с использованием продольного слоя мышечной оболочки дна желудка (более подробно см. пример 19, ниже).
В целом соединения по настоящему изобретению пригодны для лечения болезней, которые могут быть облегчены путем блокады 5-НТ2B-рецепторов. Вследствие фармакологического сходства связывания с лигандами 5-НТ2C- и 5-НТ2B-рецепторов многие терапевтические мишени, предложенные для антагонистов 5-НТ2C-рецептора, также являются мишенями для антагонистов 5-НТ2B-рецептора. В частности, ряд клинических наблюдений позволяет предположить терапевтическую активность антагонистов 5-НТ2B-рецептора в отношении предупреждения мигрени, поскольку мобилизация 5-НТ в плазму может являться ускоряющим фактором при мигрени. Кроме того, неселективные агонисты 5-НТ2B-рецептора провоцируют атаки мигрени у чувствительных людей, а неселективные антагонисты 5-НТ2B-рецептора являются эффективными в отношении предупреждения начала мигрени [Kalkman (1994), Life Sciences, 54, 641-644)].
Клинические и экспериментальные данные подтверждают терапевтическую роль антагонистов 5-НТ2C-рецептора при лечении страха. Агонист 5-HT2C-рецептора 1-(3-хлорфенил)пиперазин (mСРР) при введении пациентам-добровольцам вызывал чувство страха [Charney и др. (1987), Psychopharmacology, 92, 14-24]. mCPP также приводил к появлению симптомов страха у крысы, при этом на таких моделях чувства страха, как социальные взаимоотношения (SI) и Х-лабиринт, эти явления блокируются неселективными антагонистами 5-НТ2C/2А-рецептора, но не блокируются селективными антагонистами 5-НТ2A-рецептора [Kennett и др. (1989), Eur. J. Pharmacol., 164, 445-454 и Kennett (1993), см. выше]. Кроме того, неселективные антагонисты 5-НТ2C/2A-рецептора сами по себе вызывают анксиолитические воздействия в SI-тестах и конфликтных тестах Geller Seifter, в то время как у селективных антагонистов 5-НТ2A-рецептора это свойство не обнаружено. Эта терапевтическая мишень для антагонистов 5-НТ2C-рецептора эквивалента мишени для антагонистов 5-HT2B-рецептора.
Кроме того, введение mCPP пациентам, страдающим нарушением, связанным с состоянием паники, или обсессивно-компульсивным нарушением, приводило к увеличению уровней паники и/или страха [Charney и др. (1987), выше и Zohar и др. (1987), Arch. Gen. Psychiat., 44, 946-951]. Таким образом, современные данные подтверждают возможность применения селективных антагонистов 5-НТ2С -рецептора для лечения нарушения, связанного с генерализованным состоянием страха, нарушения, связанного с состоянием паники, и обсессивно-компульсивного нарушения. Эти терапевтические мишени для антагонистов 5-НТ2C-рецептора эквиваленты мишеням для антагонистов 5-НТ2B-рецептора.
Анксиолитическое действие может быть определено экспериментальным путем с помощью общепризнанной в данной области исследовательской двухкамерной модели Crawley и Goodwin [см., например, у Kilfoil и др., (1989), Neuropharmacology, 28(9), 901-905]. В целом этот метод заключается в оценке степени влияния соединения на естественный страх мышей в новой ярко освещенной зоне (более подробно см. в примере 21, ниже).
Клинические и экспериментальные данные подтверждают терапевтическую роль селективных антагонистов 5-НТ2C-рецептора при лечении химической зависимости. Агонист 5-НТ2C-рецептора mСРР индуцирует стремление к алкоголю у алкоголиков в состоянии абстиненции [Benkelfat и др., (1991), Arch. Gen. Psychiat. , 48, 383] . В отличие от этого неселективный антагонист 5-НТ2C/2A-рецептора ритансерин снижает пристрастие к алкоголю у крыс [Meert и др., (1991), Drug Development Res., 24, 235-249], в то время как селективный антагонист 5-НТ2A-рецептора кетансерин не влияет на пристрастие к алкоголю [Kennet и др. , (1992), J. Psychopharmacol., Abstr. A26]. Ритансерин также уменьшает пристрастие и к кокаину и к фентанилу, что было показано при использовании в качестве модели крыс, привыкших к употреблению наркотиков [Meert и др. , (1991), Drug Development Res., 25, 39-53 и Meert и др., (1991), Drug Development Res., 25, 55-66]. Клинические исследования показали, что ритансерин снижает поглощение алкоголя у хронических алкоголиков [Monti и др., (1991), Lancet. 337, 60] и пригоден для лечения пациентов при отказе от злоупотребления другими лекарственными средствами [Sadzot и др., (1989), Psychopharmacology, 98, 495-499]. Таким образом, современные данные подтверждают возможность применения селективных антагонистов 5-НТ2C-рецептора при лечении алкоголизма и привыкания к злоупотреблению другими лекарственными средствами. Эта терапевтическая мишень для антагонистов 5-НТ2C-рецептора эквивалента мишени для антагонистов 5-НТ2B -рецептора.
Положительные действия соединений при отказе от злоупотребления лекарствами могут быть определены экспериментально на мышах с помощью теста на страх при отмене [Carboni и др., (1988), Eur.J. Pharmacol., 151, 159-160]. Этот метод основан на использовании описанной выше исследовательской модели для измерения степени уменьшения с помощью соединения симптомов синдрома отмены, которые возникают после постоянного лечения наркотическим веществом и затем резкого прекращения этого лечения (более подробно см. в примере 22, ниже).
Клинические данные подтверждают терапевтическую роль селективных антагонистов 5-НТ2C-рецептора при лечении депрессии. Например, показано, что неселективные антагонисты 5-НТ2C/2A-рецептора проявляют клиническую эффективность при лечении депрессии [Murphy, (1978), Brit. J. Pharmacol., 5, 81S-85S; Klieser и др., (1988), J. Pharmacopsychiat., 21, 391-393 и Camara (1991), Biol. Psychiat., 29, 201A]. Кроме того, экспериментальные результаты позволяют предположить, что механизм, с помощью которого обычные антидепрессанты проявляют свою терапевтическую эффективность, связан с адаптивными изменениями в серотинэргической системе [Anderson (1983), Life Sci., 32, 1791-1801]. Например, постоянное лечение ингибиторами монаминоксидазы снижает mСРР-индуцируемые/5-НТ2C-опосредованные функциональные реакции в различных характерных случаях. Аналогичные воздействия проявляют селективные ингибиторы повторного поглощения 5-НТ. Эти данные позволяют предположить, что лечение, которое приводит к увеличению экстранейронных уровней 5-НТ, десенсибилизирует функцию 5-НТ2C-рецептора, что в свою очередь вызывает или способствует антидепрессивной активности [Kennett (1993), см. выше]. Эта терапевтическая мишень для антагонистов 5-НТ2C-рецептора эквивалента мишени для антагонистов 5-НТ2B-рецептора.
Клинические данные подтверждают терапевтическую активность селективных антагонистов 5-НТ2C-рецептора при лечении нарушения сна. Агонист 5-НТ2C-рецептора mСРР при введении пациентам-добровольцам приводит к уменьшению общего времени сна, эффективности сна, продолжительности фазы медленного сна (ФМС) и фазы быстрого сна, сопровождающегося быстрым движением глаз [Lawlor и др. , (1991), Biol. Psychiat., 29, 281-286]. В противоположность этому неселективный антагонист 5-НТ2C/2A-рецептора ритансерин увеличивает ФМС, уменьшает латентный период наступления сна и улучшает субъективное качество сна у здоровых добровольцев [Idzikowski и др., (1986), Brain Res., 378, 164-168; Idzikowski и др., (1987), Psychopharmacology, 93, 416-420; Declecrk и др. , (1987), Curr. Therap. Res., 41, 427-432 и Adam и др., (1989), Psychopharmacology, 99, 219-221]. Таким образом, принимая во внимание противоположные воздействия стимуляции 5-НТ2C-рецептора и блокирования 5-НТ2C-рецептора, селективные антагонисты 5-НТ2C-рецептора могут иметь важное терапевтическое значение при лечении нарушения сна [Kennett (1993), выше]. Эта терапевтическая мишень для антагонистов 5-НТ2C-рецептора эквивалента мишени для антагонистов 5-НТ2B-рецептора.
Клинические данные подтверждают терапевтическую активность селективных антагонистов 5-НТ2C-рецептора при лечении нарушений питания. Подтверждено, что неспецифические антагонисты 5-НТ2C/2A-рецептора вызывают повышенный аппетит и прибавление веса. Таким образом, существуют определенные клинические данные, подтверждающие возможность применения селективных антагонистов 5-НТ2C-рецептора для лечения нервной анорексии. Эта терапевтическая мишень для антагонистов 5-НТ2C-рецептора эквивалента мишени для антагонистов 5-НТ2B-рецептора.
Клинические данные подтверждают далее терапевтическую активность селективных антагонистов 5-НТ2C-рецептора при лечении приапизма. mСРР вызывает эрекции полового члена у крыс, причем это влияние блокируется неселективными антагонистами 5-НТ2C/2A-рецептора, но не блокируется селективными антагонистами 5-НТ2A-рецептора [Ноуеr, (1989), под ред. Fozard J., Peripheral actions of 5-HT, Oxford University Press, Oxford, 72-99]. Эта терапевтическая мишень для антагонистов 5-НТ2C-рецептора эквивалента мишени для антагонистов 5-НТ2B-рецептора.
При применении соединений по изобретению для лечения вышеуказанных состояний введение действующих веществ и их солей, представленных в настоящем описании, может осуществляться с помощью любого из приемлемых методов введения, включая оральный, парентеральный и другие системные пути введения. Может применяться любая фармацевтически приемлемая форма введения, включая твердые, полутвердые или жидкие дозируемые формы, такие как, например, таблетки, суппозитории, пилюли, капсулы, порошки, растворы, суспензии или т.п., предпочтительно в виде стандартных дозируемых форм, пригодных для однократного введения точных доз, или в виде дозируемых форм с непрерывным или контролируемым высвобождением для пролонгированного введения соединения с заранее выбранной скоростью. Композиции обычно включают общепринятый фармацевтический носитель или эксципиент и действующее вещество формулы I или его фармацевтически приемлемые соли и дополнительно могут включать другие медицинские агенты, фармацевтические агенты, носители, адъюванты и т.д.
Очевидно, что количество вводимого действующего вещества должно зависеть от субъекта, подлежащего лечению, серьезности заболевания, метода введения и рекомендаций лечащего врача. Однако эффективная доза для орального, парентерального и других системных путей введения составляет 0,01-20 мг/кг/день, предпочтительно 0,1-10 мг/кг/день. Для среднего человека весом 70 кг это количество должно составлять 0, 7-1400 мг/день или предпочтительно 7-700 мг/день.
Специалист в области лечения таких заболеваний может без проведения длительных экспериментов и, полагаясь на собственные знания и описание настоящего изобретения, установить для данного заболевания терапевтически эффективное количество соединения формулы I.
Для твердых композиций могут применяться обычные нетоксичные твердые носители, например фармацевтически чистые маннит, лактоза, целлюлоза, производные целлюлозы, кросскармеллоза натрия, крахмал, стеарат магния, сахарин натрия, тальк, глюкоза, сахароза, карбонат магния и т.п. Действующее вещество, как оно определено выше, может быть изготовлено в форме суппозиториев с использованием в качестве носителя, например, полиалкиленгликолей, ацетилированных триглицеридов и т.п. Жидкие композиции, применяемые в фармацевтических целях, могут быть, например, получены растворением, диспергированием и т.д. действующего вещества, как оно определено выше, и необязательно фармацевтических адъювантов в растворителе, таком как например, вода, физиологический раствор, водная декстроза, глицерин, этанол и т.п., с образованием раствора или суспензии. При необходимости подлежащая введению фармацевтическая композиция может также содержать в малых количествах нетоксичные вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, агенты, служащие для регулирования значения рН, и т.п., например ацетат натрия, сорбитанмонолаурат, триэтаноламинацетат натрия, триэтаноламинолеат т.д. Практические методы приготовления таких дозируемых форм известны или должны быть очевидны специалистам в данной области (см., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania, 15-е изд., 1975). Композиция или препаративная форма, подлежащая введению, в любом случае должна содержать действующее(ие) вещество (а) в количестве, эффективном для облегчения симптомов у пациента, подлежащего лечению.
Могут быть изготовлены дозируемые формы или композиции, содержащие действующее вещество (соединения формулы I или их соли) в интервале от 0,25 до 95%, с дополнением недостающего количества за счет нетоксичного носителя.
Для орального введения фармацевтически приемлемую нетоксичную композицию изготавливают включением любого из обычно применяемых эксципиентов, таких как, например, фармацевтически чистые маннит, лактоза, целлюлоза, производные целлюлозы, кросскармеллоза натрия, крахмал, стеарат магния, сахарин натрия, тальк, глюкоза, сахароза, карбонат магния и т.п. Такие композиции могут иметь форму растворов, суспензий, таблеток, пилюль, капсул, порошков, композиций с постоянным высвобождением и т.п. Такие композиции могут содержать 1-95% действующего вещества, более предпочтительно 2-50%, наиболее предпочтительно 5-8%.
Парентеральное введение обычно осуществляют путем инъекции: подкожной, внутримышечной или внутривенной. Препараты для инъекций могут быть изготовлены в виде обычных форм, таких как жидкие растворы или суспензии, твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией, или в виде эмульсии. Пригодными эксципиентами являются, например, вода, физиологический раствор, декстроза, глицерин, этанол или т.п. Кроме того, подлежащие введению фармацевтические композиции при необходимости могут также содержать в малых количествах нетоксичные вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, агенты, служащие для регулирования значения рН, и т.п., такие как, например, ацетат натрия, сорбитанмонолаурат, триэтаноламинолеат, триэтаноламинацетат натрия и т.д.
Разработанный в последнее время метод парентерального введения предусматривает имплантацию системы с медленным высвобождением или с постоянным высвобождением для поддержания постоянного уровня дозы (см., например, US 3710795).
Процент действующего вещества, содержащийся в таких композициях для парентерального введения, в значительной степени зависит от его конкретной природы, а также от активности соединения и потребностей пациента. Обычно действующие вещества рекомендуется применять в виде 0,1-10%-ного раствора, но их содержание может быть и более высоким в случае, когда композиция является твердой и подлежит дальнейшему разбавлению до вышеуказанных концентраций. Предпочтительно композиция должна содержать 0,2-2% действующего вещества в растворе.
При применении соединений по изобретению для лечения заболеваний или повреждений глаз, связанных с аномально высоким внутриглазным давлением, введение можно осуществлять с использованием любого фармацевтически приемлемого метода, обеспечивающего соответствующие местные концентрации для получения требуемой реакции. К таким методам относятся непосредственное введение в глаз в виде капель и применение вставок или имплантатов с контролируемым высвобождением лекарства, а также системное введение, как описано выше.
Капли и растворы, вносимые непосредственно в глаз, обычно являются стерилизованными водными растворами, содержащими от 0,1 до 10%, наиболее предпочтительно от 0,5 до 1% действующего вещества, вместе с пригодным буфером, стабилизатором и консервантом. Общая концентрация растворенных веществ должна быть такой, чтобы образовавшийся раствор был по возможности изотоничным по отношению к слезной жидкости (хотя это и не является абсолютно обязательным условием) и имел эквивалентное значение рН в интервале 6-8. Обычными консервантами являются фенилацетат ртути, тимерозал, хлорбутанол и хлорид бензалкония. Обычные буферные системы и соли основаны, например, на использовании цитрата, бората или фосфата, а приемлемые стабилизаторы включают глицерин и полисорбат 80. Водные растворы изготавливают простым растворением растворяемых веществ в соответствующем количестве воды, доведением значения рН до приблизительно 6,8-8,0, получением конечного объема с помощью дополнительной порции воды и стерилизацией препарата с использованием методов, хорошо известных в данной области.
Очевидно, что уровень дозы образовавшейся композиции должен зависеть от концентрации капель, состояния пациента и индивидуальной реакции на лечение. Однако обычная композиция в виде глазных капель может применяться из расчета приблизительно 2-10 капель, содержащих 0,5%-ный раствор действующего вещества, в день на глаз.
Композиции по настоящему изобретению также могут быть изготовлены для введения любым общепринятым методом по аналогии с другими композициями для местного применения, адаптированными для использования на млекопитающих. Эти композиции могут быть предназначены для применения любым обычным способом с использованием любого из широкого спектра фармацевтических носителей или наполнителей. Для такого местного применения фармацевтически приемлемая нетоксичная композиция может использоваться в полутвердой, жидкой или твердой форме, такой как, например, гели, кремы, лосьоны, растворы, суспензии, мази, порошки или т.п. Так, например, действующие вещества могут быть приготовлены в форме геля с использованием этанола, пропиленгликоля, пропиленкарбоната, полиэтиленгликолей, диизопропиладипата, глицерина, воды и т. д. с соответствующим гелеобразующими агентами, такими как карбомеры, клуцелы и т.д. При необходимости композиция может содержать в малых количествах нетоксичные вспомогательные вещества, такие как консерванты, антиоксиданты, агенты, служащие для регулирования значения рН, поверхностно-активные вещества и т. п. Практические методы приготовления таких дозируемых форм известны или являются очевидными для специалистов в данной области (см., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania, 16-е изд., 1980).
Предпочтительно фармацевтическую композицию вводят в виде однократной стандартной дозируемой формы для продолжительного лечения или в виде однократной стандартной дозируемой формы, принимаемой ad libitum (no желанию), когда специально требуется облегчение симптомов. Репрезентативные фармацевтические композиции, содержащие соединение формулы I, описаны в примерах 4-10.
Описанные ниже способы получения и примеры служат для иллюстрации изобретения и не направлены на ограничение его объема.
Способ получения 1
Способ получения соединений формулы (3)
А. Способ получения
соединения формулы (3), в котором R1 обозначает трет-бутил, a R2 обозначает водород
Метил-4,4-диметил-3-оксопентаноат (15,82 г) и гуанидинкарбонат (20,0 г) смешивали в
80 мл этанола и раствор выдерживали при температуре дефлегмации в течение 16 ч. Реакционную смесь концентрировали до 50 мл, удаляя растворитель при пониженном давлении, и добавляли 20 мл воды.
Оставшуюся смесь подкисляли уксусной кислотой, доводя значение рН до 5, получая осадок белого цвета. Осадок собирали фильтрацией, промывали водой и сушили в вакуумной печи, получая
2-амино-4-гидрокси-6-трет-бутилпиримидин (12,6 г), tпл 285-288oC (разл.).
Б. Способ получения соединений формулы (3), в которых R2 обозначает водород,
а R1 имеет различные значения
Аналогичным образом, но заменяя метил-4,4-диметил-3-оксопентаноат соответственно на этил-3-оксопентаноат, этил-4-метил-3-оксопентаноат,
этил-3-циклобутил-3-оксопропиноат, этил-3-циклопентил-3-оксопропиноат, этил-4-метил-3-оксогексаноат, этил-2-метил-3-оксобутаноат, этил-3-оксо-4-фенилпентаноат, этил-3-циклопропил-3-оксопропионат,
этил-2-фтор-3-оксобутаноат, этил-2-аминокарбонилацетат, этил-4,4,4-трифтор-3-оксобутаноат и этил-3-фенил-3-оксопропионат (в некоторых случаях вместо этилового эфира применяли метиловый эфир; оба
давали одинаково хорошие результаты) и работая аналогично методу, описанному выше в разделе 1А, получали следующие соединения формулы (3):
2-амино-6-этил-4-гидроксипиримидин,
2-амино-4-гидрокси-6-изопропилпиримидин, tпл 238-241oС,
2-амино-6-циклобутил-4-гидроксипиримидин, tпл 253-254oС,
2-амино-6-циклопентил-4-гидроксипиримидин, tпл 237-241oС (разл.),
2-амино-6-(бут-2-ил)-4-гидроксипиримидин, tпл 195-198oC,
2-амино-5,
6-диметил-4-гидроксипиримидин,
2-амино-6-бензил-4-гидроксипиримидин,
2-амино-6-циклопропил-4-гидроксипиримидин,
2-амино-5-фтор-4-гидрокси-6-метилпиримидин,
2,
6-диамино-4-гидроксипиримидин,
2-амино-4-гидрокси-6-трифтометилпиримидин и
2-амино-4-гидрокси-6-фенилпиримидин.
В. Аналогичным образом, необязательно заменяя метил-4, 4-диметил-3-оксопентаноат на другие соединения формулы (1) и необязательно заменяя гуанидинкарбонат на другие соединения формулы (2) и работая аналогично методу, описанному выше в разделе 1А, получали другие соединения формулы (3).
Способ получения 2
Способ получения соединений формулы (4)
А. Способ получения соединения формулы (4), в котором R1
обозначает трет-бутил, а R2 обозначает водород
2-амино-4-гидрокси-6-трет-бутилпиримидин (8,35 г) растворяли в 50 мл оксихлорида фосфора и раствор выдерживали при температуре
дефлегмации в течение 2 ч. Избыток оксихлорида фосфора удаляли в вакууме и остаток растворяли в 100 мл этанола. Значение рН раствора доводили до 8 с помощью охлажденного на льду концентрированного
гидроксида аммония и растворитель удаляли при пониженном давлении. Остаток фильтровали, получая твердое вещество белого цвета, которое перекристаллизовали из смеси этанол-вода, получая
2-амино-4-хлор-6-трет-бутилпиримидин (3,66 г), tлп 87,7-88,9oС.
Б. Аналогичным образом, но заменяя 2-амино-4-гидрокси-6-трет-бутилпиримидин на другие соединения
формулы (3) и работая аналогично методу, описанному выше в разделе 2А, получали следующие соединения формулы (4):
2-амино-4-хлор-6-этилпиримидин,
2-амино-4-хлор-6-изопропилпиримидин,
tпл 94-97oС,
2-амино-4-хлор-6-циклопропилметилпиримидин, tпл 116,5-120,0oС,
2-амино-4-хлор-6-циклобутилпиримидин, tпл 98-99oС,
2-амино-6-(бут-2-ил)-4-хлорпиримидин, tпл 63-65oС,
2-амино-4-хлор-6-циклопентилпиримидин, tпл 101,5-103oС,
2-амино-4-хлор-5,6-диметилпиримидин,
2-амино-6-бензил-4-хлорпиримидин,
2-амино-4-хлор-6-циклопропилпиримидин,
2-амино-4-хлор-5-фтор-6-метилпиримидин,
2,
6-диамино-4-хлорпиримидин,
2-амино-4-хлор-6-трифторметилпиримидин и
2-амино-4-хлор-6-фенилпиримидин.
В. Аналогичным образом, но заменяя 2-амино-4-гидрокси-6-трет-бутилпиримидин на другие соединения формулы (3) и работая аналогично методу, описанному выше в разделе 2А, получали другие соединения формулы (4).
Способ
получения 3
Способ получения соединений формулы (9)
А. Способ получения соединения формулы (9), в котором R3 обозначает 4,7-дифторнафт-1-ил, a R2 обозначает
водород
1,6-дифторнафталин (0,164 г, 1,0 ммоль) растворяли в 1,2-дихлорэтане (5 мл) и охлаждали до 0oС. К раствору добавляли трихлорид алюминия (0,264 г, 2,0 ммоль) в виде твердого
вещества. К раствору медленно в течение 20 мин добавляли уксусный ангидрид (0,1 мл, 1,0 ммоль), поддерживая температуру на уровне 0oС. Реакционную смесь сливали на охлажденный на льду
10%-ный водный раствор соляной кислоты и экстрагировали метиленхлоридом (2•10 мл). Органический слой сушили над сульфатом натрия, концентрировали и очищали с помощью хроматографии на колонках,
получая 1-(4,7-дифторнафт-1-ил)этанон в виде масла (0,165 г, 80%).
Б. Аналогичным образом, но заменяя 1,6-дифторнафталин на другие соединения формулы R3 и работая аналогично методу, описанному выше в разделе 3А, получали другие соединения формулы (9).
Способ получения 4
Способ получения соединений формулы (15)
А. Способ
получения соединения формулы (15), в котором R1 обозначает метил, a R2 обозначает водород
S-метилизотиомочевину (22,26 г, 160 ммоль) добавляли к раствору карбоната
натрия (16,9 г, 160 ммоль) в воде (50 мл) и перемешивали при комнатной температуре до полного растворения S-метилизотиомочевины. К смеси в виде одной порции добавляли этилацетоацетат (10,41 г, 80
ммоль). После перемешивания в течение 60 ч при комантной температуре реакцию нейтрализовали уксусной кислотой, получая осадок в виде твердого вещества белого цвета. Твердое вещество собирали,
промывали водой и сушили в вакууме, получая 4-гидрокси-6-метил-2-(метилтио)пиримидин (9,38 г, 75%), tпл 218-221oC.
Б. Способ получения соединений формулы (15), в
которых R2 обозначает водород, а R1 имеет различные значения
Аналогичным образом, но заменяя этилацетоацетат на этил-4-метил-3-оксопентаноат или на метил-4,
4-диметил-3-оксопентаноат и работая аналогично методу, описанному выше в разделе 4А, получали следующие соединения формулы (15):
4-гидрокси-6-изопропил-2-(метилтио) пиримидин и
6-трет-бутил-4-гидрокси-2-(метилтио) пиримидин.
В. Способ получения соединений формулы (15). в которых R2 обозначает водород, а R1 имеет различные значения
Аналогичным образом, но заменяя этилацетоацетат на другие соединения формулы (1) и работая аналогично методу, описанному выше в разделе 4А, получали другие соединения формулы (15).
Способ получения 5
Способ получения соединений формулы (16)
А. Способ получения соединения формулы (16). в котором R1 обозначает метил, а R2
обозначает водород
4-гидрокси-6-метил-2-(метилтио)пиримидин (9,20 г, 59 ммоль) и оксихлорид фосфора (60 мл) объединяли и выдерживали при температуре дефлегмации в течение 3 ч. Реакционную
смесь охлаждали до комнатной температуры и сливали на ледяную крошку. Образовавшуюся водную смесь экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором бикарбоната
натрия, а затем промывали водой, сушили над сульфатом магния и сушили в вакууме, получая 4-хлор-6-метил-2-(метилтио)пиримидин (8,27 г, 80%), tпл 37-38oC.
Б.
Аналогичным образом, но заменяя 4-гидрокси-6-метил-2-(метилтио) пиримидин на другие соединения формулы (15) и работая аналогично методу, описанному выше в разделе 5А, получали следующие соединения
формулы (16):
4-хлор-6-изопропил-2-(метилтио)пиримидин, tкип 127-128oC при 0,5 торр, и
6-трет-бутил-4-хлор-2-(метилтио)пиримидин, tпл 46-48oС.
В. Аналогичным образом, но заменяя 4-гидрокси-6-метил-2-(метилтио) пиримидин на другие соединения формулы (15) и работая аналогично методу, описанному выше в разделе 5А, получали другие соединения формулы (16).
Способ получения 6
Способ получения соединений формулы (17)
А. Способ получения соединения формулы (17), в котором R1 обозначает изопропил, R2 обозначает водород, а R3 обозначает 4-фтор-1-нафтил
Перемешиваемый раствор 1-бром-4-фторнафталина (4,95 г) в 100 мл тетрагидрофурана
охлаждают до -80oС, перемешивали и по каплям добавляли 2,5М н-бутиллитий (10 мл). Смесь перемешивали в течение 30 мин, затем добавляли триметоксиборан (3 мл), смесь перемешивали в течение 1
ч, затем давали нагреться до комнатной температуры и растворитель удаляли при пониженном давлении. К этому остатку добавляли бензол (100 мл), 4-хлор-6-изопропил-2-(метилтио)пиримидин (4,04 г),
тетракис(трифенилфосфин)палладий(0) (500 мг) и карбонат натрия (20 мл 2М раствора), выдерживали при температуре дефлегмации (приблизительно при 80-90oС) в течение 14 ч. Смесь фильтровали и
растворитель удаляли при пониженном давлении. Остаток хроматографировали на силикагеле, элюируя смесью 2%-ный этилацетат/гексан, и получали неочищенный
4-(4-фторнафт-1-ил)-6-изопропил-2-(метилтио)пиримидин (4,87 г), который использовали в следующей реакции без дополнительной очистки.
Б. Аналогичным образом, но заменяя
4-хлор-6-изопропил-2-(метил-тио)пиримидин на другие соединения формулы (16) и работая аналогично методу, описанному выше в разделе 6А, получали:
4-(4-фторнафт-1-ил)-6-метил-2-(метилтио)пиримидин, tпл 140-142oC и
4-(4-фторнафт-1-ил)-6-метокси-2-(метилтио)пиримидин,1Н-ЯМР 8,19 (2Н, m), 7,65 (3Н, m), 7,
25 (1Н, dd J=8, 10 Гц), 6,45 (1H, s), 3,98 (3H, s), 2,55 (3Н, s).
В. Аналогичным образом, но заменяя 4-хлор-6-изопропил-2-(метилтио) пиримидин на другие соединения формулы (16) и работая аналогично методу, описанному выше в разделе 6А, получали другие соединения формулы (17).
Г. Альтернативный способ получения соединений формулы (17), в которых R1
обозначает аралкил, из соединений формулы (17), в которых R1 обозначает алкил
Раствор 4-(4-фторнафт-2-ил)-6-метил-2-(метилтио)пиримидина (0,500 г, 1,76 ммоль) в тетрагидрофуране (2
мл) добавляли по каплям к раствору диизопропиламида лития (1,2 экв.) в тетрагидрофуране (10 мл), охлажденному до -70oС. После перемешивания в течение 30 мин к раствору в виде одной порции
добавляли бензилбромид (0,251 мл, 2,11 ммоль). Раствор нагревали до комнатной температуры и разбавляли этилацетатом (50 мл), сливали на воду (50 мл). Органический слой отделяли, сушили над сульфатом
магния и концентрировали в вакууме и образовавшееся масло очищали хроматографией на колонках, получая 4-(4-фторнафт-1-ил)-2-метилтио-6-фенэтилпиримидин (0,342 г, 52%).
Д. Аналогичным
образом, но заменяя 4-(4-фторнафт-2-ил)-6-метил-2-(метилтио) пиримидин на другие соединения формулы (16), в которых R1 обозначает алкил, и работая аналогично методу, описанному выше в
разделе 6Г, получали следующие соединения формулы (17):
4-(4-фторнафт-1-ил)-6-(2-гидроксифенэтил)-2-метилтиопиримидин и
4-(4-фторнафт-1-ил)-6-(3-гидроксипропил)-2-метилтиопиримидин.
Е. Аналогичным образом, но заменяя 4-(4-фторнафт-2-ил)-6-метил-2-(метилтио) пиримидин на другие соединения формулы (16), в которых R1 обозначает (низш. )алкил, и работая аналогично методу, описанному выше в разделе 6В, где R1 обозначает алкил, получали другие соединения формулы (17).
Способ получения 7
Способ получения соединений формулы (18)
А. Способ получения соединения формулы (18), в котором R1 обозначает изопропил, R2
обозначает водород, а R3 обозначает 4-фтор-1-нафтил
4-(4-фторнафт-1-ил)-2-метилтио-6-фенэтилпиримидин (0,342 г, 0,914 ммоль) растворяли в метиленхлориде при комнатной температуре.
Небольшими порциями добавляли мета-хлорпербензойную кислоту
(55-60%-ную, 0,554 г, 1,83 ммоль). Через 16 ч реакционную смесь промывали насыщенным водным раствором бисульфита натрия. Органический
слой промывали насыщенным водным раствором бикарбоната натрия и водой, сушили над сульфатом магния и концентрировали в вакууме, получая 4-(4-фторнафт-1-ил)-2-метилсульфонил-6-фенэтилпиримидин (0,402 г,
97%) в виде масла,1Н-ЯМР 8,07 (1Н, m), 7,85 (1Н, m), 7,47 (2Н, m), 7,32 1Н, s), 7,13 (7Н, m), 3,29 (2Н, m), 3,07 (2Н, m).
Б. Аналогичным образом, но заменяя
4-(4-фторнафт-1-ил)-2-метилтио-6-фенэтилпиримидин на другие соединения формулы (17) и работая аналогично методу, описанному выше в разделе 7А, получали следующие соединения формулы (18):
4-(4-фторнафт-1-ил)-6-(2-гидроксифенэтил)-2-метилсульфонилпиримидин, tпл 88,1-90,0oC,
4-(4-фторнафт-1-ил)-6-(3-гидроксипропил)-2-метилсульфонилпиримидин,1
Н-ЯМР 8,21 (2Н, m), 7,69 (1Н, dd, J=5,3, 8,2 Гц), 7,68 (1Н, s), 7,61 (2Н, m), 7,24 (1Н, dd, J=8, 10 Гц), 3,76 (2Н, t, J=7,5 Гц), 3,40 (3Н, s), 3,09 (2Н, t, J=7,5 Гц), 2,11 (2Н, m),
4-(4-фторнафт-1-ил)-6-метокси-2-метилсульфонилпиримидин,1Н-ЯМР 8,20 (2Н, m), 7,64 (1H, m), 7,25 (1H, dd, J=8, 10 Гц), 7,15 (1H, s), 4,20 (3Н, s), 3,39 (3Н, s), и
4-(4-фторнафт-1-ил)-6-изопропил-2-метилсульфонилпиримидин, tпл 96,1-97,1oС.
В. Аналогичным образом, но заменяя 4-(4-фторнафт-1-ил)-2-метилтио-6-фенэтилпиримидин на другие соединения формулы (17) и работая аналогично методу, описанному выше в разделе 7А, получали другие соединения формулы (18).
Пример 1
Способ получения соединения
формулы I
А. Способ получения соединения формулы 1, в котором R1 и R2 обозначают метил, R3 обозначает нафт-1-ил, а R4 и R5 обозначают
водород
Гомогенный раствор, содержащий 1-нафтилбороновую кислоту (0,382 г), 2-амино-4-хлор-5,6-диметилпиримидин (0,350 г), тетракис(трифенилфосфин) палладий (0) (0,153 г), этиловый спирт (8
мл), воду (4 мл), 1,2-диметоксиэтан (8 мл) и карбонат натрия (0,85 г), выдерживали при перемешивании при температуре дефлегмации (приблизительно 80o-90oС) в течение 14 ч. Затем
раствор охлаждали до комнатной температуры, фильтровали и экстрагировали этилацетатом. Растворитель удаляли при пониженном давлении и образовавшееся твердое вещество желтого цвета
перекристаллизовывали, получая 2-амино-5,6-диметил-4-(нафт-1-ил)пиримидин (0,213 г), tпл 213,5-215,1oС.
Б. Аналогичным образом, но необязательно заменяя
2-амино-4-хлор-5,6-диметилпиримидин на другие соединения формулы (4) и необязательно заменяя 1-нафтилбороновую кислоту на другие соединения формулы (5), а также работая аналогично методу, описанному
выше в примере 1А, получали следующие соединения формулы I:
2-амино-6-циклопентил-4-(нафт-1-ил) пиримидин, tпл 146,8-147,4oС,
2-амино-6-(бут-2-ил)-4-(нафт-1-ил)пиримидин, tпл 109,6-110,8oС,
гидробромид 2-амино-6-(2-метилпропил)-4-(нафт-1-ил)пиримидина, tпл 147,0-151,5oС,
2-амино-6-(трет-бутил)-4-(нафт-1-ил)пиримидин, tпл 161,0-161,3oС,
2-амино-6-бензил-4-(нафт-1-ил)пиримидин, tпл 147,9-148,2oС,
2-амино-6-циклобутил-4-(нафт-1-ил)пиримидин, tпл 147-148oC,
2-амино-6-циклопропил-4-(нафт-1-ил)пиримидин, tпл 182,8-184,0oС,
2-амино-4-(нафт-1-ил)-6-н-пропилпиримидин, tпл 119,5-120,5oС,
2-амино-6-изопропил-4-(нафт-1-ил)пиримидин, tпл 124-126oС,
2-амино-5-фтор-6-метил-4-(нафт-1-ил)пиримидин, tпл 155-157oС,
гидрохлорид 2-амино-6-этил-4-(нафт-1-ил)пиримидина, tпл 157-160oC,
гидрохлорид 2,6-диамино-4-(нафт-1-ил) пиримидина, tпл >290oC,
2-амино-6-трифторметил-4-(нафт-1-ил)пиримидин, tпл 152-154oC,
гидрохлорид 2-амино-4-(нафт-1-ил)-6-фенилпиримидина, tпл 232-236oС,
2-амино-4-(3-фторфенил)-6-метилпиримидин, tпл 140,6-141,4oС,
2-амино-4-(3-метоксифенил)-6-метилпиримидин, tпл 125,8-129,6oС,
2-амино-6-метил-4-(3-нитрофенил)пиримидин, tпл 198,5-199,6oС,
2-амино-4-(3-хлор-4-фторфенил)-6-метилпиримидин, tпл 163,8-165,5oС,
2-амино-4-(3,5-дихлорфенил)-6-метилпиримидин, tпл 187,0-187,9oС,
2-амино-6-метил-4-(3-трифторметилфенил)пиримидин, tпл 122,0-122,8oС,
гидрохлорид 2-амино-6-метил-4-(нафт-1-ил)пиримидина, tпл 226oC,
гидрохлорид 2-амино-4-(4-фторнафт-1-ил)-6-(3,3,3-трифторпропил) пиримидина, tпл 152-155oС,
2-амино-4-(5-фторнафт-1-ил)-6-изопропилпиримидин, tпл 86-88oС,
гидрохлорид 2-амино-4-(2-фторнафт-1-ил)-6-изопропилпиримидина, tпл 205-206oС,
гидрохлорид 2-амино-4-(2-фторнафт-1-ил)-6-метоксипиримидина, tпл 189-190oС,
гидрохлорид 2-амино-4-(4-фторнафт-1-ил)-6-метоксипиримидина, tпл >280oС,
гидрохлорид 2-амино-4-(4-фторнафт-1-ил)-6-(2,2,
2-трифторэтокси)пиримидина, tпл 206,1-208,0oС,
гидрохлорид 2-амино-6-трет-бутил-4-(2-фторнафт-1-ил)пиримидина, tпл 230-233oС,
2-амино-4-(2-фторнафт-1-ил)-6-метилпиримидин, tпл 149-150oC,
гидрохлорид 2-амино-4-(2-метилнафт-1-ил)-6-изопропилпиримидина, tпл 193-194oС,
2-амино-4-(6-метилаценафтен-5-ил)-6-метилпиримидин, tпл 198-199oС,
гидрохлорид 2-амино-6-циклопропил-4-(1Н-индол-4-ил)пиримидина, tпл >280o
С,
2-амино-6-трет-бутил-4-(1Н-индол-4-ил)пиримидин, tпл 171-173oC,
2-амино-4-(8-гидроксиметилнафт-1-ил)-6-метилпиримидин, tпл 206-208oС,
2-амино-4-(1Н-индол-7-ил)-6-изопропилпиримидин, tпл 143-145oC,
гидрохлорид 2-амино-4-(4-амино-5-хлор-2-метоксифенил)-6-изопропилпиримидина, tпл 187,
1-190,6oС,
2-амино-6-циклобутил-4-(1Н-индол-4-ил)пиримидин, tпл 225-226oС,
гидрохлорид 2-амино-6-(3-метилбутил)-4-(нафт-1-ил)пиримидина, tпл 151,5-153,0oС и
2-амино-4-(4-амино-5-хлор-2-метоксифенил)-6-метилпиримидин, tпл 183-184oС.
В. Аналогичным образом, но необязательно заменяя 2-амино-4-хлор-5,6-диметилпиримидин на другие соединения формулы (4) и необязательно заменяя 1-нафтилбороновую кислоту на другие соединения формулы (5) и работая аналогично методу, описанному выше в примере 1А, получали другие соединения формулы 1.
Пример 2
Альтернативный способ получения соединения формулы I
А. Способ получения соединения формулы I, в
котором R1 обозначает н-пропил, R2 обозначает водород, R3 обозначает 4-фторнафт-1-ил и R4 и R5 обозначают водород
К раствору
1-бром-4-фторнафталина (0,5 г) в 10 мл тетрагидрофурана при перемешивании при -78oС в атмосфере азота добавляли по каплям н-бутиллитий (1,6М, 1,53 мл). Раствору давали перемешаться в
течение 5 мин, затем по каплям добавляли триметоксиборан (0,33 мл). Раствору давали нагреться до комнатной температуры и растворитель удаляли при пониженном давлении, получая соединение формулы (7),
диметокси-(4-фторнафт-1-ил)боран, в виде твердого вещества.
Это твердое вещество растворяли в 5 мл бензола и добавляли 2-амино-4-хлор-6-н-пропилпиримидин (0,381 г), тетракис(трифенилфосфин)палладий(0) (0,100 г) и 6 мл 2М водного раствора карбоната натрия. Гетерогенный раствор выдерживали при температуре дефлегмации (приблизительно 80o-90oС) в течение 1 ч, затем раствор охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали. Фильтрат концентрировали в вакууме и остаток хроматографировали на силикагеле, элюируя смесью гексан/этилацетат, и получали 2-амино-4-(4-фторнафт-1-ил)-6-н-пропилпиримидин (0,110 г), tпл 136,9-137,4oС.
Б. Аналогичным образом, но необязательно заменяя
1-бром-4-фторнафталин на другие соединения формулы (6) и необязательно заменяя 2-амино-4-хлор-6-н-пропилпиримидин на другие соединения формулы (4) и работая аналогично методу, описанному выше в
примере 2А, получали следующие соединения формулы I:
гидрохлорид 2-амино-4-(4-хлорнафт-1-ил)-6-(2-метилпропил)пиримидина, tпл 198,2-199,8oС,
гидрохлорид
2-амино-4-(4-фторнафт-1-ил)-6-(2-метилпропил)пиримидина, tпл 191,3-193,0oС,
2-амино-4-(4-хлорнафт-1-ил)-6-этилпиримидин, tпл 142,7-143,2oС,
2-амино-4-(4-метилнафт-1-ил)-6-изопропилпиримидин, tпл 143,9-145,0oС,
гидрохлорид 2-амино-6-(трет-бутил)-4-(4-фторнафт-1-ил)пиримидина, tпл 193-194oC,
2-амино-4-(4,5-диметилнафт-1-ил)-6-метилпиримидин, tпл 194-195oС,
2-амино-4-(4,5-дифторнафт-1-ил)-6-изопропилпиримидин, tпл 123-124oС,
гидрохлорид 2-амино-4-(4-хлорнафт-1-ил)-6-изопропилпиримидина, tпл 183,2-185,6oС,
2-амино-6-циклопропил-4-(4-фторнафт-1-ил)пиримидин, tпл
150,7-151,5oС,
гидрохлорид 2-амино-6-циклопропилметил-4-(4-фторнафт-1-ил) пиримидина, tпл 128,4-129,4oС,
гидрохлорид
2-амино-6-циклобутил-4-(4-фторнафт-1-ил)пиримидина, tпл 168-171oС,
2-амино-4-(4,5-дифторнафт-1-ил)-6-метилпиримидин, tпл 200oC,
2-амино-4-(1Н, 3Н-бензо[d,е]изохромен-6-ил)-6-метилпиримидин, tпл 216-218oС,
2-амино-4-(аценафт-5-ил)-6-изопропилпиримидин, tпл 167-168oС,
2-амино-6-метил-4-(фенантрен-9-ил)пиримидин, tпл 191,3-191,8oС,
2-амино-4-(4-метилнафт-1-ил)-6-метилпиримидин, tпл 175,2-176,6oС,
гидрохлорид 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидина, tпл 156-158oС,
малеат 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидина, tпл 155-157o
С,
2-амино-6-этил-4-(2-метил-4-фторнафт-1-ил)пиримидин, tпл 121-122oС,
2-амино-4-(аценафт-5-ил)-6-метилпиримидин, tпл 211-213oС,
2-амино-4-(изохинолин-4-ил)-6-метилпиримидин, tпл 212,0-213,5oС,
2-амино-4-(хинолин-8-ил)-6-метилпиримидин, tпл 194,8-195,5oС,
2-амино-4-(4-фторнафт-1-ил)пиримидин, tпл 203,4-204,1oС,
2-амино-6-этил-4-(4-фторнафт-1-ил)пиримидин, tпл 198-199oC,
гидрохлорид
2-амино-4-(4-фторнафт-1-ил)-6-метилпиримидина, tпл 238,3-238,6oС и
гидрохлорид 2-амино-4-(2-метилнафт-1-ил)-6-метилпиримидина, tпл 216,6-219,4o
С.
В. Аналогичным образом, но необязательно заменяя 1-бром-4-фторнафталин на другие соединения формулы (6) и необязательно заменяя 2-амино-4-хлор-6-н-пропилпиримидин на другие соединения формулы (4) и работая аналогично методу, описанному выше в примере 2А, получали другие соединения формулы I.
Пример 3
Альтернативный способ получения соединения
формулы I
А. Способ получения соединения формулы 1, в котором R1 обозначает метил, R2 обозначает водород, R3 обозначает 6-метокси-3,4-дигидро-2Н-хинолин-1-ил
и R4 и R5 обозначают водород
Колбу, содержащую 6-метокси-1,2,3,4-тетрагидрохинолин (1,33 г), 2-амино-4-хлор-6-метилпиримидин (1,00 г), серную кислоту (0,6 г) и 100 мл
воды, выдерживали в паровой бане в течение 2 ч. Затем раствор охлаждали до комнатной температуры и обрабатывали гидроксидом аммония до тех пор, пока раствор не станет щелочным (рН 8-9). Образовавшееся
твердое вещество, которое осаждалось из раствора, собирали фильтрацией и перекристаллизовывали из этилового спирта, получая 2-амино-4-(6-метокси-3,4-дигидро-2Н-хинолин-1-ил)-6-метилпиримидин (0,93 г),
tпл 175,2-175,9oС.
Б. Аналогичным образом, но необязательно заменяя 6-метокси-1,2,3,4-тетрагидрохинолин на другие соединения формулы (8) и необязательно заменяя
2-амино-4-хлор-6-метилпиримидин на другие соединения формулы (4), а также работая аналогично методу, описанному выше в примере 3А, получали следующие соединения формулы I:
2-амино-4-(6-фтор-3,
4-дигидро-2Н-хинолин-1-ил)-6-метилпиримидин, tпл 156-157oC,
гидрохлорид 2-амино-6-хлор-4-(3,4-дигидро-2Н-хинолин-1-ил)пиримидина, tпл >180oC
(разл.),
дигидрохлорид 2,6-диамино-4-(3,4-дигидро-2Н-хинолин-1-ил)пиримидина, tпл 196-197oС,
6-(3,4-дигидро-2Н-хинолин-1-ил)-9Н-пурин-2-иламин, tпл
203,5-204,0oС,
2-амино-4-(2-метил-3,4-дигидро-2Н-хинолин-1-ил)-6-метилпиримидин, tпл 141-144oC,
2-амино-4-(6-метокси-3,
4-дигидро-2Н-хинолин-1-ил)-6-трифторметилпиримидин, tпл 175,6-177,5oС,
2-амино-4-(3,4-дигидро-2Н-хинолин-1-ил)-6-этилпиримидин, tпл 141,4-142,1oС,
2-амино-6-метил-4-(6-метил-3,4-дигидро-2Н-хинолин-1-ил) пиримидин, tпл 170,6-171,4oC,
2-амино-4-(3,4-дигидро-2Н-хинолин-1-ил)-6-трифторметилпиримидин, tпл 162-164oC,
2-амино-4-(6-фтор-2-метил-3,4-дигидро-2Н-хинолин-1-ил)-6-метилпиримидин, tпл 154,9-155,6oС,
4-(3,
4-дигидро-2Н-хинолин-1-ил)-2-(метиламино) пиримидин,
[2-(3,4-дигидро-2Н-хинолин-1-ил)пиримидин-4-ил] метиламин,
2-амино-6-метил-4-(2,3,4,5-тетрагидробензо[b]азепин-1-ил) пиримидин,
tпл 182,6-184,2oC,
2-амино-4-(7,8-дигидро-6Н-5-окса-9-азабензоциклогептен-9-ил)-6-метилпиримидин, tпл 189,9-192,0oС,
2-амино-4-(2,
3-дигидробензо[1,4] оксазин-4-ил)-6-метилпиримидин, tпл 177,7-178,5oС,
2-амино-4-(2-метил-3,4-дигидроиндол-1-ил)-6-метилпиримидин, tпл 182,9-183,4o
С,
гидрохлорид 2-амино-4-(3,4-дигидро-2Н-хинолин-1-ил)-6-метилпиримидина, tпл 261,5-262,3oС, и
2-амино-4-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиримидин,
tпл 142,2-143,3oС.
В. Способ получения соединения формулы I, в котором R1 обозначает хлор, R2 обозначает водород, R3 обозначает
3,4-дигидро-2Н-хинолин-1-ил, а R4 и R5 обозначают водород
1,2,3,4-тетрагидрохинолин (2,66 г, 20 ммоль) и 2-амино-4,6-дихлорпиримидин (3,30 г, 20 ммоль) растворяли в 10
мл N,N-диметилформамида (ДМФ) и весь раствор выдерживали при 70-90oС в течение 24 ч. ДМФ удаляли в вакууме и остаток кипятили с обратным холодильником с этилацетатом, получая 4,0 г твердого
вещества; твердое вещество хроматографировали на силикагеле, элюируя метиленхлоридом, и получали 2-амино-6-хлор-4-(3,4-дигидро-2Н-хинолин-1-ил)пиримидин (400 мг), tпл 167,1-167,5o
С, гидрохлорид 2-амино-6-хлор-4-(3,4-дигидро-2Н-хинолин-1-ил) пиримидина, tпл 179oС (разл.).
Г. Аналогичным образом, но необязательно заменяя 6-метокси-1,2,3, 4-тетрагидрохинолин на другие соединения формулы (8), а также необязательно заменяя 2-амино-4-хлор-6-метилпиримидин на другие соединения формулы (4) и работая аналогично методу, описанному выше в примере 3А или 3В, получали другие соединения формулы I.
Пример 4
Альтернативный способ получения соединения формулы I
А. Способ получения соединения формулы I, в
котором R1 обозначает N,N-диэтиламино, R2 обозначает водород, R3 обозначает 3,4-дигидро-2Н-хинолин-1-ил, а R4 и R5 обозначают водород
К
раствору 2-амино-6-хлор-4-(1,2,3,4-тетрагидрохинолин-1-ил) пиримидина (250 мг) в 5 мл этиленгликоля добавляли избыток диэтиламина. Смесь выдерживали в течение 2 дней при 100oС. Неочищенный
продукт очищали с помощью хроматографии, получая 300 мг твердого вещества. После обработки твердого вещества соляной кислотой-этиловым спиртом получали гидрохлорид 2-амино-6-диэтиламино-4-(3,
4-дигидро-2Н-хинолин-1-ил) пиримидина, tпл 167-170oС.
Б. Аналогичным образом, но необязательно заменяя диэтиламин на другие амины формулы HNR6R4, а также необязательно заменяя 2-амино-6-хлор-4-(1,2,3,4-тетрагидрохинолин-1-ил)пиримидин на другие соединения формулы I, в которых R1 обозначает хлор, и работая аналогично методу, описанному выше в примере 4А, получали другие соединения формулы I, в которых R1 обозначает -NR6R7.
Пример 5
Альтернативный способ получения
соединения формулы I
А. Способ получения соединения формулы I, в котором R1 обозначает метил, R2 обозначает водород, R3 обозначает 1Н-индол-4-ил, а R4 и R5 обозначают водород
4-ацетилиндол (0,101 г) кипятили с обратным холодильником в 5 мл этилацетата. К кипящему при температуре дефлемации раствору порциями добавляли
гидрид натрия (0,20 г, 60%-ная масляная дисперсия) до тех пор, пока анализ с помощью тонкослойной хроматографии не показал полное вступление в реакцию исходного продукта. Реакцию в смеси прекращали,
добавляя воду, и подкисляли до рН 3. Этилацетатный слой сушили (сульфат магния) и концентрировали, получая неочищенный продукт. Неочищенный продукт хроматографировали на силикагеле, элюируя смесью 4:1
гексан/этилацетат, с получением в результате 1-(1Н-индол-4-ил)-1,3-бутандиона (0,104 г), соединения формулы (11), tпл 104-105oС.
Б. 1-(1Н-индол-4-ил)-1, 3-бутандион (0,096 г) смешивали с карбонатом гуанидина (0,070 г) и смесь выдерживали при 150oС в течение 3 ч. Добавляли дополнительную порцию карбоната гуанидина (0,070 г) и смесь продолжали нагревать в течение еще 2 ч. Реакционную смесь нагревали, добавляя этилацетат, фильтровали и этилацетатный слой концентрировали, получая твердое вещество (0,090 г). После экспресс-хроматографии на силикагеле и элюирования смесью 1: 1 гексан/этилацетат получали 2-амино-4-(1Н-индол-4-ил)-6-метилпиримидин (0,029 г), tпл 242-243,5oС.
В. Аналогичным образом, но заменяя 4-ацетилиндол на 1-ацетилнафталин на описанной выше стадии 5А, а также заменяя карбонат гуанидина на стадии Б на 1-аргинин и работая аналогично методу, описанному выше в примере 5А и 5Б, получали 2-амино-5-(6-метил-4-нафт-1-ил)пиримидин-2-иламино)пентановую кислоту, tпл 264-266oС.
Г. Аналогичным образом, но заменяя 4-ацетилиндол на 1-ацетилнафталин на описанной выше стадии 5А и работая аналогично методу, описанному выше в примере 5А и 5Б, получали гидрохлорид 2-амино-6-метил-4-(нафт-1-ил)пиримидина.
Д. Аналогичным образом, но заменяя 1-(1Н-индол-4-ил)-1,3-бутандион на 1-(3-хлорфенил)-1,3-бутандион и работая аналогично методу, описанному выше в примере 5Б, получали 2-амино-4-(3-хлорфенил)-6-метилпиримидина, tпл l31,6-132,3oC.
Е. Способ получения соединения формулы I, в котором R1 обозначает метил, R2
обозначает водород, R3 обозначает 2,3-дигидро-1,4-бензодиоксин-5-ил, а R4 и R5 обозначают водород
1-(2,3-дигидро-1,4-бензодиоксин-5-ил)этанон (1,2 г)
растворяли в 20 мл этилацетата и добавляли гидрид натрия (0,33 г, 60%-ная масляная дисперсия). Реакционную смесь выдерживали при 80oС в течение ночи, реакцию прекращали, добавляя воду, и
нейтрализовали диоксидом углерода, получая маслянистый продукт, 1-(2,3-дигидро-1,4-бензодиоксин-5-ил)бутан-1,3-дион (0,37 г).
1-(2,3-дигидро-1,4-бензодиоксин-5-ил)бутан-1,3-дион (0,37 г) смешивали с карбонатом гуанидина (0,22 г) и смесь выдерживали при 135oС в течение 1 ч. Полученный темный продукт растворяли в метиленхлориде, фильтровали и концентрировали. Остаток хроматографировали на силикагеле, элюируя смесью 3:2 этилацетат/гексан, с получением в результате твердого вещества (0,16 г), которое обрабатывали соляной кислотой/этанолом, получая гидрохлорид 2-амино-4-(2,3-дигидро-1,4-бензодиоксин-5-ил)-6-метилпиримидина (0,125 г), tпл 240-242oС.
Ж. Способ получения соединения формулы I, в котором R1 и
R2 обозначают водород, R3 обозначает 1-метилиндол-3-ил, а R4 и R5 обозначают водород
3-ацетил-1-метилиндол (0,870 г) растворяли в 3 мл абсолютного
этанола. К этому раствору при температуре дефлегмации добавляли трет-бутокси-бис(диметиламино) метан (реагент Бредерека) (0,960 г) в 3 мл этанола. Раствор выдерживали при температуре дефлегмации в
течение 2 дней и растворитель удаляли под вакуумом при комнатной температуре. Остаток растирали со смесью 7:3 гексан/этилацетат, получая твердое вещество (0,094 г).
Твердое вещество смешивали с карбонатом гуанидина (0,037 г) и смесь выдерживали при 120oС в течение 14 ч. Реакционную смесь растворяли в горячем абсолютном этиловом спирте, фильтровали и перекристаллизовывали, получая кристаллическое твердое вещество белого цвета, 2-амино-4-(1-метилиндол-3-ил)пиримидин (0,039 г). После обработки кристалллического твердого вещества соляной кислотой/этиловым спиртом и перекристаллизации соли из этанола получали гидрохлорид 2-амино-4-(1-метилиндол-3-ил)пиримидина (0,0098 г), tпл 274-276oС.
З. Способ
получения соединения формулы I, в котором R1 обозначает изопропил, R2 обозначает водород, R3 обозначает 4,7-дифторнафт-1-ил, a R4 и R5 обозначают
водород
1-(4,7-дифторнафт-1-ил)этанон (0,150 г, 0,72 ммоль) растворяли в безводном диоксане (1 мл) и охлаждали до 0oС. Добавляли гидрид натрия (0,145 г, 3,6 ммоль, 60 мас.%
дисперсия) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли в виде одной порции этилизобутират (1,0 мл, 7,2 ммоль) и раствор нагревали до температуры дефлегмации в
течение 15 мин. После охлаждения до комнатной температуры реакционную смесь сливали на 10%-ную водную соляную кислоту и экстрагировали метиленхлоридом. Органический слой сушили над сульфатом натрия и
очищали с помощью хроматографии на колонках, получая 1-(4,7-дифторнафт-1-ил)-4-метилпентан-1,3-дион (0,120 г, 72%).
И. 1-(4,7-дифторнафт-1-ил)-4-метилпентан-1,3-дион (0,114 г, 0,5 ммоль) объединяли с карбонатом гуанидина (0,180 г, 0,5 ммоль) и выдерживали при 150oС в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и непосредственно очищали с помощью хроматографии на колонках, получая 2-амино-4-(4,7-дифторнафт-1-ил)-6-изопропилпиримидин (0,052 г, 34%), tпл 103-105oC.
К. Аналогичным образом, но заменяя на
стадии 5З 1-(4,7-дифторнафт-1-ил)этанон на 1-(4,6-дифторнафт-1-ил)этанон, на 1-(4,8-дифторнафт-1-ил)этанон, на 1-(4-метоксинафт-1-ил)этанон или на 1-(1-метил-1Н-индол-4-ил)этанон, а также
необязательно заменяя на стадии 5И этилизобутират на 4,4-диметил-3-оксопентаноат, или на 4,4-диметил-3-оксопентаноат, или на этил-2-фторизобутират и гуанидин на замещенные гуанидиновые соли и работая
аналогично методам, описанным выше в примере 5З и 5И, получали следующие соединения:
гидрохлорид 2-амино-4-(4,6-дифторнафт-1-ил)-6-изопропилпиримидина, tпл 136-138oC,
гидрохлорид 2-амино-4-(4,8-дифторнафт-1-ил)-6-изопропилпиримидина, tпл 216-219oC.
гидрохлорид 2-амино-4-(4-метоксинафт-1-ил)-6-изопропилпиримидина, tпл 195-197oC,
гидрохлорид 2-амино-6-трет-бутил-4-(4-метоксинафт-1-ил)пиримидина, tпл 219-220,5oC.
гидрохлорид
2-амино-4-(1Н-индол-4-ил)-6-изопропилпиримидина, tпл 211-212oС,
2-амино-4-(1-метил-1Н-индол-4-ил)-6-изопропилпиримидин, tпл 128-130oС,
2-амино-4-(4-фторнафт-1-ил)-6-(1-фтор-1-метилэтил)пиримидин, tпл 135,5-137,0oС,
гидрохлорид 2-амино-4-(4-фторнафт-1-ил)-6-(1-фтор-1-метилэтил) пиримидина, tпл
186,6-187,8oС,
4-(4-фторнафт-1-ил)-6-(1-фтор-1-метилэтил)-2-метиламинопиримидин, tпл 149-151oС,
гидрохлорид
2-амино-4-(4-метоксинафт-1-ил)-6-метилпиримидина, tпл 247,0-249,5oС,
гидрохлорид 2-амино-6-этил-4-(4-метоксинафт-1-ил)пиримидина, tпл 218,5-218,9oС
и
гидрохлорид 2-амино-4-(4,6-дифторнафт-1-ил)-6-(1-фтор-1-метилэтил) пиримидина, tпл 129,6-131,3oС.
Пример 6
Альтернативный способ получения
соединения формулы I
А. Способ получения соединения формулы I, в котором R1 обозначает хлор, R2 обозначает водород, R3 обозначает нафт-1-ил и R4 и
R5 обозначают водород
2-Амино-6-гидрокси-4-(нафт-1-ил)пиримидин (900 мг) добавляли к раствору хлорсульфоновой кислоты (0,05 мл) в 2,5 мл оксихлорида фосфора и смесь перемешивали
при 95oС в течение 6 ч. Смесь сливали на лед, нейтрализовали карбонатом калия и экстрагировали этилацетатом. Неочищенный продукт (70 мг) очищали с помощью хроматографии на силикагеле,
элюировали метиленхлоридом и обрабатывали соляной кислотой - этанолом, получая гидрохлорид 2-амино-6-хлор-4-(нафт-1-ил)пиримидина (25 мг), tпл 248-250oС.
Б.
Способ получения соединения формулы I, в котором R1 и R2 обозначают водород, R3 обозначает нафт-1-ил и R4 и R5 обозначают водород
2-Амино-6-хлор-4-(нафт-1-ил)пиримидин (170 мг) растворяли в 10 мл метилового спирта при 0oС. К раствору добавляли 10%-ный палладий на древесном угле (70 мг) и приблизительно 1 мл 20%-ного
раствора гидроксида натрия и смесь гидрировали (1 атмосфера) в течение 1 ч, получая 2-амино-4-(нафт-1-ил) пиримидин (80 мг) в виде твердого вещества. После обработки этого твердого вещества соляной
кислотой - этиловым спиртом получали гидрохлорид 2-амино-4- (нафт-1-ил) пиримидина (25 мг), tпл 181-184oC.
Пример 7
Альтернативный способ получения
соединения формулы I
А. Способ получения соединения формулы I, в котором R1 обозначает метокси, R2 обозначает водород, R3 обозначает нафт-1-ил и R4
и R5 обозначают водород
1-Ацетонафталин (33 г) в сероуглероде (15 г) добавляли в течение 15 мин при 12oС к раствору, содержащему 195 мл 1М трет-бутоксида калия в 400 мл
простого эфира. Реакционной смеси давали нагреться до комнатной температуры, повторно охлаждали до 10-12oС и затем по каплям в течение 45 мин добавляли метилйодид (55,0 г). Реакционную
смесь доводили до комнатной температуры в течение 16 ч, фильтровали и концентрировали. Остаток перекристаллизовывали из 125 мл метилового спирта, получая 3,
3-(бисметилсульфанил)(1-нафт-1-ил)проп-2-ен-1-он (20,1 г), tпл 73-79oC.
Б. 3,3-(бисметилсульфанил)(1-нафт-1-ил)проп-2-ен-1-он (1,28 г) добавляли к 10 мл
метанольного раствора гидрида натрия (640 мг, 60%-ная масляная дисперсия) и карбоната гуанидина (630 г). Реакционную смесь выдерживали при температуре дефлегмации в течение 6 ч, сливали на этилацетат
и промывали насыщенным раствором бикарбоната натрия, водой и соляным раствором. Органический слой сушили карбонатом калия и концентрировали приблизительно до объема 5 мл, получая
2-амино-6-метокси-4-(нафт-1-ил)пиримидин
в виде твердого кристаллического вещества, tпл 159,6-159,8oС. После обработки этого твердого кристаллического вещества соляной
кислотой - этиловым спиртом получали гидрохлорид 2-амино-4-метокси-6-(нафт-1-ил)пиримидина (300 мг), tпл 184-185oС.
В. Аналогичным образом, но заменяя
метанольный раствор на соответствующий спирт (этиленгликоль, изопропиловый спирт, этиловый спирт) и работая аналогично методу, описанному выше в примере 7Б, получали следующие соединения формулы
(I):
гидрохлорид 2-амино-6-(2-гидроксиэтокси)-4-(нафт-1-ил)пиримидина, tпл 199-201oC,
гидрохлорид 2-амино-6-изопропилокси-4-(нафт-1-ил)пиримидина, tпл
165-167oС и
гидрохлорид 2-амино-6-этокси-4-(нафт-1-ил)пиримидина, tпл 194-195oС.
Г. Способ получения соединения формулы I, в котором R1 обозначает метилтио, R2 обозначает водород, R3 обозначает нафт-1-ил и R4 и R5 обозначают водород
3,
3-(бисметилсульфанил)(1-нафт-1-ил)проп-2-ен-1-он (1,13 г) добавляли к смеси, содержащей гидрид натрия (0,38 г, 60%-ная масляная дисперсия) и карбонат гуанидина (0,40 г) в 10 мл N,N-диметилформамида
(ДМФ) при комнатной температуре. Через 1 ч смесь выдерживали при 150oС в течение 5 ч. После процесса экстракции получали
неочищенный продукт, который хроматографировали на силикагеле,
элюируя смесью 6: 1 гексан/этилацетат, с получением в результате 2-амино-4-метилтио-6-(1-нафтил)пиримидина (140 мг). После обработки свободного основания соляной кислотой/этиловым спиртом получали
гидрохлорид 2-амино-6-метилтио-4-(нафт-1-ил)пиримидина (80 мг), tпл 255-259oС (разл.).
Пример 8
Альтернативный способ получения соединения формулы I
А. Способ получения соединения формулы I, в котором R1 обозначает изопропил, R2 обозначает водород, R3 обозначает нафт-1-ил, R4 обозначает этил, a
R5 обозначает водород
4-(4-фторнафт-1-ил)-6-изопропил-2-метилсульфонилпиримидин (0,100 г, 0,29 ммоль) добавляли к раствору этиламина (0,33 мл, 5,8 ммоль) в этаноле (1 мл).
Реакционный сосуд помещали на 6 ч в камеру для облучения ультразвуком при 45oС. Этанол удаляли в вакууме, получая в результате вязкое масло. Это масло кристаллизовали из этанола и воды,
получая 2-этиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин (49%), tпл 77-78oC.
Б. Аналогичным образом, но заменяя этиламин на другие амины формулы NHR4R5 и необязательно заменяя 4-(4-фторнафт-1-ил)-6-изопропил-2-метилсульфонилпиримидин на другие соединения формулы (18) и работая аналогично методу, описанному выше в примере 8А,
получали следующие соединения формулы I:
гидрохлорид 4-(4-фторнафт-1-ил)-2-гидразино-6-изопропилпиримидина, tпл 141-145oC,
фумарат
4-(4-фторнафт-1-ил)-6-изопропил-2-(пиперазин-1-ил)пиримидина, tпл 196,1-196,6oС,
2-(2-метоксиэтиламино)-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл 87,1-87,
7oC,
4-(4-фторнафт-1-ил)-6-изопропил-2-н-пропиламинопиримидин, tпл 99,6-99,9oС,
2-аллиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл
92,8-93,4oС,
4-(4-фторнафт-1-ил)-6-изопропил-2-(пиперидин-1-ил)пиримидин, tпл 70-72oС,
2-бензиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл 73-74oС,
2-циклопропиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл 100,1-100,8oС,
гидрохлорид
2-(2-гидроксиэтиламино)-4-(4-фторнафт-1-ил)-6-изопропилпиримидина, tпл 70-71oС,
4-(4-фторнафт-1-ил)-6-изопропил-2-морфолинопиримидин, tпл 81-83oС,
2-бутиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл 87-88oC,
гидрохлорид 2-бутиламино-4-(4-фторнафт-1-ил)-6-метилпиримидина, tпл 137-139oС,
2-диметиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл 41-42oС,
4-(4-фторнафт-1-ил)-6-изопропил-2-метиламинопиримидин, tпл
115-116oС,
4-(4-фторнафт-1-ил)-6-(2-гидрокси-2-фенэтил)-2-метиламинопиримидин, tпл 138,1-139,2oC,
гидрохлорид
4-(4-фторнафт-1-ил)-6-фенэтил-2-метиламинопиримидина, tпл 130,7-131,2oC,
гидрохлорид 4-(4-фторнафт-1-ил)-2-изопропиламино-6-метоксипиримидина, tпл 191,3-191,
6oС,
гидрохлорид 2-(диметиламино)этиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидина, tпл 176,5oС,
гидрохлорид
4-(4-фторнафт-1-ил)-6-изопропил-2-(метиламино)этиламинопиримидина, tпл 152-153oС,
гидрохлорид 4-(4-фторнафт-1-ил)-6-(2-гидроксипропил)-2-(метиламино)этиламинопиримидина,
tпл 125-130oС,
гидрохлорид 2-(2-гидроксиэтил)амино-4-(4-фторнафт-1-ил)-6-метоксипиримидина, tпл 191,3-191,6oС,
6-трет-бутил-4-(4-фторнафт-1-ил)-2-метиламинопиримидин, tпл 129,4-130,0oС,
2-бензиламино-6-трет-бутил-4-(4-фторнафт-1-ил)пиримидин, tпл 106,2-106,9o
С,
гидробромид 6-трет-бутил-4-(4-фторнафт-1-ил)-2-изопропиламинопиримидина, tпл 196,5-197,2oС,
гидрохлорид
6-трет-бутил-4-(4-фторнафт-1-ил)-2-(2-метоксиэтил)аминопиримидина, tпл 114,5-117,8oС,
4-(4-фторнафт-1-ил)-6-изопропил-2-(пиридин-4-ил)метиламинопиримидин, tпл
149,1-149,5oC,
фумарат 2-(2-амино)этиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидина, tпл 172,4-172,6oC,
гидрохлорид
4-(4-фторнафт-1-ил)-6-изопропил-2-(4-метоксифенил)метиламинопиримидина, tпл 65-67oС,
4-(4-фторнафт-1-ил)-2-(тетрагидро-2-фурил)метиламино-6-изопропилпиримидин, tпл 72,7-73,8oС,
малеат 4-(4-фторнафт-1-ил)-2-(2-гидрокси)этиламино-6-изопропилпиримидина, tпл 101,9-104,1oС,
гидробромид
4-(4-фторнафт-1-ил)-2-(2-гидроксиэтокси)этиламино-6-изопропилпиримидина, tпл 115,3-116,7oC,
малеат 2-(1,
3-дигидроксипроп-2-ил)амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидина, tпл 125,3-126,6oС,
малеат 2-амино-4-(4-фторнафт-1-ил)-6-(2-метокси)этилпиримидина, tпл
94-100oС и
малеат 2-амино-4-(4-фторнафт-1-ил)-6-фенэтилпиримидина, tпл 145-146oС.
В. Аналогичным образом, но необязательно заменяя этиламин на другие амины формулы NHR4R5 и необязательно заменяя 4-(4-фторнафт-1-ил)-6-изопропил-2-метилсульфонилпиримидин на другие соединения формулы (18), а также работая аналогично методу, описанному выше в примере 8Б, получали другие соединения формулы I.
Пример 9
Способ получения N-оксида соединения формулы I
А. Способ получения N-оксида
соединения формулы I, в котором R1 обозначает метил, R2 обозначает водород, R3 обозначает нафт-1-ил, а R4 и R5 обозначают водород
2-амино-6-метил-4-(нафт-1-ил)пиримидин (0,28 г) растворяли в 15 мл хлороформа при 0oС. К раствору порциями в течение 5 мин добавляли мета-хлорпербензойную кислоту (0,54 г). По завершении
добавления раствор нагревали до 40oС в течение 30 мин. Раствор промывали 10%-ным водным тиосульфатом натрия, 1М гидроксидом натрия и водой. Хлороформный слой сушили (сульфат натрия) и
концентрировали; твердый остаток перекристаллизовывали из этилового спирта/диэтилового эфира, получая 2-амино-6-метил-4-(нафт-1-ил)пиримидин-1-N-оксид (0,07 г), tпл 228,7-229,5o
C.
Б. Аналогичным образом, но заменяя 2-амино-6-метил-6-(нафт-1-ил)пиримидин на другие соединения формулы I и работая аналогично методу, описанному выше в примере 9А, получали
следующие N-оксиды соединений формулы I:
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-3-N-оксид, tпл 188-189oС,
2-амино-6-трет-бутил-4-(4-фторнафт-1-ил)пиримидин-3-N-оксид, tпл 188,6-190,9oС,
гидрохлорид 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-1-N-оксида, tпл
207-208oС,
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-1-N-оксид, tпл 153-155oС,
2-ацетиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-1-N-оксид,1H-ЯМР (200 МГц), J 1,39 (d, 6H), 2,51 (s, 3Н), 3,81 (m, 1H), 7,21-7,27 (m, 2Н), 7,62-7,68 (m, 3Н), 8,10-8,23 (m, 1H), 8,
38-8,41 (m, 1H), и
4-(4-фторнафт-1-ил)-6-изопропилпиримидин-2-метиламино-1-N-оксид, tпл 181-182,5oC.
В. Аналогичным образом, но заменяя 2-амино-6-метил-4-(нафт-1-ил) пиримидин на другие соединения формулы I и работая аналогично методу, описанному выше в примере 9А, получали другие N-оксиды соединений формулы I.
Пример
10
Способ получения соединения формулы I, в котором R1 обозначает гидроксиалкил или алкенил
А. Способ получения соединения формулы I, в котором R1 обозначает
1-гидоокси-1-метилэтил иди изопропенил, R2 обозначает водород, R3 обозначает нафт-1-ил, а R4 и R5 обозначают водород
Ангидрид трифторуксусной
кислоты (0,211 мл, 1,50 ммоль) добавляли к раствору 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-3-N-оксида (0,148 г, 0,498 ммоль) в метиленхлориде (5 мл) при комнатной температуре. Смесь
перемешивали в течение 48 ч при комнатной температуре и затем сливали на 1н. водный гидроксид натрия. Органический слой удаляли, концентрировали в вакууме, очищали с помощью препаративной тонкослойной
хроматографии, получая смесь 2-амино-4-(4-фторнафт-1-ил)-6-(1-гидрокси-1-метилэтил)пиримидина (0,043 г, 29%), tпл 181-184oС, и 2-амино-4-(4-фторнафт-1-ил)-6-изопропенилпиримидина
(0,051 г, 36%), tпл 138-140oС.
Б. Аналогичным образом, но заменяя 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин-3-N-оксид на другие N-оксиды соединений формулы I и работая аналогично методу, описанному выше в примере 10А, получали другие соединения формулы I, в которых R1 обозначает гидроксиалкил или алкенил.
Пример 11
Способ получения соединения формулы I из других соединений формулы I
А. Способ получения соединения формулы I, в котором R1 обозначает ацетил, а R5 обозначает
водород
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин (0,5 г) растворяли в уксусном ангидриде (10 мл) и добавляли 4-диметиламинопиридин (0,125 г). Реакционную смесь перемешивали в течение
ночи при комнатной температуре, затем выдерживали при температуре от 75o до 80oС в целом в течение 4 ч и упаривали досуха под вакуумом. Остаток распределяли между водой и
этилацетатом и затем сушили над сульфатом магния. Путем упаривания выделяли диацетильное соединение в виде масла и затем растворяли в метаноле (20 мл). Раствор обрабатывали насыщенным раствором
бикарбоната натрия (2 мл) и оставляли перемешиваться в течение ночи. Образовавшееся моноацетильное производное выделяли путем упаривания досуха и сушки под вакуумом. Остаток растворяли в кипящем
гексане и сливали с небольшого количества нерастворимого остатка и кристаллизовали, получая 2-ацетиламино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин, tпл 115,4-116,7oС.
Б. Способ получения соединения формулы I, в котором R4 обозначает фениламинокарбонил, a R5 обозначает водород
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин
(288,3 г) растворяли в бензоле (50 мл) и добавляли фенилизоцианат (119,1 мг). Реакционную смесь выдерживали при температуре дефлегмации в течение 48 ч и растворитель удаляли в вакууме. Остаток
хроматографировали на силикагеле, элюируя смесью 80:20 гексан: этилацетат, с получением в результате 4-(4-фторнафт-1-ил)-6-изопропил-2-фенилуреидопиримидина (49,1 мг, tпл 117-178o
С).
Пример 12
В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции для орального введения, содержащей в качестве действующего вещества
соединение формулы I, например, 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин.
Ингредиенты - Количество на таблетку, мг
Действующее вещество - 200
Лактоза,
высушенная распылением - 148
Стеарат магния - 2
Вышеуказанные ингредиенты смешивают и вводят в желатиновую капсулу с твердым покрытием.
В качестве действующего вещества при приготовлении композиций для орального введения в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные согласно примерам 1-10.
Пример 13
В этом примере проиллюстрировано приготовление другой репрезентативной фармацевтической композиции для орального введения, содержащей в качестве действующего вещества
соединение формулы I, например 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин.
Ингредиенты - Количество на таблетку, мг
Действующее вещество - 400
Кукурузный
крахмал - 50
Лактоза - 145
Стеарат магния - 5
Вышеуказанные ингредиенты тщательно смешивают и прессуют в виде отдельных таблеток с насечкой.
В качестве действующего вещества при приготовлении композиций для орального введения в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные согласно примерам 1-10.
Пример 14
В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции, содержащей в качестве действующего вещества соединение формулы I,
например 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин.
Суспензию для орального применения приготавливают на основе следующей композиции:
Ингредиенты -
Действующее вещество - 1,0 г
Фумаровая кислота - 0,5 г
Хлорид натрия - 2,0 г
Метилпарабен - 0,1 г
Гранулированный сахар - 25,5 г
Сорбит (70%-ный раствор)
- 12,85
Veegum К (фирма Vanderbilt Co.) - 1,0 г
Корригент - 0,035 мл
Красители - 0,5 мг
Дистиллированная вода - q.s. до 100 мл
В качестве действующего
вещества при приготовлении композиций для орального введения в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные согласно примерам 1-10.
Пример 15
В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции для инъекции, содержащей в качестве действующего вещества соединение формулы I,
например 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин.
Препарат для инъекции, забуференный до значения рН 4, приготавливают на основе следующей композиции:
Ингредиенты
-
Действующее вещество - 0,2 г
Буферный раствор ацетата натрия (0,4 М) - 2,0 мл
НС1 (1н.) - q.s. до рН 4
Вода (дистиллированная, стерильная) - q.s. до 20 мл
В качестве действующего вещества при приготовлении композиций для инъекций в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные согласно примерам
1-10.
Пример 16
В этом примере проиллюстрировано приготовления репрезентативной фармацевтической композиции для местного применения, содержащей в качестве действующего
вещества соединение формулы I, например, 2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин.
Ингредиенты - Масса в граммах
действующее вещество - 0,2-10
Спан 60 - 2
Твин 60 - 2
Минеральное масло - 5
Вазелиновое масло - 10
Метилпарабен - 0,15
Пропилпарабен - 0,05
БГА (бутилированный гидроксианизол) - 0,01
Вода - q.s. до 100
Все вышеуказанные ингредиенты, за исключением воды, объединяют и нагревают до 60oС при перемешивании. Затем при интенсивном перемешивании при 60oС
добавляют достаточное количество воды для эмульгирования ингредиентов и затем добавляют воду в q.s. до 100 г.
В качестве действующего вещества при приготовлении композиций для местного применения в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные согласно примерам 1-10.
Пример 17
В этом
примере проиллюстрировано приготовление репрезентативной фармацевтической композиции, содержащей в качестве действующего вещества соединение формулы I, например
2-амино-4-(4-фторнафт-1-ил)-6-изопропилпиримидин.
Суппозитории общей массой по 2,5 г приготавливают на основе следующей композиции:
Ингредиенты
Действующее вещество
- 500 мг
Witepsol Н-15* - Баланс
( * триглицериды насыщенной жирной кислоты растительного происхождения; продукт фирмы Riches-Nelson, Inc., New York, N.Y.)
В качестве
действующего вещества при приготовлении композиций в виде суппозитория в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные согласно примерам
1-10.
Пример 18
Анализ связывания клонированного 5-HT2В-рецептора крысы
Ниже описан анализ связывания in vitro с использованием клонированных 5-НТ2В-рецепторов, радиоактивно меченных с помощью [3Н]-5НТ.
Мышиные фибробласты линии NIH3T3, экспрессирующие клонированный 5-НТ2В-рецептор, культивировали в модифицированной по способу Дульбекко среде Игла с добавлением 10%-ной фетальной телячьей сыворотки и 250 мкг/мл G418 в атмосфере 95%/5% О2/СО2. Клетки собирали, используя 2 мМ ЭДТК в забуференном фосфатом физиологическом растворе (не содержащем кальция/магния), и центрифугировали (500xg). Клеточный дебрис гомогенизировали с использованием дезинтегратора типа Polytron P10 (установка в положение 5,5 с) в буфере для гомогенизации (50 мМ трис; 5 мМ Na2 ЭДТК) и гомогенат центрифугировали при 19500 об/мин, используя центрифугу типа Sorvall/Dupont RC5C с ротором типа SS34 (30000-48000xg, 15 мин). Дебрис гомогенизировали (установка в положение 5, 5 с) в буфере для гомогенизации и гомогенат центрифугировали (30000-48000xg, 15 мин). Дебрис гомогенизировали (установка в положение 5, 5 с) в ресуспендирующем буфере (50 мМ трис; 0,5мМ ЭДТК) и гомогенат центрифугировали (30000-48000xg, 15 мин). Дебрис гомогенизировали (установка в положение 5, 5 с) в небольшом объеме ресуспендирующего буфера, получая приблизительно 1,5•108 клеток/мл. Мембраны разделяли на аликвоты объемом 1 мл и хранили при -70oС.
Мембраны подвергали оттаиванию при комнатной температуре и разбавляли буфером для анализа (4,5 мМ хлорид кальция •2Н2О; 50 мМ трис, 0,1%-ная аскорбиновая кислота). Специфическое связывание составляет по крайней мере 90% от общего связывания при использовании 1,5•10 клеток/мл на каждую пробирку для анализа. Мембраны гомогенизировали (установка в положение 5, 5 с) и затем гомогенат добавляли в пробирки для анализа, содержащие [3Н]-НТ (2•10-10 М), тестируемое соединение (1•10-10-l•10-4 М) и буфер для анализа (q.s. до 500 мкл). Анализируемую смесь инкубировали при 40oС в течение 2 ч и затем фильтровали через фильтры из стекловолокна, предварительно обработанные 0,1%-ным полиэтиленимином, используя харвестер клеток типа Brandel. Пробирки для анализа промывали холодным буфером для анализа и сушили, продувая воздух через фильтр в течение 10 с. Радиоактивность, сохранившуюся на фильтрах, определяли с помощью жидкостного сцинтилляционного счетчика. Для каждого тестируемого соединения определяли концентрацию, вызывающую 50%-ное ингибирование связывания (IC50), с использованием итеративного метода аппроксимации кривой.
С помощью методики, описанной в примере 18, установлено, что соединения по изобретению обладают сродством к 5-НТ2В -рецептору.
Пример 19
Методы оценки связывания 5-НТ2А-, 5-НТ2В-, 5-НТ2С-рецептора
Ниже описаны методы оценки связывания с
рецепторами, в которых с целью демонстрации селективности лиганды, обладающие высоким сродством к 5-НТ2В-рецепторам, подвергали обратному скринингу в отношении 5-НТ2А- и 5-НТ2С-рецепторов.
5-НТ2А-рецепторы из коры головного мозга человека метили с помощью [3Н] -кетансерина в клетках линии Cos-7, экспрессирующих клонированный 5-НТ2А-рецептор человека, и в клетках линии NIH-3T3, экспрессирующих НТ2А-рецептор крысы. Для опытов по исследованию конкурентного связывания использовали концентрацию лиганда приблизительно 0,1 нМ. Для опытов по изучению насыщения связывания использовали концентрации радиолигандов в диапазоне от 0,01 до 2,0 нМ. Опыты проводили в 0,5 мл буфера для анализа, содержащего 50 мМ трис-HCl, 4 мМ хлорид кальция и 0,1%-ную аскорбиновую кислоту (рН 7,4 при 4oС). Неспецифическое связывание определяли, используя 10 мМ немеченый кетансерин. После инкубации в течение 60 мин при 32oС мембраны собирали на фильтры, обработанные 0,1%-ным полиэтиленимином, и определяли связанную радиоактивность.
Человеческие 5-НТ2В-рецепторы метили в клетках линии Cos-7, как описано выше, за исключением того, что в качестве радиолиганда использовали [3Н]-5НТ, и за исключением того, что буфер для анализа содержал 10 мМ паргилин и 0, 1%-ную аскорбиновую кислоту. Для опытов по изучению конкурентного связывания использовали концентрацию радиолиганда приблизительно 0,4 нМ, а для опытов по изучению насыщения связывания использовали концентрации [3Н]-5НТ в диапазоне от 0,05 до 8 нМ. Неспецифическое связывание определяли с использованием 10 мМ 5-НТ. Инкубации проводили в течение 120 мин при 4oС.
5-НТ2С-рецепторы из сосудистого сплетения метили в клетках линии Cos-7, экспрессирующих 5-НТ2С-рецептор человека, и в клетках линии NIH-3T3, экспрессирующих 5-НТ2С-рецептор крысы. Опыты проводили аналогично тому, как это описано для 5-НТ2А-рецептора, за исключением того, что в качестве радиолиганда использовали [3Н] -мезулергин. Для опытов по изучению конкурентного связывания использовали концентрацию радиолиганда приблизительно 0,2 нМ, а для опытов по изучению насыщения связывания использовали конценентрации в диапазоне от 0, 1 до 18 нМ. Неспецифическое связывание определяли с использованием 10 мкМ немеченого мезулергина.
Результаты конкурентного связывания с радиолигандами анализировали с использованием 4-параметрического логарифмического уравнения и итеративного метода аппроксимации кривой с целью получения значений 1С50 и определения значения угла наклона на кривой, построенной с помощью математической модели метода связывания (угол наклона Хилла). Значения Кd, определенные из исследований по насыщению связывания, далее применяли для расчета констант ингибирования диссоциации (Кi).
Работая аналогично примеру 18, установлено, что соединения по изобретению обладают сродством к 5-НТ2B-рецептору.
Пример 20
Функциональный анализ 5-HT2B-рецептора в ткани
Ниже описан функциональный анализ in vitro, характеризующий 5-НТ-рецепторы (предполагаемый 5-НТ2B-рецептор) в продольном
слое мышечной оболочки дна желудка крысы. Дно желудков крысы получали, как описано у Baxter и др. (1994) в Brit. J. Pharmacol., 112, 323-331. Полоски продольного слоя мышечной оболочки получали из дна
желудка самцов крыс линии Sprague Dawley. Удаляли слизистую оболочку и полоски подвешивали с использованием постоянного натяжения 1 г в окисленном растворе Тирода. Температуру поддерживали на уровне
37oС и эксперименты проводили в присутствии паргилина (100 мкМ).
Опыты по изучению антагонистического действия в отношении 5-НТ с получением кривых зависимости ответа от концентрации проводили в присутствии предполагаемого антагониста или без него. Для определения сродства антагониста строили кривые с помощью математической модели метода связывания (hill plots). С целью определения агонистического действия эффективность отдельного тестируемого соединения количественно оценивали с использованием полоски ткани.
При тестировании этим методом обнаружено, что соединения по настоящему изобретению являются антагонистами 5-НТ2B-рецептора.
Пример 21
Анализ анксиолитического поведения
Ниже описан
метод определения in vivo анксиолитической активности путем измерения степени влияния лекарства на естественный страх мышей, помещенных в новое, ярко освещенное окружение.
Не подвергавшихся ранее обработке самцов мышей линии C5BI/6J, весом 18-20 г, содержали группами по 10 мышей в клетках с контролируемыми звуком, температурой и влажностью. Пищу и воду давали ad libitum. Мышей содержали при световом цикле: 12 часов света и 12 часов темноты, причем свет включали в 6.00 часов утра, а выключали в 6.00 часов вечера. Все эксперименты начинали не ранее, чем через 7 дней после доставки животных на место.
Автоматическую аппаратуру для определения изменений исследовательской активности получали от фирмы Omni-Tech Electronics Columbus Ohio, и она аналогична таковой, которая использовалась Crawley и Goodwin (1980), как описано в указанной выше работе Kilfoil и др. В целом камера представляла собой плексигласовый ящик (размером 44• 21•21 см), разделенный на два отсека темной плексигласовой перегородкой. В перегородке, разделяющей два отсека, имелось отверстие размером 13•5 см, через которое мышь могла легко пройти. Темный отсек имел прозрачные стенки и белый пол. Единственное освещение давала флуоресцентная лампа (40 Вт), помещенная над отсеками. Исследовательскую активность мышей внутри отсеков для опытов регистрировали с помощью прибора Digiscan Animal Activity Monitor System RXYZCM16 (фирма Omni-Tech Electronics).
Перед началом опыта мышам давали акклиматизироваться к лабораторным условиям в течение 60 мин. После введения мыши путем внутрибрюшинной инъекции (i. p. ) либо тестируемого соединения, либо наполнителя, мышь возвращали в клетку, в которой она ранее находилась, на 15 минут после обработки. Затем мышь помещали в центр освещенного отсека и регистрировали ее поведение в течение 10 мин.
Анксиолитическое действие проявлялось в виде общего увеличения исследовательской активности в освещенной области. Увеличение исследовательской активности проявлялось в виде увеличения латентного состояния (промежутка времени, требуемого для того, чтобы мышь начала двигаться в темный отсек после того, как ее сначала помещали в центр освещенной области), в виде увеличения челночной активности, увеличения или отсутствия изменения локомоторной активности (количества пересеченных линий разметки) и в виде уменьшения времени, проведенного в темном отделении.
При исследовании этим методом обнаружено, что соединения по настоящему изобретению улучшают анксиолитическое поведение.
Пример 22
Анализ страха при синдроме отмены
Ниже описан способ определения in vivo улучшения симптомов, вызванных
отменой наркотических веществ, путем измерения степени воздействия лекарства на страх, который возникает у мышей после постоянного введения наркотического вещества и затем резкого прекращения этих
обработок.
Не подвергавшихся ранее обработке самцов мышей линии BKW (25-30 г) содержали группами по 10 особей в клетках с контролируемыми звуком, температурой и влажностью. Пища и вода были доступны ad libitum. Мышей содержали при световом цикле: 12 часов света и 12 часов темноты, причем свет включали в 6.00 часов утра, а выключали в 6.00 часов вечера. Все эксперименты начинали не ранее чем через 7 дней после доставки животных на место.
Степень страха определяли с помощью двухкамерной исследовательской модели Crawley и Goodwin (см. пример 21). Анксиолитическое действие проявлялось в виде общего увеличения исследовательской активности в освещенной области. Увеличение исследовательской активности проявлялось в виде увеличения латентного состояния (промежутка времени, требуемого для того, чтобы мышь начала двигаться в темную камеру после того, как ее сначала помещали в центр освещенной области) в виде увеличения или отсутствия изменения локомоторной активности (количества пересеченных линий разметки), в виде увеличения случаев подъема на задние лапы и в виде уменьшения времени, проведенного в темном отделении.
Увеличение исследовательской активности в освещенной области индуцировали путем введения мышам в течение 14 дней этанола (8,0% мас./об. в воде для питья), никотина (0,1 мг/кг, i.p. дважды в день) или кокаина (1,0 мг/кг, i. p. дважды в день). Анксиолитическое действие оценивали через 1, 3, 7 и 14 дней после начала применения наркотика. Применение резко прекращали и через 8, 24 и 48 часов после этого определяли исследовательскую активность в освещенной области. Наполнитель или тестируемые соединения вводили во время фазы отмены путем внутрибрюшинной инъекции. Ответные реакции оценивали по ингибированию снижения анксиолитического поведения после прекращения введения этанола, кокаина или никотина.
При исследовании этим методом обнаружено, что соединения по настоящему изобретению улучшают симптомы, вызванные отменой наркотических веществ.
Для большого числа заявленных соединений заявитель имеет данные по их биологической активности, показывающие значения рКi для характеристики сродства различных соединений по отношению к рецепторам 5НТ2A, 5НТ2B и 5НТ2C, а также значения отношений KiB/KiA и KiB/KiC, которые являются мерой селективного сродства соединений по отношению к 2В рецепторам.
Соединения, описанные в ЕР 210044, обладают иным характером действия и соответственно могут быть использованы как антиаллергические, противовоспалительные, антиастматические средства, а также для лечения заболеваний желудочно-кишечного тракта.
В предлагаемом изобретении речь идет о возможности использования заявленных веществ (в связи с указанным сродством к 5-НТ-рецепторам) для лечения ряда заболеваний ЦНС.
Реферат
Изобретение относится к новым арилпиримидиновым соединениям формулы I обладающим действием антагониста 5HT2B-рецептора, и фармацевтической композиции. Указанные соединения и композиция могут быть использованы как антиаллергические, антиастматические, противовоспалительные средства, а также при заболеваниях желудочно-кишечного тракта. В соединениях формулы I R1 обозначает водород, С1-С12алкил, гидрокси С1-С12алкил, С3-C8циклоалкил, С3-С8циклоалкил-С1-С6алкил, С2-С12 алкенил, С1-С6тиоалкокси, галоген, фтор-С1-С12алкил, фенил-С1-6алкил, необязательно замещенный С1-6алкилом, С1-6алкокси-, гидрокси-, нитрогруппой, С1-6фторалкилом и галогеном; -NR6R7, -CO2R8 или -O(CH2)nR9, где n = 1, 2 или 3, R6 и R7 независимо друг от друга обозначают водород или С1-С6алкил, R8 обозначает водород или C1-6алкил и R9 обозначает водород, С1-С6алкил, гидрокси, гидрокси-C1-6алкил, С2-С6алкенил или C1-6алкокси, R2 обозначает водород, C1-С6 алкил, галоген или C1-C6-фторалкил, R3 обозначает фенил, тиофен, нафталин, антрацен, фенантрен, хинолин, изохинолин, 1,2,3,4-тетрагидрохинолин, индол, 2,3-дигидроиндол, 1Н-бензо[b] азепин, 2,3,4,5-тетрагидро-1Н-бензо[b] азепин, 2Н-бензо[1,4]оксазин, 3,4-дигидро-2Н-бензо[1,4] оксазин, 1Н, 3Н-бензо[d, е] изохромен, 6,7,8,9-тетрагидро-5-окса-9-бензоциклогептан, 2, 3-дигидро-1,4-бензодиоксан, необязательно замещенный С1-С6алкилом, С1-С6алкокси-, гидрокси-, нитрогруппой, C1-C6фторалкилом и галогеном; R4 обозначает водород, C1-С6алкил, фенил C1-С6алкил, необязательно замещенный C1-С6алкилом, С1-С6алкокси-, гидрокси-, нитрогруппой, C1-С6фторалкилом и галогеном; гидроксиС1-С6алкил, C(О)C1-С6алкил или- (СН2)mNR6R7, где m равно целому числу от 1 до 6 и R6 и R7 обозначают водород или С1-С6алкил, и R5 обозначает водород или С1-С6алкил, при условии, что (I) когда R3 обозначает нафтил, индол-1-ил или 2,3-дигидроиндол-1-ил и R2, R4 и R5 все обозначают водород, R1 не обозначает метил, (II) когда R3 обозначает фенил или нафтил, R1 не обозначает -NR6R7, (III) когда R3 обозначает фенил. R2 не обозначает C1-С6алкокси и R1 и R2 не обозначают галоген, (IV) когда R3 обозначает фенил и R1 обозначает Н, R2 не обозначает метил, и (V) когда R3 обозначает 1,2,3,4-тетрагидрохинолинил, R4 и R5 обозначают водород, или его фармацевтически приемлемая соль либо N-оксид. Фармацевтическая композиция содержит терапевтически эффективное количество соединения формулы I и один или несколько фармацевтически приемлемых нетоксичных носителя. 2 с. и 14 з.п.ф-лы.

Формула

где соединение является антагонистом 5-НТ2В-рецептора,
где R1 обозначает водород, С1-С12алкил, гидроксиС1-С12алкил, С3-С8циклоалкил, С3-С8циклоалкил-С1-С6алкил, С2-С12алкенил, C1-С6тиоалкокси, галоген, фтор-С1-С12алкил, фенил-С1-6алкил, необязательно замещенный C1-6алкилом, C1-6алкокси-, гидрокси-, нитрогруппой, C1-6фторалкилом и галогеном; -NR6 R7, -CО2R8 или -O(CH2)nR9, где n = 1, 2 или 3, R6 и R7 независимо друг от друга обозначают водород или C1-С6алкил, R8 обозначает водород или С1-6алкил, R9 обозначает водород, C1-С6алкил, гидрокси, гидрокси-C1-6алкил, С2-С6алкенил или C1-6алкокси,
R2 обозначает водород, C1-С6алкил, галоген или C1-С6-фторалкил,
R3 обозначает фенил, тиофен, нафталин, антрацен, фенантрен, хинолин, изохинолин, 1,2,3,4-тетрагидрохинолин, индол, 2,3-дигидроиндол, 1Н-бензо[b] азепин, 2,3,4,5-тетрагидро-1Н-бензо[b] азепин, 2Н-бензо[1,4] оксазин, 3,4-дигидро-2Н-бензо[1,4] оксазин, 1Н, 3Н-бензо[dе] изохромен, 6,7,8,9-тетрагидро-5-окса-9-бензоциклогептан, 2,3-дигидро-1,4-бензодиоксан, необязательно замещенный C1-С6алкилом, С1-С6алкокси-, гидрокси-, нитрогруппой, C1-С6фторалкилом и галогеном;
R4 обозначает водород, C1 -С6алкил, фенилC1-С6алкил, необязательно замещенный C1-С6алкилом, C1-С6алкокси-, гидрокси-, нитрогруппой, C1 -С6фторалкилом и галогеном; гидроксиС1-С6алкил, С(O)С1-С6алкил или -(CH2)mNR6R7, где m равно целому числу от 1 до 6, R6 и R7 обозначают водород или C1-С6алкил;
R5 обозначает водород или C1-С6алкил, при условии, что (I) когда R3 обозначает нафтил, индол-1-ил или 2,3-дигидроиндол-1-ил и R2, R4 и R5 все обозначают водород, R1 не обозначает метил, (II) когда R3 обозначает фенил или нафтил, R1 не обозначает -NR6R7, (III) когда R3 обозначает фенил, R2 не обозначает C1-С6 алкокси и R1 и R2 не обозначают галоген, (IV) когда R3 обозначает фенил и R1 обозначает Н, R2 не обозначает метил, и (V) когда R3 обозначает 1,2,3,4-тетрагидрохинолинил, R4 и R5 обозначают водород,
или его фармацевтически приемлемая соль либо N-оксид.
23.05.1996 по пп. 1, 15, 16;
10.03.1997 по пп. 1, 15, 16 с уточняющими их пп. 2-14.
Документы, цитированные в отчёте о поиске
Способ получения производных 2-анилинопиримидина

Комментарии