4-метил-n-2,4-диметилфенил-6-(3-фторфенил)-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамид, проявляющий анальгетическое действие - RU2653511C2
Код документа: RU2653511C2
Описание
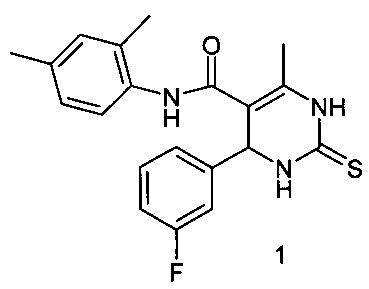
Изобретение относится к области органической химии, производным пиримидина, а именно новому биологически активному 4-метил-N-2,4-диметилфенил-6-(3-фторфенил)-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамиду (1) формулы:

обладающему анальгетическим действием, что позволяет предположить его использование в медицинской практике в качестве анальгетического средства.
Ближайшими структурными аналогами к заявляемому соединению являются соединения общей формулой 2, проявляющие антимикробное действие [Synthesis of Some New Dihydropyrimidines by Iodine as a Catalyst at Ambient Temperature and Evaluation of Their Biological Activity / P.D. Zalavadiya, R.M. Ghetiya, B.L. Dodiya [et al.] // J. Heterocyclic Chem. - 2013. - Vol. 50. - P. 973-978].

Целью предлагаемого изобретения является поиск среди производных пиримидина соединений, обладающих анальгетической активностью.
Поставленная цель достигается получением 4-метил-N-2,4-диметилфенил-6-(3-фторфенил)-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамида (1), который синтезируют трехкомпонентной реакцией 2,4-диметилацетоацетанилида, 3-фторбензальдегида, тиомочевины [Синтез N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Зорина [и др.] // Журн. органич. химии. - 2009. - Т.45, вып. 10. - С. 1591-1592]

Методика получения 4-метил-N-2,4-диметилфенил-6-(3-фторфенил)-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамида
Смесь 2.05 г (0.01 моль) 2,4-диметилацетоацетанилида, 1 мл (0.01 моль) 3-фторбензальдегида и 0.76 (0.01 моль) тиомочевины выдерживали при температуре 120-150°С до прекращения газовыделения и затвердения реакционной смеси, после охлаждения остаток обрабатывали этанолом, отфильтровывали и перекристаллизовывали из этилового спирта. Выход 1 составляет 3.28 г (89%).
Заявляемое соединение представляет собой бесцветное кристаллическое вещество, растворимое в ДМФА, уксусной кислоте, при нагревании - в этиловом спирте, устойчивое при хранении. Тпл. 236-238°С. Вычислено, % С 65.02; Н 5.46; N 11.37. C20H20FN3OS. Найдено, % С 65.14, 64.91; Н 5.54, 5.37; N 11.50, 11.26.
Спектр ЯМР1Н соединения 1 снят при рабочей частоте 300 МГц, внутренний эталон ТМС. Спектр ЯМР1Н, δ, м.д. J, Гц: 1.89 с (3Н, 4-СН3), 2.13 и 2.21 2 с (6Н, (СН3)2С6Н3), 5.41 д (1Н, 6-СН, J=2.1 Гц), 6.91-7.47 м (7Н, FC6H4, (СН3)2C6H3), 9.17 с (1Н, NH), 9.44 д (1H, 1-NH, J=2.1 Гц), 10.02 2c (1H, 3-NH, 2-SH).
В ИК-спектре соединения 1 наблюдаются полосы, обусловленные валентными колебаниями амидной группы (1678 см-1), связи NH (3158 см-1), а также полоса С=С в области 1608 см-1.
ИК-спектр соединения снят на спектрофотометре Specord М-80 в вазелиновом масле, спектр ЯМР1Н регистрировали на спектрометре Bruker 300 (рабочая частота 300 МГц) в ДМСО-d6, внутренний стандарт - ТМС. Элементный анализ проведен на приборе Perkin Elmer 2400. Температуру плавления определяли на приборе М-565.
Соединение 1 исследовали на наличие анальгетической активности. Анальгетическая активность была изучена методом «уксусных корчей». Для эксперимента использовались нелинейные мыши весом 20,0-30,0 г. Исследуемое соединение вводили в дозе 50 мг/кг внутрибрюшинно виде взвеси в 2% крахмальной слизи. Через 30 мин тем же мышам внутрибрюшинно вводили 0,75% уксусную кислоту из расчета 0,1 мл на 10 г веса животного. Показателем болевой чувствительности служило количество корчей у животного, подсчитанное в течение 15 мин с момента введения уксусной кислоты. Результаты статистически обработаны с вычислением критерия Фишера-Стьюдента. Эффект считали достоверным при Р<0,05.
В качестве эталона сравнения использовали метамизол натрия.
Острую токсичность определяли при внутрибрюшинном введении нелинейным мышам массой 20-25 г. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ДД50) [Прозоровский В.В., Прозоровская М.П., Демченко В.М. // Фармакология и токсикология. - 1978. - Т. 41. - №4. - С. 497-502]. Острая токсичность (ЛД50) заявляемого соединения составила >5100 мг/кг. Результаты исследования приведены в таблице 1.
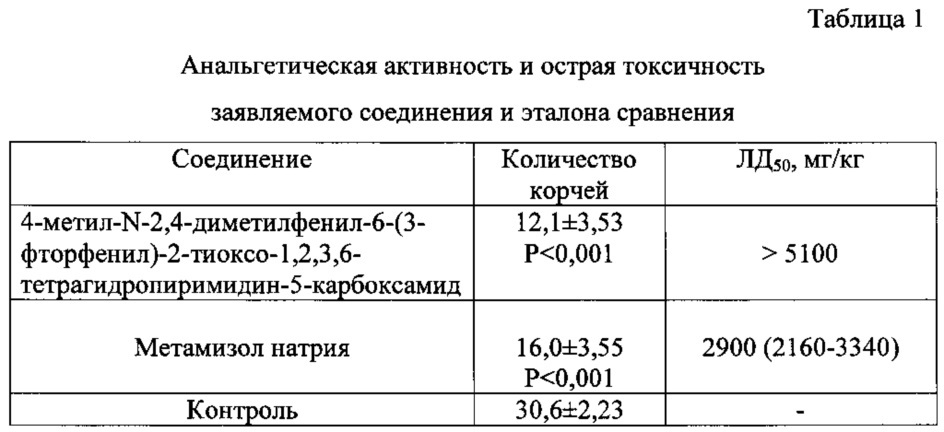
Р - в сравнении с контролем.
Таким образом, заявляемое соединение 1 - 4-метил-N-2,4-диметилфенил-6-(3-фторфенил)-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамида проявляет анальгетическое действие, превышающее активность метамизола натрия и менее токсичное в 2 раза.
Источники информации
1. Synthesis of Some New Dihydropyrimidines by Iodine as a Catalyst at Ambient Temperature and Evaluation of Their Biological Activity / P.D. Zalavadiya, R.M. Ghetiya, B.L. Dodiya [et al.] // J. Heterocyclic Chem. - 2013. - Vol. 50. - P. 973-978.
2. Синтез N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Зорина [и др.] // Журн. органич. химии. - 2009. - Т. 45, вып. 10. - С. 1591-1592.
3. Прозоровский В.В., Прозоровская М.П., Демченко В.М. // Фармакология и токсикология. - 1978. - Т. 41. - №4. - С. 497-502.
Реферат
Изобретение относится к новому производному пиримидина - 4-метил-N-2,4-диметилфенил-6-(3-фторфенил)-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамиду формулы (1)Соединение обладает анальгетическим действием, что позволяет предположить его использование в медицинской практике в качестве анальгетического средства. Соединение 1 получают реакцией трехкомпонентной конденсации 2,4-диметилацетоацетанилида, 3-фторбензальдегида и тиомочевины при выдерживании реагентов при температуре 120-150°С до прекращения газовыделения и затвердения реакционной смеси, после охлаждения остаток обрабатывают этанолом. Заявляемое соединение представляет собой бесцветное кристаллическое вещество с Т236-238°С, растворимое в диметилформамиде, уксусной кислоте, при нагревании - в этаноле, устойчивое при хранении. Соединение 1 превышает активность метамизола натрия. ЛДсоединения при внутрибрюшинном введении нелинейным мышам составляет >5100 мг/кг. 1 табл.
Формула

Комментарии