Конденсированные производные пиридазина и лекарственные препараты, содержащие данные соединения в качестве активного ингредиента - RU2292337C2
Код документа: RU2292337C2
Описание
Описание
Настоящее изобретение относится к конденсированным производным пиридазина.
Точнее, настоящее изобретение относится к
(1) производным пиридазина, представленным следующей формулой (I)

(где все символы имеют такие же значения, как описано ниже), или к их фармацевтически приемлемым солям,
(2) способу получения указанных соединений,
(3) средству, содержащему указанные соединения в качестве активного ингредиента.
Поли(ADP-рибоза)полимераза (в дальнейшем сокращенная как PARP), являющаяся ядерным ферментом, активность которого повышается при возникновении разрывов нитей ДНК, играет существенную роль в реакциях переноса фрагмента ADP-рибоза от никотинамидадениндинуклеотида (сокращенного как NAD+ в дальнейшем) к различным белкам, таким как гистоны, ДНК-полимеразы и ДНК-топоизомеразы и т.д.
Разрывы нитей ДНК, вызванные пероксинитритом (ONOO-) и радикалами кислорода, приводят к значительному увеличению активности полимеразы PARP (PARP активируется вплоть до 100 раз, когда домен полимеразы PARP, образующий «Zn-палец», связывается с ДНК, имеющей повреждения). Полагают, что повышенная активация PARP вызывает истощение NAD+, который является существенным звеном в системе электронного транспорта, и последующее истощение АТР, приводящее к недостатку энергии, в конечном счете, приводит к гибели клетки. (The suicide hypothesis of PARP activation: Free Radic. Biol. Med., 21, 855 (1996); TIPS., 19, 287 (1998)). Поэтому, полагают, что ингибитор полимеразы PARP можно использовать для торможения гибели клетки.
Поскольку каспаза-3, фермент, который является одним из ферментов семейства интерлейкин-1β-превращающего фермента, специфически расщепляет PARP как субстрат (Cell., 81, 801 (1995)), полагают, что полимераза PARP связана с апоптозом.
В литературе было сообщение о том, что 3-аминобензамидин и никотинамид, которые являются общеизвестными ингибиторами PARP, используют с целью торможения гибели клетки и устранения заболеваний в исследованиях на различных моделях ишемических болезней (ишемия головного мозга, ишемия миокарда, ишемия кишечника, ишемия скелетных мышц или ишемия сетчатки и т.д.), воспалительных заболеваний (артрит, воспалительное заболевание кишечника или рассеянный склероз и т.д.), диабета, удара, экстрапирамидного заболевания (TIPS., 19, 287 (1998); Eur. J. Pharmacol., 350, 1 (1998)) и гипералгезии (Pain, 72, 355 (1997)), проводимых in vitro, in vivo и на моделях мышей с недостаточностью полимеразы PARP. Кроме того, было сообщено, что ингибитор полимеразы PARP используют в качестве лекарственного средства против ретровирусов, такого как лекарственный препарат против ВИЧ (Biochem. Biophys. Res.Commum., 180, 504 (1991)), в качестве сенсибилизирующего вещества для противораковой терапии (Radiat. Res., 126, 367 (1991) ; Br. J. Cancer., 72, 849 (1995)) или в качестве иммунодепрессанта (Int. J. Immunopharmac., 17, 265 (1995)).
Ингибитор полимеразы PARP является пригодным для профилактики и/или лечения различных заболеваний, например ишемических болезней (инфаркт головного мозга, инфаркт миокарда, травма вследствие реперфузии и послеоперационная травма и т.д.), воспалительных заболеваний (воспалительное кишечное заболевание, рассеянный склероз, артрит или повреждение легкого и т.д.), нейродегенеративных расстройств (экстрапирамидное заболевание, болезнь Паркинсона, болезнь Альцгеймера, мышечная дистрофия или стеноз спинномозгового канала поясничного отдела позвоночника и т.д.), глаукомы, диабета, осложнения диабета, удара, травмы головы, повреждения спинного мозга, почечной недостаточности, гипералгезии или задержки кровотока и т.д. Кроме того, ингибитор применим в качестве лекарственного средства против ретровирусов, такого как лекарственный препарат против ВИЧ, сенсибилизирующего вещества для противораковой терапии или иммунодепрессанта.
В качестве ингибитора полимеразы PARP, например, в международной публикации WO00/44726 описаны производные 2H-фталазин-1-она, представленные формулой (A)
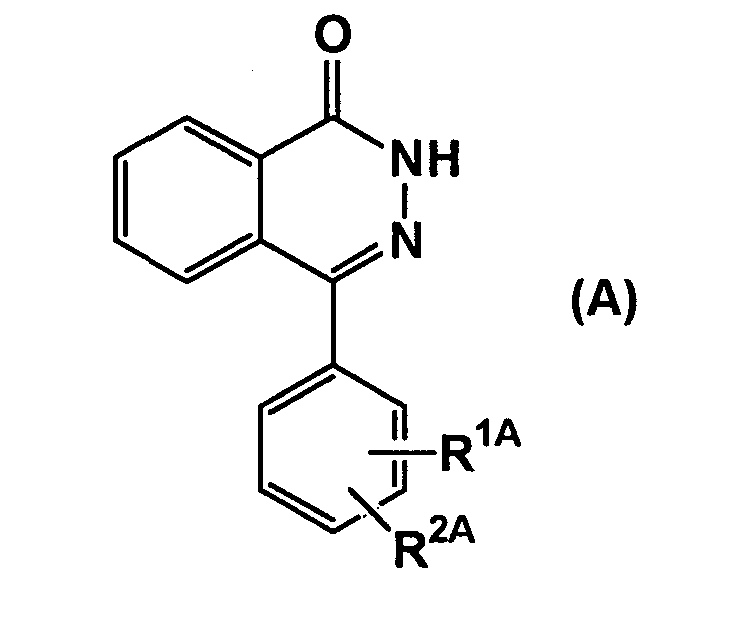
(где R1A представляет собой
(i) C1-4 алкил, замещенный гидрокси или амино, или
(ii)

в котором A1A является -NR3AC(O)- и т.д., где R3A представляет собой водород или C1-4 алкил и т.д., A2A представляет собой C1-8 алкилен и т.д., A3A является (i) водородом, (ii) -NR17AR18A или (iii) Cyc2A и т.д., где R17A является (i) водородом, (ii) C1-8 алкилом и т.д., и R18A является (i) водородом или (ii) C1-8 алкилом и т.д., Cyc2A является 3-10-членным моно- или бигетероциклическим кольцом, содержащим 1-4 атома азота, 1-2 атома кислорода и/или один атом серы, R2A является водородом или галогеном и т.д. Необходимые части были извлечены из описания групп), которые проявляют ингибиторную активность по отношению к полимеразе PARP.
В публикации DE3302021 указано, что соединения, представленные формулой (В),

(где R1B является водородом или C1-3 алкилом, R2B является водородом, R1B и R2B, взятые вместе, представляют собой C1-4 алкилен, R3B является водородом или метилом, nB равно 0-3, R4B является 1-пирролилом. Необходимые фрагменты взяты из описания групп), ингибируют агрегацию тромбоцитов.
В описании международной публикации WO98/31674 указано, что соединения, представленные формулой (C)

(где R1C является C1-4 алкокси и т.д., R2C является C1-8 алкокси и т.д., R3C и R4C является водородом или R3C и R4C, взятые вместе, представляют собой связь, R5C является водородом и т.д.Необходимые фрагменты взяты из описания групп), ингибируют фосфодиэстеразную активность.
В публикации, представленной в Journal of Medicinal Chemistry., 44(16), 2511-2522 and 2523-2535 (2001), описано, что 4-(3-хлор-4-метоксифенил)-4a,5,8,8a-тетрагидрофталазин-1(2H)-он (CAS Registry No. 244077-36-9) и 4-(3,4-диметоксифенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 358368-98-6) ингибируют фосфодиэстеразную активность.
В публикации журнала Tetrahedron., 39(20), 3419-27 (1983), описано, что 4-фенил-6,7,8,8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он (CAS Registry No. 89311-30-8) является синтетическим промежуточным соединением.
В публикации, представленной в Synthesis., 240-242 (1995), описано, что соединения 4-фенил-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 154810-22-7), 4-(4-метилфенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 154810-23-8), 4-(4-фторфенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 154810-24-9), 4-(4-хлорфенил)-5, 6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 154810-25-0), и 4-(4-бромфенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 154810-26-1) представляют собой синтетические промежуточные соединения.
В публикации журнала Bioorganic andMedicinalChemistry., 6, 349-454 (1998), описано, что 7-гидрокси-4-фенил-6,7,8, 8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он (CAS Registry No. 206126-90-1) и 4-фенил-8,8a-дигидро[1,3]тиазоло[3,4-d][1,2,4]триазин-1(2H)-он (CAS Registry No. 206126-96-7) являются синтетическими промежуточными соединениями.
В публикации, представленной в Journal of Medicinal Chemistry., 43(12), 2310-2323 (2000), описано, что 4-(пиридин-4-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 212142-89-7) является синтетическим промежуточным соединением.
В публикации FR2647676 описано, что 4-трет-бутоксикарбонилметил-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 134972-12-6) и 4-этоксикарбонилметил-5,6,7,8-тетрагидрофталазин-1(2H)-он (CAS Registry No. 134973-24-3) являются синтетическими промежуточными соединениями.
Для выявления соединения, обладающего ингибирующей активностью по отношению к (ADP-рибоза)полимеразе, проведены обширные исследования и установлено, что задача изобретения достигается производными пиридазина, представленного формулой (I).
Настоящее изобретение относится к (1) конденсированному производному пиридазина, представленному формулой (I)

где R1 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкокси, (4) гидрокси, (5) атом галогена, (6) нитро, (7) NR2R3, (8) C2-8 ацил, (9) C1-8 алкокси, замещенный фенилом или (10) C2-8 ацил, замещенный NR2R3,
R2 и R3 каждый независимо представляет собой
(1) атом водорода или (2) C1-8 алкил,
X и Y каждый независимо представляет собой
(1) C, (2) CH или (3) N,

(1) одинарной связью или (2) двойной связью,

является
(1) частично или полностью насыщенным C3-10 монокарбоциклическим арилом или (2) частично или полностью насыщенным 3-10-членным моногетероарилом, содержащим от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы,
A является (1) A1, (2) A2, (3) A3, (4) A4 или (5) A5,
A1 является

A2 является

A3 является

A4 является
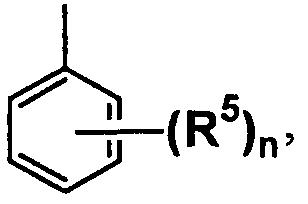
A5 является
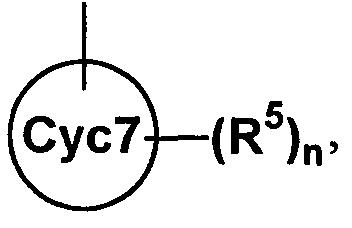
D1 является
(1) -NR6C(O)-, (2) -NR6C(S)-, (3) -NR6SO2-, (4) -CH2-NR6-, (5) -CH2-O-, (6) -OC(O)-, (7) -CH2-NR6C(O)-, (8) -NR6C(O)NR7-, (9) -NR6C(O)O-, (10) -NR6C(S)NR7-, (11) -NR6- или (12) -NR6C(=NR7)-,
R6 и R7 каждый независимо представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) фенил или (4) C1-8 алкил, замещенный фенилом,
D2 представляет собой
(1) C1-8 алкилен, (2) C2-8 алкенилен, (3) Cyc2, (4) -(C1-4 алкилен)-O-(C1-4 алкилен)-, (5) -(C1-4 алкилен)-S-(C1-4 алкилен)-, (6) -(C1-4 алкилен)-NR8-(C1-4 алкилен)-, (7) -(Cyc2)-(C1-8 алкилен)-, (8) -(C1-8 алкилен)-(Cyc2)- или (9) -(C1-4 алкилен)-(Cyc2)-(C1-4 алкилен)-,
R8 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкоксикарбонил, (4) фенил или (5) C1-8 алкил, замещенный фенилом,
D3 представляет собой
(1) атом водорода, (2) -NR9R10, (3) Cyc3, (4) -OR11, (5) COOR12, (6) CONR13R14, (7) циано, (8) атом галогена, (9) -C(=CR15)NR16R17 или (10) -NR18C(=NR19)NR20R21,
R9 и R13 каждый независимо представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C2-8 алкенил, (4) C2-8 алкинил, (5) Cyc3, (6) C1-8 алкокси, (7) C2-8 алкенилокси, (8) C2-8 алкинилокси или (9) C1-8 алкил, замещенный Cyc3, C1-8 алкокси, C1-8 алкилтио, циано, гидрокси или 1 - 3 атомами галогена,
R10 и R14 каждый независимо представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C2-8 алкенил, (4) C2-8 алкинил, (5) C1-8 алкоксикарбонил, (6) C2-8 ацил, (7) C3-8 циклоалкил, (8) C1-8 алкоксикарбонил, замещенный Cyc4 или 1 - 3 атомами водорода, или (9) C1-8 алкил, замещенный C1-8 алкокси,
R11 и R12 каждый независимо представляет собой
(1) атом водорода или (2) C1-8 алкил,
R15, R16, R17, R18, R19, R20 и R21 каждый независимо представляют собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкоксикарбонил, (4) фенил или (5) C1-8 алкил, замещенный фенилом,
R4 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкокси, (4) гидрокси, (5) атом галогена, (6) нитро или (7) NR22R23,
R22 и R23 каждый независимо представляет собой
(1) атом водорода или (2) C1-8 алкил,
E1 является C1-4 алкиленом,
E2 является
(1) -C(O)NR24-, (2) -NR24C(O)-, (3) -NR24-, (4) -C(O)O- или (5) -S-,
R24 представляет собой
(1) атом водорода, (2) C1-8 алкил или (3) C1-8 алкил, замещенный фенилом,
E3 представляет собой
(1) связь или (2) C1-8 алкилен,
E4 представляет собой
(1) C1-8 алкил, (2) C2-8 алкенил, (3) C2-8 алкинил, (4) Cyc5, (5) NR25R26, (6) OR27, (7) SR27, (8) COOR27, (9) C1-8 алкил, замещенный двумя из OR25, (10) C1-8 алкил, замещенный 1 - 3 атомами галогена, (11) циано или (12) C2-8 ацил,
R25 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C2-8 алкенил, (4) C2-8 алкинил, (5) Cyc5 или (6) C1-8 алкил, замещенный Cyc5 или OR28,
R26 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкоксикарбонил, (4) фенил или (5) C1-8 алкил, замещенный фенилом,
R27 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) Cyc5 или (4) C1-8 алкил, замещенный Cyc5,
R28 представляет собой
(1) атом водорода или (2) C1-8 алкил,
G1 является C1-8 алкиленом,
Cyc1 представляет собой
(1) частично или полностью насыщенный C3-10 моно- или бикарбоциклический арил, или (2) частично или полностью насыщенный 3-10-членный моно- или бигетероарил, содержащий от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы,
G2 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкоксикарбонил, (4) C2-8 ацил, (5) Cyc6, (6) C1-8 алкил или
C2-8 алкенил, замещенный 1 - 2 заместителями, выбранными из Cyc6, гидрокси и C1-8 алкокси, (7) C1-8 алкоксикарбонил, замещенный Cyc6, (8) -C(O)-Cyc6, (9) нитро, (10) NR41R42,
(11) C1-8 алкокси или (12) C1-8 алкил, замещенный NR41R42,
R41 и R42 каждый независимо представляет собой
(1) атом водорода или (2) C1-8 алкил,
R5 представляет собой
(1) атом водорода, (2) C1-8 алкил, (3) C1-8 алкокси, (4) гидрокси, (5) нитро, (6) NR29R30, (7) C1-8 алкил, замещенный NR29R30, (8) NHSO2OH, (9) амидино, (10) циано, (11) атом галогена, (12) Cyc8 или (13) C1-8 алкил, замещенный Cyc8,
R29 и R30 каждый независимо представляет собой
(1) атом водорода или (2) C1-8 алкил,
Cyc2, Cyc3, Cyc4, Cyc5, Cyc6 и Cyc8 каждый независимо представляет собой
(1) частично или полностью насыщенный C3-10 моно- или бикарбоциклический арил, или (2) частично или полностью насыщенный 3-10-членный моно- или бигетероарил, содержащий от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы,
Cyc7 представляет собой
(1) частично или полностью насыщенный C3-моно- или бикарбоциклический арил, или (2) частично или полностью насыщенный 3-10-членный моно- или бигетороарил, содержащий от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, при условии, что Cyc7 не является бензолом,
Cyc2, Cyc3, Cyc4, Cyc5, Cyc6 и Cyc8, возможно, замещаются 1-3 заместителями, выбранными из (1) C1-8 алкила, (2) C2-8 алкенила, (3) C1-8 алкокси, (4) атома галогена, (5) тригалоидметила, (6) тригалоидметокси, (7) C1-8 алкоксикарбонила, (8) оксо, (9) C1-8 алкила, замещенного C1-8 алкокси или фенилом, (10) гидрокси и (11) NR29R30;
m и n каждый независимо равен 1 или 2,
где
(i) когда A является A1 или A2, тогда


(ii) когда A является A4 и


тогда
R5 не является гидрокси или C1-8 алкокси,
(iii) когда A является A5, тогда

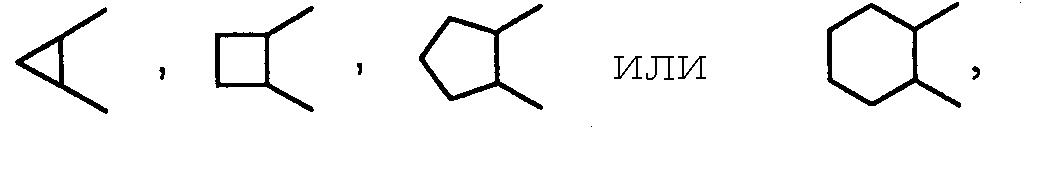
и
(iv) следующие соединения от (1) до (13) исключаются;
(1) 4-(3-хлор-4-метоксифенил)-4a,5,8, 8a-тетрагидрофталазин-1(2H)-он,
(2) 4-(3,4-диметоксифенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(3) 4-фенил-6,7,8,8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он,
(4) 4-фенил-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(5) 4-(4-метилфенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(6) 4-(4-фторфенил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он,
(7) 4-(4-хлорфенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(8) 4-(4-бромфенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(9) 7-гидрокси-4-фенил-6,7,8,8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он,
(10)4-фенил-8,8a-дигидро[1,3]тиазоло[3,4-d][1,2,4]триазин-1(2H)-он,
(11) 4-(пиридин-4-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(12) 4-трет-бутоксикарбонилметил-5,6,7,8-тетрагидрофталазин-1(2H)-он,
(13) 4-этоксикарбонилметил-5,6,7, 8-тетрагидрофталазин-1(2H)-он, или
его фармацевтически приемлемой соли,
(2) способу получения указанного соединения, и
(3) средству, включающему в себя такое соединение в качестве активного ингредиента.
В описании, C1-8 алкил означает метил, этил, пропил, бутил, пентил, гексил, гептил, октил или их изомеры.
В описании, C2-8 алкенил означает этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил или их изомеры.
В описании, C2-8 алкинил означает этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил или их изомеры.
В описании, C1-8 алкокси означает метокси, этокси, пропокси, бутокси, пентилокси, гексилокси, гептилокси, октилокси или их изомеры.
В описании, C2-8 алкенилокси означает этенилокси, пропенилокси, бутенилокси, пентенилокси, гексенилокси гептенилокси, октенилокси или их изомеры.
В описании, C2-8 алкинилокси означает этинилокси, пропинилокси, бутинилокси, пентинилокси, гексинилокси, гептинилокси, октинилокси или их изомеры.
В описании, C1-8 алкилтио означает метилтио, этилтио, пропилтио, бутилтио, пентилтио, гексилтио, гептилтио, октилтио или их изомеры.
В описании, C1-4 алкилен означает метилен, этилен, триметилен, тетраметилен или их изомеры.
В описании, C1-8 алкилен означает метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, гептаметилен, октаметилен или их изомеры.
В описании, C2-8 алкенилен означает этенилен, пропенилен, бутенилен, пентенилен, гексенилен, гептенилен, октенилен или их изомеры.
В описании, C1-8 алкоксикарбонил означает метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил, гептилоксикарбонил, октилоксикарбонил или их изомеры.
В описании, тригалоидметилом является метил, замещенный тремя атомами галогена.
В описании, тригалоидметоксилом является метоксил, замещенный тремя атомами галогена.
В описании, C2-8 ацил означает этаноил (ацетил), пропаноил (пропионил), бутаноил (бутирил), пентаноил (валерил), гексаноил, гептаноил, октаноил или их изомеры.
В описании, C3-8 циклоалкил означает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил.
В описании, галоген означает хлор, бром, фтор или йод.
В описании, частично или полностью насыщенным C3-10 монокарбоциклическим арилом, представленным формулой
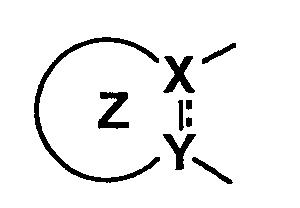
является циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, циклононан, циклодекан, циклопропен, циклобутен, циклопентен, циклогексен, циклогептен, циклооктен, циклононен, циклодецен, циклогексадиен, циклогептадиен, циклооктадиен и т.д.
В описании, частично или полностью насыщенный 3-10-членный моногетероарил, содержащий от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, представленный формулой

означает азиридин, азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, оксиран, оксетан, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидрооксепин, тетрагидрооксепин, пергидрооксепин, тииран, тиетан, дигидротиофен, тетрагидротиофен, дигидротиаин (дигидротиопиран), тетрагидротиаин (тетрагидротиопиран), дигидротиепин, тетрагидротиепин, пергидротиепин, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизоксазол, тетрагидроизоксазол (изоксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидрооксазепин, тетрагидрооксазепин, пергидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, пергидрооксадиазепин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, дигидротиазепин, тетрагидротиазепин, пергидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, пергидротиадиазепин, морфолин, тиоморфолин, оксатиан, диоксолан, диоксан, дитиолан, дитиан и т.д.
В описании, среди частично или полностью насыщенного 3-10-членного моно- или бигетероарила, содержащего от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, представленного Cyc1, Cyc2, Cyc3, Cyc4, Cyc5, Cyc6, Cyc7 и Cyc8, 3-10-членный моно- или бигетероарил, содержащий от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, означает, например, пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, фуран, пиран, оксепин, тиофен, тиаин, тиепин, оксазол, изоксазол, тиазол, изотиазол, фуразан, оксадиазол, оксазин, оксадиазин, оксазепин, оксадиазепин, тиадиазол, тиазин, тиадиазин, тиазепин, тиадиазепин, индол, изоиндол, индолизин, бензофуран, изобензофуран, бензотиофен, изобензотиофен, дитианафталин, индазол, хинолин, изохинолин, хинолизин, пурин, фталазин, птеридин, нафтиридин, хиноксалин, хиназолин, циннолин, бензоксазол, бензотиазол, бензимидазол, хромен, бензофуразан, бензотиадиазол, бензотриазол и т.д.
Кроме того, частично или полностью насыщенный 3-10-членный моно- или бигетероарил, содержащий от 1 до 4 гетероатомов, выбранных из атомов кислорода, азота и серы, означает азиридин, азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, оксиран, оксетан, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидрооксепин, тетрагидрооксепин, пергидрооксепин, тииран, тиетан, дигидротиофен, тетрагидротиофен, дигидротиаин (дигидротиопиран), тетрагидротиаин (тетрагидротиопиран), дигидротиепин, тетрагидротиепин, пергидротиепин, дигидроксазол, тетрагидрооксазол (оксазолидин), дигидроизоксазол, тетрагидроизоксазол (изоксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидрооксазепин, тетрагидрооксазепин, пергидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, пергидрооксадиазепин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, дигидротиазепин, тетрагидротиазепин, пергидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, пергидротиадиазепин, морфолин, тиоморфолин, оксатиан, индолин, изоиндолин, дигидробензофуран, пергидробензофуран, дигидроизобензофуран, пергидроизобензофуран, дигидробензотиофен, пергидробензотиофен, дигидроизобензотиофен, пергидроизобензотиофен, дигидроиндазол, пергидроиндазол, дигидрохинолин, тетрагидрохинолин, пергидрохинолин, дигидроизохинолин, тетрагидроизохинолин, пергидроизохинолин, дигидрофталазин, тетрагидрофталазин, пергидрофталазин, дигидронафтиридин, тетрагидронафтиридин, пергидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, пергидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, пергидрохиназолин, дигидроциннолин, тетрагидроциннолин, пергидроциннолин, бензоксатиан, дигидробензоксазин, дигидробензотиазин, пиразиноморфолин, дигидробензоксазол, пергидробензоксазол, дигидробензотиазол, пергидробензотиазол, дигидробензимидазол, пергидробензимидазол, диоксолан, диоксан, дитиолан, дитиан, диоксаиндан, бензодиоксан, хроман, бензодитиолан, бензодитиан и т.д.
Указанное выше гетероциклическое кольцо включает в себя N-оксид, который является соединением с окисленным азотом.
В описании, частично или полностью насыщенный C3-10 моно- или бикарбоциклический арил, представленный Cyc1, Cyc2, Cyc3, Cyc4, Cyc5, Cyc6, Cyc7 и Cyc8, представляет собой циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, циклононан, циклодекан, циклопропен, циклобутен, циклопентен, циклогексен, циклогептен, циклооктен, циклононен, циклодецен, циклопентадиен, циклогексадиен, циклогептадиен, циклооктадиен, бензол, пентален, азулен, пергидроазулен, пергидропентален, инден, пергидроинден, индан, нафталин, тетрагидронафталин или пергидронафталин и т.д.
Если не указано особо, все изомерывключены в настоящее изобретение. Например, группа алкил, алкенил, алкинил, алкилен и алкокси содержит прямые или разветвленные цепи. Кроме того, изомеры по двойной связи, кольца, конденсированного кольца (E-, Z, цис-, транс-изомер), изомеры, образованные при наличии асимметрического атома(ов) углерода (R-, S-, α-, β-изомер, энантиомер, диастереомер), оптически активные изомеры (D-, L-, d-, l-изомер), полярные соединения, полученные путем хроматографического разделения (более полярное соединение, менее полярное соединение), равновесные соединения, их смеси при произвольных отношениях и рацемические смеси также включены в настоящее изобретение.
Согласно настоящему изобретению, если не указано особо, и если очевидно специалистам в данной области, символ




Соединение согласно настоящему изобретению может быть превращено в фармацевтически приемлемую соль известными способами.
Фармацевтически приемлемая соль предпочтительно является водорастворимой.
Фармацевтически приемлемая соль означает, например, соли щелочных металлов (калия, натрия, лития и т.д.), соли щелочноземельных металлов (кальция, магния и т.д.), аммониевые соли (тетраметиламмоний, тетрабутиламмоний и т.д.), соли органических аминов (триэтиламина, метиламина, диметиламина, циклопентиламина, бензиламина, фенэтиламина, пиперидина, моноэтаноламина, диэтаноламина, трис(гидроксиметил)метиламина, лизина, аргинина, N-метил-D-глюкамина и т.д.), аддитивные соли кислоты (соли неорганических кислот (гидрохлорид, бромгидрат, йодгидрат, сульфат, фосфат, нитрат и т.д.), соли органических кислот (ацетат, трифторацетат, лактат, тартрат, оксалат, фумарат, малеат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, изетионат, глюкуронат, глюконат и т.д.) и т.д.
Кроме того, сольваты или сольваты указанных выше щелочных (земельных) металлов, аммония, органических аминов и аддитивных солей кислоты соединения согласно настоящему изобретению включены в понятие фармацевтически приемлемой соли согласно настоящему изобретению.
Предпочтительно, сольват является нетоксичным и водорастворимым. Соответствующий сольват означает, сольват, такой как, например, с водой, спиртом (этанолом и т.д.) и т.д.
В описании,

предпочтительно является частично или полностью насыщенным C3-7 монокарбоциклическим арилом, или частично или полностью насыщенным 3-7-членным моногетероарилом, содержащим 1-2 гетероатома, выбранные из атомов кислорода, азота и серы. Кроме того, частично или полностью насыщенный C3-7 монокарбоциклический арил или частично или полностью насыщенный 3-7-членный моногетероарил предпочтительно представляют собой следующие соединения;

Частично или полностью насыщенным 3-7-членным моногетероарилом, содержащим 1-2 гетероатома, выбранные из атомов кислорода, азота и серы, являются предпочтительно следующие соединения;

В описании, A является предпочтительно A1, A2 или A3.
В описании, D1 является предпочтительно -NR6C(O)-,
-NR6C(S)-, -NR6SO2- или -CH2-NR6-, и более предпочтительно
-NR6C(O)-.
В описании, D2 предпочтительно представляет собой C1-8 алкилен, C2-8 алкенилен, -(C1-4 алкилен)-O-(C1-4 алкилен)-, -(C1-4 алкилен)-S-(C1-4 алкилен)-, -(C1-4 алкилен)-NR8-(C1-4 алкилен)- или -(C1-8 алкилен)-(Cyc2)-, и более предпочтительно C1-8 алкилен.
В описании, D3 предпочтительно является -NR9R10 или Cyc3.
В описании, E1 предпочтительно является C1-4 алкиленом.
В описании, E2 предпочтительно является -C(O)NR24-, -NR24C(O)-, -NR24- или -S-.
В описании, E3 предпочтительно представляет собой связь или C1-8 алкилен.
В описании, E4 предпочтительно является Cyc5 или NR25R26.
В описании, Cyc1 предпочтительно является частично или полностью насыщенным 3-10-членным моногетероарилом, содержащим 1-2 гетероатома, выбранные из атомов кислорода, азота и серы.
В описании, когда A является A3 или A4, по крайней мере, один из X и Y предпочтительно является N.
В описании, когда A является A3 или A4,

предпочтительно является

Среди соединений согласно настоящему изобретению, представленных формулой (I), предпочтительными соединениями являются соединения, представленные формулой (I-A-1)
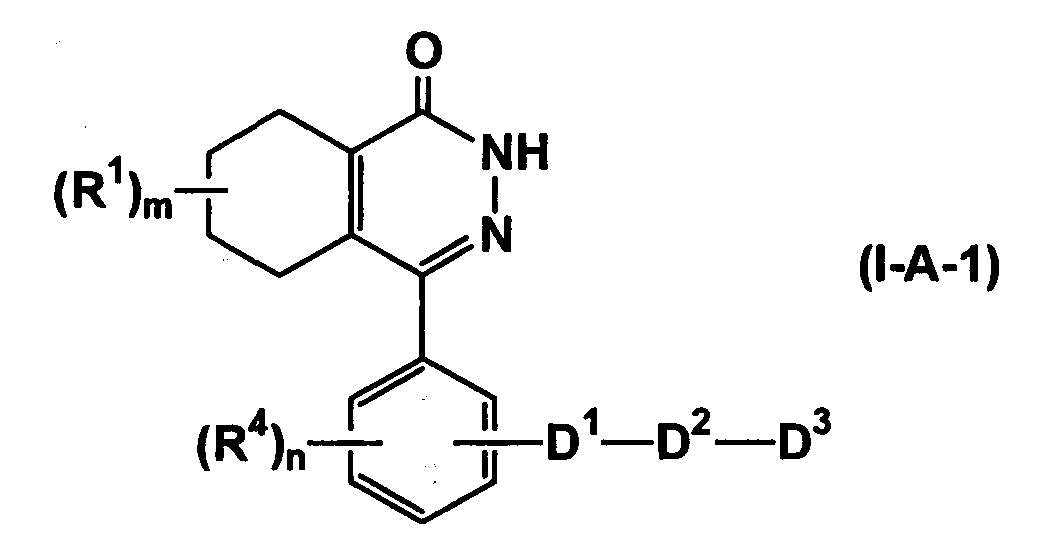
(где все символы имеют такие же значения, как описано выше), соединения, представленные формулой (I-A-2)
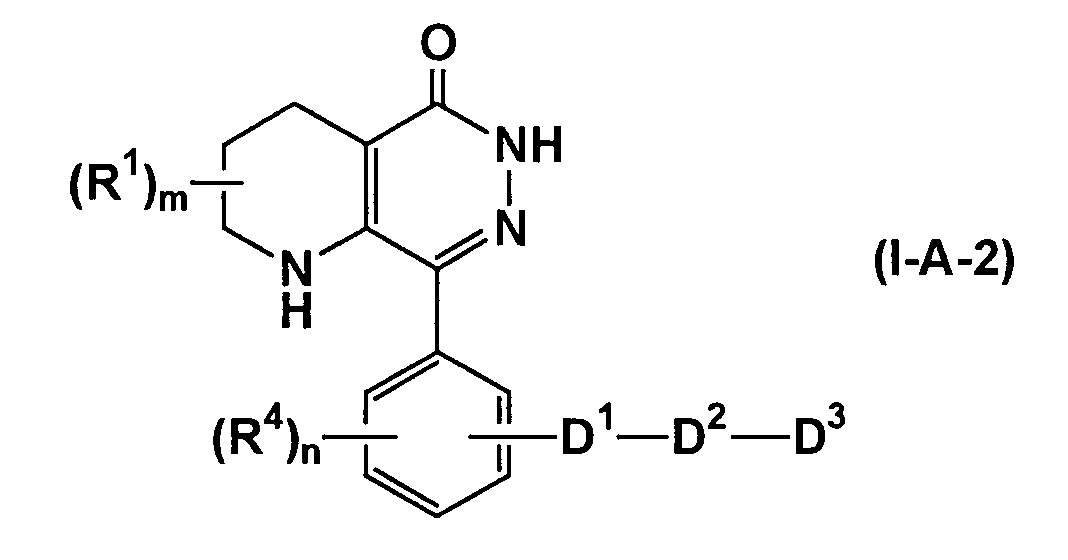
(где все символы имеют такие же значения, как описано выше), соединения, представленные формулой (I-B-1)

(где все символы имеют такие же значения, как описано выше), соединения, представленные формулой (I-B-2)

(где все символы имеют такие же значения, как описано выше), соединения, представленные формулой (I-C-1)

(где все символы имеют такие же значения, как описано выше), и соединения, представленные формулой (I-C-2)

(где все символы имеют такие же значения, как описано выше).
Определенные соединения согласно настоящему изобретению включают в себя соединения, представленные в таблицах от 1 до 90, соединения, описанные в примерах, и их фармацевтически приемлемые соли.
В каждой таблице Me представляет собой метильную группу, Et представляет собой этильную группу, Pr представляет собой пропильную группу, i-Pr представляет собой изопропильную группу, Bu представляет собой бутильную группу, c-Pr представляет собой циклопропильную группу, c-Bu представляет собой циклобутильную группу, c-Pen представляет собой циклопентильную группу, c-Hex представляет собой циклогексильную группу, Ph представляет собой фенильную группу, Bn представляет собой бензильную группу, и другие символы имеют такие же значения, как описано выше.
Таблица 1

Таблица 2

Таблица 3

Таблица 4

Таблица 5

Таблица 6

Таблица 7

Таблица 8
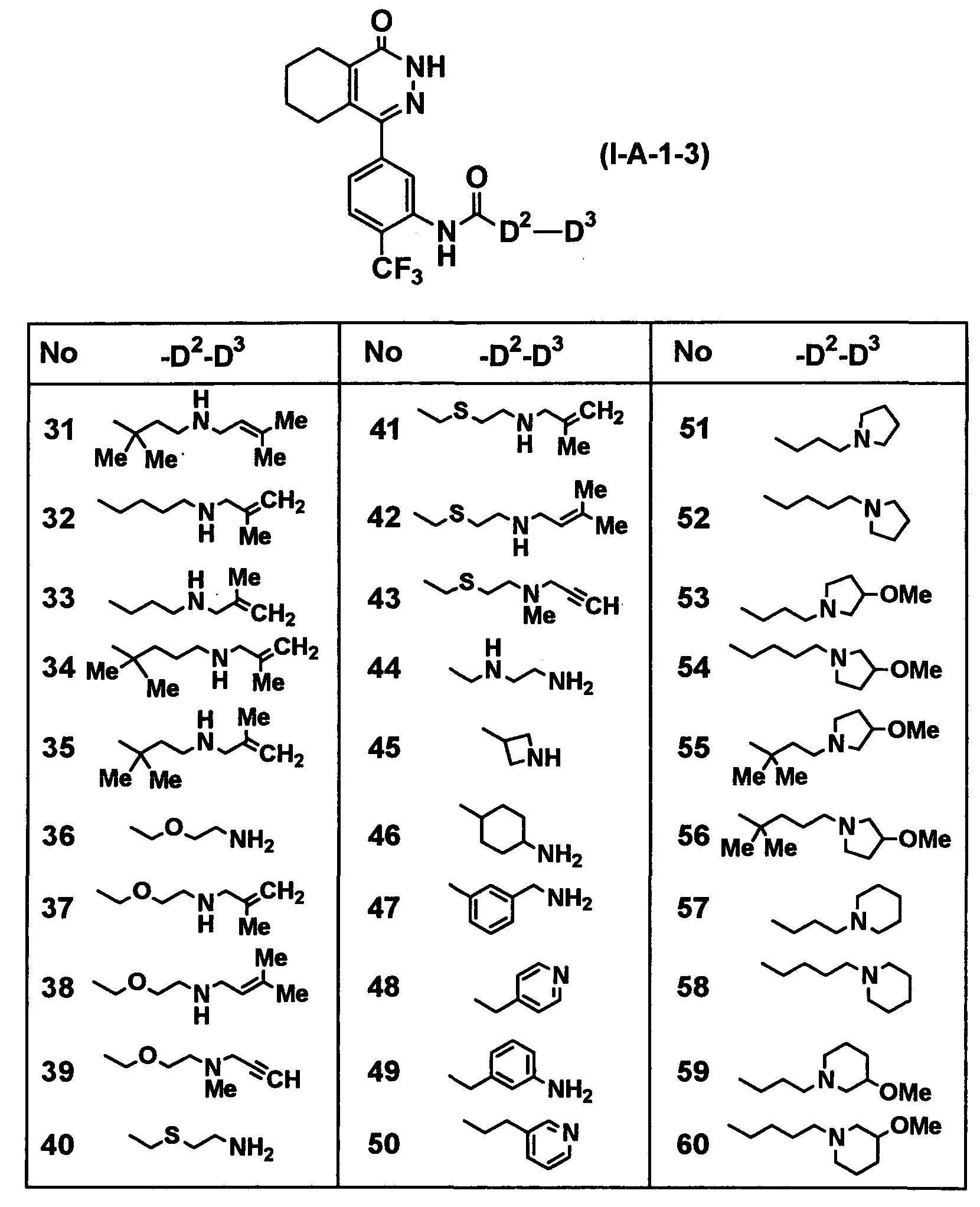
Таблица 9

Таблица 10

Таблица 11
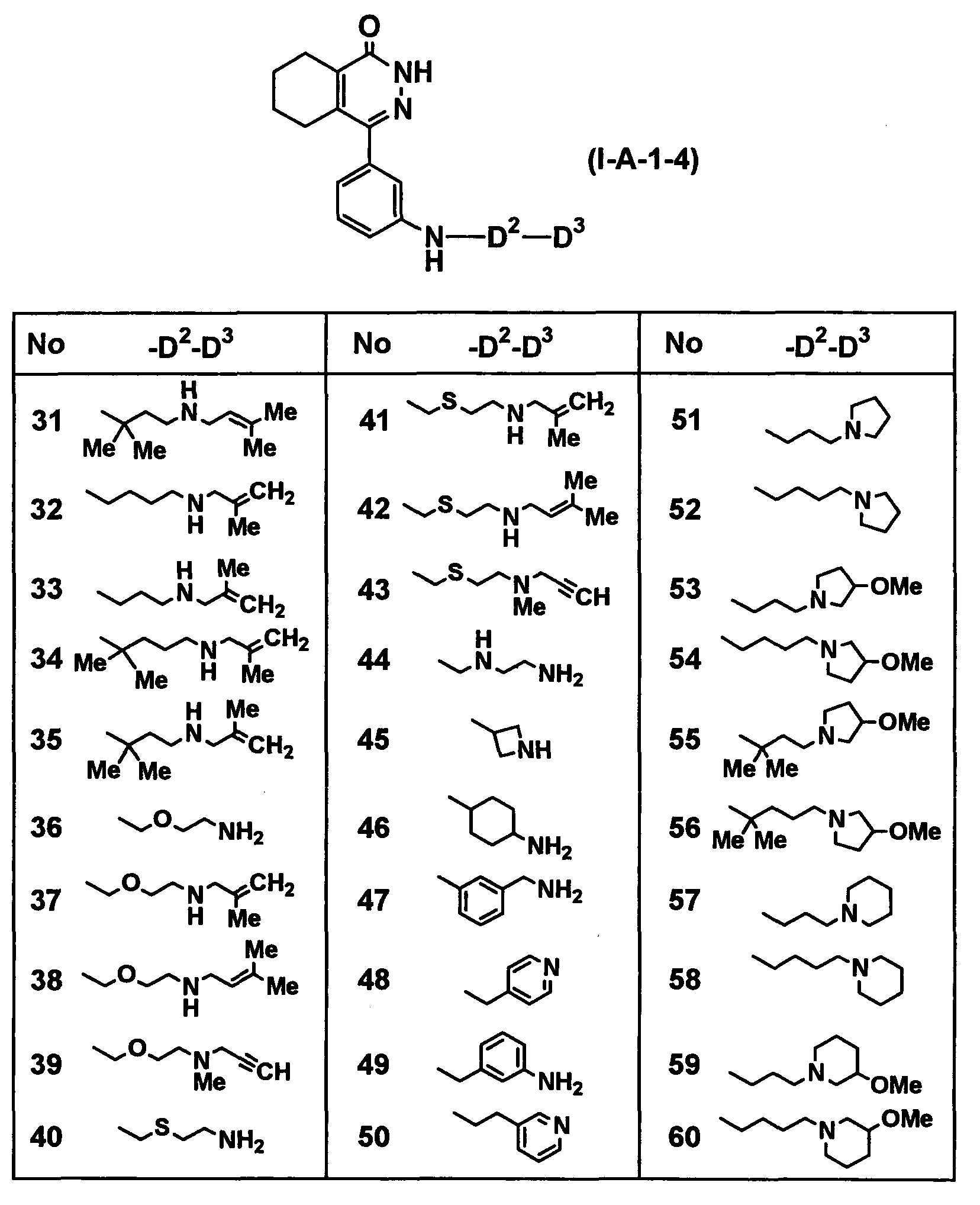
Таблица 12

Таблица 13

Таблица 14

Таблица 15

Таблица 16

Таблица 17

Таблица 18

Таблица 19

Таблица 20

Таблица 21

Таблица 22

Таблица 23

Таблица 24
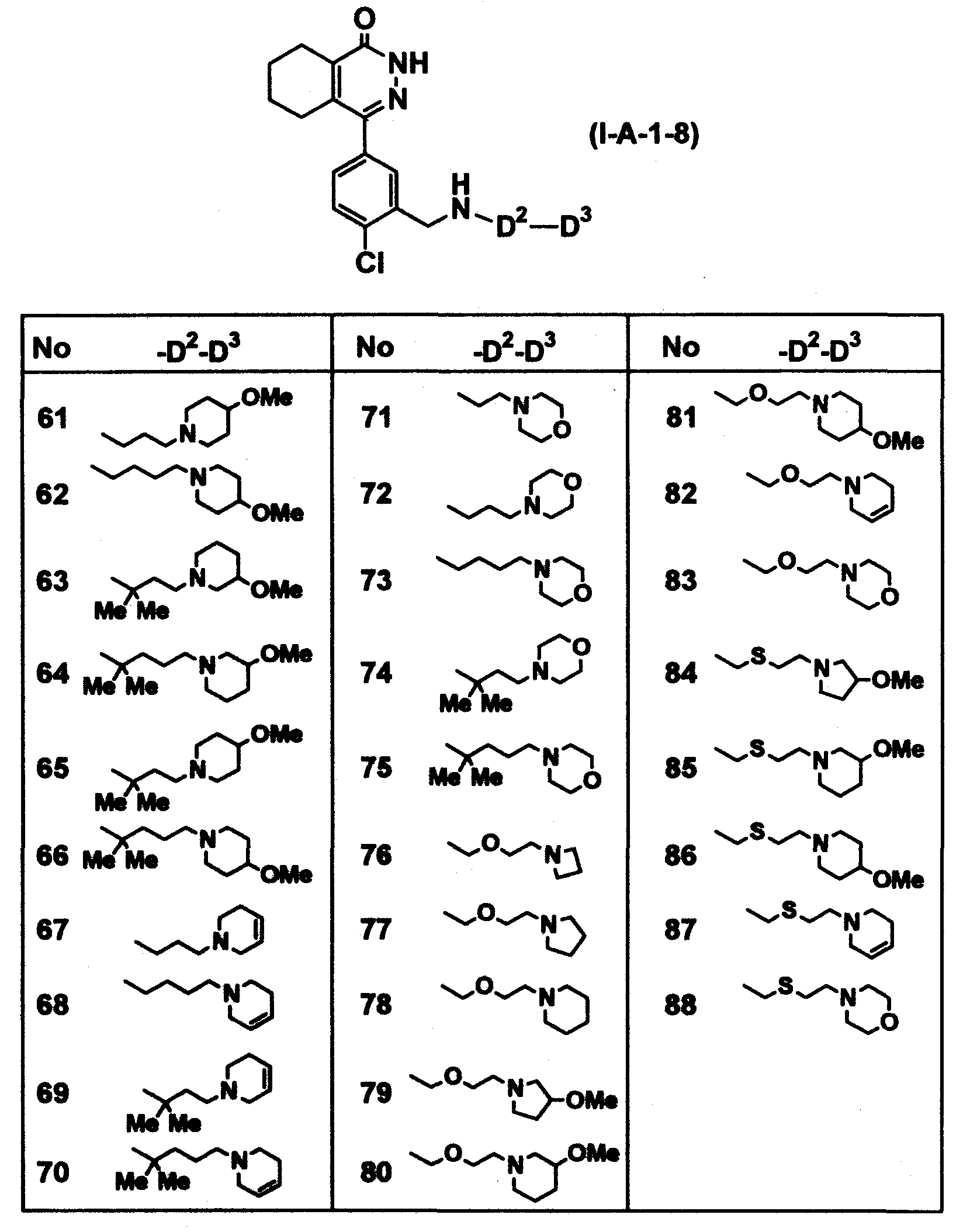
Таблица 25

Таблица 26

Таблица 27
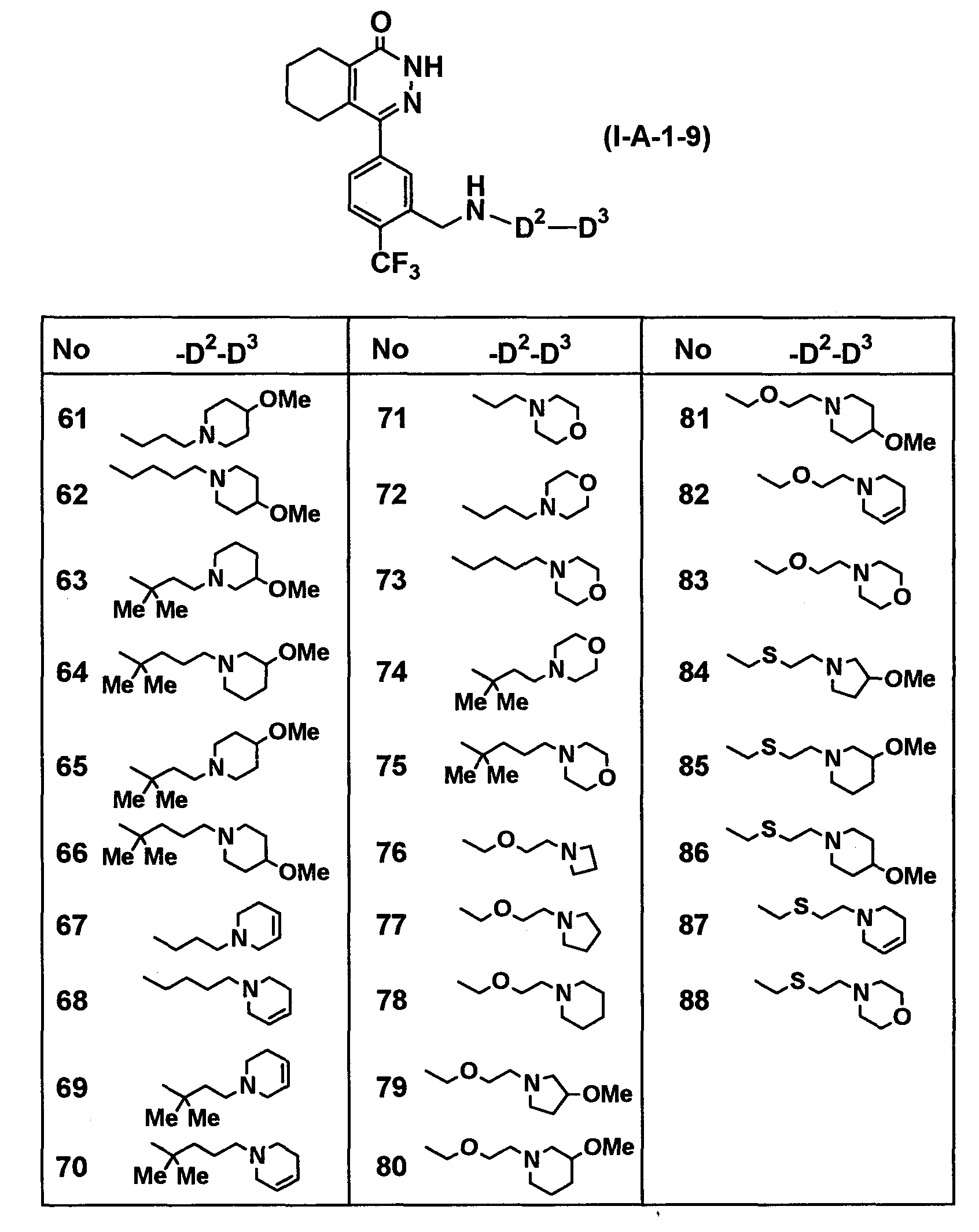
Таблица 28

Таблица 29

Таблица 30

Таблица 31

Таблица 32

Таблица 33

Таблица 34
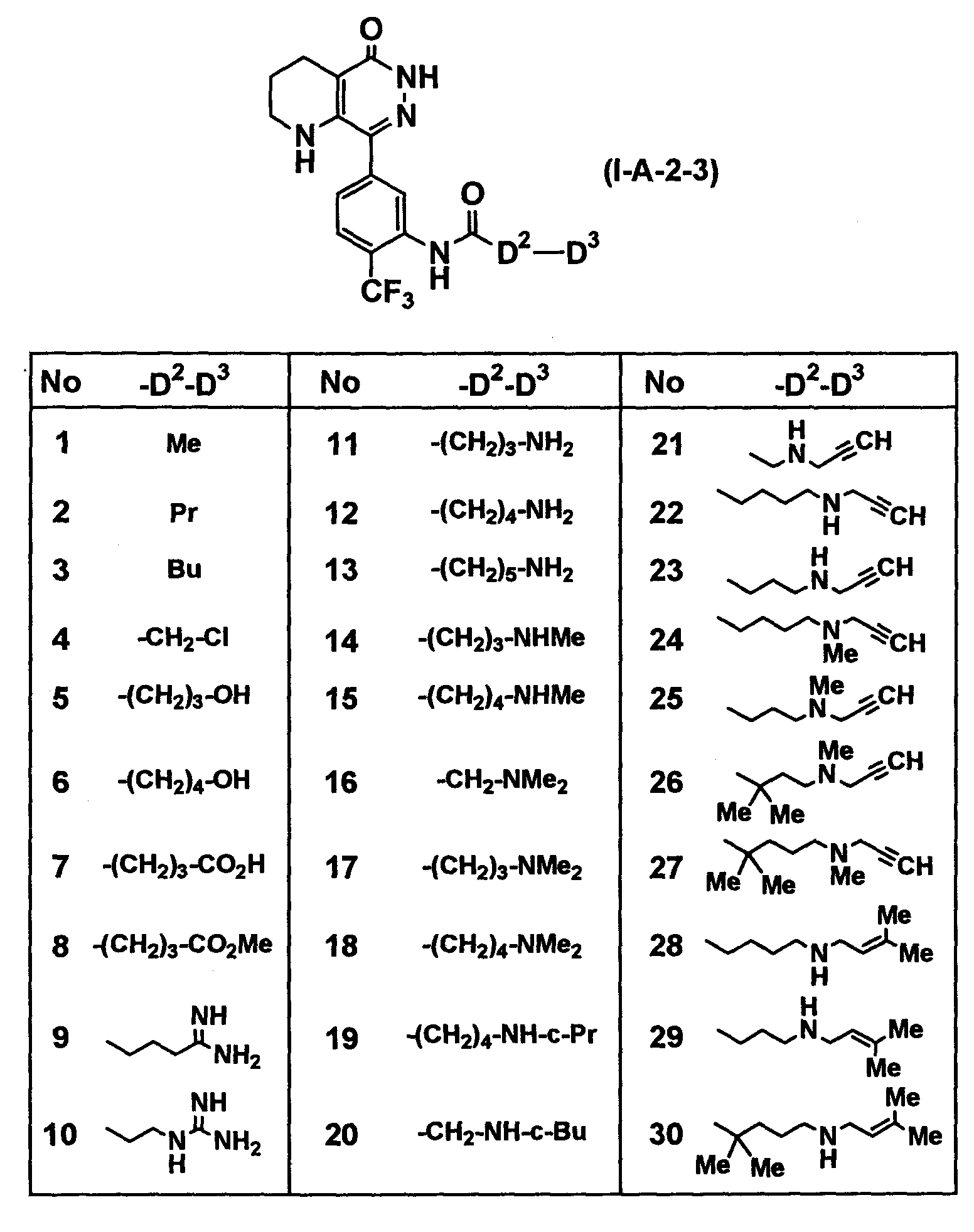
Таблица 35

Таблица 36

Таблица 37

Таблица 38

Таблица 39

Таблица 40

Таблица 41

Таблица 42

Таблица 43
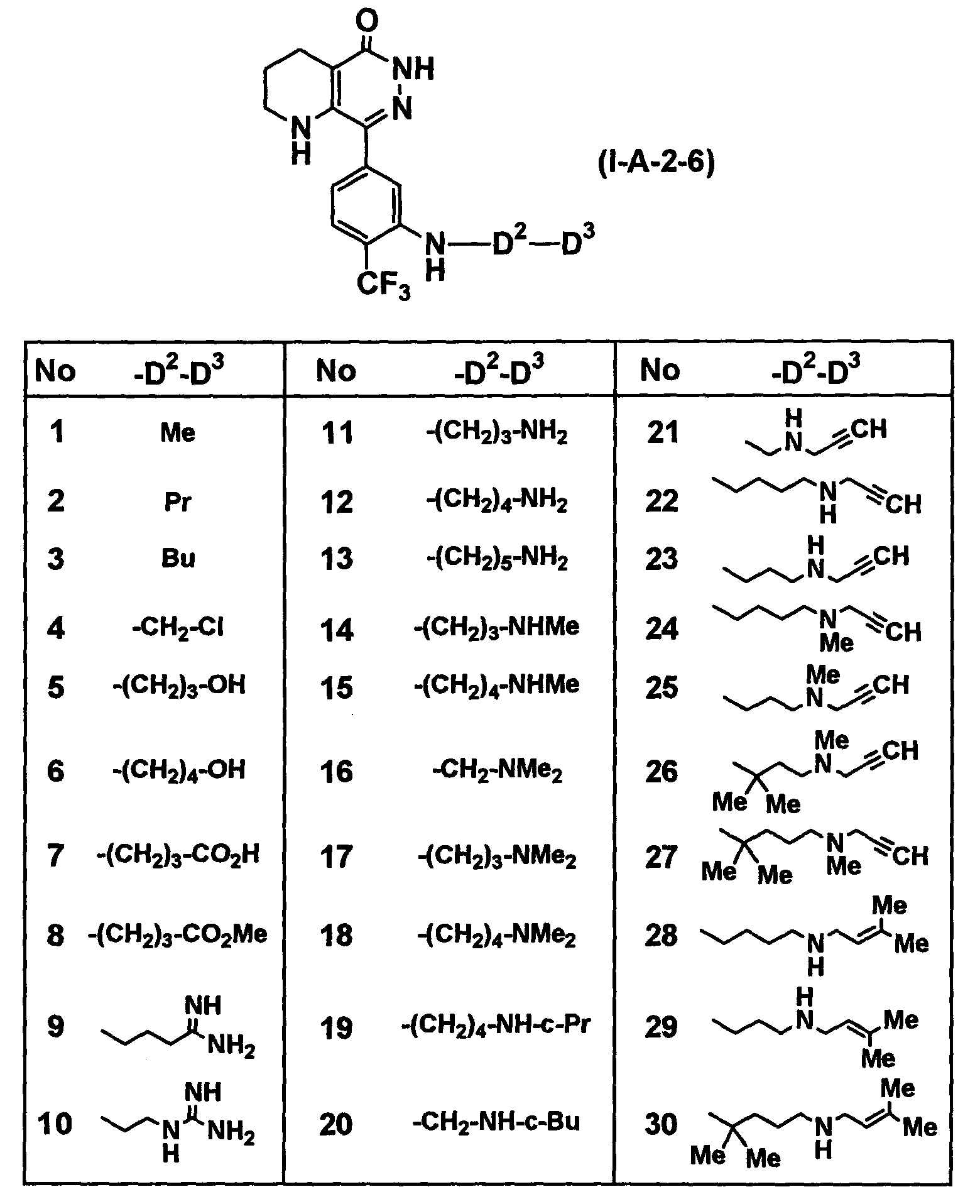
Таблица 44

Таблица 45

Таблица 46

Таблица 47
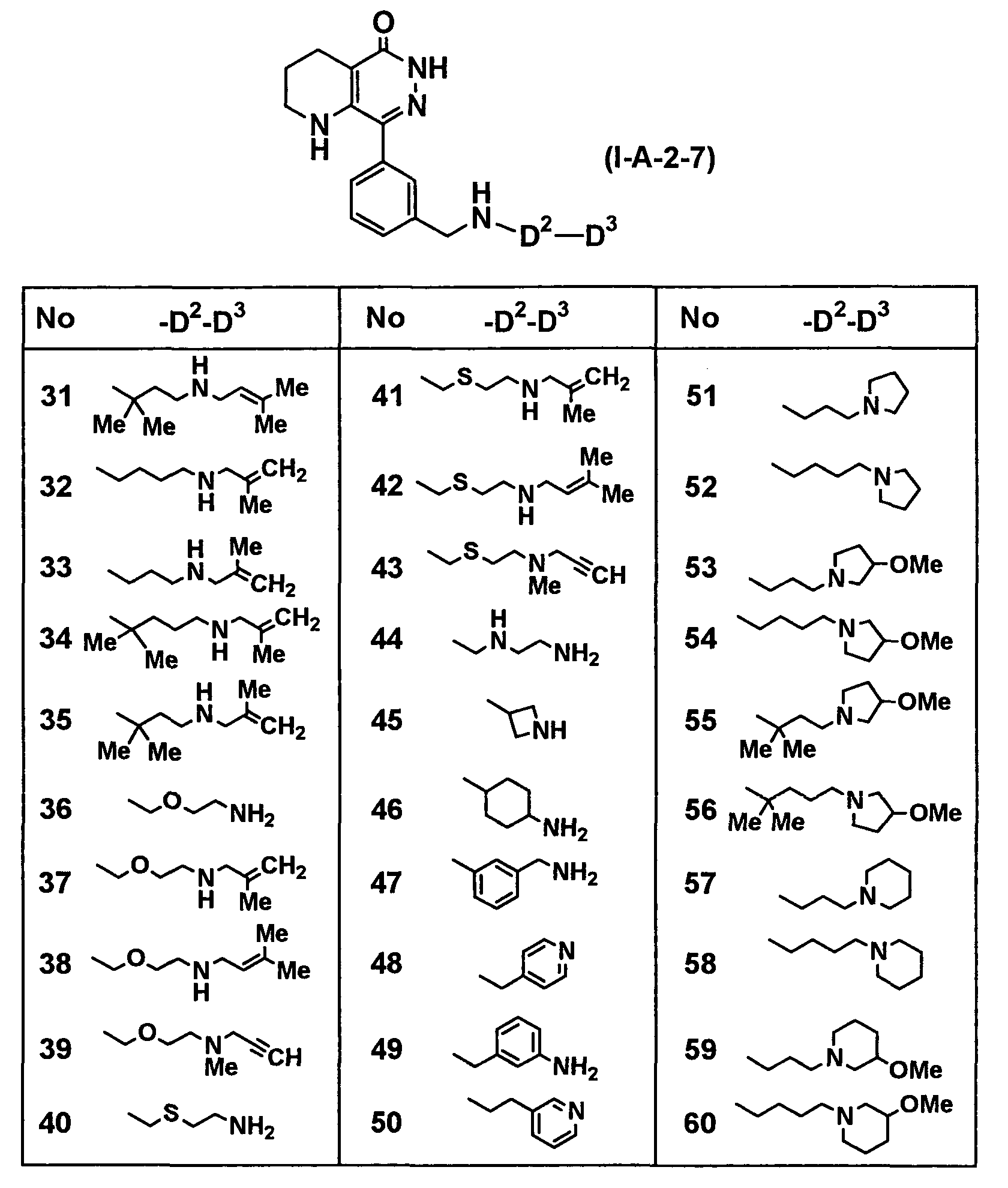
Таблица 48

Таблица 49

Таблица 50

Таблица 51
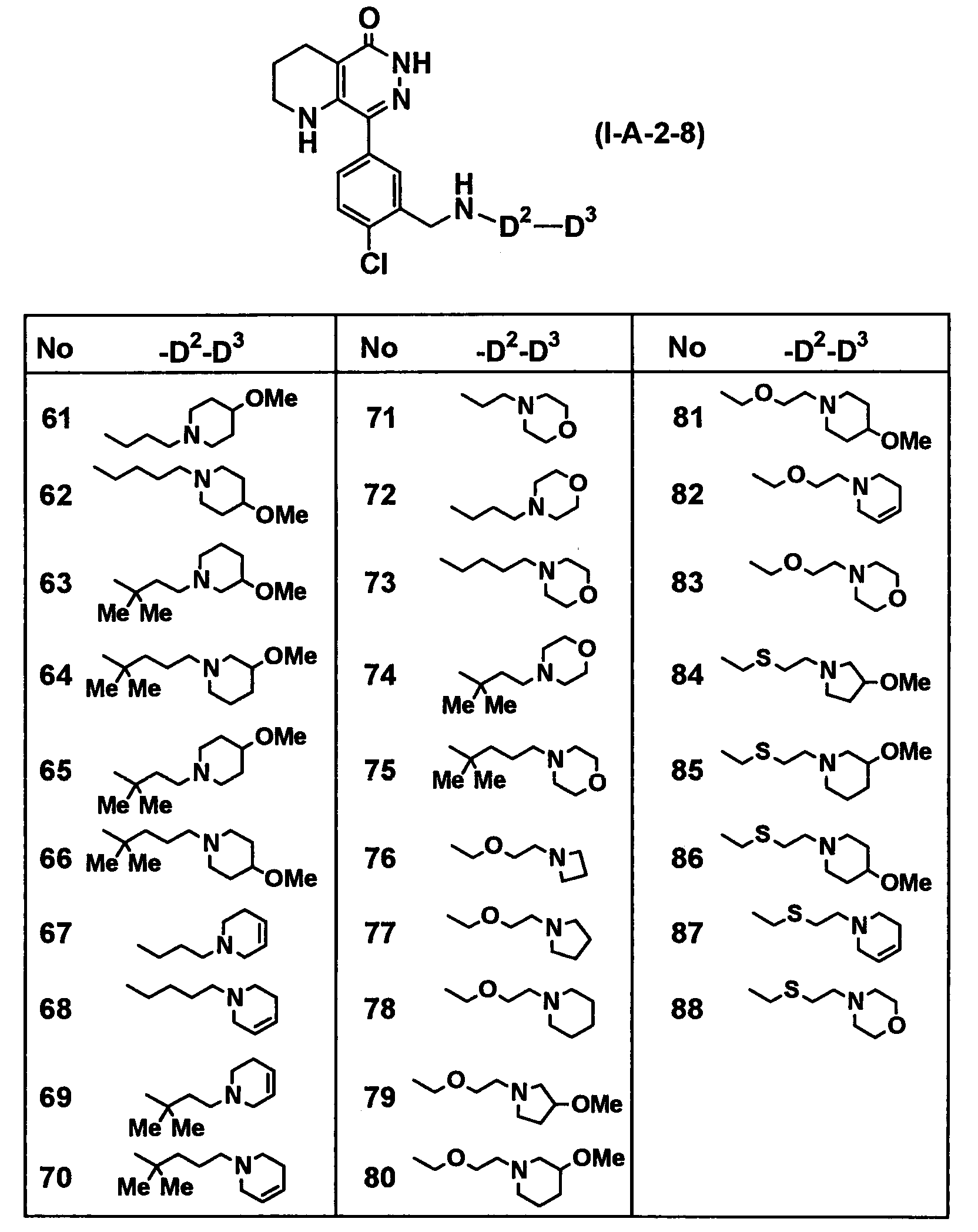
Таблица 52

Таблица 53

Таблица 54

Таблица 55
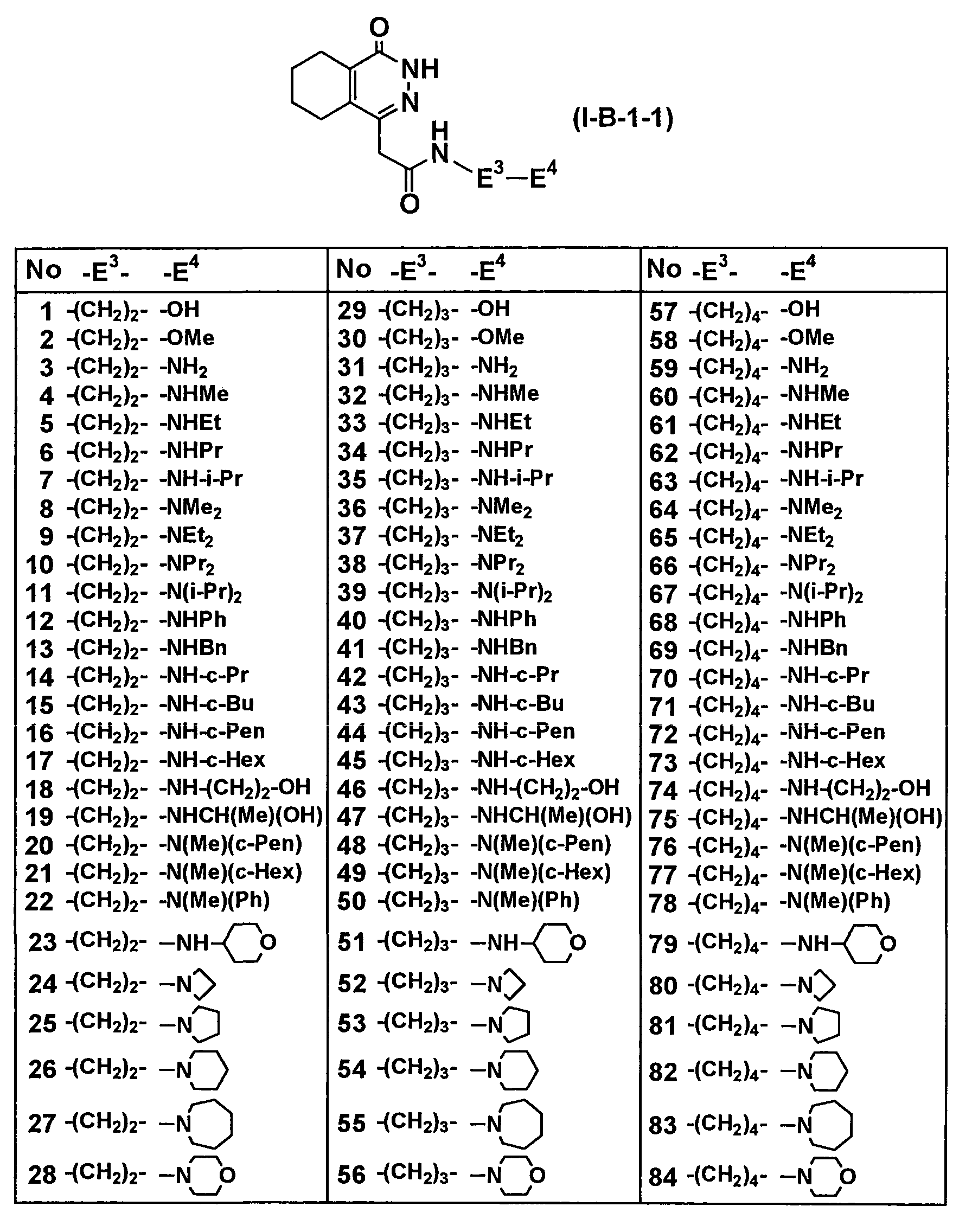
Таблица 56

Таблица 57

Таблица 58

Таблица 59
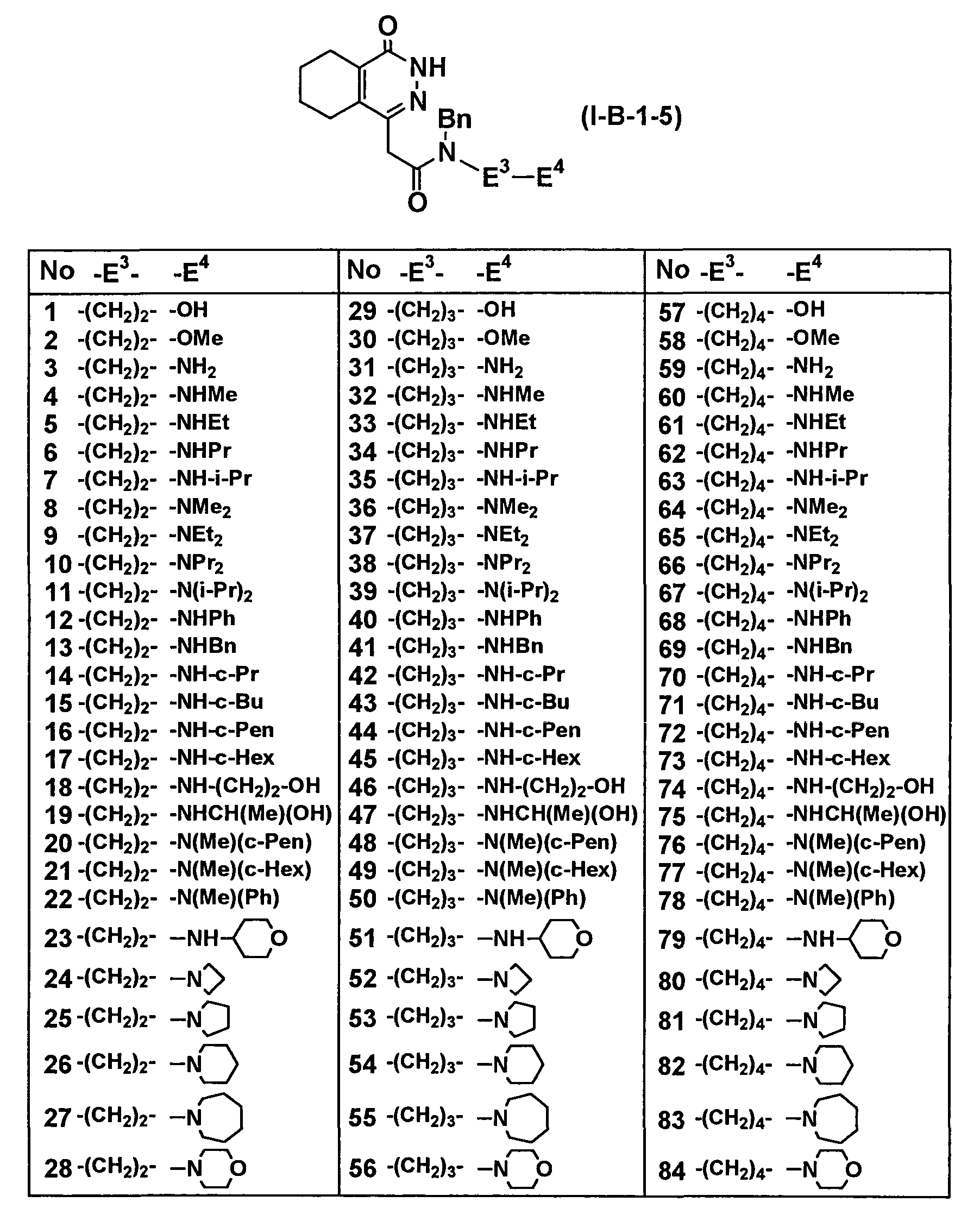
Таблица 60
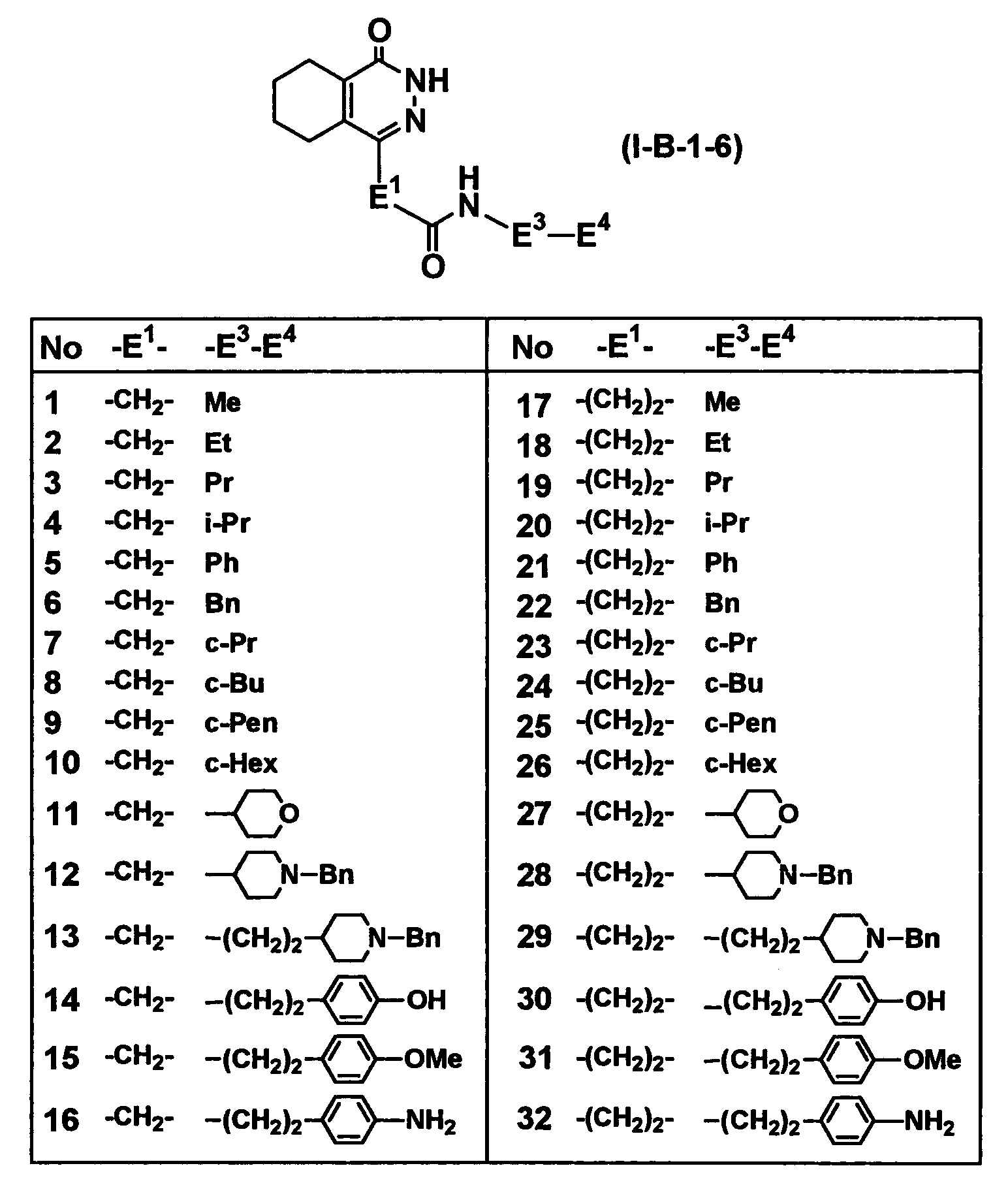
Таблица 61
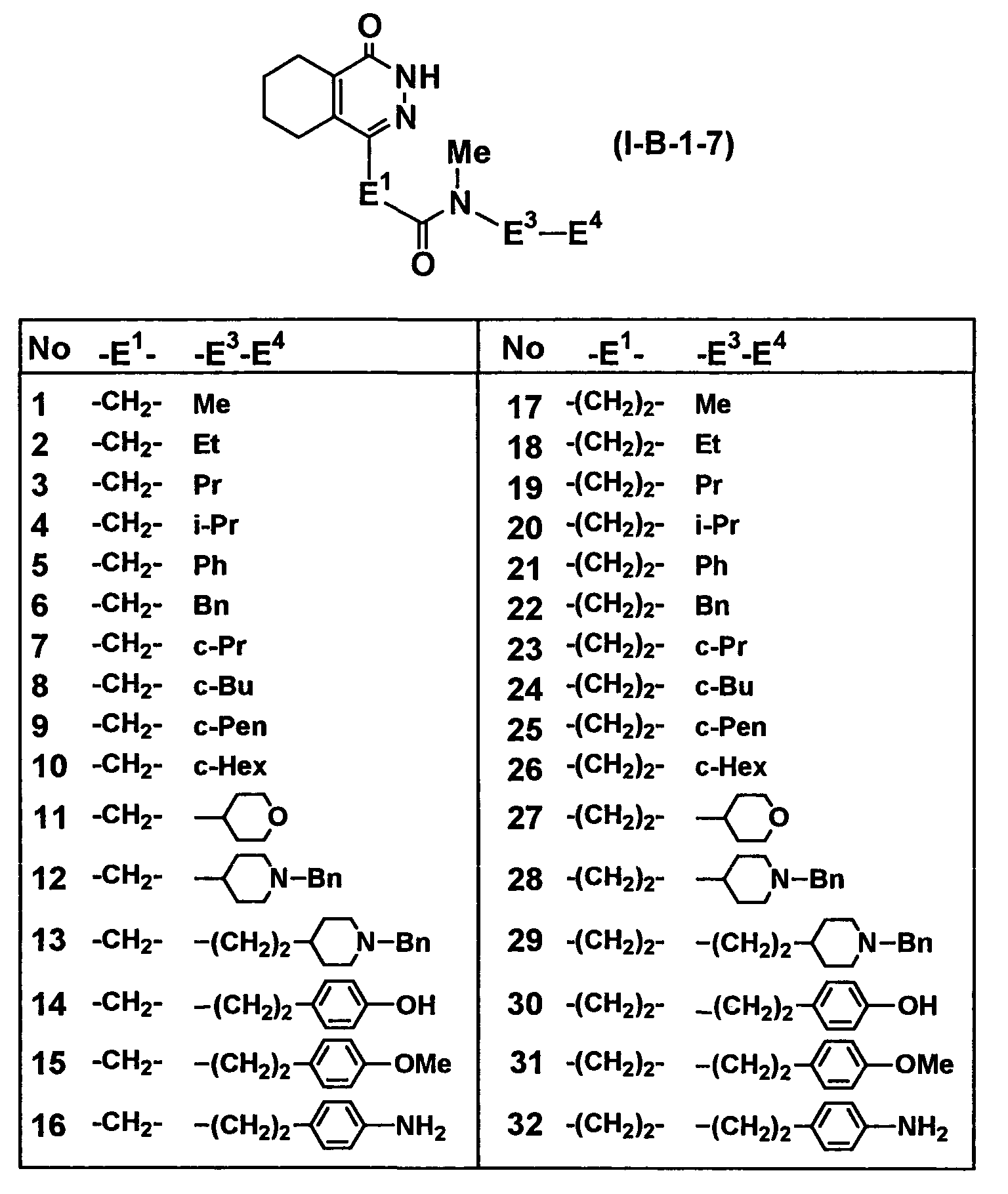
Таблица 62

Таблица 63

Таблица 64
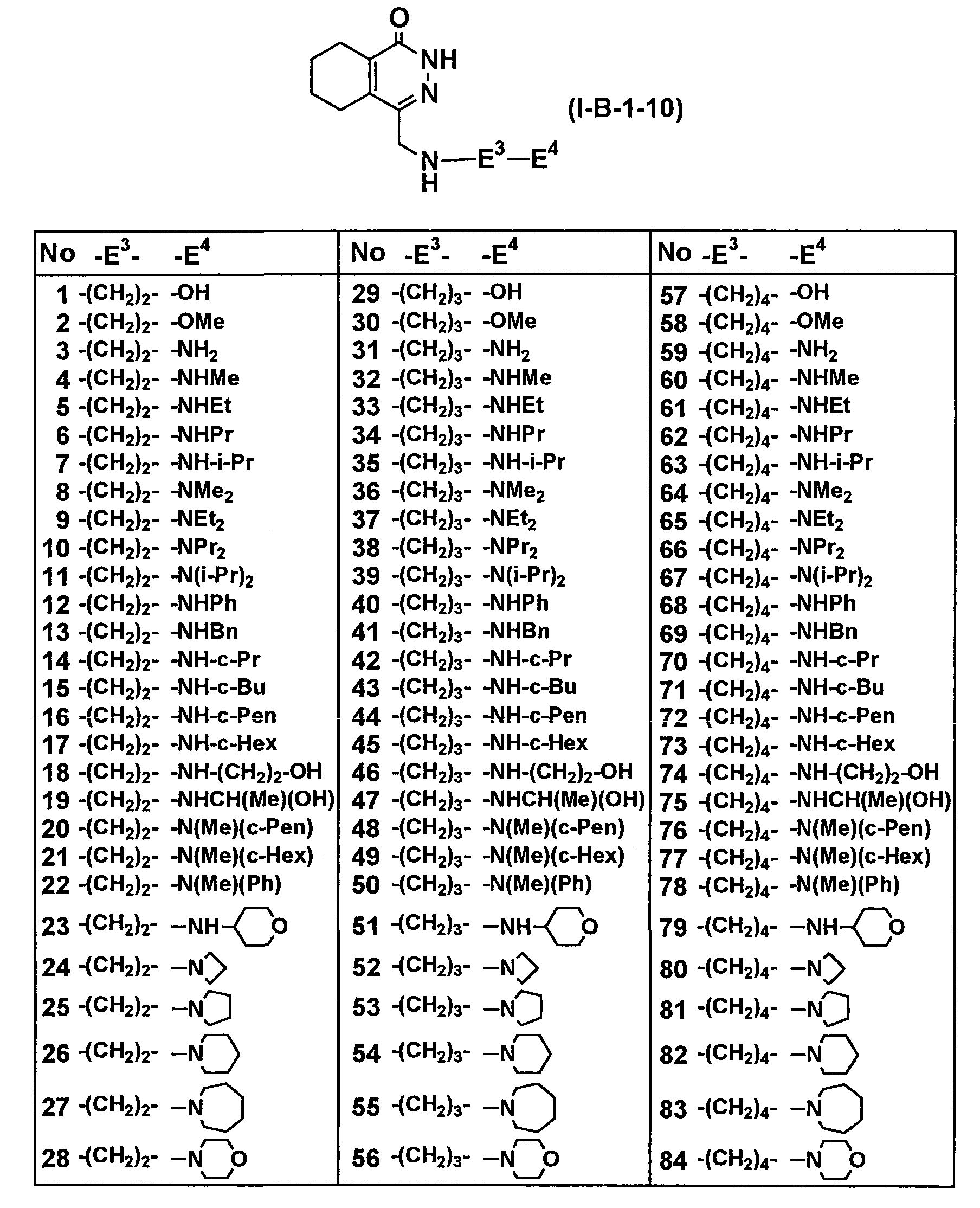
Таблица 65

Таблица 66

Таблица 67

Таблица 68
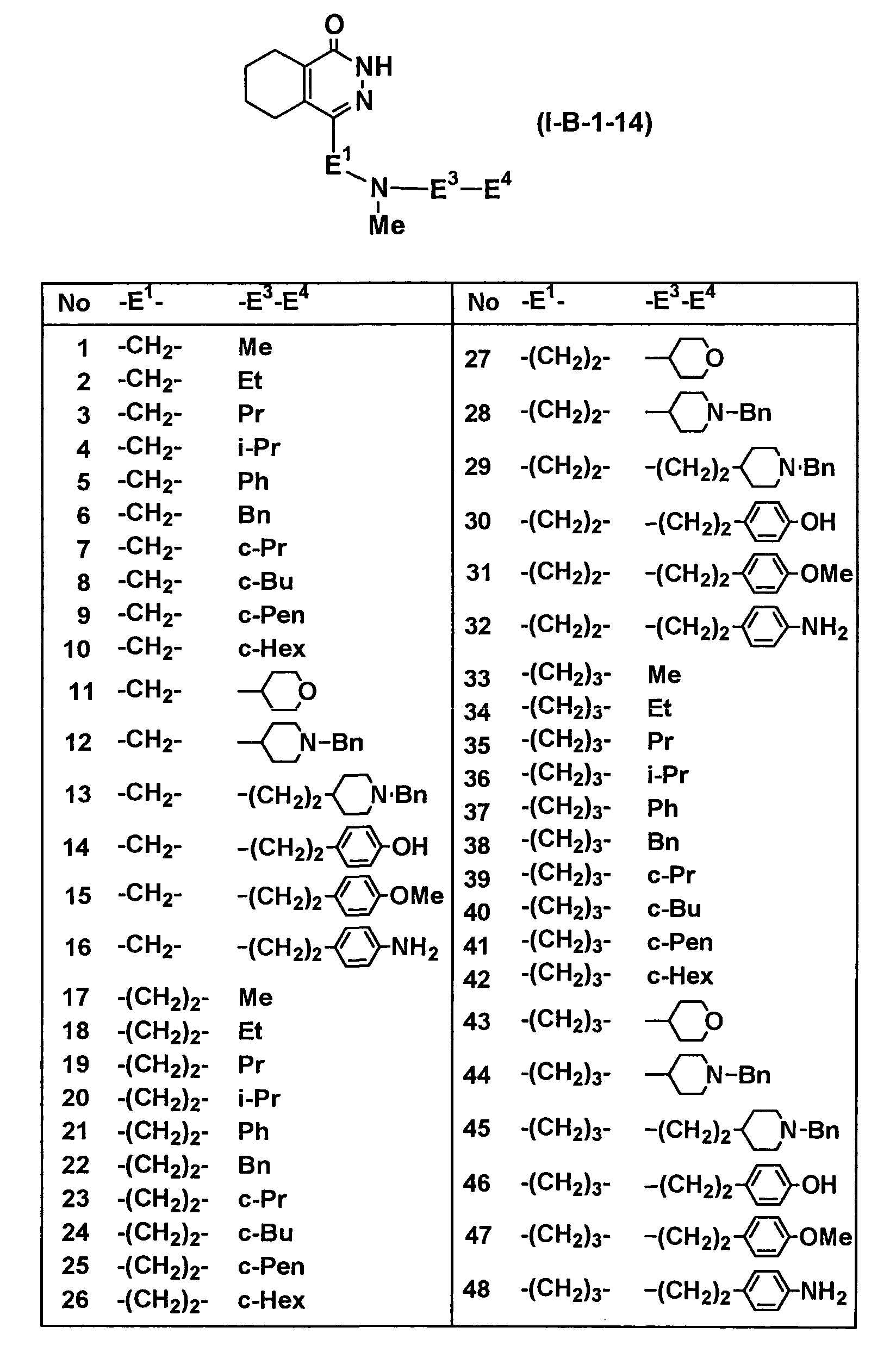
Таблица 69
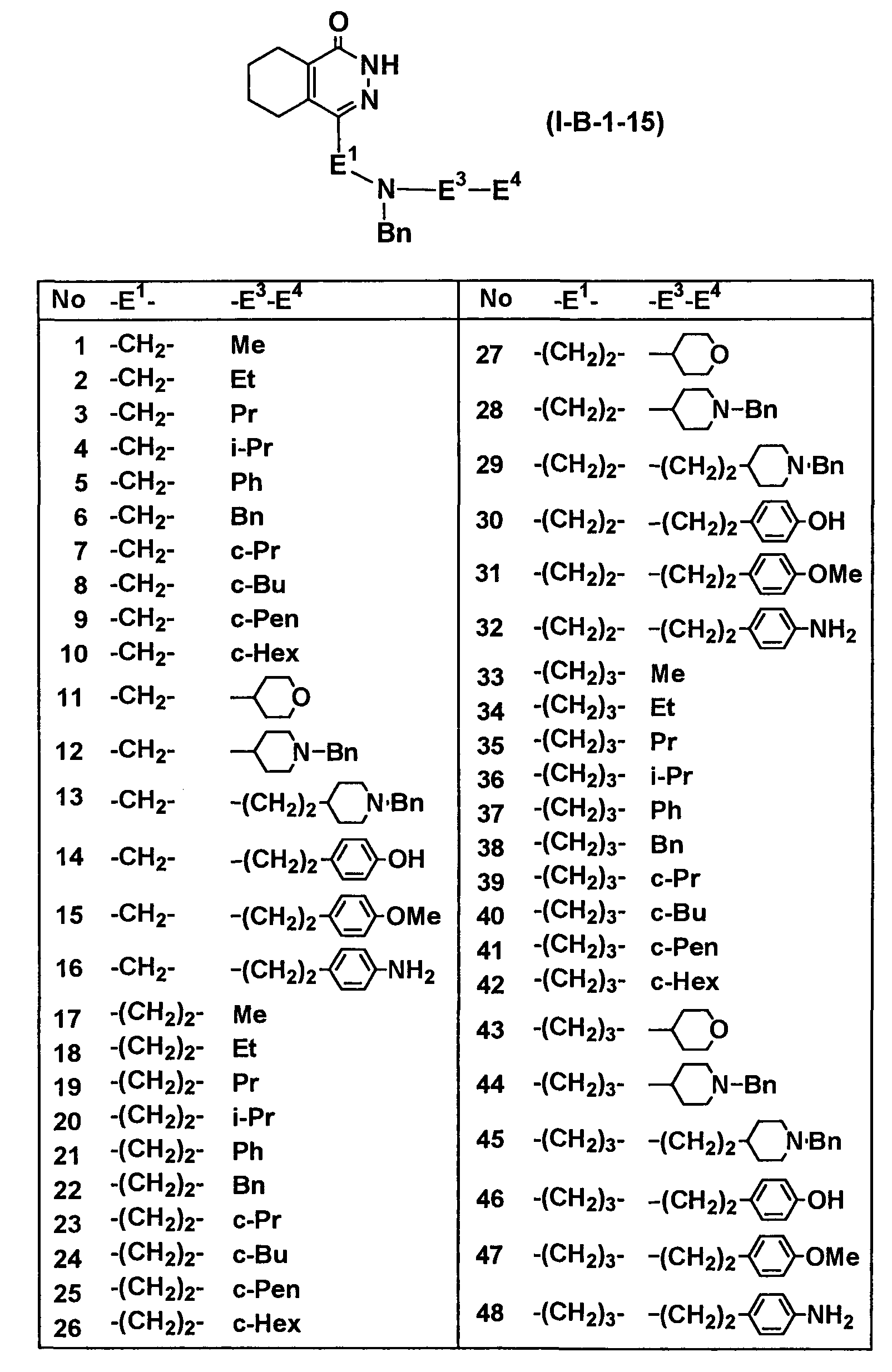
Таблица 70

Таблица 71

Таблица 72

Таблица 73

Таблица 74

Таблица 75

Таблица 76

Таблица 77

Таблица 78

Таблица 79
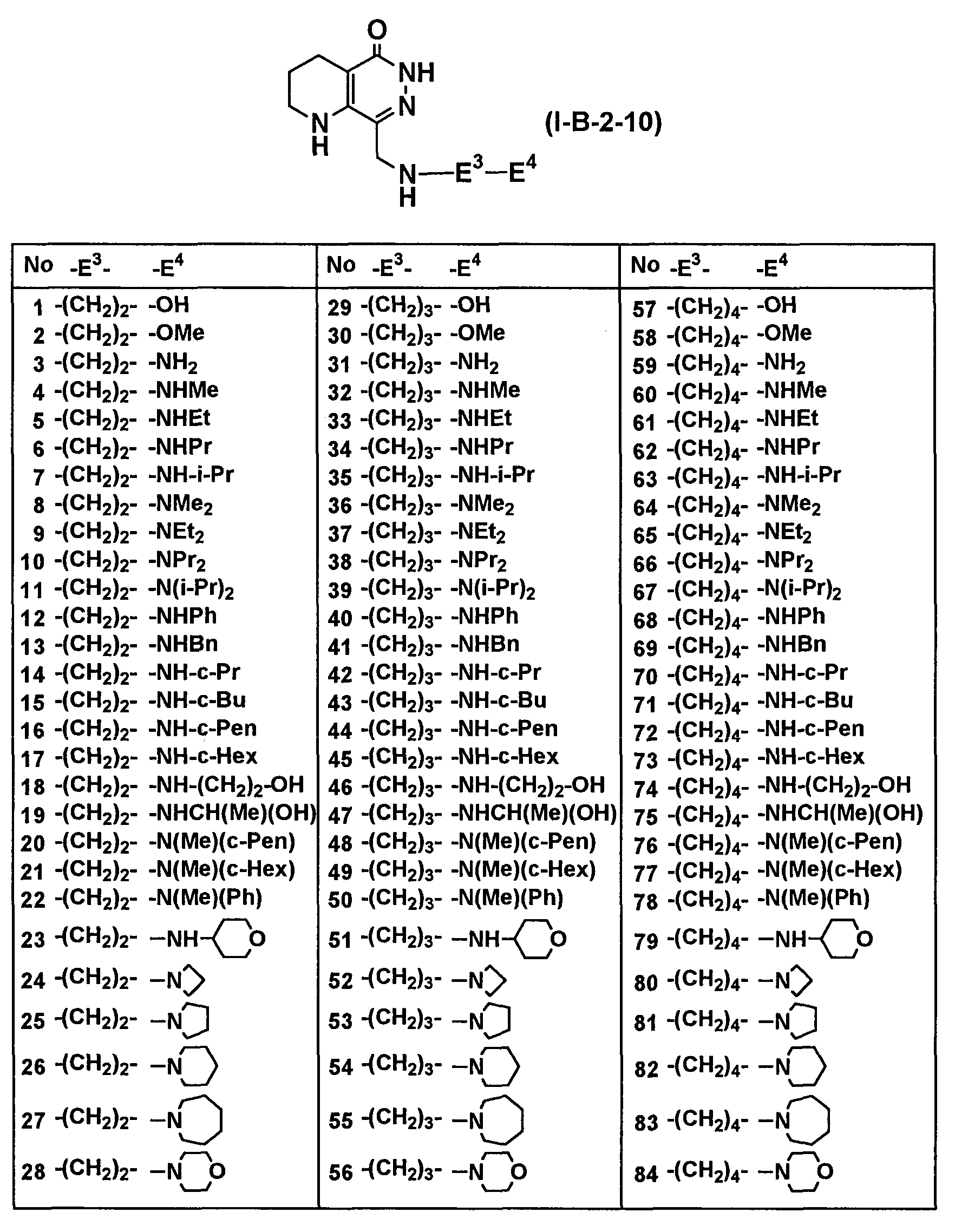
Таблица 80

Таблица 81

Таблица 82

Таблица 83

Таблица 84

Таблица 85

Таблица 86
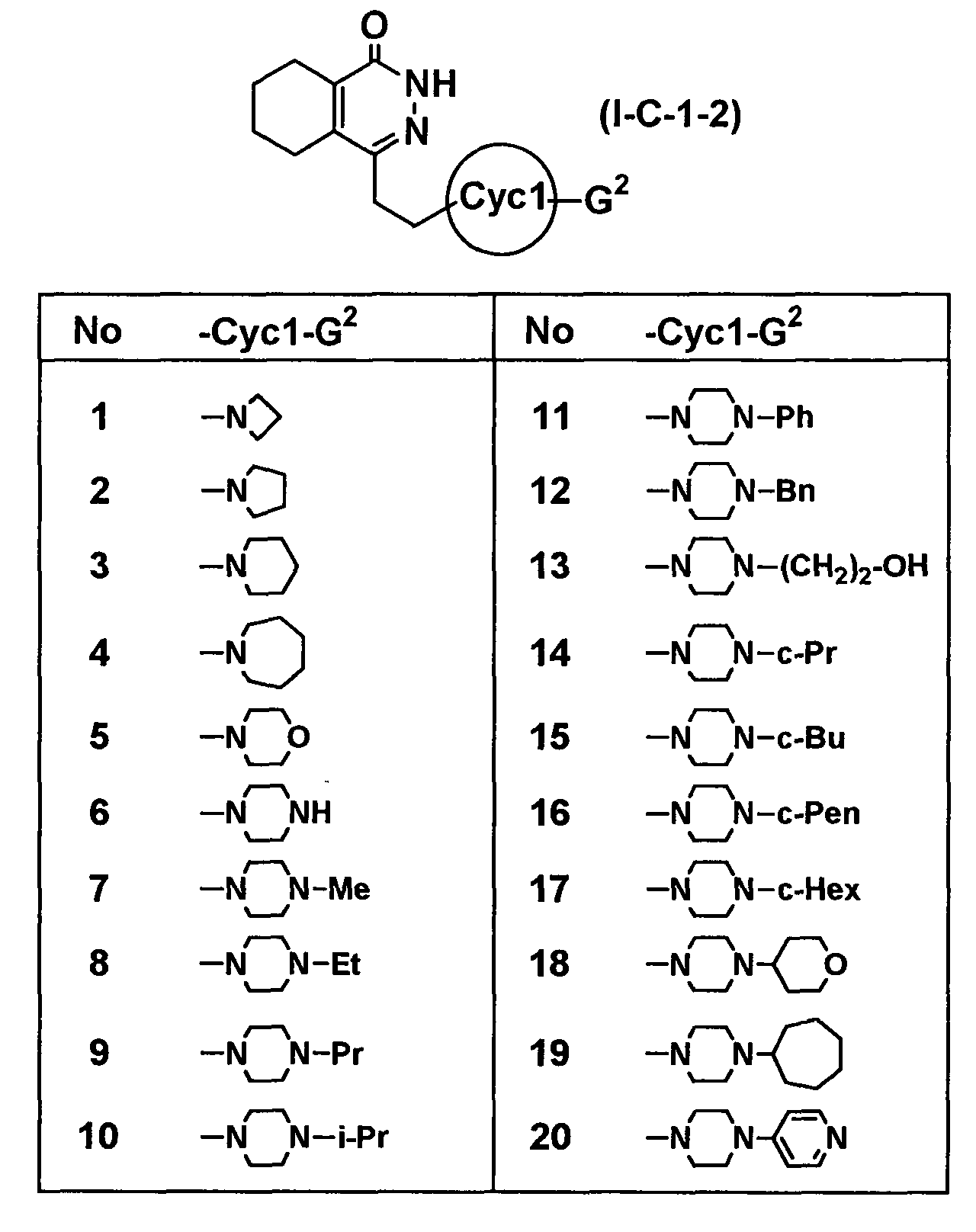
Таблица 87

Таблица 88

Таблица 89

Таблица 90

Способы получения соединения согласно настоящему изобретению:
Соединение, представленное формулой (I), может быть получено следующим способом или способом, описанным в примере.
(1) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в которомA представляет собой A1, и D1 представляет собой -NR6C(O)- или -CH2 -NR6C(O)-, т.е. соединение, представленное формулой (IA-1)

(где D1-1 является -NR6C(O)- или -CH2-NR6C(O)-, а другие символы имеют такие же значения, как описано выше), может быть получено следующим способом.
Соединение, представленное формулой (IA-1), может быть получено амидированием соединений формулы (II)

(где R31 является -NHR6 или -CH2-NHR6, а R1-1, R4-1 и

являются R1, R4 и

соответственно. При условии, что гидроксильная группа или аминогруппа в группе, представленной R1-1, гидроксильная группа или аминогруппа, представленная R4-1, и аминогруппа в группе, представленной

может быть защищенной, если необходимо. Другие символы имеют такие же значения, как определено выше, и соединения, представленного формулой (III)
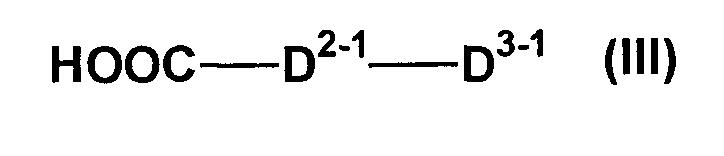
(где D2-1 и D3-1 являются D2 и D3 соответственно. При условии, что аминогруппа в группе, представленной D2-1, и карбокси-, гидрокси-, амино-, амидино- или гуанидиногруппа в D3-1 может быть защищенной, если необходимо), если необходимо, с последующим удалением защитной группы из полученного продукта.
Способ амидирования является известным способом. Например, он включает в себя способ
(1) основанный на применении ацилгалоида,
(2) основанный на применении смешанного ангидрида кислоты,
(3) основанный на использовании конденсирующего реагента.
Указанные способы описывают следующим образом.
(1) Способ, в котором применяют ацилгалоид, может быть выполнен, например, путем взаимодействия карбоновой кислоты с ацилгалоидом (например, оксалилхлоридом или тионилхлоридом и т.д.) в органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) или без растворителя при температуре от -20° С до температуры образования флегмы. И затем, образованное ацилгалоидное производное может быть подвергнуто взаимодействию с амином в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина и т.д.) при температуре от 0 до 40°С. В качестве альтернативы, образованное ацилгалоидное производное может вступать в реакцию, проводимую в органическом растворителе (диоксане, тетрагидрофуране) с использованием водного щелочного раствора (например, бикарбоната натрия, гидроксида натрия) при температуре от 0 до 40°С.
(2) Способ, в котором применяют смешанный ангидрид кислоты, может быть выполнен, например, путем взаимодействия карбоновой кислоты с ацилгалоидом (например, пивалоилхлоридом, тозилхлоридом или мезилхлоридом) или производным кислоты (этиловым эфиром хлоругольной кислоты или изобутиловым эфиром хлоругольной кислоты) в органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) или без растворителя, в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина) при температуре от 0 до 40°С. И затем, полученный смешанный ангидрид кислоты может быть подвергнут взаимодействию с амином в органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагирофуране) при температуре от 0 до 40°C.
(3) Способ, в котором применяют конденсирующий реагент, может быть выполнен, например, путем взаимодействия карбоновой кислоты с амином в органическом растворителе (например, хлороформе, метиленхлориде, диметилформамиде, диэтиловом эфире или тетрагидрофуране) или без растворителя, в присутствии или отсутствие третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина), с использованием конденсирующего реагента (например, 1,3-дициклогексилкарбодиимида (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), 1,1′-карбодиимидазола (CDI), 2-хлор-1-метилпиридиниййодида или циклического ангидрида 1-пропанфосфоновой кислоты (РРА)), в присутствии или отсутствие 1-гидроксибензотиазола (HOBt), при температуре от 0 до 40°С.
Реакция, описанная в пунктах (1), (2) и (3), может быть осуществлена в атмосфере инертного газа (например, аргона, азота) с целью достижения предпочтительного выхода.
Удаление защитной группы может быть осуществлено следующим способом.
Реакция удаления защитной группы для карбоксильной, гидроксильной, амино-, амидино- или гуанидиногруппы является хорошо известной, включая, например, следующие:
(1) щелочной гидролиз,
(2) снятие защиты в кислой среде,
(3) снятие защиты посредством гидрогенолиза,
(4) снятие силильной защиты.
Указанные способы описывают следующим образом.
(1) Снятие защиты посредством щелочного гидролиза может быть осуществлено, например, в органическом растворителе (например, метаноле, тетрагидрофуране, диоксане) при использовании гидроксида щелочного металла (например, гидроксида натрия, гидроксида калия, гидроксида лития), гидроксида щелочноземельного металла (например, гидроксида бария, гидроксида кальция) или карбоната (например, карбоната натрия, карбоната калия), или их водных растворов или их смеси, при температуре от 0 до 40°C.
(2) Снятие защиты в кислых условиях может быть осуществлено, например, в органическом растворителе (например, дихлорметане, хлороформе, диоксане, этилацетате, анизоле) посредством органической кислоты (например, уксусной кислоты, трифторуксусной кислоты, метансульфокислоты, п-толуолсульфокислоты) или посредством неорганической кислоты (например, соляной кислоты, серной кислоты) или посредством их смеси (бромистый водород/уксусная кислота), при температуре от 0 до 100°C.
(3) Снятие защиты посредством гидрогенолиза может быть осуществлено, например, в растворителе (например, типа простого эфира (например, тетрагидрофуране, диоксане, диметоксиэтане, диэтиловом эфире), типа спирта (например, метаноле, этаноле), типа бензола (например, бензоле, толуоле), типа кетона (например, ацетоне, метилэтилкетоне), типа нитрила (например, ацетонитриле), типа амида (например, диметилформамиде), воде, этилацетате, уксусной кислоте, или в смешанном растворителе, состоящем из двух или более из указанных растворителей), в присутствии катализатора (например, палладия-на-угле, палладиевой черни, гидроксида палладия, окиси платины, никеля Ренея), при нормальном давлении или в атмосфере повышенного давления водорода или в присутствии муравьинокислого аммония, при температуре от 0 до 200°C.
(4) Снятие силильной защиты может быть осуществлено, например, в смешиваемом с водой органическом растворителе (например, тетрагидрофуране, ацетонитриле) при использовании тетрабутиламмонийфторида, при температуре от 0 до 40°C.
Группа, защищающая карбоксильную группу, включает в себя, например, метил, этил, трет-бутил и бензил.
Группа, защищающая гидроксильную группу, включает в себя, например, метоксиметил, 2-тетрагидропиранил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, ацетил и бензил.
Группа, защищающая аминогруппу, амидиногруппу и гуанидиногруппу, включает в себя, например, бензилоксикарбонил, трет-бутоксикарбонил, трифторацетил, 9-флуоренилметоксикарбонил и триметилсилил.
Группы, защищающие карбоксильную группу, гидроксильную группу, аминогруппу, амидиногруппу или гуанидиногруппу, могут быть любыми другими группами, отличными от упомянутых выше групп, способными легко и избирательно удаляться, и они не являются специально оговоренными. Например, могут быть использованы защитные группы, описанные в публикации T. W. Greene, Protective Groups in Organic Synthesis, 3rd edition, Wiley, New York, 1999.
Заданные соединения согласно изобретению могут быть легко получены посредством избирательного применения реакции снятия защиты, которая не вызовет особого труда для любого специалиста в данной области.
(2) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A представляет собой A1, а D1 представляет собой -NR6SO2-, т.е. соединение, представленное формулой (IA-2)

(где все символы имеют такие же значения, как описано выше), может быть получено следующим способом.
Соединение, представленное формулой (IA-2), может быть получено путем сульфонамидирования соединений формулы (II-1)

(где все символы имеют такие же значения, как описано выше) и соединения, представленного формулой (IV)

(где R32 является галогеном, а другие символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы у полученного продукта.
Реакция сульфонамидирования является известной. Например, ее осуществляют при температуре от 0 до 40°C в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагирофуране) в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина).
Удаление защитной группы может быть осуществлено указанным выше способом.
(3) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A представляет собой A1, и D1 представляет собой -OC(O)-, т.е., соединение, представленное формулой (IA-3)

(где все символы имеют такие же значения, как описано выше), может быть получено следующим способом.
Соединение, представленное формулой (IA-3), может быть получено этерифицированием соединений формулы (V)

(где все символы имеют такие же значения, как описано выше) указанным выше соединением, представленным формулой (III)
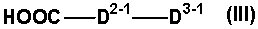
(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы у полученного продукта.
Способ этерификации является известным способом. Например, он включает в себя способ
(1) основанный на применении ацилгалоида,
(2) основанный на применении смешанного ангидрида кислоты,
(3) основанный на применении конденсирующего реагента.
Указанные способы описывают следующим образом.
(1) Способ, основанный на применении ацилгалоида, может быть осуществлен, например, путем взаимодействия карбоновой кислоты с ацилгалоидом (например, оксалилхлоридом или тионилхлоридом и т.д.) в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) или без растворителя при температуре от -20°C до температуры образования флегмы. И затем образованное ацилгалоидное производное может быть подвергнуто взаимодействию со спиртом в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина и т.д.) при температуре от 0 до 40°C.
(2) Способ, основанный на применении смешанного ангидрида кислоты, может быть осуществлен, например, путем взаимодействия карбоновой кислоты с ацилгалоидом (например, пивалоилхлоридом, тозилхлоридом или мезилхлоридом) или производным кислоты (этиловым эфиром хлоругольной кислоты или изобутиловым эфиром хлоругольной кислоты) в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране) или без растворителя, в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина) при температуре от 0 до 40°C. И затем полученный смешанный ангидрид кислоты может быть подвергнут взаимодействию со спиртом в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) при температуре от 0 до 40°C.
(3) Способ с применением конденсирующего реагента может быть осуществлен, например, путем взаимодействия карбоновой кислоты со спиртом в органическом растворителе (например, хлороформе, метиленхлориде, диметилформамиде, диэтиловом эфире или тетрагидрофуране) или без растворителя, в присутствии или отсутствие третичного амина (например, пиридина, триэтиламина, диметиланилина или диметиламинопиридина), с применением конденсирующего реагента (например, 1,3-дициклогексилкарбодиимида (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), 1,1′ -карбодиимидазола (CDI) или 2-хлор-1-метилпиридиниййодида) в присутствии или отсутствие 1-гидроксибензотиазола (HOBt) при температуре от 0 до 40°C.
Реакция, описанная в пунктах (1), (2) и (3), может проводиться в атмосфере инертного газа (например, аргона, азота), чтобы избежать присутствия воды и получить предпочтительный результат.
Удаление защитной группы может быть осуществлено указанным выше способом.
(4) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A представляет собой A1, а D1 представляет собой -CH2-O-, т.е. соединение, представленное формулой (IA-4)

(где все символы имеют такие же значения, как описано выше), может быть получено следующим способом.
Соединение, представленное формулой (IA-4), может быть получено этерификацией соединений формулы (VI-1)

(где все символы имеют такие же значения, как описано выше) и соединения формулы (VII-1)

(где R33 является уходящей группой (атом галогена, мезилокси или тозилокси и т.д.), а другие символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы, этерификацией соединений формулы (VI-2)

(где все символы имеют такие же значения, как описано выше) и соединения формулы (VII-2)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы, или этерификацией указанных выше соединений формулы (VI-1)
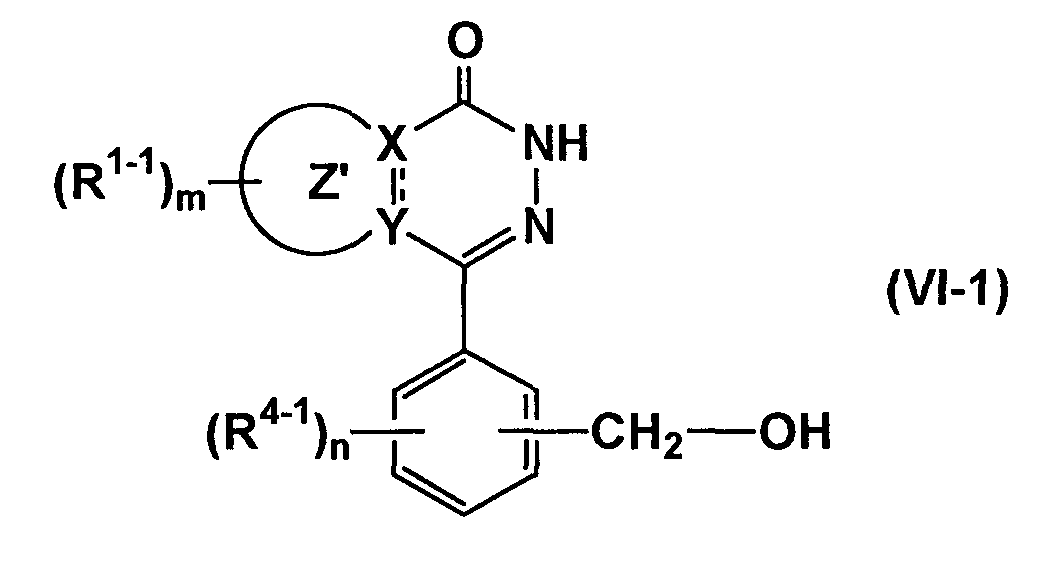
(где все символы имеют такие же значения, как описано выше) и соединения формулы (VII-2)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Реакция этерификации соединения формулы (VI-1) и соединения формулы (VII-1), соединения формулы (VI-2) и соединения формулы (VII-2) является известной. Например, ее выполняют при температуре от 0 до 100°C в инертном органическом растворителе (например, диметилформамиде, диметилсульфоксиде, хлороформе, метиленхлориде, диэтиловом эфире или тетрагидрофуране) в присутствии гидроксида щелочного металла (например, гидроксида натрия, гидроксида калия, гидроксида лития), гидроксида щелочноземельного металла (например, гидроксида бария, гидроксида кальция) или карбоната (например, карбоната натрия, карбоната калия), или их водного раствора, или их смеси.
Указанная реакция этерификации соединения формулы (VI-1) и соединения формулы (VII-2) является известной. Например, реакцию выполняют при температуре от 0 до 60°C путем взаимодействия с соответствующим спиртовым соединением в органическом растворителе (дихлорметане, диэтиловом эфире, тетрагидрофуране, ацетонитриле, бензоле, толуоле, и т.д.) в присутствии азосоединения (диэтилазодикарбоксилата, диизопропилазодикарбоксилата, 1, 1'-(азодикарбонил)дипиперидина, 1,1'-азобис(N,N-диметилформамида), и т.д.) и фосфинового соединения (трифенилфосфина, трибутилфосфина, триметилфосфина, и т.д.).
Реакцию снятия защитной группы можно осуществить способами, описанными выше.
(5) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A представляет собой A1, а D1 представляет собой -NR6-, т.е. соединение, представленное формулой (IA-5)

(где все символы имеют такие же значения, как описано выше), может быть получено следующим способом.
Соединение, представленное формулой (IA-5), может быть получено путем взаимодействия указанного выше соединения формулы (II-1)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (VIII-1)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы, или путем взаимодействия соединения формулы (IX)
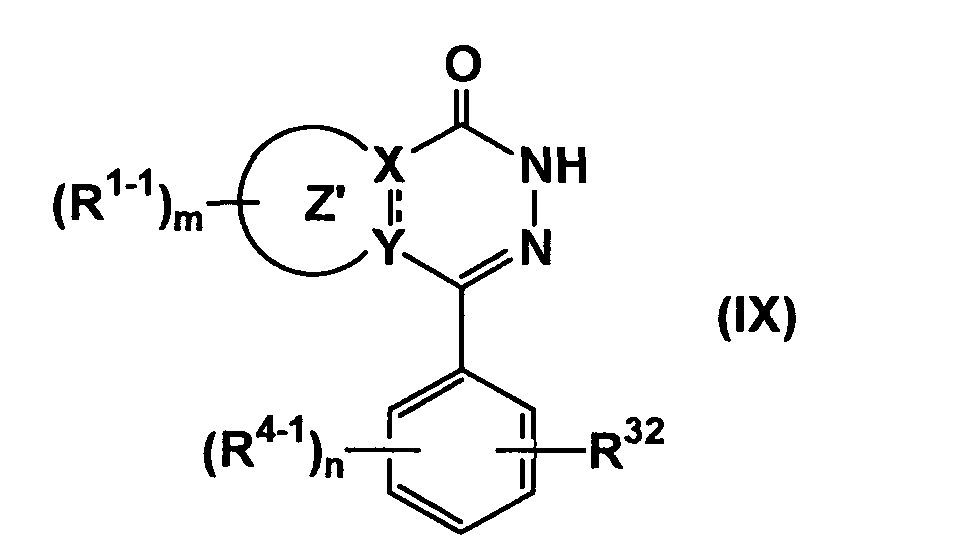
(где все символы имеют такие же значения, как описано выше) с соединением формулы (VIII-2)
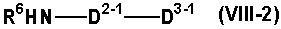
(где все символы имеют такие же значения, как описано выше), с последующим удалением защитной группы.
Указанная реакция взаимодействия соединения формулы (II) с соединением формулы (VIII-1), и соединения формулы (IX) с соединением формулы (VIII-2) является известной. Например, реакцию осуществляют при температуре от 0 до 100°C в инертном органическом растворителе (например, диметилформамиде, диметилсульфоксиде, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране или ацетонитриле) в присутствии или отсутствие основания (например, триэтиламина, пиридина).
Реакция снятия защитной группы может быть осуществлена способами, описанными выше.
Среди соединений согласно настоящему изобретению, представленных формулой (IA-5), соединение, в котором D2 представляет собой C1-8 алкилен, C2-8 алкенилен, -(C1-4 алкилен)-O-(C1-4 алкилен)-, -(C1-4 алкилен)-S-(C1-4 алкилен)-, -(C1-4 алкилен)-NR8-(C1-4 алкилен)-, -(C1-8 алкилен)-(Cyc2)- или -(C1-4 алкилен)-(Cyc2)-(C1-4 алкилен)-, т.е. соединение, представленное формулой (IA-5-1)

(где D2' представляет собой C1-8 алкилен, C2-8 алкенилен, -(C1-4 алкилен)-O-(C1-4 алкилен)-, -(C1-4 алкилен)-S-(C1-4 алкилен)-, -(C1-4 алкилен)-NR8-(C1-4 алкилен)-, -(C1-8 алкилен)-(Cyc2)- или -(C1-4 алкилен)-(Cyc2)-(C1-4 алкилен)-, а другие символы имеют такие же значения, как описано выше), может быть получено путем восстановительного аминирования указанного выше соединения формулы (II-1)

(где все символы имеют такие же значения, как описано выше), и соединения формулы (VIII-3)

(где D2'' представляет собой C1-7 алкилен, C2-7 алкенилен, -(C1-3 алкилен)-O-(C1-4 алкилен)-, -(C1-3 алкилен)-S-(C1-4 алкилен)-, -(C1-3 алкилен)-NR8-(C1-4 алкилен)-, -(C1-7 алкилен)-(Cyc2)- или -(C1-3 алкилен)-(Cyc2)-(C1-4 алкилен)-, а другие символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Реакция восстановительного аминирования является хорошо известной реакцией. Например, данную реакцию можно осуществить в органическом растворителе (например, метаноле, этаноле) в присутствии восстановителя (например, цианоборогидрида натрия, борогидрида натрия, триацетоксиборогидрида натрия) и, если необходимо, в присутствии кислоты (например, уксусной кислоты, хлористого водорода) при температуре от -20 до 60°C.
Удаление защитной группы может быть осуществлено способами, описанными выше.
(6) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A1 и D1 является -CH2-NR6-, т.е. соединение формулы (IA-6)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение, представленное формулой (IA-6), может быть получено путем взаимодействия соединения формулы (X)

(где все символы имеют такие же значения, как описано выше), с указанным выше соединением формулы (VIII-1)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы, или путем восстановительного аминирования соединения формулы (XI)

(где все символы имеют такие же значения, как описано выше), указанным выше соединением формулы (VIII-2)
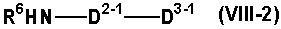
(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Реакция взаимодействия соединения формулы (X) и соединения формулы (VIII-1) может быть осуществлена таким же способом, как описанная выше реакция взаимодействия соединения формулы (IX) с соединением формулы (VIII-2).
Реакция взаимодействия соединения формулы (XI) с соединением формулы (VIII-2) может быть осуществлена таким же способом, как описанная выше реакция взаимодействия соединения формулы (II-1) с соединением формулы (VIII-3).
Удаление защитной группы может быть осуществлено способами, описанными выше.
(7) Среди соединений, представленных формулой (I), соединение, в котором A является A1 и D1 является -NR6C(O)NR7-, т.е. соединение (IA-7)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение, представленное формулой (IA-7), может быть получено путем взаимодействия указанного выше соединения формулы (II-1)

(где все символы имеют такие же значения, как описано выше), с соединением формулы (XII)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Она может быть осуществлена в органическом растворителе (например, тетрагидрофуране, метиленхлориде, диэтиловом эфире) при температуре от 0 до 100°C.
Удаление защитной группы может быть осуществлено способами, описанными выше.
(8) Среди соединений, представленных формулой (I), соединение, в котором A является A1 и D1 является -NR6C(S)NR7-, т.е. соединение формулы (IA-8)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение, представленное формулой (IA-8), может быть получено путем взаимодействия указанного выше соединения формулы (II-1)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (XIII)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Она может быть осуществлена в органическом растворителе (тетрагидрофуране, метиленхлориде, диэтиловом эфире) при температуре от 0 до 100°C.
Удаление защитной группы может быть выполнено способами, описанными выше.
(9) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A1 и D1 является -NR6C(O)O-, т.е. соединение формулы (IA-9)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение, представленное формулой (IA-9), может быть получено взаимодействием указанного выше соединения формулы (II-1)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (XIV)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Она может быть проведена в органическом растворителе (например, тетрагидрофуране, метиленхлориде, диэтиловом эфире) при температуре от -78 до 40°C.
Удаление защитной группы может быть осуществлено способами, описанными выше.
(10) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A1 и D1 является -NR6C(S)-, т.е. соединение формулы (IA-10)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение, представленное формулой (IA-10), может быть получено путем тиокарбонилирования соединения формулы (XV)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Она может быть проведена в органическом растворителе (например, диоксане, бензоле, толуоле, ксилоле, тетрагидрофуране) с использованием реагента Лавессона (2, 4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфида) при температуре от 20 до 150°C.
Удаление защитной группы может быть осуществлено способами, описанными выше.
(11) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A1 и D1 является -NR6C(=NR7 )-, т.е. соединение формулы (IA-11)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IA-11) может быть получено взаимодействием указанного выше соединения формулы (II-1)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (XVI)

(где R34 является C1-4 алкилом, а другие символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Например, она может быть проведена в органическом растворителе (например, метаноле, этаноле) при температуре от 0 до 50°C.
Удаление защитной группы может быть осуществлено способами, описанными выше.
(12) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A1 и D3 представляет собой -NR9R10 или кольцо с гетероатомом, представленное

(среди Cyc2, кольцо с гетероатомом является кольцом, имеющим, по крайней мере, один атом азота, который связывается с D2), т.е. соединение формулы (IA-12)

(где D3-2 является -NR9R10 или кольцом с гетероатомом, представленным
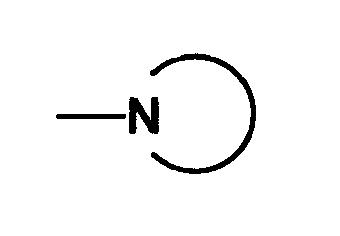
(среди Cyc2, кольцо с гетероатомом является кольцом, имеющим, по крайней мере, один атом азота, который связывается с D2, и другие символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение, представленное формулой (IA-12), может быть получено взаимодействием соединения формулы (XVII)
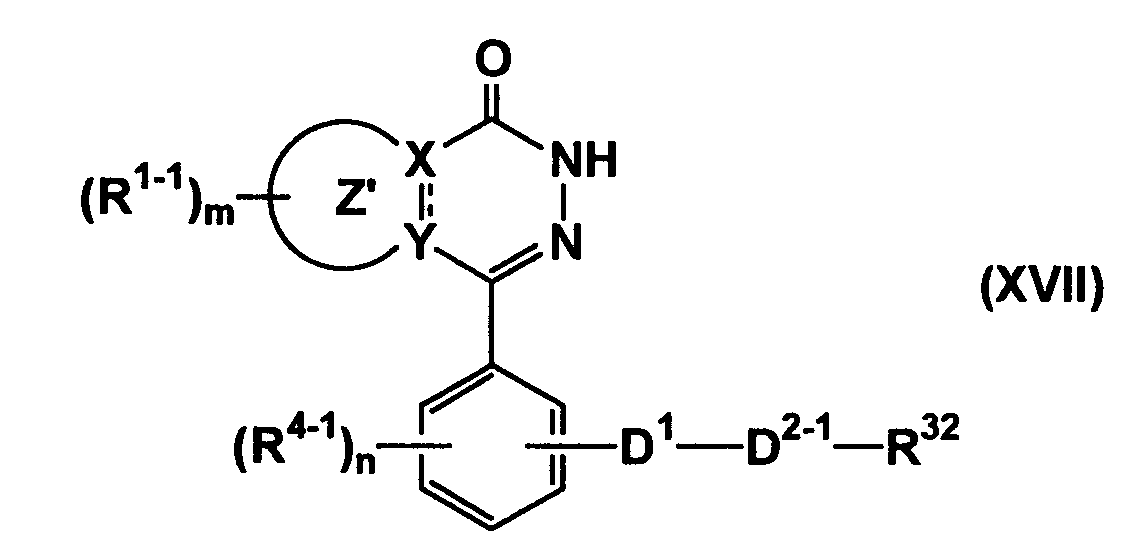
(где все символы имеют такие же значения, как описано выше) с соединением формулы (XVIII)
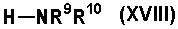
(где все символы имеют такие же значения, как описано выше) или соединением формулы (XIX)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Взаимодействие соединения формулы (XVII) с соединением формулы (XVIII) или (XIX) может быть осуществлено таким же способом, которым проведено описанное выше взаимодействие соединения формулы (IX) с соединением формулы (VIII-2).
Удаление защитной группы может быть осуществлено способами, описанными выше.
Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A1и E2 является -C(O)NR24, т.е. соединение формулы (IB-1)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IB-1) может быть получено амидированием соединения формулы (XX)

(где все символы имеют такие же значения, как описано выше) и соединения формулы (XXI)

(где E4-1 является E4. При условии, что гидроксил, амино или карбоксил в группе, представленной E4-1, может быть защищенным, если необходимо. Другие символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Амидирование и удаление защитной группы может быть осуществлено способами, описанными выше.
(14) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A2 и E2 является -NR24C(O)-, т.е. соединение формулы (IB-2)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IB-2) может быть получено реакцией амидирования соединения формулы (XXII)

(где все символы имеют такие же значения, как описано выше) и соединения формулы (XXIII)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Амидирование и удаление защитной группы может быть осуществлено способами, описанными выше.
(15) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A2 и E2 является -NR24-, т.е. соединение формулы (IB-3)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IB-3) может быть получено путем взаимодействия соединения формулы (XXIV)

(где все символы имеют такие же значения, как описано выше) с указанным выше соединением формулы (XXI)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Взаимодействие соединения формулы (XXIV) и соединения формулы (XXI) может быть проведено таким же способом, которым было осуществлено описанное выше взаимодействие соединения формулы (IX) и соединения формулы (VIII-2).
Удаление защитной группы может быть осуществлено способами, описанными выше.
(16) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A2 и E2 является -C(O)O-, т.е. соединение формулы (IB-4)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IB-4) может быть получено этерификацией соединения формулы (XX)

(где все символы имеют такие же значения, как описано выше) соединением формулы (XXV)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Этерификацию и удаление защитной группы можно осуществлять способами, описанными выше.
(17) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A2 и E2 является -S-, т.е. соединение формулы (IB-5)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IB-5) может быть получено путем взаимодействия соединения формулы (XXVI)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (XXVII)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Например, она может быть проведена в инертном органическом растворителе (например, диметилформамиде, диметилсульфоксиде, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране, ацетонитриле) в присутствии или отсутствие основания (например, триэтиламина, пиридина) при температуре от 0 до 100°C.
Удаление защитной группы может быть осуществлено способами, описанными выше.
(18) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A2 и E4 является -NR25R26 или кольцом с гетероатомом, представленным

(кольцо с гетероатомом является кольцом, содержащим, по крайней мере, один атом азота (атом азота связывается с E3) в Cyc5), т.е. соединение формулы (IB-6)

(где E4-2 является -NR25R26 или кольцом с гетероатомом, представленным

(кольцо с гетероатомом является кольцом, содержащим, по крайней мере, один атом азота (атом азота связывается с E3) в Cyc5), а другие символы имеют такие же значения, как описано выше), может быть получено следующим способом.
Соединение формулы (IB-6) может быть получено путем взаимодействия соединения формулы (XXVIII)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (XXIX)

(где все символы имеют такие же значения, как описано выше) или соединением формулы (XXX)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Взаимодействие соединения формулы (XXVIII) с соединением формулы (XXIX) или (XXX) может быть проведено таким же способом, которым было осуществлено описанное выше взаимодействие соединения формулы (IX) и соединения формулы (VIII-2).
Удаление защитной группы может быть осуществлено способами, описанными выше.
(19) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A3, т.е. соединение формулы (IC-1)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IC-1) может быть получено путем взаимодействия соединения формулы (XXXI)

(где G1-1 представляет собой связь или C1-7 алкилен, Cyc1' и G2-1 являются Cyc1 и G2 соответственно. При условии, что амино в группе, представленной Cyc1, и гидрокси и амино в группе, представленной G2-1, могут быть защищены, если необходимо. Другие символы имеют такие же значения, как описано выше) с гидразином или его солью (например, гидридом, хлоридом), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Например, она может быть проведена в органическом растворителе (например, метаноле, этаноле, пропаноле, изопропаноле, бутаноле, уксусной кислоте, тетрагидрофуране) при температуре от 50°C до температуры образования флегмы.
Удаление защитной группы может быть осуществлено способами, описанными выше.
Кроме того, среди соединений согласно настоящему изобретению, представленных формулой (IC-1), соединение, в котором Cyc1 является кольцом с гетероатомом, представленным
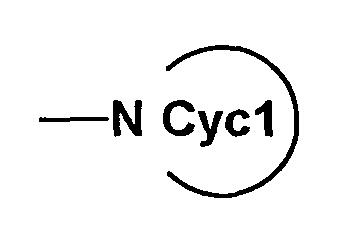
(кольцо с гетероатомом является кольцом, содержащим, по крайней мере, один атом азота (атом азота связывается с G1) в Cyc1), т.е. соединение формулы (IC-1-1)

(где

является кольцом с гетероатомом, содержащим, по крайней мере, один атом азота (атом азота связывается с G1) в Cyc1, а другие символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (IC-1-1) может быть получено путем взаимодействия соединения формулы (XXXII)
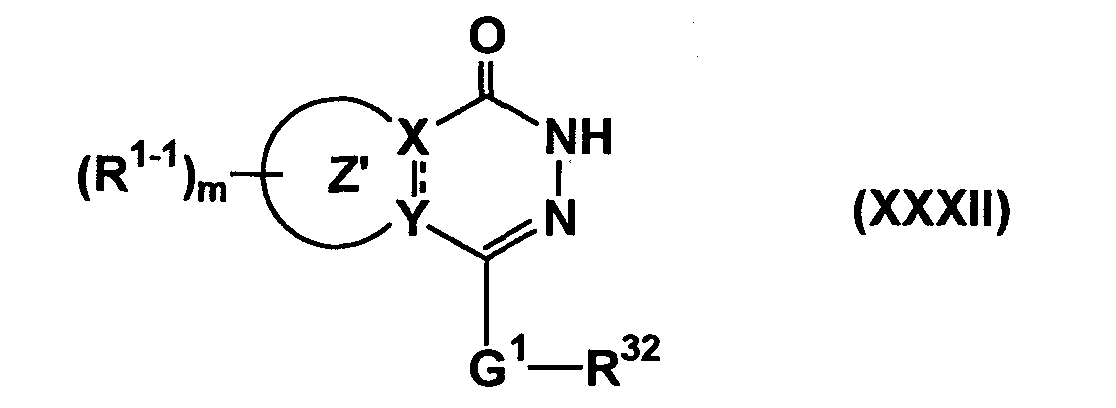
(где все символы имеют такие же значения, как описано выше) с соединением формулы (XXXIII)

(где все символы имеют такие же значения, как описано выше), если необходимо, с последующим удалением защитной группы.
Взаимодействие соединения формулы (XXXII) и соединения формулы (XXXIII) может быть осуществлено таким же способом, которым было проведено описанное выше взаимодействие соединения формулы (IX) и соединения формулы (VIII-2).
Удаление защитной группы может быть осуществлено способами, описанными выше.
(20) Среди соединений согласно настоящему изобретению, представленных формулой (I), соединение, в котором A является A4 или A5, т.е. соединение формулы (ID-1)
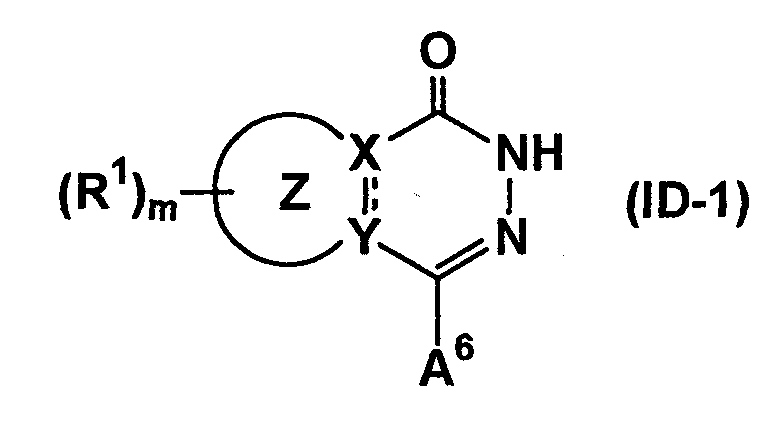
(где A6 является A4 или A5, а другие символы имеют такие же значения, как описано выше) может быть получено следующими способами a) или b).
a) Соединение формулы (ID-1) может быть получено путем взаимодействия соединения формулы (XXXIV-1)

(где R35 является C1-8 алкилом и A6-1 является A6. При условии, что гидроксигруппа или аминогруппа в группе, представленной A6-1, может быть защищена, если необходимо. Другие символы имеют такие же значения, как описано выше) или соединения формулы (XXXIV-2)

(где все символы имеют такие же значения, как описано выше) с гидразином или его солью (например, гидридом, хлоридом), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Например, она может быть проведена в органическом растворителе (например, метаноле, этаноле, пропаноле, изопропаноле, бутаноле, уксусной кислоте, тетрагидрофуране) при температуре от 50°C до температуры образования флегмы.
Удаление защитной группы может быть осуществлено способами, описанными выше.
b) Соединение формулы (ID-1) может быть получено путем взаимодействия соединения формулы (XXXV)

(где все символы имеют такие же значения, как описано выше) с гидразином или его солью (например, гидридом, хлоридом), если необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Например, она может быть проведена в органическом растворителе (например, метаноле, этаноле, пропаноле, изопропаноле, бутаноле, уксусной кислоте, тетрагидрофуране) при температуре от 50°C до температуры образования флегмы.
Удаление защитной группы может быть осуществлено способами, описанными выше.
Кроме того, среди соединений формулы (ID-1), соединение, в котором X является N,

является одинарной связью, т.е. соединение формулы (ID-1-1)

(где все символы имеют такие же значения, как описано выше) может быть получено следующим способом.
Соединение формулы (ID-1-1) может быть получено путем взаимодействия соединения формулы (XXXVI)

(где все символы имеют такие же значения, как описано выше) с соединением формулы (XXVII)

(где R35 имеет такое же значение, как описано выше), если необходимо, с последующим удалением защитной группы.
Реакция может быть осуществлена, например, в органическом растворителе (например, толуоле, тетрагидрофуране, хлороформе, метиленхлориде) в присутствии или отсутствие катализатора (например, p-толуолсульфокислоты, пиридина) при температуре от 50°C до температуры образования флегмы.
Удаление защитной группы может быть осуществлено способами, описанными выше.
Соединения, представленные формулами (II), (II-1), (III), (IV), (V), (VI-1), (VI-2), (VII-1), (VII-2), (VIII-1), (VIII-2), (VIII-3), (IX), (X), (XI), (XII), (XIII), (XIV), (XV), (XVI), (XVII), (XVIII), (XIX), (XX), (XXI), (XXII), (XXIII), (XXIV), (XXV), (XXVI), (XXVII), (XXVIII), (XXIX), (XXX), (XXXI), (XXXII), (XXXIII), (XXXIV-1), (XXXIV-2), (XXXV), (XXXVI) и (XXXVII), являются известными соединениями или могут быть получены известными способами, описанными в примерах.
Например, соединения формул (II), (II-1), (V), (VI-1), (VI-2), (IX), (X), (XI), (XX), (XXII), (XXIV), (XXVI), (XXXI), (XXXIV-1), (XXXIV-2), (XXXV) и (XXXVI) могут быть получены способом, представленным в виде реакционной схемы 1, 2, 3 и 4.
В каждой реакционной схеме R36 является -NHR6, -CH2-NHR6, -OH, -CH2-OH, -CH2-R33 или атомом галогена. Условием проведения реакций является то, что гидроксигруппа и аминогруппа в группе, представленной R36, может быть защищена, если необходимо. R37 представляет собой защитную группу аминогруппы, R38 является -NHR6, -CH2-NHR6, -OH, -CH2-OH, -CH2-R33 или атомом галогена, BOP представляет собой бензотриазол-1-илокси-трис(диметиламино)фосфонийгексафторфосфат, Me является метилом, Et является этилом, E1-1 представляет собой связь или C1-3 алкилен, Ph является фенилом, TBAF представляет собой тетрабутиламмонийфторид, TMSN3 является триметилсилилазидом, R39 является COOH, -NHR24, атомом галогена или -SCOCH3. Условием проведения реакции является то, что аминогруппа или карбоксигруппа в группе, представленной R39, может быть защищена, если необходимо. R40 является COOH, -NHR24, атомом галогена или -SCOCH3, а другие символы имеют такие же значения, как описано выше. Для любого специалиста было бы понятно, что могли бы быть использованы соединения, представленные формулами (XXXIX) и (XXXXXV), где хлор заменен бромом.
Реакционная схема 1

Реакционная схема 2



В реакционных схемах 1, 2, 3 и 4 соединения, применяемые в качестве исходных материалов, являются известными соединениями или могут быть легко получены известными способами.
При проведении каждой описанной в тексте реакции реакционный продукт может быть очищен обычными способами очистки, такими как дистилляция при нормальном давлении или пониженном давлении, высокоэффективная жидкостная хроматография, тонкослойная хроматография или колоночная хроматография с использованием силикагеля или кремнекислого магния, промывка и перекристаллизация. Очистка может быть осуществлена при проведении каждой реакции или по окончании нескольких реакций.
Фармакологические активности:
Следующие экспериментальные данные подтвердили, что соединения согласно настоящему изобретению формулы (I) проявляют ингибиторную активность по отношению к полимеразе PARP.
1) Ферментный анализ in vitro
Методы
Описанную ниже процедуру выполняли в 96-луночном планшете при комнатной температуре. В конечном объеме 80 мкл реакционная смесь содержала каждая 10 мкл 500 мМ трис/HCl (pH 8,0, WAKO), 100 мМ MgCl2, 50 мМ дитиотреитола (Sigma), 1 мг/мл активированной ДНК и 1 мМ NAD (содержащий3H-NAD). Тестируемое соединение в количестве 10 мкл добавляли к реакционной смеси и реакцию начинали путем добавления 10 мкл 0,1 Е/мкл PARP (TREVIGEN). Реакцию останавливали через 10 минут путем добавления 100 мкл 20% трихлоруксусной кислоты. Поли(ADP-рибозу), которая является продуктом реакции, собирали на стекловолокнистом фильтре (GF/C, PACKARD). Радиоактивность измеряли посредством счетчика (PACKARD). Ингибиторную активность соединения выражали как концентрацию ингибитора, производящую 50% ингибирования, рассчитанную от 100% активности контроля (дистиллированная вода). Результаты представлены в таблице 91.
2) Модель ишемического-реперфузионного повреждения (головной мозг и сердце)
Модель ишемии головного мозга и сердца вследствие повреждения при реперфузии получали согласно процедурам, описанным ранее (Jpn. J. Stroke, 8, 1 (1986), Stroke, 27, 1624-1628 (1996) и Eur. J. Pharmacol., 270, 45 (1994)). Соединения согласно настоящему изобретению оказались эффективными по отношению к данным заболеваниям.
Токсичность:
Токсичность соединений согласно настоящему изобретению, представленных формулой (I), является очень низкой (например, в результате введения крысам соединений согласно настоящему изобретению, данные соединения не воздействовали на кровообращение, исследованное по таким характеристикам, как кровяное давление, электрокардиограмма и частота сердечных сокращений), и поэтому, соединения можно рассматривать как безопасные для фармацевтического применения.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
Применение для фармацевтики:
Поскольку соединение согласно настоящему изобретению, представленное формулой (I), проявляет ингибиторную активность по отношению к полимеразе PARP, оно является пригодным для профилактики и/или лечения ишемических болезней (инфаркт мозга, инфаркт миокарда, травма вследствие реперфузии и послеоперационная травма и т.д.), воспалительных заболеваний (воспалительное кишечное заболевание, рассеянный склероз, артрит или поражение легкого и т.д.), нейродегенеративных расстройств (экстрапирамидное заболевание, болезнь Паркинсона, болезнь Альцгеймера, мышечная дистрофия или стеноз спинномозгового канала поясничного отдела позвоночника и т.д.), глаукомы, диабета, диабетического осложнения, удара, травмы головы, повреждения спинного мозга, почечной недостаточности или гипералгезии и т.д. Кроме того, соединение применимо в качестве лекарственного средства против ретровирусов, такого как лекарственный препарат против ВИЧ, сенсибилизирующего вещества для противораковой терапии или иммунодепрессанта.
Соединение, представленное формулой (I), или его фармацевтически приемлемая соль может быть введено в комбинации с другими фармацевтическими препаратами, чтобы достичь следующих результатов:
1) дополнить или повысить профилактическое и/или лечебное действие соединения, которое комбинируют;
2) улучшить динамические параметры/всасывающие свойства соединения, которое комбинируют, и снизить дозу соединения; и/или
исключить побочный эффект соединения, которое комбинируют.
Соединение, представленное формулой (I), и другие фармацевтические препараты могут быть введены в виде композиции, содержащей указанные компоненты, включенные в один препарат, или могут быть введены в виде отдельных препаратов. В случае, когда указанные фармацевтические препараты вводят в виде отдельных препаратов, они могут быть введены одновременно или в разное время. В последнем случае, соединение, представленное формулой (I), может быть введено до введения других фармацевтических препаратов. В качестве альтернативы, другие фармацевтические препараты могут быть введены до введения соединения, представленного формулой (I). Способ введения данных фармацевтических препаратов может быть одинаковым или различным.
Заболевания, на которые вышеупомянутые комбинированные препараты оказывают профилактическое и/или лечебное действие, специально не ограничивают, но они могут быть такими, для которых профилактический и/или лечебный эффект соединения, представленного формулой (I), дополняется и/или усиливается.
Примеры других фармацевтических препаратов, применяемых для дополнения и/или усиления профилактического и/или лечебного действия соединения, представленного формулой (I), применяемых для ишемических болезней, включают в себя препарат, устраняющий радикалы, модулятор астроцитов, антагонист N-метил-D-аспартата (NMDA), антагонист альфа-амино-3-гидрокси-5-метилизоксазол-4-пропионата (АМРА), антитромботическое средство, тромболитическое средство, иммуносупрессорное средство, ингибитор адгезии молекул с клетками, ингибитор синтазы окиси азота (NOS), нейротрофический фактор и ингибитор интерлейкина-8 и т.д.
Примеры других фармацевтических препаратов для дополнения и/или усиления профилактического и/или лечебного действия соединения, представленного формулой (I), применяемых в случае стеноза спинномозгового канала поясничного отдела позвоночника, включают в себя ингибитор синтазы окиси азота (NOS), ингибитор альдозоредуктазы (AR), препарат, поглотитель радикалов, антагонист N-метил-D-аспартата (NDMA), антагонист альфа-амино-3-гидрокси-5-метилизоксазол-4-пропионата (АМРА), нейротрофический фактор и ингибитор интерлейкина-8 и т.д.
Примеры препарата, устраняющего радикалы, включают в себя, например, эдаравон и эбселен (DR-3305) и т.д.
Примеры модулятора астроцитов включают в себя, например, ONO-2506 и т.д.
Примеры антитромботического средства включают в себя, например, озагрел натрия, аргатробан и аспирин и т.д.
Примеры тромболитического средства включают в себя, например, активатор плазминогена тканевого типа (t-PA), урокиназу и гепарин и т.д.
Примеры иммуносупрессорного средства включают в себя, например, циклоспорин А, циклофосфамид и такролимус и т.д.
Примеры ингибитора NOS включают в себя, например, L-NMMA и ONO-1714 и т.д.
Примеры ингибитора AR включают в себя, например, эпалрестат, зенарестат, фидарестат, зополрестат и AS-3201 и т.д.
Весовое соотношение между соединением, представленным формулой (I), и другими фармацевтическими препаратами специально не ограничивают.
Произвольно в комбинации может быть введено два или более других фармацевтических препаратов.
Примеры других фармацевтических препаратов, применяемых для дополнения и/или усиления профилактического и/или лечебного эффекта соединения, представленного формулой (I), включают в себя не только те соединения, которые выявлены до настоящего времени, но также и такие соединения, которые будут найдены на основе вышеупомянутого механизма.
Соединения согласно настоящему изобретению, представленного формулой (I), или его фармацевтически приемлемой соли, или соединения, представленного формулой (I), в комбинации с другими фармацевтическими препаратами обычно вводят человеку системно или местно пероральным или парентеральным путем.
Дозы, которые следует вводить, определяют в зависимости, например, от возраста, веса тела, симптома, желаемого терапевтического эффекта, способа введения и продолжительности лечения. Для одного взрослого человека дозы обычно составляют от 1 до 1000 мг при пероральном введении, вплоть до нескольких раз в день, и от 1 до 100 мг при парентеральном введении (предпочтительно внутривенное введение), вплоть до нескольких раз в день, или непрерывном введении от 1 до 24 часов в день через вену.
Как упомянуто выше, используемые дозы зависят от различных условий. Поэтому, имеются случаи, при которых используют дозы, являющиеся ниже или выше диапазонов доз, указанных в тексте выше.
Соединение, представленное формулой (I), или его фармацевтически приемлемая соль, или соединение, представленное формулой (I), объединенное с фармацевтическими препаратами в качестве сопутствующего лекарственного средства, может быть введено в виде, например, твердых композиций, жидких композиций или других композиций, предназначенных для перорального введения, или инъекций, препаратов для наружного употребления или суппозиториев, предназначенных для парентерального введения.
Твердые композиции для перорального введения включают в себя компактные таблетки, пилюли, капсулы, порошки и гранулы.
Капсулы включают в себя твердые капсулы и мягкие капсулы.
В таких твердых композициях, одно или более активных веществ может быть смешано, по крайней мере, с одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон или метасиликаталюминат магния. Композиции могут содержать, в соответствии с обычным способом, добавки, отличные от инертного разбавителя, например смазывающие реагенты, такие как стеарат магния, дезинтегрирующие реагенты, такие как кальциевая соль гликолята целлюлозы, стабилизатор, такой как лактоза, и солюбилизирующий реагент, такой как глутаминовая кислота или аспарагиновая кислота. Таблетки или пилюли могут быть покрыты слоем вещества, растворимого в желудке или тонком кишечнике, такого как сахароза, желатин, гидроксипропилцеллюлоза или фталат гидроксипропилметилцеллюлозы, или двумя или более слоями, если необходимо. Кроме того, капсулы, изготовленные из вещества, которое всасывается в организме, например желатина, включены в объем изобретения.
Жидкие композиции для перорального введения включают в себя фармацевтически приемлемые эмульсии, растворы, сиропы и эликсиры и т.д. Такие жидкие композиции содержат одно или более активных веществ и обычно применяемый инертный разбавитель(и) (например, очищенная вода или этанол), растворяющий активное вещество(а). Композиции могут содержать, кроме инертного разбавителя, адъювант, такой как увлажнители или суспендирующие реагенты, подсластители, вкусовые вещества, ароматизаторы и антисептические средства.
Другие композиции для перорального введения включают в себя жидкости для распыления, которые содержат одно или более активных веществ и изготавливаются известным для данной области способом. Композиции могут содержать, кроме инертного разбавителя, стабилизатор, такой как бисульфит натрия и изотонический буфер, такой как хлорид натрия, цитрат натрия или лимонная кислота. Способ изготовления спреев подробно описан, например, в патентах США № 2868691 и 3095355.
В настоящем изобретении, инъекции для парентерального введения включают в себя стерильные водные и/или неводные растворы, суспензии и эмульсии. Водные растворы или суспензии включают в себя, например, дистиллированную воду для инъекции и физиологический солевой раствор. Неводные растворы или суспензии включают в себя пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, спирт, такой как этанол и полисорбат 80 (торговое название). Кроме того, стерильные водные и неводные растворы, суспензии и эмульсии могут быть использованы в комбинации. Такие композиции могут дополнительно содержать адъюванты, такие как антисептическое средство, увлажнитель, эмульгатор, диспергирующее средство, стабилизатор (такой как лактоза) и солюбилизирующий реагент (такой как глутаминовая кислота и аспарагиновая кислота). Их стерилизуют путем фильтрования через фильтр, задерживающий бактерии, с помощью стерилизатора или облучением. Кроме того, после приготовления стерильной твердой композиции, например, лиофилизированный продукт может быть растворен в стерилизованной или стерильной дистиллированной воде для инъекции или другом стерильном растворителе до использования.
Другие композиции для парентерального введения включают в себя жидкости для наружного употребления, мази, чрескожные линименты, суппозитории для ректального применения и пессарии для вагинального применения, которые содержат одно или более активных веществ и могут быть изготовлены способами, известными в данной области.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение подробно раскрывают ниже на основании ссылочных примеров и примеров, однако, настоящее изобретение не ограничивается указанными примерами.
Растворители, указанные в скобках, обозначают проявляющие или элюирующие растворители, и соотношения используемых растворителей при хроматографическом разделении или ТСХ даны по объему. Растворители, указанные в скобках в данных ЯМР, обозначают растворитель для измерения.
Принятые сокращения в данных ЯМР
br - шир.
q - кв.
quin. - кваин.
sextet - секстет
sex - сек.
Ссылочный пример 1
3-(3-аминофенил)-3-метокси-4,5,6,7-тетрагидро-2-бензофуран-1(3Н)-он
К раствору ангидрида 3, 4,5,6-тетрагидрофталевой кислоты (3,04 г) в тетрагидрофуране (40,0 мл) добавляли раствор 3-(бис(триметилсилил)амино)фенилмагнийхлорида в тетрагидрофуране (1 М, 20,0 мл) при -78°С. Смесь перемешивали в течение 1,5 часов. Насыщенный водный раствор хлорида аммония добавляли к реакционной смеси, которую перемешивали при комнатной температуре в течение 30 минут. Безводный сульфат магния добавляли к реакционной смеси, которую затем фильтровали. Фильтрат концентрировали с получением маслянистого продукта. Тионилхлорид (5,20 мл) добавляли по каплям к метанолу (20,0 мл) при -10°С и затем раствор перемешивали при 0°С в течение 15 минут. К раствору добавляли маслянистый продукт, полученный ранее, и раствор перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрируют. Полученный остаток растворяли в метиленхлориде (20 мл) и к раствору добавляли триэтиламин (2,79 мл) при 0°С. К реакционной смеси добавляли воду, затем экстрагировали метиленхлоридом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором последовательно, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат: гексан = 3:7) с получением указанного в заголовке соединения (2,56 г), имеющего следующие физические характеристики.
ЯМР(DMSO-d6):

Пример 1
4-(3-аминофенил)-5,6,7,8-тетрагидрофталазин-1(2Н)-он
Раствор соединения, получение которого описано в ссылочном примере 1 (2,56 г), и моногидрата гидразина (503 мг) в этаноле (30,0 мл) кипятили с обратным холодильником в течение 18 часов. После охлаждения смеси до комнатной температуры, образовавшиеся кристаллы собирали фильтрованием. Их промывали гексаном и сушили при пониженном давлении. К суспензии полученного твердого вещества (32,0 мг) в метаноле (1,00 мл) добавляли по каплям 4н. хлористый водород в диоксане (0,10 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали. Полученные кристаллы сушили при пониженном давлении с получением соединения согласно настоящему изобретению (36,2 мг), имеющего следующие физические характеристики. Кроме того, соединение превращали в метансульфонат соединения обычным способом.
Гидрохлорид:
ТСХ: Rf 0,27 (этилацетат: гексан = 2:1);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0, 55 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 2 - пример 2(2)
Посредством такой же процедуры, которая описана в ссылочном примере 1→примере 1, если необходимо, следующие соединения согласно настоящему изобретению были получены путем превращения в соответствующие соли обычным способом с использованием ангидрида 3,4,5,6-тетрагидрофталевой кислоты в тетрагидрофуране или соответствующего производного, и 3-(бис(триметилсилил)амино)фенилмагнийхлорида или соответствующего производного.
Пример 2
Метансульфонат 4-(3-аминофенил)-4а,5,8,8а-тетрагидрофталазин-1(2Н)-она
ТСХ: Rf 0,50 (метанол: метиленхлорид = 1:9);
ЯМР(CD3OD):

Пример 2(1)
Метансульфонат 4-(3-аминофенил)-2,5,6,7,8, 9-гексагидро-1Н-циклогепта[d]пиридазин-1-она
ТСХ: Rf 0,47 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 2(2)
4-(3-нитро-4-хлорфенил)-5,6,7,8-тетрагидрофталазин-1(2Н)-он
ТСХ: Rf 0,24 (этилацетат: гексан = 1:1);
ЯМР(DMSO-d6):

Ссылочный пример 2
Этиловый эфир 4-(3-нитробензоил)тиоморфолин-3-карбоновой кислоты
К раствору этилового эфира тиоморфолин-3-илкарбоновой кислоты (5,05 г) в метиленхлориде (120 мл) добавляли диметиламинопиридин (352 мг), триэтиламин (4,9 мл) и 3-нитробензоилхлорид (5,62 г) на бане со льдом и затем смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 2н. соляную кислоту, реакционную смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат = 2:1) с получением указанного в заголовке соединения (5,91 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,23 (гексан: этилацетат = 2:1);
ЯМР(CDCl3):

Ссылочный пример 3
Этиловый эфир 4-((3-нитрофенил)карбонотиоил)тиоморфолин-3-карбоновой кислоты
К раствору соединения, получение которого описано в ссылочном примере 2, (5,88 г) в толуоле (90 мл) добавляли реагент Лавессона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид) (8,62 г) и смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат = 4:1) с получением указанного в заголовке соединения (6,16 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,27 (гексан: этилацетат = 4:1);
ЯМР(CDCl3):

Пример 3
4-(3-нитрофенил)-6,7,9,9а-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2Н)-он
К раствору соединения, получение которого описано в ссылочном примере 3, (4,78 г) в этаноле (50 мл) добавляли моногидрат гидразина (2,0 мл) и смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и образовавшийся осадок собирали фильтрованием с получением соединения согласно настоящему изобретению (2,30 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,45 (хлороформ: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 4 - пример 4(32)
Посредством такой же процедуры, которая описана в ссылочном примере 2→ссылочном примере 3→примере 3, следующие соединения согласно настоящему изобретению были получены с использованием этилового эфира тиоморфолин-3-илкарбоновой кислоты или соответствующего производного, и 3-нитробензоилхлорида или соответствующего производного.
Пример 4
4-(3-нитрофенил)-7,8,9,9а-тетрагидро-2Н-пиридо[1,2-d][1,2,4] триазин-1(6Н)-он
ТСХ: Rf 0,50 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(1)
4-фенил-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,18 (гексан: этилацетат = 2:1);
ЯМР(DMSO-d6):

Пример 4(2)
(9aR)-4-(3-нитрофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2, 4]триазин-1(2H)-он
ТСХ: Rf 0,18 (гексан: этилацетат = 1:1);
ЯМР(CDCl3):

[α]D = -71,9 (с, 0,16, МеОН)
Пример 4(3)
4-(4-нитрофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,28 (этилацетат: гексан = 1:1);
ЯМР(DMSO-d6):

Пример 4(4)
4-(3-метоксифенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,17 (гексан: этилацетат = 1:1);
ЯМР(DMSO-d6):

Пример 4(5)
4-(4-метоксифенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,50 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 4(6)
4-(2-нитрофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2, 4]триазин-1(2H)-он
ТСХ: Rf 0,50 (метиленхлорид: метанол = 10:1);
ЯМР(CDCl3):

Пример 4(7)
4-(3-нитрофенил)-6,7-дигидро[1,4]тиазино[4, 3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,27 (метиленхлорид: метанол = 20:1);
ЯМР(DMSO-d6):

Пример 4(8)
4-фенил-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,51 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 4(9)
4-фенил-7,8,10,10a-тетрагидро-6H-[1,2,4]триазино[5,4-c][1,4]тиазепин-1(2H)-он
ТСХ: Rf 0,53 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(10)
4-(3-нитрофенил)-7,8,10,10a-тетрагидро-6H-[1,2, 4]триазино[5,4-c][1,4]тиазепин-1(2H)-он
ТСХ: Rf 0,60 (хлороформ: метанол = 9:1).
Пример 4(11)
4-(3-диметиламинофенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,50 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 4(12)
(8aR)-4-(3-нитрофенил)-8,8a-дигидро[1,3]тиазоло[3,4-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,39 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 4(13)
4-(3-амино-5-нитрофенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,44 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 4(14)
(9aS)-4-(3-нитрофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4, 3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,51 (метиленхлорид: метанол = 10:1).
Пример 4(15)
(7R,8aS)-7-бензилокси-4-фенил-6,7,8, 8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,26 (гексан: этилацетат = 1:1);
ЯМР(DMSO-d6):

Пример 4(16а)
(7R,8aS)-7-бензилокси-4-(3-нитрофенил)-6,7,8, 8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,10 (гексан: этилацетат = 1:1);
ЯМР(DMSO-d6):

Пример 4(16b)
(7R, 8aS)-7-бензилокси-4-(3-аминофенил)-6,7,8,8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,51 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(17)
4-фенил-9,9a-дигидро-2H-[1,3]тиазино[3,4-d][1,2,4]триазин-1(8H)-он
ТСХ: Rf 0,55 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(18)
4-(3-нитрофенил)-9,9a-дигидро-2H-[1, 3]тиазино[3,4-d][1,2,4]триазин-1(8H)-он
ТСХ: Rf 0,55 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(19)
4-(3-нитро-4-метилфенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,33 (метиленхлорид: метанол = 20:1);
ЯМР(DMSO-d6):

Пример 4(20)
4-(3-цианофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,20 (гексан: этилацетат = 1:1);
ЯМР(CDCl3):

Пример 4(21)
4-(3-нитро-4-метилфенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,59 (хлороформ: метанол = 9:1).
Пример 4(22)
4-(3-фторфенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,63 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(23)
4-(3-нитро-5-фторфенил)-6,7,9,9a-тетрагидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,66 (хлороформ: метанол = 9:1).
Пример 4(24)
4-(2-метил-5-нитрофенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,59 (хлороформ: метанол = 9:1).
Пример 4(25)
4-(4-нитрофенил)-6, 7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,54 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 4(26)
4-(2-метил-3-нитрофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,49 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Пример 4(27)
4-(3-метоксифенил)-6, 7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,18 (гексан: этилацетат = 2:1);
ЯМР(DMSO-d6):

Пример 4(28)
4-(3-нитро-4-метоксифенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,18 (гексан: этилацетат = 1:1);
ЯМР(DMSO-d6):

Пример 4(29)
4-бензил-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2, 4]триазин-1(2H)-он
ТСХ: Rf 0,37 (метиленхлорид: метанол = 10:1);
ЯМР(CDCl3):

Пример 4(30)
4-3-нитробензил-6,7-дигидро[1,4]тиазино[4,3-d][1,2, 4]триазин-1(2H)-он
ТСХ: Rf 0,60 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Пример 4(31)
4-фенил-7,8,9, 9a-тетрагидро-2H-пиридо[1,2-d][1,2,4]триазин-1(6H)-он
ТСХ: Rf 0,67 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 4(32)
5-фенил-2,3-дигидро-7H-[1,3]тиазоло[3,2-d][1,2,4]триазин-8(8aH)-он
ТСХ: Rf 0,30 (этилацетат: гексан = 1:1);
ЯМР(DMCO-d6):

Пример 5
4-(3-нитро-4-гидроксифенил)-6,7-дигидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
Соединение, полученное в примере 4(28), (150 мг) и хлорид лития (59 мг) растворяли в диметилформамиде (2.0 мл) и смесь кипятили с обратным холодильником в течение 16 часов. После охлаждения до комнатной температуры, к реакционной смеси добавляли 1н. соляную кислоту. Осадок собирали фильтрацией. Его сушили с получением соединения согласно настоящему изобретению (126 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,19 (гексан: этилацетат = 1:1);
ЯМР(DMCO-d6):

Пример 6
4-(3-аминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
К раствору соединения, полученного в примере 3, (537 мг) в этаноле (4 мл) добавляли дигидрат хлорида олова (2,07 г) и смесь кипятили с обратным холодильником в течение 30 минут. После охлаждения до комнатной температуры, к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. К метанолу (2 мл) добавляли полученное твердое вещество (137 мг) и затем к смеси добавляли 4н. хлористый водород в диоксане (0,26 мл), смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали. Остаток перекристаллизовывали из смеси растворителей (изопропанол: этанол = 4:1) с получением соединения согласно настоящему изобретению (144 мг), имеющего следующие физические характеристики. Кроме того, соединение превращали в метансульфонат соединения обычным способом.
Гидрохлорид:
ТСХ: Rf 0,42 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Метансульфонат:
ТСХ: Rf 0,36 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(1) - пример 6(19)
Посредством такой же процедуры, которая описана в примере 6, если необходимо, следующие соединения согласно настоящему изобретению были получены путем превращения в соответствующие соли обычным способом при использовании соединений, полученных в примерах 4, 4(2), 4(3), 4(6), 4(7), 4(10), 4(12), 4(14), 4(13), 4(18), 4(19), 4(21), 4(23)-4(26), 4(28), 4(30) или 5, вместо соединения, полученного в примере 3.
Пример 6(1)
Метансульфонат 4-(3-аминофенил)-7,8,9, 9a-тетрагидро-2H-пиридо[1,2-d][1,2,4]триазин-1(6H)-она
ТСХ: Rf 0,44 (метанол: метиленхлорид = 1:9);
ЯМР(DMCO-d6):

Пример 6(2)
(9aR)-4-(3-аминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,27 (метиленхлорид: метанол = 10:1);
ЯМР(DMCO-d6):

Пример 6(3)
Метансульфонат 4-(4-аминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,39 (метанол: метиленхлорид = 1:10);
ЯМР(DMCO-d6):

Пример 6(4)
4-(2-аминофенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,22 (метиленхлорид: метанол = 10:1);
ЯМР(CDCl3):

Пример 6(5)
4-(3-аминофенил)-6,7-дигидро[1,4]тиазино[4,3-d][1, 2,4]триазин-1(2H)-он
свободная форма:
ТСХ: Rf 0,31 (метанол: метиленхлорид = 1:10);
ЯМР(DMCO-d6):

метансульфонат:
ТСХ: Rf 0,48 (метанол: метиленхлорид = 1:9);
ЯМР(DMCO-d6):

Пример 6(6)
4-(3-аминофенил)-7,8,10,10a-тетрагидро-6H-[1,2,4]триазино[5,4-c][1,4]тиазепин-1(2H)-он
ТСХ: Rf 0,44 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(7)
(8aR)-4-(3-аминофенил)-8,8a-дигидро[1,3]тиазоло[3,4-d][1,2, 4]триазин-1(2H)-он
ТСХ: Rf 0,56 (метанол: метиленхлорид = 1:9);
ЯМР(DMCO-d6):

Пример 6(8)
(9aS)-4-(3-аминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,44 (метиленхлорид: метанол = 10:1);
ЯМР(CDCl3):

Пример 6(9)
4-(3,5-диаминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,25 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Пример 6(10)
Метансульфонат 4-(3-аминофенил)-9, 9a-дигидро-2H-[1,3]тиазино[3,4-d][1,2,4]триазин-1(8H)-она
ТСХ: Rf 0,40 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(11)
Метансульфонат 4-(3-амино-4-метилфенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2, 4]триазин-1(2H)-она
ТСХ: Rf 0,38 (метанол: метиленхлорид = 1:10);
ЯМР(DMCO-d6):

Пример 6(12)
Метансульфонат 4-(3-амино-4-метилфенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,42 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(13)
Метансульфонат 4-(3-амино-5-фторфенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,37 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(14)
4-(2-метил-5-аминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,40 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(15)
Метансульфонат 4-(4-аминофенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,39 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(16)
Метансульфонат 4-(2-метил-3-аминофенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,41 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(17)
Метансульфонат 4-(3-амино-4-метоксифенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,53 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(18)
4-(3-амино-4-гидроксифенил)-6,7-дигидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,14 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 6(19)
4-3-аминобензил-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,29 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 7
(7R,8aS)-7-гидрокси-4-(3-нитрофенил)-6,7,8, 8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-он
К раствору соединения, полученного в примере 4(16a), (76 мг) в метиленхлориде (0.5 мл) добавляли трехбромистый бор (2 мл; 1.0 M в метиленхлориде) при -40°C и смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли бикарбонат натрия (приблизительно 1 г). Реакционную смесь оставляли медленно нагреваться до комнатной температуры и затем к реакционной смеси добавляли насыщенный солевой раствор, смесь экстрагировали метиленхлоридом. Экстракт сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (хлороформ: метанол = 19:1→9:1) с получением соединения согласно настоящему изобретению (57 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,37 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 8
Метансульфонат (7R,8aS)-7-гидрокси-4-(3-аминофенил)-6,7,8,8a-тетрагидропирроло[1,2-d][1,2,4]триазин-1(2H)-она
К раствору соединения, полученного в примере 4(16b), (188 мг) в метиленхлориде (2 мл) добавляли треххлористый алюминий (153 мг) и смесь перемешивали при комнатной температуре в течение ночи. Кроме того, треххлористый алюминий (151 мг) добавляли к реакционной смеси, которую перемешивали при комнатной температуре в течение 7 часов. К реакционной смеси последовательно добавляли бикарбонат натрия (приблизительно 1 г), небольшое количество воды и метанол, смесь перемешивали в течение 30 минут. Реакционную смесь фильтровали через целит. Фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (хлороформ: метанол = 19:1→ 9:1→4:1). К метанолу (1 мл) добавляли полученное твердое вещество и сюда же добавляли раствор метансульфокислоты (42 мг) в метаноле (1 мл). Смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали с получением соединения согласно настоящему изобретению (147 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,17 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 9
Метансульфонат 4-(3-аминометилфенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
К раствору этилового эфира 4-((3-хлорметилфенил)карбонотиоил)тиоморфолин-3-карбоновой кислоты (131 мг; соединение было получено посредством такой же процедуры, как описана в ссылочном примере 2→ссылочном примере 3 с использованием 3-хлорметилбензоилхлорида вместо 3-нитробензоилхлорида) в диметилформамиде (1,5 мл) добавляли натриевую соль фталимида (70 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали смешанным растворителем (гексан: этилацетат = 1:1). Экстракт последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. К раствору полученного твердого вещества в этаноле (2 мл) добавляли моногидрат гидразина (92 мкл) и смесь кипятили с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, выпавший осадок отделяли фильтрованием и фильтрат концентрировали. Осадок и остаток очищали колоночной хроматографией на силикагеле (хлороформ: метанол: вода = 8:2:0,2) соответственно. К полученному твердому веществу добавляли раствор метансульфокислоты в метаноле (1M, 0.11 мл) и смесь концентрировали. К полученному остатку добавляли этилацетат, и осадок отделяли фильтрованием. Осадок сушили при пониженном давлении с получением соединения согласно настоящему изобретению (40 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,11 (метиленхлорид: метанол = 10:1);
ЯМР(DMCO-d6):

Пример 10
4-(3-амино-4-фторфенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
Посредством такой же процедуры, которая описана в ссылочном примере 2→примере 6→ссылочном примере 3→примере 3, с использованием этилового эфира 3,4-дигидро-2H-1,4-тиазин-5-карбоновой кислоты вместо этилового эфира тиоморфолин-3-илкарбоновой кислоты, и 3-нитро-4-фторбензоилхлорида вместо 3-нитробензоилхлорида, было получено соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,41 (метанол: метиленхлорид = 1:10);
ЯМР(DMCO-d6):

Пример 11
8-фенил-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
В атмосфере водорода, смесь 8-фенилпиридо[2,3-d]пиридазин-5(6H)-она (100 мг; соединение было получено посредством такой же процедуры, которая описана в ссылочном примере 1→примере 1, с использованием фуро[3,4-b]пиридин-5,7-диона вместо 4,5,6,7-тетрагидро-2-бензофуран-1, 3-диона, и магнийхлорфенила вместо 3-(бис(триметилсилил)амино)магнийхлорфенила), окиси платины(IV) (10 мг), 1н. соляной кислоты (0,5 мл) и диметилформамида (5 мл) перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь фильтровали через целит. Фильтрат концентрировали. Остаток разбавляли этилацетатом. Разбавленный раствор последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток перекристаллизовывали из этанола с получением соединения согласно настоящему изобретению (42 мг), имеющего следующие физические характеристики. Кроме того, соединение превращали в его соответствующую соль обычным способом.
Свободная форма:
ТСХ: Rf 0,43 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Гидрохлорид:
ТСХ: Rf 0,40 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Метансульфонат:
ТСХ: Rf 0,39 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Пример 11(1) - пример 11(4)
Посредством такой же процедуры, которая описана в примере 11, если необходимо, следующие соединения согласно настоящему изобретению были получены путем превращения в соответствующие соли обычным способом при использовании соответствующего производного вместо 8-фенилпиридо[2,3-d]пиридазин-5(6H)-она.
Пример 11(1)
Метансульфонат 4-фенил-5,6,7,8-тетрагидропиридо[3,4-d]пиридазин-1(2H)-она
ТСХ: Rf 0,30 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 11(2)
1-фенил-5,6,7,8-тетрагидропиридо[3,4-d]пиридазин-4(3H)-он
ТСХ: Rf 0,29 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 11(3)
5-фенил-1,3,4,7-тетрагидропиридо[2,3-d]пиридазин-8(2H)-он
ТСХ: Rf 0,49 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 11(4)
8-(3-аминофенил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-он
Гидрохлорид:
ТСХ: Rf 0,40 (метиленхлорид: метанол = 9:1);
ЯМР(DMCO-d6):

Дигидрохлорид:
ТСХ: Rf 0,33 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Ссылочный пример 4
6-метоксиметил-8-фенилпиридо[2, 3-d]пиридазин-5(6H)-он
После промывания гидрида натрия (103 мг; 62.6 % в масле) гексаном, смесь суспендировали в диметилформамиде (1,5 мл). Раствор 8-фенилпиридо[2, 3-d]пиридазин-5(6H)-она (200 мг; соединение было получено посредством такой же процедуры, которая описана в ссылочном примере 1→примере 1, при использовании фуро[3,4-b]пиридин-5,7-диона вместо 4,5,6,7-тетрагидро-2-бензофуран-1,3-диона и магнийхлорфенила вместо 3-(бис(триметилсилил)амино)магнийхлорфенила) в диметилформамиде (5,7 мл) по каплям добавляли к суспензии при 0°C. Смесь перемешивали при комнатной температуре в течение 40 минут. Метоксиметилхлорид (0.27 мл) добавляли по каплям к реакционной смеси, которую перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток разбавляли смешанным растворителем, состоящим из воды и этилацетата. Смесь выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали с получением указанного в заголовке соединения (269 мг), имеющего следующие физические характеристики. Полученное соединение использовали в следующей реакции без очистки.
ТСХ: Rf 0,78 (хлороформ: метанол = 8:1).
Ссылочный пример 5
6-метоксиметил-8-фенил-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
В атмосфере аргона к окиси платины (70 мг) добавляли диметилформамид (1,0 мл). Раствор соединения, полученного в ссылочном примере 4, (269 мг) в диметилформамиде (8,0 мл) добавляли по каплям к реакционной смеси и сюда же добавляли 1н. соляную кислоту (0,9 мл). В атмосфере водорода смесь перемешивали при комнатной температуре в течение 4 часов. В атмосфере аргона реакционную смесь фильтровали через целит. Фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 40:1→30:1) с получением соединения, указанного в заголовке, (224 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,16 (гексан: этилацетат = 1:1);
ЯМР(DMCO-d6):

Ссылочный пример 6
6-метоксиметил-1-метил-8-фенил-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
После промывания гидрида натрия (141 мг; 62,6 % в масле) гексаном, смесь суспендировали в диметилформамиде (1,0 мл). Раствор соединения, полученного в ссылочном примере 5, (200 мг) в диметилформамиде (6,4 мл) добавляли по каплям к суспензии при 0°C и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли по каплям метилйодид (0,37 мл), смесь перемешивали при комнатной температуре в течение ночи. После добавления воды к реакционной смеси, смесь выливали в ледяную воду и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 100:1→50:1) с получением указанного в заголовке соединения (116 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,23 (гексан: этилацетат = 1:1).
Пример 12
1-метил-8-фенил-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
К раствору соединения, полученного в ссылочном примере 6, (110 мг) в метаноле (1,2 мл) добавляли по каплям 6н. соляную кислоту (2,4 мл), смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли по каплям 6н. соляную кислоту (2,4 мл), смесь перемешивали при 110°C в течение ночи. После охлаждения реакционной смеси до комнатной температуры, ее выливали в холодную воду. После нейтрализации 5н. раствором гидроксида натрия, раствор экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток промывали этилацетатом с получением соединения согласно настоящему изобретению (39 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,44 (хлороформ: метанол = 4:1);
ЯМР(DMCO-d6):

Ссылочный пример 7
N-метил-N-метокси-1-трет-бутоксикарбонилпиперидин-2-карбоксамид
К раствору 1-трет-бутоксикарбонилпиперидин-2-карбоновой кислоты (2.29 г) в метиленхлориде (30 мл) добавляли гидрохлорид N,O-диметилгидроксиамина (1,17 г), бензотриазол-1-илокси-трис(диметиламино)фосфонийгексафторфосфат (4,87 г, BOP реагент) и триэтиламин (4,88 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток разбавляли этилацетатом. Разбавленный раствор промывали последовательно водой, 1н. соляной кислотой, водой, насыщенным водным раствором бикарбоната натрия и насыщеннм солевым раствором, сушили над безводным сульфатом натрия и концентрировали с получением указанного в заголовке соединения (2,59 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,54 (гексан: этилацетат = 3:1);
ЯМР(CDCl3):

Ссылочный пример 8
Трет-бутиловый эфир 2-бензоилпиперидин-1-карбоновой кислоты
Раствор фениллития в смеси циклогексан-эфир (1,06 M, 6,23 мл) добавляли по каплям к раствору соединения, полученного в ссылочном примере 7, (1, 63 г) в тетрагидрофуране (30 мл) при -25°C и смесь перемешивали при -25°C в течение 3 часов. Реакционную смесь выливали в 1M раствор динатрийфосфата и экстрагировали этилацетатом. Экстракт промывали последовательно водой и насыщеннм солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат = 9:1) с получением указанного в заголовке соединения (850 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,56 (гексан: этилацетат = 4:1);
ЯМР(CDCl3):

Ссылочный пример 9
Гидрохлорид 2-бензоилпиперидина
К соединению, полученному в ссылочном примере 8, (270 мг) добавляли 4н. раствор хлористого водорода в этилацетате (4 мл) и смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь концентрировали с получением указанного в заголовке соединения (211 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,48 (хлороформ: метанол: уксусная кислота = 40:10:1);
ЯМР(DMCO-d6):

Пример 13
1-фенил-3,6,7,8,9,9a-гексагидро-4H-пиридо[1,2-d][1,2, 4]триазин-4-он (соединение a) и 1-фенил-3,6,7,8-тетрагидро-4H-пиридо[1,2-d][1,2,4]триазин-4-он (соединение b)
Соединение, полученное в ссылочном примере, (199 мг) отделяли с помощью этилацетата и насыщенного водного раствора бикарбоната натрия и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Полученный порошок растворяли в толуоле (10 мл). К раствору добавляли этиловый эфир гидразинугольной кислоты (184 мг) и моногидрат р-толуолсульфокислоты (8,4 мг) и смесь кипятили с обратным холодильником в течение ночи. После охлаждения реакционной смеси до комнатной температуры, ее разбавляли этилацетатом. Разбавленный раствор промывали последовательно 1н. соляной кислотой, водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат = 2:1→1:1). Фракцию из колонки с большей полярностью перекристаллизовывали из этилацетата с получением соединения (16,3 мг), имеющего следующие физические характеристики. Фракцию из колонки с меньшей полярностью перекристаллизовывали из смешанного раствора этилацетата и гексана (1:1) с получением соединения b (13,6 мг), имеющего следующие физические характеристики.
Соединение a:
ТСХ: Rf 0,30 (гексан: этилацетат = 1:1);
ЯМР(DMCO-d6):

Соединение b:
ТСХ: Rf 0,46 (гексан: этилацетат = 1:1);
ЯМР(DMCO-d6):

Пример 14
1-фенил-3,8,9,9a-тетрагидро-4H-[1,3]тиазино[3,4-d][1,2,4]триазин-4-он
Посредством такой же процедуры, которая описана в ссылочном примере 7→ссылочном примере 8→ссылочном примере 9→примере 13, с использованием 3-трет-бутоксикарбонил-1, 3-тиазинан-4-карбоновой кислоты вместо 1-трет-бутоксикарбонилпиперидин-2-карбоновой кислоты, было получено соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,48 (гексан: этилацетат = 1:1);
ЯМР(DMCO-d6):

Ссылочный пример 10
Метиловый эфир ((E)-3-оксо-4,5,6,7-тетрагидро-2-бензофуран-1(3H)-илиден)уксусной кислоты
Раствор ангидрида 3,4,5, 6-тетрагидрофталевой кислоты (3,04 г) и метиловый эфир (трифенилфосфоранилиден)уксусной кислоты (6,69 г) в хлороформе (50,0 мл) кипятили с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры, ее концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат: гексан = 1:9→3:7) с получением указанного в заголовке соединения (1,93 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,71 (этилацетат: гексан = 1:1);
ЯМР(CDCl3): δ 5,92(с, 1Н), 3,76(с, 3Н), 2,81(м, 2Н), 2,38(м, 2Н), 1,76(м, 4Н).
Пример 15
4-метоксикарбонилметил-5,6,7,8-тетрагидрофталазин-1(2H)-он
Раствор соединения, полученного в ссылочном примере 10, (1,04 г) и моногидрат гидразина (250 мг) в этаноле (10,0 мл) кипятили с обратным холодильником в течение 18 часов. После охлаждения реакционной смеси до комнатной температуры, ее концентрировали. Образовавшиеся кристаллы промывали этанолом и этилацетатом и сушили при пониженном давлении с получением соединения согласно настоящему изобретению (672 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,45 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6): δ 12,66 (шир.с, 1Н), 3,65(с, 2H), 3,63(с, 3H), 2, 38(м, 4H), 1,64(м, 4H).
Пример 16
4-(1-этоксикарбонилэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Посредством такой же процедуры, которая описана в ссылочном примере 10→примере 15, при использовании этилового эфира 2-(трифенилфосфоранилиден)пропановой кислоты вместо метилового эфира (трифенилфосфаранилиден)уксусной кислоты, было получено соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,56 (метанол: метиленхлорид = 1:10);
ЯМР(DMCO-d6):

Ссылочный пример 11
4-карбоксиметил-5,6,7,8-тетрагидрофталазин-1(2H)-он
Раствор 5н. гидроксида натрия (1,72 мл) добавляли по каплям к суспензии соединения, полученного в примере 15, (635 мг) в метаноле (10,0 мл) на ледяной бане и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали. К остатку добавляли 2н. соляную кислоту, рН доводили до pH 2. Образовавшиеся кристаллы собирали фильтрованием. Их промывали гексаном и сушили при пониженном давлении с получением указанного в заголовке соединения (478 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,62 (метанол: метиленхлорид: уксусная кислота = 2:8:0,1);
ЯМР(DMCO-d6):

Ссылочный пример 11(1)
4-(1-карбоксиэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Посредством такой же процедуры, которая описана в ссылочном примере 11, при использовании соединения, полученного в примере 16, вместо соединения, полученного в примере 15, было получено указанное в заголовке соединение, имеющее следующие физические характеристики.
ТСХ: Rf 0,28 (метанол: метиленхлорид = 1:4);
ЯМР(DMCO-d6):

Пример 17 и пример 17(1)
Посредством такой же процедуры, которая описана в ссылочном примере 10→примере 15→примере 11, если необходимо, были получены следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом с использованием соответствующего производного вместо 4,5,6,7-тетрагидро-2-бензофуран-1,3-диона и этилового эфира (трифенилфосфоранилиден)уксусной кислоты вместо метилового эфира (трифенилфосфоранилиден)уксусной кислоты.
Пример 17
8-этоксикарбонилметил-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,46 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 17(1)
Гидрохлорид 5-этоксикарбонилметил-1,3,4,7-тетрагидропиридо[2,3-d]пиридазин-8(2H)-она
ТСХ: Rf 0,48 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Ссылочный пример 12
4-(2-гидроксиэтил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
Соединение, полученное в примере 15, (350 мг) растворяли в тетрагидрофуране (8,0 мл). В атмосфере аргона к полученному раствору добавляли борогидрид натрия (239 мг) при 0°C и смесь кипятили с обратным холодильником в течение 13 часов. После охлаждения до 0°C, к реакционной смеси добавляли 1н. соляную кислоту, рН смеси доводили до pH 5. Выпавшее в осадок твердое вещество собирали фильтрованием. Фильтрат концентрировали и экстрагировали хлороформом. Экстракт сушили над безводным сульфатом магния и концентрировали с получением указанного в заголовке соединения, имеющего следующие физические характеристики.
ТСХ: Rf 0,32 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Ссылочный пример 13
4-(2-хлорэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К раствору соединения, полученного в ссылочном примере 12, (2, 47 г) и пиридина (201 мг) в метиленхлориде (60 мл) добавляли тионилхлорид (2,25 г) и смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли хлороформ и насыщенный водный раствор бикарбоната натрия, смесь разделяли. Органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали с получением указанного в заголовке соединения (2,58 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,52 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Ссылочный пример 14
4-(2-азидоэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Раствор соединения, полученного в ссылочном примере 13, (106 мг), триметилсилилазида (86,4 мг) и тетрабутиламмонийфторида (237 мг) в тетрагидрофуране (2,00 мл) кипятили с обратным холодильником в течение 24 часов. Реакционную смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат: гексан = 1:1) с получением указанного в заголовке соединения (85,0 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,52 (этилацетат: гексан = 4:1);
ЯМР(DMCO-d6):

Ссылочный пример 15
Гидрохлорид 4-(2-аминоэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
Суспензию соединения, полученного в ссылочном примере 14, (50,0 мг) и 5% палладия на карбонате кальция (20, 0 мг) в этаноле (3,0 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 6 часов. Реакционную смесь фильтровали через целит. Фильтрат концентрировали. К раствору полученного твердого вещества (44,0 мг) в метаноле (3,0 мл) добавляли по каплям 4н. раствор хлористый водород-этилацетат и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали. Остаток перекристаллизовывали из смеси растворителей метанола и этилацетата с получением указанного в заголовке соединения (45,9 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,39 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,1);
ЯМР(DMCO-d6):

Ссылочный пример 16
4-(2-цианоэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К суспензии соединения, полученного в ссылочном примере 13, (500 мг) в тетрагидрофуране (12 мл) добавляли триметилсилилцианид (0,94 мл) и тетрабутиламмонийфторид (1,84 г) и смесь перемешивали при 80°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь выливали в холодный насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 20:1). Полученное твердое вещество промывали трет-бутилметиловым эфиром с получением указанного в заголовке соединения (249 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,52 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Ссылочный пример 17
4-(2-карбоксиэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К суспензии соединения, полученного в ссылочном примере 16, (130 мг) в этаноле (3,2 мл) добавляли 5н. раствор гидроксида натрия (0,64 мл) и смесь перемешивали при 90°C в течение 1 дня. После охлаждения до 0°C, реакционную смесь выливали в холодную воду и промывали этилацетатом. Водный слой нейтрализовали 2н. соляной кислотой и концентрировали. Остаток промывали водой. Твердое вещество промывали водой и эфиром с получением указанного в заголовке соединения (131 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,36 (хлороформ: метанол = 4:1);
ЯМР(DMCO-d6):

Пример 18
Пиридиновая соль 3-(4-оксо-3,4,5,6,7,8-гексагидрофталазин-1-ил)фенилсульфаминовой кислоты
К суспензии соединения, полученного в примере 1, (100 мг) в метиленхлориде (1,5 мл) и диметилформамиде (1,5 мл) добавляли комплекс трехокиси серы и пиридина (144 мг) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали. Остаток промывали этилацетатом с получением соединения согласно настоящему изобретению (160 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,17 (хлороформ: метанол = 4:1);
ЯМР(CDCl3):

Пример 19
Метансульфонат 4-(3-амидинофенил)-6,7,9,9a-тетрагидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
К раствору соединения, полученного в примере 4(20), (127 мг) в диметилформамиде (3 мл) добавляли кислый сернокислый натрий (215 мг) и гексагидрат хлорида магния (474 мг) и смесь перемешивали при комнатной температуре в течение 3 часов в атмосфере аргона. К реакционной смеси добавляли этилацетат и образовавшийся осадок отделяли фильтрованием. Фильтрат промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. К раствору полученного твердого вещества (277 мг) в ацетоне (2 мл) добавляли метилйодид (0,15 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали. К остатку добавляли метанол (2 мл) и ацетат аммония (43 мг) и смесь кипятили с обратным холодильником в течение 2 часов. Реакционную смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле (хлороформ: метанол: вода = 9:1:0, 1→8:2:0,2). Полученное твердое вещество промывали смесью растворителей из метанола, этилацетата и гексана и превращали в метансульфонат соединения обычным способом с получением соединения согласно настоящему изобретению (149 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,22 (метиленхлорид: метанол = 10:1);
ЯМР(DMCO-d6):

Пример 20
4-(3-гидроксифенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
К раствору соединения, полученного в примере 4(4), (175 мг) в метиленхлориде (1,3 мл) добавляли трехбромистый бор (1,3 мл; 1,0 M в метиленхлориде) на ледяной бане и смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли трехбромистый бор (1,3 мл; 1,0 M в метиленхлориде) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли метанол, смесь концентрировали. Остаток промывали метиленхлоридом. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток перекристаллизовывали из ацетонитрила с получением соединения согласно настоящему изобретению (73 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,43 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 20(1) и пример 20(2)
Посредством такой же процедуры, которая описана в примере 20, с использованием соединения, полученного в примере 4(5) или 4(27), вместо соединения, полученного в примере 4(4), следующие соединения согласно настоящему изобретению были получены.
Пример 20(1)
4-(4-гидроксифенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,32 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Пример 20(2)
4-(3-гидроксифенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,40 (хлороформ: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 21
Бромгидрат N-(3-(4-оксо-3,4,5,6,7,8-гексагидрофталазин-1-ил)фенил)этанимидамида
К суспензии соединения, полученного в примере 1, (60 мг) в этаноле (2,5 мл) добавляли 2-нафтилметилэтанимидотиоат (74 мг) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли метанол (1,5 мл) и 2-нафтилметилэтанимидотиоат (222 мг), смесь перемешивали при 75°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 20:1→6:1) с получением соединения согласно настоящему изобретению (84 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,24 (хлороформ: метанол = 4:1);
ЯМР(DMCO-d6):

Пример 21(1) - пример 21(3)
Посредством такой же процедуры, которая описана в примере 21, с использованием соединения, синтезированного в примере 6, 6(5) или 11(4), вместо соединения, полученного в примере 1, синтезировали следующие соединения согласно настоящему изобретению.
Пример 21(1)
Бромгидрат N-(3-(1-оксо-1,2,6,7,9,9a-гексагидро[1,4]тиазино[4, 3-d][1,2,4]триазин-4-ил)фенил)этанимидамида
ТСХ: Rf 0,25 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMCO-d6):

Пример 21(2)
Бромгидрат N-(3-(1-оксо-1,2,6,7-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-4-ил)фенил)этанимидамида
ТСХ: Rf 0,24 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMCO-d6):

Пример 21(3)
N-(3-(5-оксо-1,2,3,4,5,6-гексагидропиридо[2, 3-d]пиридазин-8-ил)фенил)этанимидамид
ТСХ: Rf 0,14 (хлороформ: метанол = 4:1).
Пример 22
4-(3-метиламинофенил)-6,7-дигидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
К суспензии соединения, полученного в примере 6(5), (100 мг) в метаноле (1,1 мл) добавляли раствор метилата натрия в метаноле (0,5 мл; 28% раствор) и параформальдегид (32 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли метанол (1,1 мл) и боргидрид натрия (22 мг), смесь перемешивали при 75°C в течение 1 часа. После охлаждения до комнатной температуры, к реакционной смеси добавляли воду, смесь выливали в холодную воду. Раствор концентрировали. Остаток промывали смесью растворителей метанола и метиленхлорида и фильтровали через целит. Фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 15:1) с получением соединения согласно настоящему изобретению (15 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,44 (хлороформ: метанол = 8:1);
ЯМР(DMCO-d6):

Пример 23
4-(N-(2-(N'-трет-бутоксикарбониламино)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
Смесь соединения, полученного в ссылочном примере 11, (183 мг), триэтиламина (178 мг), трет-бутилового эфира N-(2-аминоэтил)карбаминовой кислоты (160 мг), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (338 мг), 1-гидроксибензотриазола (238 мг) и диметилформамида (3,00 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали. К остатку добавляли воду и выпавшие кристаллы собирали фильтрованием. Кристаллы промывали этилацетатом и сушили при пониженном давлении с получением соединения согласно настоящему изобретению (189 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,50 (метиленхлорид: метанол = 9:1);
ЯМР(DMCO-d6):

Пример 23(1) - пример 23(37)
Посредством такой же процедуры, которая описана в примере 23, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом с использованием соединения, полученного в примере 11, или соответствующего производного карбоновой кислоты, и трет-бутилового эфира N-(2-аминоэтил)карбаминовой кислоты или соответствующего производного.
Пример 23(1)
4-(N-(2-(морфолин-4-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,37 (метанол: метиленхлорид = 1:9);
ЯМР(DMCO-d6):

Пример 23(2)
4-(N-(2-(N',N'-диметиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,60 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,1);
ЯМР(DMCO-d6):

Гидрохлорид:
ТСХ: Rf 0,69 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMCO-d6):

Пример 23(3)
4-(N-(3-(N'-трет-бутоксикарбониламино)пропил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ЯМР(DMCO-d6):

Пример 23(4)
4-(N-(2-(N'-трет-бутоксикарбонил-N'-метиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,59 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(CDCl3):

Пример 23(5)
Гидрохлорид 4-(N-(2-(пирролидин-1-ил)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,24 (этилацетат: уксусная кислота: вода = 3:3:1);
ЯМР(DMSO-d6):

Пример 23(6)
4-(2-гидроксиэтоксикарбонилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,60 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(7)
Гидрохлорид 4-(N-(3-(N',N'-диметиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,12 (хлороформ: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(8)
Гидрохлорид 4-(N-(3-(имидазол-1-ил)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,82 (хлороформ: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(9)
4-(1-(N-(2-(N'-трет-бутоксикарбониламино)этил)карбамоил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 23(10)
Гидрохлорид 4-(N-(1-этилпирролидин-2-илметил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,59 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 23(11)
4-(N-(3-(морфолин-4-ил)пропил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,48 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 23(12)
Гидрохлорид 4-(N-(3-(пирролидин-1-ил)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,25 (хлороформ: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(13)
Гидрохлорид 4-(N-(пиридин-3-ил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,47 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 23(14)
Гидрохлорид 4-(N-(2-(пиперидин-1-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,53 (хлороформ: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(15)
Гидрохлорид 4-(N-(2-(N',N'-диметиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,26 (хлороформ: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(16)
4-(N-(4-(N'-трет-бутоксикарбониламино)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ЯМР(DMSO-d6):

Пример 23(17)
Гидрохлорид 4-(N-(пиридин-2-ил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,51 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 23(18)
4-(2-(N',N'-диметиламино)этоксикарбонилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,51 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Гидрохлорид:
ТСХ: Rf 0,51 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(19)
4-(N-(2-(пиррол-1-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,60 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(20)
Гидрохлорид 4-(N-(2-(имидазол-4-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,56 (хлороформ: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(21)
4-(1-(N-(4-(N'-трет-бутоксикарбониламино)бутил)карбамоил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,38 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 23(22)
4-(N-(пиридин-2-илметил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,85 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(23)
4-(N-(2-бромэтил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,64 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 23(24)
4-(N-(3-бомпропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,60 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 23(25)
4-(N-(5-(N'-трет-бутоксикарбониламино)пентил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ЯМР(DMSO-d6):

Пример 23(26)
4-(N-(5-метилтиазол-2-ил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,57 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 23(27)
Гидрохлорид 4-(N-(3-(N',N'-диметиламино)пропил)-N-метлкарбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,11 (метиленхлорид: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(28)
Гидрохлорид 4-(N-(2-(N',N'-диметиламино)этил)-N-метилкарбамоилметил)-5, 6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,21 (метиленхлорид: метанол: вода = 7:3:0,3);
ЯМР(DMSO-d6):

Пример 23(29)
4-(N-(4-бромбутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,65 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 23(30)
4-(2-(N-трет-бутоксикарбониламино)этоксикарбонилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ЯМР(CD3OD):

Пример 23(31)
4-(N-(4-оксо-4,5-дигидро-1,3-тиазол-2-ил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ЯМР(DMSO-d6):

Пример 23(32)
4-(N-(1-метил-4-оксо-1,5-дигидро-4H-имидазол-2-ил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,49 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 23(33)
4-(2-(N-(2-(N'-трет-бутоксикарбониламино)этил)карбамоил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,66 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 23(34)
4-(N-(2-цианоэтил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,79 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(35)
4-(N-(4-(имидазол-1-ил)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,75 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(36)
4-(N-(2-метоксикарбонилэтил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,83 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 23(37)
4-(N-метил-N-(3-хлорпропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,81 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24
4-(N-(2-гидроксиэтил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Смесь соединения, полученного в примере 15, (222 мг) и 2-аминоэтанола (305 мг) перемешивали при 100°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, образовавшиеся кристаллы промывали этилацетатом. Полученные кристаллы перекристаллизовывали из смеси растворителей метанола и этилацетата с получением соединения согласно настоящему изобретению (190 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,23 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(1) - пример 24(48)
Посредством такой же процедуры, которая описана в примере 24, если необходимо, следующие соединения согласно настоящему изобретению были синтезированы путем превращения в соответствующие соли обычным способом с использованием соединения, полученного в примере 15, или соответствующего эфирного производного, и соответствующего производного вместо 2-аминоэтанола.
Пример 24(1)
Дигидрохлорид 8-(N-(2-аминоэтил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,36 (хлороформ: метанол: 28% аммиачная вода = 15:5:1);
ЯМР(DMSO-d6):

Пример 24(2)
4-(N-(2-метоксиэтил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,53 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(3)
4-(N-(2-(N',N'-диэтиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,35 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24(4)
4-(N-пропилкарбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,60 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24(5)
4-(N-(4-гидроксибутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,68 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 24(6)
4-(N-(фуран-2-илметил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,37 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(7)
Гидрохлорид 4-(N-(пиперидин-4-илметил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,21 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,2);
ЯМР(DMSO-d6):

Пример 24(8)
4-(N-(2,3,4, 5-тетрагидрофуран-2-илметил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,45 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(9)
4-(1-(N-(2-(пиперидин-1-ил)этил)карбамоил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,20 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 24(10)
4-(N-(2-(пиридин-4-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,37 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(11)
4-(N-(2-(пиридин-2-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,36 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(12)
4-(N-(2,2-диметил-3-(N',N'-диметиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,24 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 24(13)
4-(N-(2-(N'-изопропиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,27 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6 ):

Пример 24(14)
4-(N-(2-(N'-этиламино)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,22 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 24(15)
4-(N-(3-(N'-метиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,20 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 24(16)
4-(N-(2-(пиридин-3-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,47 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(17)
4-(N-(1-бензилпиперидин-4-ил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,38 (метанол: метиленхлорид = 1:10);
ЯМР(CD3OD):

Гидрохлорид:
ТСХ: Rf 0, 49 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:9:0,1);
ЯМР(DMSO-d6):

Пример 24(18)
4-(N-(2-(N'-фениламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,47 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Гидрохлорид:
ТСХ: Rf 0,57 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(19)
4-(N-(2-(1-метилпиррол-2-ил)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,47 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(20)
4-(N-(5-гидроксипентил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,29 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(21)
4-(N-(2-(N'-бензиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,15 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6 ):

Пример 24(22)
4-(N-(2-(фуран-2-илметилтио)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,38 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(23)
4-(N-(3-(2-метилпиперидин-1-ил)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,43 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 24(24)
4-(N-(3-(N'-циклогексиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 24(25)
4-(N-(2-(N'-бутиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,66 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 24(26)
4-(N-(2-(N'-(2-гидроксипропил)амино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,51 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:10:0,1);
ЯМР(DMSO-d6):

Пример 24(27)
4-(N-(3-(N'-метил-N'-фениламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,58 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(28)
4-(N-(3-гидроксипропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,26 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(29)
4-(N-(2-(тиофен-2-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,48 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(30)
4-(N-(2-(1-метилпирролидин-2-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,30 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 24(31)
4-(N-(2-(1-бензилпиперидин-4-ил)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,44 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Гидрохлорид:
ТСХ: Rf 0,48 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:9:0,1);
ЯМР(DMSO-d6):

Пример 24(32)
4-(N-(2-(N'-(2-гидроксиэтил)амино)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,18 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 24(33)
4-(N-(3-метилтиопропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,60 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(34)
4-(N-(2-(N'-этил-N'-(3-метилфенил)амино)этил)карбамоилметил)-5, 6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,63 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(35)
4-(N-(4,4-диметоксибутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,34 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(36)
4-(N-(3-(N',N'-диэтиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,34 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24(37)
4-(N-(3-(N'-изопропиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,18 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24(38)
4-(N-(2-(1, 3-диоксолан-2-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(39)
4-(N-(3-(N'-пропиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,14 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24(40)
4-(N-(2-(N'-пропиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,31 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 24(41)
4-(N-(2-(4-метоксифенил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,47 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(42)
Гидрохлорид 4-(N-(2-(4-аминофенил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,39 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(43)
Дигидрохлорид 8-(N-(2-(N'-фениламино)этил)карбамоилметил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,40 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 24(44)
Метансульфонат 8-(N-(2-(1-бензилпиперидин-4-ил)этил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,36 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:10:0,1);
ЯМР(DMSO-d6):

Пример 24(45)
8-(N-(3-(морфолин-4-ил)пропил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,31 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 24(46)
Метансульфонат 8-(N-(2-(пиперидин-1-ил)этил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,14 (метанол: метиленхлорид: уксусная кислота = 1:4:0,2);
ЯМР(DMSO-d6):

Пример 24(47)
8-(N-(2-(морфолин-4-ил)этил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,29 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 24(48)
8-(N-(3-(N'-трет-бутоксикарбониламино)пропил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,35 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 25
4-(3-(N-(5-хлорпентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К смешанному раствору соединения, полученного в примере 1, (241 мг) и карбоната калия (89,8 мг) в тетрагидрофуране (3,00 мл) и воде (1,00 мл) на ледяной бане добавляли по каплям 5-хлорпентаноилхлорид (171 мг) и смесь перемешивали в течение 30 минут. Кроме того, к реакционной смеси добавляли карбонат калия (45,0 мг) и 5-хлорпентаноилхлорид (85,5 мг), смесь перемешивали в течение 30 минут. К реакционной смеси добавляли 1н. соляную кислоту, рН смеси доводили до pH 2. К реакционной смеси добавляли воду и образовавшиеся кристаллы собирали фильтрованием. Кристаллы промывали последовательно водой и гексаном и сушили при пониженном давлении с получением соединения согласно настоящему изобретению (347 мг), имеющего следующие физические характеристики.
ЯМР(DMSO-d6):

Пример 25(1) - пример 25(13)
Посредством такой же процедуры, которая описана в примере 25, были синтезированы следующие соединения согласно настоящему изобретению с использованием соответствующего производного вместо соединения, полученного в примере 1, и соответствующего производного вместо 5-хлорпентаноилхлорида.
Пример 25(1)
4-(3-(N-(5-бромпентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,28 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 25(2)
4-(3-(N-(4-хлорбутаноил)амино)фенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,50 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Пример 25(3)
4-(3-(N-ацетиламино)фенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,40 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 25(4)
4-(3-(N-ацетиламино)фенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,51 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 25(5)
4-(3-(N-ацетиламино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,45 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 25(6)
4-(3-(N-(4-хлорбутаноил)амино)фенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ЯМР(DMSO-d6):

Пример 25(7)
4-(3-(N-(2-хлорацетил)амино)фенил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,27 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 25(8)
4-(3-(N-(3-бромпропаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,20 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 25(9)
8-(3-(N-ацетиламино)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
Свободная форма:
ТСХ: Rf 0,31 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0,31 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 25(10)
4-(3-(N-мезиламино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,56 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 25(11)
8-(3-(N-(4-хлорбутаноил)амино)фенил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,41 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 25(12)
4-(2-(N-(2-бромацетил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,68 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 25(13)
4-(2-(N-(3-бромпропаноил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,71 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 26
4-(3-(N-(5-(N'-метил-N'-трет-бутоксикарбониламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Смесь соединения, полученного в примере 1, (277 мг) триэтиламина (223 мг), (N-метил-N-трет-бутоксикарбониламино)пентановой кислоты (277 мг), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (230 мг), 1-гидроксибензотриазола (184 мг) и диметилформамида (3,00 мл) перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали. К остатку добавляли воду, остаток экстрагировали этилацетатом. Экстракт промывали последовательно 1н. соляной кислотой, водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток перекристаллизовывали из смеси растворителей этилацетата и гексана с получением соединения согласно настоящему изобретению (298 мг), имеющего следующие физические данные.
ТСХ: Rf 0,49 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 26(1) - пример 26(19)
Посредством такой же процедуры, которая описана в примере 26, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом с использованием соединения, полученного в примере 1, или соответствующего производного и (N-метил-N-трет-бутоксикарбониламино)пентановой кислоты или соответствующего производного.
Пример 26(1)
4-(3-(N-(5-(N'-метил-N'-бензилоксикарбониламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,29 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 26(2)
4-(3-(N-(4-хлорбутаноил)амино)фенил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,48 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 26(3)
Метансульфонат 4-(3-(N-(5-(N',N'-диметиламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,30 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(CD3OD): δ 7,75(т, J = 1,8 Гц, 1H), 7,63(шир.д, J = 8,1 Гц, 1H), 7,45(т, J = 8,1 Гц, 1H), 7, 20(шир.д, J = 8,1 Гц, 1H), 3,16(м, 2H), 2,89(с, 6H), 2,74(с, 3H), 2,66-2,50(м, 6H), 1,81(м, 8H).
Пример 26(4)
4-(3-(N-(5-(N'-бензилоксикарбониламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,79 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6 ):

Пример 26(5)
4-(3-(N-(2-(2-хлорэтокси)ацетил)амино)фенил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 26(6)
4-(3-(N-(5-(N'-метил-N'-бензилоксикарбониламино)пентаноил)амино)фенил)-7,8,9,9a-тетрагидро-2H-пиридо[1,2-d][1,2, 4]триазин-1(6H)-он
ТСХ: Rf 0,28 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Пример 26(7)
4-(3-(5-(N'-метил-N'-бензилоксикарбониламино)пентаноил)аминофенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,24 (метанол: хлороформ = 1:10);
ЯМР(DMSO-d6):

Пример 26(8)
4-(3-(N-(5-(N'-метил-N'-бензилоксикарбониламино)пентаноил)амино)фенил)-2,5,6,7,8, 9-гексагидро-1H-циклогепта[d]пиридазин-1-он
ТСХ: Rf 0,54 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Пример 26(9)
4-(3-(N-(4-(N'-метил-N'-трет-бутоксикарбониламино)бутаноил)амино)фенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,35 (метиленхлорид: метанол = 10:1).
Пример 26(10)
4-(3-(N-(6-(N'-метил-N'-трет-бутоксикарбониламино)гексаноил)амино)фенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0.35 (метиленхлорид: метанол = 10:1).
Пример 26(11)
4-(3-(N-(5-(N'-(3-метил-2-бутенил)-N'-трет-бутоксикарбониламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,31 (гексан: этилацетат = 1:3);
ЯМР(DMSO-d6):

Пример 26(12)
4-(3-(N-(5-(N'-метил-N'-бензилоксикарбониламино)пентаноил)амино)фенил)-6,7-дигидро[1,4]тиазино[4, 3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,63 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(CD3OD):

Пример 26(13)
Гидрохлорид 4-(3-(N-(2-(N', N'-диметиламино)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,27 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 26(14)
4-(3-(N-(1-трет-бутоксикарбонилазетидин-3-илкарбонил)амино)фенил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,27 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 26(15)
4-(3-(N-(1-трет-бутоксикарбонилпирролидин-2-илкарбонил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ЯМР(DMSO-d6):

Пример 26(16)
4-(2-(N-(2-(N'-трет-бутоксикарбониламино)ацетил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,31 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 26(17)
4-(2-(N-(3-(N'-трет-бутоксикарбониламино)пропаноил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 26(18)
4-(2-(N-(2-(N',N'-диметиламино)ацетил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,62 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 26(19)
4-(2-(N-(4-(N'-трет-бутоксикарбониламино)бутаноил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,67 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27
4-(2-(N-бензиламино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
Соединение, полученное в ссылочном примере 13, (40 мг), йодид натрия (8,4 мг) и бензиламин (0,21 мл) перемешивали при комнатной температуре в течение 10 часов. К реакционной смеси добавляли метиленхлорид и насыщенный водный раствор бикарбоната натрия, смесь разделяли. Органический слой сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (хлороформ: метанол = 50:1) с получением соединения согласно настоящему изобретению (18 мг), имеющего следующие физические характеристики.
TLC: Rf 0,29 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(1) - пример 27(80)
Посредством такой же процедуры, которая описана в примере 27, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом с использованием соединения, полученного в ссылочном примере 13, или соответствующего производного и соответствующего производного вместо бензиламина.
Пример 27(1)
4-(2-(морфолин-4-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,38 (хлороформ: метанол: уксусная кислота = 90:10:1);
ЯМР(CD3OD):

Гидрохлорид:
ТСХ: Rf 0,24 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(2)
Гидрохлорид 4-(2-(пирролидин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,12 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(3)
Дигидрохлорид 4-(2-(4-метилпиперазин-1-ил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,32 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(4)
Гидрохлорид 4-(2-(пиперидин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,34 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6 ):

Пример 27(5)
Гидрохлорид 4-(2-(N-циклогексиламино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,34 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(6)
Гидрохлорид 4-(2-(азепан-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,28 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(7)
4-(2-(4-трет-бутоксикарбонилпиперазин-1-ил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,29 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(8)
Гидрохлорид 4-(2-(тиоморфолин-4-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,40 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(9)
Гидрохлорид 4-(2-(N-(2-пропинил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,28 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(10)
4-(2-(4-этилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,19 (хлороформ: метанол = 5:1);
ЯМР(CD3OD):

Пример 27(11)
Гидрохлорид 4-(2-(N-циклогексилметиламино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,49 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(12)
4-(2-(азокан-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (хлороформ: метанол = 5:1);
ЯМР(CD3OD):

Пример 27(13)
4-(2-(4-метил-1,4-диазепан-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,29 (хлороформ: метанол: насыщенный водный раствор аммиака = 5:1:0,1);
ЯМР(CD3OD):

Пример 27(14)
4-(2-(N-(2-(N'-трет-бутоксикарбониламино)этил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,47 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 27(15)
4-(2-(4-фенилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,50 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(16)
4-(2-(4-(2-хлорфенил)пиперазин-1-ил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (хлороформ: метанол = 9:1);
ЯМР(CDCl3):

Пример 27(17)
4-(2-(4-бензилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0, 43 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(18)
4-(2-(N-(4-трифторметилбензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,33 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(19)
4-(2-(N-метил-N-бензиламино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,32 (хлороформ: метанол = 9:1);
ЯМР(CD3 OD):

Метансульфонат:
ТСХ: Rf 0,44 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(20)
4-(2-(N-(2-фенилэтил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (метанол: метиленхлорид = 1:10);
ЯМР(CD3OD):

Пример 27(21)
4-(2-(N-(4-трифторметоксибензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,37 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(22)
4-(2-(4-(пиридин-2-ил)пиперазин-1-ил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,55 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(23)
4-(2-(N-(2-(N'-фениламино)этил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,26 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(24)
4-(2-(4-ацетилпиперазин-1-ил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,21 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(25)
4-(2-(N-(нафтален-1-илметил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,45 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 27(26)
4-(2-(N-этил-N-бензиламино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(27)
4-(2-(N-(1-бензилпиперидин-4-ил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,17 (метиленхлорид: метанол: вода = 9:1:0,1);
ЯМР(CD3OD):

Пример 27(28)
4-(2-(N-(2-гидроксиэтил)-N-бензиламино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (метиленхлорид: метанол = 9: 1);
ЯМР(CD3OD):

Пример 27(29)
4-(2-(4-циклогексилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,55 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(30)
4-(2-(N-(4-фторбензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,50 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Гидрохлорид:
ТСХ: Rf 0,43 (метиленхлорид: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(31)
4-(2-(N-(4-метоксибензил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,39 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 4:1:0,3);
ЯМР(CD3OD):

Пример 27(32)
4-(2-(N-(1-фенилэтил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,38 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(33)
4-(2-(N-(3-фторбензил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,39 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(34)
4-(2-(4-дифенилметилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,48 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(35)
4-(2-(N-(3-метоксибензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(36)
Гидрохлорид 8-(2-(пиперидин-1-ил)этил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,26 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(37)
4-(2-(N-(2-феноксиэтил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,62 (метиленхлорид: метанол: вода = 4:1:0,2);
ЯМР(CD3OD):

Пример 27(38)
4-(2-(4-бензилоксикарбонил-1, 4-диазепан-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,67 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 4:1:0,3);
ЯМР(CD3OD):

Метансульфонат:
ТСХ: Rf 0,64 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(39)
Дигидрохлорид 4-(2-(4-циклопентилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,14 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(40)
Дигидрохлорид 4-(2-(4-бутилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,16 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(41)
Тригидрохлорид 8-(2-(4-циклогексилпиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,36 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(42)
Гидрохлорид 4-(2-(N-(4-хлорбензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,75 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 27(43)
Дигидрохлорид 4-(2-(4-гексилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,68 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(44)
Дигидрохлорид 4-(2-(4-изопропилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,25 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(45)
Гидрохлорид 4-(2-(N-(2-фторбензил)амино)этил)-5,6, 7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,65 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(46)
Гидрохлорид 4-(2-(N-(3-метоксипропил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,42 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(47)
Дигидрохлорид 8-(2-(N-(4-фторбензил)амино)этил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,30 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(48)
Гидрохлорид 4-(2-(N-(фуран-2-илметил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,32 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 27(49)
Гидрохлорид 4-(2-(N-(4-метилбензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0, 16 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 27(50)
Гидрохлорид 4-(2-(N-(2-метоксибензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,34 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(51)
Гидрохлорид 4-(2-(N-(3-метилтиопропил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,069 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(52)
4-(2-(N-(пиридин-4-илметил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,39 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(53)
Тригидрохлорид 8-(2-(4-этилпиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,26 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(54)
Дигидрохлорид 4-(2-(4-(4-фторфенил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,60 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(55)
Тригидрохлорид 4-(2-(4-(пиридин-4-ил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,14 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(56)
Тригидрохлорид 8-(2-(4-циклопентилпиперазин-1-ил)этил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,45 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(57)
Тригидрохлорид 8-(2-(4-изопропилпиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,26 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 27(58)
Гидрохлорид 4-(2-(N-(тиофен-2-илметил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,32 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 27(59)
Дигидрохлорид 4-(2-(4-(2-метоксифенил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,72 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(60)
4-(2-(N-метил-N-(2-(N',N'-диметиламино)этил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,13 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 4:1:0,5);
ЯМР(CD3OD):

Пример 27(61)
Дигидрохлорид 4-(2-(4-(3-метоксифенил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,54 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(62)
Дигидрохлорид 4-(2-(4-((2E)-3-фенил-2-пропенил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,53 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(63)
Дигидрохлорид 4-(2-(4-(1-метилпропил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,13 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(64)
Гидрохлорид 4-(2-(4-(фуран-2-илкарбонил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,42 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(65)
Метансульфонат 4-(2-(N-(3-хлорбензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,38 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(66)
8-(2-(N-бензиламино)этил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,42 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(67)
8-(2-(N-(2-(N'-фениламино)этил)амино)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,23 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(68)
Тригидрохлорид 8-(2-(4-гексилпиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,51 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(69)
4-(2-(N-(2,4-дифторбензил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,15 (метанол: метиленхлорид = 1:10).
Пример 27(70)
Дигидрохлорид 4-(2-(4-(2-метилпропил)пиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0, 63 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(71)
Тригидрохлорид 8-(2-(4-(4-фторфенил)пиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,69 (метиленхлорид: метанол = 9:1);
ЯМР(CD3OD):

Пример 27(72)
Метансульфонат 8-(2-(4-(пиридин-4-ил)пиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,12 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(73)
Метансульфонат 8-(2-(4-(4-метоксифенил)пиперазин
-1-ил)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,65 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 27(74)
4-(2-(N-метил-N-(3-(N',N'-диметиламино)пропил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,10 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 4:1:0,5%);
ЯМР(CD3OD):

Пример 27(75)
4-(2-(N-(2-(N',N'-диэтиламино)этил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,13 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 4:1:0,5%);
ЯМР(CD3OD):

Пример 27(76)
8-(2-(морфолин-4-ил)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
Свободная форма:
ТСХ: Rf 0,60 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0,52 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 27(77)
Метансульфонат 8-(2-(4-метил-1,4-диазепан-1-ил)этил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,41 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,1);
ЯМР(DMSO-d6):

Пример 27(78)
Дигидрохлорид 4-(2-(4-циклогексилметилпиперазин-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,52 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(79)
Тригидрохлорид 8-(2-(4-бутилпиперазин-1-ил)этил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,28 (метиленхлорид: метанол = 4:1);
ЯМР(CD3OD):

Пример 27(80)
4-(5-(морфолин-4-ил)пентил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,43 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 28
Метансульфонат 4-(3-(N-(5-(морфолин-4-ил)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
Смесь соединения, полученного в примере 25(1), (115 мг) и морфолина (0, 5 мл) кипятили с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали. К остатку добавляли воду, остаток экстрагировали этилацетатом. Экстракт промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток перекристаллизовывали из смеси растворителей изопропанола и гексана. Раствор полученного твердого вещества (56,2 мг) и метансульфокислоты (13,2 мг) в метаноле (3,0 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали с получением соединения согласно настоящему изобретению (67,9 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,41 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 28(1) - пример 28(42)
Посредством такой же процедуры, которая описана в примере 28, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примере 25(1), или соединения, полученного в примере 23(23), 23(24), 23(29), 23(37), 25, 25(2), 25(6) - 25(8), 25(11) - 25(13), 26(2) или 26(5), и морфолина или соответствующего производного.
Пример 28(1)
Метансульфонат 4-(3-(N-(4-(морфолин-4-ил)бутаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,22 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 28(2)
Метансульфонат 4-(3-(N-(5-(4-метоксипиперидин-1-ил)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,29 (метанол: метиленхлорид = 2:3);
ЯМР(DMSO-d6):

Пример28(3)
Метансульфонат 4-(3-(N-(2-(2-(морфолин-4-ил)этокси)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,50 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 28(4)
Метансульфонат 4-(3-(N-(4-(морфолин-4-ил)бутаноил)амино)фенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,16 (хлороформ: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 28(5)
Метансульфонат 4-(3-(N-(5-(N'-(2-пропинил)амино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,30 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 28(6)
Метансульфонат 4-(3-(N-(5-(N'-(2-метил-2-пропенил)амино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,36 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:9:0,1);
ЯМР(DMSO-d6):

Пример 28(7)
Метансульфонат 4-(3-(N-(5-(1,2,3, 6-тетрагидропиридин-1-ил)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,48 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(8)
Метансульфонат 4-(3-(N-(5-(N'-циклопропиламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,35 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(9)
Метансульфонат 4-(3-(N-(4-(морфолин-4-ил)бутаноил)амино)фенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,69 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(10)
Гидрохлорид 4-(3-(N-(2-(2-(пиперидин-1-ил)этокси)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,30 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 28(11)
Гидрохлорид 4-(3-(N-(2-(2-(пирролидин-1-ил)этокси)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,55 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:9:0,1);
ЯМР(DMSO-d6):

Пример 28(12)
Гидрохлорид 4-(3-(N-(5-(3-метоксипиперидин-1-ил)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,45 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(13)
Гидрохлорид 4-(3-(N-(2-(морфолин-4-ил)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,44 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 28(14)
Гидрохлорид 4-(3-(N-(2-(N'-(2-пропинил)амино)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,43 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 28(15)
Гидрохлорид 4-(3-(N-(2-(N'-циклобутиламино)ацетил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,40 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 28(16)
Гидрохлорид 4-(3-(N-(3-(морфолин-4-ил)пропаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,41 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 28(17)
Гидрохлорид 4-(3-(N-(3-(N'-(2-пропинил)амино)пропаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,40 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 28(18)
Гидрохлорид 4-(3-(N-(4-(N'-(2-пропинил)амино)бутаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,25 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 28(19)
Дигидрохлорид 8-(3-(N-(4-(морфолин-4-ил)бутаноил)амино)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,54 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(20)
4-(2-(N-(2-(пирролидин-1-ил)ацетил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,43 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(21)
4-(N-(2-(N'-циклобутиламино)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,21 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(22)
4-(N-(2-(азепан-1-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,29 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6 ):

Гидрохлорид:
ТСХ: Rf 0,34 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(23)
4-(2-(N-(3-(N'-циклобутиламино)пропаноил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,17 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(24)
4-(2-(N-(3-(пиперидин-1-ил)пропаноил)амино)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,26 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 28(25)
4-(N-(2-(N'-метил-N'-изопропиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,25 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(26)
4-(N-(2-(N'-циклопропиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,43 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(27)
4-(N-(3-(пиперидин-1-ил)пропил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,20 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(28)
Бромгидрат 4-(N-(2-(N'-циклопентиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,35 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 28(29)
Бромгидрат 4-(N-(3-(N'-циклобутиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,30 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 28(30)
Бромгидрат 4-(N-(4-(N'-циклобутиламино)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,26 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 28(31)
Бромгидрат 4-(N-(2-(N'-циклогексиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,18 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 28(32)
Бромгидрат 4-(N-(4-(N'-метиламино)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,063 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(33)
Бромгидрат 4-(N-(4-(N'-циклопентиламино)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,28 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(34)
Бромгидрат 4-(N-(3-(N'-циклопентиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,56 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(35)
Бромгидрат 4-(N-(4-(N'-циклогексиламино)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,56 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(36)
4-(N-(3-(N'-циклопропиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(37)
4-(N-(4-(N'-циклопропиламино)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,44 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(38)
Гидрохлорид 4-(N-метил-N-(3-(N'-циклогексиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,20 метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(39)
Гидрохлорид 4-(N-метил-N-(3-(N'-циклопентиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,20 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(40)
Гидрохлорид 4-(N-метил-N-(3-(N'-циклобутиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,24 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(41)
Гидрохлорид 4-(N-метил-N-(3-(N'-циклопропиламино)пропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,24 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 28(42)
4-(N-(4-(морфолин-4-ил)бутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,38 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Гидрохлорид:
ТСХ: Rf 0,37 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:9:0,1);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0,34 (метанол: метиленхлорид: 28% аммиачная вода = 1:9:0,1);
ЯМР(DMSO-d6):

Пример 29
Метансульфонат 4-(3-(N-(5-аминопентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
Смесь соединения, полученного в примере 26(4), (430 мг) и 10% палладия-на угле (86,0 мг) в метаноле (5,0 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 10 часов. Реакционную смесь фильтровали через целит. Фильтрат концентрировали. Полученный порошок перекристаллизовывали из этилацетата с получением свободной формы указанного в заголовке соединения (268 мг). Суспензию полученной свободной формы (264 мг) и метансульфоната (74,6 мг) в метаноле (3,0 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали с получением соединения согласно настоящему изобретению (307 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,28 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 4:8:0,1);
ЯМР(CD3OD):

Пример 29(1) - пример 29(6)
Посредством такой же процедуры, которая описана в примере 29, если необходимо, следующие соединения согласно настоящему изобретению были синтезированы путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примерах 26(6) - 26(8), 26(12), 24(31) или 27(38), вместо соединения, полученного в примере 26(4).
Пример 29(1)
Метансульфонат 4-(3-(N-(5-(N'-метиламино)пентаноил)амино)фенил)-7,8,9, 9a-тетрагидро-2H-пиридо[1,2-d][1,2,4]триазин-1(6H)-она
ТСХ: Rf 0,34 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,2);
ЯМР(CD3OD):

Пример 29(2)
Метансульфонат 4-(3-(N-(5-(N'-метиламино)пентаноил)амино)фенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,26 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,2);
ЯМР(CD3OD):

Пример 29(3)
Метансульфонат 4-(3-(N-(5-(N'-метиламино)пентаноил)амино)фенил)-2,5,6,7,8,9-гексагидро-1H-циклогепта[d]пиридазин-1-она
ТСХ: Rf 0,29 (хлороформ: метанол: 28% аммиачная вода = 40:10:1);
ЯМР(DMSO-d6):

Пример 29(4)
Гидрохлорид 4-(3-(N-(5-(N'-метиламино)пентаноил)амино)фенил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,34 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 29(5)
4-(N-(2-(пиперидин-4-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,14 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,1);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0,43 (метиленхлорид: метанол: 28% аммиачная вода = 6:3:1);
ЯМР(DMSO-d6):

Пример 29(6)
4-(2-(1,4-диазепан-1-ил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,083 (метиленхлорид: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30
Метансульфонат 4-(3-(N-(5-(N'-метиламино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
К раствору соединения, полученного в примере 26, (290 мг) в метаноле (3,0 мл) добавляли по каплям 4н. хлористый водород в диоксане (2,50 мл) на ледяной бане, смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метанол: метиленхлорид = 1:9→ метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1). К суспензии полученного твердого вещества (134 мг) в метаноле (1,0 мл) добавляли по каплям 1н. раствор гидроксида натрия и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Раствор полученного твердого вещества (64,8 мг) и метансульфоната (17,6 мг) в метаноле (3,0 мл) перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали с получением соединения согласно настоящему изобретению (82,4 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,27 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,5);
ЯМР(CD3OD):

Пример 30(1) - пример 30(19)
Посредством такой же процедуры, которая описана в примере 30, если необходимо, следующие соединения согласно настоящему изобретению были синтезированы путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примере 26(9), 26(10), 26(11), 23, 26(14), 26(15), 23(3), 23(4), 23(9), 23(16), 26(16), 27(7), 23(21), 26(17), 27(14), 26(19), 23(25), 23(33) или 24(48), вместо соединения, полученного в примере 26.
Пример 30(1)
Метансульфонат 4-(3-(N-(4-(N'-метиламино)бутаноил)амино)фенил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,20 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 30(2)
Метансульфонат 4-(3-(N-(6-(N'-метиламино)гексаноил)амино)фенил)-6,7,9, 9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-она
ТСХ: Rf 0,17 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 30(3)
Гидрохлорид 4-(3-(N-(5-(N'-(3-метил-2-бутенил)амино)пентаноил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,34 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30(4)
4-(N-(2-аминоэтил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,19 (метиленхлорил: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Гидрохлорид:
ТСХ: Rf 0,44 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,2);
ЯМР(DMSO-d6):

Пример 30(5)
Гидрохлорид 4-(3-(N-(азетидин-3-илкарбонил)амино)фенил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,18 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30(6)
Гидрохлорид 4-(3-(N-(пирролидин-2-илкарбонил)амино)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,53 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 30(7)
Гидрохлорид 4-(N-(3-аминопропил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,41 (этилацетат: уксусная кислота: вода = 3:3:1);
ЯМР(DMSO-d6):

Пример 30(8)
Гидрохлорид 4-(N-(2-(N'-метиламино)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,29 (этилацетат: уксусная кислота: вода = 3:3:1);
ЯМР(DMSO-d6):

Пример 30(9)
Гидрохлорид 4-(1-(N-(2-аминоэтил)карбамоил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,62 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,2);
ЯМР(DMSO-d6):

Пример 30(10)
Гидрохлорид 4-(N-(4-аминобутил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,15 (этилацетат: уксусная кислота: вода = 3:1:1);
ЯМР(DMSO-d6):

Пример 30(11)
Гидрохлорид 4-(2-(N-(2-аминоацетил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,11 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30(12)
Дигидрохлорид 4-(2-(пиперазин-1-ил)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,15 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 30(13)
Гидрохлорид 4-(1-(N-(4-аминобутил)карбамоил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,19 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,1);
ЯМР(DMSO-d6):

Пример 30(14)
Гидрохлорид 4-(2-(N-(3-аминопропаноил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,11 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30(15)
Дигидрохлорид 4-(2-(N-(2-аминоэтил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0, 10 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,1);
ЯМР(DMSO-d6):

Пример 30(16)
Гидрохлорид 4-(2-(N-(4-аминобутаноил)амино)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,10 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30(17)
Гидрохлорид 4-(N-(5-аминопентил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,34 (хлороформ: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 30(18)
Гидрохлорид 4-(2-(N-(2-аминоэтил)карбамоил)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,18 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 30(19)
Дигидрохлорид 8-(N-(3-аминопропил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,25 (метанол: уксусная кислота = 5:1);
ЯМР(DMSO-d6):

Пример 31
4-(2-ацетилтиоэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К раствору соединения, полученного в ссылочном примере 13, (650 мг) в диметилформамиде (15 мл) добавляли тиоацетат калия (698 мг) и карбонат калия (422 мг) и смесь перемешивали при 50°С в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь выливали в холодную воду и экстрагировали этилацетатом. Экстракт промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали с получением соединения согласно настоящему изобретению (688 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,40 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 31(1)
8-(2-ацетилтиоэтил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
Посредством такой же процедуры, которая описана в примере 31, при использовании соответствующего производного вместо соединения, полученного в ссылочном примере 13, было синтезировано соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
TLC: Rf 0,43 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 32
4-(2-бензилтиоэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К суспензии соединения, полученного в примере 31, (100 мг) в метаноле (4,0 мл) добавляли бензилбромид (0,06 мл) и карбонат калия (82 мг) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в холодную 0,5н. соляную кислоту и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 70:1→30:1) с получением соединения согласно настоящему изобретению (47 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,42 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 32(1) и пример 32(2)
Посредством такой же процедуры, которая описана в примере 32, если необходимо, следующие соединения согласно настоящему изобретению были получены путем превращения в соответствующие соли обычным способом при использовании соответствующего производного вместо бензилбромида.
Пример 32(1)
4-(2-(3-(пиперидин-1-ил)пропилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,57 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 32(2)
4-(2-(2-(пиперидин-1-ил)этилтио)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,28 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Гидрохлорид:
ТСХ: Rf 0,28 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 33
4-(2-(2-гидроксиэтилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К раствору 4-(2-(2-трет-бутилдиметилсилилоксиэтилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она (300 мг; соединение было получено посредством такой же процедуры, которая описана в примере 32, при использовании 1-трет-бутилдиметилсилилокси-2-йодэтана вместо бензилбромида) в тетрагидрофуране (4,0 мл) добавляли тетрабутиламмонийфторид (638 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в холодный насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Остаток промывали трет-бутилметиловым эфиром с получением соединения (191 г) согласно настоящему изобретению, имеющего следующие физические характеристики.
ТСХ: Rf 0,36 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 33(1) - пример 33(3)
Посредством такой же процедуры, которая описана в примере 33, при использовании 4-(2-(3-трет-бутилдиметилсилилоксипропилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она, 8-(2-(2-трет-бутилдиметилсилилоксиэтилтио)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она или 8-(2-(3-трет-бутилдиметилсилилоксипропилтио)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она вместо 4-(2-(2-трет-бутилдиметилсилилоксиэтилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она, следующие соединения согласно настоящему изобретению были получены.
Пример 33(1)
4-(2-(3-гидроксипропилтио)этил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
TCX: Rf 0,37 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 33(2)
8-(2-(2-гидроксиэтилтио)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,31 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 33(3)
8-(2-(3-гидроксипропилтио)этил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,32 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 34
4-(2-(2-бромэтилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К раствору соединения, полученного в примере 33, (160 мг) в хлороформе (5,0 мл) добавляли трифенилфосфин (248 мг) и тетрабромметан (313 мг) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли по каплям метанол (1,0 мл), смесь перемешивали в течение 5 минут и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 80:1→50:1) с получением сырого соединения согласно настоящему изобретению (598 мг), имеющего следующие физические характеристики. Полученное соединение использовали в следующей реакции без очистки.
ТСХ: Rf 0,49 (хлороформ: метанол = 8:1);
ЯМР(CD3OD):

Пример 35
4-(2-(3-хлорпропилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
К суспензии соединения, полученного в примере 33(1), (110 мг) в метиленхлориде (2,1 мл) добавляли тионилхлорид (0,08 мл) и пиридин (0,01 мл) и смесь перемешивали при комнатной температуре в течение 1 дня. Реакционную смесь выливали в холодную воду и экстрагировали метиленхлоридом. Экстракт промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали с получением соединения согласно настоящему изобретению (109 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,49 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 36 и пример 36(1)
Посредством такой же процедуры, которая описана в примере 28, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примере 34 или 35, вместо соединения, полученного в примере 25(1), и циклопентиламина вместо морфолина.
Пример 36
4-(2-(2-(N-циклопентиламино)этилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,36 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 36(1)
Гидрохлорид 4-(2-(3-(N-циклопентиламино)пропилтио)этил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,38 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 37
Метансульфонат 8-(3-(N-(5-(N'-метиламино)пентаноил)амино)фенил)-2,3,4,6-тетрагидропиразино[2, 3-d]пиридазин-5(1H)-она
Посредством такой же процедуры, которая описана в ссылочном примере 1→примере 1→примере 26→примере 29, при использовании фуро[3, 4-d]пиразин-5,7-диона вместо 4,5,6,7-тетрагидро-2-бензофуран-1,3-диона было синтезировано соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,17 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 1:4:0,2);
ЯМР(CD3OD):

Пример 38
4-(N-(2-(1H-тетразол-5-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Смесь соединения, полученного в примере 23(34), (180 мг), азида триметилолова (285 мг) и толуола (1,5 мл) кипятили с обратным холодильником в течение ночи. Реакционную смесь концентрировали. Остаток промывали последовательно этилацетатом и горячим метанолом с получением соединения согласно настоящему изобретению (113 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,14 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 39
6-ацетил-4-фенил-5,6,7, 8-тетрагидропиридо[3,4-d]пиридазин-1(2H)-он
К суспензии соединения, полученного в примере 11(1), (150 мг) в тетрагидрофуране (2,9 мл) добавляли водный раствор (1,1 мл) карбоната калия (157 мг) и затем к смеси добавляли ацетилхлорид (0,05 мл) при 00С, смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь разбавляли водой и добавляли 1н. раствор соляной кислоты. Смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток промывали эфиром с получением соединения согласно настоящему изобретению (131 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,36 (хлороформ: метанол = 8:1);
ЯМР(DMSO-d6):

Пример 39(1)
Гидрохлорид 6-(2-(N,N-диметиламино)ацетил)-4-фенил-5,6,7,8-тетрагидропиридо[3,4-d]пиридазин-1(2H)-она
Посредством такой же процедуры, которая описана в примере 39, и затем путем превращения в соответствующую соль обычным способом при использовании 2-диметиламиноацетилхлорида вместо ацетилхлорида получали соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,57 (хлороформ: метанол = 4:1);
ЯМР(DMSO-d6):

Пример 40
4-(N-(2-карбоксиэтил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Посредством такой же процедуры, которая описана в ссылочном примере 11, при использовании соединения, полученного в примере 23(36), вместо соединения, полученного в примере 15, было синтезировано соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,26 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 41
4-(N-(2-(4-гидроксифенил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Посредством такой же процедуры, которая описана в примере 20, при использовании соединения, полученного в примере 24(41), вместо соединения, полученного в примере 4(4), было синтезировано соединение имеющее следующие физические характеристики.
ТСХ: Rf 0,35 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Ссылочный пример 18
3-гидрокси-4,5,6,7-тетрагидро-2-бензофуран-1(3H)-он
К раствору ангидрида 3,4,5,6-тетрагидрофталевой кислоты (10,0 г) в тетрагидрофуране (50,0 мл) добавляли борогидрид натрия (600 мг) на ледяной бане. Смесь перемешивали при комнатной температуре в течение 30 минут и кипятили с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры, к реакционной смеси добавляли 1н. раствор соляной кислоты (10,0 мл), смесь концентрировали. Воду добавляли к остатку, который затем экстрагировали этилацетатом. Экстракт промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат: гексан = 1:4) с получением указанного в заголовке соединения (5,40 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,64 (этилацетат: гексан = 1:1);
ЯМР(CDCl3):

Ссылочный пример 19
Трибутил(3-оксо-1,3,4,5,6,7-гексагидро-2-бензофуран-1-ил)фосфонийбромид
Смешанный раствор соединения, полученного в ссылочном примере 18, (1,54 г), три-n-бутилфосфина (2,02 г) и уксуснокислый раствор бромистого водорода (47%, 1,20 мл) в уксусной кислоте (0,700 мл) кипятили с обратным холодильником в течение 21 часа. После охлаждения до комнатной температуры, реакционную смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 20:1) с получением указанного в заголовке соединения (3.56 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,51 (метанол: метиленхлорид = 1:10).
Ссылочный пример 20
3-бензилиден-4,5,6,7-тетрагидро-2-бензофуран-1(3H)-он
К раствору соединения, полученного в ссылочном примере 19, (419 мг) и бензальдегида (106 мг) в метиленхлориде (4,00 мл) добавляли триэтиламин (0,130 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом. Экстракт промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат: гексан = 1:8) с получением указанного в заголовке соединения (206 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,83 (гексан: этилацетат = 2:1).
Пример 42
4-бензил-5,6,7,8-тетрагидрофталазин-1(2H)-он
Раствор соединения, полученного в ссылочном примере 20, (206 мг) и моногидрата гидразина (49, 0 мкл) в этаноле (4,00 мл) кипятили с обратным холодильником в течение 1 часа. К реакционной смеси добавляли моногидрат гидразина (49,0 мкл), смесь кипятили с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры, образовавшиеся кристаллы собирали фильтрованием. Кристаллы промывали этанолом и гексаном и сушили при пониженном давлении с получением соединения согласно настоящему изобретению (152 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,63 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6 ):

Пример 43 - пример 43(6)
Посредством такой же процедуры, которая описана в ссылочном примере 20→примере 42, при использовании соответствующего производного вместо бензальдегида были синтезированы следующие соединения согласно настоящему изобретению.
Пример 43
4-(2-фенилэтил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,51 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 43(1)
4-(пиридин-3-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,42 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 43(2)
4-(пиридин-2-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,59 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 43(3)
4-(5-метилфуран-2-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,68 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 43(4)
4-(2-нитробензил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,59 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 43(5)
4-(3-нитробензил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ЯМР(DMSO-d6):

Пример 43(6)
4-(4-нитробензил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,60 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 44
4-(2-аминобензил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Смесь раствора соединения, полученного в примере 43(4), (145 мг) и 10% палладия-на угле (30,0 мг) в метаноле (15,0 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 30 минут. Реакционную смесь фильтровали через целит. Фильтрат концентрировали с получением соединения согласно настоящему изобретению (129 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,42 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 44(1) и пример 44(2)
Посредством такой же процедуры, которая описана в примере 44, при использовании соединения, полученного в примере 43(5) или 43(6), вместо соединения, полученного в примере 43(4), были синтезированы следующие соединения согласно настоящему изобретению.
Пример 44(1)
4-(3-аминобензил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Свободная форма:
ТСХ: Rf 0,38 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0,53(метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 44(2)
4-(4-аминобензил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
TCXC: Rf 0,44 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 45
4-фенил-2,5,6,7-тетрагидро-1H-циклопента[d]пиридазин-1-он
Раствор (4aS,7aR)-4-фенил-2,4a,5,6,7,7a-гексагидро-1H-циклопента[d]пиридазин-1-она (210 мг; соединение было получено посредством такой же процедуры, которая описана в примере 1, при использовании (1R, 2S)-2-бензоилциклопентанкарбоновой кислоты вместо соединения, полученного в ссылочном примере 1), и тионилхлорида (0,500 мл) в бензоле (3,00 мл) кипятили с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры, реакционную смесь концентрировали. Остаток перекристаллизовывали из этилацетата с получением соединения согласно настоящему изобретению (154 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,21 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Ссылочный пример 21
6-фенил-5H-пирроло[3,4-b]пиридин-5,7(6H)-дион
К раствору ангидрида 2,3-пиридинкарбоновой кислоты (19,4 г) в тетрагидрофуране (260 мл) добавляли анилин (11,8 мл) и смесь кипятили с обратным холодильником в течение 2 часов. Реакционную смесь концентрировали. К реакционной смеси добавляли уксусный ангидрид (65 мл), смесь кипятили с обратным холодильником в течение 1,5 часов. После охлаждения на ледяной бане, реакционную смесь выливали в ледяную воду (200 мл) и перемешивали в течение 1 часа. Образовавшийся осадок собирали фильтрованием. Осадок промывали водой и затем промывали этанолом при нагревании с получением указанного в заголовке соединения (20,9 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,31 (гексан: этилацетат = 1:1);
ЯМР(CDCl3):

Ссылочный пример 22
7-(3-аминофенил)-7-гидрокси-6-фенил-6,7-дигидро-5H-пирроло[3, 4-b]пиридин-5-он
Раствор 3-(бис(триметилсилил)амино)фенилмагнийхлорида в тетрагидрофуране (5,50 мл, 1,0M) добавляли по каплям к суспензии соединения, полученного в ссылочном примере 21, (1,12 г) в тетрагидрофуране (20 мл) на ледяной бане и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли по каплям 1н. раствор соляной кислоты (10 мл), смесь перемешивали в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (10 мл), смесь экстрагировали этилацетатом. Экстакт промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток промывали этилацетатом при нагревании с получением указанного в заголовке соединения (1,35 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,52 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Ссылочный пример 23
2-(3-аминобензоил)никотиновая кислота
К соединению, полученному в ссылочном примере 22, (3,17 г) добавляли 6н. раствор соляной кислоты (20 мл) и смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали на ледяной бане, рН смеси доводили до рН 5 посредством 5н. раствора гидроксида натрия (24 мл) и концентрировали. Остаток перегоняли в виде азеотропной смеси с этанолом и суспендировали в этаноле (50 мл) при кипячении с обратным холодильником. Ненужный хлорид натрия отделяли фильтрованием. Фильтрат концентрировали. Остаток промывали изопропанолом (15 мл) при нагревании с получением указанного в заголовке соединения (2,13 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,49 (метиленхлорид: метанол: уксусная кислота = 8:1:1);
ЯМР(DMSO-d6):

Ссылочный пример 24
8-(3-аминофенил)пиридо[2,3-d]пиридазин-5(6H)-он
К суспензии соединения, полученного в ссылочном примере 23, (1,94 г) в этаноле (40 мл) добавляли моногидрат гидразина (400 мг) и смесь кипятили с обратным холодильником в течение ночи. После охлаждения реакционной смеси до комнатной температуры, образовавшийся осадок собирали фильтрованием. Осадок промывали этанолом с получением указанного в заголовке соединения (1,70 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,54 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 46
8-(3-аминофенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
К суспензии соединения, полученного в ссылочном примере 24, (1,67 г) и окиси платины (83 мг) в диметилформамиде (35 мл) добавляли 6н. раствор соляной кислоты (2,5 мл) и смесь перемешивали в течение 8 часов в атмосфере водорода. Реакционную смесь фильтровали через целит. Фильтрат концентрировали. К остатку добавляли насыщенный водный раствор бикарбоната натрия, остаток экстрагировали тетрагидрофураном три раза. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток растворяли в метаноле (35 мл) при нагревании. К смеси добавляли активированный уголь (340 мг), смесь перемешивали в течение 15 минут. Активированный уголь удаляли фильтрованием через целит. Фильтрат концентрировали. Остаток промывали изопропанолом при нагревании с получением соединения согласно настоящему изобретению (1,25 г; свободная форма), имеющего следующие физические характеристики. Полученное соединение (242 мг) суспендировали в метаноле (4 мл). Раствор метансульфокислоты (96 мг) в метаноле (1 мл) добавляли к смеси и перемешивали. Образовавшиеся кристаллы собирали фильтрованием. Кристаллы промывали метанолом с получением соединения согласно настоящему изобретению (258 мг; метансульфонат), имеющего следующие физические характеристики.
Свободная форма:
ТСХ: Rf 0,40 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Метансульфонат:
ТСХ: Rf 0,40 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

3 H) 3,13(м, 2 H), 2,40(т, J = 6,0 Гц, 2 H), 2,35(с, 3 H), 1,73(м, 2 H).
Пример 47 - пример 47(13)
Посредством такой же процедуры, которая описана в ссылочном примере 21→ссылочном примере 22→ссылочном примере 23→ссылочном примере 24→примере 46, если необходимо, были получены следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании фуро[3, 4-b]пиридин-5,7-диона или соответствующего производного и соответствующее производное вместо 3-(бис(триметилсилил)амино)фенилмагнийхлорида.
Пример 47
Метансульфонат 8-(3-(N,N-диметиламино)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,56 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 47(1)
Метансульфонат 8-бензил-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,51 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 47(2)
Метансульфонат 8-(3-метоксифенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,50 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 47(3)
Метансульфонат 8-(4-аминофенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,25 (метиленхлорид: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 47(4)
Метансульфонат 8-(3-(морфолин-4-илметил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,49 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 47(5)
Метансульфонат 8-(4-(N,N-диметиламино)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,50 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 47(6)
Диметансульфонат 8-(4-(морфолин-4-илметил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0, 51 (метиленхлорид: метанол = 10:1);
ЯМР(CD3OD):

Пример 47(7)
Метансульфонат 8-(2-(морфолин-4-илметил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,54 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 47(8)
Тригидрохлорид 8-(3-(4-этилпиперазин-1-илметил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,42 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 47(9)
Метансульфонат 8-(3-(N,N-диметиламинометил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,27 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 47(10)
Метансульфонат 8-(4-(N,N-диметиламинометил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,82 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 47(11)
Метансульфонат 8-(4-(N,N-диэтиламинометил)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,38 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 47(12)
Метансульфонат 4-(4-(N,N-диметиламинометил)фенил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,49 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 47(13)
Метансульфонат 8-(4-(2-(N,N-диметиламино)этил)фенил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,50 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Ссылочный пример 25
Метиловый эфир 2-(3-аминобензоил)никотиновой кислоты
После охлаждения метанола (5 мл) до -15°C к нему добавляли по каплям тионилхлорид (1,3 мл) и раствор перемешивали в течение 15 минут. К раствору добавляли соединение, полученное в ссылочном примере 23 (1,21 г). Раствор оставляли нагреваться до комнатной температуры и затем кипятили с обратным холодильником в течение ночи. Реакционную смесь концентрировали. К остатку добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток перекристаллизовывали из изопропанола (5 мл) с получением указанного в заголовке соединения (815 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,37 (гексан: этилацетат = 1:3);
ЯМР(DMSO-d6):

Ссылочный пример 26
Метиловый эфир 2-(3-(трифторацетил)аминобензоил)никотиновой кислоты
К раствору соединения, полученного в ссылочном примере 25, (800 мг) в метиленхлориде (15 мл) добавляли последовательно пиридин (505 мкл) и ангидрид трифторуксусной кислоты (529 мкл) на ледяной бане и смесь перемешивали в течение 30 минут. Реакционную смесь разбавляли метиленхлоридом и промывали последовательно 1н. раствором соляной кислоты и водой. Органический слой сушили над безводным сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат = 1:1) с получением указанного в заголовке соединения (1,10 г), имеющего следующие физические характеристики.
ТСХ: Rf 0,48 (гексан: этилацетат = 1:1);
ЯМР(CDCl3):

Ссылочный пример 27
Метиловый эфир 2-(3-(N-метил-N-(трифторацетил)амино)бензоил)никотиновой кислоты
К раствору соединения, полученного в ссылочном примере 26, (1,06 г) в диметилформамиде (12 мл) добавляли гидрид натрия (127 мг) на ледяной бане и смесь перемешивали в течение 30 минут. Метилйодид (224 мкл) добавляли к реакционной смеси, которую перемешивали при 0°С в течение 1 часа и затем при комнатной температуре в течение 6 часов. Реакционную смесь выливали в ледяную воду и экстрагировали смесью растворителей (этилацетат: гексан = 1:1) дважды. Объединенный органический слой промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток перекристаллизовывали из смеси растворителей (изопропанол: гексан = 1:1) с получением указанного в заголовке соединения (892 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,31 (гексан: этилацетат = 1:1);
ЯМР(CDCl3):

Ссылочный пример 28
8-(3-(N-метиламино)фенил)пиридо[2,3-d]пиридазин-5(6H)-он
К раствору соединения, полученного в ссылочном примере 27, (880 мг) в этаноле (12 мл) добавляли раствор моногидрата гидразина (240 мг) в этаноле (3 мл) и смесь кипятили с обратным холодильником в течение ночи. К реакционной смеси добавляли 1н. раствор гидроксида натрия (5 мл), смесь кипятили с обратным холодильником в течение 1 часа. Реакционную смесь охлаждали на ледяной бане и к смеси добавляли 1н. раствор соляной кислоты (5 мл). Выпавший осадок собирали фильтрованием. Осадок промывали водой и затем промывали этанолом при нагревании с получением указанного в заголовке соединения (581 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,39 (метиленхлорид: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 48
Метансульфонат 8-(3-(N-метиламино)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
Посредством такой же процедуры, которая описана в примере 46, при использовании соединения, полученного в ссылочном примере 28, вместо соединения, полученного в ссылочном примере 24, были синтезированы соединения согласно настоящему изобретению, имеющие следующие физические характеристики.
ТСХ: Rf 0,49 (метиленхлорид: метанол = 9:1);
ЯМР(DMSO-d6):

Пример 49
Метансульфонат 8-(4-(N-метиламино)фенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
Посредством такой же процедуры, которая описана в ссылочном примере 25→ссылочном примере 26→ссылочном примере 27→ссылочном примере 28→примере 46, при использовании соответствующего производного вместо соединения, полученного в ссылочном примере 23, были синтезированы соединения согласно настоящему изобретению, имеющие следующие физические характеристики.
ТСХ: Rf 0,39 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 50 - пример 50(4)
Посредством такой же процедуры, которая описана в ссылочном примере 20→примере 42, при использовании соответствующего производного вместо бензальдегида были синтезированы соединения согласно настоящему изобретению, имеющие следующие физические характеристики.
Пример 50
4-(2-феноксиэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,41 (метиленхлорид: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 50(1)
4-(3-феноксипропил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,40 (метиленхлорид: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 50(2)
Гидрохлорид 4-(4-(3-(N,N-диметиламино)пропокси)бензил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,37(метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 50(3)
4-(2-бензилоксиэтил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,54 (метиленхлорид: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 50(4)
4-(хинолин-3-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,53(метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 51 - пример 51(3)
Посредством такой же процедуры, которая описана в примере 27, если необходимо, были синтезированы следующие соединения путем превращения в соответствующие соли обычным способом при использовании соответствующего производного вместо соединения, полученного в ссылочном примере 13, и соответствующего производного вместо бензиламина.
Пример 51
Гидрохлорид 4-(5-(пиперидин-1-ил)пентил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,83(метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 51(1)
8-(2-(4-(2-(морфолин-4-ил)этил)пиперазин-1-ил)этил)-2,3,4,6-тетрагидропиридо[2,3,-d]пиридазин-5(1H)-он
ТСХ: Rf 0,15 (метиленхлорид: метанол: насыщенный водный раствор аммиака = 4:1:0, 5%);
ЯМР(CD3OD):δ 3,69(м, 4H), 3,33(м, 2H), 2,78-2,42(м, 22H), 1,85(м, 2H).
Пример 51(2)
Метансульфонат 8-(2-(4-бензилоксикарбонил-1,4-диазепан-1-ил)этил)-2,3,4,6-тетрагидропиридо[2,3,-d]пиридазин-5(1H)-она
ТСХ: Rf 0,19 (метиленхлорид: метанол = 19:1);
ЯМР(DMSO-d6):

Пример 51(3)
4-(4-(морфолин-4-ил)бутил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
Гидрохлорид:
ТСХ: Rf 0,29 (метиленхлорид: метанол = 10:1);
ЯМР(300 МГц, CD3 OD) 3,10-3,00(м, 4H), 2,37-2,26(м, 4H), 2,25-2,16(м, 2H), 1,85(т, J = 6,9 Гц, 2H), 1,83-1,75(м, 2H), 1,75-1,67(м, 2H), 1,08-0,88(м, 8H).
Метансульфонат:
ТСХ: Rf 0,25 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 52 - пример 52(3)
Посредством такой же процедуры, которая описана в примере 24, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании соответствующего эфирного производного вместо соединения, полученного в примере 15, и соответствующего производного вместо 2-аминоэтанола.
Пример 52
8-(N-(4-гидроксибутил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3,-d]пиридазин-5(1H)-он
ТСХ: Rf 0,54 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 52(1)
8-(N-(4-(морфолин-4-ил)бутил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3,-d]пиридазин-5(1H)-он
ТСХ: Rf 0,22 (метанол: метиленхлорид = 1:4);
ЯМР(DMSO-d6):

Пример 52(2)
Метансульфонат 8-(N-(2-(азепан-1-ил)этил)карбамоилметил)-2, 3,4,6-тетрагидропиридо[2,3,-d]пиридазин-5(1H)-она
ТСХ: Rf 0,39 (метанол: метиленхлорид: насыщенный водный раствор аммиака = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 52(3)
4-(N-(6-гидроксигексил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,23 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 53 и пример 53(1)
Посредством такой же процедуры, которая описана в примере 34, были синтезированы следующие соединения согласно настоящему изобретению при использовании соответствующего производного вместо соединения, полученного в примере 33.
Пример 53
4-(N-(5-бромпентил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,53(метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 53(1)
4-(N-(6-бромгексил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,37 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 54 - пример 54(2)
Посредством такой же процедуры, которая описана в примере 28, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примере 53, 23(23) или 53(1), вместо соединения, полученного в примере 25(1).
Пример 54
4-(N-(5-(морфолин-4-ил)пентил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-он
ТСХ: Rf 0,57 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 54(1)
Метансульфонат 4-(N-(2-(азокан-1-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,67 (метанол: метиленхлорид: 28% аммиачная вода = 2:8:0,1);
ЯМР(DMSO-d6):

Пример 54(2)
Метансульфонат 4-(N-(6-(морфолин-4-ил)гексил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,22 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 55 - пример 55(2)
Посредством такой же процедуры, которая описана в ссылочном примере 22→ссылочном примере 24→примере 20→примере 46, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании соответствующего производного вместо 4-(бис(триметилсилил)амино)фенилмагнийбромида.
Пример 55
8-(3,4-дигидроксифенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,59 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 55(1)
Метансульфонат 8-(4-гидроксифенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она
ТСХ: Rf 0,29 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 55(2)
8-(2-гидроксифенил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,4 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 56 - пример 56(6)
Посредством такой же процедуры, которая описана в примере 46, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примере 43(1), примере 43(2), 23(17), 23(22), 24(11) или 24(16), или при использовании 4-(пиридин-4-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она вместо соединения, полученного в ссылочном примере 24.
Пример 56
Ацетат 4-(пиперидин-3-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,21 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 56(1)
Ацетат 4-(пиперидин-4-илметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,16 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 56(2)
Ацетат 4-(пиперидин-2-илметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,58 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 56(3)
Метансульфонат 4-(N-(пиперидин-2-ил)карбамоилметил)-5, 6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,27 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 56(4)
Метансульфонат 4-(N-(пиперидин-2-илметил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,55 (метиленхлорид: метанол: 28% аммиачная вода = 15:5:1);
ЯМР(DMSO-d6):

Пример 56(5)
Метансульфонат 4-(N-(2-(пиперидин-2-ил)этил)карбамоилметил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,40 (метиленхлорид: метанол: 28% аммиачная вода = 15:5:1);
ЯМР(DMSO-d6):

Пример 56(6)
Метансульфонат 4-(N-(2-(пиперидин-3-ил)этил)карбамоилметил)-5,6,7, 8-тетрагидрофталазин-1(2H)-она
ТСХ: Rf 0,28 (метиленхлорид: метанол: 28% аммиачная вода = 15:5:1);
ЯМР(DMSO-d6):

Пример 57
8-(3-гидроксифенил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
Посредством такой же процедуры, которая описана в примере 20, если необходимо, путем превращения в соответствующие соли обычным способом при использовании соединения, полученного в примере 47(2), вместо соединения, полученного в примере 4(4), были синтезированы соединения согласно настоящему изобретению, имеющие следующие характеристики.
Свободная форма:
ТСХ: Rf 0,33 (метанол: метиленхлорид = 1:20);
ЯМР(DMSO-d6):

Натриевая соль:
ТСХ: Rf 0,43 (метанол: метиленхлорид = 1:9);
ЯМР(DMSO-d6):

Пример 58
8-(N-(2-(пиперидин-4-ил)этил)карбамоилметил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
Смешанный раствор соединения, полученного в примере 24(44), (307 мг), 10% палладия-на угле (307 мг) и муравьинокислого аммония (236 мг) в метаноле (3,00 мл) кипятили с обратным холодильником в течение 30 минут. После охлаждения до комнатной температуры, реакционную смесь фильтровали через целит. Фильтрат концентрировали. Остаток промывали смешанным раствором метанола и этилацетата и сушили при пониженном давлении с получением соединения согласно настоящему изобретению (187 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,13 (метанол: метиленхлорид: уксусная кислота = 1:4:1);
ЯМР(DMSO-d6):

Пример 59
8-(пиридин-2-ил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он (соединение A) и 8-(пиперидин-2-ил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он (соединение B)
В атмосфере аргона, к 8-(пиридин-2-ил)пиридо[2,3-d]пиридазин-5(6H)-ону (118 мг; данное соединение было получено посредством такой же процедуры, которая описана в ссылочном примере 22→ссылочном примере 23→ссылочном примере 24) при использовании бромида пиридин-2-илмагния вместо 3-(бис(триметилсилил)амино)фенилмагнийхлорида) добавляли последовательно метанол (6 мл), метансульфонат (51 мг) и окись платины (12 мг). Реакционную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 5,5 часов. Реакционную смесь фильтровали через целит. Фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 20:1→метиленхлорид: метанол: вода = 8:2:0,2) с получением свободной формы соединения А (14 мг) и метансульфоната соединения В (77 мг), имеющих следующие физические характеристики. Полученные соединения А и В были переведены в соответствующие соли или в свободные формы соединений обычными способами с получением соединений по изобретению, имеющих следующие физические характеристики.
Свободная форма соединения А:
ТСХ: Rf 0,51 (метиленхлорид: метанол = 10:1).
ЯМР(DMSO-d6):

Метансульфонат соединения В:
ТСХ: Rf 0,15 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Свободная форма соединения В:
ТСХ: Rf 0,14 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Метансульфонат соединения А:
ТСХ: Rf 0,50 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Диметансульфонат соединения В:
ТСХ: Rf 0,66 (метиленхлорид: метанол: аммиачная вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 59(1) - пример 59(3)
Посредством такой же процедуры, которая описана в примере 59, если необходимо, были синтезированы следующие соединения согласно настоящему изобретению путем превращения в соответствующие соли обычным способом при использовании 8-(пиридин-3-ил)пиридо[2,3-d]пиридазин-5(6H)-она, 8-(пиридин-4-ил)пиридо[2, 3-d]пиридазин-5(6H)-она или 8-(1-бензилпиридин-4-ил)пиридо[2,3-d]пиридазин-5(6H)-она вместо 8-(пиридин-2-ил)пиридо[2,3-d]пиридазин-5(6H)-она.
Пример 59(1)
Метансульфонат 8-(пиридин-3-ил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она (соединение A) и ацетат 8-(пиперидин-3-ил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она (соединение B)
Соединение А:
ТСХ: Rf 0,66 (метиленхлорид: метанол = 4:1);
ЯМР(DMSO-d6):

Соединение В:
ТСХ: Rf 0,12 (метиленхлорид: метанол: уксусная кислота = 4:1:2%);
ЯМР(DMSO-d6):

Пример 59(2)
Метансульфонат 8-(пиридин-4-ил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-она (соединение A) и 8-(пиперидин-4-ил)-2,3,4, 6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он (соединение B)
Соединение A:
ТСХ: Rf 0,28(метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Свободная форма соединения B:
ТСХ: Rf 0,053 (метиленхлорид: метанол: уксусная кислота = 4:1:2%);
ЯМР(DMSO-d6):

Диметансульфонат соединения B:
ТСХ: Rf 0,86 (метиленхлорид: метанол: вода = 8:2:0,2);
ЯМР(DMSO-d6):

Пример 59(3)
8-(1-циклогексилметилпиперидин-4-ил)-2,3,4,6-тетрагидропиридо[2, 3-d]пиридазин-5(1H)-он
ТСХ: Rf 0,41 (метиленхлорид: метанол: уксусная кислота = 4:1:2%).
Пример 60 - пример 60(7)
Посредством такой же процедуры, которая описана в ссылочном примере 2→ссылочном примере 3→примере 3, были синтезированы следующие соединения согласно настоящему изобретению при использовании этилового эфира тиоморфолин-3-илкарбоновой кислоты или соответствующего производного и соответствующего производного вместо 3-нитробензоилхлорида.
Пример 60
4-циклогексенил-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,18 (гексан: этилацетат = 2:1);
ЯМР(DMSO-d6):

Пример 60(1)
4-(фуран-2-ил)-6,7,9,9a-тетрагидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,37 (гексан: этилацетат = 1:1);
ЯМР(DMSO-d6):

Пример 60(2)
4-(тиофен-2-ил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,37 (гексан: этилацетат = 1:1);
ЯМР(DMSO-d6):

Пример 60(3)
4-(тиазол-2-ил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,53 (гексан: этилацетат = 1:1);
ЯМР(CDCl3):

Пример 60(4)
4-(пиридин-3-ил)-6,7,9,9a-тетрагидро[1,4]тиазино[4, 3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,32 (метиленхлорид: метанол = 10:1);
ЯМР(CDCl3):

Пример 60(5)
4-(1,3-диоксаиндан-5-ил)-6,7,9,9a-тетрагидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,30 (хлороформ: метанол = 9:1);
ЯМР(CD3OD):

Пример 60(6)
4-(пиридин-3-ил)-6,7-дигидро[1, 4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,36 (метанол: метиленхлорид = 1:10);
ЯМР(DMSO-d6):

Пример 60(7)
4-(нафталин-2-ил)-6,7-дигидро[1,4]тиазино[4,3-d][1,2,4]триазин-1(2H)-он
ТСХ: Rf 0,54 (метиленхлорид: метанол = 10:1);
ЯМР(DMSO-d6):

Пример 61
Гидрохлорид 4-(пиперазин-1-ил)-5,6,7,8-тетрагидрофталазин-1(2H)-она
К суспензии 4-хлор-5,6,7, 8-тетрагидрофталазин-1(2H)-она (150 мг; CAS Registry No. 89981-21-5; соединение, описанное в публикации Yakugaku Zassi., 82, 302-303 (1962)) в этиленгликоле (1,6 мл) добавляли пиперазин (420 мг) и смесь перемешивали при 200°C в течение 7 часов. После охлаждения до комнатной температуры, реакционную смесь выливали в холодный насыщенный водный раствор бикарбоната натрия и экстрагировали хлороформом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (метиленхлорид: метанол = 20:1→10:1) с получением свободной формы указанного в заголовке соединения (64 мг). К раствору полученной свободной формы соединения в метаноле (2,0 мл) добавляли 4н. раствор хлористый водород-этилацетат (1 мл). Смесь перемешивали при комнатной температуре и концентрировали. Остаток перекристаллизовывали из смеси растворителей метанола и этилацетата с получением соединения согласно настоящему изобретению (21 мг), имеющего следующие физические характеристики.
ТСХ: Rf 0,46 (метиленхлорид: метанол: уксусная кислота = 20:5:2);
ЯМР(DMSO-d6):

Пример 62
8-(пиперазин-1-ил)-2,3,4,6-тетрагидропиридо[2,3-d]пиридазин-5(1H)-он
Посредством такой же процедуры, которая описана в примере 60→примере 59, при использовании 8-хлорпиридо[2,3-d]пиридазин-5(6H)-она (соединение, описанное в публикации Chem. Pharm. Bull., 13(5), 586-593 (1965)) вместо 4-хлор-5,6,7,8-тетрагидрофталазин-1(2H)-она, было получено соединение согласно настоящему изобретению, имеющее следующие физические характеристики.
ТСХ: Rf 0,18 (метиленхлорид: метанол: уксусная кислота = 20:5:2);
ЯМР(DMSO-d6):

Композиционный пример 1
Следующие компоненты смешивали обычным способом и таблетировали с получением 100 таблеток, содержащих каждая 50 мг активного ингредиента.
Композиционный пример 2
После смешивания следующих компонентов обычным способом, образовавшийся раствор стерилизовали стандартным способом и порциями по 5 мл заполнили ампулы соответственно, лиофилизировали обычным способом с получением 100 ампул для инъекций, содержащих каждая 20 мг активного ингредиента.
Реферат
Изобретение относится к конденсированному производному пиридазина, представленному формулой (I), или его фармацевтически приемлемым солям:

где R1 представляет собой (1) атом водорода, (2) С2-8алкил, (3) гидрокси, (5) атом галогена, (3) С2-8ацил, (4) C1-8алкокси, замещенный фенилом, или (5) С2-8ацил, замещенный NR2R3; R2 и R3 каждый независимо представляет собой (1) атом водорода или (2) С1-8алкил, Х и Y каждый независимо представляет собой (1) С, (2) СН или (3) N,


является либо 5-7-членной карбоциклической, либо 5-7-членной частично или полностью насыщенной гетероциклической группами, определенными в п.1 формулы изобретения. А является одной из групп от А1 до А5, определенных в п.1 формулы изобретения. Указанные соединения обладают ингибирующим действием по отношению к поли(ADP-рибоза)полимеразе и являются пригодными как профилактические и/или лекарственные средства для различных ишемических болезней (в головном мозге, спинном мозге, сердце, пищеварительном тракте, скелетной мышце, сетчатке глаза, и т.д.), воспалительных заболеваний (воспалительное заболевание кишечника, рассеянный склероз, артрит, и т.д.), нейродегенеративных расстройств (экстрапирамидное поражение, болезнь Альцгеймера, мышечная дистрофия, стеноз спинномозгового канала поясничного отдела позвоночника, и т.д.), диабета, удара, травмы головы, почечной недостаточности, гипералгезии и т.д. Кроме того, указанные соединения являются пригодными в качестве средств, направленных против ретровирусов (ВИЧ и т.д.), сенсибилизирующих средств, предназначенных для лечения рака, и иммунодепрессивных средств. 6 н. и 13 з.п. ф-лы, 91 табл.
Формула

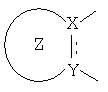






















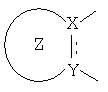
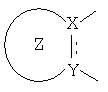




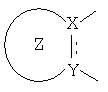




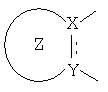




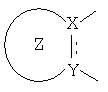




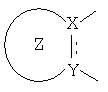
















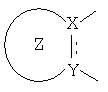
















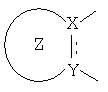
















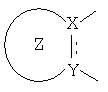
















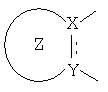


Комментарии