Способ получения бис-бензазолиловых соединений - RU2293084C2
Код документа: RU2293084C2
Описание
Настоящее изобретение относится к способу получения бисбензазолиловых соединений, которые можно использовать в качестве оптических отбеливателей для натуральных и синтетических материалов.
Известны разнообразные способы получения таких соединений.
Так, например, в US 4508903 описано получение 4,4'-бисбензоксазол-, -бензтиазол- и -бензимидазол-2-илстильбенов димеризацией соответствующих п-хлорметилфенилбензазолов. Однако такие способы страдают недостатком, состоящим в том, что получение промежуточных продуктов включает несколько реакционных стадий, что впоследствии обуславливает низкие общие значения выхода.
Особый практический интерес представляют способы, в которых проводят реакцию дикарбоновых кислот или их производных с бифункциональными ароматическими соединениями с получением гетероциклических колец в одну реакционную стадию.
Так, например, в публикации ЕР 31296 описан способ получения бензоксазолиловых и бензимидазолиловых соединений реакцией конденсации органических карбоновых кислот с о-аминофенолами и о-фенилендиаминами в смеси растворителей, включающей дифениловый эфир и дифенил, в присутствии кислотных катализаторов. Более того, в патенте Великобритании 1201287 описано получение 2,5-бисбензоксазол-2-илтиофенов реакцией конденсации тиофен-2,5-дикарбоновой кислоты с о-аминофенолами, например в кипящем 1,2,4-трихлорбензоле в присутствии борной кислоты. Таким способам свойственны недостатки, поскольку для их осуществления требуются исключительно высокие реакционные температуры, приводящие к образованию примесей, удаление которых из конечных продуктов сопряжено с затруднениями технологического порядка, следствием чего является снижение выходов продукта. К тому же удаление таких высококипящих растворителей из продуктов взаимодействия также сопряжено с затруднениями технологического порядка и может, помимо этого, привести к образованию отложений внутри реакционных сосудов, затрудняя тем самым обработку конечных продуктов. Кроме того, применение в настоящее время хлорированных ароматических растворителей является нежелательным по экологическим причинам.
В настоящее время разработан новый, выгодный способ получения бисбензазолиловых соединений, осуществление которого позволяет с высокими выходами получать эти соединения превосходной чистоты в реакционных условиях, которые хорошо подходят для промышленных процессов.
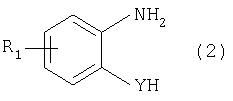
Таким образом, по настоящему изобретению предлагается способ получения соединения формулы
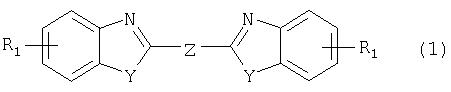
в которой
Y обозначает -О-, -S-или -N(R2)-,
причем
R2 обозначает водородный атом, C1-С10алкил или аралкил;
Z обозначает 2,5-фураниловый, 2,5-тиофениловый, 4,4'-стильбениловый или 1, 2-этилениловый остаток, а R1 обозначает атом водорода или галогена, C1-С10алкил, C1-С10алкокси, цианогруппу, СООМ или SO3М,
причем
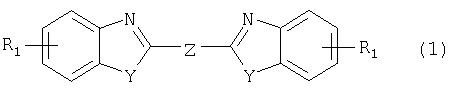
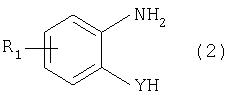
М обозначает водородный атом или атом щелочного или щелочноземельного металла, характеризующийся проведением реакции соединения формулы
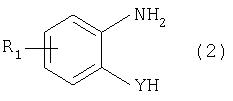
с дикарбоновой кислотой формулы

или ее эфиром, причем Y, Z и R1 имеют значения, указанные выше, в N-метилпирролидоне или N,N-диметилацетамиде в присутствии кислотного катализатора и необязательно в присутствии вспомогательного растворителя, способного удалять из реакционной смеси воду.
Молярные соотношения между соединением формулы (2) и соединением формулы (3) можно варьировать в широких интервалах. Однако целесообразно проводить реакцию по меньшей мере двух молей соединения формулы (2) с по меньшей мере одним молем дикарбоновой кислоты формулы (3). По другому варианту можно использовать моно- или диэфир, предпочтительно диэфир, соединения формулы (3). Соответствующие сложные эфиры представляют собой те эфиры, которые дериватизированы из C1-С10-, предпочтительно из С1-С4 спирта, причем наиболее предпочтительны диэтиловые эфиры.
Предлагаемый по изобретению способ особенно приемлем для получения соединения формулы (1), в которой
Y обозначает -О-, -S- или -N(R2)-,
R2 обозначает водородный атом или С1-С4алкил;
Z имеет значения, указанные выше,
R1 обозначает водородный атом или С1-С4алкил, а более предпочтительно для получения соединений формулы (1), в которой
Z обозначает 2,5-фураниловый или 2,5-тиофениловый остаток,
а также для получения тех соединений, у которых
Z обозначает 4,4'-стильбениловый или 1,2-этилениловый остаток.
В качестве реакционной среды для осуществления способа по изобретению наиболее предпочтительными являются N-метилпирролидон, N,N-диметилацетамид и их смеси. Возможно также применение N-метилпирролидона или N,N-диметилацетамида или их смесей совместно с дополнительным высококипящим инертным растворителем, например с толуолом или ксилолом. Особенно предпочтительно применение N-метилпирролидона.
Кислотный катализатор, используемый в способе по изобретению, может быть выбран из группы, включающей борную кислоту, фосфорную кислоту, титанС1-С4ортоэфиры или оловосодержащие производные, причем предпочтительна борная кислота или титанС1-С4ортоэфир, в особенности тетрапропиловый или тетрабутиловый эфир. Используемое количество катализатора можно варьировать в широких интервалах, оно зависит от химического структурного элемента. Так, например, его можно использовать в количествах, варьируемых от 0,01 до 50 мольных % в пересчете на количество соединения (2), предпочтительно от 0,1 до 30 мольных %.
Реакцию соединений формул (2) и (3) можно проводить в широком температурном диапазоне, но предпочтительно в интервале от 100 до 250°С, в частности в температурном интервале от 150 до 200°С.
Наличие вспомогательного растворителя имеет особое значение, когда соединение формулы (3) находится в форме моноэфира или в особенности свободной дикарбоновой кислоты. В этих случаях воду, которая образуется во время реакции, можно из реакционной смеси непрерывно удалять. Примеры приемлемых растворителей, хотя их выбор ими не ограничен, выбирают из группы, включающей толуол, ксилолы и смеси их изомеров, а также пиридин, причем особенно эффективны толуол и ксилол.
По изобретению реакцию, как правило, проводят под атмосферным давлением. Однако в некоторых обстоятельствах может оказаться целесообразным проведение такой реакции в условиях повышенного или пониженного давления.
Когда в рамках определения соединений формул (1) и (2) R1 обозначает атом галогена, им может быть атом фтора, брома йода или преимущественно хлора.
C1-С10алкильные группы R1 и/или R2 могут быть разветвленными или неразветвленными, такими как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, 2-этилбутил, н-пентил, изопентил, 1-метилпентил, 1,3-диметилбутил, н-гексил, 1-метилгексил, н-гептил, изогептил, 1,1,3,3-тетраметилбутил, 1-метилгептил, 3-метилгептил, н-октил, 2-этилгексил, 1,1,3-триметилгексил, 1,1,3,3-тетраметилпентил, н-нонил и н-децил. Соответственно замещены C1-С10алкиловые эфиры соединения формулы (3).
C1-С10алкоксигруппы R1 могут быть разветвленными или неразветвленными, такими как метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси, трет-бутокси, 2-этилбутокси, н-пентокси, изопентокси, 1-метилпентокси, 1,3-диметилбутокси, н-гексокси, 1-метилгексокси, н-гептокси, изогептокси, 1,1,3,3-тетраметилбутокси, 1-метилгептокси, 3-метилгептокси, н-октокси, 2-этилгексокси, 1,1,3-триметилгексокси, 1,1,3,3-тетраметилпентокси, н-нонокси или н-децокси.
Аралкильными группами R2 могут быть бензил и фенетил, которые могут быть замещены атомом галогена, C1-С10алкильными или C1-С10алкоксигруппами или, что предпочтительно, являются незамещенными.
Атом щелочного или щелочноземельного металла М может быть выбран из группы, включающей атомы К, Na, Ca и Mg, но предпочтительно К и Na.
Далее сущность настоящего изобретения проиллюстрирована следующими примерами, которые для ограничения его объема не предназначены.
Пример 1

В реакционный сосуд загружают 250 г N-метилпирролидона и с перемешиванием добавляют 82 г 98%-ной стильбен-4,4'-дикарбоновой кислоты, после чего 75 г 99%-ного 2-аминофенола, 10 г борной кислоты и 30 г ксилола. В аппарате, оборудованном водяной ловушкой Дина-Старка, создают вакуум и вакуум заменяют азотом. Светло-желтую суспензию нагревают до 195°С и при этой температуре перемешивают в течение 18 ч, причем за это время посредством водяной ловушки отгоняют 23-25 мл воды и приблизительно 25 г ксилола. Реакционную смесь охлаждают до 20°С и при этой температуре перемешивание продолжают в течение 1 ч. Желтую суспензию фильтруют и промывают 100 г N-метилпирролидона с получением 350 г коричневого раствора, который можно использовать в качестве растворителя для последующей загрузки, а затем тремя 80-граммовыми порциями воды. Полученную фильтр-прессную лепешку сушат под вакуумом в 50 мбар при 100°С с получением в виде желтого твердого вещества 120 г соединения формулы (101), охарактеризованного по максимальному УФ-поглощению λmax при 368 нм с коэффициентом погашения ε 71000.
Пример 2

Аналогично примеру 1, но с заменой 2-аминофенола 82 г 98%-ного 2-тиофенола и борной кислоты 3 г тетра-изопропилового эфира титановой кислоты в виде желтого твердого вещества получают 115 г соединения формулы (102), охарактеризованного по максимальному УФ-поглощению λmax при 375 нм с коэффициентом погашения ε 62000 и следующими данными1Н-ЯМР в D6-ДМСО: 8,12, 4Н, m; 8,00, 6Н, m; 7,85, 4Н, m и 7,48, 4Н, m.
Пример 3

Аналогично примеру 1, но с заменой 2-аминофенола 72 г 99%-ного 1,2-фенилендиамина, в виде желтого твердого вещества получают 110 г соединения формулы (103), охарактеризованного по максимуму УФ-поглощения λmax при 370 нм с коэффициентом погашения ε 63000 и следующими данными1Н-ЯМР в D6-ДМСО:
13,0, 2Н, s; 8,22, 4Н, d, J=7 Гц; 7,80, 4Н, d, J=7 Гц; 7, 68, 2Н, d, J=7 Гц; 7,54, 2Н, d, J=7 Гц; 7,48, 2Н, s и 7,22, 4Н, t, J=7 Гц.
Пример 4
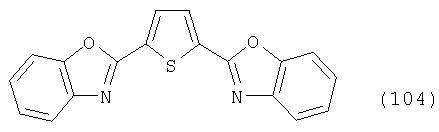
В реакционный сосуд загружают 200 г N-метилпирролидона и с перемешиванием добавляют 52 г 98%-ной тиофен-2,5-дикарбоновой кислоты, после чего 72 г 99%-ного 2-аминофенола, 10 г борной кислоты и 30 г толуола. В аппарате, оборудованном водяной ловушкой Дина-Старка, создают вакуум и вакуум заменяют азотом. Светло-желтую суспензию нагревают до 185°С и перемешивают при этой температуре в течение 12 ч, причем за это время посредством водяной ловушки отгоняют 23-25 мл воды и приблизительно 25 г толуола. Реакционную смесь охлаждают до 20°С и при этой температуре перемешивание продолжают в течение 1 ч. Желтую суспензию фильтруют, промывают 100 г N-метилпирролидона с получением 300 г коричневого раствора, который можно использовать в качестве растворителя для последующей загрузки, а затем тремя 80-граммовыми порциями воды. Полученную фильтр-прессную лепешку сушат под вакуумом в 50 мбар при 100°С с получением в виде желтого твердого вещества 75 г соединения формулы (104), охарактеризованного по максимуму УФ-поглощения λmax при 372 нм с коэффициентом погашения ε 52000 и следующими данными1Н-ЯМР в D6-ДМСО: 8,10, 2Н, s; 7,82, 4Н, m и 7,50, 4Н, m.
Пример 5

Аналогично примеру 4, но с заменой 2-аминофенола 110 г 2-амино-4-трет-бутилфенола, борной кислоты 2,2 г изопропил-орто-титаната и толуола 30 г ксилола, в виде желтого твердого вещества получают 125 г соединения формулы (105), охарактеризованного по максимальному УФ-поглощению λmax при 375 нм с коэффициентом погашения ε 51000 и синглетом при 1,30 част./млн в1 Н-ЯМР-спектральном анализе в D6-ДМСО.
Пример 6

В реакционный сосуд загружают 200 г N,N-диметилацетамида и с перемешиванием добавляют 35 г 98%-ной фумаровой кислоты, после чего 82 г 2-амино-4-метилфенола, 10 г борной кислоты и 30 г ксилола. В аппарате, оборудованном водяной ловушкой Дина-Старка, создают вакуум и вакуум заменяют азотом. Светло-желтую суспензию нагревают до 160°С и перемешивают при этой температуре в течение 10 ч, причем за это время посредством водяной ловушки отгоняют 23-25 мл воды и приблизительно 25 г ксилола. Реакционную смесь охлаждают до 20°С и при этой температуре перемешивание продолжают в течение 1 ч. Желтую суспензию фильтруют, промывают 100 г N,N-диметилацетамида, а затем тремя 80-граммовыми порциями воды. Полученную фильтр-прессную лепешку сушат под вакуумом в 50 мбар при 100° С с получением в виде желтого твердого вещества 85 г соединения формулы (106), охарактеризованного по максимальному УФ-поглощению λmax при 365 нм с коэффициентом погашения ε 42000.
Пример 7
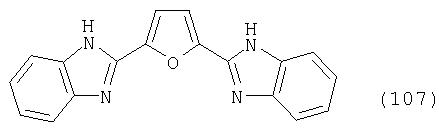
В реакционный сосуд загружают 200 г N-метилпирролидона и 65 г фуран-2,5-дикарбоновой кислоты, после чего с перемешиванием добавляют 72 г 99%-ного 1,2-фенилендиамина и 10 г борной кислоты. В аппарате, оборудованном водяной ловушкой Дина-Старка, создают вакуум и вакуум заменяют азотом. Светло-желтую суспензию нагревают до 175°С и при этой температуре перемешивают в течение 12 ч, причем за это время под слабым вакуумом отгоняют 28 г этанола. Образовавшийся раствор охлаждают до 20°С и при этой температуре перемешивание продолжают в течение 1 ч. Желтую суспензию фильтруют и промывают 100 г N-метилпирролидона с получением 300 г коричневого раствора, который можно использовать в качестве растворителя для последующей загрузки, а затем тремя 80-граммовыми порциями воды. Полученную фильтр-прессную лепешку сушат под вакуумом в 50 мбар при 100°С с получением в виде желтого твердого вещества 95 г соединения формулы (107), охарактеризованного по максимуму УФ-поглощения λmax при 375 нм с коэффициентом погашения ε 42000.
Реферат
Изобретение относится к способу получения соединения формулы

в которой Y обозначает -O-, -S- или -N(R2)-, причем R2 обозначает водородный атом, C1-C10алкил или аралкил; Z обозначает 2,5-фураниловый, 2,5-тиофениловый, 4,4'-стильбениловый или 1,2-этилениловый остаток, a R1обозначает атом водорода или галогена, C1-C10алкил, С1-С10алкокси, цианогруппу, СООМ или SO3М, причем М обозначает водородный атом или атом щелочного или щелочноземельного металла. Способ заключается в том, что проводят реакцию соединения формулы
с дикарбоновой кислотой формулы

или ее эфиром, причем Y, Z и R1 имеют значения, указанные выше, в N-метилпирролидоне или N,N-диметилацетамиде в присутствии кислотного катализатора и необязательно в присутствии вспомогательного растворителя, способного удалять из реакционной смеси воду. 10 з.п. ф-лы.
Формула
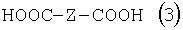

Комментарии