Конденсированные 5-членные гетероциклы или их соли, проявляющие активность по торможению агрегации - RU2041211C1
Код документа: RU2041211C1
Чертежи

Описание
Изобретение относится к новым химическим соединениям с
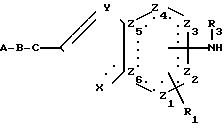
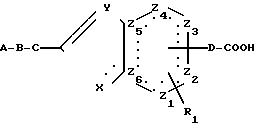
ценными фармакологическими свойствами, а именно к конденсированным пятичленным гетероциклам общей формулы

R4 атом водорода, алкильная или алкоксильная группа, содержащие 1-6 атомов углерода, арильная, гетероарильная или аралкильная группа, содержащие 1-6 атомов углерода в алкильной части;
R5 ацетидиновая, пирролидиновая, гексамитиленимино- или гептамитилениминогруппа или пиперидиновая группа, в которой метиленовая группа в четвертом положении может быть замещена кислородом, сульфенил-, сульфинил- или сульфонилгруппой или иминогруппой, которая может быть замещена R3, R4CO4, алкилсульфонил- или арилсульфонилгруппой, причем R3 и R4 имеют указанные выше значения.
Х атом кислорода, серы или азота или группа NR2, причем
R2 атом водорода, линейная или разветвленная алкильная группа, содержащая
1-15 атомов углерода, линейные или разветвленные алкенильную и алкинильную группы, содержащие 3-10 атомов углерода, причем двойная и тройная связь могут не быть присоединены непосредственно к атому
азота, циклоалкильную или циклоалкилалкильную группы, содержащие 3-7 атомов углерода в циклоалкильной части, арильную или гетероарильную группы, алкильную группу, содержащую 2-6 атомов углерода,
которая, начиная с β-положения к атому азота-NR2-группы, замещена R3O-, (R3)2N-, R4CO-NR3-, алкилсульфонил-NR3-,
арил- сульфонил-NR3-, алкилсульфенил-, алкилсульфинил-, алкилсульфонил- или R5-группами;
или алкильная группа, содержащая 1-6 атомов углерода, которая замещена одной или
двумя арильными группами, гетероарильной группой, группами R6OCO-, (R3)2NCO-, R5CO-, R3-O-CO-алкилен-NR3-CO-, (R3)2N-CO-алкилен-NR3-СО- или R5CO-алкилен-NR3-CO-, в которых R3 и R5 имеют указанные выше значения и R6 означает водород, алкильную
группу, содержащую 1-6 атомов углерода, циклоалкильную группу, содержащую 5-7 атомов углерода, или аралкильную группу,
Y NO-группа, атом азота или незамещенная или замещенная алкильной
группой метиновая группа;
Z1, Z2, Z3, Z4, которые могут быть одинаковыми или различными, означают метиновые группы, атомы углерода, иминогруппы или
атомы азота, причем по меньшей мере один из остатков Z1-Z4 должен содержать атом углерода, и одна или две соседние к атому азота метиновые группы могут быть замещены
карбонильными группами,
Z5 и Z6 означают атомы углерода или один из остатков Z5 или Z6 означает атом азота, а другой атом углерода,
А
означает цианогруппу, аминогруппу, линейную или разветвленную аминоалкильную группу, содержащую 1-4 атомов углерода, амидино-, гуанидино- или гуанидиноалкильную группу, причем в амино-, аминоалкил-,
амидино-, гуанидино- и гуанидиноалкильных группах у одного из атомов азота один или два атома водорода могут быть замещены одной или двумя алкильными группами, содержащими 1-4 атомов углерода, или
один атом водорода может быть замещен алкоксикарбонильной группой с общим количеством атомов углерода 2-5, алкенилоксикарбонильной группой с общим числом атомов углерода 4-6, алкилкарбонильной группой
с общим числом углеродных атомов 2-5, арилкарбонил-, арилоксикарбонил-, аралкоксикарбонил-, алканоилоксиметоксикарбонил-, циклоалканoилоксиметоксикарбонил-, аралканоилоксиметоксикарбонил-,
ароилоксиметоксикарбонил-, фосфоно-, диалкилфосфорил- или О-алкил-фосфоногруппами, в которых алканоильные части содержат 2-7 атомов углерода, и циклоалканоильные части содержат 4-8 атомов углерода, а
метоксильные части могут быть замещены циклоалкильной группой, содержащей 3-6 атомов углерода, аралкильной, арильной или алкильной группой или двумя алкильными группами, которые вместе с метиленовым
атомом углерода также могут образовывать пяти- или шестичленное кольцо, или, если В означает циклический амин, содержащий 4-7 членов, также означает водород или алкильную группу, которые связаны с
атомом азота иминогруппы,
В означает фениленовую группу, которая может быть один или два раза замещена атомами фтора, хлора или брома, алкильной группой, гидроксигруппой, алкоксигруппой,
алкилсульфенильной, алкилсульфинильной, алкилсульфонильной группами, нитрогруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой, алкилкарбониламиногруппой, алкилсульфониламиногруппой или
трифторметильной группой, причем заместители могут быть одинаковыми или различными и одновременно одна или две метиновые группы в вышеупомянутых фениленовых группах могут быть замещены соответственно
одним или двумя атомами азота, или циклоалкиленовую группу, содержащую 3-7 атомов углерода, причем в четырех- или пятичленном циклоалкиленовом кольце один член кольца означает атом азота и в
шести- или семичленном циклоалкиленовом кольце один или два члена кольца означают атом азота, одновременно может происходить связывание с атомами углерода соседних остатков через имеющиеся атомы азота,
инданиленовую группу или 1,2,3,4-тетрагидронафтиленовую группу, в которых насыщенное кольцо связано с остатком А и ароматическое кольцо связано с остатком С или с конденсированным
пятичленным гетероциклом,
С означает связь, алкиленовую группу, ариленовую группу, -О-алкиленовую группу, -S-алкиленовую группу, -NH-алкиленовую группу, -N-(алкил)-алкиленовую группу,
-алкилен-NH-группу, -алкилен-N-(алкил)-группу- -SO- или -SO2-алкиленовую группу;
D означает связь или алкиленовую группу;
Е означает алкиленовую группу, содержащую 1-7
атомов углерода, алкенильную или алкинильную группы, содержащие 2-7 атомов углерода, причем двойная или тройная связь может быть не связана непосредственно с атомом азота Z1-Z2
-Z3-Z4-группы, или, если Е не связано непосредственно с атомом азота Z1-Z2-Z3-Z4-группы, означает -О-, -S-, -SO-, SO2-,
-NR3-, -N(COR4)-, -CO-, -NR3-CO-, -CO-NR3-, -SO2-NR3-, алкилсульфонилимино- или арилсульфонилиминогруппу, причем R3 и R4 имеют указанные выше значения или циклоалкиленовую группу, содержащую 4-7 атомов углерода, причем в четырех- или пятичленном циклоалкиленовом кольце один член кольца может означать атом азота
и в шести- или семичленном циклоалкиленовом кольце один или два члена кольца могут означать атом азота и дополнительно соседняя с атомом азота метиленовая группа может быть замещена карбонильной
группой, причем одновременно может происходить связывание с атомами углерода соседних остатков через имеющиеся атомы азота,
F означает связь, линейную или разветвленную алкиленовую группу,
содержащую 1-6 атомов углерода, линейную или разветвленную алкениленовую или алкиниленовую группы, содержащие 2-6 атомов углерода, причем двойная или тройная связь может не примыкать непосредственно к
гетероатому или тройной связи остатка Е и упомянутые выше алкиленовая, алкениленовая и алкиниленовая группы могут быть замещены арильной группой, -СООR6-, -CON(R3)2
- или -CO-N(R3)-алкильной группами, причем остатки R3 и R6 имеют указанные выше значения и алкильная часть -СО-N(R3)- алкильной группы, которая может
содержать 1-6 атомов углерода, дополнительно может быть замещена остатками R7и R8, причем R7 и R8 могут быть одинаковыми или различными и означать атом
водорода, арильную или -СОО-R6-группу, где R6 определено выше.
циклоалкиленовую, алкилен-циклоалкилен- и циклоалкилен-алкиленовую группы, содержащие 4-6 атомов
углерода в циклоалкиленовой части, в которых находящаяся в кольце СН-группа замещена атомом азота, и связывание с соседним остатком Е может происходить также через атом азота, в случае, если
связывание происходит через атом углерода остатка Е, причем, если D означает связь, Е атом кислорода и F- алкильная группа, А может не быть непосредственно связанный с фенильным кольцом амино- или
ациламиногруппой, и, если одновременно еще Х означает атом серы и Y атом азота, группа А-В-С не может быть 4-ацетамино-пиперазиногруппой, и
G означает не связанную с гетероатомом остатка Е
карбонильную группу, которая может быть замещена гидроксильной группой, арилалкенилоксигруппой, содержащей 3-4 атомов углерода в алкенильной части, алкоксигруппой, содержащей 1-8 атомов углерода, в
которой алкокси-остаток с 1-5 атомами углерода может быть замещен арильной группой или алкоксиостаток с 1-3 атомами углерода в 1-, 2- или 3-положениях может быть замещен гетероарильной или
циклоалкильной группой, содержащей 4-8 атомов углерода, или в 2- или 3-положении пирролидин-2-он-1-ил-, морфолино-, тиоморфолино- или 1-оксидо-тиоморфолиногруппой, циклоалкоксигруппой, содержащей 4-8
атомов углерода, которая может быть замещена 1-3 алкильными группами, возможно замещенными 1-3 метильными группами, бензоциклоалкокси-, бензоциклоалкилалкокси-, бициклоалкокси- и
бициклоалкилалкоксигруппами, содержащими 4-8 атомов углерода в циклоалкильной части и 6-8 атомов углерода в бициклоалкильной части, алканоилоксиметоксигруппой с общим числом атомов углерода 2-7 в
алканоильной части, циклоалканоилоксиметоксигруппой с общим количеством атомов углерода 4-8 в циклоалканоильной части, алкоксикарбонилоксиметоксигруппой с 1-6 атомами углерода в алкильной части,
циклоалкоксикарбонилоксиметоксигруппой с 3-7 атомами углерода в циклоалкильной части, ароилоксиметокси-, аралканоилоксиметокси-, арилоксикарбонилоксиметокси- или аралкоксикарбонилоксиметоксигруппами,
в в которых метоксичасть может быть замещена алкильной группой с 1-6 атомами углерода, циклоалкильной группой с 3-7 атомами углерода, аралкильной или арильной группами,
сульфогруппу,
фосфоногруппу, О-алкилфосфоногруппа или тетразол-5-ил-группу,
а также к их таутомерам, смеси изомеров или отдельным изомерам и их солям, проявляющим ценные фармакологические свойства, в
частности активность по торможению агрегации.
Если не указано ничего другого, вышеупомянутые алкил-, алкилен- и алкоксигруппы содержат 1-3 атомов углерода. Кроме того, под выражением
"арильная группа" понимают фенильную группу, которая может быть от одного до трех раз замещена фтором, хлором, бромом или иодом, алкильной, трифторметильной, нитро-, амино-, алкиламино-,
диалкиламино-, алканоиламино-, алкилсульфониламино-, аминосульфонил-, алкиламиносульфонил-, диалкиламиносульфонил-, гидрокси-, алкокси-, аралкокси-, карбокси-, алкоксикарбонил-, аминокарбонил-,
алкиламинокарбонил-, диалкиламинокарбонил-, алкилсульфенил-, алкилсульфинил- или алкилсульфонилгруппами, причем заместители могут быть одинаковыми или различными, или нафтильную группу;
под
выражением "гетероарильная группа" понимают пятичленное гетероароматическое кольцо, которое содержит иминогруппу, атом кислорода или серы, от одного до двух атомов азота и атом кислорода или серы, или
иминогруппу и от одного до трех атомов азота, или шестичленное гетероциклическое кольцо, которое содержит 1, 2 или 3 атома азота, причем к упомянутым выше кольцам может быть приконденсировано
фенильное кольцо, и дополнительно они могут быть моно- или ди- замещены фтором, хлором, бромом, алкильной группой, алкокси-, гидрокси-, амино-, диалкиламино-, алкилкарбониламино-,
алкилсульфониламино- или трифторметилгруппами или алкиламиногруппой, содержащей 1-4 атомов углерода.
Предпочтительными являются те соединения общей формулы (I), в которых
R1 означает водород, фтор, хлор или бром, алкоксикарбониламино- или N-алкоксикарбонил-алкиламиногруппу, содержащие 1-4 атома углерода в алкоксильной части, алкил-, гидрокси-, алкокси-,
фенилакокси-, амино-, алкиламино-, диалкиламино-, пирролидино-, пиперидино-, алкилкарбониламино- или алкилсульфониламиногруппы, причем, если не оговорено ничего другого, алкильная и алкоксильная часть
могут содержать 1-3 атома углерода, и дополнительно алкильные части алкиламино- и диалкиламиногрупп могут быть замещены карбокси- или алкоксикарбонилгруппами, содержащими 1-3 атомов углерода в
алкильной части;
Х означает атом кислорода, серы или азота или группу NR2, где R2 означает атом водорода, линейную или разветвленную алкильную группу, содержащую 1-14
атомов углерода, алкенильную или алкинильную группы, содержащие 3 или 4 атома углерода, причем двойная или тройная связь может не присоединяться непосредственно к атому азота, алкильную группу,
содержащую 1-5 атомов углерода, которая замещена карбокси-, алкоксикарбонил-, аминокарбонил-, алкиламинокарбонил-, диалкиламинокарбо- нил-, фенилалкиламинокарбонил-, пирролидинокарбонил-,
карбоксиалкиламинокарбонил-, алкоксикарбонилалкиламинокарбо- нил-, 2- или 4-имидазолил- или пиридилгруппой, пиперидинокарбонилгруппой, в которой метиленовая группа в 4-ом положении может быть замещена
атомом кислорода, сульфенил-, сульфинил-, сульфонил-, имино-, алкилимино- или фенилалкилимино- группами, или фенильной группой, которая может быть моно- или дизамещена хлором или бромом, амино-,
гидрокси-, алкокси- или алкильной группой, или двумя фенильными группами,
циклоалкильную группу с 3-7 атомами углерода, пиридильную группу, фенильную группу, которая может быть моно- или
дизамещена фтором, хлором или бромом, алкильной, алкоксильной, алкилсульфенильной, алкилсульфинильной или алкилсульфонильной группами, алкильную группу, содержащую 2-4 атома углерода, которая замещена
в 2, 3- или 4-ом положении гидрокси-, алкокси-, алкилсульфенил-, алкилсульфинил-, алкилсульфонил-, 1-имидазолил- или пирролидиногруппами или пиперидиногруппой, в которой метиленовая группа в 4-ом
положении может быть замещена атомом кислорода, сульфенил-, сульфинил-, сульфонил-, имино-, алкилимино- или фенилалкилиминогруппой, или алкильную группу, содержащую 2-6 атомов углерода, которая
замещена в 2, 3, 4, 5 или 6-ом положении амино-, алкиламино- или диалкиламино-группой, причем, если не оговорено ничего другого, выше названные алкильные и алкоксильные части могут содержать 1-3 атома
углерода;
Y означает NO-группу, атом азота или возможно замещенную алкильной группой с 1-3 атомами углерода метиновую группу,
Z1, Z2, Z3 и Z4 могут быть одинаковыми или различными и означают метиновые группы, атомы углерода, иминогруппы или атомы азота, причем по меньшей мере один из остатков Z1-Z4 должен
содержать атом углерода и одна или две соседние с атомом азота метиновые группы могут быть замещены карбонильными группами.
Z5 и Z6 означают атомы углерода или
один из остатков Z5 или Z6 означает атом азота, а другой атом углерода
А означает цианогруппу, аминогруппу, линейную или разветвленную аминоалкильную группу, содержащую
1-4 атомов углерода, амидиногруппу, гуанидиногруппу или гуанидиноалкильную группу, причем в упомянутых выше амино-, аминоалкил-, амидино-, гуанидино- или гуанидиноалкильной группах у одного из атомов
азота атом водорода может быть замещен алкильной группой, содержащей 1-4 атома углерода, алкоксикарбонильной группой с общим числом атомов углерода от двух до пяти, фенилалкоксикарбонил-,
фенилоксикарбонило- кси- или бензоильной группой или алканоилоксиметоксикарбонильной группой, в которой в алканоильной части содержится от двух до четырех атомов углерода, или фосфоно-,
диалкилфосфорил- или О-алкил-фосфоногруппой, или, если В является циклическим имином, означает также атом водорода или алкильную группу с 1-3 атомами углерода, которые присоединены к иминному атому
азота,
В означает фениленовую группу, которая может быть замещена один или два раза атомами фтора, хлора или брома, алкильной, гидроксильной, алкоксильной, алкилсульфенильной,
алкилсульфинильной, алкилсульфонильной, нитро-, амино-, алкиламино-, диалкиламино-, алкилкарбониламино-, алкилсульфониламино- или трифторметильной группами, причем заместители могут быть одинаковыми
или различными, алкильные и алкоксильные части могут содержать 1-3 атомов углерода,
пиперидиленовую или пиперазиниленовую группу, которые могут также через атомы азота присоединяться к атому
углерода соседних остатков,
инданиленовую или 1,2,3,4-тетрагидронафтиленовую группу, в которых насыщенное кольцо связано с остатком А и ароматическое кольцо с остатком С или конденсированным
пятичленным гетероциклом,
С означает связь, метилен-, этилен-, фенилен-, О-метилен, S-метилен-, SO-метилен-, SO2-метилен- или -N(алкил)-метиленгруппы, которые связаны гетероатомом
с остатком В, или метилен-N(алкил)-группу, причем в алкильной части могут содержаться 1-3 атома углерода,
D означает связь, метилен- или этиленгруппу,
Е означает алкиленовую группу,
содержащую 1-5 атомов углерода, алкениленовую или алкиниленовую группы, содержащие 3-5 атомов углерода, причем двойная или тройная связь может быть не связана непосредственно с атомом азота Z1-Z2-Z3-Z4 группы, или, если Е не связано непосредственно с атомом азота Z1-Z2-Z3-Z4-группы, означает -O-, -S-, -SO-,
-SO2-, -NH-, -N(алкил)-, -N(CO алкил)-, -CO-, -NH-CO-, -N(алкил)-CO-, -CO-NH-, -CO-N(алкил)-, -SO2NH-, -SO2-N(алкил)- или алкилсульфонилиминогруппу, причем алкильные
части могут содержать 1-3 атомов углерода, циклогексиленгруппу, пиперидинилен- или пиперазиниленгруппу, в которых дополнительно соседняя с атомом азота метиленовая группа может быть замещена
карбонильной группой, причем одновременно может происходить связывание с атомами углерода соседних остатков через атомы азота,
F означает связь, алкиленовую группу, содержащую 1-4 атомов
углерода, которая может быть замещена фенильной, карбоксильной, алкоксикарбонильной, фенилалкоксикарбонильной или алкиламинокарбонильной группой, причем алкиламинокарбонильная группа в алкильной части,
которая может содержать 1-3 атомов углерода, может быть замещена фенильной, гидроксифенильной, метоксифенильной, бензилоксифенильной, карбоксильной, алкоксикарбонильной или фенилалкоксикарбонильной
группой или дополнительно другой карбоксильной, алкоксикарбонильной или фенилалкоксикарбонильной группой,
циклогексиленовую, циклогексилен-алкиленовую или алкиленциклогексиленовую группу,
содержащие 1-3 атомов углерода в алкильной, алкиленовой и алкоксильной части, пиперидиниленовую или пирролидиниленовую группу, которые могут быть также связаны через атом азота с соседним остатком Е,
если связь происходит через атом углерода остатка Е, причем в случае если D означает связь, Е означает атом кислорода и F-алкильную группу, А не может быть непосредственно присоединенной к фенильному
кольцу амино или ациламиногруппой, и
G означает не связанную с гетероатомом остатка Е карбонильную группу, которая может быть замещена гидроксигруппой, цинноамилоксигруппой, алкоксигруппой,
содержащей 1-6 атомов углерода, в которой алкоксиостаток с 1-5 атомами углерода может быть замещен фенильной группой, или алкоксиостаток с 1-3 атомами углерода в 1-, 2- или 3-ем положении может быть
замещен нафтильной группой, циклоалкильной группой, циклоалкильной группой, содержащей 5 или 6 атомов углерода, пиридильной группой или в 2- или 3-положении пирролидин-2-он-1-ил-группой,
циклоалкоксигруппой, содержащей от 5 до 8 атомов углерода, инданилокси-, 1,2,3,4-тетрагидронафтилокси-, бициклогептилокси- или бициклогептилметоксигруппой, причем бициклогептильные группы могут быть
замещены 1-3 метильным группами, алканоилоксиметокигруппой, содержащей 2-5 атомов углерода в алканоильной части, алкоксикарбонилоксиметоксигруппой, содержащей 1-2 атома углерода в алкильной части, или
циклоалкоксикарбонилоксиметоксигруппой, содержащей 5 или 6 атомов углерода в циклоалкильной части, в которых метоксичасти могут быть замещены алкильной группой,
О-алкилфосфоногруппу,
содержащую 1-3 атомов углерода, сульфо-, фосфоно- или тетразол-5-ил-группу, а также их таутомеры, смеси изомеров, отдельные изомеры и их соли с неорганическими или органическими кислотами или
основаниями.
Особенно предпочтительны соединения общей формулы (I), в которых
R1 означает атом водорода, фтора, хлора или брома, алкокси- или фенилалкоксигруппу,
содержащую 1-3 атома углерода в алкоксильной части, алкоксикарбониламино- или N-алкоксикарбонилметиламиногруппу, содержащие 1-4 атомов углерода в алкоксильной части, метильную, гидроксильную, амино,
метиламино, диметиламино, N-карбоксиметиламино-, N-карбокси- метил-метиламино-, N-метоксикарбонил- метил-метиламино-, ацетиламино-, пиперидино- или метилсульфониламиногруппу,
Х означает атом
кислорода, серы или азота или группу -NR2, причем
R2 означает атом водорода, линейную или разветвленную алкильную группу, содержащую 1-14 атомов углерода, аллильную или
пропаргиловую группу,
алкильную группу, содержащую 1-3 атомов углерода, которая замещена карбокси-, метоксикарбонил-, этоксикарбонил-, аминокарбонил-, метиламинокарбонил-,
диметиламинокарбонил-, бензиламино-, карбонил, фенилэтиламинокарбонил-, карбоксиметиламинокарбонил, метоксикарбонилметиламинокарбонил- или пиридилгруппой или пиперидинокарбонильной группой, в которой
метиленовая группа в четвертом положении может быть замещена атомом кислорода, сульфенильной, сульфинильной, сульфонильной, имино- или бензилиминогруппой,
алкилгруппу, содержащую 1-4 атомов
углерода, которая замещена фенильной группой, которая в свою очередь может быть один или два раза замещена атомом брома или хлора, амино-, гидрокси-, метокси- или метильной группами или двумя
фенильными группами,
циклоалкильную группу, содержащую 3-6 атомов углерода, пиридильную группу, фенильную группу, которая может быть один или два раза замещена атомами хлора, метильной,
метоксильной, метилсульфенильной, метилсульфинильной или метилсульфонильной группами, причем заместители могут быть одинаковыми или различными,
алкильную группу, содержащую 2 или 3 атома
углерода, которая замещена в 2 или 3-ем положении гидроксильной, метоксильной, метилсульфенильной, метилсульфинильной, метилсульфонильной, имидазольной или пирролидиногруппой или пиперидиногруппой, в
которой метиленовая группа в 4-ом положении может быть замещена атомом кислорода, сульфенильной, сульфинильной, сульфонильной, имино- или бензилиминогруппой, или
алкильную группу, содержащую
2-6 атомов углерода, которая в 2, 3, 4, 5 или 6-ом положении замещена аминогруппой,
Y означает NO-группу, атом азота или метиновую группу, которая может быть замещена метильной группой,
Z1, Z2, Z3, Z4 являются одинаковыми или различными и означают метиновые группы, атомы углерода, иминогруппы или атомы азота, причем по меньшей мере один из остатков Z1-Z4 должен содержать атом
углерода и одна или две соседние к атому азота метиновые группы могут быть замещены карбонильными группами,
Z5 и Z6 означают атомы углерода или один из остатков Z5 или Z6 означает азот, а
другой углерод,
А означает аминогруппу, линейную или разветвленную аминоалкильную группу, содержащую 1-3 атомов углерода, амидино-, гуанидино- или гуанидинметиловую группу, причем в выше
упомянутых амино-, аминоалкил-, амидино-, гуанидино- или гуанидинометильных группах водород у атома азота может быть замещен алкильной группой, содержащей 1-4 атома углерода, алкоксикарбонильной
группой с общим числом атомов углерода 2-5, бензилоксикарбонильной группой, ацетилоксиметоксикарбонильной группой, диметилфосфорил- или диэтилфосфорильной группой,
B означает фениленовую
группу, которая может быть замещена атомом фтора, хлора или брома, метильной, гидроксильной или метоксильной группой,
пиридиниленовую группу или циклоалкиленовую группу, содержащую 3-6 атомов
углерода, инданиленовую или 1,2,3,4-тетрагидронафтиленовую группу, в которых насыщенное кольцо присоединено к остатку А и ароматическое кольцо присоединено к остатку С или к конденсированному
пятичленному гетероциклу,
пиперидиниленовую или пиперазиниленовую группу, которые могут быть также через атомы азота присоединены к атомам углерода соседних остатков,
С означает
связь, фениленовую или -О-метиленовую группу,
D означает связь или метиленовую группу,
Е означает алкиленовую группу, содержащую 3-5 атомов углерода, алкениленовую группу, содержащую
3-5 атомов углерода, причем двойная связь может быть не присоединена непосредственно к атому азота -Z1-Z2-Z3-Z4-группы или в случае, если Е не присоединено непосредственно к атому азота
Z1-Z2-Z3-Z4-группы, означает -О-, -S-, -SO-, -SO2-, -NH-, -N(метил)-, -N(ацетил)-, -N(S2CH3)-, -CO-, -NH-CO-, -N(CH3)-CO-, -CO-NH-, -CO-N(CH3)-, -SO2-NH- ИЛИ -SO2-N(CH3)-группу, пиперидиниленовую,
пиперазиниленовую или окси-пиперазиниленовую группу, причем атомы азота могут быть также связаны с атомами углерода соседних остатков,
F означает связь, алкиленовую группу, содержащую 1-4
атома углерода, которая может быть замещена фенильной, карбоксильной, метоксикарбонильной, бензилоксикарбонильной, фенилэтиламинокарбонильной, (метоксифенил)этиламинокарбонильной или
алкиламинокарбонильной группой, причем алкиламинокарбонильная группа в алкильной части, содержащей 1-4 атома углерода, может быть замещена фенильной, гидроксифенильной, метоксифенильной, карбоксильной
или бензилоксикарбонильной группой или дополнительно другой карбокси- или бензилоксикарбонильной группами,
пиперидиниленовую или пирролидиниленовую группы, которые могут быть также через атом
азота связаны с соседним остатком Е, если связь происходит через атом азота остатка Е,
циклогексиленовую или циклогексиленметиленовую группу, причем, если D означает связь, E атом кислорода и
F алкильную группу, А не может быть непосредственно связанной с фенильным кольцом амино- или ациламиногруппой,
G означает не связанную с гетероатомом остатка Е карбонильную группу, которая
замещена гидроксильной группой, алкоксигруппой, содержащей 1-6 атомов углерода, которая может быть замещена в положениях 1-5 фенильной группой или в 1 или 2-ом положении циклогексил-, нафтил- или
пиридилгруппой или в 2-ом положении пирролидин-2-он-1-ил-группой, циннамилоксигруппой, циклоалкоксигруппой, содержащей 6-8 атомов углерода, инданилокси-, норборнилокси- или норборнилметилоксигруппой,
алканоилоксиметоксигруппой с общим числом атомов углерода 2-5 в алканоильной части, алкоксикарбонилоксиметоксигруппой, содержащей в алкоксильной части 1-3 атома углерода, или
циклогексилоксикарбонилоксиметоксигруппой, в которых метокси-части могут быть замещены метильной группой,
сульфо-, фосфоно-, О-метил-фосфоно или тетразол-5-ил-группу.
Объектом
изобретения являются, в частности, те соединения, в которых
R1 означает водород, метильную группу, метоксигруппу, метиламиногруппу, диметиламиногруппу, N-бутилоксикарбонилметиламиногруппу,
N-изобутилоксикарбонилметиламиногруппу, N-карбоксиметил-аминогруппу, N-карбоксиметил-метиламиногруппу, N-метоксикарбонил-метил-аминогруппу или N-метоксикарбонилметил-метиламиногруппу,
Х
означает атом кислорода или азота или -NR2 группу, причем
R2 означает атом водорода, линейную или разветвленную алкильную группу, содержащую 1-14 атомов углерода, алкильную группу, содержащую
1-3 атомов углерода, которая замещена карбокси- или метоксикарбонильной группой,
алкильную группу, содержащую 1-4 атомов углерода, которая замещена фенильной группой, которая в свою очередь
может быть замещена один или два раза бромом, амино- или метоксигруппами, двумя фенильными группами или пиридильной группой,
алкильную группу, содержащую 2 или 3 атома углерода, которая в 2
или 3-ем положении замещена амино- ии пиперидиногруппой, в которой метиленовая группа в 4-ом положении замещена иминогруппой, бензилиминогруппой, сульфенильной, сульфинильной или сульфонильной группой,
Z1, Z2, Z3, Z4 являются одинаковыми или различными и означают метиновые группы, атомы углерода, иминогруппы или атомы азота, причем по меньшей
мере один из остатков Z1-Z4 должен содержать атом углерода и одна или две соседние к атому азота метиновые группы могут быть замещены карбонильными группами,
Z5 и Z6 означают атомы углерода или один из остатков Z5 или Z6 означает азот, а другой углерод,
А означает аминогруппу, линейную или разветвленную
аминоалкильную группу, содержащую 1-3 атомов углерода, амидино-, гуанидино- или гуанидинметиловую группу, причем в выше упомянутых амино-, аминоалкил-, амидино-, гуанидино- или гуанидинометильных
группах водород у атома азота может быть замещен алкильной группой, содержащей 1-4 атома углерода, алкоксикарбонильной группой с общим числом атомов углерода 2-5, бензилоксикарбонильной группой,
ацетилоксиметоксикарбонильной группой, диметилфосфорил- или диэтилфосфорильной группой,
B означает фениленовую группу, которая может быть замещена атомом фтора, хлора или брома, метильной,
гидроксильной или метоксильной группой,
пиридиниленовую группу или циклоалкиленовую группу, содержащую 3-6 атомов углерода, инданиленовую или 1,2,3,4-тетрагидронафтиленовую группу, в которых
насыщенное кольцо присоединено к остатку А и ароматическое кольцо присоединено к остатку С или к конденсированному пятичленному гетероциклу,
пиперидиниленовую или пиперазиниленовую группу,
которые могут быть также через атомы азота присоединены к атомам углерода соседних остатков,
С означает связь, фениленовую или -О-метиленовую группу,
D означает связь или метиленовую
группу,
Е означает алкиленовую группу, содержащую 3-5 атомов углерода, алкениленовую группу, содержащую 3-5 атомов углерода, причем двойная связь может быть не присоединена непосредственно к
атому азота -Z1-Z2-Z3-Z4-группы или в случае, если Е не присоединено непосредственно к атому азота Z1-Z2-Z3-Z4
-группы, означает -О-, -S-, -SO-, -SO2-, -NH-, -N(метил)-, -N(ацетил)-, -N(S2CH3)-, -CO-, -NH-CO-, -N(CH3)-CO-, -CO-NH-, -CO-N(CH3)-, -SO2-NH- или -SO2-N(CH3)-группу, пиперидиниленовую, пиперазиниленовую или окси-пиперазиниленовую группу, причем атомы азота могут быть также связаны с атомами углерода
соседних остатков,
F означает связь, алкиленовую группу, содержащую 1-4 атома углерода, которая может быть замещена фенильной, карбоксильной, метоксикарбонильной, бензилоксикарбонильной,
фенилэтиламинокарбо- нильной, (метоксифенил)этиламинокарбонильной или алкиламинокарбонильной группой, причем алкиламинокарбонильная группа в алкильной части, содержащей 1-4 атома углерода, может быть
замещена фенильной, гидроксифенильной, метоксифенильной, карбоксильной или бензилоксикар- бонильной группой или дополнительно другой карбокси- или бензилоксикарбонильной группами,пиперидиниленовую или
пирролидиниленовую группы, которые могут быть также через атом азота связаны с соседним остатком Е, если связь происходит через атом азота остатка Е,
циклогексиленовую или
циклогексиленметиленовую группу, причем, если D означает связь, E атом кислорода и F алкильную группу, А не может быть непосредственно связанной с фенильным кольцом амино- или ациламиногруппой,
G означает не связанную с гетероатомом остатка Е карбонильную группу, которая замещена гидроксильной группой, алкоксигруппой, содержащей 1-6 атомов углерода, которая может быть замещена в
положениях 1-5 фенильной группой или в 1 или 2-ом положении циклогексил-, нафтил- или пиридилгруппой или в 2-ом положении пирролидин-2-он-1-ил-группой, циннамилоксигруппой, циклоалкоксигруппой,
содержащей 6-8 атомов углерода, инданилокси-, норборнилокси- или норборнилметилоксигруппой, алканоилоксиметоксигруппой с общим числом атомов углерода 2-5 в алканоильной части,
алкоксикарбонилоксиметоксигруппой, содержащей в алкоксильной части 1-3 атома углерода, или циклогексилоксикарбонилоксиметокси- группой, в которых метокси-части могут быть замещены метильной группой,
сульфо-, фосфоно-, О-метил-фосфоно или тетразол-5-ил-группу.
Объектом изобретения являются, в частности, те соединения, в которых
R1 означает водород,
метильную группу, метоксигруппу, метиламиногруппу, диметиламиногруппу, N-бутилоксикарбонилметиламиногруппу, N-изобутилоксикарбонил- метиламиногруппу, N-карбоксиметил-аминогруппу,
N-карбоксиметил-метиламиногруппу, N-метоксикарбонил-метил-амино- группу или N-метоксикарбонилметил-метил- аминогруппу,
Х означает атом кислорода или азота или -NR2 группу,
причем
R2 означает атом водорода, линейную или разветвленную алкильную группу, содержащую 1-14 атомов углерода, алкильную группу, содержащую 1-3 атомов углерода, которая замещена
карбокси- или метоксикарбонильной группой,
алкильную группу, содержащую 1-4 атомов углерода, которая замещена фенильной группой, которая в свою очередь может быть замещена один или два раза
бромом, амино- или метоксигруппами, двумя фенильными группами или пиридильной группой,
алкильную группу, содержащую 2 или 3 атома углерода, которая в 2 или 3-ем положении замещена амино- ии
пиперидиногруппой, в которой метиленовая группа в 4-ом положении замещена иминогруппой, бензилиминогруппой, сульфенильной, сульфинильной или сульфонильной группой,
Y означает NO-группу, атом
азота или метиновую группу;
Z1, Z2, Z3 и Z4 могут быть одинаковыми или различными и означают метиновые группы, атомы углерода, иминогруппы или
атомы азота, причем по меньшей мере два из остатков Z1-Z4 должны содержать атомы углерода и одна или две соседние к атому азота метиновые группы могут быть замещены карбонильными
группами;
Z5 и Z6 означают атомы углерода или один из остатков Z5 или Z6 атом азота и другой из этих остатков атом углерода,
А означает
аминометильную или амидиногруппу, в которых у одного из атомов азота водородный атом может быть замещен метоксикарбонильной группой,
B означает фениленовую группу;
С связь или
-О-метиленовую группу;
D связь;
Е означают алкиленовую группу, содержащую 3 или 4 углеродных атома или, если Е не является непосредственно связанной с атомом азота Z1
-Z2-Z3-Z4-группой, означает -О-, -NH-CO- или -CO-NH-группу;
F связь или алкиленовую группу, содержащую 1-3 атома углерода и
G означает карбоксигруппу,
алкоксикарбонильную группу с общим числом атомов углерода 2-5 или циклогексилоксигруппу,
их таутомеры, смеси изомеров, отдельные изомеры и их соли, в частности их физиологически переносимые
соли с неорганическими или органическими кислотами.
Новые соединения общей формулы (1) получают, например, следующими известными способами:
а) для получения соединений общей
формулы (1), в которой G означает карбоксильную группу, осуществляют гидролиз, обработку кислотой, термолиз или гидрогенолиз соединения общей формулы

в которой
А до F, R1, Z1, до Z6, X и Y имеют указанные выше значения и
G1, который связан с атомом углерода, означает группу, переводимую в карбоксильную группу.
Например, можно переводить функциональные производные карбоксильной группы, такие как незамещенные или замещенные амиды, сложные эфиры, сложные тиоэфиры, триметилсилиловые эфиры, сложные ортоэфиры, сложные иминоэфиры, амидины или ангидриды, или нитрильные группы в карбоксильную группу, гидролизом сложные эфиры с третичными спиртами, например трет.бутиловый эфир, переводят в карбоксильную группу посредством обработки кислотой или термолизом, сложные эфиры с аралканолами, например бензиловый эфир, переводят в карбоксильную группу посредством гидрогенолиза, и бис(алкоксикарбонил)метильные группы посредством гидролиза или обработкой кислотой переводят в бис(гидроксикарбонил)метильную группу, которую затем декарбоксилируют.
Гидролиз целесообразно проводить в присутствии кислоты, например соляной, серной, фосфорной, трихлоруксусной или трифторуксусной, в присутствии основания, например гидроокиси лития, гидроокиси натрия или калия, в подходящем растворителе, таком как, например вода, метанол, смесь вода/метанол, этанол, смесь вода/этанол, вода/изопропанол, вода/тетрагидрофуран или вода/диоксан при температуре между (-10)оС и (120)оС, например при температуре между комнатной и температурой кипения реакционной смеси. При обработке органической кислотой, например, трихлоруксусной или трифторуксусной, в случае наличия спиртовых гидроксильных групп происходит одновременно их перевод в соответствующую ацилоксигруппу.
Если G1 в соединении формулы (2) означает циано- или аминокарбонилгрупппу, то эти группы могут быть переведены в карбоксильные группы с помощью нитрита, например нитрита натрия, в присутствии кислоты, например серной, которую целесообразно применять одновременно в качестве растворителя при температуре между 0о и 50о.
Если G1 в соединении формулы (2) означает, например трет.бутилоксикарбонильную группу, то трет.бутильная группа может отщепляться также обработкой кислотой такой, как трифторуксусная, муравьиная, n-толуолсульфокислота, серная, фосфорная или полифосфорная, при необходимости в инертном растворителе, как, например, метиленхлорид, хлороформ, бензол, толуол, тетрагидрофуран или диоксан, предпочтительно при комнатной температуре между (-10)оС и 120оС, например при температуре между 0о и 60о, или также нагреванием при необходимости в инертном растворителе, как, например, метиленхлорид, хлороформ, бензол, толуол, тетрагидрофуран или диоксан, и предпочтительно в присутствии каталитического количества кислоты, такой как n-толуолсульфокислота, серная, фосфорная или полифосфорная, предпочтительно при температуре кипения используемого растворителя, например при 40оС и 100оС.
Если G1 в соединении формулы (2) означает, например, бензилоксикарбонильную группу, то бензильная группа может отщепляться также гидрогенолитически в присутствии катализатора гидрирования, такого как палладий на угле, в подходящем растворителе, как, например, метанол, этанол, этанол/вода, ледяная уксусная кислота, этилацетат, диоксан или диметилформамид, предпочтительно при температуре между 0о и 50оС, например при комнатной температуре, и давлением водорода 1-10 бар. При гидрогенолизе могут одновременно восстанавливаться другие остатки, например нитрогруппа до аминогруппы или бензилоксигруппа до гидроксигруппы.
б) Для получения бензимидазола общей формулы (1) проводят циклизацию соединения общей формулы

А до G, R1, R2 и Z1-Z4 имеют указанные выше значения и Y1 означает аминогруппу.
Циклизацию целесообразно проводить в растворителе или смеси растворителей таких, как метанол, этанол, изопропанол, ледяная уксусная кислота, бензол, хлорбензол, толуол, ксилол, гликоль, монометиловый эфир гликоля, диметиловый эфир диэтиленгликоля, сульфолан, диметилформамид, тетрамин, или в избытке алкилирующего средства, применяемого для получения соединений общей формулы (3), например в соответствующей кислоте или соответствующем нитриле, ангидриде, галоидангидриде кислоты, сложном эфире или амиде, например при температуре между 0о и 250оС, предпочтительно при температуре кипения реакционной среды, при необходимости в присутствии конденсирующем средства такого, как хлорокись фосфора, тионилхлорид, сульфурилхлорид, серная кислота, n-толуолсульфокислота, метансульфокислота, соляная кислота, фосфорная кислота, полифосфорная кислота, уксусный ангидрид или при необходимости также в присутствии основания такого, как этилат калия или трет.бутилат калия. Циклизацию можно проводить также и без растворителя и/или средства конденсации.
Особенно предпочтительно проводить взаимодействие таким образом, что соединение общей формулы (3) получают в реакционной смеси ацилированием соответствующего диаминосоединения или восстановлением соответствующего о-нитро-ациламиносоединения.
При прерывании восстановления нитрогруппы на стадии гидроксиламина получают при последующей циклизации N-окись соединения общей формулы (1). Полученную таким путем N-окись можно в заключение перевести восстановлением в соответствующее соединение общей формулы (1).
Последующее восстановление полученной N-окиси формулы (1) проводят предпочтительно в растворителе, например вода, вода/этанол, метанол, ледяная уксусная кислота, этилацетат или диметилформамид, водородом в присутствии катализатора гидрирования, например никеля Ренея, платины или палладия на угле, металлами, как, например, железо, олово или цинк в присутствии кислоты, как, например, уксусная, соляная или серная, такими солями, как сульфат железа (II), хлорид олова (II) или дитионит натрия, производными трехвалентного фосфора, как трифенилфосфин, триэтилфосфит или треххлористый фосфор, или гидразином в присутствии никеля Ренея при температуре между 0о и 50оС, предпочтительно однако при комнатной температуре.
в) Для получения соединений общей формулы (1), в которой А означает амидиногруппу, которая может быть замещена
алкильной группой, проводят взаимодействие образующегося в реакционной смеси соединения формулы
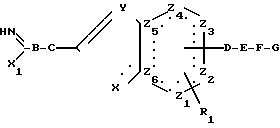
в которой
В до G, R1, Z1 по Z6, X и Y имеют указанные выше значения и
Х1 означает алкокси- или аралкоксигруппу, как, например, метоксиэтокси-, н-пропокси-, изопропокси- или бензилокси- группу, или алкилтио- или аралкилтиогруппу, как метилтио-, этилтио-, н-пропилтио- или бензилтиогруппу, или аминогруппу
с амином общей формулы
Ra-NH2, (5)
в которой
Ra означает атом водорода или алкильную группу, содержащую 1-4 атомов углерода, или с его кислотно-аддитивными солями.
Целесообразно проводить взаимодействие в растворителе, как, например, метанол, этанол, н-пропанол, вода, метанол/вода, тетрагидрофуран или диоксан при температуре между 0о и 150оС, предпочтительно при температуре между 20 и 120оС, с соответствующим свободным амином и с соответствующей кислотно-аддитивной солью, например карбонатом аммония или ацетатом аммония.
Соединения общей формулы (4) получают, например, взаимодействием соответствующего нитрила с соответствующим спиртом, например метанолом, этанолом, н-пропанолом, изопропанолом или бензиловым спиртом, в присутствии кислоты, например соляной, или в присутствии соответствующего алкоголята, как, например, метилат натрия или этилат натрия или взаимодействием соответствующего амида с солью триалкилоксония, например тетрафторборатом триэтилоксония, в растворителе, как, например, метиленхлорид, тетрагидрофуран или диоксан, при температуре между (-10)о и 50оС, предпочтительно при температуре между 0о и 20оС или соответствующего нитрила с сероводородом, целесообразно в таком растворителе, как пиридин или диметилформамид, и в присутствии основания, например триэтиламина, и последующим алкилированием полученного тиоамида с соответствующим алкил- или аралкилгалогенидом.
г) Для получения
соединений общей формулы (1), в которой А означает аминоалкильную группу, проводят восстановление соединения общей формулы
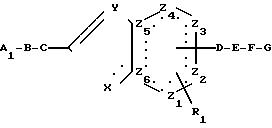
в которой
В до G, R1, Z1 до Z6, X и Y имеют указанные выше значения
А1 означает циано- или цианоалкильную группу.
Восстановление проводят предпочтительно в подходящем растворителе, как, например, метанол, метанол/вода, метанол/аммиак, метанол/вода/аммиак, метанол/соляная кислота, этанол, простой эфир, тетрагидрофуран, диоксан, диметилформамид или ледяная уксусная кислота в присутствии каталитически возбужденного водорода, например водорода, в присутствии никеля Ренея, платины или палладия на угле, или в присутствии гидрида металла, например боргидрида натрия, боргидрида лития или литийалюминийгидрида при температуре между 0о и 100оС, предпочтительно при температуре между 20о и 80оС.
д) Для получения соединений общей формулы (1), которые содержат сульфинильную или сульфонильную группу,
связанные с атомом азота, проводят окисление соединения общей формулы

А до G, R1, Z1 до Z6, X и Y имеют указанные выше значения с учетом того, что по меньшей мере один из остатков R1, B, C, E, G или Х содержит сульфенильную или сульфинильную группу, несвязанную с атомом азота.
Окисление проводят предпочтительно в растворителе или в смеси растворителей, таких как вода, вода/пиридин, ацетон, метиленхлорид, ледяная уксусная кислота, ледяная уксусная/ацетангидрид, разбавленная серная кислота или трифторуксусная кислота в зависимости от примененного окислителя целесообразно при температуре между (-80) и 100оС. Для получения соответствующего S-оксисоединения общей формулы (1) целесообразно проводить окисление с одним эквивалентом применяемого окислителя, например с перекисью водорода в ледяной уксусной, трифторуксусной или муравьиной кислоте при 0-20оС или в ацетоне при 0-60оС с перкислотой, например с пермуравьиной кислотой в ледяной уксусной или трифторуксусной кислоте при 0-50оС или с м-хлорпербензойной кислотой в метиленхлориде или хлороформе при (-20) до 60оС, с метапериодатом натрия в водном метаноле или этаноле при (-15)оС 25оС, с бромом в ледяной уксусной или водной уксусной кислоте, при необходимости в присутствии слабого основания, как, например, ацетат натрия с N-бром-сукцинимидом в этаноле, с трет.бутилгипохлоритом в метаноле при (-80) до (-30)оС, с иодбензохлоридом в водном пиридине при 0-50оС, с азотной кислотой в ледяной уксусной кислоте при 0-20оС, с хромовой кислотой в ледяной уксусной кислоте или в ацетоне при 0-20оС и с хлористым сульфурилом в метиленхлориде при (-70)оС, полученный при этом комплекс хлор-тиоэфир целесообразно гидролизовать водным этанолом.
Для получения S,S-диоксисоединения общей формулы (1) целесообразно проводить окисление, исходя из соответствующего алкилсульфинильного соединения с одним или несколькими эквивалентами применяемого окислителя или из соответствующего алкилсульфенильного соединения с двумя или несколькими эквивалентами применяемого окислителя, например с перекисью водорода в смеси ледяной уксусной кислоты и ацетангидрида, в трифторуксусной кислоте или муравьиной кислоте при 20-100оС или в ацетоне при 0-60оС, с перкислотой, как, например, пермуравьиная кислота или м-хлорпербензойная кислота в ледяной уксусной кислоте, трифторуксусной кислоте, метиленхлориде или хлороформе при температуре между 0 и 60оС, с азотной кислотой в ледяной уксусной кислоте при 0-20оС, с хромовой кислотой или перманганатом калия в ледяной уксусной кислоте, смеси вода/серная кислота или в ацетоне при 0-20оС.
е) Для получения соединений общей формулы (1), в которой А означает амино-, аминоалкил-, амидино-, гуанидино- или гуанидиноалкильную группу, которая замещена
алкоксикарбонильной группой с общим числом атомов углерода 2-5, арилметоксикарбонильной, арилэтоксикарбонильной, арилоксикарбонильной, арилкарбонильной, аралкилкарбонильной или арилкарбонильной
группой, проводят взаимодействие соединения общей формулы
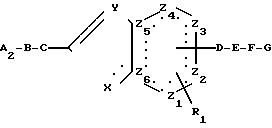
в которой
В до G, R1, Z1 до Z6, X и Y имеют указанные вначале значения и
А2 означает амино-, аминоалкил-, амидино-, гуанидино- или гуанидиноалкильную группу,
с соединением общей формулы
X2-CO Rb, (9)
в которой
Rb означает алкоксигруппу, содержащую 1-4 атомов углерода, арилметокси-, арилэтокси-, арилокси-, алкильную, аралкильную или арильную группу, и
Х2 означает нуклеофильную отщепляющуюся группу, как атом галогена, например атом хлора или брома.
Взаимодействие целесообразно проводить в растворителе, например, тетрагидрофуране, метиленхлориде, хлороформе или диметилформамиде, а также в присутствии основания, например, карбоната натрия, карбоната калия или натриевой щелочи или в присутствии третичного органического основания, например триэтиламина, N-этил-диизопропиламина, N-метил-морфолина или пиридина, которые одновременно могут служить растворителем, при температуре между (-30) и 100оС, предпочтительно при температуре между (-10) и 80оС.
ж) Для получения соединений общей формулы (1), в которой G означает не
связанную с гетероатомом остатка Е карбонильную группу, которая замещена циннамилоксигруппой или алкоксигруппой с 1-6 атомами углерода, в которой алкоксиостаток с 1-5 атомами углерода может быть
замещен фенильной группой или алкоксиостаток с 1-3 атомами углерода в 1, 2 или 3-ем положении может быть замещен нафтильной группой, циклоалкильной группой с 5 или 6 атомами углерода, пиридильной
группой или в 2 или 3-ем положении пирролидин-2-он-1-ил-группой, циклоалкоксигруппой с 5-8 атомами углерода, инданилокси-, 1,2,3,4-тетрагидронафтилокси-, бициклогептилокси- или
бициклогептилметоксигруппой, или алканоилоксиметоксигруппой с общим числом атомов углерода в алканоильной части 2-5, алкоксикарбонилоксиметоксигруппой с 1-2 атомами углерода в алкильной части или
циклоалкоксикарбонилоксиметоксигруп- пой, содержащей 5 и 6 атомов углерода в циклоалкильной части, в который метоксичасти могут быть замещены алкильной группой, проводят взаимодействие соединения
общей формулы

в которой
А до F, R1, Z1 до Z6, X и Y имеют указанные вначале значения и
G" означает карбокси- или алкоксикарбонильную группу, со спиртом общей формулы
X3-Rc, (11)
в которой
Х3 означает гидроксигруппу или нуклеофильную отщепляющуюся группу такую, как атом галогена, например атом хлора, брома или иода, и
Rc означает циннамилгруппу или алкильную группу с 1-6 атомами углерода, в которой алкильный остаток, содержащий 1-5 атомов углерода, может быть замещен фенильной группой или алкильный остаток, содержащий 1-3 атома углерода, в 1, 2 или 3 положении может быть замещен нафтильной группой, циклоалкильной группой, содержащей 5 или 6 атомов углерода, пиридильной группой или в 2- или 3-положении пирролидин-2-он-1-ил-группой,
циклоалкильную группу, содержащую 5-8 атомов углерода, инданил-, 1,2,3,4-тетрагидронафтил-, бициклогептил или бициклогептилметилгруппу, алканоилоксиметилгруппу с общим числом атомов углерода в алканоильной части 2-5, алкоксикарбонилоксиметильную группу, содержащую 1-2 атома углерода в алкильной части, или циклоалкоксикарбонилоксиметильную группу, содержащую 5 или 6 атомов углерода в циклоалкильной части, в которых метильные части могут быть замещены алкильной группой.
Взаимодействие целесообразно проводить в растворителе или в смеси растворителей, например метиленхлориде, диметилформамидe, диметилсульфоксиде, толуоле, хлорбензоле, тетрагидрофуране, толуол/тетрагидрофуране или диоксане, при необходимости в присутствии кислоты, например соляной, или в присутствии водоотнимающего средства, например изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметилхлорсилана, четыреххлористого титана, соляной кислоты, серной кислоты, метансульфокислоты, n-толуолсульфокислоты, треххлористого фосфора, пятиокиси фосфора, N,N1-дициклогексилкарбодиимида, смеси N,N1-дициклогексилкарбодиимида с N-гидроксисукцинилмидом или 1-гидрокси-бензтриазола, смеси N,N1-карбонилдиимидазола или N,N1-тионилдиимидазола, или трифенилфосфина с четырххлористым углеродом в присутствии основания, как, например, карбонат натрия, карбонат калия, натриевая щелочь, триэтиламин, N-этилдиизопропиламин, N-метил-морфолин, пиридин или 4-диметиламино-пиридин, целесообразно при температуре между 0 и 150оС, предпочтительно при 0 и 50оС.
Если Х3 означает нуклеофильную отщепляющуюся группу, то целесообразно проводить взаимодействие в растворителе, таком как метиленхлорида, тетрагидрофуран, диоксан, диметилсульфоксид или диметилформамид при необходимости в присутствии ускорителя реакции, как иодид натрия или калия и предпочтительно в присутствии основания такого, как карбонат натрия или калия или натриевая щелочь или в присутствии третичного органического основания, например N-этил-диизопропиламинa или N-метил-морфолина, которые одновременно могут служить растворителем, или при необходимости в присутствии карбоната серебра или окиси серебра при температуре между (-30) и 100оС предпочтительно при температуре между (-10)о и 80оС.
Если Х3 означает гидроксигруппу, то этерификацию целесообразно проводить в растворителе или в смеси растворителей, например метиленхлориде, диметилформамиде, диметилсульфоксиде, толуоле, хлорбензоле, тетрагидрофуране, толуол/тетрагидрофуране или диоксане при необходимости в присутствии кислоты, например соляной, или в присутствии водоотнимающего средства, например изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметилхлорсилана, четыреххлористого титана, соляной кислоты, серной кислоты, метансульфокислоты, n-толуолсульфокислоты, треххлористого фосфора, пятиокиси фосфора, N, N1-дициклогексилкарбодиимида, смеси N,N1-дициклогексил- карбодиимида с N-гидроксисукцинимидом, или 1-гидроксибензтриазола, смеси N, N1-карбонилдиимидазола или N, N1-тионилдиимидазола или трифенилфосфина с четыреххлористым углеродом при температуре между -(30)оС и 100оС, предпочтительно при температуре между (-10) и 60оС.
з) Для получения соединений общей формулы (1), в которой А означает
гуанидиноалкильную группу или амидиногруппу, которая связана с атомом азота циклической иминогруппы, проводят взаимодействие соединения общей формулы

в которой
В до G, R1, Z1 до Z6, X и Y имеют указанные выше значения и
А3 означает аминоалкильную группу или соединения общей формулы

в которой
В до G, R1, Z1 до Z6, X и Y имеют указанные выше значения с учетом того, что остаток В содержит циклическую иминогруппу,
с S-алкил-изотиомочевиной.
Взаимодействие целесообразно проводить в растворителе, например диметилформамиде, и предпочтительно в присутствии основания, например карбоната натрия, при повышенной температурe, например при температуре между 80 и 120оС.
и) Для получения соединений общей формулы (1), в которой А означает связанную с ароматическим кольцом гуанидиногруппу, проводят взаимодействие
соединения общей формулы

в которой
В до G, R1, Z1 до Z6, X и Y имеют указанные значения с учетом того, что В означает ароматические или гетероароматическое кольцо, и
А4 означает аминогруппу с цианамидом или его кислотно-аддитивной солью. Взаимодействие целесообразно проводить в растворителе, например диоксане, смеси диоксана с водой или тетрагидрофуране, предпочтительно при температуре между 60 и 120оС, например при температуре кипения реакционной смеси.
к) Для получения соединений общей формулы (1), в которой D означает связь и Е означает -NR3-CO-группу, проводят
взаимодействие соединения общей формулы
в которой
А до C, R1, R3, Z1 до Z6, X и Y имеют указанные значения
с соединением общей формулы
X4-CO-F-G, (16) в которой
F и G имеют указанные выше значения и
Х4 означает нуклеофильную отщепляющуюся группу, например гидрокси- или алкоксигруппу, или атом галогена, например атом хлора, брома или иода, или метокси- или этоксигруппу, или с его реакционно способными производными.
Взаимодействие целесообразно проводить в растворителе, например метиленхлориде, хлороформе, четыреххлористом углероде, простом эфире, тетрагидрофуране, диоксане, бензоле, толуоле, ацетонитриле или диметилформамиде, при необходимости в присутствии активирующего кислоту средства или водоотнимающего средства, например в присутствии этилового эфира хлормуравьиной кислоты, тионилхлорида, треххлористого фосфора, пятиокиси фосфора, N, N1-дициклогексилкарбодиимида, смеси N,N1-дициклогексилкарбодиимида с N-гидроксисукцинимидом, N,N1-карбонилдиимидазола или N,N1-тионилдиимидазола или смеси трифенилфосфина с четыреххлористым углеродом, при необходимости в присутствии неорганического основания, например карбоната натрия, или третичного органического основания, например триэтиламина, пиридина или 4-диметиламинопиридина, которые одновременно могут быть растворителем, при температуре между (-25) и 150оС, предпочтительно при температуре между (-10)оС и температурой кипения примененного растворителя.
Ацилирование проводится как указано выше, предпочтительно с соответствующим галоидангидридом кислоты или ангидридом кислоты, причем оно может быть проведено также без растворителя.
л) Для получения соединений
общей формулы (1), в которой А означает амино- или аминоалкильную группу, проводят взаимодействие соединения общей формулы

в которой
R1, B до G, X, Y и Z1 до Z6 имеют указанные выше значения и
А5 означает H2N-CO-T-группу, в которой Т связь или алкиленовая группа с 1-4 атомами углерода с соединением фенилиод (III) общей формулы

в которой
R9 означает ацильные остатки органической карбоновой кислоты, например ацетокси- или трифторацетоксигруппу.
Взаимодействие проводят предпочтительно в водном растворителе, например в воде или смеси вода/ацетонитрил, при температуре между 0 и 50оС, предпочтительно при комнатной температуре.
м) Для получения соединений общей формулы (1), в которой А означает аминоалкильную группу, в которой аминогруппа не связана с четвертичным атомом углерода, или аминогруппу, которая связана с
СН- или СН2-группой остатка В или С, проводят восстановление соединения общей формулы

в которой
R1, B до G, X, Y и Z1 до Z6 имеют указанные выше значения и
А6 означает гидроксиимино- или гидроксииминоалкильную группу с 1-4 атомами углерода.
Восстановление целесообразно проводить в подходящем растворителе, например метаноле, смеси метанол/вод, метанол/вода/аммиак, этанол, простой эфир, тетрагидрофуран, диоксан или диметилформамид, при необходимости с добавкой кислоты, например соляной, в присутствии каталитически активированного водорода, например водорода с никелем Ренея, платиной или палладием на угле, при температуре между 20 и 80оС.
н) Для получения соединений общей формулы (1), в которой А означает амино-, аминоалкил-, амидино-, гуанидино- или
гуанидиноалкильные группы, замещенные диалкилфосфорильными группами с 1-3 атомами углерода в алкильной части, проводят взаимодействие соединения общей формулы

в которой
R1, B до G, X, Y и Z1 до Z6 имеют указанные выше значения и
А7 означает аминогруппу, линейную или разветвленную аминоалкильную группу с 1-4 атомами углерода, амидино-, гуанидино- или гуанидиноалкильную группу с 1-3 атомами углерода в алкильной части
с соединением общей формулы
X5-PO(OR10)2, (21)
в которой
R10 означает алкильную группу с 1-3 атомами углерода, а
X5 нуклеофильную отщепляющуюся группу, например цианогруппу, атом хлора или брома. Взаимодействие целесообразно проводить в растворителе, например диметилформамиде, при температуре между 0 и 100оС, предпочтительно при температуре между 15 и 50оС.
о) Для получения соединений общей формулы (1), в которой Е означает -СО-NR3-группу, проводят
взаимодействие соединения общей формулы
в которой
А до D, X, Y и Z1 до Z6 имеют указанные выше значения с соединением общей формулы
HNR3-F-G, (23) в которой
F, G и R3 имеют указанные выше значения.
Взаимодействие целесообразно проводить в растворителе, например метиленхлориде, хлороформе, четыреххлористом углероде, простом эфире, тетрагидрофуране, диоксане, бензоле, толуоле, ацетонитриле или диметилформамиде, при необходимости в присутствии активирующего кислоту средства или водоотнимающего средства, например в присутствии этилового эфира хлормуравьиной кислоты, тионилхлорида, треххлористого фосфора, пятиокиси фосфора, N, N1-дициклогексилкарбодиимида, смеси N,N1-дициклогексилкарбодиимида с N-гидроксисукцинимидом или с 1-гидроксибензотриазолом, тетрафторбората 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронил, N,N1-карбонилдиимида- зола или N, N1-тионилдиимидазола или смеси трифенилфосфина с четыреххлористым углеродом, при необходимости в присутствии неорганического основания, например карбоната натрия, или третичного органического основания, например триэтиламина, N-метил-морфолина, пиридина или 4-диметиламинопиридина, которые одновременно могут служить растворителем, при температуре между (-25) и 150оС, предпочтительно при температуре между (-10оС) и температурой кипения используемого растворителя.
Если описанными выше способами получают соединение общей формулы (1), в которой R1 означает упомянутую выше амино- или аминоалкильную группу, то оно может быть переведено путем алкилирования в соответствующее алкиламино- или диалкиламиносоединение общей формулы (1).
Последующее алкилирование целесообразно проводить в растворителе или в смеси растворителей, например в метиленхлориде, диметилформамиде, диметилсульфоксиде, толуоле, хлорбензоле, тетрагидрофуране, толуол/тетрагидрофуране или диоксане, при необходимости в присутствии основания, например карбоната натрия, калия, натриевой щелочи, трет. бутилата калия или N-этил-диизопропиламина, при температуре между 0 и 150оС, предпочтительно при температуре между 0 и 50оС.
При описанных выше реакциях имеющиеся реакционные группы, например гидрокси-, карбокси-, фосфоно-, амино-, алкиламино- или иминогруппы могут защищаться обычными защитными группами, которые после реакции отщепляются.
Например, защитной группой для гидроксигруппы является триметилсилил-, ацетил-, бензоил-, трет. бутил-,
тpитил-, бензил- или тетрагидропиранилгруппу;
защитной группой для карбоксильной группы может быть триметилсилил-, метил-, этил-, трет.бутил-, бензил- или тетрагидропиранилгруппа;
для фосфоногруппы защитными могут быть триметилсилил-, метил-, этил-, или бензилгруппа и для аминогруппы, алкиламиногруппы или иминогруппы защитными могут быть ацетильная, трифторацетильная,
бензоильная, этоксикарбонильная, трет. бутоксикарбонильная, бензилоксикарбонильная, бензильная, метоксибензильная или 2,4-диметоксибензильная группа и для аминогруппы дополнительно фталильная
группа.
Проводимое в случае необходимости последующее отщепление защитной группы осуществляют, например, путем гидролиза в среде водного растворителя, например воды, смеси изопропанола и воды, смеси тетрагидрофурана и воды или смеси диоксана и воды, в присутствии кислоты, например трифторуксусной, соляной или серной, или в присутствии основания щелочного металла, например гидроокиси натрия или калия, или путем расщепления эфирного соединения, например в присутствии йодтриметилсилана, при температуре 0-100оС, предпочтительно при 10-50оС. Однако отщепление бензила, метоксибензила или бензилоксикарбонила осуществляют, например, путем гидрогенолиза, например водородом в присутствии катализатора, например палладия на угле, в среде растворителя, например метанола, этанола, сложного этилового эфира уксусной кислоты или ледяной уксусной кислоты, в случае необходимости с добавлением кислоты, например соляной, при 0-50оС, предпочтительно при комнатной температуре и под водородным давлением 1-7 бар, предпочтительно 3-5 бар.
Отщепление метоксибензила также можно осуществлять в присутствии окислителя, например аммонийнитрата церия (1У), в среде растворителя, например метиленхлорида, ацетонитрила или смеси ацетонитрила и воды, при 0-50оС, предпочтительно при комнатной температуре.
Однако отщепление 2,4-диметоксибензила предпочтительно осуществляют в среде трифторуксусной кислоты в присутствии анизола.
Отщепление только одного алкильного остатка от О,О1 -диалкилфосфоновой группы происходит, например, с иодидом натрия в растворителе, например ацетоне, этилметилкетоне, ацетонитриле или диметилформамиде, при температуре между 40 и 150оС, предпочтительно при температуре между 60 и 100оС.
Отщепление обоих алкильных остатков от О,О1-диалкилфосфоновой группы происходит, например, с иодтриметилсиланом, бромтриметилсиланом или смесью хлортриметилсилана с иодидом натрия в растворителе, например метиленхлориде, хлороформе или ацетонитриле, при температуре между 0оС и температурой кипения реакционной среды, предпочтительно при температуре между 20 и 60оС.
Отщепление трет.бутила или трет.бутилоксикарбонила предпочтительно осуществляют путем обработки кислотой, например трифторуксусной или соляной, в случае необходимости, в среде растворителя, например метиленхлорида, диоксана или простого эфира.
Отщепление фталила предпочтительно осуществляют в присутствии гидразина или первичного амина, например метиламина, этиламина или н-бутиламина, в среде растворителя, например метанола, этанола, изопропанола, смеси толуола и воды или диоксана, при температуре 20-50оС.
Кроме того, полученные соединения общей формулы (1) можно разделять на их энантиомеры и/или диастереомеры. Таким образом, например, смеси цис- и транс-изомеров можно разделять на отдельные цис- и транс-изомеры, а соединения по крайней мере с одним оптически активным атомом углерода можно разделять на их энантиомеры.
Таким образом, например, полученные смеси цис- и транс-изомеров можно разделять на отдельные цис- и транс-изомеры путем хроматографии, полученные соеди- нения общей формулы (1), имеющиеся в виде рацематов, можно разделять на их оптические антиподы по известному методу (см. Аллингер Н.Л. и Элиел Э. Л. в "Topics in Stereochemistry", том 6-й, Вили Интерсайенс, 1971 г), а полученные соединения общей формулы (1) по крайней мере с двумя асимметричными атомами углерода можно разделять на их диастереомеры известным образом, на основе их физических и химических различий, например, путем хроматографии и/или фракционированной кристаллизации. В том случае, если диастереомеры имеются в форме рацематов, их можно указанным образом разделять на энантиомеры.
Разделение энантиомеров предпочтительно осуществляют путем колоночной хроматографии на хиральных фазах или путем перекристаллизации из оптически активного растворителя, или путем взаимодействия с оптически активным веществом, образующим с рацематическим соединением соль или производные, например сложные эфиры или амиды, в частности с кислотой и ее активированными производными или спиртами, и разделения полученной таким образом смеси диастереомерных солей или производного, например, за счет разной растворимости, причем из чистых диастереомерных солей или производных путем обработки пригодным веществом можно получать свободные антиподы. Часто используемыми оптически активными кислотами являются, например, D- и L-формы винной или дибензоил-винной кислоты, ди-о-толил-винной кислоты, яблочной кислоты, миндальной кислоты, камфарной сульфокислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. В качестве оптически активного спирта можно использовать, например, (+)- или (-)- ментол, а в качестве оптически активного ацила в амидах -(+)- или -(-)-ментилоксикарбонил.
Кроме того, полученные соединения общей формулы (1) неорганической или органической кислотой можно переводить в их соли, в частности для их фармацевтического применения, физиологически переносимые соли. В качестве кислоты можно использовать, например, соляную, бромистоводородную, серную, фосфорную, фумаровую, янтарную, молочную, лимонную, винную или малеиновую.
Кроме того, в том случае, если полученные новые соединения общей формулы (1) содержат карбоксильную группу, их можно затем переводить в их аддитивные соли с неорганическими или органическими основаниями, в частности для применения в фармацевтике, в их физиологически переносимые аддитивные соли. В качестве основания можно использовать, например, гидроокись натрия или калия, циклогексиламин, этаноламин, диэтаноламин или триэтаноламин.
Используемые в качестве исходных соединений вещества частично известны из литературы, или их получают известными из литературы способами.
Как уже указано выше, новые конденсированные 5-членные гетероциклы общей формулы (1) и их аддитивные соли, в частности их физиологически переносимые соли с неорганическими или органическими кислотами или основаниями, обладают ценными свойствами. Так, напримеp, новые соединения общей формулы (1), в которых А означает незамещенную или замещенную у азота амино-, аминоалкил-, анидино-, гуанидино- или гуанидиноалкильную группу, или группу, в случае необходимости способную к переводу in vivo в незамещенную или замещенную у атома азота амино-, амидино- или гуанидиногруппу, например амино-, аминоалкил-, амидино-, гуанидино- или гуанидиноалкильную группу, замещенную у атома азота алкоксикарбонилом, алкенилоксикарбонилом, аралкоксикарбонилом, алкилкарбонилом, арилкарбонилом, арилоксикарбонилом, алканоилоксиметоксикарбонилом, циклоалканоилоксиметоксикарбонилом, аралканоилоксиметоксикарбонилом, арилоксиметоксикарбонилом, фосфоно-, диалкилфосфорил- или О-алкилфосфоногруппой, или В означает неалкилированную или алкилированную у азота циклическую иминогруппу и D-E-F- означают карбоксил, сульфо-, фосфоно-, О-алкил-фосфоно- или 5-тетразолилгруппы или группы, переводимые in vivo в карбоксильные, сульфо-, фосфоно-, О-алкилфосфоно- или тетразонильные группы, например карбонильные группы, замещенные алкокси-, аралкокси-, аралкенилокси-, циклоалкилалкокси-, гетероарилалкокси-, пирролидин-2-он-1-ил-алкокси-, морфолиноалкокси-, тиоморфолино-алкокси, 1-оксидо-тиоморфолиноалкокси-, циклоалкокси-, бензоциклоалкокси-, бициклоалкокси-, бициклоалкилалкокси-, алканоилоксиметокси-, циклоалкилалканоилокси-метокси-, алкоксикарбонилоксиметокси-,циклоалкилалканоил- оксиметокси-, алкоксикарбонилоксиметокси-, ароилоксиметокси-, аралканоилоксиметокси-, арилоксикарбонилоксиметокси- или аралкоксикарбонилоксиметоксигруппами, проявляют ценные фармакологические свойства, в частности наряду со сдерживающим воспаления и остеопороз действием, антитромботическое, антиагрегаторное и сдерживающее развитие опухолей и метастазов действие.
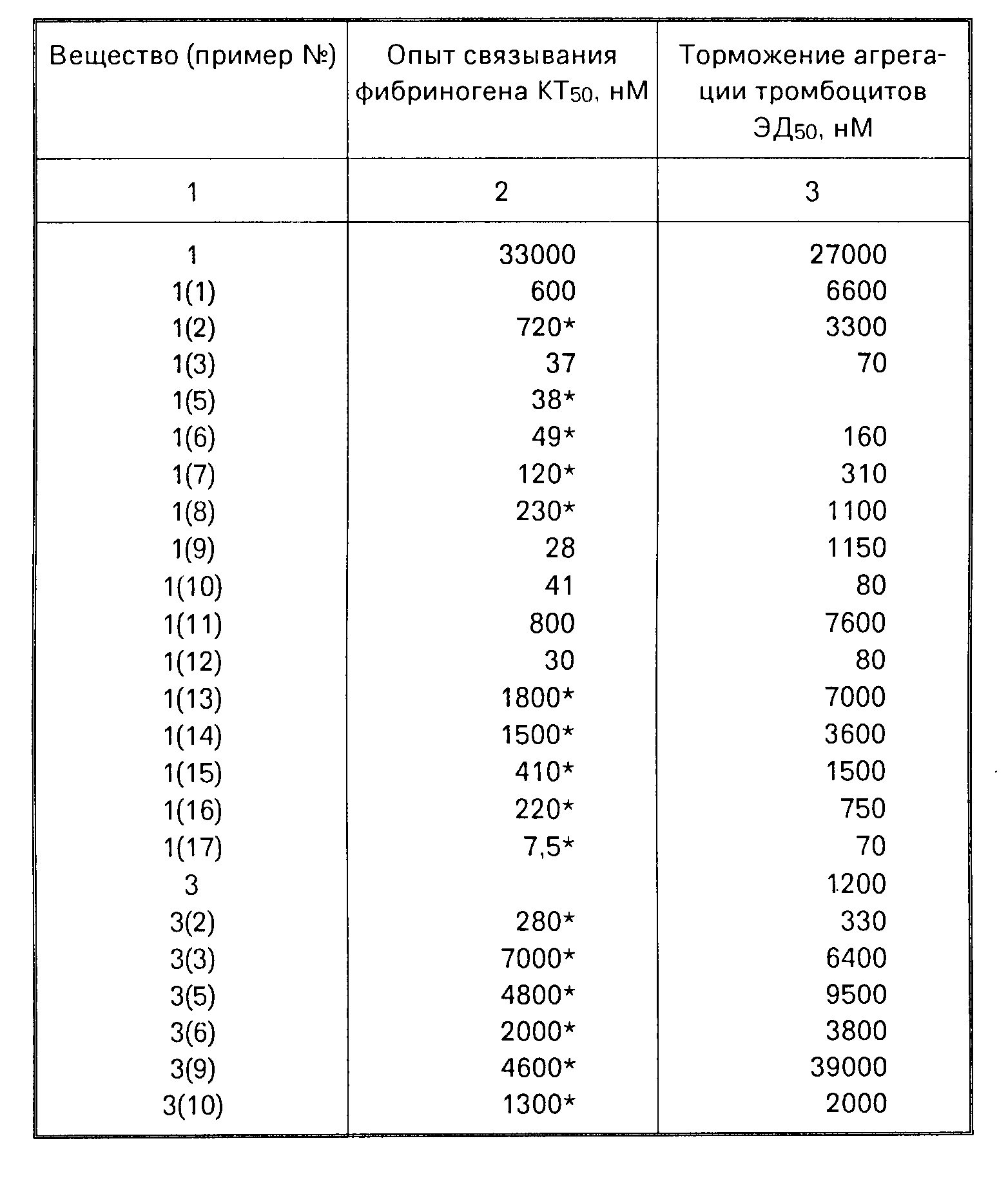
Соединения общей формулы (1), в которой А является цианогруппой, являются ценными промежуточными продуктами для получения соответствующих аминометил- и амидиносоединений общей формулы (1). Биологическое действие соединений общей формулы (1) исследовали, например, следующим образом.
1. Связывание фибриногена на тромбоцитах человека.
Извлекаемую путем прокола антекубитальной вены кровь для замедления свертывания обрабатывают тринатрийцитратом (конечная концентрация: 13 мМ) и подвергают центрифугированию при 170 г 10 мин. Богатую тромбоцитами плазму подают на колонну Сефароз 2Б (фирмы Фармасия, Швеция) и элюируют раствором из 90 мМ поваренной соли, 14 мМ тринатрийцитрата, 5 мМ глюкозы и 50 мМ трис-(оксиметил))-аминометана, доведенного до значения рН 7,4. Для опытов связывания используют прошедшие гель-фильтрацию тромбоциты, полученные перед белками плазмы.
К 750 мкл прошедших гель-фильтрацию тромбоцитов добавляют 50 мкл раствора 60 мМ хлорида кальция, 50 мкл раствора 0,6 мМ дифосфата аденозина, 100 мкл раствора вещества или растворителя и 50 мкл раствора фибриногена (содержащего 3 мкг 125-J-фибриногена). Инкубируют при комнатной температуре 20 мин. Неспецифическое связывание определяют в присутствии 3 мг на 1 мл холодного фибриногена.
900 мкл продукта инкубации с помощью пипетки осторожно подают на 250 мкл силиконового масла (смесь торговых продуктов AP 38 и AR 20 в объемном соотношении 1:2, фирма Вакер Хеми), размещенного в сосудах Эппендорфа, и центрифугируют при 10000 g в течение 2 мин. Водную фазу и часть масла отбирают шприцом, кончик шприца, содержащий тромбоциты, отрезают и с помощью гамма-счетчика определяют количество связанного фибриногена. На ряде проб с разными концентрациями вещества определяют ту концентрацию, при которой вещество задерживает связывание фибриногена на 50% (концентрацию торможения КТ50).
2. Антритромботическое действие
Методика
Агрегацию определяют по методу Борна и Кросса (J.Physiol. N 170 стр. 397, 1964 г) на богатой
тромбоцитами плазме здоровых людей. Для сдерживания свертывания к крови добавляют 3,14%-ный цитрат натрия в объемном соотношении 1:10.
Индуцированная коллагеном агрегация
Снижение оптической плотности суспензии тромбоцитов измеряют фотометрически и регистрируют после добавления вызывающего агрегацию вещества. Скорость агрегации определяют на основе угла наклона кривой
плотности. Точка кривой, показывающая наибольшую светопроницаемость, служит для рассчитывания оптической плотности.
Количество коллагена выбирают как можно более маленьким, но достаточным для получения необратимой кривой реакции. Используют имеющийся в торговле коллаген фирмы Хормонхеми, г. Мюнхен.
Перед добавлением коллагена плазму вместе с исследуемым соединением инкубируют при 37оС 10 мин. На основе полученных данных графически определяют эффективную дозу ЭД50, т.е. дозу, при которой достигается 50%-ное изменение оптической плотности в смысле торможения агрегации.
Результаты опыта приведены в таблице.
125-I-фибриноген был заменен 3Н-(3S,5S)-5-[(4'-амидино-4-бифенил)-оксиме-тил] -3-карбоксиметил- 2-пирролидонол. Соединения согласно изобретению обладают низкой токсичностью, так как при интравенозном введении 30 мг/кг трем мышам не погибло ни одно животное.
Благодаря тормозящему действию на взаимодействие между клетками или между клетками и матрицами новые конденсированные 5-членные азотосодержащие гетероциклы общей формулы (1) и их физиологические переносимые аддитивные соли пригодны для борьбы с болезнями и для профилактики болезней, при которых возникают агрегации клеток разного размера, или при которых некоторую роль играет взаимодействие между клетками и матрицами, например, для борьбы и профилактики венозных и артериальных тромбозов, церебрососудистых заболеваний легочной эмболии, инфаркта миокарда, атеросклероза, остеопороза и метастазирования опухолей. Кроме того, данные соединения пригодны для сопутствующего лечения при тромболизе при использовании фибринолитических лекарств или при вмешательстве в сосуды, например при чрезлюминарной ангиопластии, а также для лечения в случае состояния шока, псориаза, диабета и воспалений.
Для лечения и профилактики вышеуказанных болезней новые соединения применяют в дозах между 0,1 мкг и 30 мг/кг веса тела, предпочтительно 1 мкг 15 мг/кг веса тела, при 1-4 дозах в 1 сутки.
Для этого новые соединения общей формулы (1) можно переводить в известные препараты, например таблетки, драже, капсулы, порошки, суспензии, растворы, аэрозоли или суппозитории, в случае необходимости в сочетании с другими активными веществами, например антагонистами рецептора тромбоксана и ингибиторами синтеза тромбоксана или их комбинациями, антагонистами серотонина, антагонистами α-рецептора, с алкилнитратами, например глицеринтриацетатом, с ингибитором фосфодиэстеразы, простациклином и его аналогами, фибринолитином, например активатором тканевого плазминогена, проурокиназой, урокиназой, стрептокиназой, или антикоагулянтами, например, гепарином, дерматансульфатом, активированным протеином С, антагонистами витамина К, гирудином, ингибиторами тромбина или другими активированными факторами коагуляции, вместе с одним или несколькими известными инертными носителями и/или разбавителями, например, кукурузным крахмалом, лактозой, сахарозой, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, смесью воды и этанола, смесью воды с глицерином, смесью воды с сорбитом, смесью воды с полиэтиленгликолем, пропиленгликолем, стеариловым спиртом, карбоксиметилцеллюлозой, или содержащим жир веществами, например отвержденным жиром, или их пригодными смесями.
Нижеследующие примеры поясняют получение новых соединений общей формулы (1).
П р и м е р 1. 2-(4-амидино-фенил)-5-[(3-карбокси-пропил)-аминокарбонил] -1- метил-бензимидазол.
Смесь из 2,0 г 2-(4-амидино-фенил)-5-[(3-метокси-карбонилпропил)-аминокарбонил] -1- метил-бензимидазола, 20 мл метанола и 15,8 мл 1 N натриевой щелочи перемешивают 16 ч при комнатной температуре. Упаривают в вакууме, поглощают водой и нейтрализуют добавкой хлористого аммония. Выпавший осадок отфильтровывают.
Выход: 1,3 г (68% теории)
Т.пл. свыше 215оС.
значение Rf: 0,75 (силикагелевая пластина РП 18;
метанол/ 5%-ный водный раствор хлорида натрия6:4)
Аналогично получают следующие соединения:
(1) 2-(4-амидино-фенил)-5-(6)-[(2-карбокси-этил)-карбонил-амино]-бензимидазол
Т.пл. свыше 200оС
значение Rf: 0,63 (силикагелевая пластина РП 18; метанол/ 5%-ный водный раствор хлорида натрия6:4)
Рассчитано х3H2O: C 53,46 H 5,73
N 17,31
Найдено: 53,67 5,54 17,29
(2) Гидрохлорид 2-(4-амидино-фенил)-5(6)-[(2-карбоксиэтил)-аминокарбонил]-бензимидазола
Применяют гидроокись лития.
значение Rf: 0,26 (силикагель; метиленхлорид/метанол=7:3)
(3) 2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1- метил-бензимидазол
Т.пл. 247-249oC
значение Rf: 0,70 (силикагелевая пластина РП 18; метанол/ 5%-ный водный раствор хлорида натрия6:4)
(4) 2-(4-амидино-фенил)-6-[(2-карбокси-этил)-аминокарбонил]-3-метил-имидазо
[4,5-b] пиридин
значение Rf: 0,74 (силикагелевая пластина РП 18; метан/5%-ный раствор хлорида натрия6:4)
(5) гидрохлорид
2-(4-амидино-фенил)-1-бензил-5-[(2-карбокси-этил)-аминокарбо- нил] бензимидазола
значение Rf: 0,25 (силикагель; метиленхлорид/метанол=8:2)
(6)
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил] -1-(3- тиоморфолино-пропил)-бензимидазол
Применяют гидроокись лития в смеси тетрагидрофуран/вода.
значение Rf
: 0,06 (силикагель; метиленхлорид/метанол/конц. аммиак=2:1: 0,1 после двукратного проявления)
(7)
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1- [3-(S-оксидо-тиоморфолино)-пропил]-бензимидазол.
Применяют гидроокись лития в смеси тетрагидрофуран/вода.
значение Rf: 0,28 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 4:1:2, после трехразового проявления)
(8) 2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил] -1- [3-(S,
S-диоксидо-тиоморфолино)-пропил]-бензимидазол
Применяют гидроокись алюминия в смеси тетрагидрофуран/вода.
значение Rf: 0,14 (силикагель, изопропанол/вода/конц.
аммиак=7:2:1, после двукратного проявления)
(9) диацетат 2-(4-амидино-фенил)-1-(3-амино-пропил)-5-[(2-карбокси-этил) аминокарбонил]-бензимидазола
Применяют гидроокись лития в смеси
тетрагидрофуран/вода
Т.пл. выше 110оС (разл.)
значение Rf: 0,13 (силикагель; изопропанол/вода/конц. аммиак=7:2:1)
(10)
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1-метил -бензимидазол-3-оксид
Т.пл. 263-265оС (разл.)
значение Rf: 0,79 (силикагель пластина РП 18;
метанол/ 5%-ный раствор хлорида натрия6:4)
(11) 2-[(4-амидино-фенил)-оксиметил]-5(6)-карбоксиметокси- бензимидазол
значение Rf: 0,07 (силикагель; н-бутанол/ледяная
уксусная кислота/вода= 4:1:1, двукратное проявление)
Рассчитано: C 60,0 H 4,74 N 16,46
Найдено: 59,60 4,82 16,52
(12)
2-(4-амидино-фенил)-1-[2-(4-бензил-пиперазино)-этил]-5- [(2-карбокси-этил)-аминокарбонил]-бензимидазол
Применяют гидроокись лития в смеси тетрагидрофуран/вода
Т.пл. 82оС
(разл.)
значение Rf: 0,51 (силикагель; изопропанол/вода/конц. аммиак=7:2:1)
(13) 2-(4-аминометил-фенил)-5-[(2-карбокси-этил)-аминокарбонил]
-(3- тиоформофлино-пропил)-бензимидазол
Применяют гидроокись лития в смеси тетрагидрофуран/вода, значение Rf: 0,50 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида
натрия6: 10)
(14) 2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1- (3-карбокси-пропил)-бензимидазол
значение Rf: 0,10 (силикагель; метиленхлорид/метанол=8:2)
(15) 2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1- метил-6-метиламино-бензимидазол
Применяют гидроокись лития.
Т.пл. 265-266оС (разл.)
значение Rf: 0,35 (силикагель, н-бутанол/ледяная уксусная кислота/вода= 4:1:2).
(16)
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-6- (N-карбоксиметил-метиламино)-1-метил-бензимидазол
Применяют гидроокись лития.
значение Rf: 0,62
(силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия 6:4, после двукратного проявления)
(17) 8-(4-амидино-фенил)-1-(4-карбокси-бутил)-3,9-диметилксантин.
Т.пл. 263-265оС (разл.)
значение Rf: 0,48 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 4:1:1,5).
П р и м е р 2. Гидрохлорид 2-(4-амидино-фенил)-5-[(3-метоксикарбонил-пропил)-ами- нокарбонил] -1-метил-бензимидазола.
4,2 г метилового эфира 4-[4-(4-амидино-бензоил)-метиламино]-3-нитро-бензоил- амино] -масляной кислоты растворяют в 100 мл метанола, смешивают с 10 мл эфирного раствора соляной кислоты и 0,5 г 10%-ного палладия на угле и обрабатывают при комнатной температуре водородом при давлении 5 бар 22 ч.
Далее добавляют 0,3 г катализатора и оставляют на 1 ч. Катализатор отфильтровывают, фильтрат упаривают и остаток перемешивают со смесью из 100 мл уксусного эфира и 10 мл метанола в течение 1 ч при комнатной температуре, при этом выпадает вещество в кристаллической форме.
Выход: 3,7 (100% теории)
Т.пл. свыше 200оС
значение Rf
: 0,65 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
Аналогично получают следующие соединения:
(1)
2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-амино-карбонил] -1- метил-бензимидазол
значение Rf: 0,59 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида
натрия6:4)
(2) 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-метил-бензимидазол-3-оксид.
Получают аналогично выше описанному, но без добавки соляной кислоты.
значение Rf: 0,63 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
П р и м е р 3. Гидрохлорид
2-[(4-амидино-фенил)-оксиметил]-5-(6)- метоксикарбонилметокси-бензимидазола.
2,4 г 2-[(4-циан-фенил)-оксиметил]-5(6)-метоксикарбонилметокси-бензимидазола суспендируют в 300 мл метанола. Через смесь пропускают в течение 1 ч при 0-10оС газообразный хлористый водород и перемешивают 4 ч при 15-20оС. Метанол отгоняют в вакууме, остаток перемешивают с 75 мл метанола, который опять отгоняют в вакууме. Остаток суспендируют в 300 мл метанола, после чего порциями прибавляют 16,3 г карбоната аммония и перемешивают еще 16 ч. Смесью из 3 ч метанола и 1 ч концентрированной соляной кислоты доводят рН реакционной смеси до 4. Упаривают досуха и очищают остаток на силикагеле (элюент: метиленхлорид/метанол=3:1 до 0:1).
Выход: 0,9 г (32%
теории)
Т.пл. 250оС (разл.)
значение Rf: 0,64 (силикагель; метиленхлорид/метанол/ледяная уксусная кислота3:1:0,1)
Рассчитано: x H2O x HCl: C
52,87 H 5,18 N 13,70 Cl 8,67
Найдено: 53,07 5,02 13,81 8,80
Аналогично получают следующие соединения:
(1) 2-(4-амидино-фенил)-5(6)-[(2-метоксикарбонил-этил)-карбониламино]
бензимидазол
Т.пл. свыше 200оС
значение Rf: 0,11 (силикагель; эфир уксусной кислоты/этанол=7:3)
(2)
2-(4-амидино-фенил)-6-[(2-метоксикарбонил-этил)-аминокарбонил] -3- метил-имидазо [4,5-b]пиридин
значение Rf: 0,49 (силикагелевая пластин РП 18; метанол/ 5%-ный раствор хлорида
натрия6:4)
(3) гидрохлорид 2-(4-амидино-фенил)-1-бензил-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола
значение Rf: 0,22 (силикагель;
метиленхлорид/метанол=7:3)
(4) гидрохлорид 2-(4-амидино-фенил)-1-[(2-(3,4-диметоксифенил)-этил]-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензи-мидазола
значение Rf: 0,
20 (силикагель; эфир уксусной кислоты/этанол=7:3)
(5) 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-амидино-карбонил] -1-(3-пиридилметил)-бензимидазол
значение Rf: 0,60
(силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
(6) 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1- (3-тиоморфолино-пропил)-бензимидазол
значение Rf: 0,18 (силикагель; метиленхлорид/метанол/конц. аммиак=8:2: 0,1)
(7) 2-(4-амидино-фенил)-1-(3-амино-пропил)-5-[(2-метоксикарбонил-этил) -аминокарбонил]-бензимидазол
значение Rf: 0,29 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 4:1:1, после трехкратного проявления)
(8)
2-(4-амидино-фенил)-1-[2-(4-бензил-пиперазино)-этил]-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазол
значение Rf: 0,45 (силикагель; метиленхлорид/метанол=8:2)
(9)
2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-н-тетрадецил-бензимидазол
значение Rf: 0,04 (силикагель; эфир уксусной кислоты/этанол=8:2)
(10)
гидрохлорид 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбо-нил] -1-(3-метоксикарбонил-пропил)-бензимидазола
значение Rf: 0,45 (силикагель; метиленхлорид/метанол=8:2)
(11) 2-(4-амидино-фенил)-1-(3-карбокси-пропил)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазол.
Образуется в виде побочного продукта при (10)
Значение Rf: 0,19 (силикагель; метиленхлорид/метанол=8:2)
(12) 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-(4-фенил-бутил)-бензимидазол
Т.пл. 184-186о
С
значение Rf: 0,13 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
(13) гидрохлорид-гидроацетат
2-(4-амидино-фенил)-5-[(2- метоксикарбонил-этил)-аминокарбонил]-1-метил-6-метиламино- бензимидазола
Т.пл. 260-268оС (разл)
значение Rf: 0,24 (силикагель;
метиленхлорид/метанол/конц. аммиак8:2: 0,1)
(14) Гидрохлорид 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбо-нил]-6- (-метоксикарбонилметилметиламино)-1-метил-бензимидазола
значение Rf: 0,42 (силикагель; метиленхлорид/метанол/конц. аммиак=5:2: 0,2)
(15) 2-(4-амидино-фенил)-1-[(2-(4-амино-3,5-дибром-фенил)-этил]
5-[(2-метоксикарбонил-этил)-аминокарбонил]-бензимида-зол
Т.пл. 185оС (спекание при 165оС)
(16) 2-(4-амидино-фенил)-1-(3,
3-дифенил-пропил)-5-[(2-метоксикарбонил-этил) -аминокарбонил]-бензимидазол
Т.пл. свыше 200оС
значение Rf: 0,11 (силикагелевая пластина РП 18; метанол/ 5%-ный
раствор хлорида натрия=6:4)
(17) 2-(4-амидино-фенил)-6-(N-изобутилоксикарбонил-N-метиламино)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-1-метил-бензимидазол.
Т.пл.
104-106oC (разл.)
(18) Гидрохлорид-гидроацетат 8-(4-амидино-фенил)-3,9-диметил-1-(4-метоксикар-бонил-бутил)-ксантина.
Т.пл. 224-226оС (разл.)
значение Rf:0,58 (силикагель; н-бутанол/ледяная уксусная кислота/вода=4: 1:1,5)
(19) 2-(4-амидино-фенил)-5-[(3-метоксикарбонил-пиперидино)-карбонил] -1-метил-бензимидазол
значение Rf: 0,61 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия=6:4)
(20)
2-(4-амидино-фенил)-5-[(2-метоксикарбонил-пирролидино)-карбонил]-1- метил-бензимидазол
значение Rf: 0,26 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида
натрия=6:4)
П р и м е р 4. 2-(4-циан-фенил)-5-(6)-[(2-метоксикарбонил-этил)-карбониламино] бензимидазол.
К смеси из 1,5 г 5(6)-амино-2-(4-циан-фенил)-бензимидазола, 0,84 г N-этил-диизопропиламина, 20 мл метиленхлорида и 0,05 г 4-диметиламино-пиридина прикапывают 0,98 г хлорида метилового эфира янтарной кислоты. В течение 16 ч выдерживают при комнатной температуре и затем прибавляют слабо подкисленную воду, которая содержит незначительное количество метанола. Полученный кристаллизат поглощают смесью уксусного эфира, тетрагидрофурана и метанола, перемешивают с 0,1 N соляной кислотой, отгоняют в вакууме органический растворитель и полученный осадок отфильтровывают.
Выход: 1,4 г (63% теории)
Т.пл. 154-156оС.
П р и м е р 5. Гидрохлорид 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-амино- карбонил]-1- [3-(S-оксидо-тиоморфолино)-пропил]-бензимидазола.
2,2 г гидрохлорида 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-( 3-тиоморфолино-пропил)-бензимидазола растворяют в 45 мл ледяной уксусной кислоты и при охлаждении ледяной водой перемешивают с раствором 0,39 мл 30%-ной перекиси водорода в 5 мл ледяной уксусной кислоты. Перемешивают 4 ч при охлаждении льдом и 16 ч при комнатной температуре, отгоняют в вакууме растворитель и остаток очищают хроматографией (силикагель; метиленхлорид/метанол/вода=1:1:0 до 1:1:0,1).
Выход: 0,6 г (26% теории)
значение Rf: 0,46 (силикагель; метиленхлорид/метанол/конц. аммиак=1:1: 0,
1).
Аналогично получают следующие соединения:
(1) Гидрохлорид 2-(4-амидино-фенил)-1-[(3-(S,
S-диоксидотиоморфолино)-пропил]-5- (2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола. Получают с десятикратным количеством перекиси водорода нагреванием до 50оС 7 ч.
значение Rf: 0,26 (силикагель; бутанол/ледяная уксусная кислота/вода=4: 1:2 после двукратного проявления).
П р и м е р 6. 2-(4-аминометил-фенил)-1-(3-амино-пропил-5-[(2-метоксикарбонил-этил) -аминокарбонил]-бензимидазол.
3 г 1-(3-амино-пропил)-2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил) -аминокарбонил] -бензимидазола обрабатывают в смеси из 50 мл метанола и 10 мл метанольного раствора соляной кислоты водородом при давлении 5 бар в присутствии 1 г 10%-ного палладия на угле 20 ч при комнатной температуре. Отфильтровывают катализатор, упаривают в вакууме досуха и очищают остаток хроматографией на силикагеле (элюент: метанол/2 аммиак=5:1,5 до 5:2).
Выход: 1,5 г (55% теории)
значение Rf: 0,24 (силикагель; метанол/2 аммиак=5:1,5, после
двукратного проявления)
Аналогично получают следующие соединения:
(1) 2-(4-аминометил-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил]-1- (3-тиоморфолино-пропил)-бензимидазол
значение Rf: 0,40 (силикагель; метиленхлорид/метанол/конц. аммиак=8:2: 0,1).
(2) дигидрохлорид 2-(4-аминометил-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-метил-бензимидазола.
Т.пл. спекается при 185оС
значение Rf: 0,57 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия=6:4)
(3) дигидрохлорид
2-(4-аминометил-фенил)-1-[2(3,4-диметоксифенил)-этил] -5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола
значение Rf:0,03 (силикагель, эфир уксусной кислоты/этанол/кон.аммиак=8: 2:0,
02)
(4) дигидрохлорид 2-(4-аминометил-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-н-тетрадецил-бензимидазола
значение Rf: 0,03 (силикагель; эфир уксусной
кислоты/этанол/конц. аммиак 50:2:0,02)
П р и м е р 7. 2-(4-метоксикарбониламидино-фенил)-5-[(2-метоксикарбонил-этил) -аминокарбонил]-1-метил-бензимидазол
0,26 г гидрохлорида
2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1- метил-бензимидазола суспендируют в 50 мл метиленхлорида и смешивают при охлаждении льдом с 0,5 мл N-этил-диизопропиламина и 0,067 мл
метилового эфира хлорпмуравьиной кислотыф. Перемешивают при комнатной температуре, прибавляют спустя полчаса дополнительно 0,5 мл N-этил-диизопропиламина и 0,03 мл метилового эфира хлормуравьиной
кислоты и спустя еще полчаса еще 0,1 мл N-этилдиизопропила, а также 0,03 мл метилового эфира хлормуравьиной кислоты. Перемешивают еще полчаса, упаривают в вакууме и очищают на хроматографической
колонке (силикагель; элюент: эфир уксусной кислоты/этанол 100:2,5 до 100:12,5)
Выход: 0,12 г (40% теории)
значение Rf: 0,41 (силикагель; эфир уксусной кислоты/этанол=8:2).
Аналогично получают следующие соединения:
(1) 2-(4-циан-фенил)-6-(N-изобутилоксикарбонил-N-метиламино)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-1-метил-бензимидазол
значение Rf: 0,63 (силикагель; метиленхлорид/метанол/ледяная уксусная кислота25:1:0,1)
П р и м е р 8. Дигидрохлорид 2-(4-амидино-фенил)-1-[(3,
4-диметоксифенил)-этил]-5- [(2-изопропилоксикарбонил-этил)-амино-карбонил]-бензимидазола.
К 50 мл охлажденного льдом насыщенного изопропанольного раствора соляной кислоты прибавляют 0, 6 г гидрохлорида 2-(4-амидино-фенил)-1-[2-(3,4-диметокси-фенил)-этил] -5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола, покрывают петролейным эфиром и осторожно перемешивают до тех пор, пока большая часть твердого продукта не перейдет в раствор. Оставляют на 16 ч при комнатной температуре, отфильтровывают от имеющегося осадка, фильтрат упаривают в вакууме и остаток перемешивают с тетрагидрофураном.
Выход: 0,5 г (76% теории)
Т.пл. 210oC (спекается при 180оС)
Аналогично получают следующие соединения:
(1) Дигидрохлорид
2-(4-амидино-фенил)-5-[(2-циклогексилоксикарбонил-этил)-аминокарбонил] -1-(4-фенил-бутил)-бензимидазола
значение Rf: 0,69 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(2) Дигидрохлорид 2-(4-амидино-фенил)-5-[(2-циклогексил-метилоксикарбонил-этил) -аминокарбонил]-1-(4-фенил-бутил)-бензимидазола
значение Rf: 0,67 (силикагель; н-бутанол/ледяная уксусная
кислота/вода= 3:1:1)
(3) Дигидрохлорид 2-(4-амидино-фенил)-5-[(2-циклооктилоксикарбонил-этил) -аминокарбонил]-1-метил-бензимидазола.
значение Rf: 0,67 (силикагель;
н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(4) Дигидрохлорид 2-(4-амидино-фенил)-1-(4-фенил-бутил)-5- [(2-фенил-этил)-оксикарбонил]-аминокарбонил]-бензимидазола
значение Rf: 0,
78 (cиликагель; н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(5) Дигидрохлорид 2-(4-амидино-фенил)-1-[2-(4-амино-3,
5-дибром-фенил)-этил]-5- [(2-изопропилоксикарбонил-этил)-аминокарбонил]-бензимидазола
значение Rf: 0,18 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
(6)
Дигидроацетат 2-(4-амидино-фенил)-1-[(2-(2-бром-4,5-диметокси-фенил)-этил] -5- [[2-(2-норборнилоксикарбонил-этил)-аминокарбонил]-бензимидазола.
Нагревают дигидробромид
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1- [2-(3,4-диметокси-фенил)-этил]-бензимидазола с тионилхлоридом два часа и обрабатывают полученный хлорангидрид норборненовым маслом. Очистку
производят хроматографией на силикагеле (Элюент: н-бутанол/ледяная уксусная кислота/вода=3:1:1)
значение Rf: 0,72 (силикагиль; н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(7)
Дигидро-ацетат 2-(4-амидино-фенил)-1-[(2-бром-4,5-диметокси-фенил)-этил] -5- [[2-(2-инфанилоксикарбонил)-этил] -аминокарбонил]-бензимидазола.
Поступают, как описано в позиции (6)
значение Rf: 0,65 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 3:1:1).
П р и м е р 9. 2-[(4-циан-фенил)-оксиметил]-5(6)-этоксикарбонилметокси-бензимидазол
Расплавляют 4,5 г этилового эфира 3-амино-4-[(4-циан-фенил)-оксиметилкарбониламино]-фенокси-уксусной кислоты и выдерживают 15 мин при 200оС. Продукт очищают путем хроматографии на колонке, сначала на
силикагеле (элюент: метиленхлорид/метанол/конц. аммиак= 30: 1:0,1) и затем на нейтрально окиси алюминия (элюент: метиленхлорид/метанол=100:1) и кристаллизуют из смеси метиленхлорид/эфир=1:2.
Выход: 2,5 г (58% теории)
Т.пл. 111-112oC
значение Rf: 0,22 (силикагель; метиленхлорид/метанол/конц.аммиак=30:1: 0,1)
Аналогично получают следующие соединения:
(1) 1-[2-(4-бензил-пиперазино)-этил]-2-(4-циан-фенил)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазол
значение Rf: 0,58 (силикагель; метиленхлорид/метанол/конц. аммиак=19:1: 0,
1, после трехкратного проявления)
(2) Гидрохлорид 1-(3-амино-пропил)-2-(4-циан-фенил)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола. Гидроацетат-гидрохлорид
N-(2-метоксикарбонил-этил)-амида 3-амино-4-(3-амино-пропиламино)-бензойной кислоты ацилируют сначала обработкой 4-циан-бензоилхлоридом в хлорбензоле при температуре бани 140оС и при этом одновременно
отгоняют хлорбензол. Остаток нагревают 10 мин при 190оС.
Т.пл. 252оС (разл. спек. при 115оС)
значение Rf: 0,54 (силикагель; метиленхлорид/метанол/конц. аммиак=9:1: 0,2, после
двукратного проявления)
(3) 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1- метил-6-метиламино-бензимидазол.
Нагревают 35 мин.
Т.пл.
203-205оС
значение Rf: 0,68 (силикагель; метиленхлорид/метанол/конц. аммиак=30:1: 0,1, после трехкратного проявления)
(4) 8-(4-циан-фенил)-3,9-диметил-ксантин
Ацилируют
5-амино-3-метил-4-метиламино-пиримидин-2,6-дион 4-циан- бензоил-хлоридом в присутствии 4-диметиламино-пиридина в тетрагидрофуране и остаток после упаривания нагревают 45 мин при 200-205оС
значение Rf: 0,79 (силикагель; метиленхлорид/метанол/ледяная уксусная кислота=9:1:0,1, после двукратного проявления)
П р и м е р 10. Гидроацетат
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбонил]-1- (2-пиперазино-этил)-бензимидазола
0,30 г
2-(4-амидино-фенил)-1-[2-(4-бензил-пиперазино)-этил]5- [(2-карбоксиэтил)-аминокарбонил]-бензимидазола растворяют в 100 мл ледяной уксусной кислоты и обрабатывают водородом при давлении 5 бар в
присутствии 1,8 г окиси палладия в течение 36 ч при комнатной температуре. После отфильтровывания катализатора упаривают в вакууме и остаток извлекают сначала ацетоном и затем эфиром.
Выход: 0,27 г (92% теории)
Т.пл. 80оС (разл)
значение Rf: 0,14 (силикагель; изопропанол/вод/конц. аммиак=7:2:1, после двукратного проявления)
Аналогично получают следующее
соединение:
(1) Гидрохлорид 2-(4-амидино-фенил)-5(6)-[(2-метоксикарбонил-этил)-аминокарбонил] -бензимидазола.
Работают в метаноле с 10%-ным палладием на угле.
значение Rf: 0,65 (силикагель; метиленхлорид/метанол=3:1).
2,2 г гидрохлорида 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-амино- карбонил]-1-( 3-тиоморфолино-пропил)-бензимидазола растворяют в 45 мл ледяной уксусной кислоты и при охлаждении ледяной водой перемешивают с раствором 0,39 мл 30%-ной перекиси водорода в 5 мл ледяной уксусной кислоты. Перемешивают 4 ч при охлаждении льдом и 16 ч при комнатной температуре, отгоняют в вакууме растворитель и остаток очищают хроматографией (силикагель; метиленхлорид/метанол/вода=1:1:0 до 1:1:0, 1).
Выход: 0,6 г (26% теории)
значение Rf: 0,46 (силикагель; метиленхлорид/метанол/конц. аммиак=1:1: 0,1).
Аналогично получают следующие
соединения:
(1) Гидрохлорид 2-(4-амидино-фенил)-1-[(3-(S,S-диоксидотиоморфолино)-пропил]-5- (2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола. Получают с десятикратным количеством
перекиси водорода нагреванием до 50оС 7 ч.
значение Rf: 0,26 (силикагель; бутанол/ледяная уксусная кислота/вода=4: 1:2 после двукратного проявления).
П р и м е р 6. 2-(4-аминометил-фенил)-1-(3-амино-пропил-5-[(2-метоксикарбонил- этил) -аминокарбонил]-бензимидазол.
3 г 1-(3-амино-пропил)-2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил) -аминокарбонил] -бензимидазола обрабатывают в смеси из 50 мл метанола и 10 мл метанольного раствора соляной кислоты водородом при давлении 5 бар в присутствии 1 г 10%-ного палладия на угле 20 ч при комнатной температуре. Отфильтровывают катализатор, упаривают в вакууме досуха и очищают остаток хроматографией на силикагеле (элюент: метанол/2 аммиак=5:1,5 до 5:2).
Выход: 1,5 г (55% теории)
значение Rf: 0,24 (силикагель; метанол/2 аммиак=5:1,5, после двукратного проявления)
Аналогично получают следующие соединения:
(1) 2-(4-аминометил-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил]-1- (3-тиоморфолино-пропил)-бензимидазол
значение Rf: 0,40
(силикагель; метиленхлорид/метанол/конц. аммиак=8:2: 0,1).
(2) дигидрохлорид 2-(4-аминометил-фенил)-5-[(2-метоксикарбонил-этил)-амино- карбонил] -1-метил-бензимидазола.
Т.пл. спекается при 185оС
значение Rf: 0,57 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия=6:4)
(3) дигидрохлорид
2-(4-аминометил-фенил)-1-[2(3,4-диметоксифенил)-этил] -5- [(2-метоксикарбонил-этил)-аминокарбонил] бензимидазола
значение Rf:0,03 (силикагель, эфир уксусной
кислоты/этанол/кон.аммиак=8: 2:0,02)
(4) дигидрохлорид 2-(4-аминометил-фенил)-5-[(2-метоксикарбонил-этил)-амино- карбонил] -1-н-тетрадецил-бензимидазола
значение Rf: 0,03
(силикагель; эфир уксусной кислоты/этанол/конц. аммиак 50:2:0,02)
П р и м е р 7. 2-(4-метоксикарбониламидино-фенил)-5-[(2-метоксикарбонил-этил) -аминокарбонил]-1-метил-бензимидазол
0,
26 г гидрохлорида 2-(4-амидино-фенил)-5-[(2-метоксикарбонил-этил)-амино- карбонил] -1- метил-бензимидазола суспендируют в 50 мл метиленхлорида и смешивают при охлаждении льдом с 0,5 мл
N-этил-диизопропиламина и 0,067 мл метилового эфира хлормуравьиной кислоты. Перемешивают при комнатной температуре, прибавляют спустя полчаса дополнительно 0,5 мл N-этил-диизопропиламина и 0,03 мл
метилового эфира хлормуравьиной кислоты и спустя еще полчаса еще 0,1 мл N-этилдиизопропила, а также 0,03 мл метилового эфира хлормуравьиной кислоты. Перемешивают еще полчаса, упаривают в вакууме и
очищают на хроматографической колонке (силикагель; элюент: эфир уксусной кислоты/этанол 100:2,5 до 100:12,5)
Выход: 0,12 г (40% теории)
значение Rf: 0,41 (силикагель; эфир
уксусной кислоты/этанол=8:2).
Аналогично получают следующие соединения:
(1)
2-(4-циан-фенил)-6-(N-изобутилоксикарбонил-N-метиламино)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-1-метил-бен- зимидазол
значение Rf: 0,63 (силикагель;
метиленхлорид/метанол/ледяная уксусная кислота=25:1:0,1)
П р и м е р 8. Дигидрохлорид 2-(4-амидино-фенил)-1-[2-(3,4-диметоксифенил)-этил]
-5- [(2-изопропилоксикарбонил-этил)-амино- карбонил]-бензимидазола.
К 50 мл охлажденного льдом насыщенного изопропанольного раствора соляной кислоты прибавляют 0,6 г гидрохлорида 2-(4-амидино-фенил)-1-[2-(3,4-диметокси-фе- нил)-этил]-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола, покрывают петролейным эфиром и осторожно перемешивают до тех пор, пока большая часть твердого продукта не перейдет в раствор. Оставляют на 16 ч при комнатной температуре, отфильтровывают от имеющегося осадка, фильтрат упаривают в вакууме и остаток перемешивают с тетрагидрофураном.
Выход: 0,5 г (76% теории)
Т.пл. 210oC (спекается при 180оС)
Аналогично получают следующие соединения:
(1) Дигидрохлорид
2-(4-амидино-фенил)-5-[(2-циклогексилоксикарбонил-этил)-ами-нокарбонил] -1-(4-фенил-бутил)-бензимидазола
значение Rf: 0,69 (силикагель; н-бутанол/ледяная уксусная кислота/вода=
3:1:1)
(2) Дигидрохлорид 2-(4-амидино-фенил)-5-[(2-циклогексил-метилоксикарбонил-этил) аминокарбонил]-1-(4-фенил-бутил)-бензи-мидазола
значение Rf: 0,67 (силикагель;
н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(3) Дигидрохлорид 2-(4-амидино-фенил)-5-[(2-циклооктилоксикарбонил-этил) -аминокарбонил]-1-метил-бензимидазола.
значение Rf: 0,67 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(4) Дигидрохлорид
2-(4-амидино-фенил)-1-(4-фенил-бутил)-5- [(2-фенил-этил)-оксикарбонил]-аминокарбонил]-бензимидазола
значение Rf: 0,78 (cиликагель; н-бутанол/ледяная уксусная кислота/вода=
3:1:1)
(5) Дигидрохлорид 2-(4-амидино-фенил)-1-[2-(4-амино-3,5-дибром-фенил)-этил]-5- [(2-изопропилоксикарбонил-этил)-аминокар-бонил]-бензимидазола
значение Rf: 0,18
(силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
(6) Дигидроацетат 2-(4-амидино-фенил)-1-[(2-(2-бром-4,
5-диметокси-фенил)-этил]-5- [[2-(2-норборнилоксикарбонил-этил)-амино- карбонил]-бензимидазола.
Нагревают дигидробромид 2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокар- бонил]
-1- [2-(3,4-диметокси-фенил)-этил]-бензимидазола с тионилхлоридом два часа и обрабатывают полученный хлорангидрид норборненовым маслом. Очистку производят хроматографией на силикагеле (Элюент:
н-бутанол/ледяная уксусная кислота/вода=3:1:1)
значение Rf: 0,72 (силикагиль; н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(7) Дигидро-ацетат
2-(4-амидино-фенил)-1-[(2-бром-4,5-диметокси-фенил)-этил] -5- [[2-(2-инфанилоксикарбонил)-этил] -аминокарбонил]-бензимидазола.
Поступают, как описано в позиции (6)
значение
Rf: 0,65 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 3:1:1).
П р и м е р 9. 2-[(4-циан-фенил)-оксиметил]-5(6)-этоксикарбонилметокси-бензи- мидазол
Расплавляют 4,5 г этилового эфира 3-амино-4-[(4-циан-фенил)-оксиметилкарбо-ниламино] -фенокси-уксусной кислоты и выдерживают 15 мин при 200оС. Продукт очищают путем хроматографии на колонке,
сначала на силикагеле (элюент: метиленхлорид/метанол/конц. аммиак= 30: 1:0,1) и затем на нейтрально окиси алюминия (элюент: метиленхлорид/метанол=100:1) и кристаллизуют из смеси
метиленхлорид/эфир=1:2.
Выход: 2,5 г (58% теории)
Т.пл. 111-112oC
значение Rf: 0,22 (силикагель; метиленхлорид/метанол/конц.аммиак=30:1: 0,
1)
Аналогично получают следующие соединения:
(1) 1-[2-(4-бензил-пиперазино)-этил]-2-(4-циан-фенил)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазол
значение Rf: 0,58 (силикагель; метиленхлорид/метанол/конц. аммиак=19:1: 0,1, после трехкратного проявления)
(2) Гидрохлорид
1-(3-амино-пропил)-2-(4-циан-фенил)-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазола. Гидроацетат-гидрохлорид N-(2-метоксикарбонил-этил)-амида 3-амино-4-(3-амино-пропиламино)-бензойной
кислоты ацилируют сначала обработкой 4-циан-бензоилхлоридом в хлорбензоле при температуре бани 140оС и при этом одновременно отгоняют хлорбензол. Остаток нагревают 10 мин при 190о
С.
Т.пл. 252оС (разл. спек. при 115оС)
значение Rf: 0,54 (силикагель; метиленхлорид/метанол/конц. аммиак=9:1: 0,2, после двукратного
проявления)
(3) 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1- метил-6-метиламино-бензимидазол.
Нагревают 35 мин.
Т.пл. 203-205о
С
значение Rf: 0,68 (силикагель; метиленхлорид/метанол/конц. аммиак=30:1: 0,1, после трехкратного проявления)
(4) 8-(4-циан-фенил)-3,9-диметил-ксантин
Ацилируют
5-амино-3-метил-4-метиламино-пиримидин-2,6-дион 4-циан- бензоил-хлоридом в присутствии 4-диметиламино- пиридина в тетрагидрофуране и остаток после упаривания нагревают 45 мин при 200-205о
С
значение Rf: 0,79 (силикагель; метиленхлорид/метанол/ледяная уксусная кислота=9:1:0,1, после двукратного проявления)
П р и м е р 10. Гидроацетат
2-(4-амидино-фенил)-5-[(2-карбокси-этил)-аминокарбо- нил]-1- (2-пиперазино-этил)-бензимидазола
0,30 г
2-(4-амидино-фенил)-1-[2-(4-бензил-пиперазино)-этил]5- [(2-карбоксиэтил)-аминокарбонил]-бензимидазола растворяют в 100 мл ледяной уксусной кислоты и обрабатывают водородом при давлении 5 бар в
присутствии 1,8 г окиси палладия в течение 36 ч при комнатной температуре. После отфильтровывания катализатора упаривают в вакууме и остаток извлекают сначала ацетоном и затем эфиром.
Выход: 0,27 г (92% теории)
Т.пл. 80оС (разл.)
значение Rf: 0,14 (силикагель; изопропанол/вод/конц. аммиак=7:2:1, после двукратного проявления)
Аналогично получают следующее соединение:
(1) Гидрохлорид 2-(4-амидино-фенил)-5(6)-[(2-метоксикарбонил-этил)-аминокарбо- нил] -бензимидазола.
Работают в метаноле с 10%-ным палладием на угле.
значение Rf: 0,65 (силикагель; метиленхлорид/метанол=3:1).
П р и м е р 11. 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил]
-1-(3-тиоморфолино-пропил)-бензимидазол
48,6 г гидрохлорида N-(2-метоксикарбонил-этил)-амида 3-амино-4-(3-тиоморфолино-пропиламино)-бензойной кислоты растворяют при нагревании в 500 мл
ледяной уксусной кислоты, смешивают с 19,5 г 4-циан-бензоил-хлорида, нагревают 1 ч на паровой бане и затем 2 ч при температуре бани 120оС. Упаривают в вакууме и очищают остаток
хроматографией на силикагеле (элюент: метиленхлорид/метанол/конц. аммиак9:1:0 до 8:2:0,2)
Выход: 33,7 г (58% теории)
значение Rf: 0,84 (силикагель;
метиленхлорид/метанол/конц. аммиак=19:1: 0,1, после трехкратного проявления)
Аналогично получают следующие соединения:
(1) 2-(4-циан-фенил)-1-[2-(3,
4-диметокси-фенил)-этил]-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазол.
Ацилирование 4-циан-бензоилхлоридом проводят сначала в метиленхлориде с добавкой
N-этил-диизопропиламина. После отгонки растворителя помещают в ледяную уксусную кислоту и нагревают 1,5 ч при 100оС
значение Rf: 0,36 (силикагель; эфир уксусной
кислоты/этанол/конц. аммиак=50:2:0,1)
(2) 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-(3-пиридилметил)-бензимидазол.
Поступают, как описано в позиции (1), нагревают 3 ч в ледяной уксусной кислоте.
значение Rf: 0,40 (силикагель; эфир уксусной кислоты/этанол=8:2)
(3)
2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-амино-карбонил] -1-н-тетрадецил-бензимидазол.
Поступают, как описано в позиции (1)
значение Rf: 0,60 (силикагель; эфир
уксусной кислоты/этанол/конц. аммиак=50:2:0,02)
(4) 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил]-1- (3-метоксикарбонил-пропил)-бензимидазол. Поступают, как описано в позиции
(1) с триэтиламином в качестве вспомогательного основания. Растворителем служит смесь тетрагидрофуран/метиленхлорид3:1
Значение Rf: 0,68 (силикагель;
метиленхлорид/метанол=37:3).
(5) 1-бензил-2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -бензимидазол.
Поступают, как описано в позиции (4).
Значение Rf: 0,77 (силикагель; метиленхлорид/метанол=9:1)
(6) 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил]-1- (4-фенил-бутил)-бензимидазол.
Поступает, как в позиции (1).
Значение Rf: 0,61 (силикагель; эфир уксусной кислоты/этанол=50:2).
(7) 1-[2-(4-амино-3, 5-дибром-фенил)-этил]-2-(4-циан-фенил-5- [(2-метоксикарбонил-этил)-аминокарбонил]-бензимидазол.
Поступают, как в позиции (1).
Т.пл. 168-170оС
значение Rf: 0,66 (силикагель; эфир уксусной кислоты/этанол=8:2).
(8) 2-(4-циан-фенил)-1-(3,3-дифенил-пропил)-5- [(2-метокси-карбонил-этил)-аминокарбонил]-бензимидазол
Т.пл. 157-159оС
значение Rf: 0,65 (силикагель; эфир уксусной кислоты/этанол=9:1).
(9) 2-(4-циан-фенил)-5-[(2-метоксикарбонил-пирролидино)-карбонил] -1-метил-бензимидазол.
Поступают, как в позиции (1).
Т.пл. 174-176оС,
значение Rf: 0,36 (силикагель; эфир уксусной кислоты/этанол=9:1).
(10) 2-(4-циан-фенил)-5-[(3-метоксикарбонил-пиперидино)-карбонил] -1-метил-бензимидазол.
Поступают, как
в позиции (1)
Т.пл. 185-186оС
значение Rf: 0,43 (силикагель; эфир уксусной кислоты/этанол=9:1)
(11)
2-(4-циан-фенил)-6-[(2-метоксикарбонил-этил)-аминокарбонил] -3-метил-имидазол [4,5-b]пиридин.
Поступают, как в позиции (1).
Т.пл. 195-197оС,
значение Rf: 0,51 (силикагель; эфир уксусной кислоты/этанол=9:1)
П р и м е р 12. Ацетат 2-(4-аминометил-фенил)-1-(3-аминопропил)-5-[(2-карбокси- этил)
-аминокарбонил]-бензимидазола
0,8 г 2-(4-аминометил-фенил)-1-(3-амино-пропил)-5- [(2-метоксикарбонил-этил)-аминокарбонил] -бензимидазола выдерживают 20 ч при комнатной температуре в 10 мл
48%-ной бромистоводородной кислоты. Сгущают в вакууме и остаток очищают хроматографией на силикагеле (элюент: н-бутанол/ледяная уксусная кислота/вода=4:1:1 до 4:2:2).
Выход: 0,6 г
(67% теории)
значение Rf: 0,66 (силикагелевая пластина РП 18; метанол/5%-ный раствор хлорида натрия/конц. бромистоводородная кислота=6:10:0,01).
Аналогично
получают следующие соединения:
(1) Дигидробромид 2-(4-аминометил-фенил)-5- [(2-карбоксиэтил)-аминокарбонил]-1-метил-бензимидазола.
Т.пл. спекается при 220оС.
значение Rf: 0,87 г (силикагелевая пластина РП 18; метанол/5%-ный раствор хлорида натрия=6:4)
(2) Дигидробромид
2-(4-амидино-фенил)-5- [(2-карбоксиэтил)-аминокарбонил]-1-[2-(3,4-диметокси-фенил)-этил] -бензилимидазола
значение Rf: 0,72 (силикагелевая пластина РП 18; метанол/5%-ный раствор
хлорида натрия6:4)
(3) Дигидробромид 2-(4-амидино-фенил)-5-[(2-карбоксиэтил)-аминокарбонил] -1-(3-пиридилметил)-бензимидазола
значение Rf: 0,73 (силикагелевая пластина РП
18; метанол/ 5%-ный раствор хлорида натрия6:4)
(4) Дигидробромид 2-(4-аминометил-фенил)-5-[(2-карбоксиэтил)-аминокарбонил] -1-н-тетрадецил-бензимидазола
значение Rf: 0,05
(силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
(5) Дигидробромид 2-(4-аминометил-фенил)-5- [(2-карбоксиэтил)-аминокарбонил]-1-[2-(3,4-диметокси-фенил)-этил]
бензимидазола
значение Rf: 0,67 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия=6:4)
(6) Дигидробромид
2-(4-амидино-фенил)-5- [(2-карбоксиэтил)-аминокарбонил]-1-н-тетрадецил-бензимидазола
значение Rf: 0,01 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия6:4)
(7) Дигидробромид 2-(4-амидино-фенил)-5- [(2-карбоксиэтил)-аминокарбонил]-1-(4-фенил-бутил)-бензимидазол
значение Rf: 0,08 (силикагелевая пластина РП 18; метанол/ 5%-ный
раствор хлорида натрия6:4)
(8) Дигидробромид 2-(4-амидино-фенил)-1- [2-(4-амино-3,5-дибром-фенил)-этил]-5-(2-карбокси-этил)-аминокарбонил] -бензимидазола
Т.пл. свыше 225о
C
значение Rf: 0,57 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия=6:4)
(9) Дигидробромид 2-(4-амидино-фенил)-5-[(2-карбоксиэтил)-аминокарбонил]
-1-(3,3-дифенил-пропил)-бензимидазола
значение Rf: 0,71 (силикагель; н-бутанол/ледяная уксусная кислота/вода= 3:1:1)
(10) Дигидробромид
2-(4-амидино-фенил)-5- [(3-карбокси-пиперидино)-карбонил]-1-метил-бензимидазола,
значение Rf: 0,49 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор хлорида натрия=6:4)
(11) Дигидробромид 2-(4-амидино-фенил)-5-[(2-карбокси-пирролидино)-карбо- нил]-1-метил- бензимидазола
значение Rf: 0,46 (силикагелевая пластина РП 18; метанол/ 5%-ный раствор
хлорида натрия=6:4)
(12) Дигидробромид 2-(4-амидино-фенил)-6- [(2-карбоксиэтил)-аминокарбонил]-3-метил-имидазо[4,5-b]пиридина
значение Rf: 0,74 (силикагелевая пластина РП
18; метанол/ 5%-ный раствор хлорида натрия6:4)
П р и м е р 13. 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-метилен-бензимидазол
4,7 г
[N-(2-метоксикарбонил-этил)-амид]-3-амино-4-метиламино-бензойной кислоты перемешивают сначала при комнатной температуре с 40 мл хлорокиси фосфора, затем обрабатывают 3,1 г 4-циан-бензоилхлорида и
нагревают 8 ч при 90оС. Отгоняют в вакууме хлорокиси фосфора, остаток смешивают при 30оС с 500 мл воды и нейтрализуют добавкой порциями бикарбоната натрия. Отфильтровывают осадок
и экстрагируют эфиром уксусной кислоты. Уксусно-эфирные фазы упаривают, остаток объединяют с осадком и очищают хроматографией на силикагеле (элюент: эфир уксусной кислоты/этанол=100:1 до 100:5).
Полученный продукт кипятят для окончательной очистки с эфиром уксусной кислоты.
Выход: 1,86 г (27% теории)
значение Rf: 0,51 (силикагель; эфир уксусной
кислоты/этанол= 9:1).
П р и м е р 14. 2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил]-6- (N-метоксикарбонилметил-N-метил-амино]-1-метилбензимидазол
5,0 г
2-(4-циан-фенил)-5-[(2-метоксикарбонил-этил)-аминокарбонил] -1-метил-6-метиламино-бензимидазола растворяют при нагревании в 20 мл диметилформамида и прибавляют 2,3 мл N-этил-диизопропиламина.
Прикапывают 1,2 мл метилового эфира бромуксусной кислоты и нагревают 5 ч на паровой бане. Смешивают дополнительно с 1,2 мл N-этил-диизопропиламина и 0,6 мл метилового эфира бромуксусной кислоты и
нагревают еще раз 3 ч. В вакууме отгоняют растворитель, перемешивают 2 ч с 50 мл воды при комнатной температуре, отфильтровывают и растирают высушенный остаток с эфиром уксусной кислоты.
Выход: 3,2 г (54% теории)
Т.пл. 174-176оС
значение Rf: 0,34 (силикагель; метиленхлорид-метанол= 19:1, после трехкратного проявления)
Аналогично получают следующее соединение:
(1) 8-(4-циан-фенил)-3,9-диметил-1-(4-этоксикарбонил-бутил)-ксантин
Растворителем является диметилсульфоксид, основанием карбонат калия,
причем нагревают 4 ч при 80оС.
Т.пл. 148-150оС.
значение Rf: 0,33 (силикагель, эфир уксусной кислоты).
Реферат
Использование: в качестве препаратов, проявляющих активность по торможению агрегации. Сущность изобретения: конденсированные 5-членные гетероциклы ф лы (1) с определенными буквенными значениями, проявляющие активность по торможению агрегации. 1 табл.

Формула
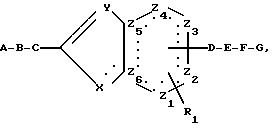
где R1 водород, фтор, хлор или бром, алкил-, аралкил-, арил-, гетероарил-, R3O-, (R3)2N-, R4CO NR3, -алкилсульфонил-NR3-арилсульфонил-NR3-, R3S-,
R3S2O или R5 группа, где R3 водород, C1 - C6-алкильная группа, арильная, гетероарильная, аралкильная, карбоксиалкильная или алкоксикарбонилалкильная группа, R4 водород, C1 C6-алкильная или C1 C6-алкоксильная группы, арильная, гетероарильная или аралкильная группы, содержащие от 1 до 6 атомов углерода в алкильной части, R5 ацетидиновая, пирролидиновая, гексаметиленимино- или гептаметилениминогруппа или пиперидиновая группа, в которой метиленовая группа в 4-м положении может быть замещена кислородом, сульфенил-, сульфинил- или сульфонилгруппой или иминогруппой, которая может быть замещена R3, R4CO-, алкилсульфонил- или арилсульфонилгруппой, причем R3 и R4 имеют указанные значения;
X сера или азот или группа NR2, где R2 водород, линейная или разветвленная C1 C15-алкильная группа, линейные или разветвленные C3 C10-алкенильная и C3 - C10-алкинильная группы, причем двойная и тройная связь могут не быть присоединены непосредственно к атому азота, циклоалкильную или циклоалкилалкильную группы, содержащие 3 7 атомов углерода в циклоалкильной части, арильную или гетероарильную группы, C2 C6-алкильную группу, которая, начиная с β -положения к атому азота - NR2-группы, замещена R3O-, (R3)2N-, R4CO NR3-, алкилсульфонил-NR3-, арилсульфонил -NR3, алкилсульфенил-, алкилсульфинил, алкилсульфонил- или R5-группами, или C1 C6-алкильную группу, которая замещена одной или двумя арильными группами, гетероарильной группой, группами R6OCO-, (R3)2NCO-, R5CO-, R3 O CO-алкилен-NR3CO-, (R3)2N CO-алкилен-NR3 CO или R5CO-алкилен-NR3 CO; где R3 и R5 имеют указанные значения, R6 водород, C1 C6-алкильная группа, циклоалкильная группа, содержащая 5 7 атомов углерода, или аралкильная группа;
Y O-группа, азот или незамещенная или замещенная алкильной группой метиновая группа;
Z1, Z2, Z3 и Z4, одинаковые или различные, - метиновые группы, углерод, иминогруппы или азот, причем по меньшей мере один из остатков Z1 Z4 должен содержать углерод и одна или две соседние с атомом азота метиновые группы могут быть замещены карбонильными группами;
Z5 и Z6 углерод или один из остатков Z5 или Z6 азот, а другой углерод;
A циано-, аминогруппа, линейная или разветвленная аминоалкильная группа, содержащая 1 4 атомов углерода, амидино-, гуанидино- или гуанидиноалкильная группа, причем в амино-, аминоалкил-, амидино-, гуанидино- и гуанидиноалкильных группах у одного из атомов азота один или два атома водорода могут быть замещены одной или двумя C1 C4-алкильными группами, или один атом водорода может быть замещен алкоксикарбонильной группой с общим количеством атомов углерода 2 5, алкенилоксикарбонильной группой с общим числом атомов углерода 4 6, алкилакарбонильной группой с общим числом углеродных атомов 2 5, арилкарбонил-, арилоксикарбонил-, аралкоксикарбонил-, алканоилоксиметоксикарбонил-, циклоалканоилоксиметоксикарбонил-, аралканоилоксиметоксикарбонил-, ароилоксиметоксикарбонил-, фосфоно-, диалкилфосфорил- или O-алкилфосфоногруппами, в которых алканоильные части содержат 2 7 атомов углерода и циклоалканоильные части содержат 4 8 атомов углерода, а метоксильные части могут быть замещены циклоалкильной группой, содержащей 3 - 6 атомов углерода, аралкильной, арильной или алкильной группой или двумя алкильными группами, которые вместе с метиленовым атомом углерода также могут образовывать пяти- или шестичленное кольцо, или, если B циклический амин, содержащий 4 7 членов, также означает водород или алкильную группу, которые связаны с атомом азота иминогруппы,
B означает фениленовую группу, которая может быть один или два раза замещена атомами фтора, хлора или брома, алкильной группой, гидрокси-, алкоксигруппой, алкилсульфенильной, алкилсульфинильной, алкилсульфонильной группами, нитро-, амино-, алкиламино-, диалкиламино-, алкилкарбониламино-, алкилсульфониламино- или трифторметильной группой, причем заместители могут быть одинаковыми или различными и одновременно одна или две метиновые группы в упомянутых фениленовых группах могут быть замещены соответственно одним или двумя атомами азота, или циклоалкиленовую группу, содержащую 3 7 атомов углерода, причем в четырех- или пятичленном циклоалкиленовом кольце один член кольца означает атом азота, и в шести- или семичленном циклоалкиленовом кольце один или два члена кольца означают атом азота, и одновременно может происходить связывание с атомами углерода соседних остатков через имеющиеся атомы азота, инданиленовую группу или 1,2,3,4-тетрагидронафтиленовую группу, в которых насыщенное кольцо связано с остатком A, а ароматическое кольцо связано с остатком C или с конденсированным пятичленным гетероциклом;
C означает связь, алкиленовую, ариленовую, O-алкиленовую, S-алкиленовую, NH-алкиленовую, N-(алкил)-алкиленовую группы, -алкилен-NH-группу, -алкилен-N-(алкил)-группу, -SO или -SO2-алкиленовую группу;
D связь или алкиленовая группа;
E C1 C7-алкиленовая группа, C2 - C7-алкенильная или C2 C7-алкинильная группы, причем двойная или тройная связь может быть не связана непосредственно с атомом азота Z1 Z2 Z3 Z4-группы, или, если E не связано непосредственно с атомом азота Z1 Z2 Z3 - Z4-группы, означает -O-; -S-; -SO-; -SO2-; -NR3-; -N(COR4)-, -CO-, -NR3 CO; -CONR3-; -SO2 - NR3-, алкилсульфонилимино- или арилсульфонилиминогруппы, где R3 и R4 имеют указанные значения, или цикло-C4 C7-алкиленовая группа, причем в четырех- или пятичленном циклоалкиленовом кольце один член кольца может означать атом азота и в шести- или семичленном циклоалкиленовом кольце один или два члена кольца могут означать атом азота, и дополнительно соседняя с атомом азота метиленовая группа может быть замещена карбонильной группой, причем одновременно может происходить связывание с атомами углерода соседних остатков через имеющиеся атомы азота;
F означает связь, линейную или разветвленную C1 - C6-алкиленовую группу, линейную или разветвленную C2 - C6-алкениленовую или C2 C6-алкиниленовую группы, причем двойная или тройная связь может не примыкать непосредственно к гетероатому или тройной связи остатка E, и упомянутые алкиленовая, алкениленовая и алкиниленовая группы могут быть замещены арильной группой, -COOR6-, CON(R3)2 или -CO-N(R3)-алкильной группами, причем остатки R3 и R6 имеют указанные значения и алкильная часть -CO-N(R3)-алкильной группы, которая может содержать 1 6 атомов углерода, дополнительно может быть замещена остатками R7 и R8, где R7 и R8, одинаковые или различные, водород, арильная или -COO-R6-группы, где R6 имеет указанное значение, циклоалкиленовую, алкилен-, циклоалкилен- и циклоалкиленалкиленовую группы, содержащие 4 6 атомов углерода в циклоалкиленовой части, в которых находящаяся в кольце CH-группа замещена атомом азота, и связывание с соседним остатком E может происходить также через атом азота, в случае, если связывание происходит через атом углерода остатка E, причем, если D связь, E кислород и F-алкильная группа, A может не быть непосредственно связанной с фенильным кольцом амино- или ациламиногруппой, и, если одновременно еще X сера и Y азот, группа A - B C не может быть 4-ацетамино-пиперазиногруппой;
G не связанная с гетероатомом остатка E карбонильная группа, которая может быть замещена гидроксильной группой, арилалкенилоксигруппой, содержащей 3 4 атомов углерода в алкенильной части, алкоксигруппой, содержащей 1 8 атомов углерода, в которой алкоксиостаток с 1 5 атомами углерода может быть замещен арильной группой или алкоксиостаток с 1 3 атомами углерода в 1-, 2- или 3-м положениях может быть замещен гетероарильной или циклоалкильной группой, содержащей 4 8 атомов углерода, или в 2- или 3-м положении пирролидин-2-он-1-ил, морфолино-, тиоморфолино- или 1-оксидо-тиоморфолиногруппой, циклоалкоксигруппой, содержащей 4 8 атомов углерода, которая может быть замещена 1 3 алкильными группами, возможно замещенными 1 3 метильными группами бензоциклоалкокси-, бензоциклоалкилалкокси-, бициклоалкокси- и бициклоалкилалкоксигруппами, содержащими 4 8 атомов углерода в циклоалкильной части и 6 8 атомов углерода в бициклоалкильной части, алканоилоксиметоксигруппой с общим числом атомов углерода 2 7 в алканоильной части, циклоалканоилоксиметоксигруппой с общим числом атомов углерода 4 8 в циклоалканоильной части, алкоксикарбонилоксиметоксигруппой с 1 6 атомами углерода в алкильной части, циклоалкоксикарбонилоксиметоксигруппой с 3 7 атомами углерода в циклоалкильной части, ароилоксиметокси-, аралканоилоксиметокси-, арилоксикарбонилоксиметокси- или аралкоксикарбонилоксиметоксигруппами, в которых метоксичасть может быть замещена алкильной группой с 1 6 атомами углерода, циклоалкильной группой с 3 7 атомами углерода, аралкильной или арильной группами, сульфогруппа, фосфоногруппа, O-алкилфосфоногруппа или тетразол-5-ил-группа,
или их соли, проявляющие активность по торможению агрегации.

Комментарии