N3-алкилированные бензимидазольные производные в качестве ингибиторов мек - RU2300528C2
Код документа: RU2300528C2
Описание
Область изобретения
Данное изобретение относится к ряду алкилированных (1Н-бензимидазол-5-ил)-(4-иод-фенил)-аминных производных, полезных при лечении гиперпролиферативных заболеваний, таких как рак и воспаление, у млекопитающих. Данное изобретение также относится к способу применения таких соединений при лечении гиперпролиферативных заболеваний у млекопитающих, в особенности у людей, а также к фармацевтическим композициям, содержащим такие соединения.
Краткое описание родственного уровня техники
Передача сигналов в клетках через рецепторы факторов роста и протеинкиназы является важным регулятором клеточного роста, пролиферации и дифференцировки. При нормальном клеточном росте факторы роста посредством активации рецепторов (то есть PDGF или EGF и других) активируют МАР-киназные пути. Одним из наиболее важных и наиболее хорошо изученных МАР-киназных путей, вовлеченных в нормальный и неконтролируемый клеточный рост, является Ras/Raf-киназный путь. Активный GTP-связанный Ras приводит к активации и непрямому фосфорилированию киназы Raf. Затем Raf фосфорилирует МЕК1 и 2 по двум остаткам серина (S218 и S222 для МЕК1 и S222 и S226 для МЕК2) (Ahn ef at., Methods in Enzymology 2001, 332, 417-431). Далее активированная МЕК фосфорилирует единственные известные субстраты МАР-киназы ERK1 и 2. Фосфорилирование ERK посредством МЕК происходит по Y204 и Т202 для ERK1 и по Y185 и Т183 для ERK2 (Ahn et al., Methods in Enzymology 2001, 332, 417-431). Фосфорилированная ERK димеризуется и затем транслоцируется в ядро, где происходит ее накопление (Khokhlatchev et al., Cell 1998, 93, 605-615). В ядре ERK вовлечена в ряд важных клеточных функций, включая ядерный транспорт, передачу сигнала, репарацию ДНК, сборку и транслокацию нуклеосом, процессинг и трансляцию мРНК, но ими не ограничивается (Ahn et al., Molecular Cell 2000, 6, 1343-1354). В целом, обработка клеток факторами роста приводит к активации ERK1 и 2, что вызывает пролиферацию и, в некоторых случаях, дифференцировку (Lewis et al., Adv. Cancer Res. 1998, 74, 49-139).
При пролиферативных заболеваниях генетические мутации и/или сверхэкспрессия рецепторов факторов роста, нижерасположенных сигнальных белков или протеинкиназ, вовлеченных в ERK-киназный путь, приводит к неконтролируемой пролиферации и, в итоге, к образованию опухоли. Например, при некоторых злокачественных новообразованиях имеются мутации, вызывающие постоянную активацию этих путей вследствие непрерывной выработки факторов роста. Другие мутации могут являться причиной дефектов в дезактивации активированного комплекса GTP-связанного Ras, что снова приводит к активации МАР-киназного пути. Мутантные онкогенные формы Ras обнаружены в 50% случаев рака толстой кишки и >90% случаев рака поджелудочной железы, а также при многих других типах злокачественных новообразований (Kohl et al., Science 1993, 260, 1834-1837). Недавно мутации в bRaf были обнаружены более чем в 60% случаев злокачественной меланомы (Davies, H. et al., Nature 2002, 417, 949-954). Эти мутации в bRaf приводят к конститутивной активации МАР-киназного каскада. Изучение образцов первичных опухолей и клеточных линий также показало конститутивную или повышенную активацию МАР-киназного пути при раке поджелудочной железы, толстой кишки, легкого, яичников и почки (Hoshino, R. et al., Oncogene 1999, 18, 813-822). Следовательно, существует строгая взаимосвязь между злокачественными новообразованиями и сверхактивацией МАР-киназного пути, происходящей в результате генетических мутаций.
Так как конститутивная или повышенная активация МАР-киназного каскада играет решающую роль в клеточной пролиферации и дифференцировке, то полагают, что ингибирование этого пути будет оказывать благоприятное воздействие при гиперпролиферативных заболеваниях. МЕК-киназа является ключевым участником в этом пути, поскольку расположена ниже Ras и Raf. Кроме того, она является привлекательной терапевтической мишенью, поскольку единственными известными субстратами фосфорилирования МЕК являются МАР-киназы ERK1 и 2. В отдельных исследованиях было показано, что ингибирование МЕК оказывает потенциальное терапевтическое благоприятное воздействие. Например, было показано, что низкомолекулярные ингибиторы МЕК подавляют рост человеческих опухолей в ксенотрансплантатах бестимусных мышей (Sebolt-Leopold et al., Nature-Medicine 1999, 5 (7), 810-816; Trachet et al., AACR April 6-10, 2002 Poster #5426; Tecle, H.IBC 2nd International Conference of Protein Kinases, 9-10 сентября, 2002), блокируют статическую аллодинию у животных (WO 01/05390, опубликованная 25 января 2001 года), а также ингибируют рост клеток при остром миелоидном лейкозе (Milella et al., J.Clin. Invest. 2001, 108 (6), 851-859).
Низкомолекулярные ингибиторы МЕК были описаны. За последние несколько лет вышли по меньшей мере тринадцать заявок на патент: США 5525625, поданная 24 января 1995 года; WO 98/43960, опубликованная 8 октября 1998 года; WO 99/01421, опубликованная 14 января 1999 года; WO 99/01426, опубликованная 14 января 1999 года; WO 00/41505, опубликованная 20 июля 2000 года; WO 00/42002, опубликованная 20 июля 2000 года; WO 00/42003, опубликованная 20 июля 2000 года; WO 00/41994, опубликованная 20 июля 2000 года; WO 00/42022, опубликованная 20 июля 2000 года; WO 00/42029, опубликованная 20 июля 2000 года; WO 00/68201, опубликованная 16 ноября 2000 года; WO 01/68619, опубликованная 20 сентября 2001 года; и WO 02/06213, опубликованная 24 января 2002 года.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном изобретении предложены алкилированные (1Н-бензимидазол-5-ил)-(4-иод-фенил)-аминные соединения формулы I и их фармацевтически приемлемые соли и пролекарства, которые полезны при лечении гиперпролиферативных заболеваний. В особенности, настоящее изобретение относится к соединениям формулы I, которые действуют в качестве ингибиторов МЕК. Кроме того, предложены препараты, содержащие соединения формулы I, и способы использования данных соединений для лечения нуждающегося в этом пациента. В дополнение к этому описаны способы получения ингибиторных соединений формулы I.
Соответственно, настоящее изобретение относится к соединениям формулы I:
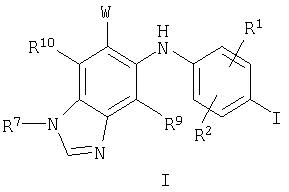
и их фармацевтически приемлемым солям, пролекарствам и сольватам, где:
R1, R2, R9 и R10 независимо выбраны из водорода, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -OR3, -C(O)R3, -C(O)OR3, -NR4C(O)R6, -OC(O)R3, -NR4SO2R6, -SO2NR3R4, -NR4C(O)R3, -C(O)NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -NR3R4 и C1-С10алкила, C2-С10алкенила, С3-С10алкинила, С3-С10циклоалкила, С3-С10циклоалкилалкила, -S(O)j(С1-С6алкил), -S(O)j(CR4R5)m-арила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклила, гетероциклилалкила, -O(CR4R5 )m-арила, -NR4(CR4R5)m-арила, -O(CR4R5)m-гетероарила, -NR4(CR4R5)m -гетероарила, -O(CR4R5)m-гетероциклила и -NR4(CR4R5)m-гетероциклила, где каждая алкильная, алкенильная, алкинильная, циклоалкильная, арильная, гетероарильная и гетероциклильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила;
R3 выбран из водорода, трифторметила и С1-С10алкила, С2-С10алкенила, С3-С10алкинила, С3-С10циклоалкила, С3-С10циклоалкилалкила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклила и гетероциклилалкила, где каждая алкильная, алкенильная, алкинильная, циклоалкильная, арильная, гетероарильная и гетероциклильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR'SO2R"", -SO2NR'R", -C(O)R', -C(O)OR', -OC(O)R', -NR'C(O)OR"", -NR'C(O)R", -C(O)NR'R", -SR"", -S(O)R"", -SO2R', -NR'R", -NR'C(O)NR"R'", -NR'C(NCN)NR"R'", -OR', арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила;
R', R" и R'" независимо выбраны из водорода, низшего алкила, низшего алкенила, арила и арилалкила;
R"" выбран из низшего алкила, низшего алкенила, арила и арилалкила;
или
любые два из R', R", R'" или R"" могут быть взяты вместе с атомом, к которому они присоединены, с образованием 4-10-членного карбоциклического, гетероарильного или гетероциклического кольца, каждое из которых возможно замещено группами в количестве от одной до трех, независимо выбранными из галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, арила, гетероарила, арилалкила, гетероарилалкила, гетероцикпила и гетероциклилалкила; или
R3 и R4 могут быть взяты вместе с атомом, к которому они присоединены, с образованием 4-10-членного карбоциклического, гетероарильного или гетероциклического кольца, каждое из которых возможно замещено группами в количестве от одной до трех, независимо выбранными из галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR'SO2R"", -SO2NR'R", -C(O)R', -C(O)OR', -OC(O)R', -NR'C(O)OR"", -NR'C(O)R", -C(O)NR'R", -SO2R"", -NR'R", -NR'C(O)NR"R'", -NR'C(NCN)NR"R"', -OR', арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила; или
R4 и R5 независимо представляют собой водород или C1-С6алкил; или
R4 и R5 могут быть взяты вместе с атомом, к которому они присоединены, с образованием 4-10-членного карбоциклического, гетероарильного или гетероциклического кольца, каждое из которых возможно замещено группами в количестве от одной до трех, независимо выбранными из галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR'SO2R"", -SO2NR'R", -C(O)R"", -C(O)OR', -OC(O)R', -NR'C(O)OR", -NR'C(O)R", -C(O)NR'R", -SO2R"", -NR'R", -NR'C(O)NR"R'", -NR'C(NCN)NR"R'", -OR', арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила;
R6 выбран из трифторметила и C1-С10алкила, С3-С10циклоалкила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклила и гетероциклилалкила, где каждая алкильная, циклоалкильная, арильная, гетероарильная и гетероциклильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR'SO2R"", -SO2NR'R", -C(O)R', -C(O)OR', -OC(O)R', -NR'C(O)OR"", -NR'C(O)R", -C(O)NR'R", -SO2R"", -NR'R', -NR'C(O)NR"R"', -NR'C(NCN)NR"R'", -OR', арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила;
R7 выбран из водорода и C1-С10алкила, С2-С10алкенила, С2-С10алкинила, С3-С10циклоалкила, С3-С10циклоалкилалкила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклила и гетероциклилалкила, где каждая алкильная, алкенильная, алкинильная, циклоалкильная, арильная, гетероарильная и гетероциклильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R8, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -NR4C(O)R6, -NR4C(O)R3, -C(O)NR3R4, -SO2R6, -NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила;
W выбран из гетероарила, гетероциклила, -C(O)OR3, -С(O)NR3R4, -C(O)NR4R3, -C(O)R4OR3, -С(O)(С3-С10циклоалкил), -С(O)(С1-С10алкил), -С(O)(арил), -С(O)(гетероарил) и -С(O)(гетероциклил), каждый из которых возможно замещен 1-5 группами, независимо выбранными из -NR3R4, -OR3, -R2и C1-С10алкила, С2-С10алкенила и С2-С10алкинила, каждый из которых возможно замещен 1 или 2 группами, независимо выбранными из -NR3R4 и -OR3;
m равен 0, 1, 2, 3, 4 или 5; и
j равен 1 или 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Новые соединения, охваченные настоящим изобретением, представляют собой соединения, описанные представленной выше общей формулой I, и их фармацевтически приемлемые соли и пролекарства.
В настоящем изобретении также предложены соединения формулы I, в которых R7 представляет собой C1-С10алкил, С3-С7циклоалкил или С3-С7циклоалкилалкил, каждый из которых может быть возможно замещен 1-3 группами, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -SO2R3, -NR4C(O)R6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила.
В настоящем изобретении также предложены соединения формулы I, где R9 представляет собой водород или галоген, и R10 представляет собой водород.
В настоящем изобретении также предложены соединения формулы I, где W представляет собой -C(O)OR3 или -C(O)NR4OR3.
В настоящем изобретении также предложены соединения формулы II:
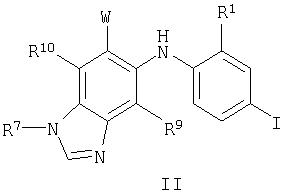
где W, R1, R7, R9 и R10 являются такими, как они определены выше для формулы I.
В настоящем изобретении также предложены соединения формулы II, в которых R7 представляет собой C1-С10алкил, С3-С7циклоалкил или С3-С7циклоалкилалкил, каждый из которых может быть возможно замещен 1-3 группами, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2Р6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -SO2R3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила.
В настоящем изобретении также предложены соединения формулы II, где R9 представляет собой водород или галоген, и R10 представляет собой водород.
В настоящем изобретении также предложены соединения формулы II, где W представляет собой -C(O)OR3 или -C(O)NR4OR3 .
В настоящем изобретении также предложены соединения формулы III:
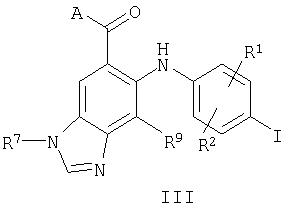
где R1, R2, R7 и R9 являются такими, как они определены выше для формулы I, и А представляет собой -OR3 или -NR4C(O)R3, где R3 и R4 являются такими, как они определены выше для формулы I.
В настоящем изобретении также предложены соединения формулы III, в которых R7 представляет собой C1-С10алкил, С3-С7циклоалкил или С3-С7циклоалкилалкил, каждый из которых может быть возможно замещен 1-3 группами, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -SO2R3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила.
В настоящем изобретении также предложены соединения формулы III, где R9 представляет собой водород или галоген.
В настоящем изобретении также предложены соединения формулы III, где R3 представляет собой водород или низший алкил, когда А представляет собой -OR3; и R4 представляет собой водород, когда А представляет собой -NR4C(O)R3.
В настоящем изобретении также предложены соединения формулы IIIa:
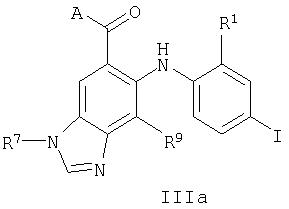
где R1, R2, R7 и R9 являются такими, как они определены выше для формулы I, и А представляет собой -OR3 или -NR4C(O)R3, где R3 и R4 являются такими, как они определены выше для формулы I.
В настоящем изобретении также предложены соединения формулы IIIa, в которых R7 представляет собой C1-С10алкил, С3-С7циклоалкил или С3-С7циклоалкилалкил, каждый из которых может быть возможно замещен 1-3 группами, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -SO2R3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR5C(O)NR3R4, -NR5C(NCN)NR3R4, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила.
В настоящем изобретении также предложены соединения формулы IIIa, где R9 представляет собой водород или галоген.
В настоящем изобретении также предложены соединения формулы IIIa, где R3 представляет собой водород или низший алкил, когда А представляет собой -OR3; и R4 представляет собой водород, когда А представляет собой -NR4C(O)R3.
За исключением точно определенных иным образом, по всему данному описанию используются следующие определения терминов.
Под "C1-С10алкилом", "алкилом" и "низшим алкилом" в настоящем изобретении понимают прямые или разветвленные алкильные группы, имеющие 1-10 атомов углерода, такие как метил, этил, пропил, изопропил, н-бутил, трет-бутил, mpem-бутил, пентил, 2-пентил, изопентил, неопентил, гексил, 2-гексил, 3-гексил, 3-метилпентил, гептил, октил и им подобные. Предпочтительные алкильные радикалы представляют собой C1-С6алкил. Более предпочтительные алкильные радикалы представляют собой C1-С3алкил.
Под "С2-С10алкенилом", "низшим алкенилом" и "алкенилом" понимают прямые и разветвленные углеводородные радикалы, имеющие от 2 до 10 атомов углерода и по меньшей мере одну двойную связь, и они включают в себя этенил, пропенил, 1-бут-3-енил, 1-пент-3-енил, 1-гекс-6-енил и им подобные. Более предпочтительными являются низшие алкенилы, имеющие 3-5 атомов углерода.
Под "С2-С10алкинилом", "низшим алкинилом" и "алкинилом" понимают прямые и разветвленные углеводородные радикалы, имеющие от 2 до 10 атомов углерода и по меньшей мере одну тройную связь, и они включают в себя этинил, пропинил, бутинил, пентин-2-ил и им подобные. Более предпочтительными являются алкинилы, имеющие 3-5 атомов углерода.
Под термином "галоген" в настоящем изобретении понимают фтор, бром, хлор и иод.
Под "арилом" понимают ароматическую карбоциклическую группу, имеющую единственное кольцо (например, фенил), множественные кольца (например, бифенил) или множественные конденсированные кольца, в которых по меньшей мере одно является ароматическим (например, 1,2,3,4-тетрагидронафтил, нафтил), которая возможно моно-, ди- или тризамещена, например, галогеном, низшим алкилом, низшим алкокси, трифторметилом, арилом, гетероарилом и гидрокси.
Под "гетероарилом" понимают состоящие из одного или более чем одного ароматического кольца системы 5-, 6- или 7-членных колец, которые включают в себя конденсированные кольцевые системы (в которых по меньшей мере одно кольцо ароматическое) из 5-10 атомов, содержащих по меньшей мере один гетероатом и вплоть до четырех гетероатомов, выбранных из азота, кислорода или серы. Примерами гетероарильных групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Спирогруппировки также включены в объем данного определения. Гетероарильные группы возможно моно-, ди- или тризамещены, например, галогеном, низшим алкилом, низшим, алкокси, галогеноалкилом, арилом, гетероарилом и гидрокси.
Как он использован здесь, термин "карбоцикл", "карбоциклил", "циклоалкил" или "С3-С10циклоалкил" относится к насыщенным карбоциклическим радикалам, имеющим от трех до десяти атомов углерода. Циклоалкил может быть моноциклической или полициклической конденсированной системой и может быть конденсирован с ароматическим кольцом. Примеры таких радикалов включают в себя циклопропил, циклобутил, циклопентил и циклогексил. Упомянутые здесь циклоалкильные группы являются незамещенными или, если указано, замещены по одному или более чем одному замещаемому положению различными группами. Например, такие циклоалкильные группы могут быть возможно замещены, например, С1-С6алкилом, C1-С6алкокси, галогеном, гидрокси, циано, нитро, амино, моно(С1-С6)алкиламино, ди(С1-С6)алкиламино, С2-С6алкенилом, С2-С6алкинилом, C1-С6галогеноалкилом, С1-С6галогеноалкокси, амино(С1-С6)алкилом, моно(С1-С6)алкиламино(С1-С6)алкилом илиди(С1-С6)алкиламино(С1-С6)алкилом.
Под "гетероциклом" или "гетероциклилом" понимают состоящие из одного или более чем одного карбоциклического кольца системы 5-, 6- или 7-членных колец, которые включают в себя конденсированные кольцевые системы из 4-10 атомов, содержащих по меньшей мере один гетероатом и вплоть до четырех гетероатомов, выбранных из азота, кислорода или серы, и при условии, что кольцо данной группы не содержит два соседних атома О или S. Конденсированная система может представлять собой гетероцикл, конденсированный с ароматической группой. Предпочтительные гетероциклы включают в себя, но не ограничены ими, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3Н-индолил и хинолизинил. Спирогруппировки также включены в объем данного определения. Упомянутые группы, как следует из приведенных выше групп, могут быть С-присоединенными или N-присоединенными, если такое возможно. Например, группа, являющаяся производным пиррола, может быть пиррол-1-илом (N-присоединенной) или пиррол-3-илом (С-присоединенной). Далее, группа, являющаяся производным имидазола, может быть имидазол-1-илом (N-присоединенной) или имидазол-3-илом (С-присоединенной). Примером гетероциклической группы, где 2 кольцевых атома углерода замещены оксо-группировками (=O), является 1,1-диоксо-тиоморфолинил. Упомянутые здесь гетероциклические группы являются незамещенными или, если указано, замещены по одному или более чем одному замещаемому положению различными группами. Например, такие гетероциклические группы могут быть возможно замещены, например, С1-С6алкилом, C1-С6алкокси, галогеном, гидрокси, циано, нитро, амино, моно(С1-С6 )алкиламино, ди(С1-С6)алкиламино, С2-С6алкенилом, С2-С6алкинилом, C1-С6галогеноалкилом, C1-С6галогеноалкокси, амино(С1-С6)алкилом, моно(С1-С6)алкиламино(С1-С6)алкилом или ди(С1-С6)алкиламино(С1-С6)алкилом.
Термин "арилалкил" означает алкильную группировку (как она определена выше), замещенную одной или более чем одной арильной группировкой (которая также определена выше). Более предпочтительными арилалкильными радикалами являются арил-С1-3-алкилы. Примеры включают в себя бензил, фенилэтил и им подобные.
Термин "гетероарилалкил" означает алкильную группировку (как она определена выше), замещенную гетероарильной группировкой (которая также определена выше). Более предпочтительными гетероарилалкильными радикалами являются 5- или 6-членные гетероарил-С1-3-алкилы. Примеры включают в себя оксазолилметил, пиридилэтил и им подобные.
Термин "гетероциклилалкил" означает алкильную группировку (как она определена выше), замещенную гетероциклической группировкой (которая также определена выше). Более предпочтительными гетероциклилалкильными радикалами являются 5- или 6-членные гетероциклил-С1-3-алкилы. Примеры включают в себя тетрагидропиранилметил.
Термин "циклоалкилалкил" означает алкильную группировку (как она определена выше), замещенную циклоалкильной группировкой (которая также определена выше). Более предпочтительными циклоалкилалкильными радикалами являются 5- или 6-членные циклоалкил-С1-3-алкилы. Примеры включают в себя циклопропилметил.
Термин "Me" означает метил, "Et" означает этил, "Bu" означает бутил, и "Ас" означает ацетил.
Фраза "фармацевтически приемлемая(ые) соль(и)", как она использована здесь, если не оговорено особо, включает в себя соли кислотных или основных групп, которые могут быть представлены в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются основными по природе, способны к образованию большого разнообразия солей с различными неорганическими и органическими кислотами. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислоты таких основных соединений по настоящему изобретению, являются кислоты, которые образуют нетоксичные соли присоединения кислоты, то есть соли, содержащие фармацевтически приемлемые анионы, такие как соли ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, соли кальция, камзилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдисилат, эстолат, эзилат, этилсукцинат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, соли гидрабамина, гидробромид, гидрохлорид, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат. Поскольку индивидуальное соединение по настоящему изобретению может включать в себя более чем одну кислотную или основную группировки, соединения по настоящему изобретению могут включать моно-, ди- или тройную соль в индивидуальном соединении.
В случае наличия кислотной группировки в соединении по настоящему изобретению соль может быть образована путем обработки соединения по настоящему изобретению основным соединением, в частности неорганическим основанием. Предпочтительными неорганическими солями являются соли, образованные с щелочными и щелочно-земельными металлами, такими как литий, натрий, калий, барий и кальций. Предпочтительные соли органических оснований включают в себя, например, соли аммония, дибензиламмония, бензиламмония, 2-гидроксиэтиламмония, бис(2-гидроксиэтил)аммония, фенилэтилбензиламина, дибензил-этилендиамина и им подобные соли. Другие соли кислотных группировок могут включать, например, такие соли, образованные с прокаином, хинином и N-метилглюкозамином, и соли, образованные с основными аминокислотами, такими как глицин, орнитин, гистидин, фенилглицин, лизин и аргинин. Особенно предпочтительной солью является натриевая или калиевая соль соединения по настоящему изобретению.
Что касается основных группировок, то соль образуют путем обработки соединения по настоящему изобретению кислотным соединением, в частности неорганической кислотой. Предпочтительные неорганические соли этого типа могут включать в себя, например, соли соляной, бромистоводородной, иодистоводородной, серной, фосфорной кислоты или им подобные. Предпочтительные органические соли этого типа могут включать в себя, например, соли, образованные с муравьиной, уксусной, янтарной, лимонной, молочной, малеиновой, фумаровой, пальмитиновой, холевой, памовой, слизевой, D-глутаминовой, D-камфорной, глутаровой, гликолевой, фталевой, винной, лауриновой, стеариновой, салициловой, метансульфоновой, бензолсульфоновой, паратолуолсульфоновой, сорбиновой, пуриновой, бензойной, коричной и подобными органическими кислотами. Особенно предпочтительной солью этого типа является соль гидрохлорид или сульфат соединения по настоящему изобретению.
В соединениях по настоящему изобретению, когда используются такие термины, как (CR4R5)m или (CR4R5)t, R4 и R5 могут варьировать при каждом повторе m или t выше 1. Например, если m или t равен 2, термины (CR4R5)m или (CR4R5)t, могут соответствовать -СН2СН2- или -СН(СН3)С(СН2СН3)(СН2СН2СН3) - либо любому числу аналогичных группировок, попадающих в пределы объема определений для R4 и R5.
Некоторые соединения по настоящему изобретению могут иметь асимметричные центры и поэтому существовать в различных энантиомерных формах. Считается, что все оптические изомеры и стереоизомеры соединений по настоящему изобретению и их смеси находятся в пределах объема данного изобретения. Что касается соединений по настоящему изобретению, данное изобретение охватывает применение рацемата, одной или более чем одной энантиомерной формы, одной или более чем одной диастереомерной формы или их смесей. Кроме того, соединения по настоящему изобретению могут существовать в виде таутомеров. Данное изобретение относится к применению всех таких таутомеров и их смесей.
Объект изобретения также включает в себя меченые изотопами соединения, которые идентичны соединениям, изложенным в настоящем изобретении, но при том обстоятельстве, что один или более чем один атом заменен атомом, имеющим атомную массу или массовое число, отличающиеся от обычно встречающихся в природе атомной массы или массового числа. Примеры изотопов, которые могут быть инкорпорированы в соединения по изобретению, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как2Н,3Н,13С,14С,15N,18О,17О,31Р,32Р,35S,18F и36Cl, соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений либо указанных пролекарств, которые содержат упомянутые выше изотопы и/или другие изотопы других атомов, находятся в пределах объема данного изобретения. Некоторые меченые изотопами соединения по настоящему изобретению, например те соединения, в которые инкорпорированы такие радиоактивные изотопы, как3H и14С, полезны в анализах распределения лекарства и/или субстрата в тканях. В особенности предпочтительны тритиевые изотопы, то есть3Н, и углерод-14, то есть14С, ввиду легкости их получения и детектирования. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть2H может давать некоторые терапевтические преимущества, вытекающие из повышенной метаболической стабильности, например, требования увеличенного периода полувыведения in vivo или сниженной дозировки, и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Как правило, меченое изотопами соединение по настоящему изобретению и его пролекарства могут быть получены посредством выполнения процедур, описанных ниже на Схемах и/или в Примерах и Подготовительных стадиях, путем замещения реагента, не меченого изотопами, легко доступным реагентом, меченым изотопами.
Кроме того, данное изобретение охватывает фармацевтические композиции и способы лечения пролиферативных расстройств или аномального клеточного роста путем введения пролекарств соединений по настоящему изобретению. Соединения по настоящему изобретению, имеющие свободные группы амино, амидо, гидрокси или карбоксильные группы, могут быть преобразованы в пролекарства. Пролекарства включают в себя соединения, где аминокислотный остаток или полипептидная цепь из двух или более чем двух (например, двух, трех или четырех) аминокислотных остатков ковалентно присоединены посредством амидной или эфирной связи к свободной аминогруппе, гидроксигруппе или группе карбоновой кислоты соединений по настоящему изобретению. Аминокислотные остатки включают в себя 20 существующих в природе аминокислот, обычно обозначаемых трехбуквенными символами, и кроме того включают в себя 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон, но не ограничены ими. Кроме того, включены дополнительные типы пролекарств. Например, могут быть получены производные свободных карбоксильных групп в виде амидов или алкиловых сложных эфиров. Могут быть получены производные свободных гидроксигрупп в виде групп, включающих в себя гемисукцинаты, фосфатные сложные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, но не ограниченных ими, как описано в Advanced Drug Delivery Reviews, 1996, 19, 115. Также включены карбаматные пролекарства гидроксигрупп и аминогрупп, как представляющие собой карбонатные пролекарства, сульфонатные сложные эфиры и сульфатные сложные эфиры гидроксигрупп. Также включено получение производных гидроксигрупп в виде (ацилокси)метиловых и (ацилокси)этиловых простых эфиров, где ацильная группа может представлять собой алкиловый сложный эфир, возможно замещенных группами, включающими в себя функциональные группы простых эфиров, аминов или карбоновых кислот, но не ограниченными ими, или где ацильная группа представляет собой сложный эфир аминокислоты, как описано выше. Пролекарства этого типа описаны в J.Med.Chem. 1996, 39, 10. Кроме того, могут быть получены производные свободных аминов в виде амидов, сульфонамидов или фосфонамидов. Все эти пролекарственные группировки могут инкорпорировать группы, включая функциональные группы простых эфиров, аминов или карбоновых кислот, но не ограничиваясь ими.
Следует понимать, что в случае использования подряд двух или более чем двух радикалов для определения присоединенного к структуре заместителя, первый названный радикал считается концевым, а названный последним радикал считается присоединенным к рассматриваемой структуре. Так например, радикал арилалкил присоединен к рассматриваемой структуре посредством алкильной группы.
Данное изобретение также относится к фармацевтической композиции для лечения гиперпролиферативного расстройства у млекопитающего, содержащей терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель. В одном воплощении указанная фармацевтическая композиция предназначена для лечения рака, такого как рак головного мозга, легкого, клеток плоского эпителия, мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, почки, яичников, предстательной железы, ободочной и прямой кишки, пищевода, яичек, гинекологической сферы или щитовидной железы. В другом воплощении указанная фармацевтическая композиция предназначена для лечения гиперпролиферативного расстройства не раковой природы, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или гиперплазия предстательной железы (например, доброкачественная гипертрофия предстательной железы (ВРН)).
Кроме того, данное изобретение относится к фармацевтической композиции для лечения панкреатита, или заболевания почек (включая пролиферативный гломерулонефрит и индуцированное диабетом почечное заболевание), или боли у млекопитающего, содержащей терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель..
Кроме того, данное изобретение относится к фармацевтической композиции для предупреждения имплантации бластоцитов у млекопитающего, содержащей терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель.
Кроме того, данное изобретение относится к фармацевтической композиции для лечения заболевания, связанного с васкулогенезом или ангиогенезом, у млекопитающего, содержащей терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель. В одном воплощении указанная фармацевтическая композиция предназначена для лечения заболевания, выбранного из группы, состоящей из опухолевого ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, воспалительного заболевания кишечника, атеросклероза, кожных заболеваний, таких как псориаз, экзема и склеродермия, диабета, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичников, молочной железы, легкого, поджелудочной железы, предстательной железы, толстой кишки и эпидермоидного рака.
Данное изобретение также относится к способу лечения гиперпролиферативного расстройства у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата. В одном воплощении указанный способ относится к лечению рака, такого как рак головного мозга, легкого, клеток плоского эпителия, мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, почки, яичников, предстательной железы, ободочной и прямой кишки, пищевода, яичек, гинекологической сферы или щитовидной железы. В другом воплощении указанный способ относится к лечению гиперпролиферативного расстройства не раковой природы, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или гиперплазия предстательной железы (например, доброкачественная гипертрофия предстательной железы (ВРН)).
Данное изобретение также относится к способу лечения гиперпролиферативного расстройства у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата в комбинации с противоопухолевым агентом, выбранным из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ингибиторов ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза и антиандрогенов.
Кроме того, данное изобретение относится к способу лечения панкреатита, или заболевания почек, или боли у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата.
Кроме того, данное изобретение относится к способу предупреждения имплантации бластоцитов у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата.
Кроме того, данное изобретение относится к способу лечения заболеваний, связанных с васкулогенезом или ангиогенезом, у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства или гидрата. В одном воплощении указанный способ предназначен для лечения заболевания, выбранного из группы, состоящей из опухолевого ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, воспалительного заболевания кишечника, кожных заболеваний, таких как псориаз, экзема и склеродермия, диабета, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичников, молочной железы, легкого, поджелудочной железы, предстательной железы, толстой кишки и эпидермоидного рака.
Пациенты, которых можно лечить соединениями по настоящему изобретению или фармацевтически приемлемыми солями, пролекарствами и гидратами указанных соединений в соответствии со способами по данному изобретению, включают в себя, например, пациентов с диагнозом псориаз, рестеноз, атеросклероз, ВРН, рак легкого, рак кости, хронический миеломоноцитарный лейкоз (CMML), рак поджелудочной железы, рак кожи, рак головы и шеи, кожная или внутриглазная меланома, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, опухоли яичек, гинекологической сферы (например, саркома матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки, карцинома влагалища или карцинома вульвы), болезнь Ходжкина, рак пищевода, так тонкого кишечника, рак эндокринной системы (например, рак щитовидной, паращитовидной желез или надпочечников), саркомы мягких тканей, рак уретры, рак пениса, рак предстательной железы, хронический или острый лейкоз, солидные опухоли у детей, лимфоцитарная лимфома, рак мочевого пузыря, рак почки или мочеточника (например, почечно-клеточный рак, карцинома почечной лоханки) или неоплазмы центральной нервной системы (например, первичная лимфома ЦНС, опухоли позвоночного столба, глиомы ствола мозга или аденомы гипофиза).
Данное изобретение также относится к фармацевтической композиции для ингибирования аномального клеточного роста у млекопитающего, содержащей количество соединения по настоящему изобретению или его фармацевтически приемлемой соли либо их сольвата или пролекарства в комбинации с количеством химиотерапевтического средства, причем количества соединения, соли, сольвата или пролекарства и химиотерапевтического средства являются совместно эффективными в ингибировании аномального клеточного роста. В настоящее время в данной области техники известно множество химиотерапевтических средств. В одном воплощении химиотерапевтическое средство выбрано из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза и антиандрогенов.
Кроме того, данное изобретение относится к способу ингибирования аномального клеточного роста у млекопитающего или лечения пролиферативного расстройства, при котором млекопитающему вводят количество соединения по настоящему изобретению или его фармацевтически приемлемой соли либо их сольвата или пролекарства в комбинации с лучевой терапией, причем количества соединения, соли, сольвата или пролекарства в комбинации с лучевой терапией являются эффективными в ингибировании аномального клеточного роста или лечении пролиферативного расстройства у млекопитающего. Методики применения лучевой терапии известны в данной области техники, и данные методики могут быть использованы в комбинированной терапии, описанной здесь. Введение соединения по данному изобретению в такой комбинированной терапии может быть определено, как описано здесь.
Полагают, что соединения по настоящему изобретению могут сделать аномальные клетки более чувствительными к лечению облучением в целях клеточного лизиса и/или ингибирования роста таких клеток. Соответственно, данное изобретение также относится к способу повышения чувствительности аномальных клеток у млекопитающего к лечению облучением, при котором млекопитающему вводят количество соединения по настоящему изобретению или его фармацевтически приемлемой соли либо сольвата или пролекарства, которое является эффективным для повышения чувствительности аномальных клеток к лечению облучением. Количество соединения, соли либо сольвата в этом способе может быть определено согласно методикам выявления эффективных количеств таких соединений, описанных здесь.
Данное изобретение также относится к способу и к фармацевтической композиции для ингибирования аномального клеточного роста у млекопитающего, которая содержит количество соединения по настоящему изобретению или его фармацевтически приемлемой соли либо их сольвата, его пролекарства или его изотопно меченного производного и количество одной или более чем одной субстанции, выбранной из антиангиогенезных агентов, ингибиторов сигнальной трансдукции и антипролиферативных агентов.
Антиангиогенезные агенты, такие как ингибиторы ММР-2 (матриксная металлопротеиназа 2), ингибиторы ММР-9 (матриксная металлопротеиназа 9) и ингибиторы СОХ-II (циклооксигеназа II), могут быть использованы в комбинации с соединением по настоящему изобретению и фармацевтическими композициями, описанными здесь. Примеры полезных ингибиторов СОХ-II включают в себя CELEBREX™ (алекоксиб), валдекоксиб и рофекоксиб. Примеры полезных ингибиторов матриксных металлопротеиназ описаны в WO 96/33172 (опубликованной 24 октября 1996 года), WO 96/27583 (опубликованной 7 марта 1996 года), заявке на европейский патент №97304971.1 (поданной 8 июля 1997 года), заявке на европейский патент №99308617.2 (поданной 29 октября 1999 года), WO 98/07697 (опубликованной 26 февраля 1998 года), WO 98/03516 (опубликованной 29 января 1998 года), WO 98/34918 (опубликованной 13 августа 1998 года), WO 98/34915 (опубликованной 13 августа 1998 года), WO 98/33768 (опубликованной 6 августа 1998 года), WO 98/30566 (опубликованной 16 июля 1998 года), публикации Европейского патента 606046 (опубликованного 13 июля 1994 года), публикации Европейского патента 931788 (опубликованного 28 июля 1999 года), WO 90/05719 (опубликованной 31 мая 1990 года), WO 99/52910 (опубликованной 21 октября 1999 года), WO 99/52889 (опубликованной 21 октября 1999 года), WO 99/29667 (опубликованной 17 июня 1999 года), международной заявке РСТ № РСТ/1В98/01113 (поданной 21 июля 1998 года), заявке на европейский патент №99302232.1 (поданной 25 марта 1999 года), заявке на патент Великобритании №9912961.1 (поданной 3 июня 1999 года), предварительной заявке США №60/148464 (поданной 12 августа 1999 года), патенте США 5863949 (выданном 26 января 1999 года), патенте США 5861510 (выданном 19 января 1999 года) и публикации Европейского патента 780386 (опубликованного 25 июня 1997 года), все из которых включены в данное описание во всей своей полноте посредством ссылки. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы, имеющие незначительную активность в отношении ингибирования ММР-1 или не имеющие такой активности. Более предпочтительными являются ингибиторы, которые селективно ингибируют ММР-2 и/или ММР-9 по сравнению с другими матриксными металлопротеиназами (то есть ММР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13).
Некоторые конкретные примеры ингибиторов ММР, полезных в настоящем изобретении, представляют собой AG-3340, RO 32-3555 и RS 13-0830.
Термины "аномальный клеточный рост" и "гиперпролиферативное расстройство" используются в данной заявке как взаимозаменяемые.
"Аномальный клеточный рост", как он использован здесь, если не оговорено особо, относится к клеточному росту, который не зависит от нормальных регуляторных механизмов (например, утрата контактного торможения). Он включает в себя, например, аномальный рост: (1) опухолевых клеток (опухолей), которые пролиферируют посредством экспрессирования мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных или злокачественных клеток других пролиферативных заболеваний, при которых наблюдается аберрантная активация тирозинкиназы; (3) любых опухолей, которые пролиферируют посредством рецепторных тирозинкиназ; (4) любых опухолей, которые пролиферируют посредством аберрантной активации серин/треонинкиназы; и (5) доброкачественных или злокачественных клеток других пролиферативных заболеваний, при которых наблюдается аберрантная активация серин/треонинкиназы.
Термин "лечение", как он использован здесь, если не оговорено особо, означает реверсирование, облегчение, подавление развития или предупреждение расстройства или состояния, к которым применяется такой термин, либо одного или более чем одного симптома такого расстройства или состояния. Термин "лечение", как он использован здесь, если не оговорено особо, относится также к акту лечения как таковому, как оно непосредственно определено выше.
Репрезентативные соединения по настоящему изобретению, которые охвачены настоящим изобретением, включают в себя соединения из примеров и их фармацевтически приемлемые соли присоединения кислот или оснований, либо их пролекарства, но ими не ограничены.
Представленные ниже примеры предназначены для иллюстрации конкретных воплощений данного изобретения и никоим образом не предназначены для ограничения объема описания или формулы изобретения.
Иллюстрация получения соединений по настоящему изобретению показана на Схемах 1-3.
Схема 1 - N алкило иодо
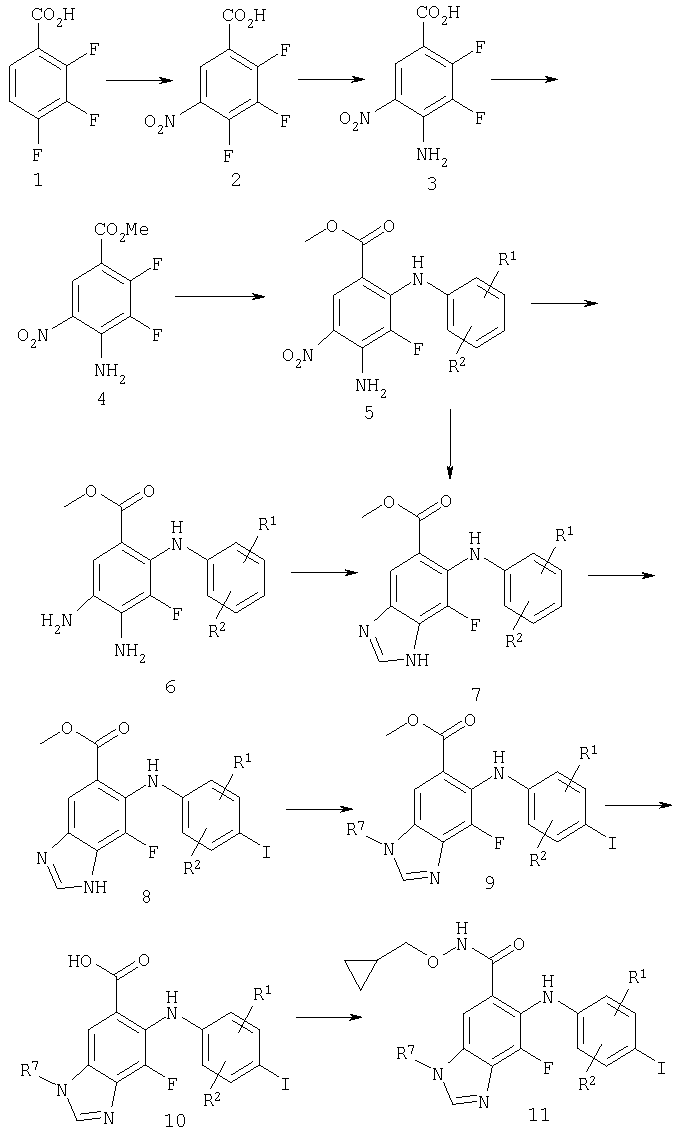
Схема 2 - N амино алкил иодо
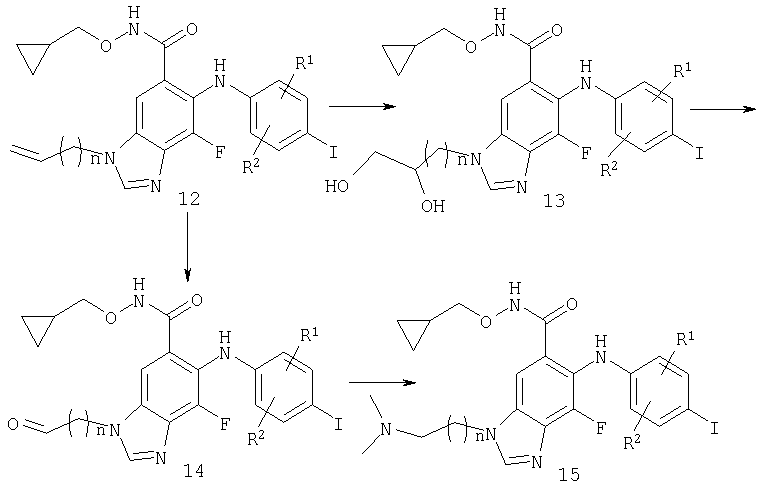
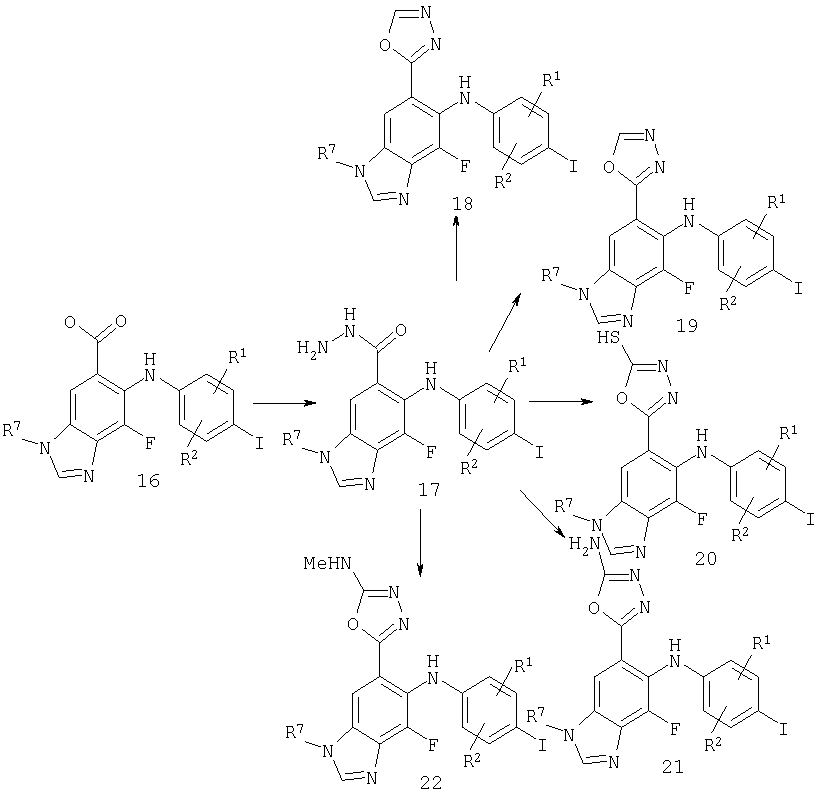
Схема 3 - пример гетероциклического оксадиазола
Общие способы синтеза, которые могут иметь отношение к получению некоторых из соединений по настоящему изобретению, предложены в опубликованной заявке РСТ под номером WO 00/42022 (опубликованной 20 июля 2000 года). Вышеупомянутая заявка на патент включена в данное описание изобретения посредством ссылки во всей своей полноте.
Представленные ниже примеры предназначены для иллюстрации конкретных воплощений данного изобретения и никоим образом не предназначены для ограничения объема описания или формулы изобретения.
Иллюстрация получения соединений по настоящему изобретению показана на Схемах 1-3.
Схема 1 иллюстрирует синтез соединений по настоящему изобретению. На стадии 1 осуществляют нитрование кислоты с использованием стандартных условий, предпочтительно дымящей азотной кислоты в H2SO4. На стадии 2 получают анилин путем замещения фторида, используя NH4OH, при комнатной температуре в воде с последующим осторожным подкисленном концентрированной минеральной кислотой до рН около 0. На стадии 3 получают сложный эфир с помощью стандартных методов, включая этерификацию по Фишеру (МеОН, H2SO4) и взаимодействие с TMSCHN2 в подходящих органических растворителях, подобных PhMe/MeOH или THF/MeOH, но ими не ограничиваясь. На стадии 4 получают дианилинопроизводное путем нагревания (от 60 до 200°С) данного сложного эфира с избытком соответствующего чистого анилина или в органическом растворителе типа ксилолов. Например, когда R1=Me и R2=Н, предпочтительным способом является перемешивание сложного эфира с 10 эквивалентами анилина в ксилолах при температуре дефлегмации до полного завершения реакции. На стадии 5 нитроарен восстанавливают с получением диамина с помощью стандартных условий восстановления, включая Н2 и Pd/C или Pd(OH)2/C либо никель Ренея в органическом растворителе, подобном EtOH или THF, Fe в АсОН, Zn в АсОН или Zn, NH4Cl (води.) в МеОН, но ими не ограничиваясь. На стадии 6 диамин подвергают циклизации путем нагревания с чистой муравьиной кислотой или формамидинацетатом в соответствующем растворителе, подобном EtOH. Альтернативно, когда R1 или R2 не представляет собой галогено, нитроарен может быть непосредственно превращен в бензимидазол на стадии 7 путем нагревания в муравьиной кислоте с Pd(OH)2/C или другим источником палладия, подобным Pd/C. На стадии 8 вводят иодид с помощью стандартных методов, включая NIS и пара-TsOH в органических сорастворителях, подобных THF и МеОН, или бензилтриметиламмония дихлориодинат и ZnCl2 в АсОН, но ими не ограничиваясь. На стадии 9 бензимидазол алкилируют, что дает почти равную смесь N1- и N3-продуктов, которые могут быть разделены стандартными методиками, включая, например хроматографию и растирание. Алкилирование осуществляют путем использования алкилирующего агента, подобного алкилгалогениду, и основания, подобного NaH или К2СО3, в подходящем органическом растворителе, подобном DMF или THF, при температурах, изменяющихся в интервале от 0 до 80°С. R7 может быть далее модифицирован с помощью различных методов синтеза, известных в данной области техники, как проиллюстрировано в примерах ниже. На стадии 10 сложный эфир гидролизуют с помощью стандартных методов омыления. Затем данную кислоту превращают в желаемый гидроксамат на стадии 11 с помощью стандартных процедур сочетания, включая EDCl, HOBt или РуВОР и соответствующий гидроксиламин в подходящих органических растворителях, подобных DMF, THF или метиленхлориду, но ими не ограничиваясь.
На Схеме 2 проиллюстрировано получение N3-алкил-амино-бензимидазольных производных. На стадии 1 концевой алкен N3-алкилированного бензимидазола гидроксамата дигидроксилируют с использованием подходящего окислителя, подобного OsO4 в подходящем растворителе, или KMnO4, или I2, AgOAc, АсОН, воде. Данный диол затем дополнительно окисляют на стадии 2, используя NaIO4 или Pb(ОАс)4 в подходящей бифазной смеси, что дает альдегид. Альтернативно (стадия 3), алкен может быть непосредственно превращен в альдегид с помощью стандартных методов, включая озон/Ме2S, NaIO4/OsO4 или KMnO4, но ими не ограничиваясь. На стадии 4 получают амин путем восстановительного аминирования, используя стандартные методы, такие как Na(CN)ВН3, Na(ОАс)3ВН, NMe4ВН(ОАс)3 в присутствии или в отсутствие АсОН в подходящем растворителе, таком как метиленхлорид, ацетонитрил или THF. Предпочтительное восстановительное аминирование относится к обработке альдегида амином, Ме4МВН(ОАс)3 и уксусной кислотой в MeCN при комнатной температуре.
Схема 3 иллюстрирует получение соединений по настоящему изобретению, где W представляет собой гетероцикл. На стадии 1 сложный метиловый эфир превращают в гидразид путем перемешивания с гидразином в подходящем растворителе, подобном ETOH, при температурах от 50 до 100°С. Желаемое гетероциклическое производное затем получают посредством циклизации с соответствующим реагентом. Для получения оксадиазола 18 гидразид обрабатывают ортоформиатом, подобным триэтилортоформиату, и кислотным катализатором, подобным пара-TsOH, в подходящем органическом растворителе, подобном ETOH, при повышенных температурах (50-100°С). Для получения гидроксиоксадиазола 19 гидразид может быть циклизован с использованием фосгена или эквивалента фосгена, подобного трифосгену, либо карбонилдиимидазола в подходящем органическом растворителе, подобном толуолу, при температурах, изменяющихся в интервале от 50 до 120° С. Меркаптооксадиазол 20 может быть получен путем осуществления взаимодействия с дисульфидом углерода и основанием, подобным КОН, в подходящем органическом растворителе, подобном ETOH, при повышенных температурах (50-100°С). Аминооксадиазол 21 может быть получен путем осуществления взаимодействия с BrCN и основанием, подобным NaHCO3, в подходящей бифазной системе растворителей, подобной диоксану и воде, при комнатной температуре. И наконец, замещенный аминооксадиазол 22 может быть получен сначала путем осуществления взаимодействия гидразида с соответствующим изотиоцианатом в подходящем органическом растворителе, подобном DMF или THF, при температурах, изменяющихся в интервале от 25 до 100°С. Промежуточное соединение может быть выделено или может быть циклизовано непосредственно путем обработки EDCl или другим карбодиимидом в подходящем органическом растворителе, подобном THF или DMF, при температурах, изменяющихся в интервале от комнатной температуры до 80°С.
Соединения по настоящему изобретению могут иметь асимметричные атомы углерода. Диастереомерные смеси могут быть разделены на свои индивидуальные диастереомеры на основании своих физико-химических различий способами, известными специалистам в данной области техники, например, хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены путем превращения энантиомерной смеси в диастереомерную смесь путем осуществления взаимодействия с подходящим оптически активным соединением (например, спиртом), разделения диастереомеров и превращения (например, гидролиза) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Считается, что все такие изомеры, включая диастереомерные смеси и чистые энантиомеры, составляют часть данного изобретения.
Активность соединений по настоящему изобретению может быть определена с помощью следующей процедуры. 6 His-меченую с N-конца конститутивно активную МЕК1 (2-393) экспрессируют в Е.coli и белок очищают традиционными методами (Ahn et al., Science 1994, 265, 966-970). Активность МЕК1 оценивают путем измерения включения γ-33Р-фосфата из γ -33Р-АТФ в His-меченую с N-конца ERK2, которую экспрессируют в Е.coli и очищают традиционными методами, в присутствии МЕК1. Анализ проводят в 96-луночном полипропиленовом планшете. Инкубационная смесь (100 мкл) содержит 25 мМ Hepes, pH 7,4, 10 мМ MgCl2, 5 мМ β-глицерофосфат, 100 мкМ Na-ортованадат, 5 мМ DTT, 5 нМ МЕК1 и 1 мкМ ERK2. Ингибиторы суспендируют в DMSO и все реакционные смеси, включая контроли, готовят в конечной концентрации 1%-ного DMSO. Реакции инициируют добавлением 10 мкМ АТФ (с 0,5 мкКи γ-33Р-АТФ/лунка) и инкубируют при температуре окружающей среды в течение 45 минут. Для остановки реакции и осаждения белков добавляют равный объем 25%-ной ТСА. Выпавшие в осадок белки отделяют на стекловолокнистых фильтровальных пластинах типа В и избыток меченого АТФ отмывают, используя харвестер Tomtec MACH III. Планшеты оставляют высушиваться на воздухе перед тем, как добавить Packard Microscint 20 из расчета 30 мкл/лунка, и планшеты считывают, используя Packard TopCount. В этом анализе соединения по данному изобретению демонстрируют величины IC50 менее чем 50 микромоль.
Следующие далее соединения приведены в качестве примеров такой активности.
Введение соединений по настоящему изобретению (здесь и далее "активное(ые) соединение(я)") может быть осуществлено любым способом, позволяющим осуществлять доставку соединений к месту действия. Эти способы включают в себя пероральные пути, интрадуоденальные пути, парентеральную инъекцию (в том числе внутривенную, подкожную, внутримышечную, внутрисосудистую, или инфузию), местное и ректальное введение.
Количество введенного активного соединения будет зависеть от подвергаемого лечению субъекта, тяжести расстройства или состояния, скорости введения, наличия соединения в распоряжении и по усмотрению лечащего врача. Тем не менее, эффективная дозировка находится в интервале от приблизительно 0,001 до приблизительно 100 мг на кг массы тела в сутки, предпочтительно от приблизительно 1 до приблизительно 35 мг/кг/сутки, в виде разовой или разделенных доз. Для человека массой 70 кг это количество будет составлять от приблизительно 0,05 до 7 г/сутки, предпочтительно от приблизительно 0,05 до приблизительно 2,5 г/сутки. В некоторых случаях уровни дозировок меньше низшего предела вышеуказанного интервала могут быть более чем достаточны, в то время как в других случаях могут быть использованы более высокие дозы, не вызывающие никаких вредных побочных эффектов, при условии, что такие более высокие дозы первоначально делят на несколько малых доз для введения в течение дня.
Активное соединение можно применять в качестве единственной терапии, либо с одним или более другим противоопухолевым веществом, например, выбранным, к примеру, из ингибиторов митоза, например винбластина; алкилирующих агентов, например цис-платина, карбоплатина и циклофосфамида; антиметаболитов, например 5-фторурацила, цитозинарабинозида и гидроксимочевины или, к примеру, одного из предпочтительных антиметаболитов, описанных в заявке на европейский патент №239362, такого как N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторов факторов роста; ингибиторов клеточного цикла; интеркалирующих антибиотиков, например адриамицина и блеомицина; ферментов, например интерферона; и антигормонов, например антиэстрогенов, таких как NolvadexTM (тамоксифен), или, например антиандрогенов, таких как CasodexTM (4'-циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)пропион-анилид). Такое комбинированное лечение может быть достигнуто путем одновременного, последовательного или раздельного введения индивидуальных компонентов лечения.
Фармацевтическая композиция может находиться, например, в форме, подходящей для перорального введения, в виде таблетки, капсулы, пилюли, порошка, препаратов непрерывного высвобождения, раствора, суспензии; для парентеральной инъекции в виде стерильных раствора, суспензии или эмульсии; для местного введения в виде мази или крема; либо для ректального введения в виде суппозитория. Фармацевтическая композиция может находиться в стандартных лекарственных формах, подходящих для однократного введения точно определенных дозировок. Фармацевтическая композиция будет включать в себя традиционный фармацевтический носитель или эксципиент и соединение по данному изобретению в качестве активного ингредиента. В дополнение к этому она может включать в себя другие медицинские или фармацевтические агенты, носители, адъюванты и так далее.
Типичные формы для парентерального введения включают в себя растворы или суспензии активных соединений в стерильных водных растворах, например водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы при желании могут быть подходящим образом забуферены.
Подходящие фармацевтические носители включают в себя инертные разбавители или наполнители, воду и различные органические растворители. При желании в фармацевтические композиции могут быть добавлены дополнительные ингредиенты, такие как корригенты, связующие, эксципиенты и тому подобное. Так для перорального введения таблетки, содержащие различные эксципиенты, такие как лимонная кислота, могут быть использованы совместно с различными разрыхлителями, такими как крахмал, альгиновая кислота и некоторые комплексные силикаты, и со связующими агентами, такими как сахароза, желатин и аравийская камедь. Вдобавок, зачастую очень полезными для таблетирования оказываются смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Кроме того, твердые композиции подобного типа могут быть использованы в мягких и твердых наполняемых желатиновых капсулах. Поэтому предпочтительные материалы включают в себя лактозу или молочный сахар и полиэтиленгликоли высокой молекулярной массы. Если для перорального введения желательны водные суспензии или эликсиры, то активное соединение в них может быть объединено с разнообразными подсластителями или корригентами, окрашивающими веществами или красителями и, при желании, с эмульгирующими агентами или суспендирующими агентами вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин или их комбинации.
Способы приготовления различных фармацевтических композиций с конкретным количеством активного соединения известны или будут очевидны специалистам в данной области техники. Смотри, например Remington's Pharmaceutical Sciences. Mack Publishing Company, Ester, Pa., 15th Edition (1975).
Примеры и подготовительные стадии, предлагаемые ниже, дополнительно иллюстрируют соединения по настоящему изобретению и способы получения таких соединений. Следует понимать, что объем настоящего изобретения никоим образом не ограничен объемом следующих далее примеров и подготовительных стадий. В следующих примерах молекулы с единственным хиральным центром, если не оговорено особо, существуют в виде рацемической смеси. Такие же молекулы с двумя или более чем двумя хиральными центрами, если не оговорено особо, существуют в виде рацемической смеси диастереомеров. Индивидуальные энантиомеры/диастереомеры могут быть получены с помощью способов, известных специалистам в данной области техники.
Описания в этой заявке всех статей и ссылок, включая патенты, включены посредством ссылки.
Данное изобретение далее проиллюстрировано следующими примерами, которые не следует истолковывать как ограничивающие данное изобретение в отношении объема или сущности описанных в них конкретных процедур.
Исходные материалы и различные промежуточные соединения могут быть приобретены из коммерческих источников, получены из имеющихся в продаже органических соединений или получены с использованием хорошо известных методов синтеза.
Репрезентативные примеры способов получения промежуточных соединений по данному изобретению изложены ниже.
Примеры
Пример 1
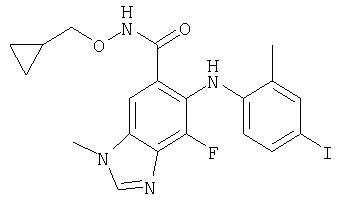
Циклопропилметокси-амид 7-фтор-6-(4-иод-2-метил-фениламино)-3-метил-3Н-бензимидазол-5-карбоновой кислоты (11а)
Стадия А: 2,3, 4-трифтор-5-нитро-бензойная кислота
В трехгорлую круглодонную колбу емкостью 3 литра загружают 125 мл H2SO4. Добавляют дымящую азотную кислоту (8,4 мл; 199 ммоль) и смесь осторожно перемешивают. В продолжение 90 минут добавляют 2,3,4-трифторбензойную кислоту (25 г, 142 ммоль) в виде порций по 5 г. Темный коричневато-желтый раствор перемешивают в течение 60 мин, в продолжение которых реакция завершается. Реакционную смесь выливают в 1 литр смеси лед/вода и экстрагируют диэтиловым эфиром (3×600 мл). Объединенные органические экстракты высушивают (MgSO4) и концентрируют при пониженном давлении с получением твердого вещества желтого цвета. Твердое вещество суспендируют в гексанах и перемешивают в течение 30 мин, после чего фильтруют с получением 29 г (92%) ожидаемого прозрачного продукта в виде твердого вещества желтоватой окраски.
Стадия В: 4-амино-2,3-дифтор-5-нитро-бензойная кислота
Раствор гидроксида аммония (˜30% в воде) (35 мл; 271 ммоль) добавляют к раствору 2,3,4-трифтор-5-нитро-бензойной кислоты (15 г; 67,8 ммоль) в 30 мл воды при 0°С с перемешиванием. По завершении добавления гидроксида аммония реакционную смесь нагревают до комнатной температуры с перемешиванием. Через 2,5 ч реакционную смесь охлаждают до 0°С и осторожно добавляют концентрированную HCl до тех пор, пока рН реакционной смеси не достигнет приблизительно 0. Реакционную смесь разбавляют водой (30 мл) и экстрагируют диэтиловым эфиром (3×50 мл). Объединенные органические экстракты высушивают (MgSO4) и концентрируют при пониженном давлении с получением 14 г (95%) ожидаемого чистого продукта.
Стадия С: метиловый эфир 4-амино-2,3-дифтор-5-нитро-бензойной кислоты
2М Раствор TMS-диазометана в гексанах (6,88 мл; 13,75 ммоль) добавляют к суспензии 4-амино-2,3-дифтор-5-нитро-бензойной кислоты (2,00 г; 9,17 ммоль) в 25 мл смеси 4:1 THF/MeOH при 0°С в атмосфере азота. По окончании добавления реакционную смесь нагревают до комнатной температуры. Через 0,5 ч избыток TMS-диазометана нейтрализуют путем осторожного добавления уксусной кислоты. Реакционную смесь затем концентрируют при пониженном давлении и высушивают in vacuo с получением 1,95 г (92%) ожидаемого чистого продукта.
Стадия D: метиловый эфир 4-амино-3-фтор-5-нитро-2-орто-толиламинобензойной кислоты
Метиловый эфир 4-амино-2,3-дифтор-5-нитро-бензойной кислоты (12,0 г; 51,7 ммоль) суспендируют в ксилолах (60 мл) и добавляют орто-толуидин (55,2 мл; 517 ммоль). Реакционную смесь нагревают с перемешиванием до температуры дефлегмации в атмосфере азота. Через 36 ч реакционную смесь охлаждают до комнатной температуры, разбавляют диэтиловым эфиром и промывают 10%-ным водным раствором HCl. Водные промывки экстрагируют диэтиловым эфиром. Объединенные органические экстракты концентрируют при пониженном давлении. Остаток растворяют в метиленхлориде и фильтруют через силикагель во фриттованной воронке, промывая метиленхлоридом. Получают три фракции. Первая (2 литра) близка к чистой. Вторая (1 литр) и третья (1 литр) фракции только частично чистые. Первую фракцию концентрируют при пониженном давлении и растирают с диэтиловым эфиром с получением 11,2 г (68%) ожидаемого чистого продукта в виде твердого вещества ярко-желтой окраски.
Стадия Е: метиловый эфир 7-фтор-6-орто-толиламино-1Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 4-амино-3-фтор-5-нитро-2-орто-толиламинобензойной кислоты (1,57 г; 4,92 ммоль), муравьиную кислоту (25 мл; 26,5 ммоль) и 20%-ный Pd(OH)2/C (1,57 г; 2,95 ммоль) в 25 мл ETOH нагревают с перемешиванием до 95°С. Через 16 ч реакционную смесь охлаждают до комнатной температуры и добавляют 0,5 г 20%-ного Pd(OH)2/C и 10 мл муравьиной кислоты. Реакционную смесь нагревают до 95°С с перемешиванием. Через 16 ч реакционную смесь охлаждают до комнатной температуры и фильтруют через целит, промывая EtOH. Фильтрат концентрируют при пониженном давлении до тех пор, пока ожидаемый продукт не выпадет в осадок. Ожидаемый продукт собирают фильтрованием. Фильтрат еще раз концентрируют, пока дополнительное количество ожидаемого продукта не выпадет в осадок. Продукт собирают фильтрованием. Повторяют концентрирование ETOH, фильтрование продукта несколько раз. Получено 1,09 г (74%) ожидаемого чистого продукта.
Стадия F: метиловый эфир 7-фтор-6-(4-иод-2-метил-фениламино)-1Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 7-фтор-6-орто-толиламино-1Н-бензимидазол-5-карбоновой кислоты (1,47 г; 4,92 ммоль) суспендируют в смеси 1:1 THF/MeOH (44 мл) и охлаждают до -78°С в атмосфере азота. Добавляют раствор NIS (1,66 г; 7,39 ммоль) в THF (2 мл) с последующим добавлением раствора TsOH·H2O (1,87 г; 9,84 ммоль) в МеОН (2 мл). Через 30 мин реакционную смесь нагревают до 0°С и добавляют 1 мл метиленхлорида. Реакционную смесь оставляют медленно нагреваться до комнатной температуры при перемешивании в продолжение 16 ч. Реакционную смесь гасят путем добавления 10%-ного раствора Na2S2O4. Реакционную смесь разбавляют водой и этилацетатом и слои разделяют. Водный слой экстрагируют этилацетатом. Объединенные органические экстракты высушивают (Na2SO4) и концентрируют при пониженном давлении. Полученное твердое вещество растирают с МеОН с получением 1,45 г (69%) ожидаемого чистого продукта.
Стадия G: метиловый эфир 7-фтор-6-(4-иод-2-метил-фениламино)-3-метил-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 7-фтор-6-(4-иод-2-метил-фениламино)-1H-бензимидазол-5-карбоновой кислоты (100 мг; 0,235 ммоль) суспендируют в DMF (2,5 мл) и охлаждают до 0°С в атмосфере азота. Добавляют NaH (95%-ный) (6 мг; 0,238 ммоль). Через 10 мин добавляют MeI (15 мкл; 0,238 ммоль). Через 45 мин реакционную смесь нагревают до комнатной температуры (кг). Через 1,5 ч реакционную смесь гасят водой и разбавляют этилацетатом и соляным раствором. Слои разделяют и водный слой экстрагируют этилацетатом. Объединенные органические экстракты высушивают (Na2SO4) и концентрируют при пониженном давлении. Неочищенную смесь продуктов очищают с помощью FCC (10:1 метиленхлорид/этилацетат) с получением 36 мг (36%) ожидаемого метил-N3-продукта и 43 мг (43%) метил-N1-продукта.
Стадия Н: 7-фтор-6-(4-иод-2-метил-фениламино)-3-метил-3Н-бензимидазол-5-карбоновая кислота
Метиловый эфир 7-фтор-6-(4-иод-2-метил-фениламино)-3-метил-3Н-бензимидазол-5-карбоновой кислоты (34 мг; 0,077 ммоль) суспендируют в смеси 1:1 THF/MeOH (2 мл) и добавляют 20%-ный NaOH (500 мкл). Через 16 ч реакционную смесь охлаждают до 0°С и по каплям добавляют 1М раствор HCl до рН 1-2. Реакционную смесь разбавляют этилацетатом и водой и слои разделяют. Органический слой промывают соляным раствором, высушивают (MgSO4) и концентрируют при пониженном давлении с получением 33 мг (100%) ожидаемого продукта в виде твердого вещества белого цвета.
Стадия I: циклопропилметокси-амид 7-фтор-6-(4-иод-2-метил-фениламино)-3-метил-3Н-бензимидазол-5-карбоновой кислоты
7-Фтор-6-(4-иод-2-метил-фениламино)-3-метил-3Н-бензимидазол-5-карбоновую кислоту (30 мг; 0,071 ммоль) суспендируют в DMF (1 мл) и добавляют HOBt (11 мг; 0,085 ммоль) с последующим добавлением триэтиламина (22 мкл; 0,162 ммоль). Добавляют циклопропилметил-гидроксиламина гидрохлорид (10 мг; 0,085 ммоль) (WO 0042022) с последующим добавлением EDCl (18 мг; 0,092 ммоль). Через 16 ч реакционную смесь разбавляют этилацетатом и водой и слои разделяют. Органический слой промывают насыщенным NH4Cl, соляным раствором, насыщенным NaHCO3, водой и соляным раствором. Органический слой высушивают (MgSO4) и концентрируют при пониженном давлении. Неочищенную реакционную смесь очищают с помощью FCC, элюируя смесью 20:1 метиленхлорид/МеОН с получением 21 мг (61%) ожидаемого чистого продукта (11а) в виде твердого вещества бежевой окраски; обнаружено: MS APCI (+) m/z 495 (М+1); обнаружено: MS APCI (-) m/z 493 (M-1);1H ЯМР (400 МГц; DMSO-d6) δ 11.62 (s, 1H), 8.38 (s, 1H), 7.69 (s, 1H), 7.57 (s, 1H), 7.43 (d, 1H), 7.25 (dd, 1H), 6.12 (dd, 1H), 3.89 (s, 3Н), 3.58 (d, 2H), 2.23 (s, 3Н), 1.01 (m, 1H), 0.47 (m, 2H), 0,19 (m, 2H);19F ЯМР (376 МГц; DMSO-d6) δ - 133.71 (s).
Пример 2
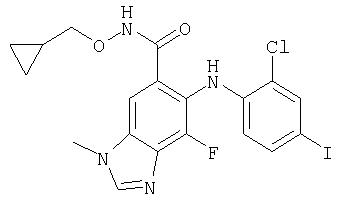
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-метил-3Н-бензимидазол-5-карбоновой кислоты (11b)
Стадия А: метиловый эфир 4-амино-3-фтор-5-нитро-2-фениламино-бензойной кислоты
Метиловый эфир 4-амино-2,3-дифтор-5-нитро-бензойной кислоты (23,48 г; 101,1 ммоль) суспендируют в ксилолах (125 мл) и добавляют анилин (92 мл; 1011 ммоль). Реакционную смесь перемешивают при 125°С в течение 16 часов в атмосфере N2. Реакционную смесь охлаждают до комнатной температуры, и твердые вещества выпадают в осадок из раствора. Твердые вещества собирают фильтрованием и промывают ксилолами и затем диэтиловым эфиром. Полученные 22,22 г (72,78 ммоль) твердого вещества желтого цвета представляют собой ожидаемый чистый продукт. Фильтрат концентрируют при пониженном давлении, заново растворяют в метиленхлориде и быстро пропускают через набивку с силикагелем с элюированием метиленхлоридом. Желаемые фракции концентрируют при пониженном давлении с получением твердого вещества коричневой окраски, которое растирают с диэтиловым эфиром, получая 5,47 г (17,91 ммоль) твердого вещества желтого цвета, которое представляет собой ожидаемый чистый продукт.Общий выход продукта составляет 27,69 г (90%); обнаружено: MS APCI (-) m/z 304 (M-1).
Стадия В: метиловый эфир 7-фтор-6-фениламино-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 4-амино-3-фтор-5-нитро-2-фениламино-бензойной кислоты (16,70 г; 54,71 ммоль), муравьиную кислоту (250 мл; 6,63 моль) и 20%-ный Pd(OH)2/C (9,00 г; 16,91 ммоль) в этаноле (250 мл) перемешивают при 40°С в течение двух часов в атмосфере N2 и затем при 95°С в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры и фильтруют через целит, промывая этилацетатом. Фильтрат концентрируют при пониженном давлении, получая твердое вещество желтого цвета. Твердое вещество растирают с диэтиловым эфиром с получением 13,47 г (86%) ожидаемого продукта в виде твердого вещества желто-коричневой окраски; обнаружено: MS APCI (+) m/z 286 (М+1); обнаружено: MS APCI (-) m/z 284 (M-1).
Стадия С: метиловый эфир 7-фтор-6-(4-иод-фениламино)-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 7-фтор-6-фениламино-3Н-бензимидазол-5-карбоновой кислоты (1,47 г; 4,91 ммоль) суспендируют в смеси 1:1 THF/MeOH (40 мл) и охлаждают до -78°С. Добавляют твердый лара-TsOH моногидрат (1,5 г; 7,4 ммоль) с последующим добавлением через 5 мин NIS (1,2 г; 5,2 ммоль). Через 15 мин реакционную смесь нагревают до 0°С и затем медленно нагревают до к.т. в течение 16 ч. Реакционную смесь гасят, добавляя 10%-ный NaHSO3. Через 30 мин реакционную смесь выливают в делительную воронку и слои разделяют. Водный слой экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и соляным раствором, высушивают (Na2SO4) и концентрируют при пониженном давлении. Остаток растирают с метиленхлоридом с получением 1,47 г (69%) ожидаемого чистого продукта в виде твердого вещества красноватой окраски; обнаружено: LC/MS ESI (+) m/z 412 (М+1).
Стадия D: метиловый эфир 6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 7-фтор-6-(4-иод-фениламино)-3Н-бензимидазол-5-карбоновой кислоты (1,4 г; 3,5 ммоль) растворяют в DMF (60 мл) и добавляют NCS (470 мг; 3,51 ммоль). Реакционную смесь перемешивают в течение 144 ч при к.т. и затем нагревают до 60°С. Через 40 ч при 60°С реакционную смесь охлаждают до к.т., гасят 10%-ным NaHSO3 и разбавляют диэтиловым эфиром. Слои разделяют и органический слой промывают водой, высушивают (Na2SO4) и концентрируют при пониженном давлении с получением 1,24 г (80%) ожидаемого продукта в виде твердого вещества коричневой окраски:1H ЯМР (400 МГц; DMSO-d6) δ 8.50 (s, 1H), 7.97 (s, 1Н), 7.78 (d, 1H), 7.42 (dd, 1H), 6.1 (bs, 1H), 3.82 (s, 3H).
Стадия Е: метиловый эфир 6-(2-хлор-4-иод-фениламино)-7-фтор-3-метил-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты (205 мг; 0,46 ммоль) растворяют в DMF (3 мл) и добавляют К2СО3 (76 мг; 0,55 ммоль) с последующим добавлением MeI (36 мкл; 0,58 ммоль). Через 2 ч реакционную смесь концентрируют почти досуха при пониженном давлении. Остаток растворяют в этилацетате, промывают насыщенным NaHCO3 и соляным раствором, высушивают (Na2SO4) и концентрируют при пониженном давлении. Очистка с помощью FCC с элюированием смесью 9:1 метиленхлорид/MeCN дает 35 мг (17%) ожидаемого продукта:1H ЯМР (400 МГц; MeOH-d4) δ 8.38 (s, 1Н), 8.17 (s, 1H), 7.67 (d, 1H), 7.39 (dd, 1H), 6.40 (dd, 1H), 3.98 (s, 3Н), 3.93 (s, 3H);19F ЯМР (376 МГц; MeOH-d4) δ - 133.8 (s).
Стадия F: циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-метил-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 6-(2-хлор-4-иод-фениламино)-7-фтор-3-метил-3Н-бензимидазол-5-карбоновой кислоты далее обрабатывают, как описано в Примере 1, получая 6-(2-хлор-4-иод-фениламино)-7-фтор-3-метил-3Н-бензимидазол-5-карбоновой кислоты циклопропилметокси-амид (11b):1H ЯМР (400 МГц; ацетон-d6) δ 8.24 (s, 1H), 7.79 (s, 1H), 7.68 (d, 1H), 7.45 (dd, 1H), 6.41 (dd, 1H), 4.01 (s, 3H), 3.75 (m, 2H), 1.09 (m, 1H), 0.51 (m, 2H), 0.23 (m, 2H).
Пример 3
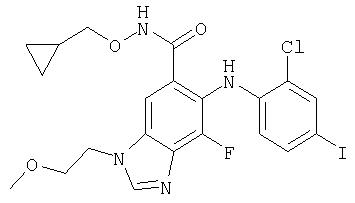
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-метокси-этил)-3Н-бензимидазол-5-карбоновой кислоты (11с)
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-метокси-этил)-3Н-бензимидазол-5-карбоновой кислоты (11с) получают из метилового эфира 6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты и 1-бром-2-метокси-этана и далее обрабатывают, как описано выше:1H ЯМР (400 МГц; МеОН-d4) δ 8.32 (s, 1H), 7.72 (s, 1H), 7.63 (m, 1Н), 7.33 (dd, 1H), 6.27 (m, 1H), 4.50 (t, 2H), 3.77 (t, 2H), 3.61 (dd, 2H), 3.37 (s, 3H), 1.06 (m, 1H), 0.51 (m, 2H), 0.22 (m, 2H);19F ЯМР (376 МГц; MeOH-d4) δ -134.91 (s).
Пример 4
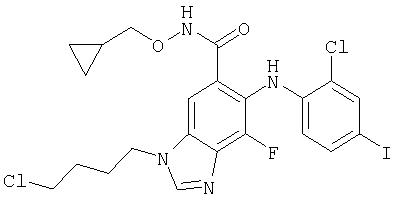
Циклопропилметокси-амид 3-(4-хлор-бутил)-6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты (11d)
Циклопропилметокси-амид 3-(4-хлор-бутил)-6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты (11d) получают из метилового эфира 6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты и 1-бром-4-хлор-бутана и далее обрабатывают, как описано выше; обнаружено; MS APCI (-) m/z 589, 591, 593 (M-, Cl-образец).
Пример 5
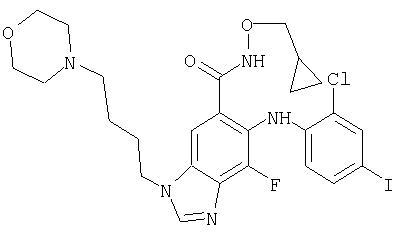
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(4-морфолин-4-ил-бутил)-3Н-бензимидазол-5-карбоновой кислоты (11е)
Циклопропилметокси-амид 3-(4-хлор-бутил)-6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты (11d) (45 мг; 0,076 ммоль) растворяют в DMF (0,5 мл) в реакторе под давлением и добавляют NaI (19 мг; 0,12 ммоль) с последующим добавлением морфолина (22 мкл; 0,25 ммоль). Реакционную смесь продувают азотом, герметично закрывают и нагревают до 65°С с перемешиванием в течение 16 ч. Реакционную смесь концентрируют при пониженном давлении и остаток разбавляют этилацетатом. Органическую фазу промывают водой и соляным раствором, высушивают (Na2SO4) и концентрируют при пониженном давлении. Очистка путем FCC с элюированием смесью 95:5 СН3CN/МеОН дает 36 мг (66%) ожидаемого продукта (11е) в виде твердого вещества; обнаружено: MS APCI (-) m/z. 640, 642 (N-, Cl-образец);1Н ЯМР (400 МГц; MeOH-d4) δ 8.37 (s, 1H), 7.71 (s, 1H), 7.63 (m, 1Н), 7.33 (dd, 1H), 6.27 (m, 1H), 4.38 (t, 2Н), 3.65 (m, 6Н), 2.41 (m, 6Н), 1.96 (m, 2Н), 1.56 (m, 2H), 1.05 (m, 1H), 0.50 (m, 2H), 0.22 (m, 2H).
Пример 6
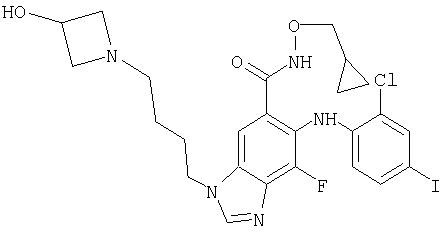
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-[4-(3-гидрокси-азетидин-1-ил)-бутил]-3Н-бензимидазол-5-карбоновой кислоты (11f)
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-[4-(3-гидрокси-азетидин-1-ил)-бутил]-3Н-бензимидазол-5-карбоновой кислоты (11f) получают, как описано выше, используя тозилат азетидин-3-ола и карбонат калия; обнаружено: MS APCI (-) m/z 626, 628 (N-, Cl-образец);1H ЯМР (400 МГц; MeOH-d4) δ 8.34 (s, 1H), 7.72 (s, 1H), 7.63 (m, 1H), 7.34 (dd, 1H), 6.27 (m, 1H), 4.34 (m, 3Н), 3.61 (m, 3H), 3.38 (m, 2H), 2.86 (m, 2H), 2.54 (m, 2H), 1.95 (m, 2H), 1.41 (m, 1H), 1.06 (m, 1H), 0.51 (m, 2H), 0.22 (m, 2H);19F ЯМР (376 МГц; MeOH-d4) δ - 133.38 (s).
Пример 7
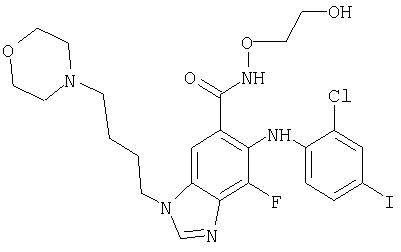
(2-Гидрокси-этокси)-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(4-морфолин-4-ил-бутил)-3Н-бензимидазол-5-карбоновой кислоты (11g)
Стадия А: (2-винилокси-этокси)-амид 3-(4-хлор-бутил)-6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты
3-(4-Хлор-бутил)-6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновую кислоту (70 мг; 0,134 ммоль) суспендируют в DMF (1 мл) в атмосфере азота и добавляют триэтиламин (44 мкл; 0,32 ммоль) с последующим добавлением НОВТ (25 мг; 0,16 ммоль). Через 5 мин добавляют O-(2-винилокси-этил)-гидроксиламин (WO 0206213) (17 мг; 0,16 ммоль) с последующим добавлением EDCI (31 мг; 0,16 ммоль). Через 16 ч реакционную смесь разбавляют смесью 1:1 этилацетат/THF. Органические слои промывают насыщенным NaHCO3, насыщенным NH4Cl и соляным раствором, высушивают (Na2SO4) и концентрируют при пониженном давлении. Очистка путем растирания с метиленхлоридом дает 80 мг (98%) ожидаемого продукта; обнаружено: MS APCI (-) m/z 605, 607, 609 (N-, Cl-образец).
Стадия В: (2-винилокси-этокси)-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(4-морфолин-4-ил-бутил)-3Н-бензимидазол-5-карбоновой кислоты
(2-Винилокси-этокси)-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(4-морфолин-4-ил-бутил)-3Н-бензимидазол-5-карбоновой кислоты получают из (2-винилокси-этокси)-амида 3-(4-хлор-бутил)-6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты, как описано выше: MS APCI (-) m/z 656, 658 (N-, Cl-образец).
Стадия С: (2-гидрокси-этокси)-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(4-морфолин-4-ил-бутил)-3Н-бензимидазол-5-карбоновой кислоты
(2-Винилокси-этокси)-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(4-морфолин-4-ил-бутил)-3H-бензимидазол-5-карбоновой кислоты (24 мг; 0,036 ммоль) суспендируют в THF (1 мл) и добавляют 1,0 н. раствор HCl (0,18 мл; 0,182 ммоль). Через 16 ч реакционную смесь разбавляют этилацетатом и нейтрализуют насыщенным раствором NaHCO3. Органический слой промывают соляным раствором, высушивают над MgSO4 и концентрируют при пониженном давлении. Неочищенную реакционную смесь очищают путем FCC, элюируя смесью 10% MeOH/DCM, с получением 12 мг (52%) ожидаемого чистого продукта (11g) в виде твердого вещества белого цвета; обнаружено: MS APCI (-) m/z 630, 632 (N-, Cl-образец);1H ЯМР (400 МГц; MeOH-d4) δ 8.39 (s, 1H), 7.74 (s, 1H), 7.63 (m, 1H), 7.33 (dd, 1H), 6.26 (m, 1H), 4.38 (t, 2H), 3.92 (t, 2H), 3.66 (m, 6Н), 2.41 (m, 6H), 1.97 (m, 2H), 1.56 (m, 2H);19F ЯМР (376 МГц; МеОН-d4) δ - 135.94 (s).
Пример 8
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-метансульфонил-этил)-3Н-бензимидазол-5-карбоновой кислоты (11h)
Стадия А: метиловый эфир 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-метансульфонил-этил)-3Н-бензимидазол-5-карбоновой кислоты
Метиловый эфир 6-(2-хлор-4-иод-фениламино)-7-фтор-3Н-бензимидазол-5-карбоновой кислоты (220 мг; 0,494 ммоль) растворяют в смеси 1:1 THF/DMF (2 мл) в атмосфере азота и добавляют К2СО3 (69 мг; 0,499 ммоль) с последующим добавлением метилвинилсульфона (51 мкл; 0,592 ммоль). Через 16 ч реакционную смесь концентрируют при пониженном давлении и остаток растворяют в этилацетате. Органические слои промывают насыщенным NaHCO3 и соляным раствором, высушивают (Na2SO4) и концентрируют при пониженном давлении. Очистка путем FCC с элюированием смесью 1:1 метиленхлорид/MeCN дает 122 мг (45%) ожидаемого продукта в виде твердого вещества беловатой окраски.
Стадия В: циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-метансульфонил-этил)-3Н-бензимидазол-5-карбоновой кислоты
Гидролиз и сочетание, как они описаны выше, дают ожидаемый продукт (11h); обнаружено: MS APCI (-) m/z 605, 607 (N-, Cl-образец);1Н ЯМР (400 МГц; ацетон-d6) δ 10.95 (bs, 1H), 8.37 (s, 1H), 8.21 (bs, 1H), 7.92 (s, 1H), 7.70 (d, 1H), 7.46 (dd, 1H), 6.44 (m, 1H), 4.93 (t, 2H), 3.85 (t, 2H), 3.75 (dd, 2H), 2.98 (s, 3Н), 1.09 (m, 1H), 0.44 (m, 2H), 0.24 (m, 2H);19F ЯМР (376 МГц; ацетон-d6) δ-132.31 (s).
Пример 9
Следующие далее соединения получают аналогично с использованием соответствующего акцептора Михаэля (Michael) и гидроксиламина.
(2-Гидрокси-этокси)-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-метансульфонил-этил)-3Н-бензимидазол-5-карбоновой кислоты (11i): обнаружено: MS APCI (-) m/z 595, 597 (M-, Cl-образец);1H ЯМР (400 МГц; МеОН-d4) δ 8.39 (s, 1H), 7.78 (s, 1H), 7.64 (d, 1H), 7.34 (dd, 1H), 6.28 (m, 1H), 4.87 (t, 2H), 3.93 (m, 2H), 3.79 (t, 2H), 3.67 (m, 2H), 2.98 (s, 3H);19F ЯМР (376 МГц; MeOH-d4) δ - 134.00 (s).
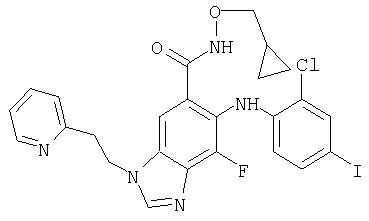
Циклопропилметокси-амид 6-(2-хлор-4-иод-фениламино)-7-фтор-3-(2-пиридин-2-ил-этил)-3Н-бензимидазол-5-карбоновой кислоты (11j): обнаружено: MS APCI (+) m/z 606, 608 (M+, Cl-образец); обнаружено: MS APCI (-) m/z 604, 606 (M-, Cl-образец);1H ЯМР (400 МГц; MeOH-d4) δ 8.47 (d, 1H), 8.13 (s, 1H), 7.65 (dt, 1H), 7.62 (m, 2H), 7.35 (dd, 1H), 7.26 (dd, 2H), 7.20 (d, 1H), 6.25 (dd, 1H), 4.75 (t, 2H), 3.62 (d, 2H), 3.39 (t, 2H), 1.09 (m, 1H), 0.51 (m, 2H), 0.25 (m, 2H);19F ЯМР (376 МГц; MeOH-d4) δ - 134.62 (s).
Пример 10
Пример получения фармацевтической композиции и изготовления фармацевтического препарата в форме таблетки.
Ингибитор МЕК смешивают с ингредиентами 2, 3, 4 и 5 в течение приблизительно 10 минут. Затем добавляют стеарат магния, полученную смесь перемешивают в течение приблизительно 2 минут и прессуют в форме таблетки.
Теперь данное изобретение, и способ и процесс его создания и применения описаны полными, недвусмысленными, лаконичными и точными выражениями, что дает возможность любому специалисту в данной области техники, к которой оно имеет отношение, проделать и применить все то же самое. Следует понимать, что вышеприведенное описывает предпочтительные воплощения настоящего изобретения, и что могут быть произведены изменения в пределах сущности и объема настоящего изобретения, которые изложены в формуле изобретения. Для того чтобы особенно обратить внимание и четко сформулировать объект, рассматриваемый как изобретение, данное описание заканчивается следующей далее формулой изобретения.
Реферат
Изобретение относится к N3-алкилированным бензимидазольным производным для изготовления лекарства для ингибирования активности МЕК. Описывается бензимидазольное соединение формулы
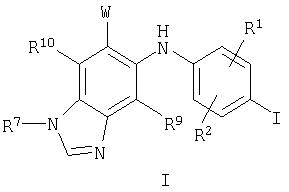
и его фармацевтически приемлемые соли и сольваты, где: R1, R2, R9 и R10 независимо выбраны из водорода, галогена, трифторметила, дифторметокси, трифторметокси, азидо, -OR3, -C(O)R3, -C(O)OR3, -OC(O)R3 и C1-С10алкила, С3-С10циклоалкила, С3-С10циклоалкилалкила, где каждая алкильная и циклоалкильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из галогена, трифторметила, дифторметокси, трифторметокси; R3 выбран из водорода, трифторметила и C1-С10алкила, С3-С10циклоалкила, С3-С10циклоалкилалкила, где каждая алкильная и циклоалкильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из галогена, трифторметила, дифторметокси, трифторметокси, -C(O)R', -C(O)OR', -OC(O)R', -OR'; R' независимо выбран из водорода, низшего алкила; R4 независимо представляет собой водород или C1-С6алкил; R6 выбран из трифторметила или С1-С10алкила, С3-С10циклоалкила, где каждая алкильная, циклоалкильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из галогена, трифторметила, дифторметокси, трифторметокси, -C(O)R', -C(O)OR', -OC(O)R', -OR'; R7 выбран из C1-С10алкила, С3-С10циклоалкила, С3-С10циклоалкилалкила, где каждая алкильная и циклоалкильная часть возможно замещена группами в количестве от одной до пяти, независимо выбранными из галогена, трифторметила, дифторметокси, трифторметокси, -C(O)R3 , -C(O)OR3, -OC(O)R3, -SO2R6, -OR3, арила, гетероарила, арилалкила, гетероарилалкила, гетероциклила и гетероциклилалкила; W выбран из -C(O)OR3, -C(O)NR3R4, -C(O)NR4OR3, -C(O)R4OR3, -С(O)(С3-С10циклоалкил), -C(O)(C1-С10алкил). Также описываются композиции для ингибирования активности МЕК, применения таких соединений в изготовлении лекарства для ингибирования активности МЕК и в изготовлении лекарства для лечения рака. 7 н.п. и 10 з.п. ф-лы.
Формула
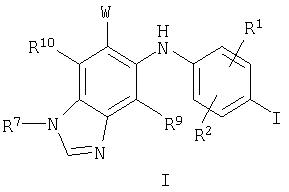
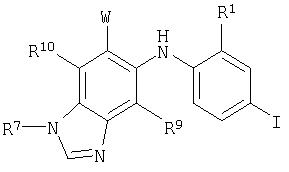
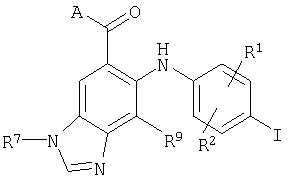
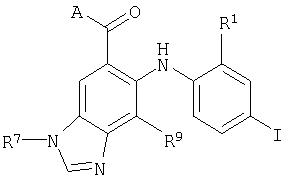

Комментарии