Замещенные фенилимидазолидины, способы их получения и фармацевтическая композиция, обладающая антиандрогенной активностью - RU2116298C1
Код документа: RU2116298C1
Чертежи

Описание
Настоящее изобретение распространяется на новые замещенные фенилимидазолидины, на метод их получения, на их применение в качестве медикаментов и на включающие их фармацевтические композиции.
В японской патентной заявке J 48087030 описываются 3-фенил 2- тиогидантоины, представленные в качестве ингибиторов прорастания некоторых растений.
Во французской патентной заявке N 2329276 описываются имидазолидины, о которых говорится, что они обладают антиандрогенной активностью. Вместе с тем, продукты указанного патента отличаются от продуктов настоящей патентной заявки.
Таким образом, предметом
настоящего
изобретения являются
продукты общей формулы (I):

в которой
R1 представляет собой цианильный или нитрорадикал или галогенный атом,
R2 представляет собой трифторметильный радикал или галогенный атом,
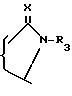
группа -A-B- выбрана среди радикалов

в которых
X представляет собой атом кислорода или серы, а R3 выбран среди следующих радикалов:
атома водорода,
радикалов, таких как алкильный, алкенильный, алкинильный, арильный или арилалкильный, включающих не более 12 атомов углерода, с возможностью замещения указанных радикалов одним или несколькими заменителями, выбранными среди таких радикалов, как гидроксильный, галогенный, меркапто, циано, ацильный или ацилоксильный, включающих не более 7 атомов углерода, арильный, O-арильный, O-аралкильный, S-арильный, в которых арильный радикал, включающий до 12 атомов углерода, может быть замещен, а атом серы может быть оксидирован с превращением в сульфоксид или сульфон, карбоксильный, свободный, превращенный в сложный эфир или в соль или амид, аминный, моно или диалкиламинный, или гетероциклический радикал, включающий от 3 до 6 атомов и включающий один или несколько гетероатомов, выбранных среди атомов серы, кислорода или азота; алкильный, алкенильный или алкинильный радикалы, которые могут быть, к тому же, прерваны одним или несколькими атомами кислорода, азота или серы с возможностью оксидирования с превращением в сульфоксид или сульфон, при этом арильный и аралкильный радикалы могут быть замещены галогенным атомом, радикалом, таким как алкильный, алкенильный или алкинильный, алкоксильный, алкенилоксильный, алкинилоксильный или трифторметильный,
триалкилсилильных радикалов, в которых линейный или разветвленный алкильный радикал включает не более 6 атомов углерода,
ацильных или ацилоксильных радикалов, включающих не более 7 атомов углерода,
Y представляет собой атом кислорода или серы или радикал =NH,
за исключением продуктов, в которых группа -A-B- представляет собой радикал:

в котором
X является атомом кислорода, R3 является атомом водорода, а Y представляет собой атом кислорода или радикал NH, R2 представляет собой галогенный атом или трифторметильный радикал, а R1 представляет собой нитрорадикал или галогенный атом.
Для определения R3, а также в нижеследующем использованные определения могут иметь следующие значения.
Под алкилом, включающим не более 12 атомов углерода, понимают, например, такие значения, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, втор-пентил, трет-пентил, нео-пентил, гексил, изогексил, втор-гексил, трет-гексил, гептил, октил, децил, ундецил, додецил, линейные или разветвленные.
Предпочтение отдается алкильным радикалам, включающим не более 6 атомов углерода, в частности таким радикалам, как метильный, этильный, пропильный, изопропильный, н-бутильный, изобутильный, трет- бутильный, пентильный, линейный или разветвленный, гексильный, линейный или разветвленный.
Под алкенилом, включающим не более 12 и предпочтительно 4 атома углерода, понимают, например, такие значения, как винил, аллил, 1-пропенил, бутенил, пентенил, гексенил.
Среди алкенильных значений предпочтение отдается аллилу и бутенилу.
Под алкинилом, включающим не более 12 и предпочтительно 4 атома углерода, понимают, например, такие значения, как этинил, пропаргил, бутинил, пентинил или гексинил.
Среди алкинильных значений предпочтение отдается пропаргилу.
Под арилом понимают карбоциклические арильные радикалы, такие как фенил или нафтил, или гетероциклические арилы с 5 или 6 атомами, включающие один или несколько гетероатомов, выбранных, в первую очередь, среди атомов кислорода, серы или азота. Среди гетероциклических арилов с 5 атомами можно назвать такие радикалы, как фурильный, тиенильный, пирролильный, тиазолильный, оксазолильный, имидазолильный, тиадиазолильный, пиразолильный, изоксазолильный.
Среди гетероциклических арилов с 6 атомами можно назвать такие радикалы, как пиридильный, пиримидинильный, пиридазинильный, пиразинильный.
Среди конденсированных арильных радикалов можно назвать такие радикалы, как индолильный, бензофуранильный, бензотиенильный, хинолинильный.
Предпочтение отдается фенильному радикалу.
Под арилалкилом понимают радикалы, полученные соединением вышеперечисленных алкильных радикалов, с возможностью замещения, и арильных радикалов, также перечисленных выше, с возможностью замещения.
Предпочтение отдается бензильному, фенилэтильному или трифенилметильному радикалам.
Под галогеном понимают, естественно, атомы фтора, хлора, брома или иода.
Предпочтение отдается атомам фтора, хлора или брома.
В качестве частных примеров алкильных радикалов, замещенных одним или несколькими галогенными атомами, можно назвать такие радикалы, как монофтор, хлор, бром или иодметил, дифтор, дихлор или дибромметил, трифторметил.
В качестве частных примеров замещенных арильных или аралкильных радикалов можно назвать радикалы, в которых фенильный радикал замещен атомом фтора или метоксильным или трифторметильным радикалом.
Под ацильным радикалом понимают, в первую очередь, радикал, включающий не более 7 атомов углерода, такой как ацетильный, пропионильный, бутирильный или бензоильный, однако он может также представлять собой валерильный, гексаноильный, акрилоильный, кротоноильный или карбамоильный радикал; можно также назвать и формильный радикал.
Под ацилоксильным радикалом понимают радикалы, в которых ацильные радикалы имеют вышеуказанное значение, а также, например, ацетоксильный или пропионилоксильный радикалы.
Под этерифицированным карбоксильным радикалом понимают, например, такие радикалы, как алкилоксикарбонильный, например, метоксикарбонильный, этоксикарбонильный, пропоксикарбонильный, бутильный или трет-бутилоксикарбонильный, циклобутилоксикарбонильный, циклопентилоксикарбонильный или циклогексилоксикарбонильный.
Можно также назвать радикалы, образованные с остатками легкорасщепляемых сложных эфиров, таких как метоксиметильный, этоксиметильный радикалы; ацилоксиалкильные радикалы, такие как пивалоилоксиметил, пивалоилоксиэтил, ацетоксиметил или ацетоксиэтил; алкилоксикарбонилоксиалкильные радикалы, такие как метоксикарбонилоксиметильный или метоксикарбонилоксиэтильный радикалы, изопропилоксикарбонилоксиметильный или изопропилоксикарбонилоксиэтильный радикалы.
Перечень подобных сложноэфирных радикалов можно найти, например, в патентной заявке ЕЭС ЕР N 0034536.
Под аминированными карбоксильными радикалами понимают радикалы

Среди радикалов

Радикал

Под карбоксильным радикалом, превращенным в соль, понимают соли, образованные, например, с помощью эквивалента натрия, калия, лития, кальция, магния или аммония. Можно также назвать соли, полученные с помощью органических оснований, таких как метиламин, пропиламин, триметиламин, диэтиламин, триэтиламин.
Предпочтение отдается соли натрия.
Под алкиламинным радикалом понимают такие радикалы, как метиламинный, этиламинный, пропиламинный или бутильный, линейный или разветвленный, аминный. Предпочтение отдается алкильным радикалам, включающим не более 4 атомов углерода, причем алкильные радикалы могут быть выбраны среди вышеперечисленных алкильных радикалов.
Под диалкиламинным радикалом понимают, например, диметиламинный, диэтиламинный, метилэтиламинный радикалы. Как и выше, предпочтение отдается алкильным радикалам, включающим не более 4 атомов углерода, выбранным в вышеприведенном перечне.
Под гетероциклическим радикалом, включающим один или несколько гетероатомов, понимают, например, насыщенные моноциклические и гетероциклические радикалы, такие как оксиранильный, оксоланильный, диоксоланильный, имидазолидинильный, пиразолидинильный, пиперидинный, пиперазинильный или морфолинильный.
Под алкильным, алкенильным или алкинильным радикалами, которые могут быть прерваны гетероатомом, выбранным среди атомов серы, кислорода или азота, понимают радикалы, включающие один или несколько из указанных атомов, с одинаковой или различной структурой. При этом указанные гетероатомы, разумеется, не могут располагаться в крайнем положении радикала. Назвать можно, например, алкоксиалкильные радикалы, такие как метоксиметильный, метоксиэтильный, метоксипропильный и метоксибутильный, или же алкоксиалкильные радикалы, такие как метоксиэтоксиметильный.
Под триалкилсилильным радикалом, в котором алкильный радикал включает не более 6 атомов углерода, понимают, например, такие радикалы, как триметилсилильный, триэтилсилильный, (1,1-диметилэтил) диметилсилильный.
Когда продукты формулы (I) включают аминный радикал, превращаемый в соль с помощью кислоты, само собой разумеется, что указанные соли кислот также являются предметом изобретения. Можно назвать соли, получаемые с помощью таких кислот, как, например, хлористоводородная и метансульфокислота.
Предметом настоящего изобретения являются, в частности,
продукты формулы (I), как определено выше, в которой Y представляет собой атом кислорода, за исключением продуктов, в которых группа
-A-B- представляет собой радикал:

в котором
X является атомом кислорода, R3 является атомом водорода, R2 представляет собой галогенный атом или трифторметильный радикал, а R1 представляет собой нитрорадикал или галогенный атом.
Среди указанных продуктов предметом настоящего изобретения, в
частности, являются те продукты, в которых группа -A-B представляет собой радикал:
в котором
X является атомом серы, а R3 имеет вышеуказанное значение.
Среди указанных продуктов предметом настоящего изобретения, в частности, являются те продукты, в которых R3 представляет собой атом водорода или алкильный радикал, включающий не более 4 атомов углерода с возможностью замещения гидроксильным или метоксильным радикалом.
Среди указанных продуктов предметом настоящего изобретения, в первую очередь, являются те продукты, в которых R1 представляет собой цианильный радикал или галогенный атом и, в частности, атом хлора.
Предметом настоящего изобретения также, в частности, являются продукты формулы (I), как
определено выше, в которой группа - А-В- представляет собой группу:

или группу:

в которой
R3 представляет собой алкильный или алкенильный радикал, включающий не более 6 атомов углерода, с возможностью замещения и прерывания одним или несколькими атомами кислорода или серы, с возможностью оксидирования, или R3 представляет собой аралкильный радикал, с возможностью замещения, или ацильный радикал или триалкилсилильный радикал.
Среди указанных продуктов предметом настоящего изобретения являются, в частности, продукты, в которых R3 представляет собой алкильный радикал, включающий не более 6 атомов углерода, с возможностью замещения галогенным атомом, гидроксильный радикал, карбоксильный радикал, свободный или превращенный в сложный эфир, гетероциклический радикал, O-аралкильный или S-арильный радикал, в котором арильный радикал может быть замещен одним или несколькими галогенными атомами или алкоксильными радикалами, а атом серы может быть оксидирован с превращением в сульфоксид или сульфон, и, в первую очередь, те из них, в которых R3 представляет собой алкильный радикал, включающий от 2 до 4 атомов углерода, замещенный атомом хлора или радикалом, таким как этоксикарбонильный, трет-бутоксикарбонильный или циклопентилоксикарбонильный, 4-фторфенилтионильный, с возможностью оксидирования с превращением в сульфоксид или сульфон, морфолинный, фенилметоксильный, трифенилметоксильный или метилсульфоноксильный.
Среди указанных продуктов предметом настоящего изобретения, в частности, также являются те продукты, в которых R3 представляет собой радикал, такой как ацетильный, бензоильный или (1,1- диметилэтил) диметилсилильный.
Предметом настоящего изобретения также являются продукты формулы (I),
как
определено выше, отвечающие формуле (I'):

в которой
R1, R2 и R3 имеют вышеуказанное значение, за исключением продуктов, в которых R1 представляет собой нитрорадикал, R2 представляет собой трифторметильный радикал, а R3 является атомом водорода.
Среди указанных продуктов предметом настоящего изобретения также являются продукты формулы (I), как определено выше, в которой R1 представляет собой нитрорадикал, а R3 является алкильным или алкенильным радикалом, включающим не более 4 атомов углерода, с возможностью замещения карбоксильным радикалом, свободным, превращенным в сложный эфир или в соль.
Среди предпочтительных продуктов
изобретения можно, в первую очередь, назвать продукты формулы (I), как определено выше, имеющие следующие
наименования:
- 4-[4,4-диметил 3-(2-гидроксиэтил) 5-оксо 2-тиоксо 1-имидазолидинил]
2-(трифторметил) бензонитрил,
- 4-(4,4-диметил 2,5-диоксо 3-(4-гидроксибутил) 1-имидазолидинил)
2-(трифторметил)
бензонитрил,
- 4-(4,4-диметил 3-(4-гидроксибутил) 5-оксо 2-тиоксо
1-имидазолидинил) 2-(трифторметил) бензонитрил,
- 3-(4-циано 3-(трифторметил) фенил) 5,5-диметил 2,
4-диоксо
1-имидазолидинбутановая кислота.
Предметом настоящего изобретения
является также способ получения продуктов общей формулы (I), как определено выше, отличающийся тем, что:
либо
в присутствии третичного основания проводят реакцию продукта формулы (II):

в которой
R1, R2 и X имеют вышеуказанное значение, с продуктом формулы (III):

в которой
R'3 имеет значения, указанные выше для R3, где возможные функциональные группы могут быть защищены, и, с учетом того, что R1 является нитрорадикалом или галогенным атомом, если R2 представляет собой галогенный атом или радикал CF3, а X представляет собой атом кислорода, R'3 не может являться атомом водорода, для получения продукта формулы (IV):

в которой
R1, R2, X и R'3 имеют вышеуказанное значение, причем при желании и в случае необходимости продукты формулы (IV) подвергают одной или нескольким из следующих реакций, в произвольном порядке:
а) реакции выделения возможных защитных групп, которые могут быть включены в R'3;
б) реакции гидролиза группы >C=NH с превращением в кетоновую группу и с возможностью превращения группы >C=S в группу >C=O;
в) реакции превращения группы (групп) >C=O в группу >C=S;
г) воздействию на продукты формулы (IV), в которой R'3 представляет собой атом водорода и после гидролиза группы >C=NH с превращением в кетоновую группу, реактивом формулы Hal-R''3, в которой R''3 имеет значения R'3 за исключением водорода, а Hal является галогенным атомом, для получения продуктов формулы (I), в которой группа -A-B- представляет собой группу

в которых
R''3 имеет вышеуказанное значение, и, при желании, воздействию на указанные продукты выделителем возможных защитных групп, которые могут быть включены в R''3 или, при необходимости, воздействию агентом этерификации, аминирования или солеобразования,
либо в присутствии третичного основания проводят реакцию продукта формулы (II):

в которой
R1, R2 и X имеют вышеуказанное значение, с продуктом формулы (III'):

в которой
R'3 имеет значение, указанное выше, а Q представляет собой либо атом щелочного металла, например натрия, либо алкильный радикал, включающий от 1 до 6 атомов углерода, для получения продукта формулы (IVa):

в которой
X, R1, R2 и R3 имеют вышеуказанное значение, причем при желании его подвергают одной или нескольким из следующих реакций, в произвольном порядке:
а) реакции выделения возможных защитных групп, которые могут быть включены в R'3;
б) реакции превращения группы (групп) >C=O в группу >C=S или, при необходимости, группы >C=S в группу >C=O;
в) воздействию на продукты формулы (IVa), в которой R'3 представляет собой атом водорода, реактивом формулы Hal-R''3, в которой R''3 имеет значения R'3, за исключением водорода, а Hal является галогенным атомом, для получения продуктов формулы (I), в которой группа -A-B- представляет собой группу

в которых
R''3 имеет вышеуказанное значение, и, при желании, воздействию на указанные продукты выделителем возможных защитных групп, которые могут быть включены в R''3 или, при необходимости, воздействию агентом этерификации, аминирования или солеобразования,
либо проводят взаимодействие соединения формулы Hal-R''3, в которой Hal и R''3 имеют указанные ранее значения, с продуктом формулы (IV'):

для получения продукта формулы (IV''):

который при желании и в случае необходимости подвергают одной или нескольким из следующих реакций, в произвольном порядке:
а) реакции выделения возможных защитных групп, которые могут быть включены в R''3, и, при необходимости, воздействию агентом этерификации, аминирования или солеобразования;
б) реакции превращения группы (групп) >C=O в группу > C=S.
Реакция продуктов формулы (II) с продуктами формулы (III) производится, главным образом, в органическом растворителе, таком как тетрагидрофуран или дихлорэтан, однако использовать можно также этиловый эфир или простой изопропиловый эфир.
Операция производится в присутствии третичного основания, такого как триэтиламин или же пиридин или метилэтилпиридин.
Возможные функциональные группы, которые может включать R3 и которые могут быть защищены в продукте формулы (III), (IVa) или (IV''), являются гидроксильными или аминными функциональными группами. Для защиты указанных функциональных групп используются обычные защитные группы. В качестве примера можно назвать следующие защитные группы аминного радикала: трет-бутил, трет-амил, трихлорацетил, хлорацетил, бензогидрил, тритил, формил, бензилоксикарбонил.
В качестве защитной группы гидроксильного радикала можно назвать такие радикалы, как формил, хлорацетил, тетрагидропиранил, триметилсилил, трет-бутилдиметилсилил.
Само собой разумеется, что вышеприведенный перечень не является исчерпывающим и что возможно использование и других защитных групп, известных в химии пептидов. Перечень подобных защитных групп приводится, например, во французской патентной заявке BF N 2499995, содержание которой включено в настоящую заявку в качестве ссылки.
Возможные реакции выделения защитных групп производятся как описано в указанной патентной заявке BF N 2499995. Предпочтительным методом выделения является кислый гидролиз с использованием таких кислот, как хлористоводородная кислота, бензолсульфокислота или паратолуолсульфокислота, муравьиная или трифторуксусная кислота. Предпочтение отдается хлористоводородной кислоте.
Возможная реакция гидролиза группы >C=NH с образованием кетоновой группы также в первую очередь производится с помощью такой кислоты, как, например, водосодержащая хлористоводородная кислота при температуре кипения.
Когда гидролиз группы >C=NH с образованием кетоновой группы производится на молекуле, включающей также группу >C=S, эта группа может быть превращена в группу >C=O. Свободный радикал OH, который может содержать R3, может быть превращен в этом случае в радикал SH.
Реакция превращения группы (групп) >C=O в группу >C=S производится с помощью реактива,
называемого реактивом Лауссона и имеющего следующую формулу:

Этот продукт выпускается, например, фирмой "ФЛУКА", а его использование описывается, например, в журнале Bull. Soc. Chim. Belg., т.87, N 3 (1987), с. 229.
Когда требуется превратить две функциональные группы >C=O в две группы >C=S, операция производится при избыточном количестве реактива Лауссона. Это распространяется и на тот случай, когда в основе имеется молекула, включающая одну функциональную группу >C=S и одну функциональную группу >C=O, и указанную группу > C=O требуется превратить в группу >C=S.
Вместе с тем, когда в основе имеется молекула, включающая две функциональные группы >C= O, а требуется получить продукт, включающий лишь одну функциональную группу, операция производится при недостатке реактива Лауссона. В этом случае получают, как правило, смесь трех продуктов: каждого из двух продуктов, содержащих одну функциональную группу >C=O и одну функциональную группу >C= S, и продукта, включающего две группы >C=S. Затем эти продукты могут быть выделены с применением обычных методов, таких как хроматография.
Воздействие на продукты формул (IV), (IVa ) или (IV') реактивом формулы Hal-R''3 производится в присутствии сильного основания, такого как гидрид натрия или калия. При этом может производиться реакция переноса фазы в присутствии солей четвертичного аммония, таких как трет-бутиламмоний.
Если защитной группой, которую может включать заменитель R''3, является, например, одна из групп, указанных ранее для R3, то реакции выделения защитных групп производятся в условиях, описанных выше.
Пример выделения трет-бутилдиметилсилильной группы с помощью хлористоводородной кислоты приводится ниже, в примерах.
Возможное превращение в сложный эфир продуктов формулы (I), в которой R''3 включает свободный радикал OH, производится в обычных условиях. Использовать можно, например, кислоту или функциональное производное, например ангидрид, такой как уксусный ангидрид, в присутствии основания, такого как пиридин.
Возможное превращение в сложный эфир или в соль продуктов формулы (I), в которой R''3 представляет собой группу COOH, производится в обычных условиях, известных специалистам.
Возможное аминирование продуктов формулы (I), в которой R''3 включает радикал COOH, производится в обычных условиях. Использовать можно первичный или вторичный амин в присутствии функционального производного кислоты, например, симметрического или смешанного ангидрида.
Предметом настоящего изобретения
также является метод получения продуктов формулы (I''):
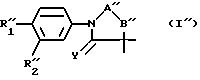
в которой
R''1, R''2, -A''-B''- имеют значения, указанные выше для R1, R2 и -A-B-, с учетом того, что, когда -A''-B''- представляет собой группу -CO-N(R'''3)-, в которой R'''3 представляет собой атом водорода или линейный или разветвленный алкильный радикал, включающий не более 7 атомов углерода, Y является атомом кислорода, R''1 представляет собой цианильный радикал, причем данный метод отличается тем, что продукт формулы (V):

в которой
R''1 и R''2 имеют вышеуказанные значения, а Hal представляет собой галогенный атом, вводится в реакцию с продуктом формулы (VI):

в которой -A''-B''- и Y имеют вышеуказанное значение, причем данная реакция производится в присутствии катализатора и, возможно, растворителя.
Что же касается продуктов формулы (V), то термин Hal обозначает, в первую очередь, атом хлора, но может также обозначать атом брома или иода.
Ролью катализатора по всей вероятности является улавливание выделяющегося галогенида водорода, способствуя, таким образом, реакции конденсации продукта формулы (V) с продуктом формулы (VI) для получения целевого продукта.
Предметом настоящего изобретения является, в частности, вышеописанный метод, в котором катализатором является металл в чистом виде или в оксидированной форме или основание.
В качестве катализатора может быть использован металл в чистом виде, в форме окиси металла или же в форме солей металла. Катализатором также может быть основание. Когда в качестве катализатора используется металл, то этим металлом может быть медь или никель.
Солями металлов могут быть хлорид или ацетат.
Когда катализатором является основание, этим основанием может быть, например, гидроксид натрия или гидроксид калия, при этом в реакционную среду, при желании, может быть добавлен диметилсульфоксид.
Предметом настоящего изобретения, в частности, является вышеописанный метод, в котором роль катализатора может играть окисел одновалентной или двухвалентной меди, медь в чистом виде или основание, такое как гидроксид натрия или гидроксид калия.
При использовании в качестве катализатора металлической меди ее предпочтительнее использовать в форме порошка.
Предметом настоящего изобретения, в частности, является вышеописанный способ, в котором в качестве катализатора используется окисел, содержащий одновалентную медь.
Используемый растворитель выбирается, в первую очередь, среди эфиров с высокой температурой кипения, таких как, например, дифениловый эфир, диглим, триглим и диметилсульфоксид, однако использовать можно также, например, масло с высокой температурой кипения, такое как парафин или вазелин.
Предметом настоящего изобретения, в частности, является вышеописанный способ, отличающийся тем, что процесс протекает в присутствии растворителя эфирного типа, такого как дифениловый эфир, диглим, триглим и диметилсульфоксид.
Предметом изобретения, в первую очередь, является описанный выше способ, в котором в качестве растворителя используется дифениловый эфир или триглим.
Описанный выше способ получения целевого продукта может протекать под давлением или при атмосферном давлении, желательно при повышенной температуре.
Таким образом, предметом изобретения является описанный выше метод, отличающийся тем, что реакция протекает при температуре выше 100oC, причем желательно, чтобы эта температура превышала 150oC.
Более конкретно, предметом настоящего изобретения является описанный выше способ, отличающийся тем, что реакция продолжается более 2 ч.
Конкретным предметом настоящего изобретения является описанный выше способ, отличающийся тем, что реакция протекает в присутствии окисла, содержащего одновалентную медь, в триглиме, при температуре, равной или превышающей 200oC, и в течение более 3 ч.
Продукты, являющиеся предметом настоящего изобретения, обладают интересными фармакологическими свойствами; замечено, в частности, что они тормозят действие андрогенных гормонов на периферийные рецепторы.
Тесты, описанные в экспериментальной части, иллюстрируют указанную антиандрогенную активность.
В связи с указанными антиандрогенными свойствами продукты, являющиеся предметом настоящего изобретения, могут использоваться в терапии взрослых без риска некоторых эффектов химической кастрации.
Указанные свойства позволяют использовать продукты общей формулы (I) настоящего изобретения в качестве медикаментов для лечения аденом и новообразований простаты, а также лечения доброкачественной гипертрофии простаты.
Указанные свойства позволяют также использовать продукты общей формулы (I) настоящего изобретения при лечении доброкачественных и злокачественных опухолей, клетки которых содержат, в частности, андрогенные рецепторы. Речь идет, в первую очередь, о раке грудной железы, головного мозга, кожи и женских половых желез, но также и о раке мочевого пузыря, лимфатической системы, почек, печени.
Продукты общей формулы (I) настоящего изобретения могут также использоваться при лечении угрей, себореи, андрогенного облысения, чрезмерного волосяного покрова или гирсутизма.
Таким образом, продукты формулы (I) находят применение в дерматологии, причем они могут использоваться как самостоятельно, так и в сочетании с другими средствами. В частности, они могут сочетаться с антибиотиком, таким как производные азелаиновой кислоты, фузидиевой кислоты, эритромицин, или с производным ретиноидов для лечения угрей, или с ингибитором 5α -редуктаза, таким как ( 5α,17β )-1,1- диметилэтил 3-оксо 4-аза-андрост-1-ен 17-карбоксамид (или Финастерид Мерк, 11-е изд.) или азелаиновая кислота или агент блокировки андрогенных рецепторов для лечения угрей, облысения или гирсутизма, или со стимулятором роста волос, таким как Миноксидил, для лечения облысения.
Продукты формулы (I) могут также применяться в ветеринарной области.
Продукты формулы (I) в виде радиоактивных препаратов могут также использоваться в диагностике, в качестве специальных меток андрогенных рецепторов. В качестве радиоактивных продуктов можно использовать, например, продукты, меченные тритием, углеродом-14 или иодом-125.
Таким образом, предметом данного изобретения является употребление в качестве медикаментов продуктов общей формулы (I), приемлемых с фармацевтической точки зрения.
Предметом настоящего изобретения является, в
частности, использование в качестве медикаментов продуктов, имеющих следующие наименования:
- 4-[4,4-диметил 3-(2-гидроксиэтил) 5-оксо
2-тиоксо 1-имидазолидинил] 2-(трифторметил)
бензонитрил,
- 4-(4,4- диметил 2,5-диоксо 3-(4-гидроксибутил) 1-имидазолидинил) 2-(трифторметил) бензонитрил,
- 4-(4,4-диметил
3-(4-гидроксибутил) 5-оксо 2-тиоксо 1-имидазолидинил)
2-(трифторметил) бензонитрил,
- 3-(4-циано 3-(трифторметил) фенил) 5,5-диметил 2,4-диоксо 1-имидазолидинбутановая кислота.
Указанные продукты могут применяться внутрь, парентеральным, перлингвальным, ректальным или местным путем.
Предметом изобретения также являются фармацевтические составы, отличающиеся тем, что они включают в качестве действующего начала как минимум одно из соединений общей формулы (I).
Указанные составы могут иметь форму растворов или взвесей для инъекций, таблеток, простых или дражевидных, капсул, микстур, суппозиториев, кремов, мазей и лосьонов; они производятся обычными методами. Действующее начало вводится в основы, обычно используемые при изготовлении указанных составов, такие как водные и безводные связующие, тальк, аравийская камедь, лактоза, амидон, стеарат магния, какао-масло, жиры животного или растительного происхождения, производные парафина, гликоли, различные увлажняющие, диспергирующие или эмульсионные агенты, консерванты.
Обычно применяемые дозы могут, в зависимости от особенностей больного и от заболевания, составлять от 10 до 500 мг в день для человека при приеме внутрь.
Исходные продукты формулы (II) настоящего изобретения могут быть приготовлены за счет воздействия
фосгена, когда X представляет
собой атом
кислорода, или тиофосгена, когда X является атомом серы, на соответствующий амин формулы (A):

Пример подобного приготовления приводится далее, в экспериментальной части. Продукт данного типа описан также во французском патенте BF N 2329276.
Амины формулы (A) описываются в патенте ЕЭС EP N 0002892 и во французском патенте BF N 2142804.
Продукты формулы (III) или (III') известны или могут быть получены на основе соответствующего циангидрина по методу, описанному в журнале J. Am. Chem. Soc. (1953 г.), 75, 4841.
Продукты формулы (III), в которых R'3 не является атомом водорода, могут быть получены путем воздействия продукта формулы R''3-Hal на 2-циано 2-аминопропан в условиях, описанных выше для воздействия R''3 Hal на продукты формулы (IV). Пример приготовления этого типа описан в статье Jilek и др. Collect. Czech. Chem. Comm. 54(8), 2248 (1989).
Продукты формулы (IV') описаны во французском патенте BF N 2329276.
Исходные продукты формул (V) и (VI), в отношении которых применяется метод, являющийся предметом изобретения, для получения продуктов формулы (l), известны и встречаются в торговой сети, но могут быть приготовлены с использованием общепринятых у специалистов методов.
Приготовление продуктов формулы (VI) описано, в частности, в следующих статьях:
- Журнал прикладной химии. 28, 969-75
(1955 г.) (CA 50,
4881 a, 1956 г. );
- Tetrahedron 43, 1753 (1987 г.);
- Журнал J. Org. Chem. 52, 2407 (1987 г.);
- Журнал
органической химии. 21. 2006 (1985 г.);
- Журнал J.
Fluor. Chem. 17, 345 (1981 г.);
или в патентах:
- немецком патенте DRP N 637.318 (1935 г.);
- патенте ЕЭС ЕР N
0130875;
- японском патенте JP N
81121524.
Продукты формулы (VI), являющиеся производными гидантоина, широко используются и цитируются в различных статьях и патентах,
например:
- Журнал J. Pharm. Pharmacol.
67, том 19(4),
стр. 209-16 (1967 г.);
- Химико-фармацевтический журнал, 67, т.1(5), с.51-2;
- немецкий патент N 2217914;
- патент ЕЭС EP N 0091596;
- Журнал J.
Chem. Soc.
Perkin. Trans. 1, c. 219-21 (1974 г.).
Предметом настоящего изобретения, в качестве новых промышленных продуктов и, в
частности, в качестве новых промышленных продуктов,
используемых как промежуточные продукты, необходимые для получения продуктов общей формулы (I), являются продукты формулы (IVi):

в которой
R1, R2 и Y имеют указанные выше значения, а группа:

выбрана среди радикалов:

в которых
X представляет собой атом кислорода или серы, а R3i выбран среди значений R3, включающих защищенную функциональную группу.
Среди защищенных функциональных групп можно назвать гидроксильную и аминную группы. Указанные функциональные группы могут быть защищены, как указано выше для заменителя R3.
Пример 1. 4-(4, 4-диметил 2,5-диоксо 3-(4-гидроксибутил) 1-имидазолидинил) 2-(трифторметил) бензонитрил).
а) Конденсация.
В суспензию 104 мг гидрида натрия в 0,8 см3 диметилформамида добавляют 600 мг 4- (4,4-диметил-2,5-диоксо-1-имидазолидинил) -2-(трифторметил)- бензонитрила, полученного как в примере 8 патентной заявки ЕЭС N 0494819, в 5 см3 диметилформамида, поддерживая температуру ниже +20oC. После 10-минутного взбалтывания добавляют 445 мг 4-хлор-трет-бутилдиметилсилилэфира и 300 мг иодида натрия. Затем нагревают в течение 16 ч при температуре +50oC, охлаждают при комнатной температуре, добавляют 87 мг гидрида натрия и снова 400 мг хлорированного эфира и 267 мг гидрида натрия и нагревают дополнительно еще в течение 1 ч. После этого охлаждают до комнатной температуры, вливают в 60 см3 воды, содержащей 600 мг первичного фосфата калия. Затем экстрагируют с использованием эфира, промывают органическую фазу водой, высушивают и выпаривают растворитель. Остаток подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (99 : 1)) и получают 526 мг продукта, используемого без дополнительной обработки на следующей стадии расщепления.
Полученный выше продукт смешивают с 5 см3 метанола и 1,5 см3 2 н. хлористоводородной кислоты. Затем взбалтывают в течение 40 мин при комнатной температуре, вливают в 30 см3 воды, экстрагируют с использованием метиленхлорида, промывают органическую фазу водой, высушивают и выпаривают растворитель. После хроматографии остатка на двуокиси кремния (элюант : метиленхлорид-ацетон (9 : 1)) выделяют фракцию Rf = 0,15, а после рекристаллизации из простого изопропилового эфира получают 307 мг целевого продукта (tпл = 102- 103oC).
Химический состав C17H18F3N3O3 = 369,35.
расчетный, %: C 55,28; H 4,91; F 15,43; N 11,38;
полученный, %: C 55,2; H 4,9; F 15,3; N 11,1.
Инфракрасный спектр - CHCl3
OH
- 3628 см-1
C≡N - 2236 см-1
C=O - 1778-1724 см-1
Ароматические соединения - 1615-1575-1505 см-1
Получение
4-хлор-трет-бутилдиметилсилилэфира, используемого на начальном этапе примера 1.
При взбалтывании смешивают 9,9 см3 4-хлор-1-бутанола и 24,3 г имидазола с 50 см3 тетрагидрофурана. Затем при температуре ниже +20oC добавляют капельным способом 2,82 г трет- бутилдиметилсилилхлорида в 20 см3 тетрагидрофурана, взбалтывают в течение 18 ч. при комнатной температуре, центрифугируют, промывают тетрагидрофураном и удаляют растворитель при пониженном давлении. Остаток очищают методом хроматографии на двуокиси кремния (элюант : циклогексан-этилацетат (95 : 5)) и получают 17,5 г целевого продукта.
Пример 2. 3-(4-циано 3-(трифторметил) фенил) 5,5- диметил 2,4-диоксо 1-имидазолидинацетат (1,1-диметил) этила.
В суспензию 78 мг гидрида натрия на 50% в масле и 0,5 см3 диметилформамида добавляют 450 мг продукта, полученного в примере 8 патентной заявки ЕЭС N 0494819, растворенного в 4 см3 диметилформамида. Затем взбалтывают в течение 15 мин и медленно добавляют при температуре, не превышающей +30oC, 0,22 см3 трет- бутилбромацетата. После этого взбалтывают в течение 16 ч, вливают в 50 г смеси воды и льда (1 : 1), добавляют 0,5 г первичного фосфата калия и экстрагируют с использованием эфира. Органическую фазу промывают водой, высушивают и выпаривают досуха, в результате чего получают 1,1 г сырого продукта, который подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (99 : 1)). Таким образом получают 425 мг целевого продукта (tпл = 122-123oC, Rf = 0,28). Элюант : метиленхлорид-ацетон (99 : 1).
Инфракрасный спектр - CHCl3
C=O - 1788-1729 см-1 (гидантоин) 1745 см-1 (сложный эфир)
C≡N - 2235 см-1
Ароматические соединения - 1616-1505 см-1
Ультрафиолетовый спектр
- EtOH
Макс. 258 н.м - ε = 16100
Перег. 277 н.м - ε = 6000
Перег. 285 н.м - ε = 3000
Пример 3. 3-(4-циано
3-(трифторметил) фенил) 5,5-диметил 2,
4-диоксо 1- имидазолидинацетат циклопентила.
Раствор 355 мг продукта, полученного в примере 9 патентной заявки ЕЭС N 0494819, 49 мг 4-диметиламинопиридина, 130 мг циклопентанола в 6,5 см3 метиленхлорида охлаждают до -10oC, после чего в него добавляют 226 мг дициклогексилкарбодиимида в 2 см3 метиленхлорида. Затем температуре раствора дают подняться до комнатной, взбалтывают в течение 25 мин, нагревают в течение 2 ч при температуре кипения, доводят до комнатной температуры, фильтруют и выпаривают растворитель.
После этого остаток подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (99 : 1)) и получают 281 мг целевого продукта.
Rf = 0,25 (элюант : метиленхлорид-ацетон (99 : 1)).
Инфракрасный спектр - CHCl3
C=O - 1786-1729 см-1 (гидантоин) - 1748 см-1
(сложный эфир)
C≡N - 2235 см-1
Ароматические соединения - 1615-1602-1576-1505 см-1
Ультрафиолетовый спектр - EtOH
Макс. 258 н.м
- ε = 16800
Перег. 276 н.м - ε = 5800
Перег. 286 н.м - ε = 3000
Пример 4. 3-(4-циано 3-(трифторметил) фенил) 5,5-диметил 2,4-диоксо
1- имидазолидинбутират этила.
Операции выполняются как в примере 2 с использованием на начальном этапе продукта, полученного в примере 8 патентной заявки ЕЭС N 0494819, и этил-4-бромбутирата. В результате получают целевой продукт (tпл = 66-67o C).
Rf = 0,16 (элюант : метиленхлорид-ацетон (99 : 1)).
Инфракрасный
спектр - CHCl3
C=O - 1770-1726 см-1
C≡N - 2235
см-1
Ароматические соединения - 1616-1576-1505 см-1
Ультрафиолетовый спектр - EtOH
Макс. 260 н.м - ε = 15500
Перег. 277 н.м - ε
= 7000
Перег.286 н.м - ε = 3600
Пример 5. 3-(4-циано
3-(трифторметил) фенил) 5,5-диметил 2,4-диоксо 1-имидазолидинбутановая кислота.
В течение 3 ч при комнатной температуре взбалтывают 1 г продукта, полученного в примере 4, в 20 см3 метанола в присутствии 3 см3 2 н. едкого натра. Затем вливают в 20 см3 воды, подкисляют 7 см3 1 н. хлористоводородной кислоты до pH 1, экстрагируют с использованием эфира, промывают водой, высушивают и удаляют растворители при пониженном давлении. В результате получают 863 мг сырого продукта (tпл. = 179-180oC), который подвергают очистке методом хроматографии на двуокиси кремния (элюант : метиленхлорид-метанол (92,5 : 7,5)). После рекристаллизации из изопропанола получают 614 мг целевого продукта (tпл. = 184-185oC).
Rf = 0,25 (элюант : метиленхлорид-метанол (92,5 : 7,5)).
Инфракрасный спектр - Вазелиновое масло
C=O
- 1770-1753-1735-1712-1690-1645
см-1
C≡N - 2230 см-1
Ароматические соединения - 1613-1587-1533-1502
см-1
Пример 6. (3-(4-циано
3-(трифторметил) фенил) 5,5-диметил 2,
4-диоксо 1-имидазолидинбутират (1,1-диметил) этила.
Путем этерификации продукта, полученного в примере 5, с помощью трет-бутанола, в присутствии дициклогексилкарбодиимида и диметиламинопиридина, как указано в примере 3, получают целевой продукт (tпл. = 96-97oC).
Rf = 0,32 (элюант : метиленхлорид-ацетон (98 : 2)).
Инфракрасный спектр - CHCl3
C=O - 1779-1725 см-1
C≡N - 2235 см-1
Ароматические
соединения - 1616-1576-1505 см-1
Ультрафиолетовый спектр - EtOH
Макс. 261 н.м - ε = 15600
Перег. 276 н.м - ε =
7800
Перег. 286 н.м
- ε = 3700
Пример 7. 3-(4-циано
3-(трифторметил) фенил) 5,5-диметил 2,4- диоксо 1-имидазолидинбутират циклопентила.
Выполняя операции, как в примере 6, с использованием циклопентанола, получают целевой продукт (tпл. = 85-86oC).
Rf=0,33 (элюант : метиленхлорид-ацетон (98 : 2)).
Инфракрасный
спектр - CHCl3>
C=O - 1779-1728
см-1
C≡N - 2236 см-1
Ароматические соединения - 1616-1578-1505 см-1
Ультрафиолетовый спектр - EtOH
Макс. 261 н.м - ε
= 16000
Перег. 277 н.м - ε = 7600
Перег. 286 н.м - ε = 3700
Пример 8. 4-(4,4-диметил 2,
5-диоксо 3- (2-((4-фторфенил) тио) этил) 1-имидазолидинил
2-(трифторметил) бензонитрил.
а) Образование фенолята
В суспензию 80 мг гидрида натрия в 0,5 см3
диметилформамида добавляют при температуре ниже +28oC
0,16 см3 4-фтортиофенола в 1,6 см3 диметилформамида и выдерживают раствор, при взбалтывании, в течение 10
мин.
б) Замещение
В раствор, полученный на
предыдущем этапе, добавляют 548 мг 4-[4,4-диметил 2,5-диоксо 3-(2-хлорэтил) 1- имидазолидинил] 2-(трифторметил) бензонитрила,
полученного,
как указано в примере 50 патентной заявки ЕЭС N 0494819,
растворенного в 4 см3 диметилформамида, взбалтывают в течение 2 ч, вливают в 50 см3 воды, содержащей 0,5 г
первичного
фосфата калия, и экстрагируют с использованием эфира. Затем
органическую фазу промывают водой, высушивают и выпаривают растворитель. Остаток подвергают хроматографии на двуокиси кремния
(элюант :
циклогексан-этилацетат (75 : 25)) и получают 570 мг целевого
продукта (tпл. = 93-94oC).
Rf=0,33 (элюант : циклогексан-этилацетат (75 : 25)).
Инфракрасный спектр - CHCl3
C=O - 1780-1726
см-1
C≡N - 2238 см-1
Ароматические соединения - 1616-1579-1506 см-1
(Фторфенил) тио - 1591-1492 см-1
Ультрафиолетовый спектр - EtOH
Макс. 254 н.м - ε = 18600
Перег. 277 н.м - ε = 7500
Перег. 286 н.м
- ε = 4200
Пример 9. (4-(4,4-диметил 2,
5-диоксо 3-(2-((4-фторфенил) сульфонил) этил) 1-имидазолидинил 2- (трифторметил) бензонитрил.
При температуре ниже +29oC 1,21 г метахлорнадбензойной кислоты в 24 см3 метиленхлорида добавляют капельным способом в 222 мг продукта, полученного в примере 8, в 4,4 см3 метиленхлорида. После 30-минутного взбалтывания вливают в 30 см3 тиосульфата натрия (0,5 М/л), взбалтывают в течение 10 мин, отстаивают и экстрагируют с использованием метиленхлорида. После этого органическую фазу промывают насыщенным водным раствором бикарбоната натрия, а затем водой, высушивают и выпаривают растворитель. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан- этилацетат (1 : 1)) и получают 220 мг продукта, который подвергают кристаллизации из изопропанола. Таким образом получают 196 мг целевого продукта (tпл. = 155-156o C).
Rf=0,22 (элюант : этилацетат-циклогексан (1 : 1)).
Инфракрасный спектр - CHCl3
C=O - 1783-1727 см-1
C≡N - 2236
см-1
Ароматические соединения
- 1615- 1593-1505-1497 см-1
SO2 - 1314-1150 см-1
Ультрафиолетовый спектр
- EtOH
Макс. 258
н.м - ε = 16700
Перег. 286 н.м
Пример 10. 4-(4,4-диметил 2,5-диоксо 3-(2-((4-фторфенил) сульфинил) этил) 1-имидазолидинил 2-(трифторметил)
бензонитрил.
В течение 30 мин при комнатной температуре взбалтывают 222 мг продукта, полученного в примере 8, в 15 см3 метанола в присутствии 5 см3 водного раствора метапериодата натрия (0,1 М/л). Затем полученную суспензию нагревают в течение 1 ч при температуре +40oC, добавляют 10 см3 метанола и 5 см3 окисляющего раствора.
После этого метанол выпаривают, добавляют 10 см3 насыщенного раствора хлорида натрия и экстрагируют с использованием этилацетата. Затем органическую фазу промывают соленой водой, высушивают и выпаривают растворитель. После хроматографии остатка на двуокиси кремния (элюант : метиленхлорид-ацетон (9 : 1)) получают 205 мг продукта, который подвергают кристаллизации из изопропанола, в результате чего получают 180 мг целевого продукта (tпл.= 145-146oC).
Rf=0,10 (элюант : метиленхлорид-ацетон (9 : 1)).
Инфракрасный спектр
- CHCl3
C=O - 1782-1727 см-1
C≡N - 2236 см-1
Ароматические соединения - 1615-1592-1505- 1493 см-1
Ультрафиолетовый спектр - EtOH
Макс. 258 н.м - ε = 17600
Перег. 285 н.м
Выполняя операции, как указано в предыдущих примерах, с использованием 4-(4,
4-диметил 2,
5-диоксо 1- имидазолидинил) 2-трифторметил) бензонитрила, полученного, как
описано в примере 8 патентной заявки ЕЭС N 0494819, и соответствующих реактивов, были получены соединения
следующих
примеров.
Пример 11. (4-(4,4-диметил 2,5-диоксо 3-((3-метоксифенил) метил) 1- имидазолидинил 2-(трифторметил) бензонитрил.
tпл.. = 88-89oC
Rf=0,21 (элюант: циклогексан-этилацетат (7: 3)),
Инфракрасный спектр - CHCl3
C=O - 1779-1724 см-1
C≡N - 2238 см-1
Ароматические соединения - 1614-1602-1588-1575- 1504-1491 см-1
Ультрафиолетовый спектр - EtOH
Макс. 260 н.м - ε = 16800
Перег. 210 н.м
- ε =
28500
Перег. 280 н.м - ε = 8900
Пример 12.
4-(4,4-диметил 2,5-диоксо 3-(2-(4-морфолинил) этил) 1- имидазолидинил 2-(трифторметил) бензонитрил.
Rf = 0,20 (элюант : метиленхлорид-ацетон (70 : 30)).
Инфракрасный
спектр - CHCl3
C=O - 1779-1725 см-1
C≡N - 2235 см-1
Ароматические соединения - 1616- 1576-1505 см-1
Морфолинил
- 1117 см-1
Ультрафиолетовый спектр - EtOH
Макс. 261 н.м - ε = 14000
Перег.
277 н.м - ε = 6900
Перег. 286 н.м - ε = 3600
Пример 13. 4-(4,4-диметил 3-(2- гидроксиэтил) 5-имино 2-тиоксо 1-имидазолидинил) 2-(трифторметил) бензонитрил.
а) Получение изотиоцианата
В раствор 22 см3
дистиллированной воды и 1 см3 тиофосгена медленно добавляют 2,23 г 1- трифторметил-4-аминобензонитрила
(полученного как описано в патенте ЕЭС N 0002892), взбалтывают в течение 1 ч,
экстрагируют с использованием хлороформа, промывают соленой водой, высушивают и выпаривают досуха при пониженном
давлении.
В результате получают 3 г продукта, используемого без дополнительной
обработки для получения имина.
б) Получение имина
При комнатной температуре смешивают 5 г
изотиоцианата,
полученного на предыдущем этапе, с 37 см3
тетрагидрофурана в присутствии 1,5 см3 триэтиламина и добавляют в один прием 2,8 г 2-[(2-гидроксиэтил) амино]
2-метилпропаннитрила,
полученного, как описано в приготовлении примера 22
патентной заявки ЕЭС N 0494819, растворенного в 10 см3 тетрагидрофурана. При этом температура самопроизвольно
повышается до +34oC. Затем раствор охлаждают до комнатной
температуры, взбалтывая его в течение 1 ч, выпаривают растворитель и хроматографируют остаток на двуокиси кремния (элюант :
метиленхлорид-метанол (7 :
3)).
Таким образом, после кристаллизации из изопропанола получают 5,87 г целевого продукта (tпл. = 181oC).
Пример 14. 4-(4,4-диметил 3-(2-гидроксиэтил) 5-оксо 2-тиоксо 1-имидазолидинил) 2- (трифторметил) бензонитрил.
В течение 1 ч при температуре кипения нагревают 4,6 г продукта, полученного в примере 13, в 65 см3 метанола в присутствии 10 см3 2 н. хлористоводородной кислоты. Затем охлаждают при комнатной температуре и вливают в 300 см3 ледяной воды. После этого экстрагируют с использованием этилацетата, промывают органическую фазу соленой водой, высушивают и выпаривают растворитель. После хроматографии остатка на двуокиси кремния (элюант : этилацетат-циклогексан (1 : 1)) собирают фракции Rf = 0,14 и после кристаллизации из метиленхлорида и циклогексана получают 4,37 г целевого продукта (tпл. = 130oC).
Химический состав: C15H14F3N3 O2S = 357,36.
расчетный, % C 50,42; H 3,95; F 15,95; N 11,76; S 8,97;
полученный, % C 50,3; H 3,9; F 15,6; N 11,6;
S 8,9.
Инфракрасный спектр
- CHCl3
OH - 3626 см-1
C≡N - 2236 см-1
C=O
- 1763 см-1
Ароматические
соединения - 1615-1578-1504 см-1
Пример 15. 4-(4,4-диметил 3- (2-гидроксиэтил) 5-имино 2-тиоксо 1-имидазолидинил) 2-(трифторметил)
5-3Н бензонитрил.
а)
Получение тритированного бензонитрила
При комнатной температуре смешивают 15 мг 2-трифторметил 4-амино 5- бромбензонитрила с 200 мкл
этилацетата в присутствии 6,5 мкл триэтиламина и 2 мг
палладия на активированном угле, после чего
вводят тритий (1,42 бар). Затем фильтруют, прополаскивают этилацетатом и выпаривают досуха при
комнатной температуре, в результате чего получают примерно 6,
66 ГБк (1,8 Ки) продукта.
б) Получение тритированного изотиоцианата
150 мкл 10%-ного раствора тиофосфена в
хлороформе добавляют в продукт, полученный на предыдущем этапе,
растворенный в 150 мкл воды, и взбалтывают в
течение 45 мин при комнатной температуре. Затем раствор разводят 0,5 мл воды и 1 мл
хлороформа, экстрагируют с использованием хлороформа, выпаривают
растворитель при пониженном давлении, забирают
толуолом и получают 50,7 ГБк (1,37 Ки) целевого продукта, который сохраняют при
-80oC.
в) Получение тритированного имина
После удаления при пониженном давлении
толуола из вышеуказанной смеси в нее добавляют 130 мкл тетрагидрофурана с 1%-ным
содержанием триэтиламина, затем добавляют 13 мкл 2-[(2-гидроксиэтил)
амино] 2-метилпропаннитрила, приготовленного, как
описано в примере 22 патентной заявки ЕЭС N 0494819, и снова добавляют 130 мкл
тетрагидрофурана с 1%-ным содержанием триэтиламина. После этого
взбалтывают в течение 30 мин при комнатной температуре и
удаляют растворители при пониженном давлении.
Получение 2-трифторметил 4-амино 5-бромбензонитрила, используемого на начальном этапе примера 15.
Раствор 2-трифторметил 4-аминобензонитрила (полученного как описано в патенте ЕЭС N 0002892) (5 моль) в 25 см3 метанола охлаждают до 0oC и добавляют бром (5,2 моль). Затем температуре раствора дают подняться до комнатной, взбалтывают в течение 3 ч, подщелачивают триэтиламином и добавляют водный раствор тиосульфата натрия. После этого удаляют растворители, экстрагируют с использованием хлороформа, промывают органическую фазу водой, высушивают и выпаривают растворитель, что позволяет получить продукт, используемый на следующем этапе без дополнительной обработки.
Инфракрасный спектр - CHCl3
NH2 - 3612-3408
см-1
C≡N - 2230 см-1
Ароматические соединения - 1621-1556-1506
см-1
Пример 16. 4-(4,4-диметил 3-(2-гидроксиэтил) 5- оксо 2-тиоксо
1-имидазолидинил) 2-(трифторметил) 5-3Н бензонитрил.
Продукт, полученный в предыдущем примере, растворенный в 180 мкл воды, нагревают до +100oC и добавляют 60 мкл 2 н. хлористоводородной кислоты. Затем взбалтывают в течение 5 мин при температуре кипения и добавляют примерно 600 мг льда, после чего экстрагируют с использованием этилацетата, промывают соленой водой, высушивают и получают 34,7 ГБк (937 мКи) продукта. После хроматографии на двуокиси кремния (элюант : циклогексан-этилацетат (60 : 40)) получают 19 ГБк (513 мКи) целевого продукта.
Пример 17. 4-(4,4-диметил 3-(3-гидроксипропил) 5-имино 2- тиоксо 1-имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 22 патентной заявки ЕЭС N 0494819 с использованием на начальном этапе 2 г изотиоцианата, полученного как описано в примере 13а, и 1,2 г соответствующего аминонитрила. В результате получают 1,70 г целевого продукта.
Rf=0,25 (элюант : метиленхлорид-ацетон (65 : 35)).
Инфракрасный спектр - CHCl3
OH - 3630 см-1
=NH - 3314-1676 см-1
C≡N - 2235 см-1
Ароматические
соединения - 1614-1578-1481 см-1
Пример 18. 4- (4,4-диметил 3-(3-гидроксипропил) 5-оксо 2-тиоксо 1-имидазолидинил)
2- (трифторметил) бензонитрил.
Операции выполняются как в примере 14 на основе 240 мг продукта, полученного как описано в примере 17, в результате чего получают 226 мг целевого продукта (tпл. = 149-150oC).
Rf=0,32 (элюант : метиленхлорид-ацетон (75 : 25)).
Инфракрасный спектр - CHCl3
OH - 3626
см-1
C=O - 1763 см-1
C≡N - 2236 см-1
Ароматические
соединения - 1615-1580-1504-1483 см-1
Пример 19. 4-(4,
4-диметил 3-(4- гидроксибутил) 5-имино 2-тиоксо 1-имидазолидинил)
2-(трифторметил) бензонитрил.
Операции выполняются как в примере 22 патентной заявки ЕЭС N 0494819 с использованием на начальном этапе 2 г изотиоцианата и 1,38 г соответствующего аминонитрила, в результате чего получают 2,08 г целевого продукта.
Rf=0,25 (элюант : метиленхлорид-ацетон (65 : 35)).
Инфракрасный спектр - CHCl3
OH - 3630 см-1
=NH - 3314-1675
см-1
C≡N - 2235 см-1
Ароматические соединения - 1614-1577-1504 см-1
Пример 20.
4-(4,4-диметил 3-(4-гидроксибутил) 5-оксо 2-тиоксо
1-имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 14 на основе 300 мг продукта, полученного как описано в примере 19, в результате чего получают 236 мг целевого продукта (tпл. = 78-79oC).
Rf=0,31 (элюант : метиленхлорид-ацетон (75 : 25)).
Инфракрасный спектр - CHCl3
OH
- 3624 см-1
C=O - 1762 см-1
C≡N - 2237 см-1
Ароматические соединения
- 1615-1580-1504 см-1
Ультрафиолетовый
спектр - EtOH
Макс. 232 н.м - ε = 19500
Макс. 232 н.м - ε = 24000
Перег. 266 н.м
Пример 21.
4-(4,4-диметил 3-(2-метоксиэтил) 5-имино 2-тиоксо
1- имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 22 патентной заявки ЕЭС N 0494819 с использованием на начальном этапе 2,5 г изотиоцианата и 1,56 г соответствующего аминонитрила, в результате чего получают 2,36 г целевого продукта.
Rf=0,23 (элюант : метиленхлорид-ацетон (92,5 : 7,5)).
Инфракрасный спектр
- CHCl3
=NH - 3314 см-1
C≡N - 2236 см-1
Ароматические
соединения - 1614-1578-1504 см-1
C=N - 1675 см-1
Пример 22. 4-(4,4-диметил 3-(2- метоксиэтил) 5-оксо
2-тиоксо 1-имидазолидинил) 2-(трифторметил)
бензонитрил.
Операции выполняются как в примере 14 на основе продукта, полученного как описано в примере 21, в результате чего получают целевой продукт (tпл. = 98-99oC).
Rf=0,32 (элюант : метиленхлорид-ацетон (99 : 1)).
Инфракрасный спектр - CHCl3
C=O - 1757
см-1
C≡N - 2236
см-1
Ароматические соединения - 1615- 1580-1504 см-1
Ультрафиолетовый спектр - EtOH
Макс. 232 н.м - ε
= 18200
Макс. 254 н.м - ε
= 22400
Перег. 265 н.м
Пример 23. 4-(4,4-диметил 3-(1-метилэтил)
5-имино 2-тиоксо 1- имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 22 патентной заявки ЕЭС N 0494819 с использованием на начальном этапе 2,5 г изотиоцианата и 1,32 г соответствующего аминонитрила, в результате чего получают 880 мг целевого продукта.
Rf=0,20 (элюант : метиленхлорид-ацетон (96 : 4)).
Инфракрасный спектр - CHCl3
=NH - 3310-1675 см-1
C≡N - 2236 см-1
Ароматические соединения - 1614-1580-1504 см-1
Пример 24. 4-(4,4-диметил 3-(1-метилэтил) 5-оксо 2-тиоксо 1-имидазолидинил)
2-(трифторметил) бензонитрил.
Операции выполняются как в примере 14 на основе 880 мг продукта, полученного как описано в примере 23, и 35 см3 6 н. хлористоводородной кислоты, затем экстрагируют с использованием хлороформа, в результате чего получают 744 мг целевого продукта (tпл. =203-204oC).
Rf=0,45 (элюант : циклогексан-этилацетат (1 : 1)).
Инфракрасный спектр
- CHCl3
OH - 3626 см-1
C=O
- 1753 см-1
C≡N - 2232 см-1
Ароматические соединения - 1615-1580-1504 см-1
Ультрафиолетовый спектр - EtOH
Макс. 232 н.м
- ε = 18900
Макс. 235 н.м - ε =
22500
Перег. 273 н.м
Пример 25. 3-(3,4-дихлорфенил 5,5-диметил
1-(3-гидроксипропил) 4-имино 2-имидазолидинтион.
Операции выполняются как в примере 51 патентной заявки ЕЭС N 0494819 с использованием 2,4 г изоцианата 3,4-дихлорфенила и 1,6 г соответствующего аминонитрила. После хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (6 : 4)) получают 2,16 г целевого продукта.
Rf=0,25.
Инфракрасный спектр - CHCl3
OH - 3630 см-1 + ассоцииров.
C=NH
- 3294-1676 см-1 (F)
Ароматические соединения - 1595-1569-1482 см-1
Пример 26. 3-(3,4- дихлорфенил 5,5-диметил
1-(3-гидроксипропил) 2-тиоксо
4-имидазолидинон.
Операции выполняются как в примере 52 патентной заявки ЕЭС N 0494819 с использованием 0,88 г продукта, полученного в примере 25, и 35 см3 6 н. хлористоводородной кислоты. После экстрагирования с использованием хлороформа получают 0,79 г целевого продукта (tпл. = 202-203oC).
Инфракрасный спектр
- CHCl3
C=O - 1753 см-1
C≡N - 2232 см-1
Ароматические
соединения - 1615-1580-1504 см-1
Ультрафиолетовый спектр
- EtOH
Макс. 232 н. м - ε = 18900
Макс. 235 н.м - ε = 22500
Перег. 273 н.м
Пример 27. 4-(4,4-диметил 3-(4-гидроксибутил)
5-имино 2-тиоксо
1- имидазолидинил) 2-(трифторметил) (5-3Н) бензонитрил.
а) 4-амино 2-(трифторметил) (5-3Н) бензонитрил.
16 мг 2-трифторметил 4-амино 5- бромбензонитрила, 2 мг палладия на активированном угле, 200 мкл этилацетата и 6,5 мкл триэтиламина охлаждают до -180oC и смешивают в инертной среде, после чего выдерживают в среде трития, давая температуре подняться до +20oC; давление при этом составляет 1,68 бар.
Затем взбалтывают для обеспечения абсорбции (Р = 0,42 бар), охлаждают до -180oC, удаляют избыток трития, дают температуре подняться до +20oC, после чего фильтруют, ополаскивают этилацетатом и концентрируют фильтрат при температуре +40oC, при пониженном давлении.
В результате получают 68 ГБк целевого продукта.
б) 4-тиоизоцианат 2-(трифторметил) (5-3Н) бензонитрил.
В среде аргона смешивают 34 ГБк полученного выше тритированного аминопроизводного, 150 мкл деминерализованной воды и 150 мкл 10%-ного раствора тиофосгена в хлороформе.
Затем взбалтывают в течение 45 мин при температуре +20oC, отстаивают, повторно экстрагируют с использованием хлороформа, высушивают на сульфате магния, фильтруют и концентрируют при пониженном давлении.
Полученный тиоизоцианат используют на следующем этапе без дополнительной обработки.
в) 4-(4,4-диметил 3-(4-гидроксибутил) 5-имино 2-тиоксо 1- имидазолидинил) 2-(трифторметил) (5-3Н) бензонитрил.
В тиоизоцианат, полученный на этапе б), примешивают в среде аргона 350 мкл тетрагидрофурана с 1%-ным содержанием триэтиламина и 20 мкл пропаннитрила, полученного как описано выше.
Затем взбалтывают в течение 2 ч при температуре +20oC и концентрируют при +20oC, при пониженном давлении.
Имин используют на следующем этапе без дополнительной обработки.
Получение 2-(4-гидроксибутиламино) 2-метилпропаннитрила, используемого на этапе в).
Смешивают 550 мкл циангидрина ацетона и 500 мкл 4-амино 1- бутанола, взбалтывают в течение 16 ч при температуре +20oC и используют полученный таким образом продукт на следующем этапе без дополнительной обработки.
Пример 28. 4-(4,4-диметил 3-(4-гидроксибутил) 5-оксо 2-тиоксо 1-имидазолидинил) 2-(трифторметил) (5-3Н) бензонитрил.
К имину, полученному в примере 27, добавляют 200 мкл 2 н. хлористоводородной кислоты, доводят за 5 мин до температуры кипения, охлаждают до +20oC, разбавляют 1 см3 воды, экстрагируют с использованием этилацетата, промывают водой и концентрируют при пониженном давлении.
Сырой продукт очищают методом хроматографии на двуокиси кремния (элюант : циклогексан-этилацетат (6 : 4)).
В результате получают 2,8 ГБк целевого продукта.
Пример 29. 4-(4, 4-диметил 3-(4-гидроксибутил) 5-имино 2-тиоксо 1-имидазолидинил) 2-(трифторметил) бензо (14C) нитрил.
а) 4-амино 2-(трифторметил) бензо (14C) нитрил.
В среде азота смешивают 377 мг цианистой меди (14C) (9 ГБк) и 1,0732 г 4-бром 3- (трифторметил) бензоламина в 8 см3 диметилформамида.
Затем нагревают в течение 4 ч при температуре кипения, после чего охлаждают до 0oC, разбавляют 20 см3 ацетона и фильтруют нерастворимую фракцию, фильтрат концентрируют при +70oC при пониженном давлении. Остаток забирают метиленхлоридом, фильтруют, а фильтрат концентрируют при пониженном давлении.
Полученный бензонитрил (14C) очищают методом хроматографии на двуокиси кремния (элюант : метиленхлорид-циклогексан (70 : 30)).
В результате получают 0,558 г (6,62 ГБк) целевого продукта.
б) 4-тиоизоцианат 2-(трифторметил) бензо (14C) нитрил.
В среде азота смешивают 189 мг бензонитрила (14C), полученного на этапе а), 2,7 см3 воды и 85 мкл тиофосгена.
Затем энергично взбалтывают в течение 5 мин, добавляют 30 мкл тиофосгена и взбалтывают в течение 1 ч при температуре +20oC, после чего экстрагируют с использованием хлороформа, промывают водой, высушивают и концентрируют при пониженном давлении.
Полученный таким образом тиоизоцианат используют на следующем этапе без дополнительной обработки.
в) 4-(4,4-диметил 3-(4-гидроксибутил) 5-имино 2-тиоксо 1- имидазолидинил) 2-(трифторметил) бензо (14C) нитрил.
В тиоизоцианат, полученный на этапе б), добавляют в среде азота 2 см3 тетрагидрофурана, пропаннитрил, полученный как указано ниже, растворенный в 1,5 см3 метиленхлорида, и 150 мкл триэтиламина.
Затем нагревают в течение 30 мин при температуре кипения и концентрируют при пониженном давлении.
Полученный таким образом имин используют на следующем этапе без дополнительной обработки.
Получение 2-(4-гидроксибутиламино) 5- метилпропаннитрила, используемого на этапе в).
Смешивают 220 мкл циангидрина ацетона и 200 мкл 4-амино 1-бутанола, взбалтывают в течение 16 ч при температуре +20oC, разбавляют 2 см3 метиленхлорида, высушивают, фильтруют и концентрируют фильтрат при пониженном давлении.
Полученный таким образом пропаннитрил используют на следующем этапе без дополнительной обработки.
Пример 30. 4-(4,4-диметил 3-(4-гидроксибутил) 5-оксо 2- тиоксо 1-имидазолидинил) 2-(трифторметил) бензо (14C) нитрил.
К имину, полученному в примере 29, добавляют 6 см3 метанола и 1,6 см3 2 н. хлористоводородной кислоты.
Затем доводят за 45 мин до температуры кипения, охлаждают до +20oC, разбавляют 10 см3 воды, экстрагируют с использованием метиленхлорида, промывают водой и концентрируют при пониженном давлении.
Сырой продукт очищают методом хроматографии на двуокиси кремния (элюант : эфир-ацетонитрил-циклогексан (50 : 15 : 35)).
В результате получают 328 мг целевого продукта.
Пример 31. 4-(4, 4-диметил 3-(4-гидроксибутил) 5-имино 2-оксо 1-имидазолидинил) 2-(трифторметил) (5-3Н) бензонитрил.
а) 4- амино 2-(трифторметил) (5-3Н) бензонитрил.
Операции выполняются как на этапе а) примера 27 с использованием 16 мг 4-амино 5-бром 2- трифторметилбензонитрила, 2 мг палладия на активированном угле, 200 мкл этилацетата, 6,5 мкл триэтиламина.
В результате получают 68 ГБк целевого продукта.
б) 4-изоцианат 2-(трифторметил) (5-3Н) бензонитрил.
В среде аргона смешивают 34 ГБк полученного выше тритированного аминопроизводного, 100 мкл 20%-ного раствора фосгена в толуоле.
Затем нагревают в течение 1 ч до температуры +80oC, вновь добавляют 100 мкл фосгена и нагревают в течение 1 ч при +80oC, повторяют эту операцию еще один раз и концентрируют при температуре +20oC, при пониженном давлении.
Полученный изоцианат используют на следующем этапе без дополнительной обработки.
в) 4-(4,4-диметил 3-(4-гидроксибутил) 5-имино 2-оксо 1- имидазолидинил) 2-(трифторметил) (5-3Н) бензонитрил.
В изоцианат, полученный на этапе б), примешивают в среде аргона 200 мкл метиленхлорида, 50 мкл хлорметиленового раствора пропаннитрила, полученного как указано ниже, и 20 мкл триэтиламина.
Затем взбалтывают в течение 30 мин, вновь добавляют 50 мкл раствора пропаннитрила и взбалтывают еще 30 мин при температуре +20oC, при пониженном давлении.
Имин используют на следующем этапе без дополнительной обработки.
Получение 2-(4-гидроксибутиламино) 2-метилпропаннитрила, используемого на этапе в).
Смешивают 220 мкл циангидрина ацетона и 200 мкл 4-амино 1- бутанола, взбалтывают в течение 16 ч при температуре +20oC, разбавляют 3 см3 метиленхлорида и высушивают на сульфате магния.
Отстоявшийся таким образом раствор используют на следующем этапе без дополнительной обработки.
Пример 32. 4-(4, 4-диметил 2,5-диоксо 3-(4-гидроксибутил) 1-имидазолидинил) 2-(трифторметил) (5-3Н) бензонитрил.
К имину, полученному в примере 31, добавляют 200 мкл метанола, 50 мкл 2 н. хлористоводородной кислоты, доводят за 45 мин до температуры кипения, охлаждают до +20oC, разбавляют 1 см3 воды, экстрагируют с использованием метиленхлорида, промывают водой и концентрируют при температуре +20oC, при пониженном давлении.
Сырой продукт очищают методом хроматографии на двуокиси кремния (элюант : метиленхлорид-этилацетат (7 : 3), а затем (5 : 5)).
В результате получают 16 ГБк целевого продукта.
Пример 33. 4-(4,4-диметил 3-(4-гидроксибутил) 5-имино 2-оксо 1-имидазолидинил) 2-(трифторметил) бензо (14C) нитрил.
а) 4-амино 2-(трифторметил) бензо (14C) нитрил.
Операции выполняются как на этапе а) примера 29 с использованием 377 мг цианистой меди (14C), 1,0732 г 4-бром 3-трифторметилбензоламина и 8 см3 диметилформамида.
В результате получают 0,558 г (6,62 ГБк) целевого продукта.
б) 4-изоксианат 2-(трифторметил) бензо (14C) нитрил.
В среде азота смешивают 182,4 мг бензонитрила (14C) (0,97 ммоль), 2 см3 диоксана и 1 см3 20%-ного раствора фосгена в толуоле.
Затем полученный раствор нагревают в течение 22 ч при температуре +60oC и концентрируют при +60oC, при пониженном давлении.
Полученный таким образом изоцианат используют на следующем этапе без дополнительной обработки.
в) 4-(4,4-диметил 3-(4-гидроксибутил) 5-имино 2-оксо 1- имидазолидинил) 2-(трифторметил) бензо (14C) нитрил.
В изоцианат, полученный на этапе б), добавляют в среде азота 1,5 см3 метиленхлорида (на силипорите NK 30), пропаннитрил, полученный как в примере 31, растворенный в 1,5 см3 метиленхлорида, 150 мкл триэтиламина.
Затем взбалтывают в течение 1 ч при температуре +20o C, затем концентрируют при пониженном давлении.
Имин используют на следующем этапе без дополнительной обработки.
Пример 34. 4-(4,4-диметил 2,5-диоксо 3-(4-гидроксибутил) 1-имидазолидинил) 2-(трифторметил) бензо (14C) нитрил.
К имину, полученному в примере 33, добавляют 5 см3 метанола и 1,2 см3 1 н. хлористоводородной кислоты, после чего доводят за 40 мин до температуры кипения, а затем охлаждают до +20oC, разбавляют 10 см3 воды, экстрагируют с использованием метиленхлорида, промывают водой и концентрируют при пониженном давлении.
Сырой продукт очищают методом хроматографии на двуокиси кремния (элюант : эфир-ацетонитрил-циклогексан (50 : 15 : 35)).
В результате получают 289 мг (1,26 ГБк) целевого продукта.
Пример 35. 4-(2,5-диоксо 4,4-диметил 3-(4-трифенилметоксибутил) 1-имидазолидинил) 2-(трифторметил) бензонитрил.
В течение 16 ч при комнатной температуре взбалтывают 370 мг продукта, полученного в примере 1, 307 мг трифенилметилхлорида в присутствии 10 мг
4- диметиламинопиридина, 0,
25 см3
триэтиламина и 4 см3 диметилформамида. Затем нагревают в течение 4 ч при температуре +40oC, вливают в воду, экстрагируют с
использованием эфира, промывают
водой, высушивают,
удаляют растворитель при пониженном давлении и остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан- этилацетат (75:25)). В
результате получают 467 мг
целевого продукта
(Rf= 0,25).
Инфракрасный спектр - CHCl3
C=O - 1778-1725 см-1 (F)
C≡N - 2235
см-1
Ароматические соединения
- 1615-1597-1505-1490 см-1
Пример 36. 4-(2,5-диоксо 4,4-диметил 3-(4-фенилметоксибутил) 1-имидазолидинил) 2-(трифторметил)
бензонитрил.
К 370 мг продукта, полученного в примере 1, растворенного в 4 см3 диметилформамида, добавляют за несколько приемов 48 мг гидрида натрия, взбалтывают 30 мин, а затем добавляют 0,12 см3 бромбензила и 40 мг иодистого тетрабутиламмония. После полуторачасовой реакции добавляют идентичное количество каждого из реактивов, взбалтывают в течение 1 ч, вливают в ледяной водный раствор первичного фосфата калия и экстрагируют с использованием эфира, промывают водой, высушивают, удаляют растворитель при пониженном давлении и остаток подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (99 : 1)). В результате получают 140 мг целевого продукта (tпл. = 75- 76oC).
Инфракрасный
спектр - CHCl3
C=O - 1779-1725
см-1
C≡N - 2235 см-1
Ароматические соединения - 1615-1580-1505-1497 см-1
Пример
37. 4-[4,4-диметил 2,5-диоксо
3-(4-метоксибутил)
1-имидазолидинил) 2-(трифторметил) бензонитрил.
К 370 мг продукта, полученного в примере 1, растворенного в 3 см3 диметилформамида, добавляют за несколько приемов 50 мг гидрида натрия, взбалтывают 20 мин, добавляют 0,06 см3 метилиодида, взбалтывают 1 ч, вновь добавляют 50 мг гидрида натрия, а затем, через 20 мин, 0,06 см3 метилиодида. После этого реакционную среду вливают в воду, экстрагируют с использованием эфира, промывают водой, высушивают, выпаривают растворитель и подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (98 : 2)). В результате получают 135 мг целевого продукта (tпл. = 80-81oC).
Инфракрасный
спектр - CHCl3
C=O
- 1779-1725
см-1 (F)
C≡N - 2234 см-1
Ароматические соединения - 1616-1576-1505 см-1.
OCH3 - ≈ 2830 см-1
Пример 38. 4-[3-(4-хлорбутил) 4,4-диметил 2,5-диоксо 1-имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 2 с использованием на начальном этапе 600 мг продукта, полученного в примере 8 патентной заявки ЕЭС N 0494819, и 660 мг 1-хлор 4-иодбутана, растворенного в 1 см3 диметилформамида, охлажденного до +5o C. В результате получают 604 мг целевого продукта (tпл. = 80-81oC).
Инфракрасный спектр - CHCl3
C=O - 1779-1725 см-1 (F)
C≡N
- 2238 см-1
Ароматические соединения - 1616-1575- 1505 см-1
Пример 39. 4-[3-[4-[(метилсульфонил)
окси] бутил] 4,4- диметил 2,5-диоксо
1-имидазолидинил]
2-(трифторметил) бензонитрил.
0,17 см3 метансульфонилхлорида добавляют в 740 мг продукта, полученного в примере 1, растворенного в 7,4 см3 пиридина, и 24 мг 4- диметиламинпиридина. Затем взбалтывают в течение 1 ч, вливают в ледяную воду, экстрагируют с использованием метиленхлорида, промывают водой, удаляют путем дистилляции остаточный пиридин, хроматографируют остаток на двуокиси кремния (элюант : метиленхлорид-этилацетат (8 : 2)), в результате чего получают 771 мг целевого продукта.
Инфракрасный спектр - CHCl3
C=O - 1779-1725 см-1
C≡N - 2235 см-1
Ароматические соединения - 1615-1575-1505 см-1

Ультрафиолетовый спектр - EtOH
Макс. 261 н.м - ε = 14900
Перег. 279-297 н.м
Пример 40. 4-(3-ацетил 4,4-диметил 2,5- диоксо 1-имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 2 с использованием на начальном этапе 420 мг продукта, полученного в примере 8 патентной заявки ЕЭС N 0494819, и дважды 0,1 см3 ацетилхлорида. После хроматографии на двуокиси кремния (элюант : метиленхлорид-этилацетат (98 : 2)) получают 334 мг целевого продукта (tпл. = 129-130oC).
Инфракрасный спектр - CHCl3
C=O - 1800-1740-1717
см-1
C≡N
- 2240 см-1
Ароматические соединения - 1616-1505 см-1
Ультрафиолетовый спектр - EtOH
Макс. 250 н.м - ε =
12000
Перег. 274-284 н.м
Пример 41.
4-(3-бензоил 4,4- диметил 2,5-диоксо 1-имидазолидинил) 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 2 с использованием на начальном этапе 300 мг продукта, полученного в примере 8 патентной заявки ЕЭС N 0494819, и дважды 0,12 см3 бензоилхлорида, растворенного в 0,5 см3 диметилформамида. После хроматографии на двуокиси кремния (элюант : циклогексан-этилацетат (8 : 2)) получают 285 мг целевого продукта (tпл. = 179-180oC).
Инфракрасный спектр - CHCl3
C=O
- 1800-1780-1746-1699 см-1
C≡N - 2235 см-1
Ароматические соединения - 1617-1600-1580-1504 см-1
Ультрафиолетовый спектр - EtOH
Макс. 250 н.м - ε = 28500
Перег. 275 н.м - ε = 6500
Перег. 263 н.м - ε = 3850
Пример 42.
4-[3-[диметил (1,1-диметилэтил) силил] 4,4-диметил 2,
5-диоксо
1-имидазолидинил] 2-(трифторметил) бензонитрил.
Операции выполняются как в примере 2 с использованием на начальном этапе 450 мг продукта, полученного в примере 8 патентной заявки ЕЭС 0494819, и 300 мг диметил-трет-бутилсилилхлорида в 2 см3 диметилформамида. После хроматографии на двуокиси кремния (элюант : метиленхлорид-ацетон (99 : 1)) получают 527 мг целевого продукта (tпл. = 147-148oC).
Инфракрасный спектр - CHCl3
C≡N
- 2236 см-1
Ароматические соединения
- 1615-1579-1505 см-1
Ультрафиолетовый спектр - EtOH
Макс. 258 н.м - ε = 17000
Перег. 275-285
н.м
Дополнительно к вышеописанным продуктам в
рамках настоящего изобретения
могут быть получены нижеуказанные продукты формулы:

в которой YA представляет собой атом кислорода или серы, а R3A имеет нижеследующие значения:
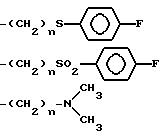
-(CH2 )n-OH
-(CH2)n-COO-alk

-(CH2)n -CO-alk

-(CH2)n-C≡N
в которых
alk, alk1 и alk2 представляют собой алкильный радикал, включающий до 4 атомов углерода, а n принимает целочисленное значение от 1 до 4.
Пример 43.
Были
приготовлены таблетки, отвечающие следующей формуле:
- 4-(5-оксо-2-тиоксо-3,4,4-триметил 1-имидазолидинил)
- 2-(трифторметил) бензонитрил 100 мг
- Основа для готовой
таблетки 300 мг
(Деталировка основы : лактоза, крахмал,
тальк, стеарат магния).
ФАРМАКОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРОДУКТОВ ИЗОБРЕТЕНИЯ
1.
Исследование воздействия
продуктов изобретения на андрогенный рецептор.
Андрогенный рецептор
Самцы крыс Спраг-Даулей EOPS (весом от 180 до 200 г), кастрированные за 24 ч,
умерщвляются, после чего у
них вырезают простаты, взвешивают и гомогенизируют при
температуре 0oC с помощью трубчатого измельчителя стекло-стекло в забуференном растворе (Tris 10 ммоль,
сахароза 0,25 моль, ФМСФ
(фенилметансульфонилфторид) 0,1 ммоль, молибдат натрия 20
ммоль, HCl pH 7,4, к которым добавляют на месте 2 ммоль ДТТ (DL дитиотреитол) из расчета 1 г ткани на 8 мл буферного
раствора.
Затем гомогенат подвергают ультрацентрифугированию (209 000 г • 30 мин) при температуре 0oC. Полученные таким образом аликвоты надосадочной жидкости подвергаются инкубации в течение 30 мин и в течение 24 ч при температуре 0oC при постоянной концентрации (Т) тритированного тестостерона, и в присутствии возрастающих концентраций (от 0 до 2500•10-9 моль), либо холодного тестостерона, либо тестируемых продуктов. Концентрация связанного тритированного тестостерона (В) измеряется затем в каждом инкубате методом адсорбции углем-декстраном.
Расчет относительного связующего воздействия (ARL).
Прочерчивают две кривые: процент связанного тритированного гормона В/Т в зависимости
от логарифма концентрации холодного
контрольного гормона и В/Т в
зависимости от логарифма концентрации холодного тестируемого продукта. Затем определяют прямую уравнения I50 = (B/Tмакс. + B/Tмин.)/2,
в котором В/Тмакс. = % связанного тритированного гормона для инкубации данного тритированного гормона при концентрации Т.
В/Тмин. = % связанного тритированного гормона для инкубации данного тритированного гормона при концентрации Т в присутствии большого избытка холодного гормона (2500•10-9 моль).
Пересечения прямой I50 и кривых позволяют вычислить концентрации холодного контрольного гормона (CH) и холодного тестируемого продукта (CX), которые ослабляют на 50% связь тритированного гормона с рецептором. Относительное связующее воздействие (ARL) тестируемого продукта определяется с помощью уравнения ARL = 100 (CH) / (CX).
При этом получают следующие результаты, выраженные в ARL (см. табл. 1).
2. Определение андрогенной или антиандрогенной активности продуктов изобретения с помощью дозировки орнитин- декарбоксилазы.
Протокол
эксперимента
Шестинедельным и кастрированным за 24 ч самцам мышей Свис вводят через рот или подкожно исследуемые продукты (0,5%-ную
суспензию в метилцеллюлозе или раствор в этаноле),
одновременно с подкожной
инъекцией пропионата тестостерона из расчета 3 мг/кг (раствор в кукурузном масле) для определения антиандрогенной
активности. Агонистическая активность определяется в
отсутствие пропионата
тестостерона.
Пропионат тестостерона вводится из расчета 10 мл/кг.
Через 20 ч после ввода препарата животные умерщвляются, после чего у них вырезают почки и гомогенизируют при температуре 0oC с помощью измельчителя тефлон-стекло в 10 объемах буферного раствора Tris - HCl 50 ммоль (pH 7,4), содержащего 250 мкмоль фосфата пиридоксала, 0,1 ммоль ЭДТА и 5 ммоль дитиотреитола. Затем гомогенат подвергают центрифугированию (209 000 г • 30 мин).
Принцип
дозировки
При температуре +37oC почечная
орнитин-декарбоксилаза превращает смесь холодного изотопного орнитина и тритированного орнитина в холодный путресцин и тритированный
путресцин.
Затем путресцин собирают на ионообменную селективную бумагу. После высушивания избыточный непреобразованный тритированный и холодный орнитин удаляется тремя промывками аммиаком с молярной концентрацией 1 моль/л. Бумага высушивается, после чего определяется радиоактивность путем добавления сцинтиллятора аквалита.
Результаты выражаются в молях (10-15 моль) образовавшегося тритированного путресцина / ч. / мг протеинов.
Результаты выражаются в % ингибирования ODL контрольных гормонов, подвергнувшихся воздействию одного только пропионата тестостерона (см. табл.2).
Тест А : Продукты вводятся подкожно из расчета 1,5 мг/кг, при объеме 10 мкл.
Тест Б : Продукты вводятся через рот из расчета 1 мг/кг.
Тест В : Продукты вводятся через рот из расчета 3 мг/кг.
Вышеуказанные тесты показывают, что тестированные продукты изобретения обладают высокой антиандрогенной активностью и лишены агонистической активности.
Реферат
Изобретение относится к новым замещенным фенилимидазолидинов, к способу их получения и к их использованию в фармацевтических композициях. Новые замещенные проявляют антиандрогенную активность. 4 с. и 10 з.п. ф-лы, 2 табл.
Формула

в которой R1 - цианогруппа или галоген;
R2 - трифторметильный радикал или галоген;
-А - В - выбраны из группы

где Х - кислород или сера;
R3 - водород, С1 - С12-алкил, возможно замещенный одним или несколькими радикалами, выбираемыми из гидроксила, галогена, фенила или -S-фенила, в которых фениловый радикал может быть замещен галогеном или алкоксигруппой, карбоксирадикалом, свободным или этерифицированным, морфолино, причем алкиловые радикалы, кроме того, могут прерываться одним или несколькими атомами кислорода или серы, а все атомы серы, в случае необходимости, могут быть окислены до сульфоксида или сульфона, триалкил ацил;
Y - атом кислорода или радикал = NH.

в котором Х - атом кислорода;
R3 - атом водорода;
R2 - атом галогена или трифторметил;
R1 - атом галогена.

в котором Х - атом серы;
R3 имеет значение, указанное в п.1.

или группа

в которой R3 - алкильный радикал, включающий не более 6 атомов углерода, с возможностью замещения и прерывания одним или несколькими атомами кислорода или серы с возможностью окисления атома серы.
-4-[4, 4-диметил-3-(2-гидроксиэтил)-5-оксо-2-тиоксо-1-имидазолидинил] -2-(трифторметил)бензонитрил;
-4-[4,4-диметил-3-(4-гидроксибутил)-5-оксо-2-тиоксо-1-имидазолидинил] -2-(трифторметил)бензонитрил.
-3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-2, 4-диоксо-1-имидазолидинбутановая кислота;
-4-(4,4-диметил, 2, 5-диоксо-3-(4-гидроксибутил)-1-имидазолидинил)-2-(трифторметил)бензонитрил.

в которой R1, R2 и Х имеют указанные значения,
с соединением формулы III

в которой



в которой R1, R2, X и












в которых

при желании, с последующим снятием защитных групп радикала


в которой R1, R2 и Х имеют указанные значения,
с соединением формулы III

в которой

а Q - либо атом щелочного металла, например натрия, или алкильный радикал, включающий 1 - 6 атома углерода,
для получения продукта формулы IVа
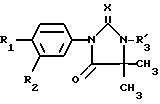
в которой X, R1, R2 и

и, при желании, удаляют возможные защитные группы радикала










в которых
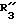
с последующим, при желании, удалением защитных групп радикала

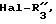
в которой Hal и

с соединением формулы IV

где R1, R2 имеют указанные значения,
для получения соединения формулы IV
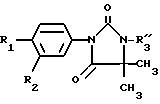
где R1, R2,

и, при желании, в полученном соединении удаляют возможные защитные группы радикала




в которой R1, R2 и Y имеют указанные значения,
а группа

выбрана среди радикалов

в которых Х - атом кислорода или серы,
а


Комментарии