Ингибитор связывания сфингозин-1-фосфата - RU2395499C2
Код документа: RU2395499C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым соединениям, которые оказывают ингибирующее воздействие на связывание между сфиногозин-1-фосфатом, обладающим многочисленными физиологическими функциями, и его рецептором Edg-1 (Рецептор гена эндотелиальной дифференциации тип-1, S1P1). Настоящее изобретение относится также к фармацевтическим композициям, включающим указанные соединения в качестве активных ингредиентов, и синтетическим промежуточным производным для данных соединений.
УРОВЕНЬ ТЕХНИКИ
Сфингозин-1-фосфат (далее называемый “S1P”) является физиологически активным липидом, который образуется в процессе метаболизма сфинголипидов (например, сфингомиелина) в клетках. Известно, что S1P обладает широким многообразием функций, таких как индукция клеточной дифференциации, стимуляция роста клеток, ингибирование подвижности клеток и ингибирование апоптоза, и известно также, что он оказывает такие физиологические функции, как ангиогенез, индукция брадикардии, активация воспалительных клеток и активация тромбоцитов (Непатентный документ 1).
В качестве S1P рецепторов известны следующие 5 подтипов: Edg-1(S1P1), Edg-3(S1P3), Edg-5(S1P2), Edg-6(S1P4) и Edg-8(S1P5) (Непатентный документ 2).
Среди данных подтипов Edg-1(S1P1) экспрессируется в высокой степени в иммуноцитах (например, Т клетках, дендритных клетках) и сосудистых эндотелиальных клетках, из чего может следовать, что Edg-1(S1P1) очень способствует миграции S1P-стимулируемых Т клеток (Непатентный документ 3), миграции тучных клеток (Непатентный документ 4) и выходу Т и В клеток из лимфоидных органов (Непатентный документ 5) и ангиогенезу (Непатентный документ 6) и вовлечен в аутоиммунные заболевания, такие как болезнь Крона, спастический колит, синдром Сьегрена, рассеянный склероз и системная красная волчанка, также как и в другие заболевания, такие как ревматоидный артрит, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартрит, связанная с возрастом макулярная деградация и пр.
Таким образом, лиганды для Edg-1(S1P1) были бы эффективными для лечения или профилактики данных заболеваний.
Ранее известные Edg-1(S1P1) лиганды включают некоторые типы тиофеновых производных (Непатентный документ 7), производные фосфорной кислоты (Патентные документы 1 и 2, Непатентные документы 8 и 9) и тиазолидиновые производные (Патентный документ 3), производные карбоновых кислот (Патентные документы 4, 5, 6 и 8, Непатентные документы 10 и 11), производные, содержащие амино группу (Патентный документ 7), и производные пиррола (Патентный документ 9).
Патентный документ 1: WO2002-18395
Патентный документ 2: JP 2003-137894 A
Патентный документ 3: JP 2002-332278 A
Патентный документ 4: WO2002-092068
Патентный документ 5: WO 2003-105771
Патентный документ 6: WO 2004-058149
Патентный документ 7: WO 2004-103279
Патентный документ 8: WO 2005-058848
Патентный документ 9: WO 2005-123677
Непатентный документ 1: J Biol Chem. 2004, 279: 20555, FASEB J 2002, 16: 625, Proceedings of the Japanese Society for Immunology 2003, 33: 2-J-W30-20-P
Непатентный документ 2: Pharmacol Res 2003, 47: 401
Непатентный документ 3: FASEB J 2002, 16:1874
Непатентный документ 4: J Exp Med 2004, 199: 959
Непатентный документ 5: Nature 2004, 427: 355
Непатентный документ 6: J Clin Invest 2000, 106: 951, Biocchim Biophys Acta 2002, 1582: 222
Непатентный документ 7: J Biol Chem 2004, 279: 13839
Непатентный документ 8: Bioorg Med Chem Lett 2003, 13: 3401
Непатентный документ 9: J Biol Chem. 2005; 280: 9833
Непатентный документ 10: J Med Chem. 2004, 47: 6662
Непатентный документ 11: J Med Chem. 2005, 48: 6169
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является предоставление соединений, имеющих новый скелет, которые оказывают ингибирующее воздействие на связывание между S1P и его рецептором Edg-1(S1P1) и которые являются полезными для фармацевтических целей.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ПРОБЛЕМ
В результате обширных и интенсивных усилий, предпринятых в поиске лигандных соединений для Edg-1(S1P1), авторы настоящего изобретения выяснили, что данная цель достигается соединением следующей формулы (I) или его фармацевтически приемлемой солью. Данное открытие привело к созданию настоящего изобретения.
Воплощения изобретения будут даны ниже для соединения формулы (I) и его промежуточного соединения формулы (II) (называемые далее, каждое, как “соединение настоящего изобретения”).
1. Соединение, представленное формулой (I), или его фармацевтически приемлемая соль:
[Формула 1]

{где Ar представляет моноциклическое гетероциклическое кольцо, содержащее один или два атома азота,
где указанный Ar может быть замещен заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы, фенильной группы и атома галогена,
Y1, Y2и Y3, каждый, представляет атом углерода или атом азота,
А представляет атом кислорода, атом серы, группу, представленную формулой -SO2-, или группу, представленную формулой -NR6- (где R6 представляет атом водорода или С1-С6 алкильную группу),
R1 представляет атом водорода, С1-С6 алкильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из гидроксильной группы, атома галогена, С1-С6 алкокси группы (где указанная алкокси группа может быть замещена фенильной группой) и фенильной группы (где указанная фенильная группа может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы)], С3-С8 циклоалкильную группу, С2-С8 алкенильную группу, С2-С8 алкинильную группу или фенильную группу,
R2 представляет атом водорода, С1-С6 алкильную группу или С3-С8 циклоалкильную группу,
R3 представляет (i) атом водорода, (ii) С1-С18 алкильную группу, (iii) С2-С8 алкенильную группу, которая может быть замещена фенильной или бензилокси группой, (iv) С2-С8 алкинильную группу, которая может быть замещена фенильной группой, (v) С3-С8 циклоалкильную группу, которая может быть сконденсирована с бензольным кольцом, (vi) С1-С6 алкильную группу, замещенную заместителем(ями), выбранным из следующей группы [где указанная группа состоит из атома галогена, фенильной группы (где указанная фенильная группа может быть замещена 1-5 заместителями, выбранными из группы, состоящей из фенильной группы, циано группы, атома галогена, С1-С6 алкильной группы, С1-С6 алкокси группы, трифторметильной группы, метоксикарбонильной группы, С1-С6 алкилтио группы, диметиламино группы, нитро группы и ацетамидо группы), С3-С8 циклоалкильной группы, гидроксильной группы, С1-С6 алкилтио группы, С1-С6 алкокси группы, бензилокси группы, фенокси группы, трифторметильной группы, дифторметильной группы, бензолсульфонильной группы, нафтильной группы, С7-С10 трициклоалкильной группы, карбометокси(фенил)метильной группы, дифенилметильной группы, 1-фенилэтильной группы, имидазолильной группы, индолильной группы, пиридильной группы, оксетанильной группы, оксоланильной группы, метилпиперидинильной группы, пиперазино группы, которая может быть замещена С1-С6 алкильной группой(ами), бензилпиперидинильной группы, морфолино группы, 2-оксопирролидин-1-ильной группы, 2-оксоимидаозолидин-1-ильной группы, группы, представленной формулой
-CO2R11
(где R11 представляет атом водорода или С1-С6 алкильную группу), группы, представленной формулой
[Формула 2]

(где R12 и R13, каждый, представляет атом водорода или С1-С6 алкильную группу), группы, представленной формулой
[Формула 3]

(где R14 и R15, каждый, представляет атом водорода, С1-С6 алкильную группу, фенильную группу или 4-пиридилкарбонильную группу), и формулы
-COR16
(где R16 представляет С1-С6 алкильную группу или фенильную группу)], (vii) оксоланильную группу, метилпиперидинильную группу или группу, представленную формулой
[Формула 4]

или (viii) необязательно замещенную арильную группу,
R4 представляет атом водорода или С1-С6 алкильную группу, которая может быть замещена карбоксильной группой, и
R5 представляет (i) С1-С10 алкильную группу, (ii) С1-С10 алкильную группу, которая замещена одним или двумя заместителями, выбранными из следующей группы (где указанная группа состоит из С3-С8 циклоалкильной группы, пиридильной группы и фенильной, фенокси или нафтильной группы, которая может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из атома галогена и С1-С6 алкокси группы), (iii) С3-С8 циклоалкильную группу, (iv) С2-С8 алкенильную группу, (v) С2-С8 алкенильную группу, замещенную фенильной группой, (vi) С2-С8 алкинильную группу, (vii) С2-С8 алкинильную группу, замещенную фенильной группой, или (viii) необязательно замещенную арильную группу, при условии, что когда Ar представляет группу, представленную следующей формулой:
[Формула 5]

которая может быть замещена С1-С6 алкильной группой, R5 не является С1-С10 алкильной группой.
2. Соединение или его фармацевтически приемлемая соль согласно воплощению 1, где в формуле (I)
Ar представляет моноциклическое гетероциклическое кольцо, содержащее один или два атома азота,
А представляет атом кислорода, атом серы или группу, представленную формулой -NR6- (где R6 представляет атом водорода или С1-С6 алкильную группу),
R1 представляет атом водорода, С1-С6 алкильную группу или С1-С6 алкильную группу, замещенную фенильной группой,
R2 представляет С1-С6 алкильную группу или С3-С8 циклоалкильную группу,
R3 представляет С1-С6алкильную группу или необязательно замещенную арильную группу,
R4 представляет атом водорода или С1-С6 алкильную группу, и
R5 представляет (i) С1-С10 алкильную группу, (ii) С1-С10 алкильную группу, которая замещена одним или двумя заместителями, выбранными из следующей группы (где указанная группа состоит из С3-С8 циклоалкильной группы, фенильной группы, нафтильной группы, пиридильной группы и фенильной группы, замещенной одним или двумя заместителями, выбранными из группы, состоящей из атома галогена и С1-С6 алкокси группы), (iii) С3-С8 циклоалкильную группу, (iv) С2-С8 алкенильную группу, (v) С2-С8 алкенильную группу, замещенную фенильной группой, (vi) С2-С8 алкинильную группу, (vii) С2-С8 алкинильную группу, замещенную фенильной группой, или (viii) необязательно замещенную арильную группу.
3. Соединение или его фармацевтически приемлемая соль согласно воплощению 1, где Ar представляет заместитель, представленный следующей формулой:
[Формула 6]
которая может быть замещена заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, фенильной группы и атома галогена.
4. Соединение или его фармацевтически приемлемая соль согласно воплощению 1, где Ar представляет заместитель, представленный следующей формулой:
[Формула 7]

которая может быть замещена заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, фенильной группы и атома галогена.
5. Соединение или его фармацевтически приемлемая соль согласно воплощению 1, где Ar представляет заместитель, представленный следующей формулой:
[Формула 8]

которая может быть замещена заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, фенильной группы и атома галогена.
6. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-5, где A представляет атом кислорода.
7. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1 и 3-6, где R1 представляет С1-С6 алкильную группу, которая может быть замещена атомом(ами) галогена, или бензильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы.
8. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1 и 3-6, где R1 представляет метильную группу, этильную группу или бензильную группу, которая может быть замещена атомом(ами) галогена.
9. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-6, где R1 представляет метильную группу или этильную группу.
10. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-9, где R4 представляет атом водорода.
11. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-10, где R2 представляет С1-С6 алкильную группу или С3-С6 циклоалкильную группу.
12. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-10, где R2 представляет этильную группу или циклопропильную группу.
13. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1 и 3-12, где R5 представляет (i) С1-С10 алкильную группу, (ii) С1-С10 алкильную группу, которая замещена одним или двумя заместителями, выбранными из следующей группы (где указанная группа состоит из С3-С8 циклоалкильной группы, пиридильной группы и фенильной, фенокси или нафтильной группы, которая может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из атома галогена и С1-С6 алкокси группы), (iii) С2-С8 алкенильную группу, которая может быть замещена фенильной группой, или (iv) фенильную группу, нафтильную группу, тиенильную группу, пирролильную группу, пиразолильную группу, пиридильную группу, фуранильную группу, бензотиенильную группу, изохинолинильную группу, изоксазолильную группу, тиазолильную группу, бензотиадиазолильную группу, бензоксадиазолильную группу, фенильную группу, сконденсированную с 5- - 7-членным насыщенным углеводородным кольцом, которое может содержать в качестве членов кольца один или два атома кислорода, урацильную группу, кумарильную, дигидроиндолильную или тетрагидроизохинолинильную группу, где каждая из указанных групп может быть замещена 1-5 заместителями, выбранными из следующей группы
[где указанная группа состоит из С1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, С2-С8 алкенильной группы, атома галогена, С1-С6 алкокси группы, которая может быть замещена атомом(ами) фтора, пиразолильной, оксазолильной, изоксазолильной, тиадиазолильной или пиримидинильной группы, которая может быть замещена заместителем(ями), выбранным из группы Y (где группа Y состоит из метильной группы, трифторметильной группы, атома галогена и метилсульфанильной группы), С1-С6 алкилтио группы, С1-С6 алкилсульфонильной группы, бензолсульфонильной группы, морфолиносульфонильной группы, морфолинокарбониламино группы, аминосульфонильной группы, С2-С10 алкоксикарбонильной группы, морфолино группы, которая может быть замещена С1-С6 алкильной группой(ами), фенильной группы, которая может быть замещена С1-С6 алкокси группой(ами), фенокси группы, пиридинкарбонильной группы, пиридинокси группы, циано группы, С2-С7 алканоильной группы, которая может быть замещена атомом(ами) фтора, и С2-С7 алканоиламино группы].
14. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-12, где R5 представляет С1-С10 алкильную группу, замещенную С3-С8 циклоалкильной группой, С1-С10 алкильную группу, замещенную нафтильной группой, С2-С8 алкенильную группу, замещенную фенильной группой, фенильную или нафтильную группу, которая может быть замещена 1-5 заместителями, выбранными из следующей группы (где указанная группа состоит из С1-С6 алкильной группы, атома галогена, С1-С6 алкокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы, С1-С6 алкилсульфонильной группы, С2-С7 алканоильной группы, С2-С7 алкоксикарбонильной группы и циано группы), пирролильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы и метоксикарбонильной группы, фуранильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из С1-С6 алкильной группы, трифторметильной группы и атома галогена), тиенильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из С1-С6 алкильной группы, трифторметильной группы, тиадиазолильной группы, оксазолильной группы и атома галогена), или бензотиенильную, дигидробензодиоксепинильную, бензодиоксолильную, дигидробензодиоксинильную, дигидробензофуранильную, тетрагидронафтильную, инданильную, тиадиазолильную, бензоксадиазолильную или бензотиадиазолильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы и атома галогена.
15. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-12, где R5 представляет С1-С6 алкильную группу, замещенную нафтильной группой, С2-С6 алкенильную группу, замещенную фенильной группой, незамещенную фенильную группу, фенильную группу, замещенную 1-5 заместителями, выбранными из следующей группы (где указанная группа состоит из метильной группы, метокси группы и атома галогена), фенильную группу, замещенную 1-3 заместителями, выбранными из следующей группы, и, по крайней мере, одно из ее 3- и 4-положений является замещенным (где указанная группа состоит из С1-С6 алкильной группы, атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы, метилсульфонильной группы, ацетильной группы, метоксикарбонильной группы и циано группы), нафтильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из атома галогена, С1-С6 алкильной группы, циано группы и С1-С6 алкилсульфонильной группы), фуранильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из трифторметильной группы и атома галогена, или бензотиенильную, бензоксадиазолильную, бензодиоксолильную, дигидробензодиоксинильную, дигидробензофуранильную, инданильную или бензотиадиазолильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы и атома галогена.
16. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-12, где R5 представляет фенильную группу, 3- и 4-положения которой замещены атомом галогена, или нафтильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена, С1-С6 алкильной группы и циано группы.
17. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-16, где R3 представляет фенильную группу, нафтильную группу, пиразолильную группу, пиридильную группу, индолильную группу, бензотиазолильную группу, бензотиадиазолильную группу, пиразолопиримидинильную группу, хинолинильную группу, изохинолинильную группу, бензотиенильную группу или дигидрохинолинонильную группу, где каждая из указанных групп может быть замещена 1-3 заместителями, выбранными из следующей группы [где указанная группа состоит из заместителей, перечисленных ниже: С1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, С3-С8 циклоалкильной группы, атома галогена, С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из атома фтора, фенильной группы, амино группы, замещенной двумя С1-С4 алкильными группами, и морфолино группы), фенокси группы, фенильной группы, карбоксильной группы, С2-С10 алкоксикарбонильной группы, гидроксильной группы, С2-С7 моноциклической насыщенной углеводородной группы, содержащей атом(ы) азота в качестве членов кольца (где указанная насыщенная углеводородная группа может быть замещена С1-С6 алкильной группой(ами)), азотсодержащей моноциклической ненасыщенной углеводородной группы, морфолинильной группы, которая может быть замещена С1-С6 алкильной группой(ами), пиперазино группы, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из С1-С6 алкильной группы (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, морфолино группой, гидроксильной группой или С1-С6 алкокси группой), формильной группы, С2-С7 алканоильной группы, карбамоильной группы, которая может быть замещена одной или двумя С1-С4 алкильными группами, аминосульфонильной группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, и С1-С6 алкилсульфонильной группы), и формулы
-NR7R8
где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, гидроксильной группой или С1-С6 алкокси группой), С1-С6 алканоильную группу, карбамоильную группу, которая может быть замещена одной или двумя С1-С4 алкильными группами, морфолинокарбонильную группу, аминосульфонильную группу, которая может быть замещена одной или двумя С1-С6 алкильными группами, или С1-С6 алкилсульфонильную группу, или, альтернативно, R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородное кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы].
18. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-16, где R3 представляет 2-нафтильную группу (где указанная нафтильная группа может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы), 3-пиразолильную группу (где указанная пиразолильная группа может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы, трифторметильной группы и атома галогена), или 5-бензотиазолильную, 5-бензотиадиазолильную, 7-дигидрохинолинонильную, 7-изохинолинильную, 7-хинолинильную, 3-пиридильную или индолильную группу, которая может быть замещена С1-С6 алкильной группой(ами), незамещенную фенильную группу или замещенную фенильную группу, показанную ниже в (А)-(С):
(А) фенильную группу, 4-положение которой замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, С3-С8 циклоалкильной группы, С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, морфолино группы и фенильной группы), атома галогена, трифторметокси группы, фенокси группы, фенильной группы, 1-пирролильной группы и -NRARB (где RA и RB, каждый, представляют С1-С6 алкильную группу, или RA и RBнеобязательно образуют вместе с атомом азота, к которому присоединены RA и RB, 3- - 5-членное насыщенное углеводородное кольцо), и далее 3-положение которой может быть замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, атома галогена и С1-С6 алкокси группы,
(В) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из гидроксильной группы, С1-С6 алкильной группы и С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, морфолино группы и фенильной группы), и далее которая может быть замещена одной или двумя С1-С6 алкильными группами, или 4-положение которой может быть замещено атомом галогена,
и
(С) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных ниже в (i)-(v), и, дополнительно, 4-положение которой может быть замещено атомом галогена:
(i) С2-С7 моноциклической насыщенной углеводородной группы, содержащей в качестве члена(ов) кольца атом(ы) азота (где указанная насыщенная углеводородная группа может быть замещена С1-С6 алкильной группой(ами)),
(ii) азотсодержащей моноциклической ненасыщенной углеводородной группы,
(iii) морфолинильной группы, которая может быть замещена С1-С6 алкильной группой(ами),
(iv) пиперазино группы [где указанная пиперазино группа может быть замещена С1-С6 алкильной группой, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из амино группы, замещенной двумя С1-С4 алкильными группами, и морфолино группы), или С2-С7 алканоильной группой], и
(v) формула -NR7R8
где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, гидроксильной группой или С1-С6 алкокси группой), С1-С6 алканоильную группу, карбамоильную группу, которая может быть замещена одной или двумя С1-С4 алкильными группами, морфолинокарбонильную группу, аминосульфонильную группу, которая может быть замещена одной или двумя С1-С6 алкильными группами, или С1-С6 алкилсульфонильную группу, или, альтернативно, R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородное кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
19. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-16, где R3 представляет фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных ниже в (i)-(v), и, дополнительно, 4-положение которой может быть замещено атомом галогена:
(i) С2-С7 моноциклической насыщенной углеводородной группы, содержащей в качестве члена(ов) кольца атом(ы) азота (где указанная насыщенная углеводородная группа может быть замещена С1-С6 алкильной группой(ами)),
(ii) азотсодержащей моноциклической ненасыщенной углеводородной группы,
(iii) морфолинильной группы, которая может быть замещена С1-С6 алкильной группой(ами),
(iv) пиперазино группы [где указанная пиперазино группа может быть замещена С1-С6 алкильной группой, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из амино группы, замещенной двумя С1-С4 алкильными группами, и морфолино группы), или С2-С7 алканоильной группой], и
(v) формула -NR7R8
где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, гидроксильной группой или С1-С6 алкокси группой), С1-С6 алканоильную группу, карбамоильную группу, которая может быть замещена одной или двумя С1-С4 алкильными группами, морфолинокарбонильную группу, аминосульфонильную группу, которая может быть замещена одной или двумя С1-С6 алкильными группами, или С1-С6 алкилсульфонильную группу, или, альтернативно, R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородной кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
20. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-16, где R3 представляет фенильную группу, 4-положение которой замещено атомом фтора или хлора.
21. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1-16, где R3 представляет 6-индолильную группу.
22. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1 и 3-16, где R3 представляет С1-С18 алкильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из атома галогена, амино группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, С1-С6 алкокси группы, пиперазино группы, которая может быть замещена С1-С6 алкильной группой(ами), фенильной группы и морфолино группы), С2-С8 алкенильную группу, С2-С8 алкинильную группу или С3-С8 циклоалкильную группу.
23. Соединение или его фармацевтически приемлемая соль согласно любому из воплощений 1 и 3-16, где R3 представляет С1-С6 алкильную группу, замещенную заместителем(ями), выбранным из следующей группы (где указанная группа состоит из амино группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, и С1-С6 алкокси группы), или С3-С5 циклоалкильную группу.
24. Фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль согласно любому из воплощений 1-23.
25. Фармацевтическая композиция согласно воплощению 24, которая является терапевтическим агентом от аутоиммунного заболевания, такого как болезнь Крона, спастический колит, синдром Сьегрена, рассеянный склероз или системная красная волчанка, ревматоидного артрита, астмы, атопического дерматита, отторжения после трансплантации органов, рака, ретинопатии, псориаза, остеоартрита или связанной с возрастом макулярной деградации.
26. Соединение, представленное формулой (II), или его соль:
[Формула 9]

(где R1, R2и R3 имеют значения, определенные выше в воплощении 1, и Y4и Y5, каждый, представляет атом азота или формулу СR17 (где R17 представляет атом водорода, С1-С6 алкильную группу, фенильную группу или атом галогена), при условии, что один из Y4и Y5 представляет атом азота).
27. Соединение или его соль согласно воплощению 26, где в формуле (II) Y4 представляет СН и Y5 представляет атом азота.
28. Соединение или его соль согласно воплощению 26 или 27, где R1 представляет С1-С6 алкильную группу, которая может быть замещена атомом(ами) галогена, или бензильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы.
29. Соединение или его соль согласно воплощению 26 или 27, где R1 представляет метильную группу, этильную группу или бензильную группу, которая может быть замещена атомом(ами) галогена.
30. Соединение или его соль согласно воплощению 26 или 27, где R1 представляет метильную группу или этильную группу.
31. Соединение или его соль согласно любому из воплощений 26-30, где R2 представляет С1-С6 алкильную группу или С3-С8 циклоалкильную группу.
32. Соединение или его соль согласно любому из воплощений 26-30, где R2 представляет этильную группу или циклопропильную группу.
33. Соединение или его соль согласно любому из воплощений 26-32, где R3 представляет фенильную группу, нафтильную группу, пиразолильную группу, пиридильную группу, индолильную группу, бензотиазолильную группу, бензотиадиазолильную группу, пиразолопиримидинильную группу, хинолинильную группу, изохинолинильную группу, бензотиенильную группу или дигидрохинолинонильную группу, где каждая из указанных групп может быть замещена 1-3 заместителями, выбранными из следующей группы [где указанная группа состоит из заместителей, перечисленных ниже: С1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, С3-С8 циклоалкильной группы, атома галогена, С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из атома фтора, фенильной группы, амино группы, замещенной двумя С1-С4 алкильными группами, и морфолино группы), фенокси группы, фенильной группы, карбоксильной группы, С2-С10 алкоксикарбонильной группы, гидроксильной группы, С2-С7 моноциклической насыщенной углеводородной группы, содержащей атом(ы) азота в качестве члена(ов) кольца(ец) (где указанная насыщенная углеводородная группа может быть замещена С1-С6 алкильной группой(ами)), азотсодержащей моноциклической ненасыщенной углеводородной группы, морфолинильной группы, которая может быть замещена С1-С6 алкильной группой(ами), пиперазино группы, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, морфолино группой, гидроксильной группой или С1-С6 алкокси группой), формильной группы, С2-С7 алканоильной группы, карбамоильной группы, которая может быть замещена одной или двумя С1-С4 алкильными группами, аминосульфонильной группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, и С1-С6 алкилсульфонильной группы], и формулы
-NR7R8
где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, гидроксильной группой или С1-С6 алкокси группой), С1-С6 алканоильную группу, карбамоильную группу, которая может быть замещена одной или двумя С1-С4 алкильными группами, морфолинокарбонильную группу, аминосульфонильную группу, которая может быть замещена одной или двумя С1-С6 алкильными группами, или С1-С6 алкилсульфонильную группу, или, альтернативно, R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородной кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы].
34. Соединение или его соль согласно любому из воплощений 26-32, где R3 представляет 2-нафтильную группу (где указанная нафтильная группа может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы), 3-пиразолильную группу (где указанная пиразолильная группа может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы, трифторметильной группы и атома галогена), или 5-бензотиазолильную, 5-бензотиадиазолильную, 7-дигидрохинолинонильную, 7-изохинолинильную, 7-хинолинильную, 3-пиридильную или индолильную группу, которая может быть замещена С1-С6 алкильной группой(ами), незамещенную фенильную группу или замещенную фенильную группу, показанную ниже в (А)-(С):
(А) фенильную группу, 4-положение которой замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, С3-С8 циклоалкильной группы, С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, морфолино группы и фенильной группы), атома галогена, трифторметокси группы, фенокси группы, фенильной группы, 1-пирролильной группы и -NRARB (где RA и RB, каждый, представляет С1-С6 алкильную группу, или RA и RBнеобязательно образуют вместе с атомом азота, к которому RA и RB присоединены, 3- - 5-членное насыщенное углеводородное кольцо), и далее 3-положение которого может быть замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, атома галогена и С1-С6 алкокси группы,
(В) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из гидроксильной группы, С1-С6 алкильной группы и С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, морфолино группы и фенильной группы), и, дополнительно, которая может быть замещена одной или двумя С1-С6 алкильными группами, или 4-положение которой может быть замещено атомом галогена,
и
(С) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных ниже в (i)-(v), и, дополнительно, 4-положение которой может быть замещено атомом галогена:
(i) С2-С7 моноциклической насыщенной углеводородной группы, содержащей в качестве члена(ов) кольца атом(ы) азота (где указанная насыщенная углеводородная группа может быть замещена С1-С6 алкильной группой(ами)),
(ii) азотсодержащей моноциклической ненасыщенной углеводородной группы,
(iii) морфолинильной группы, которая может быть замещена С1-С6 алкильной группой(ами),
(iv) пиперазино группа [где указанная пиперазино группа может быть замещена С1-С6 алкильной группой, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из амино группы, замещенной двумя С1-С4 алкильными группами, и морфолино группы), или С2-С7 алканоильной группой], и
(v) формула -NR7R8
где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, морфолино группой, гидроксильной группой или С1-С6 алкокси группой), С1-С6 алканоильную группу, карбамоильную группу, которая может быть замещена одной или двумя С1-С4 алкильными группами, морфолинокарбонильную группу, аминосульфонильную группу, которая может быть замещена одной или двумя С1-С6 алкильными группами, или С1-С6 алкилсульфонильную группу, или, альтернативно R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородное кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
35. Соединение или его соль согласно любому из воплощений 26-32, где R3 представляет С1-С18 алкильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы (где указанная группа состоит из атома галогена, амино группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, С1-С6 алкокси группы, пиперазино группы, которая может быть замещена С1-С6 алкильной группой(ами), фенильной группы и морфолино группы), С2-С8 алкенильную группу, С2-С8 алкинильную группу или С3-С8 циклоалкильную группу.
Настоящее изобретение будет проиллюстрировано подробно ниже.
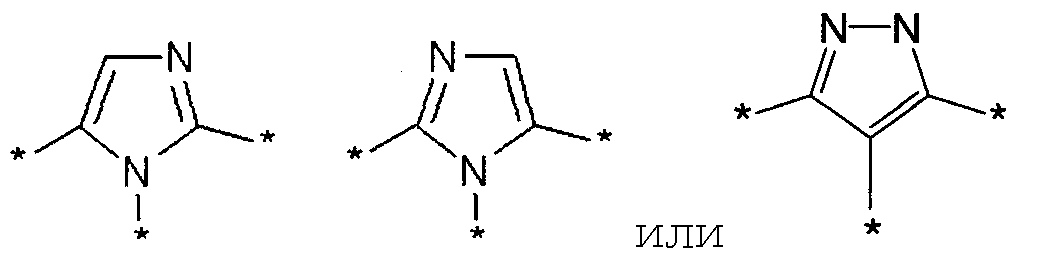
Имеется в виду, что моноциклическое гетероциклическое кольцо, содержащее один или два атома азота, представленное символом Ar, включает пиррол, имидазол и пиразол, показанные ниже.
[Формула 10]

Термин “атом галогена” относится к атому фтора, хлора, брома или йода.
Термин “С1-С6 алкильная группа” относится к линейной или разветвленной алкильной группе, содержащей 1-6 атомов углерода. Примеры ее включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу и н-гексильную группу.
Термин “С3-С8 циклоалкильная группа” относится к циклоалкильной группе, содержащей 3-8 атомов углерода. Примеры ее включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Термин “С2-С8 алкенильная группа” относится к линейной или разветвленной алкенильной группе, содержащей 2-8 атомов углерода. Примеры ее включают винильную группу, аллильную группу, 1-пропенильную группу, изопропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1,3-бутадиенильную группу, 2-метилаллильную группу, 2-метил-пропенильную группу, 2-пентенильную группу и 3-метил-бут-2-енильную группу.
Термин “С2-С8 алкинильная группа” относится к линейной или разветвленной алкинильной группе, содержащей 2-8 атомов углерода. Примеры ее включают этинильную группу, 2-пропинильную группу, 2-бутинильную группу, 1-метил-проп-2-инильную группу, 2-пентинильную группу и 4-пентинильную группу.
Термин “С1-С6 алкокси группа” относится к линейной или разветвленной алкокси группе, содержащей 1-6 атомов углерода. Примеры ее включают метокси группу, этокси группу, пропокси группу, изопропокси группу, бутокси группу, изобутокси группу, втор-бутокси группу, трет-бутокси группу, пентилокси группу и гексилокси группу.
Термин “С1-С10 алкильная группа” относится к линейной или разветвленной алкильной группе, содержащей 1-10 атомов углерода. Примеры ее включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу, н-гексильную группу, н-гептильную группу, н-октильную группу и н-гексадецильную группу.
Термин “С1-С6 алкилтио группа” относится к линейной или разветвленной алкилтио группе, содержащей 1-6 атомов углерода. Примеры ее включают метилтио группу, этилтио группу, пропилтио группу, изопропилтио группу, бутилтио группу, изобутилтио группу, пентилтио группу и гексилтио группу.
Термин “С1-С6 алкилсульфонильная группа” относится к линейной или разветвленной алкилсульфонильной группе, содержащей 1-6 атомов углерода. Примеры ее включают метансульфонильную группу, этансульфонильную группу, пропан-2-сульфонильную группу и гексансульфонильную группу.
Термин “С2-С10 алкоксикарбонильная группа” относится к линейной или разветвленной алкоксикарбонильной группе, содержащей 2-10 атомов углерода. Примеры ее включают С2-С7 алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа и трет-бутоксикарбонильная группа, также как и октилоксикарбонильную группу.
Термин “С2-С7 алканоильная группа” относится к линейной или разветвленной алканоильной группе, содержащей 2-7 атомов углерода. Примеры ее включают ацетильную, пропаноильную группу, бутаноильную группу и гексаноильную группу.
Термин “С1-С6 алканоильная группа” относится к линейной или разветвленной алканоильной группе, содержащей 1-6 атомов углерода. Примеры ее включают формильную группу, ацетильную группу, пропаноильную группу и бутаноильную группу.
Имеется в виду, что фраза “амино группа, которая может быть замещена одной или двумя С1-С6 алкильными группами”, включает, например, амино группу, метиламино группу, этиламино группу, изопропиламино группу, гексиламино группу, диметиламино группу, диэтиламино группу, диизопропиламино группу и дигексиламино группу.
Имеется в виду, что фраза “аминосульфонильная группа, которая может быть замещена одной или двумя С1-С6 алкильными группами”, включает, например, сульфамоильную группу, диметиламиносульфонильную группу и диэтиламиносульфонильную группу.
Имеется в виду, что фраза “карбамоильная группа, которая может быть замещена С1-С4 алкильной группой(ами)”, включает карбамоильную группу, метилкарбамоильную группу, этилкарбамоильную группу и пропилкарбамоильную группу.
Фраза “пиперазино группа, которая может быть замещенной” или “необязательно замещенная пиперазино группа”, относится к пиперазино группе, которая может быть замещена (предпочтительно по ее атому азота) заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, морфолино группой, гидроксильной группой или С1-С6 алкокси группой), формильной группы, С2-С7 алканоильной группы, карбамоильной группы, которая может быть замещена одной или двумя С1-С4 алкильными группами, аминосульфонильной группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, и С1-С6 алкилсульфонильной группы. Конкретные примеры включают пиперазино группу, метилпиперазино группу, изопропилпиперазино группу, диметиламиноэтилпиперазино группу и ацетилпиперазино группу.
Фраза “С2-С7 моноциклическая насыщенная углеводородная группа, содержащая атом(ы) азота в качестве члена(ов) кольца”, относится к 3- - 9-членной моноциклической насыщенной углеводородной группе, которая содержит один или два атома азота в качестве ее членов кольца и замещена через ее кольцевой атом углерода. Примеры включают азетидинильную группу, пирролидинильную группу и пиперидинильную группу (например, 4-пиперидинильную группу).
Термин “азотсодержащая моноциклическая ненасыщенная углеводородная группа” относится к 5- или 6-членному ненасыщенному кольцу, содержащему 1-3 атома азота в качестве членов кольца. Примеры включают пирролильную группу (например, пиррол-1-ильную группу), имидазол-1-ильную группу (например, имидазолильную группу), пиразолильную группу, триазол-4-ильную группу (например, [1,2,4]триазол-4-ильную группу) и пиридильную группу.
Подразумевается, что 3- - 5-членное насыщенное углеводородное кольцо, образуемое RA и RB вместе с атомом азота, к которому присоединены RA и RB, включает азиридинильную группу, азетидинильную группу и пирролидинильную группу.
Подразумевается, что 3- - 8-членное насыщенное углеводородное кольцо, образуемое R7 и R8 (или RС и RD) вместе с атомом азота, к которому присоединены R7 и R8 (или RС и RD), включает азиридинильную группу, азетидинильную группу, пирролидинильную группу и пиперидинильную группу.
Подразумевается, что фраза “фенильная группа, сконденсированная с 5- - 7-членным насыщенным углеводородным кольцом, которое может содержать в качестве членов кольца один или два атома кислорода”, включает бензодиоксепинильную группу, бензодиоксолильную группу, дигидробензодиоксинильную группу, дигидробензофуранильную группу, тетрагидронафтильную группу и инданильную группу.
Термин “арильная группа”, используемый здесь, относится к ароматической углеводородной группе, частично насыщенной ароматической углеводородной группе, ароматической гетероциклической группе или частично насыщенному ароматическому гетероциклическому кольцу. Ароматическая углеводородная группа относится, например, к С6-С14 ароматической углеводородной группе, включающей фенильную группу, нафтильную и антрильную группу.
Частично насыщенная ароматическая углеводородная группа относится к группе, получаемой частичным насыщением С6-С14 полициклической ароматической углеводородной группы. Примеры включают тетрагидронафтильную группу и инданильную группу.
Ароматическая гетероциклическая группа относится к С2-С13 моноциклической или полициклической ароматической и гетероциклической группе, содержащей 1-6 гетероатома (например, атомов кислорода, серы и/или азота). Примеры ее включают тиенильную группу, фуранильную группу, пирролильную группу, изотиазолильную группу, изоксазолильную группу, пиразолильную группу, тиазолильную группу, оксазолильную группу, имидазолильную группу, пиридильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, бензотиенильную группу, бензофуранильную группу, индолильную группу, бензотиазолильную группу, бензоксазолильную группу, бензимидазолильную группу, хинолинильную группу, изохинолинильную группу, бензоксадиазолильную группу, бензотиадиазолильную группу и пиразолопиримидинильную группу (например, 5,7-диметил-пиразоло[1,5-a]пирмидин-2-ильную группу).
Частично насыщенное ароматическое гетероциклическое кольцо относится к гетероциклическому кольцу, получаемому частичным насыщением полициклической ароматической гетероциклической группы. Такое гетероциклическое кольцо может быть замещено оксо группой. Примеры его включают дигидрохинолинильную группу:
[Формула 11]

дигидробензофуранильную группу, дигидробензодиоксинильную группу, дигидробензодиоксепинильную группу, бензодиоксолильную группу, дигидробензоксазолильную группу и дигидробензоксазинильную группу.
В случае, когда такая арильная группа является замещенной, заместители для арильной группы включают заместители, перечисленные ниже, и арильная группа может быть замещена 1-5 данными заместителями:
атом галогена, циано группу, нитро группу, сульфамоильную группу, гидроксильную группу, карбоксильную группу, С1-С6 алкильную группу, трифторметильную группу, метоксикарбонилэтильную группу, С1-С6 алкокси группу (где указанная алкокси группа может быть замещена фенильной группой, С1-С6 алкиламино группой, С2-С12 диалкиламино группой или морфолино группой), трифторметокси группу, дифторметокси группу, цианоэтокси группу,
С2-С8 алкенильную группу, С2-С8 алкинильную группу,
С3-С8 циклоалкильную группу, С2-С7 алканоильную группу, трифторацетильную группу, С2-С10 алкоксикарбонильную группу,
фенильную группу (где указанная фенильная группа может быть замещена С2-С7 алканоильной группой или С1-С6 алкокси группой),
фенокси группу, которая может быть замещена С1-С6 алкокси группой,
пиразолильную группу, 1-метил-5-трифторметил-1Н-пиразол-3-ильную группу, метилпиримидинильную группу, 2-метилсульфанил-пиримидин-4-ильную группу, оксазолильную группу (например, оксазол-5-ильную группу),
изоксазол-5-ильную группу, 5-трифторметил-изоксазол-3-ильную группу, пиридилокси группу (например, 4-пиридилокси группу),
пиридинкарбонильную группу, бензоильную группу, пирролильную группу (например, пиррол-1-ильную группу), имидазолильную группу (например, имидазол-1-ильную группу), тиазолильную группу,
[1,2,3]тиадиазол-4-ильную группу, триазолильную группу (например, [1,2,4]триазол-4-ильную группу), С1-С6 алкилтио группу (например, метилтио группу), С1-С6 алкилсульфонильную группу (например, метансульфонильную группу), бензолсульфонильную группу, пирролидинсульфонильную группу, морфолинилсульфонильную группу, 4-пиперидинильную группу, которая может быть замещена С1-С6 алкильной группой(ами), морфолино группу, которая может быть замещена С1-С6 алкильной группой(ами), пиперазино группу, которая замещена С1-С6 алкильной группой(ами) или С1-С6 алкильной группой(ами), замещенной(ыми) диметиламино группой, или
группу, представленную формулой -NR7R8 [где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена С1-С6 алкокси группой или диметиламино группой), С1-С6 алканоильную группу, карбамоильную группу, карбамоильную группу, замещенную С1-С4 алкильной группой(ами), морфолинокарбонильную группу, диметиламиносульфонильную группу или С1-С6 алкилсульфонильную группу, или, альтернативно, R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородное кольцо, где указанное кольцо может быть замещено диметилендиокси группой, оксо группой или гидроксильной группой] (например, ацетамидо, диметиламино, метилуреидо, бутилуреидо, триметилуреидо, морфолинилкарбониламино группой), метоксиэтилуреидо группу и пиридилэтоксикарбониламино группу.
Термин “фармацевтически приемлемая соль” относится к соли щелочного, щелочноземельного металла, аммония или алкиламмония, или соли минеральной или органической кислоты. Примеры ее включают натриевую соль, калиевую соль, кальциевую соль, аммониевую соль, алюминиевую соль, триэтиламмониевую соль, ацетатную соль, пропионатную соль, бутиратную соль, формиатную соль, трифторацетатную соль, малеатную соль, тартратную соль, цитратную, стеаратную, сукцинатную, этилсукцинатную, лактобионатную соль, глюконатную соль, глюкогептатную соль, бензоатную соль, метансульфонатную соль, этансульфонатную соль, 2-гидроксиэтансульфонатную соль, бензолсульфонатную соль, паратолуолсульфонатную соль, лаурилсульфатную соль, малатную соль, аспартатную соль, глютаматную соль, адипатную соль, соль с цистеином, соль с N-ацетилцистеином, гидрохлоридную соль, гидробромидную соль, фосфатную соль, сульфатную соль, гидроиодидную соль, никотинатную соль, оксалатную соль, пикратную соль, тиоцианатную соль, ундеканоатную соль, соль с акрилатным полимером и соль с карбоксивиниловым полимером.
Соединения настоящего изобретения могут иметь стереоизомеры, включая оптические изомеры, диастереоизомеры и геометрические изомеры. Все из указанных стереоизомеров и их смеси охватываются объемом настоящего изобретения. Некоторые из соединений и промежуточных соединений настоящего изобретения могут также существовать, например, в виде кетоенольных таутомеров.
Как показано в примере испытания, описанном далее, соединения настоящего изобретения оказывают сильное ингибирующее воздействие на связывание между S1P и его рецептором Edg-1(S1P1), и, следовательно, ожидается, что они оказывают профилактическое или терапевтическое воздействие на аутоиммунные заболевания, такие как болезнь Крона, спастический колит, синдром Сьегрена, рассеянный склероз и системная красная волчанка, также как и на другие заболевания, такие как ревматоидный артрит, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартрит, связанная с возрастом макулярная деградация и пр.
Предпочтительные воплощения соединений настоящего изобретения будут даны ниже.
Предпочтительным примером Ar является 5-членное ненасыщенное кольцо, содержащее один или два атома азота. Более предпочтительной является имидазольная группа, представленная следующей формулой:
[Формула 12]


и еще более предпочтительной является

Данные кольца могут быть замещены заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, фенильной группы и атома галогена. Более предпочтительно Ar является незамещенным.
Предпочтительным примером А является атом кислорода.
Предпочтительным примером R1 является С1-С6 алкильная группа, которая может быть замещена атомом(ами) галогена или бензильной группой, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы. Более предпочтительной является метильная, этильная или бензильная группа, которая может быть замещена атомом(ами) галогена (более предпочтительно атомом(ами) фтора), и еще более предпочтительной является метильная группа.
Предпочтительным примером R2 является этильная группа или циклопропильная группа.
Предпочтительным примером R4 является атом водорода.
Предпочтительным примером R3 является С1-С6 алкильная группа, замещенная заместителем(ями), выбранным из следующей группы (где указанная группа состоит из амино группы, которая может быть замещена одной или двумя С1-С6 алкильными группами, и С1-С6 алкокси группы), С3-С5 циклоалкильную группу или необязательно замещенную фенильную группу, 2-нафтильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из атома галогена и С1-С6 алкильной группы, 3-пиразолильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы), трифторметильной группы и атома галогена], или 5-бензотиазолильную, 5-бензотиадиазолильную, 7-дигидрохинолинонильную, 7-изохинолинильную, 7-хинолинильную, 3-пиридильную или индолильную (предпочтительно 6-индолильную) группу, которая может быть замещена С1-С6 алкильной группой(ами) (предпочтительно метильной группой).
Имеется в виду, что “необязательно замещенная фенильная группа” среди предпочтительных воплощений группы R3 включает незамещенную фенильную группу и замещенную фенильную группу, показанную ниже в (А)-(С):
(А) фенильную группу, 4-положение которой замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, С3-С8 циклоалкильной группы, С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, морфолино группы и фенильной группы), атома галогена, трифторметокси группы, фенокси группы, фенильной группы, 1-пирролильной группы и -NRARB (где RA и RB, каждый, представляет С1-С6 алкильную группу или RA и RBнеобязательно образуют вместе с атомом азота, к которому присоединены RA и RB, 3- - 5-членное насыщенное углеводородное кольцо), и далее 3-положение которой может быть замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, атома галогена и С1-С6 алкокси группы,
(В) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из гидроксильной группы, С1-С6 алкильной группы и С1-С6 алкокси группы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, морфолино группы и фенильной группы), и далее которая может быть замещена одной или двумя С1-С6 алкильными группами или 4-положение которой может быть замещено атомом галогена, и
(С) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных ниже в (i)-(v), и, дополнительно, 4-положение которой может быть необязательно замещено атомом галогена, где азот в указанной азотсодержащей группе является предпочтительно третичным и предпочтительно используемым для присоединения к фенильной группе:
(i) С2-С7 моноциклической насыщенной углеводородной группы, содержащей в качестве члена(ов) кольца атом(ы) азота, которая замещена в фенильной группе через атом углерода (где указанная насыщенная углеводородная группа может быть замещена С1-С6 алкильной группой(ами)) (например, пиперидинильная группа, которая может быть замещена С1-С6 алкильной группой(ами), примером которой является 4-пиперидинильная группа),
(ii) азотсодержащей моноциклической ненасыщенной углеводородной группы (например, пирролильной группы, имидазолильной группы),
(iii) морфолинильной группы, которая может быть замещена С1-С6 алкильной группой(ами) (например, морфолино группы),
(iv) необязательно замещенной пиперазино группы [например, пиперазино группа, которая может быть замещена (предпочтительно по ее кольцевому атому азота) заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (где указанная алкильная группа может быть замещена заместителем(ями), выбранным из группы, состоящей из амино группы, замещенной двумя С1-С4 алкильными группами, и морфолино группы), и С2-С7 алканоильной группы]], и
(v) формула -NR7R8
где R7 и R8, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С6 алкильными группами, морфолино группой, гидроксильной группой или С1-С6 алкокси группой), С1-С6 алканоильную группу, карбамоильную группу, которая может быть замещена одной или двумя С1-С4 алкильными группами, морфолинокарбонильную группу, аминосульфонильную группу, которая может быть замещена одной или двумя С1-С6 алкильными группами, или С1-С6 алкилсульфонильную группу, или, альтернативно, R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3- - 8-членное насыщенное углеводородное кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы].
Формула -NR7R8в (v) более предпочтительно является формулой -NRСRD, определенной ниже:
RС и RD, каждый, представляет атом водорода, С1-С6 алкильную группу (где указанная алкильная группа может быть замещена амино группой, которая может быть замещена одной или двумя С1-С4 алкильными группами, гидроксильной группой или С1-С4 алкокси группой), формильную группу, ацетильную группу, аминокарбонильную группу, диметиламиносульфонильную или метилсульфонильную группу, или, альтернативно, RС и RD необязательно образуют вместе с атомом азота, к которому присоединены RС и RD, 3- - 8-членное насыщенное углеводородное кольцо, где указанное кольцо может быть замещено заместителем(ями), выбранным из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
Особенно предпочтительным воплощением R3 является фенильная группа, 4-положение которой замещено атомом фтора или хлора, 6-индолильная группа или фенильная группа, которая замещена заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных в (i), (iv) и (v) воплощениях пункта (С) выше, и, дополнительно, 4-положение которой может быть замещено атомом галогена.
Предпочтительным воплощением R5 является С1-С10 (предпочтительно С1-С6) алкильная группа, замещенная С3-С8 циклоалкильной группой, С1-С10 (предпочтительно С1-С6) алкильная группа, замещенная нафтильной группой, С2-С8(предпочтительно С2-С6) алкенильная группа, замещенная фенильной группой, фенильная группа или нафтильная группа (предпочтительно 2-нафтильная группа), которая может быть замещена 1-5 заместителями, выбранными из следующей группы (где указанная группа состоит из С1-С6 алкильной группы, атома галогена, С1-С6 алкокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы, С1-С6 алкилсульфонильной группы, С2-С7 алканоильной группы, С2-С7 алкоксикарбонильной группы и циано группы), пирролильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы) и метоксикарбонильной группы], фуранильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы), трифторметильной группы и атома галогена], тиенильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы), трифторметильной группы, тиадиазолильной группы, оксазолильной группы и атома галогена], или, альтернативно, бензотиенильную группу (предпочтительно 2-бензотиенильную группу), фенильную группу, сконденсированную с 5- - 7-членным насыщенным углеводородным кольцом, которое может содержать один или два атома кислорода в качестве членов кольца (например, бензодиоксепинильную группу, бензодиоксолильную группу, дигидробензодиоксинильную группу, дигидробензофуранильную группу, тетрагидронафтильную группу группу, инданильную группу), тиадиазолильную, бензоксадиазолильную группу или бензотиадиазолильную группу (предпочтительно 5-бензотиадиазолильную группу), каждая из которых может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы (предпочтительно метильной группы) и атома галогена.
Имеется в виду, что “фенильная группа, которая может быть замещенной”, среди предпочтительных воплощений группы R5 включает незамещенную фенильную группу, фенильную группу, которая замещена 1-5 заместителями, выбранными из группы, состоящей из С1-С6 алкильной группы (предпочтительно метильной группы), С1-С6 алкокси группы (предпочтительно метокси группы) и атома галогена, и фенильную группу, которая замещена 1-3 заместителями, выбранными из следующей группы, и, по крайней мере, одно из 3- и 4-положений которой является замещенным, где указанная группа состоит из С1-С6 алкильной группы, атома галогена, С1-С6 алкокси группы (предпочтительно метокси группы), трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы, С1-С6 алкилсульфонильной группы (предпочтительно метилсульфонильной группы), метоксикарбонильной группы, ацетильной группы и циано группы, более предпочтительно атома галогена, метильной группы и метокси группы и еще более предпочтительно атома галогена.
Имеется в виду, что “нафтильная группа, которая может быть замещенной”, среди предпочтительных воплощений группы R5 включает нафтильную группу, которая может быть замещена заместителем(ями) (предпочтительно 1-3 заместителями), выбранными из группы, состоящей из атома галогена, С1-С6 алкильной группы (предпочтительно метильной группы), циано группы и С1-С6 алкилсульфонильной группы (предпочтительно метилсульфонильной группы). Более предпочтительной является нафтильная группа, которая замещена заместителем(ями), выбранным из группы, состоящей из атома галогена, С1-С6 алкильной группы (предпочтительно метильной группы) и циано группы. В случае 2-нафтильной группы, примеры включают незамещенную 2-нафтильную группу и 2-нафтильную группу, которая замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы (замещенной в любом положении, более предпочтительно в 5-, 7- и/или 8- положении(ях)) и других заместителей (замещенных в 5-, 7- и/или 8-положении(ях)). Аналогичным образом, в случае 1-нафтильной группы примеры ее включают незамещенную нафтильную группу и 1-нафтильную группу, которая замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы (замещенной в любом положении), и других заместителей, предпочтительно атома галогена (замещенного предпочтительно в 4-положении).
Особенно предпочтительным воплощением R5 является фенильная группа, 3- и 4-положения которой, каждое, замещены атомом галогена, незамещенная 2-нафтильная группа или 2-нафтильная группа, 5-, 7- и/или 8-положение(я) которой замещено(ы) заместителем(ями), выбранным из группы, состоящей из атома галогена, С1-С6 алкильной (предпочтительно метильной) группы и циано группы.
Особенно предпочтительными воплощениями R3 и R5 являются следующие.
В случае, когда R3 является фенильной группой, 4-положение которой замещено атомом фтора или хлора, R5 представляет С1-С10 (предпочтительно С1-С6) алкильную группу, замещенную нафтильной группой, С2-С8(предпочтительно С2-С6) алкенильную группу, замещенную фенильной группой, замещенную фенильную группу [например, фенильную группу, которая замещена 1-5 метильными группами, фенильную группу, которая замещена 1-3 заместителями, выбранными из следующей группы, и, по крайней мере, одно из 3- и 4-положений которой является замещенным, где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы, этильной группы, пропильной группы), атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы (предпочтительно винильной группы), метоксикарбонильной группы, ацетильной группы и циано группы], бензотиенильную группу, нафтильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из атома галогена, С1-С6 алкильной группы (предпочтительно метильной группы), циано группы и С1-С6 алкилсульфонильной группы (предпочтительно метилсульфонильной группы)], пирролильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из метильной группы и метоксикарбонильной группы, тиенильную группу, замещенную С1-С6 алкильной группой(ами) (предпочтительно метильной группой), или бензодиоксолильную группу, дигидробензодиоксинильную группу, дигидробензофуранильную группу, тетрагидронафтильную группу, инданильную группу или бензотиадиазолильную группу (предпочтительно 5-бензотиадиазолильную группу).
В случае, когда R3 представляет 6-индолильную группу:
R5 представляет С1-С10 (предпочтительно С1-С6) алкильную группу, замещенную нафтильной группой, С2-С8(предпочтительно С2-С6) алкенильную группу, замещенную фенильной группой, необязательно замещенную фенильную группу [например, незамещенную фенильную группу, фенильную группу, которая замещена 1-5 метильными группами, фенильную группу, которая замещена 1-3 заместителями, выбранными из следующей группы, и, по крайней мере, одно из 3- и 4-положений которой является замещенным, где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы, этильной группы, пропильной группы), атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы (предпочтительно винильной группы), метоксикарбонильной группы, ацетильной группы и циано группы], бензотиенильную группу, нафтильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из атома галогена, С1-С6 алкильной группы (предпочтительно метильной группы), циано группы и С1-С6 алкилсульфонильной группы (предпочтительно метилсульфонильной группы)], пирролильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы (предпочтительно метильной группы) и метоксикарбонильной группы, или бензодиоксолильную группу, дигидробензодиоксинильную группу, дигидробензофуранильную группу, тетрагидронафтильную группу, инданильную группу или бензотиадиазолильную (предпочтительно 5-бензотиадиазолильную) группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной (предпочтительно метильной) группы) и атома галогена.
В случае, когда R3 является воплощением, показанным в (С) выше:
R5 представляет С1-С6 алкильную группу, замещенную С3-С8циклоалкильной группой, С1-С10 (предпочтительно С1-С6) алкильную группу, замещенную нафтильной группой, С2-С8(предпочтительно С2-С6) алкенильную группу, замещенную фенильной группой, необязательно замещенную фенильную группу [например, незамещенную фенильную группу, фенильную группу, которая замещена 1-5 заместителями, выбранными из С1-С6 алкильной группы (предпочтительно метильной группы) и атома галогена, фенильную группу, которая замещена 1-3 заместителями, выбранными из следующей группы, и, по крайней мере, одно из 3- и 4-положений которой является замещенным, где указанная группа состоит из С1-С6 алкильной группы, атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, С1-С6 алкенильной группы, С1-С6 алкилсульфонильной группы (предпочтительно метилсульфонильной группы)], метоксикарбонильной группы, ацетильной группы и циано группы], нафтильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из атома галогена, С1-С6 алкильной группы (предпочтительно метильной группы), циано группы и С1-С6 алкилсульфонильной группы (предпочтительно метилсульфонильной группы)], пирролильную группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной группы (предпочтительно метильной группы) и метоксикарбонильной группы, тиенильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы), трифторметильной группы, тиадиазолильной группы, оксазолильной группы и атома галогена], фуранильную группу, которая может быть замещена заместителем(ями), выбранным из следующей группы [где указанная группа состоит из С1-С6 алкильной группы (предпочтительно метильной группы), трифторметильной группы и атома галогена], или бензотиенильную, бензодиоксолильную, дигидробензодиоксинильную, дигидробензофуранильную, тетрагидронафтильную, инданильную, тиадиазолильную (предпочтительно 5-тиадиазолильную), бензоксадиазолильную или бензотиадиазолильную (предпочтительно 5-бензотиадиазолильную) группу, которая может быть замещена заместителем(ями), выбранным из группы, состоящей из С1-С6 алкильной (предпочтительно метильной) группы) и атома галогена.
Предпочтительными оптически активными формами соединений настоящего изобретения являются соединения, имеющие следующую структуру.
[Формула 13]

Соединения настоящего изобретения могут быть синтезированы, например, с помощью процедур, показанных ниже, путем примера.
[Формула 14]
(Схема 1)

[Формула 15]
(Схема 1)

(Схема 1)

В показанных выше стадиях символы R1, R2, R3, R5 и А имеют значения, определенные выше, R41 имеет те же значения, что и R4, за исключением атома водорода, RЕ представляет С1-С6 алкильную или фенильную группу, Met представляет типичный металл, такой как Li, Na, MgCl или MgBr, Met' представляет типичный металл (например, Li, Na, B, Mg, Al, Zn, Sn), или группу, представленную комплексом между таким типичным металлом и его лигандом (где лигандом может быть гидроксильная группа, атом галогена, метокси группа или бидентатный лиганд, представленный формулой -О(СН2)3О-), L представляет уходящую группу (где уходящей группой может быть, например, атом галогена, такой как атом хлора, брома или йода, ацетилокси группа, метансульфонилокси группа или п-толуолсульфонилокси группа), и Х представляет атом галогена, такой как атом хлора, брома или йода.
[Формула 16]
(Схема 2)

В показанных выше стадиях символы R1, R2, R3, R5 и А имеют значения, определенные выше, R41 имеет те же значения, что и R4, за исключением атома водорода, RЕ представляет С1-С6 алкильную или фенильную группу, Met представляет типичный металл, такой как Li, Na, MgCl или MgBr, Met' представляет типичный металл (например, Li, Na, B, Mg, Al, Zn, Sn), или группу, представленную комплексом между таким типичным металлом и его лигандом (где лигандом может быть гидроксильная группа, атом галогена, метокси группа или бидентатный лиганд, представленный формулой -О(СН2)3О-), L представляет уходящую группу (где уходящей группой может быть, например, атом галогена, такой как атом хлора, брома или йода, ацетилокси группа, метансульфонилокси группа или п-толуолсульфонилокси группа), и Х представляет атом галогена, такой как атом хлора, брома или йода.
[Формула 17]
(Схема 3)

В показанных выше стадиях символы R1, R3, R5 и А имеют значения, определенные выше, R41 имеет те же значения, что и R4, за исключением атома водорода, R2А представляет -СН2-R21 (где R21 представляет С1-С5 алкильную группу), RBB представляет С1-С6 алкильную или фенильную группу, Met представляет типичный металл, такой как Li, Na, MgCl или MgBr, L представляет уходящую группу (где уходящей группой может быть, например, атом галогена, такой как атом хлора, брома или йода, ацетилокси группа, метансульфонилокси группа или п-толуолсульфонилокси группа), и Х представляет атом галогена, такой как атом хлора, брома или йода.
Ниже дано подробное описание каждой схемы.
Схема 1, Процeдура А
Стадия 1А-1: Соединение, представленное формулой (1а), может вводиться в реакцию с имидазолом в присутствии основания с использованием или без использования растворителя, с получением соединения, представленного формулой (1b). Используемое количество соединения, представленного формулой (1а), составляет обычно 1-10 эквивалентов, предпочтительно 1,0-3,0 эквивалента, имидазола. Примеры доступного для использования основания включают гидроксиды щелочных металлов (например, NaOH, KOH), соли щелочных металлов (например, NaHCO3, K2CO3), амиды щелочных металлов (например, LiNH2, NaNH2) и гидрид натрия. Используемое количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1,0-3,0 эквивалента, имидазола. Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником. Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая воду, простые эфиры (например, диоксан, тетрагидрофуран (ТГФ)), полярные апротонные растворители (например, диметилформамид (ДМФ), N,N'-диметилацетамид (DMA), N-метилпирролидинон (NMP), N,N'-диметилпропиленмочевина (DMPU), гексаметилфосфорамид (HMPA), диметилсульфоксид (ДМСО), аммиак или их смеси. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадия 1А-2: Соединение, представленное формулой (1b), может подвергаться реакции с галогенирующим агентом с получением соединения, представленного формулой (1с). Примеры галогенирующего агента включают Cl2, Br2, I2, N-хлорсукцинимид (NCS), N-бромсукцинимид (NBS), N-иодсукцинимид (NIS), 2,4,4,6-тетрабромциклогексадиенон, гексахлорэтан, PCl5 и SOCl2. Количество используемого галогенирующего агента составляет обычно 1-10 эквивалентов, предпочтительно 1,0-1,5 эквивалента, от соединения, представленного формулой (1b). Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая воду, простые эфиры (например, диоксан, ТГФ, Et2O), полярные апротонные растворители (например, ДМФ, DMA, NMP, DMPU, HMPA), спирты (например, MeOH, EtOH), галогенированные растворители (например, CCl4, CHCl3, CH2Cl2), CH3CN, уксусную кислоту или их смеси. Если необходимо, добавляется основание. Примеры основания включают гидроксиды щелочных металлов (например, NaOH, KOH), соли щелочных металлов (например, NaHCO3, K2CO3, AcONa), амины (например, Et3N, iPr2NЕt, iPr2NH), n-BuLi, диизопропиламид лития (LDA) и NaH. Количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1,0-1,2 эквивалента, от соединения, представленного формулой (1b). Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от -78°С до комнатной температуры. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадия 1А-3: Соединение, представленное формулой (1с), может подвергаться реакции соединением, представленным формулой (1d), в присутствии основания с использованием или без использования растворителя, с получением соединения, представленного формулой (1е). Количество используемого соединения (1d) составляет обычно 1-5 эквивалентов, предпочтительно 1-3 эквивалента, от соединения, представленного формулой (1с). Примеры основания включают соли щелочных металлов (например, Na2CO3, K2CO3, Cs2CO3, NaHCO3, KHCO3, NaOH, димезилнатрий, NaH, NaNH2, трет-BuOK, трет-BuONa), амины (например, Et3N, iPr2NЕt, iPr2NH, пирролидин, пиперидин), AcONa и АсОК. Количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1-3 эквивалента, от соединения, представленного формулой (1с). Температура реакции находится в пределах от 0°С до 300°С, и реакция может выполняться, например, при нормальном давлении, при повышенном давлении или в условиях микроволнового облучения. Примеры реакционного доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O), ДМФ, DMA, NMP, DMPU, HMPA, ДМСО или их смеси. Если необходимо, вводится добавка. Примеры добавки включают соли металлов (например, CuI, CuCl) или медный порошок. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 1 до 12 часов.
Стадия 1А-4: Соединение, представленное формулой (1е), может подвергаться реакции с основанием в растворителе, а затем подвергаться реакции соединением, представленным формулой (1f), с получением соединения, представленного формулой (1g). Количество используемого соединения (1f) составляет обычно 1-5 эквивалентов, предпочтительно 1-2 эквивалента, от соединения, представленного формулой (1е). Примеры основания включают n-BuLi и LDA. Используемое количество основания составляет обычно 1-5 эквивалентов, предпочтительно 1-1,2 эквивалента, от соединения, представленного формулой (1е). Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от -78°С до комнатной температуры. Примеры реакционного доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O), ДМФ, DMA, DMPU, HMPA, ДМСО или их смеси. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 12 часов.
Стадия 1А-5: Соединение, представленное формулой (1g), может полвергаться реакции с восстанавливающим агентом в растворителе с получением соединения, представленного формулой (1h). Примеры восстанавливающего агента включают NaBH4, KBH4, LiB(втор-Bu)3H, (изо-Bu)2AlH и LiAlH4. Количество восстанавливающего агента составляет 0,5-5 эквивалентов, предпочтительно 0,5-1,2 эквивалента, от соединения, представленного формулой (1g). Примеры растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O) и спирты (например, MeOH, EtOH). Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от 0°С до комнатной температуры. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 2 часов.
Стадия 1А-6: Соединение, представленное формулой (1h), может подвергаться реакции с метансульфонилхлоридом, п-толуолсульфонилхлоридом, безводным трифлатом или аналогичными в растворителе и, если необходимо, в присутствии основания, такого как пиридин или триэтиламин, с последующей реакцией с азидирующим агентом (например, NaN3, LiN3, Zn(N3)2), или, альтернативно, может непосредственно обрабатываться диэтилазодикарбоксилатом (DEAD)/PPh3/HN3, дифенилфосфорилазидом (DPPA)/1,8-диазабицикло[5.4.0]ундец-7-еном (DBU), Zn(N3)2/2 пиридином или т.п. с получением соединения, представленного формулой (1i). Примеры растворителя включают простые эфиры (например, диоксан, ТГФ), галогенированные растворители (например, CH3CN, CCl4, CHCl3, CH2Cl2), бензол и толуол.
Стадия 1А-7: Соединение, представленное формулой (1i), может подвергаться реакции с восстанавливающим агентом в растворителе и, если необходимо, в присутствии катализатора (например, Pd/C, Pd(OH)2/C, PtO2) с получением соединения, представленного формулой (1j). Примеры восстанавливающего агента включают водород, формиат аммония, гидразин, PPh3 и Mg. Примеры доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O), спирты (например, MeOH, EtOH), воду, AcOEt или их смеси.
Стадия 1А-8: Соединение, представленное формулой (1j), может подвергаться реакции с соединением, представленным формулой (1k), в присутствии основания с использованием растворителя или без него, с последующим образованием соли, как необходимо для получения соединения, представленного формулой (1l), или его фармацевтически приемлемой соли. Используемое количество соединения, представленного формулой (1k), составляет обычно 1-5 эквивалентов, предпочтительно 1-1,2 эквивалента, от соединения, представленного формулой (1j). Примеры доступного для использования основания включают гидроксиды щелочных металлов (например, NaOH, KOH), соли щелочных металлов (например, NaHCO3, K2CO3) и амины (например, Et3N, iPr2NЕt, iPr2NH). Количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1-3 эквивалента, от соединения, представленного формулой (1j). Температура реакции находится в пределах от 0°С до температуры кипения растворителя с обратным холодильником, предпочтительно от 0°С до комнатной температуры. Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая галогенированные углеводороды (например, CHCl3, CH2Cl2), простые эфиры (например, диоксан, ТГФ, Et2O) или их смеси. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадия 1А-9: Соединение, представленное формулой (1l), может подвергаться реакции с соединением, представленным формулой (1m), в присутствии основания с использованием или без использования растворителя, с последующим образованием соли, необходимой для получения соединения, представленного формулой (1n), или его фармацевтически приемлемой соли. Используемое количество соединения, представленного формулой (1m), составляет 1-10 эквивалентов, предпочтительно 1,1-1,5 эквивалента, от соединения, представленного формулой (1l). Примеры доступного для использования основания включают гидроксиды щелочных металлов (например, NaOH, KOH), соли щелочных металлов (например, NаНCO3, K2CO3) и амины (например, Et3N, iPr2NЕt, iPr2NH). Количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1,0-3,0 эквивалента, от соединения, представленного формулой (1l). Температура реакции находится в пределах от 0°С до температуры кипения растворителя с обратным холодильником, предпочтительно от 0°С до комнатной температуры. Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая воду, простые эфиры (например, диоксан, ТГФ, Et2O), ДМФ, DMA, NMP, DMPU, HMPA, ДМСО или их смеси. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Далее, исходя из соединения, представленного формулой (1ga), которое получается с помощью галогенирования соединения, представленного формулой (1g), процедуры, показанные на стадиях 1А-5 - 1А-9 Схемы 1, могут повторяться с получением галоген-замещенного соединения, представленного формулой (1nb).
Далее, соединение, представленное формулой (1ga), может подвергаться реакции с соединением, представленным формулой (1gb), с получением соединения, представленного формулой (1gc). Исходя из получающегося в результате соединения, представленного формулой (1gс), процедуры, показанные на стадиях 1А-5 - 1А-9 Схемы 1, могут повторяться с получением соединения, представленного формулой (1nа), имеющего заместитель RE.
Стадия 1А-5А: Соединение, представленное формулой (1g), может подвергаться реакции с галогенирующим агентом с получением соединения, представленного формулой (1ga). Примеры галогенирующего агента включают Cl2, Br2, I2, NCS, NBS, NIS, 2,4,4,6-тетрабромциклогексадиенон, PCl5 и SOCl2. Количество используемого галогенирующего агента составляет обычно 2-10 эквивалентов, предпочтительно 1,0-2,5 эквивалента, от соединения, представленного формулой (1g). Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая воду, простые эфиры (например, диоксан, ТГФ), полярные апротонные растворители (например, ДМФ, DMA, NMP, DMPU, HMPA, ДМСО), спирты (например, MeOH, EtOH), галогенированные растворители (например, CCl4, CHCl3, CH2Cl2), CH3CN, уксусную кислоту или их смеси. Если необходимо, добавляется основание. Примеры основания включают гидроксиды щелочных металлов (например, NaOH, KOH), соли щелочных металлов (например, NaHCO3, K2CO3, AcONa) и амины (например, Et3N, iPr2NЕt). Используемое количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1,0-1,2 эквивалента, от соединения, представленного формулой (1g). Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от -78°С до комнатной температуры. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадия 1А-5B: Соединение, представленное формулой (1ga), может подвергаться реакции с соединением, представленным формулой (1gb), в присутствии переходного металла и, если необходимо, в присутствии основания с получением соединения, представленного формулой (1gc). В соединении, представленном формулой (1gb), Met' представляет типичный металл (например, Li, Na, B, Mg, Al, Zn, Sn) или группу, представленную комплексом между таким типичным металлом и его лигандом (где лигандом может быть гидроксильная группа, атом галогена, метокси группа или бидентатный лиганд, представленный формулой -О(СН2)3О-). Используемое количество соединения, представленного формулой (1gb), составляет 1-10 эквивалентов, предпочтительно 1,0-1,5 эквивалента от соединения, представленного формулой (1ga). Примеры переходного металла включают тетракис(трифенилфосфин)палладий(0), ацетат палладия(II), хлорид палладия(II), трис(дибензилиденацетон)дипалладий(0)хлороформный аддукт и бис(ацетилацетонато)никель(0). Используемое количество такого переходного металла обычно составляет 0,01-0,5 эквивалента от соединения, представленного формулой (1ga).
Желательно также добавлять фосфин, за исключением случая, когда фосфин уже координируется. Примеры фосфина включают триэтилфосфин, трибутилфосфин, трифенилфосфин, бис(дифенилфосфино)этан, бис(дифенилфосфино)пропан, бис(дифенилфосфино)бутан и бис(дифенилфосфино)ферроцен. Используемое количество такого фосфина составляет 1-2 эквивалента от переходного металла. Примеры основания включают гидроксиды щелочных металлов (например, NaOH, KOH) и соли щелочных металлов (например, NaHCO3, Na2CO3, K2CO3, К3РО4, Cs2CO3). Количество используемого основания составляет обычно 1-10 эквивалентов, предпочтительно 1,5-3,0 эквивалента, от соединения, представленного формулой (1ga). Температура реакции находится в пределах от 0°С до температуры кипения растворителя с обратным холодильником, предпочтительно от комнатной до температуры кипения растворителя с обратным холодильником. Примеры доступного для использования растворителя включают воду, простые эфиры (например, диоксан, ТГФ, Et2O), ДМФ, DMA, NMP, DMPU, HMPA, ДМСО или их смеси. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Альтернативно, как показано на Схеме 1, Процедуры В и С, соединение, представленное формулой (1n), может также синтезироваться с помощью изменения порядка реакций на стадиях Схемы 1, Процедуры А.
Схема 1, Процедура В
Стадия 1В-1: Соединение, представленное формулой (1с), которое получено на стадии 1А-2 Схемы 1, может подвергаться реакции с основанием, а затем с ДМФ для формилирования с получением соединения, представленного формулой (1о). Используемое количество ДМФ составляет обычно 1-5 эквивалентов, предпочтительно 1-2 эквивалента, от соединения, представленного формулой (1с). Примеры основания включают n-BuLi и LDA. Используемое количество основания составляет обычно 1-5 эквивалентов, предпочтительно 1-1,2 эквивалента, от соединения, представленного формулой (1с). Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от -78°С до комнатной температуры. Примеры реакционного растворителя, доступного для использования, включают простые эфиры (например, диоксан, ТГФ, Et2O), ДМФ, DMA, DMPU, HMPA, ДМСО или их смеси. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 12 часов.
Стадия 1В-2: Соединение, представленное формулой (1о), может подвергаться реакции с соединением, представленным формулой (1d), таким же образом, как показано на стадии 1А-3 Схемы 1, с получением соединения, представленного формулой (1р).
Стадия 1В-3: Соединение, представленное формулой (1р), может подвергаться реакции с соединением, представленным формулой (1q), с получением соединения, представленного формулой (1h). Используемое количество соединения, представленного формулой (1q), составляет 1-10 эквивалентов, предпочтительно 1,1-1,5 эквивалента, от соединения, представленного формулой (1h). Примеры доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O) или их смеси. Температура реакции находится в пределах от -78°С до комнатной температуры, предпочтительно от -30°С до 0°С. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Исходя из полученного соединения, представленного формулой (1h), процедуры, показанные на стадиях 1А-6 - 1А-9 Схемы 1, могут повторяться с получением соединения, представленного формулой (1n).
Далее, исходя из соединения, представленного формулой (1рa), которое получается с помощью галогенирования соединения, представленного формулой (1р), процедуры, показанные на стадиях 1В-3 и 1А-6 - 1А-9 Схемы 1, могут повторяться с получением галоген-замещенного соединения, представленного формулой (1nb).
Далее, соединение, представленное формулой (1рa), может подвергаться реакции с соединением, представленным формулой (1gb), с получением соединения, представленного формулой (1pb). Исходя из полученного соединения, представленного формулой (1pb), процедуры, показанные на стадиях 1B-3 и 1A-6 - 1А-9 Схемы 1, могут повторяться с получением соединения, представленного формулой (1na), имеющего заместитель RE.
Стадия 1В-3А: Исходя из соединения, представленного формулой (1р), те же процедуры, что показаны на стадиях 1А-5А Схемы 1, могут повторяться с получением соединения, представленного формулой (1ра).
Стадия 1В-3В: Исходя из соединения, представленного формулой (1ра), и соединения, представленного формулой (1gb), те же процедуры, что показаны на стадиях 1А-5В Схемы 1, могут повторяться с получением соединения, представленного формулой (1рb).
Схема 1, Процедура С
Стадия 1С-1: Исходя из соединения, представленного формулой (1о), полученного на стадии 1В-1 Схемы 1, и соединения, представленного формулой (1q), те же процедуры, что показаны на стадии 1В-3 Схемы 1, могут повторяться с получением соединения, представленного формулой (1r).
Стадия 1С-2: Исходя из соединения, представленного формулой (1r), тa же процедурa, что показанa на стадии 1A-6 Схемы 1, может быть повторена с получением соединения, представленного формулой (1s).
Стадия 1С-3: Исходя из соединения, представленного формулой (1s), тa же процедурa, что показанa на стадии 1A-7 Схемы 1, может быть повторена с получением соединения, представленного формулой (1t).
Стадия 1С-4: Исходя из соединения, представленного формулой (1t), и соединения, представленного формулой (1d), тa же процедурa, что показанa на стадии 1A-3 Схемы 1, может быть повторена с получением соединения, представленного формулой (1j).
Исходя из полученного соединения, представленного формулой (1j), процедуры, показанные на стадиях 1А-8 - 1А-9 Схемы 1, могут повторяться с получением соединения, представленного формулой (1n).
Схема 2
Стадия 2-1: Исходя из соединения, представленного формулой (1b), и соединения, представленного формулой (1f), тa же процедурa, что показанa на стадии 1A-4 Схемы 1, может быть повторена с получением соединения, представленного формулой (2a).
Стадия 2-2: Соединение, представленное формулой (2а), может подвергаться реакции с галогенирующим агентом с получением соединения, представленного формулой (2b). Примеры галогенирующего агента включают Cl2, Br2, I2, NCS, NBS, NIS, 2,4,4,6-тетрабромциклогексадиенон, PCl5 и SOCl2. Количество используемого галогенирующего агента составляет обычно 2-10 эквивалентов, предпочтительно 1,0-2,5 эквивалента, от соединения, представленного формулой (2a). Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая воду, простые эфиры (например, диоксан, ТГФ), полярные апротонные растворители (например, ДМФ, DMA, NMP, DMPU, HMPA, ДМСО), спирты (например, MeOH, EtOH), галогенированные растворители (например, CCl4, CHCl3, CH2Cl2), CH3CN, уксусную кислоту или их смеси. Если необходимо, добавляется основание. Примеры основания включают гидроксиды щелочных металлов (например, NaOH, KOH), соли щелочных металлов (например, NaHCO3, K2CO3, AcONa) и амины (например, Et3N, iPr2NЕt). Используемое количество основания составляет обычно 1-10 эквивалентов, предпочтительно 1,0-1,2 эквивалента, от соединения, представленного формулой (2a). Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от -78°С до комнатной температуры. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадия 2-3: Исходя из соединения, представленного формулой (2b), и соединения, представленного формулой (1d), тa же процедурa, что показанa на стадии 1A-3 Схемы 1, может быть повторена с получением соединения, представленного формулой (2c).
Стадия 2-4: Соединение, представленное формулой (2с), может подвергаться реакции в растворителе в присутствии катализатора (например, Pd/C, Pd(OH)2/C, PtO2) в атмосфере водорода с получением соединения, представленного формулой (2d). Примеры растворителя включают простые эфиры (например, диоксан, ТГФ), спирты (например, MeOH, EtOH) и AcOEt. Используемое количество катализатора составляет обычно 0,01-1 часть по массе от соединения, представленного формулой (2с).
Стадия 2-5: Исходя из соединения, представленного формулой (2d), тa же процедурa, что показанa на стадии 1A-5 Схемы 1, может быть повторена с получением соединения, представленного формулой (2e).
Стадия 2-6: Исходя из соединения, представленного формулой (2e), тa же процедурa, что показанa на стадии 1A-6 Схемы 1, может быть повторена с получением соединения, представленного формулой (2f).
Стадия 2-7: Исходя из соединения, представленного формулой (2f), тa же процедурa, что показанa на стадии 1A-7 Схемы 1, может быть повторена с получением соединения, представленного формулой (2g).
Стадия 2-8: Исходя из соединения, представленного формулой (2g), и соединения, представленного формулой (1k), тa же процедурa, что показанa на стадии 1A-8 Схемы 1, может быть повторена с получением соединения, представленного формулой (2h).
Стадия 2-9: Исходя из соединения, представленного формулой (2h), и соединения, представленного формулой (1m), тa же процедурa, что показанa на стадии 1A-9 Схемы 1, может быть повторена с получением соединения, представленного формулой (2i).
Кроме того, исходя из соединения, представленного формулой (2c), процедуры, показанные на стадиях 2-5 - 2-9 Схемы 2, могут повторяться с получением галоген-замещенного соединения, представленного формулой (2ib).
Кроме того, соединение, представленное формулой (2с), может вводиться в реакцию с соединением, представленным формулой (1gb), с получением соединения, представленного формулой (2са). Исходя из полученного соединения, представленного формулой (2са), процедуры, показанные на стадиях 2-5 и 2-9 Схемы 2, могут повторяться с получением соединения, представленного формулой (2ia), имеющего заместитель RE.
Стадия 2-4А: Исходя из соединения, представленного формулой (2c), процедуры, показанные на стадиях 1А-5B Схемы 1, могут повторяться с получением соединения, представленного формулой (2cа).
Cхема 3
Стадия 3-1: Диэтилоксалацетатная натриевая соль и соединение, представленное формулой (3а), могут вводиться в реакцию в присутствии уксусной кислоты с получением соединения, представленного формулой (3b).
Стадия 3-2: Соединение, представленное формулой (3b), может подвергаться реакции с галогенирующим агентом (например, POCl3) в ДМФ с получением соединения, представленного формулой (3с).
Стадия 3-3: Исходя из соединения, представленного формулой (3с), и соединения, представленного формулой (1d), та же процедура, что показана на стадии 1А-3 Схемы 1, может повторяться с получением соединения, представленного формулой (3d).
Стадия 3-4: Соединение, представленное формулой (3d), может подвергаться реакции с соединением, представленным формулой (3е), с получением соединения, представленного формулой (3f). Используемое количество соединения, представленного формулой (3е), составляет 1-10 эквивалентов, предпочтительно 1,1-1,5 эквивалента, от соединения, представленного формулой (3d). Примеры доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O) или их смеси. Температура реакции находится в пределах от -78°С до комнатной температуры, предпочтительно от -30°С до 0°С. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадия 3-5: Соединение, представленное формулой (3f), может подвергаться реакции с восстанавливающим агентом в присутствии кислоты Льюиса с получением соединения, представленного формулой (3g). Примеры кислоты Льюиса включают трифторуксусную кислоту (TFA), TiCl4, SnCl4 и AlCl3. Количество кислоты Льюиса составляет 1-20 эквивалентов, предпочтительно 5-10 эквивалентов, от соединения, представленного формулой (3f). Примеры восстанавливающего агента включают Et3SiH, Bu3SnH и NaBH4. Количество восстанавливающего агента составляет 1-5 эквивалентов, предпочтительно 1-3 эквивалентов, от соединения, представленного формулой (3f). Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая галогенированные растворители (например, CCl4, CHCl3, CH2Cl2) или их смеси. Температура реакции находится в пределах от -78°С до температуры кипения растворителя с обратным холодильником, предпочтительно от 0°С до комнатной температуры.
Стадия 3-6: Соединение, представленное формулой (3g), может вводиться в реакцию с восстанавливающим агентом с получением соединения, представленного формулой (3h). Примеры восстанавливающего агента включают NaBH4, KBH4, LiB(H)Et3, LiB(втор-Bu)3H, (изо-Bu)2AlH Al H (O-t-Bu)3, LiAlH4, LiHAl(O-t-Bu)3 и NaH2Al(OCH2CH2OCH3). Количество восстанавливающего агента составляет 0,5-5 эквивалентов, предпочтительно 0,5-1,2 эквивалента, от соединения, представленного формулой (3g). Примеры доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, диэтиловый эфир), гексан, бензол, толуол или их смеси. Температура реакции находится в пределах от -78°С до комнатной температуры, предпочтительно от -78°С до 0°С. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 4 часов.
Стадия 3-7: Соединение, представленное формулой (3h), может вводиться в реакцию с соединением, представленным формулой (1q), таким же образом, как показано на стадии 1В-3 Схемы 1, с получением соединения, представленного формулой (3i). Количество соединения, представленного формулой (1q), составляет 1-10 эквивалентов, предпочтительно 1,1-1,5 эквивалента, от соединения, представленного формулой (3h). Примеры доступного для использования растворителя включают простые эфиры (например, диоксан, ТГФ, Et2O) или их смеси. Температура реакции находится в пределах от -78°С до комнатной температуры, предпочтительно от -30°С до 0°С. Хотя время реакции будет варьировать в зависимости от температуры реакции и/или исходного соединения, обычно оно составляет от 30 минут до 24 часов.
Стадии 3-8 и 3-9: Исходя из соединения, представленного формулой (3i), те же процедуры, что показаны на стадиях 1А-6 и 1А-7 Схемы 1, могут повторяться с получением соединения, представленного формулой (3j).
Стадия 3-10: Исходя из соединения, представленного формулой (3j), и соединения, представленного формулой (1k), та же процедура, что показана на стадии 1А-8 Схемы 1, может повторяться с получением соединения, представленного формулой (3k).
Стадия 3-11: Исходя из соединения, представленного формулой (3k), и соединения, представленного формулой (1m), та же процедура, что показана на стадии 1А-9 Схемы 1, может повторяться с получением соединения, представленного формулой (3l).
Стадия 3-12: Соединение, представленное формулой (3l), может подвергаться реакции с кислотой с получением соединения, представленного формулой (3m). Примеры кислоты включают соляную кислоту/пиридин и BBr3. Используемое количество кислоты составляет 1-20 эквивалентов, предпочтительно 10-20 эквивалентов, от соединения, представленного формулой (3l). Когда требуется растворитель, может использоваться любой растворитель, пока он является инертным по отношению к реакции, включая галогенированные растворители (например, CCl4, CHCl3, CH2Cl2) или их смеси. Температура реакции находится в пределах от комнатной температуры до 200°, предпочтительно от комнатной температуры до 180°С.
Для использования в качестве фармацевтических композиций к соединениям настоящего изобретения могут добавляться обычно используемые эксципиенты, расширители, регуляторы рН, солюбилизаторы и т.д., а затем производится составление фармацевтических форм с использованием стандартных приемов в виде таблеток, гранул, пилюль, капсул, порошков, растворов, суспензий, инъецируемых составов и др. Получаемые таким образом фармацевтические композиции могут вводиться в виде оральных или парентеральных форм.
Соединения настоящего изобретения могут вводиться взрослым пациентам в количестве 1-1000 мг в день в виде одной дозы или раздельных доз. Данная дозировка может быть увеличена или уменьшена в зависимости от типа заболевания, возраста, веса тела и симптомов заболевания пациента и т.п.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
Было найдено, что соединения настоящего изобретения являются сильными лигандами Edg-1 (S1P1), как видно из описанного ниже примера испытаний.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет дополнительно описано более подробно с помощью следующих примеров и примера испытаний.
Пример 1
3,4-Дихлор-N-[1-(3-этил-2(4-метилфенокси)-3Н-имидазол-4-ил)этил]бензолсульфонамид (Соединение 74)
[Формула 18]

1-Этил-2-йод-1Н-имидазол
[Формула 19]

(1) К раствору 1 этил-1Н-имидазола (2,844 г) в ТГФ (60 мл) в атмосфере аргона при -78°С по каплям добавляли n-BuLi (н-бутиллитий) (11,6 мл, 2,59 н. в гексане). После перемешивания при той же температуре в течение 30 минут по каплям добавляли раствор I2 (7,614 г) в ТГФ (25 мл). Реакционную смесь нагревали до комнатной температуры, разбавляли насыщенным водным раствором бикарбоната натрия и экстрагировали AcOEt. После промывания насыщенным водным раствором Na2S2O3 органический слой сушили над безводным сульфатом магния, фильтровали и затем выпаривали для удаления растворителя, получая таким образом указанное в заголовке соединение (6,492 г) в виде светло-желтого твердого вещества.
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,40 (т, J=7,4 Гц, 3H), 3,95 (кв, J=7,4 Гц, 2H), 7,02-7,06 (м, 1H), 7,07-7,11 (м, 1H).
1-Этил-2(4-метилфенокси)-1Н-имидазол
[Формула 20]

(2) Смесь соединения, полученного в Примере 1-(1), (30,27 г), 4-крезола (17,69 г), Cs2CО3 (53,43 г) и N,N'-диметилпропиленмочевины (DMPU) (136 мл) перемешивали при 200°С в течение 3 часов. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали AcOEt. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, гексан/AcOE = 10% - 40%), получая указанное в заголовке соединение (8,54 г, желтое масло).
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,39 (т, J=7,3 Гц, 3H), 2,32 (с, 3H), 3,89 (кв, J=7,3 Гц, 3H), 6,65 (д, J=1,8 Гц, 1H), 6,70 (д, J=1,8 Гц, 1H), 7,03-7,320 (м, 4H).
1-(3-Этил-2-(4-метилфенокси)-3Н-имидазол-4-ил)этанол
[Формула 21]

(3) К раствору соединения, полученного в примере 1-(2,) (2,493 г), в ТГФ (123 мл) в атмосфере аргона при -78°С по каплям добавляли n-BuLi (4,8 мл, 2,59 н. в гексане) и перемешивали при той же температуре в течение 3,5 часов. Реакционную смесь охлаждали до -100°С, смешивали с Ас2О (2,3 мл), нагревали до -65°С на протяжении 50 минут, разбавляли насыщенным водным раствором бикарбоната натрия и экстрагировали AcOEt. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и затем выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, AcOEt/гексан = 10% - 30%), получая смесь 1-(3-этил-2-(4-метилфенокси)-3Н-имидазол-4-ил)этанона и 1-этил-2(4-метилфенокси)-1Н-имидазола (1,509 г, бесцветное масло). К раствору полученных соединений (1,508 г) в МеОН (13 мл) при 0°С добавляли NaBH4 (243 мг) и перемешивали при той же температуре в течение 15 минут, а затем при комнатной температуре в течение 15 минут. Реакционную смесь концентрировали, разбавляли водой и экстрагировали AcOEt. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, AcOEt/гексан = 20% - 99%), получая указанное в заголовке соединение (1,131 г, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,38 (т, J=7,3 Гц, 3H), 1,62 (д, J=6,6 Гц, 3H), 2,33 (с, 3H), 3,86-4,20 (м, 2H), 4,70-4,88 (м, 1H), 6,60 (д, J=0,9 Гц, 1H), 7,04-7,21 (м, 4H).
5-(1-Азидоэтил)-1-этил-2-(4-метилфенокси)-1Н-имидазол
[Формула 22]

К раствору соединения, полученного в Примере 1-(3), (1,130 г), в толуоле (46 мл) при 0°С добавляли дифенилфосфорилазид (DPPA) (1,48 мл) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU) и перемешивали при комнатной температуре в течение 11,5 часов. Реакционную смесь разбавляли водой и экстрагировали AcOEt. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и затем выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, AcOEt/гексан = 0% - 10%), получая указанное в заголовке соединение (983 мг, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,38 (т, J=7,1 Гц, 3H), 1,67 (д, J=6,8 Гц, 3H), 2,33 (с, 3H), 3,90-4,07 (м, 2H), 4,25-4,40 (м, 1H), 6,68 (д, J=0,9 Гц, 1H), 7,02-7,30 (м, 4H).
1-(3-Этил-2(4-метилфенокси)-3Н-имидазол-4-ил)этиламин
[Формула 23]

(5) Смесь соединения, полученного в Примере 1-(4), (983 мг), и палладия-активированного угля (197 мг, Pd 10 мас.%) в толуоле (46 мл) перемешивали в атмосфере водорода (примерно 1 атмосфера) при комнатной температуре в течение 4 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали. Полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, AcOEt/гексан = 10% - 99%), получая указанное в заголовке соединение (754 мг, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,37 (т, J=7,1 Гц, 3H), 1,49 (д, J=6,6 Гц, 3H), 2,32 (с, 3H), 3,82-4,12 (м, 3H), 6,53 (д, J=0,9 Гц, 1H), 7,04-7,20 (м, 4H).
3,4-Дихлор-N-[1-(3-этил-2(4-метилфенокси)-3Н-имидазол-4-ил)этил]бензолсульфонамид (Соединение 74)
[Формула 24]

(6) К раствору соединения, полученного в Примере 1-(5), (24 мг), в ТГФ (2,0 мл) при комнатной температуре добавляли Et3N (0,041 мл) и 3,4-дихлорбензолсульфонилхлорид (48 мг) и перемешивали при комнатной температуре в течение 12 часов. После добавления AcOEt органический слой промывали последовательно 1 н. водным раствором соляной кислоты и солевым раствором, сушили над безводным сульфатом магния, фильтровали и затем выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью силикагельной NН-типа колоночной хроматографии (элюент:AcOEt) с последующей перекристаллизацией (AcOEt/гексан), получая указанное в заголовке соединение (Соединение 74) (25 мг, бесцветный порошок).
1H ЯМР (200 MГц, ДМСО-d6) δ м.д.: 1,18 (т, J=7,1 Гц, 3H), 1,26 (д, J=6,8 Гц, 3H), 2,29 (с, 3H), 3,65-3,91 (м, 2H), 4,41-4,62 (м, 1H), 6,42 (с, 1H), 6,97-7,07 (м, 2H), 7,13-7,24 (м, 2H), 7,71 (дд, J=8,4, 2,1 Гц, 1H), 7,87 (д, J=8,4 Гц, 1H), 7,93 (д, J=2,1 Гц, 1H), 8,28-8,43 (м, 1H).
Точка плавления: 142,5-143,5°С
Пример 2
3,4-Дихлор-N-[1-(1-этил-5-(4-метилфенокси)-1Н-имидазол-2-ил)этил]бензолсульфонамид (Соединение 179)
[Формула 25]

1-(1-Этил-1Н-имидазол-2-ил)этанон
[Формула 26]

(1) К раствору 1-этил-1Н-имидазола (1,923 г) в ТГФ (40 мл) в атмосфере аргона при -78°С по каплям добавляли n-BuLi (7,7 мл, 2,59 н. в гексане). После перемешивания при той же температуре в течение 30 минут реакционную смесь добавляли по каплям при -78°С через воронку к раствору АсСl (1,56 мл) в ТГФ (40 мл). Реакционную смесь нагревали до комнатной температуры в течение 2 часов, разбавляли насыщенным водным раствором бикарбоната натрия и экстрагировали AcOEt. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и затем выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (силикагель NН-типа, AcOEt/гексан = 0% - 10%), получая указанное в заголовке соединение (335 мг, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,42 (т, J=7,3 Гц, 3H), 2,67 (с, 3H), 4,43 (кв, J=7,3 Гц, 2H), 7,09 (с, 1H), 7,15 (д, J=0,7 Гц, 1H).
1-(4,5-Дибром-1-этил-1Н-имидазол-2-ил)этанон
[Формула 27]

К раствору соединения, полученного в Примере 2-(1), (1,08 г), в CH3CN (78 мл) при 0°С добавляли N-бромсукцинимид (NBS) (2,782 г), смесь нагревали при температуре кипения с обратным холодильником в течение 3 часов, а затем перемешивали в течение ночи при комнатной температуре. После отгонки растворителя полученный остаток очищали с помощью колоночной хроматографии на силикагеле (силикагель нейтрального ОН-типа, AcOEt/гексан = 5% - 20%), получая указанное в заголовке соединение (1,865 г, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,35 (т, J=7,1 Гц, 3H), 2,63 (с, 3H), 4,51 (кв, J=7,1 Гц, 2H).
1-(4-Бром-1-этил-5-(4-метилфенокси)-1Н-имидазол-2-ил)этанон
[Формула 28]

(3) Смесь соединения, полученного в Примере 2-(2), (833 мг), 4-крезола (883 мкл), Cs2CO3 (2,979 г) и DMPU (2,8 мл) перемешивали при 100°С в течение 30 минут и затем при 150°С в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, разбавляли водным раствором NaOH (2,0 н.) и экстрагировали смесью этилацетат/гексан (1/4). После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, AcOEt/гексан = 2% - 5%), получая указанное в заголовке соединение (235 мг, бесцветное твердое вещество).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,27 (т, J=7,2 Гц, 3H), 2,33 (с, 3H), 2,63 (с, 3H), 4,31 (кв, J=7,2 Гц, 2H), 6,76-6,88 (м, 2H), 7,08-7,20 (м, 2H).
1-(1-Этил-5-(4-метилфенокси)-1Н-имидазол-2-ил)этанон
[Формула 29]

(4) Смесь соединения, полученного в Примере 2-(3), (154 мг), палладия-активированного угля (31 мг, Pd 10 мас.%) и AcONa (47 мг) в МеОН (4,0 мл) перемешивали в атмосфере водорода (примерно 1 атм.) при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали, разбавляли водой и экстрагировали этилацетатом.
Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем выпаривали при пониженном давлении для удаления растворителя, получая таким образом указанное в заголовке соединение (113 мг, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,35 (т, J=7,1 Гц, 3H), 2,35 (с, 3H), 2,61 (с, 3H), 4,40 (кв, J=7,1 Гц, 2H), 6,53 (с, 1H), 6,94-7,06 (м, 2H), 7,12-7,22 (м, 2H).
1-(1-Этил-5-(4-метилфенокси)-1Н-имидазол-2-ил)этанол
[Формула 30]
(5) К раствору соединения, полученного в Примере 2-(4), (171 мг), в МеОН (7,0 мл) при 0°С добавляли NaBH4 (26 мг) и перемешивали при той же температуре в течение 15 минут. Реакционную смесь промывали водой и экстрагировали этилацетатом. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и выпаривали для удаления растворителя, получая указанное в заголовке соединение (158 мг, бесцветное масло).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,33 (т, J=7,3 Гц, 3H), 1,67 (д, J=5,9 Гц, 3H), 2,32 (с, 3H), 3,92-4,07 (м, 2H), 4,76-4,98 (м, 1H), 6,35-6,53 (м, 1H), 6,90-7,02 (м, 2H), 7,07-7,18 (м, 2H).
2-(1-Азидо-этил)-1-этил-5-(4-метилфенокси)-1Н-имидазол
[Формула 31]

(6) Исходя из соединения, полученного в Примере 2-(5), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (бесцветное масло, выход 40%).
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,34 (т, J=7,3 Гц, 3H), 1,79 (д, J=6,8 Гц, 3H), 2,33 (с, 3H), 3,81-4,05 (м, 2H), 4,38-4,53 (м, 1H), 6,47 (с, 1H), 6,91-7,01 (м, 2H), 7,08-7,18 (м, 2H).
1-(1-Этил-5-(4-метилфенокси)-1Н-имидазол-2-ил)этиламин
[Формула 32]

(7) Исходя из соединения, полученного в Примере 2-(6), повторяли ту же самую процедуру, которая применялась в Примере 1-(5), получая указанное в заголовке соединение (бесцветное масло) с количественным выходом.
1H ЯМР (200 Гц, CDCl3) δ м.д.: 1,30 (т, J=7,3 Гц, 3H), 1,53 (д, J=6,8 Гц, 3H), 2,32 (с, 3H), 3,77-4,16 (м, 3H), 6,44 (с, 1H), 6,90-7,00 (м, 2H), 7,06-7,16 (м, 2H).
3,4-Дихлор-N-[1-(1-этил-5-(4-метилфенокси)-1Н-имидазол-2-ил)этил]бензолсульфонамид (Соединение 179)
[Формула 33]
(8) Исходя из соединения, полученного в Примере 2-(7), повторяли ту же самую процедуру, которая применялась в Примере 1-(6), получая указанное в заголовке соединение (Соединение 179) (бесцветное масло, выход 73%).
1H ЯМР (200 MГц, ДМСО-d6) δ м.д.: 1,12 (т, J=7,1 Гц, 3H), 1,30 (д, J=6,8 Гц, 3H), 2,28 (с, 3H), 3,67-3,88 (м, 2H), 4,53-4,70 (м, 1H), 6,25 (с, 1H), 6,84-6,95 (м, 2H), 7,12-7,25 (м, 2H), 7,69 (дд, J=8,5, 2,1 Гц, 1H), 7,84 (д, J=8,5 Гц, 1H), 7,90 (д, J=2,1 Гц, 1H), 8,47-8,64 (м, 1H).
Точка плавления: 133,0-134,5°С
Пример 3
N-[1-(3-Этил-2-п-толилокси-3Н-имидазол-4-ил)-этил]-4-метоксибензолсульфонамид (Соединение 23)
[Формула 34]
К раствору соединения, полученного в Примере 1-(5), (12,3 мг), в ТГФ (0,3 мл) последовательно добавляли Et3N (25 мкл) и раствор 4-метоксибензолсульфонилхлорида (15,5 мг) в ТГФ (0,3 мл) и перемешивали при комнатной температуре в течение 2 часов. После добавления PSA (амин на полимерном носителе, VARIAN, 1,4 м.экв/г) (785 мкл) реакционную смесь перемешивали при комнатной температуре в течение 12 часов и фильтровали для удаления нерастворимых веществ. После отгонки растворителя полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (SiO2 кислотного OН-типа, этилацетат/гексан = 50%-100%, МеОН/СHCl3 = 10%), получая указанное в заголовке соединение (Соединение 23, 14,3 мг) в виде бесцветного порошка.
APCI MS(M-H)-: 414, APCI MS(M-H)+: 416
Пример 4
3,4-Дихлор-N-[1-(4-хлор-1-этил-5-п-толилокси-1Н-имидазол-2-ил)этил]бензолсульфонамид (Соединение 183)
[Формула 35]

1-(4,5-Дихлор-1-этил-1Н-имидазол-2-ил)этанон
[Формула 36]

(1) Повторяли ту же процедуру, которая использовалась в Примере 2-(2), получая указанное в заголовке соединение (бесцветное масло, выход 47%), за исключением того, что вместо N-бромсукцинимида (NBS) использовали N-хлорсукцинимид (NCS).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,36 (т, J=7,2 Гц, 3Н), 2,61 (с, 3Н), 4,48 (кв, J=7,2 Гц, 2Н).
1-(4-Хлор-1-этил-5-п-толилокси-1Н-имидазол-2-ил) этанон
[Формула 37]

(2) Исходя из соединения, полученного в Примере 4-(1), повторяли ту же самую процедуру, которая применялась в Примере 2-(3), получая указанное в заголовке соединение (бесцветное твердое вещество, выход 47%).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,28 (т, J=7,2 Гц, 3Н), 2,33 (с, 3Н), 2,62 (с, 3Н), 4,32 (кв, J=7,2 Гц, 2Н), 6,81-6,86 (м, 2Н), 7,12-7,16 (м, 2Н).
1-(4-Хлор-1-этил-5-п-толилокси-1Н-имидазол-2-ил)этанол
[Формула 38]

(3) Исходя из соединения, полученного в Примере 4-(2), повторяли ту же самую процедуру, которая применялась в Примере 2-(5), получая указанное в заголовке соединение (светло-желтое масло, выход 87%).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,28 (т, J=7,3 Гц, 3Н), 1,66 (д, J=6,4 Гц, 3Н), 2,32 (с, 3Н), 3,83-3,98 (м, 2Н), 4,81-4,88 (м, 1Н), 6,81-6,87 (м, 2Н), 7,09-7,14 (м, 2Н).
2-(1-Азидоэтил)-4-хлор-1-этил-5-п-толилокси-1Н-имидазол
[Формула 39]

(4) Исходя из соединения, полученного в Примере 4-(3), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (светло-желтое масло, выход 87%).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,28 (т, J=7,1 Гц, 3Н), 1,78 (д, J=6,4 Гц, 3Н), 2,32 (с, 3Н), 3,82-3,94 (м, 2Н), 4,40-4,45 (м, 1Н), 6,81-6,86 (м, 2Н), 7,10-7,15 (м, 2Н).
1-(4-Хлор-1-этил-5-п-толилокси-1Н-имидазол-2-ил)этиламин
[Формула 40]

(5) К раствору соединения, полученного в Примере 4-(4), (460 мг), и РРh3 (790 мг) в ТГФ (50 мл) добавляли Н2О (0,6 мл) и нагревали при температуре кипения с обратным холодильником в течение 15 часов. После следующего добавления Н2О (0,6 мл) реакционную смесь нагревали при кипении с обратным холодильником дополнительно в течение 4 часов, охлаждали до комнатной температуры и выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (SiO2 нейтральный ОН-типа, МеОН/СНСl3 = 0%-10%), получая указанное в заголовке соединение (372 мг, бесцветное масло).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,26 (т, J=7,3 Гц, ЗН), 1,52 (д, J=6,9 Гц, 3Н), 2,31 (с, 3Н), 3,79-3,96 (м, 2Н), 4,03-4,10 (м, 1Н), 6,82-6,88 (м, 2Н), 7,08-7,15 (м, 2Н).
3,4-Дихлор-N-[1-(4-хлор-1-этил-5-п-толилокси-1Н-имидазол-2-ил)этил]бензолсульфонамид (Соединение 183)
[Формула 41]

(6) Исходя из соединения, полученного в Примере 4-(5), повторяли ту же самую процедуру, которая применялась в Примере 1-(6), получая указанное в заголовке соединение (Соединение 183) (бесцветный порошок, выход 66%).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,17 (т, J=7,3 Гц, 3Н), 1,49 (д, J=6,9 Гц, 3Н), 2,32 (с, 3Н), 3,68-3,89 (м, 2Н), 4,52-4,65 (м, 1Н), 5,55-5,72 (м, 1Н), 6,72-6,77 (м, 2Н), 7,10-7,16 (м, 2Н), 7,52-7,61 (м, 2Н) 7,84 (д, J=2,3 Гц, 1Н).
Точка плавления: 122,5-123,5°С
Пример 5
3,4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-5-метил-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 188)
[Формула 42]

2-Хлор-1-этил-1Н-имидазол
[Формула 43]

(1) К раствору 1-этил-1Н-имидазола (2,2 г) в ТГФ (12 мл) в атмосфере аргона при -78°С по каплям добавляли n-BuLi (9,1 мл, 2,64 н. в гексане). После перемешивания при той же температуре в течение 30 минут добавляли по каплям раствор гексахлорэтана (5,7 г) в ТГФ (12 мл) и перемешивали при той же температуре в течение 1 часа. Реакционную смесь разбавляли насыщенным водным раствором хлорида аммония, нагревали до комнатной температуры и экстрагировали этилацетатом. После промывания водой и насыщенным водным раствором хлорида натрия органический слой сушили над сульфатом магния, фильтровали и затем выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0% - 20%), получая указанное в заголовке соединение (2,74 мг, бесцветное масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,40 (т, J=7,3 Гц, 3H), 3,96 (кв, J=7,3 Гц, 2H), 6,88-6,98 (м, 2H).
1-(2-Хлор-3-этил-3Н-имидазол-4-ил)этанон
[Формула 44]

(2) К раствору соединения, полученного в Примере 5-(1), (2,74 г), в ТГФ (40 мл) в атмосфере аргона при -78°С по каплям добавляли n-BuLi (8,35 мл, 2,64 н. в гексане) и перемешивали при той же температуре в течение 30 минут. Полученную реакционную смесь добавляли при -78°С к раствору Ас2О (2,1 мл) в ТГФ (40 мл) и нагревали до 0°С в течение 2,5 часов. Реакционную смесь разбавляли насыщенным водным раствором бикарбоната натрия и экстрагировали этилацетатом. После промывания насыщенным водным раствором хлорида натрия органический слой сушили над сульфатом магния, фильтровали и затем выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 NН-типа, AcOEt/гексан = 10%), получая указанное в заголовке соединение (2,57 мг, светло-желтое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,33 (т, J=7,2 Гц, 3H), 2,46 (с, 3H) 4,42 (кв, J=7,2 Гц, 2H) 7,69 (с, 1H).
1-[3-Этил-2-(4-фторфенокси)-3Н-имидазол-4-ил)этанон
[Формула 45]

(3) Смесь соединения, полученного в Примере 5-(2), (13,20 г), 4-фторфенола (12,86 г), Cs2CO3 (49,9 г) и DMPU (15 мл) перемешивали при 200°С в течение 2 часов. После охлаждения до комнатной температуры добавляли МеОН/CHCl3 (МеОН/CHCl3 = 20%) и нерастворимые вещества отфильтровывали. Фильтрат концентрировали и полученный сырой продукт очищали с помощью колоночной хроматографии (нейтральный SiO2 ОН-типа, AcOEt/гексан = 0% - 30%), получая указанное в заголовке соединение (22,37 г, светло-желтое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,38 (т, J=7,2 Гц, 3H), 2,42 (с, 3H), 4,38 (кв, J=7,2 Гц, 2H), 7,04-7,12 (м, 2H), 7,19-7,23 (м, 2H), 7,47 (с, 1H).
1-[5-Бром-3-этил-2-(4-фторфенокси)-3Н-имидазол-4-ил)этанон
[Формула 46]

(4) К раствору соединения, полученного в примере 5-(3), (5,0 г), в ДМФ (50 мл) добавляли N-бромсукцинимид (NBS) (7,15 г) и перемешивали при комнатной температуре в течение 6 часов. После дополнительного добавления NBC (1,83 г) и перемешивания в течение дополнительных 4 часов реакционную смесь концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (нейтральный SiO2 ОН-типа, AcOEt/гексан = 0% - 10%), получая указанное в заголовке соединение (4,916 г, желтое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,35 (т, J=7,1 Гц, 3H), 2,64 (с, 3H), 4,37 (кв, J=7,1 Гц, 2H), 7,06-7,11 (м, 2H), 7,20-7,24 (м, 2H).
1-[3-Этил-2-(4-фторфенокси)-5-метил-3Н-имидазол-4-ил]-этанон
[Формула 47]

(5) Смесь соединения, полученного в Примере 5-(4), (3,66 г), триметилбороксина (1,57 мл), Pd(PPh3)4 (1,29 г) и К2СО3 (4,64 г) в диоксане (25 мл) перемешивали в атмосфере аргона при 115°С в течение 6 часов. К данной смеси далее добавляли триметилбороксин (0,52 мл) и перемешивали при той же температуре дополнительно в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали для удаления нерастворимых веществ. Фильтрат концентрировали и полученный остаток очищали с помощью колоночной хроматографии (нейтральный SiO2 ОН-типа, AcOEt/гексан = 0% - 50%), получая указанное в заголовке соединение (627 мг, желтое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,33 (т, J=7,0 Гц, 3H), 2,46 (2с, 6H), 4,32 (кв, J=7,0 Гц, 2H) 7,05-7,10 (м, 2H) 7,19-7,22 (м, 2H).
1-[3-Этил-2-(4-фторфенокси)-5-метил-3Н-имидазол-4-ил]этанол
[Формула 48]

(6) Исходя из соединения, полученного в Примере 5-(5), повторяли ту же самую процедуру, которая применялась в Примере 2-(5), получая указанное в заголовке соединение (светло-желтое масло, выход 42%).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,35 (т, J=7,1 Гц, 3H), 1,58 (дд, J=6,9, 1,8 Гц, 3H), 2,13 (с, 3H), 3,93-4,09 (м, 2H), 4,94-5,01 (м, 1H), 6,99-7,06 (м, 2H), 7,15-7,20 (м, 2H).
1-[3-Этил-2-(4-фторфенокси)-5-метил-3Н-имидазол-4-ил]этилазид
[Формула 49]
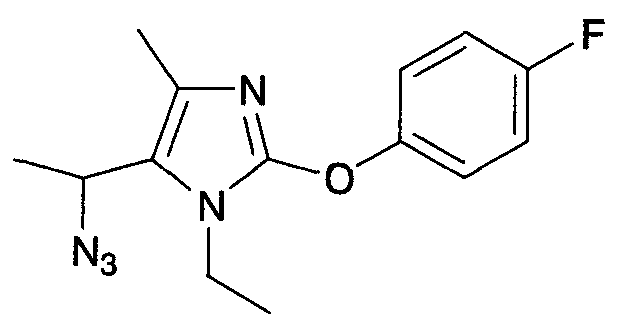
(7) Исходя из соединения, полученного в Примере 5-(6), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (желтое масло, выход 44%).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,36 (т, J=7,3 Гц, 3H), 1,60 (д, J=7,3 Гц, 3H), 2,19 (с, 3H), 3,88-4,00 (м, 2H), 4,70-4,76 (м, 1H), 7,00-7,08 (м, 2H), 7,17-7,22 (м, 2H).
5-(1-Аминоэтил)-1-этил-2-(4-фторфенокси)-4-метил-1Н-имидазол
[Формула 50]

(8) Смесь соединения, полученного в Примере 5-(7), (120 мг), и палладия-активированного угля (24 мг, Pd 10 мас.%) в МеОН (3,0 мл) перемешивали в атмосфере водорода (примерно 1 атмосфера) при комнатной температуре в течение 4 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали, получая указанное в заголовке соединение (120 мг, бесцветное масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,33 (т, J=7,1 Гц, 3H), 1,48 (д, J=6,9 Гц, 3H), 2,16 (с, 3H), 3,92-4,14 (м, 2H), 4,27 (кв, J=6,9 Гц, 1H), 6,99-7,05 (м, 2H), 7,14-7,21 (м, 2H).
3,4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-5-метил-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 188)
[Формула 51]

(9) Исходя из соединения, полученного в Примере 5-(8), повторяли ту же самую процедуру, которая применялась в Примере 1-(6), получая указанное в заголовке соединение (Соединение 188) (бесцветный порошок, выход 73%).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,25 (т, J=7,1 Гц, 3H), 1,55 (д, J=6,9 Гц, 3H), 2,00 (с, 3H), 3,60-3,73 (м, 1H), 3,77-3,89 (м, 1H), 4,63-4,74 (м, 1H), 4,95-5,03 (м, 1H), 7,00-7,08 (м, 2H), 7,11-7,18 (м, 2H), 7,43-7,52 (м, 2H), 7,75 (д, J=1,8 Гц, 1H).
Точка плавления: 119,5-120,0°С
Пример 6
3,4-Дихлор-N-[1-(4-этил-1-метил-5-п-толилокси-1Н-пиразол-3-ил)этил]бензолсульфонамид (Соединение 180)
[Формула 52]

Этиловый эфир 5-гидрокси-1-метил-1Н-пиразол-3-карбоновой кислоты
[Формула 53]

(1) К раствору натриевой соли диэтилоксальацетата (30,0 г) в толуоле (200 мл) добавляли уксусную кислоту (200 мл) и метилгидразин (15 мл) и перемешивали при 100°С в течение 8,5 часов. Реакционную смесь концентрировали и полученный остаток разбавляли насыщенным водным раствором хлорида натрия и экстрагировали AcOEt. Полученный органический слой сушили над сульфатом магния, фильтровали и затем выпаривали при пониженном давлении для удаления растворителя. Полученное твердое вещество промывали смесью Еt2О/гексан (Et2O/гексан = 2/1) и сушили, получая указанное в заголовке соединение (18,8 г, коричневый порошок).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,25 (т, J-7,1 Гц, 3Н), 3,59 (с, 3Н), 4,16-4,25 (м, 2Н), 5,77 (с, 1Н).
Этиловый эфир 5-хлор-4-формил-1-метил-1Н-пиразол-3-карбоновой кислоты
[Формула 54]
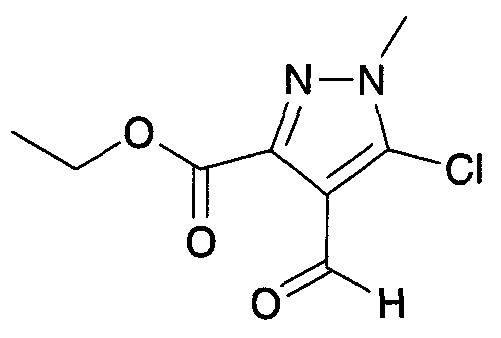
(2) К 1,2-дихлорэтану (75 мл) последовательно по каплям добавляли ДМФ (13,7 мл) и POCl3 (82,5 мл) при 0°С в атмосфере азота. К данной смеси по каплям добавляли раствор соединения, полученного в Примере 6-(1), (10 г) в 1,2-дихлорэтане (75 мл) и нагревали до комнатной температуры. После перемешивания при 110°С в течение 4,5 часов реакционную смесь охлаждали до комнатной температуры и выпаривали для удаления растворителя. Полученный остаток добавляли к насыщенному водному раствору бикарбоната натрия и перемешивали в течение 2 часов. После экстрагирования AcOEt органический слой сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт перекристаллизовывали (AcOEt/гексан), получая указанное в заголовке соединение (14,7 г, желтое твердое вещество).
1H ЯМР (600 MГц, ДМСО-d6) δ м.д.: 1,32 (т, J=7,0 Гц, 3H), 3,92 (с, 3H), 4,36 (кв, J=7,0 Гц, 2H), 10,24 (с, 1H).
Этиловый эфир 4-формил-1-метил-5-п-толилокси-1Н-пиразол-3-карбоновой кислоты
[Формула 55]

(3) К раствору 4-крезола (3,62 мл) в ДМФ (80 мл) при комнатной температуре добавляли NаН (1,38 г, 60% в минеральном масле) и перемешивали при комнатной температуре в течение 15 минут с последующим добавлением соединения, полученного в Примере 6-(2), (5,00 г). После перемешивания при 110°С в течение 1,5 часов реакционную смесь охлаждали до комнатной температуры и выпаривали для удаления растворителя. Полученный остаток очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0%-50%), получая указанное в заголовке соединение (3,54 г, бесцветное твердое вещество).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,27-1,38 (м, 3Н), 2,27 (с, 3Н), 3,74 (с, 3Н), 4,32-4,42 (м, 2Н), 6,84-6,94 (м, 2Н), 7,10-7,20 (м, 2Н), 10,08 (с, 1Н).
Этиловый эфир 4-(1-гидроксиэтил)-1-метил-5-п-толилокси-1Н-пиразол-3-карбоновой кислоты
[Формула 56]

(4) К раствору соединения, полученного в Примере 6-(3), (3,50 г) в ТГФ (20 мл)/Еt2O (120 мл) добавляли MeMgBr (5,26 мл, 3,0 ммол в Et2O) в атмосфере азота при -30°С. После нагревания до 0°С реакционную смесь перемешивали в течение 2,5 часов, разбавляли насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, а затем экстрагировали AcOEt. Органический слой сушили над сульфатом натрия, фильтровали и затем выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0%-50%), получая указанное в заголовке соединение (2,17 г, светло-желтое масло).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,22 (д, J=6,4 Гц, 3Н), 1,28-1,32 (м, 3Н), 2,26 (с, 3Н), 3,56 (с, 3Н), 4,28 (кв, J=6, 9 Гц, 2Н), 4,75 (д, J=4,6 Гц, 1Н), 5,03-5,11 (м, 1Н), 6,79-6,84 (м, 2Н), 7,13-7,19 (м, 2Н).
Этиловый эфир 4-этил-1-метил-5-п-толилокси-1Н-пиразол-3-карбоновой кислоты
[Формула 57]

(5) К раствору соединения, полученного в Примере 6-(4), (2,14 г), в СНСl3 (40 мл) при -20°С добавляли СF3СООН (5,4 мл) и Et3SiH (2,3 мл) и перемешивали при комнатной температуре в течение 3,5 часов. Полученную реакционную смесь очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0%-50%), получая указанное в заголовке соединение (1,36 г, бесцветное масло).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,93 (т, J=7,5 Гц, 3Н), 1,29 (т, J=7,0 Гц, 3Н), 2,27 (с, 3Н), 2,42 (кв, J=7,5 Гц, 2Н), 3,63 (с, 3Н), 4,27 (кв, J=7,0 Гц, 2Н), 6,78-6,87 (м, 2Н), 7,16-7,22 (м, 2Н).
4-Этил-1-метил-5-п-толилокси-1Н-пиразол-3-карбальдегид
[Формула 58]
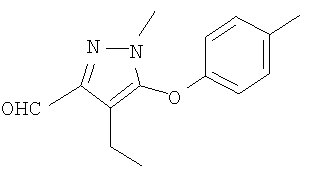
(6) К раствору соединения, полученного в Примере 6-(5), (1,36 г), в ТГФ (30 мл) при -20°С добавляли LiB(С2Н5)3Н (9,9 мл, 1,0 М в ТГФ) и перемешивали в течение 2 часов. Затем реакционную смесь нагревали до 0°С и перемешивали в течение 2 часов с последующим добавлением АсОН (10% в EtOH). После перемешивания при комнатной температуре в течение 0,5 часа реакционную смесь выпаривали для удаления растворителя, разбавляли водным раствором НСl (1,0 М) и экстрагировали AcOEt. Органический слой сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0%-99%), получая указанное в заголовке соединение (72 мг, бесцветное масло) и 4-этил-1-метил-5-п-толилокси-1Н-пиразол-3-ил)-метанол (554 мг, бесцветное масло).
4-Этил-1-метил-5-п-толилокси-1Н-пиразол-3-карбальдегид
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,94 (т, J=7,5 Гц, 3Н), 2,27 (с, 3Н), 2,42 (кв, J=7,5 Гц, 2Н), 3,71 (с, 3Н), 6,84-6,89 (м, 2Н), 7,18-7,22 (м, 2Н), 9,81 (с, 1Н).
4-Этил-1-метил-5-п-толилокси-1Н-пиразол-3-ил)-метанол
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,94 (т, J=7,8 Гц, 3Н), 2,23 (кв, J=7,8 Гц, 2Н), 2,26 (с, 3Н), 3,48 (с, 3Н), 4,34 (д, J=5,5 Гц, 2Н), 4,90 (т, J=5,5 Гц, 1Н), 6,76-6,83 (м, 2Н), 7,12-7,22 (м, 2Н).
1-(4-Этил-1-метил-5-п-толилокси-1Н-пиразол-3-ил)этанол
[Формула 59]

(7) К раствору 4-этил-1-метил-5-п-толилокси-1Н-пиразол-3-карбальдегида, полученного в Примере 6-(6), (470 мг) в Et2O (10 мл) добавляли MeMgBr (0,71 мл, 3,0 ммол в Et2O) при -30°С в атмосфере азота. После перемешивания при 0°С в течение 4 часов реакционную смесь разбавляли насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0%-50%), получая указанное в заголовке соединение (406 мг, бесцветное масло).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,93 (м, 3Н), 1,39 (д, J=6,4 Гц, 3Н), 2,22-2,32 (м, 5Н), 3,47 (с, 3Н), 4,64-4,72 (м, 1Н), 4,92 (д, J=5,0 Гц, 1Н), 6,75-6,81 (м, 2Н), 7,14-7,20 (м, 2Н).
3-(1-Азидоэтил)-4-этил-1-метил-5-п-толилокси-1Н-пиразол
[Формула 60]
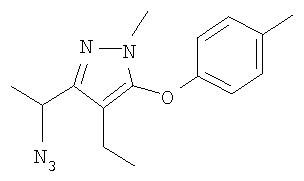
(8) Исходя из соединения, полученного в Примере 6-(7), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (бесцветное масло, выход 70%).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,92 (т, J=7,8 Гц, 3Н), 1,53 (д, J=6,9 Гц, 3Н), 2,23 (кв, J=7,8 Гц, 2Н), 2,27 (с, 3Н), 3,54 (с, 3Н), 4,69 (кв, J=6,9 Гц, 1Н), 6,75-6,83 (м, 2Н), 7,14-7,22 (м, 2Н).
1-(4-Этил-1-метил-5-п-толилокси-1Н-пиразол-3-ил)этиламин
[Формула 61]

(9) Исходя из соединения, полученного в Примере 6-(8), повторяли ту же самую процедуру, которая применялась в Примере 1-(5), получая указанное в заголовке соединение (бесцветное масло, выход 89%).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,92 (м, 3Н), 1,29 (д, J=6,9 Гц, 3Н), 2,18-2,29 (м, 5Н), 3,46 (с, 3Н), 3,94 (кв, J=6,9 Гц, 1Н), 6,75-6,82 (м, 2Н), 7,14-7,20 (м, 2Н).
3,4-Дихлор-N-[1-(4-этил-1-метил-5-п-толилокси-1Н-пиразол-3-ил)этил]бензолсульфонамид (Соединение 180)
[Формула 62]

(10) Исходя из соединения, полученного в Примере 6-(9), повторяли ту же самую процедуру, которая применялась в Примере 1-(6), получая указанное в заголовке соединение (Соединение 180) (бесцветный порошок, выход 48%).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,78 (т, J=7,6 Гц, 3Н), 1,33 (д, J=6,9 Гц, 3Н), 1,95-2,12 (м, 2Н), 2,26 (с, 3Н), 3,37 (с, 3Н), 4,37-4,51 (м, 1Н), 6,60-6,70 (м, 2Н), 7,12-7,22 (м, 2Н), 7,64 (дд, J=8,5, 2,1 Гц, 1Н), 7,77-7,89 (м, 2Н), 8,41 (ушир.с, 1Н).
Точка плавления: 114,0-115,0°С
Пример 7
3, 4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]пропил}бензолсульфонамид (Соединение 191)
[Формула 63]

2-Хлор-3-этил-3Н-имидазол-4-карбальдегид
[Формула 64]

(1) К раствору 2-хлор-1-этил-1Н-имидазола, полученного в Примере 5-(1), (15,0 г), в ТГФ (570 мл) по каплям добавляли n-BuLi (2,64 М в гексане, 45,5 мл) при -78°С в течение 1 часа и перемешивали при той же температуре в течение 30 минут. При той же самой температуре в течение 15 минут по каплям добавляли диметилформамид (8,9 мл) и реакционную смесь нагревали до 0°С в течение 5 часов. Реакционную смесь разбавляли насыщенным водным раствором хлорида аммония и водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (SiO2 ОН-типа, AcOEt/гексан = 0% - 60%), получая указанное в заголовке соединение (14,1 г) в виде бесцветных кристаллов.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,37 (т, J=7,1 Гц, 3H), 4,27-4,50 (м, 2H), 7,69 (с, 1H), 9,64 (с, 1H).
3-Этил-2-(4-фторфенокси)-3Н-имидазол-4-карбальдегид
[Формула 65]

(2) Суспензию соединения, полученного в Примере 7-(1), (5,0 г), 4-фторфенола (2,87 г) и Cs2CО3 (10,4 г) в DMPU (10 мл) перемешивали при 200°С в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь разбавляли смесью метанол/хлороформ (1/4) и фильтровали. Фильтрат концентрировали и полученный остаток очищали с помощью колоночной хроматографии (SiO2 ОН-типа, AcOEt/гексан = 0% - 30%), получая указанное в заголовке соединение (4,16 г) в виде светло-желтой жидкости.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,44 (т, J=7,3 Гц, 3H), 4,37 (кв, J=7,3 Гц, 2H), 7,10-7,17 (м, 2H), 7,36-7,40 (м, 2H).
1-[3-Этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]-пропан-1-ол
[Формула 66]

(1) К раствору соединения, полученного в Примере 7-(2), (468 мг), в Et2O (4,0 мл) при 0°С добавляли EtMgBr (1,0 М в ТГФ, 4,0 мл) и перемешивали от той же температуры до комнатной температуры в течение 2 часов. Реакционную смесь разбавляли насыщенным водным раствором хлорида аммония и водный слой экстрагировали этилацетатом. После промывания насыщенным водным раствором хлорида натрия органический слой сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (SiO2 ОН-типа, AcOEt/гексан = 0% - 50%), получая указанное в заголовке соединение (1,1 г) в виде бесцветного твердого вещества.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,06 (т, J=7,3 Гц, 3H), 1,39 (т, J=7,1 Гц, 3H), 1,83-2,02 (м, 2H), 3,95-4,10 (м, 2H), 4,43-4,51 (м, 1H), 6,53-6,60 (м, 1H), 7,02-7,10 (м, 2H), 7,17-7,25 (м, 2H).
5-(1-Азидопропил)-1-этил-2-(4-фторфенокси)-1Н-имидазол
[Формула 67]

(4) Исходя из соединения, полученного в Примере 7-(3), (550 мг), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (606 мг) в виде бесцветного масла.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,02-1,11 (м, 3H), 1,39 (т, J=7,1 Гц, 3H), 1,96-2,06 (м, 2H), 3,89-4,02 (м, 2H), 4,02-4,08 (м, 1H), 6,64-6,71 (м, 1H), 7,02-7,41 (м, 4H).
1-[3-Этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]пропиламин
[Формула 68]

(5) Исходя из соединения, полученного в Примере 7-(4), (606 мг), повторяли ту же самую процедуру, которая применялась в Примере 1-(5), получая указанное в заголовке соединение (214 мг) в виде бесцветного порошка.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,00 (т, J=7,3 Гц, 3H), 1,37 (т, J=7,1 Гц, 3H), 1,63-1,73 (м, 1H), 1,84-1,94 (м, 1H), 3,70 (т, J=6,9 Гц, 1H), 3,93-4,10 (м, 2H), 6,50 (с, 1H), 7,01-7,07 (м, 2H), 7,17-7,24 (м, 2H).
3,4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]пропил}бензолсульфонамид (Соединение 191)
[Формула 69]

(6) Исходя из соединения, полученного в Примере 7-(5), (107 мг), повторяли ту же самую процедуру, которая применялась в Примере 1-(6), получая указанное в заголовке соединение (Соединение 191) (144 мг) в виде бесцветного порошка.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 0,92 (т, J=7,3 Гц, 3H), 1,30 (т, J=7,1 Гц, 3H), 1,68-1,87 (м, 2H), 3,77-3,93 (м, 2H), 4,30-4,40 (м, 1H), 4,80-4,92 (м, 1H), 6,43 (с, 1H), 7,02-7,11 (м, 2H), 7,14-7,22 (м, 2H), 7,52-7,56 (м, 1H), 7,56-7,62 (м, 1H), 7,86 (д, J=1,8 Гц, 1H).
Точка плавления: 137,5-138,5°С
Пример 8
*3,4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]пропил}бензолсульфонамид (Соединения 253 и 254)
[Формула 70]

Соединение, полученное в примере 7, (80 мг), подвергали оптическому расщеплению на оптической разделительной колонке (колонка: CHIRALPAK AD [Diacel Chemical Industries, Ltd., Japan], 2 см ⌀ × 25 см L; элюент: i-PrOH/гексан = 50%, скорость потока: 6,0 мл/мин), получая указанное в заголовке соединение (Соединение 253) [(R)-(+)-форма, 31 мг, бесцветный порошок, чью конфигурацию определяли с помощью рентгеновского структурного анализа] и другое указанное в заголовке соединение (Соединение 254) [(S)-(-)-форма, 28 мг, бесцветный порошок, чью конфигурацию определяли с помощью рентгеновского структурного анализа].
(R)-(+)-3,4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]пропил}бензолсульфонамид (Соединение 253)
[Формула 71]

[б]D26 +19,7° (c 0,436, CHCl3)
Время удерживания: 7,6 мин (колонка: CHIRALPAK AD [Diacel Chemical Industries, Ltd., Japan], 4,6 мм ⌀ × 250 мм L; элюент: i-PrOH/гексан = 60%, скорость потока: 0,5 мл/мин)
(S)-(-)-3,4-Дихлор-N-{1-[3-этил-2-(4-фторфенокси)-3Н-имидазол-4-ил]пропил}бензолсульфонамид (Соединение 254)
[Формула 72]

[б]D25 -17,3° (c 0,557, CHCl3)
Время удерживания: 14,7 мин (колонка: CHIRALPAK AD [Diacel Chemical Industries, Ltd., Japan], 4,6 мм ⌀ × 250 мм L; элюент: i-PrOH/гексан = 60%, скорость потока: 0,5 мл/мин)
Пример 9
3,4-Дихлор-N-{1-[3-этил-2-(4-хлорфенокси)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 189)
[Формула 73]

1-(2-Хлор-3-этил-3Н-имидазол-4-ил)этанол
[Формула 74]

(1) К раствору 2-хлор-3-этил-3Н-имидазол-4-карбальдегида, полученного в Примере 7-(1), (13,60 г), в Et2O (429 мл) при -30°С в атмосфере аргона добавляли MeMgBr (37,2 мл, 3,0 М в Et2O). После нагревания до 0°C реакционную смесь разбавляли насыщенным водным раствором NH4Cl и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Полученный сырой продукт (коричневое твердое вещество) промывали гексаном и затем сушили, получая указанное в заголовке соединение (13,01 г) в виде светло-коричневого твердого вещества.
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,37 (т, J=7,3 Гц, 3H), 1,62 (д, J=6,6 Гц, 3H), 3,89-4,30 (м, 2H), 4,80 (кв, J=6,6 Гц, 1H), 6,80 (с, 1H).
5-(1-Азидоэтил)-2-хлор-1-этил-1Н-имидазол
[Формула 75]

(2) Исходя из соединения, полученного в Примере 9-(1), (11,95 г), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (светло-желтое масло, 13,67 г).
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,37 (т, J=7,3 Гц, 3H), 1,69 (д, J=6,6 Гц, 3H), 3,90-4,15 (м, 2H), 4,26-4,40 (м, 1H), 6,95 (д, J=0,9 Гц, 1H).
1-(2-Хлор-3-этил-3Н-имидазол-4-ил)этиламин
[Формула 76]

(3) К раствору соединения, полученного в Примере 9-(2), (5,99 г), и PPh3 (7,869 г) в ТГФ (300 мл) добавляли Н2О (10 мл) и нагревали при температуре кипения с обратным холодильником в течение 15,5 часов. После охлаждения до комнатной температуры растворитель отгоняли и полученный сырой продукт растворяли в CHCl3 (200 мл). Для отделения органического слоя добавляли соляную кислоту (1,0 н., 100 мл) и к водному слою добавляли CHCl3 (200 мл) для дальнейшего отделения органического слоя. Водный слой доводили до основного рН с помощью NaOH (5,0 г), высаливали с помощью NaCl и экстрагировали CHCl3 (200 мл × 2). Объединенные органические слои сушили сульфатом натрия, фильтровали и концентрировали, получая указанное в заголовке соединение (бесцветное масло, 4,588 г).
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,36 (т, J=7,3 Гц, 3H), 1,49 (д, J=6,6 Гц, 3H), 3,90-4,29 (м, 3H), 6,80 (с, 1H).
1-[2-(4-Хлорфенокси)-3-этил-3Н-имидазол-4-ил]этиламин
[Формула 77]

(4) В устойчивую к давлению трубку с винтовой крышкой помещали соединение, полученное в Примере 9-(3), (120 мг), 4-хлорфенол (133 мг), Cs2CO3 (563 мг) и DMPU (0,69 мл) и перемешивали при 200°С в течение 3 часов, а затем при 250°С в течение 1,5 часов. После остывания до комнатной температуры добавляли смесь MeOH/CHCl3 (MeOH/CHCl3 = 20%, 5 мл) и реакционную смесь очищали (SiO2 NН-типа, MeOH/CHCl3 = 1/4, 5 мл), давая коричневое масло, которое затем очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, AcOEt, MeOH/CHCl3 = 0% - 20%), получая указанное в заголовке соединение (58 мг, коричневое масло).
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,36 (т, J=7,0 Гц, 3H), 1,50 (д, J=6,6 Гц, 3H), 3,79-4,12 (м, 3H), 6,55 (д, J=0,9 Гц, 1H), 7,12-7,36 (м, 4H).
3,4-Дихлор-N-{1-[3-этил-2-(4-хлорфенокси)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 189)
[Формула 78]

(5) Исходя из соединения, полученного в Примере 9-(4), (55 мг), повторяли ту же самую процедуру, которая применялась в Примере 1-(6), получая указанное в заголовке соединение (Соединение 189) (53 мг) в виде бесцветного порошка.
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,35 (т, J=7,1 Гц, 3H), 1,37 (д, J=6,9 Гц, 3H), 3,87-4,05 (м, 2H), 4,58-4,70 (м, 1H), 4,81 (ушир.с, 1H), 6,55 (с, 1H), 7,14-7,22 (м, 2H), 7,34 (д, J=8,7 Гц, 2H), 7,61 (д, J=8,7 Гц, 1H), 7,67-7,75 (м, 1H), 7,94-8,01 (м, 1H).
Точка плавления: 153,0-157,0°С
Пример 10
3,4-Дихлор-N-{1-[2-(4-хлорфенокси)-3-этил-3Н-имидазол-4-ил]этил}-N-метил-бензолсульфонамид (Соединение 248)
[Формула 79]

К раствору соединения, полученного в Примере 9-(5), (36 мг), в ДМФ (2,0 мл) добавляли К2СО3 (21 мг) и MeI (5 мкл) и перемешивали при комнатной температуре в течение 7 часов. Нерастворимые вещества отфильтровывали и фильтрат концентрировали. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 NН-типа, MeOH/CHCl3 = 0% - 2%) с последующей перекристаллизацией (АсОЕt-гексан), получая указанное в заголовке соединение (Соединение 248) (30 мг, бесцветный порошок).
1H ЯМР (200 MГц, CDCl3) δ м.д.: 1,15 (д, J=7,0 Гц, 3H), 1,39 (т, J=7,3 Гц, 3H), 2,63 (с, 3H), 4,04-4,16 (м, 2H), 5,29 (кв, J=7,0 Гц, 1H), 6,59 (с, 1H), 7,16-7,24 (м, 2H), 7,30-7,36 (м, 2H), 7,64 (д, J=8,4 Гц, 1H), 7,69 (дд, J=8,4, 1,8 Гц, 1H), 7,96 (д, J=1,8 Гц, 1H).
Точка плавления: 142,0-144,0°С
Пример 11
N-{1-[2-(3-Аминофенокси)-3-этил-3Н-имидазол-4-ил]этил}-3,4-дихлорбензолсульфонамид (Соединение 233)
[Формула 80]

1.5 трифторуксусная соль 1-(2-хлор-3-этил-3Н-имидазол-4-ил)этиламина
[Формула 81]

(1) Соединение, полученное в Примере 9-(3), (4,20 г), растворяли в CHCl3 (48 мл) с последующим добавлением трифторуксусной кислоты (2,8 мл) при 0°С. После нагревания до комнатной температуры реакционную смесь перемешивали в течение 1 часа и затем концентрировали, получая указанное в заголовке соединение (8,262 г, бесцветный порошок).
1H ЯМР (200 MГц, ДМСО-d6) δ м.д.: 1,23 (т, J=7,3 Гц, 3H), 1,53 (д, J=6,6 Гц, 3H), 3,77-4,23 (м, 2H), 4,45-4,59 (м, 1H), 7,08 (с, 1H), 8,25 (ушир.с, 3H).
Элементарный анализ: вычислено (С:34,85%, Н:3,95%, N:12,19%), найдено (С:34,58%, Н:3,85%, N:12,11%)
3-[5-(1-Аминоэтил)-1-этил-1Н-имидазол-2-илокси]фениламин
[Формула 82]

(2) В устойчивую к давлению трубку с винтовой крышкой помещали соединение, полученное в Примере 11-(1), (1,00 г), 3-аминофенол (633 мг), Cs2CO3 (2,83 г) и DMPU (4,0 мл) и перемешивали при 250°С в течение 2 часов. После остывания до комнатной температуры добавляли CHCl3 и воду и смесь концентрировали. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, MeOH/CHCl3 = 10% - 20%), получая указанное в заголовке соединение (103 мг, коричневое масло).
1H ЯМР (600 MГц, ДМСО-d6) δ м.д.: 1,19-1,24 (м, 3H), 1,35 (д, J=6,4 Гц, 3H), 3,80-4,00 (м, 3H), 5,19-5,24 (м, 2H), 6,19-6,22 (м, 1H), 6,29-6,33 (м, 2H), 6,43 (д, J=0,9 Гц, 1H), 6,93-6,98 (м, 1H).
N-{1-[2-(3-Аминофенокси)-3-этил-3Н-имидазол-4-ил]этил}-3,4-дихлорбензолсульфонамид (Соединение 233)
[Формула 83]
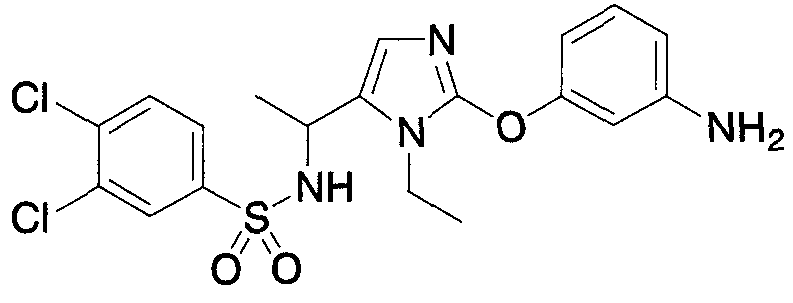
(3) К раствору соединения, полученного в Примере 11-(2), (97 мг), и Et3N (0,11 мл) в ТГФ (1,0 мл) при -78°С добавляли раствор 3,4-дихлорбензолсульфонилхлорида (96,7 мг) в ТГФ (1,0 мл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (SiO2 NН-типа, МеОН/CHCl3 = 2%), получая указанное в заголовке соединение (Соединение 233) (150 мг, светло-коричневое аморфное вещество).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,31 (т, J=7,1 Гц, 3H), 1,36 (д, J=6,9 Гц, 3H), 3,73 (ушир.с, 2H), 3,84-3,95 (м, 2H), 4,59-4,65 (м, 1H), 5,03 (д, J=8,3 Гц, 1H), 6,45-6,49 (м, 1H), 6,49 (с, 1H), 6,51-6,56 (м, 2H), 7,09-7,14 (м, 1H), 7,57 (д, J=8,3 Гц, 1H), 7,63-7,66 (м, 1H), 7,96 (д, J=2,3 Гц, 1H).
Пример 12
3,4-Дихлор-N-{1-[3-этил-2-(3-метансульфониламинофенокси)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 234)
[Формула 84]

К раствору соединения, полученного в Примере 11-(3), (37 мг), в пиридине (0,37 мл) при комнатной температуре добавляли метансульфонилхлорид (0,01 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. После добавления воды реакционную смесь концентрировали и полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 NН-типа, MeOH/CHCl3 = 5% - 10%), получая указанное в заголовке соединение (33 мг, бесцветное аморфное вещество).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,31-1,39 (м, 6H), 2,97 (с, 3H), 3,90-3,97 (м, 2H), 4,59-4,67 (м, 1H), 5,06 (д, J=8,3 Гц, 1H), 6,56 (с, 1H), 6,91-6,97 (м, 2H), 7,04 (с, 1H), 7,24-7,29 (м, 1H), 7,62 (д, J=8,3 Гц, 1H), 7,70 (д, J=8,7 Гц, 1H), 7,87 (с, 1H), 7,97 (д, J=1,4 Гц, 1H).
Пример 13
3,4-Дихлор-N-{1-[3-этил-2-(3-пиррол-1-ил-фенокси)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 249)
[Формула 85]

К раствору соединения, полученного в Примере 11-(3), (40 мг), в АсОН (300 мкл) добавляли 2,5-диметокси-тетрагидрофуран (20,3 мкл) и перемешивали при 130°С в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, MeOH/CHCl3 = 0% - 2%), а затем очищали с помощью колоночной хроматографии (SiO2 NH-типа, AcOEt), получая указанное в заголовке соединение (Соединение 249) (19 мг, бесцветное порошкообразное соединение).
1H ЯМР (600 МГц, СDСl3) δ м.д.: 1,36 (т, J=7,3 Гц, 3Н), 1,40 (д, J=6,9 Гц, 3Н), 3,91-4,00 (м, 2Н), 4,52-4,57 (м, 1Н), 4,63-4,69 (м, 1Н), 6,32-6,34 (м, 1Н), 6,57 (с, 1Н), 7,04-7,73 (м, 9Н), 7,95-7,99 (м, 1Н).
Пример 14
3,4-Дихлор-N-[1-(3-этил-2-п-толилсульфанил-3Н-имидазол-4-ил)этил]бензолсульфонамид (Соединение 241)
[Формула 86]

3-Этил-2-п-толилсульфанил-3Н-имидазол-4-карбальдегид
[Формула 87]

(1) В устойчивую к давлению трубку с винтовой крышкой помещали соединение, полученное в Примере 7-(1), (500 мг), ДМФ (2,0 мл) 4-метилбензолтиол (803 мг), Сs2СО3 (3,08 г) и перемешивали при 150°С в течение 2 часов, а затем при 170°С в течение 2 часов. После остывания до комнатной температуры реакционную смесь разбавляли насыщенным водным раствором NH4Cl и экстрагировали AcOEt. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Полученный сырой продукт очищали с помощью колоночной хроматографии (кислый SiO2 ОН-типа, AcOEt/гексан = 0%-20%), получая указанное в заголовке соединение (571 мг, желтое твердое вещество).
1H ЯМР (600 МГц, СDСl3) δ м.д.: 1,31 (т, J=7,l Гц, 3Н), 2,35 (с, 3Н), 4,39-4,48 (м, 2Н), 7,06-7,29 (м, 2Н), 7,36-7,43 (м, 2Н), 7,75 (с, 1Н), 9,62 (с, 1Н).
1-(3-Этил-2-п-толилсульфанил-3Н-имидазол-4-ил)этанол
[Формула 88]

(2) К раствору соединения, полученного в Примере 14-(1), (571 мг), в ТГФ (5,0 мл) в атмосфере аргона при комнатной температуре добавляли MeМgBr (1,55 мл, 3,0 М в Et2O) и перемешивали в течение 5 часов. Реакционную смесь разбавляли насыщенным водным раствором NH4Cl, экстрагировали этилацетатом, сушили над сульфатом магния, фильтровали и концентрировали. Полученный сырой продукт очищали с помощью колоночной хроматографии (нейтральный SiO2 ОН-типа, AcOEt/гексан = 20%-99%), получая указанное в заголовке соединение (490 мг, бесцветное масло).
1H ЯМР (600 МГц, СDСl3) δ м.д.: 1,25 (т, J=7,8 Гц, 3Н), 1,65 (д, J=6,9 Гц, 3Н), 2,29 (с, 3Н), 4,07-4,28 (м, 2Н), 4,79-4,89 (м, 1Н), 7,05-7,12 (м, 3Н), 7,14-7,21 (м, 2Н).
5-(1-Азидоэтил)-1-этил-2-п-толилсульфанил-1Н-имидазол
[Формула 89]

(3) Исходя из соединения, полученного в Примере 14-(2), (490 мг), повторяли ту же самую процедуру, которая применялась в Примере 1-(4), получая указанное в заголовке соединение (бесцветное масло, 360 мг).
1H ЯМР (600 МГц, CDCl3) δ м.д.: 1,25 (т, J=7, 3 Гц, 3Н), 1,70 (д, J=6,9 Гц, 3Н), 2,29 (с, 3Н), 4,02-4,18 (м, 2Н), 4,32-4,40 (м, 1Н), 7,08 (д, J=8,7 Гц, 2Н), 7,13-7,20 (м, 3Н).
3,4-Дихлор-N-[1-(3-этил-2-п-толилсульфанил-3Н-имидазол-4-ил)этил]бензолсульфонамид (Соединение 241)
[Формула 90]

(4) К раствору соединения, полученного в Примере 14-(3), (360 мг), и PPh3 (657 мг) в ТГФ (4,0 мл) добавляли Н2O (0,44 мл) и нагревали при температуре кипения с обратным холодильником в течение 4,5 часов. После охлаждения до комнатной температуры растворитель отгоняли и полученный сырой продукт очищали с помощью колоночной хроматографии (нейтральный SiO2 ОН-типа, AcOEt/гексан = 0%-60%), получая бесцветное масло (284 мг), которое затем растворяли в ТГФ (2,0 мл). К данному раствору при комнатной температуре добавляли Et3N (0,30 мл) и 3,4-дихлорбензолсульфонилхлорид (316 мг) и перемешивали при комнатной температуре в течение 12 часов. После добавления AcOEt органический слой промывали последовательно 1 н. соляной кислотой и солевым раствором, сушили над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле NН-типа (элюент: AcOEt) с последующей перекристаллизацией (AcOEt/гексан), получая указанное в заголовке соединение (Соединение 241) (267 мг, бесцветный порошок).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,20 (т, J=7,3 Гц, 2H), 1,37 (д, J=6,9 Гц, 3H), 2,30 (с, 3H), 4,00-4,20 (м, 2H), 4,59-4,71 (м, 1H), 5,27 (д, J=8,3 Гц, 1H), 6,89 (с, 1H), 7,07-7,12 (м, 2H), 7,16-7,21 (м, 2H), 7,53 (д, J=8,3 Гц, 1H), 7,64 (дд, J=8,3, 2,3 Гц, 1H), 7,95 (д, J=2,3 Гц, 1H).
Точка плавления: 173,0-174,0°С
Пример 15
3,4-Дихлор-N-{1-[3-этил-2-(толуол-4-сульфонил)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 252)
[Формула 91]

К раствору соединения, полученного в Примере 14-(4), (100 мг), в хлороформе (2,0 мл) добавляли м-хлорпербензойную кислоту (611 мг) и перемешивали при комнатной температуре в течение ночи. Затем добавляли м-хлорпербензойную кислоту (410 мг) и перемешивали при комнатной температуре в течение дополнительных 3 часов. После добавления AcOEt органический слой промывали последовательно 5% водным раствором Na2S2O3 и насыщенным водным раствором бикарбоната натрия, сушили над сульфатом магния, фильтровали и выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, AcOEt/гексан = 0% - 30%) и далее очищали с помощью колоночной хроматографии (SiO2 NН-типа, (AcOEt/гексан = 0% - 99%) с последующей перекристаллизацией (AcOEt/гексан), получая указанное в заголовке соединение (Соединение 252) (13 мг, бесцветное порошкообразное соединение).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,38-1,43 (м, 6H), 2,45 (с, 3H), 4,32-4,53 (м, 2H), 4,62-4,70 (м, 1H), 6,84 (с, 1H), 7,35-7,39 (м, 2H), 7,52-7,56 (м, 1H), 7,59-7,63 (м, 1H), 7,89-7,94 (м, 3H).
Точка плавления: 180,0-183,0°С
Пример 16
3,4-Дихлор-N-{1-[3-этил-2-(1Н-индол-6-илокси)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 250)
[Формула 92]

1-[3-Этил-2-(1Н-индол-6-илокси)-3Н-имидазол-4-ил]этиламин
[Формула 93]

(1) В устойчивую к давлению трубку с винтовой крышкой помещали соединение, полученное в Примере 11-(1), (500 мг), 1Н-индол-6-ол (405 мг), Cs2CO3 (1,42 г) и DMPU (2,0 мл) и перемешивали при 250°С в течение 2,5 часов. После остывания до комнатной температуры добавляли смесь MeOH/CHCl3 (MeOH/CHCl3 = 1/4) и нерастворимые вещества отфильтровывали. Фильтрат концентрировали, и полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, MeOH/CHCl3 = 0% - 2%), и далее очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, MeOH/CHCl3 = 20% - 50%), получая указанное в заголовке соединение (146 мг, коричневое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,40 (т, J=7,1 Гц, 3H), 1,49 (д, J=6,4 Гц, 3H), 3,97-4,12 (м, 3H), 6,46-6,49 (м, 1H), 6,54 (с, 1H), 6,96 (дд, J=8,5, 2,1 Гц, 1H), 7,11-7,14 (м, 1H), 7,30-7,34 (м, 1H), 7,56 (д, J=8,7 Гц, 1H), 8,42 (ушир.с, 1H).
3,4-Дихлор-N-{1-[3-этил-2-(1Н-индол-6-илокси)-3Н-имидазол-4-ил]этил}бензолсульфонамид (Соединение 250)
[Формула 94]

(2) К раствору соединения, полученного в Примере 16-(1), (36 мг), и Et3N (37,1 мкл) в ТГФ (0,5 мл) при -78°С добавляли раствор 3,4-дихлорбензолсульфонилхлорида (20,8 мкл) в ТГФ (0,5 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали и полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 NН-типа, МеОН/CHCl3 = 2% - 5%) с последующей перекристаллизацией (AcOEt-гексан), получая указанное в заголовке соединение (Соединение 250) (19 мг, бесцветный порошок).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,33-1,40 (м, 6H), 3,90-4,01 (м, 2H), 4,61-4,72 (м, 2H), 6,49 (с, 1H), 6,51-6,53 (м, 1H), 6,95 (дд, J=8,5, 2,1 Гц, 1H), 7,16-7,19 (м, 1H), 7,32 (д, J=2,3 Гц, 1H), 7,57-7,61 (м, 2H), 7,65-7,69 (м, 1H), 7,97 (д, J=2,3 Гц, 1H), 8,28 (ушир.с, 1H).
Точка плавления: 150,5-153,5°С
Пример 17
3,4-Дихлор-N-(1-{3-этил-2-[3-(4-метилпиперазин-1-ил)фенокси]-3Н-имидазол-4-ил}этил)бензолсульфонамид
(Соединение 184)
[Формула 95]

1-{3-Этил-2-[3-(4-метилпиперазин-1-ил)фенокси]-3Н-имидазол-4-ил}этанон
[Формула 96]

(1) Смесь 2-хлор-1-этил-1Н-имидазола, полученного в Примере 5-(2), (1,0 г), 3-(4-метилпиперазин-1-ил)фенола (1,67 г), Cs2CO3 (3,78 г) и DMPU (3,0 мл) перемешивали при 200°С в течение 1 часа. После остывания до комнатной температуры добавляли AcOEt и нерастворимые вещества отфильтровывали. Фильтрат концентрировали и полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, AcOEt/гексан = 0% - 99%), получая указанное в заголовке соединение (1,88 г, желтое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,36 (т, J=7,1 Гц, 3H), 2,35 (с, 3H), 2,41 (с, 3H), 2,53-2,58 (м, 4H), 3,19-3,28 (м, 4H), 4,31-4,40 (м, 2H), 6,63-6,71 (м, 1H), 6,74-6,81 (м, 2H), 7,21-7,31 (м, 1H), 7,49 (с, 1H).
1-{3-Этил-2-[3-(4-метилпиперазин-1-ил)фенокси]-3Н-имидазол-4-ил}этанол
[Формула 97]

(2) К раствору соединения, полученного в Примере 17-(1), (1,87 г), в МеОН (10,0 мл) при 0°С добавляли NaBH4 (325 мг) и перемешивали при той же температуре в течение 2 часов. Реакционную смесь разбавляли насыщенным водным раствором NH4Cl и экстрагировали AcOEt. После промывания солевым раствором органический слой сушили над сульфатом магния, фильтровали и затем выпаривали для удаления растворителя. Полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, AcOEt/гексан = 0% - 99%, MeOH/CHCl3 = 0% - 3%), получая указанное в заголовке соединение (1,40 г, желтое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,37 (т, J=7,3 Гц, 3H), 1,62 (д, J=6,4 Гц, 3H), 2,34 (с, 3H), 2,52-2,59 (м, 4H), 3,18-3,24 (м, 4H), 3,92-4,11 (м, 2H), 4,77-4,85 (м, 1H), 6,61-6,67 (м, 2H), 6,69-6,73 (м, 1H), 6,76-6,79 (м, 1H), 7,18-7,23 (м, 1H).
1-{3-[5-(1-Азидоэтил)-1-этил-1Н-имидазол-2-илокси]фенил}-4-метилпиперазин
[Формула 98]
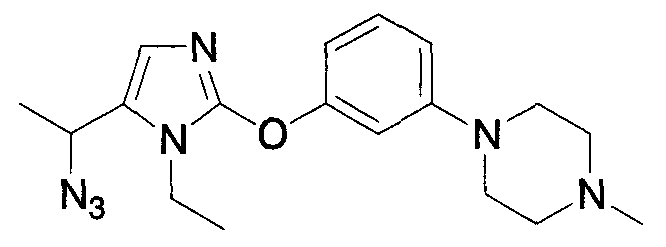
(3) К раствору соединения, полученного в Примере 17-(2), (408 мг), в толуоле (6,0 мл) при 0°С добавляли DPPA (1,48 мл) и DBU (368 мкл) и перемешивали при комнатной температуре в течение 16 часов. После добавления CHCl3 реакционную смесь очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, MeOH/CHCl3 = 5% - 10%), получая указанное в заголовке соединение (332 мг, светло-коричневое масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,37 (т, J=7, Гц, 3H), 1,68 (д, J=6,9 Гц, 3H), 2,34 (с, 3,H), 2,52-2,61 (м, 4H), 3,18-3,25 (м, 4H), 3,86-4,04 (м, 2H), 4,30-4,37 (м, 1H), 6,64-6,67 (м, 1H), 6,70-6,73 (м, 2H), 6,74-6,76 (м, 1H), 7,19-7,24 (м, 1H).
1-{3-этил-2-[3-(4-метилпиперазин-1-ил)фенокси]-3Н-имидазол-4-ил}этиламин
[Формула 99]

(4) Смесь соединения, полученного в Примере 17-(3), (322 мг), и палладия-активированного угля (32 мг, Pd 10 мас.%) в МеОН (6,5 мл) перемешивали в атмосфере водорода (примерно 1 атмосфера) при комнатной температуре в течение 14 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали. Полученный сырой продукт очищали с помощью колоночной хроматографии (силикагель NН-типа, MeOH/CHCl3 = 0% - 2%), получая указанное в заголовке соединение (190 мг, бесцветное масло).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,36 (т, J=7,1 Гц, 3H), 1,49 (д, J=6,4 Гц, 3H), 2,35 (с, 3H), 2,53-2,60 (м, 4H), 3,19-3,25 (м, 4H), 3,90-4,11 (м, 3H), 6,55-6,56 (м, 1H), 6,63-6,71 (м, 2H), 6,76-6,79 (м, 1H), 7,15-7,25 (м, 1H).
3,4-Дихлор-N-(1-{3-этил-2-[3-(4-метилпиперазин-1-ил)фенокси]-3Н-имидазол-4-ил}этил)бензолсульфонамид
(Соединение 184)
[Формула 100]

(5) К раствору соединения, полученного в Примере 17-(4), (60 мг), в ТГФ (3,0 мл) при комнатной температуре добавляли Et3N (50 мкл) и 3,4-дихлорбензолсульфонилхлорид (30 мг) и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали, полученный сырой продукт очищали с помощью колоночной хроматографии (SiO2 нейтрального ОН-типа, AcOEt/гексан = 50% - 99%, МеОН/CHCl3 = 0% - 5%) и затем очищали с помощью колоночной хроматографии (SiO2 NН-типа, AcOEt/гексан = 50% - 99%, МеОН/CHCl3 = 0% - 2%) с последующей перекристаллизацией (AcOEt-гексан), получая указанное в заголовке соединение (Соединение 184) (65 мг, бесцветный порошок).
1H ЯМР (600 MГц, CDCl3) δ м.д.: 1,33 (т, J=7,1 Гц, 3H), 1,37 (д, J=6,9 Гц, 3H), 2,36 (с, 3H), 2,50-2,65 (м, 4H), 3,18-3,30 (м, 4H), 3,83-4,00 (м, 2H), 4,58-4,69 (м, 1H), 4,75-5,01 (м, 1H), 6,48-6,55 (м, 1H), 6,60-6,66 (м, 1H), 6,69-6,77 (м, 2H), 7,18-7,25 (м, 1H), 7,56-7,62 (м, 1H), 7,63-7,72 (м, 1H), 7,97 (с, 1H).
Точка плавления: 164,5-165,5°С
Исходя из соответствующих исходных материалов, повторяли те же процедуры, что представлены в Примерах 1-17 с последующим образованием соли, при необходимости, с получением соединений, показанных в Таблице 1 ниже.
Соединения, полученные в приведенных выше примерах, также показаны в Таблице 1, наряду с другими соединениями.
В Таблице 1 некоторые соединения имеют величины двух данных для каждого из APCI MS (M-H)- и APCI MS (M+H)+. Это потому, что ввиду присутствия изотопов хлора или брома определялись два пика.
Пример Испытания 1 (испытание ингибирования связывания S1P1)
Действие соединений настоящего изобретения по ингибированию связывания Edg-1 (S1P1) определяли с использованием мембранной фракции штамма НЕК-293 клеток с переносом гена человека Edg-1 (S1P1) в соответствии со способом, описанным в литературе (Science. 2002, 296: 346) (показывающим связывание Kd = 0,15 нМ, Bmax = 2,5 фмоль/мкг до [33Р]-S1P). Мембранную фракцию получали с помощью обработки клеток солюбилизирующим буфером (1 мМ Tris/HCl, pH 7,2) в течение 10 минут на льду, центрифугирования при 1000 × g в течение 5 минут для удаления нерастворимых фракций, а затем центрифугирования при 40000 × g в течение 30 минут при 4°С. Полученную мембранную фракцию растворяли в связывающем буфере (20 мМ Tris-HCl, pH 7,4, 100 мМ NaCl, 15 мМ NaF, 2 мМ дезоксипиридоксин, 4 мг/мл BSA свободное от жирной кислоты) и затем добавляли [33Р]-S1P (производства ARC, конечная концентрация 0,1 нМ) и раствор ДМСО (конечная концентрация соединения 10-5М, конечная концентрация ДМСО 0,1%) испытуемого соединения. После этого смесь перемешивали и затем обрабатывали в течение 1 часа при 30°С. С использованием устройства для сбора клеток мембранную фракцию собирали на GF/C фильтр унифильтр-96 (производства Perkin Elmer), промывание осуществляли четыре раза связывающим буфером и фильтр сушили. Добавляли двадцать пять мкл Microscint 0 (производства Perkin Elmer) и измеряли радиоактивность с использованием Top Count NXT (производства Packard) для вычисления количества (А) [33Р]-S1P, связанного с мембранной фракцией, при добавлении соединения.
Ту же самую процедуру осуществляли в отсутствие испытуемого соединения и вычисляли количество (В) связанного [33Р]-S1P. Далее, ту же самую процедуру осуществляли в отсутствие испытуемого соединения с использованием НЕК-293 клеток, в которые не вводили Edg-1 (S1P1) ген, и вычисляли фоновое количество (С) связанного [33Р]-S1P.
Степени ингибирования связывания Edg-1 (S1P1) соединения, вычисленные с использованием следующего уравнения, показаны в Таблице 1.
Степень ингибирования (%) = [1-(А-С)/(В-С)]×100.
Кроме того, так же вычисляли (IC50) концентрацию испытуемого соединения, требуемую для обеспечения 50% ингибирования связывания, вызываемого в отсутствие испытуемого соединения. Упомянутое выше испытание связывания мембранной системы осуществляли в присутствии испытуемого соединения при различных концентрациях для вычисления степени ингибирования связывания Edg-1 (S1P1) при каждой концентрации согласно вышеупомянутому уравнению с последующим вычислением значения IC50 для каждого соединения с помощью программного обеспечения для анализа данных Origin (Lightstone Corp., Japan).
Результаты показали, что соединения, перечисленные ниже, имеют значения IC50 70 нМ или ниже и показывают особенно сильную активность:
Соединения 186, 189, 194, 214, 229 и 236.
Более того, соединения, перечисленные ниже, имеют значения IC50 35 нМ или ниже и показывают более сильную активность:
Соединения 187 и 234.
Соединения, перечисленные ниже, имеют значения IC50 15 нМ или ниже и показывают гораздо более сильную активность:
Соединение 208, 246 и 247.
Подробные данные IC50 показаны ниже для каждого из соединений (ед. изм.: нМ):
Соединение 184: 14,3; Соединение 185: 3,7; Соединение 190: 10,9; Соединение 192: 23,0; Соединение 195: 20,0; Соединение 198: 10,3; Соединение 200: 17,0; Соединение 203: 23,5; Соединение 207: 18,2; Соединение 209: 42,0; Соединение 213: 49,0; Соединение 235: 58,5; Соединение 244: 32,5; Соединение 250: 20,5; Соединение 253: 27,5.
Ниже будут даны Примеры получения для промежуточных соединений формулы (II) согласно настоящему изобретению.
Исходя из соответствующих исходных веществ, повторялись те же самые процедуры, показанные в Примере 1-(1) - (5), Примере 2-(1) - (7), Примере 4-(1) - (5), Примере 5-(1) - (8), Примере 7-(1) - (8), Примере 9-(1) - (4), Примере 11-(1) и (2), Примере 16-(1) и Примере 17-(1) - (4), с последующим образованием соли, при необходимости с получением промежуточных соединений или их солей, которые являются полезными в получении соединений формулы (I) согласно настоящему изобретению. Полученные таким образом промежуточные соединения показаны в Таблице 2, наряду с промежуточными соединениями, полученными в примерах, показанных выше.






ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Ввиду того что соединения настоящего изобретения являются превосходными Edg-1 (S1P1) лигандами, они полезны в качестве терапевтических и/или профилактических агентов от аутоиммунных заболеваний, таких как болезнь Крона, спастический колит, синдром Сьегрена, рассеянный склероз и системная красная волчанка, так же как и других заболеваний, таких как ревматоидный артрит, астма, атопический дерматит, отторжение после трансплантации органа, рак, ретинопатия, псориаз, остеоартрит, возрастная макулярная дегенерация и т.д.
Реферат
Настоящее изобретение относится к области органической химии, а именно к соединениям формулы I или к его фармацевтически приемлемой соли, где Аr представляет имидазол или пиразол, где указанный Аr может быть замещен заместителем(ями), выбранным из группы, состоящей из C1-С6 алкильной группы, фенильной группы и атома галогена, Y1, Y2 Y3, каждый, представляет атом углерода или атом азота, А представляет атом кислорода, атом серы или группу, представленную формулой -SO2-, R1 представляет атом водорода, C1-С6 алкильную группу, которая может быть замещена одной фенильной группой (где указанная фенильная группа может быть замещена одним заместителем, выбранным из группы, состоящей из атома галогена и C1-С6 алкильной группы), или фенильную группу, R2 представляет C1-С6 алкильную группу, R3 представляет (i) C1-C18 алкильную группу, (ii) C2-C8 алкенильную группу, (iii) C2-C8 алкинильную группу, (iv) С3-C8 циклоалкильную группу, (v) C1-С6 алкильную группу, замещенную 1-3 заместителем(ями), выбранным из группы, указанной в п.1 формулы изобретения, или (vi) фенильную группу, нафтильную группу, пиразолильную группу, пиридильную группу, индолильную группу, хинолинильную группу или изохинолинильную группу, где каждая из указанных групп может быть замещена 1-3 заместителями, выбранными из группы, указанной в п.1, R4 представляет атом водорода или C1-С6 алкильную группу, и R5 представляет (i) C1-С10 алкильную группу, (ii) C1-С10 алкильную группу, которая замещена одним или двумя заместителями, выбранными из группы, указанной в п.1, (iii) C2-C8 алкенильную группу, которая может быть замещена фенильной группой, или (iv) фенильную группу, нафтильную группу, тиенильную группу, пирролильную группу, п
Формула
[Формула 1]

где Аr представляет имидазол или пиразол,
где указанный Аr может быть замещен заместителем(ями), выбранным из группы, состоящей из C1-С6 алкильной группы, фенильной группы и атома галогена,
Y1, Y2 и Y3, каждый, представляет атом углерода или атом азота,
А представляет атом кислорода, атом серы или группу, представленную формулой -SO2-,
R1 представляет атом водорода, C1-С6 алкильную группу, которая может быть замещена одной фенильной группой (где указанная фенильная группа может быть замещена одним заместителем, выбранным из группы, состоящей из атома галогена и C1-С6 алкильной группы), или фенильную группу,
R2 представляет C1-С6 алкильную группу,
R3 представляет (i) C1-C18 алкильную группу, (ii) C2-C8 алкенильную группу, (iii) C2-C8 алкинильную группу, (iv) С3-C8 циклоалкильную группу, (v) C1-С6 алкильную группу, замещенную 1-3 заместителем(ями), выбранным из следующей группы [где указанная группа состоит из атома галогена, фенильной группы, C1-С6 алкоксигруппы, пиперазиногруппы, которая может быть замещена C1-С6 алкильной группой(ами), морфолиногруппы,
группы, представленной формулой:
[Формула 3]

(где R14 и R15, каждый, представляет C1-С6 алкильную группу),
или (vi) фенильную группу, нафтильную группу, пиразолильную группу, пиридильную группу, индолильную группу, хинолинильную группу или изохинолинильную группу, где каждая из указанных групп может быть замещена 1-3 заместителями, выбранными из следующей группы [где указанная группа состоит из заместителей, перечисленных ниже: C1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, атома галогена, С1-С6 алкоксигруппы (где указанная алкоксигруппа может быть замещена заместителем(ями), выбранным из группы, состоящей из аминогруппы, замещенной двумя C1-C4 алкильными группами, и морфолиногруппы), пиперидинильной группы или пиперидиногруппы (где указанная пиперидинильная или пиперидиногруппа может быть замещена C1-С6 алкильной группой(ами)), имидазолильной группы, пирролильной группы, морфолинильной группы, пиперазиногруппы, которая может быть замещена C1-С6 алкильной группой(ами), и формулы:

где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6 алканоильную группу],
R4 представляет атом водорода или C1-С6 алкильную группу, и
R5 представляет (i) С1-С10 алкильную группу, (ii) C1-С10 алкильную группу, которая замещена одним или двумя заместителями, выбранными из следующей группы (где указанная группа состоит из С3-C8 циклоалкильной группы, пиридильной группы и фенильной, фенокси- или нафтильной группы, которая может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из атома галогена и C1-С6 алкоксигруппы), (iii) C2-C8 алкенильную группу, которая может быть замещена фенильной группой, или (iv) фенильную группу, нафтильную группу, тиенильную группу, пирролильную группу, пиразолильную группу, пиридильную группу, фуранильную группу, бензотиенильную группу, изохинолинильную группу, изоксазолильную группу, тиазолильную группу, бензотиадиазолильную группу, бензоксадиазолильную группу, фенильную группу, сконденсированную с 5-7-членным насыщенным углеводородным кольцом, которое может содержать в качестве членов кольца один или два атома кислорода, урацильную группу или тетрагидроизохинолинильную группу, где каждая из указанных групп может быть замещена 1-5 заместителями, выбранными из следующей группы
[где указанная группа состоит из C1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, C2-C8 алкенильной группы, атома галогена, C1-С6 алкоксигруппы, которая может быть замещена атомом(ами) фтора, оксазолильной, изоксазолильной или тиадиазолильной группы, которая может быть замещена трифторметильной(ыми) группой(ами), C1-С6 алкилтиогруппы, C1-С6 алкилсульфонильной группы, бензолсульфонильной группы, морфолиносульфонильной группы, морфолинокарбониламиногруппы, С2-С10 алкоксикарбонильной группы, морфолиногруппы, фенильной группы, которая может быть замещена C1-С6 алкоксигруппой(ами), феноксигруппы, пиридинкарбонильной, пиридиноксигруппы, цианогруппы, C2-C7 алканоильной группы, которая может быть замещена атомом(ами) фтора, и С3-С7 алканоиламиногруппы],
при условии, что когда Аr представляет группу, представленную следующей формулой:
[Формула 5]

которая может быть замещена C1-С6 алкильной группой, R5 не является C1-С10 алкильной группой,
и соединение формулы (I) не является
5-(3,5-дихлорфенилтио)-4-изопропил-2-метансульфониламинометил-1-метил-1H-имидазолом или
5-(3,5-дихлорфенилтио)-4-изопропил-1-метил-2-п-толуолсульфониламинометил-1 Н-имидазолом}.
Аr представляет имидазол или пиразол,
А представляет атом кислорода или атом серы,
R1 представляет атом водорода, C1-С6 алкильную группу или C1-С6 алкильную группу, замещенную фенильной группой,
R2 представляет C1-С6 алкильную группу,
R представляет (i) С1-С6 алкильную группу или (ii) фенильную группу, нафтильную группу, пиразолильную группу, пиридильную группу, индолильную группу, хинолинильную группу или изохинолинильную группу, где каждая из указанных групп может быть замещена 1-3 заместителями, выбранными из следующей группы [где указанная группа состоит из заместителей, перечисленных ниже: C1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, атома галогена, C1-С6 алкоксигруппы (где указанная алкоксигруппа может быть замещена заместителем(ями), выбранным из группы, состоящей из аминогруппы, замещенной двумя C1-C4 алкильными группами, и морфолиногруппы), пиперидинильной группы или пиперидиногруппы (где указанная пиперидинильная или пиперидиногруппа может быть замещена C1-С6 алкильной группой(ами)), имидазолильной группы, пирролильной группы, морфолинильной группы, пиперазиногруппы, которая может быть замещена C1-С6 алкильной группой(ами), и формулы:

где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6алканоильную группу],
R4 представляет атом водорода или C1-С6алкильную группу, и
R5 представляет (i) C1-С10 алкильную группу, (ii) C1-С10 алкильную группу, которая замещена одним или двумя заместителями, выбранными из следующей группы (где указанная группа состоит из С3-C8 циклоалкильной группы, фенильный группы, нафтильной группы, пиридильной группы и фенильной группы, замещенной одним или двумя заместителями, выбранными из группы, состоящей из атома галогена и C1-С6 алкоксигруппы), (iii) C2-C8 алкенильную группу, (iv) C2-C8 алкенильную группу, замещенную фенильной группой, или (v) фенильную группу, нафтильную группу, тиенильную группу, пирролильную группу, пиразолильную группу, пиридильную группу, фуранильную группу, бензотиенильную группу, изохинолинильную группу, изоксазолильную группу, тиазолильную группу, бензотиадиазолильную группу, бензоксадиазолильную группу, фенильную группу, сконденсированную с 5-7-членным насыщенным углеводородным кольцом, которое может содержать в качестве членов кольца один или два атома кислорода, урацильную группу или тетрагидроизохинолинильную группу, где каждая из указанных групп может быть замещена 1-5 заместителями, выбранными из следующей группы
[где указанная группа состоит из C1-С6 алкильной группы, которая может быть замещена атомом(ами) фтора, C2-C8 алкенильной группы, атома галогена, C1-С6 алкокси группы, которая может быть замещена атомом(ами) фтора, оксазолильной, изоксазолильной или тиадиазолильной группы, которая может быть замещена трифторметильной(ыми) группой(ами), C1-С6 алкилтиогруппы, C1-С6 алкилсульфонильной группы, бензолсульфонильной группы, морфолиносульфонильной группы, морфолинокарбониламино группы, С2-С10 алкоксикарбонильной группы, морфолиногруппы, фенильной группы, которая может быть замещена C1-С6 алкоксигруппой(ами), феноксигруппы, пиридинкарбонильной, пиридиноксигруппы, цианогруппы, C2-C7 алканоильной группы, которая может быть замещена атомом(ами) фтора, и C2-C7 алканоиламиногруппы].
[Формула 6]



который может быть замещен заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы, фенильной группы и атома галогена.
[Формула 7]


который может быть замещен заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы, фенильной группы и атома галогена.
[Формула 8]

который может быть замещен заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, фенильной группы и атома галогена.

где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6 алканоильную группу].
(А) фенильную группу, 4-положение которой замещено заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы, С1-С6 алкоксигруппы (где указанная алкокси группа может быть замещена заместителем(ями), выбранным из группы, состоящей из аминогруппы, замещенной двумя C1-C4 алкильными группами и морфолиногруппы), атома галогена, 1-пирролильной группы и -NRARB (где RA и RB, каждый, представляет C1-С6 алкильную группу), и далее 3-положение которой может быть замещено заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы, атома галогена и C1-С6 алкоксигруппы,
(B) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы и С1-С6 алкоксигруппы (где указанная алкоксигруппа может быть замещена заместителем(ями), выбранным из группы, состоящей из аминогруппы, замещенной двумя C1-C4 алкильными группами, и морфолиногруппы), и далее которая может быть замещена одной или двумя C1-С6 алкильными группами, или 4-положение которой может быть замещено атомом галогена,
и
(C) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных ниже в (i)-(v), и, дополнительно, 4-положение которой может быть замещено атомом галогена:
(i) пиперидинильной или пиперидиногруппы (где указанная пиперидинильная или пиперидино группа может быть замещена C1-С8 алкильной группой(ами)),
(ii) имидазолильной или пирролильной группы,
(iii) морфолинильной группы,
(iv) пиперазиногруппы [где указанная пиперазино группа может быть замещена C1-С6 алкильной группой], и
(v) формулы -NR7R8
где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6 алканоильную группу.
(i) пиперидинильной или пиперидиногруппы (где указанная пиперидинильная или пиперидиногруппа может быть замещена C1-С6 алкильной группой(ами)),
(ii) имидазолильной или пирролильной группы,
(iii) морфолинильной группы,
(iv) пиперазиногруппы [где указанная пиперазиногруппа может быть замещена C1-C8 алкильной группой], и
(v) формулы -NR7R8
где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6 алканоильную группу.
[Формула 9]

(где R1, R2 и R3 имеют значения, определенные выше в п.1, и Y4 и Y5, каждый, представляет атом азота или формулу CR17 (где R17 представляет атом водорода, C1-С6 алкильную группу, фенильную группу или атом галогена), при условии, что один из Y4 и Y5 представляет атом азота).

где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6 алканоильную группу].
(A) фенильную группу, 4-положение которой замещено заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы, C1-С6 алкоксигруппы (где указанная алкоксигруппа может быть замещена заместителем(ями), выбранным из группы, состоящей из аминогруппы, замещенной двумя C1-C4 алкильными группами, и морфолиногруппы), атома галогена, 1-пирролильной группы и -NRARB (где RA и RB, каждый, представляет C1-С6 алкильную группу) и, дополнительно, 3-положение которой может быть замещено заместителем, выбранным из группы, состоящей из С1-С6 алкильной группы, атома галогена и C1-С6 алкоксигруппы,
(B) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из C1-С6 алкильной группы и C1-С6 алкоксигруппы (где указанная алкоксигруппа может быть замещена заместителем(ями), выбранным из группы, состоящей из аминогруппы, замещенной двумя C1-C4 алкильными группами, и морфолиногруппы), и далее которая может быть замещена одной или двумя C1-С6 алкильными группами, или 4-положение которой может быть замещено атомом галогена,
и
(C) фенильную группу, 3-положение которой замещено заместителем, выбранным из группы, состоящей из азотсодержащих групп, показанных ниже в (i)-(v), и, дополнительно, 4-положение которой может быть замещено атомом галогена:
(i) пиперидинильной или пиперидиногруппы (где указанная пиперидинильная или пиперидиногруппа может быть замещена C1-С6 алкильной группой(ами)),
(ii) имидазолильной или пирролильной группы,
(iii) морфолинильной группы,
(iv) пиперазиногруппы [где указанная пиперазиногруппа может быть замещена C1-C6 алкильной группой], и
(v) формулы -NR7R8
где R7 и R8, каждый, представляет атом водорода, C1-С6 алкильную группу или C1-С6 алканоильную группу.
Документы, цитированные в отчёте о поиске
2-замещенные 4,5-диарилимидазолы, способ получения и фармацевтическая композиция на их основе
Способ получения производных имидазола или их солей

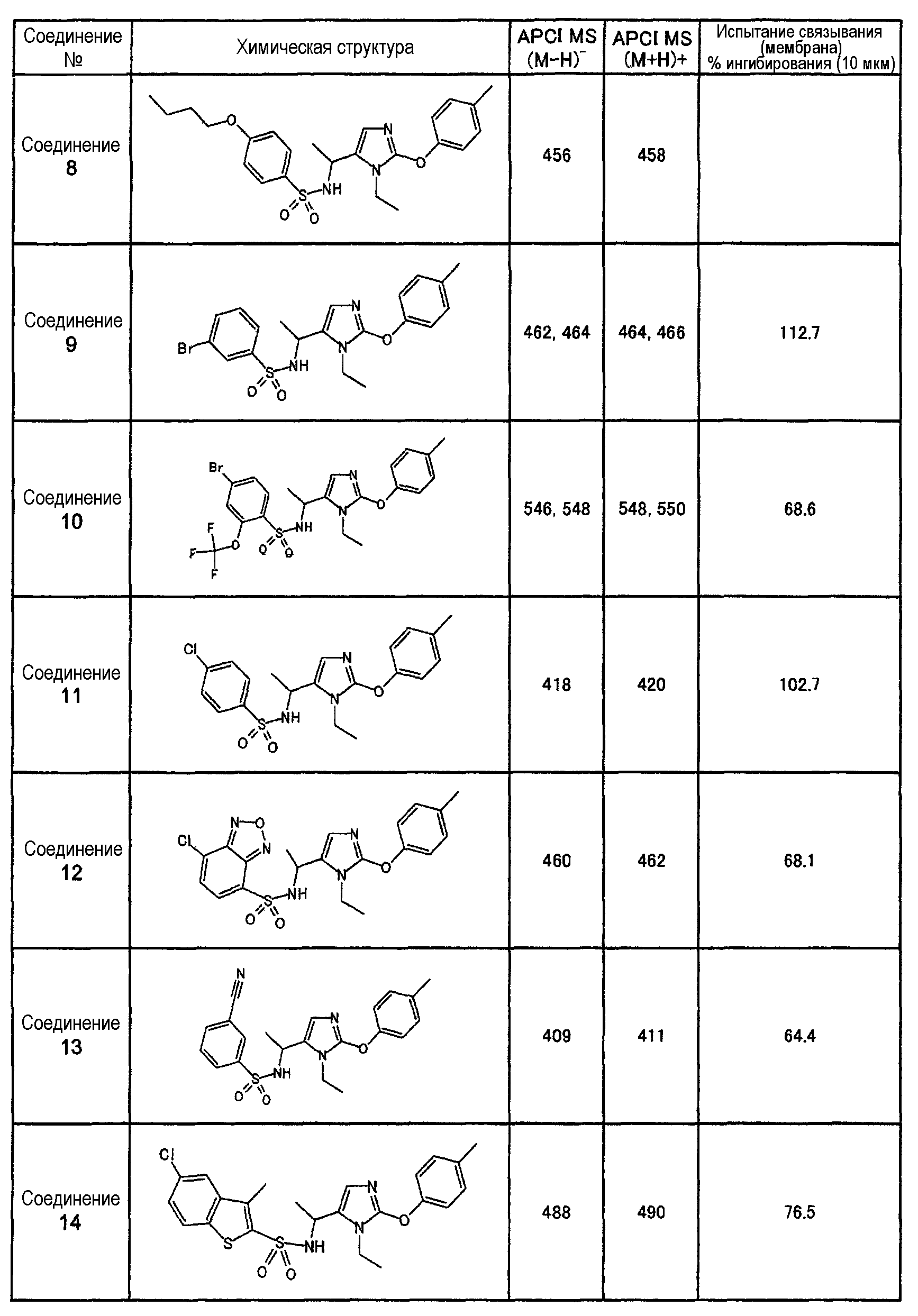

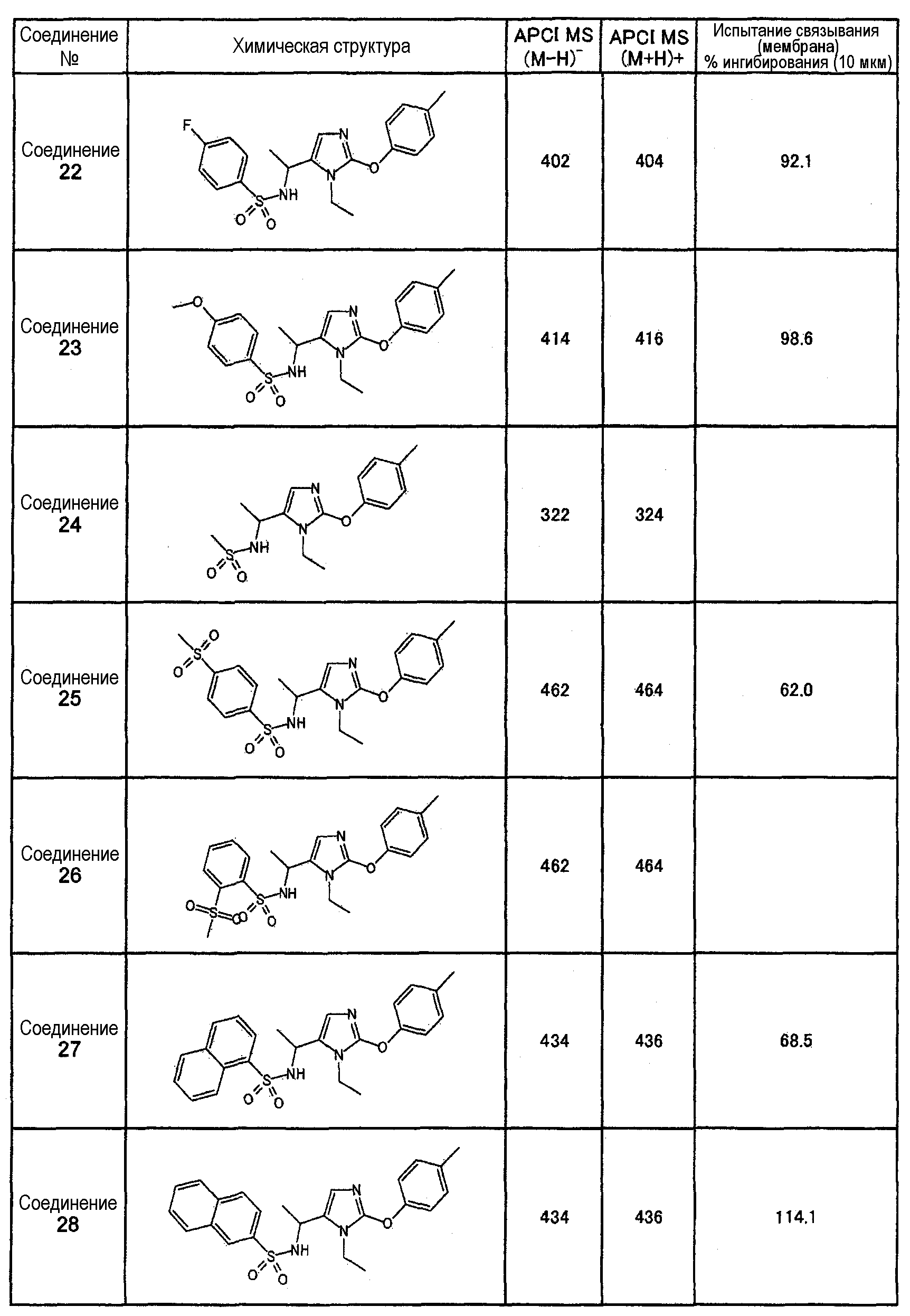
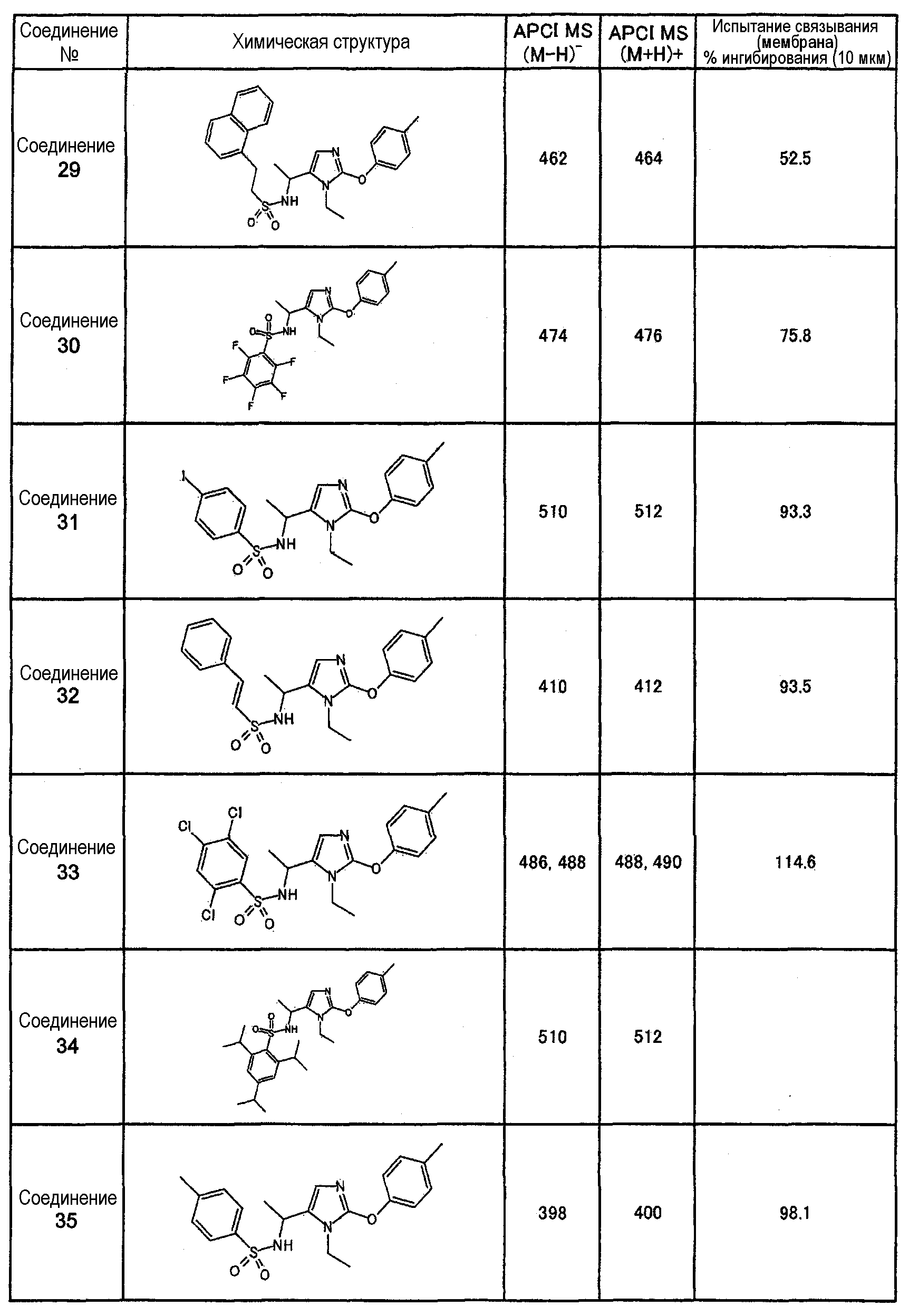




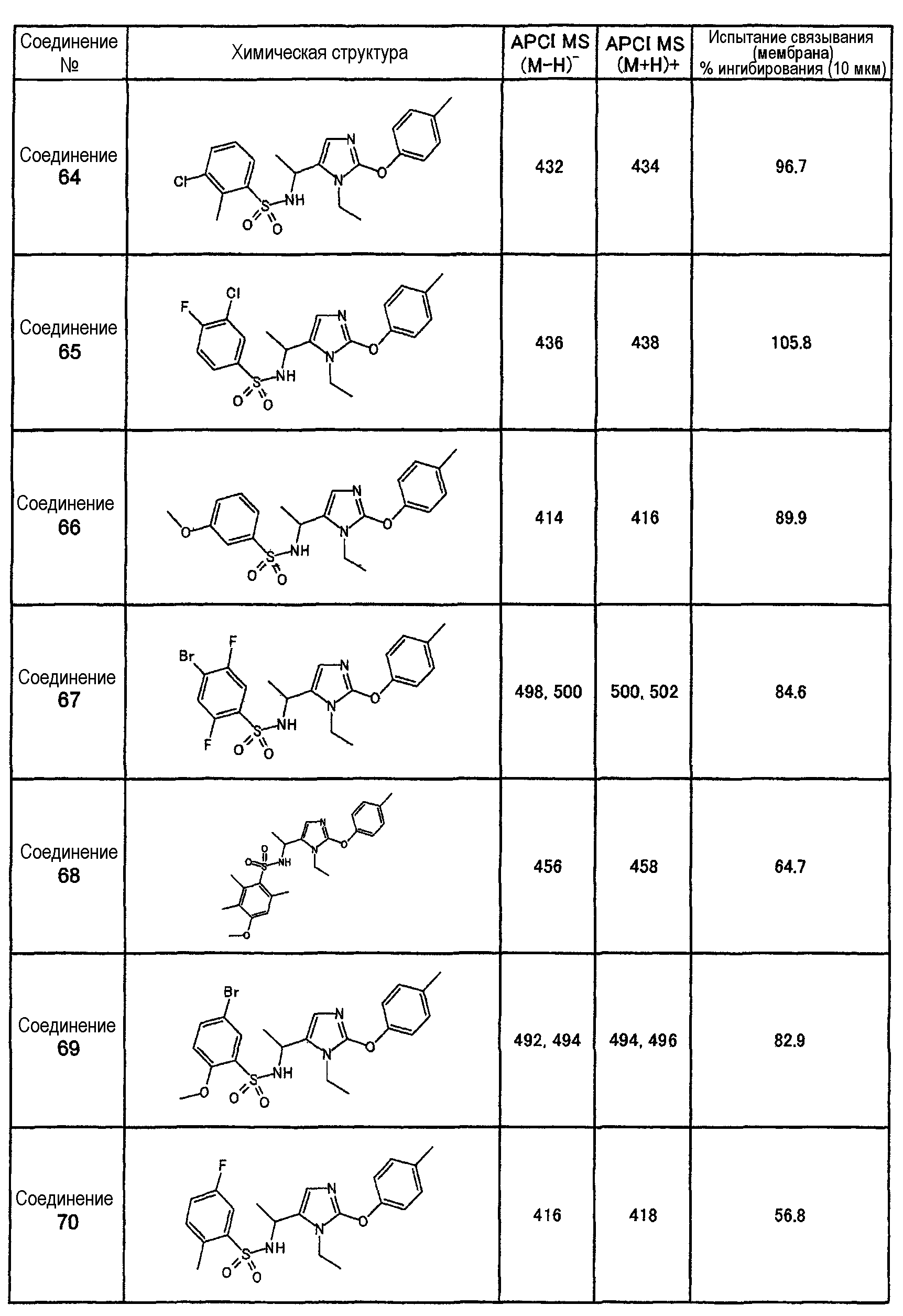













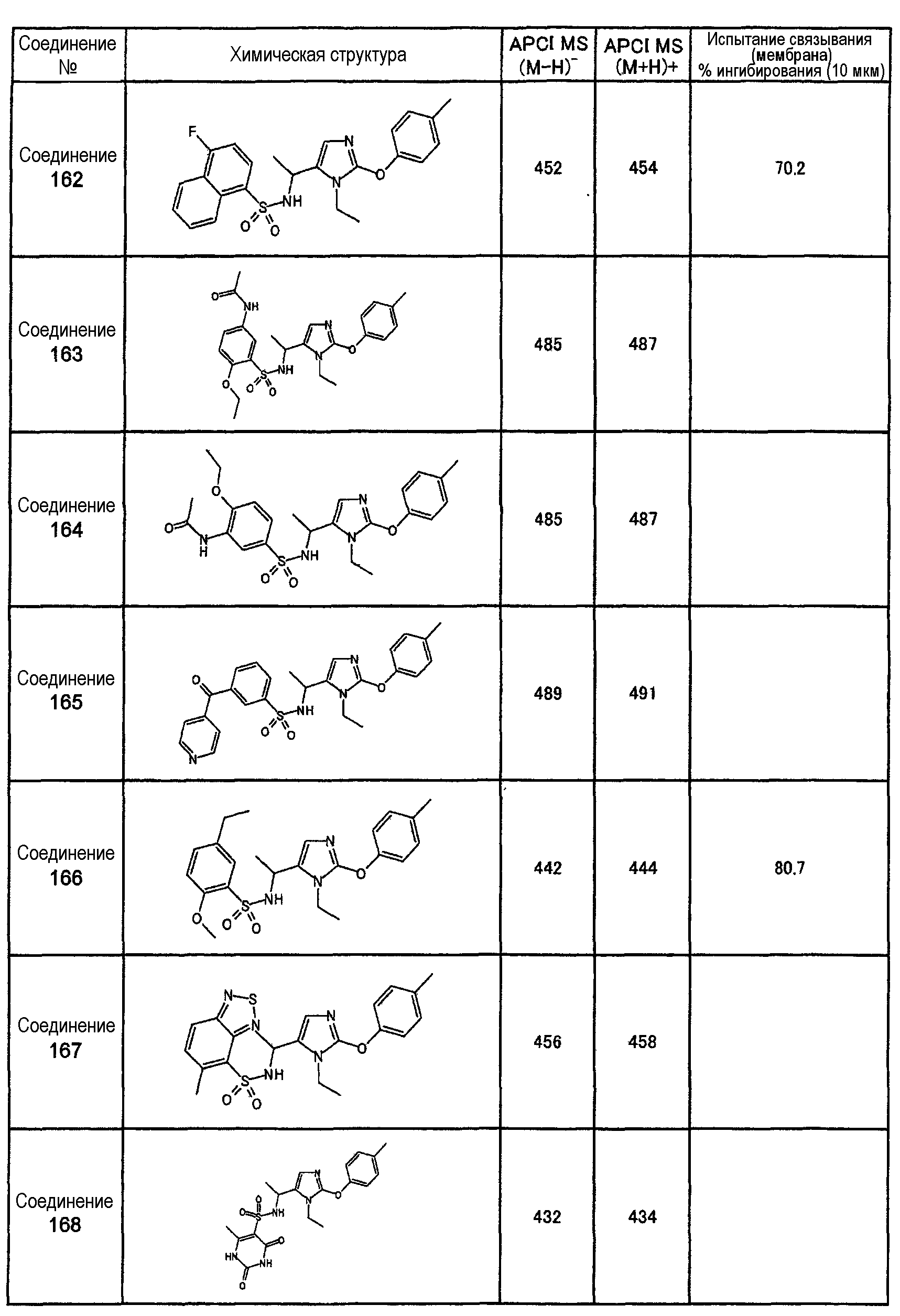














Комментарии