Фенилэтенил- или фенилэтинилпроизводные в качестве антагонистов глутаматного рецептора - RU2284323C9
Код документа: RU2284323C9
Описание
Настоящее изобретение относится к применению фенилэтенил- или фенилэтинилпроизводных общей формулы

где
R1, R2, R3, R4 и R5 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген, (низш.)алкокси, -(CH2)n-NRR', -(CH2)n-N(R)-С(O)-(низш.)алкил, арил или гетероарил, который является незамещенным или замещенным одним или более (низш.)алкилом,
R, R' и R'' каждый независимо друг от друга означает водород или (низш.)алкил,
А означает -СН=СН- или -С≡С-, а
В означает

где
R6 означает водород, (низш.)алкил, -(CH2)n-C(O)OR или галоген,
R7 означает водород, (низш.)алкил, -(CH2)n -C(O)OR', галоген, нитро- или гетероарил, который является незамещенным или замещенным (низш.)алкилом или циклоалкилом,
R8 означает водород, (низш.)алкил, -(CH2 )n-OH, -(CH2)n-C(O)OR'' или арил,
R9 означает (низш.)алкил,
R10 означает водород, (низш.)алкил или галоген,
R11 означает водород или алкил,
R12 означает -(СН2)n-N(R)-С(O)-(низш.)алкил,
R13 означает водород или (низш.)алкил,
R14, R15, R16 и R17 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген или (низш.)алкокси,
R18, R19 и R20 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген или (низш.)алкокси,
R21 означает водород или (низш.)алкил,
R22 означает водород, (низш.)алкил или (низш.)алкил, содержащий один или более заместителей, выбранных из групп гидрокси или галоген,
R23 означает водород, (низш.)алкил, (низш.)алканоил или нитро,
R24, R25 и R26 независимо означают водород или (низш.)алкил,
n равно 0, 1,2, 3, 4, 5 или 6,
X означает -СН2-, -О- или -S-, а
Y означает -СН= или -N=, и их фармацевтически приемлемых солей.
Некоторые из соединений настоящей формулы I известны и описаны в литературе. Например, синтез 1-метил-2-фенилэтинил-1Н-имидазола, 1-метил-5-фенилэтинил-1Н-имидазола и 1-метил-4-фенилэтинил-1Н-имидазола, а также синтез соответствующих производных фенилэтенила описан в Chem. Pharm. Bull. 35 (2), 823-828 (1987). Соединения получали по катализируемой палладием реакции соответствующих галоген-1,3-азолов с фенилацетиленом или стиролом. 1-Метил-2-(4-метоксифенилэтинил)-1Н-имидазол можно синтезировать в виде нелинейного оптического хромофора, как описано в Chem. Mater. 6(7), 1023-1032 (1994). Получение 2-алкил-5-фенилэтинил-1Н-имидазол-4-карбоксальдегидов в качестве промежуточных соединений при получении замещенных имидазолов для использования в качестве блокаторов ангиотензина II описано в WO 91/00277. 1-Метил-5-(2-фенилэтенил)-1Н-имидазол также был получен в качестве промежуточного соединения при синтезе гетероциклических пищевых мутагенов, как описано в Environ. Health Perspect., 67, 41-45 (1986).
В настоящее время неожиданно было установлено, что соединения общей формулы I являются метаботропными антагонистами глутаматного рецептора и обладают ценными терапевтическими свойствами. Эти соединения могут использоваться при лечении или профилактике нарушений, опосредованных рецептором mGluR5.
В центральной нервной системе (ЦНС) передача сигнала происходит при связывании нейромедиатора, который посылается нейроном, с нейрорецептором.
Глутамат является основным стимулирующим нейромедиатором мозга и играет уникальную роль в проявлении многочисленных функций ЦНС. Глутамат-зависимые сигнальные рецепторы подразделяются на две основных группы. Первая основная группа, а именно ионотропные рецепторы, образует лиганд-активируемые ионные каналы. Метаботропные глутаматные рецепторы (mGluR) принадлежат ко второй основной группе и, кроме того, относятся к семейству рецепторов, сопряженных с G-белками.
К настоящему времени известно восемь различных членов группы mGluR, а некоторые из них подразделяются на подвиды. Эти восемь рецепторов можно подразделить на три подгруппы по гомологии аминокислотной последовательности, механизмам передачи сигнала и селективности к агонистам. Группа I включает mGluRl и mGluR5, к группе II относятся mGluR2 и mGluR3, к группе III относятся mGluR4, mGluR6, mGluR7 и mGluR8.
Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, можно использовать для лечения и профилактики острых и/или хронических неврологических нарушений, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, расстройство познавательной способности и потеря памяти, а также хронической и острой боли.
В связи с этими другими показаниями для лечения является ограниченная функция мозга, вызванная операцией шунтирования или пересадкой органа, недостаточное кровоснабжение мозга, травма спинного мозга, травма головы, гипоксия во время беременности, остановка сердца или гипогликемия. Другими показаниями для лечения являются хорея Гентингтона, боковой амиотрофический склероз, деменция, вызванная заболеванием СПИД, глазные травмы, ретинопатия, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными средствами, а также состояния, которые приводят к недостаточности функций глутаматных рецепторов, такие как мышечные спазмы, судороги, мигрень, недержание мочи, привыкание к никотину, опийная наркомания, страх, рвота, дискинезия и депрессии.
К нарушениям, которые полностью или частично опосредуются mGluR5, относятся, например, острые, травматические и хронические дегенеративные процессы нервной системы, такие, как болезнь Альцгеймера, старческая деменция, болезнь Паркинсона, хорея Гентингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и страх, депрессия и боль. Селективные антагонисты mGluR5 прежде всего пригодны для лечения состояния страха и боли.
Объектом настоящего изобретения является применение соединений формулы I и их фармацевтически приемлемых солей при получения лекарственных средств для лечения или профилактики нарушений, опосредованных рецептором mGluR5, новые соединения формулы I-A или формулы I-B, их получение, лекарственные средства на основе соединения по изобретению и их получение, а также применение соединений формулы I-A или формулы I-B для лечения или профилактики нарушений, опосредованных рецептором mGluR5, таких как болезнь Альцгеймера, старческая деменция, болезнь Паркинсона, хорея Гентингтона, расстройство познавательной способности и потеря памяти, церебральная ишемия, боковой амиотрофический склероз и рассеянный склероз, ограниченные функции мозга, вызванные операцией шунтирования или пересадки органов, недостаточное кровоснабжение мозга, травма спинного мозга, травма головы, гипоксия при беременности, остановка сердца и гипогликемия, психиатрические заболевания, такие как психоз, эпилепсия, шизофрения и страх, депрессия, а также хроническая и острая боль.
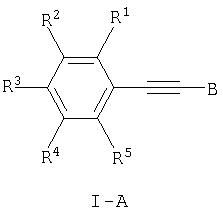
Настоящее изобретение относится к новым соединениям общей формулы,

где
R1, R2, R3, R4 и R5 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген, (низш.)алкокси, -(CH2)n-NRR', -(CH2)n-N(R)-С(O)-(низш.)алкил, арил или гетероарил, который является незамещенным или замещенным одним или более (низш.)алкилом,
R, R' и R'' независимо означают водород или (низш.)алкил,
В означает

где
R6 означает водород, (низш.)алкил, -(CH2)n-C(O)OR или галоген,
R7 означает водород, (низш.)алкил, -(CH2)n-C(O)OR', галоген, нитро- или гетероарил, который является незамещенным или замещенным (низш.)алкилом или циклоалкилом,
R8 означает водород, (низш.)алкил, -(CH2)n-OH, -(CH2)n-C(O)OR'' или арил,
R9 означает (низш.)алкил,
R10 означает водород, (низш.)алкил или галоген,
R11 означает водород или алкил,
R12 означает -(CH2)n-N(R)-С(O)-(низш.)алкил,
R13 означает водород или (низш.)алкил,
R14, R15, R16 и R17 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n -галоген или (низш.)алкокси,
R18, R19 и R20 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген или (низш.)алкокси,
R21 означает водород или (низш.)алкил,
R22 означает водород, (низш.)алкил или (низш.)алкил, содержащий один или более заместителей, выбранных из групп гидрокси или галоген,
R23 означает водород, (низш.)алкил, (низш.)алканоил или нитро,
R24, R25 и R26 каждый независимо друг от друга означает водород или (низш.)алкил,
n равно 0, 1, 2, 3, 4, 5 или 6,
X означает -СН2-, -О- или -S-, а
Y означает -СН= или -N=,
и к их фармацевтически приемлемым солям, за исключением
1-метил-2-фенилэтинил-1Н-имидазола,
1-метил-2-(4-метоксифенилэтинил)-1Н-имидазола,
1-метил-5-фенилэтинил-1Н-имидазола и
1-метил-4-фенилэтинил-1Н-имидазола.
Кроме того, настоящее изобретение относится к новым соединениям общей формулы
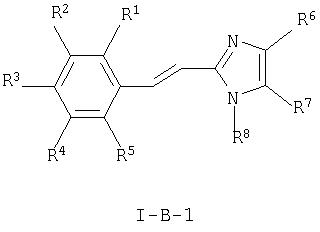
где
R1, R2, R3, R4 и R5 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген, (низш.)алкокси, -(CH2)n-NRR', -(CH2)n -N(R)-С(O)-(низш.)алкил, арил или гетероарил, который является незамещенным или замещенным одним или более (низш.)алкилом,
R, R' и R'' каждый независимо друг от друга означает водород или (низш.)алкил,
R6 означает водород, (низш.)алкил, -(CH2)n-C(O)OR или галоген,
R7 означает водород, (низш.)алкил, -(CH2)n-C(O)OR', галоген, нитро- или гетероарил, который является незамещенным или замещенным (низш.)алкилом или циклоалкилом, а
R8 означает водород, (низш.)алкил, -(CH2)n-OH, -(CH2)n-C(O)OR'' или арил, и к их фармацевтически приемлемым солям.
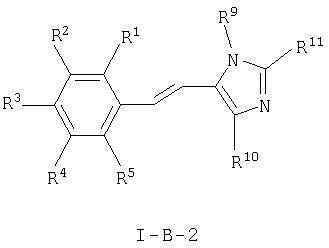
Кроме того, настоящее изобретение относится также к соединениям формулы

где
R1, R2, R3, R4 и R5 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген, (низш.)алкокси, -(CH2)n-NRR', -(CH2)n-N(R)-С(O)-(низш.)алкил, арил или гетероарил, которые являются незамещенными или замещенными одним или более (низш.)алкилом,
R и R' независимо друг от друга означают водород или (низш.)алкил,
R9 означает (низш.)алкил,
R10 означает галоген, а
R11 означает водород или алкил,
и к их фармацевтически приемлемым солям.
Общие термины, используемые в описании, имеют следующие значения, независимо от того применяются ли они отдельно или в различных сочетаниях.
Термин "(низш.)алкил", используемый в описании заявки, означает остатки насыщенных углеводородов с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, предпочтительно от 1 до 4, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и т.п.
Термин "циклоалкил" означает насыщенную карбоцикличесую группу, содержащую от 3 до 7 атомов углерода, предпочтительно циклопропил, циклопентил или циклогексил.
Термин "галоген" означает фтор, хлор, бром и иод.
Термин "(низш.)алкокси" означает группу (низш.)алкил, имеющую значения, указанные выше, которая присоединена через атом кислорода, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси и т.п.
Предпочтительными группами (низш.)алканоил являются формил, этаноил или пропаноил.
Предпочтительными арильными группами являются фенил или нафтил.
Гетероарильные группы являются выбраннными из ряда фурил, пирролил, тиенил, 1H-имидазолил, 2Н-имидазолил, 4Н-имидазолил, 1H-пиразолил, 3Н-пиразолил, 4Н-пиразолил, 1,2-оксазолил, 1,3-оксазолил, 1Н-[1,2,4]триазолил, 4Н-[1,2, 4]триазолил, 1Н-[1,2,3]триазолил, 2Н-[1,2,3]триазолил, 4Н-[1,2,3]триазолил, [1,2,4]оксадиазолил, [1,3,4]оксадиазолил, [1,2,3]оксадиазолил, 1H-тетразолил, 2Н-тетразолил, [1,2,3,4]оксатриазолил, [1,2,3, 5]оксатриазолил, 1,3-тиазолил, 1,2-тиазолил, 1H-пентазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, хинолинил и их дигидропроизводные. Гетероарильная группа необязательно замещена группой (низш.)алкил. Предпочтительными гетероарильными группами являются пирролил и [1,2,4]оксадиазолил.
Термин "фармацевтически приемлемая соль" означает любую соль неорганической или органической кислоты или основания, которая обладает необходимой фармакологической активностью исходного соединения.
Для вышеуказанного применения прежде всего предпочтительны соединения формулы I, в которых А означает -С≡С-, а В означает В1.
Примерами таких соединений являются:
этиловый эфир 3, 5-диметил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 5-метил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(3-метоксифенилэтинил)-3, 5-диметил-3Н-имидазол-4-карбоновой кислоты,
1-метил-2-фенилэтинил-1Н-имидазол,
2-(5-нитро-2-фенилэтинилимидазол-1-ил)этанол,
2-фенилэтинил-1Н-имидазол,
этиловый эфир 2-(2,6-дихлорфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 5-метил-1-фенил-2-фенилэтинил-1Н-имидазол-4-карбоновой кислоты,
этиловый эфир 3,5-диметил-2-мета-толилэтинил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(3-ацетиламинофенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-[3-(2,5-диметилпиррол-1-ил)фенилэтинил]-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
5-(3,5-диметил-2-фенилэтинил-3Н-имидазол-4-ил)-3-метил-[1,2.4]оксадиазол,
3-циклопропил-5-(3,5-диметил-2-фенилэтинил-3Н-имидазол-4-ил)-[ 1,2,4]оксадиазол,
этиловый эфир 2-(4-хлорфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(4-фторфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-бифенил-4-илэтинил-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(2-фторфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
2-(2-фторфенилэтинил)-1-метил-1Н-имидазол,
этиловый эфир 2-(4-аминофенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
2-(2-хлорфенилэтинил)-1-метил-1Н-имидазол или
этиловый эфир (4, 5-дихлор-2-фенилэтинилимидазол-1-ил)уксусной кислоты.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I, в которых А означает -С≡С-, а В означает В2.
Примером такого соединения является 1-метил-5-фенилэтинил-1Н-имидазол.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I, в которых А означает -С≡С-, а В означает В3.
Примером такого соединения является N-[2-(5-метокси-2-фенилэтинил-1Н-индол-3-ил)этил] ацетамид.
Для вышеуказанного применения предпочтительны также соединения формулы I, в которых А означает -С≡С-, а В означает В4.
Примерами таких соединений являются
3-фенилэтинил-4Н-5-тиа-2,6, 9b-триазациклопента[а]нафталин или 3-фенилэтинил-4Н-5-окса-2,9b-диазациклопента[а]нафталин. Кроме того, для вышеуказанного применения предпочтительны соединения формулы I, в которых А означает -С≡С-, а В означает В5.
Примерами таких соединений являются:
1-хлор-3-(2-метил-5-нитро-4-фенилэтинилимидазол-1-ил)пропан-2-ол,
3-метил-5-фенилэтинил-3Н-имидазол-4-карбальдегид,
4-фенилэтинил-1Н-имидазол,
1-метил-4-фенилэтинил-1Н-имидазол или
1, 2-диметил-5-нитро-4-фенилэтинил-1Н-имидазол.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I, в которых А означает -С≡С-, а В означает В6.
Примером такого соединения является 1,3-диметил-5-фенилэтинил-1Н-пиразол.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I, в которых А означает -С=С-.
Для вышеуказанного применения прежде всего предпочтительны соединения формулы I, в которых А означает -С=С-, а В означает В1.
Примерами таких соединений являются:
4,5-диизопропил-1-метил-2-стирил-1Н-имидазол,
2-[2-(4-фторфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол,
2-[2-(4-хлорфенил)винил]-4, 5-диизопропил-1-метил-1Н-имидазол,
2-[2-(4-бутоксифенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол,
4,5-диизопропил-2-[2-(4-метокси-2,3, 6-триметилфенил)винил]-1-метил-1Н-имидазол,
4,5-диизопропил-2-[2-(4-метоксифенил)винил]-1-метил-1Н-имидазол,
2-[2-(4-хлор-3-фторфенил)винил]-4, 5-диизопропил-1-метил-1Н-имидазол,
2-[2-(4-этоксифенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол,
4,5-диизопропил-1-метил-2-[2-(2,3, 4-триметоксифенил)винил]-1Н-имидазол,
2-[2-(2,4-дихлорфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол или
4,5-диизопропил-1-метил-2-(2-пара-толилвинил)-1Н-имидазол.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I, в которых А означает -С=С-, а В означает В2.
Примерами таких соединений являются:
4-бром-1-метил-5-стирил-1Н-имидазол или
1-метил-5-стирил-1Н-имидазол.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I-A, в которых В означает В1, за исключением 1-метил-2-фенилэтинил-1H-имидазола и 1-метил-2-(4-метоксифенилэтинил)-1Н-имидазола.
Примерами таких соединений являются:
2-(5-нитро-2-фенилэтинилмидазол-1-ил)этанол,
2-фенилэтинил-1Н-имидазол,
2-(2-фторфенилэтинил)-1-метил-1Н-имидазол,
2-(2-хлорфенилэтинил)-1-метил-1Н-имидазол или
этиловый эфир (4,5-дихлор-2-фенилэтинилимидазол-1-ил)уксусной кислоты.
Более предпочтительны соединения формулы I-A, в которых В означает В1, a R7 означает -(CH2)n-C(O)OR' или гетероарил, который незамещен или замещен (низш.)алкилом или циклоалкилом. Предпочтительны прежде всего соединения, в которых R означает -(CH2)n-C(O)OR', где n равно 0, а R' означает (низш.)алкил.
Примерами таких соединений являются:
этиловый эфир 3, 5-диметил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 5-метил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(3-метоксифенилэтинил)-3, 5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(2,6-дихлорфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 5-метил-1-фенил-2-фенилэтинил-1Н-имидазол-4-карбоновой кислоты,
этиловый эфир 3,5-диметил-2-мета-толилэтинил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(3-ацетиламинофенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-[3-(2,5-диметилпиррол-1-ил)фенилэтинил]-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
5-(3,5-диметил-2-фенилэтинил-3Н-имидазол-4-ил)-3-метил-[1,2,4]оксадиазол,
3-циклопропил-5-(3,5-диметил-2-фенилэтинил-3Н-имидазол-4-ил)-[1,2,4]оксадиазол,
этиловый эфир 2-(4-хлорфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(4-фторфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-бифенил-4-илэтинил-3,5-диметил-3Н-имидазол-4-карбоновой кислоты,
этиловый эфир 2-(2-фторфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты или
этиловый эфир 2-(4-аминофенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты.
Кроме того, предпочтительны соединения формулы I-A, в которых В означает В4.
Примерами таких соединений являются:
3-фенилэтинил-4Н-5-тиа-2,6,9b-триазациклопента[а]нафталин или
3-фенилэтинил-4Н-5-окса-2,9b-диазациклопента[а]нафталин.
Кроме того, для вышеуказанного применения предпочтительны соединения формулы I-A, в которых В означает В5, за исключением 1-метил-4-фенилэтинил-1H-имидазола.
Примерами таких соединений являются:
1-хлор-3-(2-метил-5-нитро-4-фенилэтинилимидазол-1-ил)пропан-2-ол,
3-метил-5-фенилэтинил-3Н-имидазол-4-карбальдегид,
4-фенилэтинил-1Н-имидазол или
1,2-диметил-5-нитро-4-фенилэтинил-1Н-имидазол.
Кроме того, предпочтительны соединения формулы
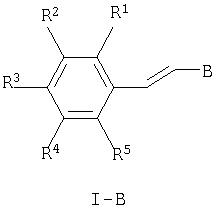
где
R1, R2, R3, R4 и R5 каждый независимо друг от друга означает водород, (низш.)алкил, -(СН2)n-галоген, (низш.)алкокси, -(CH2)n-NRR', -(CH2)n-N(R)-С(O)-(низш.)алкил, арил или гетероарил, которые являются незамещенными или замещенными одним или более (низш.)алкилом,
и в которых В означает В1, а R7 означает (низш.)алкил или -(CH2)n-C(O)OR'.
Предпочтительны прежде всего соединения, в которых R7 означает (низш.)алкил.
Примерами таких соединений являются:
4, 5-диизопропил-1-метил-2-стирил-1Н-имидазол,
2-[2-(4-фторфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол,
2-[2-(4-хлорфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол,
2-[2-(4-бутоксифенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол,
4,5-диизопропил-2-[2-(4-метокси-2,3,6-триметилфенил)винил]-1-метил-1Н-имидазол,
4, 5-диизопропил-2-[2-(4-метоксифенил)винил]-1-метил-1Н-имидазол,
2-[2-(4-хлор-3-фторфенил)винил]-4,5-диизопропил-1-метил-1H-имидазол,
2-[2-(4-этоксифенил)винил]-4, 5-диизопропил-1-метил-1H-имидазол,
4,5-диизопропил-1-метил-2-[2-(2,3,4-триметоксифенил)винил]-1Н-имидазол,
2-[2-(2,4-дихлорфенил)винил]-4, 5-диизопропил-1-метил-1H-имидазол или
4,5-диизопропил-1-метил-2-(2-пара-толилвинил)-1Н-имидазол.
Кроме того, предпочтительны соединения формулы I-B, в которых В означает В2, а R10 означает галоген.
Примером такого соединения является 4-бром-1-метил-5-стирил-1Н-имидазол.
Указанные соединения формул I-A и I-B и их фармацевтически приемлемые соли можно получить известными способами, например способом, описанным ниже, который включает взаимодействие соединения формулы

с соединением формулы

где Х означает галоген или трифторметансульфонил, а R1-R6 имеют значения, указанные выше,
с образованием соединения формулы I-A, если А означает -С≡С-, а В имеет значения, указанные выше,
или с образованием соединения формулы I-B, если А означает -НС=СН-, а В означает
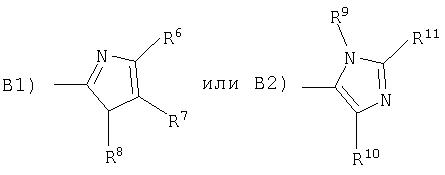
где
R6 означает водород, (низш.)алкил, -(СН2)n-С(O)OR или галоген,
R7 означает водород, (низш.)алкил, -(CH2)n-C(O)OR', галоген, нитро- или гетероарил, который является незамещенным или замещенным (низш.)алкилом или циклоалкилом,
R8 означает водород, (низш.)алкил, -(CH2)n-OH, -(CH2)n-C(O)OR'' или арил,
R9 означает (низш.)алкил,
R10 означает галоген, а
R11 означает водород или алкил,
и при необходимости превращение соединений формул I-A или I-B в фармацевтически приемлемую соль.
Эта реакция катализируется солями палладия (II).
Соединения формулы I по изобретению, где А означает -С≡С- получают при взаимодействии производного ацетилена формулы II, например этинилбензола, с соответствующим соединением формулы III, например эфиром 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты. По методу, описанному в Chem. Pharm. Bull. 35(2), 823-828 (1987), эта катализируемая палладием реакция С-С-конденсации требует присутствия хлорида бис(трифенилфосфин)палладия (II), иодида меди и триэтиламина и проводится в полярном растворителе, таком как диметилформамид или ацетонитрил, при температуре от 90°С до 100°С в течение от 1,5 до 3 ч. Реакцию можно также проводить в присутствии эквимолярных количеств хлорида бис(трифенилфосфин)палладия (II) и трифенилфосфина в избытке триэтиламина при температуре 55°С в течение 16 ч.
Фенилэтинил-производные формулы II являются коммерческими препаратами или их можно легко получить методами, известными в данной области.
Соединения формулы III также являются коммерческими препаратами или их можно легко получить соответствующими методами, в зависимости от гатероциклической системы В.
2-Галогено-1H-имидазолы формулы III (В означает В1) получают по методам, описанным в патентах US 4711962, US 3341548, и в Synth. Commun. 19, 2551-2566 (1989).
2-Трифторметансульфонил-1Н-имидазолы формулы IIIa можно получить из 2-оксо-2,3-дигидро-1Н-имидазола формулы VI, например из этилового эфира 5-метил-2-оксо-1-фенил-2,3-дигидро-1Н-имидазол-4-карбоновой кислоты, который получают по методу, описанному в US 3303199. Реакцию с ангидридом трифторметансульфокислоты и триэтиламином проводят в дихлорметане при комнатной температуре (схема 1, Tf означает трифторметансульфонил).
Схема 1
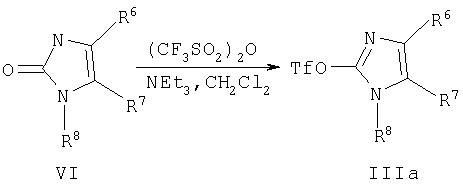
5-(2-Бром-3,5-диметил-3Н-имидазол-4-ил)-[1,2,4]оксадиазолы формулы IIIb получают при взаимодействии 3, 5-диметил-3Н-имидазол-4-карбоновой кислоты VII с N-гидроксикарбоксамидинами формулы VIII в присутствии 1,1'-карбонилдиимидазола и диметилформамида в качестве растворителя с образованием имидазолил-[1, 2,4]оксадиазолов формулы IX, которые затем бромируют при комнатной температуре (схема 2, R'' означает (низш.)алкил или циклоалкил).
Схема 2

Соответствующее производное индола формулы III (В означает В3), например, N-[2-(2-иод-5-метокси-1Н-индол-3-ил)этил]ацетамид можно получить по методу, описанному в J. Labelled Compd. Radiopharm., 39, 677-684 (1997).
3-Иод-4Н-5-тиа-2,6, 9b-триазациклопента[а]нафталины и 3-иод-4Н-5-окса-2,9b-диазациклопента[а]нафталины формулы III (В означает В4) получают методом, аналогичным описанному в ЕР 0059390.
4-Галогено-1Н-имидазолы формулы III (В означает В 5) можно получить по методам, описанным, например, в J. Med. Chem., 17(9), 1019-1020 (1974), Chem. Pharm. Bull., 42, 1784-1790 (1994) или Aust. J. Chem., 40 (8), 1399-1413 (1987).
Соединения формулы III, в которых В означает В6, можно получить, например, методом, аналогичным описанному в Бюлл. АН СССР, сер.хим. (перевод на англ.) 626-628 (1983) и в Изв. АН СССР, сер.хим., 688-690 (1983).
Фенилэтенил-производные формулы I можно получить в условиях, аналогичных условиям реакции соединения формулы III с фенилэтеном формулы II.
Кроме того, соединения формулы I, в которых А означает -С=С-, и их фармацевтически приемлемые соли можно также получить при взаимодейстии реакции соединения формулы

где X1 означает галоген,
с соединением формулы

с образованием соединения формулы
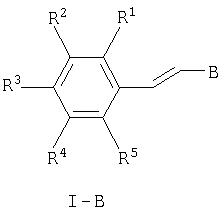
где R1-R5 имеют значения, указанные в п.1, а В означает

где
R6 означает водород, (низш.)алкил, -(CH2)n -C(O)OR или галоген,
R7 означает водород, (низш.)алкил, -(CH2)n-C(O)OR', галоген, нитро- или гетероарил, который является незамещенным или замещенным (низш.)алкилом или циклоалкилом,
R8 означает водород, (низш.)алкил, -(СН2)n-ОН, -(СН2)n-С(O)OR'' или арил,
R9 означает (низш.)алкил,
R10 означает галоген, а
R11 означает водород или алкил,
и при необходимости превращение соединения формулы I-B в его фармацевтически приемлемую соль.
Таким образом, соединения формулы I-B получают по реакции Виттига взаимодействием соответствующего альдегида формулы V, например 4, 5-диизопропил-1-метил-1Н-имидазол-2-карбальдегида с соответствующим галогенидом бензилтрифенилфосфония формулы IV, например хлоридом бензилтрифенилфосфония, в присутствии сильного основания, такого, как алкоксид натрия, амид натрия или гидрид натрия.
Соли трифенилфосфония формулы IV получают из трифенилфосфина (PPh3) и соответствующих бензилгалогенидов Х (схема 3).
Схема 3

Альдегиды формулы V можно получить известными методами. Например, 4,5-диизопропил-1-метил-1Н-имидазол-2-карбальдегид получают аналогично тому, как описано в Inorg. Chim. Acta, 296 (1), 208-221 (1999), а 5-бром-3-метил-3Н-имидазол-4-карбальдегид получают аналогично тому, как описано в Chem. Pharm. Bull. 42, 1784-1790 (1994).
Фармацевтически приемлемые соли соединений формул I-A и I-B можно получить известными методами, принимая во внимание природу соединения, соль которого необходимо получить. Пригодными для получения фармацевтически приемлемых солей оснований формулы I являются неорганические или органические кислоты, например хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, пара-толуолсульфокислота и т.п. Пригодными для получения фармацевтически приемлемых солей кислотных соединений являются соединения щелочных или щелочно-земельных металлов, например натрия, калия, кальция, магния и т.п., основные амины или основные аминокислоты.
Соединения формулы I и их фармацевтически приемлемые соли являются, как указано выше, антагонистами метаботропного глутаматного рецептора и могут использоваться для лечения или профилактики нарушений, опосредованных рецептором mGluR5, таких как острые и/или хронические неврологические нарушения, расстройство познавательной способности и потеря памяти, а также острой и хронической боли. Другими излечиваемыми неврологическими нарушениями являются, например, эпилепсия, шизофрения, страх, острые, травматические или хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческая деменция, хорея Гентингтона, боковой амиотрофический склероз, рассеянный склероз, деменция, вызванная СПИД, глазные травмы, ретинопатия, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными средствами, а также состояния, которые приводят к недостаточности функций глутаматных рецепторов, такие как мышечные спазмы, судороги, мигрень, недержание мочи, привыкание к никотину, психозы, опийная наркомания, страх, рвота, дискинезия и депрессии. Другими показаниями для лечения являются ограниченные функции мозга, вызванные операцией шунтирования или пересадки органов, недостаточное кровоснабжение мозга, травмы спинного мозга, травмы головы, гипоксия во время беременности, остановка сердца и гипогликемия.
Соединения формулы I и их фармацевтически приемлемые соли прежде всего применяются в качестве аналгетиков. Виды боли, подлежащие лечению, включают боль, вызванную воспалительным процессом, таким как артрит и ревматоидный артрит, васкулит, невропатическую боль, такую как невралгия тройничного нерва или невралгия при опоясывющем лишае, диабетическую неврологическую боль, каузалгию, гипералгезию, острую хроническую боль, послеоперационную боль и боль, ассоциированную с различными состояниями, такими как онкологическое заболевание, ангина, почечные или желчные (печеночные) колики, менструация, мигрень и подагра.
Фармакологическую активность соединений определяли следующим методом
Клетки EBNA временно трансфицировали кДНК, кодирующей рецептор mGlu5a крысы, по методике, описанной E.-J.Schlaeger и K.Christensen (Transient gene expression in mammalian cells grown in serum-free suspension culture, Cytotechnology, 30, 71-83 (1999). Трансфицированные клетки EBNA инкубировали с реактивом Fluo 3-AM (фирма Fluka, конечная концентрация 0,5 мкМ) при 37°С в течение 1 ч, четырежды промывали буферным раствором для анализа (среда DMEM, дополнительно содержащий соль Хэнка и 20 мМ ХЕПЕС) и измеряли концентрацию [Са2+]i на флуориметрическом ридере планшетов (FLIRP, фирма Molecular Devices Corporation, La Jolla, Калифорния, США). Если определяют антагонистичекую активность соединений, то их испытывают в присутствии 10 мкМ глутамата в качестве агониста.
Кривые ингибирования (антагонистическое действие) строили по четырехфакторному логистическому уравнению, определяя величину IC50, а коэффициент Хилла определяли с использованием итеративной нелинейной кривой, построенной с использованием программы Origin (фирма Microcal Sofware Inc., Northampton, MA, США).
Соединения по настоящему изобретению являются антагонистами рецептора mGluR 5а. По результатам анализа соединения обладали активностью 10 мкМ или меннее, обычно 2 мкМ или менее, и в наилучшем варианте 0,02 мкМ или менее.
Удельная активность соединений по настоящему изобретению представлена в таблице:
Соединения формулы I и их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например в качестве фармацевтических препаратов. Фармацевтические препараты можно вводить пероральным способом, например, в форме таблеток, таблеток с оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно проводить ректальным способом, например, в форме суппозиториев, или парентеральным способом, например, в форме инъекционных растворов.
Соединения формулы I и их фармацевтически приемлемые соли можно перерабатывать с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. В качестве носителей для таблеток, таблеток с оболочкой, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; однако в зависимости от природы активного вещества в случае мягких желатиновых капсул обычно не требуется никаких носителей. Пригодными носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п. Для водных инъекционных растворов водорастворимых солей соединений формулы I можно использовать адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., однако, как правило, в этом нет необходимости. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизирующие агенты, стабилизирующие агенты, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные вещества.
Как указывалось выше, лекарственные средства, содержащие соединение формулы IA или IB или их фармацетически приемлемые соли и терапевтически инертный эксципиент, также являются объектом настоящего изобретения, как и способ получения таких лекарственных средств, который включает введение одного или более соединений формулы IA или IB или их фармацетически приемлемых солей и, при необходимости, одного или более других терапевтически полезных веществ в галеновую лекарственную форму вместе с одним или более терапевтически инертных носителей.
Дозы могут изменяться в широких пределах в соответствии с индивидуальными требованиями в каждом конкретном случае. Обычно эффективная доза для перорального или парентерального введения составляет 0,01-20 мг/кг/сут, для всех указанных показаний предпочтительная доза составляет 0,1-10 мг/кг/сут. Соответственно, суточная доза для взрослого пациента массой 70 кг составляет 0,7-1400 мг/сут, предпочтительно 7-700 мг/сут.
Наконец, как указано выше, объектом настоящего изобретения является применение соединений формулы I и их фармацетически приемлемых солей для получения лекарственных средств, прежде всего для лечения или профилактики указанных выше нарушений, опосредованных рецептором mGluR5.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
Этиловый эфир 3, 5-диметил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты
а) Этиловый эфир 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение получали по методу, описанному в US 4711962.
б) Этиловый эфир 3,5-диметил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты
Соединение получали по методу, описанному в Chem. Pharm. Bull. 35(2), 823-828 (1987).
17,5 мг (0,025 ммоля) Хлорида бис(трифенилфосфин)палладия (II), 2,9 мг (0,015 ммоля) иодида меди, 60,5 мг (0,6 ммоля) триэтиламина, 32,4 мг (0,3 ммоля) этинилбензола и 61,8 мг (0,25 ммоля) этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты растворяли в 1 мл ДМФ и встряхивали при 90°С в течение 3 ч. Указанное в заголовке соединение (19,3 мг, выход 29%, MC: m/e 269,3 [М+Н+]) выделяли из реакционной смеси методом ЖХВР (колонка 20×50 мм, YMC CombiPrep C18, градиент растворителя: 10-95% CH3CN в 0,1% ТФУ в воде, время 6,0 мин, λ 230 нм, скорость элюции 40 мл/мин).
1H-ЯМР (400 МГц, CDCl3, 25°С): δ (част./млн) 1,39 (t, J 7,22 Гц, 3Н), 2,51 (s, 3Н), 3,99 (s, 3Н), 4,35 (q, J 7,22 Гц, 2Н), 7,34-7,40 (m, 3Н), 7,56-7,59 (m, 2H).
13С-ЯМР (100 МГц, CDCl3, 25°С): δ (част./млн) 14,26, 15, 78, 34,31, 60,44, 77,83, 94,86, 119,77, 121,14, 128,46, 129,48, 131,82, 134,55, 147,76, 160,58.
Пример 2
Этиловый эфир 5-метил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты
а) Этиловый эфир 2-бром-5-метил-3Н-имидазол-4-карбоновой кислоты
Соединение получали по методу, описанному в US 4711962.
б) Этиловый эфир 5-метил-2-фенилэтинил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, MC: m/e 255,2 [М+Н+], получали из этилового эфира 2-бром-5-метил-3Н-имидазол-4-карбоновой кислоты по общему методу, описанному в примере 1б.
Пример 3
Этиловый эфир 2-(3-метоксифенилэтинил)-3, 5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, MC: m/e 299,3 [М+Н+], получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 1-этинил-3-метоксибензола по общему методу, описанному в примере 1б.
Пример 4
1-Метил-2-фенилэтинил-1Н-имидазол
Указанное в заголовке соединение, MC: m/e 183,0 [М+Н+], получали из 2-иод-1-метил-1H-имидазола по общему методу, описанному в примере 1б.
Пример 5
2-(5-Нитро-2-фенилэтинилимидазол-1-ил)этанол
а) 2-(2-Иод-5-нитроимидазол-1-ил)этанол
2-(2-Иод-5-нитроимидазол-1-ил)этанол получали по методу, описанному в US 3341548.
б) 2-(5-Нитро-2-фенилэтинилимидазол-1-ил)этанол
Указанное в заголовке соединение, МС: m/e 258,0 [М+Н+], получали из 2-(2-иод-5-нитроимидазол-1-ил)этанола по общему методу, описанному в примере 1б.
Пример 6
2-Фенилэтинил-1Н-имидазол
а) 2-Иодимидазол
2-Иодимидазол получали по методу, описанному в Synth. Commun., 19, 2551-2566 (1989).
б) 2-Фенилэтинил-1Н-имидазол
Указанное в заголовке соединение, МС: m/e 169,4 [М+Н+], получали из 2-иодимидазола по общему методу, описанному в примере 1б.
Пример 7
Этиловый эфир 2-(2,6-дихлорфенилэтинил)-3, 5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/e 197,4 [М+Н+], получали из 1,3-дихлор-2-этинилбензола и этилового эфира 2-бром-3, 5-диметил-3Н-имидазол-4-карбоновой кислоты по общему методу, описанному в примере 1б.
Пример 8
Этиловый эфир 5-метил-1-фенил-2-фенилэтинил-1Н-имидазол-4-карбоновой кислоты
а) Этиловый эфир 5-метил-2-оксо-1-фенил-2,3-дигидро-1Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение получали по методу, описанному в US 3303199.
б) Этиловый эфир 5-метил-1-фенил-2-фенилэтинил-1Н-имидазол-4-карбоновой кислоты
Смесь 492 мг (2 ммоля) этилового эфира 5-метил-2-оксо-1-фенил-2, 3-дигидро-1Н-имидазол-4-карбоновой кислоты, 846 мг (3 ммоля) ангидрида трифторметансульфокислоты, 303 мг (3 ммоля) триэтиламина и 10 мл дихлорметана перемешивали при комнатной температуре в течение 1 ч. Летучие компоненты упаривали при пониженном давлении, остаток фильтровали через силикагель (элюент: этилацетат/гексан, 1:4). После упаривания растворителя при пониженном давлении получали масло желтого цвета (463 мг). Полученное масло (378 мг), 122 мг (1,2 ммоля) фенилацетилена, 70 мг (0,1 ммоля) хлорида бис(трифенилфосфин)палладия (II), 303 мг (3 ммоля) триэтиламина и 10 мг (0,05 ммоля) иодида меди растворяли в 5 мл ДМФ и перемешивали при 100°С в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли 30 мл эфира, промывали водой, солевым раствором и сушили над MgSO4. После выпаривания растворителя получали масло, из которого хроматографией на колонке с силикагелем (этилацетат/гексан, 2:3) выделяли указанное в заголовке соединение (277 мг, выход 51%).
1H-ЯМР (400 МГц, CDCl3, 25°С): δ (част./млн) 1,44 (t, J 7 Гц, 3Н), 2,47 (s, 3Н), 4,42 (q, J 7 Гц, 2Н), 7,20-7,42 (m, 5H), 7,34-7,38 (m, 2Н), 7,53-7,60 (m, 3H).
13С-ЯМР (100 МГц, CDCl3, 25°C): δ (част./млн) 11,53, 14,94, 60,90, 79,34, 92,92, 121,91, 127,79, 128,73, 129,47, 129,86, 130,00, 130,15, 131,90, 132,08, 135,42, 137,91, 163,75.
Пример 9
Этиловый эфир 3,5-диметил-2-мета-толилэтинил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/e 283,6 [М+Н+], получали из 1-этинил-3-метилбензола и этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты по общему методу, описанному в примере 1б.
Пример 10
Этиловый эфир 2-(3-ацетиламинофенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/e 326,8 [М+Н+], получали из N-(3-этинилфенил)ацетамида и этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты по общему методу, описанному в примере 1б.
Пример 11
Этиловый эфир 2-[3-(2,5-диметилпиррол-1-ил)фенилэтинил]-3,5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/e 362,8 [М+Н+ ], получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 1-(3-этинилфенил)-2,5-диметил-1Н-пиррола по общему методу, описанному в примере 1б.
Пример 12
5-(3,5-Диметил-2-фенилэтинил-3Н-имидазол-4-ил)-3-метил-[1,2,4]оксадиазол
а) 5-(3,5-Диметил-3Н-имидазол-4-ил)-3-метил-[1,2,4]оксадиазол
Раствор 3, 5-диметил-3Н-имидазол-4-карбоновой кислоты (1,0 г, 7,14 ммоля) и 1,1'-карбонилдимидазола (1, 74 г, 10,7 ммолей) в ДМФ (35 мл) перемешивали при КТ в течение 3 ч. Затем добавляли N-гидроксиацетамидин (0, 68 г, 9,18 ммоля), реакционную смесь перемешивали при 80°С в течение 16 ч, упаривали, остаток растворяли в уксусной кислоте (30 мл). Раствор перемешивали при 100°С в течение 2 ч, упаривали, выливали в насыщенный раствор NaHCO3 (50 мл) и экстрагировали дихлорметаном (7×30 мл). Объединенные органические экстракты промывали солевым раствором (70 мл), сушили (MgSO4) и упаривали, при этом получали продукт реакции (0,78 г, выход 61%) в виде твердого вещества белого цвета, tпл. 95°C, MC: m/e 178,2 (М+)
б) 5-(2-Бром-3,5-диметил-3Н-имидазол-4-ил)-3-метил-[1.2.4]оксадиазол
К перемешиваемому при КТ раствору 5-(3,5-диметил-3Н-имидазол-4-ил)-3-метил-[1,2,4]оксадиазола (0,7 г, 3,93 ммоля) в хлороформе (7 мл) добавляли по каплям раствор брома (0,94 г, 0,30 мл, 5,89 ммоля) в хлороформе (7 мл). Реакционную смесь перемешивали при КТ в течение 26 ч, упаривали, выливали в насыщенный раствор NaHCO3 (40 мл) и экстрагировали дихлорметаном (2×30 мл). Объединенные органические экстракты промывали солевым раствором (40 мл), сушили (MgSO4) и упаривали, при этом получали неочищенный продукт (0,84 г) в виде масла желтого цвета. После очистки хроматографией на колонке с силикагелем (этилацетат/МеОН, 98:2) получали указанное в заголовке соединение (0,52 г, выход 51%) в виде твердого вещества белого цвета, tпл. 89°C, MC: m/e 256,258 (М+)
в) 5-(3,5-Диметил-2-фенилэтинил-3Н-имидазол-4-ил)-3-метил-[1,2,4]оксадиазол
К перемешиваемому раствору 5-(2-бром-3,5-диметил-3Н-имидазол-4-ил)-3-метил-[1,2,4]оксадиазола (0,52 г, 2,02 ммоля) в ТГФ (10 мл) добавляли при КТ хлорид бис(трифенилфосфин)палладия (II) (71 мг, 0,1 ммоля), фенилацетилен (0,31 г, 3,03 ммоля), трифенилфосфин (27 мг, 0,1 ммоля) и триэтиламин (0,61 г, 6,07 ммоля). Через реакционную смесь пропускали аргон в течение 10 мин, и продолжали перемешивать при 55°С в течение 16 ч. Затем реакционную смесь выливали в воду (50 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты промывали солевым раствором (40 мл), сушили (MgSO4) и упаривали, при этом получали неочищенный продукт (0,81 г, в виде масла желтого цвета. После очистки хроматографией на колонке с силикагелем (этил ацетат/толуол, 5:1) получали указанное в заголовке соединение (0,31 г, выход 55%) в виде твердого вещества светло-желтого цвета. tпл. 137°С, МС: m/e 278,1 (М+)
Пример 13
3-Циклопропил-5-(3,5-диметил-2-фенилэтинил-3Н-имидазол-4-ил)-[1,2,4]оксадиазол
а) 3-Циклопропил-5-(3,5-диметил-3Н-имидазол-4-ил)-[1,2, 4]оксадиазол
Указанное в заголовке соединение, твердое вещество грязно-белого цвета, tпл. 88°С, МС: m/e 204,3 (М+), получали из 3, 5-диметил-3Н-имидазол-4-карбоновой кислоты и N-гидроксициклопропанкарбоксамидина по общему методу, описанному в примере 12а.
б) 5-(2-Бром-3,5-диметил-3Н-имидазол-4-ил)-3-циклопропил-[1, 2,4]оксадиазол
Указанное в заголовке соединение, твердое вещество белого цвета, tпл. 81°С, МС: m/e 282,284 (М+), получали бромированием 3-циклопропил-5-(3, 5-диметил-3Н-имидазол-4-ил)-[1,2,4]оксадиазола по общему методу, описанному в примере 12б.
в) 3-Циклопропил-5-(3,5-диметил-2-фенилэтинил-3Н-имидазол-4-ил)-[1,2,4]оксадиазол
Указанное в заголовке соединение, твердое вещество белого цвета, tпл. 120°С, МС: m/e 305,2 (М+Н+), получали из 5-(2-бром-3, 5-диметил-3Н-имидазол-4-ил)-3-циклопропил-[1,2,4]оксадиазола и фенилацетилена по общему методу, описанному в примере 12в.
Пример14
Этиловый эфир 2-(4-хлорфенилэтинил)-3, 5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/е 303,0 (М+Н+), получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 1-хлор-4-этинилбензола по общему методу, описанному в примере 1б.
Пример 15
Этиловый эфир 2-(4-фторфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/е 286,8 (М+Н+), получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 1-этинил-4-фторбензола по общему методу, описанному в примере 1б.
Пример 16
Этиловый эфир 2-бифенил-4-илэтинил-3,5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/е 345,4 (М+Н+), получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 4-этинилбифенила по общему методу, описанному в примере 1б.
Пример 17
Этиловый эфир 2-(2-фторфенилэтинил)-3,5-диметил-3Н-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/е 287,4 (М+Н+), получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 1-этинил-2-фторбензола по общему методу, описанному в примере 1б.
Пример 18
2-(2-Фторфенилэтинил)-1-метил-1H-имидазол
Указанное в заголовке соединение, МС: m/е 201,2 (М+Н+), получали из 2-иод-1-метил-1H-имидазола и 1-этинил-2-фторбензола по общему методу, описанному в примере 1б.
Пример 19
Этиловый эфир 2-(4-аминофенилэтинил)-3,5-диметил-3H-имидазол-4-карбоновой кислоты
Указанное в заголовке соединение, МС: m/е 284,4 (М+Н+), получали из этилового эфира 2-бром-3,5-диметил-3Н-имидазол-4-карбоновой кислоты и 4-этиниланилина по общему методу, описанному в примере 1б.
Пример 20
2-(2-Хлорфенилэтинил)-1-метил-1H-имидазол
Указанное в заголовке соединение, МС: m/е 217,6 (М+Н+), получали из 2-иод-1-метил-1H-имидазола и 1-хлор-2-этинилбензола по общему методу, описанному в примере 1б.
Пример 21
Этиловый эфир (4,5-дихлор-2-фенилэтинилимидазол-1-ил)уксусной кислоты
Указанное в заголовке соединение, МС: m/е 323,0 (М+Н+), получали из этилового эфира (2-бром-4,5-дихлоримидазол-1-ил)уксусной кислоты и этинилбензола по общему методу, описанному в примере 1б.
Пример 22
1-Метил-5-фенилэтинил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 183,4 (М+Н+), получали из 5-иод-1-метил-1H-имидазола по общему методу, описанному в примере 1б.
Пример 23
N-[2-(5-Метокси-2-фенилэтинил-1Н-индол-3-ил)этил]ацетамид
а) N-[2-(2-Иод-5-метокси-1Н-индол-3-ил)этил]ацетамид
Указанное в заголовке соединение получали из N-[2-(5-метоксииндол-3-ил)этил]ацетамида по методу, описанному в J. Labelled Compd. Radiopharm., 39, 677-684(1997).
б) N-[2-(5-Метокси-2-фенилэтинил-1Н-индол-3-ил)этил]ацетамид
Указанное в заголовке соединение, МС: m/е 333,3 (М+Н+), получали из N-[2-(2-иод-5-метокси-1Н-индол-3-ил)этил]ацетамида по общему методу, описанному в примере 1б.
Пример 24
3-Фенилэтинил-4Н-5-тиа-2,6,9b-триазациклопента[а]нафталин
а) 3-Иод-4Н-5-тиа-2,6,9b-триазациклопента[а]нафталин
Указанное в заголовке соединение получали аналогично тому, как описано в ЕР 0059390.
б) 3-Фенилэтинил-4Н-5-тиа-2,6,9b-триазациклопента[а]нафталин
Указанное в заголовке соединение, МС: m/е 290, 3 (М+Н+), получали из 3-иод-4Н-5-тиа-2,6, 9b-триазациклопента[а]нафталина по общему методу, описанному в примере 1б.
Пример 25
3-Фенилэтинил-4Н-5-окса-2,9b-диазациклопента[а]нафталин
а) 3-Иод-4Н-5-окса-2,9b-диазациклопента[а]нафталин
3-Иод-4Н-5-окса-2,9b-диазациклопента[а]нафталин получали аналогично тому, как описано в ЕР 0059390.
б) 3-Фенилэтинил-4Н-5-окса-2,9b-диазациклопента[а]нафталин
Указанное в заголовке соединение, МС: m/е 273, 2 (М+Н+), 545,1 (2М+Н), получали из 3-иод-4Н-5-окса-2, 9b-диазациклопента[а]нафталина по общему методу, описанному в примере 1б.
Пример 26
1-Хлор-3-(2-метил-5-нитро-4-фенилэтинилимидазол-1-ил)пропан-2-ол
а) 1-Хлор-3-(4-иод-2-метил-5-нитроимидазол-1-ил)пропан-2-ол
1-Хлор-3-(4-иод-2-метил-5-нитроимидазол-1-ил)пропан-2-ол получали по методу, описанному в J. Med. Chem. 17(9), 1019-1020 (1974).
б) 1-Хлор-3-(2-метил-5-нитро-4-фенилэтинилимидазол-1-ил)пропан-2-ол
Указанное в заголовке соединение, МС: m/е 319,7, 321,9 (М+Н+), получали из 1-хлор-3-(4-иод-2-метил-5-нитроимидазол-1-ил)пропан-2-ола по общему методу, описанному в примере 1б.
Пример 27
3-Метил-5-фенилэтинил-3Н-имидазол-4-карбальдегид
а) 5-Бром-3-метил-3Н-имидазол-4-карбальдегид
5-Бром-3-метил-3Н-имидазол-4-карбальдегид получали по методу, описанному в Chem. Pharm. Bull., 42, 1784-1790 (1994).
б) 3-Метил-5-фенилэтинил-3Н-имидазол-4-карбальдегид
Указанное в заголовке соединение, МС: m/е 210,6 (М+Н+), получали из 5-бром-3-метил-3Н-имидазол-4-карбальдегида по общему методу, описанному в примере 1б.
Пример 28
4-Фенилэтинил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 162,2 (М+Н+), получали из 4-бромимидазола и этинилбензола по общему методу, описанному в примере 1б.
Пример 29
1-Метил-4-фенилэтинил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 183,2 (М+Н+), получали из 4-иод-1-метил-1H-имидазола по общему методу, описанному в примере 1б.
Пример 30
1, 2-Диметил-5-нитро-4-фенилэтинил-1Н-имидазол
а) 1,2-Диметил-4-иод-5-нитроимидазол
1,2-Диметил-4-иод-5-нитроимидазол получали по методу, описанному в Aust. J. Chem., 40(8), 1399-1413 (1987).
б) 1,2-Диметил-5-нитро-4-фенилэтинил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 242,4 (М+Н+), получали из 1, 2-диметил-4-иод-5-нитроимидазола по общему методу, описанному в примере 1б.
Пример 31
1,3-Диметил-5-фенилэтинил-1Н-пиразол
а) 5-Иод-1, 3-диметил-1Н-пиразол
Указанное в заголовке соединение получали по методу, описанному в Бюл. АН СССР, сер. хим., 626-628 (1983) и Изв. АН СССР, сер.хим., 688-690 (1983).
б) 1,3-Диметил-5-фенилэтинил-1Н-пиразол
Указанное в заголовке соединение, МС: m/е 196,8 (М+Н+), получали из 5-иод-1,3-диметил-1Н-пиразола по общему методу, описанному в примере 1б.
Пример 32
4,5-Диизопропил-1-метил-2-стирил-1Н-имидазол
а) 4,5-Диизопропил-1-метил-1H-имидазол-2-карбальдегид
4, 5-Диизопропил-1-метил-1Н-имидазол-2-карбальдегид получали аналогично тому, как описано в Inorg. Chim. Acta, 296 (1), 208-221 (1999).
б) 4,5-Диизопропил-1-метил-2-стирил-1Н-имидазол
194 мг (0,5 ммоля) хлорида бензилтрифенилфосфония и 97 мг (0,5 ммоля) 4,5-диизопропил-1-метил-1Н-имидазол-2-карбальдегида добавляли к 1,3 мл 0,5 М раствора MeONa в МеОН. Смесь встряхивали при 60°С в течение 3 сут, а затем охлаждали до комнатной температуры. После добавления 0,2 мл муравьиной кислоты указанное в заголовке соединение (59 мг, выход 44%, МС: m/е 269,4 [М+Н+]) выделяли из реакционной смеси методом ЖХВР (колонка 20×50 мм, YMC CombiPrep C18, градиент растворителя: 10-95% CH3CN в 0,1% ТФУ в воде, время 6,0 мин, λ 230 нм скорость элюции 40 мл/мин).
Пример 33
2-[2-(4-Фторфенил)винил]-4,5-диизопропил-1-метил-1H-имидазол
Указанное в заголовке соединение, МС: m/е 286,8 (М+Н+), получали из хлорида 4-фторбензилтрифенилфосфония по общему методу, описанному в примере 32б.
Пример 34
2-[2-(4-Хлорфенил)винил]-4, 5-диизопропил-1-метил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 302,9 (М+Н+), получали из хлорида 4-хлорбензилтрифенилфосфония по общему методу, описанному в примере 32б.
Пример 35
2-[2-(4-Бутоксифенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 340,9 (М+Н+), получали из бромида (4-бутоксибензил)трифенилфосфония по общему методу, описанному в примере 32б.
Пример 36
4,5-Диизопропил-2-[2-(4-метокси-2,3, 6-триметилфенил)винил]-1-метил-1Н-имидазол
а) Хлорид 2,3,6-триметил-4-метоксибензилтрифенилфосфония
Хлорид 2,3,6-триметил-4-метоксибензилтрифенилфосфония получали аналогично тому, как описано в Liebigs Ann. Chem., 10, 1740-1745 (1984).
б) 4,5-Диизопропил-2-[2-(4-метокси-2,3,6-триметилфенил)винил]-1-метил-1H-имидазол
Указанное в заголовке соединение, МС: m/е 340,9 (М+Н+), получали из хлорида 2,3,6-триметил-4-метоксибензилтрифенилфосфония по общему методу, описанному в примере 32б.
Пример 37
4,5-Диизопропил-2-[2-(4-метоксифенил)винил]-1-метил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 298,9 (М+Н+), получали из бромида (4-метоксибензил)трифенилфосфония по общему методу, описанному в примере 32б.
Пример 38
2-[2-(4-Хлор-3-фторфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол
а) Бромид 4-хлор-3-фторбензилтрифенилфосфония
Бромид 4-хлор-3-фторбензилтрифенилфосфония получали аналогично тому, как описано в ЕР 0692485.
б) 2-[2-(4-Хлор-3-фторфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 320,8 (М+Н+), получали из бромида 4-хлор-3-фторбензилтрифенилфосфония по общему методу, описанному в примере 32б.
Пример 39
2-[2-(4-Этоксифенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 312,9 (М+Н+), получали из бромида (4-этоксибензил)трифенилфосфония по общему методу, описанному в примере 32б.
Пример 40
4,5-Диизопропил-1-метил-2-[2-(2,3,4-триметоксифенил)винил]-1Н-имидазол
а) Бромид трифенил-(2,3,4-триметоксибензил)фосфония
Бромид трифенил-(2,3, 4-триметоксибензил)фосфония получали аналогично тому, как описано в DE 4307049.
б) 4,5-Диизопропил-1-метил-2-[2-(2,3,4-триметоксифенил)винил]-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 359,0 (М+Н+), получали из бромида трифенил-(2,3,4-триметоксибензил)фосфония по общему методу, описанному в примере 32б.
Пример 41
2-[2-(2,4-Дихлорфенил)винил]-4,5-диизопропил-1-метил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 336,8 (М+Н+), получали из хлорида 2, 4-дихлорбензилтрифенилфосфония по общему методу, описанному в примере 32б.
Пример 42
4,5-Диизопропил-1-метил-2-(2-пара-толилвинил)-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 282,9 (М+Н+), получали из бромида 4-метилбензилтрифенилфосфония по общему методу, описанному в примере 32б.
Пример 43
4-Бром-1-метил-5-стирил-1Н-имидазол
а) 5-Бром-3-метил-3Н-имидазол-4-карбальдегид
5-Бром-3-метил-3Н-имидазол-4-карбальдегид получали по методу, описанному в Chem. Pharm. Bull., 42, 1784-1790 (1994).
б) 4-Бром-1-метил-5-стирил-1Н-имидазол
Указанное в заголовке соединение, МС: m/е 263,0 (М+Н+), получали из 5-бром-3-метил-3Н-имидазол-4-карбальдегида по общему методу, описанному в примере 21б.
Пример 44
1-Метил-5-стирил-1Н-имидазол
Указанное в заголовке соединение получали аналогично тому, как описано в Chem. Pharm. Bull., 35, 823-828 (1987).
Пример А
Таблетки указанного состава получали обычным способом
мг в таблетке
Пример Б
Таблетки указанного состава получали обычным способом
мг в таблетке
Пример В
Капсулы указанного состава получали обычным способом
мг в капсуле
Активный ингредиент в виде частиц соответствующего размера, кристаллическую лактозу и микрокристаллическую целлюлозу равномерно перемешивали, просеивали и добавляли тальк и стеарат магния. Полученной смесью заполняли твердые капсулы соответствующего размера.
Реферат
Изобретение относится к применению фенилэтенил- или фенилэтинилпроизводных в качестве антагонистов глутаматного рецептора. Описывается применение соединения общей формулы
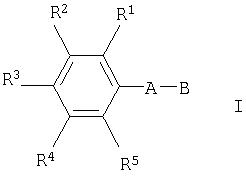
где R1, R2, R3, R4 и R5 каждый независимо друг от друга означает водород, C1-C6алкил, -(СН2)n-галоген, C1-C6алкокси, -(CH2)n-NRR', -(CH2)n-N(R)-C(O)-(C1-C6)алкил, фенил или пирролил, который является незамещенным или замещенным одним или более C1 -C6алкилом, R, R' и R" каждый независимо друг от друга означает водород или C1-C6алкил, А означает -CH=СН- или -C≡С-, а В означает

где R6 означает водород, C1-C6алкил, -(CH2)n -C(O)OR или галоген, R7 означает водород, C1-C6алкил, -(CH2)n-C(O)OR', галоген, нитро- или оксодиазолил, который является незамещенным или замещенным C1-C6алкилом или циклоалкилом, R8 означает водород, C1-C6алкил, -(СН2)n-OH, -(CH2)n -C(O)OR" или фенил, R9 означает C1-C6алкил, R10 и R11означает водород, R12 означает -(CH2)n-N(R)-C(O)-(C1-C6)алкил, R13 означает водород, R14, R15, R16 и R17 каждый независимо друг от друга означает водород или C1-C6алкокси, R18, R19 и R20 каждый независимо друг от друга означает водород, R21 означает водород или С1-C6алкил, R22 означает водород, С1-C6алкил или С1-C6алкил, содержащий один или более заместителей, выбранных из групп гидрокси или галогена, R23 означает водород, C1-C6алканоил или нитро, R24, R25 и R26 каждый независимо друг от друга означает водород или C1-C6алкил, n равно 0, 1, 2, 3, 4, 5 или 6, X означает -О- или -S-, a Y означает -CH= или -N=, и его фармацевтически приемлемых солей для изготовления лекарственных средств, предназначенных для лечения или профилактики нарушений, опосредованных рецептором mGluR5. Также описываются соединения формулы I-A, соединение формулы I-B-1, соединение формулы I-B-2 и лекарственное средство для лечения или профилактики нарушений, опосредованных рецептором mGluR5. 5 н. и 39 з.п. ф-лы, 1 табл.
Формула







Комментарии