Применение производных имидазола для приготовления фармкомпозиций, активных к рецепторам ат1 и ат2 ангиотензина, некоторые из этих соединений, способ получения производных имидазола и фармацевтические композиции на их основе - RU2141321C1
Код документа: RU2141321C1
Чертежи


Описание
Настоящее изобретение касается нового использования производных имидазола при лечении заболеваний, вызванных рецепторами AT1 и AT2 ангиотензина, некоторых из этих продуктов, способа их получения, их применения в качестве медикаментов и содержащих их фармацевтических композиций.
Ангиотензин II известен как циркулирующий гормон, способный также действовать как нейропептид на уровне центральной нервной системы, как указано в заявках на европейские патенты ЕР 0465368 и ЕР 0503162 или международный WO 91/14367.
Недавно было установлено, что в действительности существуют два подвида рецепторов ангиотензина II: рецептор AT1 и рецептор AT2.
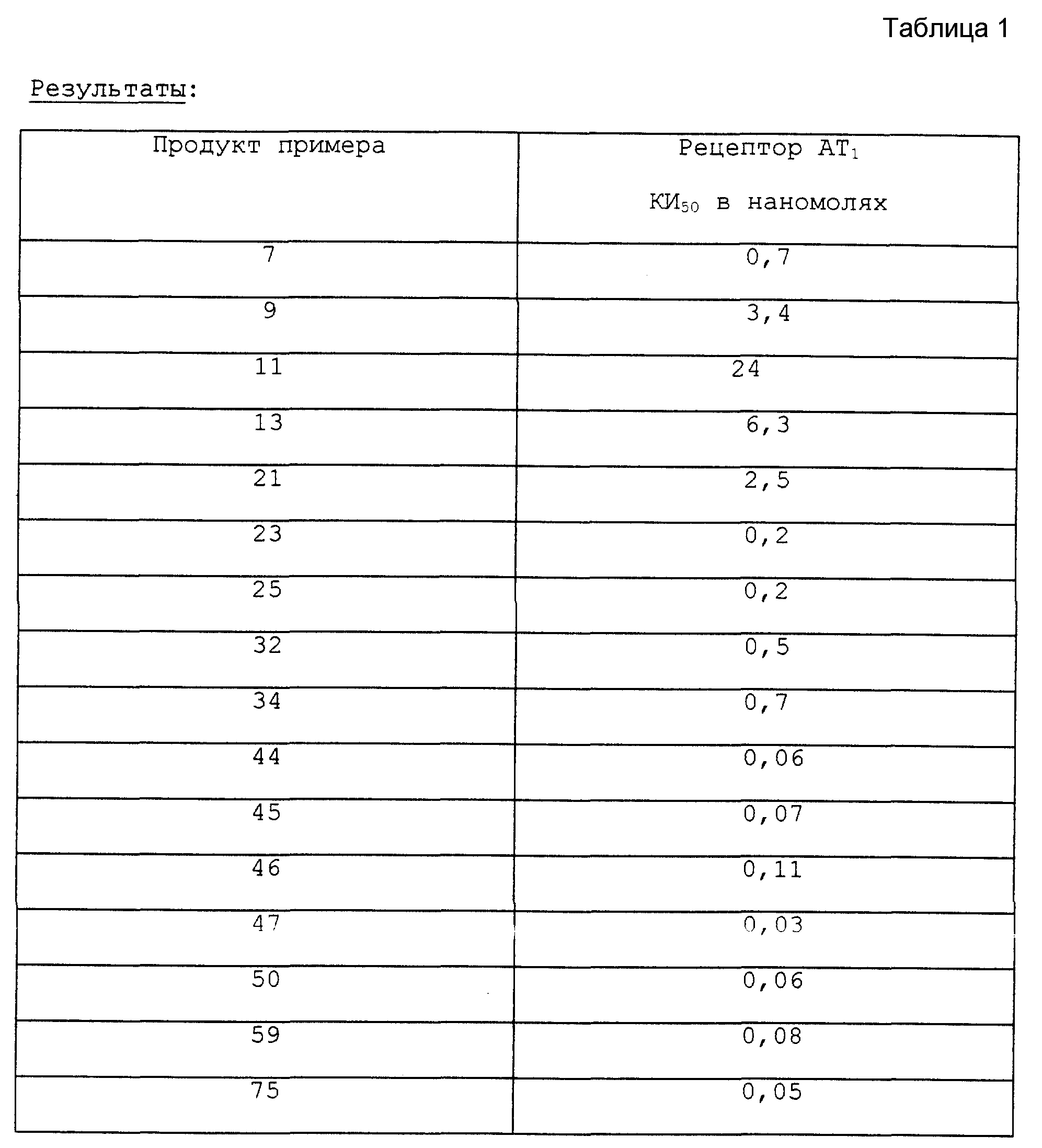
Первоначальные исследования касались выявления антагонистов к рецептору AT1 в качестве вещества с антигипертензивной активностью.
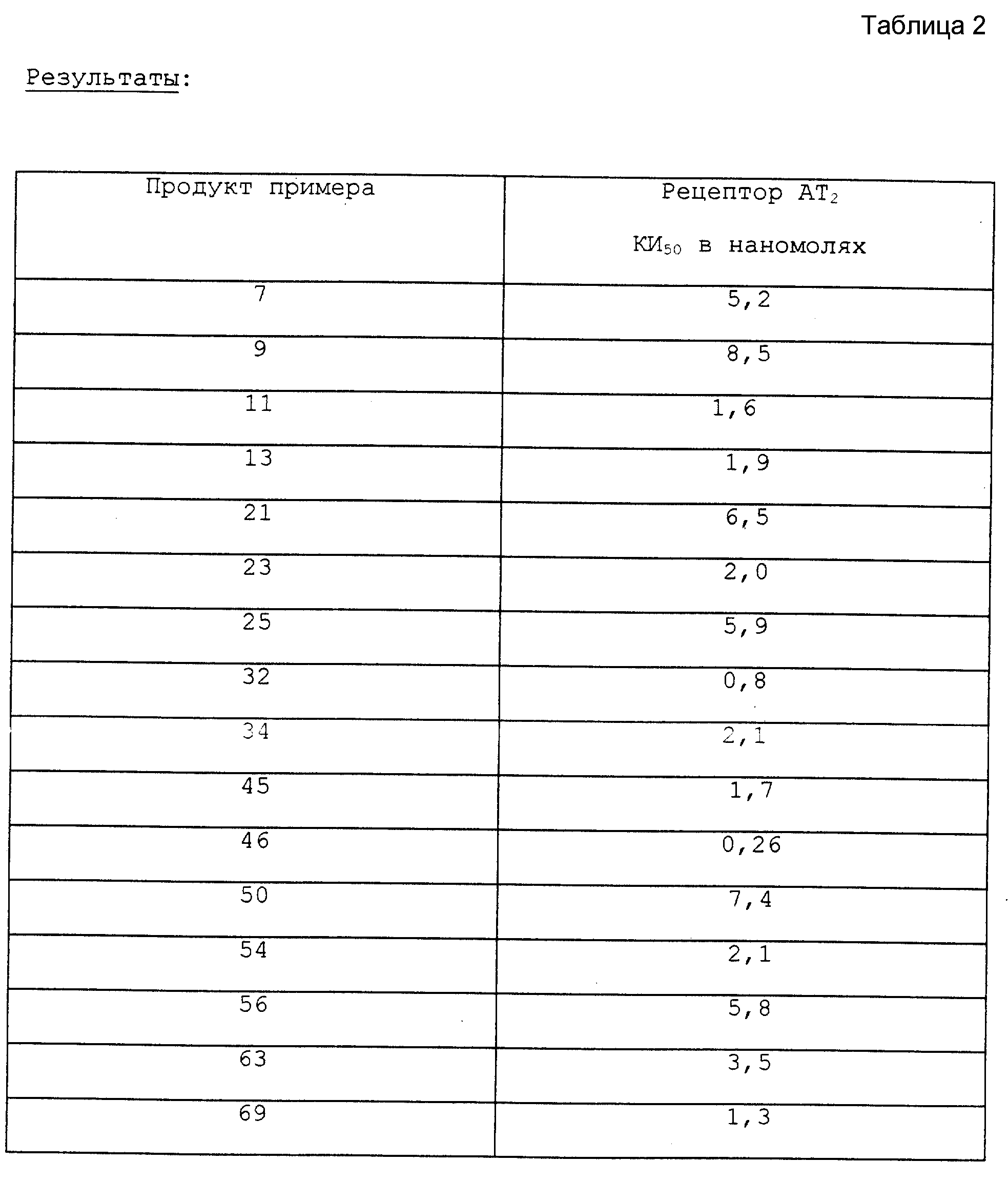
Последние исследования показали, что соединения формулы (I) согласно настоящему изобретению имеют сродство не только к рецептору AT1, но и к рецептору AT2.
Таким образом, настоящее изобретение касается нового использования соединений формулы (I) при лечении заболеваний, вызванных аномальной стимуляцией рецепторов AT1 и AT2 ангиотензина II.
Объектом настоящего изобретения является также использование для приготовления фармацевтических композиций, предназначенных для лечения заболеваний,
вызванных аномальной стимуляцией рецепторов AT1 и AT2 ангиотензина II, соединений формулы (I):
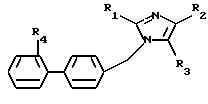
в которой R1 - алкил, алкилтио и алкокси, линейный или разветвленный, содержащий не более 6 атомов углерода, арил, арилтио, арилокси, арилалкил, в котором алкил, линейный или разветвленный, содержит не более 6 атомов углерода
R2 означает:
а) радикалы -S- R, -O-R и
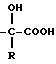
где R - алкил или алкенил, линейный или разветвленный, содержащий не более 8 атомов углерода, циклоалкил, содержащий не более 6 атомов углерода, или арил, причем радикалы алкил, алкенил, циклоалкил и арил, при необходимости, замещены одним или несколькими радикалами, выбранными среди атомов галогена, гидроксила, алкокси, алкилтио, линейного или разветвленного, содержащего не более 6 атомов углерода, и фенила, при необходимости, замещенного одним или несколькими радикалами, выбранными среди атомов галогена, гидроксила, алкокси, линейного или разветвленного, содержащего не более 6 атомов углерода;
б) атом галогена;
в) радикал
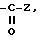
где Z - гидроксил, алкокси или карбокси, свободный, превращенный в соль или этерифицированный;
R3 выбран из группы, включающей:
- карбоксирадикал, свободный, превращенный в соль или этерифицированный,
- ацильный радикал, при необходимости, замещенный радикалом фенил, тиенил или тетразолил,
- атом галогена,
- алкил, алкенил или алкилтио, линейный или разветвленный, со держащий не более 8 атомов углерода, при необходимости, замещенный одним или несколькими радикалами, выбранными из атомов галогена и радикалов, включающих:
гидроксил, алкокси, ацил, арил,
карбоксирадикал, свободный, превращенный в соль, этерифицированный или амидированный,
радикалы
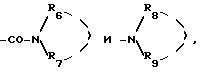
где либо R6 и R7 или R8 и R9, одинаковые или различные, выбираются из группы, включающей:
- атом водорода,
- радикалы ацил, алкил и алкенил, содержащие не более 6 атомов углерода, алкилсульфонил и арилсульфонил, причем радикалы могут быть замещены одним или несколькими радикалами, одинаковыми или различными, выбранными из атомов галогена, гидроксила, алкоксирадикалов, содержащих не более 6 атомов углерода, или карбоксирадикала, свободного, превращенного в соль или этерифицированного,
- радикалы арил, арилалкил и арилалкенил, в которых радикалы алкил и алкенил, линейные или разветвленные, содержат не более 6 атомов углерода, при этом радикалы арил, арилалкил и арилалкенил могут быть замещены одним или несколькими радикалами, выбираемыми из атомов галогена, радикалов гидроксила, нитро, радикалов алкила, алкенила, галоалкила, алкокси и ацила, содержащих не более 6 атомов углерода, аминорадикала, возможно замещенного одним или двумя алкилрадикалами, одинаковыми или различными, содержащими не более 6 атомов углерода, и карбоксирадикалов, свободных, превращенных в соль или этерифицированных,
либо, с одной стороны, R6 и R7 и, с другой стороны, R8 и R9 образуют соответственно с атомом азота, с которым они связаны, гетероциклический радикал, выбираемый из радикалов имидазолила, пирролила, пирролинила, пирролидинила, пиперидинила, пиримидинила, пиридазинила, пиперазинила, фенилпиперазинила, оксазолила, морфолинила и тиоморфолинила, азепина, индолила, причем эти радикалы могут быть замещены одним или несколькими радикалами, одинаковыми или различными, выбранными из атомов галогена, радикалов гидроксила, трифторметила, алкила и алкокси, причем эти радикалы содержат не более 6 атомов углерода,
либо R8 и R9, одинаковые или различные, означают аминокислоту, или один из R8 или R9 означают радикал карбамоил, алкоксикарбонил или бензилоксикарбонил, или R8 и R9 образуют вместе с атомом азота, с которым они связаны, радикал фталимидо или сукцинимидо,
R4 представляет собой:
а) радикалы-(CH2)m1-COOR14 , -(CH2)m1- CONHR14, -(CH2)m1-CN,
где m означает целое число от 0 до 4, - SO2-NH-SO2-R14, -NH-SO2-R14, -PO3R14, -NH-SO2-CF3 и
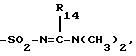
-(CH2)m1-SO3R14, -CO-NH-OR14, -CO-NH-NH-SO2-CF3, -CO-NH-SO2-R14, -CH2SO2 NHCO-R14, -CH2-SO2-NHR14, -CH2CONH-SO2R14, -NHSO2NHCO-R14, -NHCONHSO2-R14, NH-CH2-SO2- NHR14, -CONHSO2NR14R15, -SO2NHCONR14R15, -SO2N(R14 )OR15, - SO2NHPO(R14)2, -CONHPO(R14)2, -SO2NHCN, -SO2NHCOR14, SO2- NHCO2R14, -SO2NHSO2NR14R15, -SO2NHSO2N(-CH2-CH2-)2D, -NHSO2NHSO2R14, -NHSO2 NHPO(R14)2, -NR14COCO2H, -SO2NHCO2R14, -SO2-NH-CS-R14, -SO2 -NH-CS-NH-R14,
где D означает атом кислорода или серы,
б) радикал -SO2-W-R14, где W - радикал -NR15-, NH-CO-, -NH-CO-O-, -N= CH-N-R15- или -NH-CO-NR15-, радикал, в котором либо R14 и R15, одинаковые или различные, выбираются из атома водорода, радикала алкила или алкенила, линейного или разветвленного, содержащего не более 8 атомов углерода, циклоалкила, содержащего не более 6 атомов углерода, и арила, причем радикалы алкила, алкенила, циклоалкила и арила могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, алкокси, содержащего не более 4 атомов углерода, нитро, циано, амино, моно и диалкиламино, карбокси свободного, превращенного в соль или этерифицированного, галоалкила, алкилтио, галоалкилтио, галоалкокси, карбамоила, ацила, ацилокси, циклоалкила, циклоалкенила, арила, фенилтио, пиридила, тетразолила, тиенила, нитропиридила, пиримидила, диазолила, пиперидинила, алкилпиперидинила, тиазолила, алкилтиазолила, тетрагидрофуранила и метилтетрагидрофуранила, возможно замещенных одним или несколькими радикалами, выбранными из атомов галогена и радикала гидроксила или алкоксила, содержащих не более 4 атомов углерода;
либо R14 и R15 образуют с атомом азота, с которым они связаны, радикал, выбранный из радикалов пирролила, пирролинила, пирролидинила, пиперазинила, алкилпиперазинила, фенилпиперазинила, морфолинила и индолинила, причем алкильные радикалы в продуктах формулы (I) могут быть прерваны одним или несколькими гетероатомами, выбранными из атомов кислорода, серы и азота, при этом атомы серы в продуктах формулы (I) могут быть окислены до сульфона или сульфоксида, причем вышеназванные продукты формулы (I) находятся во всех возможных формах рацемических изомеров, энантиомеров и диастереоизомеров, а также их солей присоединения с органическими и неорганическими кислотами или с органическими и неорганическими основаниями. Продукты формулы (I), которые определены выше, описаны в заявках на европейские патенты ЕР 465368 и ЕР 503162 и могут быть приготовлены, как описано в этих заявках.
В продуктах формулы (I):
- термин алкилрадикал, линейный или разветвленный, означает, предпочтительно, метил, этил, пропил, изопропил, бутил,
изобутил, втор-бутил и
трет-бутил, но также может быть пентилом или гексилом, и особенно изопентилом и изогексилом,
- термин алкенилрадикал, линейный или разветвленный, означает,
предпочтительно, винил, аллил,
1- пропенил, бутенил, в частности 1-бутенил, или пентенил,
- термин алкинил радикал, линейный или разветвленный, означает, предпочтительно, этинил, пропаргил,
бутинил или пентинил. Среди
алкилрадикалов, прерванных одним или несколькими гетероатомами, можно назвать, например, радикалы метоксиметил, метоксиэтоксиметил, пропилтиопропил, пропилоксипропил,
пропилтиоэтил, метилтиометил,
- термин атом галогена означает, предпочтительно, атом хлора, но может также быть атомом фтора, брома или иода,
- термин алкокси радикал, линейный или
разветвленный, означает,
предпочтительно, радикалы метокси, этокси, пропокси или изопропокси, но может также означать бутоксирадикал, линейный, вторичный или третичный,
- термин ацилрадикал
означает, предпочтительно,
радикал, содержащий от 1 до 6 атомов углерода, как, например, радикал формил, ацетил, пропионил, бутирил или бензоил, а также радикал пентаноил, гексаноил, акрилоил,
кротоноил или карбамоил.
- термин ацилоксирадикал означает, например, радикал, в котором ацилрадикал имеет значения, указанные выше, и, предпочтительно, означает формилокси, ацетилокси,
пропионилокси, бутирилокси или
бензоилокси,
- термин циклоалкил означает, предпочтительно, радикалы циклопропил, циклобутил и, в частности, радикалы циклопентил и циклогексил,
- термин арилрадикал означает
ненасыщенные радикалы, моноциклические или состоящие из конденсированных циклов, карбоциклические, причем гетероциклические радикалы могут содержать один или несколько
гетероатомов, одинаковых или
различных, выбранных из атомов кислорода, азота или серы. В качестве примера такого арилрадикала можно назвать радикалы фенил, нафтил, тиенил, такой как 2-тиенил и
3-тиенил, фурил, такой как 2-фурил,
пиридил, такой как 2-пиридил и 3-пиридил, пиримидил, пирролил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил, тиадиазолил, тиатриазолил, оксазолил,
оксадиазолил, 3- или 4-изоксазолил;
бензотиенил, такой как 3-бензотиенил, бензофурил, бензопирролил, бензимидазолил, бензоксазолил, тионафтил, индолил, индолинил или пуринил, пирролидинил, пиперидино,
морфолино, пиперазинил, причем эти
радикалы могут быть замещены одним или несколькими радикалами, такими как определены выше, и означать, например, метилпиперазинил, фторметилпиперазинил,
этилпиперазинил, пропилпиперазинил,
фенилпиперазинил или бензилпиперазинил;
- термин арилалкил означает радикалы, в которых соответственно радикалы алкил и арил могут принимать значения,
определенные выше для этих радикалов;
в качестве примеров таких арилалкильных радикалов можно назвать радикалы бензил, дифенилметил, трифенилметил, нафтилметил, инденилметил, тиенилметил,
такой как 2-тиенилметил, фурилметил, такой
как фурфурил, пиридилметил, пиримидилметил или пирролилметил, причем в неограничивающем перечне радикалов, перечисленных выше, алкилрадикал может означать
также этил, пропил или бутил, как, например,
в радикале фенилэтил;
- термин галоалкил означает, предпочтительно, радикалы, в которых алкилрадикал определен выше и замещен одним или
несколькими атомами галогена, определенными выше,
например, радикалы бромоэтил, трифторметил, трифторэтил или пентафторэтил,
- термин алкилтио означает, предпочтительно, радикалы, в которых
алкилрадикал определен выше, например, радикалы
метилтио или этилтио,
- термин галоалкилтио означает, предпочтительно, радикалы, в которых алкилрадикал определен выше и замещен одним или
несколькими атомами галогена, определенными выше,
например радикалы бромоэтилтио, трифторметилтио, трифторэтилтио или пентафторэтилтио,
- термин галоалкокси означает, предпочтительно,
радикалы, в которых алкоксирадикал определен выше и
замещен одним или несколькими атомами галогена, определенными выше, например радикалы бромоэтокси, трифторметокси, трифторэтокси или
пентафторэтокси,
- термин арилокси означает радикалы, в
которых арилрадикал определен выше, например радикал фенокси,
- термин арилтио означает, предпочтительно, радикалы, в которых
арилрадикал определен выше, например радикал фенилтио,
- термин арил, замещенный радикалом алкилтио, означает, например, радикал бензилтио или фенетилтио.
Во всех радикалах,
которые могут представлять R1, R2, R3 и R4, указанных выше, атомы серы могут быть не окислены, как в радикалах алкилтио, арилтио, циклоалкилтио, например
циклогексилтио, или, напротив, могут быть окислены с образованием
радикалов алкилсулфинил, циклоалкилсульфинил, арилсульфинил, алкилсульфонил, циклоалкилсульфонил или арилсульфонил,
циклоалкилсульфонил или арилсульфонил, причем:
- радикал алкилтио,
алкилсульфинил и алкилсульфонил означает радикалы, в которых алкилрадикал, линейный или разветвленный, может иметь значения,
указанные выше для алкилрадикала; и предпочтительно означает радикалы
метилтио, гидроксилметилтио, этилтио, аминоэтилтио, метилсульфинил, этилсульфинил, метилсульфонил, этилсульфонил, но могут также
быть радикалами пропилтио, изопропилтио, бутилтио, втор-бутилтио,
трет-бутилтио, изопентилтио или изогексилтио, или эти же радикалы, но в которых радикал тио окислен до сульфинила или сульфонила,
- термин арилтио, арилсульфинил и арилсульфонил означает
радикалы, в которых арильная часть может иметь значения, указанные выше для арила, например, фенилтио, пиридилтио или пиримидилтио,
имидазолилтио, N-метилимидазолилтио, или эти же радикалы, но в
которых радикал тио окислен до сульфинила или сульфонила, например фенилсульфинил или фенилсульфонил. Среди заместителей радикалов
алкилтио, алкокси, арилтио и арилокси, возможно окисленных, можно
назвать, например, радикалы гидроксил, алкокси, карбокси свободный, превращенный в соль или этерифицированный, ацил, ацилокси, алкил,
фенил, атомы галогена.
В качестве примера алкилрадикалов, замещенных арилрадикалом, можно назвать радикалы бензил, дифенилметил, трифенилметил, нафтилметил, инденилметил, тиенилметил, такой как 2-тиенилметил, фурилметил, например, фурфурил, пиридилметил, пиримидилметил или пирролилметил, причем в неограничивающем перечне радикалов, перечисленных выше, алкилрадикал может означать также радикал этил, пропил или бутил, как например, радикал фенэтил.
В качестве примеров алкенилрадикалов, замещенных арил-радикалом, можно назвать значения, приведенные выше для арилалкилов, в которых алкилрадикал заменен на алкенилрадикал, например радикалы фенилвинил или фенилаллил, причем в этих радикалах фенил может быть заменен на радикал нафтил, пиридил или на один из арилрадикалов, описанных выше. Арилалкилрадикалы, описанные выше, означают, предпочтительно, алкилфенилрадикалы, такие как бензил, фенэтил, а также фенилпропил и фенилбутил радикалы.
Радикалы карбамоил и аминосоединений формулы (I) означают радикалы, в которых к атому азота присоединены два радикала, одинаковых или различных, выбираемых из атома водорода с образованием аминорадикала; указанных выше алкилгрупп с образованием моноалкил- или диалкиламино радикалов, в которых алкилы, линейные или разветвленные, содержат от 1 до 6 атомов углерода; радикалов фенил, бензил, фенэтил или нафтил, причем все эти радикалы могут быть замещены, как указано выше и ниже. Когда R6 и R7, с одной стороны, R8 и R9, с другой стороны, или R14 и R15, с другой стороны, которые определены выше, образуют вместе с атомом азота, к которому они присоединены, гетероциклы, то речь идет, например, о цикле пирролила, имидазолила, индолила, индолинила, пуринила, пирролидинила, пиперидино, морфолино, пиперазинила, имидазолидинила, пиразолидинила, тиоморфолинила, азепина; эти радикалы могут при необходимости быть замещены заместителями, упомянутыми выше, и, в частности, одним или несколькими радикалами, выбранными из атомов хлора и фтора, радикалами метил, этил, изопропил, трет- бутил, метокси, этокси, пропокси, бензоил, метоксикарбонил, этоксикарбонил, как, например, в метилпиперазиниле, этилпиперазиниле, пропилпиперазиниле, фенилпиперазиниле или бензилпиперазиниле: причем в этих двух последних радикалах радикалы фенил и бензил могут быть замещены, как указано выше для радикалов арил, арилалкил и арил-алкенил, как, например, в хлорфениле или трифторфениле.
Гетероцикл, который могут образовывать R6 и R7, с одной стороны, R8 и R9, с другой стороны, или R14 и R15, с другой стороны, соответственно с атомом азота, к которому они присоединены, означает предпочтительно насыщенный гетероцикл.
Кроме того, в продуктах формулы (I) карбамоил или аминорадикалы являются такими, что радикалы, которые присоединены к атому азота, одинаковые или различные, могут представлять собой алифатические или циклические цепи или могут образовывать с атомом азота, с которым они связаны, гетероцикл, как это было описано выше для R6, R7, R8 , R9, R14 и R15.
Радикалы "замещенный карбамоил и замещенный амино" означают соответственно радикалы, в которых атом азота может быть замещен одним или двумя радикалами, выбранными среди радикалов, описанных выше, в частности одним или несколькими алкилами, описанными выше, и означать моноалкиламино, в частности метиламино, этиламино или изопропиламино или, диалкиламино, в частности диметиламино, диэтиламино или метилэтиламино, причем эти алкилрадикалы могут быть сами замещены, как указано выше, и, например, означать радикалы метоксиметил, метоксиэтил, этоксиэтил.
В качестве неограничивающего примера радикал карбамоил означает радикалы карбамоила, замещенные на атоме азота одним или двумя радикалами алкила, возможно замещенными, как указано выше, с образованием, в частности, группы N-моноалкилкарбамоила, такой как N-метилкарбамоил, N-этилкарбамоил, или группы N, N-диалкилкарбамоила, такой как N, N-диметилкарбамоил, N,N-диэтилкарбамоил; или группы N-(гидроксиалкил) карбамоил, такой как N-(гидроксиметил) карбамоил, N-(гидроксиэтил) карбамоил, фенилкарбамоил; или с образованием пиридилкарбамоила; бензилкарбамоила; N-метил-N-фенилкарбамоила; пиридилметилкарбамоила. С другой стороны, в качестве замещенных алкилрадикалов можно назвать также алкилы, замещенные карбамоильным радикалом, описанным выше, с образованием группы карбамоилалкила, такой как карбамоилметил или карбамоилэтил.
Радикал амино может быть радикалом алкоксикарбониламино, причем этот радикал предпочтительно является радикалом трет-бутилоксикарбониламино или радикалом бензилоксикарбониламино. Радикалы амино и карбамоил могут быть, в частности, замещены одной или двумя аминокислотами, выбранными из 20 природных аминокислот, таких как пролин или, например, глицин, аланин, лейцин, изолейцин, валин или фенилаланин или из других природных аминокислот, известных специалисту.
В зависимости от значения m1, равного 0, 1, 2, или 4, радикал -(CH2)m - будет означать простую связь, радикал метилен, радикал этилен, пропилен, изопропилен или бутилен.
Радикал или радикалы карбокси в соединениях формулы (I) могут быть превращены в
соль или этерифицированы различными группами или агентами, известными специалисту, среди
которых можно отметить, например:
- для образования солей - минеральные основания, такие как,
например, один эквивалент натрия, калия, лития, кальция, магния или аммония, или органические
основания, такие как, например, метиламин, пропиламин, триметиламин, диэтиламин, триэтиламин, N,
N-диметилэтаноламин, трис(гидроксиметил) аминометан, этаноламин, пиридин, пиколин, дициклогексиламин,
морфолин, бензиламин, прокаин, лизин, аргинин, гистидин, N-метилглюкамин,
- из
этерифицирующих групп - алкильные радикалы, образующие группы алкоксикарбонильные, такие как, например,
метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил или бензилоксикарбонил, причем эти
алкильные радикалы могут быть замещены радикалами, выбранными, например, из атомов галогена, радикалов гидрокси,
алкокси, ацил, ацилокси, алкилтио, амино или арил, и означать, например, хлорметил,
гидроксипропил, метоксиметил, пропионилоксиметил, метилтиометил, диметиламиноэтил, бензил или фенетил.
Соли присоединения с минеральными или органическими кислотами продуктов формулы (I) могут быть, например, соли, образованные с такими кислотами, как хлорводородная, бромводородная, иодводородная, азотная, серная, фосфорная, пропионовая, уксусная, муравьиная, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная, щавелевая, глиоксиловая, аспарагиновая, аскорбиновая, кислоты алкилмоносульфоновые, такие как, например, кислота метансульфоновая, этансульфоновая, пропансульфоновая, кислоты алкилдисульфоновые, такие как, например, кислота метандисульфоновая, кислота альфа, бета-этандисульфоновая, кислоты арилмоносульфоновые, такие как бензолсульфоновая, и арилдисульфоновые кислоты.
Когда оба R2 и R3 представляют собой
серосодержащие группы, причем R2 и R3 одинаковы или различны, в
предпочтительных соединениях эти серосодержащие группы необязательно имеют одну и ту же степень окисления. Так,
R2 и R3 могут представлять собой радикалы алкилтио, замещенные
одним или несколькими атомами галогена, такими как хлор и фтор, например, радикалы:
-S-CF3;
-S-CHF2; -SCH2F; -S-CF2-CHF2; -S-CF2-CF3
В частности, изобретение касается указанного выше применения соединений формулы (I),
описанных выше и соответствующих формуле (IA):
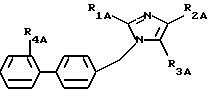
где R1A - алкил или алкилтио, линейный или разветвленный, содержащий не более 6 атомов углерода,
R2A - представляет:
а) радикалы -S-RA и
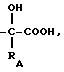
в которых RA - алкил или алкенил, линейный или разветвленный, содержащий не более 8 атомов углерода, циклоалкил или фенил, причем эти радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогенов, в частности фтором,
б) атом галогена,
в) радикал
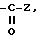
где Z - карбоксирадикал, свободный, превращенный в соль или этерифицированный;
R3A представляет:
- карбоксирадикал, свободный, превращенный в соль, этерифицированный или амидированный,
- формил и ацетилрадикал, при необходимости, замещенный радикалом фенил, бензил, фенэтил или тетразолил,
- атом галогена,
- алкил, алкенил или алкилтио, линейный или разветвленный, содержащий не более 8 атомов углерода, при необходимости, замещенный одним или несколькими атомами, выбранными из радикалов: гидроксил, алкокси, ацил, фенил, карбокси свободный, превращенный в соль, этерифицированный или амидированный; карбамоил и амино, при необходимости, замещенные на атоме азота одним или несколькими радикалами, выбранными из алкилрадикалов, содержащих не более 6 атомов углерода, радикалов ацил, алкисульфонил, фенилсульфонил, фенил, фенилалкил, причем эти радикалы, при необходимости, замещены одним или несколькими радикалами, выбранными из атомов галогена, гидроксирадикала и алкоксирадикалов, линейных или разветвленных, содержащих не более 4 атомов углерода;
R4A означает SO2-WA-R16A, где WA - представляет радикал -NH-, NH-CO-, -NH-CO-O-,
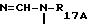
или -NH-CO-NH- и R16A и R17A представляют атом водорода, радикал алкил или алкенил, линейный или разветвленный, содержащий не более 4 атомов углерода, или радикал арил, причем эти радикалы при необходимости замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидрокси, алкокси, содержащих не более 4 атомов углерода, нитро, циано, амино, моно- и диалкиламинов, карбокси, свободного, превращенного в соль или этерифицированного, циклогексил, циклогексенил, пиридил, тиенил и фенил, причем эти радикалы, при необходимости, замещены атомом галогена или радикалом гидрокси или алкокси, содержащим не более 4 атомов углерода, при этом атомы серы в продуктах формулы (IA), при необходимости, могут быть окислены до сульфона или сульфоксида, причем продукты формулы (IA) находятся во всех возможных формах рацемических изомеров, энантиомеров и диастереоизомеров, а также их солей присоединения с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
Радикал SO2-WA-R16A, который представляет R4A, может
представлять следующие радикалы:
SO2NH2, - SO2-N=CH-N(CH3)2, -SO2
-NH-CO-CF3,
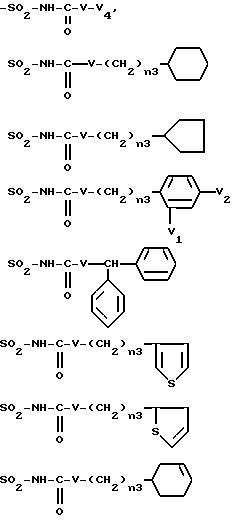
-SO2-NH-V-CH2-CH=CH2
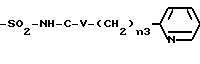
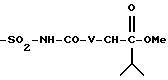
где n3 означает целое число между 0 и 3, V представляет - NH-, -О- или простую связь, V1 и V2, одинаковые или различные, представляют атом водорода, атом галогена, а именно хлора и фтора, и радикал алкокси, а именно метокси, V4 представляет атом водорода, радикал алкил, такой как метил, этил, пропил и бутил.
Более конкретно изобретение касается
использования следующих соединений формулы (I),
обозначаемых
соответственно от P1 до P13:
-2-бутил-1-[(2'-(((((циклогексилметил)амино)карбонил) амино)сульфонил)(1,
1'-бифенил)4-ил)метил]
4-(метилтио)1H- имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'- (((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'- бифенил)4-ил)метил]
1H-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'-(((((1 -β- фениллпропил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1H-имидазол-5-карбоновая кислота,
-2-бутил-.4(метилтио)-1- [(2'-(((((1-(4-фенилбутил)амино)карбонил)амино)сульфонил) (1,1'-бифенил)4-ил)метил] 1H-имидазол-5-карбоновая кислота,
-2-бутил-1-[(2'-((((((4- метокси)фенилметил)амино)карбонил)амино)сульфонил)(1,1'- бифенил)4-ил)метил] 4-метилтио-1H-имидазол-5-карбоновая кислота,
-2-бутил-1-[(2'-((((((4-фтор)фенилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил] 4-метилтио-1H- имидазол-5-карбоновая кислота,
-2-бутил-1-[(2'-(((((1-(1- карбокси-2-фенил)этил)амино)карбонил)амино)сульфонил (1, 1'-бифенил)4-ил)метил] 4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'-((((2- тиенил)метоксикарбонил)амино)сульфонил)(1,1'-бифенил)4-ил) метил]1H-имидазол-5-карбоновая кислота,
-2-бутил-4
(метилтио)1- [{2'-((((3-тиенил)метоксикарбонил)амино)сульфонил)(1,1' - бифенил)4-ил)метил] 1H-имидазол-5-карбоновая кислота,
-2-бутил-1-(2'-((((циклогексен-4-ил)метоксикарбонил)амино)
сульфонил)(1, 1'-бифенил)4-ил)метил]4-метилтио-1Н-имидазол-5- карбоновая кислота,
-2-бутил-1-(2' - ((((циклогексил)метоксикарбонил)амино)сульфонил)(1,
1'- бифенил)4-ил)метил]4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутилтио-4-(метилтио)-1- [(2'-(((фенилметоксикарбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил]
1Н-имидазол-5- карбоновая кислота,
-((4'-((2-бутил-5-формил-4-метокси-1Н- имидазол-1-ил)метил)(1,1'-бифенил)2-ил)сульфонил) карбамат(фенилметилена).
Соединения, указанные выше, могут быть получены, как указано в заявке на европейский патент ЕР 0503162.
Среди соединений формул (I) и (IA) некоторые соединения формулы (IB) являются новыми. Таким образом,
изобретение относится также к соединениям формулы IB
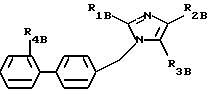
где R1B - алкильный радикал, линейный или разветвленный, содержащий не более 4 атомов углерода,
R2B - радикал алкилтио, линейный или разветвленный, содержащий не более 4 атомов углерода, при необходимости замещенный одним или несколькими атомами фтора,
R3B представляет:
- карбоксирадикал, свободный, превращенный в соль, этерифицированный или амидированный,
- ацил, карбамил,
- алкил и алкенил, содержащий не более 6 атомов углерода, замещенный одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидрокси, алкокси, карбокси, свободного, превращенного в соль, этерифицированного или амидированного, фенила и карбамила, при необходимости замещенного фенилом или бензилом.
R4B представляет радикал
-SO2-NH2, -SO2-N=CH-N(CH3)2,
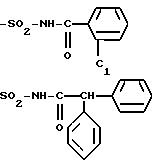
SO2-NH-CO2Et, SO2-NH-CO2Pr, -SO2-NH-CO2Bu, -SO2-NH-CO2H,
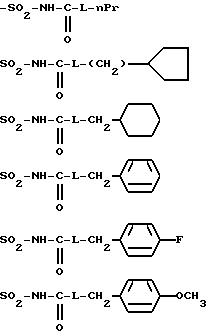
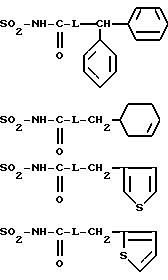
где L означает -О- или -NH-, при этом атомы серы в соединениях формулы (IB) могут, при необходимости, быть окислены до сульфона или сульфоксида, причем названные соединения находятся во всех возможных формах рацемических изомеров, энантиомеров и диастереоизомеров, также их солей присоединения с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
Объектом изобретения были продукты
формулы (IB), в частности те, что определены выше, отвечающие следующим формулам:
-2-бутил -α-гидрокси-α- метил-4-(метилтио)1-[(2'-((((фенилметокси) карбонил)амино)сульфонил)(1,
1'-бифенил)4-ил) метил] 1H-имидазол-5-уксусная кислота,
-2-бутил -α-гидрокси-α- метил-4-(метилтио)1-[(2'- ((((пропиламино)карбонил)амино)сульфонил) (1,1'-бифенил)4-ил)метил]
1H-имидазол-5-уксусная кислота,
-2-бутил-α-гидрокси-α- метил-4-(метилтио)1-[(2'- (((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1H-имидазол-5-уксусная
кислота,
-2-бутил-1-[(2'-(((((циклогексилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил] -α-гидрокси-α- метил- 4-(метилтио)1H-имидазол-5-уксусная кислота,
-1-[(2'-(((фенилметил)амино)сульфонил)(1,1'-бифенил) 4-ил)метил] α- гидрокси-4-(метилтио)-2-пропил-1H-имидазол-5- уксусная кислота,
-1-[(2'-(((((циклогексилметил)амино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил] 4-(метилтио)2-пропил-1H- имидазол-5-карбоксилат натрия,
-4-(метилтио)-1-[(2'- (((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'- бифенил)4-ил)метил] 2-пропил-1H-имидазол-5-карбоновая кислота.
-α-бутил-α
- гидрокси-4-метилтио)-1-[(2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил) метил] 2-пропил-1H-имидазол-5-ацетат натрия,
-α-гидрокси-4-метилтио-α
- фенил-1-[(2'- (((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'- бифенил)4-ил)метил] 2-пропил-1H-имидаэол-5-уксусная кислота,
1-1-[(2'-(((((циклогексилметил)амино)карбонил)амино)
сульфонил)(1,1'-бифенил)4-ил)метил] -4-((дифторметил) тио)-2 пропил-1H-имидазол-5-карбоновая кислота,
-4-((дифторметил)тио)-1-[(2'-(((((фенилметил) амино) карбонил)амино)сульфонил) (1,
1'-бифенил)4-ил)метил]2-пропил-1H- имидазол-5-карбоновая кислота,
-4-((дифторметил)тио) 2- пропил-1-[(2'-(((((тиенилметил) амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил]
1H-имидазол- 5-карбоновая кислота,
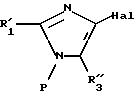
Объектом изобретения является также способ получения соединений формулы (I), определенной выше, заключающийся в том, что:
либо соединение формулы
II
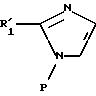
в которой R'1 имеет значение, указанное выше для R1, в котором возможные реакционноспособные функции, при необходимости, защищены защитными группами, а P представляет защитную группу атома азота, подвергают галогенированию с образованием соединения формулы III:
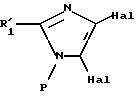
где R'1 и P имеют значения, указанные выше, и Hal представляет атом галогена, которое подвергают реакции обмена галоген - металл с одним из атомов галогена, затем взаимодействию с соединением формул (IVa), (IVb), (lVc), (lVd) или (IVe):
(-S-R')2 (IVa) или MeSO2SR' (IVb)
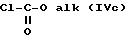
или
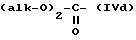
или
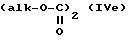
в которых R' имеет значение, указанное выше для R, в котором возможные реакционноспособные функции, при необходимости, защищены защитными группами, a alk представляет алкильный радикал, содержащий не более 4 атомов углерода, с образованием соединения формулы V
где R'1, P и Hal имеют значения, указанные выше, и R''3 представляет S-R' или K-O-alk, как определено выше, и K представляет радикал
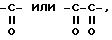
причем соединение формулы (V) можно подвергнуть реакции обмена галоген - металл на атоме галогена, затем взаимодействию с соединением формул (IV'a), (IV'b), (IV'c), (IV'd) или IV'e
(-S-R'')2 (IV'a) или MeSO2SR'' (IV'b)
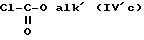
или
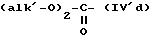
или
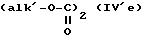
в которых R'', одинаковый или отличный от R', имеет значение, указанное выше для R, в котором возможные реакционноспособные функции, при необходимости, защищены защитными группами, а alk', одинаковый или отличный от alk, представляет алкильный радикал, содержащий не более 4 атомов углерода, с образованием соединения формулы VII
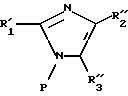
в которой R'1 и P имеют указанные выше значения и R''2 и R''3, одинаковые или различные, представляют -S-R', -S-R'', -K-O-alk или -K-O-alk', определенные выше, в которых R', R'', alk, alk' и K имеют значения, указанные выше, затем соединение формулы (VII), в котором освобождают блокированную аминофункцию, вводят в реакцию с соединением формулы VIII
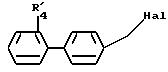
в которой R'4 имеет значение, указанное выше для R4, в котором возможные реакционноспособные функции могут быть защищены защитными группами, и Hal представляет атом галогена с образованием соединения формулы I1
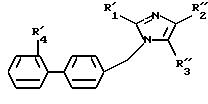
где R'1, R''2, R''3 и R'4 имеют значения, указанные выше, либо соединение формулы IX
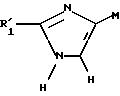
в которой R'1 имеет указанное выше значение, и М представляет атом водорода или радикал R'2, который имеет значение, указанное выше для R2, в котором реакционные функции, при необходимости, защищены защитными группами,
подвергают реакции с соединением формулы (VIII), определенным выше, с образованием соединения формулы X
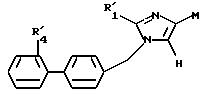
в которой R'1, M и R'4 имеют значения, указанные выше, соединение формулы (X), в случае, когда М представляет R'2, определенный выше, подвергают галогенированию с образованием соединения формулы XI
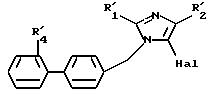
в которой R', R'2, R'4 и Hal имеют указанные выше значения, полученное соединение подвергают реакции обмена галоген - металл, затем взаимодействию с соединением формулы XII
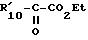
в которой R'10 имеет значение, указанное выше для R10, в котором возможные реакционные функции, при необходимости, защищены защитными группами, с образованием соединения формулы I2
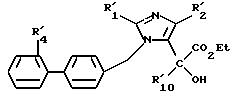
в которой R'1, R'2, R'4 и R'10 имеют значения, указанные выше, и
либо соединение формулы (I2) омыляют с образованием соединения формулы I4
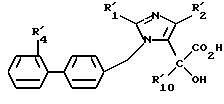
в которой R'1, R'2, R'4 и R'10 имеют значения, указанные выше, или соединение формулы (X), в случае, когда М представляет атом водорода, подвергают галогенированию с образованием соединения формулы XIV
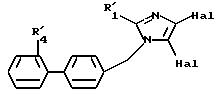
где R'1, R'4 и Hal имеют указанные выше значения, которое можно подвергнуть реакции обмена галоген - металл, затем взаимодействию с соединением формул (IVa), (IVb), (IVc), (IVd), или (IVe), определенных выше, с образованием соединения формулы I7
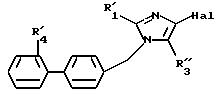
в которой R'1, R'4, Hal и R''3 имеют указанные выше значения, полученное соединение формулы (I7) подвергают реакции обмена галоген - металл, затем взаимодействию с соединением формул (IV'a), (IV'b), (IV'c), (IV'd) или (IV'e), определенных выше, с образованием соединения формулы I8
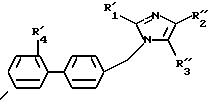
в которой R'1, R'4, R''2 и R''3 имеют значения, указанные выше,
либо соединение формулы XX
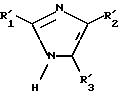
в которой R'1 и R'2 имеют значения, указанные выше, и R'3 имеет значение, указанное выше для R3, в котором возможные реакционные функции, при необходимости, защищены защитными группами, подвергают взаимодействию с соединением формулы (VIII), определенным выше, с образованием соединения формулы I'
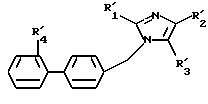
в которой R'1 и R'2, R'3 и R'4 имеют значения, указанные выше,
соединения формул (I1), (I2), (I3), (I4), (I5), (I6) (I7), (I8) и (I'), которые являются соединениями формулы (I), выделяют или для получения других соединений формулы (I) их подвергают одной или нескольким реакциям преобразования в любом порядке, а именно:
а) этерификации кислотной функции,
b) омылению эфирной функции в кислотную функцию,
с) преобразование эфирной функции в ацильную функцию,
d) преобразованию цианофункции в кислотную функцию,
е) преобразованию кислотной функции в амидную функцию, затем, при необходимости, в тиомидную функцию,
f) восстановлению карбоксифункции до спиртовой функции,
g) преобразованию алкоксифункции в гидрокси функцию или гидрокси функцию в алкоксифункцию,
h) окислению спиртовой функции до альдегида кислоты или кетона,
i) преобразованию формильного радикала в карбамильный радикал,
J) преобразованию карбамильного радикала в нитрильный радикал,
k) преобразованию нитрильного радикала в тетразолил,
l) окислению группы алкилтио или арилтио до сульфоксида или сульфона соответственно,
m) преобразованию сульфида, сульфоксида или сульфона в соответствующий сульфоксимин,
n) преобразованию оксофункции в тиоксо,
o) дегидратации гидроксилалкильного радикала в алкенильный радикал,
p) преобразованию кислотной функции в функцию:
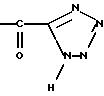
q) преобразованию β - кето-сульфоксида в α- кето-тио-эфир,
r) преобразованию карбамата в мочевину и, в частности, сульфонилкарбамата в сульфонилмочевину,
s) удалению защитных групп, которые могут нести реакционные защищенные функции,
t) солеобразованию минеральной или органической кислотой или основанием для получения соответствующей соли,
u) разделению путем фракционной кристаллизации рацемических форм на расщепленные соединения, причем полученные таким образом соединения формулы (I) имеют все возможные формы рацемических изомеров, энантиомеров и диастереоизомеров.
В предпочтительных условиях осуществления изобретения реакцию галогенирования соединений формул (II) и (X), определенных ранее, до получения соединений формул (III) и (XI) или (XIV), определенных выше, осуществляют в обычных условиях, известных специалисту, а именно, бромированием с помощью N-бромосукцинимида в дихлорметане или брома в уксусной кислоте.
Соответствующее соединение формулы (V) может быть получено взаимодействием соединения формулы (III), определенного выше, с металлорганическим соединением, таким как н-бутиллитий, в растворителе, таком как тетрагидрофуран, при температуре около -78oC с последующим взаимодействием с соединением формул (IVa), (IVb), (IVc), (IVd) или (IVe).
Реакция соединения формулы (V), определенного выше, с соединением формул (IV'a), (IV'b), (IV'c), (IV'd) или (IV'e), определенного выше, для получения соединения формулы (VII), определенного выше, может быть осуществлена тем же способом с использованием н-бутиллития в качестве металлорганического соединения.
Аминофункция соединения формулы (VII), определенного выше, защищенная группой P, определенной выше, может быть освобождена при обычных условиях, известных специалисту, а именно, когда P представляет радикал -CH2-O-(CH2)-Si(CH3)3, воздействием трифторуксусной кислоты или в присутствии иона фторида.
В соединении формулы (VIII) Hal представляет предпочтительно атом брома, но может также представлять атом хлора или иода.
Реакция соединения формулы (VIII) с соединением формул (VII), (IX) или (XX) может быть осуществлена в растворителе, таком как, например, диметилформамид или диметилацетамид, тетрагидрофуран, диметоксиэтан или диметилсульфоксид при температуре рефлюкса растворителя или при комнатной температуре предпочтительно при перемешивании; реакция осуществляется предпочтительно в присутствии основания, например гидрида натрия или калия, карбоната натрия или калия, метилата, этилата или трет-бутилата натрия или калия.
Соединение формулы (I2), определенное выше, получают взаимодействием соединения формулы (XII), определенного выше, с магнийорганическим производным соединения формулы (XI) в растворителе, таком как тетрагидрофуран или толуол.
Магнийорганическое производное соединения формулы (XI) получают воздействием определенного выше соединения формулы (XI), в которой Hal может, например, представлять атом брома, на магнийорганическое соединение, например изопропилхлорид магния, в растворителе таком, как, например, толуол. Реакция омыления продукта формулы (I2), определенного выше, до продукта формулы (I4), определенного выше, может быть осуществлена обычными методами, известными специалисту, например, в присутствии едкого натра или едкого калия, или карбоната цезия, в растворителе, таком как метанол, этанол, диоксан или диметоксиэтан.
Реакция преобразования соединения формулы (XIV), определенного выше, в соединение формулы (I7), определенное выше, затем в соединение формулы (I8), определенное выше, может быть осуществлена в тех же условиях, которые указаны для получения соединений формул (V) и (VII), определенных выше, исходя из соединения формулы (III), определенной выше.
В соответствии со значениями R'1, R'2, R''1-2, R'3, R''3 и R'4 производные формул (I1), (I2), (I4), (I7), (I8) и (I') могут являться соединениями формулы (I) или быть преобразованы в другие продукты формулы (I) при осуществлении одной или нескольких реакций от a) до u), указанных выше.
Таким образом, различные реакционные функции некоторых продуктов описанных выше реакций могут при необходимости быть защищены: речь идет, например, о радикалах гидроксил, ацил, свободный карбокси или амино и моноалкиламино, которые могут быть защищены соответствующими защитными группами.
Неограничивающий перечень защитных групп реакционных функций приведен ниже:
- гидроксильные группы могут быть защищены, например,
алкильными радикалами, такими как трет-бутил,
триметилсилил, трет-бутилдиметилсилил, метоксиметил, тетрагидропиранил, бензилили ацетил;
- аминогруппы могут быть защищены, например,
радикалами ацетил, тритил, бензил, трет-бутоксикарбонил,
фталимидо или другими радикалами, известными в химии пептидов;
- ацильные группы, такие как формильная группа, могут быть защищены,
например, в форме кеталей или тиокеталей циклических или
нециклических, таких как диметил или диэтилкеталь или этилендиоксикеталь, диэтилтиокеталь или этилендитиокеталь;
- кислотные функции
описанных выше соединений могут быть амидированы первичным
или вторичным амином, например, в метиленхлориде в присутствии, например, хлоргидрата 1-этил-3-(диметиламинопропил)карбодиимида при
комнатной температуре;
- кислотные функции могут быть
защищены, например, в виде сложных эфиров, образованных с легко расщепляемыми эфирами такими, как эфиры бензиловые или трет-бутиловые
или эфиры, известные в химии пептидов.
Соединения формулы (I1), (I2), (I4), (I7), (I8), (I1'), определенные выше, могут быть подвергнуты реакциям, таким как описано ниже.
a) Этерификация возможных карбоксифункций соединений, описанных выше, может быть осуществлена обычными методами, известными специалисту.
b) Преобразование эфирных функций в кислотные функции описанных выше соединений может осуществляться при обычных условиях, известных специалисту, а именно, кислотным или щелочным гидролизом, например гидролизом с помощью едкого натра или едкого кали в спиртовой среде, например, в метаноле, или с помощью серной или соляной кислоты.
c) Реакция
присоединения по эфирной функции
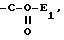
в которой E1 может представлять радикал алкил или арил, при необходимости, замещенный и при необходимости защищенный в виде ацильной функции
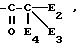
может быть осуществлена, в частности, действием карбонаниона
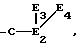
в котором E2, E3 и E4 одинаковые или различные, выбранными из атома водорода, радикалов алкил, алкилтиоарил, алкилсульфоксид, арилсульфоксид, алкилсульфон, ацил, карбокси свободный, превращенный в соль, этерифицированный или амидированный, причем радикалы алкил, алкилтио и арил могут быть замещены и защищены, как указано выше.
Подобная реакция осуществляется так, как описано в экспериментальной части, или согласно обычным методам, известным специалисту.
d) Цианофункции соединений, описанных выше, могут быть преобразованы в кислотные функции при обычных условиях, известных специалисту, например, двойным гидролизом в кислой среде, например, в смеси серной кислоты, ледяной уксусной кислоты и воды, причем эти три ингредиента берутся предпочтительно в равных частях, или же в смеси едкого натра, этанола и воды при температуре рефлюкса.
е) Реакция преобразования кислотной функции в амидофункцию может быть осуществлена, в частности, путем образования сначала хлорангидрида кислоты в обычных условиях, известных специалисту, и, например, воздействием SOCl2, затем амидированием, как указано выше, или прямым амидированием указанной выше кислоты.
Так, радикал
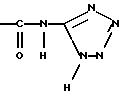
можно получить, преобразуя кислотную функцию в хлорангидрид кислоты, а именно, действием SOCl2 в растворителе, например в толуоле или бензоле, затем действием амина формулы
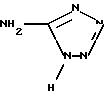
Амид, полученный таким образом, может быть преобразован в тио-амид, в частности, действием реактива Лавессона в толуоле.
f) Карбоксифункции, свободные или этерифицированные, описанных выше соединений могут быть восстановлены до спиртовых функций методами, известными специалисту: этерифицированные карбоксифункции могут быть восстановлены до спиртовых функций методами, известными специалисту, а именно, гидридом лития и алюминия в растворителе, таком как, например, тетрагидрофуран, диоксан или этиловый эфир.
Свободные карбоксифункции соединений, описанных выше, могут быть восстановлены до спиртовых функций, например, гидридом бора.
g) Алкоксифункции, такие как метокси, описанных выше соединений могут быть преобразованы в гидроксильные функции в обычных условиях, известных специалисту, например, трибромидом бора в растворителе, таком как, например, метиленхорид, а также бромгидратом или хлоргидратом пиридина, бромводородной или хлорводородной кислотой в воде, или трифторуксусной кислотой при температуре рефлюкса.
h) Спиртовые функции вышеописанных соединений могут быть преобразованы в альдегидные или кислотные функции окислением в обычных условиях, известных специалисту, например, оксидом марганца для получения альдегидов, или реактивом Джонса для получения кислот.
i)j) Реакции преобразования формилрадикала в радикал карбамоил и радикала карбамоил в радикал нитрил осуществляют, в частности, для R3 и R4 в обычных условиях, известных специалисту, например, через получение кето-нитрила и замещением на амин (Chem. Comm. 1971, р. 733).
k) Возможные нитрильные функции описанных выше соединений могут быть преобразованы в тетразолил в обычных условиях, известных специалисту, например, путем циклоприсоединения с азидом металла, например, с азидом натрия или с азидом триалкилолова к нитрильной функции, как указано в методе, описанном в публикации J. Organometallic Chemistry., 33, 337(1971) KOZIMA S.& coll.
1) Алкилтио и арилтиогруппы описанных выше соединений могут быть преобразованы в соответствующие сульфоксидные или сульфоновые группы при обычных условиях, известных специалисту, например, перкислотами, например, перуксусной кислотой или метахлорпербензойной кислотой, или озоном, оксоном, периодатом натрия в растворителе, таком как метиленхлорид или диоксан, при комнатной температуре.
Получению сульфоксидной функции может благоприятствовать эквимолярная смесь продукта, содержащего алкилтио или арилтиогруппу, и с таким реактивом, как перкислота.
Получению сульфоновой функции благоприятствует смесь продукта, содержащего алкилтио или арилтио группу, и с избытком такого реактива, как перкислота.
m) Возможные сульфидные, сульфоксидные или сульфоновые функции описанных выше соединений могут быть преобразованы в соответствующие сульфоксиминовые функции при обычных условиях, известных специалисту: ниже описаны неограничивающие примеры получения соединений, содержащих сульфоксиминовые группы. Так, например, для получения соединений таких как, например, N- (арилсульфонил)сульфоксимины, например, в случае, когда арильной группой является толуольный радикал, сульфоксимин может быть получен взаимодействием азида паратолуолсульфонила и соответствующего сульфоксида, т.е. -S(O)CH3, предпочтительно в присутствии меди, как указано, например, в публикации J.A. C.S., 95, pp. 42-87 (1973) JOHNSON C.R.& coll.
Другой используемый метод состоит в обработке N-тозилсульфилимина, полученного из сульфида действием на него, например, хлорамина "Т", окислителем, например, гипохлоридом натрия в условиях переноса фаз, как описано в публикации J.Org. Chem., 49, pp. 2282 (1984) AKUTAGAWA К. & coll.
n) Реакция преобразования оксофункции в тиоксофункцию может быть осуществлена, в частности, реактивом Лавессона в условиях, определенных выше.
o) Реакция дегидратации гидроксиалкильного радикала в алкенил может быть осуществлена с помощью кислоты, такой как соляная концентрированная или серная кислота в спирте или диоксане.
p) Реакция преобразования кислотной функции
в тетразолилкарбоксифункцию
может быть осуществлена предварительным преобразованием кислотной функции в хлорангидрид кислоты, как указано выше, затем взаимодействием цианида меди при обычных условиях,
известных специалисту, с
полученным хлоридангидридом кислоты, получая таким образом радикал
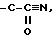
который затем можно преобразовать в радикал
например, действием соединения Sn(Bu)3 N3 в толуоле,
q) реакция преобразования функции β-кето сульфоксид в функцию α-кето тиоэфир может быть осуществлена бромированием кетосульфоксида в положении альфа, например, действием N-бромсукцинимида в метиленхлориде, затем реакцией ПУММЕРЕР, осуществленной в смеси трифторуксусной кислоты и метиленхлорида, или смеси серной кислоты и диоксана.
В частности,
как было указано выше, в пунктах (с) и (q) можно осуществить ряд реакций по следующей схеме:
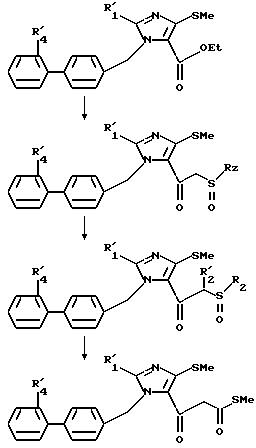
в этих соединениях R'1 и R'4 имеют значения, указанные выше, и Rz и R'z, одинаковые или различные, представляют радикал алкил или арил, при необходимости, замещенный как указано выше.
Эта схема иллюстрирована ниже в экспериментальной части под названием "Приготовление 4".
r) Реакция преобразования карбамата в мочевину и, в частности, сульфонилкарбамата в сульфонилмочевину может быть осуществлена, например, при температуре рефлюкса растворителя, например толуола, в присутствии соответствующего амина.
s) Удаление защитных групп, например, указанных выше, может быть осуществлена при обычных условиях, известных специалисту, а именно кислотным гидролизом с помощью такой кислоты, как соляная кислота, бензолсульфокислота или пара-толуолсульфокислота, муравьиная или трифторуксусная кислота, или же каталитическим гидрированием. Фталимидная группа может быть удалена с помощью гидразина.
Перечень различных используемых защитных групп приведен, например, в патенте BF 2499995.
t) Описанные выше соединения могут быть переведены в соль, например, действием органической или неорганической кислоты, или органического или неорганического основания согласно методам, известным специалисту.
u) Возможные оптически активные формы описанных выше соединений могут быть получены разделением рацематов согласно обычным методам, известным специалисту.
Описанные реакции проиллюстрированы ниже в примерах приготовления.
Некоторые исходные продукты формул (II), (IX) и (XX) известны и могут быть получены, например, как указано в европейском патенте ЕР 168950.
Другие исходные продукты формул (II), (IX) и (XX) могут быть получены согласно европейскому патенту ЕР 0465368, или как описано в примерах приготовления 1-5.
Некоторые исходные продукты
формул (II), (IX) и (XX) выпускаются в продажу,
такие, как, например: следующие соединения формулы (II):
- 2-фенилимидазол
- 2-метоксиметилимидазол
- 2-пропилимидазол
- 2-изопропилимидазол
- 2-этилимидазол
- 2-метилимидазол
соединения формулы (IX):
- 4-метил-2-фенилимидазол
- 2,4-диметилимидазол
- 2-этил-4-метилимидазол.
Примеры продуктов формулы (XX), выпускаемых в продажу, приведены в патентах ЕР 0465368 или ЕР 0503162.
Кроме того, некоторые соединения формул (II), (IX) и (XX) могут быть получены из других соединений формул (II) или (IX), если их подвергнуть одной или нескольким реакциям, описанным выше в пунктах a) - u).
Некоторые
соединения формул (IX) и (XX) могут быть также
получены моногалогенированием вышеописанного соединения формулы (II) с получением соединения формулы P1
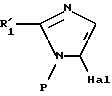
в которой R'1 и P имеют значения, указанные выше для соединения формулы (II), затем продукт формулы (P1) после реакции обмена галоген - металл подвергают реакции взаимодействия с электрофильным соединением по методам, известным специалисту, в частности, как это описано выше для преобразования соединения формулы (III) в соединение формулы (V).
Используя тот же способ, можно получить некоторые соединения формул (IX) и (XX) исходя из соединения формулы (III), определенного выше. Можно
также отметить, что
соединение формулы
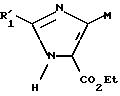
в которой R'1 и М имеют указанные выше значения, описанное в ЕР 0465368, может быть подвергнуто термическому омылению и затем декарбоксилированию с получением соединения формулы (IX), определенного выше.
Эта реакция описана ниже в экспериментальной части.
Соединения формулы (III), в которых R'1 представляет радикал алкилтио, могут быть получены либо из соединений формулы (II), так, как описано выше, либо из промышленных продуктов таких, как 2,4,5-трибромимидазол или 4,5-дибром-2- фенилимидазол так, как описано выше для преобразования соединения формулы (III) в соединение формулы (V).
Исходные соединения формулы (VIII) имеются в продаже или их получают согласно обычным методам, известным специалисту.
Исходные соединения формул (IVa), (IVb),
(lVc), (lVd),
(lVe), (XII) и (XV) коммерчески доступны, в частности, соединения формулы (IVa) такие, как втор-фторбутилдисульфид, этил-дисульфид, изопропилдисульфид, метилдисульфид, бензилдисульфид,
фенилдисульфид,
пропилдисульфид;
- соединение формулы (IVb), такое как метилметантиосульфонат;
- соединения формулы (IVc), такие как метилхлорформиат, бензилхлорформиат,
изобутилхлорформиат,
этилхлорформиат, N-пропилхлорформиат;
- соединения формулы (IVd), такие как диметилкарбонат, диэтилкарбонат;
- соединения формулы (IVe), такие как
ди-трет-бутилоксалат, диэтилоксалат,
диметилоксалат;
- соединения формулы (XII), такие как этилтиофен-2-глиоксилат, этил-3-метил-2-оксобутират, этилфенилглиоксилат, метилпируват,
метилбензилформиат;
- соединения
формулы (XV), такие как метилизоцианат, 2-карбометоксифенилизоцианат, бензилизоцианат, циклогексилизоцианат, N-пропилизоцианат, аллилизоцианат,
фенилизоцианат.
Способ получения некоторых соединений формулы (VIII) описан, в частности, в европейском патенте ЕР 0465368.
Примеры получения соединений формулы (VIII) описаны также в литературе и примеры их приведены, в частности, в патенте US 4880804, или, например, в публикации Chemistry and Industry, 7 September, 1987, HOWARD and COLQUHOUN, стр. 612-617.
Соединения формулы (IB), описанные выше, а также их соли присоединения с кислотами имеют интересные фармакологические свойства.
Соединения обладают антагонистическими свойствами к рецептору ангиотензина II и являются, таким образом, ингибиторами действия ангиотензина II, в частности, сосудосужающего эффекта и трофического эффекта на уровне миоцитов.
Эти свойства обосновывают их применение в терапии, изобретение, таким образом, касается применения в качестве медикаментов соединений формулы (IB), определенной выше, причем соединения формулы (IB) представлены во всех возможных рацемических или оптически активных изомерных формах, а также их солей присоединения с органическими и неорганическими фармацевтически приемлемыми кислотами.
Более конкретно,
изобретение касается применения в качестве медикаментов соединений, описанных ниже в примерах, и, в частности, следующих
соединений формулы (IB):
- 2-бутил-α
-гидрокси-α-метил-4-(метилтио)-1-[(2'- ((((фенилметокси)карбонил)амино)сульфонил)(1,1'- бифенил)4-ил)метил]1H-имидазол-5-уксусная
кислота,
- 2-бутил-α-гидрокси-α
-метил-4-(метилтио)-1-[(2'- ((((пропиламино)карбонил)амино)сульфонил)(1,1'- бифенил)4-ил)метил] 1H-имидазол-5-уксусная кислота,
- 2-бутил-α-гидрокси-α
-метил-4- (метилтио)-1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил) (1,1'-бифенил)4-ил)метил] 1H-имидазол-5-уксусная кислота,
- 2-бутил-1-[(2'-(((((циклогексилметил)амино)карбонил)
амино)сульфонил)(1,1'-бифенил)4-ил)метил] α-гидрокси-α-метил-4-(меилтио) 1H-имидазол-5-уксусная кислота,
- 1-[(2'-(((фенилметил)амино)сульфонил)(1,1'-бифенил) 4-ил)метил]
α-гидрокси-4-(метилтио)2-пропил 1H- имидазол-5-уксусная кислота,
- 1-[(2'-(((((циклогексилметил)амино)карбонил)
амино)сульфонил)(1,1'-бифенил)4-ил)метил] 4-(метилтио)
2-пропил-1H-имидазол-5-карбоксилат натрия,
- 4-(метилтио)1- [(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,
1'-бифенил)4-ил)метил] 2-пропил-1H-имидазол-5-карбоновая кислота,
-α-бутил-α- гидрокси-4-(метилтио)1-[(2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)
метил] -2-пропил-1H-имидазол-5-ацетат натрия,
-α
-гидрокси-4-(метилтио)-α-фенил 1 [(2'-(((((фенилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил]
2-пропил-1H- имидазол-5-уксусная кислота,
- 1-[(2'-(((((циклогексилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] - 4-((дифторметил)тио)2-пропил-1H-имидазол-5-карбоновая
кислота,
- 4
-((дифторметил)тио)1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил)1,1'-бифенил)4-ил)метил] -2- пропил-1H-имидазол-5-карбоновая кислота,
- 4 -((дифторметил)
тио)2-пропил-1-[(2'-(((((2-тиенилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1H-имидазол-5- карбоновая кислота,
а также их фармацевтически приемлемые соли.
Медикаменты, являющиеся предметом изобретения, могут быть использованы при лечении сердечно-сосудистых заболеваний, связанных с вазомоторными нарушениями или изменением объема циркулирующей крови: инфаркт миокарда и его последствия, сердечная недостаточность, почечная недостаточность, стенокардия, гиперальдостиронизм, высокое артериальное давление и их последствия. Эти медикаменты, являющиеся предметом изобретения, можно также использовать для лечения глаукомы, атеросклероза и различных видов висцеральных спазм, а также в качестве нейропредохраняющих веществ или для профилактики пост-ангиопластических рестенозов.
Кроме того, медикаменты, являющиеся предметом изобретения, могут использоваться благодаря их антигипертрофическому и антифибринолитическому эффекту на сердечном и сосудистом уровне. В частности, они могут быть использованы для лечения и профилактики сердечно-сосудистых нарушений, связанных с диабетом.
Они могут также быть использованы для лечения некоторых желудочно-кишечных, гинекологических заболеваний, в частности, благодаря их релаксирующему эффекту в матке.
Медикаменты, являющиеся предметом изобретения, могут быть использованы при лечении расстройств памяти, познавательных функций, а также состояний тревоги.
Изобретение касается также фармацевтических композиций, содержащих в качестве активного начала по крайней мере один из медикаментов, описанных выше.
Соединения формулы (IB) по настоящему изобретению имеют сродство не только к рецептору AT1, но также и к рецептору AT2 ангиотензина II.
Предметом изобретения было, таким образом, использование соединений формулы (IB), определенных выше, для получения фармацевтических композиций, предназначенных для лечения заболеваний, вызванных аномальной стимуляцией рецепторов AT1 и/или AT2 ангиотензина II.
Преимущество соединений формул (I), (IA) и (IB), которые обладают сродством одновременно к рецептору AT1 и к рецептору AT2, состоит в том, что одновременной блокировкой этих двух рецепторов увеличивается эффективность, то есть защитное действие в результате введения этих препаратов в пораженные органы, а именно, сердце, сосуды и почки, чем расширяется его применение не только для лечения сердечно-сосудистых, но и мочеполовых органов.
При увеличении циркуляции ангиотензина II явлением обратного контроля одновременная блокировка рецептора AT и AT2 обеспечит длительный эффект при лечении повышенного артериального давления и профилактики осложнений, в частности, сердечной и сосудистой гипертрофии, так же как и фиброзных образований в жизненноважных органах. В отношении соединений, имеющих сродство одновременно к рецептору AT1 и к рецептору AT2, можно также отметить их свойство улучшать познавательные способности.
Изобретение, в частности, касается использования соединений формул (I), (IA) и (IB), определенных выше, для приготовления фармацевтических композиций, предназначенных для лечения высокого артериального давления, сердечной недостаточности и пост-ангиопластических рестенозов.
Более конкретно, изобретение касается использования соединений формул (I), (IA) и (IB), определенных выше, для приготовления фармацевтических композиций, предназначенных для лечения почечной недостаточности.
Изобретение касается также использования соединений формул (I), (IA) и (IB), определенных выше, для приготовления фармацевтических композиций, предназначенных для лечения и профилактики сердечно-сосудистых нарушений, связанных с диабетом.
Фармацевтические композиции, указанные выше, предназначены для орального, ректального, парентерального введения или местного нанесения на кожу и на слизистую оболочку, а также для внутривенного или внутримышечного введения.
Эти композиции могут быть твердыми или жидкими и находиться во всех фармацевтических формах, обычно используемых в медицине, например простые таблетки или драже, желатиновые капсулы, гранулы, свечи, инъекции, мази, кремы, гели и аэрозоли; они готовятся обычными методами. Активное начало может в них находиться вместе с эксципиентами, обычно используемыми в фармацевтических композициях, такими, как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные носители, жиры животного и растительного происхождения, парафиновые производные, гликоли, различные смачивающие, диспергирующие или эмульгирующие агенты, консерваторы.
Обычная дозировка, варьирующаяся в зависимости от используемого препарата, пациента и вида заболевания, может быть, например, от 1 до 100 мг в день для взрослых (орально).
Следующие примеры иллюстрируют изобретение, не ограничивая его.
Приготовление 1: 2-бутил-α-гидрокси-α -метил-1-[(2'-((((диметиламино)метилен)амино) сульфонил)(1,1'-бифенил)4-ил)метил] 4-(метилтио)1H-имидазол-5-этилацетат.
Стадия A: 4'-[(2-бутил
4-(метилтио)1H-имидазол-1-ил)метил]N- [(диметиламино)метилен](1,1'-бифенил)2-сульфонамид
а) 2-бутил-4-(метилтио)1H-имидазол
760 мг 2-н-бутил-4-метилтиоимидазол-5-этилкарбоксилата,
приготовленного так, как описано в европейской заявке ЕР 0465368, вводят в 15 см3 NaOH(2N). Нагревают до температуры рефлюкса и перемешивают в течение 24 ч. После охлаждения разбавляют 50
см3 H2O, экстрагируют 2х20 см3 CH2Cl2, промывают 20 см3 H2O и высушивают. Получают 535 г целевого продукта. Т.пл.=64oC.
ИК-спектр (CHCl3)
Отсутствие C=O
=C-NH - 3452 см-1
Сопряженная система - 1596 - 1502 см-1
б)
4'-[(2- бутил-4-(метилтио)1H-имидазол-1-ил)метил] N-[(диметиламино) метилен](1,1'-бифенил)2-сульфонамид.
5 г 2-бутил-4(метилтио) 1H-имидазола растворяют в 120 см3 ТГФ. Затем медленно добавляют в полученный оранжевый раствор 1,55 г 50%-ной дисперсии гидрида натрия в масле. Повышают температуру до 25oC. В течение 30 мин перемешивают при этой температуре, затем вводят 14 г 4'-бромметил N-[(диметиламино)метилен] (1,1'-дифенил)2-сульфонамида. При комнатной температуре перемешивают до окончания реакции, либо в течение приблизительно 3 ч. Поглощают водой, экстрагируют в ацетате эфира, разделяют хроматографией на двуокиси кремния, элюируя этилацетатом, затем сгущают в изоэфире, фильтруют и сушат. Таким образом получают 9,35 г целевого продукта (бесцветные кристаллы). Т.пл.=148oC.
ИК-спектр: CHCl3
Отсутствие =C-NH-
SO2-N-CH-N < - 1627 см-1
ароматика,
гетероароматика - 1593-1564-1516-1500 см-1
Стадия В: 4'-[(5-бром-2-бутил-4-(метилтио)1H-имидазол 1-ил)метил] N- [(диметиламино)метилен](1,
1'-бифенил)2-сульфонамид.
10,4 г продукта, полученного на стадии A, растворяют в 450 см3 CH2Cl2 и добавляют 3,9 г N-бромсукцинимида. Перемешивают в течение приблизительно 15 мин при комнатной температуре, промывают водой и соленой водой, декантируют, сушат, фильтруют и удаляют растворитель в вакууме при 50oC.
Сгущают в изоэфире, фильтруют и сушат. Получают 11,8 г целевого продукта (бесцветные кристаллы). Т.пл.=158oC.
ИК-спектр: CHCl3
-N-CH-N < - 1628 см-1
ароматика
гетероароматика - 11592-1568 см-1
Микроанализ: Br
Рассчитано,%: - 14,54
Получено,%: - 14,4 -14,7.
Стадия C:
2-бутил -α-гидрокси-α- метил- 1-[(2'-((((диметиламино)метилен)амино)сульфонил) (1,1'-бифенил)4- ил)метил] 4-метилтио)1H-имидазол-5-этилацетат
Растворяют 11,8 г продукта,
полученного на стадии B, в 160 см3 ТГФ. Затем добавляют, не превышая 25oC, 17,5 см3 1M раствора магниевого изопропилхлорида в простом эфире. После приблизительно 30
мин перемешивания при комнатной температуре медленно добавляют 4 см3 этилпуривата. Приблизительно 1 ч перемешивают при комнатной температуре, добавляют 1 см3 этилпуривата и
продолжают перемешивание в течение еще 1 ч.
Поглощают с помощью 200 см3 10%-ного раствора NH4Cl, экстрагируют в этилацетате, сушат, концентрируют до объема около 200 см3, фильтруют и сушат полученные кристаллы.
Получают 6 г целевого продукта (бесцветные кристаллы).
Т.пл.=208-210oC.
ИК-спектр: CHCl3
размытый OH - около 3530 см-1
C=O - 1722 см-1
C=N - 1626 см-1
Гетероцикл + ароматика - 1565, 1518
см-1
УФ-спектр:
1) В этиловом спирте
изг. 274 нм - ε = 3100
изг. 231 нм - ε = 23000
2) в ЭтOH - HCl N/100
изг. 228 нм
- ε = 30000
изг. 273 нм - ε = 3400
Приготовление 2: 2-метил-4-(метилтио)-1-[(2'- ((((диметиламино)метилен)амино)сульфонил) (1,1'-бифенил)4-ил) метил] - α
-оксо-1H-имидазол-5-этилацетат.
Стадия A: 4,5-дибром-2-метил-1-[(2-(триметилсилил)этокси) метил)1H-имидазол. Соединение получают двумя последовательными реакциями.
1)
Защита 2-метилимидазола
Растворяют 6,8 г 2-метил- имидазола в 250 см3 ТГФ и добавляют маленькими порциями 4 г 50%-ного гидрида натрия в масле. Реакция экзотермическая,
поддерживают
температуру среды не выше комнатной в течение около 30 мин.
В реакционную среду прикапывают 17,5 см3 хлорида SEM (2-триметилсилил)этоксиметилхлорида). После 20-минутного перемешивания при 20oC гидролизуют избыток гидрида натрия добавлением 20%-ного ТГФ в H2O.
Полученный раствор экстрагируют этилацетатом и промывают
водой.
Органическую фазу собирают и сушат. Получают желтое масло, которое очищают хроматографией на двуокиси кремния с элюантом:
CH2Cl2 - метанол (90-10).
Получают 14 г защищенного соединения.
2) Бромирование
Полученное защищенное соединение растворяют в 250 см3 CH2Cl2. Затем в этот
раствор
добавляют 25 г N-бромсукцинимида небольшими порциями.
Перемешивают около 30 мин при комнатной температуре. Органическую фазу промывают раствором бикарбоната натрия, затем обильно водой. После высушивания и выпаривания извлекают 13,4 г целевого продукта (гомогенное желтое масло).
ИК-спектр: CHCl3
Отсутствие =C-NH-
Сопряженная
система - 1520 см-1
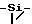
Стадия B: 2-метил-1-[(2-(триметилсилил)этокси)метил] 5- (метилтио) α-оксо-1H-имидазол-4-этилацетат.
Растворяют в безводной атмосфере 3 г продукта, полученного на стадии A, в 20 см3 безводного ТГФ. Этот раствор затем охлаждают до -78oC и при этой температуре добавляют 5,6 см3 1,5 М н-бутиллития в гексане. Перемешивание продолжают при - 78oC в течение 10 мин.
Затем вводят 0,76 см3 диметилдисульфида, затем медленно повышают температуру до 20oC и перемешивают приблизительно в течение 30 мин.
Реакционную среду снова охлаждают до -78oC и добавляют 5,6 см3 1,5 М н-бутиллития в гексане. После перемешивания при -78oC в течение 10 мин, добавляют сразу 5,5 см3 диэтилоксалата. Перемешивание проводят при комнатной температуре в течение приблизительно 30 мин. Реакционную среду затем выливают в ледяную воду. Экстрагируют этилацетатом, промывают органическую фазу раствором бикарбоната натрия, затем водой и сушат. Извлекают масло бурого цвета, которое очищают хроматографией на двуокиси кремния с элюантом: этилацетат-циклогексан (50-50). Получают 1,63 г целевого продукта (масло).
ИК-спектр; CHCl3
C=O - 1738-1673 см3
Сопряженная система - 1538
см-1
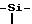
Стадия C: 2-метил-5-(метилтио) α -оксо-1H-имидазол-4-этилацетат.
Растворяют 1,6 г продукта, полученного на стадии B, в 30 см3 CH2Cl2, добавляют 10 см3 трифторуксусной кислоты. Реакционную среду нагревают до температуры рефлюкса приблизительно 10 ч. Раствор затем сушат и остаток поглощают водой. Водную фазу подщелачивают добавлением бикарбоната натрия, экстрагируют этилацетатом, промывают водой, затем сушат и извлекают 920 мг целевого продукта (желтое масло), используемого в этом виде для продолжения синтеза.
ИК-спектр: CHCl3
=C-NH - 3415 см-1
C=O - 1716-1633 см-1
Сопряженная система - 1530-1502 см-1
Стадия D:
2-метил-4(метилтио)1-[(2'-((((диметиламино)метилен)
амино)сульфонил) (1,1'-бифенил) 4-ил)метил] α- оксо-1H-имидазол-5- этилацетат.
Растворяют 880 мг продукта, полученного на стадии C, в 10 см3 безводного ДМФ и последовательно добавляют 800 мг карбоната калия, затем 2,2 г 4'-бромметил-N-[(диметиламино)метилен] (1,1'-бифенил) 2-сульфонамида. Перемешивание проводят при комнатной температуре в течение приблизительно 3 ч. Полученную желтую суспензию выливают в воду. Экстрагируют этилацетатом, промывают водой, затем сушат и извлекают желтую смолу, которую очищают на двуокиси кремния с этилацетатом в качестве элюанта.
Получают 1,17 г целевого продукта.
ИК-спектр: CHCl3
Отсутствие =C-NH
C=O
сложный эфир - 1735 см-1
Другая C=O - 1629 см-1 (F)
C=N
Ароматика - 1570 см-1
гетероатом - 1516 см-1
Приготовление 3: 1-[(2'-(аминосульфонил) (1,1'-бифенил)
4-ил) метил] 4-(метилтио) α- оксо-2-пропил-1H-имидазол-5-этилацетат.
Стадия A: 4, 5-дибром-2-н-пропил-1-[(2-триметилсилил)этокси) метил] 1H-имидазол.
Действуют так же, как на стадии A приготовления 2, но заменяя 2-метил-1H-имидазол на 2-пропил-1H-имидазол.
Продукт получают двумя последовательными реакциями.
1) Защита
2-пропилимидазола
Растворяют 30 г 2-пропилимидазола в 500 см3 ТГФ и добавляют маленькими
порциями 12,5 г 50%-ного гидрида натрия в масле.
Затем добавляют в реакционную среду 53 см3 хлорида SEM, гидролизуют с помощью ТГФ, содержащего 20% H2O.
Получают 57,3 г защищенного соединения.
2) Бромирование
Защищенное соединение, полученное выше, растворяют в 500 см3 CH2Cl2.
Добавляют 93,5 г N-бромсукцинимида и получают 93,7 г целевого продукта.
ИК-спектр: CHCl3
Отсутствие =C-NH-
Сопряженная система - 1520 см-1
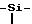
Стадия В: 2-н-пропил-1-[(2-(триметилсилил)этокси)метил] 5- (метилтио) α-оксо-1H-имидазол-4-этилацетат.
Вводят в безводной атмосфере 36,7 г продукта, полученного на стадии A, в 200 см3 ТГФ, добавляют при -78oC 63,7 см3 1,5 М бутиллития в гексане, затем 8,62 см3 диметилдисульфида, температуру повышают до комнатной. Затем добавляют при -78oC 63,7 см3 1,5 М бутиллития в гексане, затем 55 см3 этилоксалата. Получают 11,75 г целевого продукта.
ИК-спектр: CHCl3
C=O - 1737-1672 см-1
Сопряженная система - 1527 см-1
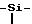
Стадия C: 2-н-пропил-5-(метилтио) α- оксо-1H-имидазол-4-этилацетат.
Действуют как на стадии С приготовления 2, но исходят из 11 г продукта, полученного на стадии В, в 200 см3 CH2Cl2 и 40 см3 трифторуксусной кислоты. Получают 7,15 г целевого продукта.
ИК-спектр: CHCl3
=C-NH - 3413 см-1
C=O - 1714 -1633 см-1
Сопряженная система - 1524-1492 см-1
Стадия D:
2-н-пропил-4-(метилтио) 1-[(2'-((((диметиламино) метилен)амино)сульфонил) (1,1'-бифенил)
4-ил)метил] α- оксо-1H- имидазол-5-этилацетат.
Действуют как на стадии D приготовление 2, но исходят из 7 г продукта, полученного на стадии С, в 100 см3 ДМФ и 7,5 г карбоната калия и 15,6 г 4'-(бромметил) N-[(диметиламино) метилен] (1,1'-бифенил)-2-сульфонамида. Получают, таким образом, 7,83 г целевого продукта.
ИК-спектр: CHCl3
Отсутствие =C-NH
C=O сложный эфир - 1735 см-1
Другая C=O - 1630 см-1 (F)
C=N
Стадия E: 1-[(2'-аминосульфонил) (1,1'-бифенил)4-ил)метил]
2-н-пропил-4-(метилтио) α-оксо-1H-имидазол-5-этилацетат.
Действуют как на стадии A примера 2, но исходят из 7,8 г продукта, полученного на стадии D, в 100 см3 этанола и 30 см3 концентрированной HCl и, таким образом получают 3,6 г целевого продукта.
ИК-спектр: CHCl3
-NH2 - 3443-3343 см-1
C=O - 1734 -1627 см-1
Ароматика - 1593 см-1
Гетероатом
- 1565 см-1
N-H2 изгиб - 1542 см-1
Приготовление 4: 1-[(2'-(аминосульфонил) (1,1'-бифенил) 4-ил) метил] 2-бутил-4 (метилтио) α
-оксо-1H-имидазол-5-этан-S-метилтиоат.
Стадия A: 4'-[(2-бутил-5-((метилсульфинил)
ацетил) 4-(метилтио) 1H-имидазол-1-ил) метил] (1,1'-бифенил) 2-сульфонамид
Сначала получают
ДМСО, вводя 3,36 г 50%-ного гидрида натрия в масле. NaH отделяют от масла 3 последовательными
промываниями в пентане. Затем сушат и добавляют 70 см3 безводного диметилсульфоксида,
температуру смеси доводят до 75oC в течение приблизительно 1 ч. Затем понижают температуру
до 0oC и добавляют к аниону полученного ДМСО 70 см3 безводного ТГФ и 9,5 г
2-бутил 1-[(2'-((((диметиламино)метилен)амино)сульфонил) (1,
1'-бифенил)4-ил)метил]4-метилтио)1-H-имидазол-5-этилкарбоксилата, приготовленного, как указано в европейской заявке на патент EP 0503162,
растворяют в 70 см3 безводного ТГФ. Затем повышают
температуру до комнатной, смесь перемешивают 1/2 ч. Реакционную смесь вливают в 400 см3 H2O.
Раствор подкисляют с помощью 2N HCl до pH 2, экстрагируют 4x200 см3 метиленхлорида, промывают органическую фазу 4x100 см3 дистиллированной H2O. Органическую фазу сушат, фильтруют и выпаривают.
Очищают на двуокиси кремния, используя в качестве элюанта CH2Cl2 - метанол (9-1) и извлекают 7,5 г целевого продукта.
ИК-спектр: CHCl3
Отсутствие SO2
N=N
-NH2 - 3440-3340 см-1
C=O - 1628 см-1
Ароматика - 1545 -1525-1495 см-1
+ Гетероцикл
SO2
- 1345-1165 см-1
SO - 1050 см-1
Стадия B: 4'-[[5-[бром(метилсульфинил) ацетил] 2-бутил 4-(метилтио)
1H-имидазолил]метил] (1,1'-бифенил) 2-сульфонамид.
Вводят 1 г продукта, полученного на стадии A, и 530 мг K2CO3. Затем добавляют 10 см3 безводного CH2Cl2, доводят температуру среды до 0oC и прикапывают 342 мг N-бромсукцин-имида, растворяют в минимуме безводного CH2Cl2. Затем добавляют 100 см3 CH2Cl2 и промывают органическую фазу 3x200 см3 дистиллированной водой и 1x100 см3 насыщенного NaCl. Сушат, фильтруют и концентрируют досуха.
Получают 1,09 г целевого продукта.
ИК-спектр в CHCl3
-NH2 - 3440-3344 см-1
>= O - 1634 см-1
Сопряженная система - 1542-1520 см-1
+ Ароматика
+ NH2
Стадия C: 1-[(2'-(аминосульфонил) (1,
1'-бифенил)4-ил)метил]2- бутил-4-(метилтио) α-оксо-2-пропил-1H-имидазол-5-этан-S-метилтиоат.
Растворяют 6,8 г продукта, полученного на стадии B, в 60 см3 смеси, содержащей 25 см3 ТФА и 75 см3 CH2Cl2, и доводят до температуры рефлюкса метиленхлорида в течение около 5 ч. Нейтрализуют раствором насыщенного NaHCO3 до pH 5-6, экстрагируют 2x200 см3 этилацетата, промывают 1x100 см3 насыщенного NaCl, сушат, фильтруют и концентрируют досуха. Очищают на двуокиси кремния с AcOEt-циклогексан (5-5) в качестве элюанта. Затем извлекают 2,7 г целевого продукта.
ИК-спектр в CHCl3
NH2 - 3445-3350 см-1
>
= O - 1670-1614 см-1
Ароматика - 1542 см-1 - 1518 см-1
+
гетероароматика
+ NH2
Приготовление 5: 1-[(2'(аминосульфонил)
(1,1'-бифенил)4-ил) метил] 4-(метилтио) 2-пропил-1H-имидазол-5-этилкарбоксилат.
Стадия A: циано-[(1-оксобутил)амино]этилацетат.
Смешивают 5 г этил(гидроксиимино)цианоацетата, 40 см3 тетрагидрофурана, 11,5 см3 масляного ангидрида и 2,5 г платины и перемешивают в атмосфере водорода до насыщения. Фильтруют, промывают 5x15 см3 этиловым эфиром, выпаривают эфир, добавляют понемногу 200 см3 бензиновой фракции G, центрифугируют, промывают 3x10 см3 бензиновой фракции G и сушат при 75oC. Концентрируют до объема 10 см3, добавляют 50 см3 бензиновой фракции G, кристаллизуют в течение 30 мин при комнатной температуре, центрифугируют, промывают 3x3 см3 бензиновой фракции G и сушат при температуре 75oC. Получают 5,73 г продукта. Т.пл.=110oC. Рекристаллизация для анализов.
Растворяют 540 мг полученного продукта в 50 см3 изопропилового эфира при температуре рефлюкса, фильтруют, концентрируют, выдерживают приблизительно в течение 1 ч при комнатной температуре, центрифугируют, промывают изопропиловым эфиром и сушат. Получают 440 мг целевого продукта. Т.пл.=110oC.
Микроанализ: C9H14N2O3 = 198,22
Рассчитано,%: C 54,53; H 17,12; N 14,13; O 24,22
Получено,%: C 54,5; H 7,2; N 14,0; O -.
ИК-спектр CHCl3
=C-NH - -3430 см-1
-C=N
- -2245 см-1
C=O - 1758 см-1 эфир - 1692 см-1 амид
Амид II - 1492
см-1
Стадия B: 3-амино-2-[(1-оксобутил)амино]
3-(метилтио)2-этилпропеноат.
В раствор 20 г нитрила, полученного на стадии A, и 400 мл этанола добавляют 1,4 мл триэтиламина, охлаждают приблизительно до -10oC и вводят около 22 г метилмеркаптана путем барботирования. Перемешивают в течение около 72 ч при 0oC. Удаляют избыток метантиола, выпаривают этанол, сгущают бензиновой фракцией G, фильтруют и сушат. Получают 24,3 г целевого продукта (бесцветные кристаллы). Т.пл.=120-124oC.
Микроанализ: C10
H18N2O3S = 246,33
Рассчитано,
%: C 48,76; H 7,37; N 11,37; S 13,02; O 19,49
Получено,%: C 48,6; H 7,5; N 11,4; S 12,6; O -.
ИК-спектр CHCl3
=C-NH2 - 3500, 3412 см-1
=C-NH - 3365, 3275 см-1
C=O размытый - 1665 см-1
C=C и NH2 изг. - 1592 см-1
Амид II - 1488 см-1
УФ-спектр в ЭтОН
Макс. 220 нм - ε = 5500
Макс. 291-292 - ε = 19400
Стадия
C: 4-(метилтио)2-пропил-1-H-имидазол 5-этилкарбоксилат.
В раствор 20,1 г пентахлорида фосфора в 300 см3 метиленхлорида, охлажденный приблизительно до -70oC, добавляют раствор 12,9 г 4-диметиламинопиридина в 90 см3 метиленхлорида.
Выдерживают около 15 мин при температуре -70oC, затем вводят раствор 12 г продукта, полученного на стадии В, в 120 см3 метиленхлорида. Оставляют до повышения температуры до комнатной и выдерживают при перемешивании в течение приблизительно 22 ч.
Выливают реакционную смесь в 2,5 л ледяной воды и нейтрализуют добавлением примерно 60 г бикарбоната натрия. Перемешивают еще около 30 мин, декантируют и экстрагируют с 500 см3 CH2Cl2. Промывают соленой водой, сушат и выпаривают растворитель при 50oC. Очищают хроматографией на двуокиси кремния с элюантом CH2Cl2-AсOEt (90-10), затем CH2Cl2-AсOEt (80-20). Выпаривают растворители при 50oC, сгущают бензиновой фракцией G, фильтруют и сушат. Получают 7,4 г целевого продукта (бесцветные кристаллы). Т.пл.K95 = 85oC.
Микроанализ: C10H16N2O2S = 228,32
Рассчитано,%: C 52,61; H 7,06; N 12,27; S 14,04; O 14,02
Получено,%: C 52,7; H 7,3; N 12,2; S 14,0; O -.
ИК-спектр CHCl3
=C-NH - 3440-3260 см-1
C=O размытый макс. - -1672 см-1
Гетероцикл - 1542-1498 см-1
УФ-спектр в ЭтОН
Макс. 213-214 нм - ε = 14500
Инфл. 229 нм - ε = 7200
Макс. 286 нм - ε = 12200
УФ-спектр в ЭтОН/HCl N/10
Макс. 238 нм - ε = 6800
Макс. 277 нм - ε = 9600
Обратным потоком основания ---> макс. 296 нм
Стадия D:
1-[(2'-((((диметиламино)метилен)амино)сульфонил) (1,1'-бифенил) 4-ил)метил]
4-(метилтио)2-пропил-1H-имидазол-5-этилкарбоксилат.
Растворяют 8,1 г продукта, полученного на стадии C, в 80 см3 диметилформамида и добавляют 16,1 г 4'-(бромметил) N-[(диметиламино)метилен] (1,1'-бифенил)2-сульфонамида и 4,9 г карбоната калия. Перемешивают при комнатной температуре в течение около 24 ч. Выпаривают ДМФ при 50oC, сгущают в воде, фильтруют, промывают водой и сушат при приблизительно 60oC.
Сгущают в 240 см3 ACOEt при перемешивании в течение около 30 мин при температуре около 50o C, добавляют 160 см3 гексана, фильтруют и сушат. Получают 14 г целевого продукта (бесцветные кристаллы). Т.пл.K163: 182oC.
ИК-спектр CHCl3
Отсутствие =C-NH
C=O - 1690 см-1
C=N - 1628 см-1
Гетероцикл
- 1504-1565 см-1
УФ-спектр в ЭтОН
Изг. 230 нм
- ε = 32000
Макс. 287 нм - ε = 15500
Стадия E: 1-[(2'-(аминосульфонил) (1,
1'-бифенил)4-ил)метил] 4-(метилтио)2-пропил-1H-имидазол-5-этилкарбоксилат.
Смешивает 11,2 г продукта, полученного на стадии D, с 200 см3 этанола и 100 см3 концентрированной соляной кислоты. Нагревают при температуре рефлюкса около 2 ч. Выпаривают этанол, разбавляют 400 см3 воды, подщелачивают при перемешивании добавлением натрового щелока и экстрагируют этилацетатом. Промывают водой и соленой водой, сушат, фильтруют и выпаривают растворитель при 50oC.
Очищают хроматографией на двуокиси кремния с элюантом AсOEt 60 - Гексан 40. Получают 9,3 г целевого продукта (бесцветные кристаллы).
Т.пл.K135 = 130 -132oC.
ИК-спектр CHCl3
Отсутствие исходных продуктов
C=O - 1689 см-1
NH2 - 3444-3340
см-1
Сопряженная система
+ ароматика - 1618-1590-1560-1540-1508
см-1
УФ-спектр в ЭтОН
Изг. 210 нм - ε = 45000
Изг. 234 нм
- ε = 17000
Макс.286 нм - ε = 15000
Пример 1.
1-[(2'-(аминосульфонил) (1,1'-бифенил) 4-ил)метил] 2-бутил -α-гидрокси-α-метил 4-(метилтио)
1H-имидазол-5-этил-ацетат.
Вводят 1,24 г продукта, полученного в приготовлении 1, 30 см3 этанола 95oC и 10 см3 концентрированной HCl.
Нагревают при температуре рефлюкса до полного превращения, т.е. в течение около 2 ч.
Охлаждают, разбавляют в воде, подщелачивают добавлением NaOHk, насыщают жидкую фазу K2CO3, экстрагируют в AсOEt, затем очищают хроматографией на двуокиси кремния с растворителем AcOEt. Получают 930 мг целевого продукта (бледно-желтая смола).
ИК-спектр CHCl3
Отсутствие -SO2-N=CH-N <
OH - около 3520 см-1 размытый
NH2 - около 3442 см-1, -3355 см-1
C=O - 1721 см-1
Ароматический - 1614 см-1
Гетероароматический - 1592 см-1
NH2 - 1565-1543-1517 см-1
Пример 2. 2-бутил-1-[(2'-(((этоксикарбонил)амино)сульфонил) (1,
1'-бифенил)4-ил)метил] α- метилен-4-(метилтио) 1H-имидазол- 5-этилацетат.
Стадия A: 1-[(2'-(аминосульфонил) (1,1'-бифенил) 4-ил)метил] 2-бутил -α- метилен-4-(метилтио) 1H-имидазол-5-этилацетат.
Вводят 5,7 г продукта, полученного в приготовлении 1, в 300 см3 диоксана и добавляют 30 см3 концентрированной серной кислоты. Нагревают при температуре рефлюкса в течение приблизительно 5 ч. Извлекают водой и AcOEt, подщелачивают в концентрированном едком натре, насыщают добавлением K2CO3 и продолжают экстракцию с помощью AcOEt. Очищают на двуокиси кремния с элюантом AcOEt - CH2Cl2 (60-40) и получают 1,33 г целевого продукта.
Стадия B: 2-бутил-1-[(2'-(((этоксикарбонил)амино)сульфонил) (1,1'-бифенил)4-ил)метил] α-метилен-4-(метилтио) 1H-имидазол- 5-этилацетат.
Смешивают 1 г продукта, полученного на стадии A, в 15 см3 диметоксиэтана, 550 мг К2CO3 и 0,4 см3 этилхлорформиата. Нагревают при температуре рефлюкса около 1 ч, разбавляют в воде и экстрагируют в AcOEt. Очищают на двуокиси кремния с элюантом AcOEt - гексан (60-40), затем элюируют с помощью CHCl3, содержащим 2% MeOH, и извлекают 720 мг целевого продукта.
Пример 3. 2-бутил -α- метилен-4-(метилтио)-1-2'(((этоксикарбонил) амино)сульфонил) (1, 1'-бифенил)4-ил)метил] 1H-имидаэол-5-уксусная кислота.
Перемешивают при комнатной температуре в течение 6 ч 650 мг продукта примера 2 в растворе 10 см3 диоксана с 5 см3 2N NaOH. Разбавляют водой, экстрагируют нейтральную фракцию в AcOEt, подкисляют добавлением HClk и экстрагируют в AcOEt. Очищают сначала на двуокиси кремния с элюантом CHCl3-MeOH (80-20), выпаривают растворители, сгущают в изоэфире, фильтруют и сушат при комнатной температуре. Растворяют 200 мг полученной кислоты в 10 см3 2N NaOH и разбавляют 10 см3 воды.
Фильтруют, промывают водную фазу простым эфиром, затем подкисляют добавлением HClk. Экстрагируют в AcOEt, промывают соленой водой, сушат, фильтруют и выпаривают растворитель. Сгущают бензиновой фракцией G, фильтруют и сушат при комнатной температуре. Получают 118 мг целевого продукта.
Микроанализ: C27H31N3O6S2 = 557,69
Рассчитано,%: C 58,15; H 5,60; N 7,53; S 11,50
Получено,
%: C 57,8; H 5,7; N 7,7; S 11,9.
Пример 4. 1-[(2'-(аминосульфонил)(1,1'-бифенил)4-ил)метил] 2-бутил-4-(метилтио)α- метилен-1H-имидазол-5-уксусная кислота.
Стадия A: 1-[(2'-(аминосульфонил)(1,1'-бифенил)4-ил)метил] 2-бутил -α-гидрокси-α-метил-4-(метилтио)1H-имидазол-5-уксусная кислота.
Вводят 5,9 г продукта, полученного в приготовлении 1, в 300 см3 диоксана и добавляют 30 см3 серной кислоты, разбавленной наполовину. Нагревают приблизительно до 100oC и перемешивают в течение 3 ч. Выпаривают диоксан, разбавляют водой и экстрагируют с помощью CHCl3, содержащей 20% MeOH. Очищают на двуокиси кремния с элюантом CHCl3-MeOH (80-20) и получают 4,5 г целевого продукта.
Стадия B: 1-[(2'-(аминосульфонил) (1, 1'-бифенил) 4-ил)метил] 2-бутил-4-(метилтио) α- метилен-1H-имидазол-5-уксусная кислота.
Вводят 1 г продукта, полученного на стадии A, в 50 см3 диоксана и добавляют 5 см3 концентрированной серной кислоты. Нагревают около 5 ч, разбавляют водой, насыщают NaCl и экстрагируют CHCl3, содержащего 20% MeOH.
Очищают на двуокиси кремния с элюантом CHCl3-MeOH (80-20) и получают 595 мг целевого продукта.
Пример 5. 2-бутил-α -метилен-4-(метилтио)-1-[(2'((((пропиламино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 1H-имидазол-5-уксусная кислота (соль натрия).
В смесь 545 мг продукта примера 4, 310 мг К2CO3 и 20 см3 ацетона, нагретую до температуры рефлюкса, добавляют 0,12 см3 пропилизоцианата. Затем продолжают нагревание при температуре рефлюкса в течение приблизительно 3 ч.
Выпаривают часть ацетона, разбавляют водой, насыщают добавлением NaCl после подкисления HClk и экстрагируют CHCl3, содержащим 20% MeOH. Очищают на двуокиси кремния с элюантом CHCl3-MeOH (80-20), затем растворяют в 20 см3 2N NaOH и подкисляют до pH 1 при перемешивании добавлением HClk. Перемешивают при комнатной температуре около 3 ч, фильтруют, промывают водой до нейтрального состояния и сушат. Получают 190 мг целевого продукта.
Микроанализ: C23H33N4NaO5S2 = 592,72
Рассчитано,%: C
56,74; H 5,61; N 9,45; S 10,82
Получено,%: C 56,6; H 5,7; N 9,7; S 11,1.
Пример 6. 2-бутил-α-гидрокси α-метил-4-(метилтио)-1-[(2'-((((фенилметокси) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 1H-имидазол-5-этилацетат.
В раствор 265 мг продукта примера 1 в 4 см3 диметоксиэтана добавляют 138 мг K2 CO3 и 0,08 см3 бензихлорформиата. Нагревают в течение 30 мин при температуре рефлюкса, разбавляют водой, экстрагируют в AcOEt и очищают на двуокиси кремния элюантом CHCl3-MeOH (95-5). Рекупирируют 280 мг целевого продукта.
Пример 7. 2-бутил-α-гидрокси α-метил-4-(метилтио)-1-[(2'-((((фенилметокси) карбонил)амино)сульфонил) (1, 1'-бифенил) 4-ил)метил] 1H-имидазол-5-уксусная кислота.
Вводят 311 мг продукта примера 6 в 10 см3 MeOH, добавляют 10 см3 2N NaOH и перемешивают в течение около 2 ч при комнатной температуре. Экстрагируют в эфире, водную фазу подкисляют до pH 1 прибавлением HClk и экстрагируют CHCl3, содержащим 20% MeOH, затем выпаривают. Вновь растворяют в 10 см3 2N едкого натра и 15 см3 воды, фильтруют, подкисляют добавлением HClk фильтруют, промывают водой и бензиновой фракцией G и сушат. Получают 216 мг целевого продукта. Т.пл. = 140-150oC.
ИК-спектр: Нюйол
Размытая область OH/NH
C=O - 1744
см-1
Ароматический - 1620 см-1
Гетероароматический - 1591 см-1
Амид - 1500 см-1
Микроанализ: C32H35N3O7S2 = 637,38
Рассчитано,
%: C 60,26; H 5,53; N 6,59; S 10,05; O 27,56
Получено,%: C 59,95; H 5,3; N 6,6; S 10,4; O -.
Пример 8. 2-бутил-α-гидрокси α -метил-4-(метилтио)-1-[(2'-((((пропиламино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 1H-имидазол-5-этилацетат.
Вводят 1,3 г продукта примера 1 в 40 см3 ацетона и добавляют 680 мг карбоната калия. Нагревают до температуры рефлюкса, добавляют 0,25 см3 пропилизоцианата. Продолжают нагревание при температуре рефлюкса около 2 ч, охлаждают, фильтруют, промывают ацетоном и выпаривают растворитель. Очищают на двуокиси кремния элюантом CHCl3 MeOH (98-2). Сгущают в изоэфире, фильтруют и сушат при комнатной температуре. Получают 170 мг целевого продукта.
ИК-спектр: CHCl3
OH - 3510 см-1 размытый
=C-NH - 3403 см-1 +
ассоциированный
> O - 3707 см-1
Амид II - 1615 см-1
Ароматический - 1600 см-1
Гетероароматический - 1539 см-1
Пример 9. 2-бутил-α-гидрокси-α
-метил-4-(метилтио)-1-[(2'-((((пропиламино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 1H-имидазол-5-уксусная кислота.
В раствор 582 мг продукта примера 8 в 10 см3 MeOH добавляют 5 см3 2N NaOH. Перемешивают при комнатной температуре около 5 ч. Выпаривают в вакууме MeOH, разбавляют водой и экстрагируют нейтральную фракцию в AcOEt. Отфильтровывают водную фазу, подкисляют добавлением HClk и экстрагируют CHCl3, содержащим 20% MeOH, затем выпаривают. Сгущают в изоэфире при перемешивании, фильтруют и сушат при комнатной температуре. Для очистки растворяют 420 мг полученного продукта в 50 см3 1N едкого натра при перемешивании. Экстрагируют нейтральную фракцию простым эфиром, отфильтровывают водную фазу и подкисляют постепенным добавлением HCl (концентрированной) при перемешивании. Перемешивают еще около 30 мин, фильтруют, промывают водой и бензиновой фракцией G и сушат. Получают 170 мг целевого продукта.
ИК-спектр:
Очень размытая область ОН
=C-NH - 3400 см-1
C=O - 1753-1705-1632 см-1
Ароматический - 1592 см-1
Гетероароматический - 1551 см-1 (F)
Амид II - 1504 см-1
УФ-спектр:
В ЭтОН для М = 588,75
Макс. 268 нм - ε = 3100
Макс. 276 нм
- ε = 2800
Изг. 215, 236 нм
Пример 10. 2-бутил-α-гидрокси-α
-метил-4-(метилтио)-1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил]
1H-имидазол-5-этилацетат.
Вводят 500 мг продукта примера 1 в 15 см3 ацетона и добавляют 260 мг карбоната калия. Нагревают до температуры рефлюкса и вводят 0,13 см3 бензилизоцианата. Затем продолжают нагревание при температуре рефлюкса в течение еще 1 ч. Фильтруют, выпаривают растворитель и очищают на двуокиси кремния элюантом CHCl3-MeOH (98-2). Получают 590 мг целевого продукта.
Пример 11. 2-бутил-α -гидрокси-α-метил-4-(метилтио)-1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 1H-имидазол-5-уксусная кислота.
В раствор 590 мг продукта примера 10 в 10 см3 метанола добавляют 5 см3 2N едкого натра и перемешивают при комнатной температуре около 1 ч. Замораживают, разбавляют водой, подкисляют HClk и экстрагируют CHCl3, содержащим 20% MeOH. Для очистки растворяют полученный продукт в 20 см3 2N NaOH и 30 см3 воды, экстрагируют простым эфиром, фильтруют водный раствор и подкисляют при перемешивании добавлением концентрированной HCl. Фильтруют и промывают водой, затем сушат. Получают 444 мг целевого продукта. Т.п.к = 158-160oC.
Микроанализ: C32H36N4O6S2 = 636,79
Рассчитано,%: C 60,
36; H 5,70; N 8,80; S 10,07
Получено,%: C 60,2; H 5,5; N 8,6; S 10,2.
Пример 12. 2-бутил-1-[(2'-(((((циклогексилметил)амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] α-гидрокси-α-метил-4-(метилтио) 1H-имидазол-5-этилацетат.
Вводят 178 мг продукта примера 1 в 10 см3 ацетона и добавляют 46 мг карбоната калия. Нагревают до температуры рефлюкса, затем вводят 47 мг циклогексилметилизоцианата. Нагревают около 1 ч с рефлюксом, отфильтровывают нерастворимый остаток и выпаривают растворитель. Очищают на двуокиси кремния элюантом AсOEt-гексан (60-40), затем CHCl3-MeOH (95-5). Получают 200 мг целевого продукта.
Пример 13. 2-бутил-1-[(2'-(((((циклогексилметил)амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] -α-гидрокси-α -метил-4-(метилтио)1H-имидазол-5-уксусная кислота.
Вводят 200 мг продукта примера 12 в 2 см3 этанола, добавляют 0,2 см3 6N КОН и перемешивают при комнатной температуре около 48 ч. Разбавляют водой, подкисляют добавлением концентрированной HCl. Фильтруют, промывают водой и сушат. Для очистки растворяют в 60 см3 2N NaOH и 9 см3 воды. Экстрагируют простым эфиром, отфильтровывают водную фазу, подкисляют концентрированной HCl, фильтруют, промывают в воде и сушат при комнатной температуре. Получают 129 мг целевого продукта.
Микроанализ: C32H42N4O6S2 = 642,84
Рассчитано,%: C
59,79; H 6,59; N 8,72; S 9,98
Получено,%: C 59,3; H 6,5; N 8,7;
S 9,9.
Пример 14. 1-[(2'-(аминосульфонил) (1,1'-бифенил)4-ил)метил] -α-гидрокси-α -2-диметил-4-(метилтио) 1H-имидазол-5-этилацетат.
Стадия A: -α -гидрокси-α-2-диметил-4-(метилтио)1-[(2'-((((диметиламино)метилен)амино)сульфонил) (1, 1'-бифенил)4-ил)метил]1H-имидазол-5-этилацетат.
Вводят 1,1 г продукта, полученного в приготовлении 2, в 20 см3 ТГФ, в который медленно добавляют 2,4 см3 метилхлорида магния, перемешивают около 1 ч при комнатной температуре. Медленно добавляют в среду раствор, насыщенный NH4Cl, экстрагируют этилацетатом, промывают водой, затем высушивают, очищают на двуокиси кремния этилацетатом +5% этанола в качестве элюанта и получают 770 мг целевого продукта.
ИК-спектр: CHCl3
OH - 3520 см-1
C=O - 1725 см-1
C=N - 1624 см-1
Ароматический - 1592-1564
см-1
Гетероароматический - 1531-1517 см-1
Стадия B:
1-[(2'-(аминосульфонил)(1,1'-бифенил)4-ил)метил] -α-гидрокси-α
-2-диметил-4-(метилтио)1H-имидазол-5-этил-ацетат.
Вводят 750 мг продукта, полученного на стадии A, в смесь этанол-HCl (20 см3-5 см3) и доводят до температуры рефлюкса в течение 5 ч. Затем концентрируют, извлекают ледяной водой и подщелачивают NH4OH, центрифугируют, промывают водой, затем сушат при комнатной температуре. Водную фазу экстрагируют этилацетатом, промывают водой, сушат. Получают в целом 540 мг целевого продукта.
ИК-спектр: CHCl3
Отсутствие -N=CH-
NH2 - 3445-3440 см-1
ОН - 3515 см-1
C=O - 1722 см-1
Ароматический - 1591-1563 см-1
Гетероароматический - 1530-1517 см-1
NH2-деф.
Пример 15. N-(фенилметил)1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1, 1'-бифенил)4-ил)метил] α-2-диметил-α-гидрокси-4-(метилтио) 1H-имидазол-5-ацетамид.
Вводят 500 мг продукта примера 14 в 20 см3 ацетона, добавляют 282 мг карбоната калия и доводят до температуры рефлюкса. Добавляют 0,15 см3 бензилизоцианата. Реакционную среду выдерживают с рефлюксом при перемешивании в течение 3 ч. Центрифугируют, промывают этилацетатом, затем органический раствор доводят до сухого состояния. Очищают сначала на двуокиси кремния элюантом CH2Cl2-метанол (95-5), затем сгущают в 20 см3 этанола, центрифугируют, промывают 2x5 см3 этанола, затем сушат. Растворяют в смеси из 10 см3 этанола и 10 см3 2N NaOH, затем оставляют на ночь при комнатной температуре. Реакционную среду подкисляют добавлениям кислого фосфата натрия, экстрагируют этилацетатом, промывают водой, затем сушат. Очищают на двуокиси кремния элюантом CH2Cl2 -метанол (90-10), затем сгущают в 5 см3 горячего этанола, центрифугируют и промывают 5 см3 этанола. Получают 144 мг целевого продукта (твердое белое вещество). Т.пл. = 220oC.
ИК-спектр: Нюйол
Размытая область
поглощения OH/NH
C=O - 1711-1645 см-1
Ароматический - 1592-1547 см-1
Гетероароматический - 1518-1493 см-1
Амид II
Пример
16. α-гидрокси-α-2-диметил-4-(метилтио)-1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1,
1'-бифенил) 4-ил)метил] 1H-имидазол-5-этилацетат.
Стадия A: 1-[(2'-(аминосульфонил) (1,1'-бифенил)4-ил)метил] 2-метил-4-(метилтио) α- оксо-1H-имидазол-5-этилацетат.
Вводят 4,8 г продукта, полученного в приготовлении 2, в смесь 50 см3 этанола и 30 см3 концентрированной HCl. Реакционную среду доводят до температуры рефлюкса в течение 5 час. Раствор затем концентрируют в вакууме, затем извлекают ледяной водой. Подщелачивают добавлением NH4OH до pH ~ 8, затем экстрагируют этилацетатом, промывают водой, сушат и хроматографически очищают на двуокиси кремния этилацетатом в качестве элюента. Таким образом получают 2,4 г целевого продукта.
ИК-спектр: CHCl3
-NH2
- 3443-3343 см-1
C=O - 1734-1627 см-1
Ароматический - 1593 см-1
Гетероатом - 1565 см-1
NH2 деф. - 1542 см-1
Стадия B: 2-метил-4-(метилтио)-1-[(2'-(((((фенилметил)
амино)карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] α-оксо-1H-имидазол-5-этилацетат.
Вводят 0,8 г продукта, полученного на стадии A, в 25 см3 ацетона и добавляют 465 мг карбоната калия. Смесь доводят до температуры рефлюкса, прикапывают 0,2 см3 бензилизоцианата, перемешивают при этих условиях около 1 ч. Выпаривают досуха, поглощают остаток водой, затем подкисляют добавлением кислого фосфата калия, осадок центрифугируют, промывают обильно водой, потом сушат. Очищают сгущением в смеси 10 см3 изопропанола и 20 см3 изопропилового эфира, центрифугируют, сушат, промывают 2x25 см3 изопропилового эфира и получают 480 мг целевого продукта (желтое твердое вещество). Т.пл.=130oC.
ИК-спектр: CHCl3
Отсутствие SO2NH2
-NH-C= размытый - 3395-3375 см-1
C=O - 1732-1714-1624 см3 широкий
Ароматический - 1539 см-1
Гетероатом - 1497 см-1
Амид II
Стадия C: -α
-гидрокси-α
-2-диметил-4-(метилтио)-1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 1H-имидазол-5-этилацетат.
Вводят 455 мг продукта,
полученного на стадии B,
в 10 см3 ТГФ, медленно добавляют 1,25 см3 метилхлорида магния, перемешивают около 30 мин при комнатной температуре, полученный раствор выливают в воду,
экстрагируют этилацетатом,
органическую фазу промывают водой и сушат. Очищают на двуокиси кремния элюантом CH2Cl2-метанол (95-5) и получают 270 мг целевого продукта. Т.пл.
=110oC
ИК-спектр: CHCl3
-ОН - 3515 см-1 + ассоциированный
=C-NH - 3395 см-1
C=O - 1713 см-1 размытый
Ароматический - 1605-1592
см-1
Гетероатом - 1562-1535 см-1
Амид II - 1498 см-1
Пример 17. α-2-диметил-α
-гидрокси-4-(метилтио)-1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 1H-имидазол-5-уксусная кислота.
Вводят 250 мг продукта примера 16 в смесь
NaOH-этанол (5 см3 - 5 см3) и перемешивают в течение около 3 ч при комнатной температуре. Реакционную среду выливают в воду, затем подкисляют добавлением 2N HCl и добавляют 20
см3 этилацетата. После приблизительно 30 мин перемешивания при 0oC обильно промывают водой, сгущают в 2x10 см3 кипящего этанола, затем 10 см3
изопропилового
спирта и сушат. Получают 165 мг целевого продукта (твердого белого вещества). Т.пл.=245oC
ИК-спектр: CHCl3
OH/NH - 3350 см-1 + общая
абсорбция
C=O - 1666 см-1
Область COO- - 1625 см-1
Ароматический - 1607-1580 см-1
Гетероатом - 1560-1535 см-1
Амид II - 1497 см-1
Пример 18. -α-гидрокси-α-2-диметил-4-(метилтио)-1-[(2'-((((пропиламино)карбонил) амино)сульфонил) (1,1'-бифенил) 4-ил) метил]
1H-имидазол-5-этилацетат.
Стадия A: 2-диметил-4-(метилтио) α- оксо-1-[(2'-((((пропиламино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 1H-имидазол-5-этилацетат.
Действуют как на стадии B примера 16. Вводят 0,85 г продукта, полученного на стадии A примера 16, в 15 см3 ацетона, в который добавляют 500 мг карбоната калия. Доводят до температуры рефлюкса и добавляют 0,17 см3 н-пропилизоцианата, затем выдерживают при рефлюксе около 1 ч. Суспензию концентрируют, полученный остаток поглощают водой, затем подкисляют добавлением 2N соляной кислоты до pH 2. Затем центрифугируют, промывают водой и сушат при комнатной температуре. Очищают на двуокиси кремния, используя в качестве элюанта CH2Cl2 + 3% метанола и получают 380 мг целевого продукта.
ИК-спектр: CHCl3
=C-NH - 3402-3378 см-1
C=O - 1732-1716-1625 см-1
Область COO- - 1625 см-1
Ароматический - 1561 см-1
Амид II - 1540 см-1
Стадия B: -α-гидрокси-α
-2-диметил-4-(метилтио)-1-[(2'-((((пропиламино)карбонил) амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 1H-имидазол-5-этилацетат.
Действуют как на стадии C примера 16, используя в качестве исходного 350 мг продукта, полученного на стадии A, в 10 см3 ТГФ и добавляют 1 см3 метилхлорида магния при температуре около 10oC. Затем перемешивают при комнатной температуре около 1 ч. Затем добавляют насыщенный раствор NH4Cl, экстрагируют этилацетатом, промывают водой, затем сушат. Очищают на двуокиси кремния, используя в качестве элюанта CH2Cl2-метанол (95-5) и получают 130 мг целевого продукта.
Пример 19. α-2-диметил-α -гидрокси-4-(метилтио)-1-[(2'-(((((пропиламино)карбонил) амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 1H-имидазол-5-уксусная кислота.
Действуют как в примере 17, но используя 130 мг продукта примера 18 в 5 см3 1N NaOH, и перемешивают при комнатной температуре в течение 16 ч.
Реакционную среду подкисляют добавлением кислого фосфата натрия, затем центрифугируют, промывают обильно водой и сушат.
Очищают сгущением в 5 см3 этилацетата и получают 70 мг целевого продукта. Т.пл.=205oC.
ИК-спектр: Нюйол
Размытая область абсорбции OH/HN
C=O - 1709-1667-1629 см-1
Ароматический - 1575-1559 см-1
Амид II - 1550-1513 см-1
Пример 20. α
-гидрокси-4-(метилтио)-1-[(2'-(((((фенилметил) амино)карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 2-пропил-1H-имидазол-5-этилацетат.
Стадия A: 1-[(2'-(((этоксикарбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 4-(метилтио) α- оксо-2-пропил-1H-имидазол-5-этилацетат.
Вводят 3,3 г продукта, полученного в приготовлении 3, в 60 см3 диметоксиэтанола, в который добавляют последовательно 1,81 г карбоната калия, затем 1,25 см3 этилхлорформиата. Раствор доводят до температуры рефлюкса в течение 5 ч, затем фильтруют, промывают этилацетатом и органический раствор высушивают досуха. Поглощают с помощью CH2Cl2, обильно промывают водой, затем сушат. Очищают хроматографически на двуокиси кремния, используя в качестве элюанта CH2Cl2-метанол 96-4 и получают 1,5 г целевого продукта.
ИК-спектр: CHCl3
=C-NH - 3384 см-1
C=O - 1739-1626 см-1
Ароматический - 1564 см-1
Гетероатом - 1516 см-1
Амид II - 1480 см-1
Стадия B:
1-[(2'-(((этоксикарбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] α-гидрокси-4-(метилтио)2-пропил- 1H-имидазол-5-этилацетат.
Вводят 1,3 г продукта, полученного на стадии A, в 50 см3 этанола, охлаждают приблизительно до -20oC/-25oC и добавляют 90 мг боргидрида натрия. Перемешивают при -20oC около 15 мин. Выпаривают этанол, затем поглощают с помощью 100 см3 ледяной воды и добавляют 50 см3 этилацетата, затем выпаривают органическую фазу, центрифугируют, обильно промывают, затем сушат. Получают 1,05 г целевого продукта. Т.пл.=147oC.
ИК-спектр: CHCl3
Отсутствие сопряженного кетона
ОН - 3590-3508 см-1
-NH - 3385 см-1
+ общая абсорбция
C=O - 1746 см-1
Ароматический - 1614-1590 см-1
Гетероцикл - 1560-1540 см-1
Амид - 1538-1500
см-1
Стадия C: α- гидрокси-4-(метилтио)-1-[(2'-(((((фенилметил) амино)карбонил)амино)сульфонил) (1,1'-бифенил)4-ил) метил]
2-пропил-1H-имидазол-5-этилацетат.
Вводят 1 г продукта, полученного на стадии B, в 30 см3 толуола, в который добавляют 1 см3 бензиламина, нагревают до температуры рефлюкса приблизительно 30 мин. Сушат, поглощают водой и подкисляют добавлением кислого фосфата натрия. Экстрагируют этилацетатом, органическую фазу промывают водой, затем сушат. Очищают на двуокиси кремния с помощью элюанта CH2Cl2- этанол (96-4) и получают 730 мг целевого продукта.
ИК-спектр: CHCl3
Абсорбция ОН - 3500 см-1
NH - 3370 см-1 размытая
C=O - 1714 см-1
Сопряженная система - 1664-1592 см-1
Ароматический - 1538-1502 см-1
Амид II - 1538-1500 см-1
Пример 21. 1-[(2'-(((фенилметил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] α-гидрокси-4-(метилтио) 2-пропил-1H-имидазол-5-уксусная
кислота.
Вводят 400 мг продукта примера 20 в смесь этанол-NaOH (5 см3-5 см3) и перемешивают около 3 ч при комнатной температуре. Затем концентрируют, извлекают водой и подкисляют добавлением 1N HCl, центрифугируют, обильно промывают водой, затем сушат. Для очистки растворяют при нагревании в смеси 25 см3 этилацетата и 25 см3 этанола, фильтруют, концентрируют наполовину, затем оставляют на ночь при комнатной температуре. После центрифугирования осадок обильно промывают последовательно 20 см3 этилацетата, затем 20 см3 этанола, высушивают и получают 136 мг целевого продукта. Т.пл.=225oC.
ИК-спектр: CHCl3
Поглощение OH/NH
C=O - 1672-1640 см-1
Пример 22. 1-[(2'-(((((циклогексилметил)амино)карбонил)
амино)сульфонил) (1,1'-бифенил)4-ил)метил] 4-(метилтио) 2-пропил-1Н-имидазол-5-этилкарбоксилат.
Вводят 400 мг продукта, полученного в приготовлении 5, в 5 мл безводного ацетона и 236 мг карбоната калия К2CO3. Доводят до температуры рефлюкса и добавляют 200 мкл циклогексилметилизоцианата. После приблизительно 1 ч перемешивания при нагревании раствор охлаждают до комнатной температуры, гидролизуют водным насыщенным раствором NH3CI, затем экстрагируют с помощью CH2Cl2. После высушивания и выпаривания перекристаллизовывают в простом эфире после растворения в минимуме CH2Cl2, затем фильтруют, сушат и получают 420 мг целевого продукта (твердое белое вещество).
ЯМР-спектр: CDCl3
Пример 23. 1-[(2'-(((((циклогексилметил)амино)карбонил) амино)сульфонил) (1,1'-бифенил)4-ил)метил] 4-(метилтио) 2-пропил-1H- имидазол-5-карбоксилат натрия.
Вводят 380 мг продукта примера 22 в 8 мл этанола и 5 мл 2N NaOH и перемешивают при комнатной температуре в течение приблизительно 48 часов. Затем выпаривают этанол и добавляют 10 мл воды, водную фазу экстрагируют этилацетатом, фильтруют, охлаждают до 0oC и постепенно подкисляют до pH 2. После 30-минутного перемешивания осадок фильтруют и высушивают, получают 240 мг целевого продукта.
ИК-спектр: CHCl3
Кислотная согласно области
ОН
=C-NH - 3390 см-1
> O - 1705-1680 см-1
Ароматический - 1606
см-1
Гетероатом - 1545 см-1
Амид II
- 1527 см-1
Пример 24. 4-(метилтио)-1-[(2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1,
1'-бифенил) 4-ил)метил] 2-пропил-1H-имидазол-5-этилкарбоксилат.
Вводят 2 г продукта, полученного в приготовлении 5, в 25 мл безводного ацетона и 1,2 г карбоната калия. Доводят до температуры рефлюкса и добавляют 740 мкл бензилизоцианата. После приблизительно двухчасового перемешивания охлаждают до комнатной температуры, гидролизуют насыщенным водным раствором NH4Cl, затем экстрагируют метиленхлоридом. Сушат, перекристаллизовывают в простом эфире, фильтруют и получают 1,9 г целевого продукта.
Пример 25. 4-(метилтио)-1-[(2'-(((((фенилметил)амино)карбонил)амино) сульфонил) (1,1'-бифенил) 4-ил)метил] 2-пропил-1H-имидазол-5-карбоновая кислота.
Вводят 1,8 г продукта, полученного в примере 24, в 10 мл этанола и 10 мл 2N едкого натра, затем перемешивают при комнатной температуре 36 ч. Затем выпаривают этанол и после прибавления 25 мл воды экстрагируют водную фазу простым эфиром, фильтруют, охлаждают до 0oC и медленно подкисляют до pH 1,5 с помощью 1N HCl. Фильтруют и сушат, получают 1,4 г целевого продукта.
ИК-спектр: CHCl3
Кислотная согласно области ОН
=C-NH - 3480 см-1
> O - 1706-1690
см-1 размытый
Ароматический - 1539 см-1
Гетероароматический
- 1521 см-1
Амид II - 1500 см-1
Пример 26.
4'-((5-ацетил-2-бутил-4(метилтио) 1H-имидазол-1- ил)метил) N-((пропиламино)карбонил) (1,1'-бифенил)2-сульфонамид.
Стадия A: 4'-((2-бутил-5-((метилсульфинил) ацетил) 4-(метилтио) 1H-имидазол-1-ил)метил) N-((пропиламино) карбонил) (1,1'-бифенил) 2-сульфонамид.
Вводят 3,52 г 50%-ного NaH в масле, удаляют из NaH масло тремя последовательными промывками в пентане. Затем сушат. Добавляют 42 см3 безводного ДМСО, повышают температуру смеси до 75oC в течение 1 ч, затем смесь охлаждают до 0oC и добавляют к образовавшемуся аниону ДМСО 40 см3 безводного ТГФ и прикапывают 12 г 2-бутил-H-(метилтио) [[2'-((((пропиламино) карбонил) амино)сульфонил) (1,1'-бифенил) 4-ил] 1H-имидазол 5-этилкарбоксилата, растворенного в 80 см3 безводного ТГФ. Выдерживают до повышения температуры до комнатной, перемешивают приблизительно 1 ч. Затем реакционную смесь выливают в 400 см3 дистиллированной воды и подкисляют до pH 2 с помощью 2N соляной кислоты. Экстрагируют 3x200 см3 метиленхлорида и промывают органическую фазу 1x200 см3 насыщенным раствором NH4Cl и 2x200 см3 дистиллированной воды.
Органическую фазу сушат, фильтруют и концентрируют досуха. Сгущают изопропиловым эфиром, затем очищают на двуокиси кремния, используя в качестве элюанта CH2Cl2-метанол (95-5), сгущают в изоэфире и получают 8,93 г целевого продукта (белый порошок).
Микроанализ
Рассчитано,%: C 55,61; H 5,99; N 9,27; S 15,9; O 13,23;
Получено,%: C 55,5; H 5,9; N 9,2; S 16,0; О - .
ИК-спектр: CHCl3
NH - - 3370 см-1
ассоциированный
> O - 1710-1635 см-1
Стадия B: 4'-((5-ацетил-2-бутил 4-(метилтио) 1H-имидаэол) 1-ил) метил)
N-((пропиламино)карбонил) (1,1'-бифенил)
2-сульфонамид.
В раствор 1 г продукта, полученного на стадии A, в 35 см3 этанола добавляют 20 см3 10%-го водного раствора хлорида аммония и 650 мг электроциклического цинка. Смесь перемешивают в течение 24 ч, затем фильтруют, выпаривают, вновь растворяют в этилацетате, промывают водой, сушат и выпаривают. Остаток очищают, пропуская через двуокись кремния, элюируя метиленхлоридом, содержащим 2% метанола. Получают 711 мг целевого продукта с точкой плавления 176-177oC.
Микроанализ
Рассчитано,%: C 59,
75; H 6,31; N 10,32; S 11,82
Получено,%: C 59,6; H 6,3; N 10,1; S 11,7.
ИК-спектр: CHCl3
NH - 3402 и 3368 см-1
> O - 1628
см-1
Ароматический - 1545-1525-1495 см-1
+ гетероароматический - 1541-1493 см-1
+ Амид II
Пример 27.
2-бутил-4-(метилтио)-1-[(2'-(((((дифенилметил) амино)карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 1H-имидазол 5-этилкарбоксилат.
Растворяют в 70 см3 толуола 1,8 г 2-бутил-1- [(2'-(((этоксикарбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 4-метилтио) 1H-имидазол-5-этилкарбоксилата, приготовленного, как указано в EP 0503162, и 1,16 г дифениламинометана. Нагревают около 14 ч до 85oC, охлаждают, добавляют AcOEt и промывают органическую фазу с помощью 1N HCl, затем водой. Сушат, выпаривают, кристаллизуют в простом эфире, центрифугируют и получают 0,8 г целевого продукта. Т.пл.=125oC.
ИК-спектр в CHCl3
=C-NH - 3366 см-1
> O - 1715-1689-1665
см-1
Пример 28. 2-бутил-1-[(2'-(((((дифенилметил)амино)карбонил) амино)сульфонил) (1,1'-бифенил) 4-ил)метил] 4-(метилтио) 1H-имидазол-5-карбоксилат калия (дисоль калия)
Вводят 7 мл EtOH 99
в 350 мг продукта из примера 27 и прикапывают 0,33 мл 6N КОН. Затем перемешивают около 48 ч при комнатной температуре, центрифугируют, промывают 2x2 мл EtOH 99. Сгущают с помощью 3,
5 см3
EtOH 96, перемешивают приблизительно 45 мин, центрифугируют, промывают 2x1 см3 EtOH 96, затем эфиром. Перекристаллизовывают при нагревании и при охлаждении в 5 см3 EtOH 96 и
получают 170 мг целевого продукта. Т.пл. выше 260oC.
ИК-спектр: Нюйол
Размытая область абсорбции OH/NH
> O - 1600 см-1
Ароматический - 1539 см-1
Гетероатом - 1517 см-1
Микроанализ: C36H34K2N4O5S2H2
Рассчитано,%: C 56,6; H 4,7; N 7,3; S 8,4
Получено,%: C 56,0; H 4,7; N 7,2; S 8,5.
Пример 29. 2-бутил-4-(метилтио) 1-[(2'-(((дифенилацетил) амино)сульфонил) (1, 1'-бифенил)4-ил) метил] 1H-имидазол-5-этилкарбоксилат.
В суспензию 10 мл толуола и 365 мг 1-[(2'-(аминосульфонил) (1,1'-бифенил)4-ил)метил] 2-бутил-4-(метилтио) 1H-имидазол 5-этилкарбоксилата, приготовленного, как описано в EP 0503162, добавляют 225 мг ацетилдифенилхлорида и 119 мг DMAP. Нагревают около 30 мин до 70oC, охлаждают, извлекают водой, экстрагируют этилацетатом, сушат и выпаривают. Кристаллизуют в 5 см3 ацетонитрила, затем при нагреве и охлаждении в 7 см3 ацетонитрила и получают 200 мг целевого продукта. Т.пл. > 210oC.
ИК-спектр: CHCl3
Отсутствие NH2
NH - 3360 см-1 + ассоциированный
C=O - 1725-1680 см-1
(сложный
эфир)
Ароматический - 1613-1600 см-1
Гетероцикл - 1560-1508 см-1
Амид II - 1496-1483 см-1
SO2 - 1346 см-1
Пример 30. 2-бутил-1-[(2'-(((дифенилацетил) амино) сульфонил) (1,1'-бифенил) 4-ил) метил] 4-(метилтио) 1H-имидазол-5-карбоновая кислота.
Растворяют в 10 мл MeOH 500 мг продукта из примера 29 и добавляют 5 мл 2N NaOH. Перемешивают в течение 18 ч при комнатной температуре, выпаривают метанол, поглощают водой, экстрагируют в этилацетате, подкисляют водную фазу с помощью 2N HCl (pH 1) и экстрагируют CH2Cl2, затем сушат и выпаривают. Перекристаллизовывают при нагреве и охлаждении в 50 см3 этанола и получают 340 мг целевого продукта. Т.пл.= 205oC.
ИК-спектр: Нюйол
Область OH/NH: макс. 3249 см-1 + общая абсорбция
> O - 1728-1645 см-1
Ароматический +
- 1584-1565 см-1
Гетероароматический - 1545-1510-1495 см-1
УФ-спектр: в ЭтОН
Макс. 284 нм - ε = 14400
Изг. 213,241
Пример 31.
α-бутил-α-гидрокси 4-(метилтио)1-[(2'-(((((фенилметил) амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 2-пропил-1Н-имидазол-5-этилацетат.
Стадия A: 4-(метилтио) α-оксо-1-[(2'-(((((фенилметил)амино) (карбонил) амино) сульфонил) (1,1'-бифенил)4-ил)метил] 2-пропил- 1H-имидазол-5-этилацетат.
Вводят 3,6 г продукта, полученного в приготовлении 3, в 50 см3 ацетона, затем за 1 раз 2 г карбоната калия. Среду затем доводят до температуры рефлюкса и прикапывают 1 см3 бензилизоцианата. Выдерживают при рефлюксе в течение 2 ч. Затем выливают в 500 см3 ледяной воды, подкисляют среду добавлением 1N соляной кислоты, центрифугируют, обильно промывают водой, сушат при 50oC. Очищают сгущением в 50 см3 изопропилового эфира и получают 4,2 г продукта, 500 мг которого очищают перекристаллизацией в 25 см3 этанола, после центрифугирования и сушки получают 300 мг целевого продукта. Т.пл.= 188oC.
ИК-спектр: CHCl3
=C-NH - 3375 см-1
C=O - 1714-1621 см-1
Сопряженная система +
- 1537 см-1
Ароматический + - 1495 см-1
Амид II +
Стадия B: α-бутил-α-гидрокси 4-(метилтио)
1-[(2'-(((((фенилметил) амино) карбонил)
амино) сульфонил) (1,1'-бифенил) 4-ил)метил] 2-пропил-1H-имидазол-5-этилацетат.
Вводят 750 мг продукта, полученного на стадии A, в 50 см3 безводного ТГФ, охлаждают до 0oC и прикалывают 2,8 см3 н-бутилхлорида магния, перемешивают при 0oC в течение 30 мин, затем при комнатной температуре в течение 1 ч. Реакционную среду подкисляют добавлением 0,1N соляной кислоты, затем экстрагируют этилацетатом. Органическую фазу обильно промывают водой, затем сушат. Получают желтую смолу. Очищают двумя последовательными хроматографиями на двуокиси кремния с элюантом CH2Cl2 + 2,5% метанола и получают 300 мг целевого продукта.
ИК-спектр: CHCl3
OH - 3520 см-1
NH - 3408 см-1
C=O - 1714 см-1
Сопряженная система - 1604 см-1
Ароматический - 1532 см-1
(размытый, F)
Амид II - 1500
см-1
Пример 32. α-бутил-α-гидрокси 4-(метилтио) 1-[(2'-(((((фенилметил) амино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил)
метил] 2-пропил-1H-имидазол-5-ацетат
натрия.
Вводят 260 мг продукта, полученного в примере 31, в 5 см3 едкого натра, 20 см3 этанола, перемешивают при комнатной температуре в течение 4 ч. Реакционную среду подкисляют добавлением 2N HCl, после экстрагирования этилацетатом промывшим в воде органическую фазу, затем высушивают, очищают хроматографией на двуокиси кремния с элюантом CH2Cl2-метанол. Снова очищают концентрированным HPL на двуокиси кремния с элюантом H2O-метанол (60-40) и получают 90 мг целевого продукта. Т.пл.= 210oC.
ИК-спектр: Нюйол
Размытая область абсорбции OH/NH
C=O - 1620 см-1 (F)
Ароматический - 1520 см-1
Гетероатом
- 1500 см-1
Амид II
Пример 33. 4'-[(5-(1,2-дигидроксиэтил) 4-(метилтио)2-пропил- 1H-имидазол-1-ил)метил] -N-(((фенилметил) амино) карбонил) (1,1'-бифенил)
2-сульфонамид.
Растворяют 500 мг продукта, полученного на стадии A примера 31, в 10 см3 ТГФ. Охлаждают до 0oC и добавляют 2 мл LiBH4 в растворе 2М/ТГФ. После выдерживания в течение 3 ч при комнатной температуре, добавляют 2 см3 уксусной кислоты, 20 см3 H2O и экстрагируют в AcOEt. Сушат и выпаривают досуха. После хроматографии на двуокиси кремния (элюант CH2Cl2/MeOH (94/6) и сгущения в изопропиловом эфире, получают 75 мг целевого продукта. Т.пл.=140oC.
Пример 34. α-гидрокси 4-(метилтио)-α -фенил-1-[(2'-(((((фенилметил) амино) карбонил) амино) сульфонил) (1,1'-бифенил) 4-ил) метил] 2-пропил-1H-имидазол-5-уксусная кислота.
Растворяют 250 мг продукта, полученного на стадии A примера 31, в 5 см3 безводного ТГФ. Прикапывают 430 мкл 3М PhMgBr в простом эфире. После выдерживания в течение 1 ч при комнатной температуре, гидролизуют с помощью 2N HCl, экстрагируют в AcOEt, сушат и выпаривают досуха.
Полученный остаток растворяют в смеси 5 см3 этанола и 5 см3 2N NaOH. После выдерживания в течение ночи при комнатной температуре подкисляют 1N HCl, фильтруют, промывают полученный осадок водой, затем 5 см3 AcOEt и 5 см3 изопропилового эфира. Получают 67 мг твердого белого продукта. Т.пл.= 170oC.
Пример 35. 2-бутил-4-(метилтио) 1-[(2'-((((пропиламино) карбонил)амино)сульфонил) (1,1'-бифенил) 4-ил) метил] 1H-имидазол-5- карбоксамид.
Вводят 600 мг 2-бутил-H-(метилтио)-1-[[2'- ((((пропиламино)карбонил)амино)сульфонил) (1,1'-бифенил)4-ил]метил] 1H-имидазол-5-карбоновой кислоты в 15 мл толуола и добавляют 600 мкл тионилхлорида SOCl2. Перемешивают при комнатной температуре 1 ч, оставляют на ночь при 55oC. Растворитель затем выпаривают, извлекают толуолом и снова выпаривают. Сушат, извлекают 15 мл диоксана и добавляют 10 капель 20%-ной NH4OH. После приблизительно 1 ч перемешивания подкисляют 1N HCl до pH 4, затем экстрагируют CH2 Cl2 и сушат. Очищают на двуокиси кремния с элюантом CH2Cl2-AcOEt (50-50), затем AcOEt-CH2Cl2-MeOH (50-50-5%) и после выпаривания получают 350 мг целевого продукта (твердое белое вещество).
ИК-спектр: CHCl3
=C-NH2 - 3383-3375 см-1
=C-NH - 3315 см-1
>
O - 1710-1651 см-1
Ароматический - 1616 см-1
Гетероароматический - 1584 см-1
Амид II - 1545 см-1
NH2 - 1506
см-1
Микроанализ: C36H33N5O4S2; M = 543
Рассчитано,%: C 57,4; H 6,12; N 12,87; S 11,79
Получено,%: C 57,6;
H 6,0; N 12,4; S 11,6.
Следующие соединения были получены по способу, описанному в примере 23 или 25, используя в качестве исходных соответствующие соединения:
Пример 36.
4-бром-1-((2'-(((((фенилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол-5-карбоновая кислота.
Т.пл.= 128oC rf=0,34 (MeOH-CH2 Cl2 20-80).
Пример 37. 4-бром-α-гидрокси-α-метил-1-((2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 2-пропил-1H-имидазол-5-уксусная кислота.
Т.пл.= 153oC, rf=0,46 (MeOH-CH2Cl2 20-80).
Пример 38. 4-(бутилтио) -α - оксо-1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил) (1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол-5-уксусная кислота.
Т.пл.= 192oC, rf=0,36 (MeOH-CH2 Cl2 20-80).
Пример 39. 4-(бутилтио)1-((2'-(((((фенилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол-5- карбоновая кислота.
Т.пл.= 197oC.
Пример 40. 1-((2'-(((3-циклопентил-1-оксопропил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)4-(метилтио)2-пропил-1H- имидазол-5-карбоновая кислота.
Т.пл. ≈190oC, rf=0,4 (CH2Cl2-MeOH 95-5).
Пример 41. α-гидрокси-α -метил-4-(метилтио)-1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 2-пропил-1H-имидазол-5-ацетамид.
Т.пл. = 213-215oC, rf=0,25 (CH2Cl2-MeOH 9-1).
Пример 42. 2-бутил-4-(метилтио)1-((2'-(((фенилацетил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)1H-имидазол-5-карбоновая кислота.
Т.пл. = 175oC
Пример 43. 2-бутил -α-гидрокси-α-метил-4-(метилтио)-1-((2'-(((фенилацетил) амино)сульфонил)(1,1'-бифенил)4-ил)метил)5-имидазолуксусная кислота
rf=0,4 (AcOEt-EtOH-H2O 70-20-10).
Пример 44. 2-этил-4-(метилтио)1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 1H-имидазол-5-карбоновая кислота.
Т.пл. = 164oC, rf = 0,6 (AcOEt-EtOH-H2O 70-20-10).
Пример 45. 1-((2'-(((((циклогексилметил)амино)карбонил)амино) сульфонил)(1, 1'-бифенил)4-ил)метил)4-(дифторметил)тио)2-пропил 1H-имидазол-5-карбоновая кислота.
Т.пл. = 125oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 46. 4-((дифторметил)тио)-1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил) 4-ил)метил)2-пропил-1H-имидазол-5-карбоновая кислота.
Т.пл. = 150oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 47. 4-((дифторметил)тио)-2-пропил 1 ((2'-(((((2-тиен-2-ил-этил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил) метил)1H-имидазол-5-карбоновая кислота.
Т.пл. = 130oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 48. 4-((дифторметил)тио)-1-((2'-(((((2-фенилэтил)амино) карбонил)амино)сульфонил)(1,1'-бифенил) 4-ил)метил)2-пропил-1H-имидазол-5-карбоновая кислота.
Т.пл. = 118oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 49. 1-((2'-(((((2-хлорфенилметил)амино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)4-((дифторметил)тио) 2-пропил-1H-имидазол 5-карбоновая кислота.
Т.пл. = 134oC, rf=0,1 (CH1Cl2-MeOH 95-5).
Пример 50. 4-((дифторметил)тио)-2-пропил 1-((2'-(((((2-тиенил- метил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 1H-имидазол-5-карбоновая кислота.
Т.пл. = 142oC, rf=0,1 (CH2Cl2 -MeOH 95-5).
Пример 51. 1-((2'-((((((1,3-бензодиоксол-5-ил)метил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил)4-((дифторметил)тио) 2-пропил 1H-имидазол 5-карбоновая кислота.
Т.пл. = 124oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 52. 4-((дифторметил)тио)1-((2'-(((((1-нафтилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 2-пропил-1H-имидазол-5-карбоновая кислота.
Т.пл. = 144oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 53. 4-((дифторметил)тио)-1-((2'-(((((3-фенилпропил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 2-пропил-1H-имидазол-5-карбоновая кислота.
Т.пл. = 108oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 54. 1-((2'-((((2-циклопентилэтил)карбонил)амино)сульфонил) (1, 1'-бифенил)4-ил)метил)4-((дифторметил)тио-2-пропил-1H-имидазол 5- карбоновая кислота.
Т.пл. = 118oC, rf=0,2 (CH2Cl2-MeOH 95-5).
Пример 55. 4-((дифторметил)тио)-1-((2'-(((((4-фторфенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол 5 карбоновая кислота.
Т.пл. = 122o C, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 56. 1-((2'-(((((2-циклогексен-1-ил-этил)амино)карбонил) амино)сульфонил)(1, 1'-бифенил)4-ил)метил)4-((дифторметил)тио) 2-пропил-1H-имидазол-5-карбоновая кислота.
Т.пл. = 114oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 57. 4-(метилтио)1-((2'-(((((1-фенилэтил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол-5- карбоновая кислота.
Т.пл. = 139oC, rf=0,15 (CH2Cl2-MeOH 95-5).
Пример 58. 1-((2'-((((2-циклогексиламино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)4-(метилтио)2-пропил-1H- имидазол-5 карбоновая кислота.
Т.пл. = 150oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 59. 2-бутил-4-хлор-1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил)1H-имидазол-5-карбоновая кислота.
Т.пл ≈ 135oC
Пример 60.
2-бутил-4-((дифторметил)тио)1-((2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил)1H-имидазол-5 карбоновая кислота.
rf=0,4 (CH2Cl2 -MeOH 90-10).
Пример 61. 2-бутил-1- (((((циклогекилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил)4-((дифторметил)тио) 1H-имидазол-5-карбоновая кислота.
Т.пл. = 130oC
Пример 62. 4-(метилтио)-1-((2'-((((фениламино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол-5-карбоновая кислота.
rf=0,55 (AcOEt-EtOH-H2O 70-20-10).
Пример 63. 1-((2'-(((((4-метилфенил)амино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)4-(метилтио)2-пропил 1H-имидазол-5 карбоновая кислота.
rf=0,70 (AcOEt-EtOH-H2O 70-20-10).
Пример 64. 2-этил-α-гидрокси-4-(метилтио)-α - фенил-1-((2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 1H-имидазол-5-уксусная кислота.
Т.пл. ≈ 200oC (разл.), rf = 0,25 (CH2Cl2-MeOH 90-10).
Пример 65. 2-бутил-β-гидрокси-4-(метилтио)-1-((2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 1H-имидазол-5-пропионовая кислота.
Т.пл. ≈ 190oC, rf = 0,1 (CH2Cl2-MeOH 90-10).
Пример 66. 1-((2'(((бутоксикарбонил)амино)сульфонил)(1,1'-бифенил) 4- ил)метил)4-(метилтио)2-пропил)-1H-имидазол-5-карбоновая кислота.
Т.пл. = 202-204oC, rf = 0,30 (CH2 Cl2-MeOH 90-10).
Пример 67. 4-(метилтио)-2-пропил-1-((2'-(((((2-тиенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) 1H-имидазол-5-карбоновая кислота.
Т.пл. ≈ 140oC, rf=0,1 (CH2Cl2-MeOH 95-5).
Пример 68. 1-((2'- (((((циклопентилметил)амино)карбонил) амино)сульфонил)(1, 1'-бифенил)4-ил)метил-4-(метилтио)2-пропил 1H-имидазол-5-карбоновая кислота.
Т.пл. ≈ 190oC, rf = 0,30 (CH2Cl2-MeOH 90-10).
По способу примера 28 получают следующее соединение.
Пример 69. 1-((2'(((((циклогексилметил)амино)карбонил)амино) сульфонил)(1, 1'-бифенил)4-ил)метил)2-этил-4-(метилтио)1H-имидазол-5-карбоксилат калия (соль калия).
Т.пл. > 260oC, rf = 0,33 (CH2Cl2-MeOH 90-10).
По способу примера 5, используя в качестве исходного вещества соответствующие кислоту или эфир и изоцианат, получают следующее соединение.
Пример 70. 4'-((5-формил-4-(метилтио)2-пропил-1H-имидазол-1-ил)метил) N-(((фенилметил)амино)карбонил)(1, 1'-бифенил)2-сульфонамид.
Т.пл. = 180oC, rf=0,3 (CH2Cl2 -AcOEt 70-30).
Пример 71. 2-бутил-1-(2'(((((циклогексилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил) α-гидрокси-4-метилтио)α -(трифторметил)1H-имидазол-5-уксусная кислота.
rf=0,45 (AcOEt-EtOH-H2O 70-20-10).
Пример 72. 2-бутил-α- гидрокси-4-(метилтио)-1-((2' (((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) α- трифторметил) 1H-имидазол-5-уксусная кислота.
rf=0,60 (AcOEt-EtOH-H2O 70-20-10).
Пример 73. 2-бутил 4-(метилтио)1-((2' ((((фениламино)карбонил) амино)сульфонил)(1, 1'-бифенил)4-ил)метил)1H-имидазол-5-карбоновая кислота.
Т.пл. ≈ 165oC, rf = 0,65 (AcOEt-EtOH-H2O 70-20-10).
Пример 74. 2-бутил-α -гидрокси-5-(метилтио)-1-((2' (((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил) α-(трифторметил) 1H-имидазол-4-уксусная кислота.
rf=0,25 (AcOEt-EtOH-H2O 70-20-10).
Пример 75. 2-бутил-1-(2' (((((циклогексилметил)амино)карбонил) амино)сульфонил)(1,1'-бифенил)4-ил)метил) 4-(метилтио)1H-имидазол-5-карбоновая кислота.
Т.пл. ≈ 175oC, rf = 0,6 (CH2Cl2-MeOH 80-20).
Пример 76. 1-((2'(((((циклогексилметил)амино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)4-(метилтио)2-пропил 1H-имидазол-5-этилкарбоксилат.
Т.пл. ≈ 104oC, rf=0,6 (CH2Cl2-MeOH 80-20).
По способу примера 26, используя в качестве исходного соответствующий эфир или хлороформиат, получают следующее соединение.
Пример 77. 1-((2'-(((бутоксикарбонил)амино)сульфонил)(1,1'-бифенил) 4-ил)метил)4-(метилтио)2-пропил 1H-имидазол-5-этилкарбоксилат.
rf=0,40 (AcOEt-гексан 60-40).
Действуя также, как в примере 20, стадия B, но используя в качестве исходного производное соответствующего соединения, получают следующие соединения.
Пример 78. Na-содержащее производное 4'-((2-бутил -5-(α- гидрокси (1H-тетразолил)метил-4-(метилтио)1H-имидазол-1-ил) метил)N-(((фенилметил)амино)карбонил)(1,1'-бифенил)2-сульфонамид.
Т.пл. = 180oC, rf=0,2 (CH2Cl2-MeOH 80-20).
Пример 79. 3-(2-бутил-1-((2'-((((пропиламино)карбонил)амино) сульфонил)(1, 1'-бифенил)4-ил)метил)4-(метилтио)1H-имидазол-5-ил) 3-гидроксиэтилпропаноат.
Т.пл. = 135-136oC
Действуя так же, как на стадии B примера 31 или по способу примера
34, но используя соответствующие магнийорганическое
соединение и эфир, получают следующее соединение.
Пример 80. α-этил α -гидрокси-4-(метилтио)1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1, 1'-бифенил)4-ил)метил)2-пропил-1H-имидазол 5-ацетат натрия (соль натрия).
Т.пл. = 215oC, rf=0,35 (CH2Cl2-MeOH 90-10).
Пример 81. α-гидрокси α-гексил-4-(метилтио)1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1, 1'-бифенил)4-ил)метил)1H-имидазол-5-ацетат натрия (соль натрия).
Т.пл. ≈ 190oC, rf=0,35 (CH2Cl2-MeOH 90-10).
Пример 82. α-гидрокси 4-(метилтио) α-(фенилметил)-1-((2'-(((((фенилметил) амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил)-2-пропил 1H-имидазол-5-ацетат натрия (соль натрия).
Т.пл. = 220oC, rf=0,3 (CH2Cl2-MeOH 90-10).
Пример 83. α-гидрокси-α- (1-метилэтил)-4-(метилтио)1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил 1H-имидазол-5- уксусная кислота.
Т.пл. = 180oC, rf=0,36 (CH2Cl2-MeOH 90-10).
Пример 84. α-этенил-α-гидрокси 4-(метилтио)1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил)2-пропил-1H-имидазол 5-уксусная кислота.
Т.пл. = 225oC, rf=0,15 (CH2 Cl2-MeOH 90-10).
Нагревая до 100oC соответствующий карбамат с циклопентилметиламином в толуоле,
получают соответствующее соединение:
Пример 85.
1-((2'-(((((циклопентилметил)амино)карбонил)амино) сульфонил)(1,1'-бифенил)4-ил)метил)4-(метилтио)-2-пропил 1H-имидазол-5-этилкарбоксилат.
Т.пл. ≈ 163oC, rf=0,5 (CH2Cl2-AcOEt 80-20).
Гидрируя 2 ч при 50oC при давлении 2 бар соответствующее производное в метаноле в присутствии катализатора, получают следующее производное.
Пример 86. 2-бутил-α-метил 4-(метилтио)1-((2'-(((((фенилметил)амино) карбонил)амино)сульфонил)(1, 1'-бифенил)4-ил)метил)1H-имидазол 5-уксусная кислота.
rf=0,30 (CH2Cl2-MeOH 90-10).
Пример 87 (фармацевтическая композиция).
Приготавливают таблетки по следующей формуле:
Продукт
примера 15 - 50 мг
Эксципиент таблетки - 200 мг
(составляющие эксципиента: лактоза, тальк, крахмал, стеарат
магния).
ФАРМАКОЛОГИЧЕСКИЕ РЕЗУЛЬТАТЫ
1 - Тест
с рецептором AT1 ангиотензина II
Используют свежий мембранный препарат печени крысы. Ткань измельчают в
политроне в буферном растворе 50 мМ Tris pH 7,4, с последующими 3
центрифугированиями со скоростью 30000 g 15 мин с промежуточным отбором осадков в буферном растворе Tris pH 7,4.
Последние осадки переводятся в суспензию в инкубационном буферном растворе (20 мM Tris, 135 мМ NaCl, 10 мМ KCl, 5 мМ глюкозы, 135 мМ MgCl2, 0,3 мM PMSF, 0,1 мM бацитрацина, 0,1% лизоцима).
1 мл аликвотных (кратных) фракций помешают в стеклянные трубки и добавляют125I ангиотензина II (25000 DPM/трубка) и исследуемый продукт. Сначала тестируют 3•10-5 М продукта, в тройном количестве. Когда тестируемое соединение смещает более 50% радиоактивности, специфически связанной с рецептором, он тестируется заново в диапазоне семи концентраций с целью определения концентрации, которая ингибирует 50% радиоактивности, специфически связанной с рецептором. Таким образом определяют концентрацию 50%-ного ингибирования.
Неспецифическую связь определяют добавлением 10-5 М соединения примера 94 европейского патента 0253310 (в тройном количестве). Инкубируют при 25oC в течение 150 мин, помещают в водяную баню при 0oC на 5 мин, фильтруют в вакууме, промывают буферным раствором Tris pH 7,4 и определяют радиоактивность в присутствии твердого сцинтиллирующего агента.
Результат выражают непосредственно в концентрации 50%-ного ингибирования (КИ50), то есть в концентрации исследованного соединения, выраженной в Нм, необходимой для смещения 50% специфической радиоактивности, связанной с исследуемым рецептором (см. табл. 1).
2 - Тест с рецептором AT2 ангиотензина II
Используют свежий мембранный препарат,
приготовленный из матки крольчихи, предварительно обработанную за 4 дня
до тестирования путем мкг эстрадиола, введенного подкожно. Ткань измельчают в политроне в буферном растворе 50 мМ Tris, pH 7,4,
с последующими тремя центрифугированиями со скоростью 30000 g 15 мин с
промежуточным отбором осадков в буферном растворе Tris pH 7,4.
Последние осадки переводят в суспензию в инкубационном буферном растворе (20 мМ Tris, 135 мМ NaCl, 10 мМ KCl, 5 мМ глюкозы, 10 мМ MgCl2•6H2O, 0,3 мМ PMSF, 0,1 мМ бацитрацина, 0,1% лизоцима, pH 7,4).
Полученный гомогенат преинкубируют в течение 20 мин при 25o C в присутствии 10 мМ дитиотрентола, затем доводят до 0-4oC.
1 мл аликвотных фракций помещают в стеклянные трубки и добавляют125I ангиотензина II (25000 DPM/трубка) и исследуемое соединение. Сначала тестируют 3•10-5 М соединения (в тройном количестве). Когда тестируемое соединение смещает более 50% радиоактивности, специфически связанной с рецептором, его тестируют заново в диапазоне семи концентраций с целью определения концентрации, которая ингибирует 50% радиоактивности, специфически связанной с рецептором. Таким образом, определяют концентрацию 50% ингибирования.
Неспецифическая связь определяется добавлением ЕХР 655 (= PD 123-177 Warner-Lamber) в количестве 10-5 М (в тройном количестве). Инкубируют при 25oC в течение 150 мин, помещают в водяную баню при 0oC на 5 мин, фильтруют в вакууме, промывают в буферном растворе Tris pH 7,4 и определяют радиоактивность в присутствии твердого сцинтиллятора.
Результат выражают непосредственно в концентрации 50% ингибирования (КИ50), то есть в концентрации тестируемого соединения, выраженной в нМ, необходимой для смещения 50% специфической радиоактивности, связанной с исследуемым рецептором (см. табл. 2).
Для соединений P1-P13, описанных выше, получены следующие результаты (см. табл. 3).
3 - Тест на антагонистическую активность к ангиотензину II у
демедулированной крысы
Самцы крыс Spraque-Dawley (250-350 г) анестезированы внутрибрюшинно
пентабарбиталом натрия (60 мг на кг). Диастолическое артериальное давление регистрируется с помощью
катетера (ПЭ 50) с гепарином, введенного в левую сонную артерию животного и соединенного с прибором,
фиксирующим давление (Gould, Pressure Processor) через датчик давления Gould.
Катетер вводят в правую яремную вену животного для обеспечения инъекции молекул исследуемого соединения. Животное смещают под аппарат, искусственного дыхания. Осуществляют двустороннее сечение блуждающих нервов. Крыса таким образом демедулирована.
После периода, достаточного для
стабилизации, приступают к изучению антагонизма соединений по отношению к ангиотензину II
(Гипертензин, Циба) следующим образом:
- три последовательные инъекции ангиотензина II (0,75 мг/кг) с
интервалом 15 мин позволяют получить воспроизводимую и стабильную ответную реакцию на
величину давления;
- сохраняя 15-минутную периодичность введения ангиотензина II, соединения (0,01-10
мг/кг) вводятся за 5 мин до введения ангиотензина II. Величина давления, вызванного
ангиотензином II в присутствии антагониста, выражается в процентах по отношению к величине давления, вызванного
одним ангиотензином II. Таким образом определяется доза 50% ингибирования (ДИ50) исследуемого соединения (см. табл. 4).
Каждое животное было использовано и как контрольное.
Реферат
Изобретение касается химии и
медицины. Предложено новое средство, фармацевтические композиции на его основе для лечения заболеваний, связанных с аномальной стимуляцией рецепторов АТ1 и АТ2, - соединение
формулы I
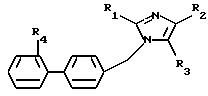
Значения радикалов приведены в формуле. Предложены новые соединения с вышеуказанной активностью и способы их получения. 6 с. и 9 з.п.ф-лы, 4 табл.
Формула
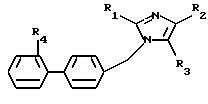
в которой R1 - алкил, алкилтио и алкокси, линейный или разветвленный, содержащий не более 6 атомов углерода; арил, арилтио, арилокси или арилалкил, в котором алкил, линейный или разветвленный, содержит не более 6 атомов углерода;
R2 означает
а) радикалы - S-R, -O-R и
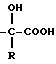
в которых R - алкил или алкенил, линейный или разветвленный, содержащий не более 8 атомов углерода; циклоалкил, содержащий не более 6 атомов углерода, или арил, причем алкил, алкенил, циклоалкил и арил могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, гидроксила, алкокси и алкилтио, линейного или разветвленного, содержащего не более 6 атомов углерода и фенила, при необходимости замещенного одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксила, алкокси, линейного или разветвленного, содержащего не более 6 атомов углерода,
б) атом галогена,
в) радикал
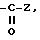
где Z - гидроксил, алкокси или карбокси свободный, превращенный в соль или этерифицированный,
R3 выбирают из карбоксирадикала свободного, превращенного в соль или этерифицированного; ацильного радикала, при необходимости замещенного фенилом, тиенилом или тетразолилом; атома галогена; алкила, алкенила или алкилтио, линейного или разветвленного, содержащего не более 8 атомов углерода и, при необходимости, замещенного одним или несколькими радикалами, выбранными из атомов галогена, или радикалов: гидроксила, алкокси, ацила, арила; карбокси свободного, превращенного в соль, этерифицированного или амидированного; радикалов
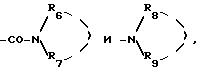
в которых либо R6 и R7 или R8 и R9, одинаковые или различные, выбираются из атома водорода; радикалов ацил, алкил и алкенил, содержащих не более 6 атомов углерода, и алкилсульфонил и арилсульфонил, причем радикалы могут быть замещены одним или несколькими радикалами, одинаковыми или различными, выбранными из атомов галогена, гидроксила, алкоксирадикалов, содержащих не более 6 атомов углерода, или карбокси свободного радикала, превращенного в соль или этерифицированного; радикалов арил, арилалкил и арилалкенил, в которых алкил и алкенил, линейные или разветвленные, содержат не более 6 атомов углерода, при этом радикалы арил, арилалкил и арилалкенил могут быть замещены одним или несколькими радикалами, выбранными из атомов галогенов, гидроксила, нитро, алкила, алкенила, галоалкила, алкокси, и ацила, содержащих не более 6 атомов углерода, аминорадикала, возможно замещенного одним или двумя алкильными радикалами, одинаковыми или различными, содержащими не более 6 атомов углерода и карбоксирадикалов, свободных, превращенных в соль или этерифицированных либо, с одной стороны, R6 и R7, и с другой стороны, R8 и R9 образуют соответственно с атомом азота, с которым они связаны, гетероциклический радикал, выбираемый из радикалов имидазолила, пирролила, пирролинила, пирролидинила, пиперидинила, пиримидинила, пиридазинила, пиперазинила, фенилпиперазинила, оксазолила, морфолинила и тиоморфолинина, азепина, индолила, причем эти радикалы могут быть замещены одним или несколькими радикалами, одинаковыми или различными, выбранными из атомов галогена, радикалов гидроксила, трифторметила, радикалов алкила и алкилокси, содержащих не более 6 атомов углерода, либо R8 и R9, одинаковые или различные, означают аминокислоту, или один из R8 и R9 означает радикал карбамоил, алкоксикарбонил или бензилоксикарбонил, или R8 и R9 образуют вместе с атомом азота, с которым они связаны, радикал фталимидо или сукцинимидо,
R4 представляет собой:
а) радикалы -(CH2)m1-COOR14, -(CH2)m1-CONHR14, -(CH2 )m1-CN, где m1 означает целое число от 0 до 4, -SO2-NH-SO2-R14, -NH-SO2-R14, -PO3R14, -NH-SO2-CF3 и
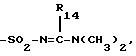
-(CH2)m1-SO3R14, -CO-NH-OR14, -CO-NH-NH-SO2-CF3, -CO-NH-SO2-R14, -CH2SO2NHCO-R14, -CH2-SO2-NHR14, -CH2 CONH-SO2R14, -NHSO2 NHCO-R14, -NHCONHSO2-R14, NH-CH2-SO2-NHR14, -CONHSO2NR14 R15, -SO2NHCONR14R15, -SO2N(R14)OR15, -SO2NHPO(R14)2, -CONHPO(R14)2, -SO2NHCN, -SO2NHCOR14, SO2-NHCO2R14, -SO2NHSO2NR14R15, -SO2NHSO2 N(-CH2-CH2-)2D, -NHSO2NHSO2R14, -NHSO2NHPO(R14)2,
-NR14COCO2H, -SO2NHCO2R14, -SO2 -NH-CS-R14, -SO2-NH-CS-NH-R14, где D - атом кислорода или серы,
б) радикал -SO2-W-R14, где W - радикал -NR15-, -NH-CO-, -NH-CO-O-, -N= CH-N-R15- или -NH-CO-NR15-, радикал, в котором либо R14 и R15, одинаковые или различные, выбираются из атома водорода, радикала алкила или алкенила, линейного или разветвленного, содержащего не более 8 атомов углерода, циклоалкила, содержащего не более 6 атомов углерода, и арила, причем радикалы алкила, алкенила, циклоалкила и арила могут быть замещены одним или несколькими радикалами, выбранными среди атомов галогена, радикалов гидроксил, алкокси, содержащего не более 4 атомов углерода, нитро, циано, амино, моно и диалкиламино, карбокси, свободного, превращенного в соль или этерифицированного, галоалкила, алкилтио, галоалкилтио, галоалкокси, карбамоила, ацила, ацилокси, циклоалкила, циклоалкенила, арила, фенилтио, пиридила, тетразолила, тиенила, нитропиридила, пиримидила, диазолила, пиперидинила, алкилпиперидинила, тиазолила, алкилтиазолила, тетрагидрофуранила и метилтетрагидрофуранила, возможно замещенных одним или несколькими радикалами, выбранными из атомов галогена и радикала гидроксила или алкоксила, содержащего не более 4 атомов углерода; либо R14 и R15 образуют с атомом азота, с которым они связаны, радикал, выбранный среди радикалов пирролила, пирролинила, пирролидинила, пиперазинила, алкилпиперазинила, фенилпиперазинила, морфолинила и индолинила, причем алкильные радикалы в продуктах формулы I могут быть прерваны одним или несколькими гетероатомами, выбранными из атомов кислорода, серы и азота, а атомы серы в продуктах формулы I могут быть окислены до сульфона или сульфоксида, при этом вышеназванные продукты формулы I находятся во всех возможных формах рацемических изомеров, энантиомеров и диастереоизомеров, а также их солей присоединения с органическими и неорганическими кислотами или с органическими и неорганическими основаниями.
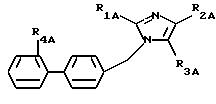
где R1А - алкил или алкилтио, линейный или разветвленный, содержащий не более 6 атомов углерода;
R2А представляет
а) радикалы - S-RА и
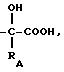
в которых RА - алкил или алкенил, линейный или разветвленный, содержащий не более 8 атомов углерода, циклоалкил или фенил, причем эти радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, в частности фтором,
б) атом галогена,
в) радикал
где Z - карбоксирадикал, свободный, превращенный в соль или этерифицированный,
R3А означает карбоксирадикал, свободный, превращенный в соль, этерифицированный или амидированный; формил и ацетилрадикал, возможно, замещенный радикалом фенил, бензил, фенэтил или тетразолил; атом галогена; алкил, алкенил или алкилтио, линейный или разветвленный, содержащий не более 8 атомов углерода, возможно, замещенный одним или несколькими радикалами, выбранными из радикалов: гидроксил, алкокси, ацил, фенил, карбокси свободный, превращенный в соль, этерифицированный или амидированный, карбамоил и амино, возможно замещенные на атоме азота одним или двумя радикалами, выбранными из алкилрадикалов, содержащих не более 6 атомов углерода, радикалов ацил, алкилсульфонил, фенилсульфонил, фенил, фенилалкил, причем эти радикалы, при необходимости, замещены одним или несколькими радикалами, выбранными из атомов галогена, гидроксирадикала и алкоксирадикалов, линейный или разветвленных, содержащих не более 4 атомов углерода;
R4А означает SO2-WА-R16А , где WА - представляет радикал -NH-, -NH-CO-, -NH-CO-O-,
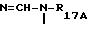
или -NH-CO-NH-, R16А и R17А представляют атом водорода, радикал алкил или алкенил, линейный или разветвленный, содержащий не более 4 атомов углерода, или радикал арил, причем эти радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, алкокси, содержащего не более 4 атомов углерода, нитро, циано, амино, моно- и диалкиламино, карбокси свободного, превращенного в соль или этерифицированного, циклогексил, циклогексенил, пиридил, тиенил и фенил, причем эти радикалы могут быть замещены атомом галогена или радикалом гидроксил или алкокси, содержащим не более 4 атомов углерода, при этом атомы серы в соединениях формулы IА могут быть окислены до сульфона или сульфоксида, при этом продукты формулы IА находятся во всех возможных формах рацемических изомеров, энантиомеров и диастереоизомеров,
а также их соли присоединения с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
-2-бутил-1-[(2'-(((((циклогексилметил)амино)карбонил)амино)сульфонил)(1, 1'-бифенил)4-ил)метил]4-(метилтио)1Н-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'-(((((1-β-фенил пропил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'-(((((1-(4-фенилбутил))амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота,
-2-бутил-1-[(2'-((((((4-метокси)фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил]4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутил-1-[(2'-((((((4-фтор)фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутил-1-[(2'-(((((1-(1-карбокси-2-фенил)этил)амино)карбонил)амино)сульфонил(1,1'-бифенил)4-ил)метил] 4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)-1-[(2'-((((2-тиенил)метоксикарбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота,
-2-бутил-4(метилтио)1-[(2'-((((3-тиенил)метоксикарбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота,
-2-бутил-1-(2'-((((циклогексен-4-ил)метоксикарбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутил-1-(2'-((((циклогексил)метоксикарбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил]4-метилтио-1Н-имидазол-5-карбоновая кислота,
-2-бутилтио-4-(метилтио)-1-[(2'-(((фенилметоксикарбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота,
-((4'-((2-бутил-5-формил-4-метокси-1Н-имидазол-1-ил)метил)(1,1'-бифенил)2-ил)сульфонил)карбамат(фенилметилена).
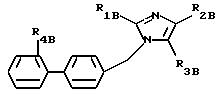
где R1B - алкильный радикал, линейный или разветвленный, содержащий не более 4 атомов углерода;
R2B - радикал алкилтио, линейный или разветвленный, содержащий не более 4 атомов углерода, возможно замещенный одним или несколькими атомами фтора;
R3B представляет карбоксирадикал свободный, превращенный в соль, этерифицированный или амидированный; ацил, карбамоил; алкил и алкенил, содержащие не более 6 атомов углерода, замещенные одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксила, алкокси, карбокси, свободного, превращенного в соль, этерифицированного или амидированного, фенила и карбамоила, возможно замещенного фенилом или бензилом,
R4B представляет радикал -SO2-NH2, -SO2-N=CH-N(CH3)2,
-SO2-NH-CO2Et, -SO2-NH-CO2Pr, -SO2-NH-CO2Bu, -SO2-NH-CO2H,
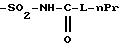
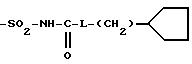
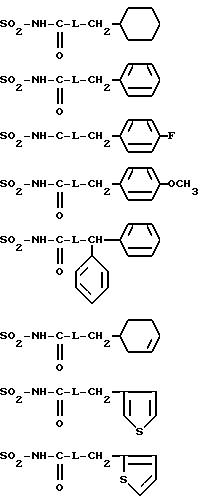
где L означает -O- или -NH-,
при этом атомы серы в соединениях формулы (IB) могут быть окислены до сульфона или сульфоксида, причем названные соединения формулы (IB) находятся во всех возможных формах рацемических изомеров, энантиомеров и диастереоизомеров, а также их соли присоединения с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
-2-бутил-α-гидрокси-α -метил-4-(метилтио)1-[(2'-((((фенилметокси)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-уксусная кислота,
-2-бутил-α-гидрокси-α -метил-4-(метилтио)1-[(2'-((((пропиламино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-уксусная кислота,
-2-бутил-α-гидрокси-α -метил-4-(метилтио)1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-уксусная кислота,
-2-бутил-1-[(2'-(((((циклогексилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил]-α-гидрокси-α-метил-4-(метилтио)1Н-имидазол-5-уксусная кислота,
-1-[(2'-(((фенилметил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] α-гидрокси-4-(метилтио)-2-пропил-1Н-имидазол-5-уксусная кислота,
-1-[(2'-(((((циклогексилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил]4-(метилтио)2-пропил-1Н-имидазол-5-карбоксилат натрия,
-4-(метилтио)1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 2-пропил-1Н-имидазол-5-карбоновая кислота,
-α-бутил-α -гидрокси-4-(метилтио)-1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 2-пропил-1Н-имидазол-5-ацетат натрия,
-α-гидрокси-4-(метилтио)-α -фенил-1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 2-пропил-1Н-имидазол-5-уксусная кислота,
-1-[(2'-(((((циклогексилметил)амино)карбонил)амино)сульфонил)(1, 1'-бифенил)4-ил)метил] -4-((дифторметил)тио)-2-пропил-1Н-имидазол-5-карбоновая кислота,
-4-((дифторметил)тио)-1-[(2'-(((((фенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 2-пропил-1Н-имидазол-5-карбоновая кислота,
-4-((дифторметил)тио)2-пропил-1-[(2'-(((((тиенилметил)амино)карбонил)амино)сульфонил)(1,1'-бифенил)4-ил)метил] 1Н-имидазол-5-карбоновая кислота.
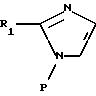
в которой R'1 имеет значение, указанное выше для R1, в котором возможные реакционноспособные функции могут быть защищены защитными группами, а P представляет защитную группу атома азота, подвергают галогенированию с образованием соединения формулы III
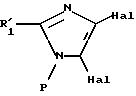
где R'1 и P имеют значения, указанные выше, и Hal представляет атом галогена, которое подвергают реакции обмена галоген - металл с одним из атомов галогена, затем реакции взаимодействия с соединением формул IVa, IVb, IVc, IVd или IVe:
(-S-R')2 (IVa) или MeSO2SR' (IVb)
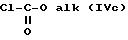
или
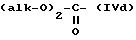
или
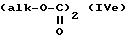
в которых R' имеет значение, указанное выше для R, в котором возможные реакционноспособные функции могут быть защищены защитными группами, а alk означает алкильный радикал, содержащий не более 4 атомов углерода, с образованием соединения формулы V
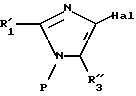
где R'1, P и Hal имеют значения, указанные выше, и R''3 представляет -S-R' или K-O-alk, определенные выше, где K представляет радикал
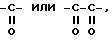
полученное соединение формулы V подвергают реакции обмена галоген - металл с атомом галогена, затем реакции взаимодействия с соединением формул IV'a, IV'b, IV'c, IV'd или IV'e: (-S-R'')2 (IV'a) или MeSO2SR'' (IV'b)
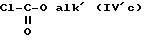
или
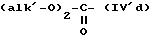
или
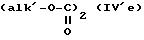
в которых R'', одинаковый или отличный от R', имеет значение, указанное выше для R, в котором возможные реакционноспособные функции могут быть защищены защитными группами;
alk', одинаковый или отличный от alk, означает алкильный радикал, содержащий не более 4 атомов углерода,
с получением соединения формулы VII
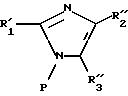
в которой R'1 и P имеют указанные выше значения;
R''2 и R''3, одинаковые или различные, представляют -S-R', -S-R'', -K-O-alk или -K-O-alk', описанные выше, в которых R', R'', alk, alk' и K имеют значения, указанные выше, затем соединение формулы VII, после освобождения блокированной аминофункции с помощью группы P, определенной выше, вводят во взаимодействие с соединением формулы VIII
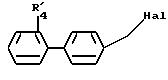
в которой R'4 имеет значение, указанное выше для R'4, и в которой возможные реакционные функции могут быть защищены защитными группами;
Hal обозначает атом галогена,
с получением соединения формулы I1

где R'1, R''2, R''3 и R'4 имеют значения, указанные выше,
причем соединения формул I1, могут быть соединениями формулы I и могут быть для получения других соединений формулы I подвергнуты одной или несколькими реакциями преобразования в любом порядке, а именно: а) этерификации кислотной функции, b) омылению эфирной функции в кислотную функцию, c) преобразованию эфирной функции в ацильную функцию, d) преобразованию цианофункции в кислотную функцию, e) преобразованию кислотной функции в амидную функцию, затем, при необходимости, в тиоамидную функцию, f) восстановлению карбоксифункции до спиртовой, g) преобразованию алкоксифункции в гидроксилфункцию или гидроксифункции в алкоксифункцию, h) окислению спиртовой функции до альдегида, кислоты или кетона, i) преобразованию формильного радикала в карбамильный радикал, j) преобразованию карбамильного радикала в нитрильный радикал, k) преобразованию нитрильного радикала в тетразолил, l) окислению группы алкилтио или арилтио до сульфоксида или сульфона соответственно, m) преобразованию сульфида, сульфоксида или сульфона в соответствующий сульфоксимин, n) преобразованию оксофункции в тиоксо, o) дегидратации гидроксилалкильного радикала в алкенильный радикал, p) преобразованию кислотной функции в функцию
q) преобразованию β-кето-сульфоксида в α-кетотио эфир, r) преобразованию карбамата в мочевину и, в частности, сульфонилкарбамата в сульфонилмочевину, s) удалению защитных групп, которые могут нести реакционноспособные функции, t) солеобразованию минеральной или органической кислотой или основанием для получения соответствующей соли, u) разделению путем фракционной кристаллизации рацемических форм на раздвоенные соединения, причем полученные таким образом соединения формулы I имеют все возможные формы рацемических изомеров, энантиомеров и диастереоизомеров.
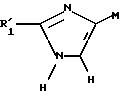
в которой R'1 имеет указанное выше значение;
M представляет атом водорода или радикал R'2, который имеет значение, указанное выше для R2, в котором возможные реакционные функции могут быть защищены защитными группами,
подвергают реакции с соединением формулы VIII, определенным выше, с получением соединения формулы X
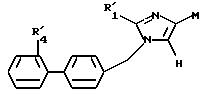
в которой R'1 M и R'4 имеют значения, указанные выше,
полученное соединение формулы X в случае, когда M представляет R'2, определенный выше, подвергают галогенированию с получением соединения формулы XI
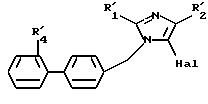
в которой R'1, R'2, R'4 и Hal имеют указанные выше значения,
которое подвергают реакции обмена галоген - металл, затем реакции взаимодействия с соединением формулы XII
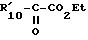
в которой R'10 имеет значение, указанное выше для R10,
в котором возможные реакционные функции возможно защищены защитными группами, с получением соединения формулы I2
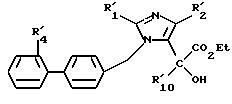
в которой R'1, R'2, R'4 и R'10 имеют значения, указанные выше,
или соединение формулы I2 при желании омыляют с получением соединения формулы I4
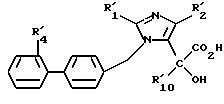
в которой R'1, R'2, R'4 и R'10 имеют значения, указанные выше,
полученное соединение формулы X в случае, когда M представляет атом водорода, подвергают галогенированию, с получением соединения формулы XIV
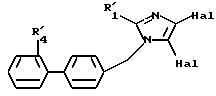
где R'1, R'4 и Hal, имеют указанные выше значения,
которое вводят в реакцию обмена галоген - металл, затем подвергают взаимодействию с соединением формул IVa, IVb, IVc, IVd или IVe, определенных выше, с получением соединения формулы I7
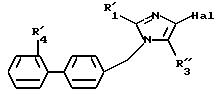
в которой R'1, R'4, Hal и R''3 имеют указанные выше значения,
которое можно подвергнуть реакции обмена галоген - металл, затем взаимодействию с соединением формул IV'a, IV'b, IV'c, IV'd или IV'e, определенных выше, с получением соединения формулы I8
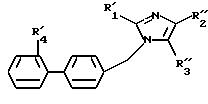
в которой R'1, R'4, R''2 и R''3 имеют значения, указанные выше,
причем соединения формул I2, I4, I7 и I8 могут быть соединениями формулы I и могут быть для получения других соединений формулы I, подвергнуты одной или несколькими реакциям преобразования в любом порядке, а именно: а) этерификации кислотной функции, b) омылению эфирной функции в кислотную функцию, c) преобразованию эфирной функции в ацильную функцию, d) преобразованию цианофункции в кислотную функцию, e) преобразованию кислотной функции в амидную функцию, затем, при необходимости, в тиоамидную функцию, f) восстановлению карбоксифункции до спиртовой, g) преобразованию алкоксифункции в гидроксилфункцию или гидроксифункции в алкоксифункцию, h) окислению спиртовой функции до альдегида, кислоты или кетона, i) преобразованию формильного радикала в карбамильный радикал, j) преобразованию карбамильного радикала в нитрильный радикал, k) преобразованию нитрильного радикала в тетразолил, l) окислению группы алкилтио или арилтио до сульфоксида или сульфона, соответственно, m) преобразованию сульфида, сульфоксида или сульфона в соответствующий сульфоксимин, n) преобразованию оксофункции в тиоксо, o) дегидратации гидроксилалкильного радикала в алкенильный радикал, p) преобразованию кислотной функции в функцию
q) преобразованию β-кето-сульфоксида в α-кето тио эфир, r) преобразованию карбамата в мочевину и, в частности, сульфонилкарбамата в сульфонилмочевину, s) удалению защитных групп, которые могут нести реакционноспособные функции, t) солеобразованию минеральной или органической кислотой или основанием для получения соответствующей соли, u) разделению путем фракционной кристаллизации рацемических форм на раздвоенные соединения, причем полученные таким образом соединения формулы I имеют все возможные формы рацемических изомеров, энантиомеров и диастереоизомеров.
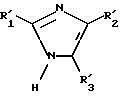
в которой R'1 и R'2 имеют значения, указанные выше;
в котором возможные реакционные функции возможно защищены защитными группами, подвергают реакции взаимодействия с соединением формулы VIII, определенным выше, с получением соединения формулы I'
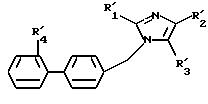
в которой R'1 и R'2, R'3 и R'4 имеют значения, указанные выше, причем соединения формулы I' могут быть соединениями формулы I и могут быть для получения других соединений формулы I подвергнуты одной или нескольким реакциям преобразования в любом порядке, а именно: а) этерификации кислотной функции, b) омылению эфирной функции в кислотную функцию, c) преобразованию эфирной функции в ацильную функцию, d) преобразованию цианофункции в кислотную функцию, e) преобразованию кислотной функции в амидную функцию, затем, при необходимости, в тиоамидную функцию, f) восстановлению карбоксифункции до спиртовой, g) преобразованию алкоксифункции в гидроксилфункцию или гидроксифункции в алкоксифункцию, h) окислению спиртовой функции до альдегида, кислоты или кетона, i) преобразованию формильного радикала в карбамильный радикал, j) преобразованию карбамильного радикала в нитрильный радикал, k) преобразованию нитрильного радикала в тетразолил, l) окислению группы алкилтио или арилтио до сульфоксида или сульфона соответственно, m) преобразованию сульфида, сульфоксида или сульфона в соответствующий сульфоксимин, n) преобразованию оксофункции в тиоксо, o) дегидратации гидроксилалкильного радикала в алкенильный радикал, p) преобразованию кислотной функции в функцию
q) преобразованию β-кето-сульфоксида в α-кето тио эфир, r) преобразованию карбамата в мочевину и, в частности, сульфонилкарбамата в сульфонилмочевину, s) удалению защитных групп, которые могут нести реакционноспособные функции, t) солеобразованию с минеральной или органической кислотой или с основанием для получения соответствующей соли, u) разделению путем фракционной кристаллизации рацемических форм на раздвоенные соединения, причем полученные таким образом соединения формулы I имеют все возможные формы рацемических изомеров, энантиомеров и диастереоизомеров.

Комментарии