Способ синтеза ароматических оксимов - RU2720240C2
Код документа: RU2720240C2
Описание
Настоящее изобретение относится к способу синтеза молекул, содержащих оксимную функциональную группу.
Оксим легко может превращаться при окислении в нитрилоксид, известный тем, что он вступает в реакцию с непредельными связями, в частности с углерод-углеродной связью, которые могут присутствовать в полимере, образуя ковалентную связь с указанным полимером. Таким образом, указанные молекулы, если они дополнительно содержат другую функциональную группу, например способную к взаимодействию с наполнителем, оказываются представляющими интерес промежуточными продуктами реакций для введения функциональных групп в полимер.
В самом деле, в области промышленных часто используют смеси полимеров с наполнителями. Для того чтобы такие смеси обладали нужными свойствами, производится постоянный поиск средств, позволяющих улучшить распределение наполнителей в полимерах. Одно из средств достижения этого результата состоит в использовании связующих веществ, способных устанавливать взаимодействия между полимером и наполнителем.
Учитывая пользу этих молекул, одна из целей состоит в получении оксимов, при необходимости содержащих функциональную группу, способную к взаимодействию с наполнителем, для получения которых требовалось бы как можно меньшее количество стадий, при этом без ущерба для чистоты оксимов и без снижения их выхода. Значительное увеличение количества стадий негативно сказывается на общей эффективности способа синтеза нужного соединения, а также на соответствующих затратах на капиталовложения и производство. Кроме того, другая проблема при синтезе оксимов состоит в сведении к минимуму количества и объема растворителей, используемых в рамках способа получения, с целью облегчить обработку эффлюентов, уменьшить соответствующие затраты на капиталовложения и производство, но, естественно, без ущерба как для выхода оксимов, так и для их чистоты.
Целью настоящего изобретения является разработка способа, обеспечивающего решение вышеупомянутых проблем.
В соответствии с изобретением способ синтеза соединения формулы (I):

где:
А - углеродная цепь, которая может содержать по меньшей мере одну группу, содержащую один или несколько гетероатомов, выбранных предпочтительно из О, N, Si, S и P;
R1 - углеродная цепь, необязательно замещенная или прерванная одним или несколькими гетероатомами;
n - целое число от 0 до 4;
Sp - атом или группа атомов,
включает две последовательные стадии (b1) и (b2) в соответствии с принципами однореакторного синтеза, на которых:
(b1) осуществляют реакцию соединения формулы (II):
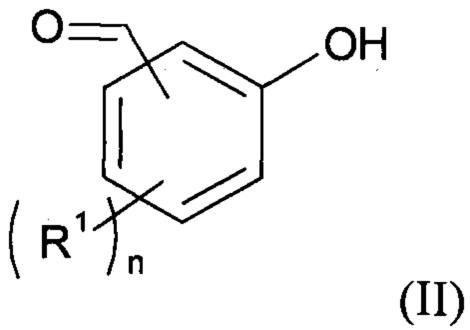
с соединением формулы (III): Z-Sp-A (III), где Z - нуклеофуг;
в присутствии:
по меньшей мере одного полярного растворителя;
по меньшей мере одного основания;
при температуре T1 от 70 до 150°С,
с получением простого эфира;
(b2) осуществляют реакцию указанного простого эфира с водным раствором гидроксиламина при температуре Т2 от 30 до 70°С.
Стадии (b1) и (b2) представляют собой «однореакторные» реакции, в ходе которых осуществляется двухстадийный однореакторный синтез, то есть без выделения промежуточного простого эфира.
Под «полярным растворителем» в контексте изобретения понимается растворитель с диэлектрической постоянной более 2,2.
Предпочтительно, за стадией (b2) следует стадия (с), на которой осуществляют выделение соединения формулы (I).
Под «нуклеофугом» в контексте изобретения понимается уходящая группа, уносящая связывающую электронную пару.
Под «углеродной цепью» в контексте изобретения понимается цепь, содержащая один или несколько атомов углерода.
Следует уточнить, что употребляемые в данном описании выражения «от … до …» следует понимать как включающие каждое из указанных предельных значений.
Благодаря предлагаемому способу удается синтезировать соединение формулы (I) из соединения формулы (II) в соответствии с двухстадийным однореакторным синтезом. В соответствии с заявкой на выдачу патента WO 2012/007684 соединение формулы (I) получают также из соединения формулы (II), но при этом выделяют и очищают промежуточное соединение простого эфира.
Остальные преимущества и признаки изобретения явствуют из нижеследующего подробного описания.
Способ согласно изобретению обеспечивает синтез вышеупомянутого соединения формулы (I).
Преимущественно, А является углеродной цепью, содержащей по меньшей мере одну группу, включающую один или несколько гетероатомов, предпочтительно выбранных из О, N, Si, S и Р, более предпочтительно из О, N, S и их комбинаций.
Предпочтительно, А является С1-С20 углеродной цепью, более предпочтительно С1-С12.
Предпочтительно, А выбирают из способной к связыванию группы, сложноэфирной группы, например группы сложного эфира карбоновой кислоты, и иономерной группы.
В случае, когда А является способной к связыванию группой, подразумевается, что группы А способны связываться друг с другом с помощью водородных связей.
Таким образом, каждая способная к связыванию группа, способная связываться с помощью водородных связей, содержит по меньшей мере один донорный «центр» и один акцепторный центр по отношению к водородной связи, так что две одинаковых способных к связыванию группы оказываются самокомплементарными и могут связываться друг с другом с образованием по меньшей мере двух водородных связей.
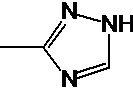
Предпочтительно, А является способной к связыванию группой, выбранной из группы имидазолидинила, тиоимидазолидинила, триазоила, тритиоазоила, уреила, тиоуреила, бис-уреила, бис-тиоуреила, уреидопиримидила и тиоуреидопиримидила либо группы, соответствующей формуле (IV): -C(OR2)=O (IV), где R2 - углеродная группа, необязательно содержащая по меньшей мере один гетероатом.
Под «углеродной группой» в контексте изобретения понимается группа, содержащая один или несколько атомов углерода.
Преимущественно, указанная углеродная группа R2, необязательно содержащая по меньшей мере один гетероатом, содержит от 1 до 20 атомов углерода, предпочтительно от 1 до 12, более предпочтительно от 1 до 6, еще более предпочтительно от 1 до 3. Таким образом, указанная углеродная группа R2 может представлять собой метальную группу или этильную группу.
Предпочтительно, в случае, когда А является способной к связыванию группой, она соответствует одной из следующих формул (V)-(IX):


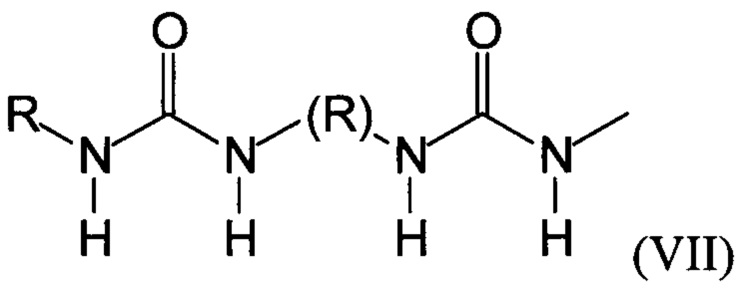


где:
R - углеводородная группа, необязательно содержащая по меньшей мере один гетероатом;
X - атом кислорода, серы или группа NH, предпочтительно атом кислорода.
Предпочтительно, формула (V) соответствует ди- или триазотированному гетероциклическому соединению из 5 или 6 атомов, предпочтительно диазотированному, содержащему по меньшей мере одну карбонильную, тиокарбонильную или иминовую функциональную группу.
Предпочтительно, группа формулы (V) представляет собой группу формулы (Va):

где X выбирают из атома кислорода и атома серы, предпочтительно атом кислорода.
Группа Sp представляет собой спейсерную группу, обеспечивающую соединение атома кислорода с группой А как указано в формуле (I), а потому может быть группой любого известного типа.
Группа Sp предпочтительно представляет собой линейную, разветвленную или циклическую С1-С24 углеводородную цепь, которая может содержать один или несколько ароматических радикалов и/или один или несколько гетероатомов. Указанная цепь может быть необязательно замещена, при условии что заместители не будут реагировать с группой А и оксимной функциональной группой.
Преимущественно, группа Sp представляет собой линейную или разветвленную С1-С24 алкиленовую цепь, предпочтительно C1-С10, необязательно прерванную одним или несколькими атомами азота или кислорода, более предпочтительно линейную С1-С6 алкиленовую цепь.
Предпочтительно, группа Sp содержит звено, выбранное из -(CH2)y1-, -[NH-(СН2)y2]х1- и -[O-(СН2)у3]х2-, где y1, у2 и у3 являются, независимо друг от друга, целыми числами от 1 до 6, a x1 и х2 являются, независимо друг от друга, целыми числами от 1 до 4.
Предпочтительно, R1 является насыщенной углеродной цепью, более предпочтительно алкильной группой, предпочтительно C1-C12 алкильной группой, более предпочтительно C1-С6, еще более предпочтительно С1-С4, или OR', где R' - алкильная группа, предпочтительно С1-С12 алкильная группа, более предпочтительно C1-С6, еще более предпочтительно С1-С4, и еще более предпочтительно метальной группой, этильной группой или группой ОСН3.
Преимущественно, n является целым числом от 0 до 3.
Как уже было разъяснено ранее, способ согласно изобретению включает стадию (b1), на которой осуществляют реакцию соединения формулы (II), приведенной выше, с соединением формулы (III): Z-Sp-A (III), приведенной выше.
Предпочтительно, группу Z выбирают из хлора, брома, йода, мезилатной группы, тозилатной группы, ацетатной группы и трифторметилсульфонатной группы.
Указанную стадию (b1) способа согласно изобретению проводят в присутствии по меньшей мере одного полярного растворителя и по меньшей мере одного основания при температуре от 70 до 150°С.
Преимущественно, полярный растворитель представляет собой полярный растворитель, способный смешиваться с водой, предпочтительно протонный растворитель.
В качестве примеров растворителей, подлежащих использованию в рамках способа согласно изобретению, можно назвать диметилформамид (ДМФ), диметилсульфоксид (ДМСО), 1,3-диметил-2-имидазолидинон (ДМИ), 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (ДМП), изопропанол, ацетонитрил, этанол, н-бутанол и н-пропанол.
В соответствии с одним из частных вариантов осуществления изобретения протонный растворитель является спиртовым.
Предпочтительно, соединение формулы (II) составляет от 5 до 40 мас. %, предпочтительно от 10 до 30 мас. %, относительно массы растворителя.
На стадии (b1) способа согласно изобретению можно использовать основание, традиционно применяемое в реакциях этерификации. Ввиду присутствия альдегидной группы, особенно подверженной окислению и нуклеофильным реакциям, а также присутствия в соединении формулы (II) иных возможных функциональных групп, специалист в области техники выберет такое основание, чтобы обеспечить избирательную направленность реакции в отношении получения целевого простого эфира.
Предпочтительно, основание выбирают из щелочных алкоголятов, щелочных карбонатов, щелочноземельных карбонатов, щелочных гидроксидов, щелочноземельных гидроксидов и их смесей.
В соответствии с одним из предпочтительных вариантов осуществления можно добавлять:
один или несколько катализаторов, выбранных из катализатора типа соли серебра (I), межфазного катализатора типа четвертичного аммония и их смесей;
одну или несколько ионных жидкостей.
Предпочтительно, основание выбирают из метилата натрия, карбоната калия и гидроксида натрия, предпочтительно карбоната калия.
В соответствии с одним из частных вариантов осуществления изобретения количество основания составляет от 1,5 до 8 эквивалентов, предпочтительно от 2 до 6 эквивалентов, относительно количества соединения формулы (II).
Как уже говорилось выше, стадию (b1) способа согласно изобретению проводят при температуре T1 от 70 до 150°С.
Предпочтительно, температура T1 составляет от 70 до 120°С, более предпочтительно от 80 до 110°С.
Как уже было сказано ранее, за стадией (b1) способа согласно изобретению следует стадия (b2), на которой в реакционную среду, содержащую указанный простой эфир, добавляют водный раствор гидроксиламина при температуре Т2 от 30 до 70°С.
Предпочтительно, добавление водного раствора гидроксиламина осуществляют тогда, когда конверсия соединения формулы (II) составляет по меньшей мере 70%.
Преимущественно, температуру Т2 изменяют от 40 до 60°С.
Предпочтительно, способ согласно изобретению включает стадию (с) выделения, как указано выше, соединения формулы (I).
Предпочтительно, соединение формулы (I) выделяют посредством осаждения водой, необязательно с последующим промыванием водой.
В соответствии с одним из частных вариантов осуществления изобретения способ согласно изобретению включает перед стадией (b1) стадию (a1), на которой получают соединение формулы (II), для чего осуществляют реакцию соединения формулы (X):

с формилирующим агентом, образующимся in situ или нет, и по меньшей мере одной кислотой Льюиса в присутствии по меньшей мере одного органического растворителя.
Предпочтительно, кислоту Льюиса выбирают из TiCl4 и SnCl4, более предпочтительно TiCl4.
Предпочтительно, количество кислоты Льюиса составляет от 0,5 до 4 эквивалентов, более предпочтительно от 1 до 3 эквивалентов, относительно количества соединения формулы (X).
В соответствии с одним из частных вариантов осуществления изобретения органический растворитель представляет собой хлорированный растворитель, предпочтительно выбранный из дихлорметана, хлороформа и 1,2-дихлорэтана, более предпочтительно дихлорметана.
Как уже было сказано выше, соединение формулы (X) вступает в реакцию с формилирующим агентом, образующимся in situ или нет, в ходе реакции формилирования. При этом можно использовать любой формилирующий агент, традиционно применяемый в реакциях формилирования.
Предпочтительно, формилирующий агент выбирают из дихлорметилметилового эфира и дихлорметилэтилового эфира, более предпочтительно дихлорметилметилового эфира.
Преимущественно, агент, образующийся in situ, получают посредством реакции метилформиата или этилформиата с хлорирующим агентом, предпочтительно пентахлоридом фосфора.
Предпочтительно, соединение формулы (X) составляет от 5 до 15 мас. % относительно массы растворителя.
В соответствии с одним из частных вариантов осуществления изобретения способ согласно изобретению включает перед стадией (b1) стадию (а2), на которой получают соединение формулы (III), для чего осуществляют реакцию соединения формулы (XI): HO-Sp-A (XI) с агентом, обеспечивающим образование нуклеофуга Z.
Предпочтительно, указанный агент представляет собой тионилхлорид.
Преимущественно, стадию (а2) проводят в отсутствие или в присутствии по меньшей мере одного растворителя, предпочтительно хлорированного растворителя, более предпочтительно дихлорметана.
Преимущественно, за стадией (а2) непосредственно следует стадия (а3), на которой осуществляют выделение соединения формулы (III), предпочтительно посредством очистки толуолом, более предпочтительно посредством кристаллизации соединения формулы (III) в толуоле. Благодаря способу согласно изобретению обеспечивается возможность синтеза соединения формулы (I), как указано выше. Указанное соединение, которое содержит оксимную функциональную группу, может быть необязательно подвергнуто реакции окисления с целью его превращения в соединение, содержащее функциональную группу нитрилоксида, описанного, например, в заявке WO 2012/007684.
Предметом изобретения является также применение соединения формулы (I), полученного способом согласно изобретению.
Изобретение дополнительно проиллюстрировано приводимыми ниже примерами, перечень которых не является исчерпывающим.
ПРИМЕРЫ
Структурный анализ, а также определение молярной чистоты молекул синтеза осуществляют методом ЯМР-анализа. Спектры получают с помощью спектрометра Avance 500 MHz BRUKER, снабженного «широкополосным» зондом BBIz-grad 5 мм. В рамках количественного эксперимента ЯМР1Н используют одноимпульсную последовательность 30° с задержкой повторения 3 секунды после каждой из 64-х регистраций. Пробы растворяют в дейтерированном диметилсульфоксиде (ДМСО). Этот растворитель используют также для сигнала дейтериевой стабилизации. Калибровку проводят по сигналу протонов дейтерированного ДМСО при 2,44 млн-1 в сравнении со стандартом ТМС (тетраметилсилановым) при 0 млн-1. Спектр ЯМР1Н, связанный с экспериментами 2D HSQC1Н/13С (двумерная гетероядерная одноквантовая корреляция) и НМВС1Н/13С (гетероядерная корреляция через несколько связей) позволяет осуществить структурное определение молекул (ср. таблицы отнесений). Количественное определение молекул осуществляют на основе количественного ЯМР-спектра 1D1Н.
Масс-спектрометрический анализ выполняют с прямой инжекцией методом электрораспылительной ионизации (ID/ESI). Анализы проводили на спектрометре НСТ Bruker (производительность 600 мкл/мин., давление распыляющего газа 10 фунт/кв. дюйм, расход распыляющего газа 4 л/мин.).
Пример 1. Синтез оксима 2-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида)
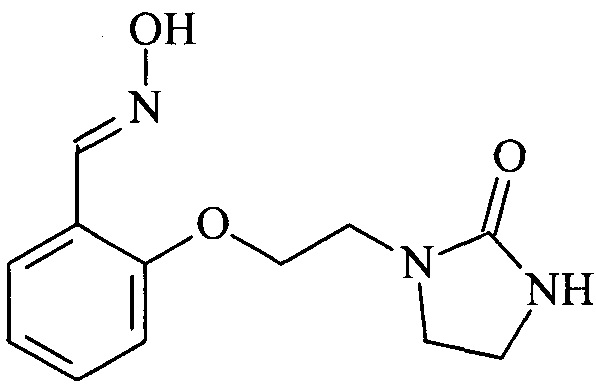
Оксим 2-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида) синтезируют из салицилового альдегида и 1-(2-хлорэтил)имидазолидин-2-она посредством однореакторного синтеза в два стадии b1 и b2. Этот оксим может быть получен независимо в соответствии с двумя описанными ниже протоколами.
Протокол 1 (согласно изобретению)
Загружают в реактор емкостью 1 л 30 г салицилового альдегида (0,25 моль) и 200 г этанола. Добавляют 172,8 г карбоната калия (1,25 моль) и нагревают с обратным холодильником. Затем добавляют отдельными порциями в течение 5 часов 92,8 г 1-(2-хлорэтил)имидазолидин-2-она (0,63 моль). По завершении добавлений дают возможность протекания реакции в течение 2 часов с обратным холодильником. Охлаждают до 50°С, после чего добавляют в течение 15 минут 24,8 г 50%-ного водного раствора гидроксиламина (0,38 моль). Оставляют смесь реагировать в течение 2 часов при температуре 50°С. Концентрируют реакционную смесь до объема 50 мл, затем добавляют при температуре окружающей среды 500 мл воды. Полученный осадок фильтруют, промывают водой, затем пентаном и высушивают в вакууме.
В результате получают белое твердое вещество (40,5 г, выход по массе 65%) с точкой плавления 88°С.
Протокол 2 (согласно изобретению)
Загружают в реактор емкостью 1 л 30 г салицилового альдегида (0,25 моль) и 300 г ацетонитрила. Добавляют 172,8 г карбоната калия (1,25 моль) и нагревают с обратным холодильником. Затем добавляют отдельными порциями в течение 6 часов 109,5 г 1-(2-хлорэтил)имидазолидин-2-она (0,74 моль). По завершении добавлений дают возможность протекания реакции в течение 2 часов с обратным холодильником. Охлаждают до 50°С, после чего добавляют в течение 15 минут 24,8 г 50%-ного водного раствора гидроксиламина (0,38 моль). Оставляют смесь реагировать в течение 2 часов при температуре 50°С. Концентрируют реакционную смесь, затем добавляют при температуре окружающей среды 500 мл воды. Полученный осадок фильтруют, промывают водой, затем пентаном и высушивают в вакууме.
В результате получают белое твердое вещество (41,8 г, выход по массе 70%) с точкой плавления 88°С.
Пример 2. Синтез оксима 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида)

Оксим 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида) получают с использованием двух методик синтеза. В соответствии с первой методикой, указанный оксим синтезируют в четыре стадии - стадия a1, стадия а2, стадия b1 и стадия b2. Вторая методика синтеза отличается от первой тем, что стадии b1 и b2 осуществляют в соответствии с двухстадийным однореакторным синтезом.
На каждом из стадий соединения могут независимо синтезироваться в соответствии с несколькими протоколами. Стадию a1 проводят согласно разным протоколам 3-8, стадию а2 согласно разным протоколам 9-11, стадию b1 - согласно разным протоколам 12-14 и стадию b2 - согласно двум протоколам 15 и 16.
Двухстадийный однореакторный синтез осуществляют с использованием разных протоколов 17-20.
Стадия a1 - получение 3-гидрокси-2,4,6-триметилбензальдегида

Протокол 3
Это соединение может быть получено с использованием протокола, описанного в заявке на выдачу патента WO 2012/007684.
Протокол 4
К раствору TiCl4 (10,44 г, 0,055 моль) в дихлорметане (5 мл), охлажденном до 12°С, добавляют в течение 10 минут раствор мезитола (5,0 г, 0,037 моль) в дихлорметане (15 мл). После перемешивания в течение 5-10 минут при температуре 10-15°С добавляют раствор дихлорметилметилового эфира (6,75 г, 0,059 моль) в дихлорметане (5 мл) в течение времени от 10 до 15 минут. По истечении 15-часовой выдержки при температуре окружающей среды в реакционную среду заливают смесь из 100 мл воды и 50 г льда. После перемешивания в течение 30-40 минут сырой продукт фильтруют, промывают водой (4 раза по 10 мл) и высушивают на воздухе.
Целевой продукт (3,93 г) получают с выходом по массе 65%.
Оцененное в ходе ЯМР1H значение молярной чистоты превышает 90%.
Тонкослойная хроматография (ТСХ): Rf = 0,87 (SiO2; EtOAc; проявление УФ-облучением и парами I2) или Rf = 0,35 (SiO2; гептан : EtOAc = 3:1; проявление УФ-облучением и парами I2).
Протокол 5
К раствору мезитола (6,0 г, 0,044 моль) в дихлорметане (30 мл) (в инертной атмосфере) при температуре 2°С прикапывают TiCl4 (15,04 г, 0,079 моль) в течение 15-20 минут, поддерживая температуру реакционной среды на уровне ниже 8°С. После перемешивания в течение 5 минут при температуре 6°С добавляют дихлорметилметиловый эфир (7,60 г, 0,066 моль) в течение 35-40 минут. По истечении 16-часовой выдержки при температуре окружающей среды в реакционную среду заливают смесь из 75 мл воды и 50 г льда. После перемешивания в течение 1 часа 30 минут продукт фильтруют, промывают водой (4 раза по 5 мл) и высушивают на воздухе.
Целевой продукт (5,53 г, 0,034 моль) получают с выходом по массе 76%.
Оцененное в ходе ЯМР1Н значение молярной чистоты превышает 98%.
ТСХ: Rf = 0,87 (SiO2; EtOAc; проявление УФ-облучением и парами I2) или Rf = 0,35 (SiO2; гептан : EtOAc = 3:1; проявление УФ-облучением и парами I2).
Протокол 6
К раствору SnCl4 (183,6 г, 0,705 моль) в дихлорметане (250 мл), охлажденному до 13°С, добавляют в течение 20 минут раствор метизола (40,0 г, 0,294 моль) в дихлорметане (250 мл). После 5-минутного перемешивания при температуре 13°С добавляют раствор дихлорметилметилового эфира (50,6 г, 0,441 моль) в дихлорметане (100 мл) в течение 30 минут. Реакционную среду перемешивают в течение 15 минут при температуре окружающей среды.
Затем сливают реакционную среду на смесь воды со льдом (800 мл воды на 0,7 кг льда). После перемешивания в течение часа отделяют органическую фазу. Водную фазу экстрагируют с помощью CH2Cl2 (2 раза по 100 мл). Объединенные органические фазы промывают водой (2 раза по 100 мл), высушивают с помощью Na2SO4 и концентрируют при пониженном давлении (10 мбар, 23°С) до получения 53 г масла.
К реакционному сырому продукту добавляют водный раствор диметиламина (500 мл, 40% в воде). Смесь нагревают до 60°С и перемешивают при этой температуре в течение 2,5 часов. Добавляют воду (1,0 л) и экстрагируют водную фазу дихлорметаном (4 раза по 100 мл). Промывают собранные органические фазы раствором HCl в воде (1:2) (три раза по 100 мл) и водой (три раза по 100 мл). После концентрирования при пониженном давлении (150 мбар, 23°С) добавляют петролейный эфир 40/60 (100 мл). Охлаждают раствор до -18°С в течение 15 часов. Полученные кристаллы фильтруют и промывают смесью дихлорметана (5 мл) и петролейного эфира (15 мл), а затем петролейным эфиром 40/60 (два раза по 20 мл) и, наконец, высушивают на воздухе.
Получают твердое вещество (20,02 г) с выходом по массе 42%.
После концентрирования фильтрата при пониженном давлении (60 мбар, 23°С) в него добавляют петролейный эфир 40/60. Раствор охлаждают до -18°С в течение 6 часов. Полученные кристаллы фильтруют и промывают петролейным эфиром 40/60 (два раза по 10 мл), после чего высушивают на воздухе.
Получают вторую фракцию продукта (3,02 г) с выходом 6,3%.
Далее проводят очистку растиранием с использованием описанного ниже протокола.
Объединяют две фракции твердых веществ и растворяют их в смеси дихлорметана (150 мл) с петролейным эфиром 40/60 (100 мл). Охлаждают раствор до -18°С в течение 4-6 часов. Кристаллы фильтруют, промывают петролейным эфиром 40/60 (два раза по 20 мл) и высушивают на воздухе.
Получают продукт (11,9 г) с выходом по массе 25%.
Оцененное в ходе ЯМР1H значение молярной чистоты превышает 96%.
ТСХ: Rf = 0,87 (SiO2; EtOAc; проявление УФ-облучением и парами I2) или Rf = 0,35 (SiO2; гептан : EtOAc = 3:1; проявление УФ-облучением и парами I2).
Протокол 7
К PCl5 (91,7 г, 0,441 моль) добавляют в инертной атмосфере при температуре 22-29°С в течение 70 минут этилформиат (34,8 г, 0,470 моль). Поскольку имеет место экзотермическая реакция, температура среды может достигать 40-60°С. Перемешивают реакционную среду в течение 1 часа при окружающей температуре. После полного растворения PCl5 перемешивают реакционную среду в течение еще 1-2 часов при окружающей температуре. Образуемый в результате этого формилирующий агент используют на следующем стадии без дополнительной очистки.
К раствору мезитола (40,0 г, 0,294 моль) в дихлорметане (100 мл) при температуре 11°С добавляют TiCl4 (105,0 г, 0,529 моль) в течение 45 минут. После выдержки в течение 5 минут при температуре 12-13°С добавляют ранее полученный формилирующий агент в течение 1,5-2,0 часов, поддерживая температуру в пределах от 9 до 22°С. Полученную суспензию перемешивают в течение 15 часов при окружающей температуре. Затем сливают реакционную среду на смесь воды (500 мл) со льдом (500 г). После перемешивания в течение 15-20 минут осадок фильтруют и промывают водой (5 раз по 50 мл). Полученные кристаллы высушивают на воздухе.
Получают целевой продукт (27,5 г, 0,170 моль) с выходом по массе 58%.
Оцененное в ходе ЯМР1Н значение молярной чистоты составляет 97%.
ТСХ: Rf = 0,35 (SiO2; гептан : EtOAc = 3:1; проявление УФ-облучением и парами I2).
Протокол 8
Загружают в реактор емкостью 2 л с холодильником и азотной продувкой 105,8 г тетрахлорида титана (0,56 моль). Осуществляют охлаждение до 15°С и заливают в течение 40 минут 40 г мезитола (0,29 моль), растворенного в 400 г диметиламина. Затем, поддерживая температуру на уровне 15-20°С, заливают в течение часа 40,6 г дихлорметилметилового эфира (0,35 моль). По окончании добавления дают возможность протекания реакции в течение 3 часов при температуре окружающей среды. Далее медленно переносят реакционную смесь в реактор с 800 г воды, в котором поддерживается температура ниже 20°С. После перемешивания в течение 30 минут производят декантацию и выделение органической фазы. Водную фазу дважды экстрагируют 100 г дихлорметана. Промывают собранные органические фазы 200 г воды, после чего концентрируют до объема 100 мл. Добавляют 100 г пентана и охлаждают до -15°С. Полученные кристаллы промывают смесью дихлорметана и пентана 1/1 в количестве 50 г, а затем высушивают в вакууме.
Получают твердое вещество бело-бежевого цвета (45,4 г, выход по массе 94%) с точкой плавления 113°С.
Стадия а2 - получение 1-(2-хлорэтил)имидазолидин-2-она

Протокол 9
Это соединение может быть получено с использование протокола, описанного в заявке на выдачу патента WO 2012/007684.
Протокол 10
К 1-(2-гидроксиэтил)имидазолидин-2-ону (высушенному при пониженном давлении при температуре 60°С) (5,0 г, 38,42 ммоль) прикапывают SOCl2 (5,0 мл, 69,34 ммоль) в течение 2-3 минут. Смесь перемешивают при температуре 80°С (Тр-ра) в течение 1 часа 30 минут, а затем в течение полутора часов при температуре 100°С (Тр-ра). После выпаривания избытка SOCl2 при пониженном давлении (Тр-ра 50°С, 8-9 мбар) получают реакционный сырой продукт (7,53 г, выход по массе 105,9%) в виде желтого масла. Добавляют к реакционному сырому продукту воду (10 мл) и регулируют рН водной фазы до значения 8 посредством добавления карбоната калия.
После кристаллизации при температуре окружающей среды в воде фильтруют осадок и промывают его водой (2-3 мл). Кристаллы высушивают на воздухе.
Получают целевой продукт (2,87 г, 19,31 моль), выход по массе 50%.
Оцененное в ходе ЯМР1Н значение молярной чистоты превышает 90%.
Протокол 11.
Загружают 120 г 1-(2-гидроксиэтил)имидазолидин-2-она (0,92 моль) в реактор емкостью 1 л с холодильником и азотной продувкой. Нагревают до 90°С и добавляют 120,4 г тионилхлорида (1,02 моль) в течение 30 минут. Дают возможность протекания реакции в течение 2 часов при температуре 90°С. Затем добавляют 400 г толуола и нагревают с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают при температуре окружающей среды. Полученный осадок фильтруют, промывают толуолом и высушивают в вакууме. Получают 123,2 г белого твердого вещества (с точкой плавления 93°С и выходом по массе 90%).
Стадия b1 (за рамками изобретения) - получение 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил(этокси)бензальдегида
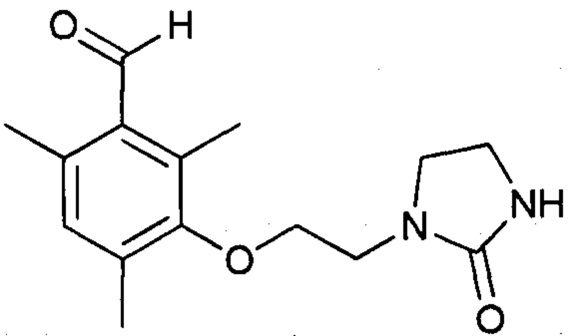
Протокол 12
Это соединение может быть получено с использование протокола, описанного в заявке на выдачу патента WO 2012/007684.
Протокол 13
Смесь 3-гидрокси-2,4,6-триметилбензальдегида (25,0 г, 0,152 моль) и K2CO3 (126,3 г, 0,914 моль) в ДМФА (диметилформамиде) (200 мл) перемешивают при температуре 30-35°С в течение 5-10 минут. Затем добавляют 1-(2-хлорэтил)имидазолидин-2-он (33,9 г, 0,228 моль). Доводят температуру реакционной смеси до 90°С (Тр-ра) в течение 2,5-3 часов. После этого добавляют вторую порцию 1-(2-хлорэтил)имидазолидин-2-она (22,6 г, 0,152 моль) и доводят температуру смеси до 100°С (Тр-ра) в течение 3 часов. Наконец, добавляют третью порцию 1-(2-хлорэтил)имидазолидин-2-она (22,6 г, 0,152 моль) и доводят температуру смеси до 110-115°С (Тр-ра) в течение 3-4 часов. После возврата к температуре 23°С реакционную смесь разбавляют водой (4,0 л). Органическую фазу экстрагируют с помощью CH2Cl2 (6 раз по 200 мл). Собранные органические фазы концентрируют при пониженном давлении (85 мбар, 36°С). Полученный остаток извлекают с помощью Et2O (200 мл) и перемешивают смесь при температуре окружающей среды в течение 2 часов. Полученный осадок фильтруют, промывают на фильтре с помощью Et2O (25 мл) и высушивают при окружающей температуре.
Получают белое твердое вещество (31,93 г, выход по массе 76%).
Молярная чистота превышает 82% (ЯМР1Н).
Протокол 14
К смеси 3-гидрокси-2,4,6-триметилбензальдегида (0,44 г, 3,3 ммоль), 1-(2-гидроксиэтил)имидазолидин-2-она (0,64 г, 4,9 ммоль) и трифенилфосфина (1,31 г, 5,0 ммоль) в ТГФ (тетрагидрофуране) (30 мл) при температуре окружающей среды добавляют раствор диизопропилазодикарбоксилата (1,01 г, 5,0 ммоль) в ТГФ (15 мл) в течение 5-10 минут. Реакционную смесь перемешивают в течение 15 часов при температуре окружающей среды, после чего в нее добавляют воду (15 мл). Концентрируют растворители при пониженном давлении (28°С, 50 мбар). Экстрагируют водную фазу этилацетатом (трижды по 25 мл). Собранные органические фазы промывают водным раствором, насыщенным NaCl. Концентрируют растворитель при пониженном давлении примерно до 3 мл (30°С). После очистки на хроматографической колонке (∅ 1,5 см, Н 11 см) (элюент : этилацетат : этанол (10:1) выпаривают растворитель досуха.
Получают белое твердое вещество (0,77 г, выход по массе 84%).
Молярная чистота превышает 78% (ЯМР1Н).
Стадия b2 (за рамками изобретения) - получение оксима 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида

Продукты, выделяемые в результате исполнения протоколов 12, 13 и 14, используются в последующих протоколах (15, 16). Данная стадия выходит за рамки изобретения вследствие того, что имеет место выделение этих продуктов.
Протокол 15
Это соединение может быть получено с использование протокола, описанного в заявке на выдачу патента WO 2012/007684.
Протокол 16
К раствору 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида (31,5 г, 0,114 моль) в этаноле (300 мл) при температуре 44°С добавляют раствор гидроксиламина (12,0 г, 0,182 моль, 50%-ный раствор в воде, Aldrich) в этаноле (20 мл). Перемешивают реакционную смесь в течение 4 часов при температуре 50°С. Затем к раствору добавляют воду (80 мл). Концентрируют реакционную смесь при пониженном давлении (80 мбар, 40°С). Полученный раствор охлаждают до 15-20°С и перемешивают в течение 5-10 минут. Полученный осадок фильтруют, промывают на фильтре смесью этанола с водой (дважды по 10/15 мл) и высушивают в течение 15-20 часов при атмосферном давлении и окружающей температуре.
Получают белое твердое вещество (28,32 г, выход по массе 85%).
Оцененное в ходе ЯМР1Н значение молярной чистоты превышает 87%.
ТСХ: Rf = 0,58 (SiO2; EtOAc : EtOH = 5:1; проявление УФ-облучением и парами I2).
Однореакторный синтез в две стадии b1 и b2 (согласно изобретению) - получение оксима 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида
Протокол 17 (согласно изобретению)
К смеси 3-гидрокси-2,4,6-триметилбензальдегида (10,0 г, 0,061 моль) и K2CO3 (50,5 г, 0,365 моль) в ДМФ (100 мл) при температуре 35°С добавляют 1-(2-хлорэтил)имидазолидин-2-он (13,55 г, 0,091 моль). Доводят температуру реакционной смеси до 90°С (Тр-ра) и перемешивают эту смесь при указанной температуре в течение 2,5-3 часов. Затем добавляют вторую порцию 1-(2-хлорэтил)имидазолидин-2-она (9,03 г, 0,061 моль) и перемешивают смесь при температуре 100°С (Тр-ра) в течение 2,5 часов. Наконец, добавляют третью порцию 1-(2-хлорэтил)имидазолидин-2-она (9,03 г, 0,061 моль, техническая чистота) и перемешивают смесь при температуре 105°С (Тр-ра) в течение 4 часов.
Понижают температуру реакционной смеси до 43°С, после чего добавляют раствор гидроксиламина (6,84 г, 0,104 моль, 50%-ный раствор в воде, Aldrich). Перемешивают реакционную смесь в течение 5 часов при температуре 50-53°С. Добавляют вторую порцию раствора гидроксиламина (приблизительно 3 г, 50%-ный раствор в воде, Aldrich). Перемешивают реакционную смесь в течение 1,5-2 часов при температуре 50-53°С. Затем разбавляют смесь водой в количестве 1,25 л. Полученную суспензию перемешивают в течение 15 часов при температуре окружающей среды. Полученный осадок фильтруют, промывают на фильтре водой (4 раза по 50 мл) и высушивают при окружающей температуре.
Получают серое твердое вещество (12,87 г, выход по массе 72%).
Оцененное в ходе ЯМР1Н значение молярной чистоты превышает 86%.
Протокол 18 (согласно изобретению)
Загружают в реактор емкостью 1 л 30 г 3-гидрокси-2,4-6-триметилбензальдегида (0,18 моль) и 200 г ДМФ. Добавляют 126,5 г карбоната калия (0,92 моль) и нагревают с обратным холодильником. Затем добавляют отдельными порциями в течение 6 часов 67,9 г 1-(2-хлорэтил)имидазолидин-2-она (0,46 моль). По завершении добавлений дают возможность протекания реакции в течение 2 часов с обратным холодильником. Охлаждают до 50°С, после чего добавляют в течение 15 минут 14,3 г 50%-ного водного раствора гидроксиламина (0,22 моль). Оставляют смесь реагировать в течение 2 часов при температуре 50°С. Концентрируют реакционную смесь до объема 50 мл, затем добавляют при температуре окружающей среды 500 мл воды. Полученный осадок фильтруют, промывают водой и высушивают в вакууме.
Получают твердое вещество бело-бежевого цвета (44,6 г, выход по массе 85%) с точкой плавления 167°С.
Протокол 19 (согласно изобретению)
К смеси 3-гидрокси-2,4,6-триметилбензальдегида (22,8 г, 0,139 моль) и K2CO3 (115,2 г, 0,833 моль) в изопропаноле (160 мл) при температуре 50°С добавляют 1-(2-хлорэтил)имидазолидин-2-он (30,9 г, 0,208 моль). Доводят температуру реакционной смеси до 100°С (Тр-ра) и поддерживают эту температуру в течение 3-4 часов. Затем добавляют вторую порцию 1-(2-хлорэтил)имидазолидин-2-она (20,06 г, 0,139 моль, техническая чистота) и перемешивают смесь при температуре 100°С (Тр-ра) в течение 5 часов. Наконец, добавляют третью порцию 1-(2-хлорэтил)имидазолидин-2-она (20,06 г, 0,139 моль, техническая чистота) и перемешивают смесь при температуре 105°С (Тр-ра) в течение 8-10 часов.
Понижают температуру реакционной смеси до температуры окружающей среды, после чего добавляют в реакционную смесь изопропанол (25 мл). Нагревают смесь до 55°С и добавляют раствор гидроксиламина (14,68 г, 0,222 моль, 50%-ный раствор в воде, Aldrich) в изопропаноле (25 мл). Перемешивают реакционную смесь в течение 7 часов при температуре 50°С. Сливают реакционную смесь в воду (3 л). После перемешивания в течение 5 часов полученный осадок фильтруют, промывают на фильтре водой (600 мл) и высушивают при окружающей температуре.
Получают серое твердое вещество (30,35 г, выход по массе 75%).
Оцененное в ходе ЯМР1H значение молярной чистоты превышает 87%.
Протокол 20 (согласно изобретению)
Загружают в реактор емкостью 1 л 30 г 3-гидрокси-2,4-6-триметилбензальдегида (0,18 моль) и 200 г изопропанола. Добавляют 126,5 г карбоната калия (0,92 моль) и нагревают с обратным холодильником. Затем добавляют отдельными порциями в течение 6 часов 67,9 г 1-(2-хлорэтил)имидазолидин-2-она (0,46 моль). По завершении добавлений дают возможность протекания реакции в течение 2 часов с обратным холодильником. Охлаждают до 50°С, после чего добавляют в течение 15 минут 14,3 г 50%-ного водного раствора гидроксиламина (0,22 моль). Оставляют смесь реагировать в течение 2 часов при температуре 50°С. Концентрируют реакционную смесь до объема 50 мл, затем добавляют при температуре окружающей среды 500 мл воды. Полученный осадок фильтруют, промывают водой и высушивают в вакууме.
Получают белое твердое вещество (43,0 г, выход по массе 82%) с точкой плавления 167°С.
Таким образом, оксим 2,4,6-триметил-3-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида получают благодаря двухстадийному однореакторному синтезу непосредственно из 3-гидрокси-2,4-6-триметилбензальдегида.
Итак, способ согласно изобретению позволяет добиться увеличения суммарного выхода продукта, а также снижения затрат на капиталовложения и производство.
Пример 3. Синтез оксима 3-метокси-4-(2-(2-оксоимидазолидин-1-ил)этокси)бензальдегида

Протокол 21 (согласно изобретению)
В реактор емкостью 1 л загружают 30 г ванилина (0,20 моль) и 200 г изопропанола. Добавляют 138,2 карбоната калия (1 моль) и нагревают с обратным холодильником. Затем добавляют отдельными порциями в течение 6 часов 89,2 г 1-(2-хлорэтил)имидазолидин-2-она (0,6 моль). По завершении добавлений дают возможность протекания реакции в течение 2 часов с обратным холодильником. Охлаждают до 50°С, после чего добавляют в течение 15 минут 19,8 г 50%-ного водного раствора гидроксиламина (0,30 моль). Оставляют смесь реагировать в течение 2 часов при температуре 50°С. Концентрируют реакционную смесь до объема 50 мл, затем добавляют при температуре окружающей среды 500 мл воды. Полученный осадок фильтруют, промывают водой и высушивают в вакууме.
Получают белое твердое вещество (33,5 г, выход по массе 60%) с точкой плавления 189°С.
Реферат
Изобретение относится к способу синтеза соединения формулы (I), который включает две последовательные стадии (b1) и (b2) в соответствии с принципами однореакторного синтеза. На стадии (b1) осуществляют реакцию соединения формулы (II) с соединением формулы Z-Sp-А (III) в присутствии по меньшей мере одного полярного растворителя, по меньшей мере одного основания при температуре Тот 70 до 150°С с целью образования простого эфира. На стадии (b2) осуществляют реакцию указанного простого эфира с водным раствором гидроксиламина при температуре Тот 30 до 70°С. В указанных формулах А представляет собой способную к связыванию группу, выбранную из группы имидазолидинила, тиоимидазолидинила, триазоила, тритиоазоила, уреила, тиоуреила, бис-уреила, бис-тиоуреила, уреидопиримидила и тиоуреидопиримидила либо группы, соответствующей формуле (IV): -C(OR)=O (IV), где Rпредставляет собой углеродную группу, содержащую от 1 до 20 атомов углерода и необязательно содержащую по меньшей мере один гетероатом; Rпредставляет собой С-Салкильную группу или OR’, где R’ представляет собой С-Салкильную группу; n - целое число от 0 до 4; Sp представляет собой линейную или разветвленную С-Салкиленовую цепь, необязательно прерванную одним или несколькими атомами азота или кислорода; Z – нуклеофуг. Предлагаемый способ позволяет уменьшить количество стадий без ущерба для чистоты целевых оксимов и без снижения их выхода. 22 з.п. ф-лы, 3 пр.(I)(II)
Формула








Документы, цитированные в отчёте о поиске
Молекулы, несущие способные к ассоциации группы

Комментарии