Способ получения производных имидазолина или их солей - SU923367A3
Код документа: SU923367A3
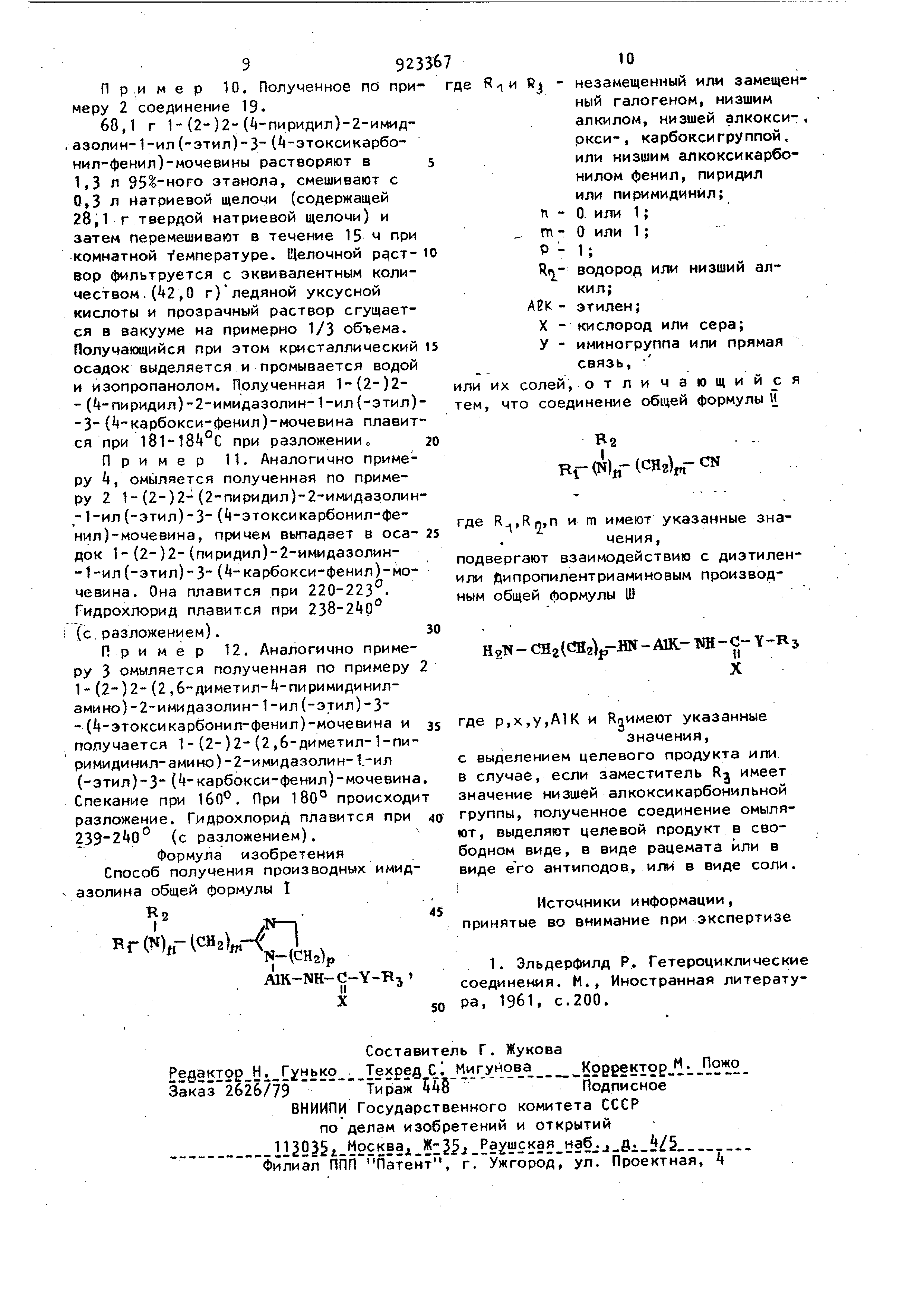
Описание
39 с диэтилен- или дипропилентриамино вым производным общей формулы 11 HgH-CHgtCHglp-HN-AlK-NH-C-Y-Rjl X где р,х,у,А1Ки R5 имеют вышеуказанные значения, с выделением целевого продукта или, в случае, если заместит-ель Rj имеет значение низшей алкоксикарбонильной группы, то полученное соединение омы ляют, выделяют целевой продукт в сво бодном виде, в виде рацемата или в виде его антиподов, или в виде соли. Для получения солей применяются в особенности такие кислоты, которые пригодны для образования терапевтически пригодных солей. В качестве таких кислот, например, могли бы быт галогенводородные кислоты, серная ки лота, фосфорные кислоты, азотная кис лота, алифатические, алициклические, ароматические или гетероциклические карбоновые или сульфокислоты, такие -kaK муравьиная, уксусная, пропионорая , янтарная гликолевая, молочная, яблочная, винная, лимонная, аскорбино вая, малеиновая, гйдроксималеиновая или бензвиноградная кислота, фенилуксусная , бензойная, р-аминобензой ная , антраниловая, р-гидроксибензойная , салициловая или р-аминосалициловая кислота, эмбокислота, метансульфо- , гидроксиэтансульфо-, этилен сульфоновая кислота; галогенсульфо-, толуолсульфо-, нафталинсульфокислота или сульфаминовая кислота; метионин, триптофан, лизин или аргинин. Эти или другие соли новых соединений , как например, пикраты, могут служить также для очистки полученных свободных оснований тем, что свободные основания переводят в соли, последние выделяют и из солей опять высвобождают основания. Смотря по числу асимметричных Сатомов и выбору исходных веществ и рабочим методам, новые соединения могут быть в виде рацематных смесей, как рацематы или как оптические антиподы . Рацематные смеси на основании физи ко-химических различий составных частей известным методом могут разделять ся на чистые рацематы, например с ПОМОЩЬЮхроматографии и/или фракционированной кристаллизации. Чистые рацематы известными методами , например путем перекристаллизации 7 . ИЗ оптически активного растворителя, с помощью микроорганизмов, или путем превращения с оптически активными кислотами , образующими с рацемическим соединением соли, и разделения таким путем полученных солей на основании их различной растворимости, могут разлагаться на диастереомеры, из которых антиподы могут высвобождаться с помощью воздействия пригодного средства . Особенно употребительными оптически активными кислотами являются, например О- и L-формы винной кислоты, ди-о-толуолвинная кислота, яблочная кислота, миндальная кислота, камфарсульфокислота или хинная кислота. Предпочтительно выделяют более действенный из обоих антиподов. Также можно получать конечные продукты в форме чистых рацематов соответствующих оптических антиподов. Один или несколько асимметрических С-атомов полученных исходных веществ используют в форме чистых рацематов соответствующих оптических антиподов. Новые активные вещества или фармацевтически приемлемые соли могут применяться орально или ректально, а также парентерально. Согласно изобретению фармацевтические составы веществ содержат минимум одно соединение общей формулы (I) в качестве активного вещества вместе с обычными фармацевтическими носителями . Тип носителей во многом зависит от области применения. Для орального лечения опухолей принимаются во внимание в особенности твердые формы единичных доз, как таблетки , драже и капсулы. Ежедневные дозы содержат между 8 и 100 мг/кг теплокровного. Пригодные формй единичных- доз, как драже или таблетки, содержат преимущественно 10-200 мг активного начала согласно изобретению, причем содержание активного вещества составляет 10-90 вес.. Для получения таблеток и ядер драже соединения общей формулы (I). комбинируют с твердыми порошкообразными носителями, как лактоза, сахароза, сорбит, кукурузный крахмал, картофельный крахмал или амилопектин, произвольные целлюлозы или желатин, преимущественно при добавлении веществ, придающих скользкость , как стеарат магния или кальция или полиэтиленгликоля пригодного молекулярного веса. Ядра драже покрывают затем, например, концентрирован92 ными сахарными растворами, которые еще могут содержать, арабскую резину, тальк и/или двуокись титана, или лакон , растворенными в смеси легко летучих органических растворителей. К этим покрытиям могут добавляться красители дпя обозначения различных доз активного вещества. Мягкие желатиновые капсулы и другие закрытые капсулы состоят из смеси желатина и глицерина и могут содержать смеси соединения формулы (1) с полиэтиленг ликолем Разъемная капсула содержит гранулят активного вещества с твердыми порошкообразными носителями, как например лактоза, сахароза, сорбит, магнит, крахмалами, как картофельный крахмал, маисовый или амилопектин, производные целлюлозы и желатины, а также стеарат магния или стеариновая кислота. Получение типичных форм аппликации по примерам 1-6. Пример 1. 250,0 г активного начала смешивают с 550,0 г лактозы и 292,0 г картофельного крахмалаi смесь увлажняется спиртовым раствором 8 г желатина и гранулируется через сито. После сушки примешивают 60,0 г картофельного крахмала, 60,0 г талька, 10,0 г стеарата магния и 20,0 г коллоидной двуокиси кремния и прессуют смесь в 10000 таблеток весом по 125 мг и 25 мг содержания активного начала, которые в случае желания могут быть снабжены частичными насечками для более тонкого приспособления дозировки. Пример 2. Из 100,0 г активного вещества, 379,0 г лактозы и спиртового раствора 6,0 г желатина получают гранулят, который после сушки смешивают с 10,0 г коллоидной двуок1 и кремния, ,0 г талька, 60,0 г картофельного крахмала и г стеарата магния, и прессуют в 10000 ядер драже. Последние затем покрываются концентрированным сиропом из 533,5 г кристаллической сахарозы, 20,0 г желлака , 75,0 г арабской резины, 250,0 г талька, 20,0 г коллоидной двуокиси кремния и 1,5 г красителя и сужается. Каждое полученное драже весит 150 мг и каждое содержит 10 мг активного вещества. Пример 3. Для приготовления сиропа с 0,25VHbiM содержанием активного вещества 3 л дистиллированной воды растворяют 1,5 л глицерина, А2 г метилового эфира р-гидроксибензойной кислоты, 18 г Н-ПРОПИЛОВОГО эфира р-гидроксибензойной кислоты и при легком нагревании к 25,0 г активного вещества добавляют j л 70%-ного растB6f3a сорбита, 1000 г кристаллической сахарозы, 350 г глюкозы и ароматическое вещество, например 250 г или по 5 г естественного лимонного ароматаj фильтруют полученный раствор и фильтрат дополняют дистиллированной водой до 10 л. П р и м е р k. Чтобы получить 1000 капсул с содержанием aкtивнoгo вещества в каждой по 100 мг, смешива100 г активного вещества со 173.1 г ют лактозы, равномерно увлажняют смесь водным раствором 2,0 г желатина и гранулируют ее через пригодное сито (например, сито Ш). Гранулят смешивают с 10,0 г осушенного кукурузного крахмала и 15,0 г талька и равномерно заполняют ее в 1000 капсул из твердого желатина с размером 1. Пример 5.В качестве ректально применяемых фармацевтических препаратов применяются, например, суппозитории , которые состоят из комбинации соединения общей формулы (I) в качестве активного вещества с основной массой суппозитория. В качестве основной массы суппозиториев пригодными являются естественные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканопы. Могут применяться также желатиновые ректиальные капсулы , которые состоят из комбинации активного вещества с основной массой; в качестве основы принимаются во внимание, жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды . Пример 6. Для парентерального применения являются пригодными в первую очередь растворы для инъекции |i3 вышеописанных солей. Инъекционные, растворы гидрохлорида готовятся следующим образом. 20,0 г гидрохлорида активного вещества растворяются в 1500 мл кипяченой, свободной от пирогёнов, воды и раствор разбавляetcH такой же водой до 2000 мл. Раствор отфильтровывается, заполняется в 1000 «1мпул по 2 мл и стерилизуется. Одна ампула (2 мл) содержит 20 мг 1,0 -ного активного вещества. Получение, новых соединений общей формулы (I) и промежуточных продуктов по , примерам . 9 Пример 7. 22,Or гидрохлори да этилового эфира 2-хлор-бензимида, полученного из 2-хлор6ензнитрила и одного эквивалента этилового спирта в хлороформе и насыщения полученного раствора газом хлористого водорода, и 23,6 г 1-(1-(1-аминоэтил-(2)-амино )-этил(2)-3(р-толил)-мочевины, по лученной путем медленного прикапывания 1 моля р-толилизоцианата в раствор 3 молей диэтилентриамина в толуо ле, нагреваются в 150 мл этилового спирта До окончания образования аммиака с обратной флегмой до кипения. Спиртовый раствор упаривается в ваку ме до небольшого объема и порционно смешивается со смесью ацетон:уксусный эфир (1:1) и растирается, причем выпадает в осадок описанная в примере 2 кристаллическая 1-(2)-2--{2-xлopфeнил )-2-имидaзoлин-1-ил (-этил) 3 (р толил)-мочевина в виде гидрохлорида , т.пл. 108 С, Высвобожденное с помощью карбоната калия основание плавится при 166-1б8°С. Пример 8. Аналогично примеру 1 получают следующие соединения. 1.1-(2-)2-(2,6-Диxлopaнилинoмeтил )-2-имидaзoлин-1-ил (-этил)-3 - (р-толил)-мочевину, т.пл. 9 97°С; 2.1-(2-)-(2-Xлopфeнил)-2-имцдaзoлин-1-ил (-3)(р-толил)-мочевину, т.пл. 1б6-1б7°С; 3.1 - (2-) 2- (Анилинометил)-2-имидазолин-1-ил (-этил)-3(р-толил)-мочевину , т.пл. 159-1б1°С . 1- (2-)2-(2,6-Диxлopaнилинoмeтил )2-имидaзoлин- 1-ил- (этил- )-( нил)мочевину, т.пл, 1бЗ-1б5 С 5.1- (2)2-(2-Хлоранилинометил)-2-имидазолин-1-ил (-этил)-3(3 трифторметилфенил )-мочевину, т.пл. l8l183 С . 6.1-(2-)2-(4-Xлopaнилинoмeтил) -2-имидазолидин- 1-ил (-этил)-З (-три фторметилфенил)-мочевину, т.пл. 1731 77С; 7.1-(2-)2-(2-Хлоранилинометил)-2-имидазолин-1-ил (-этил)-3(р-толил мочевину, т.пл. 8. 1(2-)С2-Анилинометил)-2-ияиДазо
ЛИН-1-ил(-этил)-З-(3 хлорфенил)-мочееииу , т.пл. 1 0-1/+3°С.
9.1- (2- )2- (Ани-оинометил)-2-имидазолин- 1-ил (-этил)-3(З-трифторметилфенил )-мочевину, т.пл. 128-130-С
10.1-(2-)2-(2-Xлopaнилинoмeтил)-2-имидaзoлин- 1-ил(-этил)-3(-хлорфенил )-мочевину, т.пл. С
спирта. Остаток.состоит из хлорида натрия; раствор после полного сгущения дает кристаллический гидрохлорид 1-12-) 2-(2-хлЬрфенил}-2-имидазолин- 1-ил (,-этил)-3( -карбоксифенил) -мочевинный , который перекристаллизовывается из смеси метанолизопропанолом и плавится при 2 0-;242°С при разложении. 7 11.1- (2-)2-(-Хлоранилинометил)-2-имидазолин-1-ил (-этил)-3- (4-толил )-мочевину, т.пл; 17б-179°С 12.1-(2-)2-Бензил-имидазолин 1-ил (-этил)-З-(4-толил)-мочевину, т.пл. IlS-ISI C 13.1-(2-)2-(2-Оксифенил)-2-имидазолинил (-этил)-3(4-толил)-мочевин .у, т.пл. 115°С- (с разложением). Н. 1-{2-)2-(|-Метоксифенил)-2-имидазолинил (-этил)-3 {4-толиол)-мочеыину , т.пл. 66-70°С. 15. 1-(2-)2-(4-Пиридил)-2-имидазолинил (-этил)-З-(-толил)-мочевину, т.пл. 109-111°С. 16. 1-(2-)2-(2-Пиридил)-2-имидазолинил (-этил)-З-(-толил)-мочевину, т.пл. 1б5-1б7°С. 17. Гидрохлорид 1-(2-)2-(2-хлорФ )2 имидaзoлин-1-ил{-этил)-3 ,- (-4-этокси-карбонил-фенил)-мочевины. т.пл. ЙО°С (с разложением). 18.7-(2-)2-(2-Пиридил)-3-имидазолин-1-ил (-этил)-3-(-этоксикарбонил-фенил )-мочевину, т.пл. 152-15 °С. 19.1-(2-)2-(«-Пиридил)-2-имидазолин-1-ил (-этил)-3(-этоксикарбонилфеНИЛ )-мочевину, т.пл. 120 С. 20.Оксалат 1-(2-)2-(2-хлорфенил)-2-имидазолин-1-ил (-этил)-З-(фенилтиомочевины ), т.пл. I42c. 21.1-(2-)2-(3-Пиридилметил)-2-имидазолин-1-ил (-этил)-3-(4-этоксикарбонил-фенил ) -мочевину,т.пл.168,. 22.Гидрохлорид 1-(2-)2-(.,6-диметил-4-пиримидиниламино )-2-имидазолин- 1-ил- 3 (-этоксикарбонйл-фенил)мочевины , т.пл. 218-220С. Пример 9- 22,6г полученного по примеру 2 гидрохлорида 1-(2-)2 (2-хлорфенил)-2-имидазолин-1-ил (-этил)-3 ( -этоксикарбонилфенил) -мочевины растворяют в 900 мл спирта и смешивают с 50 мл 1 н натриевой щелочи. После добавления 200 мл 2 н. натриевой щелочи перемешивают в течение ночи, нейтрализуют с 200 мл 2 н. соляной кислоты и слабо подкисляют с 51 мл 1 н. соляной кислоты. При вращении упаривают до сухого остатка и остаток дважды выпаривают со 100 мл




Реферат

Формула


Комментарии