Производные имидазолина, обладающие cb1-антагонистической активностью - RU2357958C2
Код документа: RU2357958C2
Описание
Настоящее изобретение касается 1,2,4-тризамещенных производных имидазолина как CB1-антагонистов, способов получения данных соединений и новых промежуточных продуктов, используемых в синтезе указанных производных имидазолина. Изобретение также касается применения раскрытого здесь соединения для производства лекарственного средства, оказывающего целебное действие. Целебное действие раскрыто здесь или очевидно для специалиста в данной области из описания и общих знаний. Изобретение также касается применения соединения по изобретению для производства лекарственного средства для лечения или профилактики заболевания или состояния. Более подробно, изобретение касается нового применения для лечения заболевания или состояния, раскрытого здесь или очевидного для специалиста в данной области из описания и общих знаний в данной области. В вариантах изобретения раскрытые здесь конкретные соединения используют для производства лекарственного средства, используемого при лечении нарушений, в которые вовлечены каннабиноидные рецепторы, или которые можно лечить воздействием на данные рецепторы.
Многозамещенные производные имидазолина известны из WO 03/101954 и WO 03/101969. Описанные там соединения являются сильнодействующими ингибиторами фактора транскрипции NF-KB, делая их пригодными в лечении некоторых типов опухолей. Указанные производные имидазолина также обладают высокой активностью как противовоспалительные агенты и антибиотики, что дает дополнительный ряд показаний, при которых они, по-видимому, представляют терапевтический интерес, включая воспалительные и инфекционные заболевания. Для соединений, описанных в упоминаемой выше патентной заявке, не показано наличие какого-либо сродства к каннабиноидным рецепторам и, следовательно, маловероятно, чтобы они имели терапевтическое значение при нарушениях, в которые вовлечены данные каннабиноидные рецепторы.
Целью настоящего изобретения является идентификация производных имидазолина с высокой активностью как модуляторов каннабиноидных рецепторов CB1 при сохранении по существу физико-химических свойств, что делает некоторые производные имидазолина полезными терапевтическими агентами.
В настоящее время неожиданно обнаружено, что сильный антагонизм или обратный агонизм каннабиноидных рецепторов CB1имеется у новых производных 4,5-дигидро-1H-имидазола формулы (I):
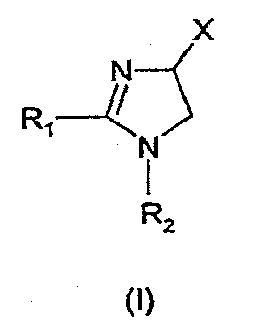
где - R1 и R2 независимо обозначают фенил, тиенил или пиридил, причем указанные группы могут быть замещены 1, 2 или 3 заместителями Y, которые могут быть одинаковыми или разными, из группы, включающей разветвленные или линейные C1-3-алкилы или C1-3-алкокси, фенил, гидрокси, хлор, бром, фтор, йод, трифторметил, трифторметилтио, трифторметокси, карбоксил, трифторметилсульфонил, циано, карбамоил, сульфамоил и ацетил, или R1 и/или R2 обозначают нафтил,
- X обозначает одну из подгрупп (i) или (ii),
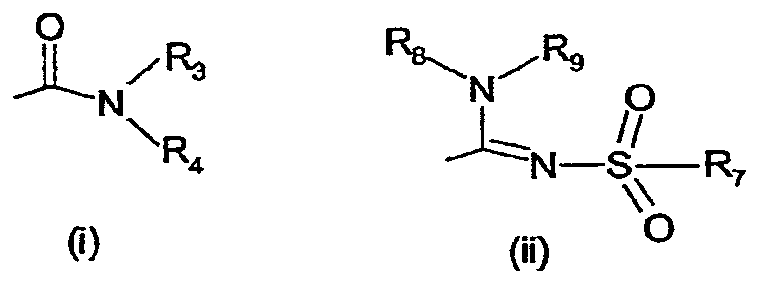
где - R3 обозначает атом водорода или разветвленную или линейную C1-3алкильную группу,
- R4 обозначает разветвленную или линейную C1-8алкильную или C3-8-циклоалкил-C1-2-алкильную группу, разветвленный или линейный C1-8-алкокси, C3-8циклоалкил, C5-10 бициклоалкил, C6-10 трициклоалкил, причем указанные группы могут содержать один или более гетероатомов из группы (O, N, S), и указанные группы могут быть замещены гидрокси-группой, 1-3 метильными группами, этильной группой или 1-3 атомами фтора, или R4 обозначает фенил, фенокси, бензил, фенетил или фенилпропильную группу, необязательно замещенную по фенильному кольцу 1-3 заместителями Y, где Y имеет указанное выше значение, или R4обозначает пиридил или тиенильную группу, или R4 обозначает группу NR5R6, в которой R5 и R6 вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, имеющую от 4 до 10 кольцевых атомов, причем указанная гетероциклическая группа содержит один или два гетероатома из группы (O, N, S), и указанная гетероциклическая группа может быть замещена разветвленным или линейным C1-3алкилом, фенилом, гидрокси или трифторметильной группой или атомом фтора, или
R3 и R4 вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, имеющую от 4 до 10 кольцевых атомов, причем указанная гетероциклическая группа содержит один или два гетероатома из группы (O, N, S), и указанная гетероциклическая группа может быть замещена разветвленным или линейным C1-3алкилом, фенилом, гидрокси- или трифторметильной группой или атомом фтора,
- R7 обозначает бензильную, фенильную, тиенильную или пиридильную группу, причем указанные группы могут быть замещены по ароматическому кольцу 1, 2, 3 или 4 заместителями Y, где Y имеет значения, указанные выше, которые могут быть одинаковыми или разными, или R7обозначает C1-8разветвленный или линейный алкил, C3-8алкенил, C3-10циклоалкил, C5-10бициклоалкил, C6-10трициклоалкил или C5-8циклоалкенил, или R7 обозначает нафтил, или R7обозначает аминогруппу, или R7 обозначает C1-8диалкиламиногруппу, C1-8моноалкиламиногруппу или насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, имеющую от 4 до 10 кольцевых атомов, причем указанная гетероциклическая группа содержит 1 или 2 атома азота, и указанная гетероциклическая группа может содержать 1 гетероатом из группы (O, S), и указанная гетероциклическая группа может быть замещена разветвленным или линейным C1-3 алкилом, фенилом, гидрокси или трифторметильной группой или атомом фтора,
- R8 обозначает атом водорода или метильную группу,
- R9 обозначает атом водорода или метильную, этильную или метоксигруппу,
и их таутомеров, стереоизомеров, пролекарств и солей.
В соединениях формулы (I) присутствует, по меньшей мере, один центр хиральности (по положению C4 имидазолинового фрагмента). Изобретение касается рацематов, смесей диастереомеров, а также индивидуальных стереоизомеров, имеющих формулу (I). Изобретение также касается E-изомера, Z-изомера и E/Z смесей соединений, имеющих формулу (I).
В область настоящего изобретения входят пролекарства упоминаемых выше соединений. Пролекарства представляют собой терапевтические агенты, которые сами по себе неактивны, но трансформируются в один или более активных метаболитов. Пролекарства являются биологически обратимыми производными молекул лекарства, используемыми с целью преодоления некоторых барьеров применимости молекул исходного лекарства. Эти барьеры включают (но не ограничены этим) растворимость, проницаемость, стабильность, предсистемный метаболизм и ограничения целеуказания (Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F. D. King, p. 215; J. Stella, "Prodrugs as therapeutics", Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P. Ettmayer и др., "Lessons learned from marketed and investigational prodrugs", J. Med. Chem., 47, 2393-2404, 2004). Пролекарства, то есть соединения, которые при введении людям любым известным способом метаболизируются с образованием соединений, имеющих формулу (1), включены в изобретение. В частности, это касается соединений с первичными или вторичными амино- или гидрокси-группами. Можно осуществлять взаимодействие таких соединений с органическими кислотами, получая соединения, имеющие формулу (1), где присутствует дополнительная группа, которая легко удаляется после введения, например (но не только этого) амидина, енамина, основания Манниха, гидроксил-метиленового производного, производного O-(ацилоксиметиленкарбамата), карбамата, сложного эфира, амида или енаминона.
Изобретение в особенности касается соединений, имеющих формулу (I)
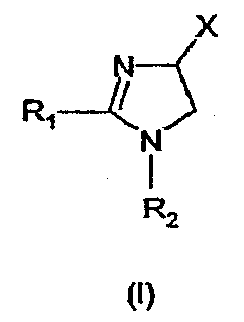
где - R1 и R2 независимо обозначают фенил, причем фенильная группа может иметь 1, 2 или 3 заместителя Y, которые могут быть одинаковыми или разными, из группы: разветвленный или линейный C1-3-алкил или C1-3-алкокси, фенил, гидрокси, хлор, бром, фтор, йод, трифторметил, трифторметилтио, трифторметокси, карбоксил, трифторметилсульфонил, циано, карбамоил, сульфамоил и ацетил, или R1 и/или R2обозначают нафтил, тиенил или пиридил,
- X обозначает одну из подгрупп (i) или (ii)
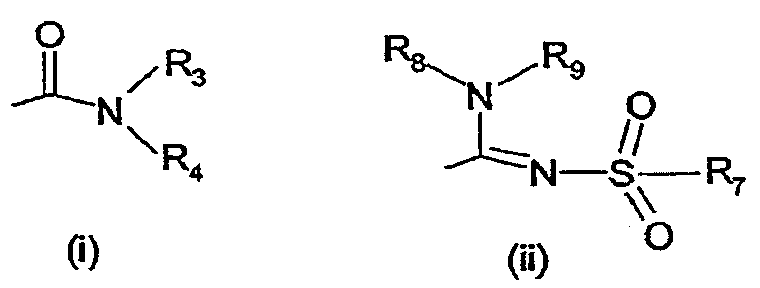
где - R3 обозначает атом водорода,
- R4 обозначает разветвленную или линейную C1-8 алкильную, разветвленную или линейную C1-8алкокси или
C3-8 циклоалкильную группу, причем указанные группы могут быть замещены гидрокси-группой, 1-3
метильными группами, этильной группой или 1-3 атомами фтора, или R4 обозначает фенильную, фенокси, пиридильную или тиенильную группу, или R4 обозначает группу NR5R6, где R5 и R6 вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, имеющую от 4 до 10 кольцевых атомов, причем гетероциклическая группа содержит один или два гетероатома из группы (O, N, S) или
R3 и R4 вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, имеющую от 4 до 10 кольцевых атомов, причем гетероциклическая группа содержит один или два гетероатома из группы (O, N, S) и гетероциклическая группа может быть замещена метильной, гидрокси- или трифторметильной группой или атомом фтора,
- R7 обозначает фенильную группу, причем фенильная группа может быть замещена по ароматическому кольцу 1, 2, 3 или 4 заместителями Y, где Y имеет значения, которые указаны выше и которые могут быть одинаковыми или разными, или R7 обозначает C1-8разветвленный или линейный алкил, C3-10 циклоалкил или C5-10 бициклоалкил, или R7 обозначает нафтил, или R7 обозначает аминогруппу, или R7 обозначает C1-8диалкиламиногруппу, C1-8моноалкиламиногруппу или насыщенную или ненасыщенную, моноциклическую или бициклическую, гетероциклическую группу, имеющую от 4 до 10 кольцевых атомов, причем гетероциклическая группа содержит 1 или 2 атома азота, и гетероциклическая группа может содержать 1 гетероатом из группы (O, S), и гетероциклическая группа может быть замещена разветвленной или линейной C1-3алкильной или гидрокси-группой,
- R8 обозначает атом водорода,
- R9 обозначает атом водорода
и их таутомеров, стереоизомеров, пролекарств и солей.
Благодаря высокой CB1-антагонистической активности соединения по данному изобретению подходят для использования при лечении таких психиатрических нарушений, как психоз, беспокойство, депрессия, недостаток внимания, нарушения памяти, когнитивные нарушения, нарушения аппетита, ожирение, в частности юношеское ожирение и ожирение, вызванное приемом лекарств, аддикция, расстройства импульсивного контроля, половое влечение, лекарственная зависимость и неврологические нарушения, такие как нейродегенеративные нарушения, слабоумие, дистония, мышечная спастичность, тремор, эпилепсия, множественный склероз, травматическое поражение головного мозга, удар, болезнь Паркинсона, болезнь Альцгеймера, эпилепсия, болезнь Хантингтона, болезнь Туретта, церебральная ишемия, апоплексия мозга, черепно-мозговая травма, повреждение спинного мозга, нейровоспалительные нарушения, рассеянный склероз, вирусный энцефалит, нарушения, связанные с димиелинизацией, а также для лечения болевых нарушений, включая невропатические болевые нарушения, и других заболеваний, вовлекающих нейротрансмиссию каннабиноидов, включая лечение септического шока, глаукомы, рака, диабета, рвоты, тошноты, астмы, респираторных заболеваний, желудочнокишечных нарушений, язв желудка, диареи, сердечно-сосудистых нарушений, атеросклероза, цирроза печени и сексуальных нарушений.
Активность соединений изобретения по модулированию каннабиноидных рецепторов делает их особенно полезными при лечении ожирения, юношеского ожирения и ожирения, вызванного приемом лекарств, при использовании в комбинации с ингибиторами липазы. Конкретными примерами соединений, которые можно использовать в таких комбинированных препаратах, являются (но не ограничены этим) синтетический ингибитор липазы орлистат, ингибиторы липазы, выделенные из микроорганизмов, такие как липстатин (из Streptomyces toxytricini), эбелактон B (из Streptomyces aburaviensis), синтетические производные данных соединений, а также экстракты растений, которые, как известно, обладают активностью по ингибированию липазы, например, экстракты Alpinia officinarum, или соединения, выделенные из таких экстрактов, такие как 3-метилэфиргалангин (из A. officinarum).
ОБЩИЕ АСПЕКТЫ СИНТЕЗА
Синтез соединений, имеющих формулу (I), где X обозначает подгруппу (i), представлен на схеме 1. Промежуточные продукты, имеющие общую формулу (II), можно получить согласно известным способам, смотри, например: I. K. Khanna и др., J. Med. Chem. 2000, 43, 3168-3185; I. K. Khanna и др., J. Med. Chem. 1997, 40, 1634-1647; WO 03/027076 или WO 03/040107. Промежуточные продукты, имеющие общую формулу (IV), можно получить согласно известным способам, смотри, например: I. K. Khanna и др., J. Med. Chem. 2000, 43, 3168-3185.
Можно провести взаимодействие карбоксамидиновых производных общей формулы (II) с 2-хлоракрилонитрилом (III), получая 4,5-дигидро-1H-имидазольное производное общей формулы (IV). Данное взаимодействие предпочтительно проводить в присутствии основания, например, N,N-диизопропилэтиламина. Полученные производные общей формулы (IV) можно этерифицировать спиртом R10-OH, получая производное 4,5-дигидро-1H-имидазола общей формулы (V), где R10 обозначает разветвленную или линейную C1-5 алкильную группу или бензильную группу. Данное взаимодействие предпочтительно проводить в кислых условиях. Соединение общей формулы (V) может взаимодействовать с амином R3R4NH, предпочтительно в присутствии триметилалюминия (Me3Al), давая соединение формулы (I), где X обозначает подгруппу (i), и R3 и R4 имеют значения, которые даны выше на странице 2.
Дополнительную информацию по реакциям амидирования, промотированным триметилалюминием Al(CH3)3, можно найти в работе J. I. Levin, E. Turos, S. M. Weinreb, Synth Commun. (1982), 12, 989-993.
По-другому соединение общей формулы (V) можно гидролизовать до соответствующего производного карбоновой кислоты общей формулы (VI), где R11обозначает H или щелочноземельный металл, в частности Li, Na или K. По-другому можно провести взаимодействие соединения общей формулы (VI) с хлорирующим агентом, таким как тионилхлорид, получая соответствующий хлорангидрид кислоты. Можно провести взаимодействие соединения общей формулы (VI) с амином R3R4NH, получая соединение формулы (I), где X обозначает подгруппу (i), и R3 и R4 имеют значения, которые даны выше на странице 2, способами активации и взаимодействия, такими как образование активного сложного эфира, или в присутствии так называемого агента сочетания, например, DCC, HBTU, BOP (бензотриазол-1-илокситрис(диметиламино) фосфоний гексафторфосфат) и подобные. Дополнительную информацию по способам активации и взаимодействия аминов с карбоновыми кислотами можно найти в работах:
a) M. Bodanszky и A. Bodanszky, The Practice of Peptide Synthesis, Springer-Verlag, New York, 1994; ISBN: 0-387-57505-7;
b) K. Akaji и др., Tetrahedron Lett. (1994), 35, 3315-3318);
c) F. Albericio и др., Tetrahedron Lett. (1997), 38, 4853-4856).
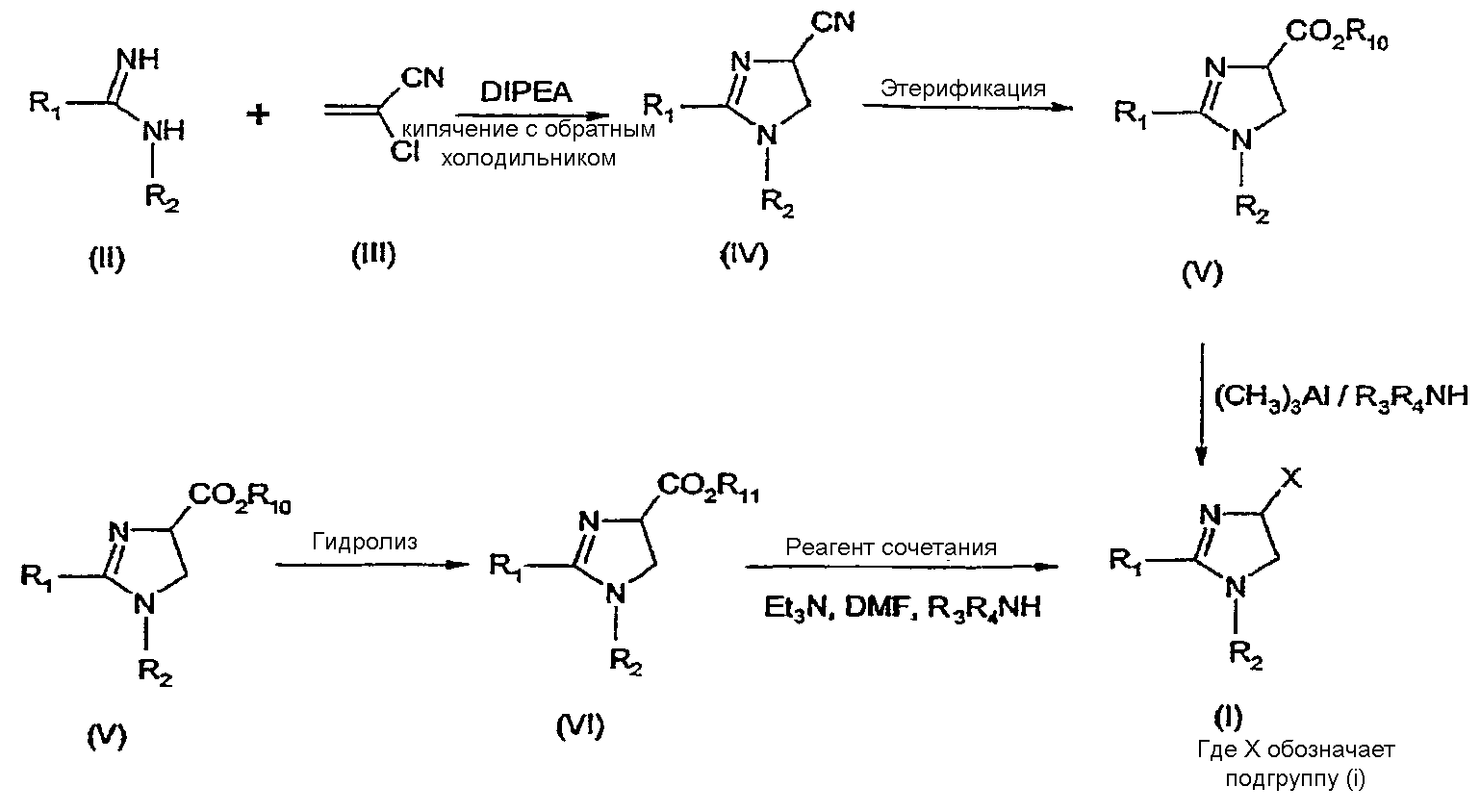
Схема 1
Синтез соединений, имеющих формулу (I), где X обозначает подгруппу (ii), представлен на схеме 2.
Промежуточный продукт общей формулы R7SO2NH2 либо является коммерчески доступным, либо его можно получить по стандартной методике синтеза, например, из соответствующего соединения R7SO2Cl (смотри, например, McManus и др., J. Med. Chem. 1965, 8, 766). Можно провести взаимодействие соединения общей формулы (IV) с соединением общей формулы R7O2NH2 в присутствии кислоты Льюиса, например, AlMe3, в инертном органическом ратворителе, таком как бензол, получая соединение общей формулы (I), где X обозначает подгруппу (ii) и R1, R2 и R7 имеют значения, которые даны выше на страницах 1-3, и где R8 и R9 обозначают атом водорода. Можно провести взаимодействие соединения общей формулы (V) с соединением общей формулы R7SO2NH2, получая соединение общей формулы (VII). Данное взаимодействие предпочтительно проводить в присутствии сильного ненуклеофильного основания. Можно провести взаимодействие соединения общей формулы (VII) с хлорирующим реагентом по реакции хлоримидирования и затем обработку амином R8R9NH, получая соединение формулы (I), где X обозначает подгруппу (ii).
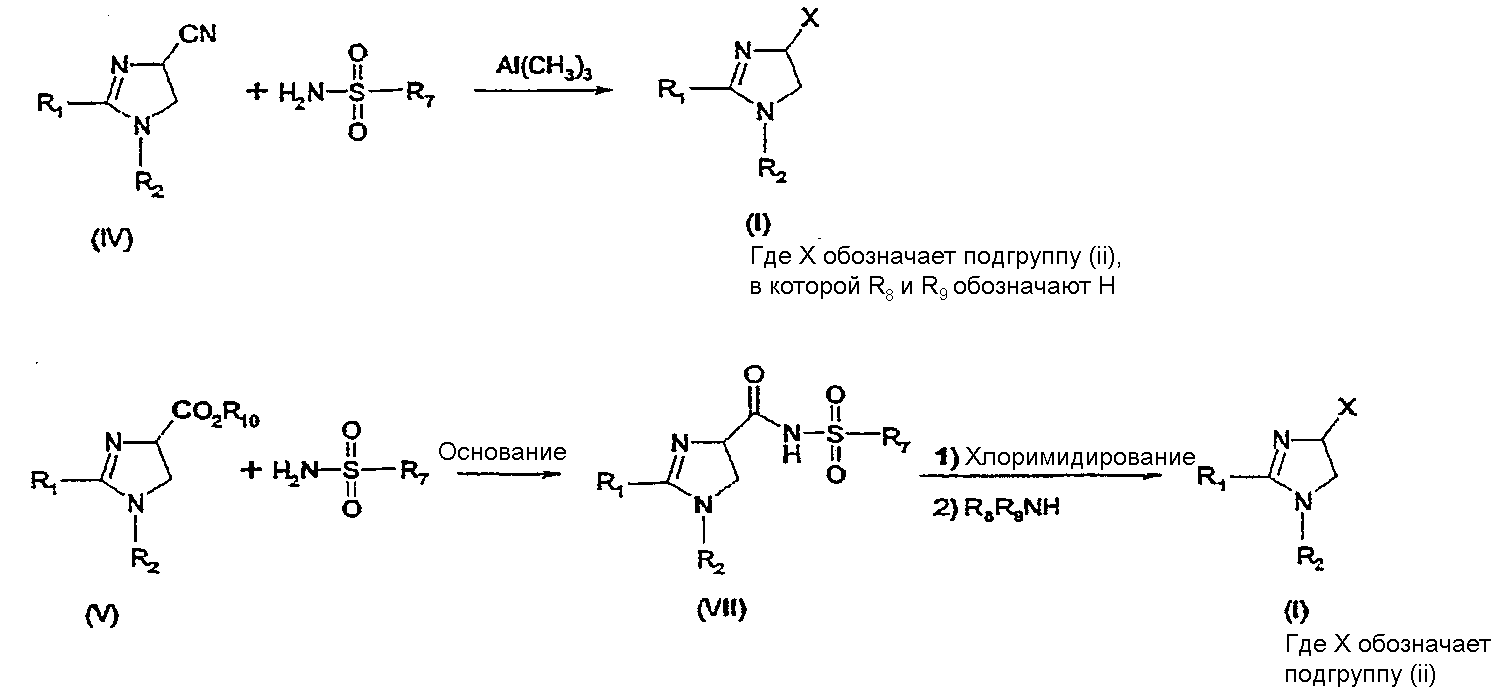
Схема 2
Выбор конкретного способа синтеза зависит от таких факторов, как совместимость функциональных групп с используемыми реагентами, возможность использования защитных групп, катализаторов, активирующих агентов и агентов сочетания и основные отличительные структурные признаки, присутствующие в конечном получаемом соединении.
Указанные далее соединения можно получить согласно данным методикам. Они предназначены для дополнительной более подробной иллюстрации изобретения и, следовательно, как полагают, никоим образом не ограничивают области данного изобретения.
ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ
Соединения изобретения можно представить в виде форм, подходящих для введения обычными способами, используя такие вспомогательные вещества, как жидкие или твердые носители. Фармацевтические композиции изобретения можно вводить энтерально, перорально, парентерально (внутримышечно или внутривенно), ректально или локально (в определенном месте). Их можно вводить в виде растворов, порошков, таблеток, капсул (включая микрокапсулы), мазей (кремов или гелей) или суппозиториев. Подходящими наполнителями для таких препаратов являются обычные фармацевтические жидкие или твердые наполнители и разбавители, растворители, эмульгаторы, лубриканты, вкусовые агенты, красители и/или буферные вещества. Часто используемыми вспомогательными веществами, которые можно упомянуть, являются: карбонат магния, диоксид титана, лактоза, маннит и другие сахара, тальк, белок молочной сыворотки, желатин, крахмал, целлюлоза и ее производные, животные и растительные масла, такие как рыбий жир, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, такие как, например, стерильная вода и моно- или многоатомные спирты, такие как глицерин.
Соединения настоящего изобретения обычно вводят в виде фармацевтических композиций, которые представляют собой важные и новые варианты данного изобретения благодаря присутствию данных соединений; здесь раскрыты более подробно конкретные соединения. Типы фармацевтических композиций, которые можно использовать, включают (но не ограничены этим) таблетки, жевательные таблетки, капсулы, растворы, парентеральные растворы, суппозитории, суспензии и другие типы, раскрытые здесь или понятные для специалистов в данной области из описания и общих знаний в данной области. В вариантах изобретения обеспечена фармацевтическая упаковка или набор, содержащий один или более контейнеров, заполненных одним или несколькими ингредиентами фармацевтической композиции по изобретению. К такому контейнеру (контейнерам) могут прилагаться различные печатные материалы, например, инструкции по применению или памятка в виде, установленном правительственным органом, регулирующим производство, использование или продажу фармацевтических продуктов, причем указанная памятка отражает одобрение данным органом производства, использования или продажи для введения человеку или ветеринарного применения.
ФАРМАКОЛОГИЧЕСКИЕ СПОСОБЫ
In vitro сродство к каннабиноидным рецепторам CB1
Сродство соединений изобретения к каннабиноидным рецепторам CB1 можно определить, используя мембранные препараты клеток яичников китайского хомяка (CHO), в которые стабильно трансфицирован человеческий каннабиноидный рецептор CB1в сочетании с [3H]CP-55,940 в качестве радиолиганда. После инкубации свежеприготовленного препарата клеточных мембран с [3H]-лигандом, с добавлением или без добавления соединений изобретения, проводят разделение связанных и свободных лигандов фильтрованием через фильтр из стекловолокна. Радиоактивность на фильтре определяют при помощи жидкостного сцинтилляционного счетчика.
In vitro антагонизм каннабиноидных рецепторов CB1
In vitro антагонизм рецепторов CB1можно оценить, используя человеческий рецептор CB1, клонированный в клетках яичников китайского хомяка (CHO). CHO-клетки выращивают в питательной среде Игла, модифицированной по способу Дульбеко (DMEM), дополненной 10% телячьей зародышевой сывороткой, инактивированной нагреванием. Среду отсасывают и заменяют DMEM, не содержащей телячьей зародышевой сыворотки, но содержащей [3H]-арахидоновую кислоту, и инкубируют в течение ночи в инкубаторе для клеточных культур (5% CO2/95% воздуха; 37°C; атмосфера, насыщенная водой). В течение этого периода [3H]-арахидоновая кислота включается в мембранные фосфолипиды. В день исследования среду отсасывают и клетки промывают три раза, используя 0,5 мл DMEM, содержащей 0,2% бычьего сывороточного альбумина (BSA). Стимуляция рецепторов CB1посредством WIN 55,212-2 ведет к активации PLA2 с последующим высвобождением [3H]-арахидоновой кислоты в среду. Такому (WIN 55,212-2)-индуцированному высвобождению противодействуют антагонисты рецепторов CB1зависимым от концентрации образом.
In vivo антагонизм каннабиноидных рецепторов CB1
In vivo CB1-антагонизм можно оценить, проводя тест на (CP-55,940)-индуцированную гипотензию у крыс. Самцам нормотензивных крыс (225-300 г; Harlan, Horst, The Netherlands) производят анестезию пентобарбиталом (80 мг/кг внутрибрюшинно). Измеряют кровяное давление, используя канюлю, вставленную в левую сонную артерию, при помощи датчика давления Spectramed DTX-plus (Spectramed B.V., Bilthoven, The Netherlands). Используя персональный компьютер (Compaq Deskpro 386 s) и программу накопления данных Po-Ne-Mah (Po-Ne-Mah Inc., Storrs, USA), регистрируют сигнал кровяного давления после повышения посредством Nihon Kohden Носитель Amplifier (Type AP-621G; Nihon Kohden B.V., Amsterdam, The Netherlands). Сердечный ритм является производным сигнала пульсирующего давления. Все соединения вводят перорально в виде микросуспензии в 1% метилцеллюлозе за 30 мин до введения анестезии, которую проводят за 60 мин до введения агониста рецепторов CB1CP-55,940. Объем инъекции составляет 10 мл/кг. После гемодинамической стабилизации вводят агонист рецепторов CB1CP-55,940 (0,1 мг/кг внутривенно) и устанавливают гипотензивный эффект (Wagner, J. A.; Jarai, Z.; Batkai, S.; Kunos, G. Hemodynamic effects of cannabinoids: coronary and cerebral vasodilation mediated by cannabinoid CB1 receptors. Eur.J.Pharmacol. 2001, 423, 203-10).
Фармацевтически приемлемые соли можно получать, используя стандартные методики, хорошо известные в данной области, например, смешивая соединение настоящего изобретения с подходящей кислотой, например, неорганической кислотой, такой как соляная кислота, или с органической кислотой.
ДОЗА
Сродство соединений изобретения с каннабиноидными рецепторами определяют, как описано выше. Из способности связывания, измеренной для данных соединений формулы (1), можно оценить теоретическую наименьшую эффективную дозу. При концентрации соединения от одного до двух Ki-значений, по-видимому, 100% каннабиноидных рецепторов заняты данным соединением. Перевод этой концентрации в мг соединения на кг массы пациента дает теоретическую наименьшую эффективную дозу при условии идеальной биодоступности. Фармакокинетика, фармакодинамика и другие анализы могут изменить фактически вводимую дозу в большую или меньшую сторону. Целесообразная вводимая доза составляет 0,001 - 1000 мг/кг, предпочтительно 0,1-100 мг/кг массы тела пациента.
ПРИМЕР 1: СИНТЕЗ КОНКРЕТНЫХ СОЕДИНЕНИЙ
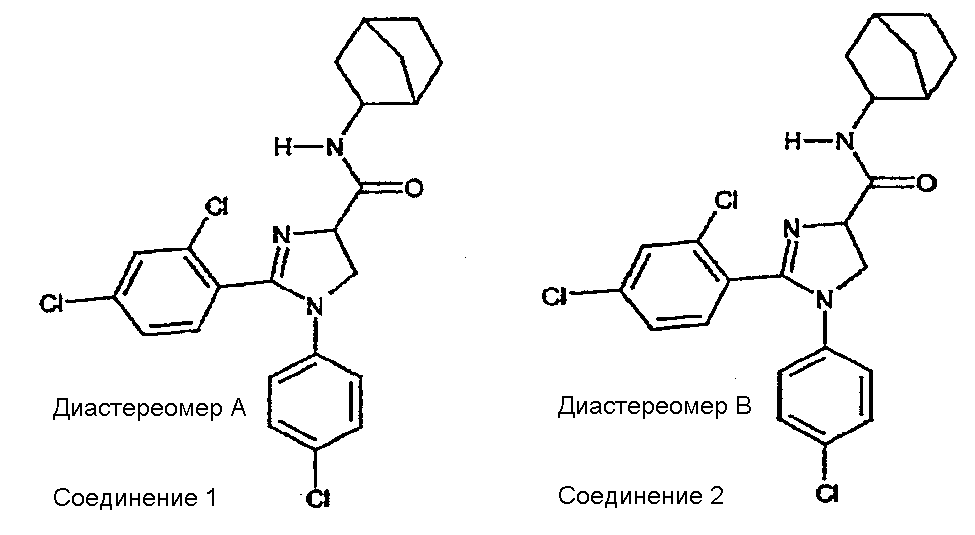
Соединения 1-2
Часть A: перемешиваемую магнитной мешалкой смесь н-(4-хлорфенил)-2,4-дихлорбензолкарбоксамидина (10,0 г, 0,033 моль), 2-хлоракрилонитрила (5,7 г, 0,065 моль) и N,N-диизопропилэтиламина (DIPEA) (12,5 мл, 0,069 моль) в тетрагидрофуране (150 мл) нагревают при температуре кипения с обратным холодильником в течение 40 ч (в атмосфере N2). После охлаждения до комнатной температуры смесь концентрируют в вакууме. Остаток растворяют в смеси дихлорметана и воды (200 мл/200 мл). Дихлорметановый слой собирают, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток перекристаллизовывают из смеси этанол/вода, получая 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбонитрил (11,23 г, 97% выход).1H-ЯМР (400 МГц, CDCl3): d 4,28 (дд, J = 10 и 8 Гц, 1H), 4,36 (т, J = 10 Гц, 1H), 5,07 (дд, J = 10 и 8 Гц, 1H), 6,68 (ш. д, J = 8 Гц, 2H), 7,16 (ш. д, J = 8 Гц, 2H), 7,32-7,36 (м, 2H), 7,45 (д, J = 8 Гц, 1H).
Часть B: ацетилхлорид (17,76 мл, 0,25 моль) медленно добавляют к этанолу (1 л), получая раствор A. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбонитрил (17,52 г, 0,05 моль) добавляют одной порцией к раствору A. После охлаждения до комнатной температуры смесь перемешивают еще 40 ч и концентрируют в вакууме. Остаток растворяют в дихлорметане и промывают (3x) водным (5%) NaHCO3. Дихлорметановый слой отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая этил 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбоксилат (18,0 г, 90% выход) в виде масла коричневого цвета, которое медленно затвердевает при стоянии.1H-ЯМР (400 МГц, CDCl3): d 1,34 (т, J = 7 Гц, 3H), 4,15 (дд, J = 10 и 8 Гц, 1H), 4,22-4,41 (м, 3H), 4,91 (дд, J = 10 и 8 Гц, 1H), 6,66 (ш. д, J = 8 Гц, 2H), 7,11 (ш. д, J = 8 Гц, 2H), 7,30 (дд, J = 8 и 2 Гц, 1H), 7,33 (д, J = 2 Гц, 1H), 7,46 (дд, J = 8 Гц, 1H).
Часть C: к перемешиваемому магнитной мешалкой раствору экзо-2-аминобицикло[2.2.1]гептана (0,67 мл, 0,009 моль) в безводном дихлорметане (10 мл) добавляют триметилалюминий (5,4 мл 2N раствора в гексане, 0,0108 моль) и полученный раствор перемешивают в течение 20 мин при комнатной температуре. Медленно добавляют раствор этил 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбоксилата (2,385 г, 0,006 моль) в безводном дихлорметане (10 мл) и проводят взаимодействие полученной смеси при 40°C в течение 40 час (в атмосфере N2). После охлаждения до комнатной температуры смесь гасят водным (5%) NaHCO3 и экстрагируют дихлорметаном. Дихлорметановый слой отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая сырой сироп желтого цвета (2,58 г), который дополнительно очищают методом флэш-хроматографии (силикагель, этилацетат/петролейный эфир = 8/2 (об./об.)), получая быстрее движущийся 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(экзо-2-бицикло[2.2.1]гептил)-4,5-дигидро-1H-имидазол-4-карбоксамид (диастереомер A) (0,70 г, 25% выход) и более медленно движущийся 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(экзо-2-бицикло[2.2.1]гептил)-4,5-дигидро-1H-имидазол-4-карбоксамид (диастереомер B) (0,69 г, 25% выход).
Диастереомер A:1H-ЯМР (400 МГц, CDCl3): d 1,10-1,58 (м, 7H), 1,76-1,84 (м, 1H), 2,26-2,30 (м, 2H), 3,74-3,82 (м, 1H), 4,27 (д, J ~ 10 Гц, 2H), 4,78 (т, J ~ 10 Гц, 1H), 6,65 (ш. д, J = 8 Гц, 2H), 6,70-6,78 (м, 1H), 7,12 (ш. д, J = 8 Гц, 2H), 7,29 (ш. с, 2H), 7,40 (ш. с, 1H).
Диастереомер B:1H-ЯМР (400 МГц, CDCl3): d 1,10-1,56 (м, 7H), 1,78-1,85 (м, 1H), 2,17-2,20 (м, 1H), 2,26-2,30 (м, 1H), 3,76-3,82 (м, 1H), 4,25-4,30 (м, 2H), 4,78 (дд, J = 10 и 8 Гц, 1H), 6,66 (ш. д, J = 8 Гц, 2H), 6,80 (ш. д, J ~ 7 Гц, 1H), 7,11 (ш. д, J = 8 Гц, 2H), 7,30 (ш. с, 2H), 7,41 (ш. с, 1H).
Соединения 3 и 4
Часть A: проводят взаимодействие смеси этил 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбоксилат (3,97 г, 0,01 моль)/метанол/вода с LiOH (1,3 г, 0,054 моль) при комнатной температуре в течение 16 час. Полученную смесь концентрируют в вакууме, получая сырой литий 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбоксилат (4,7 г).
Часть B: смесь сырого литий 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбоксилата (1,0 г, ~0,0027 моль), бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфата (BOP) (1,2 г, 0,0027 моль), 1-аминопиперидина (0,3 г, 0,003 моль) и триэтиламина (1 мл) в ДМФА (30 мл) перемешивают при комнатной температуре в течение 16 час. После концентрирования в вакууме добавляют воду и полученную смесь экстрагируют (2x) дихлорметаном. Дихлорметановые слои собирают, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая остаток, который дополнительно очищают методом флэш-хроматографии (силикагель, дихлорметан/метанол = 95/5 (об./об.)), получая 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-4,5-дигидро-1H-имидазол-4-карбоксамид (380 мг, 31% выход). Температура плавления 113-116°C.1H-ЯМР (200 МГц, CDCl3): d 1,33-1,48 (м, 2H), 1,60-1,80 (м, 4H), 2,68-2,82 (м, 4H), 4,28-4,35 (м, 2H), 4,84 (дд, J = 11 и 9 Гц, 1H), 6,65 (ш. д, J = 8 Гц, 2H), 7,11 (ш. д, J = 8 Гц, 2H), 7,23-7,33 (м, 2H), 7,41 (д, J = 2 Гц, 1H), 7,57 (ш. с, 1H).
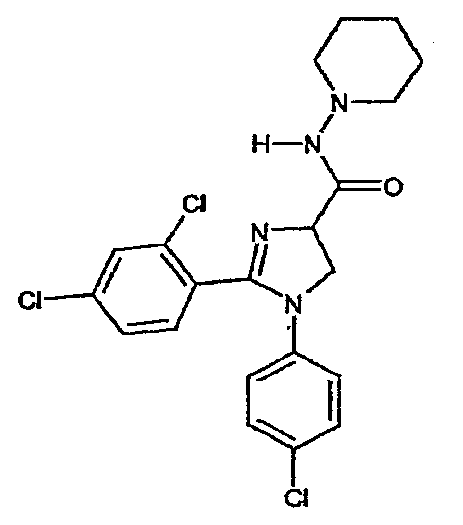
Соединение 3
Аналогичным образом получают соединение 4:
Соединение 4: 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-циклогексил-4,5-дигидро-1H-имидазол-4-карбоксамид. Температура плавления: 127-129°C.1H-ЯМР (200 МГц, CDCl3): d 1,04-2,03 (м, 10H), 3,73-3,92 (м, 1H), 4,23-4,33 (м, 2H), 4,81 (т, J ~ 10 Гц, 1H), 6,66 (ш. д, J = 8 Гц, 2H), 6,79 (ш. д, J ~ 7 Гц, 1H), 7,12 (ш. д, J = 8 Гц, 2H), 7,25-7,32 (м, 2H), 7,41 (ш. с, 1H).
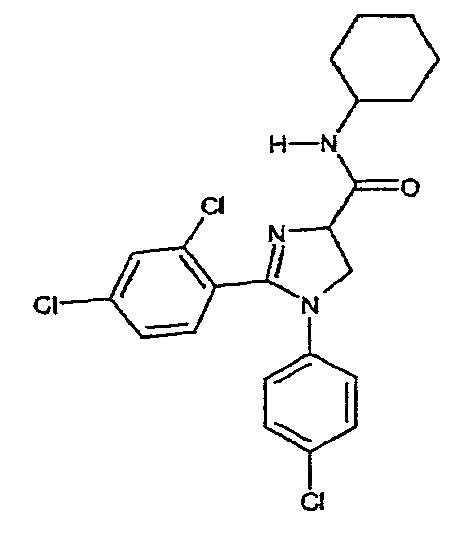
Соединение 4
Соединения 5-8
Часть A: к суспензии 4-хлорбензолсульфонамида (0,45 г, 0,00236 моль) в бензоле (5 мл) добавляют по каплям триметилалюминий (1,2 мл 2N раствора в толуоле, 0,0024 моль), получая прозрачный раствор, который перемешивают при комнатной температуре в течение 1 час. Добавляют 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4,5-дигидро-1H-имидазол-4-карбонитрил (0,55 г, 0,00157 моль) и полученную смесь нагревают при 90°C в течение 16 час. После охлаждения до комнатной температуры медленно добавляют смесь метанол/вода (8/2 (об./об.)), твердые вещества удаляют фильтрованием и промывают хлороформом (50 мл). Фильтрат концентрируют в вакууме. Остаток растирают в н-пентане и дважды перекристаллизовывают из метанола, получая 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-[(4-хлорфенил)сульфонил]-4,5-дигидро-1H-имидазол-4-карбоксамидин (0,435 г, 51% выход). Температура плавления: 165-166°C.1H-ЯМР (200 МГц, CDCl3): d 4,11-4,35 (м, 2H), 4,94 (дд, J =12 и 10 Гц, 1H), 6,63 (ш. д, J = 8 Гц, 2H), 7,12 (ш. д, J = 8 Гц, 2H), 7,22-7,52 (м, 6H), 7,90 (ш. д, J = 8 Гц, 2H), 8,10-8,20 (м, 1H).
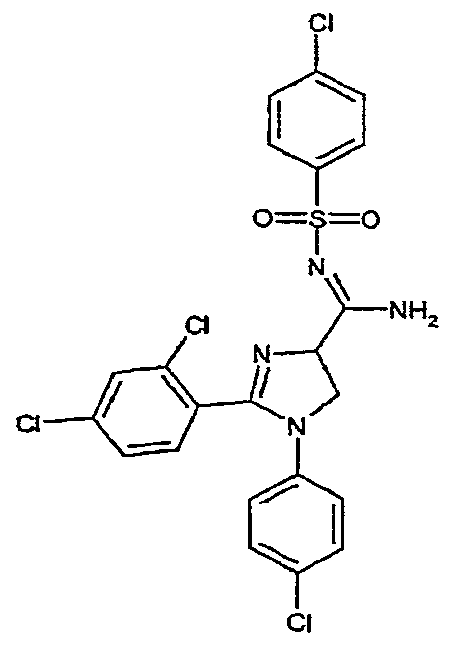
Соединение 5
Аналогичным образом получают перечисленные ниже соединения, имеющие формулу (I):
Соединение 6: 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-[(4-фторфенил)сульфонил]-4,5-дигидро-1H-имидазол-4-карбоксамидин. Температура плавления 172-175°C.1H-ЯМР (200 МГц, CDCl3): d 4,12-4,35 (м, 2H), 4,93 (дд, J =12 и 10 Гц, 1H), 6,63 (ш. д, J = 8 Гц, 2H), 7,08-7,43 (м, 8H), 7,90-8,02 (м, 2H), 8,10-8,20 (м, 1H).
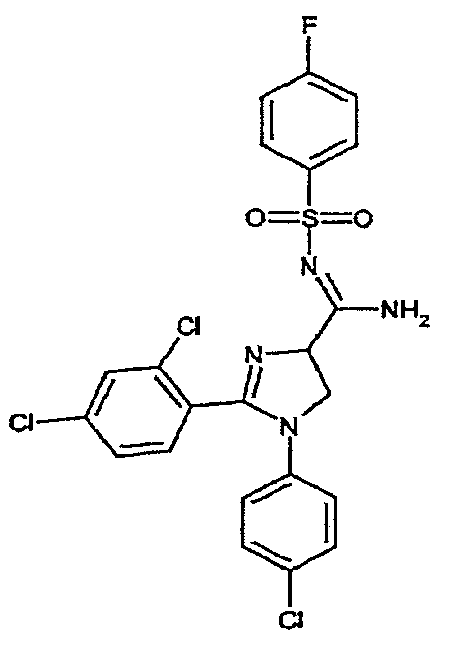
Соединение 6
Соединение 7: 2-(4-хлорфенил)-N-(диметиламиносульфонил)-1-фенил-4,5-дигидро-1H-имидазол-4-карбоксамидин. Температура плавления: 136-139°C.1H-ЯМР (200 МГц, CDCl3): d 2,79 (с, 6H), 4,20-4,40 (м, 2H), 4,97 (т, J ~ 10 Гц, 1H), 6,83 (ш. д, J = 8 Гц, 2H), 7,05-7,50 (м, 8H), 7,80-7,90 (м, 1H).
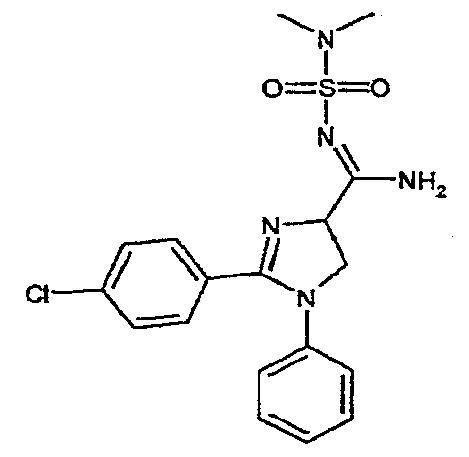
Соединение 7
Соединение 8: 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(диметиламиносульфонил)-4,5-дигидро-1H-имидазол-4-карбоксамидин. Температура плавления: 146-147°C.
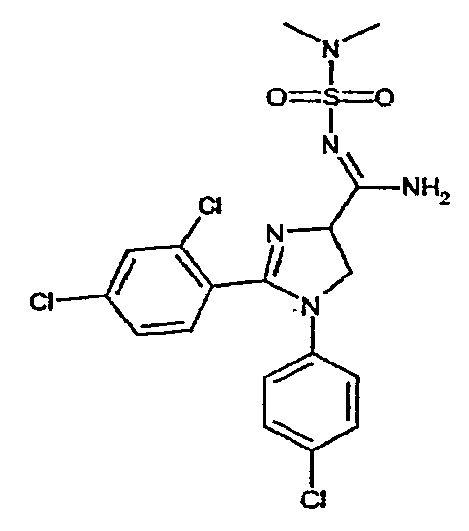
Соединение 8
ПРИМЕР 2: ПРЕПАРАТЫ, ИСПОЛЬЗУЕМЫЕ В ИССЛЕДОВАНИЯХ НА ЖИВОТНЫХ
Препарат соединения 1:
Для перорального (p.o.) введения: к требуемому количеству (0,5-15 мг) соединения, указанного выше как «соединение 1», в стеклянной пробирке добавляют стеклянные бусины и вещество перемалывают на вихревой мешалке в течение 2 мин. После добавления 1 мл 1% раствора метилцеллюлозы в воде соединение суспендируют вихревой мешалкой в течение 10 мин. Для получения концентраций 1 мг/мл и выше дополнительно суспендируют остающиеся в суспензии частицы, используя ультразвуковую баню.
ПРИМЕР 3: РЕЗУЛЬТАТЫ ФАРМАКОЛОГИЧЕСКИХ ТЕСТОВ
Данные по сродству к каннабиноидным рецепторам и in vitro функциональности, полученные согласно данным выше протоколам, показаны ниже в таблице.
Реферат
Настоящее изобретение относится к производным имидазолина, обладающим СВ1-антагонистической активностью, имеющим общую формулу I, где: R1 и R2 независимо обозначают фенил, который может быть замещен 1-2 заместителями Y, которые могут быть одинаковыми и представляют собой хлор, бром, фтор, йод, X обозначает одну из подгрупп (i) или (ii), где: R3 обозначает атом водорода или линейную C1-3алкильную группу, R4 обозначает С3-8циклоалкил или С5-10, причем указанные группы могут содержать один атом N, R7 обозначает бензильную или фенильную группу, причем указанные группы могут быть замещены по ароматическому кольцу 1 заместителем Y, где Y имеет значения, указанные выше, которые могут быть одинаковыми или разными, или R7 обозначает C1-8диалкиламиногруппу, R8 обозначает атом водорода, R9 обозначает атом водорода и их соли. Также изобретение относится к фармацевтической композиции на основе соединения формулы I и ее применению для лечения заболеваний, обусловленных каннабиоидной нейротрансмиссией. Технический результат: получены новые соединения, обладающие полезной биологической активностью. 5 н. и 4 з.п. ф-лы, 1 табл.
Формула
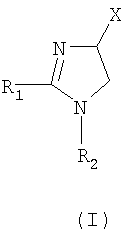
где
- R1 и R2 независимо обозначают фенил, который может быть замещен 1-2 заместителями Y, которые могут быть одинаковыми и представляют собой хлор, бром, фтор, йод,
- X обозначает одну из подгрупп (i) или (ii),
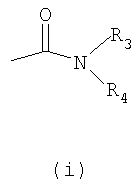
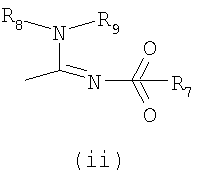
где
- R3 обозначает атом водорода или линейную С1-3алкильную группу,
- R4 обозначает С3-8циклоалкил или С5-10, причем указанные группы могут содержать один атом N,
- R7 обозначает бензильную или фенильную группу, причем указанные группы могут быть замещены по ароматическому кольцу 1 заместителем Y, где Y имеет значения, указанные выше, которые могут быть одинаковыми или разными, или R7 обозначает С1-8диалкиламиногруппу,
- R8 обозначает атом водорода,
- R9 обозначает атом водорода и их соли.

где
- R1 и R2 независимо обозначают фенил, причем указанная фенильная группа может быть замещена 1-2 заместителями Y, имеющими значения, которые даны в п.1,
- X имеет значения, которые даны в п.1,
- R3 обозначает атом водорода,
- R4 имеет значения, которые даны в п.1,
- R7 обозначает фенильную группу, причем указанная фенильная группа может быть замещена по ароматическому кольцу 1 заместителем Y, где Y имеет значения, указанные выше, которые могут быть одинаковыми или разными, или R7 обозначает
C1-8диалкиламиногруппу,
- R8 и R9 имеют значения, которые даны в п.1, и их соли.
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(экзо-2-бицикло[2.2.1]гептил)-4,5-дигидро-1Н-имидазол-4-карбоксамид (диастереомер А);
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(экзо-2-бицикло[2.2.1]гептил)-4,5-дигидро-1Н-имидазол-4-карбоксамид (диастереомер В);
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-4,5-дигидро-1Н-имидазол-4-карбоксамид;
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-циклогексил-4,5-дигидро-1Н-имидазол-4-карбоксамид;
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-[(4-хлорфенил)сульфонил]-4,5-дигидро-1Н-имидазол-4-карбоксамидин;
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-[(4-фторфенил)сульфонил]-4,5-дигидро-1Н-имидазол-4-карбоксамидин;
2-(4-хлорфенил)-N-(диметиламиносульфонил)-1-фенил-4,5-дигидро-1Н-имидазол-4-карбоксамидин;
1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(диметиламиносульфонил)-4,5-дигидро-1Н-имидазол-4-карбоксамидин.

Комментарии