Способ получения бисимидазолина - SU1199200A3
Код документа: SU1199200A3
Описание
Изобретение относится к способу получения новых производных имидаз лина, а именно бисимидазолинов общей формулы V. Jl-(C2HnX))njRi NyR N-lC HfjiOr CH CHYOVjCOR N-/ где R - аликильная структура димеризованной жирной кислот с 34 атомами углерода; 0,1; - Н или СН или группа атом кислорода NСН; , или -(CH2CHyo)-Ri; Н или -COR - ff-алкил Cg-C,7 n, - числа от О до 2 2, 4; А СЕ CHjCOO Сп ф обладающих антиэмульгирующими и ант коррозионными свойствами. Цель изобретения - получение новых соединений, обладающих ценными свойствами. Предлагаемый способ иллюстрирует . ся следующими примерами. Пример 1. В сепараторе воды вьщерживают 0,5 моль димерной ® г- H3C-N;N-CH2R © ж CH3-NN-CH2где R (здесь и в следующих формах алкилькая структура с 34 атомами углерода динеризованной жирной кислоты Молекулярный вес 1299, ИКС 1610 с и 1740 см . Вычислено, Z: С 73,97; Н 11,64, N6,,46. Найдено, %: С 73,1; Н 12,0; N 6,8; СЕ 4,6. CH2-C R . Л HN М-СН2-С 002 жирной кислоты с 1 моль амина в 30-150°С с обрат300 г ксилола при ным потоком до вьщеления около 36мл воды. После дистиллирования ксилола получают вязкий продукт. По методике примера 1 изготовлены бисимидазолины IVa-IVc соответственно: из 285 г (0,5 моль) Припол 1022 и 105 г ( 1 моль) диэтилентри- амина; из 285 г (0,5 моль) Припол 1022 и 104 г (1 моль) аминозтилэтаноламина; из 285 г (0,5 моль) Припол 1010 и 103 г ( 1 моль) дизтилентриамина . Бисимидазолины IVa-IVc обнарзгживают в инфракрасном спектре характеристическую линию поглощения С N при 1610 см . Пример 2. В раствор приготовленного по общему указанию бисимидазолина IVa в 300 г ксилола добавляют 250 г (1 моль) стеариновой Смесь вьщерживают при 130- кислоты. 150 с с обратным потоком. Нагрев продолжают до вьзделения 18 мл воды. После отделения ксилола добавляют 650 г изобутанола и кватернизируют в автоклаве при 70 С хлористым метилом . Получают коричневую льющуюся жидкость, содержащую 50% соединения формулы N-CO(CH7,)iBCH3 ц 2С1 I -CO(CH2libCH3 Пример 3. После произведенного , как в примере 1, превращения бисмидазолина IVa с 250 г стеарииовой кислоты при добавляют 60 г ( 1 моль) уксусной кислоты. После отделения ксилола и добавки 650 г изобутанола получают раствор, содержащий 50% соединения формулы - CO(CHr,)isCH3 2СНзСо6 Н-СО( Молекулярный вес 1319, ИКС 1610 erf и 1740 . Вычислено, %: С 7.4,7; Н 11,8; N 6,4., Найдено, %: С 75,2; Н 11,1 ; N 6,7. Пример 4. В раствор имидазолина IVa в 300 ксилола . добавляют 125 г (0,5 моль) стеариновой НзС lL -CH2-CH7€ ) т Н 6Молекулярный вес 1062,5; ИКС 1610 и 1740 .
Вычислено, %: С 72,3; Н 11,2; N 5,3; С1 6,7„
. Найдено, %: С 71,9; Н 10,9; N 5,5; се 5,0.
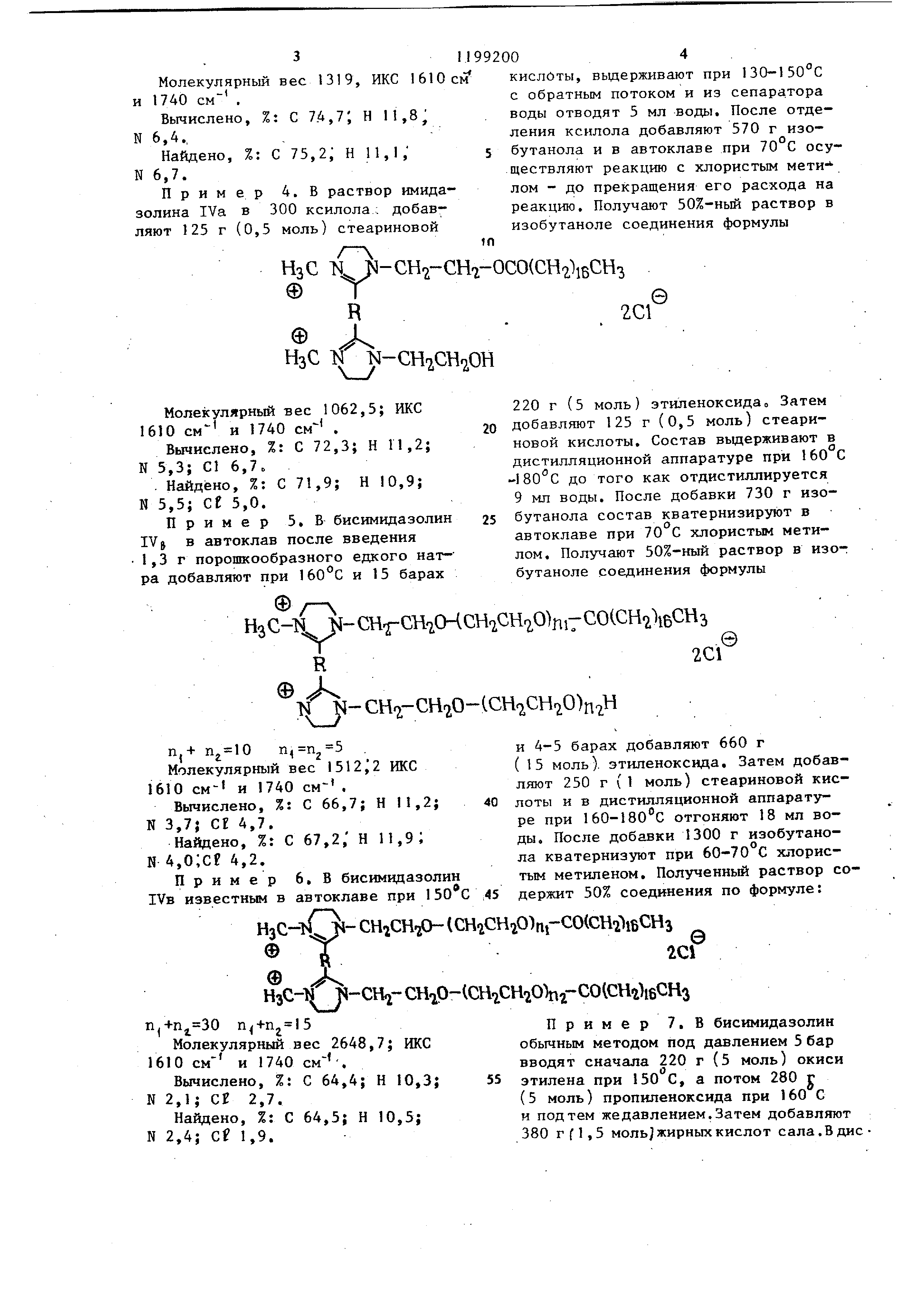
Пример 5, В бисимидазолин IVJ в автоклав после введения 1,3 г порошкообразного едкого натра добавляют при 160 С и 15 барах
г-
НзС-li К-СН СН2СИСН.1СН7,0)п17СО(
R
©А Т4 N-CHoTfN- СН -СН20-1СН.,СНг,0)пгН
п,+
Молекулярный вес 1512;2 ЖС 1610 см- и 1740 .
Вычислено, %: С 66,7; Н 11,2; N 3,7; Cf 4,7.
Найдено, %: С 67,2, Н 11,9; N 4,0;cf 4,2.
Пример 6,В бисимидазолин 1Ув известным в автоклаве при 150 С AS
НзС-тО СН СНтр- 1СНгСН20)пг О СВД1бСНз
®
НзС-1 -сн -СНгр-(СНгСН20)пг-СО(сНг)1бСНз
п,
Молекулярный вес 2648,7; ИКС 1610 и 1740 .
Вычислено, %: С 64,4; Н 10,3; N 2,1; Ct 2,7.
Найдено, %: С 64,5; Н 10,5; N 2,4; Cf 1,9. CH-iCH OH
220 г (5 моль) зтиленоксида Затем добавляют 125 г (0,5 моль) стеариновой кислоты. Состав выдерживают в дистилляционной аппаратуре при 160 С до того как отдистиллируется 9 мл воды. После добавки 730 г изобутанола состав кватернизируют в автоклаве при 70 С хлористым метилом . Получают 50%-ный раствор в изот бутаноле соединения формулы
2С1
и 4-5 барах добавляют 660 г ( 15 моль), этиленоксида. Затем добавляют 250 г (1 моль) стеариновой кислоты и в дистилляционной аппаратуре при 160-180с отгоняют 18 мл воды . После добавки 1300 г изобутанола кватернизуют при 60-70 С хлористым метиленом. Полученный раствор согс1
Пример 7.В бисимидазолин обычным методом под давлением 5 бар вводят сначала 220 г (5 моль) окиси этилена при 150 С, а потом 280 г (5 моль) пропиленоксида при 160 С и подтем же давлением. Затем добавляют 380 rfl,5 моль жирных кислот сала.Вдис кислоты, выдерживают при 130-150°С с обратным потоком и из сепаратора воды отводят 5 мл воды. После отделения ксилола добавляют 570 г изо- бутанола и в автоклаве при 70 С осуществляют реакцию с хлористьм мeти лом - до прекращения его расхода на реакцию. Получают 50%-ный раствор в изобутаноле соединения формулы O(CH2.1iBCH3 , 2С1 держит 50% соединения по формуле: тилляционном аппарате состав вьщержива-, ют дотого.как будетотогнано 27мл воды. Далее добавляют 1200 гизобутанола ипо (СН2CH2-CH2N
СНг-СН М-(СН2СН20)пг-СН2СНО)й,2-СОВ
.СНз
(СН2-СН20)п2-(СНОСНО ЬгН где R2 - алкил жирной кислоты сала, 2(п ,+П2) 10, 2(т,-Нп2) 10 п п га ., .т2 2,54,, Молекулярный вес 2501,8 ИКС 1610 см- и 1740 см . Вычислено, %: С 71,1 Н 10,9; N 3,4. . С 70,9; Н n,l;N 3,7, Найдено, Kj4-CH2C%NN-CH3CH H где R алкил жирной кислоты сала 2{п,+П2)5 1,2 5. Молекулярный вес 1882.5J ИКС 1610 см- и 1740 . Вычислено, %: 080,4 ;Н 7,5,N 5 Найдено, %: С 80,9; Н 7,8;N 4, Пример 9. 420 г (0,5 моль димерной жирной кислоты Жирная ки лота 7002 нагреваются с 104 г Ф/ CHo-N N Y К Ф Js. з-о где R, - 2-этилгексил. Молекулярный вес 961,5; ИКС 1610 см- и 1740 . Вычислено, %: С 68,7; Н 10,5; N 5,8; Ct 3,3. Найдено, %: С 69,2; Н 9,9; N 6,2; С1 3,1. Пример 10. К бисимидазолину IVB после добавки 1,5 г порршкоСНз
СН20)пг (CH2-CHO)mi- СОН . СНз лучают коричневую льющуюся жидкость, содержащую 50%активного вещества,следутащей формулы пример 8, К бисимидазолину IVa обычн1л образом при добавляет ПО г (2,5 моль) этиленоксиду . Затем при 160-180 с производят этерйфикацшо 500 г (2 моль) жирной кислоты сала. После добавки 925 г изо0утанола получают 50%-ный раствор соединения формулы 2CHaO)ni-CX)Ri )nuCOKi 2 ( 1 моль) амииоэтилэтаноламином без растворителя - пока не будет отогнано 36 мл воды. Затем добавляют 72 г (0,5 моль) 2-этилгексановой кислоты и отгоняют еще 9 мл воды. После введения 630г изобутанолакватернизируют с 80г диметилсульфатапри 65С.В результате получают50%-ный раствор в изобутаноле соединения следующейформулы СН20СОК| СНз80/1 СН20Н образного NaOH добавляют 880 г (20 моль) этиленоксида при 150 С и 5 бар. Затем добавляют 250 г ( 1 моль) стеариновой кислоты и нагу вают при до тех пор, пока не отгонят 18 мп . Затем в автоклав нагнетают при 70 С СН,СЕ до прекр еиия поглощения.j Получают 1550 г соеди ния формулы
Ф/-
3 / CWi- W2-0-()rfrC-(CH)l6-CH3
СНгСН -0-(СНг-СН2-0)пг-С-(СН2)1Б-СНз
икс 1610 ), 1730 см ()о
Вычислено, %: С 62,5; Н 10,4; N 1,8; С 2,3.
Найдено, %: С 61,8; Н 10,9; N 1,7; Ct 1,9.
В табл.1-4 показано антиэмульгирующее действие соединений по изобретению на нефтяные эмульсии при обычных для нефтяных месторождений.
Эмульгаторы применяются в 50%-ны изобутанольных растворах, впрыскиваемых михродозирукщимн установками Сепарация эмульгируемой воды происходит в закрываеьшх пробками конических калиброванные химических стаканах . Количество эмульсии составляет в каждом случае 100 см .
Абсолютное водосодержание эмульсии определяется в каждом случае
О
2С1
,0
I п,20; п,20 предварительными опытами по ДинуСтарку .
Ингибирование коррозии. Для опре-. деления эффекта ингибирования коррозии опытные полоски углеродистой стали поверхностью 20 см погружали на 6 ч при 60°С в 20%-ный раствор хлорида натрия содержащий добавку 10 мг/л, 20 мг/л или 30 мг/л испытуемого продукта . Через опытиый раствор во время испытания пропускали непрерывный поток пузырьков углекислоты. Мерой/ коррозивности является установленная затем абсолютная потеря веса металлической полоски.
Полученные результаты сведены в таблицу 5.
Таким образом, используемые согласно изобретениют продукты обладают свойствами хорошего расщепителя и одновременно иигибитора коррозии.
Таблица i





Реферат


Комментарии