Замещенные производные имидазола, способ введения фармацевтической композиции и способ лечения на основе этих соединений - RU2232154C2
Код документа: RU2232154C2
Описание
1. Область изобретения
Настоящее изобретение относится к способу лечения глаукомы или повышенного внутриглазного давления и других болезней со значительно сниженными сердечно-сосудистыми или седативным побочными эффектами путем введения млекопитающим, в том числе людям, соединений, которые являются селективными агонистами только адренергических рецепторов подтипов α2В или α2В и α2С и которые не имеют существенной активности в отношении рецепторов подтипа α2А. Настоящее изобретение также относится к новым соединениям и фармацевтическим композициям, адаптированным для введения указанных соединений млекопитающим, в том числе людям.
2. Краткое описание уровня техники
Соединения, которые обладают адренергической активностью, широко известны в данной области техники и описаны в многочисленных патентах США и иностранных патентах и в научных публикациях. Общеизвестно и признано в данной области техники, что адренергическая активность полезна в лечении животных вида млекопитающих, в том числе людей, для излечения или частичного снятия симптомов и состояний многочисленных болезней и состояний. Другими словами, в данной области техники общепризнанно, что фармацевтические композиции, имеющие в качестве активного ингредиента адренергическое(ие) соединение(я), пригодны для лечения глаукомы, хронической боли, закупорки носового канала, высокого кровяного давления, застойной сердечной недостаточности и для анестезии.
В данной области техники два основных семейства адренергических рецепторов названы альфа-адренергическими рецепторами и бета-адренергическими рецепторами, и известно, что каждое из этих двух семейств имеет подтипы, которые обозначают буквами алфавита, например α2А, α2В (Bylund et al, Pharmacol Rev. 46, pp.121-136 (1994)).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением обнаружено, что адренергические соединения, которые действуют селективно и предпочтительно даже специфично как агонисты рецепторов подтипов α2В или α2В/α2С (в дальнейшем называемые α2В или α2В/2С), отдавая им предпочтение перед рецепторами подтипа α2А, обладают желательными терапевтическими свойствами адренергических средств, но без одного или более чем одного нежелательного побочного эффекта, такого как изменение кровяного давления или седативный эффект. Для целей настоящего изобретения определено, что соединение является специфичным или по меньшей мере селективным агонистом рецепторов подтипа(ов) α2В или α2В/2С, если это соединение по меньшей мере приблизительно в десять раз более действенно как агонист в отношении рецепторов либо α2B и α2C, либо обоих подтипов, чем в отношении рецепторов подтипа α2А, или если различие в эффективности соединений в отношении рецепторов α2B или α2В/2С относительно рецептора α2А больше, чем 0,3, а его эффективность в отношении рецептора α2А не превышает 0,4.
Таким образом, настоящее изобретение относится к способам лечения животных класса млекопитающих, в том числе людей, фармацевтической композицией, содержащей в качестве активного ингредиента одно или более чем одно соединение, которое является специфичным или селективным адренергическим агонистом α2В или α2В/2С, для лечения многих болезней или состояний, против которых альфа-адренергические соединения используются, включая, без ограничения, глаукому, повышенное внутриглазное давление, хроническую боль, диарею и закупорку носового канала. Кроме того, соединения по настоящему изобретению пригодны для лечения мышечной спастичности, в том числе гиперактивного мочеиспускания, диареи, диуреза, синдромов отмены боли, в том числе невропатической боли, нейродегенеративных болезней, в том числе зрительной невропатии, спинальной ишемии и удара, дефицита памяти и познавательной способности, дефицита внимания, психозов, в том числе маниакальных расстройств, тревоги, депрессии, гипертензии, застойной сердечной недостаточности, сердечной ишемии и закупорки носового канала.
Настоящее изобретение также относится к фармацевтическим композициям, используемым в вышеупомянутых способах лечения.
Настоящее изобретение особо охватывает способы лечения болезней и состояний, для лечения которых эффективными являются адренергические соединения, но их применение ограничено из-за их общеизвестных побочных эффектов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения, которые используют в фармацевтических композициях и способах лечения по настоящему изобретению являются селективными или специфичными агонистами адренергических рецепторов подтипов α2В или α2В/2С, отдавая им предпочтение перед рецепторами подтипа α2А. В соответствии с настоящим изобретением соединение рассматривается как селективный агонист α2В или α2В/2С, если различие в эффективности соединений как агониста рецепторов подтипа(ов) α2B или α2В/2С по сравнению с рецепторами подтипа α2А больше, чем 0,3, а его эффективность в отношении рецепторов α2А не превышает 0,4, и/или соединение по меньшей мере приблизительно в десять раз более действенно. Предпочтительно, соединения, используемые в соответствии с настоящим изобретением, являются специфичными агонистами рецепторов подтипов α2B или α2В/2С. В этом отношении специфичный агонист особо определен в том смысле, что специфичный α-адренергический агонист не действует как агонист рецепторов подтипа α2А ни в какой измеримой или биологически значимой степени.
Был обнаружен ряд агентов, которые являются функционально селективными в отношении подтипов α2B или α2В/2С указанных адренергических рецепторов. Эта предпочтительная активность может быть определена многими функциональными анализами, такими как Cyclic AMP Production (продукция циклического аденозинмонофосфата) (Shimizu et al., J. Neurochem. 16, pp.1609-1619 (1969)); RSAT (технология выбора и амплификации рецептора) (Messier et al., Pharmacol. Toxicol. 76, pp.308-311 (1995)) и цитосенсорная микрофизиометрия (Neve et al, J. Biol. Chem. 267, pp.25748-25753 (1992)), с использованием клеток, которые в естественных условиях экспрессируют индивидуальные подтипы или имели один из представленных подтипов. Используемые клетки или рекомбинантные рецепторы должны быть человеческими или от вида, который, как показано, имеет сходную фармакологию. В исследовании, приведенном ниже, использовали анализ RSAT на клетках, временно трансфецированных рецепторами α2А человека (ген с10), рецепторами α2В крысы (ген RNG) и рецепторами α2С человека (ген с4). Показано, что рецептор α2B крысы имеет фармакологию, которая соответствует рецептору α2B человека (Bylund et al., Pharmacol, Rev. 46, pp.127-129 (1994)).
Для лечения в частности глаукомы можно применять местное введение. Любой местный фармацевтический препарат, такой как раствор, суспензия, гель, мазь или бальзам и тому подобное, можно наносить на глаз при глаукоме и на кожу для лечения при других показаниях. Приготовление таких местных препаратов широко известно в области фармацевтических препаратов (Remington’s Pharmaceutical Science, Edition 17, Mack Publishing Company, Easton, Pennsylvania).
Если лекарственное средство нужно вводить системно, то его можно изготавливать в виде порошка, пилюли, таблетки или тому подобного, либо в виде сиропа или эликсира для перорального введения. Для внутривенного, внутрибрюшинного, внутриоболочечного и эпидурального введения соединение готовят в виде раствора или суспензии, которые можно вводить посредством инъекции. В некоторых случаях может быть полезным приготовление препаратов этих соединений в виде суппозитория или в виде препарата продолжительного высвобождения, в том числе в форме кожного пластыря, для депонирования на или под кожу или для внутримышечной инъекции.
Лечение глаукомы или любых других показаний, которые, как известно или как обнаружено, являются чувствительными к лечению адренергическими соединениями, осуществляют путем введения терапевтически эффективной дозы одного или более чем одного соединения по настоящему изобретению. Терапевтическая концентрация представляет собой такую концентрацию, которая вызывает ослабление конкретного состояния или замедляет его развитие. В некоторых случаях лекарственное средство можно применять в профилактических целях для предупреждения начала конкретного состояния. Вводимая терапевтическая концентрация будет изменяться от состояния к состоянию и в некоторых случаях может изменяться в зависимости от степени тяжести состояния, которое лечат, и восприимчивости пациента к лечению. Соответственно, вводимую терапевтическую концентрацию лучше всего определять в данный момент времени и в данном месте путем рутинного экспериментирования. Однако предполагается, что для лечения например глаукомы препарат, содержащий от 0,001 до 5% по массе, предпочтительно приблизительно от 0,01 до 3%, как правило будет соответствовать терапевтически эффективной концентрации. При системном введении количество от 0,001 до 50 мг/кг, предпочтительно от 0,001 до 10 мг/кг веса тела в сутки, но наиболее предпочтительно приблизительно от 0,01 до 1,0 мг/кг, в большинстве случаев будет приводить в терапевтическому результату.
Так как специфичные селективные агонисты α2В и α2В/2С не имеют существенных α2А побочных эффектов, то лечение болезней или состояний такими соединениями по настоящему изобретению имеет преимущество, особенно когда лечение назначено человеку с сердечно-сосудистыми проблемами.
Общие структуры типичных адренергических соединений, представляющих собой специфичные в отношении α2В и α2С агонисты или селективные в отношении α2В и α2В/2С агонисты, которые используют в фармацевтических композициях и способах лечения по настоящему изобретению, представлены общими формулами ниже.
В одном аспекте данного изобретения соединение, обладающее селективной агонистической активностью в отношении адренергических рецепторов подтипа(ов) α2В или α2В/α2С по сравнению с адренергическими рецепторами подтипа 2А, представлено общей формулой

где пунктирные линии представляют собой возможные двойные связи;
R представляет собой Н или низший алкил;
X представляет собой S или C(H)R1, где R1 представляет собой Н или низший алкил, либо R1 отсутствует, когда X представляет собой S или когда связь между X и кольцом, представленным формулой

является двойной связью;
Y представляет собой O, N, S, (CR)y, где y является целым числом от 1 до 3, -СН=СН- или -Y1СН2-, где Y1 представляет собой O, N или S; x является целым числом 1 или 2, причем x=1, когда R2, R3 или R4 связан с ненасыщенным атомом углерода, и x=2, когда R2, R3 или R4 связан с насыщенным атомом углерода;
R2 представляет собой Н, низший алкил, галоген, гидрокси, низшую алкоксигруппу, низший алкенил, ацил или низший алкинил, либо R2 может представлять собой оксо, когда он присоединен к насыщенному атому углерода;
каждый из R3 и R4 представляет собой Н, низший алкил, галоген, низший алкенил, ацил, низший алкинил, арил, гетероарил или замещенный арил или гетероарил, где указанный заместитель представляет собой галоген, низший алкил, низшую алкоксигруппу, низший алкенил, ацил, низший алкинил, нитро, циано, трифторметил, гидрокси или фенил, либо вместе они представляют собой -(C(R2)х)z-; -Y1(C(R2)x)z ’-; -Y1(C(R2)x)yY1-; -(C(R2)x)-Y1-(C(R2)x)-; -(C(R2)x)-Y1 -(C(R2)x)-(C(R2)x)- и -Y1-(C(R2)x)-Y1-(C(R2)x)-, где z является целым числом от 3 до 5, z’ является целым числом от 2 до 4, а x и y являются такими, как определено выше, и, кроме того, любой конец каждой из этих двухвалентных группировок может быть присоединен либо к R3, либо к R4 с образованием конденсированной кольцевой структуры

и образованное таким образом кольцо может быть полностью ненасыщенным, частично ненасыщенным или полностью насыщенным при условии, что углерод кольца имеет валентность не более чем 4, азот имеет валентность не более чем 3, а O и S имеют валентность не более чем 2.
В другом аспекте изобретения приведенное выше соединение представлено формулой

где X может представлять собой C(H)R1, а R1 представляет собой Н.
В указанном соединении формулы II R2 может представлять собой Н, а

может представлять собой фуранильный радикал.
В таких фуранильных производных формулы II R3 и R4 вместе могут представлять собой (СН)4, либо R3 может представлять собой Н, а R4 может представлять собой трет-бутил, либо R3 и R4 могут представлять собой Н, либо R3 может представлять собой Н, а R4 может представлять собой метил или этил.
Альтернативно, в соединении формулы I R1 может представлять собой метил, а

может представлять собой фуранильный радикал.
Альтернативно, в указанных соединениях формулы II R2 может представлять собой Н, а

может представлять собой тиенильный радикал.
В таких тиенильных производных формулы II R3 и R4 вместе могут представлять собой (СН2)4, либо R3 может представлять собой фенил, а R4 может представлять собой Н, либо R3 и R4 вместе могут представлять собой (СН2)3S, либо R3 и R4 могут представлять собой Н, либо R3 и R4 вместе могут представлять собой (СН)4, либо R3 может представлять собой Н, а R4 может представлять собой метил, либо R3 может представлять собой бромо, а R4 может представлять собой Н, либо R3 может представлять собой водород, а R4 может представлять собой хлоро, либо R3 может представлять собой метил, а R4 может представлять собой водород.
Альтернативно, в соединениях формулы II

может представлять собой циклогексильный радикал.
В таких циклогексильных производных формулы II R2 может представлять собой водород, а R3 и R4 вместе могут представлять собой (СН)4, либо R2 может представлять собой оксо, а R3 и R4 вместе могут представлять собой (СН)4, либо R2 может представлять собой водород или оксо, а R3 и R4 вместе могут представлять собой (СН)2S, либо R2 может представлять собой водород, а R3 и R4 вместе могут представлять собой (СН2)4, образуя октагидронафталин, либо R2 может представлять собой оксо, а R3 и R4 вместе могут представлять собой (СН2)4, либо R2 может представлять собой оксо, а R3 и R4 вместе могут представлять собой (СН2)С(СН3)(СН), либо R2 может представлять собой водород, а R3 и R4 вместе могут представлять собой S(CH2)2, либо R2, R3 и R4 могут представлять собой Н, либо R2 может представлять собой оксо, а R3 и R4 вместе могут представлять собой (СН)2С(ОСН3)СН, либо R3 и R4 вместе могут представлять собой -Y1-C(R2)x-C(R2)x-Y1-, где Y1 представляет собой N, образуя тетрагидрохиноксалин, где R2 может представлять собой водород или оксо.
Альтернативно, в соединениях формулы II

может представлять собой тетрагидрохинолиновый радикал, где R3 и R4 вместе представляют собой -Y1-C(R2)x-C(R2)x-C(R2)x-, где Y1 представляет собой N. В таких тетрагидрохинолиновых производных (R2)x может представлять собой водород или оксо; или может представлять собой тетрагидроизохинолиновый радикал, где R3 и R4 вместе представляют собой -C(R2)x-Y1-C(R2)x-C(R2)x-, где Y1 представляет собой N, а (R2)х может представлять собой водород или оксо.
Альтернативно, в соединениях формулы II
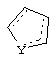
может представлять собой циклопентильный радикал.
В таких циклопентильных производных формулы II R2 может представлять собой Н, а R3 и R4 вместе могут представлять собой (СН)4, либо R2 может представлять собой оксо, а R3 и R4 вместе могут представлять собой (СН)4, либо R2 может представлять собой водород, а R3 и R4 вместе могут представлять собой (СН2)3.
В другом аспекте изобретения Y представляет собой (СН2)3, X может представлять собой СН, а R2 может представлять собой оксо, либо X может представлять собой CH2, R2 может представлять собой Н, а R3 и R4 вместе могут представлять собой (СН)4. Альтернативно, R3 и R4 вместе могут представлять собой (СН)4, Y может представлять собой
CH2C(CR
Наконец, в соединениях формулы II

может представлять собой фенильный радикал.
В таких фенильных производных формулы I X может представлять собой СН2, R2 может представлять собой Н или СН3, R2, R3 и R4 могут представлять собой Н, либо R3 и R4 вместе представляют собой O(CR2)2O, образуя 1,4-бензодиоксановое производное, либо альтернативно, X может представлять собой S, а R2, R3 и R4 могут представлять собой Н.
В другом аспекте изобретения указанное соединение имеет формулу

где Y представляет собой S или O.
В таком соединении формулы III X может представлять собой C(H)R1, R, R1, R2, R3 и R4 могут представлять собой H, а Y может представлять собой O или S.
В другом аспекте изобретения указанное соединение имеет формулу
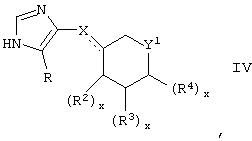
и R3 и R4 вместе представляют собой (СН)4.
В таких соединениях формулы IV Y1 может представлять собой О, R2 может представлять собой оксо, а X представляет собой CH или CH2, либо один из R2 представляет собой гидрокси, а другой может представлять собой Н, либо R2 может представлять собой H.
В таких соединениях формулы IV Y1 может представлять собой S, X может представлять собой CH2, а R2 может представлять собой оксо, либо R2 может представлять собой H, а X может представлять собой CH, и R2 может представлять собой оксо.
В другом аспекте изобретения соединение, обладающее селективной активностью в отношении адренергических рецепторов подтипа(ов) 2В или 2В и 2С по сравнению с адренергическими рецепторами подтипа с 2А, представлено формулой

альтернативно, W представляет собой бициклический радикал, выбранный из группы, состоящей из

где R5, R6, R7 и R8 выбраны из группы, состоящей из Н и низшего алкила, при условии, что по меньшей мере один из R5 и R6 или R6 и R7 представляет собой OC(R9)C(R9)N(R) с образованием конденсированного кольца с

где R9 представляет собой Н, низший алкил или оксо;
и

где R10 представляет собой Н, низший алкил, фенил или фенил, замещенный низшим алкилом, а Z представляет собой O или NH. Соединения, где W представляет собой норборнил, известны и заявлены в одновременно рассматриваемой переуступленной заявке 09/003902, поданной 7 января 1998 года, содержание которой во всей свое полноте включено в данное описание изобретения ссылкой.
В одном аспекте изобретения Z может представлять собой O, а W может представлять собой

и R10 может быть выбран из группы, состоящей из Н, фенила и о-метилфенила; например, R10 может представлять собой о-метилфенил.
В другом аспекте изобретения W может представлять собой

где Z может представлять собой NR, R может представлять собой метил или водород, один из (R9)x может представлять собой Н, и R5 может представлять собой H.
Альтернативно, W может представлять собой

где R может представлять собой H, а R8 может представлять собой метил.
Понятно, что сделанная выше ссылка на низшие алкил, алкоксигруппу, алкенил или алкинил предназначена для обозначения радикалов, имеющих от одного до восьми атомов углерода, предпочтительно от одного до четырех атомов углерода. Сделанная выше ссылка на арил предназначена для обозначения радикалов, имеющих от шести до четырнадцати атомов углерода, предпочтительно от шести до десяти атомов углерода. В случае ссылки на галоген предпочтительными являются фторо и хлоро.
Изобретение дополнительно иллюстрируется следующими примерами (в том числе общими схемами синтеза), которые являются иллюстрацией различных аспектов изобретения и не предназначены для ограничения объема изобретения, как оно определено пунктами прилагаемой формулы изобретения.
Пример А
Синтез 1-диметилсульфамоил-2-трет-бутилдиметилсилил-5-имидазолкарбоксальдегида

Методика
К 320 мл бензола добавляли имидазол (1) (20,0 г, 0,29 моль), триэтиламин (41,0 мл, 0,29 моль) и N, N-диметилсульфамоилхлорид (31,6 мл, 0,29 моль). Реакционную смесь перемешивали в течение 48 часов при комнатной температуре (кт), а затем фильтровали. Фильтрат собирали и концентрировали при пониженном давлении. Вакуумная перегонка неочищенного продукта (~0,5 мм Hg, 115-118°С) привела к получению 38,7 г (76%) прозрачного и бесцветного масла. При охлаждении продукт затвердевал с образованием белых кристаллов (2). К 430 мл тетрагидрофурана (ТГФ) добавляли 1-(диметилсульфамоил)имидазол (2) (18,8 г, 0,11 моль). Раствор охлаждали до -78°С. В реакционную колбу по каплям добавляли раствор н-бутиллития (н-BuLi) в гексане (1,6 М, 70,9 мл, 0,11 моль). По завершении добавления реакционную смесь перемешивали в течение 1 часа при -78°С. К этой реакционной смеси через канюлю добавляли трет-бутилдиметилсилилхлорид (17,8 г, 0,12 моль) в 50 мл ТГФ. После окончания добавления реакционную смесь медленно нагревали до кт, а затем перемешивали в течение 24 часов. Реакционную смесь разбавляли водой и отделяли органический слой. Органическую фазу промывали рассолом, а затем сушили над сульфатом натрия. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении. Колоночная хроматография (20% этилацетата/гексан в качестве элюента) привела к получению светло-желтого твердого вещества. Перекристаллизация из пентана дала 30 г (94%) белых кристаллов (3).
К 100 мл ТГФ добавляли 1-диметилсульфамоил-2-трет-бутилдиметилсилилимидазол (3) (5,0 г, 17,3 ммоль). Раствор охлаждали до -20°С. В реакционную колбу по каплям добавляли раствор вторичного бутиллития (втор-BuLi) в гексане (1,3 М, 14,6 мл, 19 ммоль). По завершении добавления реакционную смесь перемешивали в течение 1 часа при -20°С. К этой реакционной смеси добавляли 8 мл диметилформамида (ДМФ), а затем перемешивали при кт в течение 3,5 часов. Реакционную смесь разбавляли водой и отделяли органический слой. Органическую фазу промывали рассолом, а затем сушили над сульфатом натрия. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении. Колоночная хроматография (20% этилацетата/гексан в качестве элюента) привела к получению светло-желтого масла. При охлаждении продукт затвердевал с образованием желтых кристаллов 1-диметилсульфамоил-2-трет-бутилдиметилсилил-5-имидазолкарбоксальдегида (4).
Пример Б-1
Методика получения гидрохлорида 4(5)-(7-метокси-1,2,3,4-тетрагидронафталин-2-илметил)-1Н-имидазола:

Методика
К 8,5 мл 40%-ного раствора серной кислоты добавляли 7-метокси-1-тетралон (1) (1,5 г, 8,5 ммоль) и 1-диметилсульфамоил-2-трет-бутилдиметилсилил-5-имидазолкарбоксальдегид (2) (2,7 г, 8,5 ммоль). Реакционную смесь нагревали в течение 24 часов при 900С. После охлаждения до кт реакционную смесь делали основным избытком концентрированного гидроксида аммония. Смесь два раза экстрагировали ТГФ. Органические слои объединяли и промывали рассолом. Органический слой отделяли и сушили над сульфатом натрия. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении с получением 2,7 г желтого твердого вещества (3), содержащего 3-(3Н-имидазол-4(5)илметилен)-7-метоксихроман-4-он. Этот неочищенный продукт суспендировали в 100 мл этанола и добавляли катализатор палладий на углероде (10%, 0,27 г). Смесь встряхивали в гидрогенизаторе Парра при давлении водорода 40 фунт/кв.дюйм (275,8 кПа). Через 19 часов реакционную смесь фильтровали через целит, и фильтрат концентрировали при пониженном давлении. Колоночная хроматография с использованием 7% метанола в хлороформе привела к получению 1,05 г (46%) твердого вещества желтовато-коричневого цвета, содержащего 2-[3Н-имидазол-4(5)-илметил]-7-метокси-3, 4-дигидро-2Н-нафталин-1-он (4) (Б-1а). (4) (0,5 г, 1,95 моль) добавляли к 20 мл метанола. К раствору добавляли борогидрид натрия (74 мг, 1,95 моль). После перемешивания в течение 2,5 часов при кт реакционную смесь гасили водой. Затем реакционную смесь два раза экстрагировали этилацетатом. Органические слои объединяли и промывали рассолом. Органический слой отделяли и сушили над сульфатом натрия. Смесь фильтровали, фильтрат концентрировали при пониженном давлении с получением 0,5 г белого твердого вещества (5), содержащего 2-[3Н-имидазол-4(5)-илметил]-7-метокси-3, 4-дигидро-2Н-нафталин-1-ол. Этот неочищенный продукт растворяли в 26 мл дихлорметана. Добавляли триэтилсилан (2,5 мл, 15,6 моль) и трифторуксусную кислоту (4,8 мл, 62,3 моль), и эту реакционную смесь перемешивали при кт в течение 22 часов. Реакционную смесь делали основной 2 н. NaOH, и органический слой отделяли и промывали рассолом. Раствор сушили над сульфатом натрия. Смесь фильтровали, фильтрат концентрировали при пониженном давлении. Колоночная хроматография с использованием 7% метанола в хлороформе привела к получению 0,39 г (83%) желтовато-коричневого масла (6). Продукт растворяли в метаноле и добавляли избыток хлороводорода (HCl) в эфире. Раствор концентрировали при пониженном давлении с получением 0,3 г твердого вещества желтовато-коричневого цвета. Колоночная хроматография с использованием 7% метанола в хлороформе, после перекристаллизации из смеси ацетона и метанола, привела к получению 0,25 г (46%) гидрохлорида 4(5)-(7-метокси-1,2,3, 4-тетрагидронафталин-2-илметил)-1Н-имидазола (Б-1) в виде белых кристаллов (7).
1Н ЯМР (300 МГц, CD3OD) 8.83 (s, 1H), 7.38 (s, 1H), 6.95 (d, 1H, J = 8.5 Гц), 6.66 (d, 1H, J=8.4 Гц), 6.57 (s, 1H), 3.73 (s, 3H), 2.71-2.81 (m, 5H), 2.43-2.52 (m, 1H), 1.90-2.14 (m, 2H), 1.40-1.51 (m, 1H).
Следуя методике Примера Б-1, различные конденсированные циклические соединения подвергают взаимодействию с получением производных имидазола, перечисленных ниже.
Пример Б-2 (а-г)
4-хроманон (2а) 3-(3Н-имидазол-4(5)-илметилен)хроман-4-он
(2б) 3-(3Н-имидазол-4(5)-илметил)хроман-4-он
(2в) 3-(3Н-имидазол-4(5)-илметил)хроман-4-ол
(2г) 4(5)-хроман-3-илметил-1Н-имидазол
Пример Б-3 (а-б)
1-тетралон (3а) 2-(3Н-имидазол-4(5)-илметил)-3,4-дигидро-2Н-нафталин-1-он
(3б) 4(5)-(1,2,3, 4-тетрагидронафталин-2-илметил)-1Н-имидазол
Пример Б-4 (а-б)
4-метил-1-тетралон (4а) 4(5)-(4-метил-1,2,3,4-тетрагидронафталин-2-илметил)-1Н-имидазол
(4б) 2-(3Н-имидазол-4(5)-илметил)-4-метил-3,4-дигидро-2Н-нафталин-1-он
Пример Б-5 (а-б)
тиохроман (5а) 3-(3Н-имидазол-4(5)-илметилен)тиохроман-4-он
(5б) 3-(3Н-имидазол-4(5)-илметил)тиохроман-4-он
Пример Б-6
Гидрохлорид предыдущего соединения получают в соответствии со стадией 5 способа Примера Б-1, приведенного выше.
тиохроман 4(5)-тиохроман-3-илметил-1Н-имидазол
Пример Б-7 (а-в)
1-инданон (7а) 2-(3Н-имидазол-4(5)-илметилен)индан-1-он
(7б) 2-(3Н-имидазол-4(5)-илметил)индан-1-он
(7в) 4(5)-индан-2-илметил-1Н-имидазол
Пример Б-8 (а-б)
7-метил-1-тетралон (8а) 2-(3Н-имидазол-4(5)-илметил)-7-метил-3,4-дигидро-2Н-нафталин-1-он
(8б) 4(5)-(7-метил-1,2,3,4-тетрагидронафталин-2-илметил)-1Н-имидазол
Гидрохлорид этого соединения получают способом Примера Б-6.
Пример Б-9 (а-в)
4-кето-4,5,6,7-тетрагидротианафтен (9а) 4(5)-(4,5,6,7-тетрагидробензо[b]тиофен-5-илметил)-1Н-имидазол
Гидрохлорид этого соединения получают способом Примера Б-6.
(9б) 5-(3Н-имидазол-4(5)-илметил)-6,7-дигидро-5Н-бензо[b]тиофен-4-он
Гидрохлорид этого соединения получают способом Примера Б-6.
(9в) 5-(октагидробензо[b]тиофен-5-илметил)-1Н-имидазол
Пример Б-10
4,4-диметил-1-тетралон 4(5)-(4,4-диметил-1,2,3, 4-тетрагидронафталин-2-илметил)-1Н-имидазол
Пример Б-11 (а-б)
1-бензоциклогептанон (11а) 4(5)-(6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-илметил)-1Н-имидазол
(11б) 6-(1Н-имидазол-4(5)-илметилен)-(6,7,8,9-тетрагидробензоциклогептен-5-он
Пример В-1
Методика получения 4(5)-тиофен-3-илметил-1Н-имидазола:

Методика
1-(Диметилсульфамоил)имидазол (1) (2,0 г, 11,4 ммоль) переносят в 42 мл безводного ТГФ и охлаждают до -78°С. К раствору (1) по каплям добавляют н-BuLi (6,6 мл, 10,6 ммоль). Полученный раствор перемешивают при -78°С в течение 30 минут. К реакционной смеси добавляют трет-бутилдиметилсилилхлорид (ТБСХ) (1,6 г, 10,6 ммоль) в 8 мл ТГФ. Реакционную смесь нагревают до кт и перемешивают в течение ночи. На следующий день реакционную смесь охлаждают до -20°С и добавляют 7,3 мл (11,6 ммоль) н-BuLi. После перемешивания при -20°С в течение 45 минут к реакционной смеси добавляют 3-тиофенкарбоксальдегид (2) (1,0 мл, 11,6 ммоль). Затем реакционную смесь нагревают до кт и перемешивают в течение ночи. На следующий день реакцию гасят водой и разбавляют этилацетатом.
Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (2:5 этилацетат/гексан) приводит к получению 3,0 г (7,5 ммоль) диметиламида 2-(трет-бутилдиметилсилил)-5-(гидрокситиофен-2-илметил)имидазол-1-сульфоновой кислоты (3). (3) (1,5 г, 3,74 ммоль) переносят в 37 мл ТГФ. К раствору (3) по каплям добавляют 1 М раствор тетра-н-бутиламмония фторида (ТБАФ) в ТГФ (4,1 мл, 4,1 ммоль). Реакционную смесь перемешивают в течение ночи при кт. На следующий день реакцию гасят водой, а затем реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Выделяют 0,94 г (3,3 ммоль) диметиламида 5-(гидрокситиофен-2-илметил)имидазол-1-сульфоновой кислоты (4). (4) (0,5 г, 1,74 ммоль) переносят в 23 мл дихлорметана, к раствору добавляют 2,2 мл (13,9 ммоль) триэтилсилана и 4,3 мл (55, 7 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивают при кт в течение ночи, а затем гасят водой и нейтрализуют твердым бикарбонатом натрия. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием смеси этилацетата и гексана (1:1) приводит к получению 0,42 г (1,55 ммоль) диметиламида 5-(тиофен-2-илметил)имидазол-1-сульфоновой кислоты (5). (5) (0,42 г, 1,55 ммоль) переносят в 10 мл 1,5 н. раствора HCl и нагревают с обратным холодильником в течение 3 часов, а затем перемешивают при кт в течение ночи. Реакционную смесь разбавляют этилацетатом, нейтрализуют твердым бикарбонатом натрия, а затем делают основной 2н. NaOH. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием смеси хлороформа и метанола (10:1) приводит к получению 0,17 г (1,0 ммоль) 4(5)-тиофен-3-илметил-1Н-имидазола (6) (В-1).
1Н ЯМР (300 МГц, CD3OD) 7.52 (s, 1H), 7.25-7.27 (m, 1H), 6.96-7.01 (m, 2H), 6.77 (s, 1H), 3.98 (s, 2H).
Пример В-2
В способе Примера В-1 3-тиофенкарбоксальдегид заменяют изомером 2-карбоксальдегидом с получением 4(5)-тиофен-2-илметил-1Н-имидазола.
Пример В-3
В способе Примера В-1 3-тиофенкарбоксальдегид заменяют 5-метил-2-тиофенкарбоксальдегидом с получением 4(5)-(5-метилтиофен-2-илметил)-1Н-имидазола.
Пример В-4
В способе Примера В-1 3-тиофенкарбоксальдегид заменяют 5-хлор-2-тиофенкарбоксальдегидом с получением 4(5)-(5-хлортиофен-2-илметил)-1Н-имидазола.
Пример В-5
В способе Примера В-1 осуществляют замену на 2-фуранкарбоксальдегид с получением 4(5)-фуран-2-илметил-1Н-имидазола.
Пример В-6
В способе Примера В-1 осуществляют замену на 3-фуранкарбоксальдегид с получением 4(5)-фуран-3-илметил-1Н-имидазола.
Пример В-7
В способе Примера В-1 осуществляют замену на 5-метил-2-фуранкарбоксальдегид с получением 4(5)-(5-метилфуран-2-илметил)-1Н-имидазола.
Пример В-8
В способе Примера В-1 осуществляют замену на бензальдегид с получением 4(5)-бензил-1Н-имидазола.
Пример В-9
В способе Примера В-1 осуществляют замену на 3-тианафтенкарбоксальдегид с получением 4(5)-бензо[b]тиофен-2-илметил-1Н-имидазола.
Пример В-10
В способе Примера В-1 осуществляют замену на 2-бензофуранкарбоксальдегид с получением 4(5)-бензофуран-2-илметил-1Н-имидазола.
Пример В-11
В способе Примера В-1 осуществляют замену на 5-этил-2-фуранкарбоксальдегид с получением 4(5)-(5-этилфуран-2-илметил)-1Н-имидазола.
Пример В-12
В способе Примера В-1 осуществляют замену на 4-бром-2-тиофенкарбоксальдегид с получением 4(5)-(4-бромтиофен-2-илметил)-1Н-имидазола.
Пример В-13
В способе Примера В-1 осуществляют замену на 4-фенил-2-тиофенкарбоксальдегид с получением 4(5)-(4-фенилтиофен-2-илметил)-1Н-имидазола.
Пример В-14
В способе Примера В-1 осуществляют замену на 4-метил-2-тиофенкарбоксальдегид с получением гидрохлорида 4(5)-(4-метилтиофен-2-илметил)-1Н-имидазола.
Пример Г-1
Методика получения оксазолидин-2-илиден-(3-фенилбицикло[2.2.1]гепт-2-ил)амина:

Методика
Эндо экзо относительную стереохимию соединения получили путем образования β-нитростирола как показано выше. Обработка метанольного раствора бензальдегида (10 г, 94,3 ммоль) нитрометаном (51 мл, 943 ммоль) в присутствии гидроксида натрия (3 н. раствор в метаноле до рН 8) привела к получению нитроспирта с 60%-ным выходом. Дегидратацию спирта осуществляли путем обработки хлорангидридом метансульфоновой кислоты (3,56 г, 31,1 ммоль), а затем триэтиламином (6,3 г, 62,2 ммоль) в дихлорметане (35 мл) с 97%-ным выходом продукта. Для очистки соединения выполняли Kugelrohr перегонку. Создание скелета бицикло[2.2.1]гептана проводили в одну стадию. Реакцию Дильса-Альдера проводили нагреванием нитростирола (4,5 г, 30,2 ммоль) с циклопентадиеном (3,98 г, 60,4 ммоль) в 1,2-дихлорэтане (10 мл). Реакция Дильса-Альдера протекает при нитросоотношении эндо:экзо приблизительно 3:1. Соотношение и относительную стереохимию показывает рентгенографический анализ. Восстановление как нитрогруппы, так и олефина проводили в атмосфере водорода в присутствии 10% по массе палладия на угле. Разделение изомеров проводили на этой стадии, используя флэш-хроматографию с использованием 5% насыщенного аммиаком метанола в дихлорметане. Амин (0,7 г, 3,74 ммоль) обрабатывали хлорэтилизоцианатом (0,38 мл, 4,49 ммоль) с получением хлорэтилмочевины, которую затем нагревали в присутствии водного раствора NaHCO3 с получением оксазолидин-2-илиден-(3-фенилбицикло[2.2.1]гепт-2-ил)амина (Г-1) с 51%-ным выходом.
1Н ЯМР (300 МГц, CDCl3) d 1.36-1.80 (m, 6H), 2.14 (d, 1H, J=4.40 Гц), 2.37 (s, 1H), 2.65 (s, 1H), 3.71-3.78 (m, 2H), 3.95-3.98 (m, 1H), 4.19-4.25 (t, 2H, J=17.15 Гц, J=8.36 Гц), 7.17-7.29 (m, 5H).
Пример Г-2
Получают оксазолидин-2-илиден-(3-о-толилбицикло[2.2.1]гепт-2-ил)амин, осуществляя в способе Г-1 замену на о-метил-β-нитростирол.
Пример Г-3
Получают бицикло[2.2.1]гепт-2-ил-оксазолидин-2-илиденамин, осуществляя в способе Г-1 замену на нитроэтен.
Пример Д-1
Методика получения имидазолидин-2-илиден-(4-метил-3, 4-дигидро-2Н-бензо[1,4]оксазин-6-ил)амина:
К 2-амино-4-нитрофенолу (1) (4,00 г, 25,95 ммоль), триэтиламину (15,20 мл, 109,0 ммоль) и 4-диметиламинопиридину (0,063 г, 0,52 ммоль), суспендированных в безводном CH2Cl2 (250 мл) при 0°С в атмосфере аргона посредством шприца добавляли хлорангидрид хлоруксусной кислоты (2,27 мл, 28,55 ммоль). После нагревания с обратным холодильником в течение 72 часов чистый продукт отфильтровывали и промывали водой. Маточный раствор последовательно промывали фосфорной кислотой (0,5 М), насыщенным бикарбонатом натрия, водой, рассолом, а затем сушили над MgSO4. Этот раствор наносили на диоксид кремния и очищали флэш-хроматографией на диоксиде кремния, используя смесь гексана и этилацетата (4:6), с получением дополнительного продукта. Объединенные твердые вещества сушили в вакууме с получением чистого 6-нитро-4Н-бензо[1,4]оксазин-3-она (2) (4,12 г) с 82%-ным выходом. К суспензии (2) (1,49 г, 7,65 ммоль) в безводном ТГФ (40 мл) в двухгорлой круглодонной колбе, снабженной обратным холодильником, в атмосфере аргона добавляли комплекс боран-диметилсульфид (15,3 мл, 30,62 ммоль). Смесь нагревали с обратным холодильником до тех пор, пока по результатам тонкослойной хроматографии исходное вещество больше не обнаруживалось (2 ч). Реакционную смесь охлаждали до кт и осторожно гасили, добавляя по каплям метанол. Затем полученную смесь нагревали с обратным холодильником в течение дополнительных 10 минут. Неочищенную реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией на диоксиде кремния, используя смесь гексана и этилацетата (8:2), с получением чистого 6-нитро-3,4-дигидро-2Н-бензо[1,4]оксазина (3) (1,36 г) в виде оранжевого твердого вещества с 99%-ным выходом. К (3) (0,032 г, 0,178 ммоль) и формалину (37%-ный в Н2О, 0,20 мл, 2,67 ммоль) в безводном ацетонитриле (1,5 мл) при температуре окружающей среды добавляли цианоборогидрид натрия (0,034 г, 0,534 ммоль). Перед тем как добавить ледяную уксусную кислоту (0,032 мл, 0,534 ммоль), этот раствор перемешивали в течение 30 минут. Полученную смесь перемешивали в течение дополнительных 16 часов. Органические вещества переносили в диэтиловый эфир и последовательно промывали NaOH (2 н.) и рассолом, сушили над MgSO4 и концентрировали в вакууме. Полученные твердые вещества очищали флэш-хроматографией на диоксиде кремния, используя смесь гексана и этилацетата (7:3), с получением чистого 4-метил-6-нитро-3,4-дигидро-2Н-бензо[1,4]оксазина (4) (0,031 г) с 93%-ным выходом. К (4) (2,16 г, 11,12 ммоль) и 10% палладию на углероде (0,216 г, 10 мас.%) в атмосфере аргона добавляли метанол (МеОН) (30 мл), а затем ТГФ (30 мл). Через полученную суспензию барботировали водород, пока по результатам тонкослойной хроматографии (2 ч) (4) оставался видимым. Добавляли целит, и смесь фильтровали через слой целита, а затем промывали МеОН. Полученный раствор концентрировали в вакууме с получением чистого 4-метил-3,4-дигидро-2Н-бензо[1,4]оксазин-6-иламина (5) (1,86 г) в виде бледно-лилового масла со 100%-ным выходом, которое далее использовали без дополнительной очистки. К (5) (1,86 г, 11,34 ммоль) и имидазолин-2-сульфоновой кислоте (1,84 г, 12,24 ммоль) в безводном ацетонитриле (50 мл) в атмосфере аргона при 0°С добавляли триэтиламин (3,26 мл, 23,36 ммоль). Этот раствор постепенно нагревали до температуры окружающей среды и перемешивали в течение дополнительных 16 часов. Добавляли дополнительное количество имидазолин-2-сульфоновой кислоты (0,86 г, 5,55 ммоль), и полученную смесь перемешивали в течение еще 5 часов. Этот раствор концентрировали в вакууме, и остаток переносили в Н2О. Органические вещества экстрагировали CH2Cl2 и промывали два раза NaOH, затем рассолом, сушили над MgSO4 и концентрировали в вакууме. Полученную смесь очищали флэш-хроматографией на диоксиде кремния, используя 20% метанол (насыщенный аммиаком) в хлороформе, с получением чистого имидазолидин-2-илиден-(4-метил-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)амина (6) (Д-1) (0,905 г) с 34%-ным выходом.
1Н ЯМР (CDCl3): 2.81 (s, 3H); 3.26 (t, J=8.9 Гц, 2H); 3.60 (s, 4H); 4.26 (m, 2H); 4.60 (vbrs, 2H); 6.34 (dd, J=8.2 Гц, J=2.4 Гц, 1H); 6.39 (d, J=2.4 Гц, 1H); 6.68 (d, J=8.2 Гц, 1H).
Пример Е и Ж
Методика получения 6-(имидазолидин-2-илиденамино)-5-метил-4Н-бензо[1,4]оксазин-3-она (Е) и имидазолидин-2-илиден-(5-метил-3,4-дигидро-2Н-бензо[1,4]оксазин-8-ил)амина (Ж):
К 2-амино-3-метилфенолу (1) (14,72 г, 0,120 моль), триэтиламину (35,0 мл, 0,251 моль) и 4-диметиламинопиридину (0,29 г, 2,39 ммоль) в безводном CH2Cl2 (100 мл) при 0°С в атмосфере аргона посредством шприца по каплям добавляли хлорангидрид хлоруксусной кислоты (10,0 мл, 0,126 моль). После окончания добавления полученный раствор нагревали с обратным холодильником в течение 24 часов. Органические вещества последовательно промывали фосфорной кислотой (0,5 М), насыщенным бикарбонатом натрия, водой и рассолом и затем сушили над MgSO4. Полученный раствор концентрировали и переносили в ТГФ, в который добавляли эфир. Полученные кристаллы отфильтровывали с получением чистого 5-метил-4Н-бензо[1,4]оксазин-3-она (2) (12,30 г) с 63%-ным выходом. К (2) (14,64 г, 89,72 ммоль), растворенному в концентрированной H2SO4 (65 мл), при -10°С добавляли 70% концентрированную HNO3 (8,08 г, 89,72 ммоль) в концентрированной H2SO4 (25 мл) при быстром механическом перемешивании со скоростью, благодаря которой внутренняя температура поддерживалась ниже -5°С. По окончании добавления смесь выливали на измельченный лед (500 мл) и полученные твердые вещества отфильтровывали и суспендировали в холодной воде (300 мл), одновременно добавляя NaOH в количестве, достаточном для установления рН 7. Полученный желтый порошок растворяли в ТГФ, наносили на диоксид кремния и очищали флэш-хроматографией, используя смесь 60% гексана и этилацетат, с получением нитропродукта в виде смеси двух региоизомеров, т.е. целевого 6-замещенного ароматического вещества, представляющего собой 6-нитро-5-метил-4Н-бензо[1,4]оксазин-3-он (3) (55%), и 8-замещенного побочного продукта, представляющего собой 8-нитро-5-метил-4Н-бензо[1,4]оксазин-3-он (4) (22%). В данный момент эти изомеры трудно разделить, и их направляли на следующую стадию в виде смеси. К смеси (3) (1,93 г, 9,27 ммоль) и (4) (0,48 г, 2,32 ммоль), растворенной в растворе МеОН (300 мл) и ТГФ (300 мл) в атмосфере аргона добавляли 10% палладий на угле (1,20 г). Полученный раствор подвергали воздействию Н2 при давлении, равном 1 атмосфере. Через 16 часов катализатор отфильтровывали, и полученный раствор концентрировали в вакууме и очищали флэш-хроматографией на диоксиде кремния, используя смесь 50% гексана и этилацетат, с получением 6-амино-5-метил-4Н-бензо[1,4]оксазин-3-она (5) (0,96 г) с 46%-ным выходом и 8-амино-5-метил-4Н-бензо[1,4]оксазин-3-она (6) (0,17 г) с 8%-ным выходом. (5) (1,20 г, 6,74 ммоль), имидазолин-2-сульфоновую кислоту (2,02 г, 13,48 ммоль) и триэтиламин (2,35 мл, 16,85 ммоль) нагревали с обратным холодильником в безводном ацетонитриле (50 мл) в атмосфере аргона в течение 48 часов. Добавляли дополнительное количество имидазолин-2-сульфоновой кислоты (1,01 г, 6,74 ммоль) и триэтиламина (1,41 мл, 10,12 ммоль), и полученную смесь перемешивали в течение дополнительных 24 часов. Этот раствор концентрировали в вакууме, и остаток переносили в раствор CHCl3 /изопропиловый спирт (3:1) и последовательно промывали NaOH (1н.) и рассолом, сушили над MgSO4 и концентрировали в вакууме. Полученную пену очищали флэш-хроматографией на диоксиде кремния, используя 20% метанол (насыщенный аммиаком) в хлороформе, с получением 6-(имидазолидин-2-илиденамино)-5-метил-4Н-бензо[1,4]оксазин-3-она (7) (0,42 г) в виде пены с 27%-ным выходом наряду с 55% возвратного исходного вещества. HCl соль перекристаллизовывали из смеси этанола и диэтилового эфира (EtOH/Et2O) с получением тонких белых игл.
1Н ЯМР (ДМСО): 2.10 (s, 3H); 3.59 (s, 4H); 4.53 (s, 2H); 6.83 (d, J=8.6 Гц, 1H); 6.90 (d, J=8.6 Гц, 1H); 8.07 (brs, 2H); 10.15 (vbrs, 1H); 10.42 (s, 1H).
(6) (0,222 г, 1,35 ммоль), имидазолин-2-сульфоновую кислоту (0,223 г, 1,49 ммоль) и триэтиламин (0,415 мл, 2,98 ммоль) нагревали при 95°С в безводном ацетонитриле (10 мл) в запаянной ампуле в течение 2 часов. Добавляли дополнительное количество имидазолин-2-сульфоновой кислоты (0,112 г, 0,75 ммоль) и реакцию продолжали в течение еще 16 часов. Этот раствор концентрировали в вакууме, и остаток переносили в раствор CHCl3/изопропиловый спирт (3:1) и последовательно промывали NaOH (2 н.) и рассолом, сушили (MgSO4) и концентрировали в вакууме. Полученное масло перекристаллизовывали из CHCl3 с получением чистого 6-(имидазолидин-2-илиденамино)-5-метил-4Н-бензо[1,4]оксазин-3-она (8) (Е) (0,048 г) в виде белого порошка с 15%-ным выходом вместе с 35% возвратного исходного вещества. К суспензии (8) (0,08 г, 0,321 ммоль) в безводном ТГФ (50 мл) в трехгорлой круглодонной колбе, снабженной обратным холодильником, в атмосфере аргона добавляли комплекс боран-диметилсульфид (0,48 мл, 0, 936 ммоль). Смесь нагревали с обратным холодильником до тех пор, исходное вещество пока по результатам тонкослойной хроматографии больше не обнаруживалось (3 ч). Реакционную смесь охлаждали до комнатной температуры и осторожно гасили, добавляя по каплям метанол. Неочищенную реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией на диоксиде кремния, используя 20% метанол (насыщенный аммиаком) в хлороформе с получением имидазолидин-2-илиден-(5-метил-3,4-дигидро-2Н-бензо[1,4]оксазин-8-ил)амина (9) (Ж) (0,03 г) в виде HCl соли с 37%-ным выходом.
1Н ЯМР (CDCl3): 2.07 (s, 3H); 3.46 (t, J=4.3 Гц, 2H); 3.55 (s, 4H); 4.24 (t, J=4.3 Гц, 2H); 5.60-5.95 (vbrs, 2H); 6.44 (d, J=8.0 Гц, 1H); 6.57 (d, J=8.0 Гц, 1H).
Пример З
Методика получения 4(5)-фенилсульфанил-1Н-имидазола:

1-(N,N-диметилсульфамоил)имидазол (1,5 г, 8,6 ммоль) переносили в 28 мл ТГФ. Раствор охлаждали до -78°С и посредством шприца по каплям добавляли н-BuLi (5,4 мл, 8,6 ммоль). После перемешивания при -78°С в течение 1 часа добавляли ТБСХ (1,3 г, 8,56 ммоль) в 10 мл ТГФ. Баню удаляли, и реакционную смесь оставляли нагреваться до кт. Реакционную смесь перемешивали в течение ночи. Реакционную смесь охлаждали до -20°С и добавляли н-BuLi (5,4 мл, 8,6 ммоль). Через 45 минут добавляли фенилдисульфид (1,9 г, 8,6 ммоль) в 8 мл ТГФ. Реакционную смесь перемешивали при кт в течение 48 часов. Реакционную смесь гасили насыщенным хлоридом аммония и экстрагировали этилацетатом. Органический слой собирали и промывали водой, а затем рассолом. Раствор сушили над сульфатом натрия, и при пониженном давлении удаляли растворитель. Флэш-хроматография (2,5% EtOAc/гексан) привела к получению 2,8 г (7,0 ммоль) диметиламида 2-(трет-бутилдиметилсилил)-5-фенилсульфанилимидазол-1-сульфоновой кислоты (1) в виде масла желтого цвета. Соединение (1) (2,8 г, 7,0 ммоль) растворяли в ТГФ, и этот раствор охлаждали до 0°С. К раствору по каплям добавляли ТБАФ (7,0 мл, 7,0 ммоль). Реакционную смесь перемешивали в течение ночи при кт. На следующий день реакцию гасили водой и экстрагировали этилацетатом. Органический слой промывали водой, а затем рассолом. Раствор сушили над сульфатом натрия, и при пониженном давлении удаляли растворитель. Флэш-хроматография (50% EtOAc/гексан) привела к получению 474 мг диметиламида 5-фенилсульфанилимидазол-1-сульфоновой кислоты (2) и 290 мг 5-фенилсульфанил-1Н-имидазола (3) (З). 478 г (2) добавляли к 2 н. HCl, и этот раствор нагревали с обратным холодильником в течение 2 часов. Реакционную смесь делали основной с использованием 2 н. NaOH и экстрагировали этилацетатом. Органический слой промывали водой, а затем рассолом. Раствор сушили над сульфатом натрия и при пониженном давлении удаляли растворитель. Флэш-хроматография (EtOAc) привела к получению (3) в виде белого кристаллического твердого вещества. В сумме выделили 360 мг (2,0 ммоль) (3).
1Н ЯМР (300 МГц, CD3OD) 7.91 (s, 1H), 7.37 (s, 1H), 7.19-7.23 (m, 2H), 7.07-7.11 (m, 3H).
Пример И
Методика получения метансульфоната 4(5)-(1,2,3, 4-тетрагидронафталин-2-илметил)-4,5-дигидро-1Н-имидазола:

Методика
ммоль в безводном ТГФ (250 мл) при 20°С в атмосфере аргона посредством шприца добавляли 3,26 мл (32,90 ммоль) комплекса боран-диметилсульфид (BH3-Me2S). После перемешивания в течение 16 часов добавляли МеОН (4 мл), и смесь нагревали до 55°С до прекращения выделения газа. Смесь концентрировали до масла, переносили в Et2O и последовательно промывали 2 М фосфорной кислотой, насыщенным бикарбонатом натрия, водой и рассолом, а затем сушили над MgSO4 и снова концентрировали. Полученное масло очищали Kugelrohr перегонкой при высоком вакууме и 150°С с получением чистого спирта (1,2,3,4-тетрагидронафталин-2-ил)метанола) (2) (4,09 г) с 93%-ным выходом. К трифенилфосфину (10,179 г, 38,809 ммоль) и имидазолу (2,64 г, 38, 809 ммоль) в безводном бензоле (175 мл) при быстром перемешивании добавляли йод (8,60 г, 33,865 ммоль) в бензоле (75 мл), а затем (2) в бензоле (50 мл). Через 3 часа твердые вещества отфильтровывали, количество фильтрата уменьшали под вакуумом до объема 50 мл, к которому добавляли гексан (200 мл). Полученные твердые вещества отфильтровывали, фильтрат последовательно промывали водой и рассолом, сушили над MgSO4 и концентрировали в вакууме. Полученное масло очищали флэш-хроматографией на диоксиде кремния, используя гексан, с получением чистого 2-йодметил-1,2,3,4-тетрагидронафталина (3) (6,239 г) с 90%-ным выходом. К (3) (10,02 г, 36,85 ммоль) и Cul (1,41 г, 7,37 ммоль) в безводном ТГФ (50 мл) при -78°С в атмосфере аргона медленно добавляли винилмагнийбромид (1 М раствор в ТГФ, 73,70 мл, 73,70 ммоль) со скоростью, при которой не происходило появления окраски. Этот раствор оставляли нагреваться до 0°С и перемешивали в течение 6 часов. Полученную смесь повторно охлаждали до -40°С и гасили, осторожно добавляя 2 М фосфорной кислоты (35 мл). Этот раствор разбавляли 100 мл воды и экстрагировали гексанами. Органические фракции последовательно промывали водой и рассолом, сушили над MgSO4 и концентрировали в вакууме. Полученное масло очищали флэш-хроматографией на диоксиде кремния, используя гексан, с получением 2-аллил-1,2,3, 4-тетрагидронафталина (4) (5,618 г) с 88%-ным выходом. (4) (5,615 г, 32,645 ммоль) и мета-хлорнадбензойную кислоту (м-ХНБК) (14,08 г, 81,613 ммоль) перемешивали в безводном метиленхлориде (50 мл) в течение 16 часов. Твердые вещества отфильтровывали и добавляли фторид калия KF (5,11 г, 88,142 ммоль), и эту смесь перемешивали в течение еще одного часа. Твердые вещества отфильтровывали, и реакционную смесь концентрировали в вакууме. Полученное масло очищали флэш-хроматографией на диоксиде кремния, используя смесь 5% этилацетата и гексан, с получением 2-(1,2,3, 4-тетрагидронафталин-2-илметил)оксирана (5) (5,41 г) с 88%-ным выходом. К (5) (1,626 г, 8,649 ммоль) в растворе ацетона (20 мл) и воды (5 мл) добавляли азид натрия (1,97 г, 30,271 ммоль). Этот раствор нагрели до 850С и перемешивали в течение 48 часов. Раствор концентрировали в вакууме, и остаток переносили в CHCl3 и последовательно промывали водой и рассолом, сушили над MgSO4 и концентрировали в вакууме. Полученное масло очищали флэш-хроматографией на диоксиде кремния, используя смесь 30% этилацетата и гексан, с получением чистого 1-азидо-3-(1,2,3, 4-тетрагидронафталин-2-ил)пропан-2-ола (6) (1,762 г) с 88%-ным выходом. Смесь (6) (1,88 г, 8,140 ммоль), трифенилфосфина (2,67 г, 10,173 ммоль), фталимида (1,50 г, 10,173 ммоль), диэтилазодикарбоксилата (ДЭАДК) (1,77 г, 10,173 ммоль) перемешивали в безводном ТГФ (50 мл) в течение 4 часов. Этот раствор концентрировали в вакууме, переносили в раствор гексана (25 мл) и эфира (25 мл) и перемешивали в течение 16 часов. Твердые вещества отфильтровывали и фильтрат концентрировали в вакууме. Полученное масло очищали флэш-хроматографией на диоксиде кремния, используя смесь 20% этилацетата и гексан, с получением 2-[1-азидометил-2-(1,2,3,4-тетрагидронафталин-2-ил)этил]изоиндол-1,3-диона (7) (2,487 г), загрязненного небольшим количеством примеси, который использовали без дополнительной очистки. Смесь (7) (3,93 г, 10,917 ммоль) и гидразина (0,680 мл, 21,833 ммоль) нагревали с обратным холодильником в этаноле (60 мл) в течение 16 часов. Твердые вещества отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на диоксиде кремния, используя 5% МеОН в CH2Cl2, с получением 1-азидометил-2-(1,2,3, 4-тетрагидронафталин-2-ил)этиламина (8) (2,057 г) с 88%-ным выходом. Смесь (8) (2,056 г, 8,940 ммоль) и 10% палладия на угле (0,260 г) перемешивали в МеОН (30 мл) в атмосфере водорода при давлении 1 атмосфера в течение 16 часов. Твердые вещества отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на диоксиде кремния, используя 10% МеОН, насыщенный аммиаком, в CH2Cl2, с получением 3-(1,2,3,4-тетрагидронафталин-2-ил)пропан-1,2-диона (9) (1,557 г) с 85%-ным выходом. Смесь (9) (0,590 г, 2,892 ммоль) и метансульфоновой кислоты (0,980 мл, 14,460 ммоль) нагревали в триэтилортоформиате (10 мл) при 1050С в течение 3 часов. Реакционную смесь концентрировали в вакууме, и твердые вещества отфильтровывали. Последующая перекристаллизация этих твердых веществ из смеси МеОН и эфира дала чистый метансульфонат 4(5)-(1,2,3,4-тетрагидронафталин-2-илметил)-4,5-дигидро-1Н-имидазола (И) (0,435 г) с 48%-ным выходом.
1Н ЯМР (CDCl3): 1.37-1.56 (m, 1H); 1.56-1.70 (m, 1H); 1.80-2.02 (m, 2H); 2.32-2.55 (m, 2H); 2.72 (s, 3H); 2.75-2.95 (m, 3H); 3.48-3.59 (m, 1H); 3.93-4.08 (m, 1H); 4.31-4.47 (m, 1H); 7.00-7.20 (m, 4H); 8.46 (s, 1H); 10.04 (s, 1H); 10.35 (brs, 1H).
Пример К-1
Методика получения 4(5)-циклогексилметил-1Н-имидазола:

Методика
2-Трет-бутилдиметилсилил-1-диметилсульфамоилимидазол (1) (4,1 г, 14,2 ммоль) переносят в 47 мл безводного ТГФ и охлаждают до -20°С. К раствору (1) по каплям добавляют н-BuLi (8,9 мл, 14,2 ммоль). Полученный раствор перемешивают при -20°С в течение 45 минут. Затем к реакционной смеси по каплям добавляют циклогексилметилйодид (2) (3,14 г, 14 ммоль). Затем реакционную смесь нагревают до кт и перемешивают в течение ночи. На следующий день реакцию гасят насыщенным хлоридом аммония и разбавляют водой. Смесь экстрагируют этилацетатом (3×100 мл). Органические слои объединяют и промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (4:1 этилацетат/гексан) приводит к получению 2,26 г (5,6 ммоль) 5-циклогексилметил-2-трет-бутилдиметилсилил-1-диметилсульфамоилимидазола (3). (3) (2,26 г, 5,6 ммоль) переносят в 56 мл ТГФ и охлаждают до 0°С. К раствору (3) по каплям добавляют 1 М раствор ТБАФ в ТГФ (5,6 мл, 5,6 ммоль). Реакционную смесь нагревают до кт и перемешивают в течение ночи. На следующий день реакционную смесь гасят водой, а затем экстрагируют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (1:1 этилацетат/гексан) приводит к получению 1,2 г (4,42 ммоль) 5-циклогексилметил-1-диметилсульфамоилимидазола (4). (4) (1,2 г, 4,42 ммоль) переносят в 25 мл 1,5 н. раствора HCl и нагревают с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и разбавляют этилацетатом. 2 н. NaOH доводят рН смеси до 13, а затем экстрагируют хлороформом (4×100 мл). Органические слои объединяют и промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (9:1 хлороформ/метанол) приводит к получению 700 мг (4,27 ммоль) 4(5)-циклогексилметил-1Н-имидазола (5) (К-1).
1Н ЯМР (CDCl3): 0.92-1.00 (m, 2H); 1.16-1.26 (m, 3H); 1.57-1.73 (m, 6H); 2.48 (d, J=6.9 Гц, 2H); 6.77 (s, 1H); 7.56 (s, 1H).
Пример К-2
В способе Примера К-1 осуществляют замену на (S)-2-йодметил-1,2,3,4-тетрагидронафталин с получением (S)-4(5)-(1,2,3, 4-тетрагидронафталин-2-илметил)-1Н-имидазола. (S)-2-йодметил-1,2,3,4-тетрагидронафталин получили из (S)-1,2,3,4-тетрагидро-2-нафтойной кислоты. (S)-1,2,3,4-тетрагидро-2-нафтойную кислоту получили в результате разделения 1,2,3,4-тетрагидро-2-нафтойной кислоты (J. Med. Chem. 1983, 26, 328-334).
Пример К-3
В способе Примера К-1 осуществляют замену на (R)-2-йодметил-1, 2,3,4-тетрагидронафталин с получением (R)-4(5)-(1,2,3,4-тетрагидронафталин-2-илметил)-1Н-имидазола. (R)-2-йодметил-1,2,3,4-тетрагидронафталин получили из (R)-1,2,3,4-тетрагидро-2-нафтойной кислоты. (R)-1,2,3,4-тетрагидро-2-нафтойную кислоту получили в результате разделения 1,2,3,4-тетрагидро-2-нафтойной кислоты (J. Med. Chem. 1983, 26, 328-334).
Пример Л-1
Методика получения 4(5)-(4,5,6,7-тетрагидробензо[b]тиофен-2-илметил)-1Н-имидазола:

4,5,6,7-тетрагидробензо[b]тиофен (1) (2,1 г, 15 ммоль) переносят в 75 мл безводного ТГФ и охлаждают до -78°С. К раствору (1) по каплям добавляют н-BuLi (6,0 мл, 15 ммоль). Полученный раствор перемешивают при -78°С в течение 60 минут. К реакционной смеси добавляют 1-диметилсульфамоил-2-трет-бутилдиметилсилил-5-имидазолкарбоксальдегид (2) (4,8 г, 15 ммоль) в 25 мл ТГФ. Реакционную смесь нагревают до кт и перемешивают в течение 2 часов, а затем гасят водой и разбавляют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (1:3 этилацетат/гексан) приводит к получению 5,2 г (11 ммоль) диметиламида 2-(трет-бутилдиметилсилил)-5-[гидрокси-(4,5,6,7-тетрагидробензо[b]тиофен-2-ил)метил]имидазол-1-сульфоновой кислоты (3). (3) (5,2 г, 11,3 ммоль) переносят в 57 мл ТГФ. К раствору (3) по каплям добавляют 1 М раствор фторида тетра-н-бутиламмония (ТБАФ) в ТГФ (11,3 мл, 11,3 ммоль). Прежде чем гасить реакцию водой, а затем экстрагировать этилацетатом, реакционную смесь перемешивают в течение 1 часа 15 минут. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Перекристаллизация из гексана/этилацетата приводит к получению диметиламида 5-[гидрокси-(4,5,6,7-тетрагидробензо[b]тиофен-2-ил)метил]имидазол-1-сульфоновой кислоты (4) (2,1 г, 6,2 ммоль). Кроме того, получают дополнительные 2 г неочищенного продукта. (4) (2,0 г, 5,9 ммоль) переносят в 78 мл дихлорметана, к раствору добавляют 7,5 мл (46,9 ммоль) триэтилсилана и 14,4 мл (0,19 моль) трифторуксусной кислоты. Реакционную смесь перемешивают при кт в течение ночи, а затем гасят водой и нейтрализуют 2 н. NaOH. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием смеси этилацетата и гексана (1:1) приводит к получению 0,75 г (2,3 ммоль) диметиламида 5-(4,5,6, 7-тетрагидробензо[b]тиофен-2-илметил)имидазол-1-сульфоновой кислоты (5). (5) (0,42 г, 1,55 ммоль) переносят в 15 мл 1,5 н. раствора HCl и нагревают с обратным холодильником в течение 2 часов, а затем перемешивают при кт в течение ночи. Реакционную смесь разбавляют этилацетатом, нейтрализуют 2 н. NaOH. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Неочищенный продукт растворяют в метаноле и добавляют избыток HCl в эфире. Растворитель удаляют при пониженном давлении с получением 0,6 г (2,3 ммоль) 4(5)-(4,5,6,7-тетрагидробензо[b]тиофен-2-илметил)-1Н-имидазола (6) (Л-1).
1Н ЯМР (CD3OD): 8.80 (s, 1H); 7.34 (s, 1H); 6.57 (s, 1H); 4.18 (s, 2H); 2.65-2.69 (m, 2H); 2.51-2.55 (m, 2H); 1.74-1.83 (m, 4H).
Пример Л-2
В способе Примера Л-1 осуществляют замену на 2-(трет-бутил)фуран с получением 4(5)-(5-трет-бутилфуран-2-илметил)-1Н-имидазола.
Пример Л-3
В способе Примера Л-1 осуществляют замену на 5,6-дигидро-4Н-тиено[2,3-b]тиопиран с получением 4(5)-(5, 6-дигидро-4Н-тиено[2,3-b]тиопиран-2-илметил)-1Н-имидазола.
Пример М
Методика получения 4(5)-(1-фуран-2-илэтил)-1Н-имидазола:
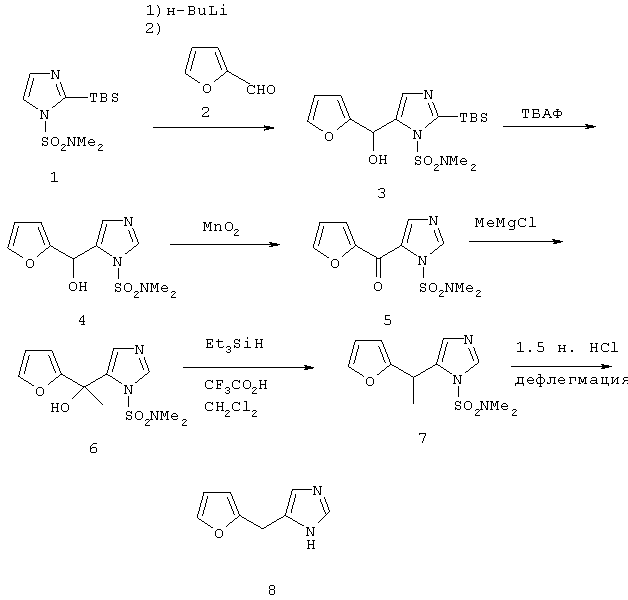
2-(Трет-бутилдиметилсилил)-1-(диметилсульфамоил)имидазол (1) (3,3 г, 11,4 ммоль) переносят в 38 мл безводного ТГФ и охлаждают до -78°С. К раствору (1) по каплям добавляют н-BuLi (7,2 мл, 11,4 ммоль). Полученный раствор перемешивают при -78°С в течение 30 минут. К реакционной смеси добавляют 2-фурфурол (2) (0,94 мл, 11,4 ммоль). Реакционную смесь нагревают до кт и перемешивают в течение ночи. На следующий день реакцию гасят насыщенным хлоридом аммония, и реакционную смесь разбавляют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (4:1 этилацетат/гексан) приводит к получению 4,4 г (11,4 ммоль) диметиламида 2-(трет-бутилдиметилсилил)-5-(фуран-2-илгидроксиметил)имидазол-1-сульфоновой кислоты (3). (3) (4,4 г, 11,4 ммоль) переносят в 110 мл ТГФ и охлаждают до 0°С. К раствору (3) по каплям добавляют 1 М раствор фторида тетра-н-бутиламмония (ТБАФ) в ТГФ (11,4 мл, 11,4 ммоль). Реакционную смесь перемешивают в течение ночи при кт. На следующий день реакцию гасят водой, и реакционную смесь затем экстрагируют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Получают 3,9 г неочищенного диметиламида 5-(фуран-2-илгидроксиметил)имидазол-1-сульфоновой кислоты (4). (4) (1,0 г, 3,7 ммоль) переносят в 37 мл дихлорметана, к раствору добавляют 1,6 г (18,5 ммоль) диоксида марганца. Реакционную смесь перемешивают при кт в течение ночи, а затем фильтруют через целит. Элюент собирают, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием смеси этилацетата и гексана (1:1) приводит к получению 0,69 г (2,6 ммоль) диметиламида 5-(фуран-2-илкарбонил)имидазол-1-сульфоновой кислоты (5). (5) (0,69 г, 2,6 ммоль) переносят в 26 мл ТГФ. Раствор охлаждают до -78°С. Добавляют 1,7 мл (5,1 ммоль) 3 М раствора метилмагнийхлорида. После перемешивания при -78°С в течение 1,5 часов реакционную смесь нагревают до кт и перемешивают в течение дополнительного 1 часа. Реакцию гасят водой, и реакционную смесь затем экстрагируют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Кристаллизация из смеси эфира и гексана приводит к получению 0,39 г (1,4 ммоль) диметиламида 5-(1-фуран-2-ил-1-гидроксиэтил)имидазол-1-сульфоновой кислоты (6). Получают дополнительные 0,19 г (6). (6) (0,58 г, 2,0 ммоль) переносят в 27 мл дихлорметана, к раствору добавляют 2,6 мл (16,3 ммоль) триэтилсилана и 5,5 мл (71,4 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивают при кт в течение ночи, а затем гасят водой и нейтрализуют твердым бикарбонатом натрия. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием смеси этилацетата и гексана (2:1) приводит к получению 0,53 г (2,0 ммоль) диметиламида 5-(1-фуран-2-илэтил)имидазол-1-сульфоновой кислоты (7). (7) (0,34 г, 1,3 ммоль) переносят в 10 мл 1,5 н. раствора HCl и нагревают с обратным холодильником в течение 30 минут, а затем перемешивают при кт в течение ночи. Реакционную смесь разбавляют этилацетатом, а затем делают основной с использованием 2 н. NaOH. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (10:1 хлороформ/метанол) приводит к получению 0,1 г (0,62 ммоль) 4(5)-(1-фуран-2-илэтил)-1Н-имидазола (8) (М).
1Н ЯМР (300 МГц, CDCl3) 7.56 (m, 1H), 7.33-7.34 (m, 1H), 6.81 (m, 1H), 6.29-6.31 (m, 1H), 6.06-6.07 (m, 1H), 4.22 (q, J=7.2 Гц, 1H), 1.63 (d, J=7.2 Гц, 3H).
Пример Н
Методика получения 4(5)-(2,3-дигидробензо[1,4]диоксин-6-илметил)-4-метил-1Н-имидазола:

Методика
4-Метил-1-(диметилсульфамоил)имидазол (1) (2,0 г, 10,6 ммоль) переносят в 42 мл безводного ТГФ и охлаждают до -78°С. К раствору (1) по каплям добавляют н-BuLi (6,6 мл, 10,6 ммоль). Полученный раствор перемешивают при -78°С в течение 30 минут. К реакционной смеси добавляют трет-бутилдиметилсилилхлорид (NBDMSCL) (1,6 г, 10,6 ммоль) в 10 мл ТГФ. Реакционную смесь нагревают до кт и перемешивают в течение ночи. На следующий день реакционную смесь охлаждают до -20°С и добавляют 7,3 мл (11,6 ммоль) н-BuLi. После перемешивания при -20°С в течение 30 минут к реакционной смеси добавляют 1,4-бензодиоксан-6-карбоксальдегид (2) (1,92 г, 11,7 ммоль) в 10 мл ТГФ. Затем реакционную смесь нагревают до кт и перемешивают в течение 3 часов. Реакцию гасят водой, и реакционную смесь разбавляют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография (1:2 этилацетат/гексан) приводит к получению 3,9 г (8,4 ммоль) диметиламида 2-(трет-бутилдиметилсилил)-5-[(2,3-дигидробензо[1,4]диоксин-6-ил)гидроксиметил]-4-метилимидазол-1-сульфоновой кислоты (3). (3) (1,0 г, 2,14 ммоль) переносят в 21 мл ТГФ. К раствору (3) по каплям добавляют 1 М раствор тетра-н-бутиламмония фторида (ТБАФ) в ТГФ (2,35 мл, 2,35 ммоль). Реакционную смесь перемешивают в течение 30 минут при кт. Реакцию гасят водой, и реакционную смесь затем экстрагируют этилацетатом. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием этилацетата в качестве элюента приводит к получению 0,75 г (2,12 ммоль) диметиламида 5-[(2,3-дигидробензо[1,4]диоксин-6-ил)гидроксиметил]-4-метилимидазол-1-сульфоновой кислоты (4). (4) (0,75 г, 2,12 ммоль) переносят в 28 мл дихлорметана, к раствору добавляют 2,7 мл (17,0 ммоль) триэтилсилана и 5,2 мл (67,8 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивают при кт в течение ночи, а затем гасят водой и нейтрализуют твердым бикарбонатом натрия. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Флэш-хроматография с использованием смеси этилацетата и гексана (3:1) приводит к получению 0,63 г (1,87 ммоль) диметиламида 5-(2,3-дигидробензо[1, 4]диоксин-6-илметил)-4-метилимидазол-1-сульфоновой кислоты (5). (5) (0,63 г, 1,87 ммоль) переносят в 10 мл 1,5 н. раствора HCl и нагревают с обратным холодильником в течение. Реакционную смесь разбавляют этилацетатом, нейтрализуют твердым бикарбонатом натрия. Органический слой промывают водой, а затем рассолом. Органическую фазу сушат над сульфатом натрия, и при пониженном давлении удаляют растворитель. Кристаллизация из смеси эфира и гексана приводит к получению 0,33 г (1,43 ммоль) 4(5)-(2,3-дигидробензо[1,4]диоксин-6-илметил)-4-метил-1Н-имидазола (6) (Н).
1Н ЯМР (300 МГц, ацетон-d6) 7.37 (s, 1H), 6.66-6.67 (m, 3H), 4.18 (s, 4H), 3.73 (s, 1H), 2.13 (s, 3H).
Пример О
Методика получения 2-(3Н-имидазол-4(5)-илметил)-3,4,5,6,7,8-гексагидро-2Н-нафталин-1-она (О-1), 4(5)-2,3,4,4а,5,6,7,8-октагидронафталин-2-илметил)-1Н-имидазола (О-2) и 4(5)-(1,2,3,4,5,6,7, 8-октагидронафталин-2-илметил)-1Н-имидазола (О-3):

1-Декалон (10,0 г, 66 ммоль) и 4(5)-имидазолкарбоксальдегид (6,3 г, 66 ммоль) добавляли к 100 мл этанола. К раствору добавляли NaOH (5,2 г, 130 ммоль) в 20 мл воды. Реакционную смесь нагревали с обратным холодильником в течение 5 дней. Реакционную смесь охлаждали до кт и делали основной водным раствором HCl. Раствор экстрагировали ТГФ/этилацетатом. Органические слои объединяли и промывали рассолом. Органическую фазу сушили над сульфатом магния, и при пониженном давлении удаляли растворитель с получением неочищенного продукта. Этот неочищенный продукт нагревали с обратным холодильником в 40%-ной H2 SO4 в течение 1 дня. Реакционную смесь охлаждали до кт и делали основной насыщенным K2CO3. Раствор экстрагировали ТГФ/этилацетатом. Органические слои объединяли и промывали рассолом. Органическую фазу сушили над сульфатом магния, и при пониженном давлении удаляли растворитель. Очистка флэш-хроматографией (15:1 CH3Cl/MeOH) привела к получению О-1 (4,9 г, выход 32%).
1Н ЯМР: 7.55 (s, 1H), 6.77 (s, 1H), 3.08-3.14 (m, 2H), 1.52-2.46 (m, 13H).
Гидрохлорид О-1 обрабатывали NaOH с получением свободного основания (3,0 г, 11 ммоль), которое затем добавляли к диэтиленгликолю (100 мл). К раствору добавляли гидразингидрат (3,2 мл, 100 ммоль), и реакционную смесь оставляли перемешиваться в течение ночи при кт. Добавляли NaOH (3,1 г, 77 моль), и раствор нагревали с обратным холодильником в течение 5 дней. Реакционную смесь охлаждали до кт и разбавляли водой. Раствор экстрагировали ТГФ/этилацетатом. Органические слои объединяли и промывали рассолом. Органическую фазу сушили над сульфатом магния, и при пониженном давлении удаляли растворитель. Очистка флэш-хроматографией (8:1 CH3 Cl/MeOH) привела к получению О-2 (0,64 г, выход 27%).
1Н ЯМР: 7.58 (s, 1H), 6.76 (s, 1H), 5.24 (d, J=4.3 Гц, 1H), 0.91-2.58 (m, 16H).
О-2 (1,0 г, 4,6 ммоль) добавляли к 10 мл концентрированной HCl. Раствор перемешивали при кт в течение 30 минут, а затем нейтрализовали K2CO3. Раствор экстрагировали ТГФ/этилацетатом. Органические слои объединяли и промывали рассолом. Органическую фазу сушили над сульфатом магния, и при пониженном давлении удаляли растворитель. Очистка флэш-хроматографией (15:1 CH3 Cl/MeOH) привела к получению О-3.
1Н ЯМР: 7.54 (s, 1H), 6.74 (s, 1H), 2.45-2.52 (m, 3H), 1.46-1.97 (m, 14H).
Пример П
Методика получения гидрохлорида 4(5)-октагидропентален-2-илметил)-1Н-имидазола:

А. В колбу, высушенную на огне и охлажденную до 0°С в атмосфере аргона, добавляли эфир (10 мл) (White and Whitesell synthesis, Synthesis pp. 602-3 (1975)). Затем добавляли н-бутиллитий (35 мл 2,5 М раствора в гексане, 2,2 экв.), а потом медленно добавляли диизопропиламин (14 мл, 2,5 экв.), и эту смесь оставляли перемешиваться в течение 30 минут при 0°С. К этому полученному раствору диизопропиламида лития добавляли оксид циклооктена (5,0 г, 1,0 экв.). Смесь перемешивали при кт в течение одного дня, а затем нагревали до температуры образования флегмы в атмосфере аргона в течение 2 дней. Реакцию гасили, добавляя NH4Cl. Раствор экстрагировали ТГФ/EtOAc. Органические экстракты объединяли, промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме с получением желто-коричневого масла, которое представляло собой 1-гидроксиоктагидропентален. Соединение использовали на следующей стадии без дополнительной очистки.
Б. Полученный таким образом спирт (5,0 г, 1 экв.) растворяли в дихлорметане (200 мл), к этому раствору добавляли хлорхромиат пиридиния (13 г, 1,5 экв.), и эту смесь перемешивали при кт в течение одного дня. Затем раствор фильтровали через короткую колонку из SiO2, используя диэтиловый эфир в качестве элюента. Полученный раствор концентрировали в вакууме с получением масла бледного зеленовато-желтого цвета, которое использовали на следующей стадии без дополнительной очистки.
В. Октагидро-пентален-1-он (5,0 г, 1,0 экв.) с вышеприведенной стадии добавляли к 4(5)-имидазолкарбоксальдегиду (3,8 г, 1,0 экв.) и 40%-ной H2SO4 (20 мл), и смесь выдерживали при 90°С в течение 3 дней. Затем реакцию гасили, добавляя гидроксид аммония, и реакционную смесь экстрагировали смесью тетрагидрофурана и этилацетата. Органические экстракты объединяли, промывали рассолом, сушили над сульфатом магния. Полученный водный слой нейтрализовали HCl/NH4Cl. Водный слой повторно экстрагировали так, как описано выше, и объединенные органические фракции концентрировали в вакууме с получением оранжевого твердого вещества.
Г. Это оранжевое твердое вещество растворяли в этаноле, к которому добавляли палладий на угле (0,5 г). Реакционную колбу помещали в атмосферу водорода под давлением 40 фунт/кв.дюйм (275,8 кПа) на один день. Реакционный раствор фильтровали через целит с использованием дополнительного количества этанола в качестве элюента. Раствор концентрировали в вакууме с получением желто-коричневого масла. Очистка колоночной хроматографией с использованием смеси хлороформа и метанола (17:1) привела к получению кетона, содержащего некоторое количество примесей.
Д. Кетонную функциональную группу затем удаляли, добавляя продукт упомянутой выше стадии (8,2 г, 1,0 экв.) к диэтиленгликолю (80 мл) и гидразингидрату (13,0 г, 1,0 экв.). Эту смесь перемешивали в течение ночи, затем добавляли гидроксид калия (11,0 г, 5,0 экв.), и раствор перемешивали с обратным холодильником в течение одного дня. Реакционный раствор охлаждали до кт и промывали водой. Раствор экстрагировали ТГФ/EtOAc и объединенные фракции промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме с получением желтого масла. При растворении этого масла в безводном этаноле, насыщенном HCl, и нагревании получили моногидрохлорид.
Пример Р
Методика получения 7-(3Н-имидазол-4(5)-илметил)-6,7-дигидро-5Н-изохинолин-8-она (Р-1) и 7-(3Н-имидазол-4(5)-илметил)-5, 6,7,8-тетрагидроизохинолина (Р-2):
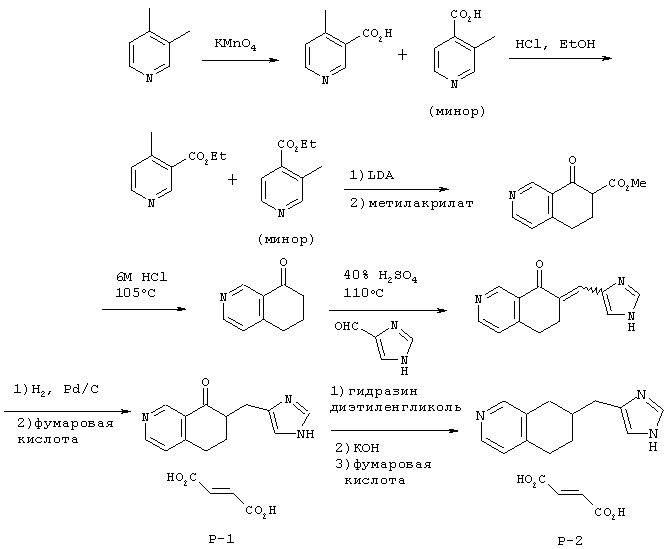
А. 3,4-лутидин (21,4 г, 1 экв.) растворяли в 200 мл воды при 20°С и в течение 5 дней порциями по 6,32 г два раза в день добавляли перманганат калия (всего 63,2 г, 2 экв.). Через 5 дней раствор помещали на хранение в морозильную камеру, затем размораживали и фильтровали через целит. Полученный бесцветный раствор концентрировали при 90°С на ротационном испарителе до тех пор, пока не получили белое твердое вещество. Это твердое вещество перекристаллизовывали из 5 н. HCl с получением 9,56 г белых кристаллов. Анализ ЯМР показал смесь двух региоизомеров, причем требуемый изомер являлся основным продуктом.
Б. Эти кристаллы нагревали с обратным холодильником в безводном этаноле, насыщенном газообразным HCl, в атмосфере аргона в течение 6 часов. Затем на ротационном испарителе из раствора удаляли этанол, остаток переносили в 100 мл воды, и твердым бикарбонатом натрия устанавливали рН между 7 и 8. Водную фазу экстрагировали диэтиловым эфиром (3х), и объединенные органические фракции промывали рассолом, сушили над сульфатом магния, а затем фильтровали и концентрировали с получением бесцветного масла (3,56 г, выход 10,8%).
В. Для образования диизопропиламида лития in situ диизопропиламин (2,84 г, 1,3 экв.) посредством шприца добавляли к н-BuLi (11,21 мл, 1,3 экв.) в 100 мл безводного ТГФ в атмосфере аргона при -78°С. К этому раствору посредством шприца добавляли вышеупомянутый продукт Б (3,56 г, 1 экв.) в 20 мл тетрагидрофурана, и смесь перемешивали при -78°С в течение 20 минут. В это же время через канюлю по каплям добавляли метилакрилат (4,85 мл, 2,5 экв.) в 20 мл тетрагидрофурана. Раствор перемешивали в течение еще 2 часов и гасили, добавляя 40 мл 10%-ного ацетата калия. Раствор оставляли нагреваться до 20°С, а затем концентрировали на ротационном испарителе. Водный остаток три раза экстрагировали хлороформом. Объединенные фракции промывали рассолом и сушили над сульфатом магния, фильтровали и концентрировали до черного твердого вещества, которое хранили под высоким вакуумом. Хроматография на силикагеле с использованием смеси гексан/этилацетат (7/3→6/4) привела к получению 2,41 г (58, 2%) целевого продукта, который использовали на следующей стадии без дополнительной очистки.
Г. Вещество со стадии В (0,48 г, 1 экв.) растворяли в 1 мл 6 М раствора HCl и нагревали при 105°С в течение 16 часов, а потом раствор концентрировали на ротационном испарителе при 80°С до твердого состояния. Остаток переносили в 2 мл воды и нейтрализовали твердым бикарбонатом натрия. Нейтрализованный раствор экстрагировали хлороформом (3х) и объединенные фракции промывали рассолом, сушили над сульфатом магния и концентрировали до бесцветного масла (0,456 г, 93,4%).
Д. Изохинолин (1,91 г, 1 экв.), полученный на упомянутой выше стадии Г, нагревали с 4(5)-имидазолкарбоксальдегидом (1,25 г, 1 экв.) при 110°С в 15 мл 40%-ной серной кислоты в течение 30 часов. Реакционную смесь хранили несколько дней при 0°С в атмосфере аргона. Затем раствор разбавляли 20 мл воды и подщелачивали NH4OH до рН 8,9. Твердые вещества собирали фильтрованием и сушили под сильным вакуумом. Продукт представлял собой желтое твердое вещество (2,81 г, 96,1%), содержащее смесь обоих изомеров положения при экзодвойной связи.
Е. Упомянутый выше продукт Д растворяли в 150 мл метанола, и к этому раствору добавляли Pd/C (0,412 г, 0,15 экв. мас.). Затем метанольный раствор насыщали H2путем повторения операций вакуумирования и насыщения Н2. Раствор перемешивали при давлении Н2, равном 1 атм, в течение 20 часов до тех пор, пока ТСХ не показала отсутствие ненасыщенного исходного вещества. Раствор фильтровали через целит и концентрировали до масла. В результате хроматографии на диоксиде кремния с использованием дихлорметана и метанола (9/1) получили чистый продукт (1,853 г, 65, 04%) в виде белой пены. Пену переносили в метанол, в который добавляли фумаровую кислоту (0,4817 г, 1,5 экв.) при нагревании для растворения твердых веществ. Раствор медленно охлаждали с получением не совсем белых кристаллов (0,826 г, 74%), которые представляют собой соединение Р-1. Р-2 получили восстановлением с использованием гидразина способом, описанным в стадии Д примера П, упомянутого выше.
Пример С
Методика получения (Z)-6-(3Н-имидазол-4(5)-илметилен)-7,8-дигидро-6Н-хинолин-5-она (С-1), (Е)-6-(3Н-имидазол-4(5)-илметилен)-7,8-дигидро-6Н-хинолин-5-она (С-2), 6-(3Н-имидазол-4(5)-илметил)-7,8-дигидро-6Н-хинолин-5-она (С-3), дигидрохлорида 6-(3Н-имидазол-4(5)-илметил)-5,6,7,8-тетрагидрохинолина (С-4) и 6-(3Н-имидазол-4(5)-илметил)-5,6,7, 8-октагидрохинолин-5-она (С-5).

Методика:
А. Реакционноспособный азидо-реагент с первой стадии образовывался in situ при добавлении монохлорида йода (67,6 г, 1,15 экв.) в 50 мл ацетонитрила по каплям через капельную воронку к перемешанной суспензии азида натрия (58,84 г, 2,5 экв.) в 350 мл безводного ацетонитрила при -10°С в атмосфере аргона. Добавление заканчивали через 30 минут, смесь перемешивали в течение еще 30 минут, и посредством шприца добавляли циклогексенон (34,81 г, 1,0 экв.), а затем перемешивали при 20°С в течение еще 20 часов. Затем смесь вливали в один литр воды и экстрагировали тремя порциями диэтилового эфира по 200 мл. Объединенные фракции промывали 5%-ным раствором тиосульфата натрия, а затем рассолом. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме при 20°С. Остаток переносили в 1 л ДМСО при 0°С и добавляли вторую порцию NaN3, и смесь перемешивали до тех пор, пока она не нагреется до температуры окружающей среды. Затем эту смесь разбавляли 2,5 л ледяной воды и десять раз экстрагировали дихлорметаном (10×250 мл). Объединенные органические фракции концентрировали на ротационном испарителе до объема ~1 л, и этот концентрат три раза экстрагировали 250 мл воды, а затем рассолом, потом сушили над сульфатом магния и концентрировали до темного масла (39,5 г) и хранили при -40°С. Масло очищали хроматографией на диоксиде кремния, используя смесь гексан:этилацетат (от 9/1 до 8/2). Выделили два изомера, первый с азидогруппой в α положении к кето-функциональной группе в количестве 13,22 г (выход 26,6%). β-изомер получили в количестве 15,825 г с 32,0%-ным выходом.
Б. Трифенилфосфин растворяли в 20 мл дихлорметана и помещали в атмосферу аргона при 20°С. К перемешанному раствору через канюлю добавляли β-изомер, полученный как описано выше, и выдерживали при 200С в течение 2 часов. По мере протекания реакции из раствора высвобождался азот, и через 2 часа ТСХ показала отсутствие исходного материала. Раствор концентрировали и пропускали через колонку с силикагелем, используя смесь дихлорметана и метанола (от чистого дихлорметана до 95/5) в качестве элюента. Амидофосфонатное промежуточное соединение получили в количестве 2,139 г с 65,1%-ным выходом.
В. Амидофосфонат растворяли в 100 мл безводного о-ксилола, а затем при перемешивании добавляли 10% Pd/C. Затем к смеси посредством шприца добавляли свежеперегнанный акролеин и нагревали до температуры образования флегмы в течение 4 часов, потом добавляли остальной акролеин, и нагревание с обратным холодильником продолжали в течение 44 часов в атмосфере аргона. В этот момент ТСХ показала, что осталось некоторое количество промежуточного соединения, поэтому добавляли еще 0,5 г Pd/C, и смесь снова нагревали до температуры образования флегмы в течение еще 8 часов. Смесь охлаждали до кт, фильтровали и концентрировали на ротационном испарителе для удаления избытка акролеина до тех пор, пока не осталось приблизительно 100 мл о-ксилольного раствора. Этот раствор охлаждали, добавляя лед, и три раза экстрагировали 1 н. HCl. Объединенные водные фракции экстрагировали 3х Et2O. Затем водную фазу охлаждали до 0°С и концентрированным раствором NaOH устанавливали рН ~10. Водную фазу затем 5 раз экстрагировали порциями хлороформа по 100 мл. Объединенные фракции хлороформа промывали водой, а затем рассолом и сушили над сульфатом магния, фильтровали и, наконец, концентрировали с получением 3,51 г масла с 84,4%-ным выходом 7, 8-дигидро-6Н-хинолин-5-она.
Г. 4(5)-имидазолкарбоксальдегид конденсировали с хинолиноном, как описано в Стадии Д Примера Р и получили как С-1, так и С-2.
Д. Затем экзодвойную связь восстанавливали палладием на угле, как описано в Стадии Е Примера Р выше, до двух продуктов, которые разделяли хроматографией с получением С-3 и

Е. Кетогруппу удаляли по методике восстановления гидразином, как описано в Стадии Д Примера П выше, с получением С-4.
Ж. Продукт С-5, представляющий собой полностью восстановленное хинолиновое кольцо, получили стандартным восстановлением
Пример Т-1
Методика получения (Е)-6-(3Н-имидазол-4(5)-илметилен)-7,8-дигидро-6Н-хиноксалин-5-она

Методика:
А. Смесь 5,6,7,8-тетрагидрохиноксалина (23,75 г, 1 экв.), бензальдегида (19,81 мл, 1,1 экв.) и уксусного ангидрида (33,4 мл, 2, 0 экв.) перемешивали при 150°С в атмосфере аргона в течение 15 часов, после чего ТСХ показала наличие главным образом целевого продукта с некоторым остаточным количеством исходных веществ. Исходные вещества удаляли вакуумной перегонкой с использованием колонки Вигре при 170°С. Затем кубовый остаток подвергали Kugelrohr перегонке при температуре 170-220°С. Первая фракция была слегка загрязнена исходными веществами (4,71 г). Вторая фракция была чистой (18,93 г). После применения высокого вакуума первая фракция кристаллизуется. После объединения фракций получили 20,11 г, 51%.
Б. Продукт со Стадии А выше, растворяли в 100 мл метанола и слегка нагревали, затем охлаждали до -35 ÷ -40°С, и через раствор барботировали озон. После того как через несколько минут исходное вещество начинало кристаллизоваться из раствора, раствор нагревали и добавляли еще 200 мл метанола, после чего реакция возобновлялась. Через приблизительно 30 минут раствор стал бледно-голубым. Затем в течение 30 минут через раствор барботировали азот, потом в раствор впрыскивали метилсульфид (3,5 мл), после чего раствор перемешивали в течение еще 30 минут при -35°С, затем оставляли нагреваться до температуры окружающей среды при перемешивании. После приблизительно 48 часов при 20°С смесь перегоняли с водяным паром для удаления растворителей с получением остатка 8,4 г желто-коричневого масла. Этот остаток переносили в диэтиловый эфир и 3 раза экстрагировали порциями 1 н. HCl по 25 мл. Объединенные водные фракции промывали диэтиловым эфиром трижды. Водный раствор постепенно подщелачивали до рН 8 концентрированным NaOH. Затем из водной фазы хлороформом (3х) экстрагировали свободный амин. Объединенные хлороформные экстракты два раза промывали рассолом, сушили MgSO4 и концентрировали до желтого масла (3,01 г). После выдержки в высоком вакууме в течение 1 часа, осталось 2,97 г. Этот остаток перекристаллизовывали из диэтилового эфира с получением 2,35 г ярко-желтого твердого вещества. Выход 67,5%.
В. 7,8-Дигидрохиноксалин-5-он и 4(5)-имидазолкарбоксальдегид (Aldrich Chemicals) суспендировали в 75 мл безводного тетрагидрофурана при 20°С в атмосфере аргона с последующим добавлением пиперидина, а затем уксусной кислоты. Смесь перемешивали в течение 16 часов при 20°С. Через 20 часов ТСХ показала, что не осталось никаких следов хиноксалона. Твердые вещества собирали фильтрованием и промывали небольшим количеством тетрагидрофурана, а затем хлороформом. Твердое вещество сушили при сильном вакууме с получением 6,85 г Т-1. Выход 90,3%.
Пример Т-2 и Т-3
Подобно тому, как получали Т-1, 5,6,7,8-тетрагидроизохинолин (5,42 г, 1 экв., Aldrich) перемешивали с бензальдегидом (5,182 г, 1,2 экв.) и уксусным ангидридом (6,309 г, 2,0 экв.), затем смесь подвергали вакуумной перегонке и использовали на следующей стадии без дополнительной очистки. Выход (неочищенного): 8,28 г.
Неочищенный продукт (7,96 г) с приведенной выше стадии подвергали озонолизу, как описано в Стадии Б выше. После обработки и хроматографии получили 5,18 г бледного масла. Выход: 97,8%, предполагающий чистое исходное вещество.
Полученный 7,8-дигидро-6Н-изохинолин-5-он (1,692 г, 1 экв.) конденсировали с 4(5)-имидазолкарбоксальдегидом, как описано в Стадии В выше, с получением 2,23 г ненасыщенного соединения, аналогичного Т-1 на схеме, приведенной выше, с 92,8%-ным выходом. Этот продукт для восстановления экзодвойной связи обрабатывали палладием на угле, как описано в Стадии Е Примера Р, с получением 6-(3Н-имидазол-4(5)-илметил)-7,8-дигидро-6Н-изохинолин-5-она (Т-2) с 52%-ным выходом.
Кетон, упомянутый выше, восстанавливали с использованием гидразина и превращали в фумарат, как подробно описано в Примере Р, Стадия Е. Выход после восстановления: 62%. Выход фумарата после перекристаллизации: 30,4% 6-(3Н-имидазол-4(5)-илметил)-5,6,7,8-тетрагидроизохинолина (Т-3).
Пример У
Методика получения соли 4(5)-(4а-метил-2,3,4,4а,5,6,7, 8-октагидронафталин-2-илметил)-1Н-имидазола бут-2-ендиовой кислоты:

Бромид метилтрифенилфосфония (2,75 г, 7,70 ммоль) суспенидровали в 50 мл диэтилового эфира. При -10°С добавляли н-BuLi (3,08 мл, 7,70 ммоль, 2,5 М раствор в смеси гексанов). Перед охлаждением до -70°С эту смесь перемешивали в течение 35 минут. Посредством шприца добавляли раствор (R)-(+)-4,4а,5,6,7,8-гексагидро-4а-метил-2(3Н)-нафталинона (1) (1,0 г, 6,09 ммоль) в 15 мл эфира. Эту смесь нагревали до 0°С за 30 минут и перемешивали при кт в течение еще 30 минут. Раствор промывали рассолом (2×20 мл), сушили над MgSO4, фильтровали и удаляли растворитель.
Хроматография на SiO2 с использованием гексанов дала 0,82 г (83%) диена 2 в виде прозрачного бесцветного масла.
Эта методика гидроборирования придерживается известной методики (Brown, H. C. et. al., J. Am. Chem. Soc. 1969, 91, 2144). К раствору диена 2 (750 мг, 4,63 ммоль) в 20 мл ТГФ при 0°С добавляли 9-BBN (11,8 мл, 5,9 ммоль 0,5 М раствора в ТГФ). Через 30 минут смесь нагревали до кт и оставляли реагировать при кт в течение 1 часа. Для получения LiAlH(OMe)3 к перемешанному раствору LiAlH4 (5,04 мл, 5,04 ммоль, 1,0 М в эфире) добавляли сухой МеОН (3,75 мл, 15,0 ммоль, 4,0 М раствор в ТГФ). К этому алкоксиалюмогидриду посредством шприца добавляли боран. Через 10 минут при кт через раствор в течение 20 минут барботировали оксид углерода. Добавляли фосфатный буфер (25 мл, рН 7,0), а затем H2O2 (10 мл, 30%-ный раствор) и перемешивали в течение 30 минут. После типичного процесса экстракции масло очищали хроматографией на SiO2 смесью от 5 до 10% EtOAc:Hx с получением бесцветного альдегида 3 в качестве основного продукта (455 мг, 51%).
Эта процедура получения соответствует известному протоколу (Horn, D.A.; Yakushijin, K.;

Далее имидазол очищали перемешиванием в ТГФ или МеОН с эквимолярным количеством фумаровой кислоты при кт в течение 10 минут. Растворитель удаляли, и соль перекристаллизовывали, разбавляя в ТГФ и перетирая со смесью эфира и гексанов, с выделением 70-80% чистого фумарата (4) (У).
1Н ЯМР (500 МГц, ДМСО-d6, относительно (отн.) ТМС): δ 7.73 (s, 1H), 6.83 (s, 1H), 6.60 (s, 2H), 5.12 (s, 1H), 2.45-2.44 (m, 2H), 2.30 (brs, 1H), 2.12 (brs, 1H), 1.91-1.88 (m, 1H), 1.73-1.71 (m, 1H), 1.56-1.46 (m, 5H), 1.30-1.09 (ряд m, 4H), 1.01 (s, 3H).
13С (125 МГц, ДМСО-d6, отн. ТМС): δ 167.0, 143.5, 134.8, 134.5, 128.7, 123.7, 118.2, 42.3, 36.7, 35.0, 32.8, 32.5 (2C), 28.4, 25.9, 24.4, 22.3.
Пример Ф-1
Методика получения соли 4(5)-(3-метил-циклогекс-2-енилметил)-1Н-имидазола бут-2-ендикислоты:
Раствор 3-метил-2-циклогексен-1-она (1) (5 г, 45,4 ммоль) в 25 мл эфира по каплям через капельную воронку добавляли к раствору LiAlH4 (45 мл, 1 М раствор в ТГФ) в эфире (100 мл) при -10°С. Через 1 час смесь осторожно гасили NH4Cl (10 мл) и обрабатывали 10%-ной HCl (7 мл). Органический слой экстрагировали эфиром (3×70 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали хроматографией, элюируя 20% EtOAc:Hx с получением 2 в виде прозрачного бесцветного спирта, 4,46 г (88%).
Раствор спирта 2 (1,68 г, 15 ммоль) в этилвиниловом эфире (38 мл) обрабатывали Hg(OAc)2 (3,2 г, 10 ммоль) и NaOAc (410 мг, 5 ммоль) при 35°С в течение 4 часов. Смесь вливали в 5%-ный раствор КОН (15 мл), разбавляли эфиром и экстрагировали гексанами. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Неочищенный остаток использовали на следующей стадии без дополнительной очистки.
В соответствии с известной методикой (Greico, P.A.; et al., J. Am. Chem. Soc. 1991, 113, 5488) 3 М раствор LiClO4 (16 г, 150 ммоль) в 50 мл эфира обрабатывали неочищенным виниловым эфиром 3 при кт в течение 30 минут. Всю смесь вливали в раствор бикарбоната натрия (150 мл). После экстракции альдегида 4 эфиром органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали хроматографией на SiO2 с EtOAc:Hx или согласно протоколу

1Н ЯМР (500 МГц, d6-ДМСО, отн. ТМС): δ 7.71 (s, 1H), 6.82 (s, 1H), 6.61 (s, 2H), 5.27 (s, 1H), 2.46-2.32 (ряд, 3H), 1.85 (brs, 2H), 1.60 (s, 3H); 1.35-0.86 (ряд m, 4H).
13С (125 МГц, ДМСО-d6, отн. ТМС): δ 167.3, 134.9, 134.5, 125.5, 118.1, 35.5, 32.6, 30.1, 28.5, 24.0, 21.4.
Пример Ф-2
Бут-2-ендиоат 4(5)-(3,5,5-триметил-циклогекс-2-енилметил)-1Н-имидазола получают, осуществляя в способе Ф-1 замену на изофорон.
Пример Ф-3
Бут-2-ендиоат 4(5)-(3-метил-циклопент-2-енилметил)-1Н-имидазола получают, осуществляя в способе Ф-1 замену на 3-метил-2-циклопентен-1-он.
Пример Х-1
Методика получения бут-2-ендиоата 4(5)-циклогекс-2-енилметил-1Н-имидазола:

Раствор циклогексенона (1) (2,88 г, 30 ммоль) в гексанах при -78°С обрабатывали DIBAL (30 мл, 1,0 М раствор в циклогексане). Через 25 минут добавляли МеОН (7 мл), и смесь нагревали до кт. Добавляли насыщенный раствор сегнетовой соли, а затем разбавляли эфиром (100 мл). Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Продукт очищали хроматографией на SiO2 с использованием 20% EtOAc:Hx с получением прозрачного бесцветного спирта 2, 2,0 г (68%).
Раствор упомянутого выше спирта 2 (2,0 г, 20,4 ммоль) в 1,1,1-триэтоксиэтане (30 мл) и пропионовой кислоте (~0,025 мл, кат.) нагревали для удаления этанола. После удаления этанола нагревание продолжали при 145°С в течение 1 часа. 1,1, 1-триэтоксиэтан удаляли простой перегонкой. После охлаждения остатка до кт продукт очищали хроматографией на SiO2 с использованием смеси 5% эфира:Hx с получением сложного эфира 3 в виде прозрачного бесцветного масла. 1,08 г (~31%).
Раствор упомянутого выше сложного этилового эфира 3 (1,0 г, 5,9 ммоль) растворяли в гексанах (50 мл) и охлаждали до -78°С. По каплям добавляли раствор DIBAL (5,8 мл, 1,0 М раствор в циклогексане). Через 15 минут добавляли диэтиловый эфир (50 мл), и смесь перемешивали с раствором сегнетовой соли (25 мл) в течение 10 минут. Органический слой отделяли, сушили и фильтровали. Хроматография на SiO2 с использованием 7% Et2O:Hx привела к получению альдегида в виде прозрачного бесцветного масла, 0,52 г (74%). Альдегид 4 подвергали обработке по протоколу
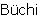
1Н ЯМР (500 МГц, ДМСО-d6, отн. ТМС): δ 7.67 (s, 1H), 6.80 (s, 1H), 6.60 (s, 2H), 5.66-5.54 (m, 2H), 2.52-2.42 (m, 2H), 2.34 (brs, 1H), 1.93 (s, 2H), 1.66 (brs, 2H), 1.46-1.43 (m, 1H), 1.22-1.16 (m, 1H).
13С (125 МГц, ДМСО-d6, отн. ТМС): δ 166.3, 134.3, 134.2, 131.2, 126.9, 118.1, 96.5, 35.0, 32.5, 28.4, 24.8, 20.7.
Пример Х-2
Бут-2-ендиоат 4(5)-(4-метил-циклогекс-2-енилметил)-1Н-имидазола получают, осуществляя в способе Х-1 замену на 6-метил-2-циклогексен-1-он.
Пример Ц
Методика получения бут-2-ендиоата 2-(1Н-имидазол-4(5)-илметил)-циклогексанона:

Методика
К 4(5)-имидазолкарбоксальдегиду (2,52 г, 26,23 ммоль), суспендированному в циклогексаноне (25,74 г, 262,25 ммоль), в атмосфере аргона добавляли пиперадин (0,56 г, 6,56 ммоль) и уксусную кислоту (0,52 г, 8,65 ммоль). После нагревания с обратным холодильником в течение 16 часов циклогексанон удаляли Кugelrohr перегонкой. Хроматография на SiO2 с использование смеси 5-10% МеОН (насыщенного NH3):CH2Cl2 дала 4,07 г (88%) ненасыщенного имидазола 1 в виде масла.
Ненасыщенный имидазол 1 (1,02 г, 5,81 ммоль) в МеОН (40 мл), содержащем палладий (10 мас.% на активированном угле) (0,15 г) гидрировали при давлении Н2, равном 1 атмосфере. Через 16 часов палладий отфильтровывали, и фильтрат концентрировали при пониженном давлении. Имидазол перекристаллизовывали путем перемешивания в МеОН с эквимолярным количеством фумаровой кислоты до исчезновения всех твердых веществ, последующего добавления небольшого количества диэтилового эфира и хранения в холодных условиях. Указанное в заголовке соединение 2 (Ц) 0,80 г (48%) получили в виде белых кристаллов.
1Н ЯМР (300 МГц, CDCl3, отн. ТМС): δ 9.5-6.5 (vbs, 3H), 7.71 (s, 1H), 6.80 (s, 1H), 6.60 (s, 2H), 2.91 (dd, J=14.8 Гц, J=5.4 Гц, 1H), 2.75-2.60 (m, 1H), 2.42-2.28 (m, 2H), 2.27-2.17 (m, 1H), 2.02-1.89 (m, 2H), 1.78-1.68 (m, 1H), 1.68-1.45 (m, 2H); 1.32-1.17 (m, 1H).
13С (75 МГц, ДМСО-d6, отн. ТМС): δ 211.6, 166.6, 134.4, 134.2, 133.8, 117.4, 49.7, 41.4, 33.1, 27.5, 25.8, 24.3.
Пример Ч-1
Методика получения бут-2-ендиоата 4(5)-(3,4-диметил-циклогекс-3-енилметил)-1Н-имидазола:

2,3-Диметил-1,3-бутадиен (10,16 г, 123,72 ммоль), этилакрилат (11,06 г, 110,47 ммоль) и гидрохинон (0,12 г, 1,11 ммоль) нагревали при перемешивании при 165°С в запаянной трубке в течение 16 часов, а затем при 205°С в течение дополнительных 4 часов. Kugelrohr перегонка полученного остатка при 150°С и 0,5 Торр дала 14,11 г (70%) сложного циклогексенового эфира 1 в виде масла в колбе при 20°С. К раствору сложного эфира 1 (13,62 г, 72,32 ммоль) в безводном ТГФ (200 мл) при -78°С в атмосфере аргона добавляли LiAlH4 (54,30 мл, 1 М раствор в диэтиловом эфире). Эту смесь перемешивали в течение 1 часа при 20°С, а затем гасили при 0°С осторожным последовательным добавлением Н2О (2,06 мл), NaOH (2,06 мл 15%-ного водного раствора) и дополнительной порции Н2О (6,18 мл). Твердые вещества отфильтровывали, и при пониженном давлении концентрировали фильтрат. Kugelrohr перегонка полученного остатка при 150-180°С и 0,5 Торр дала 9,98 г (98%) спирта 2 в виде бесцветного летучего масла в колбе при 0°С. К раствору трифенилфосфина (27,13 г, 103,45 ммоль) и имидазола (7,04 г, 103,45 ммоль) в безводном бензоле (450 мл) в атмосфере аргона за 10-минутный период при быстром механическом перемешивании добавляли I2 (22,75 г, 89,61 ммоль) в бензоле (170 мл). Через 10 дополнительных минут к быстро перемешиваемой смеси за 5-минутный период времени добавляли спирт 2 (9,23 г, 65,89 ммоль) в бензоле (100 мл). Через 2 часа реакционную смесь разбавляли смесью гексанов (800 мл), и твердые вещества отфильтровывали. Органические вещества промывали тремя порциями Н2О (800 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаточные твердые вещества отфильтровывали, и полученное масло очищали Кugelrohr перегонкой при 200°С и 0,5 Торр с получением 11,99 г (73%) йодида 3 в виде бледного масла в колбе при 0°С. К раствору описанного ранее 1-N-(диметилсульфамоил)-2-трет-бутилдиметилсилилимидазола (4,34 г, 15,00 ммоль) в безводном ТГФ (50 мл) при -78°С в атмосфере аргона добавляли н-бутиллитий (5,76 мл, 2, 5 М раствор в смеси гексанов). Эту смесь перемешивали в течение 10 минут при -10°С, а затем перед добавлением по каплям через канюлю йодида 3 (3,00 г, 12,00 ммоль) в ТГФ (25 мл), охлаждали до -20°С. Полученный раствор перемешивали в течение 16 часов при 20°С, затем гасили насыщенным водным NaHCO3 и концентрировали при пониженном давлении. Остаток переносили в диэтиловый эфир и последовательно промывали водой и рассолом, сушили (MgSO4) и концентрировали. Последующая очистка хроматографией на SiO2 с использованием смеси 5-10% EtOAc:гексаны дала 0,89 г (15%) имидазола 4 в виде бледного масла. К раствору имидазола 4 (0,89 г, 2,17 ммоль) в безводном ТГФ (25 мл) в атмосфере аргона добавляли фторид тетрабутиламмония (2,38 мл, 1 М раствор в ТГФ), и полученный раствор перемешивали в течение 1 часа при 20°С. Смесь концентрировали при пониженном давлении, и остаток переносили в диэтиловый эфир и последовательно промывали насыщенным водным NaHCO3 и рассолом, сушили (MgSO4) и концентрировали. Остаток очищали хроматографией на SiO2 с использованием смеси 50% EtOAc:гексаны с получением 0, 56 г (87%) имидазола 5 в виде бледного масла. К раствору 5 (0,53 г, 1,77 ммоль) в МеОН (5 мл) добавляли водный раствор КОН (15 мл 5 М раствора), и смесь нагревали с обратным холодильником в течение 32 часов. Смесь концентрировали при пониженном давлении, разбавляли Н2О (5 мл) и экстрагировали CHCl3. Объединенные органические фракции последовательно промывали Н2О и рассолом, сушили (MgSO4) и концентрировали при пониженном давлении. Имидазол перекристаллизовывали путем перемешивания в МеОН с эквимолярным количеством фумаровой кислоты до исчезновения всех твердых веществ и последующего добавления небольшого количества диэтилового эфира. Указанное в заголовке соединение 6 (Ч-1) 0,27 г (57%) получили в виде белых кристаллов.
1Н ЯМР (300 МГц, ДМСО-d6, отн. ТМС): δ 10.3-8.8 (vbs, 3H), 7.88 (s, 1H), 6.89 (s, 1H), 6.59 (s, 2H), 2.48 (d, J = 6.7 Гц, 2H), 2.00-1.70 (m, 4H), 1.70-1.57 (m, 2H), 1.56 (s, 3H), 1.54 (s, 3H), 1.21-1.04 (m, 1H).
13С ЯМР (75 МГц, ДМСО-d6, отн. ТМС): δ 166.7, 134.4, 134.1, 133.4, 124.8, 124.3, 117.9, 37.6, 34.1, 32.2, 31.1, 28.7, 19.0, 18.7.
Пример Ч-2
Бут-2-ендиоат 4(5)-циклогекс-3-енилметил-1Н-имидазола получают, осуществляя в способе Ч-1 замену на 3-циклогексен-1-метанол.
Пример Ш-1
Методика получения бут-2-ендиоата 4(5)-(4-метил-циклогекс-3-енилметил)-1Н-имидазола:

Методика
К суспензии NaH (60% в масле) (6,92 г, 288,28 ммоль) в безводном ТГФ (1500 мл) при 0°С в атмосфере аргона при энергичном механическом перемешивании по каплям добавляли триметилфосфоноацетат (52,50 г, 288,28 ммоль). Смесь перемешивали в течение дополнительных 30 минут, а затем добавляли по каплям 1, 4-циклогександионмоно-этиленкеталь (40,93 г, 262,07 ммоль) в ТГФ (170 мл). Смесь перемешивали в течение дополнительных 18 часов при 20°С, а затем концентрировали при пониженном давлении. Этот остаток переносили в диэтиловый эфир (1000 мл) и последовательно промывали Н2О и рассолом, сушили (MgSO4), фильтровали и концентрировали с получением 60,08 г (98%) ненасыщенного сложного эфира 1, который направляли на следующую стадию без дополнительной очистки. К раствору ненасыщенного сложного эфира 1 в EtOAc (500 мл) добавляли палладий (10 мас.% на активированном угле) (2, 13 г). Суспензию насыщали Н2, несколько раз выполняя операции вакуумирования и повторного насыщения Н2, а затем перемешивали в течение 16 часов при давлении Н2, равном 1 атмосфере. К реакционной смеси добавляли целит (5 г), палладий отфильтровывали, и фильтрат концентрировали при пониженном давлении с получением 59,45 г (98%) насыщенного эфира 2, который направляли на следующую стадию без дополнительной очистки. Ненасыщенный сложный эфир 2 в безводном ТГФ (400 мл) медленным потоком при энергичном механическом перемешивании при -78°С в атмосфере аргона добавляли к раствору LiAlH4 (200,00 мл, 1 М раствор в диэтиловом эфире). После нагревания до 20°С добавляли дополнительное количество ТГФ (600 мл), и реакционную смесь перемешивали в течение 1 часа. Смесь охлаждали до 0°С и гасили осторожным, последовательным добавлением Н2О (7,60 мл), NaOH (7,60 мл 15%-ного водного раствора) и дополнительной порции Н2 О (22,80 мл). Твердые вещества отфильтровывали, и фильтрат концентрировали при пониженном давлении. Последующая очистка хроматографией на SiO2 с использованием смеси 20-50% EtOAc:гексаны дала 50,93 г (98%) спирта 3 в виде бледного масла. К раствору хлорангидрида щавелевой кислоты (20,65 мл, 41,29 ммоль) в безводном CH2Cl2 (100 мл) при -78°С в атмосфере аргона по каплям добавляли раствор ДМСО (6,72 г, 86,02 ммоль) в CH2Cl2 (25 мл). После механического перемешивания в течение 15 минут по каплям добавляли раствор спирта 3 (6,40 г, 34,41 ммоль) в CH2Cl2 (80 мл) и, перед добавлением триэтиламина (27,85 г, 275,30 ммоль), смесь перемешивали в течение дополнительных 15 минут при -78°С. Реакционную смесь перемешивали в течение 2 часов при 20°С, а затем гасили насыщенным водным NaHCO3. Эту смесь экстрагировали CH2Cl2, и объединенные органические фракции последовательно промывали Н2О и рассолом, сушили (MgSO4) и концентрировали при пониженном давлении. Полученные твердые вещества очищали хроматографией на SiO2 с использованием смеси 20-30% EtOAc:гексаны с получением 5,08 г (79%) альдегида 4 в виде белого твердого вещества. Раствор альдегида 4 (5,08 г, 27,59 ммоль) в EtOH (40 мл) обрабатывали при 20°С в течение 3 часов тозилметилизоцианидом (ToSMIC) (5,15 г, 26,27 ммоль) и NaCN (0,13 г, 2,68 ммоль), а затем охлаждали. После 2 часов охлаждения твердые вещества отфильтровывали, растворяли в безводном МеОН, насыщенном NH3 (30 мл) и нагревали в запаянной трубке при 100°С в течение 3,5 часов. Затем реакционную смесь концентрировали при пониженном давлении, и остаток переносили в CHCl3, последовательно промывали насыщенным водным NaHCO3 и рассолом, сушили (MgSO4) и концентрировали до красного масла. Этот остаток далее очищали хроматографией на SiO2 с использованием смеси 5-10% МеОН (насыщенный NH3):CH2Cl2 с получением 1,87 г (31%) имидазола 5 в виде масла розового цвета. Раствор 5 (0,55 г, 2,48 ммоль) в ацетоне (2 мл), содержащем HCl (5 н., 0,5 мл), перемешивали в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении, остаток переносили в Н2О, нейтрализовали до рН 7 насыщенным водным NaHCO3 и исчерпывающе экстрагировали смесью CHCl3 и изопропилового спирта (3:1). Объединенные органические части последовательно промывали Н2 О и рассолом, сушили (MgSO4) и концентрировали. Хроматография на SiO2 с использованием смеси 5-10% МеОН (насыщенного NH3):CHCl3 дала 0,43 г (97%) целевого кетона 6. Раствор 6 (0,20 г, 1,11 ммоль) в безводном ДМФ (4 мл) в атмосфере аргона обрабатывали триэтиламином (0,14 г, 1,33 ммоль) и диметилсульфамоилхлоридом (0,19 г, 1,33 ммоль) и перемешивали в течение 16 часов. Твердые вещества отфильтровывали, и фильтрат концентрировали Kugelrohr перегонкой при 100°С и 0,5 Торр. Остаток переносили в CHCl3 и последовательно промывали Н2О и рассолом, сушили (MgSO4) и концентрировали. Хроматография на SiO2 с использованием смеси 1-5% МеОН:CH2Cl2 дала 0,22 г (69%) целевого защищенного имидазола 7 в виде смеси региоизомеров, которую направляли на следующую стадию без разделения. Раствор 7 (0,18 г, 0,62 ммоль) в безводном ТГФ (10 мл) в атмосфере аргона обрабатывали метилмагнийхлоридом (0,32 мл, 3,0 М раствор в ТГФ), и полученную смесь перемешивали в течение 16 часов. Реакционную смесь гасили небольшим количеством МеОН, концентрировали при пониженном давлении, и остаток переносили в Н2О. Смесь подкисляли, добавляя по каплям 1 н. HCl до тех пор, пока раствор не становился гомогенным, а затем насыщенным водным NaHCO3 доводили рН до 7. Органические вещества экстрагировали в CHCl3, и объединенные органические порции последовательно промывали Н2О и рассолом, сушили (MgSO4) и концентрировали. Хроматография на SiO2 с использованием смеси 5% МеОН:CH2Cl2 дала 0,18 г (95%) спирта 8 в виде смеси региоизомеров, которую направляли на следующую стадию без разделения. Раствор 8 (0,14 г, 0,46 ммоль) в безводном бензоле (3 мл) при 0°С в атмосфере аргона обрабатывали гидроксидом (метоксикарбонилсульфамоил)триэтиламмония, внутренней солью (Вurgess реагентом) (0,12 г, 0,51 ммоль) и перемешивали в течение 1 часа при 20°С. Реакционную смесь концентрировали при пониженном давлении, и последующая очистка хроматографией на SiO2 с использованием 5% МеОН:CH2Cl2 дала 0,12 г (92%) алкенов 9 и 10 в виде смеси изомеров, которую направляли на следующую стадию без разделения. Смесь изомеров 9 и 10 (0,12 г, 0,42 ммоль) нагревали с обратным холодильником в растворе, состоящем из МеОН (2 мл) и KOH (2 мл 5 н. раствора) в течение 30 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток переносили в Н2О и исчерпывающе экстрагировали CHCl3. Объединенные органические части последовательно промывали Н2О и рассолом, сушили (MgSO4) и концентрировали. Хроматография на SiO2 с использованием смеси 5-10% МеОН (насыщенным NH3):CH2Cl2 дала 0,05 г (67%) алкенов 11 и 12 в виде смеси изомеров, которую направляли на следующую стадию без разделения.
Смесь алкенов 11 и 12 (0,045 г, 0,26 ммоль) и гидрата п-толуолсульфоновой кислоты (0,063 г, 0,32 ммоль) нагревали с обратным холодильником в 1,2-дихлорэтане (2 мл) в атмосфере аргона в течение 20 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали хроматографией на SiO2 с использованием смеси 10% МеОН (насыщенный NH3):CH2Cl2 с получением свободного основания имидазола 13 (Ш-1) в виде одного изомера. Имидазол перекристаллизовывали путем перемешивания в МеОН или ТГФ с эквимолярным количеством фумаровой кислоты до исчезновения всех твердых веществ, последующего добавления небольшого количества диэтилового эфира и хранения в холодных условиях. Указанное в заголовке соединение 13 (Ш-1) 0,040 г (54%) получили в виде белых кристаллов.
1Н ЯМР (300 МГц, ДМСО, отн. ТМС): δ 7.65 (s, 1H), 6.78 (s, 1H), 6.60 (s, 2H), 5.31 (s, 1H), 2.44 (d, J=6.7 Гц, 2H), 2.02-1.82 (m, 3H), 1.82-1.60 (m, 3H), 1.59 (s, 3H), 1.26-1.11 (m, 1H).
13С ЯМР (75 МГц, ДМСО-d6, отн. ТМС): δ 175.0, 165.2, 134.3, 134.1, 133.2, 120.3, 118.3, 33.2, 32.4, 31.2, 29.3, 28.3, 23.4.
Пример Ш-2
Бут-2-ендиоат 4(5)-(4-этил-циклогекс-3-енилметил)-1Н-имидазола получают, осуществляя в способе Ш-1 замену на этилмагнийхлорид.
Пример Ш-3
Бут-2-ендиоат 4(5)-(4-пентил-циклогекс-3-енилметил)-1Н-имидазола получают, осуществляя в способе Ш-1 замену на пентилмагнийхлорид.
Пример Щ
Способ измерения селективности α
-агониста включает в себя анализ RSAT (технология выбора и амплификации рецептора), описанный в Messier et al., 1995, “High throughput assays of cloned adrenergic, muscarinic, neurokinin and
neurotrophin receptors in living mammalian cells”, Pharmacol. Toxicol. 76:308-11 и адаптированный для применения с использованием альфа2 рецепторов. В этом анализе измеряют рецептор
- опосредованную потерю контактного ингибирования, которая приводит к селективной пролиферации клеток, содержащих рецептор, в смешанной популяции конфлюэнтных клеток. Увеличение числа клеток оценивают
с использованием соответствующего трансфецированного маркерного гена, такого как b-галактозидаза, активность которого можно легко измерить в 96-луночном планшете. Рецепторы, которые активируют G белок,
Gq, вызывают этот ответ. Рецепторы альфа2, которые обычно связаны с Gi, активируют RSAT ответ, если совместно экспрессируются с гибридным Gq белком,
имеющим домен распознавания рецептора Gi, называемый Gq/
Клетки NIH-3T3 наносят при плотности 2× 106 клеток на 15 см планшеты и выдерживают в модифицированной по Дульбекко среде Игла, дополненной 10% сыворотки теленка. Через 1 день клетки подвергают совместной трансфекции посредством преципитации фосфата кальция экспрессирующимися в млекопитающих плазмидами, кодирующими p-SV-b-галактозидазу (5-10 мг), рецептор (1-2 мг) и G белок (1-2 мг). В трансфекционную смесь можно также включить 40 мг ДНК спермы лосося. На следующий день добавляют свежую среду, и через 1-2 дня клетки собирают и замораживают в аликвотах на 50 анализов. Клетки размораживают, и по 100 мл добавляют к аликвотам по 100 мл лекарственных средств в различных концентрациях в трех повторах в 96-луночных планшетах. Инкубирование продолжают при 37°С в течение 72-96 часов. После промывки физиологическим раствором, забуференным фосфатом, b-галактозидазную ферментативную активность определяют путем добавления 200 мл хромогенного субстрата (состоящего из 3,5 мМ о-нитрофенил-b-D-галактозидазы и 0,5% нонидета Р-40 в физиологическом растворе, забуференном фосфатом), инкубирования в течение ночи при 30°С и измерения оптической плотности при 420 нм. Оптическое поглощение является мерой ферментативной активности, которая зависит от числа клеток и отражает рецептор - опосредованную клеточную пролиферацию. Определяют ЕС50 и максимальный эффект каждого лекарственного средства в отношении каждого рецептора альфа2. Эффективность или характеристическую активность рассчитывают как отношение максимального эффекта лекарственного средства к максимальному эффекту стандартного полного агониста для каждого подтипа рецепторов. В качестве стандартного агониста для рецепторов альфа2А и альфа2В используют бримонидин, называемый также UK14304-18. Оксиметазолин является стандартным агонистом, используемым для рецепторов альфа2В.
В таблице 1 ниже приведены значения характеристической активности для соединений упомянутых выше Примеров Б-Ш в отношении подтипов α2-адренорецепторов, которая определена анализом RSAT, и для некоторых адренергических соединений, не обладающих селективной агонистической активностью в отношении α2В или α2В/α2С подтипа(ов). В отношении α2А подтипа соединения Примеров неактивны или проявляют низкую эффективность (≤0,4). Они обладают значительной большей эффективностью в отношении подтипов α2В и α2С, чем в отношении подтипа α2А. Следовательно, в отличие от офтальмических α2-адренорецепторных соединений, таких как клонидин и бримонидин, соединения Примеров Б-Ш могут селективно активировать подтипы α2-адренорецепторов, отличные от подтипа α2А.

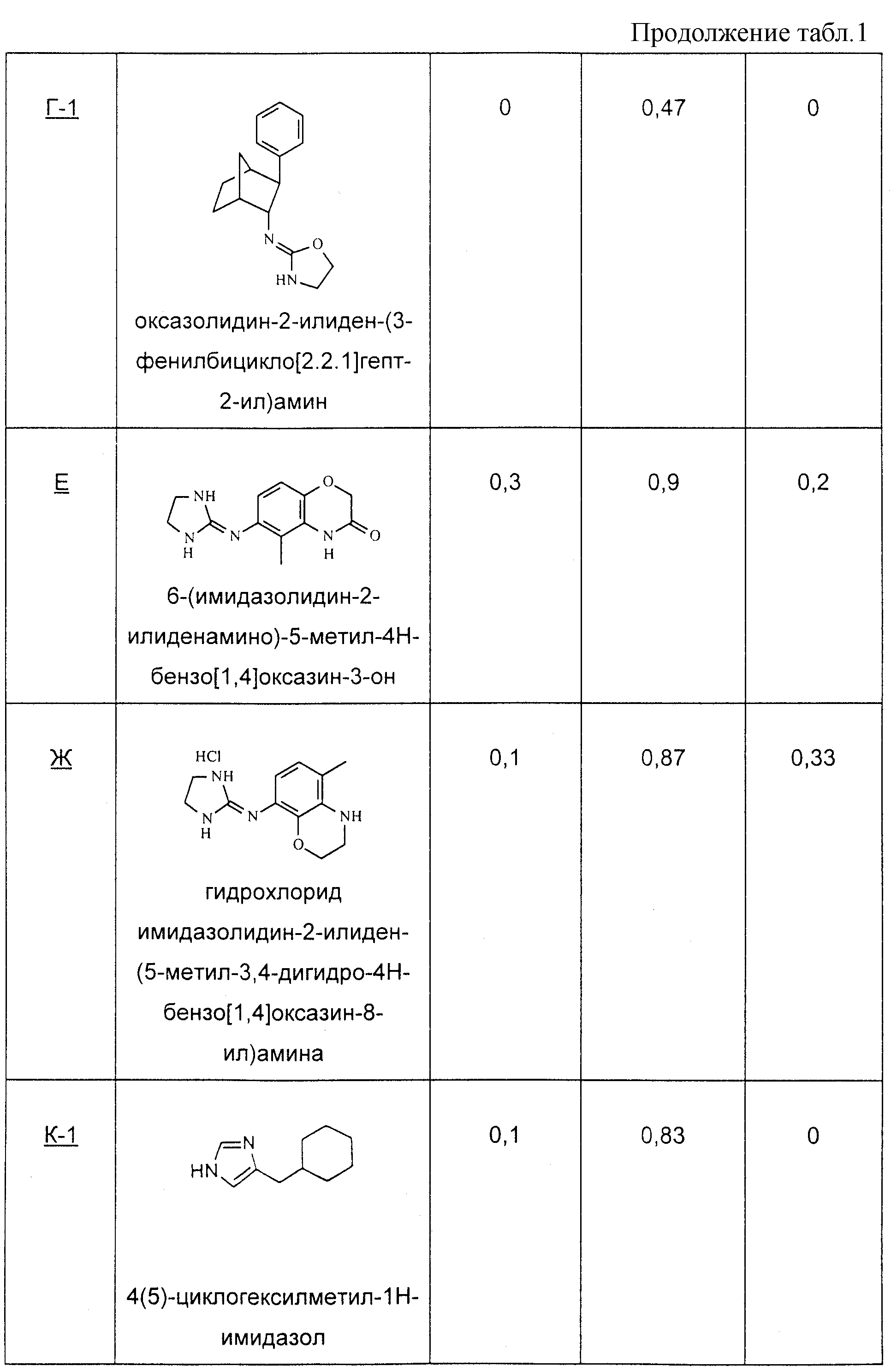
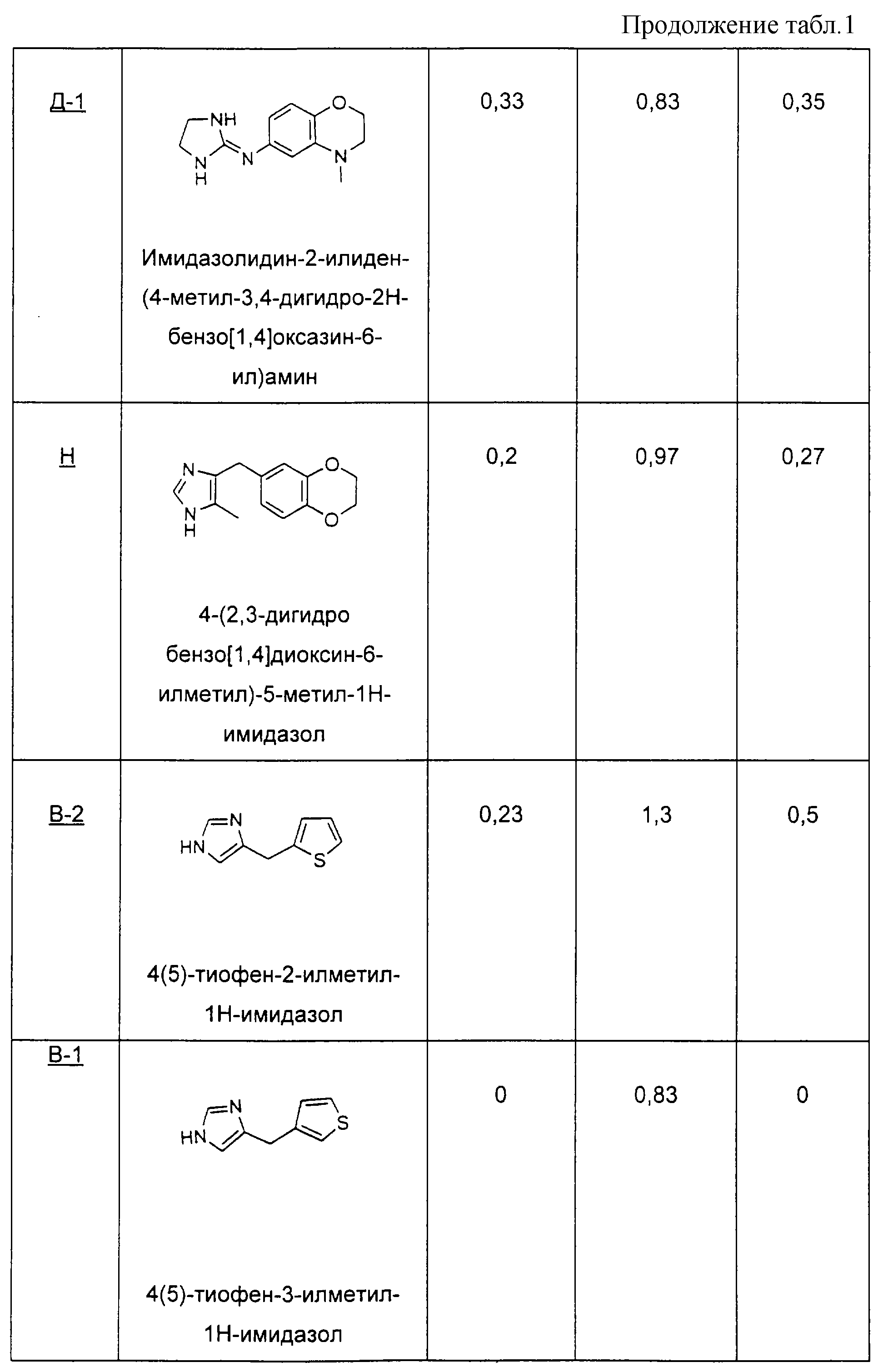



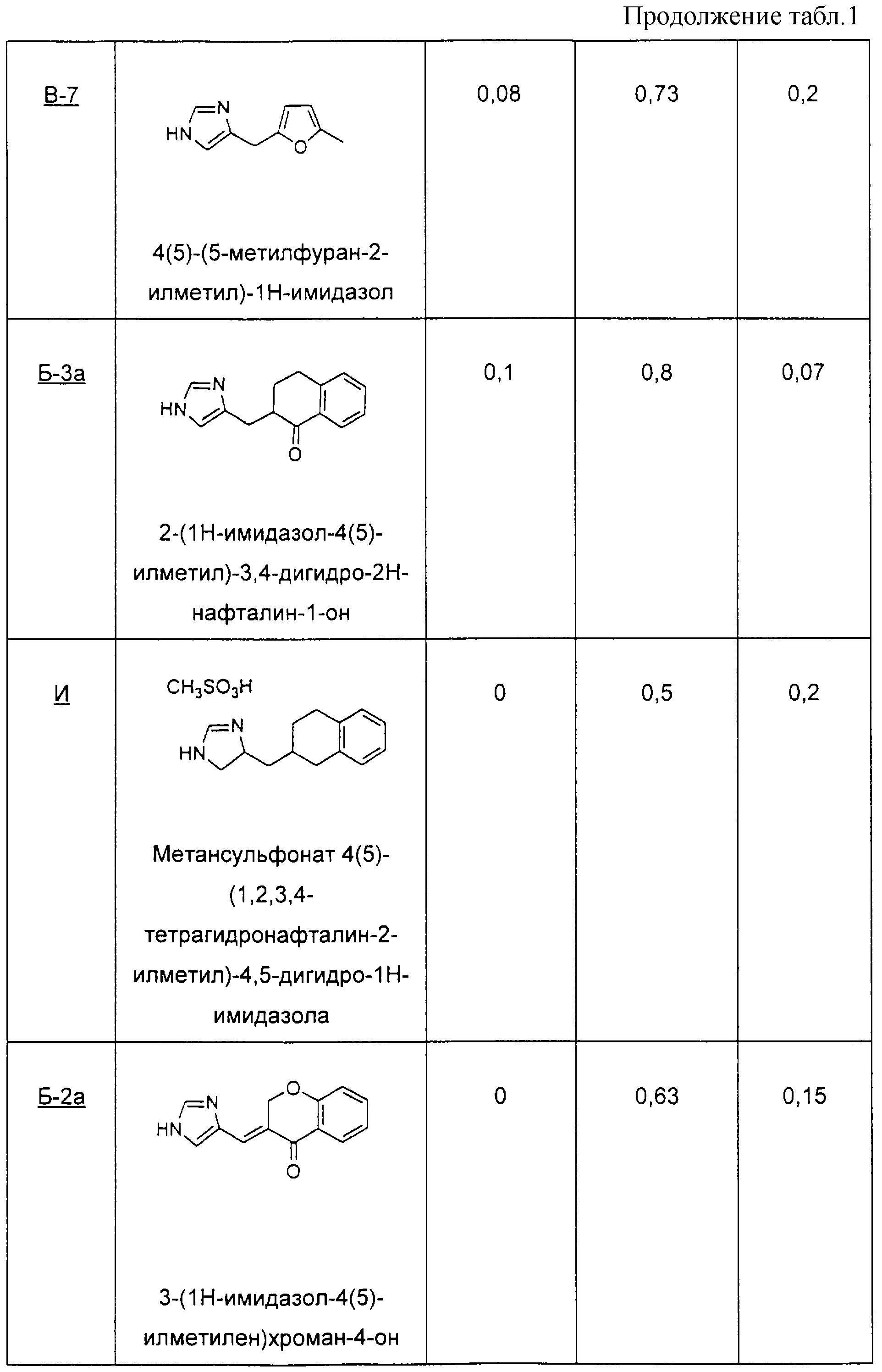



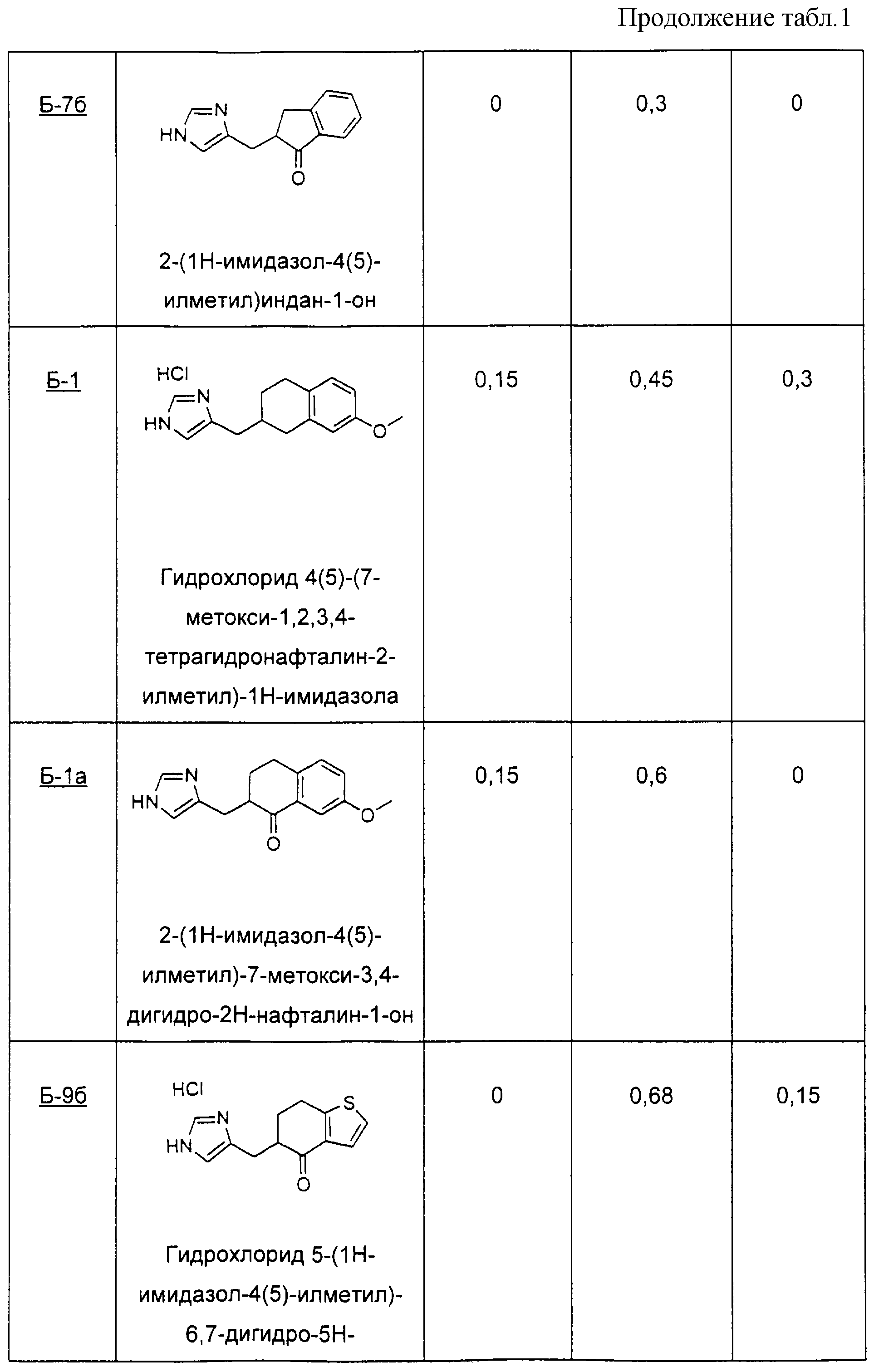




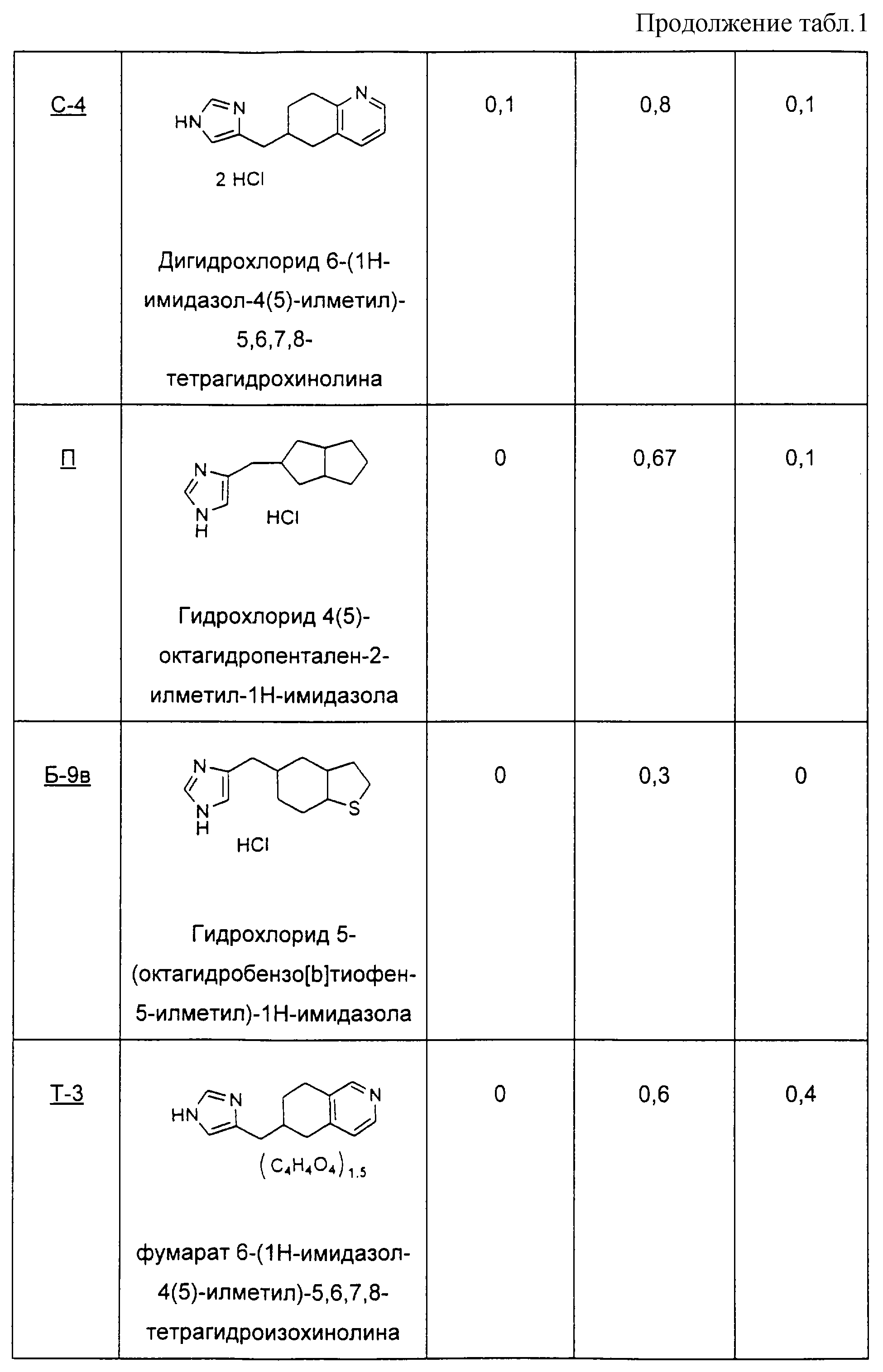

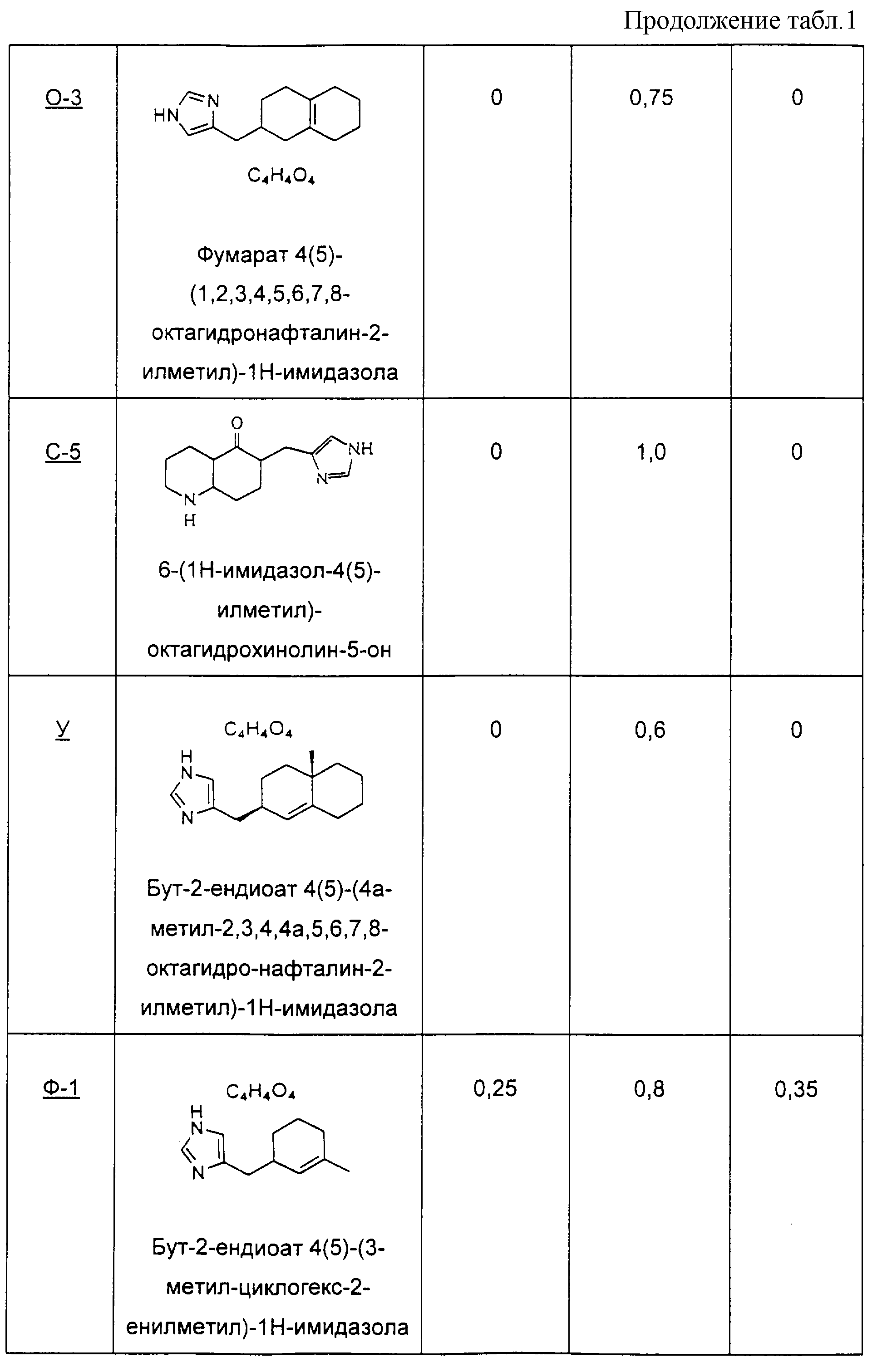

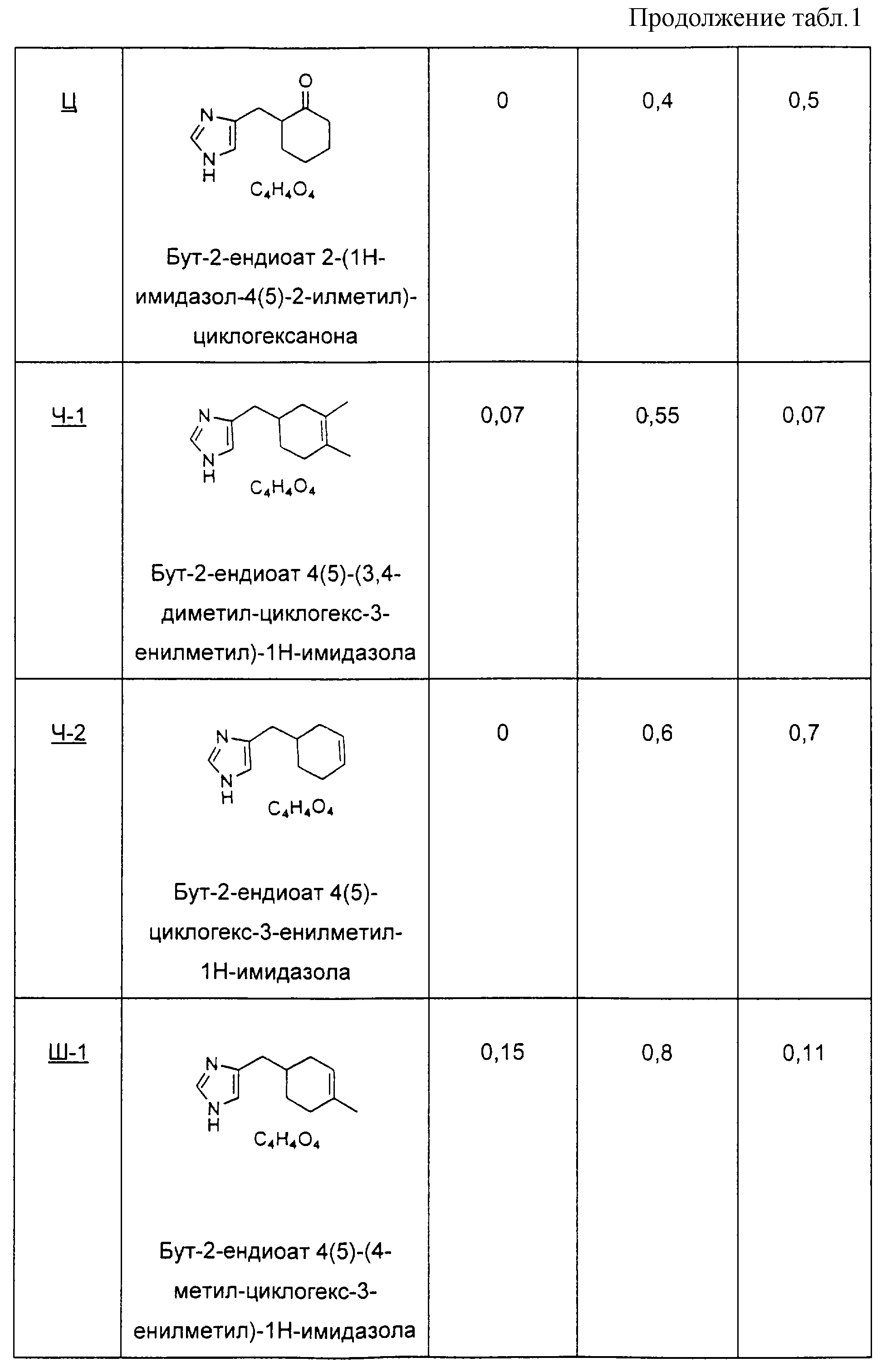

Пример Э
Снижение внутриглазного давления (ВГД) и седативный побочный эффект
Измерения ВГД проводили у находящихся полностью в сознании самок обезьян cynomolgus весом 3-4 кг с устойчивым повышенным внутриглазным давлением, которое создавали в правом глазу посредством Ar-лазерной фотокоагуляции трабекулярной сети глаза. Для экспериментов использовали животных ~2 месяца после операции. Во время экспериментов обезьяны сидели на стульях специальной конструкции (Primate Products, San Francisco) и питались апельсиновым соком и плодами, когда это было необходимо. Для измерения ВГД использовали пневматонометр 30R model Digilab (Alcon, Texas).
Перед измерениями ВГД для минимизации дискомфорта глаза, вызванного тонометрией, каждой обезьяне местно наносили 25 мкл анестетика (пропаркаина). Делали два основных измерения перед закапыванием лекарственных средств, а затем проводили периодические измерения в течение 6 часов после закапывания. Тестируемые соединения вводили в один глаз в виде одной глазной капли объемом 50 мкл; другой глаз получал равный объем солевого раствора.
На обезьянах было испытано много селективных в отношении α2В или α 2В/2С соединений примеров. Неожиданно оказалось, что, как показывает таблица 2, все эти разные по структуре соединения снижали ВГД в обработанном глазе.
Одновременно измеряли седативный эффект и оценивали его согласно следующей шкале: 0 = резвость, типичные вокализация, телодвижения и т.д; 1 = спокойствие, меньше движений; 2 = легкий седативный эффект, некоторая вокализация, реагирование на стимуляцию; 3 = седативный эффект, вокализация отсутствует, некоторый ответ на стимуляцию; 4 = сон.
К тому же, соединения по настоящему изобретению не вызвали седативного эффекта, в противоположность клонидину и бримонидину, которые вызывали седативный эффект.



Пример АА
Измерение сердечно-сосудистых побочных эффектов
Сердечно-сосудистые измерения проводили в другой группе обезьян с использованием автоматического сфигмоманометра BP 100S (Nippon Colin., Japan). Внутривенное (IV) введение некоторых соединений по настоящему изобретению в дозах, которые в 10-30 раз больше, чем дозы клонидина и бримонидина, не уменьшало частоту сердечных сокращений или не снижало кровяное давление. Интересно, что соединение 4(5)-3-метилтиофен-2-илметил)-1Н-имидазол, которое обладает характеристической активностью в отношении α2А-подтипа 0,43, продемонстрировало слабое влияние на частоту сердечных сокращений. Клонидин и бримонидин оказывали еще более сильное воздействие на частоту сердечных сокращений (таблица 3).


Пример ББ
Исследования в приведенных выше Примерах Э и АА показывают, что терапевтический эффект альфа2-агонистов можно отделить от седативного и сердечно-сосудистых побочных эффектов. Этого разделения достигают с использованием соединений, для которых общим свойством является предпочтительная активность в отношении альфа2В и альфа2В/альфа2С подтипов относительно альфа2А подтипа.
Известные из уровня техники альфа2-адренергические агонисты, которые активируют все три подтипа альфа2-рецепторов, вызывают седативный эффект, гипотензию и брадикардию, что препятствует или строго ограничивает их применение для лечения болезней и состояний, которые, как известно, они облегчают. Такие болезни и расстройства включают мышечную спастичность, в том числе гиперактивное мочеиспускание, диарею, диурез, синдромы отмены, боль, в том числе невропатическую боль, нейродегенеративные болезни, в том числе зрительную невропатию, спинальную ишемию и удар, дефицит памяти и познавательной способности, дефицит внимания, психозы, в том числе маниакальные расстройства, тревогу, депрессию, гипертензию, застойную сердечную недостаточность, сердечную ишемию и закупорку носового канала (Hieble et al., “Therapeutic applications of agents interacting with alpha-adrenoceptors, в Alpha-adrenoceptors: molecular biology, bbiochemistry and pharmacology”. Prog. Basic Clin. Pharmacol.) Basel, Karger) 8, pp.180-220 (1991)). Например, было показано, что клонидин является клинически эффективным для облегчения послеоперационной боли, боли, связанной с раком, и нейрогенной боли. Однако для того, чтобы эти и другие альфа2-агонисты были действительно клинически перспективными, требуется создание соединений, которые не вызывают седативный эффект, гипотензию и брадикардию (Maze MB and Tranquilli, W. “Alpha-2 adrenoceptor agonists: defining the role in clinical anesthesia”. Anesthesiology 74, 581-605 (1991)).
Перечисленные выше болезни и расстройства можно лечить посредством активации рецепторов подтипа(ов) α2В или α2В/2С. Следовательно, описанные выше альфа2-соединения, которые, как было показано выше, не вызывают седативный и сердечно-сосудистые эффекты, пригодны и имеют преимущество в лечении этих состояний.
Улучшение состояния нейрональной дегенерации при глаукоматозной невропатии является другим примером нового применения соединений по изобретению. Недавние исследования показали, что в нескольких моделях нейрональной дегенерации на крысах клонидин и другие альфа2 -агонисты оказывают нейрозащитное действие в отношении клеток сетчатки глаза. Эти модели включают индуцированную светом дегенерацию фоторецепторов у крыс-альбиносов (Wen et. al., “Alpha-2 adrenergic agonists induce basic fibroblast growth factor expression in photoreceptors in vivo and ameliorate light damage.” J.Neurosc. 16, 5986-5992) и калиброванное повреждение зрительного нерва у крыс, приводящее к вторичной потере ганглиозных клеток сетчатки глаза (Yoles et al, “Injury-induced secondary degeneration of rat optic nerve can be attenuated by alpha2-adrenoceptor agonists AGN 191103 and brimonidine”. Invest. Ophthalmol. Vis. Sci. 37, 540, S114). Однако в отличие от соединений по настоящему изобретению, дозы, используемые в этих исследованиях - от 0,1 до >1 мг/кг путем внутрибрюшинной или внутримышечной инъекции - так же вызывают седативный и сердечно-сосудистый эффекты. Индукцию экспрессии основного фактора роста фибробластов (bFGF) рассматривают как чувствительный индикатор активации альфа2-рецепторов сетчатки (Wen et. al., выше), а измерение индукции bFGF после местного введения альфа2-агонистов в глаза крыс показывает, что приблизительно 1% доза необходима для того, чтобы вызвать 2-3-кратное увеличение уровней bFGF, что свидетельствует о нейрозащите, опосредованной альфа2-агонистом (Wen et. al., выше; Lai et. al., “Neuroprotective effect of ocular hypotensive agent brimonidin”, Proceedings of Xith Congress of the European Society of Ophalmology (Bologna, Monduzzi Editore), 439-444). Известно, что эти местные дозы современных альфа2-агонистов, таких как клонидин, приводят к системным побочным эффектам, таким как седативный эффект и гипотензия, что препятствует их применению в качестве глазных нейрозащитных агентов. Кроме того, в должным образом переуступленной и одновременно рассматриваемой заявке 08/496292, поданной 28 июня 1995 года, раскрыто и заявлено применение некоторых неселективных α2-адренергических агентов в лечении нейронального повреждения, и содержание этой заявки во всей своей полноте включено в данное описание изобретения ссылкой.
Соединения по настоящему изобретению не вызывают седативного и сердечно-сосудистых эффектов у обезьян после местного введения доз по меньшей мере 3%. Таким образом, нейрозащитных концентраций этих соединений можно достичь, не вызывая побочных эффектов. В действительности, как сообщается ниже, показано, что соединение Примера Б-9(б) является нейрозащитным в модели калиброванного повреждения зрительного нерва на крысах (Yoles et. al., выше) (смотри таблицу 4 ниже).

Этот уровень нейрозащиты сравним с эффектом, наблюдаемым в предыдущих исследованиях со стандартным альфа2-адренорецепторным агонистом, бримонидином, и нейрозащитным агентом, МК801.
Пример ВВ
Облегчение боли, в том числе невропатической боли, является другим примером расстройства, при котором соединения по настоящему изобретению являются полезными и предпочтительными, так как облегчают боль без нежелательных побочных эффектов. Клонидин, агонист, который активирует все три альфа2-рецептора, клинически применяли для лечения хронической боли, но его применимость для этого показания ограничена, так как он вызывает седативный и сердечно-сосудистые побочные эффекты. Соединения по настоящему изобретению сравнивали с клонидином и бримонидином в модели невропатической боли на грызунах, которая, как известно, прогнозируют клиническую активность (Kim, S. and Chung, J. “An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat.” Pain 50 pp. 3550363 (1992)). После лигирования двух спинномозговых нервов у животных развивается чувствительность к обычно неболезненным раздражителям, таким как прикосновение. Способность альфа2-соединений реверсировать эту чувствительность, называемую аллодиния, проверяли через 30 минут после или интратекального, или внутрибрюшинного введения дозы. Седативную активность каждого соединения измеряли также с использованием камеры активации.
Соединения по изобретению, например О-1, даже при очень больших дозах могут облегчать аллодинию без седативного эффекта, в противоположность клонидину и бримонидину, которые вызывают седативный эффект при дозах, которые немного выше их антиаллодиниевых доз (смотри таблицы 5 и 6).

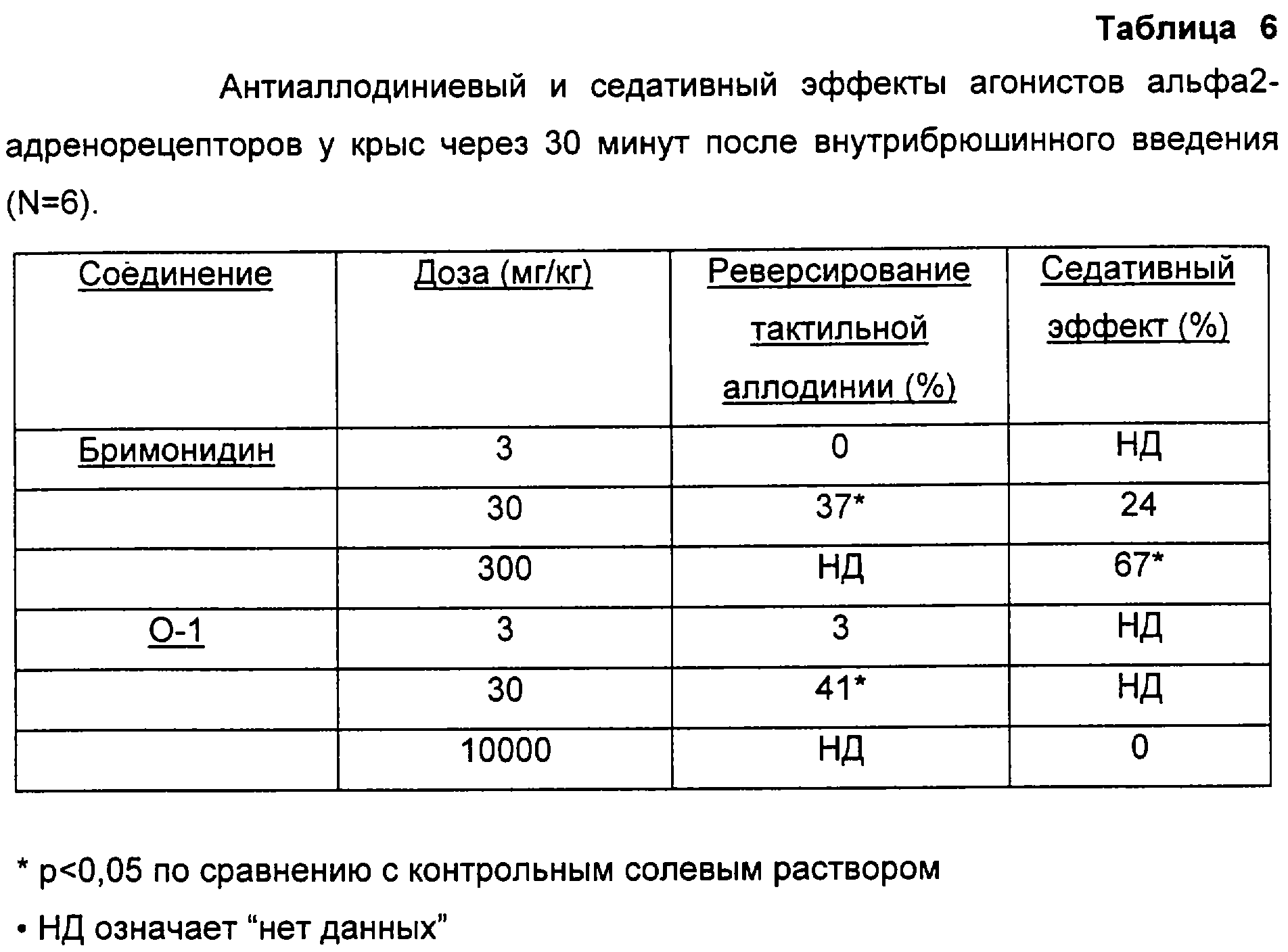
Результаты этих Примеров демонстрируют, что общие побочные эффекты α2А-адренорецепторных лекарственных средств опосредованы α2А-подтипом, и что их действие, понижающее глазное давление, и другие терапевтические действия могут быть опосредованы подтипом, отличным от α2А-подтипа. Таким образом, α2-адренорецепторные соединения неродственных структурных классов, у которых общим является то, что они обладают низкой функциональной активностью в отношении α2А-подтипа, снижают внутриглазное давление (ВГД) и вызывают другие терапевтические действия без доза-ограничивающих побочных эффектов.
Пример фармацевтической композиции по изобретению
Раствор
Активное соединение (гидрохлорид 4-(7-метокси-1,2,3,4,-тетрагидронафталин-2-илметил)-1Н-имидазола в виде белого кристаллического вещества) 2%.
Физиологический раствор (0,9% раствор NaCl в воде) 98%.
Активное соединение растворяют в физиологическом растворе и наливают в стерильную тару.
Несмотря на то, что описаны конкретные воплощения изобретения, следует иметь в виду, что данное изобретение, разумеется, не ограничивается ими, так как могут быть созданы многие очевидные модификации, и подразумевается, что данное изобретение охватывает любые такие модификации, которые находятся в объеме прилагаемой формулы изобретения.
Реферат
Изобретение относится к производным имидазола формулы (1), где X, Y, R, R2, R3 и R4 такие, как определено в формуле изобретения. Эти соединения являются селективными агонистами по отношению к адренергическим рецепторам подтипа(ов) α2В или α2B/α2C. Также описан способ введения фармацевтической композиции и способ лечения на основе этих соединений. 12 н. и 74 з.п. ф-лы, 6 табл.
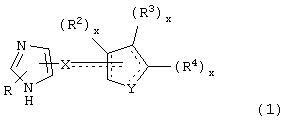
Формула


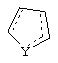

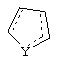


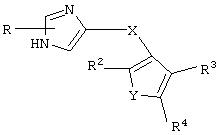


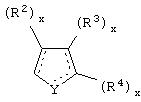








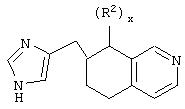

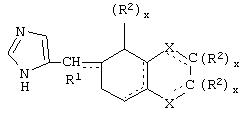



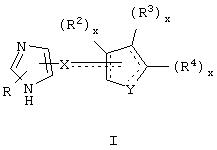


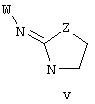





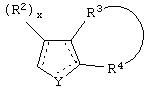










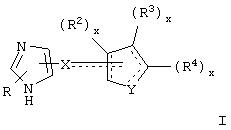





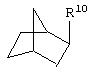
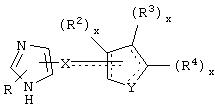




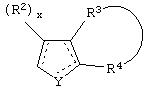



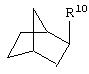


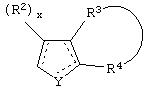
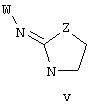




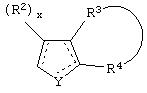




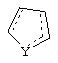


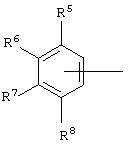

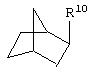
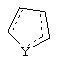







Комментарии