Способ получения производных 1,5-дифенилпиразолкарбоновой кислоты - RU2326116C1
Код документа: RU2326116C1
Описание
Объектом настоящего изобретения является новый способ получения производных 1,5-дифенилпиразол-3-карбоновой кислоты.
Сложные эфиры l, 5-дифенил-4-метилпиразол-3-карбоновой кислоты описаны, в частности, в европейском патенте EP 576 357 и в американском патенте US 5 624 941. Эти эфиры являются промежуточными продуктами для получения производных 1,5-дифенил-4-метилпиразол-3-карбоновой кислоты, которые являются антагонистами рецепторов каннабиоидов CB1.
В частности 5-(4-хлорфенил)-1-(2, 4-дихлорфенил)-4-метилпиразол-3-этилкарбоксилат, описанный в европейском патенте EP 656 354, является промежуточным продуктом, для получения N-пиперидино-5-(4-хлорфенил)-1-(2, 4-дихлорфенил)-4-метилпиразол-3-карбоксамида, международное наименование которого римонабант.
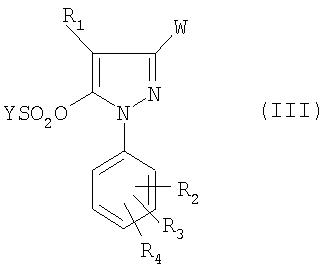
Объектом настоящего изобретения является способ получения соединения формулы:

в которой:
- W означает группу -COOR или радикал -CN;
- R1 означает атом водорода или галогена или (C1-C4)алкильную группу;
- R2, R3, R4, R5, R6, R7 каждый независимо друг от друга означает атом водорода или галогена или (C1-C4)алкильную, (C1-C4)алкокси или трифторметильную группу;
- R означает (C1-C4)алкильную или бензильную группу;
отличающийся тем, что производное фенилборной кислоты формулы:

в которой R5, R6 и R7 такие, как определено для (I), приводят во взаимодействие в растворителе в присутствии катализатора в основной среде с соединением формулы:

в которой:
- W, R1, R2, R3, R4 такие, как определено для (I);
- Y означает (C1-C4)алкильную, (C1-C4)перфторалкильную, фенильную группу, незамещенную или замещенную метильной группой, хлором или нитрогруппой.
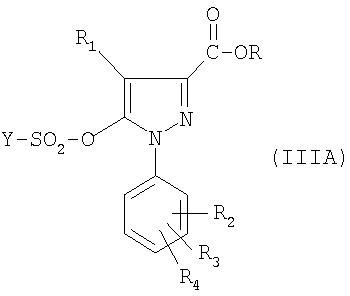
В частности объектом настоящего изобретения является способ получения соединения формулы:

в которой:
- R1, R2, R3, R4, R5, R6, R7 и R такие, как определено для соединения формулы (I);
отличающийся тем, что производное фенилборной кислоты формулы (II), такой, как определено выше, приводят во взаимодействие в растворителе в присутствии катализатора в основной среде с соединением формулы:

в которой:
- Y, R, R1, R2, R3 и R4 такие, как определено выше.
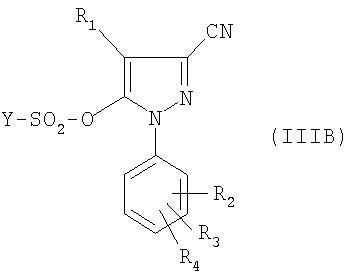
В частности объектом настоящего изобретения является также способ получения соединения формулы:
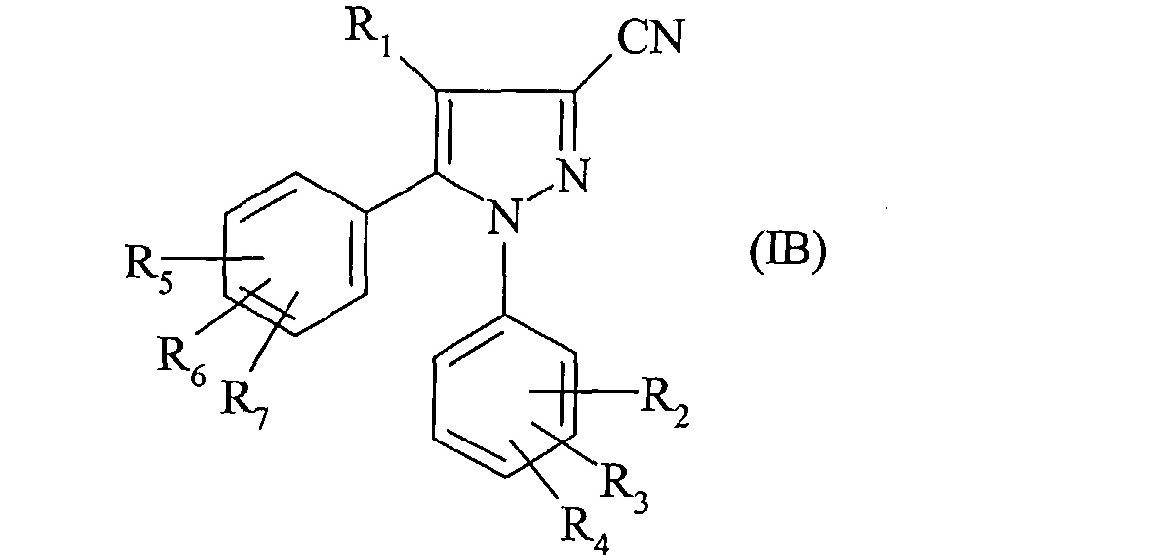
в которой:
- R1, R2, R3, R4, R5, R6 и R7 такие, как определено для соединения формулы (I);
отличающийся тем, что производное фенилборной кислоты формулы (II) такой, как определено выше, приводят во взаимодействие в растворителе в присутствии катализатора в основной среде с соединением формулы:
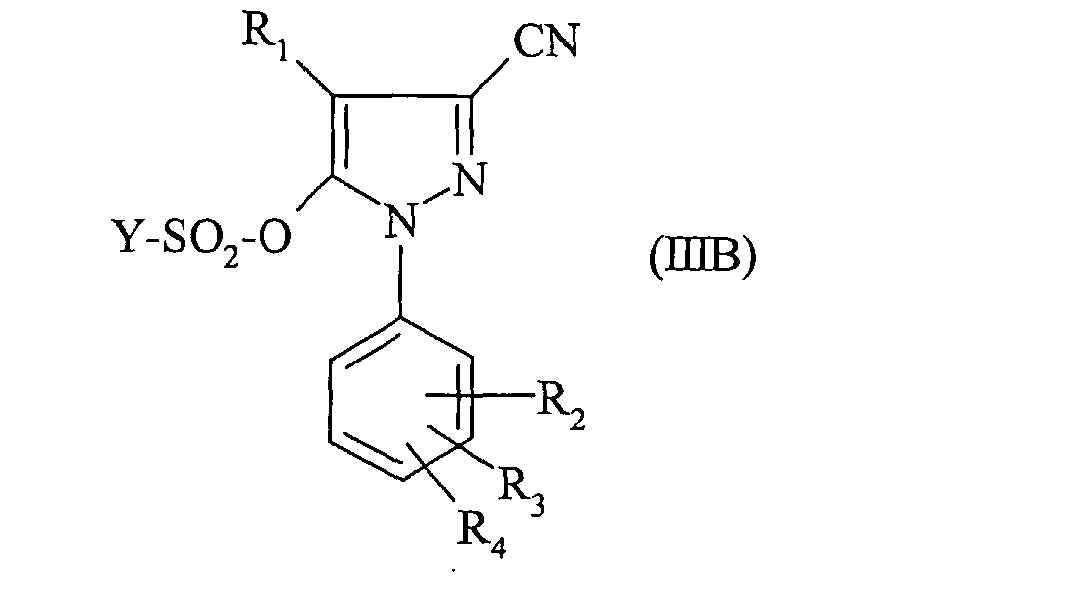
в которой:
- Y, R1, R2, R3 и R4 такие, как определено выше.
Предпочтительно реакция соединения формулы (II) с соединением формулы (III), (IIIA) или (IIIB) проводится в ароматическом растворителе, например толуоле, или в эфирном растворителе, например тетрагидрофуране или диметоксиэтане, или в диоксане, в присутствии комплекса палладия, например тетракис(трифенлфосфин)палладия, и в основной среде, например в присутствии карбоната щелочного металла, такого как карбонат натрия или карбонат калия.
Согласно предпочтительной форме осуществления реакция проводится в двухфазной среде в присутствии тетракис(трифенлфосфин)палладия, причем основная среда образована карбонатом натрия в водной растворе.
Согласно одному предпочтительному способу для получения соединения формулы (I) производное фенилборной кислоты формулы (II) приводят во взаимодействие с соединением формулы (III), в которой Y означает группу CF3, а именно с соединением формулы:

Также согласно одному предпочтительному способу для получения соединения формулы (IA) производное фенилборной кислоты формулы (II) приводят во взаимодействие с соединением формулы (IIIA), в которой Y означает группу CF3, а именно с соединением формулы:

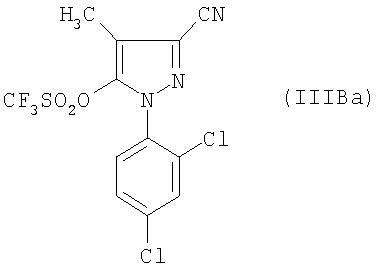
Наконец, согласно одному предпочтительному способу для получения соединения формулы (IB) производное фенилборной кислоты формулы (II) приводят во взаимодействие с соединением формулы (IIIB), в которой Y означает группу CF3, а именно с соединением формулы:
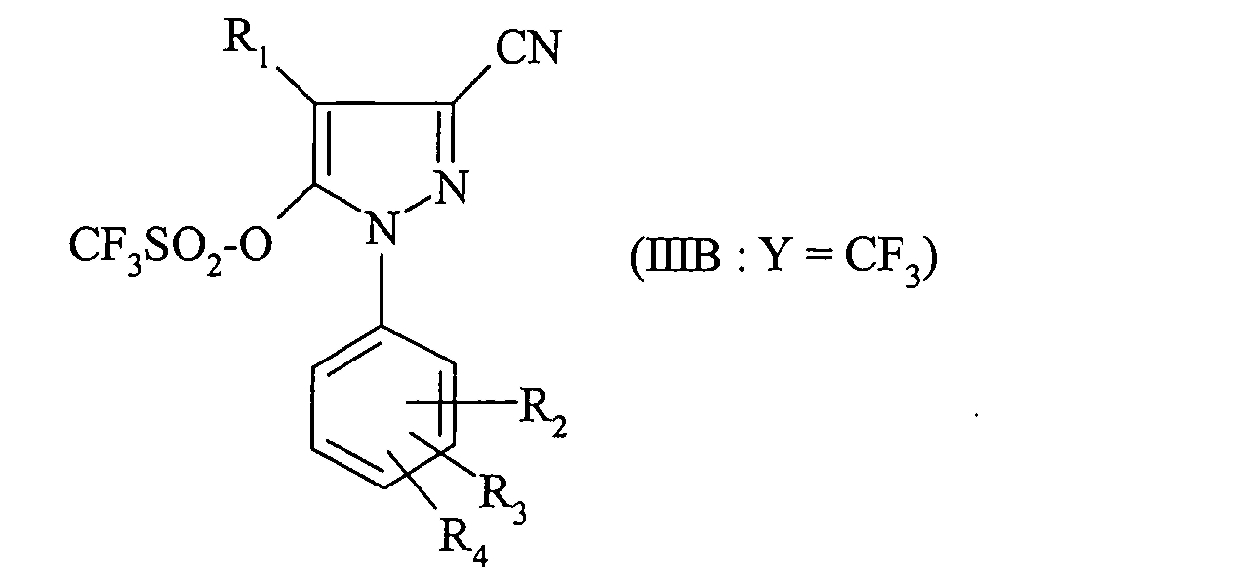
Более предпочтительно приводят во взаимодействие 4-хлорфенилборную кислоту с соединением формулы:
Также более предпочтительно приводят во взаимодействие 4-бромфенилборную кислоту с соединением формулы:

Еще более предпочтительно приводят во взаимодействие 4-хлорфенилборную кислоту с соединением формулы:
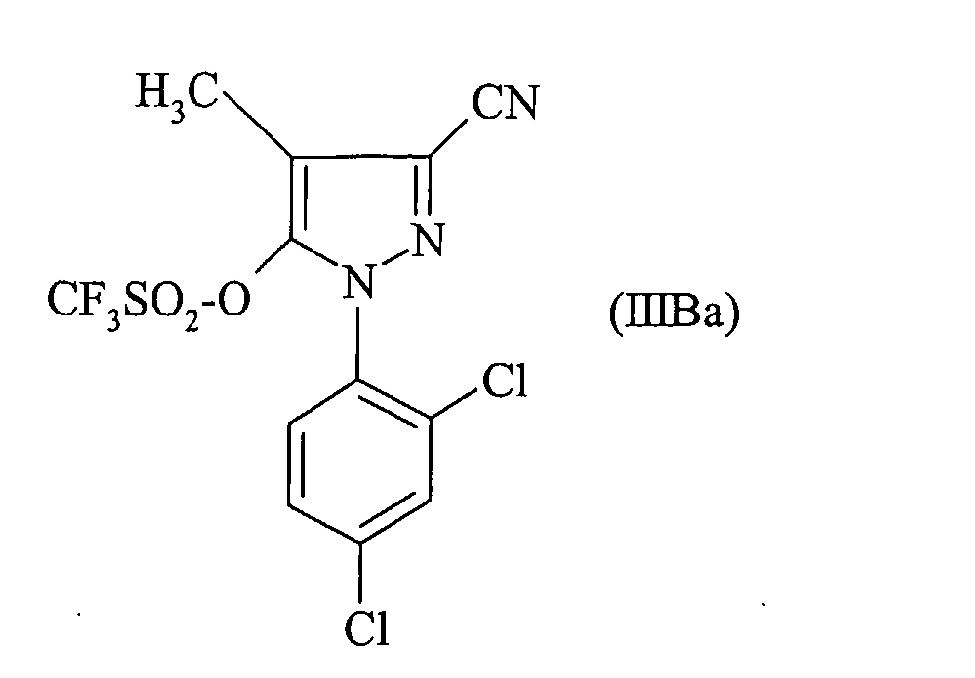
Наконец, более предпочтительно приводят во взаимодействие 4-бромфенилборную кислоту с соединением формулы:

Соединение формулы (III) получено из производного пиразолона формулы:
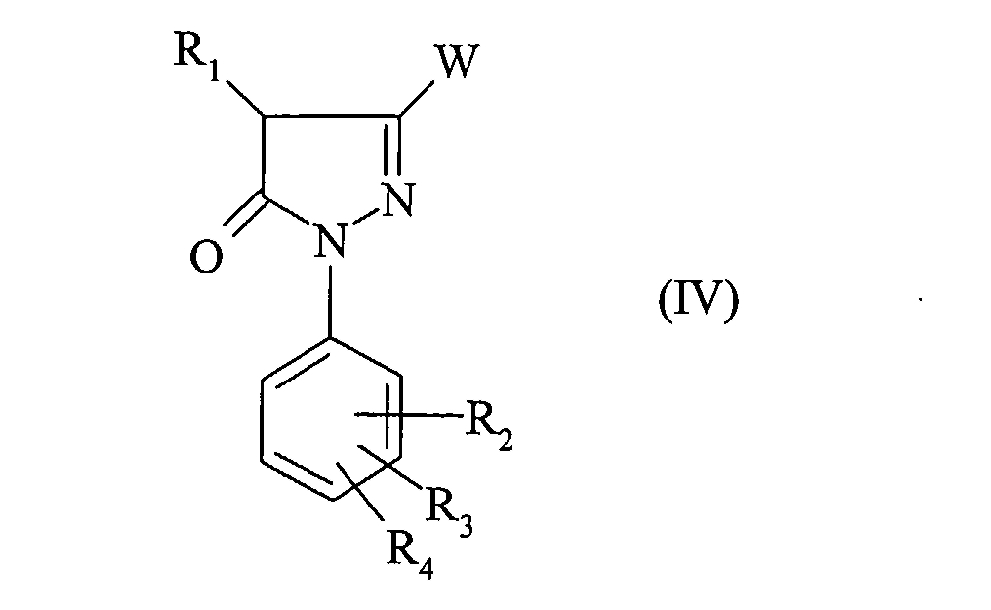
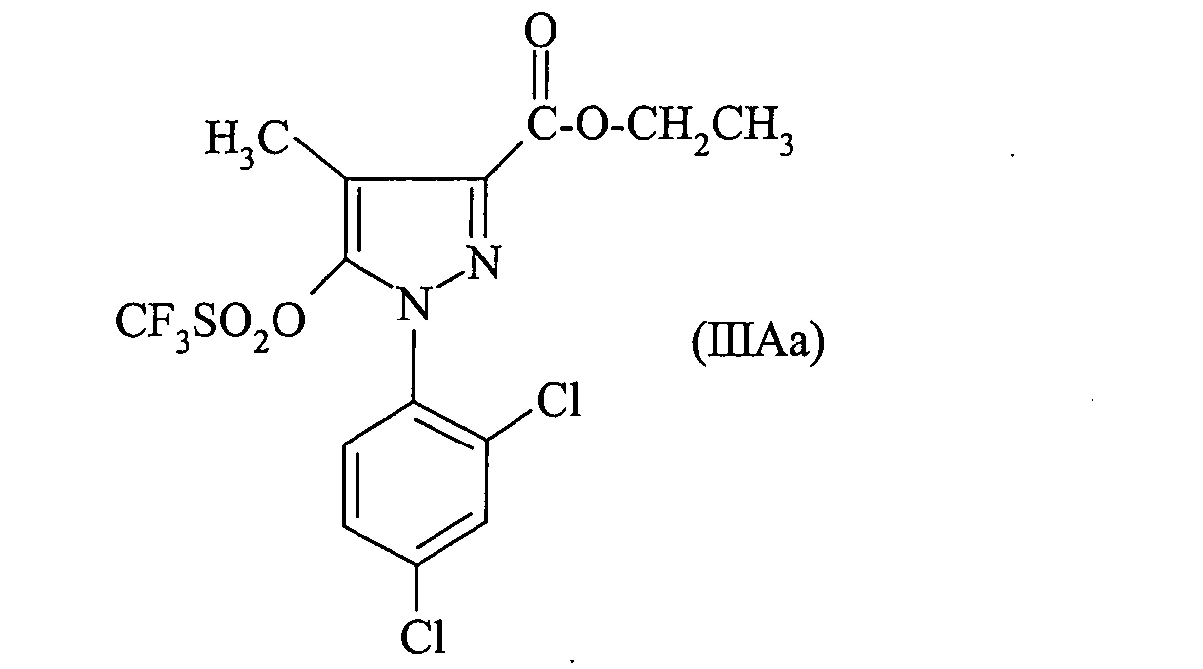
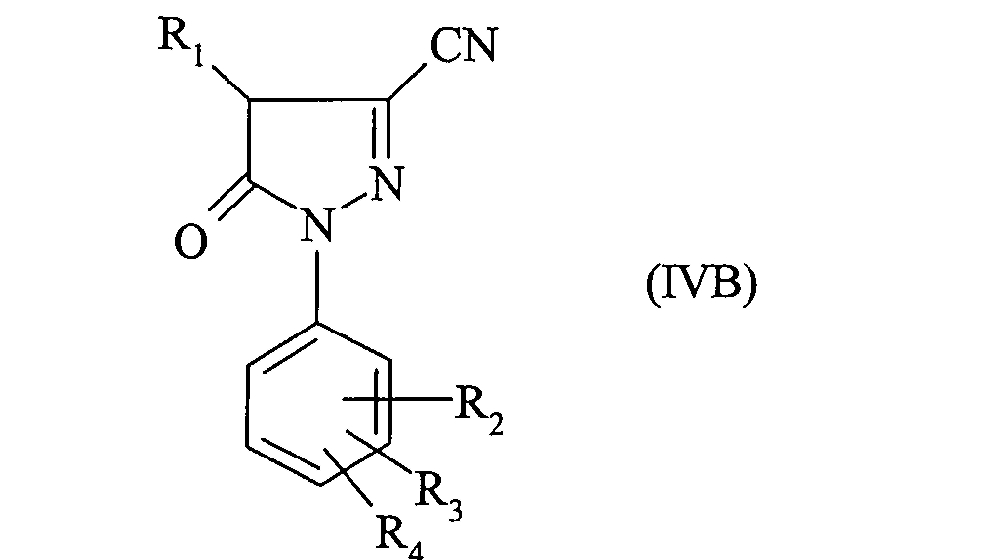
В частности соединение формулы (IIIA) получено из производного пиразолона формулы:

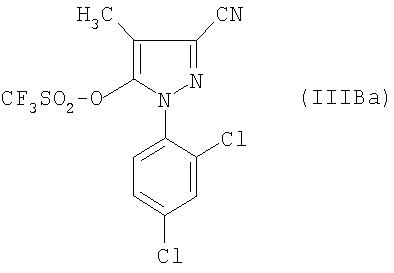
В частности также соединение формулы (IIIB) получено из производного пиразолона формулы:
Для получения соединения формулы (III), (IIIA) или (IIIB) ангидрид формулы (YSO2)2О или хлорид формулы YSO2Cl приводят во взаимодействие с соединением формулы (IV), (IVA) или (IVB), причем реакция проводится в присутствии основания, предпочтительно третичного амина.
В частности соединение формулы:

получено реакцией трифторметансульфонового ангидрида с производным пиразолона формулы:

в присутствии основания, такого как третичный амин, в растворителе, таком как дихлорметан.
В частности также соединение формулы:

получено реакцией трифторметансульфонового ангидрида с производным пиразолона формулы:
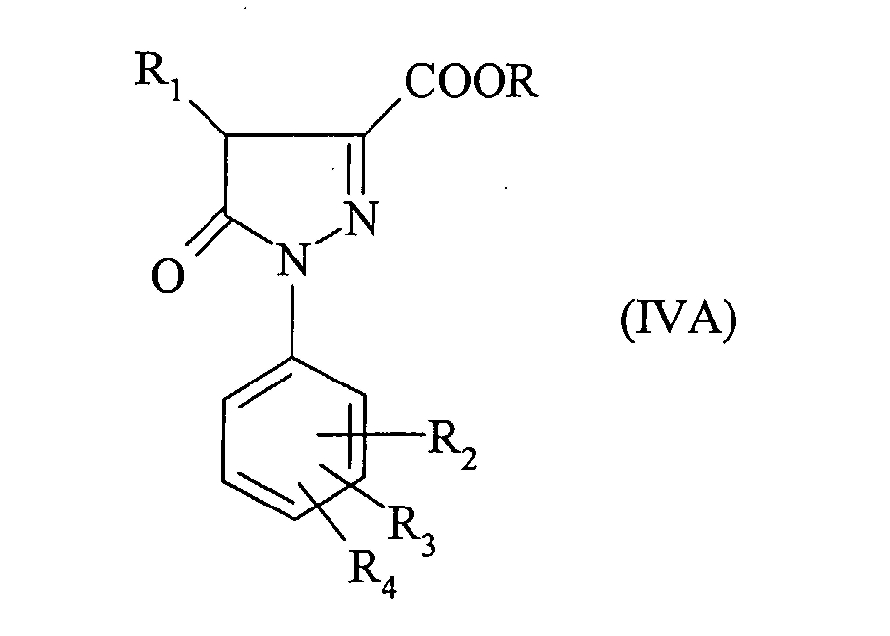
в присутствии основания, такого как третичный амин, и в растворителе, таком как дихлорметан.
В частности, наконец, соединение формулы:

получено реакцией трифторметансульфонового ангидрида с производным пиразола формулы:
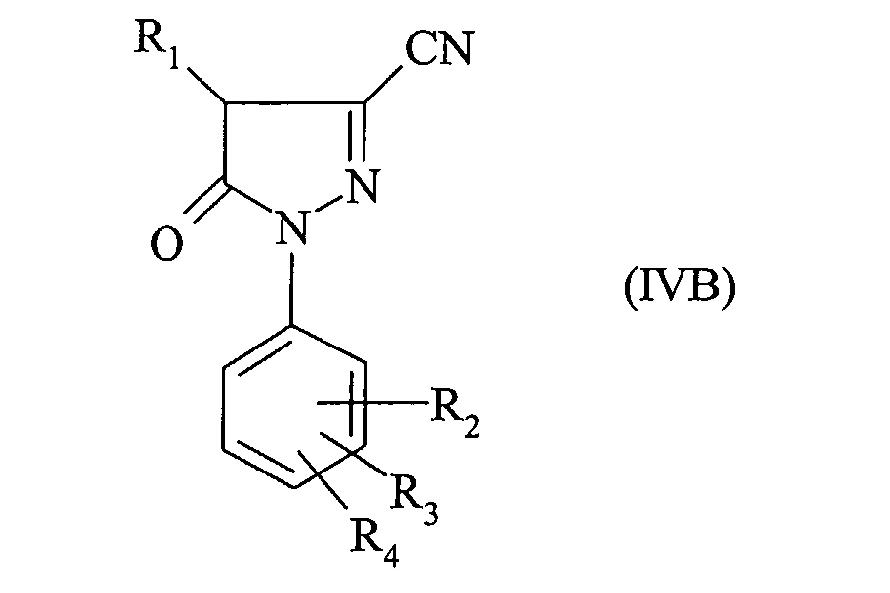
в присутствии такого основания, как третичный амин, и в растворителе, таком, как дихлорметан.
Предпочтительно, соединение формулы (III), (IIIA) или (IIIB), в которой Y означает CF3, получено под действием трифторметансульфонового ангидрида и триэтиламина в эквимолярной смеси, в дихлорметане, при температуре, составляющей от -5 до +5°C.
Соединение формулы:

получено реакцией производного гидразина формулы:

в которой R2, R3, R4 такие, как определено для (I), с производным формулы:
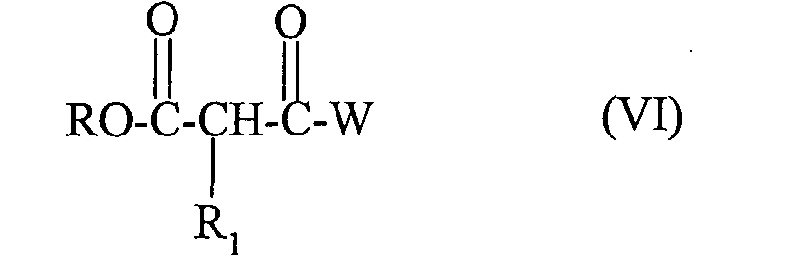
в которой R, R1 и W такие, как определено выше для (I).
В частности, соединение формулы:

получено реакцией производного гидразина формулы (V) с производным формулы:

В частности также соединение формулы:

получено реакцией производного гидразина формулы (V) с производным формулы:

Предпочтительно используют хлоргидрат гидразина формулы (V) в растворителе, в кислой среде, например в уксусной кислоте, или в толуоле в присутствии соляной, уксусной или трифторуксусной кислоты.
Производные 3-оксосукцината формулы (VI), (VIA) или (VIB) известны или получены по известным методам, таким как конденсация Клайзена енолята эфира с эфиром щавелевой кислоты.
Соединение формулы (IV) может существовать в двух таутомерных формах;
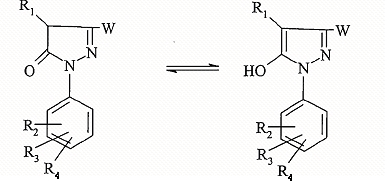
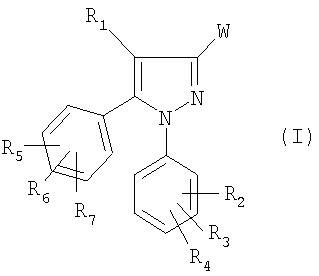
Согласно другому его аспекту объектом настоящего изобретения являются соединения формулы:
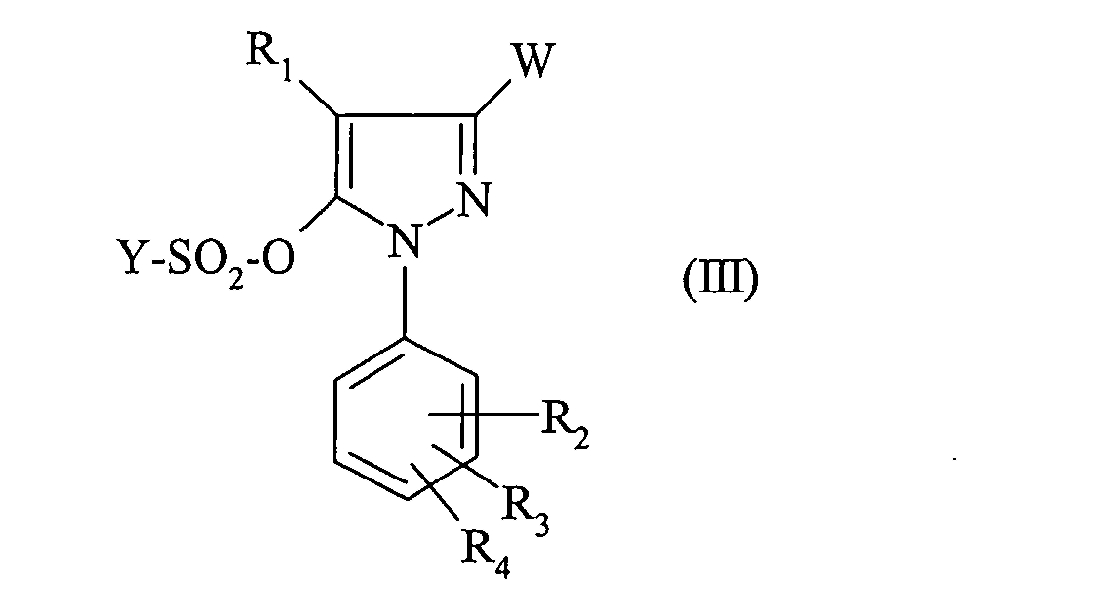
в которой:
- W означает группу -COOR или радикал CN;
- Y означает (C1-C4)алкильную, (C1-C4)перфторалкильную, фенильную группу, незамещенную или замещенную метильной группой, хлором или нитрогруппой;
- R1 означает атом водорода или галогена или (C1-C4)алкильную группу;
- R2, R3, R4 каждый независимо друг от друга означает атом водорода или галогена или (C1-C4)алкильную, (C1-C4)алкокси или трифторметильную группу.
- R означает (C1-C4)алкильную или бензильную группу;
Предпочтительно объектом настоящего изобретения являются соединения формулы:
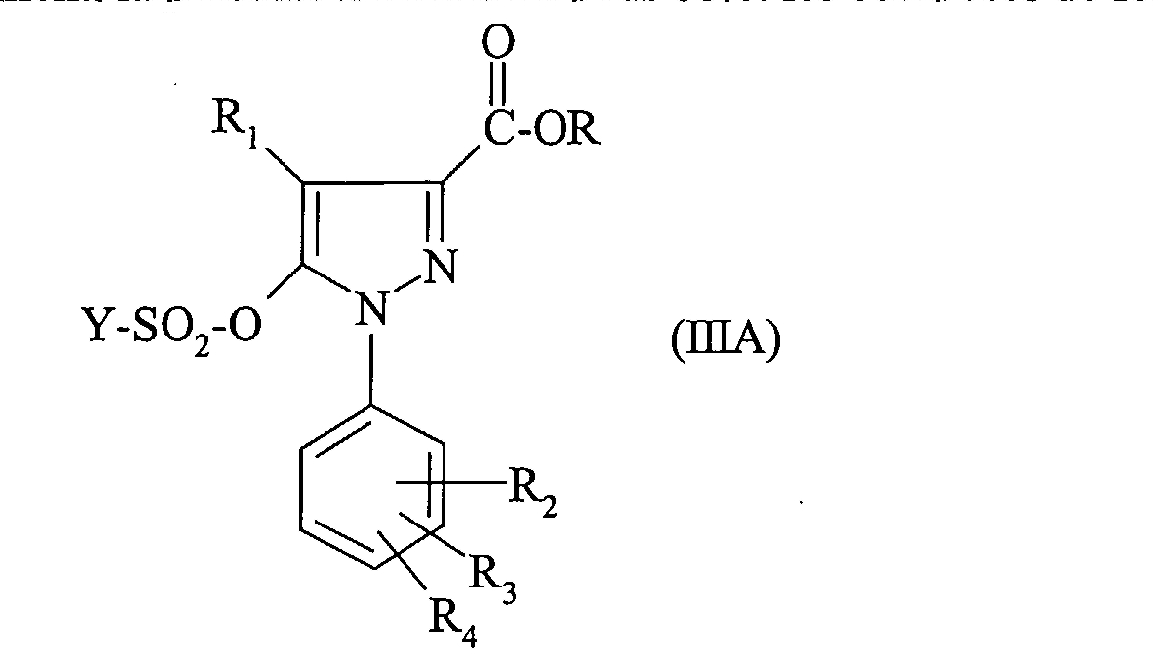
в которой:
- Y, R, R1, R2, R3 и R4 такие, как определено выше.
Предпочтительно объектом настоящего изобретения являются соединения формулы:

в которой:
- Y, R1, R2, R3 и R4 такие, как определено выше.
Более предпочтительно объектом настоящего изобретения является соединение формулы:

Более предпочтительно объектом настоящего изобретения является также соединение формулы:

Еще более предпочтительно объектом настоящего изобретения является соединение формулы:
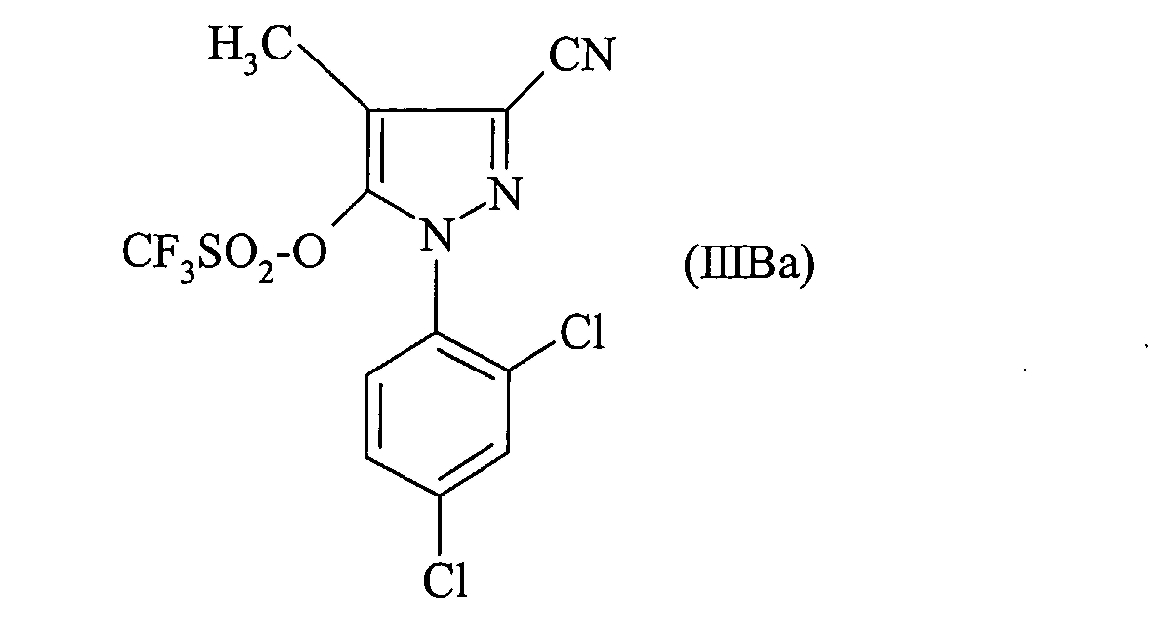
Наконец, более предпочтительно объектом настоящего изобретения является соединение формулы:

Следующий пример не является ограничительным, он иллюстрирует один вариант осуществления изобретения.
Масс-спектры измерены в режиме ионизации, называемом электроспреем (ES).
Сигналы, обнаруженные ЯМР, выражаются таким образом: с: синглет; шир.с: уширенный синглет; д: дублет; дв.д: двойной дублет; т: триплет; дв.т: двойной триплет; кв: квадруплет; мас: масс.; м: мультиплет.
Пример 1
Получение 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1Н-пиразол-3-этилкарбоксилата
A) 1-(2,4-дихлорфенил)-4-метил-5-оксо-4, 5-дигидро-1Н-пиразол-3-этилкарбоксилат
В атмосфере азота помещают 12,6 г хлоргидрата 2,4-дихлорфенилгидразина в 100 мл толуола; после перемешивания добавляют 10 г диэтил-2-метил-3-оксосукцината, затем нагревают и добавляют при 55°C 5 мл ТФУК. Продолжают перемешивать при температуре образования флегмы растворителя в течение 4 с половиной часов. Доводят до температуры окружающей среды, затем нагревают до 75°C и гидролизуют реакционную среду 30 мл воды. Декантируют, водную фазу отгоняют, затем органическую фазу выпаривают для удаления остаточной ТФУК. Органическую фазу вводят в 10 мл толуола, затем кристаллизуют полученный продукт, м=10,2 г.
ES-: [M-H]-=313,0
ЯМР (ДМСО-d6 1H при 300 МГц): 1,26 ppm: т: 3H; 2,11 ppm: с: 3H; 4,23 ppm: кв: 2H; 7,57 ppm: мас: 2H; 7,87 ppm: шир.с: 1H; 11,04 ppm: шир.с: 1H.
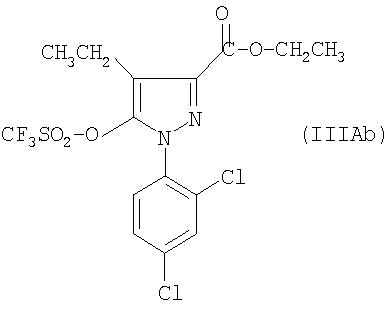
B) 1-(2, 4-дихлорфенил)-4-метил-5-(((трифторметил)сульфонил)окси)-1H-пиразол-3-этилкарбоксилат
В атмосфере азота суспендируют 5 г пиразолона, полученного на предыдущем этапе, в 25 мл DCM и охлаждают при перемешивании до 0°C. Добавляют 2,4 мл ТФУК, затем 3 мл трифторметансульфонового ангидрида и продолжают перемешивать при 0°C в течение 15 минут. Реакционную среду гидролизуют 20 мл DCM. Реакционную среду декантируют, затем органическую фазу промывают 20 мл воды. Водную фазу отгоняют. Органическую фазу выпаривают и полученное масло подвергают хроматографии на силикагеле, элюируя смесью пентан/AcOEt (90/10; об/об). Фракции, содержащие требуемое соединение, объединяют и выпаривают досуха. Получают 6,77 г требуемого соединения.
ES+: [M+Na]+= 468,8
ЯМР (ДМСО-d6 1H при 300 МГц): 1,31 ppm: т: 3H; 2,27 ppm: с: 3H; 4,34 ppm: кв: 2H; 7,72 ppm: дв.д: 1H; 7,79 ppm: д: 1H; 8,04 ppm: д: 1H.
C) 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1Н-пиразол-3-этилкарбоксилат
В атмосфере азота смешивают 2,55 г трифлата пиразола с предыдущего этапа, 1,08 г 4-хлорфенилборной кислоты и 67 мг тетракис(трифенилфосфин)палладия; добавляют 25 мл толуола и 7,1 мл водного раствора (2М) карбоната натрия. Реакционную среду перемешивают при 65°C в течение 6 часов. Реакционную среду декантируют, водную фазу отгоняют, затем органическую фазу промывают 10 мл воды. После декантации органическую фазу выпаривают. Полученный продукт очищают хроматографией на силикагеле, элюируя смесью циклогексан/AcOEt (85/15; об/об). Получают 1,890 г искомого соединения.
ЯМР (ДМСО-d6 1H при 300 МГц): 1,31 ppm: т: 3H; 2,23 ppm: с: 3H; 4,32 ppm: кв: 2H; 7,24 ppm: д: 2H; 7,46 ppm: д: 2H; 7,57 ppm: дв.д: 1H; 7,73 ppm: д: 1H; 7,77: д: 1H.
Реферат
Настоящее изобретение относится к способу получения соединения формулы (I), в которой W означает группу -COOR или -CN; R1 означает атом водорода, галогена или (С1-С4)алкильную группу; R2, R3, R4, R5, R6, R7 каждый независимо друг от друга означает атом водорода или галогена или (С1-С4)алкильную, (С1-С4)алкокси или трифторметильную группу; R означает (С1-С4)алкильную или бензильную группу

Способ заключается в том, что производное соответствующей фенилборной кислоты приводят во взаимодействие с соединением формулы (III)
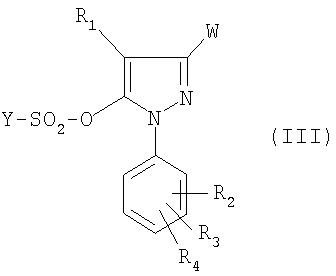
Технический результат - получение новым способом производных 1,5-дифенилпиразол-3-карбоновой кислоты, применимых для производства антагонистов рецепторов каннабиоидов CB1.
Формула














Комментарии