Способ лечения гиперкортизолемии, головных болей, нейропатической боли и родственных расстройств - RU2561588C2
Код документа: RU2561588C2
Описание
Область техники
Настоящее описание относится к лечению и ведению гиперкортизолемии, головных болей и нейропатической боли при помощи композиции, содержащей азиатикозид и мадекассосид необязательно в сочетании, по меньшей мере, с одним эксципиентом.
Известный уровень техники
Серотонин является нейромедиатором, участвующим в разнообразных функциях мозга. Рецепторы серотонина, обычно известные как рецепторы 5-гидрокситриптамина (5-НТ), широко экспрессируются в различных участках организма, таких как мозг, кровеносные сосуды, сердечные клапаны, желудочно-кишечный тракт, тромбоциты и т.д. Связывание серотонина с 5-НТ рецепторами может вызывать передачу как возбуждающих, так и тормозящих нервных импульсов. Идентифицировано четырнадцать 5-НТ рецепторов. Серотонин способен вызывать комплекс сердечнососудистых эффектов, включая гипотензию или гипертензию, расширение или сужение кровеносных сосудов, брадикардию или тахикардию и т.д. Оказываемое серотонином действие зависит от природы 5-НТ рецептора, с которым он связывается, а также скученности и чувствительности рецепторов. Рецепторы серотонина 5-НТ1А, 5-НТ1В и 5-HT1D экспрессируются в кровеносных сосудах и центральной нервной системе. Связывание серотонина с этими рецепторами вызывает сужение кровеносных сосудов. При лечении мигрени используются лекарственные средства, связывающиеся с 5-НТ1В и 5-HT1D рецепторами. Однако, поскольку 5-НТ1В рецепторы также экспрессируются в клапанах сердца, продолжительное введение этих лекарственных средств может стать причиной пороков сердечных клапанов. Аналогично, помимо сужения кровеносных сосудов (вазоконстрикции), 5-НТ1А рецепторы также участвуют в передаче болевых сигналов. Агонист 5-НТ1А рецептора может уменьшать восприятие боли до значительного уровня, почти до 80%, по сравнению с обычными опиоидными лекарственными средствами. Таким образом, ясно, что действие серотонина меняется в зависимости от типа 5-НТ рецептора, с которым он связывается.
Международная классификация головных болей (2ое издание) описывает мигрень как нейроваскулярное заболевание, характеризующееся сильно выраженной пульсирующей односторонней головной болью, связанной с анорексией, тошнотой, рвотой, светобоязнью и/или звукобоязнью. Наиболее распространенными типами мигрени являются (i) мигрень с аурой, начинающаяся с висцеральных, сенсорных или моторных симптомов с последующей головной болью; и (ii) мигрень без ауры - головная боль аналогичная (i), но без предшествующей ауры.
Для описания этиологии мигрени существует множество теорий. Васкулярная теория утверждает, что головные боли при мигрени являются следствием расширения кровеносных сосудов, вызванного высвобождением сосудорасширяющих веществ, подобных нейропептидам, нейрокининам и т.д. Общепризнано, что этот нейроваскулярный синдром преимущественно возникает в результате активации тригеминоваскулярной системы. Были идентифицированы определенные структуры мозга, возможно вовлеченные в появление мигрени: менингеальная артерия, окруженная тучными клетками в оболочках головного мозга; крупные мозговые артерии; тройничный нерв от менингеальных артерий и церебральных артерий; и тройничный нерв, соединяющий ганглии тройничного нерва с каудальным ядром тройничного нерва (TNC). TNC передает болевые сигналы в высшие болевые центры в таламусе и коре головного мозга. Активация тройничных нервов также может вызывать высвобождение различных нейропептидов, включая кодируемый геном кальцитонина пептид, на окончаниях чувствительных нервов. Это является причиной патофизиологии сосудов, приводящей к нейровоспалению.
В настоящее время громко заявлена серотониновая теория, которая поддерживает роль увеличения серотонина и 5-HIAA в период мигренозной атаки. Сообщалось, что по сравнению с нормальными субъектами в мозге пациентов с мигренью обнаруживается увеличенный синтез серотонина. Это может приводить к кортикальной гипервозбудимости. Интересно, что также сообщалось, что мигрень представляет собой синдром пониженного серотонина. Таким образом, участие серотонина в мигрени не является убедительным. Другие гипотезы поддерживают роль гормонов и анатомических изменений в развитии мигрени. Таким образом, патофизиология мигрени очень сложна и не очень четко понята.
Селективные ингибиторы обратного захвата серотонина (SSRIs) представляют собой класс соединений, обычно используемых для лечения депрессии и тревожных расстройств. Они увеличивают внеклеточную концентрацию нейромедиатора серотонина путем ингибирования его обратного захвата в пресинаптических нейронах и увеличения в синаптической щели серотонина, доступного для связывания с постсинаптическим рецептором. Существует неправильное представление о том, что все SSRIs являются подходящими лекарственными средствами при мигрени. Это не так, поскольку повышенные уровни серотонина могут связываться со всеми 14 5-НТ рецепторами с одинаковой аффинностью, и многие из них противопоказаны при мигрени. Более того, существует неопределенность в отношении экспрессии многих 5-НТ рецепторных белков, которые связаны с другими состояниями ЦНС. Например, сообщается, что 5-НТ1А рецепторы не синтезируются в ЦНС в случае высоких уровней нейростероидов.
Lampl et al. (2010), в своей статье об антидепрессивных средствах для профилактики мигрени, опубликованной в European Neurological Journal, критически проанализировал опубликованные данные об эффективности SSRIs при Мигрени и сделал заключение, что благоприятное действие SSRIs после хронической терапии было равноценно действию, наблюдаемому в группе плацебо. Это показывает, что SSRIs, как правило, могут и не быть полезны при мигрени. Для заключения об участии молекулы в лечении мигрени ключевым является понимание ее селективности к подтипам 5-НТ рецептора.
На основе определения мигрени и ее известной патофизиологии, совершенно очевидно, что оптимальное лекарственное средство от мигрени должно ингибировать расширение кровеносных сосудов (или вызывать сужение кровеносных сосудов) и уменьшать восприятие боли или болевое возбуждение нервных волокон. Эти два прямых действия лекарственного средства обеспечат возможность облегчения симптомов, связанных с мигренью. 5-НТ1А рецепторы оказываются превосходной мишенью для достижения этого двойного действия. Селективные агонисты 5-НТ1А рецепторов являются перспективными в отношении предоставления лучшего лечения мигрени, чем современный стандарт лечения мигрени, а именно - класс триптановых лекарственных средств.
Нейропатическая боль представляет собой еще одно патологическое болевое состояние, характеризующееся постоянной невралгической болью, независимой от сенсорной стимуляции, наряду с гиперчувствительностью в болезненном участке. Она связана с множеством заболеваний, таких как диабет, алкоголизм, васкулит, идиопатическая полинейропатия, повреждение спинного мозга, рак, инсульт, HIV, дегенеративные неврологические заболевания, синдром Гийена-Барре, постгерпетическая невралгия и невралгия тройничного нерва. Нейропатическая боль обусловлена повреждением или нарушением функций периферической или центральной нервной системы, которые увеличивают симптомы потери чувствительности, парэстезии и боли.
Нейропатическая боль не является единым синдромом. Она является проявлением целого ряда лежащих в ее основе механизмов. Эктопические импульсы нейромы, изменения натриевых и калиевых каналов в поврежденных нервах, симпатическая активацию и недостаточность центрального тормозящего пути являются некоторыми из этих патологических механизмов.
На сегодняшний день лечения, способного предотвратить развитие нейропатической боли, не существует. Страдающие от нейропатической боли пациенты не реагируют на нестероидные противовоспалительные лекарственные средства (NSAIDs). Стандартом лечения, предписанным для облегчения боли, являются антидепрессивные средства и антиконвульсивные средства. Однако эти лекарственные средства недостаточно эффективны и имеют тяжелые побочные эффекты. Механизм действия антидепрессивных средств при лечении нейропатической боли не совсем понятен. Saarto et al. (2010), в обзоре применения антидепрессивных средств при нейропатической боли, опубликованном в The Cochrane Library, показал, что лишь приблизительно у одной трети пациентов использование антидепрессивных средств облегчает нейропатическую боль, и приблизительно одна пятая пациентов прекращает лечение вследствие тяжелых побочных эффектов. Исходя из имеющихся данных опубликованных клинических исследований, SSRI лекарственные средства не являются эффективными для лечения нейропатической боли, в то время как трициклические антидепрессивные средства более эффективны для обеспечения клинически значимого купирования боли. Активность агонистов 5-НТ1А рецепторов относительно уменьшения восприятия боли может являться перспективной для лечения нейропатической боли.
Meijer et al. (1994, Eur J Pharmacol., Vol.266, No.3, pp.255-61) показал, что продолжительное воздействие на клетки гиппокампа крысы таких нейростероидов, как кортикостерон, ингибировало экспрессию мРНК 5-НТ1А рецепторов. У людей в условиях стресса избыток секреции нейростероидов может подавлять экспрессию 5-НТ1А рецептора, что в свою очередь увеличивает болевую чувствительность. Этим объясняется миалгия, или хроническая боль, которую испытывают пациенты, страдающие от депрессивных расстройств. Продолжительное воздействие высоких уровней нейростероида кортизола на ткани тела приводит к расстройству, известному как синдром Кушинга или гиперкортизолизм. Синдром Кушинга может быть вызван продолжительным экзогенным введением стероидных гормонов, таких как глюкокортикоиды, адренокортикотропный гормон (АСТН), противозачаточными таблетками, содержащими гормон эстроген и другими эндогенными нарушениями в организме. Симптомы синдрома Кушинга включают одно или более из следующего: диабет, высокое кровяное давление, ожирение верхней части тела, увеличенное отложение жира вокруг шеи, округленное лицо, истончение рук и ног, сильная усталость, слабые мышцы и т.д. Раздражительность, тревога, когнитивные нарушения и депрессия являются типичными поведенческими симптомами, связанными с синдромом Кушинга. Лечение синдрома Кушинга включает введение таких ингибирующих кортизол лекарственных средств, как кетоконазол и метирапон в сочетании с лекарственными средствами для симптоматического лечения.
Настоящее описание связано с лечением и устранением синдрома Кушинга, мигрени, нейропатической боли, миалгии и связанных с этим болей. Они представляют собой неврологические расстройства, требующие продолжительной терапии. Настоящее описание ставит целью использование полученной из растения композиции, содержащей 15-50% азиатикозида и 20-50% мадекассосида, необязательно в сочетании с эксципиентами, как безопасного и эффективного средства лечения для постоянного введения у пациентов, страдающих от этих заболеваний.
Bhaskaran et al. (US 20080194499) раскрывает композицию для ингибирования обратного захвата серотонина, содержащую 15-50% азиатикозида и 20-50% мадекассосида. Этот документ показывает, что композиция полезна при лечении заболеваний, опосредованных уменьшением уровня серотонина, а именно депрессии, понижении настроения, опорожнения желудка и т.д., благодаря увеличению уровня нейромедиатора серотонина. Этот документ сообщает, что композиция усиливает действие серотонина путем блокирования обратного захвата серотонина. Однако нет указаний или ясности относительно применения этой композиции в отношении эффектов восприятия боли и нейропатической боли, ослабления вазодилатации и изменения повышенной секреции нейростероидов. Эта заявка также ничего не сообщает относительно уменьшения симптомов, связанных с синдромом Кушинга (гиперкортизолемией). Данная заявка говорит об увеличении концентрации серотонина путем уменьшения обратного захвата пресинаптическими рецепторами.
Сущность изобретения
Соответственно, настоящее изобретение относится к способу устранения болезненного состояния, выбранного из группы, содержащей гиперкортизолемию, головную боль и нейропатическую боль или любую комбинацию этих состояний, указанный способ включает введение фармацевтически эффективного количества композиции, содержащей азиатикозид и мадекассосид, необязательно в сочетании, по меньшей мере, с одним эксципентом, нуждающемуся в этом субъекту.
Подробное описание изобретения
Настоящее описание относится к способу лечения болезненного состояния, выбранного из группы, содержащей гиперкортизолемию, головную боль и нейропатическую боль или любую комбинацию этих состояний, при этом указанный способ включает введение фармацевтически эффективного количества композиции, содержащей азиатикозид и мадекассосид, необязательно в сочетании, по меньшей мере, с одним эксципиентом, нуждающемуся в этом субъекту.
В одном варианте осуществления настоящего описания азиатикозид находится в концентрации в пределах приблизительно от 15% до 50% и мадекассосид находится в концентрации в пределах приблизительно от 20% до 50%.
В другом варианте осуществления настоящего описания композицию получают из растения Centella Asiatica.
В следующем варианте осуществления настоящего описания состояние гиперкортизолемии представляет собой синдром Кушинга.
В еще одном варианте осуществления настоящего описания состояние головной боли выбирают из группы, содержащей мигрень, головную боль напряжения и кластерную головную боль или любую их комбинацию.
В еще одном варианте осуществления настоящего описания композиция вводится в дозе в пределах приблизительно от 1 мг/кг до 100 мг/кг веса тела в день.
В еще одном варианте осуществления настоящего описания субъект является животным или человеком.
В еще одном варианте осуществления настоящего описания эксципиент выбирают из группы, содержащей гранулирующие вещества, связывающие вещества, смазывающие вещества, разрыхлители, подсластители, скользящие вещества, антиадгезивы, антистатические вещества, поверхностно-активные вещества, антиоксиданты, камеди, покровные вещества, окрашивающие вещества, вкусовые добавки, пластифицирующие добавки, консерванты, суспендирующие вещества, эмульгаторы, растительный целлюлозный материал и средства для сферонизации или любые их комбинации.
В еще одном варианте осуществления настоящего описания композиция заключена в состав лекарственных форм, выбранных из группы, содержащей таблетки, пастилки, леденцы, водную или масляную суспензии, мазь, пластырь, гель, лосьон, зубную пасту, капсулу, эмульсию, кремы, спрей, капли, дисперсные порошки или гранулы, эмульсию в твердых или мягких желатиновых капсулах, сиропы, эликсиры, фитоцевтические средства, нутрицевтические средства и продукты питания или любые их комбинации.
В другом варианте осуществления настоящего описания композиция опосредует ноцицепцию, сужение кровеносных сосудов и изменение секреции нейростероидов.
В еще одном варианте осуществления настоящего описания композиция селективно связывается с 5-НТ1А рецептором.
В еще одном варианте осуществления настоящего описания композиция вводится в диапазоне доз 1-100 мг/кг у животных и 1-50 мг/кг у людей в день.
В еще одном варианте осуществления настоящего описания процесс приготовления композиции содержащей азиатикозид и мадекассосид, содержит следующие стадии:
a. получение экстракта из растения Centella asiatica;
b. фильтрование и концентрирование экстракта;
c. растворение концентрированного экстракта в растворителе для получения раствора;
d. обработка раствора растворителями для удаления жировых веществ,
e. хлорофилла и других окрашивающих веществ;
f. пропускание обработанного раствора через адсорбенты для получения чистого раствора; и
g. концентрирование чистого раствора для получения композиции.
В еще одном варианте осуществления настоящего описания растворитель выбирают из группы, содержащей гетероциклические ароматические соединения, алифатические соединения, кетоны, спирты, нитрилы, сложные эфиры, простой эфир и смеси одного или более из них.
В еще одном варианте осуществления настоящего описания растворитель, используемый для экстракции, предпочтительно является алифатическим спиртом.
В еще одном варианте осуществления настоящего описания экстракция проводится при температуре в диапазоне от 20°C до 38°C, предпочтительно при 30°C.
В другом варианте осуществления настоящего описания экстракция проводится в течение от 6 до 10 часов, предпочтительно в течение 8 часов.
В еще одном варианте осуществления настоящего описания концентрирование проводится при температуре в диапазоне от 40°C до 50°C, предпочтительно при 45°C.
В следующем варианте осуществления настоящего описания растворитель предпочтительно является деионизированной водой.
В еще одном варианте осуществления настоящего описания растворитель выбирают из группы, содержащей гексан, петролейный эфир и метилизобутилкетон.
В еще одном варианте осуществления настоящего описания адсорбент выбирают из группы, содержащей смолу, активированный уголь, силикагель и их смесь.
В еще одном варианте осуществления настоящего описания концентрирование проводится при температуре в диапазоне от 50°C до 65°C.
Настоящее описание также относится к производству лекарственного средства, содержащего азиатикозид и мадекассосид, необязательно в сочетании с эксципиентами, для применения при синдроме Кушинга, мигрени, нейропатической боли и миалгии.
В еще одном варианте осуществления настоящего описания эксципиенты выбирают из группы, содержащей гранулирующие вещества, связывающие вещества, смазывающие вещества, разрыхлители, подсластители, скользящие вещества, антиадгезивы, антистатические вещества, поверхностно-активные вещества, антиоксиданты, камеди, покровные вещества, окрашивающие вещества, вкусовые добавки, пластифицирующие добавки, консерванты, суспендирующие агенты, эмульгаторы, средства для сферонизации и растительный целлюлозный материал.
В еще одном варианте осуществления настоящего описания указанная композиция заключена в состав различных лекарственных форм, выбранных из группы, содержащей таблетки, пастилки, леденцы, водные или масляные суспензии, мазь, пластырь, гель, лосьон, зубную пасту, капсулу, эмульсию, кремы, спрей, капли, дисперсные пудры или гранулы, эмульсию в твердых или мягких желатиновых капсулах, сиропы, эликсиры, линимент, мазь, трансдермальный пластырь, назальный спрей, фитоцевтические средства, нутрицевтические средства и продукты питания.
В другом варианте осуществления настоящего описания подразумевается, что в композицию могут входить небольшие доли целлюлозного материала из семян Centella asiatica.
Кроме того, описание тщательно разработано при помощи следующих примеров. Однако эти примеры не следует истолковывать как ограничивающие рамки описания.
Пример 1
1 килограмм надземной части, содержащей преимущественно листья и стебли, растения Centella asiatica, собирали в чистом и сухом виде, и измельчали до размера, обеспечивающего 100% прохождение через молотковую дробилку с размером ячейки сита 20. Это вещество многократно экстрагировали 5 литрами этилового спирта в противоточном экстракторе с неподвижным слоем на протяжении 10 часов при 30°C. Через 10 часов экстракт фильтровали для очистки от всех находящихся во взвешенном состоянии веществ. Чистый фильтрат концентрировали до полужидкого при 40 в роторном испарителе под вакуумом. К концентрированной массе добавили 3 литра деионизированной воды для получения гомогенной жидкости. Жидкость дважды экстрагировали путем промывания 2 литрами гексана и отделяли нижний водный слой. Водный слой снова дважды экстрагировали 1 литром метилизобутилкетона. Нижний водный слой отделяли и пропускали через слой адсорбирующей смолы Amberlite XAD1180 (400 мл), поддерживая скорость потока 25 мл в минуту и контролировали отсутствие centella saponins в выходящем потоке.
Колонку тщательно промывали 5 литрами (в избытке) деминерализованной воды до обесцвечивания смывов. Адсорбенты колонки элюировали этиловым спиртом до тех пор, пока TLC-анализ не показал отсутствие centello saponins в элюате. Получаемый в результате элюат пропускали через колонку, содержащую 100 грамм активированного угля и 250 грамм силикагеля с размером от 60 до 120 меш. Получаемые в результате элюаты собирали, колонку тщательно промывали этиловым спиртом и все смывы объединяли с элюатом и концентрировали на установке для вакуумной перегонки при 45-50 до получения порошка. Этот порошок растворяли в 300 мл деминерализованной воды до получения прозрачной жидкости с содержанием твердого вещества 20% и сушили распылением в распылительной сушке с параллельным непрямым потоком горячего воздуха в следующих условиях: температура на входе 140°C и температура на выходе 80°C. Методом HPLC был получен выход, составивший 30 г бледно-желтого водорастворимого порошка с составом 41% азиатикозида и 36% мадекассосида.
Пример 2
1 килограмм надземной части, содержащей преимущественно листья и стебли растения Centella asiatica, собирали в чистом и сухом виде, и измельчали до размера, обеспечивающего 100% прохождение через молотковую дробилку с размером ячейки сита 20 меш. Это вещество многократно экстрагировали 5 литрами метилового спирта в противоточном экстракторе с неподвижным слоем на протяжении 8 часов при 30°C. Через 8 часов экстракт фильтровали для очистки от всех находящихся во взвешенном состоянии веществ. Чистый фильтрат концентрировали до полужидкого при 40 в роторном испарителе под вакуумом. К концентрированной массе добавляли 3 литра деионизированной воды для получения гомогенной жидкости. Жидкость дважды экстрагировали путем промывания 2 литрами гексана и отделяли нижний водный слой. Водный слой снова дважды экстрагировали 1 литром метилизобутилкетона. Нижний водный слой отделяли и пропускали через слой адсорбирующей смолы Amberlite XAD1180 (400 мл), поддерживая скорость потока 25 мл в минуту и контролировали отсутствие centella saponins в выходящем потоке.
Колонку тщательно промывали 5 литрами (в избытке) деминерализованной воды до обесцвечивания смывов. Адсорбенты колонки элюировали этиловым спиртом до тех пор, пока TLC-анализ не показал отсутствие centello saponins в элюате. Получаемый в результате элюат пропускали через колонку, содержащую 100 грамм активированного угля и 250 грамм силикагеля размера от 60 до 120 меш. Получаемые в результате элюаты собирали, колонку тщательно промывали изопропиловым спиртом и все смывы объединяли с элюатом и концентрировали на установке для вакуумной перегонки при 45-50 до получения порошка. Этот порошок растворяли в 300 мл деминерализованной воды до получения прозрачной жидкости с содержанием твердого вещества 20% и сушили распылением в распылительной сушке с параллельным непрямым потоком горячего воздуха в следующих условиях: температура на входе 140°C и температура на выходе 80°C. Методом HPLC был получен выход, составивший 32 г бледно-желтого водорастворимого порошка с составом 39% азиатикозида и 34% мадекассосида.
Пример 3
10 г 41% азиатикозида и 36% мадекассосида из примера 1 смешивали с 1 г азиатикозида с чистотой 99% для получения композиции, содержащей 11 г (46,3% азиатикозида и 32,7% мадекассосида). Этот пример показывает способ достижения желаемого состава композиции, содержащей 15-50% азиатикозида и 20-15% мадекассосида, путем смешивания разных композиций, имеющих различные концентрации азиатикозида и мадекассосида. Специалисту в данной области техники должно быть ясно, что полученная в этом описании композиция может быть получена путем смешивания компонентов, азиатикозида и мадекассосида, доступных в результате экстракции из растительных источников или получаемых путем химического синтеза указанных компонентов.
Тестовая композиция, содержащая 15-50% азиатикозида и 20-50% мадекассосида, была в дальнейшем исследована на физиологическую активность в следующих примерах.
Пример 4. Исследование активности тестовой композиции у крыс с удаленными обонятельными луковицами
Билатеральная эктомия обонятельных луковиц (ОВХ) представляет собой животную модель хронической депрессии, которая демонстрирует ключевую роль гипоталамо-гипофизарно-надпочечниковой (НРА) оси в поддержании гомеостаза. ОВХ вызывает нарушение НРА оси и приводит к поведенческим и физиологическим изменениям, являющимся признаком хронической депрессии у животных. После наступления восстановления после хирургической операции ОВХ-животные демонстрируют резкое увеличение веса тела. Это увеличение массы сопровождалось другими характерными физиологическими изменениями, такими как увеличенное потребление пищи, возникновение депрессии, повышенные концентрация натрия и уровни кортизола. Эти симптомы оказались связанными с синдромом Кушинга. Интересно отметить, что ОВХ модель имитирует состояние при синдроме Кушинга.
Синдром Кушинга связан с состояниями избыточного веса, резистентности к инсулину, депрессии, увеличенного потребления пищи и увеличенной секреции кортизола. Для изучения активности тестовой композиции, содержащей 39% азиатикозида и 34% мадекассосида, мы использовали животную модель крыс с билатеральной эктомией обонятельных луковиц (ОВХ), которая воспроизводит все вышеупомянутые симптомы, наблюдаемые при синдроме Кушинга.
Методика. Самцов крыс линии Wistar обезболивали кетамином (80 мг/кг) и хирургическим путем удаляли обонятельные луковицы с помощью затупленной иглы для подкожных инъекций, присоединенной к водяному насосу, без повреждения лобных долей. Животным давали возможность восстановиться после операции в течение 2 недель. Постоянное лечение тестовой композицией проводилось в течение 14 дней. Поведенческий тест проводили, помещая животных в открытое пространство, и наблюдали, подсчитывая число передвижений, подъемов на задние лапы и «чисток» в течение 5 минут. Показатель передвижений оценивали как среднее число квадратов, пересеченных за 3 минуты. Показателем подъемов на задние лапы было количество подъемов на задние лапы за 3 минуты. Показатель «чисток» оценивали как число «чисток» за 3 минуты. В последний день лечения брали кровь для измерения сывороточного кортикостерона. Кортикостерон является основным глюкокортикоидом, обнаруживаемым у грызунов, и является эквивалентом гормона кортизола, обнаруживаемого у человека.
Результаты. ОВХ-животные демонстрировали увеличение веса тела на 21,28% по сравнению с нормальным приростом массы на 7,.9%, наблюдаемым в контрольной ложно-оперированной группе. Тестовая композиция достоверно подавляла вызванное ОВХ увеличение веса тела на 12%; 16,88% и 18,56% в дозах 3, 10 и 30 мг/кг.

Потребление пищи контролировали у всех подопытных животных в течение 14 дней восстановления после операции. У животных в ОВХ-контрольной группе наблюдалось увеличение потребления пищи на 36% по сравнению с ложнооперированной контрольной группой. Лечение тестовой композицией в дозах 10 и 30 мг/кг в течение 14 дней достоверно нормализовало потребление пищи.

Тест «открытое поле» проводили для оценки локомоторной активности животных. ОВХ- животные проявляли гиперактивность, подтверждающую депрессию. Повышенный показатель передвижений указывает на тревожность депрессированного животного, находящегося в новом окружении. Тестовая композиция достоверно уменьшала эту гиперактивность на 30,3%; 51,2% и 64,7% в дозах 3, 10 и 30 мг/кг.

У ОВХ контрольных животных наблюдалась повышенная секреция кортикостерона в крови. У животных, леченых тестовой композицией во всех дозах, уровни кортикостерона в крови достоверно снизились. ОВХ вызывало увеличение концентрации натрия в сыворотке, которое было достоверно снижено при использовании тестовой композиции в дозах 10 и 30 мг/кг. Также наблюдалось снижение уровня сахара в крови.

Исследование показало эффективность тестовой композиции, продемонстрированную на крысах с удаленными обонятельными луковицами, для лечения состояний синдрома Кушинга, а именно увеличения веса, депрессии, повышенного потребления пищи, повышенной секреции кортизола и увеличения сывороточного натрия, вызванных эндогенными факторами. Следовательно, тестовая композиция является эффективной при лечении и контролировании течения синдрома Кушинга и всех других состояний гиперкортизолизма.
Пациенты, страдающие от депрессии, испытывают тяжелую мышечную боль или миалгию. Это может быть связано с увеличенной секрецией кортизола, которая в свою очередь, воздействует на экспрессию регулирующих боль 5-НТ1А рецепторов. Продемонстрирована возможность использования тестовой композиции для увеличения переносимости боли, и, следовательно, ее эффективность для лечения и контроля за течением миалгии и других состояний неврологической боли, путем уменьшения уровней кортикостерона у ОВХ крыс.
Пример 5. Действие в комбинации с антагонистом 5-НТ1А рецепторов
Активность тестовой композиции оценивали путем предварительного блокирования 5-НТ1А рецепторов антагонистом с последующей обработкой тестовой композицией. Активность измеряли по показателю времени неподвижности подопытных животных при проведении теста принудительного плавания.
Методика. Самцов мышей Swiss albino весом 25-30 г обрабатывали 1 мг/кг (р.о.) антагониста 5-НТ1А рецепторов (NAN-190) с последующим введением 10 мг/кг (р.о.) или 30 мг/кг (р.о.) тестовой композиции. Через один час после обработки животных проводили тест принудительного плавания и измеряли время неподвижности. Использованное временное ограничение составляло 360 сек.
Результаты. У животных, обработанных только тестовой композицией, в тесте принудительного плавания наблюдалось достоверное уменьшение времени неподвижности по сравнению с нормальными контрольными животными. Уменьшение времени неподвижности составляло приблизительно 24,87% у животных, обработанных 10 мг/кг тестовой композиции, и 30,14% у животных, обработанных 30 мг/кг тестовой композиции. Блокирование 5-НТ1А рецепторов антагонистом отменяло активность тестовой композиции, указывая на то, что действие тестовой композиции опосредовано 5-НТ1А рецепторами.

Пример 6. Действие тестовой композиции при вызванной нитроглицерином повышенной болевой чувствительности у крыс
Этот пример оценивает потенциальную антимигренозную активность тестовой композиции вследствие повышения болевой переносимости. Нитроглицерин вызывает повышенную болевую чувствительность у крыс посредством расширения церебральных артерий аналогично мигренозной боли у людей.
Методика. Крыс Wistar обоих полов весом 200-250 г помещали в пластиковые клетки, по меньшей мере, на 10 дней перед тестированием. Повышенную болевую чувствительность оценивали при помощи устройства для отдергивания хвоста (UGO BASILE). Крыс помещали в секцию для отдергивания хвоста таким образом, что хвост закрывал щель над фотоэлементом. Применяли нагрев ИК-излучением, а интенсивность света регулировали так, чтобы получить нормальную реакцию через 8-12 секунд. Во избежание повреждения тканей использовали временное ограничение 20 сек. Когда крыса чувствовала боль и отдергивала свой хвост, на фотоэлемент попадал свет, при этом регистрировалось время. После определения базовых значений, крысам внутрибрюшинно вводили нитроглицерин в дозе 10 мг/кг. Через пятнадцать минут перорально вводили тестовую композицию, содержащую 41% азиатикозида и 36% мадекассозида (30 мг/кг), или пентазоцин (20 мг/кг). Время ответа оценивали через 30, 60, 90, 120, 180 и 240 мин после обработки.

Результаты. Тестовая композиция достоверно отменяла повышенную болевую чувствительность, вызванную введением нитроглицерина, у животных. Начало активности после введения тестовой композиции было незамедлительным. Также, время ответа в группе с тестовой композицией было ближе к таковому у нормальных животных, чем таковое в группе, обработанной наркотическим лекарственным средством пентазоцином, что указывает на облегчение боли без каких-либо седативных побочных эффектов. Это исследование подтверждает, что тестовая композиция пригодна при лечении и в тактике ведения пациентов с мигренью, кластерной головной болью, головной болью напряжения и всеми связанными с этим головными болями.
Пример 7. Действие тестовой композиции у пациентов, страдающих от мигрени
Проспективное исследование по оценке эффективности тестовой композиции против случаев мигренозных атак было проведено на 5 субъектах с диагнозом хронической мигрени. Субъектам давали капсулы тестовой композиции в дозе 300 мг дважды в день в течение 1 месяца, и эффективность тестовой композиции анализировали на основе результатов, отмечаемых пациентами, в начале и конце периода исследования.

После начала введения тестовой композиции субъекты сообщали об уменьшении частоты атак и интенсивности мигренозных головных болей. Субъекты также сообщали о более низкой зависимости от обезболивающих средств. Также было отмечено уменьшение связанных с мигренью симптомов, таких как раздражительность, пониженная переносимость света, запаха, шумов; тошнота, рвота и т.д. Таким образом, тестовая композиция оказалась пригодной для предотвращения и/или облегчения мигрени у испытуемых.
Пример 8. Состав тестовой композиции
Капсулы в примере 7 были приготовлены путем дробления тестовой композиции, содержащей 41% азиатикозида и 36% мадекассозида, смешивания с 1,5% вес/вес микрокристаллической целлюлозы, 1% вес/вес разрыхлителя прежелатинизированного крахмала, 0,5% вес/вес кросповидона и 0,5% вес/вес антиадгезива стеарата магния. Смешанным гранулятом заполняли капсулы.
Аналогичный состав тестовой композиции в диапазоне 15-50% азиатикозида и 20-50% мадекассозида может быть изготовлен путем добавления эксципиентов, выбранных из списка, содержащего следующее: гранулирующие вещества, связывающие вещества, смазывающие вещества, разрыхлители, подсластители, окрашивающие вещества, вкусовые добавки, покровные вещества, пластифицирующие добавки, консерванты, суспендирующие агенты, эмульгаторы, средства для сферонизации и любые их комбинации. Причем тип композиции может быть выбран из группы, включающей таблетки, капсулы, пастилки, леденцы, порошок, сироп, раствор, аэрозоль, суспензию, дисперсные порошки или гранулы, эмульсию в твердых или мягких желатиновых капсулах, сиропы, эликсиры, линимент, мазь, трансдермальный пластырь, фитоцевтические средства, нутрицевтические средства и продукты питания. В зависимости от способа введения могут использоваться различные эксципиенты/носители. Специалист в данной области техники может выбрать подходящий состав тестовой композиции для лечения и ведения пациентов с гиперкортизолемией (синдромом Кушинга), мигренью, нейропатической болью, миалгией и связанными с этим болями.
Пример 9. Действие тестовой композиции на нейропатическую боль у животных
Для оценки терапевтических возможностей тестовой композиции для лечения нейропатической боли использовали модель нейропатической боли у крыс с пережиманием седалищного нерва (SNCI). SNCI модель обеспечивает частичную денервацию, что позволяет анализировать болевое поведение, вызванное стимуляцией нерва-мишени в задней лапе.
Методика. Самцам крыс Wistar весом 220-250 г проводили анестезию при помощи кетамина (80 мг/кг) и в стерильных условиях обнажали правый седалищный нерв высоко на уровне бедра. «Спинку» нерва освобождали от окружающих соединительных тканей и при помощи пинцета для радужной оболочки фиксировали нерв на месте путем сдавливания эпиневрия на его дорсальной стороне. Нерв дважды пережимали с использованием тупоконечного пинцета в течение 30 сек с интервалом 60 сек. Животным давали восстановиться после операции. На 2 день после операции вводили тестовую композицию, содержащую 41% азиатикозида и 36% мадекассозида, в дозах 10, 30 и 100 мг/кг (р.о.) и продолжали введение до 30 дней. Оценивали следующие параметры:
a) Тест Рэндэлла-Селитто - к правой задней лапе прикладывали увеличивающееся механическое давление, и давление, при котором крыса отдергивала лапу, отмечали как пороговое болевое давление.

b) Нити Фон Фрея - механо-тактильную аллодинию оценивали прикладыванием силы с использованием жестких нейлоновых нитей диаметром 1 мм к середине подошвенной поверхности правой задней лапы. Проворное отдергивание правой задней конечности считали положительным ответом и регистрировали силу, с которой крыса отдергивала свою лапу.

c) Тест с погружением хвоста - Тепловую чувствительность позвоночника оценивали путем погружения концевой части хвоста крысы на холод в диапазоне 0-4°C и измерения продолжительности рефлекса отдергивания хвоста. Использованное временное ограничение составляло 15 сек.

d) Тест на двигательную координацию - Двигательную координацию оценивали при помощи устройства «вращающийся стержень». Крыс помещали на 1 мин на вращающийся стержень. Время до падения с валика регистрировали как силу захвата.
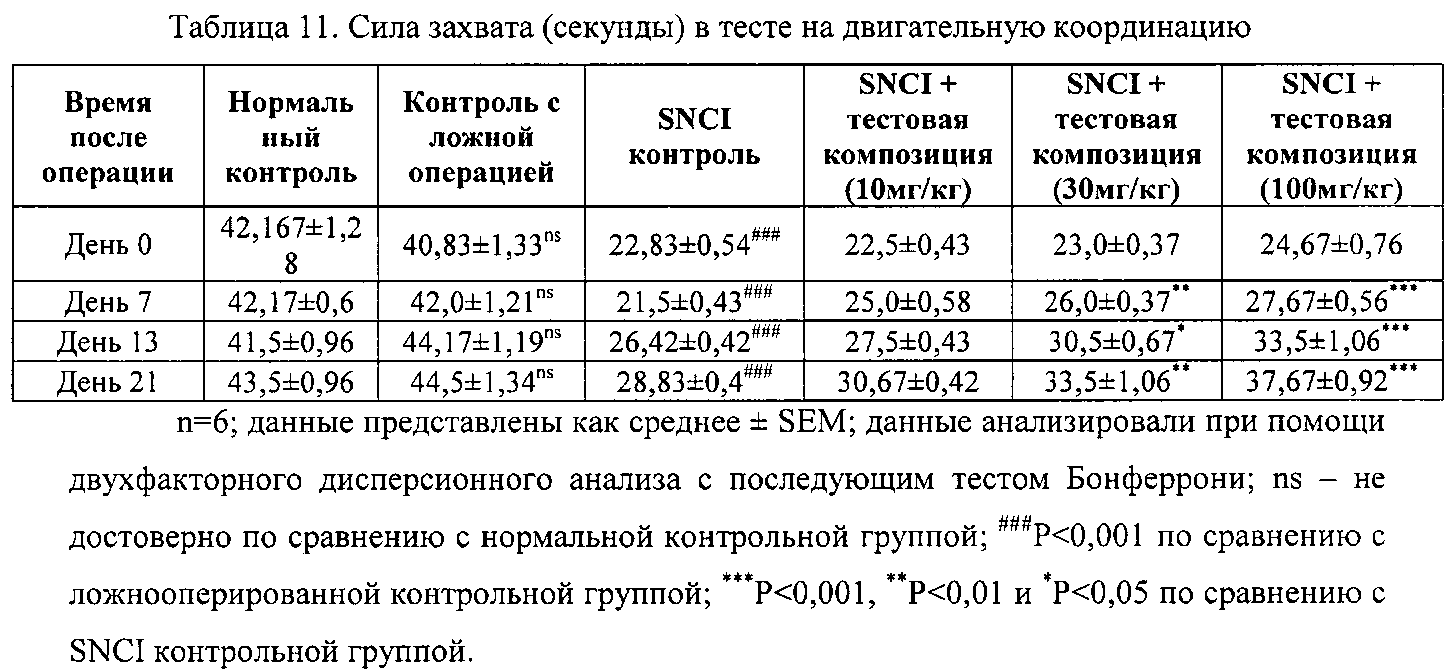
Результаты. Тестовая композиция достоверно снижала симптомы нейропатической боли, вызванные пережиманием седалищного нерва у крыс. При постоянном лечении тестовой композицией наблюдалось достоверное снижение повышенной болевой чувствительности, аллодинии и термочувствительности поврежденной конечности. Тестовая композиция также нормализовала двигательную координацию травмированных животных, как видно из теста с вращающимся стержнем. Таким образом, тестовая композиция является пригодной при лечении пациентов с нейропатической болью и ее симптомами при постоянном использовании.
Пример 10. Действие тестовой композиции у пациентов, страдающих от нейропатической боли
Проспективное исследование по оценке эффективности тестовой композиции при регулировании нейропатической боли было проведено на 3 пациентах старше 50 лет, страдающих от диабета в течение 3-5 лет. Пациентам назначали капсулы тестовой композиции, составленной как в примере 8, в дозе 300 мг дважды в день в течение 2 месяцев, а эффективность тестовой композиции анализировали на основе результатов, отмечаемых пациентами, в начале и конце периода исследования.

После начала введения тестовой композиции субъекты сообщали об уменьшении частоты атак внезапной боли. Сообщалось об уменьшении интенсивности чувства жжения, пощипывания, онемения и боли, вызванной такими сигналами, как прикосновение, холодная/горячая водяная баня, воздействие света и т.д. Тестовая композиция оказалась пригодной для контроля над нейропатической болью у субъектов.
Пример 11. Состав назального спрея тестовой композиции
55 мг тестовой композиции, содержащей 46,8% азиатикозида и 31,8% мадекассозида, растворяли в 140 мл физиологического раствора (0,09% вес/об NaCl). К этому добавляли 10 мг бензалконий хлорида и перемешивали в течение 1 ч. Эту смесь стерилизовали, фильтровали через фильтр 0,4 микрон и заполняли флаконы для назального спрея. Одно впрыскивание назального спрея доставляет 140 мкл состава, что эквивалентно 55 мкг тестовой композиции.
Пример 12. Действие назального спрея при вызванной нитроглицерином повышенной болевой чувствительности у крыс
Этот пример оценивает потенциальную активность тестовой композиции, заключенной в состав назального спрея. Нитроглицерин вызывает повышенную болевую чувствительность у крыс посредством расширения церебральных артерий аналогично мигренозной боли у людей.
Методика. Крыс Wistar обоих полов весом 200-250 г помещали в пластиковые клетки, по меньшей мере, на 10 дней перед тестированием. Повышенную болевую чувствительность оценивали при помощи устройства для отдергивания хвоста (UGO BASILE). Крыс помещали в секцию для отдергивания хвоста таким образом, что хвост закрывал щель над фотоэлементом. Применяли нагрев ИК-излучением, а интенсивность света регулировали так, чтобы получить нормальную реакцию через 8-12 секунд. Во избежание повреждения тканей использовали временное ограничение 20 сек. Когда крыса чувствовала боль и отдергивала свой хвост, на фотоэлемент попадал свет, при этом регистрировалось время. После определения базовых значений, крысам внутрибрюшинно вводили нитроглицерин в дозе 10 мг/кг. Через пятнадцать минут тестовую композицию, созданную в примере 11, распыляли в носовую полость. Время ответа оценивали через 30, 60, 90, 120, 180 и 240 мин после обработки.
Таблица 13. Действие тестовой композиции в виде назального спрея при вызванной нитроглицерином гиперальгезии у крыс

Результаты. Тестовая композиция, заключенная в состав назального спрея, достоверно отменяла болевую чувствительность, вызванную нитроглицерином. Начало активности тестовой композиции было незамедлительным аналогично оральной обработке, показанной в примере 6. Доза, необходимая для достижения этого эффекта с использованием назального спрея, также была весьма низкой, что демонстрирует улучшенную доставку тестовой композиции назальным способом. Это исследование подтверждает, что тестовая композиция, заключенная в состав назального спрея, является безопасной и эффективной для контролирования боли. Таким образом, тестовая композиция, заключенная в состав назального спрея, пригодна при лечении и ведении пациентов с гиперкортизолемией (синдром Кушинга), мигренью, нейропатической болью, миалгией и связанными с этим болями.
Пример 13. Образование комплексов тестовой композиции с циклодекстрином
Этот пример показывает, что тестовая композиция может образовывать комплексы с циклодекстринами, а именно α, β и γ-циклодекстринами, для увеличения стабильности тестовой композиции по отношению к желудочному или кишечному соку.
К 200 мл деминерализованной воды добавляли 50 грамм β-циклодекстрина при перемешивании при 80-85°C до получения прозрачной жидкости. К этому медленно добавляли 40 грамм тестовой композиции, содержащей 46,8% азиатикозида и 31,8% мадекассозида, порциями в течение 1 ч при перемешивании при 85°C. Полное растворение смеси с образованием прозрачной жидкости являлось крайне важным, после чего раствор держали при 85-90°C в течение 3 ч при перемешивании. Через 3 часа раствору дали возможность медленно охладиться при комнатной температуре, а затем перемешивали в течение следующих 8 ч. Раствор фильтровали и высушивали под вакуумом при 75°C до постоянного веса. Выход составил 73 грамма. 100 мг этого комплекса растворяли в 7 мл деминерализованной воды.
Реферат
Изобретение относится к медицине и может быть использовано для лечения болезненного состояния, выбранного из группы, включающей гиперкортизолемию, головную боль и нейропатическую боль или любую комбинацию этих состояний. Для этого вводят фармацевтически эффективное количество композиции, содержащей азиатикозид и мадекассозид, нуждающемуся в этом субъекту. Изобретение позволяет лечить пациентов с гиперкортизолемией, головной болью и нейропатической болью при постоянном использовании. 9 з.п. ф-лы, 13 табл., 13 пр.

Комментарии