Производные пиразола или их фармацевтически приемлемые кислотно-аддитивные соли - RU2059622C1
Код документа: RU2059622C1
Чертежи

Описание
Изобретение относится к новым производным пиразола и их фармацевтически приемлемым солям.
В частности, оно касается новых производных пиразола и их фармацевтически приемлемых солей, которые обладают противовоспалительным, обезболивающим и противотромботическим действием, к способам их получения, к фармацевтической композиции, содержащей такие производные и соли, и к способам их терапевтического применения в лечении и/или профилактике воспалительных состояний, различных болей, коллагенезов, аутоиммунных заболеваний, различных болезней иммунитета и тромбозов у людей или животных, а боле конкретно к способам лечения и/или профилактики воспаления и боли в суставах и мышцах (например, ревматоидного артрита, ревматоидного спондилита, остеоартрита, падагрического артрита и т.д.), воспалительного состояния кожи (например, солнечного ожога, экземы и т.д.), воспалительного состояния глаз (например, конъюнктивита и т.д.), нарушения деятельности легких, при котором имеет место воспаление (например, астмы, бронхита, болезни любителей голубей, астматического бронхита сельскохозяйственных рабочих и т.д.), состояния желудочно-кишечного тракта, связанного с воспалением (например, афтоидной язвы, болезни Крона, атрофического гастрита, вариоларной формы гастрита, язвенного колита, истощающих поносов маленьких детей, регинарного илеита, синдрома раздражения кишечника и т.д.), воспаления десен, воспаления, боли и опухания после операции или ранения, лихорадочного состояния, боли и других состояний, связанных с воспалением, в частности тех, при которых продукты липоксигеназы и циклооксигеназы являются пpизнаком системной красной волчанки, склеродермии, полимиозита, нодозного периартериита, ревматического полиартрита, синдрома Шегрена, болезни Бесета, тиреоидита, диабета типа I, нефротического синдрома, апластической анемии, злокачественной миастении, увеита, контактного дерматита, псориаза, болезни Кавасаки, саркоидоза, болезни Ходжкина и т. п. Кроме того, установлено, что предлагаемое соединение полезно для применения в качестве лечебного и/или профилактического средства для сердечно-сосудистых заболеваний или сосудистых заболеваний головного мозга, заболеваний, вызванных гипергликемией и гиперлипемией.
Одной из целей изобретения является создание новых полезных производных пиразола и их фармацевтически приемлемых солей, которые обладали бы противовоспалительным, обезболивающим и противотромботическим действием.
Другой целью изобретения является создание фармацевтической композиции, содержащей в качестве активного ингредиента упомянутые производные пиразола и их фармацевтически приемлемые соли.
И еще одной целью изобретения является создание терапевтического способа лечения и/или профилактики воспалительных состояний, различных болей и других, упомянутых болезней путем применения упомянутых производных пиразола и их фармацевтически приемлемых солей.
Известны уже некоторые производные пиразола, обладающие противовоспалительным и обезболивающим действием, такие, как описаны, например, в описании к патенту Канады N 1 130 808 и в публикации европейских патентов N 272 704 и 293 220.
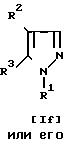
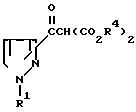
Целевые производные пиразола в соответствии с изобретением являются новыми и могут быть представлены общей формулой I

R2 водород; метил, замещенный амино, низшим алкиламино, галогеном или ацилокси; ацил; ациламино; циано; галоген; низший алкилтио; низший алкилсульфинил; или гетероциклическая группа; и
R3 арил, замещенный низшим алкилом, низшим алкилтио, низшим алкилсульфонилом, галогеном, амино, низшим алкиламино, ациламино, низшим алкил(ацил)амино, низшим алкокси, циано, гидрокси или ацилом; или гетероциклическая группа, которая может быть замещена низшим алкилтио, низшим алкилсульфинилом или низшим алкилсульфонилом, причем, когда R2 карбокси, этерифицированный карбокси или три(гало)метил, то R3 арил, замещенный низшим алкилтио, низшим алкилсульфинилом, амино, низшим алкиламино, ациламино, низшим алкил(ацил)амино, гидрокси или ацилом; или гетероциклическая группа, замещенная низшим алкилтио, низшим алкилсульфинилом или низшим алкилсульфонилом; или R1 арил, замещенный заместителем(ями), выбранным(и) из группы, состоящей из низшего алкилтио, низшего алкилсульфинила, низшего алкилсульфонила, гидрокси, низшего алкилсульфонилокси, нитро, амино, низшего алкиламино, ациламино или низшего алкил(ацил)амино; или гетероциклическая группа; и их фармацевтически приемлемые соли.
Целевое соединение I или его соль можно получить следующими способами.
Способ 1.
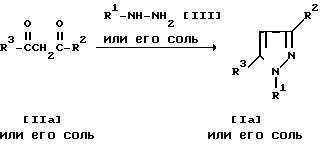

Способ 2
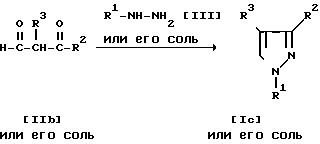

Способ 3
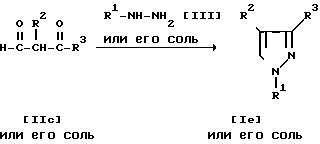

Способ 4
Способ 5
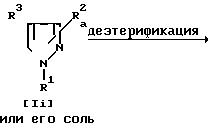
Способ 6
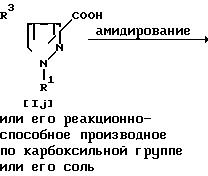
Способ 7

Способ 8
Способ 9

Способ 10
Способ 11



Способ 12
Способ 13
Способ 14
Способ 15

Способ 16
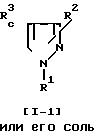
Способ 17
Способ 18
Способ 19
Способ 20

Способ 21
Способ 22
Способ 23
Способ 24

Способ 25
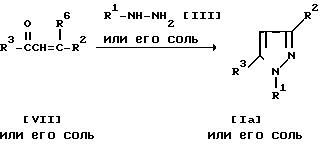
где R1, R2 и R3 каждый в соответствии с данным определением;
R арильная или гетероциклическая группа, каждая из которых замещена низшим алкилтио; R
Ниже дается подробное разъяснение приведенных в предыдущей и последующих частях описания изобретения подходящих примеров различных определений.
Подразумевается, что термин "низший" означает группу, имеющую 1-6 атомов углерода, если не предусмотрено иное.
Подходящим "низшим алкилом" и низшей алкильной частью в терминах "низший алкилтио", "низший алкилсульфонил", "низший алкил(ацил)амино", "низший алкилсульфинил" и "низший алкилсульфонилокси" может быть алкил с прямой или разветвленной цепью, такой, как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил или т.п. причем предпочтительным является метил.
Подходящим "низшим алкокси" могут быть метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси и т.п. причем предпочтительным является метокси.
Подходящим "арилом" могут быть фенил, нафтил и т.п. причем предпочтительным является фенил.
Арильная группа вместо R1 может быть замещена 1-5 заместителями, упомянутыми выше, а арильную группу вместо R3 замещают 1-5 заместителями, указанными выше, причем предпочтительным числом заместителей является число в диапазоне 1-3.
Подходящая "гетероциклическая группа" может представлять собой насыщенную или ненасыщенную, моноциклическую или полициклическую группу, содержащую по крайней мере один гетероатом, такой, как атом азота, атом кислорода или атом серы.
Предпочтительными примерами такой "гетероциклической группы могут служить ненасыщенная 3-8-членная (более предпочтительно 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-4 атома азота, например, пирролил, имидазолил, пиразолил, пиридил, N-оксид пиридила, дигидропиридил, тетрагидропиридил, пиримидил, пиразинил, пиридазинил, триазинил, триазолил, тетразинил, тетразолил и т.д. насыщенная 3-8-членная (более предпочтительно 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-4 атома азота, например, пирролидинил, имидазолидинил, пиперидино, пиперазинил и т.д. ненасыщенная конденсированная гетероциклическая группа, содержащая 1-5 атомов азота, например, индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил и т.д. ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, например, оксазолил, изоксазолил, оксадиазолил и т.д. насыщенная 3-8-челнная гетеромоноциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, например, морфолино, сиднонил и т.д. ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, например, бензоксазолил, бензоксадиазолил и т.д. ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая 1-2 атома серы и 1-3 азота, например, тиазолил, изотиазолил, тиадиазолил и т.д. ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая 1-2 атома серы, например тиенил и т.д. ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота, например, бензотиазолил, бензотиадиазолил и т.д. ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая атом кислорода, например фурил и т.д. ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома серы, например, бензотиенил и т.д. ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома кислорода, например, бензофуранил и т.д. или тому подобное.
Упомянутая "гетероциклическая группа, может быть замещена низшим алкилом в соответствии с приведенными выше примерами, причем предпочтительным является пирролидинил, N-метилпиперазинил, тетразолил, тиенил или пиридил.
Подходящим "цикло(низшим)алкилом" могут быть циклопропил, циклобутил, циклопентил, циклогексил и т.п. причем предпочтительным является циклопропил. Подходящим "галогеном" могут быть фтор, хлор, бром и иод, из которых предпочтительным является фтор. Подходящим "низшим алкиламино(низшим)алкилом" может быть моно- или ди(низший алкил)амино, замещенный низшим алкилом, такой, как метиламинометил, метиламиноэтил, метиламинопропил, метиламиногексил, этиламинометил, этиламиноэтил, этиламинопропил, этиламиногексил, диметиламинометил, диметиламиноэтил, диметиламинопропил, диметиламиногексил, диэтиламинометил, диэтиламиноэтил, диэтиламинопропил, диэтиламиногексил или т. п. Подходящими "низшим алкиламино" и низшей алкилсамоновой частью в термине "низшей алкиламинометил" может быть моно- или ди(низшей)алкиламино, такой, как метиламино, этиламино, диметиламино, диэтиламино или т.п. Подходящим "гало(низшим)алкилом" могут быть хлорметил, фторметил, бромметил, дифторметил, дихлорметил, трифторметил, трихлорметил, 2-фторэтил и т.п.
Подходящими "ацилом" и ацильной частью в терминах "ацилокси", "ациламино", и "низший алкил(ацил)амино" могут быть карбокси; этерифицированный карбокси; карбамоил, необязательно замещенный заместителем(ями), выбранным(и) из группы, состоящей из низшего алкила, цикло(низшего)алкила, арила и гидрокси; низший алканоил, необязательно замещенный низшим алкокси; гетероциклический карбонил; низший алкилсульфонил и т.п.
Этерифицированным карбокси может быть замещенный или незамещенный низший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, гексилоксикарбонил, 2-иодэтоксикарбонил, 2,2,2-трихлорэтоксикарбонл и т. д. ), замещенный или незамещенный арилоксикарбонил (например, феноксикарбонил, 4-нитрофеноксикарбонил, 2-нафтилоксикарбонил, и т. д. ), замещенный или незамещенный ар(низший)алкоксикарбонил (например, бензолоксикарбонил, фенэтилоксикарбонил, бензгидрилоксикарбонил, 4-нитробензилоксикарбонил и т.д.) и т.п.
Низшим алканоилом может быть формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и тому подобное. Гетероциклическая часть в термине "гетероциклический карбонил" может быть такой же, как в примерах для "гетероциклической группы". Подходящим "гетероциклическим карбонилом" может быть N-содержащий гетероциклический карбонил такой, как пирролидинилкарбонил, имидазолидинилкарбонил, пиперидинкарбонил, пиперазинилкарбонил, N-метилпиперазинилкарбонил или т.п. из которых предпочтительным является пирролидинилкарбонил или N-метилпиперазинилкарбонил. Подходящим "низшим алкилсульфонилом" может быть метилсульфонил, этилсульфонил, пропилсульфонил и т.п. причем предпочтительным является метилсульфонил.
Подходящим "низшим алкилсульфинилом" может быть метилсульфинил, этилсульфинил, пропилсульфинил и т.п. причем предпочтительным является метилсульфинил. щенный ар(низший)алкоксикарбонил (например, бензолоксикарбонил, фенэтилоксикарбонил, бензгидрилоксикарбонил, 4-нитробензилоксикарбонил и т.д.) и т.п.
Низшим алканоилом может быть формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и тому подобное. Гетероциклическая часть в термине "гетероциклический карбонил" может быть такой же, как в примерах для "гетероциклической группы". Подходящим "гетероциклическим карбонилом" может быть N-содержащий гетероциклический карбонил такой, как пирролидинилкарбонил, имидазолидинилкарбонил, пиперидинкарбонил, пиперазинилкарбонил, N-метилпиперазинилкарбонил или т.п. из которых предпочтительным является пирролидинилкарбонил или N-метилпиперазинилкарбонил. Подходящим "низшим алкилсульфонилом" может быть метилсульфонил, этилсульфонил, пропилсульфонил и т.п. причем предпочтительным является метилсульфонил.
Подходящим "низшим алкилсульфинилом" может быть метилсульфинил, этилсульфинил, пропилсульфинил и т.п. причем предпочтительным является метилсульфинил.
Подходящими фармацевтически приемлемыми солями целевого соединения I являются обычные нетоксические соли и включают соль присоединения кислоты такую, как соль присоединения неорганической кислоты (например, гидрохлорид, гидробромид, сульфат, фосфат и т.д.), соль присоединения органической кислоты (например, формат, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, толуолсульфонат и т. д. ), соль с аминокислотой (например, аргининовая соль, соль аспаргиновой кислоты, соль глутаминовой кислоты и т.д.), соль металла, такая, как соль щелочного металла (например, соль натрия, соль калия и т.д.) и соль щелочноземельного металла (например, соль кальция, моль магния и т.д.), соль аммония, соль присоединения органического основания (например, соль триметиламина, соль триэтиламина и т.д.) и т.п.
Ниже дано подробное пояснение способов получения целевого соединения I.
Способ 1.
Соединение Ia или его соль и/или соединение Ib или его соль могут быть получены путем осуществления взаимодействия соединения IIa или его соли с соединением III или его солью.
Подходящими солями соединения IIa и соединения III могут быть те же самые, что указаны в качестве примера для соединения I.
Эту реакцию обычно проводят в традиционном растворителе, таком, как спирт (например, метанол, этанол и т.д.), диоксан, тетрагидрофуран, уксусная кислота или любой другой органический растворитель, не оказывающий вредного влияния на реакцию.
Температура реакции не является строго нормируемой и реакцию обычно осуществляют при нагреве.
Способ 2. Соединение Ic или его соль и/или соединение Id или его соль могут быть получены путем осуществления взаимодействия соединения IIb или его соли с соединением III или его солью.
Подходящими солями соединений IIb и III могут быть те же самые соли, что указаны в качестве примера для соединения I.
Реакция может быть проведена, по существу, так же, как в способе I и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обратиться к способу 1.
Способ 3.
Соединение Iе или его соль и/или соединение If или его соль могут быть получены путем осуществления взаимодействия соединения IIc или его соли с соединением III или его солью.
Подходящими солями соединений IIc и III могут быть те же самые соли, что указаны в качестве примера для соединения I.
Эта реакция может быть проведена по существу так же, как в способе 1 и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обратиться к способу 1.
Способ 4.
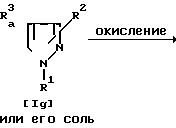
Соединение Ih или его соль можно получить путем осуществления взаимодействия соединения Ig или его соли с окислителем.
Подходящим окислителем могут служить пероксид водорода, реактив Джонса, перкислота (например, перуксусная кислота, пербензойная кислота, метахлорпербензойная кислота и тд.). хромовая кислота, перманганат калия, периодат щелочного металла (например, периодат натрия и т.д.) и т.п.
Эту реакцию обычно проводят в растворителе, не оказывающем на нее вредного влияния, таком, как уксусная кислота, дихлорметан, ацетон, этилацетат, хлороформ, вода, спирт (например, метанол, этанол и т.д.), их смесь или т.п.
Температура реакции не является строго нормируемой, и реакцию обычно проводят при условиях от охлаждения до умеренного нагрева.
При этой реакции в случае, когда в качестве исходного соединения используют соединение Ig, имеющие арил, замещенный низшим алкилтио, вместо R1 и/или низший алкилтио вместо R2, в соответствии с условиями реакции может быть получено соединение I, имеющее арил, замещенный низшим алкилсульфинилом или низшим алкилсульфонилом вместо R1 и/или низший алкилсульфинил или низший алкилсульфонил вместо R2. Эти случаи включены в объем предлагаемой реакции.
Способ 5.
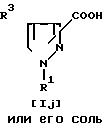
Соединение Ij и его соль могут быть получены путем деэтерификации соединения Ii или его соли.
Реакцию проводят традиционным методом, таким, как гидролиз, восстановление или т.п.
Гидролиз предпочтительно осуществляют в присутствии основания или кислоты, включая кислоту Льюиса. Подходящее основание может включать неорганическое и органическое основания, такие, как щелочной металл (например, натрий, калий и т.д.), щелочноземельный металл (например, магний, кальций и т.д.), их гидроксид, карбонат или бикарбонат, триалкиламин (например, триметиламин, триэтиламин и т.д.), пиколин, 1,5-диазобицикло 4,3,0 нон-5-ен, 1,4-диазабицикло 2,2,2 октан, 1,8-диазабицикло 5,4,0 ундец-7-ен или т.п. Подходящая кислота может включать органическую кислоту (например, муравьиную, уксусную, пропионовую, трихлоруксусную, трифторуксусную и т.д.), неорганическую кислоту (например, хлористоводородную, бромистоводородную, иодистоводородную, серную и т.д.) и кислоту Льюиса (например, трибромид бора и т.д.).
Реакцию обычно проводят в растворителе, таком, как вода, спирт (например, метанол, этанол и т.д.), метиленхлорид, тетрагидрофуран, их смесь или любой другой растворитель, не оказывающий вредного влияния на реакцию. В качестве растворителя можно использовать также жидкое основание или кислоту. Температура реакции не является строго нормируемой, и реакцию обычно проводят при условиях от охлаждения до умеренного нагрева.
Реакция может быть применена предпочтительно для отщепления эфирного фрагмента, такого, как 4-нитробензил, 2-иодэтил, 2,2,2-трихлорэтил или т.п. Метод восстановления, применяемый для реакции отщепления, может включать химическое восстановление и каталитическое восстановление.
Подходящими восстановителями, используемыми в химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т.д.) или металлического соединения (например, хлорида хрома, ацетат хрома и т.д.) и органической или неорганической кислоты (например, муравьиной, уксусной, пропионовой, трифторуксусной, паратолуолсульфокислоты, хлористоводородной, бромистоводородной и т.д.).
Подходящими катализаторами, используемыми в каталитическом восстановлении, являются традиционные катализаторы, такие, как платиновый катализатор (например, платиновая пластина, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.д.), палладиевый катализатор (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на углероде, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.д.), никелевый катализатор (например, восстановленный никель, оксид никеля, никель Ренея и т.д.), кобальтовый катализатор (например, восстановленный кобальт, кобальт Ренея и т.д.), железный катализатор (например, восстановленное железо, железо Ренея и т.д.), медный катализатор (например, восстановленная медь, медь Ренея, медь Уллмана и т.д.) или т.п.
Восстановление обычно осуществляют в растворителе, не оказывающем вредного влияния на реакцию, таком, как вода, спирт (например, метанол, этанол, пропанол и т. д.), N,N-диметилформамид или их смесь. Кроме того, в случае, когда упомянутые кислоты, используемые в химическом восстановлении, находятся в жидком виде, они же могут быть использованы в качестве растворителя. В качестве упомянутого растворителя могут служить также подходящий растворитель, используемый в каталитическом восстановлении, и другие традиционные растворители, такие, как простой диэтиловый эфир, диоксан, тетрагидрофуран и т.д. или их смесь.
Температура реакции восстановления не является строго нормируемой, и реакцию обычно проводят при условиях в пределах от охлаждения до умеренного нагрева.
При этой реакции в случае, когда в качестве исходного соединения используют Ii, имеющее арил, замещенный низшим алкокси, вместо R1, в соответствии с условиями реакции может быть получено соединение Ij. имеющее арил, замещенный гидрокси, вместо R1. Этот случай тоже включен в объем предлагаемой реакции.
Способ 6.
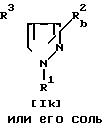
Соединение Ik или его соль можно получить путем осуществления взаимодействия соединения I или его реакционноспособного производного по карбоксильной группе или их соли с амином или формамидом и алкоксидом щелочного металла.
Подходящим "амином" могут быть аммиак, низший алкиламин, ариламин, цикло(низший)алкиламин, низший алкилгидроксиламин, аминокислота, N-содержащее гетероциликлическое соединение и т.п.
Низшим алкиламином может быть моно- или ди(низший)алкиламин, такой, как метиламин, этиламин, пропиламин, изопропиламин, бутиламин, изобутиламин, пентиламин, гексиламин, диметиламин, диэтиламин, дипропиламин, дибутиламин, диизопропиламин, дипентиламин, дигексиламин или т.п. причем предпочтительным является метиламин или диметиламин. Ариламином могут быть анилин, нафтиламин и т. п. Цикло (низшим) алкиламином могут быть циклопропиламин, циклобутиламин, циклопентиламин, циклогексиламин и т.п. причем предпочттельным является циклопропиламин. Низшим алкилгидроксиамином могут быть метилгидроксиламин, этилгидроксиламин, пропилгидроксиламин, бутилгидроксиламин, изопропилгидроксиламин и т.п. причем предпочтительным является метилгидроксиламин. Аминокислотой могут быть глицин, аланин, β -аланин, изолейцин, тирозин и т.п. причем предпочтительным является глицин.
N-содержащим гетероциклическим соединением может быть насыщенное 5 или 6-членное N-, или N- и S-, или N- и О-содержащее гетероциклическое соединение, такое, как пирролидин, имидазолидин, пиперидин, пиперазин, N-(низший)алкилпиперазин (например, N-метилпиперазин, N-этилпиперазин и т.д.), морфолин, тиоморфолин или т.п. из которых предпочтительным является пирролидин или N-метилпиперазин.
Подходящим "алкоксидом щелочного металла" могут быть метоксид натрия, этоксид натрия, трет-бутоксид калия и т.п.
Подходящее реакционноспособное производное по карбоксильной группе соединения Ij может включать сложный эфир, галогенангидрид, ангидрид кислоты и т.п. Подходящими примерами реакционноспособных производных могут быть галогенангидрид (например, хлорангидрид, бромангидрид и т.д.); симметричный ангидрид кислоты; смешанный ангидрид с 1,1'-карбонилдиимидазолом или кислотой, такой, как алифатическая кислота (например, уксусная, триметилуксусная и т. д.), замещенная фосфорная кислота (например, диалкилфосфорная, дифенилфосфорная и т.д.); сложный эфир, такой, как низший алкиловый эфир (например, метиловый, этиловый, пропиловый, гексиловый и т.д.), замещенный или незамещенный ар(низший)алкиловый сложный эфир (например, бензиловый, бензгидриловый, парахлорбензиловый и т.д.), замещенный или незамещенный ариловый эфир (например, фениловый, толиловый, 4-нитрофениловый, 2,4-динитрофениловый, пентахлорфениловый, нафтиловый и т.д.) или сложный эфир с N,N-диметилгидроксиламином, N-гидроксисукцинимидом, N-гидроксифталимидом или 1-гидрокси-6-хлор-1Н-бензотриазолом, или т.п.
Реакцию обычно осуществляют в традиционном растворителе, таком, как вода, ацетон, диоксан, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, формамид, этилацетат, N, N-диметилформамид, пиридин или любой другой органический растворитель, не оказывающий вредного влияния на реакцию. Из указанных растворителей гидрофильные растворители могут быть использованы в смеси с водой.
При использовании соединения Ij в реакции в форме свободной кислоты реакцию предпочтительно осуществляют в присутствии традиционного конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид, N-циклогексил-N-морфолиноэтилкарбоди- имид, N-этил-N'-(3-диметиламинопропил)карбодиимид, тионилхлорид, оксалилхлорид, низший алкоксикарбонилгалогенид (например, этилхлорформиат, изобутилхлорформиат и т. д. ), 1-(парахлорбензолсульфонилокси)-6- хлор-1Н-бензотриазол или т.п. Реакцию предпочтительно осуществляют также в присутствии традиционного основания, такого, как триэтиламин, пиридин, натрийгидроксид или т.п.
Температура реакции не является строго нормируемой, и реакция может быть проведена при условиях в пределах от охлаждения до сильного нагрева.
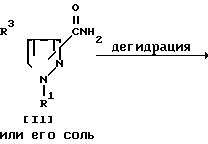
Способ 7.
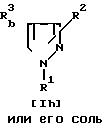
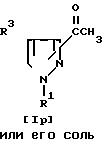
Соединение Im или его соль можно получить путем осуществления взаимодействия соединения Il его соли с дегидратирующим реагентом.
Подходящим дегидратирующим реагентом может быть соединение фосфора (например, пентоксид фосфора, пентахлорид фосфора, оксихлорид фосфора и т.д. ), тионихлорид, ангидрид кислоты (например, уксусный ангидрид и т.д.), фосген, арилсульфонилхлорид (например, бензолсульфонилхлорид, паратолуолсульфонилхлорид и т.д.), метансульфонилхлорид, сульфаминовая кислота, аммонийсульфамат, N, N'-дициклогексилкарбодиимид, низший алкоксикарбонилгалогенид (например, этилхлорформиат и т.д.) и т.п.
Реакцию обычно проводят в традиционном растворителе, таком, как ацетонитрил, метиленхлорид, этиленхлорид, бензол, M,N-диметилформамид, пиридин или любой другой органический растворитель, не оказывающий вредного влияния на реакцию.
Кроме того, если упомянутые дегидратирующие реагенты находятся в жидком виде, они тоже могут быть использованы в качестве растворителя. Температура реакции не является строго нормируемой и реакцию предпочтительно проводят при умеренном или сильном нагреве.
При этом реакции, когда в качестве гидратирующего реагента используют метилсульфонилхлорид, а в качестве исходного соединения используют соединение Il, имеющее арил, замещенный гидрокси, вместо R1и/или арил, замещенный амино, вместо R3, в соответствии с условиями реакции может быть получено соединение Im, имеющее арил, замещенный метилсульфонилокси, вместо R1 и/или арил, замещенный метилсульфониламино, вместо R3. Эти случаи тоже включены в объем предлагаемой реакции.
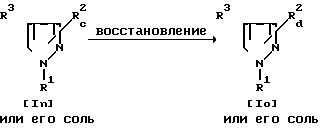
Способ 8.
Соединение Io или его соль могут быть получены путем осуществления взаимодействия соединения In или его соли с восстановителем. Подходящим восстановителем могут быть диборан, литийалюминийгидрид и т.п. Реакцию обычно проводят в традиционном растворителе, таком, как простой диэтиловый эфир, тетрагидрофуран или любой другой органический растворитель, не оказывающий вредного влияния на реакцию.
Температура реакции не является строго нормируемой и реакция может быть проведена при условиях в пределах от охлаждения до сильного нагрева.
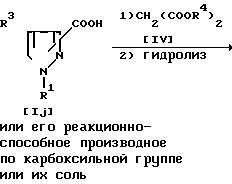
Способ 9. Соединение Ip может быть получено следующим образом.
Сначала осуществляют взаимодействие соединения Ij или его реакционноспособного производного по карбоксильной группе или их соли с соединением IV, а затем полученный продукт заставляет участвовать в реакции гидролиза. Подходящим реакционноспособным производным по карбоксильной группе соединения I могут быть галогенангидрид (например, хлорангидрид, бромангидрид и т.д.) и т.п. На первой стадии реакцию предпочтительно проводят в присутствии основания, такого, как щелочной металл (например, литий, натрий, калий и т.д.), щелочно-земельный металл (например, кальций, магний и т.д.), гидрид щелочного металла (например, натрийгидрид и т.д.), гидрид щелочно-земельного металла (например, кальцийгидрид и т.д.), алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д.), алкоксид щелочноземельного металла (например, метоксид магния, этоксид магния и т.д.) и т.п.
Реакцию обычно осуществляют в растворителе, не оказывающем на нее вредного влияния, таком, как простой диэтиловый эфир, тетрагидрофуран, диоксан и т.п.
Температура реакции не является строго нормируемой и реакцию проводят при условиях от охлаждения до сильного нагрева.
При этой реакции могут быть получены соединения
формулы
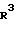
(Iz) или его соль, где R1, R3 и R4 каждый в соответствии с данным определением.
Соединение Iz или его соль затем подвергают гидролизу и получают в результате соединение Ip или его соль.
Гидролиз предпочтительно осуществляют в присутствии кислоты.
Подходящей кислотой могут быть те же самые кислоты, что указаны в качестве примера в вышеупомянутом способе 5.
Режим и условия этой реакции гидролиза могут быть такими же, как в упомянутом способе 5.
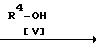
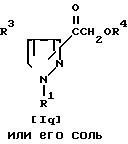
Способ 10.
Соединение Iq или его соль могут быть получены путем осуществления взаимодействия соединения Iр или его соли с соединением (V).
Данную реакцию предпочтительно осуществляют в присутствии соли таллия (III), например нитрата таллия (III) и т.д. и т.п.
Реакцию обычно проводят в растворителе, таком, как диоксан. тетрагидрофуран или любой другой органический растворитель, не оказывающий вредного влияния на реакцию. Температура реакции не является строго нормируемой и реакцию предпочтительно проводят при температуре окружающей среды или при нагреве от умеренного до сильного.
Способ 11.
Соединение Ir или его моль могут быть получены путем осуществления взаимодействия соединения (VIa) или его соли с нитратным соединением. Подходящей солью соединения (VIa) могут быть те же самые соли, что указаны в качестве примера для соединения (I). Подходящим нитритным соединением могут быть нитрит щелочного металла (например, нитрит натрия, нитрит калия и т.д. ), алкилнитрит (например, трет-бутилнитрит и т.д.) и т.п.
Данную реакцию обычно осуществляют в присутствии хлорида меди, (II), фосфорноватистой кислоты и т.п.
Реакцию обычно проводят в растворителе, таком, как диоксан, тетрагидрофуран, ацетонитрил или любой другой органический растворитель, не оказывающий вредного влияния на реакцию.
Температуру реакции не является строго нормируемой, и реакция может быть проведена при условиях в пределах от охлаждения до сильного нагрева.
Реакцию обычно проводят в растворителе, таком, как диоксан, тетрагидрофуран или любой другой органический растворитель, не оказывающий вредного влияния на реакцию. Температура реакции не является строго нормируемой и реакцию предпочтительно проводят при температуре окружающей среды или при нагреве от умеренного до сильного.
Способ 11.
Соединение Ir или его моль могут быть получены путем осуществления взаимодействия соединения (VIa) или его соли с нитратным соединением. Подходящей солью соединения (VIa) могут быть те же самые соли, что указаны в качестве примера для соединения (I). Подходящим нитритным соединением могут быть нитрит щелочного металла (например, нитрит натрия, нитрит калия и т.д. ), алкилнитрит (например, трет-бутилнитрит и т.д.) и т.п.
Данную реакцию обычно осуществляют в присутствии хлорида меди, (II), фосфорноватистой кислоты и т.п.
Реакцию обычно проводят в растворителе, таком, как диоксан, тетрагидрофуран, ацетонитрил или любой другой органический растворитель, не оказывающий вредного влияния на реакцию.
Температура реакции не является строго нормируемой, и реакция может быть проведена при условиях в пределах от охлаждения до сильного нагрева.
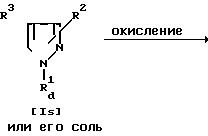
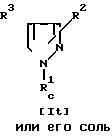
Способ 12.
Соединения It или его соль могут быть получены путем осуществления взаимодействия соединения Is или его соли с окислителем.
Эта реакция может быть осуществлена, по существу, так же, как реакция способа 4, и поэтому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обращаться к способу 4.
При этой реакции в случае, когда в качестве исходного соединения используют соединение Is, имеющее низший алкилтио вместо R2 и/или арил или гетероциклическую группу, каждая из которых замещена низшим алкилтио, вместо R3, в соответствии с условиями реакции может быть получено соединение Is, имеющее низший алкилсульфинил или низший алкилсульфонил вместо R2 и/или арильную или гетероциклическую группу, каждая из которых замещена низшим алкилсульфинилом или низшим алкилсульфонилом, вместо R3. Эти случаи включены в объем данной реакции.
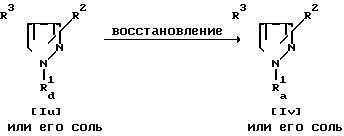
Способ 13.
Соединение Iv или его соль могут быть получены путем восстановления соединения Iu или его соли.
Реакция может включать химическое восстановление и каталитическое восстановление, которые осуществляют традиционным образом.
Подходящими восстановителями, используемыми при химическом восстановлении, являются металл (например, олово, цинк, железо и т.д.), комбинация такого металла и/или металлического соединения (например, хлорида хрома, ацетата хрома и т.д.) с органической или неорганической кислотой (например, муравьиной, уксусной, пропионовой, трифторуксусной, паратолуолсульфокислотой, хлористоводородной, бромистоводородной и т.д.), комбинация такого металла и/или металлического соединения с основанием (например, аммиаком, аммонийхлоридом, натрийгидроксидом и т.д.), металловодородное соединение, такое, как алюминийводородное соединение (например, литийалюминийгидрид, натрийалюминийгидрид, алюминийгидрид, три-трет-бутоксиалюминийгидрид лития и т.д.), бороводородное соединение (например, натрийборогидрид, литийборогидрид, натрийцианборогидрид, тетраметиламмонийборогидрид, боран, диборан и т.д.), соединение фосфора (например, фосфортрихлорид, фосфортрибромид, трифенилфосфин, триэтилфосфин и т.д.) и т.п.
Подходящими катализаторами, используемыми в каталитическом восстановлении, являются традиционные катализаторы, такие, как платиновый катализатор (например, платиновая пластина, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.д.), палладиевый катализатор (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на углероде, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.д.), никелевый катализатор (например, восстановленный никель, оксид никеля, никель Ренея и т.д.), кобальтовый катализатор (например, восстановленный кобальт, кобальт Ренея и т.д.), железный катализатор (например, восстановленное железо, железо Ренея и т.д.), медный катализатор (например, восстановленная медь, медь Ренея, медь Уллмана и т.д.) или т.п.
Восстановление обычно осуществляют в растворителе. Подходящим для использования растворителем может быть вода, спирт (например, метанол, этанол, пропанол и т.д.), ацетонитрил или любой другой традиционный органический растворитель, такой, как простой диэтиловый эфир. диоксан, тетрагидрофуран и т.д. или их смесь.
Температура реакции не является строго нормируемой, и реакцию предпочтительно проводят при нагреве от умеренного до сильного.
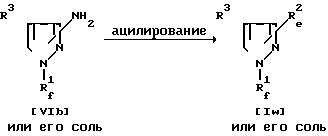
Способ 14.
Соединение Iw может быть получено путем осуществления взаимодействия соединения VIb или его соли с ацилирующим реагентом.
Подходящей солью соединения VIb могут служить те же самые соли, что указаны в качестве примера для соединения (I).
Ацилирующий реагент может включать органическую кислоту, представленную формулой R5-OH, где R5 ацил, такой, как указано выше, или ее реакционноспособное производное.
Подходящим реакционноспособным производным органической кислоты может быть традиционное производное, такое как галогенангидрид (например, хлорангидрид, бромангидрид и т.д.), азид кислоты, ангидрид кислоты, активированный амид, активированный сложный эфир или т.п.
При использовании в качестве ацилирующего реагента свободной кислоты реакцию ацилирования предпочтительно можно проводить в присутствии традиционного конденсирующего средства, такого, как N, N'-дициклогексилкарбодиимид или т.п.
Реакцию обычно осуществляют в традиционном растворителе, таком, как вода, ацетон, диоксан, хлороформ, метиленхлорид, ацетонитрил, этиленхлорид, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин или любой другой органический растворитель, не оказывающий вредного влияния на реакцию, или их смесь. Реакцию также предпочтительно проводят в присутствии традиционного основания, такого, как триэтиламин, пиридин, натрийгидроксид или т.п. Температура реакции не является строго нормируемой, и реакция может быть проведена как при охлаждении, так и при нагреве.
Способ 15.
Соединение Iy или его соль могут быть получены путем осуществления взаимодействия соединения Ix или его соли с алкилирующим реагентом. Подходящим алкилирующим реагентом может быть низший алкилгалогенид (например, метилиодид, этилбромид и т.д.), комбинация карбонильного соединения, такого, как алифатический кетон (например, ацетон, этилметилкетон и т.д.), карбальдегид (например, формальдегид, этанал и т.д.), эфир ортокарбоновой кислоты (например, триэтилортоформиат и т.д.) или т.п. с восстановителем, включающим химические и каталитические восстановители (например, муравьиную кислоту, натрийборогидрид, натрийцианборогидрид, палладий на угле и т.д.).
При использовании в качестве алкилирующего реагента низшего алкилгалогенида реакцию предпочтительно осуществляют в присутствии основания, такого, как щелочной металл (например, натрий, калий и т.д.), щелочноземельный металл (например, магний, кальций и т.д.) или их гидрид, гидроксид, карбонат или бикарбонат. Реакцию обычно проводят в традиционном растворителе, не оказывающем на нее вредного влияния, таком, как вода, диоксан, спирт (например, метанол, этанол и т.д.), ацетонитрил, тетрагидрофуран, N,N-диметилформамид или их смесь. Кроме того, когда упомянутый алкилирующий реагент находится в жидком виде, он тоже может быть использован в качестве растворителя.
Температура реакции не является строго нормируемой, и реакция может быть проведена как при охлаждении, так и при нагреве.
При этой реакции в случае, когда в качестве исходного соединения используют соединение Ix, имеющее аминометил вместо R2 и/или арил, замещенный амино или ациламино, вместо R3, в соответствии с условиями реакции может быть получено соединение Iy, имеющее низший алкиламинометил вместо R2 и/или арил, замещенный низшим алкиламино или низшим алкил(ацил)амино, вместо R3. Эти случаи включены в объем данной реакции.
Способ 16.
Соединение (1-2) или его соль могут быть получены путем осуществления взаимодействия соединения (1-1) или его соли с ацилирующим реагентом. Эта реакция может быть проведена, по существу, так же, как реакция способа 14 и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обращаться к способу 14.
При этой реакции в случае, когда в качестве исходного соединения используют соединение (I-I), имеющее арил, замещенный амино или гидрокси, вместо R1 и/или аминометил вместо R2, в соответствии с условиями реакции может быть получено соединение (1-2), имеющее арил, замещенный ациламино или ацилокси, вместо R1 и/или ациламинометил вместо R2. Эти случаи включены в объем данной реакции.
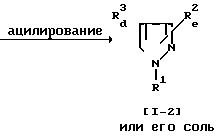
Способ 17.
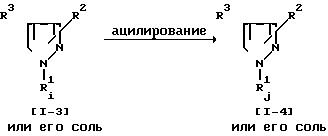
Соединение (1-4) или его соль могут быть получены путем осуществления взаимодействия соединения (1-3) или его соли с ацилирующим реагентом. Реакция может быть осуществлена, по существу, так же, как реакция способа 14 и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обращаться к способу 14.
При этой реакции в случае, когда в качестве исходного соединения используют соединение (1-3), имеющее арил, замещенный амино или гидрокси, вместо R3 и/или аминометил вместо R2, в соответствии с условиями реакции может быть получено соединение (1-4), имеющее арил, замещенный ациламино или ацилокси, вместо R3 и/или ациламинометил вместо R2. Эти случаи включены в объем данной реакции.
Способ 18.
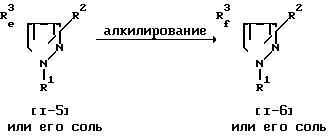
Соединение (1-6) или его соль могут быть получены путем осуществления взаимодействия соединения (1-5) или его соли с алкилирующим реагентом. Эта реакция может быть осуществлена, по существу, так же, как реакция способа 15 и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обращаться к способу 15. При этой реакции в случае, когда в качестве исходного соединения используют соединение (1-5), имеющее аминометил вместо R2 и/или арил, замещенный амино или ациламино, вместо R1, в соответствии с условиями реакции может быть получено соединение (1-6), имеющее низший алкиламинометил вместо R2 и/или арил, замещенный низшим алкиламино или низшим алкил(ацил)амино, вместо R1. Эти случаи включены в объем данной реакции.
Способ 19.
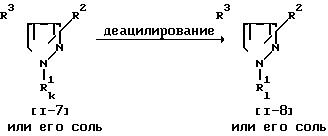
Соединение (1-8) или его соль могут быть получены путем деацилирования соединения (1-7) или его соли. Эта реакция предпочтительно может быть проведена в присутствии неорганической кислоты (например, хлористоводородной, бромистоводородной и т.д.) и органической кислоты (например, трифторуксусной, метансульфокислоты, толуолсульфокислоты и т.д.).
Реакцию обычно осуществляют в традиционном растворителе, таком, как вода, спирт (например, метанол, этанол и т.д.), тетрагидрофуран, диоксан или любой другой органический растворитель, не оказывающий вредного влияния на реакцию, или их смесь. Температура реакции не является строго нормируемой, и реакция может быть проведена и при охлаждении, и при нагреве. При этой реакции в случае, когда в качестве исходного вещества используют вещество (1-7), имеющее арил, замещенный ациламино или низшим алкил(ацил)амино, вместо R3 , в соответствии с условиями реакции может быть получено соединение (1-8), имеющее арил, замещенный амино или низшим алкиламино, вместо R3. Этот случай включен в объем данной реакции.
Способ 20.
Соединение (1-10) или его соль могут быть получены путем деацилирования соединения (1-9) или его соли. Эта реакция может быть осуществлена по существу так же, как реакция способа 19 и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обращаться к способу 19. При этой реакции в случае, когда в качестве исходного соединения используют соединение (1-9), имеющее арил, замещенный ациламино или низшим алкил(ацил)амино, вместо R1, в соответствии с условиями реакции может быть получено соединение (1-10), имеющее арил, замещенный амино или низшим алкиламино, вместо R1. Этот случай включен в объем данной реакции.
Способ 21.
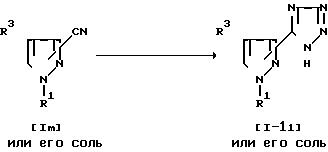
Соединение (1-11) или его соль могут быть получены путем осуществления взаимодействия соединения Im или его соли с азидным соединением. Подходящим азидным соединением может быть азид щелочного металла (например, азид натрия, азид калия и т. д.), азид щелочноземельного металла (например, азид кальция и т.д.), азид водорода и т.п. Реакцию обычно проводят в традиционном растворителе, таком, как тетрагидрофуран, диоксан, N.N-диметилформамид или любой другой органический растворитель, не оказывающий вредного влияния на реакцию. Температура реакции не является строго нормируемой, и реакция может быть проведена при нагреве от умеренного до сильного.
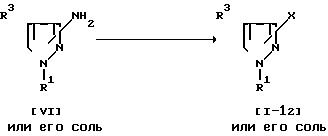
Способ 22.
Соединение (1-12) может быть получено следующим образом.
Сначала осуществляют взаимодействие соединения (VI) или его соли с нитритным соединением, а затем полученный продукт заставляют взаимодействовать с галогенидом меди (I). Подходящей солью соединения (VI) могут быть те же самые соли, что указаны в качестве примера для соединения (I). Подходящим нитритным соединением могут быть нитрит щелочного металла (например, нитрит натрия, нитрит калия и т.д.), алкилнитрит (например, трет-бутилнитрит и т.д. ) и т.п. Подходящим галогенидом меди (I) могут быть хлорид меди (I), бромид меди (I) и т.п.
На первой стадии реакции предпочтительно осуществляют в присутствии кислоты (например, серной кислоты и т.д.).
Реакцию обычно проводят в растворителе, таком, как вода, тетрагидрофуран, диоксан, ацетонитрил или любой другой органический растворитель, не оказывающий вредного влияния на растворитель, или их смесь. Температура реакции не является строго нормируемой и реакция может быть осуществлена при условиях от охлаждения до умеренного нагрева. На второй стадии реакции предпочтительно осуществляют в присутствии галогенида щелочного металла (например, бромида натрия и т.д.) и неорганической кислоты (например, бромистоводородной и т.д.). Реакцию обычно осуществляют в растворителе, таком, как вода, тетрагидрофуран, диоксан или любой другой органический растворитель, не оказывающий вредного влияния на реакцию. Температура реакции не является строго нормируемой, и реакция может быть проведена при нагреве от умеренного до сильного.
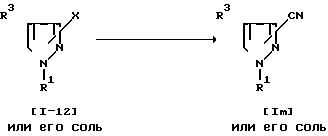
Способ 23.
Соединение Im или его соль могут быть получены путем осуществления взаимодействия соединения (1-12) или его соли с цианидом меди (I).
Реакцию обычно осуществляют в традиционном растворителе, таком, как пиридин, хинолин, N, N-диметилформамид, N-метилпирролидон или любой другой органический растворитель, не оказывающий вредного влияния на реакцию, или без растворителя. Температура реакции не является строго нормируемой, и реакция может быть осуществлена при нагреве от умеренного до сильного.
Способ 24.
Соединение (1-12) или его соль могут быть получены путем осуществления взаимодействия соединения (1-13) или его соли с галогенидом. Реакцию обычно осуществляют в традиционном растворителе, таком, как дихлорметан, хлороформ, тетрахлорметан или любой другой органический растворитель, не оказывающий вредного влияния на реакцию. Температура реакции не является строго нормируемой, и реакция может быть проведена при условиях от охлаждения до умеренного нагрева.
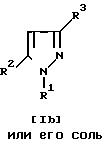
Способ 25.
Соединение Ia или его соль и/или соединение Ib или его соль могут быть получены путем осуществления взаимодействия соединения (VII) или его соли с соединением (III) или его солью. Подходящими солями соединений (III) или (VII) могут быть те же самые соли, что указаны в качестве примера для соединения (I). Эта реакция может быть осуществлена, по существу, так же, как реакция способа 1, и потому в отношении режима и условий (например, растворитель, температура реакции и т.д.) этой реакции следует обращаться к способу 1.
Соединения, полученные указанными способами, могут быть выделены и очищены традиционным методом, таким, как порошкование, перекристаллизация, колоночная хроматография, повторное осаждение или т.п.
Целевое соединение (I) и его фармацевтически приемлемые соли обладают сильным противовоспалительным, обезболивающим и антитромботическим действием и полезны для лечения и/или профилактики воспалительных состояний, различных болей, коллагенезов, аутоиммунных заболеваний, различных болезней иммунитета и тромбозов у людей или животных, а более конкретно пригодны для лечения и/или профилактики воспаления и боли в суставах и мышцах (например, ревматоидного артрита, ревматоидного спондилита, остеоартрита, подагрического артрита и т.д.), воспалительного состояния кожи (например, солнечного ожога, экземы и т.д.), воспалительного состояния глаз (например, конюнктивита и т. д. ), нарушения деятельности легких, при котором имеет место воспаление (например, астмы, бронхита, болезни любителей голубей, астматического бронхита сельскохозяйственных рабочих и т.д.), состояния желудочно-кишечного тракта, связанного с воспалением (например, афтоидной язвы, болезни Крона, атрофического гастрита, вариоларной формы гастрита, язвенного колита, истощающих поносов маленьких детей, регинарного илеита, синдрома раздражения кишечника и т.д.), воспаления десен, воспаления, боли и опухания после операции или ранения, лихорадочного состояния, боли и других состояний, связанных с воспалением, в частности тех, при которых продукты липоксигеназы и циклооксигеназы являются признаком системной красной волчанки, склеродермии, полимиозита, нодозного периартериита, ревматического полиартрита, синдрома Шегрена, болезни Бесета, тиреоидита, диабета типа I, нефротического синдрома, апластической анемии, злокачественной миастении, увеита, контактного дерматита, псориаза, болезни Кавасаки, саркоидоза, болезни Ходжкина и т.п. Кроме того, установлено, что целевое соединение полезно для применения в качестве лечебного и/или профилактического средства для сердечно-сосудистых заболеваний или сосудистых заболеваний мозга, заболеваний, вызванных гипергликемией и гиперлипемией.
Для того, чтобы иллюстрировать полезность целевого соединения (I), ниже приведены данные фармакологических испытаний.
(А) Противовоспалительное действие.
Действие на стимулированный артрит у крыс.
Метод испытания.
Использовали по десять крыс-самок Sprague Dawley на группу. В правую заднюю лапку впрыснули подкожно дозу 0,5 мг туберкулезных палочек Mycobacretium tubereulosis (штамм Aoyama B), взвешенных в 0,05 мл жидкого парафина. Инъекция микробактериального стимулятора вызвала местные воспалительные поражения (первичное поражение), а затем, примерно через 10 дней, вторичные поражения в обеих (инъецированной и неинъецированной) лапках. Разница в объемах обеих лапок до и после инъекции стимулятора была мерой артрита. Лекарство вводили внутрь (перорально) один раз в день в течение 23 дней подряд,начиная с первого дня.
Результаты представлены в табл.1 и 3.
(В) Обезболивающее действие.
Воспалительная гиперальгезия (повышенная болевая чувствительность), вызванная посредством пивных дрожжей у крыс.
Метод испытания.
Использовали по десять крыс-самцов Sptague Dawley на группу. В правую заднюю лапку впрыснули 0,1 мл 5% пивных дрожжей, взвешенных в 0,5% метилцеллюлозе. Через 3 ч после инъекции дрожжей определили болевой порог путем приложения давления к ступне и регистрации давления, при котором крыса отдернула лапку.
Через 2 ч после инъекции дрожжей ввели внутрь лекарство. Порог болевой чувствительности у подвергнутых лечению животных сравнили с болевым порогом у контрольных животных.
Результаты испытания приведены в табл.2.
(С) Противоревматическое действие.
Действие на вызванный коллагеном артрит у мышей.
Метод испытания.
Было использовано по восемь мышей-самцов DBA/1 на группу. Бычий коллаген типа II растворили в 0,1 М уксусной кислоте и эмульгировали в полном стимуляторе Фрейнда (СFA). В мышей ввели внутрикожно у основания хвоста 0,2 мг коллагена типа II в СFA. Через 21 день мышей подвергли контрольному заражению с использованием той же самой процедуры. Начиная с 10 дня после контрольного заражения, вводили внутрь (перорально) лекарство один раз в день в течение 3 недель, причем каждую неделю мышей проверяли на наличие видимых признаков артрита. Был использован индекс артрита для характеристики конечности по степеням 0-3, представляющим опухание и покраснение сустава (степень 1), видимое повреждение сустава (степень 2) и обнаруживаемый анкилоз сустава (степень 3).
Результаты испытания приведены в табл.4.
(D) Противотромботическое действие.
Действие на агрегацию тромбоцитов, вызванную коллагеном.
Метод испытания.
Из человеческой крови приготовили богатую
тромбоцитами плазму (PRP), содержащую 3х108 тромбоцитов на миллилитр. К 245 мкл PRP добавили 5 мкл лекарственного раствора (испытываемые соединения, растворенные в диметилсульфоксиде) и
затем перемешали в течение 2 мин при 37оС. К раствору добавили 5 мкл коллагена (0,5 мкг/мл), служащего в качестве возбудителя агрегации. Агрегацию измерили посредством агрегометра (NKK
НЕМАТRACER 1). Активность ингибиторов (испытываемых соединений) выразили через значения IC50, т.е. дозы, потребные для подавления (ингибирования) реакций агрегации тромбоцитов на 50%
Результаты испытания приведены ниже.
Испытываемое соединение по примеру 6 IC50(M) 5,3 х 10-6
(Е) Влияние на реакцию замедленного типа повышенной
чувствительности на бычий коллаген типа II.
Метод испытания.
Для этого испытания использовали семь мышей-самцов DBA/1. Мышей сенсибилизировали у основания хвоста 125 мкг коллагена типа II, эмульгированного в полном стимуляторе Фрейнда, содержащем Mycobacterium tuberculosis штамм Н37Р ("Wako Pure Chemical Industries Ltd", Осака, Япония). Спустя две недели произвели инъекцию служащей для контрольного заражения дозы 0,04 мл коллагена (2,5 мг/мл) типа II в снабженном фосфатным буфером физиологическим растворе (PBS) в подошвенную область правой задней ноги и 0,04 PBS в левую заднюю ногу. Спустя 24 ч после контрольного заражения, измерили объем обеих задних ног посредством измерителя объема (Muromachi МК-550).
Сразу после сенсибилизации вводили внутрь лекарство каждый день, исключая дни отдыха.
Результаты испытания были выражены в процентах ингибирования по сравнению с контрольным опытом для каждого исследования.
Результаты испытания приведены в табл. 5.
Для терапевтических целей соединение (1) и его фармацевтически приемлемая соль в соответствии с изобретением могут быть использованы в виде фармацевтического препарата, содержащего одно из упомянутых соединений в качестве активного ингредиента в смеси с фармацевтически приемлемым носителем (формообразующим веществом) таким, как органический или неорганический твердый или жидкий эксципиент, пригодный для внутреннего, парентерального или наружного употребления. Фармацевтические препараты могут быть в форме капсул, таблеток, драже, гранул, средства для ингаляции, суппозиториев, раствора, суспензии, эмульсии или т.п. При необходимости в указанные препараты могут быть введены вспомогательные вещества, стабилизаторы, увлажнители или эмульгаторы, буферы и другие широко используемые добавки.
Дозировку соединения (1) изменяют в зависимости от возраста и состояния больного, но средняя разовая доза примерно 0,1, 1, 10, 50, 100, 250, 500 и 1000 мг соединения (1) может быть эффективной для лечения вышеупомянутых болезней. В общем, можно назначать 0,1-1000 мг на человека в день.
С целью иллюстрации настоящего изобретения ниже даны следующие приготовления и примеры.
Приготовление 1.
Смесь 4-(метилтио)ацетофенона (1 г) и натрийгидрида (60% 288 мш) в N, N-диметилформамиде (7 мл) перемешали при температуре окружающей среды в течение 30 мин. Смесь охладили до 0оС и по каплям добавили к ней диэтилоксалат (0,98 мл). Полученную в результате смесь перемешали при температуре окружающей среды в течение 3 ч, вылили в ледяную воду и подкислили разбавленной хлористоводородной кислотой. Осадки отфильтровали, промыли водой и высушили при пониженном давлении, в результате чего получили бледно-коричневый порошок этил-4-4-(метилтио)фенил-2,4-диоксобутатоата (1,6 г).
Сразу после сенсибилизации вводили внутрь лекарство каждый день, исключая дни отдыха.
Результаты испытания были выражены в процентах ингибирования по сравнению с контрольным опытом для каждого исследования.
Результаты испытания приведены в табл. 5.
Для терапевтических целей соединение (1) и его фармацевтически приемлемая соль в соответствии с изобретением могут быть использованы в виде фармацевтического препарата, содержащего одно из упомянутых соединений в качестве активного ингредиента в смеси с фармацевтически приемлемым носителем (формообразующим веществом), таким, как органический или неорганический твердый или жидкий эксципиент, пригодный для внутреннего, парентерального или наружного употребления. Фармацевтические препараты могут быть в форме капсул, таблеток, драже, гранул, средства для ингаляции, суппозиториев, раствора, суспензии, эмульсии или т.п. При необходимости в указанные препараты могут быть введены вспомогательные вещества, стабилизаторы, увлажнители или эмульгаторы, буферы и другие широко используемые добавки.
Дозировку соединения (1) изменяют в зависимости от возраста и состояния больного, но средняя разовая доза примерно 0,1, 1, 10, 50, 100, 250, 500 и 1000 мг соединения (1) может быть эффективной для лечения вышеупомянутых болезней. В общем, можно назначать 0,1-1000 мг на человека в день.
С целью иллюстрации настоящего изобретения ниже даны следующие приготовления и примеры.
Приготовление 1.
Смесь 4-(метилтио)ацетофенона (1 г) и натрийгидрида (60% 288 мг) в N, N-диметилформамиде (7 мл) перемешали при температуре окружающей среды в течение 30 мин. Смесь охладили до 0оС и по каплям добавили к ней диэтилоксалат (0,98 мл). Полученную в результате смесь перемешали при температуре окружающей среды в течение 3 ч, вылили в ледяную воду и подкислили разбавленной хлористоводородной кислотой. Осадки отфильтровали, промыли водой и высушили при пониженном давлении, в результате чего получили бледно-коричневый порошок этил-4-4-(метилтио)фенил-2,4-диоксобутаоата (1,6 г).
Температура плавления: 91-97оС.
ИК-пектр (нуйол): 3420, 1735, 1620, 1595, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,29 (3Н, т. J 7 Гц), 2,54 (3Н, с.), 4,25 (2Н, кв. J7 Гц), 6,78 (1Н, с.), 7,35 (2Н, д. J 8,5 Гц), 7,91 (2Н, д. J 8,5 Гц).
Масс-спектр (m/z): 266 (М+), 193.
Следующие соединения (приготовления от 2-1 до 2-7) были получены аналогичным приготовлению 1 образом.
Приготовление 2.
1) 1-[4-(метилтио)фенил]-4,4,4-трифторбутан-1,3-дион.
Температура плавления: 79-83оС.
ИК-спектр (нуйол): 1590 (шир.), 1490 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,57 (3Н, с.), 7,0 (1Н, с.), 7,42 (2Н, д. J 8,6 Гц), 8,06 (2Н, д. J 8,6 Гц).
Масс-спектр (m/z): 262 (М+).
2) Этил-4-[5-(метилтио)-2-тиенил]-2,4-диоксабутаноат.
Температура плавления: 33-45оС.
ИК-спектр (нуйол): 1730, 1620, 1560, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J 7 Гц), 2,64 (3Н, с.), 4,38 (2Н, кв. J 7 Гц), 6,84 (1Н, с.), 6,95 (1Н, д. J 4 Гц), 7,27 (1Н, с.), 7,63 (1Н, д. J 4 Гц).
Масс-спектр (m/z): 272 (М+).
3) Этил-4-[4-формиламино)фенил]-2, 4-диоксобутаноат.
Температура плавления: 171-174оС (разл.).
ИК-спектр (нуйол): 3300, 1730, 1700, 1600, 1525 см-1.
Масс-спектр (m/z): 263 (М+).
4) Этил-4-(4-ацетилфенил)-2,4-диоксобутаноат.
Температура плавления: 81-82оС.
ИК-спектр (нуйол): 1725, 1690, 1600 см-1.
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J 7 Гц), 2,67 (3Н, с.), 4,42 (2Н, кв. J 7 Гц), 7,11 (1Н, с.), 8,0-8,2 (4Н, м,), 15,13 (1Н, с.).
Масс-спектр (m/z): 262 (М+).
5) Этил-4[3,5-ди(трет-бутил)-4-гидроксифенил]-2,4-диоксобутаноат.
Температура плавления: 128-131оС.
ИК-спектр (нуйол): 3600, 1730, 1630, 1595 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,35 (3Н, т. J 7 Гц), 1,43 (18Н, с.), 4,32 (2Н, кв. J 7 Гц), 6,99 (1Н, с.), 7,74 (2Н, с.).
6) 4-Фтор-1-[4-(метилтио)фенил]бутан-1,3-дион.
Температура плавления: 64-68оС.
ИК-спектр (нуйол): 1675, 1595, 1550 см-1.
ЯМР-спектр (CDCl3, δ): 2,49 (3Н, с.), 4,33 (1Н, с.), 5,11 (1Н, с.), 6,38 (1H, д. J 3 Гц), 7,17 (2Н, д. J9 Гц), 7,74 (2Н, д. J 9 Гц).
7) 4,4-Дифтор-1-[4-(метилтио)фенил]бутан-1,3-дион.
ИК-спектр: 1640, 1595 см-1.
Масс-спектр (m/z): 244 (М+).
Приготовление 3.
Раствор диэтилцианметилфосфоната (5,3 мл) в тетрагидрофуране (10 мл) добавили по каплям к охлажденной льдом смеси натрийгидрида (60% 1,3 г) в тетрагидрофуране (40 мл). Смесь перемешали при 5оС в течение 15 мин. К полученной смеси добавили раствор 4-(метилтио)бензальдегида (5 г) в тетрагидрофуране (10 мл) при 5-10оС. Смесь перемешали при температуре окружающей среды в течение 5 ч, разбавили этилацетатом и промыли водой. Органический слой высушили и сконцентрировали при пониженном давлении. Остаток промыли небольшим количеством диэтилового эфира и высушили, получив в результате бледно-коричневые кристаллы 3-[4-(метилтио)фенил] акрилонитрила (4,7 г).
ИК-спектр (нуйол): 2220, 1615, 1590, 1490 см-1 .
ЯМР-спектр (DMSO-d6, δ): 2,51 (3Н, с.), 6,40 (1Н, д. J 16,7 Гц), 7,2-7,7 (5Н, м.).
Масс-спектр (m/z): 175 (М+).
Приготовление 4.
4-Фторфенилгидразингидрохлорид (4 г) добавили к раствору натрия (1,13 г) в этаноле (50 мл) и смесь грели с обратным холодильником в течение 1 ч. К охлажденной смеси добавили 3,4-(метилтио)фенил акрилонитрил (4,3 г) и полученную в результате смесь нагревали с обратным холодильником в течение ночи. Добавили этилацетат в воду и органический слой отделили, высушили и сконцентрировали. Маслянистый остаток (7,6 г) подвергли очистке путем колоночной хроматографии на силикагеле (76 г), элюируя смесью толуола и этилацетат (2: 1), и в результате получили коричневые кристаллы 4,5-дигидро-1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-амина (5 г).
Температура плавления: 100-110оС.
Масс-спектр (m/z): 301 (М+ ).
Приготовление 5.
Смесь 4,5-дигидро-1-(4-фторфенил)-5-4-(метилтио)фенил пиразол-3-амина (1 г) и оксида (1,16 г) марганца (IV) в дихлорметане (100 мл) перемешали при температуре окружающей среды в течение 2 ч. Нерастворимое вещество отфильтровали, и фильтрат сконцентрировали до сухости. Остаток (1 г) очистили путем колоночной хроматографии на силикагеле (16 г), элюируя смесью хлороформа и этилацетата (5:1), и в результате получили бледно-коричневый порошок 1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-амина (0,64 г).
ИК-спектр (нуйол): 3400, 1600, 1565, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,46 (3Н, с.), 4,97 (2Н, с.), 5,82 (1Н, с.), 7,0-7,3 (8Н, м.).
Масс-спектр (m/z): 299 (М+).
Приготовление 6.
Раствор натрийнитрита (3,6 г) в воде (18 мл) добавили по каплям к охлажденному льдом с солью раствору 4-фтор-2-нитроанилина (7 г) в концентрированной хлористоводородной кислоте (45 мл) в интервале 30 мин. Затем к смеси добавили по каплям раствор дигидрата (28,6 г) двуххлористого олова в концентрированной хлористоводородной кислоте (24 мл) при температуре ниже 5оС в часовом интервале. Осадки собрали путем фильтрации и промыли диэтиловым эфиром, получив в результате кристаллы 4-фтор-2-нитрофенилгидразингидрохлорида (4, 4 г).
Температура плавления: 260оС.
Масс-спектр (m/z): 171 (М+).
Приготовление 7.
Раствор углероддисульфида (4, 6 г) в тетрагидрофуране (60 мл) добавили по каплям к смеси 4-(метилтио)ацетофенона (10 г) и 60%-ного натрийгидрида (4,8 г) в тетрагидрофуране (100 мл) при температуре окружающей среды в часовом интервале. Смесь перемешали при 40оС в течение 2 ч и добавили к ней раствор йодметана (17,1 г) в тетрагидрофуране (60 мл). Полученную смесь перемешали при 40оС в течение 1 ч и при нагреве с обратным холодильником в течение 1 ч. К смеси добавили воду и хлороформ. Органический слой промыли водой, высушили и подвергли упариванию в вакууме. Остаток промыли метанолом и получили в результате кристаллы 1-[4-(метилтио)фенил]-3,3-бис(метилтио)-2-пропен-1-она (10,5 г).
Температура плавления: 119-122оС.
ИК-спектр (нуйол): 1620, 1590, 1550, 1495 см-1.
ЯМР-спектр (CDCl3 δ): 2,52 (3Н, с.), 2,53 (3Н, с.), 2,56 (3Н, с.), 6,74 (1Н, с.), 7,26 (2Н, д. J 7 Гц), 7,83 (2Н, д. J 7 Гц).
Масс-спектр (m/z): 270 (М+).
Приготовление 8.
Смесь этил-4-(4-толил)-2,4-диоксобутаноата (4,7 г) и 4-фторфенилгидразингидрохлорида (3,6 г) в диоксане (35 мл) и этаноле (35 мл) кипятили с обратным холодильником в течение 5 ч. Смесь профильтровали и фильтрат сконцентрировали в вакууме. Маслянистый остаток (8 г) подвергли очистке путем колоночной хроматографии на силикагеле (130 г) с элюированием хлороформом, в результате чего получили масло этил-1-(4-фторфенил)-5-(4-толил)пиразол-3-карбокси- лата (2,7 г).
ИК-спектр (пленка): 1720, 1610, 1510 см-1.
ЯМР-спектр (СDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,31 (3Н, с.), 4,40 (2Н, кв. J 7 Гц), 6,8-7,4 (9Н, м.).
Следующие ниже соединения (приготовления от 9-1 до 9-3) были получены аналогичным приготовлению 8 образом.
Приготовление 9.
1) Этил-1-(4-фторфенил)-5-(4-метоксифенил)пиразол-3-карбоксилат.
Температура плавления: 91-93оС.
ИК-спектр (нуйол): 1715, 1610, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,38 (3Н, т. J7 Гц), 3,81 (3Н, с.), 4,45 (2Н, кв. J 7 Гц), 6,8-7,4 (9Н, м.).
Масс-спектр (m/z): 340 (М+).
2) Этил-1,5-бис(4-метоксифенил)пиразол-3-карбоксилат.
ИК-спектр (пленка): 1730, 1610, 1510 см-1.
3) Этил-5-(4-цианфенил)-1-(4-фторфенил)пиразол-3-карбоксилат.
Температура плавления: 147-148оС.
ИК-спектр (нуйол): 2230, 1735, 1610, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J7 Гц), 4,46 (2Н, кв. J 7 Гц), 7,0-7,8 (9Н, м.),
Масс-спектр (m/z): 335 (М+).
Приготовление 10.
Смесь этил-1-(4-фторфенил)-5-(4-толил)пиразол-3-карбоксилата (2,7 г) и калийгидроксида (1,1 г) в метаноле (40 мл) кипятили с обратным холодильником в течение 30 мин. Растворитель выпарили и остаток растворили в воде и промыли этилацетатом. Водный слой подкислили разбавленной хлористоводородной кислотой и экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали, получив в результате кристаллы 1-(4-фторфенил)-5-(4-толил)пиразол-3-карбоно- вой кислоты (2,1 г).
Температура плавления: 170-173оС.
ИК-спектр (нуйол): 2750, 2600, 1690, 1600, 1510 см-1.
Масс-спектр (m/z): 296 (М+).
П р и м е р 1. Смесь этил-4-[4-(метилтио)фенил]-2, 4-диоксобутаноата (1 г) и 4-фторфенилгидразингидрохлорида (0,67 г) в этаноле (10 мл) и диоксане (10 мл) кипятили с обратным холодильником в течение 5 ч. Растворитель выпарили и остаток растворили в хлороформе и промыли водой. Органический слой высушили над магнийсульфатом и сконцентрировали Остаток (1,6 г) подвергли очистке путем колоночной хроматографии на силикагеле (30 г) с элюированием смесью толуола и этилацетата (20: 1) и получили в результате этил-1-(4-фторфенил)-3-[4-(метилтио)фенил]пиразол-5-карбоксилат (0,11 г).
Температура плавления: 100-104оС.
ИК-спектр (нуйол): 1730, 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 1,29 (3Н, т. J7 Гц), 2,51 (3Н, с.), 4,27 (2Н, кв. J 7 Гц), 7,1-7,9 (9Н, м.).
Масс-спектр (m/z): 356 (М+).
Кроме того, тем же самым растворителем элюировали вторую фракцию, которую сконцентрировали в вакууме, и получили в результате бледно-коричневые кристаллы этил-1-(4-фторфенил)-5-[4-(метилтио)фенил] пиразол-3-карбоксилата (1,1 г).
Температура плавления: 100-102оС.
ИК-спектр (нуйол): 1710, 1600, 1510см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,48 (3Н, с.) 4,45 (2Н, кв. J 7 Гц), 7,0-7,4 (9Н, м.).
Масс-спектр (m/z): 356 (М+).
П р и м е р 2. Раствор этил-1-(4-фторфенил)-5-[4-(метилтил)фенил]пиразол-3-кар- боксилата и раствора (0,79 мл ) пероксида водорода в уксусной кислоте (9,5 мл) перемешали при 70оС в течение 3 ч. Смесь охладили в ледяной водяной бане и осадки отфильтровали и промыли этанолом, по- лучив в результате бесцветные кристаллы этил-1-(4-фторфенил)-5-[4-(метилсульфонил) фенил]пиразол-3-карбоксилата (0,94 г).
Температура плавления: 210-212оС.
ИК-спектр (нуйол): 1715, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,32 (3Н, т. J 7 Гц), 3,25 (3Н, с.), 4,35 (2Н, кв. J 7 Гц), 7,3-7,4 (7Н,м,), 7,92 (2Н, д. J 8,5 Гц).
Масс-спектр (m/z): 338 (М+).
П р и м е р 3. Смесь этил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксилата (4,4 г) и 4 натрийгидроксида (5,7 мл) в тетрагидрофуране (20 мл), этаноле (10 мл) и диоксане (20 мл) перемешали при температуре окружающей среды в течение всей ночи. К смеси добавили воду (50 мл) и подкислили ее хлористоводородной кислотой. Осадок отфильтровали и промыли водой, получив в результате бесцветные кристаллы 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоновую кислоту (4,1 г).
Температура плавления: 232-234оС.
ИК-спектр (нуйол): 1695, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 7,2-7,6 (7Н, м.), 7,92 (2Н, д. J 8,3 Гц), 13,1 (1Н, с.).
Масс-спектр (m/z): 360 (М+).
П р и м е р 4. Смесь 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-кар- боновой кислоты (1,1 г) и фосфорпентахлорида (0,67 г) в толуоле (16 мл) и тетрагидрофуране (9 мл) перемешали при температуре окружающей среды в течение 2 ч. Нерастворимое вещество отфильтровали, и фильтрат сконцентрировали, получив в результате масло 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]-пиразол-3-карбонилхлорида (1,37 г).
МК-спектр (пленка): 1760, 1605, 1510 см-1.
К упомянутому хлорангидриду кислоты добавили смесь 25%-ного водного раствора (2 мл) метиламина, ледяной воды (5 мл) и тетрагидрофурана (10 мл). Смесь перемешивали в течение всей ночи. Осадок отфильтровали, и фильтрат экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали. Остаток (0,21 г) и осадок (0,83 г) объединили и перекристаллизовывали из смеси этилацетата и этанола, получив в результате бесцветные кристаллы 1-(4-фторфенил)-N-метил-5-[4-(метилсульфонил)фенил] пиразол-3-карбоксамида 1,0 г).
Температура плавления: 271-273оС.
ИК-спектр (нуйол): 3400, 1660, 1605, 1550, 1535, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2078 (3Н, д. J 6 Гц), 3,25 (3Н, с.), 7,16 (1Н, с.), 7, 3-7,6 (6Н, м.), 7,91 (2Н, д. J 8,3 Гц), 8,35 (1Н, кв. J 4,6 Гц).
Масс-спектр (m/z): 373 (М+).
Нижеследующие соединения (примеры от 5-1 до 5-12) были получены аналогогичным примеру 4 образом.
П р и м е р 5.
1) 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 215-217оС.
ИК-спектр (нуйол): 3470, 3200, 1680, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с,), 7,16 (1Н, с.), 7,2-7, 6 (7Н, м,), 7,77 (1Н, с.), 7,91 (2Н, д. J 8,5 Гц).
Масс-спектр (m/z): 359 (М+), 341.
2) 1-4-Фторфенил)-N, N-диметил-3-[4-(метилсульфонил)фенил] -пиразол-5- карбоксамид.
Температура плавления: 192-193оС.
ИК-спектр (нуйол): 1640, 1605, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,95 (3Н, с.), 2096 (3Н, с.), 3,27 (3Н, с.), 7,3-8,3 (9Н, м.).
Масс-спектр (m/z): 387 (М+). боновой кислоты (1,1 г) и фосфорпентахлорида (0,67 г) в толуоле (16 мл) и тетрагидрофуране (9 мл) перемешали при температуре окружающей среды в течение 2 ч. Нерастворимое вещество отфильтровали, и фильтрат сконцентрировали, получив в результате масло 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]-пиразол-3-карбонилхлорида (1,37 г).
ИК-спектр (пленка): 1760, 1605, 1510 см-1.
К упомянутому хлорангидриду кислоты добавили смесь 25%-ного водного раствора (2 мл) метиламина, ледяной воды (5 мл) и тетрагидрофурана (10 мл). Смесь перемешивали в течение всей ночи. Осадок отфильтровали, и фильтрат экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали. Остаток (0,21 г) и осадок (0,83 г) объединили и перекристаллизовывали из смеси этилацетата и этанола, получив в результате бесцветные кристаллы 1-(4-фторфенил)-N-метил-5-[4-(метилсульфонил)фенил]пиразол-3-карбок- самида 1,0 г).
Температура плавления: 271-273оС.
ИК-спектр (нуйол): 3400, 1660, 1605, 1550, 1535, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,78 (3Н, д. J 6 Гц), 3,25 (3Н, с.), 7,16 (1Н, с.), 7,3-7,6 (6Н, м.), 7,91 (2Н, д. J 8,3 Гц), 8,35 (1Н, кв. J4,6 Гц).
Масс-спектр (m/z): 373 (М+).
Нижеследующие соединения (примеры от 5-1 до 5-12) были получены аналогогичным примеру 4 образом.
П р и м е р 5.
1) 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 215-217о С.
ИК-спектр (нуйол): 3470, 3200, 1680, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с,), 7,16 (1Н, с.), 7,2-7,6 (7Н, м,), 7,77 (1Н, с.), 7,91 (2Н, д. J 8,5 Гц).
Масс-спектр (m/z): 359 (М+), 341.
2) 1-(4-Фторфенил)-N, N-диметил-3-[4-(метилсульфонил)фенил] -пиразол-5- карбоксамид.
Температура плавления: 192-193оС.
ИК-спектр (нуйол): 1640, 1605, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,95 (3Н, с.), 2096 (3Н, с.), 3,27 (3Н, с.), 7,3-8,3 (9Н, м.).
Масс-спектр (m/z): 387 (М+).
3) 1-(4-Фторфенил)-3-[4-(метилсульфонил)фенил]пиразол-5-карбоксамид.
Температура плавления: 270-271оС.
ИК-спектр (нуйол): 3380, 3200, 1670, 1625, 1605, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,2-8,2 (11Н, м.).
Масс-спектр (m/z): 359 (М+).
4) 5-[3,5-Ди(трет-бутил)-4-гидроксифенил] -1-(4-фторфенил)пиразол-3-карбокса- мид.
Температура плавления: 247-249оС.
ИК-спектр (нуйол): 3650, 3500, 3350, 1660, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,26 (18Н, с.), 6,98 (3Н, с.), 7,2-7,7 (6Н, м).
Масс-спектр (m/z): 409 (М+).
5) N-фенил-1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксамид.
Температура плавления: 200-205оС (разл.).
ИК-спектр (нуйол): 3400, 1680, 1595, 1530, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,46 (3Н, с.), 7,0-7,6 (12Н, м.), 7,83 (2Н, J 8 Гц), 10,19 (1Н, с.).
Масс-спектр (m/z): 409 (М+).
6) 1-(4-Фторфенил)-5-[4-(метилтио)фенил] -3-(1-пирролидинилкарбонил)пиразол.
Температура плавления: 139-140оС.
ИК-спектр (нуйол): 1615, 1515 см-1.
ИК-спектр (CDCl3, δ): 1,8-2,1 (4Н, м.), 2,48 (3Н, с.), 3,70 (2Н, т. J 6 Гц), 3,98 (2Н, т. J6 Гц), 6,9-7,4 (9Н, м.).
Масс-спектр (m/z): 381 (М+).
7) N-Циклопропил-1-(4-фторфенил)-5-[4-(метилтио)фенил] пиразол-3-карбоксамид.
Температура плавления: 147-148оС.
ИК-спектр (нуйол): 3360, 1675, 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 0,6-0,9 (4Н, м.), 2,48 (3Н, с.), 2,8-3,0 (1Н, м. ), 7, 0-7,4 (9Н, м.).
Масс-спектр (m/z): 367 (М+).
8) 1-(4-Фторфенил)-3-(4-метил-1-пиперазинилкарбонил)-5-[4-(метилсульфонил) фенил]пиразол.
Температура плавления: 170-173оС.
ИК-спектр (нуйол): 1620, 1520, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 2,34 (3Н, с.), 2,4-2,6 (4Н, м.), 3,08 (3Н, с.), 3,8-4,2 (4Н, м.), 6,9-7,5 (7Н, м,). 7,91 (2Н, д. J 8 Гц).
Масс-спектр (m/z): 442 (М+).
9) N-Гидрокси-N-метил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил] пиразол-3-карбоксамид.
Температура плавления: 185-188оС (разлож.).
ИК-спектр (нуйол): 3420, 1720, 1645, 1560, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 3,09 (3Н, с.), 3,86 (3Н, с.), 7,0-7,5 (7Н, м.), 7,91 (2Н, д. J 8 Гц).
Масс-спектр (m/z): 389 (М+).
10) N-{1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]-3-пиразолил-карбонил} гли- цин.
Температура плавления: 258-260оС (разлож.).
ИК-спектр (нуйол): 3420, 1720, 1645, 1560, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 3,89 (2Н, д. J 6 Гц), 7,20 (1Н, с.), 7,3-7,6 (6Н, м.), 7,92 (2Н, д. J 8 Гц), 8,5Л (1Н, т. J6 Гц).
Масс-спектр (m/z): 417 (М+).
11) N-Метил-1-[4-(N-формилметиламино)фенил]-5-[4-(метилсульфонил) фенил] пиразол-3-карбоксамид.
ИК-спектр (нуйол): 3350, 1660, 1605, 1550, 1515 см-1.
Масс-спектр (m/z): 412 (М+).
12) N, N-Диметил-1-[4-(N-формилметиламино)фенил] -5-[4-(метилсульфонил) фенил]пиразол-3-карбоксамид.
Масс-спектр (m/z): 426 (М+).
П р и м е р 6. Смесь 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-кар- боксамида (2,7 г) и метансульфонилхлорида (3,4 мл) в пиридине (25 мл) перемешали при 50оС в течение 6 ч. Растворитель выпарили и к остатку добавили этилацетат и воду. Осадок отфильтровали и промыли водой и этилацетатом. Фильтрат отделили и органический слой промыли разбавленной хлористоводородной кислотой, высушили и сконцентрировали досуха. Остаток и первый осадок объединили и перекристаллизовали из смеси этанола и этилацетат, получив в результате бесцветные кристаллы 1-(4-фторфенил)-5-4-(метилсульфонил)фенил пиразол-3-карбонитрила (2,4 г).
Температура плавления: 194-196оС.
ИК-спектр (нуйол): 2240, 1600, 1515см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 7,3-7,6 (7Н, м.), 7,95 (2Н, д. J ) 6,7 Гц).
Масс-спектр (m/z): 341 (М+).
Следующие соединения (примеры от 7-1 до 7-4) были получены аналогичным примеру 3 образом.
П р и м е р 7.
1) 1-(4-Фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоновая кислота.
ИК-спектр (нуйол): 3500, 1695, 1600, 1515 см-1.
2) 1-(4-фторфенил)-3-[4-(метилсульфонил)фенил]пиразол-5-карбоновая кислота.
Температура плавления: 259-260оС (разлож.).
ИК-спектр (нуйол): 1705, 1605, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,3-8,3 99Н, м.).
Масс-спектр (m/z): 360 (М+).
3) 5-[3, 5-Ди(трет-бутил)-4-гидроксифенил] -1-(4-фторфенил)пиразол-3-карбоновая кислота.
Температура плавления: 239-242оС.
ИК-спектр (нуйол): 3550, 1690, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,25 (18Н, с.) 6,96 (2Н, с.), 7,03 (1Н, с.), 7,25-7,45 (4Н, м.).
4) 1-[4-(N-формилметиламино)фенил] -5-4-(метилсульфонил)фенил пиразол-3-карбоновая кислота.
ИК-спектр (нуйол): 1720, 1665, 1605, 1520 см-1.
Масс-спектр (m/z): 399 (М+).
П р и м е р 8. Смесь 1-(4-фторфенил)-5-[4-(метилтио)фенил]-пиразол-3-карбоновой кислоты (3 г) и 1,1-карбонилдиимидазола (1,6 г) в тетрагидрофуране (39 мл) кипятили с обратным холодильником в течение 1 ч. Добавили диметиламингидрохлорид (1,04 г) и калийкарбонат (1,33 г) и полученную смесь перемешивали и кипятили с обратным холодильником в течение 3 ч. Смесь разбавили этилацетатом, промыли последовательно водой, водным раствором натрийбикарбоната, разбавленной хлористоводородной кислотой и водой, высушили и сконцентрировали, получив в результате бледно-коричневое масло 1-(4-фторфенил)-N, N-диметил-5-[4-(метилтио)фенил]пира- зол-3-карбоксамида (2,6 г).
ИК-спектр (пленка): 1620, 1510 см-1.
П р и м е р 9. Смесь 1-(4-фторфенил)-N,N-диметил-5-[4-(метилтио)фенил] пиразол-3- карбоксамида (1 г) и мета-хлорпербензойной кислоты (1,8 г) в дихлорметане (17 мл) перемешивали на протяжении ночи при температуре окружающей среды. Нерастворимое вещество отфильтровали и фильтрат промыли водным раствором натрийбикарбоната, высушили и сконцентрировали до сухости. Остаточное масло (1,4 г) подвергли очистке путем колоночной хроматографии на силикагеле (30 г) с элюированием смесью хлороформа и метанола (20:1). Полученное масло (1,0 г) выкристаллизовали из простого эфира и получили в результате бесцветные кристаллы N,N-диметил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3- карбоксамида (0,69 г).
Температура плавления: 171-173оС.
ИК-спектр (нуйол): 1620, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,02 (3Н, с.), 3,25 (3Н, с.), 3,32 (3Н, с.), 7,08 (1Н, с.), 7,2-8,0 (8Н, м.).
Масс-спектр (m/z): 387 (М+).
П р и м е р 10. Смесь 1-(4-фторфенил)-N,N-диметил-5-[4-(метилтио)фенил] пира- зол-3-карбоксамида (1,6 г) и литийалюминийгидрида (0,34 г) в диэтиловом эфире (8,5 мл) и бензоле (13 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. К смеси добавили по каплям 4н. натрийгидроксид (10 мл), а также добавили этилацетат (20 мл). Нерастворимое вещество отфильтровали и фильтрат отделили. Органический слой промыли водой, высушили и сконцентрировали. Остаток (1,2 г) подвергли очистке путем колоночной хроматографии на силикагеле (30 г) с элюированием смесью этилацетата и метанола (5:1) и в результате получили бледно-коричневое масло 3-(N,N-диметиламинометил)-1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразо- ла 0,69 г).
ИК-спектр (пленка): 2820, 2770, 1600, 1560, 1510 см-1.
Масс-спектр (m/z): 341 (М+), 298.
Нижеследующие соединения (примеры от 11-1 до 11-3) были получены аналогичным примеру 9 образом.
П р и м е р 11.
1) 3-(N,N-Диметиламинометил)-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил] пиразолгидрохлорид.
Температура плавления: 157-160оС (разлож.).
ИК-спектр (нуйол): 3350, 2580, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 3,54 (6н, с.), 4,99 (2Н, с.), 7,07 (1Н, с.), 7,2-8,0 (8Н, м.), 12,9 (1Н, с.).
Масс-спектр (m/z): 373 (М+), 330.
2) Этил-1-(4-фторфенил)-3-[4-(метилсульфонил)фенил]пиразол-5-карбоксилат.
Температура плавления: 203-205оС.
ИК-спектр (нуйол): 1725, 1605, 1515 см-1 .
ЯМР-спектр (DMSO-d6, δ): 1,21 (3Н, т. J 7 Гц), 3,27 (3Н, с.), 4,23 (2Н, кв. J 7 Гц), 7,8-8,3 (9Н, м.).
Масс-спектр (m/z): 388 (М+).
3) 1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]-3-(трифторметил)пиразол.
Температура плавления: 210-212оС.
ИК-спектр (нуйол): 3150, 1605, 1520, 1505 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,3-7,6 (7Н, м.), 7,96 (2Н, д. J 8,3 Гц.
Масс-спектр (m/z): 384 (М+).
П р и м е р 12. Смесь 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-кар- боновой кислоты (6,4 г) и тионилхлорида (30 мл) в тетрагидрофуране (60 мл) кипятили с обратным холодильником в течение 1 часа и сконцентрировали при пониженном давлении, получив в результате 1-(4-фторфенил)-5-4-(метилсульфонил)фенил пиразол-3-карбонилхлорид.
Раствор диэтилмалоната (3,46 г ) и этанола (1,96 мл) в этиловом эфире (19,6 мл) добавили по каплям к перемешиваемой смеси магния (518 мг), этанола (0,785 мл) и четыреххлористого углерода (1,18 мл) в эфире (19, 6 мл) в атмосфере азота. Полученную смесь перемешали при температуре окружающей среды в течение 100 мин и кипятили с обратным холодильником в течение 25 мин. Раствор вышеупомянутого хлорангидрида в тетрагидрофуране (24 мл) добавили порциями к смеси. Смесь перемешали при комнатной температуре в течение 85 мин. и кипятили с обратным холодильником в течение 70 мин. Реакционную смесь вылили в 10% -ную серную кислоту (160 мл) и экстрагировали этилацетатом. Экстракт промыли водой и высушивали над магнийсульфатом. Растворитель выпарили при пониженном давлении и получили в результате 3-бис(этоксикарбонил)ацетил-1-(4-фторфе- нил)-5-[4-(метилсульфонил) фенил]пиразол.
К 3-бис(этоксикарбонил)ацетил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил] пиразолу добавили смесь серной кислоты (3,9 мл), уксусной кислоты (23,6 мл) и воды (19,6 мл). Смесь кипятили с обратным холодильником в течение 5 ч и сконцентрировали. Остаток растворили в этилацетате и раствор промыли водой, высушили и сконцентрировали. Остаток подвергли очистке путем колоночной хроматографии на силикагеле (150 г) с элюированием смесью хлороформа и этилацетат (3:1) и в результате получили бледно-коричневые кристаллы 3-ацетил-1-(4-фторфенил)-5-[4-(метилсульфо- нил)фенил]пиразол (4,2 г).
Температура плавления: 207-209оС.
ИК-спектр (нуйол): 1690, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,57 (3Н, с.) 3,25 (3Н, с.), 7,2-8,0 (9Н, м,).
Масс-спектр (m/z): 358 (М+).
П р и м е р 13. Смесь 3-ацетил-1-(4-фторфенил)-5-[4-метилсульфонил)фенил]пиразо- ла (1,1 г) нитраттригидрата (1,6 г) таллия (III) и хлорной кислоты (70% 3,3 мл) в метаноле (16 мл) и диоксане (8 мл) перемешали при температуре окружающей среды в течение всей ночи. Нерастворимое вещество отфильтровали и фильтрат разбавили хлороформом, промыли водой, высушили и сконцентрировали. Остаток подвергли очистке путем колоночной хроматографии на силикагеле (100 г) с элюированием смесью толуола и этилацетата (2:1) и получили в результате бледно-коричневые кристаллы 1-(4-фторфенил)-3-(метоксиацетил)-5-[4-(ме- тилсульфонил)фенил]пиразола (0,13 г).
Температура плавления: 151-154оС.
ИК-спектр (нуйол): 1705, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 3,39 (3Н, с.), 4,81 (2Н, с,), 7,2-8,0 (9Н, м.).
Следующие ниже соединения (примеры от 14-1 до 14-26) были получены аналогичным примеру 1 образом.
П р и м е р 14.
1) 1-(4-Фторфенил)-5-[4(метилтио)фенил]-3-(трифторметил)пиразол.
ИК-спектр (пленка): 1605, 1515, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 2,48 (3Н, с.), 6,72 (1Н, с.), 7,0-7,4 (8Н, м.).
Масс-спектр (m/z): 352 (М+).
2) Этил-5-[4-)метилтио)фенил] -1-(4-пиридил)пиразол-3-карбоксилат- гидрохлорид.
Температура плавления: 181-186оС.
ИК-спектр (нуйол): 1720, 1630, 1600, 1510 см-1.
ЯМP-спектр (DMSO-d6, δ): 1,34 (3Н, т. J7 Гц), 2,51 (3Н, с.), 4,37 (2Н, кв. J 7 Гц), 7,21 (1Н, с.), 7,33 (4Н, с.), 7, 72 (2Н, л. J5 Гц), 8,85 (2Н, д. J 5 Гц).
Масс-спектр (m/z): 339 (М+).
3) Этил-1-(2-фторфенил)-5-[4-(метилтио)фенил]-3-карбоксилат.
ИК-спектр (пленка): 1725, 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,39 (3Н, т. J=7 Гц), 2,42 (3Н, с.), 4,42 (2Н, кв. J 7 Гц), 6.9-7,6 (9Н, м,).
4) Этил-1-(2,4-дифторфенил)-5-[4-(метилтил/фенил]пиразол-3-карбоксилат.
ИК-спектр (пленка): 1720, 1605, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 1,40 (3Н, т. J 7 Гц), 2,42 (3Н, с.), 4,43 (2Н, кв. J 7 Гц), 6,7-7,8 (8Н, м.).
5) Этил-1-(3-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
ИК-спектр (пленка): 1720, 1605, 1490 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,44 (3Н, с.), 4,42 (2Н, кв. J 7 Гц), 6,9-7,5 (9Н, м,).
6) Этил-5-[4-(метилтио)фенил]-1-фенилпиразол-3-карбоксилат.
ИК-спектр (пленка): 1705, 1600, 1560, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 1,40 (3Н, т. J7 Гц), 2,45 (3Н, с.), 4,42 (2Н, кв. J 7 Гц), 6,9-7,5 (10Н, м.).
7) Этил-1-(4-метоксифенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
ИК-спектр (пленка): 1720, 1605, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2.47 (3Н, с.), 3,86 (3Н, с. ), 4,45 (2Н, кв. J 7 Гц), 6,8-7,4 (9Н, м.).
8) Этил-1-(4-метилфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
ИК-спектр (пленка): 1720, 1605, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,37 (3Н, с.), 2,47 (3Н, с. ), 4,45 (2Н, кв. J 7 Гц). 7,00 (1Н, с.), 7,0-7,4 (8Н, м.).
9) Этил-5-(4-фторфенил)-1-[4-(метилтио)фенил]пиразол-3-карбоксилат.
Температура плавления: 95-96,5оС.
ИК-спектр (нуйол): 1710, 1610, 1545, 1495 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,49 (3Н, с.), 4,45 (2Н, кв. J 7 Гц). 6,9-7,3 (9Н, м.).
Масс-спектр (m/z): 356 (М+).
10) Этил-5-[4-(метилтио)фенил]-1-(4-нитрофенил)пиразол-3-карбоксилат.
Температура плавления: 157-159оС.
ИК-спектр (нуйол): 1695, 1655, 1590, 1510 см-1.
Масс-спектр (m/z): 383 (М+).
11) Этил-1-(4-фторфенил)-5-[5-(метилтио)-2-тиенил]пиразол-3-карбоксилат.
ИК-спектр (пленка); 1720, 1600, 1510 см-1.
ЯМР-спектр (СDCl3, δ): 1,39 (3Н, т. J7 Гц), 2,44 (3Н, с.), 4,42 (2Н, кв. J 7 Гц), 6,6-7,4 (7Н, м.).
12) Этил-1-(4-фторфенил)-5-[4-(формиламино)фенил]пиразол-3-карбоксилат.
Температура плавления: 184-188оС.
ИК-спектр (нуйол): 3300, 1730, 1720, 1690, 1600, 1510 см-1.
Масс-спектр (m/z): 353 (М+).
13) Этил-5-[5-(метилтио)-2-тиенил]-1-(4-нитрофенил)пиразол-3-карбоксилат.
ИК-спектр (пленка): 1725, 1600, 1525, 1500 см-1.
14) Этил-1-(4-нитрофенил)-5-(4-толил)пиразол-3-карбоксилат.
Температура плавления: 147-149оС.
ИК-спектр (нуйол): 1715, 1595, 1525, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J7 Гц), 2,39 (3Н, с.), 4,43 (2Н, кв. J 7 Гц), 6,9-8,3 (9Н, м.).
Масс-спектр (m/z): 351 (М+).
15) Этил-5-(4-метоксифенил)-1-(4-нитрофенил)пиразол-3-карбоксилат.
Температура плавления: 161-162оС.
ИК-спектр (нуйол): 1710, 1615, 1595, 1525, 1500 см-1.
Масс-спектр (m/z): 367 (М+).
16) Этил-5-(4-ацетилфенил)-1-(4-фторфенил)пиразол-3-карбоксилат.
Температура плавления: 220-222оС.
ИК-спектр (нуйол): 1710, 1610, 1510 см-1.
Масс-спектр (m/z): 352 (М+).
17) Этил-5-[3,5-ди(трет-бутил)-4-гидроксифенил] -1-(4-фторенил) пиразол-3-карбоксилат.
Температура плавления: 173-174оС.
ИК-спектр (нуйол): 3550, 1730, 1605, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,25 (18Н, с.), 1,31 (3Н, т. J 8 Гц), 4,32 (2Н, кв. J 8 Гц), 6,96 (2Н, с.), 7,08 (1Н, с.), 7,2-7,5 (4Н, м.).
Масс-спектр (m/z): 438 (М+).
18) Этил-1-(2, 5-дифторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
Температура плавления: 81-84оС.
ИК-спектр (нуйол): 1730, 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J7 Гц), 2,47 (3Н, с.), 4,46 (2Н, кв. J 7 Гц), 7,0-7,4 (8Н, м.).
Масс-спектр (m/z): 374 (М+),
19)
Этил-5-[4-(метилтио)фенил]-1-(2-нитрофенил)пиразол-3-карбоксилат.
Температура плавления: 155-157оС.
ИК-спектр (нуйол): 1715, 1605, 1535 см-1.
ЯМР-спектр (CDCl3, δ): 1,41 (3Н, т. J 7 Гц), 2,45 (3Н, с.), 4,44 (2Н, кв. J 7 Гц), 7,0-8,1 (9Н, м.).
Масс-спектр (m/z): 383 (М+).
20) Этил-1-(4-фтор-2-нитрофенил)-5-[4(метилтио)фенил]пиразол-3-карбоксилат.
ИК-спектр (пленка): 1725, 1590, 1545, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,41 (3Н, т. J7 Гц), 2,46 (3Н, с,), 4,36 (2Н, кв. J 7 Гц), 6,9-8,0 (8Н, м.).
Масс-спектр (m/z): 401 (М+).
21) 5-[4-(Метилтио/фенил]-1-(4-нитрофенил)-3-(трифторметил)пиразол.
Температура плавления: 163-164оС.
ИК-спектр (нуйол): 1600, 1525 см-1.
22) 3-(Фторметил)-1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол.
ИК-спектр (пленка): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2, 44 (3Н, с.), 5,14 (1Н, с.), 5,67 (1Н, с,), 6,53 (1Н, с.), 6,8-7,3 (8Н, м.).
Масс-спектр (m/z): 316 (М+).
23) 3-(Фторметил)-5-[4-(метилтио)фенил]-1-(4-нитрофенил)пиразол.
Температура плавления: 165-167оС.
ИК-спектр (нуйол): 1600, 1520, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 2,50 (3Н, с.), 5,36 (1Н, с.), 5,60 (1Н, с.), 6,64 (1Н, с.), 7,1-8,3 (8Н, м.).
Масс-спектр (m/z): 343 (М+).
24) 3-(Дифторметил)-1-(4-нитрофенил)- -5-[4-(метилтио) фенил]пиразол.
Температура плавления: 124-129оС.
ИК-спектр (нуйол): 1600, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 2,50 (3Н, с.), 6,5-8,5 (10Н, м.).
Масс-спектр (m/z): 361 (М+).
25) 3-(Дифторметил)-1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол.
Температура плавления: 70-71оС.
ИК-спектр (нуйол): 1600, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 2,48 (3Н, с.), 6,7-7,4 (10Н, м.).
Масс-спектр (m/z): 334 (М+).
26) Этил-1-(2-хлорфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
Температура плавления: 119-120оС.
ИК-спектр (нуйол): 1715, 1605 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,45 (3Н, с.), 4,45 (2Н, кв. J 7 Гц), 7,0-7,6 (9Н, м.).
Масс-спектр (m/z): 372 (М+), 344.
Следующие ниже соединения (примеры от 15-1 до 15-29) были получены аналогичным примеру 6 образом.
П р и м е р 15.
1) 1-(4-Фторфенил)-3-[4-(метилсульфонил)фенил]пиразол-5-карбонитрил.
Температура плавления: 200-202оС.
ИК-спектр (нуйол): 2240, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,28 (3Н, с.), 7,4-8,3 (9Н, м.).
Масс-спектр (m/z): 341 (М+).
2) 1-(4-Фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрил.
Температура плавления: 106-107оС.
ИК-спектр (нуйол): 2250, 1600, 1510 см-1.
ЯМР-спектр (СDCl3, δ): 2,48 (3Н, с.), 6,84 (1Н, с.), 7,0-7,4 (8Н, м,).
Масс-спектр (m/z): 309 (М+).
3) 5-[4-Метилсульфонил)фенил]-1-(4-пиридил)пиразол-3-карбонитрил.
Температура плавления: 194-195оС.
ИК-спектр (нуйол): 2250, 1585, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,27 (3Н, с,), 7,3-8,1 (7Н, м,), 8,70 (2Н, д. J 5 Гц).
Масс -спектр (m/z): 324 (М+).
4) 5-[4-(метилтио)фенил]-1-(4-пиридил)пиразол-3-карбонитрилгидрохлорид.
Температура плавления: 185-188оС.
ИК-спектр (нуйол): 2350, 2250, 2120, 2020, 1630, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,50 (3Н, с,), 7,1-7,6 (7Н, м.), 8,75 (2Н, д. J 6 Гц).
Масс-спектр (m/z): 292 (М+).
5) 1-(2-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 147-148оС.
ИК-спектр (нуйол): 2250, 1600, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 3,07 (3Н, с,), 7,00 (1Н, с.), 7,0-8,0 (8Н, м.).
Масс-спектр (m/z): 341 (М+).
6) 1-(2,4-Дифторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 129-130оС.
ИК-спектр (нуйол): 2250, 1610, 1520 см-1 .
ЯМР-спектр (CDCl3, δ): 3,08 (3Н, с.), 6,8-8,0 (8Н, м.)
Масс-спектр (m/z): 359 (М+).
7) 1-(3-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 167-168оС.
ИК-спектр (нуйол): 2250, 1600, 1495 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,2-8,0 (9Н, м.).
Масс-спектр (m/z): 341 (М+).
8) 5-[4-(Метилсульфонил)фенил]-1-фенилпиразол-3-карбонитрил.
Температура плавления: 179-180оС.
ИК-спектр (нуйол): 2250, 1600, 1500 см-1.
ЯМР-спектр (DMSO-d3, δ): 3,25 (3Н, с.), 7,3-8,0 (10Н, м.).
Масс-спектр (m/z): 323 (М+).
9) 1-(4-Метоксифенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 153-154оС.
ИК-спектр (нуйол); 2250, 1600, 1515 см-1 .
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 3,80 (3Н, с.), 7,0-8,0 (9Н, м.).
Масс-спектр (m/z): 353 (М+).
10) 1-(4-Метилфенил)-5-[4(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 210-211оС.
ИК-спектр (нуйол): 2250, 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,41 (3Н, с.), 3,08 (3Н, с.), 6,96, (1Н, с.), 7,1-8,0 (8Н, м.).
11) 5-(4-Фторфенил)-1-[4-(метилтио)фенил]пиразол -3-карбонитрил.
Температура плавления: 82-83оС.
ИК-спектр (нуйол): 2250, 1610, 1545, 1500, см-1.
Масс-спектр (m/z): 309 (М+).
12) 5-[4-(метил)фенил]-1-(4-нитрофенил)пиразол-3-карбонитрил.
Температура плавления: 165-166оС.
ИК-спектр (еуйол): 2250, 1600, 1520, 1480 см-1.
Масс-спектр (m/z): 336 (М+).
13) 1-(4-Фторфенил)-5-[5-(метилтио)-2-тиенил]пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1600, 1510 см-1.
14) 5-[5-(метилтио)-2-тиенил]-1-(4-нитрофенил)пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1600, 1525, 1500 см-1.
15) 1-(4-Фторфенил)-5-[4-(N-формилметиламино)фенил]пиразол-3-карбонитрил.
Температура плавления: 147-148оС.
ИК-спектр (нуйол): 2250, 1675, 1615, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,19 (3Н, с.), 7,2-7,7 (9Н, м,), 8,64 (1Н, с.).
Масс-спектр (m/z): 320.
16) 5-[4-(Ацетамидо)фенил]-1-(4-фторфенил)пиразол-3-карбонитрил.
Температура плавления: 96-98оС.
ИК-спектр (нуйол): 3340, 2250, 1670, 1600, 1535, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,04 (3Н, с.), 7,1-7,6 (9Н, м.), 10,10 (1Н, с. ).
Масс-спектр (m/z): 320 (М+).
17) 1-[4-(N-Формилметиламино)фенил]-5-(4-толил)пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1680, 1610, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,38 (3Н, с.), 3,33 (3Н, с.), 6,8-7,4 (9Н, м.), 8,55 (1Н, с.).
18) 1-(4Фторфенил)-5-(4-метоксифенил)пиразол-3-карбонитрил.
Температура плавления: 122-123оС.
ИК-спектр (нуйол): 2250, 1610, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 3,82 (3Н, с,), 6,8-7,4 (9Н, м.).
Масс-спектр (m/z): 293 (М+).
19) 5-(4-Метоксифенил)-1-(4-нитрофенил)пиразол-3-карбонитрил.
Температура плавления: 125-126оС.
ИК-спектр (нуйол): 2250, 1615, 1520, 1500 см-1.
Масс-спектр (m/z): 320 (М+).
20) 1,5-Бис(4-метоксифенил)пиразол-3-карбонитрил.
Температура плавления: 79-80оС.
ИК-спектр (нуйол): 2250, 1610, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 3,81 (3Н, с.), 3,83 (3Н, с.), 6,7-7,3 (9Н, м.).
Масс-спектр (m/z): 305 (М+).
21) 5-(4-Цианфенил(-1-(4-фторфенил)пиразол-3-карбонитрил.
Температура плавления: 154-156оС.
ИК-спектр (нуйол): 2250, 2230, 1615, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 6,96 (1Н, с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 288 (М+).
22) 5-[3,5-Ди(трет-бутил)-4-гидроксифенил] -1-(4-фторфенил)пиразол-3-карбони- трил.
Температура плавления: 189-190оС.
ИК-спектр (нуйол): 3600, 2250, 1600, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,24 (18Н, с.), 6,96 (2Н, с.). 7,3-7,5 (5Н, м. ).
Масс-спектр (m/z): 391 (М+), 376.
23) 1-(2-Фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрил.
Температура плавления: 76-77оС.
ИК-спектр (нуйол): 2250, 1600, 1505 см-1.
ЯМР-спектр (CDCl3, δ): 2,46 (3Н, с.), 6,87 (1Н, с.), 7,0-7,0 (8Н, м,).
Масс-спектр (m/z): 309 (М+).
24) 1-(2,4-Дифторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрил.
Температура плавления: 74-75оС.
ИК-спектр (нуйол): 2250, 1600, 1520 см-1.
ЯМР-спектр (СDCl3, δ): 2,47 (3Н, с.), 6,8-7,6 (8Н, м,).
Масс-спектр (m/z): 327 (М+).
25) 1-(2,5-Дифторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1625, 1600, 1510 см-1.
26) 1-[4-(N-Формилметиламино)фенил] -5-[4-(метилтио)фенил] пиразол-3-карбони- трил.
Температура плавления: 132-134оС.
ИК-спектр (нуйол): 2250, 1670, 1600, 1515 см-1.
Масс-спектр (m/z): 348 (М+).
27) 5-[4-(Метилтио)фенил]-1-(2-нитрофенил)пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1605, 1535 см-1.
28) 1-(4-Фтор-2-нитрофенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1590, 1510 см-1.
29) 1-(2-Хлорфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрил.
Температура плавления; 124-125оС.
ИК-спектр (нуйол): 2250, 1600 см-1 .
ЯМР-спектр (CDCl3, δ): 2,45 (3Н, с.), 6,88 (1Н, с.), 7,0-7,5 (8Н, м.).
Масс-спектр (m/z): 325 (М+).
П р и м е р 16. Смесь 1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-амина (3 г), хлорида (1,6 г) меди (1,6 г) и трет-бутилнитрита (1,14 г) в ацетонитриле (50 мл) и диоксане (20 мл) перемешали при температуре окружающей среды в течение 4 ч. Нерастворимое вещество отфильтровали и к фильтрату добавили этилацетат и воду. Органический слой отделили, промыли разбавленной хлористоводородной кислотой, высушили и сконцентрировали. Маслянистый остаток подвергли очистке путем колоночной хроматографии на силикагеле (40 г) с элюированием смесью толуола и этилацетата (10:1) и в результате получили коричневое масло (1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразола (1,4 г).
ИК-спектр (пленка): 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 2,48 (3Н, с.), 6,48 (1Н, д. J 1,8 Гц), 6,9-7,4 (8Н, м.), 7,70 (1Н, д. J 1,8 Гц).
Масс-спектр (m/z): 284 (М+).
Следующие ниже соединения (примеры от 17-1 до 17-30) были получены аналогичным примеру 2 образом.
П р и м е р 17.
1) 1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол.
Температуpа плавления: 110-112оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 6,83 (1Н, д. J 1,9 Гц), 7,2-8,0 (9Н, м.).
Масс-спектр (m/z): 316 (М+).
2) 1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 197оС.
ИК-спектр (нуйол): 2240, 1600, 1515 см-1.
3) Этил-5-[4-(метилсульфонил)фенил]-1-(4-пиридил)пиразол-3-карбоксилат.
Температура плавления: 195-199оС.
ИК-спектр (нуйол): 1715, 1585, 1500 cм-1.
ЯМР-спектр (DMSO-d6, δ): 1,33 (3Н, т. J 7 Гц), 3,28 (3Н, с.), 4,37 (2Н, кв. J 7 Гц), 7,2-7,4 (3Н, м.), 7,62 (2Н, д. J 8,5 Гц), 7,97 (2Н, д. J 8,5 Гц), 8,68 (2Н, шир. с.).
Масс-спектр (m/z): 371 (М+).
4) Этил-1-(2-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксилат.
Температура плавления: 165-167оС.
ИК-спектр (нуйол): 1725, 1600, 1500 см-1 .
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J7 Гц), 3,06 (3Н, с.), 4,47 (2Н, кв. J 7 Гц), 7,0-7,9 (9Н, м.).
Масс-спектр (m/z): 388 (М+), 316.
5) Этил-1-(2,4-дифторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбокси- лат.
Температура плавления: 184-185оС.
ИК-спектр (нуйол): 1730, 1605, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 1,40 (3Н, т. J7 Гц), 3,07 (3Н, с.), 4,47 (2Н, кв. J 7 Гц), 6,8-8,0 (8Н, м.),
Масс-спектр (m/z): 406
(М+).
6) Этил-1-(3-фторфенил)-5-[4-(метисульфонил)фенил]пиразол-3-карбоксилат.
Температура плавления: 110-112оС.
ИК-спектр (нуйол): 1720, 1605, 1490 см-1.
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J7 Гц), 3,09 (3Н, с.), 4,47 (2Н, кв. J 7 Гц), 7,0-8,1 (1Н, м.).
Масс-спектр (m/z): 388 (М+).
7) Этил-5-[4-(метилсульфонил)фенил]-1-фенилпиразол-3-карбоксилат.
ИК-спектр (пленка): 1720, 1600, 1500 см-1.
8) Этил-1-(4-метоксифенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксилат.
Температура плавления: 122-125оС.
ИК-спектр (нуйол): 1715, 1610, 1590, 1515 см-1.
Масс-спектр (m/z: 400 (М+).
9) Этил-1-(4-метилфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксилат.
Температура плавления: 149-151оС.
ИК-спектр (нуйол): 1720, 1600, 1520 см-1.
Масс-спектр (m/z): 384 (М+).
10) 5-[4-Метилсульфонил)фенил]-1-(4-нитрофенил)пиразол-3-карбонитрил.
Температура плавления: 199-200оС.
ИК-спектр (нуйол): 2250, 1600, 1530, 1500 см-1.
Масс-спектр (m/z): 368 (М+).
11) 1-(4-Фторфенил)-5-[5-(метилсульфонил)-2-тиенил]пиразол-3-карбонитрил.
Температура плавления: 131-132оС.
ИК-спектр (нуйол): 2250, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ):3,35 (3H, c.), 7,3-7,8 (7H, м.).
Масса-спектр (m/z): 347 (М+).
12) 5-[5-(Метилсульфонил)-2-тиенил] -1-(4-нитрофенил)пиразол-3-карбонитрил.
Температура плавления: 98-106оС.
ИК-спектр (нуйол):2250, 1615, 1595, 1530 см-1.
Масс-спектр (m/z): 374 (М+).
13) 1-(2, 5-Дифторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 139-140оС.
ИК-спектр (нуйол): 2250, 1620, 1605, 1505 см-1 .
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,4-8,0 (8Н, м.).
Масс-спектр (m/z): 359 (М+).
14) 1-[4-(N-Формилметиламино)фенил] -5-[4-(метилсульфонил)фенил] пиразол-3- карбонитрил.
Температура плавления: 170-173оС.
ИК-спектр (нуйол): 2250, 1610, 1520 см-1.
ЯМР-спектр (DMSО-d6, δ): 3,23 (3Н, с.), 3,26 (3Н, с.), 7,4-8,0 (9Н, м.), 8,68 (1Н, с.).
Масс-спектр (m/z): 380 (М+).
15) 5-[4-(Метилсульфонил)фенил]-1-(2-нитрофенил)пиразол-3-карбонитрил.
Температура плавления: 123-125оС.
ИК-спектр (нуйол): 2250, 1605. 1535 см-1.
Масс-спектр (m/z): 368 (М+).
16) 1-(4-Фтор-2-нитрофенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбони- трил.
Температура плавления: 191-193оС.
ИК-спектр (нуйол): 2250, 1600, 1545, 1510 см-1.
Масс-спектр (m/z): 386 (М+).
17) 5-[4-(Метилсульфонил)фенил]-1-(4-нитрофенил)-3-(трифторметил)пиразол.
Температура плавления: 163-164оС.
ИК-спектр (нуйол): 1600, 1535 см-1.
Масс-спектр (m/z): 411 (М+).
18) 3-Бром-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 185-186оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,24 (3Н, с.), 7,03 (1Н, с.). 7,2-8,0 (8Н, м,).
Масс-спектр (m/z): 396, 394.
19) N-Циклопропил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-кар- боксамид.
Температура плавления: 185-186оС.
ИК-спектр (нуйол); 3350, 1660, 1605, 1545, 1535, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 0,6-1,0 (4Н, м.), 2,8-3,0 (1Н, м.), 3,08 (1Н, с.), 7,0-7,5 (8Н, м.), 7,90 (2Н, д. J 8 Гц).
Масс-спектр (m/z): 399 (М+).
20) Этил-5-[4-(метилсульфонил)фенил]-1-[4-нитрофенил]пиразол-3-карбоксилат.
Температура плавления: 209-210оС.
ИК-спектр (нуйол): 1710, 1600, 1525 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,33 (3Н, т. J 7 Гц), 3,26 (3Н, с.), 4,37 (2Н, кв. J 7 Гц), 7,3 (1Н, с.), 7,5-8,4 (8Н, м.).
Масс-спектр (m/z): 415 (М+).
21) 3-(Фторметил)-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 166-167оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 5,35 (1Н, с.), 5,59 (1Н,с.), 6,9-8,0 (8Н, м.).
Масс-спектр (m/z): 348.
22) 1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]-3-пиразолилметилацетат.
Температура плавления: 102-103оС.
ИК-спектр (нуйол): 1740, 1720, 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,14 (3Н, с,), 3,07 (3, с,), 5,10 (2Н, с.), 6,66 (1Н, с.), 7,0-8,0 (8Н, м.).
Масс-спектр (m/z): 388 (М+), 345.
23) 3-(Хлорметил)-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 155-156оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 4,82 (2Н, с.), 6,91 (1Н, с.), 7,2-8,0 (8Н, м.).
Масс-спектр (m/z): 364 (М+ ).
24) 3-(Фторметил)-5-[4-(метилсульфонил)фенил]-1-(4-нитрофенил)пиразол.
Температура плавления: 152-153оС.
ИК-спектр (нуйол): 1600, 1525 см-1.
Масс-спектр (m/z): 375 (М+).
25) 3-(Дифторметил)-1-[4-(метиламино)фенил] -5-4-(метилсульфонил)фенил пиразол.
Температура плавления: 175-176оС.
ИК-спектр (нуйол): 3430, 1615, 1540 см-1.
ЯМР-спектр (CDCl3, δ): 2,72 (3Н, с.), 3,07 (3Н, с.), 3,97 (1Н, с.), 6,5-8,1 (10Н, м.).
Масс-спектр (m/z): 277 (М+).
26) 3-Дифторметил)-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 190-191оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 3,08 (3Н, с.), 6,5-8,0 (10Н, м.).
Масс-спектр (m/z): 366 (М+).
27) 4-Бром-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 169-170оС.
ИК-спектр (нуйол): 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,10 (3Н, с.э, 7,0-98.0 (9Н, м,).
Масс-спектр (m/z): 396, 394.
28) N-фенил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбокса- мид.
Температура плавления: 232-233оС.
ИК-спектр (нуйол): 3350, 1680, 1595, 1535, 1505 см-1.
ЯМР-спектр (DMSP-d6, δ): 3,26 (3Н, с.), 7,0-8,0 (1Н, м.), 10.26 (1Н0 с. ).
Масс-спектр (m/z): 435.
29= 1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]-3-(1-пирролидинил-карбонил/ пиразол.
Температура плавления: 229-230оС.
ИК-спектр (CDCl3, δ): 1,77-2,07 (4Н, м.), 3,00 (3Н, с.), 3,67 (2Н, т. J 6 Гц), 3,97 92Н, т. J 6 Гц), 6,9-7,5 (7Н, м.). 7,87 (2Н, д, J 8 Гц).
Масс-спектр (m/z): 413 (М+).
30) 1-(2-Хлорфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 151-152оС.
ИК-спектр (CDCl3, δ ): 3,05 (3Н, с.), 7,02 (1Н, с.), 7,3-8,0 (8Н, м,).
Масс-спектр (m/z): 357 (М+).
ЯМР-спектр (DMSO-d6, δ): 3,10 (3Н, с.э, 7,0-98.0 (9Н, м, ).
Масс-спектр (m/z): 396, 394.
28) N-фенил-1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбокса- мид.
Температура плавления: 232-233оС.
ИК-спектр (нуйол): 3350, 1680, 1595, 1535, 1505 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,0-8,0 (1Н, м.), 10,26 (1Н, с. ).
Масс-спектр (m/z): 435.
29) 1-(4-Фторфенил)-5-[4-(метилсульфонил)фенил]-3-(1-пирролидинил-карбонил/ пиразол.
Температура плавления: 229-230оС.
ИК-спектр (нуйол): 1615, 1515, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 1,77-2,07 (4Н, м.), 3,00 (3Н, с.), 3,67 (2Н, т. J 6 Гц), 3,97 (2Н, т. J 6 Гц), 6,9-7,5 (7Н, м.). 7,87 (2Н, д, J8 Гц).
Масс-спектр (m/z): 413 (М+).
30) 1-(2-Хлорфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 151-152оС.
ИК-спектр (нуйол):2250, 1610, 1545, 1490 см-1 .
ЯМР-спектр (CDCl3, δ): 3,05 (3Н, с.), 7,02 (1Н, с.), 7,3-8,0 (8Н, м,).
Масс-спектр (m/z): 357 (М+).
П р и м е р 18. Смесь этил-1-(4-фторфенил)-5-[4-(метилтио)фенил] пиразол-3-карбоксилата (3,6 г) и калийгидроксида (2 г) в метаноле (50 мл) кипятили с обратным холодильником в течение 30 мин. Растворитель выпарили. Остаток растворили в воде и промыли хлороформом. Водный слой подкислили разбавленной хлористоводородной кислотой и экстрагировали этилацетатом. Экстракт промыли водой, высушили над магнийсульфатом и сконцентрировали. По- лученный остаток перекристаллизовали из этанола, получив в результате кристаллы 1-(4-фторфенил)-5-[4-(метилтио)фенил]пира- зол-3-карбоновой кислоты (2 г).
Температура плавления: 199-200оС.
ИК-спектр (нуйол): 3550, 3300, 2500, 1710, 1680, 1600, 1515 см-1.
Масс-спектр (m/z): 328 (М+).
Следующие ниже соединения (примеры от 19-1 до 19-11) были получены аналогичным примеру 18 образом.
П р и м е р 19.
1) 5-[4-(метилсульфонил)фенил] -1-(4-пиридин)пиразол-3-карбоновая кислота.
Температура плавления: 270-271оС (разлож.).
ИК-спектр (нуйол): 1690, 1610, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,28 (3Н, с.), 7,2-8,0 (7Н, м.) 8,66 (2Н, шир. с.), 13,25 (1Н, с.).
Масс-спектр (m/z): 343 (М+).
2) 5-[4-(Метилтио)фенил]-1-(4-пиридил/пиразол-3-карбоновая кислота.
Температура плавления: 225-227оС.
ИК-спектр (нуйол): 3400, 2400, 1700, 1600, 1510 см-1.
Масс-спектр (m/z): 311 (М+).
3) 1-(2-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоновая кислота.
Температура плавления: 228-229оС (разлож.).
ИК-спектр (нуйол): 2600, 1700, 1600, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 7,22 (1Н, с.), 7, 3-8,0 (8Н, м.), 13,17 (1Н, с.).
Масс-спектр (m/z): 360 (М+).
4) 1-(2,4-Дифторфенил)-5-[4-(метилсульфонил)фенил] пиразол-3-карбоновая кислота.
Температура плавления: 231-233оС (разлож.).
ИК-спектр (нуйол): 2600, 1700, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ ): 3,25 (3Н, с.), 7,3-8,0 (8Н, м.), 13,20 (1Н, с. ).
Масс-спектр (m/z): 378 (М+).
5) 1-(3-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоновая кислота.
ИК-спектр (нуйол): 2630, 1705, 1600, 1490 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,1-8,0 (9Н, м.).
Масс-спектр (m/z): 360 (М+).
6) 5-[4-(Метилсульфонил)фенил]-1-фенилпиразол-3-карбоновая кислота.
Температура плавления: 203-205оС.
ИК-спектр (нуйол): 2625, 1700, 1600, 1495 см-1.
Масс-спектр (m/z): 342 (М+).
7) 1-(4-Метоксифенил)-5-[4-)метилсульфонил)фенил] пиразол-3-карбоновая кислота.
Температура плавления: 197-199оС.
ИК-спектр (нуйол): 1700, 1600, 1515 см-1.
Масс-спектр (m/z): 372 (М+).
8) 1-(4-Метилфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоновая кислота.
Температура плавления: 185-187оС.
ИК-спектр (нуйол): 2600, 1700, 1600, 1510 см-1.
Масс-спектр (m/z): 356 (М+).
9) 5-(4-Фторфенил)-1-[4-метилтио)фенил]пиразол-3-карбоновая кислота.
Температура плавления: 176-178оС.
ИК-спектр (нуйол):3500, 1680, 1610, 1545, 1490 см-1.
Масс-спектр (m/z): 328 (М+).
10) 5-[4-(Метилтио)фенил]-1-(4-нитрофенил)пиразол-3-карбоновая кислота.
Температура плавления: 188-189оС.
ИК-спектр (нуйол): 1690, 1595, 1520 см-1.
Масс-спектр (m/z): 355 (М+).
11) 1-(2,4-Дифторфенил)-5-[4-(метилтио)фенил] пиразол-3-карбоновая кислота.
Температура плавления: 188-190оС.
ИК-спектр (нуйол): 3300, 2500, 1705, 1680, 1600, 1520 см-1.
Масс-спектр (m/z): 346 (М+).
П р и м е р 20. Смесь этил-1-(4-метоксифенил)-5-[4-(метилсульфонил)фенил] пира- зол-3-карбоксилата (2 г), и йодистоводородной кислоты (57% 5 мл) в уксусной кислоте (10 мл) кипятили с обратным холодильником в течение 5 ч. Реакционную смесь сконцентрировали, и остаток подвергли порошкованию в водном растворе натрийбисульфита, получив в результате порошок. Этот неочищенный порошок подвергли очистке путем колоночной хроматографии на силикагеле (80 г) с элюированием смесью хлороформа и метанола и в результате получили порошок 1-(4-гидроксифенил)-5-[4-(метилсульфонил) фенил]пиразол-3-карбоновой кислоты (0,86 г).
Температура плавления: 233-236оС (разл.).
ИК-спектр (нуйол): 3550, 3250, 1700, 1600, 1515 см-1.
Масс-спектр (m/z): 358 (М+).
П р и м е р 21. Смесь 1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоновой кислоты (13,5 г) и тионилхлорида 910 мл) в дихлорэтане (30 мл) кипятили с обратным холодильником в течение1 часа. Смесь сконцентрировали и в результате получили масло 1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонилхлорида.
ИК-спектр (пленка): 1760, 1605, 1510 см-1.
Раствор упомянутого хлорида в тетрагидрофуране (50 мл) добавили по каплям к смеси 28% -ной аммиачной воды и тетрагидрофуране (50 мл) при 5-10оС. Смесь перемешали в течение 1 ч при температуре окружающей среды. Растворитель выпарили и остаток подвергли порошкованию водой, получив в результате кристаллы 1-(4-фторфенил)-5-[4-(метилтио)фенил] пира- зол-3-карбоксамида (11,2 г).
Температура плавления: 180-181оС.
ИК-спектр (нуйол): 3500, 3425, 1670, 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 2,48 (3Н, с.), 5,70 (1Н, с.), 6,87 (1Н, с.), 7,0-7,4 (9Н, м.).
Масс-спектр (m/z): 327 (М+).
Следующие ниже соединения (примеры от 22-1 до 22-13) были получены аналогичным примеру 21 образом.
П р и м е р 22.
1) 5-[4-(Метилсульфонил)фенил]-1-(4-пиридил)пиразол-3-карбоксамид.
Температура плавления: 286-288оС.
ИК-спектр (нуйол): 3550, 3300, 3200, 1690, 1595, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,28 (3Н, с.), 7,18 (1Н, с.), 7,3-8,0 (8Н, м.), 8,66 (2Н, д. 5 Гц).
2) 5-[4-(метилтио)фенил]-1-(4-пиридил)пиразол-3-карбоксамид.
Температура плавления: 213-215оС.
ИК-спектр (нуйол): 3360, 3150, 1680, 1595 см-1.
3) 1-(2-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 198-199оС.
ИК-спектр (нуйол): 3500, 3150, 1690, 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ)): 3,06 (3Н, с.), 5,68 (1Н, с.), 6,86 (1Н, с.), 7,1-7,9 (9Н, м.).
Масс-спектр (m/z): 359 (М+).
4) 1-(2,4-Дифторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 213-214оС.
ИК-спектр (нуйол): 3440, 3150, 1685, 1610, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 7,23 (1Н, с.), 7,3-8,0 (7Н, м.).
Масс-спектр (m/z): 377 (М+).
5) 1-(3-Фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 217-218оС.
ИК-спектр (нуйол):3460, 3220, 1680, 1600, 1490 см-1.
ЯМР=спектр (DMSO-d6, δ): 3,26 (3Н, с.), 7,1-8,0 (11Н, м.).
Масс-спектр (m/z): 359 (М+).
6) 5-[4-(Метилсульфонил)фенил]-1-фенилпиразол-3-карбоксамид.
Температура плавления: 265-266оС.
ИК-спектр (нуйол): 3475, 3200, 1680, 1600, 1495 см-1.
ЯМР-спектр (DMSO d6, δ): 3,24 (3Н, с.), 7,16 (1Н, с.), 7,3-8,0 (11Н, м. ).
Масс-спектр (m/z): 331 (М+).
7) 1-(4-Метоксифенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 178-179оС.
ИК-спектр (нуйол): 3480, 3310, 3230, 1675, 1590, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,24 (3Н, с.), 3,79 (3Н, с.), 6,9-8,0 (11Н, м. ).
Масс-спектр (m/z): 371 (М+).
8) 1-(4-Гидроксифенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 269-271оС.
ИК-спектр (нуйол): 3550, 3460, 3200, 1680, 1600, 1520 см-1.
Масс-спектр (m/z): 357 (М+).
9) 1-(4-Метилфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамид.
Температура плавления: 125-130оС.
ИК-спектр (нуйол):3470, 3200, 1680, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,35 (3Н, с.), 3,24 (3Н, с.), 7,1-8,0 (11Н, м, ).
Масс-спектр (m/z): 355 (М+).
10) 5-(4-Фторфенил)-1-[4-(метилтио)фенил]пиразол-3-карбоксамид.
Температура плавления: 157-159оС.
ИК-спектр (нуйол): 3460, 3270, 1670, 1610, 1595, 1545, 11495 см-1.
Масс-спектр (m/z): 327 (М+).
11) 5-[4-(метилтио)фенил]-1-(4-нитрофенил)пиразол-3-карбоксамид.
Температура плавления: 192-194оС.
ИК-спектр (нуйол): 3480, 3150, 1690, 1610, 1595, 1520 см-1.
Масс-спектр (m/z): 354 (М+).
12) 1-(4-Фторфенил)-5-(4-толил)пиразол-3-карбоксамид.
Температура плавления: 183-186оС.
ИК-спектр (нуйол): 3500, 3350, 3300, 1685, 1610, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,29 (3Н, с.), 6,8-7,5 (9Н, м.), 7,68 (2Н, с.).
Масс-спектр (m/z): 295 (М+).
13) 1-(2,4-Дифторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксамид.
Температура плавления: 171-173оС.
ИК-спектр (нуйол): 3440, 3200, 1665, 1600, 1515 см-1.
Масс-спектр (m/z): 345 (М+).
П р и м е р 23. Смесь 1-(4-гидроксифенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксамида (1,3 г) и метансульфонилхлорида (2,5 г) в пиридине (20 мл) перемешали при 50оС в течение 5 ч. Растворитель выпарили, и к остатку добавили разбавленную хлористоводородную кислоту и этилацетат. Органический слой промыли водой, высушили и сконцентрировали. Остаток подвергли очистке путем колоночной хроматографии на силикагеле (20 г) с элюированием смесью хлороформа и метанола (20: 1) и в результате получили кристаллы 5-[4-(метилсульфонил)фенил] -1-[4-(метилсульфонилок- си)фенил] пиразол- 3-карбонитрила (0,79 г).
Температура плавления: 195-196оС.
ИК-спектр (нуйол): 2250, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,10 (3Н, с.), 3,45 (3Н, с.), 7,4-8,0 (9Н, м.).
Масс-спектр (m/z): 417 (М+).
П р и м е р 24. Раствор натрийпериодата (0,7 г) в воде (5 мл) добавили к охлажденному льдом раствору 1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбонитрила (0,6 г) в метаноле (50 мл). Полученный раствор перемешали при комнатной температуре в течение 8 ч. Нерастворимое вещество отфильтровали, и фильтрат сконцентрировали. По- лученный остаток растворили в этилацетате и промыли водным раствором натрийгидросульфата и водой. Органический слой высушили и сконцентрировали, получив в результате маслянистый остаток (0,6 г). Остаток очистили путем колоночной хроматографии на силикагеле (13 г) с элюированием смесью хлороформа и метанола (50:1). Очищенный продукт выкристаллизовали из смеси гексана и этанола, получив в результате кристаллы 1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол-3-карбонитрила (0,45 г).
Температура плавления: 104-105оС.
ИК-спектр (нуйол): 2250, 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,76 (3Н, с.), 6,94 (1Н, с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 325 (М+), 310.
П р и м е р 25. Смесь 5-(4-фторфенил)-1-[4-(метилтио)фенил]пиразол-3-карбонитри- ла (0,75 г) и 30% раствора пероксида водорода (1,4 мл) в уксусной кислоте (10 мл) перемешали при 50оС в течение 4 ч. Реакционную смесь сконцентрировали, и остаток перекристаллизовали из этанола, получив в результате кристаллы 5-(4-фторфенил)-1-[4-(метилсульфонил)фенил)пира- зол-3-карбонитрила (0,66 г).
Температура плавления: 162-163оС.
ИК-спектр (нуйол): 3140, 2250, 1610, 1595, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 3,09 (3Н, с.), 6,89 (1Н. с.), 7,0-8,0 (8Н, м.).
Масс-спектр (m/z): 341 (М+).
П р и м е р 26. Смесь 5-[4-(метилсульфонил)фенил]-1-(4-нитрофенил)пиразол-3-кар- бонитрила (1,1 г), железного порошка (1,1 г) и аммонийхлорида (0,11 г) в этаноле (20 мл) и воде (7 мл) кипятили с обратным холодильником в течение 1 ч. Растворитель выпарили, и остаток отфильтровали, промыли водой и растворили в горячем этилацетате. Раствор профильтровали, и фильтрат сконцентрировали. Полученный остаток перекристаллизовывали из этилацетата и получили в результате кристаллы 1-(4-аминофенил-5-[4-(метилсульфонил)фенил]пира- зол-3-карбонитрила (0,83 г).
Температура плавления: 228-229оС.
ИК-спектр (нуйол): 3480, 3400, 3150, 2250, 1645, 1605, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,25 (3Н, с.), 5,57 (2Н, с.), 6,5-8,0 (9Н, м.).
Масс-спектр (m/z): 338 (М+).
П р и м е р 27. Смесь 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-амина (0,7 г) и уксусного ангидрида (0,22 мл) в дихлорметане (15 мл) перемешали при температуре окружающей среды в течение 3 ч и сконцентрировали. Остаток подвергли очистке путем колоночной хроматографии на силикагеле (15 г) с элюированием смесью толуола и этилацетата (2:1). Целевой продукт (0,63 г) перекристаллизовали из этанола и получили в результате бледно-коричневые кристаллы N-{1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]-3-пиразолил}ацетамида (0,52 г).
Температура плавления: 203-205оС.
ИК-спектр (нуйол): 3350, 1690, 1580, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,05 (3Н, с.), 3,21 (3Н, с.), 6,98 (1Н, с,), 7,2-7,6 (6Н, м.), 7,89 (2Н, д. J 8
Гц), 10,72 (1Н, с.);
Масс-спектр (m/z): 373 (М+), 331.
П р и м е р 28. Метилхлорформиат (0,163 мл) в ацетонитриле (0,7 мл) добавили по каплям к перемешанному раствору 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил] пира- зол-3-амина (0,7 г) и пиридина (0,171 мл) в ацетонитриле (6 мл) и тетрагидрофуране (7 мл) при -20оС. Смесь перемешали при 5оС в течение часа, разбавили этилацетатом, помыли водой, осушили и сконцентрировали. Остаток (0,9 г) перекристаллизовали из смеси хлороформа и этанола и получили в результате бледно-коричневые кристаллы метил-N-{1-(4-фторфенил)-5-[4-(метилсуль- фонил)фенил]-3-пиразолил}карбамата (0,51 г).
Температура плавления: 225-227оС.
ИК-спектр (нуйол): 3320, 1730, 1585, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,16 (3Н, с.), 3,62 (3Н, с.), 6,73 (1Н, с.), 7,1-7,5 (6Н,м.), 7,84 (2Н, д. J 8 Гц), 10,22 (1Н, с.).
Масс-спектр (m/z): 389 (М+), 357.
П р и м е р 29. Смесь 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-амина (0,8 г) и метансульфонилхлорида (0,224 мл) в пиридине (8 мл) перемешали при температуре окружающей среды в течение 2 ч. Пиридин выпарили и остаток растворили в этилацетате, промыли водой и разбавленной хлоpистоводородной кислотой, высушили и сконцентрировали. Остаточное масло (1,1 г) подвергли очистке путем колоночной хроматографии на силикагеле (20 г) с элюированием смесью толуола и этилацетата (2:1). Продукт (0,74 г) перекристаллизовали из этанола и получили в результате бледно-коричневые кристаллы N-{ 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил] -3-пиразолил} метансульфонамида (0,62 г).
Температура плавления: 186-187оС.
ИК-спектр (нуйол): 3150, 1555, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,17 (3Н, с.), 3,24 (3Н, с.), 6,55 (1Н, с.), 7, 2-7,6 (6Н, м.), 7,91 (2Н, д, J 8,5 Гц), 10,37 (1Н, с.).
Масс-спектр (m/z): 409 (М+).
П р и м е р 30. Смесь 1-(4-аминофенил)-5-[4-(метилсульфонил)фенил]пиразол-3-кар- бонитрила (0,7 г) и муравьиной кислоты (1 мл) в формалине (37% 5 мл) нагревали с обратным холодильником в течение 30 мин. Добавили хлороформ и смесь промыли водой, высушили и сконцентрировали. Остаточное масло подвергли очистке путем колоночной хроматографии на силикагеле с элюированием смесью этилацетата и толуола (2:1). Полученный продукт перекристаллизовали из этилацетата и получили в результате кристаллы 1-[4-(диметиламино)фенил] -5-4-(метилсульфонил)фенил]пи- разол-3-карбонитрила (0,46 г).
Температура плавления:171-172оС.
ИК-спектр (нуйол): 2240, 1610, 1530 см-1.
Масс-спектр (m/z): 366 (М+).
П р и м е р 31. Смесь 1-(4-аминофенил)-5-[4-(метилсульфонил)фенил пиразол-3-карбонитрила (1 г), метилиодида (0,42 г) и калийкарбоната (0,6 г) в N, N-диметилформамиде (10 мл) перемешали при температуре окружающей среды в течение 1 ч. Смесь вылили в воду и экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали. Остаток (1,2 г) подвергли очистке путем колоночной хроматогорафии на силикагеле (20 г), использовав для элюирования хлороформ, и получили в результате кристаллы 1-[4-(метиламино)фенил] -5-[4-(метилсульфонил)фенил] пиразол-3-карбонитрила (0,31 г).
Температура плавления: 166-168оС.
ИК-спектр (нуйол): 3450, 2240, 1610, 1530 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,51 (3Н, д. J 5 Гц), 3,25 (3Н, с.), 6,17 (1Н, кв. J 5 Гц), 6,5-8,0 (9Н, м.).
Следующее ниже соединение (пример 32) было получено аналогичным примеру 10 образом.
П р и м е р 32. 1-(4-Фторфенил)-5-[4-(метилтио)фенил]пиразол-3-илметиламин.
ИК-спектр (пленка): 3400, 3300, 1600, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 1,85 (2Н, с.), 2,47 (3Н, с.), 3,96 (2Н, с.), 6,43 (1Н, с.), 7,0-7,4 (8Н, м.).
Масс-спектр (m/z): 313 (М+).
Следующие ниже соединения (примеры от 33-1 до 33-7) были получены аналогичным примеру 24 образом.
П р и м е р 33.
1) 1-(2-Фторфенил)-5-[4-(метилсульфинил)фенил]пиразол-3-карбонитрил.
Температура плавления: 139-140оС.
ИК-спектр (нуйол): 2250, 1600, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 2,73 (3Н, с.), 6,96 (1Н, с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 325 (М+), 310.
2) 1-(2,4-Дифторфенил)-5-[4-(метилсульфинил)фенил]пиразол-3-карбонитрил.
Температура плавления: 136-137оС.
ИК-спектр (нуйол): 2260, 1615, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 2,74 (3Н, с.), 6,8-7,7 (8Н, м.).
Масс-спектр (m/z): 343 (М+), 328.
3) 1-[4-(N-формилметиламино)фенил]-5-[4-(метилсульфинил)фенил]пиразол-3 карбонитрил.
ИК-спектр (пленка): 2250, 1680, 1610, 1515 см-1.
4) 5-[4-Метилсульфинил)фенил]-1-(4-нитрофенил)-3-(трифторметил)пиразол.
Температура плавления: 167-168оС.
ИК-спектр (m/z): 395 (М+).
5) 3-(Фторметил)-1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол.
Температура плавления: 130-131о С.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,75 (3Н, с.), 5,36 (1Н, с.), 5,60 (1Н, с.)9 6,69 (1Н, с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 332 (М+).
6) 3-(Хлорметил)-1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол.
Температура плавления: 96-97о С.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,75 (3Н, с. ), 4,70 (2Н, с.), 6,65 (1Н,с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 348 (М+).
7) 3-(Дифторметил)-1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол.
Температура плавления: 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,75 (3Н, с.), 6,5-7,7 (10Н, м.).
Масс-спектр (m/z): 350 (М+), 335.
Следующие ниже соединения (примеры от 34-1 до 34-13) были получены аналогичным примеру 26 образом.
П р и м е р 34.
1) 1-(4-Аминофенил)-5-[-(метилсульфонил)-2-тиенил]пиразол-3-карбонитрил.
Температура плавления: 200-203оС.
ИК-спектр (нуйол): 3500, 3420, 2250, 1620, 1520 см-1.
Масс-спектр (m/z): 344 (М+).
2) Этил-1-(4-аминофенил)-5-(4-толил)пиразол-3-карбоксилат.
Температура плавления: 174-175оС.
ИК-спектр (нуйол): 3460, 3380, 1730, 1700, 1635, 1520 см-1.
Масс-спектр (m/z): 321 (М+).
3) 1-(4-Аминофенил)-1-(4-метоксифенил)пиразол-3-карбонитрил.
Температура плавления: 175-177оС.
ИК-спектр (нуйол): 3420, 3350, 2250, 1640, 1610, 1520 см-1.
Масс-спектр (m/z): 290 (М+).
4) Этил-1-(4-аминофенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
Температура плавления: 153-155оС.
ИК-спектр (нуйол): 3450, 3350, 3230, 1715, 1635, 1610, 1520 см-1.
Масс-спектр (m/z): 353 (М+).
5) 1-(2-Аминофенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 191-192оС.
ИК-спектр (нуйол): 3500, 3400, 2250, 1635, 1600, 1500 см-1.
Масс-спектр (m/z): 338 (М3).
6) 1-(2-Амино-4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 206-208оС.
ИК-спектр (нуйол): 3500, 3400, 2250, 1630, 1510 см-1.
Масс-спектр (m/z): 356 (М+).
7) 1-(4-Аминофенил)-5-[4-(метилтио)фенил]-3-(трифторметил)пиразол.
Температура плавления: 112-113оС.
ИК-спектр (нуйол): 3500, 3400, 1625, 1600, 1520, 1500 см-1.
Масс-спектр (m/z): 349 (М+).
П р и м е р 33.
1) 1-(2-Фторфенил)-5-[4-(метилсульфинил)фенил]пиразол-3-карбонитрил.
Температура плавления: 139-140оС.
ИК-спектр (нуйол): 2250, 1600, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 2,73 (3Н, с.), 6,96 (1Н, с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 325 (М+), 310.
2) 1-(2,4-Дифторфенил)-5-[4-(метилсульфинил)фенил]пиразол-3-карбонитрил.
Температура плавления: 136-137оС.
ИК-спектр (нуйол): 2260, 1615, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 2,74 (3Н, с.), 6,8-7,7 (8Н, м.).
Масс-спектр (m/z): 343 (М+), 328.
3) 1-[4-(N-формилметиламино)фенил]-5-[4-(метилсульфинил)фенил]пиразол-3 карбонитрил.
ИК-спектр (пленка): 2250, 1680, 1610, 1515 см-1.
4) 5-[4-Метилсульфинил)фенил]-1-(4-нитрофенил)-3-(трифторметил)пиразол.
Температура плавления: 167-168оС.
ИК-спектр (нуйол):1600, 1530, 1495 см-1.
Масс-спектр (m/z): 395 (М+).
5) 3-(Фторметил)-1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол.
Температура плавления: 130-131оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,75 (3Н, с.), 5,36 (1Н, с.), 5,60 (1Н, с.), 6,69 (1Н, с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 332 (М+).
6) 3-(Хлорметил)-1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол.
Температура плавления: 96-97оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,75 (3Н, с. ), 4,70 (2Н, с.), 6,65 (1Н,с.), 7,0-7,7 (8Н, м.).
Масс-спектр (m/z): 348 (М+).
7) 3-(Дифторметил)-1-(4-фторфенил)-5-[4-(метилсульфинил)фенил]пиразол.
Температура плавления: 165-166оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,75 (3Н, с.), 6,5-7,7 (10Н, м.).
Масс-спектр (m/z): 350 (М+), 335.
Следующие ниже соединения (примеры от 34-1 до 34-13) были получены аналогичным примеру 26 образом.
П р и м е р 34.
1) 1-(4-Аминофенил)-5-[5-(метилсульфонил)-2-тиенил]пиразол-3-карбонитрил.
Температура плавления: 200-203оС.
ИК-спектр (нуйол): 3500, 3420, 2250, 1620, 1520 см-1.
Масс-спектр (m/z): 344 (М+).
2) Этил-1-(4-аминофенил)-5-(4-толил)пиразол-3-карбоксилат.
Температура плавления: 174-175оС.
ИК-спектр (нуйол): 3460, 3380, 1730, 1700, 1635, 1520 см-1.
Масс-спектр (m/z): 321 (М+).
3) 1-(4-Аминофенил)-1-(4-метоксифенил)пиразол-3-карбонитрил.
Температура плавления: 175-177оС.
ИК-спектр (нуйол): 3420, 3350, 2250, 1640, 1610, 1520 см-1.
Масс-спектр (m/z): 290 (М+).
4) Этил-1-(4-аминофенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксилат.
Температура плавления: 153-155оС.
ИК-спектр (нуйол): 3450, 3350, 3230, 1715, 1635, 1610, 1520 см-1.
Масс-спектр (m/z): 353 (М+).
5) 1-(2-Аминофенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 191-192оС.
ИК-спектр (нуйол): 3500, 3400, 2250, 1635, 1600, 1500 см-1.
Масс-спектр (m/z): 338 (М+).
6) 1-(2-Амино-4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 206-208оС.
ИК-спектр (нуйол): 3500, 3400, 2250, 1630, 1510 см-1.
Масс-спектр (m/z): 356 (М+).
7) 1-(4-Аминофенил)-5-[4-(метилтио)фенил]-3-(трифторметил)пиразол.
Температура плавления: 112-113оС.
ИК-спектр (нуйол): 3500, 3400, 1625, 1600, 1520, 1500 см-1.
Масс-спектр (m/z): 349 (М+).
8) 1-(4-Аминофенил)-5-[4-(метилсульфонил)фенил]-3-(трифторметил)пиразол.
Температура плавления: 250-251оС.
ИК-спектр (нуйол): 3500, 2400, 1640, 1600, 1520, 1500 см-1.
Масс-спектр (m/z): 381 (М+).
9) 1-(4-Аминофенил)-5-[4-(метилсульфинил)фенил]-3-(трифторметил)пиразол.
Температура плавления: 213-214оС.
ИК-спектр (нуйол): 3500, 3380, 3250, 1645, 1610, 1525, 1505 см-1.
Масс-спектр (m/z): 335 (М+).
10) 1-(4-Аминофенил)-3-(метилсульфонил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 208-210оС.
ИК-спектр (нуйол): 3500, 3400, 1635, 1605, 1520 см-1.
Масс-спектр (m/z): 391 (М+ ).
11) 1-(4-Аминофенил)-3-(фторметил)-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 112-116оС.
ИК-спектр (нуйол): 3420, 3240, 1610, 1520 см-1.
12) 1-(4-Аминофенил)-3-(дифторметил)-5-[4-метилтио)фенил]пиразол.
ИК-спектр (пленка): 3500, 3380, 1625, 1520 см-1.
13) Этил-1-(4-аминофенил)-5-[4-(метилсульфонил)фенил]пиразол-3-карбоксилат.
Температура плавления: 245-247оС.
ИК-спектр (нуйол): 3450, 3350, 1740, 1645, 1605, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,32 (3Н, т. J 7 Гц), 3.24 (3Н, с.), 4.33 (2Н, кв. J 7 Гц), 5,51 (2Н, с.), 6,5-8,0 (9Н, м.).
Масс-спектр (m/z): 385 (М+).
Следующие ниже соединения (примеры 35-1 и 35-2) были получены аналогичным примеру 27 образом.
П р и м е р 35.
1) 5-[4-(Ацетамидо)фенил]-1-(4-фторфенил)пиразол-3-карбоксамид.
Температура плавления: 273-275оС.
ИК-спектр (нуйол): 3500, 3200, 1670, 1600, 1550, 1510 см-1.
Масс-спектр (m/z): 338 (М+).
2) 1-[4-(Ацетамидо)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 206-207оС.
ИК-спектр (нуйол): 3270, 2250, 1690, 1670, 1605, 1555, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,07 (3Н, с.), 3,25 (3Н, с.), 7,3-8,0 (9Н, м.), 10,21 (1Н, с.).
Масс-спектр (m/z): 380 (М+).
Следующее ниже соединение (пример 36) было получено аналогичным примеру 29 образом.
П р и м е р 36. 1-[4-(Метилсульфониламино)фенил]-5-[4-(метилсульфонил)фенил]пи- разол-3- карбонитрил.
Температура плавления: 232-233оС.
ИК-спектр (нуйол): 3240, 2250, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,09 (3Н, с.), 3,26 (3Н, с.), 7,2-8,0 (9Н, м.), 10,17 (1Н, с.).
Масс-спектр (m/z): 416 (М+).
Следующие ниже соединения (примеры от 37-1 до 37-4) были получены аналогичным примеру 31 образом.
П р и м е р 37.
1) 1-[4-(Диметиламино)фенил]-5-[5-(метилсульфонил)-2-тиенил]пиразол-3-карбо- нитрил.
Температура плавления: 168-169оС.
ИК-спектр (нуйол): 2250, 1610, 1525 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,01 (6Н, с.), 3,33 (3Н, с.), 6,7-7,8 (7Н, м.).
Масс-спектр (m/z): 372 (М+).
2) 1-[4-(Этиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура плавления: 167-168оС.
ИК-спектр (нуйол): 3400, 2240, 1610, 1525 см-1.
ЯМР-спектр (CDCl3, δ): 1,28 (3Н, т. J7 Гц), 3,07 (3Н, с.), 3,13 (2Н, кв. J 7 Гц), 6,5-8,0 (9Н, м.).
Масс-спектр (m/z): 366 (М+), 351.
3) 1-[4-(Диэтиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбони- трил.
Температура плавления: 155-156оС.
ИК-спектр (нуйол): 2240, 1610, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 1,18 (6Н, т. J 7 Гц), 3,07 (3Н, с.), 3,37 (4Н, кв. J 7 Гц), 6,5-8,0 (9Н, м.).
Масс-спектр (m/z): 394 (М+), 379.
4) 3-(Фторметил)-1-[4-(метиламино)фенил[-5-[4-(метилсульфонил)фенил]пиразол.
Температура плавления: 151-153оС.
ИК-спектр (нуйол): 3425, 1615, 1535 см-1.
ЯМР-спектр (CDCl3, δ): 2,85 (3Н, с.), 3.06 (3Н, с.), 3,94 (1Н, с.), 5,36 (1Н, с.), 5,60 (1Н, с.), 6,5-8,0 (9Н, м.).
Масс-спектр (m/z): 359 (М+).
П р и м е р 38. Смесь этил-1-(4-фторфенил)-5-[5-(метилтио)-2-тиенил]пиразол-3-кар- боксилата (2,1 г) и натрийметоксида (895 мг) в формамиде (10 мл) перемешали при 100оС в течение 1 ч. К реакционной смеси добавили воду, и осадок собрали, промыли водой и высушили в вакууме, получив в результате кристаллы 1-(4-фторфенил)-5-[5-(метилтио)-2-тиенил] пиразол-3-карбоксамида (1,6 г).
Температура плавления: 132-140оС.
ИК-спектр (нуйол): 3500, 3300, 3200, 1700, 1665, 1600, 1510 см-1.
Масс-спектр (m/z): 333 (М+).
Следующие ниже соединения (примеры от 39-1 до 39-16) были получены аналогичным примеру 38 образом.
П р и м е р 39.
1) 5-[5-(Метилтио)-2-тиенил]-1-(4-нитрофенил)пиразол-3-карбоксамид.
ИК-спектр (нуйол): 3350, 3180, 1675, 1595, 1520 см-1.
2) 1-(4-Фторфенил)-5-[4-(N-формилметиламино)фенил]пиразол-3-карбоксамид.
Температура плавления: 222-224оС.
ИК-спектр (нуйол): 3500, 3430, 3200, 1660, 1615, 1510 см-1.
Масс-спектр (m/z): 338 (М+).
3) 5-(4-Аминофенил)-1-(4-фторфенил)пиразол-3-карбоксамид.
Температура плавления: 195-199оС.
ИК-спектр (нуйол): 3500, 3360, 3200, 1675, 1630, 1610, 1510 см-1.
Масс-спектр (m/z): 296 (М+).
4) 1-[4-(N-Формилметиламино)фенил]-5-(4-толил)пиразол-3-карбоксамид.
Температура плавления: 202-206оС.
ИК-спектр (нуйол): 3400, 3200, 1665, 1610, 1520 см-1.
Масс-спектр (m/z): 334 (М+).
5) 1-(4-Фторфенил)-5-(4-метоксифенил)пиразол-3-карбоксамид.
Температура плавления: 136-142оС.
ИК-спектр (нуйол): 3500, 3350, 3200, 1705, 1690, 1665, 1610, 1510 см-1.
Масс-спектр (m/z): 311 (М+).
6) 5-(4-Метоксифенил)-1-(4-нитрофенил)пиразол-3-карбоксамид.
Температура плавления: 200-202оС.
ИК-спектр (нуйол): 3400, 3170, 1680, 1610, 1595, 1520 см-1.
Масс-спектр (m/z): 338 (М+).
7) 1,5-Бис(4-метоксифенил)пиразол-3-карбоксамид.
Температура плавления: 130-131оС.
ИК-спектр (нуйол): 3450, 3300, 3250, 1675, 1660, 1610, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,75 (3Н, с.), 3,78 (3Н, с.), 6, 7-7,6 (11Н, м. ).
Масс-спектр (m/z): 323 (М+).
8) 5-4-Ацетилфенил)-1-(4-фторфенил)пиразол-3-карбоксамид.
Температура плавления: 300оС.
ИК-спектр (нуйол): 3500, 3420, 1675, 1590, 1510 см-1.
9) 5-(4-Цианфенил)-1-(4-фторфенил)пиразол-3-карбоксамид.
Температура плавления: 181-185оС.
ИК-спектр (нуйол): 3500, 3350, 2240, 1660, 1600, 1510 см-1.
Масс-спектр (m/z): 306 (М+).
10) 1-(2-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксамид.
Температура плавления: 140-146оС.
ИК-спектр (нуйол): 3400, 3300, 1670, 1600, 1500 см-1.
Масс-спектр (m/z): 327 (M+).
11) 1-(2,5-Дифторфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксамид.
Температура плавления: 185-187оС.
ИК-спектр (нуйол): 3450, 3300, 3150, 1690, 1610, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,46 (3Н, с.), 7,0-7,8 (10Н, м.).
Масс-спектр (m/z): 345 (М+).
12) 1-[4-(N-формилметиламино)фенил] -5-[4-(метилтио)фенил] пиразол-3- карбоксамид.
Температура плавления: 183-189oС.
ИК-спектр (нуйол): 3350, 3200, 1670, 1655, 1605, 1520 см-1.
Масс-спектр (m/z): 366 (М+).
13) 5-[4-(Метилтио)фенил]-1-(2-нитрофенил)пиразол-3-карбоксамид.
Температура плавления: 196-199оС (разл.).
ИК-спектр (нуйол): 3500, 3160, 1690, 1610, 1530 см-1.
Масс-спектр (m/z): 354 (М+).
14) 1-(4-Фтор-2-нитрофенил)-5-[4-(метилтио)фенил]пиразол-3-кароксамид.
ИК-спектр (нуйол): 3430, 3200, 1670, 1590, 1540, 1510 см-1.
15) 1-[4-(N,N-Формилметиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол- 3-карбоксамид.
Температура плавления: 278-283оС (разл.).
ИК-спектр (нуйол): 3350, 1665, 1600, 1520 см-1.
Масс-спектр (m/z): 398 (М+).
16) 1-(2-Хлорфенил)-5-[4-(метилтио)фенил]пиразол-3-карбоксамид.
Температура плавления: 195-201оС.
ИК-спектр (нуйол): 3450, 3150, 1690, 1610, 1590 см-1.
Масс-спектр (m/z): 343 (М+).
П р и м е р 40. Смесь 1-(4-аминофенил)-5-[5-(метилсульфонил)-2-тиенил] пиразол-3-карбонитрила (1,1 г) и муравьиной кислоты (5 мл) нагрели с обратным холодильником в течение 30 мин. Смесь сконцентрировали, и остаток подвергли порошкованию в воде, в результате чего получили кристаллы 1-[4-(формиламино)фенил] -5-[5-(метилсульфо- нил)-2-тиенил]пиразол-3-карбонитрила (1,1 г).
Температура плавления: 152-158оС.
ИК-спектр (нуйол): 3260, 2250, 1675, 1605, 1515 см-1.
Масс-спектр (m/z): 372 (М+).
Следующие ниже соединения (примеры от 41-1 до 41-11) были получены аналогичным примеру 40 образом.
П р и м е р 41.
1) Этил-1-[4-(формиламино)фенил]-5-(4-толил)пиразол-3-карбоксилат.
Температура плавления: 201-203о С.
ИК-спектр (нуйол): 3260, 1730, 1690, 1600, 1530 см-1.
2) 1-[4-(Формиламино)фенил]-5-(4-метоксифенил)пиразол-3-карбонитрил.
ИК-спектр (пленка): 3300, 2250, 1690, 1610, 1515 см-1.
3) Этил-1-[4-(формиламино)фенил] -5-[4-(метилтио)фенил] пиразол-3-карбоксилат.
Температура плавления: 190-192оС.
ИК-спектр (нуйол): 3250, 1730, 1690, 1605, 1520 см-1.
4) 1-[4-(Формиламино)фенил] -5-[4-(метилсульфонил)фенил]пиразол-3-карбони- трил.
Температура плавления: 195-197оС.
ИК-спектр (нуйол): 3270, 2240, 1690, 1670, 1605, 1550, 1515 см-1.
ЯМР-спектр DMSO-d6, δ): 3,26 (3Н, с.), 7,2-8,0 (9Н, м.), 9,32 (1Н, с.), 10,48 (1Н, с.).
Масс-спектр (m/z): 366 (М+).
5) 1-[2-(Формиламино)фенил] -5-[4-(метилсульфонил)фенил]пиразол-3-карбони- трил.
Температура плавления: 109-118оС.
ИК-спектр (нуйол): 3330, 2250, 1700, 1600, 1520 см-1.
Масс-спектр (m/z): 366 (М+), 338.
6) 1-[4-(Формиламино)фенил]-5-[4-(метилтио)фенил]-3-(трифторметил)пиразол.
Температура плавления: 134-135оС.
ИК-спектр (нуйол): 3370, 1700, 1605, 1530 см-1.
Масс-спектр (m/z): 377 (М+).
7) 1-[4-(Формиламино)фенил]-5-[4-(метилсульфонил)фенил]-3-(трифторметил) пиразол.
Температура плавления: 163-166оС.
ИК-спектр (нуйол): 3270, 1680, 1610, 1550, 1520, 1500 см-1.
Масс-спектр (m/z): 409 (М+).
8) 1-[4-(Формиламино)фенил]-5-[4-(метилсульфонил)фенил]-3-(трифторметил) пиразол.
ИК-спектр (пленка): 3270, 1690, 1610, 1525, 1500 см-1.
9) 1-[4-(Формиламино)фенил]-3-(метилсульфонил)-5-[4-(метилсульфонил)фенил] пиразол.
Температура плавления: 193-195оС.
ИК-спектр (нуйол): 3380, 1700, 1670, 1605, 1535 см-1.
Масс-спектр (m/z): 419 (М+).
10) 3-(Дифторметил)-1-[4-(формиламино(фенил]-5-[4-(метилтио)фенил]пиразол.
Температура плавления: 127-131оС.
ИК-спектр (нуйол): 3300, 1680, 1670, 1610, 1520 см-1.
Масс-спектр (m/z: 359 (М+).
11) Этил-1-[4-(формиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3- карбоксилат.
Температура плавления: 214-216оС.
ИК-спектр (нуйол): 3270, 1740, 1670, 1605, 1555, 1510 см-1.
Масс-спектр (m/z): 413 (М+ ).
П р и м е р 42. Раствор 1-[4-(формиламино)фенил]-5-[5-(метилсульфонил)-2-тиенил] пиразол-3- карбонитрила (1,1 г) в N,N-диметилформамиде (3 мл) добавили по каплям к суспензии натрийгидрида (60% 118 мг) в N, N-диметилформамиде (2 мл). Смесь перемешали при 0оС в течение 30 мин. К смеси добавили по каплям раствор иодметана (0,84 г) в N,N-диметилформамиде (2 мл) при 0оС. Полученную смесь перемешали при 0оС в течение 1 ч, вылили в охлажденную льдом разбавленную хлористоводородную кислоту и экстрагировали этилацетатом. Экстракт промыли водой, высушили над магнийсульфатом и упарили в вакууме. Остаток перекристаллизовали из этанола и получили в результате кристаллы 1-[4-(N-формилметиламино)фенил]-5-[5-(метилсуль- фонил)-2-тиенил] пиразол-3-карбонитри- ла (1 г).
Температура плавления: 170-173оС.
ИК-спектр (нуйол): 2250, 1675, 1600, 1520 см-1.
Масс-спектр (m/z): 386 (М+).
Следующие ниже соединения (примеры от 43-1 до 43-12) были получены аналогичным примеру 42 образом.
П р и м е р 43.
1) Этил-1-(4-фторфенил)-5-[4-(N-формилметиламино)фенил]пиразол-3-карбоксилат.
Температура плавления: 118-120оС.
ИК-спектр (нуйол): 1715, 1680, 1610, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 1,43 (3Н, т. J7 Гц), 3,32 (3Н, с.), 4,46 (2Н, кв. J 7Гц), 7,0-7,5 (9Н, м.), 8,85 (1Н, с.).
Масс-спектр (m/z): 367 (М+).
2) Этил-1-[4-(N-формилметиламино)фенил]-5-(4-толил)пиразол-3-карбоксилат.
ИК-спектр (пленка): 1720, 1675, 1610, 1515 см-1.
ЯМР-спектр (SMSO-d6, δ): 1,39 (3Н, т. J 7 Гц), 2,32 (3Н, с.), 3,28 (3Н, с.), 4,42 (2Н, кв. J 7 Гц), 6,9-7,5 (9Н, м.), 8,42 (1Н, с.).
3) 1-[4-(N-формилметиламино)фенил]-5-(4-метоксифенил)пиразол-3-карбонитрил.
ИК-спектр (пленка): 2250, 1680, 1610, 1515 см-1.
4) Этил-1-[4-(N-формилметиламино)фенил] -5-[4-(метилтио)фенил]пиразол-3-кар- боксилат.
ИК-спектр (пленка): 1720, 1680, 1605, 1520 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 2,47 (3Н, с.), 3,28 (3Н, с, ), 4,42 (2Н, кв. J 7 Гц). 6,9-7,4 (9Н, м.), 8,37 (1Н, с.).
5) 1-[4-(N-формилметиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-кар- бонитрил.
Масс-спектр (m/z):380 (M+).
6) 1-[2-(N-формилметиламино]фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-кар- бонитрил.
Температура плавления: 172-173оС.
ИК-спектр (нуйол): 2250, 1670, 1600, 1500 см-1.
Масс-спектр (m/z): 380 (M+), 352.
7) 1-[4-(N-Формилметиламино)фенил]-5-[4-(метилтио)фенил]-3-(трифторметил)пира- зол.
Температура плавления: 142-144oC.
ИК-спектр (нуйол):1680, 1610, 1520, 1500 см-1.
Масс-спектр (m/z): 391
8)
1-[4+(N-Формилметиламино)фенил] -5-[4-(метилсульфонил)фенил] -3- (трифторметил)пиразол.
Температура плавления: 118-120оС.
ИК-спектр (нуйол): 1660, 1610, 1520, 1500 см-1.
Масс-спектр (m/z): 423 (М+).
9) 1-[4-(N-Формилметиламино)фенил] -5-[4-(метилсульфонил)фенил] -3-(трифторметил) пиразол.
ИК-спектр (пленка): 1675, 1610, 1520, 1500 см-1.
10) 1-[4-(N-Формилметиламино)фенил]-3-(метилсульфонил)-5-[4-(метилсульфонил) фенил]пиразол.
Температура плавления: 146-150оС.
ИК-спектр (нуйол): 1675, 1605, 1520 см-1.
Масс-спектр (m/z): 433 (М+).
11) 3-(Дифторметил)-1-[4-(N-формилметиламино)фенил]-5-[4-(метилтио)фенил] пиразол.
Температура плавления: 109-115оС.
ИК-спектр (нуйол): 1680, 1605, 1520 см-1.
Масс-спектр (m/z): 373 (М+).
12) Этил-1-[4-(N-формилметиламино)фенил] -5-[4-(метилсульфонил)фенил] пиразол- 3-карбоксилат.
ИК-спектр (нуйол); 1745, 1725, 1680, 1600, 1520 см-1.
Масс-спектр (m/z): 427 (М+).
П р и м е р 44. Смесь 1-[4-(N-формилметиламино)фенил]-5-[5-(метилсульфонил)-2-тиенил] пиразол-3- карбонитрила (1 г) и 10% хлористоводородной кислоты (3 мл) в метаноле 915 мл) перемешали при 60оС в течение 3 ч. Охладив, смесь профильтровали, и фильтрат сконцентрировали в вакууме. Остаток промыли этанолом и получили в результате кристаллы 1-[4-(метиламино)фенил]-5-[5-(метилсульфонил)-2-тиенил]пиразол-3- карбонитрилгидрохлорида (0,89 г).
Температура плавления: 205-207оС.
ИК-спектр (нуйол): 2600, 2450, 2250, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,76 (3Н, с.), 3,33 (3Н, с,), 6,77 (2Н, д. J 8 Гц), 7,26 (2Н, д. J 8 Гц), 7,43 (1Н. д. J 3 Гц), 7, 62 (1Н, с.), 7,78 (1Н, д. J 3 Гц).
Масс-спектр (m/z): 358 (М+).
Следующие ниже соединения (примеры от 45-1 до 45-14) были получены аналогичным примеру 44 образом.
П р и м е р 45.
1) 1-(4-Фторфенил)-5-[4-(метиламино)фенил]пиразол-3-карбонитригидрохло- рид.
Температура плавления: 189-191о С.
ИК-спектр (нуйол): 2650, 2450, 2250, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,73 (3Н, с.), 6,8-7,5 (9Н, м.).
Масс-спектр (m/z): 292 (М+).
2) 1-[4-(Метиламино)фенил]-5-(4-толил)пиразол-3-карбонитрилгидрохлорид.
Температура плавления: 199-201оС.
ИК-спектр (нуйол): 2600, 2450, 1610, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,29 (3Н, с.), 2,76 (3Н, с.), 6,9-7,5 (9Н, м,), 7,62 (2Н, с.).
Масс-спектр (m/z):288 (М+).
3) 1-[4-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил- гидрохлорид.
Температура плавления: 218-221оС.
ИК-спектр (нуйол): 3450, 2650, 2460, 2250, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,70 (3Н, с.), 3,25 (3Н, с.),
5,46 (2Н, с.), 6,5-8,0 (9Н, м.)
Масс-спектр (m/z): 352 (М+).
4) 1-[4-(Метиламино)фенил] -5-[4-(метилтио)фенил]пиразол-3-карбонитрил- гидрохлорид.
Температура плавления: 113-120оС.
ИК-спектр (нуйол): 3400, 2650, 2450, 2250, 1600, 1515 см-1.
ЯМР-спектр (DMSP-d6, δ): 2,46 (3Н, с.), 2,74 (3Н, с.), 6,57 (2Н, с.), 6,5-7,4 (9Н, м.).
Масс-спектр (m/z): 330 (М+).
5) 1-[4-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитригидро хлорид.
Температура плавления: 175-177оС (разл.).
ИК-спектр (нуйол): 2630, 2450, 2250, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,74 (3Н, с.), 2,76 (3Н, с.), 6,53 (2Н, с.) 6,7-7,8 (9Н, м,).
Масс-спектр (m/z): 336 (М+), 319.
Температура плавления: 118-120оС.
ИК-спектр (нуйол): 1660, 1610, 1520, 1500 см-1.
Масс-спектр (m/z): 423 (М+).
9) 1-[4-(N-Формилметиламино)фенил] -5-[4-(метилсульфонил)фенил] -3-(трифторметил) пиразол.
ИК-спектр (пленка): 1675, 1610, 1520, 1500 см-1.
10) 1-[4-(N-Формилметиламино)фенил]-3-(метилсульфонил)-5-[4-(метилсульфонил) фенил]пиразол.
Температура плавления: 146-150оС.
ИК-спектр (нуйол): 1675, 1605, 1520 см-1.
Масс-спектр (m/z): 433 (М+).
11) 3-(Дифторметил)-1-[4-(N-формилметиламино)фенил]-5-[4-(метилтио)фенил] пиразол.
Температура плавления: 109-115оС.
ИК-спектр (нуйол): 1680, 1605, 1520 см-1.
Масс-спектр (m/z): 373 (М+).
12) Этил-1-[4-(N-формилметиламино)фенил] -5-[4-(метилсульфонил)фенил] пиразол- 3-карбоксилат.
ИК-спектр (нуйол); 1745, 1725, 1680, 1600, 1520 см-1.
Масс-спектр (m/z): 427 (М+).
П р и м е р 44. Смесь 1-[4-(N-формилметиламино)фенил]-5-[5-(метилсульфонил)-2-тиенил] пиразол-3- карбонитрила (1 г) и 10% хлористоводородной кислоты (3 мл) в метаноле (15 мл) перемешали при 60оС в течение 3 ч. Охладив, смесь профильтровали, и фильтрат сконцентрировали в вакууме. Остаток промыли этанолом и получили в результате кристаллы 1-[4-(метиламино)фенил]-5-[5-(метилсульфонил)-2-тиенил]пира- зол-3- карбонитрилгидрохлорида (0,89 г).
Температура плавления: 205-207оС.
ИК-спектр (нуйол): 2600, 2450, 2250, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,76 (3Н, с.), 3,33 (3Н, с,), 6,77 (2Н, д. J 8 Гц), 7,26 (2Н, д. J 8 Гц), 7,43 (1Н. д. J 3 Гц), 7,72 (1Н, с.), 7,78 (1Н, д. J 3 Гц).
Масс-спектр (m/z): 358 (М+).
Следующие ниже соединения (примеры от 45-1 до 45-14) были получены аналогичным примеру 44 образом.
П р и м е р 45.
1) 1-(4-Фторфенил)-5-[4-(метиламино)фенил]пиразол-3-карбонитригидрохло- рид.
Температура плавления: 189-191оС.
ИК-спектр (нуйол): 2650, 2450, 2250, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,73 (3Н, с.), 6,8-7,5 (9Н, м.).
Масс-спектр (m/z): 292 (М+).
2) 1-[4-(Метиламино)фенил]-5-(4-толил)пиразол-3-карбонитрилгидрохлорид.
Температура плавления: 199-201оС.
ИК-спектр (нуйол): 2600, 2450, 2250, 1610, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,29 (3Н, с.), 2,76 (3Н, с.), 6,9-7,4 (9Н, м,), 7,62 (2Н, с.).
Масс-спектр (m/z):288 (М+).
3) 1-[4-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил- гидрохлорид.
Температура плавления: 218-221оС.
ИК-спектр (нуйол): 3450, 2650, 2460, 2250, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,70
(3Н, с.), 3,25 (3Н, с.), 5,46 (2Н, с.), 6,5-8,0 (9Н, м.)
Масс-спектр (m/z): 352 (М+).
4) 1-[4-(Метиламино)фенил]-5-[4-(метилтио)фенил]пиразол-3-карбонитрилгидро- хлорид.
Температура плавления: 113-120оС.
ИК-спектр (нуйол): 3400, 2650, 2450, 2250, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,46 (3Н, с.), 2,74 (3Н, с.), 6,57 (2Н, с.), 6,5-7,4 (9Н, м.).
Масс-спектр (m/z): 330 (М+).
5) 1-[4-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитриги- дрохлорид.
Температура плавления: 175-177оС (разл.).
ИК-спектр (нуйол): 2630, 2450, 2250, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,74 (3Н, с.), 2,76 (3Н, с.), 6,53 (2Н, с.) 6,7-7,8 (9Н, м, ).
Масс-спектр (m/z): 336 (М+), 319.
6) 1-[2-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3-карбонитрил.
Температура
плавления: 192-193оС,
ИК-спектр (нуйол): 3450, 2250, 1610, 1520 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,66 (3Н, д. J 5 Гц), 3,22 (3Н, с.), 5, 33 (1Н, кв. J 5 Гц), 6,5-8,0 (9Н, м.).
Масс-спектр (m/z): 352 (М+).
7) 1-[4-(Метиламино)фенил]-5-[4-(метилтио)фенил]-3-(трифторметил)пиразол.
Температура плавления: 168-169оС.
ИК-спектр (нуйол): 3400, 1610, 1535, 1500 см-1.
ЯМР-спектр (CDCl3, δ): 2,47 (3Н, с.), 2,84 (3Н, с.), 6,5-7,3 (9Н, м.).
Масс-спектр (m/z): 363 (М+).
8) 1-[4-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]-3-(трифторметил) пиразолгидрохлорид.
Температура плавления: 200-202оС.
ИК-спектр (нуйол): 2725, 2600, 2450, 1600, 1520, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,75 (3Н, с.), 3,26 (3Н, с.), 6,8-8,0 (9Н, м.), 8,42 (2Н, с.).
Масс-спектр (m/z): 395 (М+).
9) 1-[4-(Метиламино)фенил]-5-[4-(метилсульфонил)фенил]-3-(трифторметил) пиразолгидрохлорид.
Температура плавления: 171-172оС.
ИК-спектр (нуйол): 2625, 2450, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,76 (6Н, с.), 6,8-7,8 (10Н, м.).
Масс-спектр (m/z): 379 (М+).
10) 1-[4-(Метиламино)фенил]-3-(метилсульфонил)-5-[4-(метилсульфонил)фенил] пиразолгидрохлорид.
Температура плавления:209-211оС.
ИК-спектр (нуйол): 2650, 2450, 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,74 (3Н, с.), 3,26 (3Н, с,). 3,35 (3Н, с.), 6,7-8,0 (9Н. м.).
Масс-спектр (m/z): 405 (М+).
11) 3-(Дифторметил)-1-[4-(метиламино)фенил]-5-[4-(метилтио)фенил]пиразол.
Температура плавления: 128-129оС.
ИК-спектр (нуйол): 3360, 1610, 1530 см-1.
ЯМР-спектр (CDCl3, δ): 2,47 (3Н, с.), 2,84 (3Н, с.), 6,4-7,2 (10Н, м.).
Масс-спектр (m/z): 345 (М+).
12) N-Метил-1-[4-(метиламино)фенил] -5-[4-(метилсульфонил)фенил] пиразол-3-кар- боксамид.
Температура плавления: 187-188оС.
ИК-спектр (нуйол): 3400, 1670, 1650, 1610, 1560, 1525 см-1.
ЯМР-спектр (CDCl3, δ): 2,86 (3Н, с.), 2,92 (3Н, д. J 5 Гц), 3,06 (3Н, с. ), 4,03 (1Н, с.), 6, 5-8,0 (10Н, м.).
Масс-спектр (m/z): 384 (М+).
13) N,N-Диметил-1-[4-(метиламино)фенил]-5-[4-(метилсульфонил)фенил]пиразол-3- карбоксамид.
Температура плавления: 204-205оС.
ИК-спектр (нуйол): 3420, 1620, 1530 см-1.
ЯМР-спектр (CDCl3, δ): 2,86 (3Н, с.), 3,07 (3Н, с.), 3,14 (3Н, с.), 3,44 (3Н, с.), 4,00 (1Н, с.), 6,4-8,0 (9Н, м.).
Масс-спектр (m/z): 398 (М+).
14) 1-[4-(Метиламино)фенил] -5-[4-(метилсульфонил)фенил]пиразол-3-карбокса- мид.
Температура плавления: 215-216оС.
ИК-спектр (нуйол): 3470, 3370, 3160, 1675, 1610, 1530 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,69 (3Н, д. J 5 Гц), 3,24 (3Н, с.), 6,07 (1Н, кв. J 5 Гц), 6,55 (2Н, д. J 9 Гц), 7,0-8,0 (9Н, м.).
Масс-спектр (m/z): 370 (М+).
П р и м е р 46. Этил-1-[4-(метиламино)фенил]-5-[4-(метилсульфонил)фенил] пиразол-3- карбоксилат, полученный аналогично примеру 44, ввели в реакцию аналогичным примеру 3 образом и получили в результате 1-[4-(метиламино)фенил] -5-[4-(метилсульфо- нил)фенил] пиразол-3-карбоновую кислоту.
Температура плавления: 235-240оС (разл.).
ИК-спектр (нуйол): 3400, 1715, 1610, 1530 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,69 (3Н, с.), 3,24 (3Н, с.), 6,09 (1Н, с.), 6,55 (2Н, д. J -=9 Гц), 7,05 (2Н, д. J 9 Гц), 7,17 (1Н, с.), 7,53 (2Н. д. J 8 Гц), 7,89 (2Н, д. J 8 Гц).
Масс-спектр (m/z): 371 (М+).
П р и м е р 47. Смесь 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-кар- бонитрила (1 г), аммонийхлорида (0,25 г) и натрийазида (0,24 г) в N, N-диметилформамиде (10 мл) перемешали при 105оС в течение 10 ч. Смесь вылили в ледяную воду, и осадок собрали, промыли водой и перекристаллизовали из смеси этанола и тетрагидрофурана, получив в результате кристаллы 1-(4-фторфенил)-5-[4-(метилсульфонил)фе- нил]-3-(5-тетразолил)пиразола (0,71 г).
Температура плавления: 278-279оС.
ИК-спектр (нуйол): 3150, 1655, 1620, 1600, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,27 (3Н, с,), 7,3-7,6 (7Н, м.), 7,95 (2Н, д. J 8 Гц).
Масс-спектр (m/z): 384 (М+ ).
Следующие ниже соединения (примеры 48-1 и 48-2) были получены аналогичным примеру 47 образом.
П р и м е р 48.
1) 1-(4-Фторфенил)-5-[4-(метилтио)фенил]-3-(5-тетразолил)пиразол.
Температура плавления: 242-243оС (разл.).
ИК-спектр (нуйол): 1605, 1510 см-1 .
ЯМР-спектр (DMSO-d6, δ): 2,48 (3Н, с.), 7,1-7,6 (9Н, с.).
Масс-спектр (m/z): 352 (М+).
2) 1-(4-Фторфенил)-5-[4-(метилсульфинил)фенил]-3-(5-тетразолил)пиразол.
Температура плавления: 272-273оС (разл.).
ИК-спектр (нуйол): 1615, 1510 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,79 (3Н, с.), 7,3-7,8 (9Н, м.).
Масс-спектр (m/z): 368 (М+).
П р и м е р 49. Смесь этил-4-[4-(формиламино)фенил]-2,4-диоксобутаноата (6 г) и 4-фторфенилгидразингидрохлорида (4,1 г) в уксусной кислоте (30 мл) перемешали при 100оС в течение 2 ч. Смесь сконцентрировали, и остаток обработали 10% хлористоводородной кислотой (10 мл) и метанолом (40 мл) при 60оС в течение 2 ч. Растворитель выпарили, и остаток растворили в воде. Полученный раствор нейтрализовали и экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали в вакууме. Остаток промыли этанолом, получив в результате кристаллы этил-5-(4-аминофенил)-1-(4-фторфенил)пиразол-3-карбо- ксилата (3,4 г).
Температура плавления: 158-160оС.
ИК-спектр (нуйол): 3450, 3350, 3250, 1720, 1640, 1610, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,42 (3Н, т. J7 Гц), 4,44 (2Н, кв. J 7 Гц), 6,5-7,4 (9Н, м.).
Масс-спектр (m/z): 325 (М+).
П р и м е р 50. Раствор натрийнитрита (0,26 г) в воде (0,3 мл) добавили к охлажденной льдом с солью смеси 1-(4-фторфенил)-5-[4-(метилтио)фенил]-3-пиразоламина (1 г), ацетонитрила (1 мл), серной кислоты (0,6 мл) и воды (1,6 мл). Смесь перемешали при 0оС в течение 30 мин. Полученную в результате смесь добавили порциями к смеси бромида (645 мг) меди (1), бромида (582 мг) натрия, бромистоводородной кислоты (1,7 мл) и воды (3 мл) при 80оС. Смесь перемешали при 80оС в течение 30 мин и экстрагировали толуолом. Экстракт промыли водой, высушили и упарили в вакууме. Полученный остаток подвергли очистке путем колоночной хроматографии на силикагеле (10 г) и в результате получили кристаллы 3-бром-1-(4-фторфенил)-5-[4-(метилтио)фенил] пиразола (0,35 г).
Температура плавления: 98-99оС.
ИК-спектр (нуйол): 1600, 1510, 1680 см-1.
ЯМР-спектр (CDCl3, δ): 2,48 (3Н, с.), 6,49 (1Н, с.), 6,9-7,3 (8Н, м.).
Масс-спектр (m/z): 364 (М+).
П р и м е р 51. Смесь 4-бром-1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразола (1,9 г) и цианида (0,7 г) меди (1) нагревали при 200оС в течение 6 ч. Смесь экстрагировали этилацетатом, и экстракт сконцентрировали в вакууме. Остаток (0,95 г) подвергли очистке путем колоночной хроматографии на силикагеле (20 г), использовав для элюирования хлороформ, и в результате получили кристаллы 1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-4-карбонитрила (0,95 г).
Температура плавления: 122-123оС.
ИК-спектр (нуйол): 2230, 1600, 1505 см-1.
ЯМР-спектр (CDCl3, δ): 2,50 (3Н, с.), 7,0-7,8 (8Н, м.). 8,00 (1Н, с.).
Масс-спектр (m/z): 309 (М+).
П р и м е р 52. Раствор брома (0,9 г) в дихлорметане (2 мл) добавили по каплям к охлажденному льдом раствору 1-(4-фторфенил)-5-[4-(метилтио)фенил] пиразола (16 г) в дихлорметане (10 мл). Смесь перемешали при 5оС в течение 1 ч, промыли раствором натрийбисульфита и водой, высушили и сконцентрировали в вакууме. Остаток (1,9 г) перекристаллизовали из этанола и получили в результате кристаллы 4-бром-1-(4-фторфенил)-5-[4-(метилтио)фенил] -пиразола (1,3 г).
Температура плавления: 85-87оС.
ИК-спектр (нуйол): 1600, 1510 см-1.
Масс-спектр (m/z): 364, 362.
П р и м е р 53. Смесь 1-[4-(метилтио)фенил]-3,3-бис(метилтио)-2-пропен-1-она (2,7 г) и 4-фторфенилгидразингидрата (1,8 г) в уксусной кислоте (15 мл) перемешали при 100оС в течение 7 ч. Растворитель выпарили, и остаток растворили в этаноле. Нерастворимое вещество отфильтровали, и фильтрат сконцентрировали в вакууме. Остаток подвергли очистке путем колоночной хроматографии на силикагеле (25 г), использовав для элюирования хлороформ, и в результате получили масло 1-(4-фторфенил)-3-(метилтио)-5-[4-)метилтио)фенил]пи- разола (0,73 г).
ИК-спектр (нуйол): 1590, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 2,48 (3Н, с.), 2,59 (3Н, с.), 6,40 (1Н, с.), 6,9-7,4 (8Н, м.).
Следующее ниже соединение (пример 54) было получено аналогичным примеру 53 образом.
П р и м е р 54. 3-(Метилтио)-5-[4-(метилтио)фенил]-1-(4-нитрофенил)пиразол.
Температура плавления: 71-73оС.
ИК-спектр (нуйол): 1595, 1515, 1500 см-1.
Масс-спектр (m/z): 357 (М+).
П р и м е р 55. Смесь 5-(4-аминофенил)-1-(4-фторфенил)пиразол-3-карбоксамида (0,27 г) и метансульфонилхлорида (0,63 г) в пиридине (5 мл) перемешали при 60оС в течение 5 ч. Растворитель выпарили и остаток растворили в смеси этилацетата и воды. Органический слой отделили, промыли водой, высушили и сконцентрировали в вакууме. Остаток кристаллизовали из этанола, получив в результате 1-(4-фторфенил)-5-[4-(метилсульфониламино)фенил]пиразол-3- карбонитрил (0,19 г).
Температура плавления: 202-205оС.
ИК-спектр (нуйол): 3160, 2250, 1615, 1510 см-1.
ЯМР-спекр (DMSO-d6, δ): 3,05 (3Н, с.), 7,1-7,5 (9Н, м.), 10,06 (1Н, с.).
Масс-спектр (m/z): 356 (М+), 277,
П р и м е р 56. Смесь 1-(2-амино-4-фторфенил)-5-[4-(метилсульфонил)фенил] пира- зол-3-карбонитрила (0,87 г), метилиодида (0,69 г) и калийкарбоната (0,27 г) в N,N-диметилформамиде (5 мл)
перемешали при 45оС в течение 19 ч. Смесь вылили в воду и экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали в вакууме. Остаток (1 г) подвергли очистке путем
колоночной хроматографии на силикагеле (15 г), использовав для элюирования хлороформ.
Из первого элюата получили 1-[2-(диметиламино)-4-фторфенил] -5-[4-(метилсульфо- нил)фенил]пиразол-3- карбонитрил (0,11 г).
Температура плавления: 200-202оС.
ИК-спектр (нуйол): 2250, 1620, 1500 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,11 (6Н, с.), 3,21 (3Н, с.), 6,7-7,9 (8Н, м.).
Масс-спектр (m/z): 384 (М+).
Из второго элюата получили 1-[4-фтор-2-(метиламино)фенил] -5-[4-(метилсульфо- нил)фенил]пиразол-3- карбонитрил (0,44 г).
Температура плавления: 192-193оС.
ИК-спектр (нуйол): 3450, 2250, 1620, 1530 см-1.
ЯМР-спектр (DMSO-d6, δ): 2,65 (3Н, д. J 3 Гц), 3,23 (3Н, с.), 5,68 (1Н, кв. J 3 Гц), 6,3-8,0 (8Н, м.).
Масс-спектр (m/z): 370 (М+).
П р и м е р 57. Смесь 1-(4-фторфенил)-3-(метилтио)-5-[4-(метилтио)фенил] пиразола (0,73 г), 30% пероксида (1,5 мл) водорода и концентрированной серной кислоты (2 капли) в уксусной кислоте (10 мл) перемешали при 60оС в течение 4 ч. Растворитель выпарили и остаток растворили в этилацетате. Раствор промыли последовательно водным раствором найтрийбикарбоната и водой, высушили и сконцентрировали. Остаток перекристаллизовали из смеси этилацетата и этанола, получив в результате кристаллы 1-(4-фторфенил)-3-(метилсульфонил)-5-[4-(ме- тилсульфонил)фенил]пиразола (0,54 г).
Температура плавления: 209-210оС.
ИК-спектр (нуйол): 1600, 1515 см-1.
ЯМР-спектр (DMSO-d6, δ): 3,26 (3Н, с.), 3,88 (3Н, с.), 7,3-8,0 (9Н, м.),
Масс-спектр (m/z): 394 (М+).
Следующее ниже соединение (пример 58) было получено аналогичным примеру 57 образом.
П р и м е р 58. 3-(Метилсульфонил)-5-[4-(метилсульфонил)фенил]-1-(4-нитрофенил)пиразол.
Температура плавления: 187-189оС.
ИК-спектр (нуйол): 1600, 1530, 1500 см-1.
Масс-спектр (m/z): 421.
П р и м е р 59. Смесь 4-фтор-1-[4-(метилтио)фенил]бутан-1,3-диона (2 г) и 4-фторфенилгидразингидрохлорида (1,6 г) в уксусной кислоте (10 мл) нагревали с обратным холодильником в течение 5 ч. Растворитель выпарили и остаток растворили в этилацетате. Полученный в результате раствор промыли водным раствором натрийбикарбоната, высушили и сконцентрировали в вакууме. Остаток (3 г) подвергли очистке путем колоночной хроматографии на силикагеле, использовав для элюирования хлороформ. Из первого элюата получили масло 3-(хлорметил)-1-(4-фторфенил)-5-[4-(метилтио)фе- нил]пиразола (1,3 г).
ИК-спектр (пленка): 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 2,44 (3Н, с.), 4,64 (2Н, с.), 6,49 (2Н, с.), 6,8-7,3 (8Н, м.).
Масс-спектр (m/z): 332 (М+).
Из второго элюата получили масло 1-(4-фторфенил)-5-4-(метилтио)фенил-3-пира- золметилацетата (0,6 кг).
ИК-спектр (пленка): 1740, 1600, 1515 см-1.
ЯМР-спектр (CDCl3, δ): 2,11 (3Н, с.), 2,44 (3Н, с.), 5,14 (2Н, с.), 6,46 (1Н, с.), 6,8-7,3 (8Н, м.).
П р и м е р 60. Раствор ацетилхлорида (0,48 г) в этилацетате (10 мл) добавили по каплям к охлажденному льдом раствору 1-(4-фторфенил)-5-4-(метилтио)фенил пиразол-3-илметиламина (106 г) и триэтиламина (1 г) в этилацетате (50 мл). Смесь перемешали при 5оС в течение 1 ч, последовательно промыли разбавленной хлористоводородной кислотой, раствором натрийбикарбоната и водой, высушили и сконцентрировали в вакууме. Смесь вышеупомянутого остатка (2,5 г), содержащую N-{1-(4-фторфенил)-5-[4-(метилтио)фенил]пиразол-3-илметил} ацета- мид и мета-хлорпербензойную кислоту (2,8 г) в дихлорметане (50 мл), перемешали при комнатной температуре в течение всей ночи. Смесь промыли раствором натрийбикарбоната и сконцентрировали в вакууме. К оставшемуся порошку (2,1 г), содержащему N-{1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-илметил} ацетамид, добавили этанол и концентрированную хлористоводородную кислоту (15 мл). Смесь нагревали с обратным холодильником в течение 7 ч и сконцентрировали досуха. Остаток растворили в воде, затем раствор сделали основным с помощью натрийгидроксида и экстрагировали этилацетатом. Экстракт промыли водой, высушили и сконцентрировали в вакууме. Полученный остаток (1,4 г) подвергли очистке путем колоночной хроматографии на силикагеле (100 г), использовав для элюирования смесь хлороформа и метанола (10: 1), и в результате получили кристаллы 1-(4-фторфенил)-5-[4-(метилсульфонил)фенил]пиразол-3-илмети- ламина (1,0 г).
Температура плавления: 150-152оС.
ИК-спектр (нуйол): 3380, 3300, 1600, 1510 см-1.
ЯМР-спектр (CDCl3, δ): 1,85 (2Н, с.), 3,07 (3Н, с.), 3,99 (2Н, с.), 6,57 (1Н, с.), 7,0-7,5 (6Н, м.), 7,87 (2Н, д. J 8 Гц).
Масс-спектр (m/z): 345 (М+).
Реферат
Использование: в химико-фармацевтической промышленности. Сущность изобретения: производные пиразола ф-лы, приведенной в тексте описания, обладающие противовоспалительным действием. 6 з. п. ф-лы, 2 табл.
Формула

где R1 фенил, возможно замещенный 1-2 заместителями, выбранными из группы, содержащей низший алкил, галоген, низший алкокси, низший алкилтио, низший алкилосульфонил, низший алкил сульфонилокси, окси, нитро, амино, низший алкиламино, низший диалкиламино, низший алканоиламино, низший алкилсульфониламино и низший алкил (низший алканоил)амино;
R2 водород, метил, замещенный амино, низшим диалкиламино, 1-3 атомами галогена или низшей алканоилоксигруппой, карбоксигруппа, низший алкоксикарбонил, карбамоил, возможно замещенный 1 2 заместителями, выбранными из группы, содержащей низший алкил, карбокси(низший)алкил, циклопропил, фенил и окси, низший алканоил, возможно замещенный низший алкоксигруппой, пирролидинилкарбонил, N-метил-пиперазинилкарбонил, низший алканоиламино, низший алкоксикарбониламино, низший алкилсульфониламино, циано, галоген, низший алкилтио, низший алкилосульфонил или тетразолил;
R3 фенил, замещенный низшим алкилом и/или окси, низшим алкилтио, низшим алкилсульфонилом, низшим алкилсульфинилом, галогеном, амино, низшим алкиламино, низшим алканоиламино, низшим алкилсульфониламино, низшим алкил(низший алканоил)амино, низшим алкокси, циано, низшим алканоилом, или тиенил, замещенный низшим алкилтио или низшим алкилсульфонилом при условии, что когда R2 означает карбоксигруппу или низший алкоксикарбонил или тригалоидметил, то либо R3 означает фенил, замещенный низшим алкилтио, низшим алкилсульфонилом, низшим алкилсульфинилом, амино, низшим алкиламино, низшим алканоиламино, низшим алкилсульфониламино, низшим алкил(низшим алканоил)амино, окси, низшим алканоилом, или тиенил, замещенный низшим алкилтио или низшим алкилсульфонидом, либо R1 означает фенил, возможно замещенный низшим алкилтио, низшим алкилсульфонилом, окси, низшим алкилсульфонилокси, нитро, амино, низшим алкиламино, низшим диалкиламино, низшим алканоиламино, низшим алкилсульфониламино или низшим алкил(низшим алканоил)амино,
или их фармацевтически приемлемые кислотно-аддитивные соли.
22.09.89 при R1 фенил, замещенный атомом галогена, R2 - водород, метил, замещенный низшим диалкиламино, 3-мя атомами галогена, низший алкоксикарбонил, карбоксигруппа, карбамоил, ди(низший алкил)карбомоил, циано, низший алканоил, возможно замещенный низшей алкоксигруппой, R3 фенил, замещенный низшим алкилтио или низшим алкилсульфонилом.

Комментарии