Состав, содержащий смешанный экстракт шелковицы и кожицы poria cocos, предназначенный для профилактики, облегчения состояния и лечения нейродегенеративных расстройств - RU2679654C2
Код документа: RU2679654C2
Чертежи
Описание
Область техники
Настоящее изобретение относится к композиции, содержащей смешанный экстракт шелковицы и кожицы Poria cocos, предназначенный для профилактики, облегчения состояния или лечения нейродегенеративных расстройств.
Предшествующий уровень техники
Дегенеративное неврологическое заболевание - это заболевание, при котором происходит ухудшение ментальной функции из-за постепенной структурной и функциональной утраты нейронов. Дегенеративное неврологическое заболевание может сопровождаться такими симптомами, как деменция, экстрапирамидные нарушения, церебеллярные нарушения, сенсорные нарушения и двигательные расстройства, в связи с дегенерацией нервных клеток в определенных областях нервной системы. Могут также возникать сложные симптомы из-за одновременных множественных нарушений. Заболевание диагностируется в соответствии с клиническими проявлениями у пациента. Однако симптомы широко варьируются и зачастую они сходны с клиническими симптомами других заболеваний, что затрудняет постановку диагноза (Soc. Sci. Med. Vol. 40. No. 6, pp. 847-858, 1995).
Дегенеративное неврологическое заболевание медленно прогрессирует и часто связано с процессом старения. После начала заболевания оно непрерывно прогрессирует в течение нескольких лет или десятилетий до самой смерти, а лечение затруднено, поэтому социальное бремя заболевания велико. Известно, что заболевание с большой вероятностью связано с генетическими факторами, такими как семейная история, но приобретенные факторы также играют важную роль. Дегенеративные неврологические расстройства классифицируются в соответствии с их клиническими симптомами, примеры включают в себя прогрессирующую деменцию (болезнь Альцгеймера и т.д.), неврологические расстройства (такие как болезнь Пика), расстройства позы и движения (такие как болезнь Паркинсона), прогрессирующую атаксию, мышечную атрофию и слабость, сенсорные и двигательные расстройства и так далее (International Journal of Engineering and Technology, Vol. 2, No. 4, August 2010 Classification of Neurodegenerative Disorders Based on Major Risk Factors Employing Machine Learning Techniques).
Цитотоксичность Аβ бляшек и клубков гиперфосфорилированного тау-белка обращает на себя внимание как прямая причина деменции при болезни Альцгеймера - типичном дегенеративном заболевании мозга.
Аβ (бета-амилоид) получается из прекурсора АРР (предшественника бета-амилоида) и продуцируется действием ферментов, таких как β-секретаза и γ-секретаза, и распространяется вне нервных клеток. Когда концентрация Аβ низкая, он находится в растворенном состоянии, но когда она выше определенного уровня, Аβ белки связываются друг с другом с образованием нерастворимых сенильных бляшек. Это вещество может разрушать периферические нервные клетки и быть причиной воспаления и нейротоксичности. Например, считается, что с сенильными бляшками связаны гибель нейронов и микрогранулез, наблюдаемые у пациентов с болезнью Альцгеймера. Результаты анализа in vitro показали, что Аβ может индуцировать активацию микроглиальных клеток (мозговых макрофагов). Это подтверждает гипотезу о том, что основной причиной Аβ-индуцированной болезни Альцгеймера являются микрогранулез и воспаление головного мозга, наблюдаемые у пациентов с болезнью Альцгеймера. На сегодняшний день не существует широко распространенных методов лечения или методов лечения, которые обеспечивали бы значимое растворение Аβ после образования сенильных бляшек или предотвращали бы образование отложений.
Тау-белок состоит из четырех частей: N-концевая выступающая часть, домен агрегации пролина, домен связывания микроорганелл и С-концевой фрагмент (Mandelkow et al., Acta. Neuropathol., 103, 26-35, 1996). Он играет роль в соединении микротрубочек, которые образуют физическую структуру нервных клеток. Известно, что дегенеративные заболевания головного мозга, такие как тауопатия, вызваны аномально гиперфосфорилированным или трансформированным тау-белком в нервных клетках центральной нервной системы. К типичным таупатиям относятся болезнь Альцгеймера, болезнь Пика, фронттемпоральная деменция и болезнь Паркинсона, связанные с хромосомой 17 (FTDP-17) и так далее (Lee et al., Annu. Rev. Neurosci., 24, 1121-1159, 2001; Bergeron et al., J. Neuropathol. Exp.Neurol., 56, 726-734, 1997; Bugiani et al., J. Neuropathol. Exp.Neurol., 58, 667-677, 1999; Delacourte et al., Ann. Neurol., 43, 193-204, 1998; Ittner and Gotz, Nat. Rev. Neurosci., 12, 65-72, 2011).
В теории Альцгеймера в 1980-е годы было предположено, что нейротрофические факторы обладают терапевтическим потенциалом в отношении дегенеративных неврологических расстройств (Nature. 1987 Sep 3-9;329(6134):65-8. Amelioration of cholinergic neuron atrophy and spatial memory impairment in aged rats by nerve growth factor). Исследования показали, что холинергические нейроны в базальном переднем мозге, утраченные в результате старения, что, как известно, является одной из причин болезни Альцгеймера, восстанавливаются при введении в боковой желудочек нейротрофического ростового фактора (НРФ - NGF), в результате чего улучшался объем памяти экспериментальных животных. Поэтому исследования по лечению дегенеративных неврологических заболеваний с помощью нейротрофических факторов были продолжены. В последующем исследовании было проведено исследование по восстановлению функции двигательного нерва при введении экспериментальным животным нейротрофического фактора головного мозга (BDNF), нейротрофина-3 (NT-3), нейротрофина-4 (NT-4) и цилиарного нейротрофического фактора (CNTF), которые являются семейством нейротрофических факторов, нарушающих функцию двигательного нерва за счет образования узелков лицевого нерва и седалищного нерва, и были получены положительные результаты (Nature. 1992 Dec 24-31; 360(6406):757-9. Brain-derived neurotrophic factor prevents the death of motoneurons in newborn rats after nerve section.). Кроме того, в эксперименте с использованием рекомбинантной линии мышей (линии wobbler) с заболеванием, при котором по мере старения постепенно утрачиваются количество и функция двигательных нейронов, количество данных нейронов увеличивалось и функция улучшалась при введении мышам BDNF и CNTF (Science. 1994 Aug 19;265(5175): 1107-10. Arrest of motor neuron disease in wobbler mice cotreated with CNTF and BDNF). В дополнение к вышеуказанным исследованиям сообщалось, что нейротрофические факторы улучшают состояние экспериментальных животных при расстройствах памяти, когнитивных и поведенческих расстройствах за счет увеличения количества и функции нейронов в различных сенсорных и моторных нейропатических моделях.
Научное название шелковицы - Morus alba, и когда плоды лиственного дерева шелковица приобретает пурпурную окраску, их собирают, сушат и используют в качестве лекарственного средства. В восточной медицине шелковица используется для лечения головокружения, шума в ушах, жажды и диабета и т.д. В Японии она применяется в лечении таких состояний, как «Yanghyulguopoong» и «Wind-Heat», и в качестве тонизирующего, обезболивающего, снотворного средства, средства при шуме в ушах, головокружении, болях в спине и так далее (Namba, Т., The Encyclopedia of Wakan-Yaku with Color Pictures Vol. 1 Hoikusha, Osaka, Japan, 1993). В корейской медицинской энциклопедии Donguibogam говорится, что шелковица помогает при жажде и приносит пользу пяти органам, и обладает жизненными силами дерева шелковицы (Donguibogam korean translation committee, Donguibogam, Namsandang, Seoul, Korea, 2000). В китайской фармакопее (КФ) шелковица назначается при головокружении, шуме в ушах, бессоннице и жажде и т.д.
Шелковица содержит антоцианин, фенольную кислоту, флавоноид и другие вещества в качестве основных компонентов; сообщалось, что этот выделенный отдельный компонент и его экстракт обладают сахароснижающим и антиокислительным действием, активностью подавления МАО (моноаминоксидазы) и защищают нейроны.
Научное название тутового гриба - Poria cocos (пория кокосовидная). Poria cocos - это растение семейства Polyporaceae (полипоровые, трутовые грибы), порядка Aphyllophorales (афиллофоровые) класса Eubasidiomycetes (базидиомицеты) подкласса Hymenomycetidae (гименомицеты). Poria cocos - это вид гриба, относящегося к бациллам, который является грибком коричневой гнили, который является разновидностью сапрофитных организмов в сосне, но он также паразитирует на корнях растущей сосны. Мицелий растет, разветвляясь до белого, одновременно начинает расти гифа. Если имеются подходящие условия окружающей среды - температура и влажность, формируются твердые массы склероции. Они носят название «тутовый гриб». В зависимости от цвета внутренней части, белый - это Poria cocos wolf (белая пория кокосовидная), розовый - Jeokbokryeong (красная пория кокосовидная). Внешнюю оболочку Poria cocos называют кожицей Poria cocos.
Основными компонентами Poria cocos являются пархимовая кислота (C33H52O5), пинеколиновая кислота (C30H18O3), 3β-гидрокси-ланоста-7,9(11), 24-триен-21-оновая кислота, тумулозиновая кислота (C31H50O), эбрикоиновая кислота (C31H50O3) и тому подобное. Кроме того, в ней содержатся пургиминовая кислота, эбрикоиновая кислота, полипотеновая кислота А, С, тритерпеноиды и т.д. Другими составляющими являются эргостерол, лецитин, аденин, холин, глюкоза, фруктоза, белок и большое количество неорганических веществ.
Кожица Poria cocos сладкая, по своей природе теплая, вкус и свойства -легкие, поэтому она считается лекарственным веществом с охлаждающими свойствами. В предшествующей литературе описано, что Poria cocos может облегчать жажду, обладает мягкими мочегонными свойствами, удаляет влагу, облегчает состояние и повышает энергию за счет гармонизации функции пищеварительной системы, облегчает боли в пояснице, хорошо улучшает кровообращение в брюшной полости. В основном она использовалась в рецептурах, относящихся к проблемам с памятью. В недавних статьях сообщалось о противодиабетических и противораковых свойствах Poria cocos (Ling Hui, Evaluation of the chemotherapeutic and chemopreventive potential of triterpenoids from Poria cocos, Ling Hui, doctoral thesis of department of pharmacy, National University of Singapore, 2010).
Кожица Poria cocos - это внешняя оболочка склероции Poria cocos, относящейся к полипоровым. Она известна как лекарственное вещество, которое уменьшает отек, удаляя воду. В частности, в ней содержится в большом количестве тритерпеновая порикоиковая кислота на основе лоростана, в Donguibogam говорится о том, что кожица Poria cocos используется как компонент в используемом при отеках составе Opisan (кожура мандарина, околоплодник ареки, кожура имбиря, кожица белой шелковицы). В недавних исследованиях сообщалось, что кожица Poria cocos обладает таким терапевтическим действием, как мочегонное, а также стимуляция образования мочи и уменьшение отека. (Triterpenes from the surface layer of Poria cocos, Takaaki tai, Phytochem, vol. 39, no. 5, 1995; Urinary metabonomic study of the surface layer of Poria cocos as an effective treatment for chronic renal injury in rats, ying yong zhao et al, Journal of Ethnopharmacology, vol. 148, no. 2, s2013).
Исходя из этого, авторы провели исследования для разработки материалов для фармацевтических и пищевых композиций для эффективной профилактики, облегчения и лечения дегенеративных неврологических заболеваний. В результате авторы настоящего изобретения подтвердили, что эти растительные экстракты демонстрируют значительную активность в восстановлении памяти при нейропатии мозга, вызванной различными повреждениями головного мозга или нарушающими память лекарственными средствами во время исследования нейропсихологической активности шелковицы и кожицы Poria cocos. Кроме того, было показано, что эти травяные экстракты препятствуют выработке веществ, которые вызывают гибель нейронов в мозге, и защищают нервные клетки, способствуя экспрессии белков, способствующих регенерации и дифференциации нервных клеток. Авторы настоящего изобретения создали настоящее изобретение, подтвердив, что смешивание экстрактов шелковицы и кожицы Poria cocos в определенном соотношении обеспечивает максимальный эффект по сравнению с однокомпонентными растительными экстрактами.
Подробное раскрытие изобретения
Техническая задача
Цель настоящего изобретения заключается в разработке фармацевтической композиции для профилактики и лечения дегенеративных неврологических заболеваний и здорового функционального питания для профилактики и облегчения дегенеративных неврологических заболеваний, в которой в качестве действующего вещества используется смешанный экстракт шелковицы и кожицы Poria cocos.
Техническое решение
Для достижения вышеуказанной цели в настоящем изобретении представлена фармацевтическая композиция для профилактики и лечения дегенеративных неврологических заболеваний и здорового функционального питания для профилактики и облегчения дегенеративных неврологических заболеваний, содержащая смешанный экстракт шелковицы и кожицы Poria cocos.
Полезные эффекты изобретения
Согласно настоящему изобретению, смешанный экстракт шелковицы и кожицы Poria cocos подавляет образование бета-амилоида (Abeta) и фосфорилирование тау-белка, которые могут вызывать дегенеративные заболевания головного мозга путем провоцирования гибели нейронов, и обладает эффектом защиты нервных клеток, способствуя выработке NGF, являющегося фактором, способствующим выживанию и дифференциации нервных клеток. Кроме того, экстракт обладает свойством ингибирования ацетилхолинэстеразы (AChE), за счет чего повышается нервная проводимость, и опосредуется действие, улучшающее память. Таким образом, смешанный экстракт шелковицы и кожицы Poria cocos может быть эффективно использован для разработки фармацевтической композиции для профилактики и лечения дегенеративных неврологических заболеваний, включая деменцию, или для разработки здорового питания для профилактики и облегчения дегенеративных неврологических заболеваний.
Краткое описание чертежей
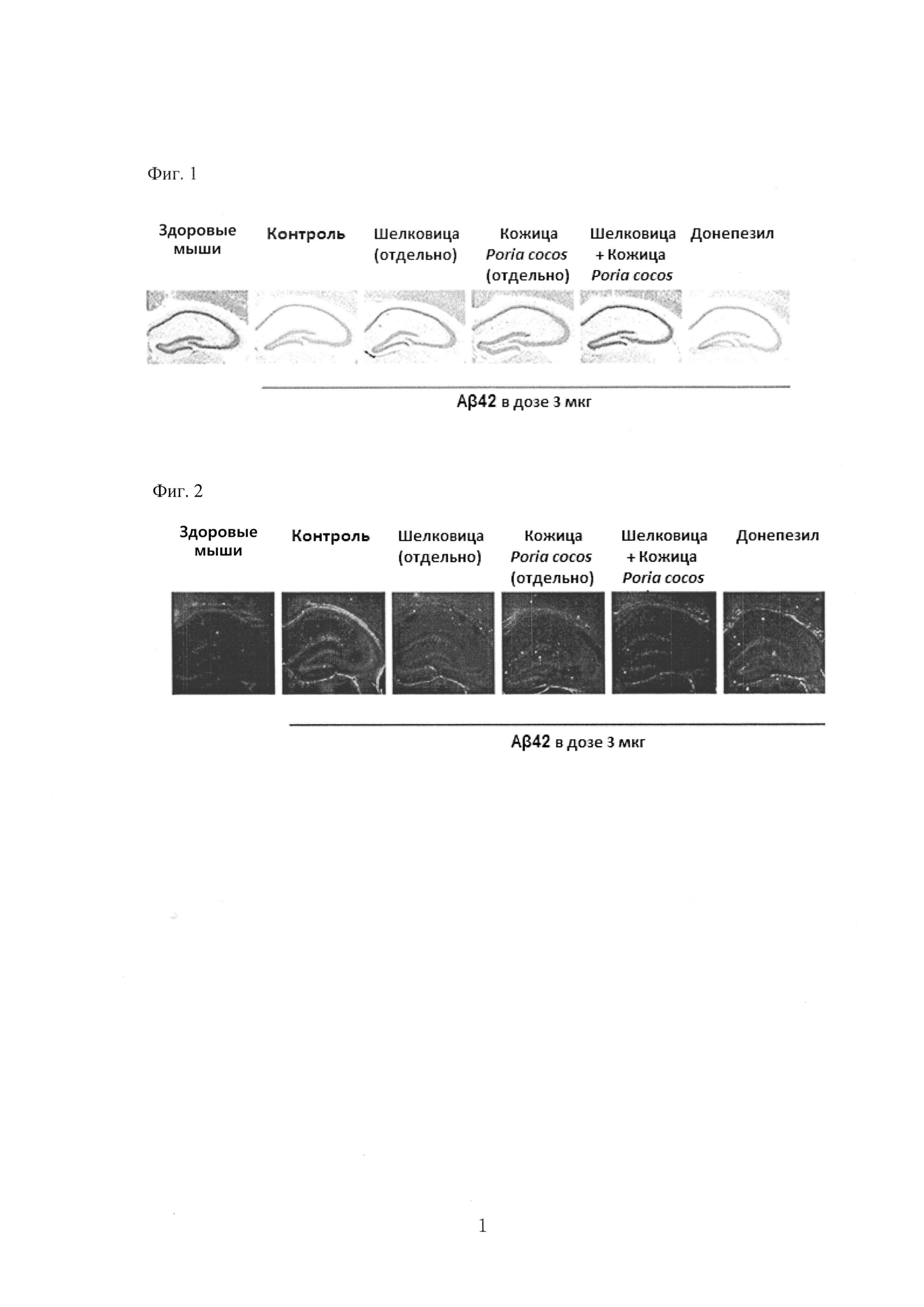
На ФИГ. 1 показаны результаты, полученные при инъекции смешанного растительного экстракта, однокомпонентного экстракта и контрольного препарата в модели с индукцией нейротоксичности бета-амилоидом и окрашивании NeuN (маркер нейронных клеток).
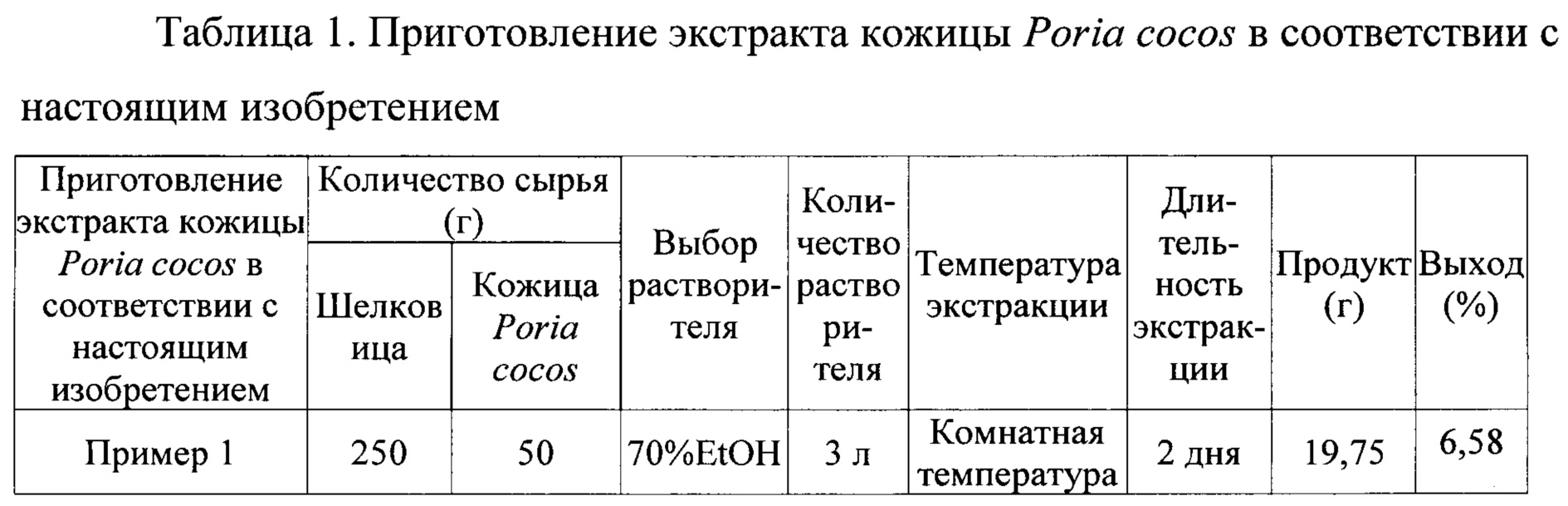
На ФИГ. 2 показаны результаты, полученные со смешанным экстрактом, однокомпонентным экстрактом и контрольным препаратом в модели с индукцией нейротоксичности бета-амилоидом и при окрашивании FJB (маркер гибели клеток).
Принцип изобретения
Далее настоящее изобретение раскрыто подробно.
Настоящее изобретение относится к фармацевтической композиции для профилактики или лечения дегенеративных неврологических заболеваний, содержащей в качестве действующего вещества смешанный экстракт шелковицы и кожицы Poria cocos.
Смешанный экстракт согласно настоящему изобретению может быть получен в соответствии с обычным способом приготовления растительных экстрактов, но конкретно означает неочищенный экстракт, полученный с использованием воды, спирта или смеси воды и спирта. Спирт, который является одним из экстракционных растворителей, может представлять собой низший спирт, имеющий от 1 до 4 атомов углерода, предпочтительно метанол, этанол, бутанол или винный спирт, более предпочтительно этанол, но не ограничивается перечисленным. Винный спирт здесь означает этанол, полученный ферментированием крахмального или сахаридного сырья с последующей дистилляцией. Далее смешанный растворитель из воды и спирта особо не ограничивается, и смесь может иметь любое желаемое соотношение.
В одном из примеров осуществления настоящего изобретения смешанный экстракт шелковицы и кожицы Poria cocos может быть экстрагирован смесью, содержащей от 60 до 80% (по объему) этанола, или от 65 до 75% (по объему) этанола или 70% (по объему), без ограничения перечисленным.
В другом примере осуществления настоящего изобретения весовое отношение шелковицы и кожицы Poria cocos может быть таково, что от 4 до 7 весовых частей шелковицы приходятся на 1 весовую часть кожицы Poria cocos, или от 4 до 6 весовых частей шелковицы приходятся на 1 весовую часть кожицы Poria cocos, или 5 весовых частей шелковицы приходятся на 1 весовую часть кожицы Poria cocos, без ограничения перечисленным.
Смешанный экстракт согласно настоящему изобретению включает все формы экстракта, полученного экстрагированием смеси шелковицы и Poria cocos, и экстракта, полученного раздельным экстрагированием шелковицы и Poria cocos с последующим смешиванием экстрактов. В частности, шелковицу и кожицу Poria cocos смешивают в необходимом весовом соотношении и экстрагируют, или отдельно экстрагируют шелковицу и кожицу Poria cocos соответствующими методами, а затем экстракты смешивают в необходимом весовом соотношении.
Более конкретно, смешанный экстракт согласно настоящему изобретению может быть получен следующим образом. Сначала шелковицу и кожицу Poria cocos промывают и сушат, затем высушенные растения разрезают для получения растений в нарезанном виде. Высушенные и нарезанные шелковицу и кожицу Poria cocos смешивают при весовом отношении шелковицы и кожицы Poria cocos в интервале 0,1÷10, и предпочтительно смесь получают путем смешивания так, что от 4 до 7 весовых частей шелковицы приходятся на 1 весовую часть кожицы Poria cocos. К смеси шелковицы и кожицы Poria cocos добавляется вода, или низший спирт, содержащий от 1 до 4 атомов углерода, или смесь воды и низшего спирта, предпочтительно 70 об.% этанола, в количестве, в 1÷20 (об/вес) раз или предпочтительно в 5÷10 (об/вес) раз большем массы смеси. Затем смесь подвергается экстракции при температуре от 10°С до 100°С, предпочтительно при комнатной температуре в течение от 1 часа до 72 часов, предпочтительно 48 часов, экстракцией холодной водой, экстракцией горячей водой, ультразвуковой экстракцией, экстракцией с обратным холодильником, тепловой экстракцией или сверхкритической экстракцией. Предпочтительно проводить однократную экстракцию холодной водой и концентрирование при пониженном давлении с получением смешанного экстракта шелковицы и кожицы Poria cocos.
Полученная в соответствии с настоящим изобретением композиция, содержащая смешанный экстракт шелковицы и кожицы Poria cocos, может быть использована в качестве действующего вещества для лечения дегенеративных неврологических заболеваний. Соответственно, в настоящем изобретении предложена фармацевтическая композиция для профилактики и лечения дегенеративных неврологических заболеваний, которая содержит смешанный экстракт шелковицы и кожицы Poria cocos в качестве действующего вещества и использование смешанного экстракта шелковицы и кожицы Poria cocos для приготовления лекарственного средства для применения при дегенеративных неврологических заболеваниях, и способ лечения дегенеративного неврологического заболевания, включающий введение субъекту терапевтически эффективного количества смешанного экстракта шелковицы и кожицы Poria cocos.
Как указано выше, «дегенеративное неврологическое заболевание» в соответствии с настоящим изобретением означает дегенеративное заболевание, влияющее на ментальную функцию и вызванное постепенной структурной и функциональной потерей нервных клеток (нейронов). В частности, это понятие включает в себя заболевания из группы, в которую входят болезнь Альцгеймера, болезнь Крейтцфельдта-Якоба, болезнь Хантингтона, рассеянный склероз, синдром Гийена-Барре, болезнь Паркинсона, болезнь Лу Герига, прогрессирующая деменция, вызванная постепенной гибелью нейронов, прогрессирующая атаксия и так далее.
В одном из примеров осуществления настоящего изобретения, фармацевтическая композиция для профилактики и лечения дегенеративных неврологических заболеваний, содержащая в качестве действующего вещества смешанный экстракт шелковицы и кожицы Poria cocos в интервале от 0,01 до 90 весовых частей, или в интервале от 0,1 до 90 весовых частей, или в интервале от 1 до 90 весовых частей или в интервале от 10 до 90 весовых частей на 100 весовых частей конечной фармацевтической композиции, но не ограничивается нижеперечисленным и может изменяться в зависимости от состояния, типа и течения заболевания.
В другом примере осуществления настоящего изобретения фармацевтическая композиция для профилактики и лечения дегенеративных неврологических заболеваний, содержащая в качестве действующего вещества смешанный экстракт шелковицы и кожицы Poria cocos, может быть включена в состав фармацевтических препаратов для профилактики и лечения дегенеративных неврологических расстройств, включая подходящие для фармацевтического применения носители, разбавители или эксципиенты (вспомогательные вещества).
Примерами носителей, эксципиентов и разбавителей являются лактоза, декстроза, сахароза, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, аравийская камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлоза, метилцеллюлоза, микрокристаллическая целлюлоза, поливинилпирролидон, вода, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло.
Композиция согласно настоящему изобретению может быть составлена в форме препаратов для приема внутрь, таких как порошки, гранулы, таблетки, капсулы, суспензии, эмульсии, сиропы, аэрозоли, и в форме препаратов для наружного применения, суппозиториев или стерильного раствора для инъекций в соответствии с обычным способом приготовления соответствующих лекарственных форм. Как правило, лекарственную форму можно получить, используя разбавитель, наполнитель, экстендер, связующее, смачивающий агент, разрыхлитель, поверхностно-активное вещество или обычно используемый эксципиент.К твердым лекарственным формам для приема внутрь относятся таблетки, пилюли, порошки, гранулы, капсулы и тому подобное; они могут содержать, по меньшей мере, один эксципиент, например, крахмал, карбонат кальция, сахарозу, лактозу, желатин и тому подобное. В дополнение к простым эксципиентам могут также использоваться лубриканты (смазывающие вещества), такие как стеарат магния и тальк. К жидким препаратам для приема внутрь относятся суспензии, растворы, эмульсии и сиропы. В дополнение к обычно используемым простым разбавителям, таким как вода и вазелиновое масло, могут быть включены различные вспомогательные вещества, такие как увлажнители, подсластители, ароматизаторы, консерванты и др. К препаратам для парентерального введения относятся стерилизованные водные растворы, неводные растворы, суспензии, эмульсии, лиофилизированные препараты и суппозитории. Примерами суспендирующих агентов являются пропиленгликоль, полиэтиленгликоль, растительное масло, например, оливковое масло, инъекционный эфир, например этилолеат, и так далее. Примеры основ для суппозиториев включают в себя витепсол, макрогол, твин 61, масло какао, лаурин, глицерожелатин и так далее.
Настоящее изобретение предлагает способ для лечения нейродегенеративных заболеваний, который включает введение млекопитающему, включая человека, фармацевтической композиции, содержащей в качестве действующего вещества смешанный экстракт шелковицы и кожицы Poria cocos в терапевтически эффективном количестве.
Дозировка фармацевтической композиции для профилактики и лечения дегенеративных неврологических заболеваний, содержащей в качестве действующего вещества смешанный экстракт шелковицы и кожицы Poria cocos, согласно настоящему изобретению, может варьироваться в зависимости от возраста, пола и веса тела пациента. В общем случае предпочтительно использовать дозировку в интервале от 0,1 до 100 мг/кг, или в интервале от 1 до 30 мг/кг, с введением один или несколько раз в день. Дозировка может быть увеличена или уменьшена в зависимости от способа введения, степени тяжести заболевания, пола, веса тела, возраста, состояния здоровья, диеты, времени и способа введения, скорости выведения и т.д. В связи с этим дозировка никоим образом не ограничивает объем раскрытия изобретения.
Фармацевтическая композиция, содержащая смешанный экстракт шелковицы и кожицы Poria cocos согласно настоящему изобретению, может вводиться различными способами млекопитающим, таким как крысы, мыши, домашний скот, человек. Могут рассматриваться все способы введения, например, пероральное, ректальное или внутривенное, внутримышечное или подкожное введение, внутриутробная дуральная или интрацеребральная инъекция.
Смешанный экстракт шелковицы и кожицы Poria cocos в соответствии с настоящим изобретением имеет небольшую токсичность и побочные эффекты, поэтому его можно безопасно использовать для долгосрочного применения в профилактических целях.
Настоящее изобретение также предлагает пищевую композицию, включающую смешанный экстракт шелковицы и кожицы Poria cocos. Смешанный экстракт шелковицы и кожицы Poria cocos подавляет образование веществ, вызывающих гибель нейронов в мозге и способствуем экспрессии белков, стимулирующих регенерацию и дифференциацию нейронов для защиты нервных клеток и может эффективно использоваться для производства продуктов здорового функционального питания и обычных продуктов питания, которые могут обладать, в частности, профилактическими и лечебными свойствами при нейродегенеративных заболеваниях.
В частности, под продуктами здорового функционального питания в настоящем изобретении понимаются продукты согласно определения в «Законе о здоровой функциональной пище» 2002 года, заново определенные как те, для которых «функциональность и безопасность для организма человека были достаточно обоснованы и соответствуют уведомлению 2004-12 Управления по контролю за продуктами и лекарствами о Положении о признании ингредиентов здоровых функциональных продуктов или ингредиентов, указанных в Законе».
Возможны различные способы использования пищевой композиции, содержащей смешанный экстракт шелковицы и кожицы Poria cocos в соответствии с настоящим изобретением, для питания с целью облегчения симптомов дегенеративных неврологических заболеваний. В качестве пищевого продукта, к которому может быть добавлен растительный экстракт согласно настоящему изобретению, различные продукты, такие как напитки, гумми, чай, витаминные комплексы, продукты и напитки здорового функционального питания, их также можно использовать в виде пилюль, порошков, гранул, инъекций, таблеток, капсул или напитков.
Обычно смешанный экстракт шелковицы и кожицы Poria cocos согласно настоящему изобретению может добавляться в продукт питания в количестве от 0,1% (весовых) до 15% (весовых), предпочтительно от 0,2% (весовых) до 10% (весовых), а в случае композиции для напитка для здорового функционального питания - от 0,1 г до 30 г, предпочтительно от 0,2 г до 5 г, на объем 100 мл.
В случае, когда пищевая композиция в соответствии с настоящим изобретением готовится в форме напитка, отсутствуют особые ограничения на жидкие ингредиенты, отличные от тех, которые содержат растительные экстракты в качестве основных ингредиентов в указанной пропорции. Кроме того, в качестве дополнительного ингредиента могут добавляться различные ароматизаторы или натуральные углеводы, например, обычные напитки.
Примеры вышеупомянутых натуральных углеводов включают в себя моносахариды, такие как глюкоза и фруктоза; дисахариды, такие как мальтоза, сахароза; полисахариды, такие как декстрин, циклодекстрин и тому подобное, или сахарные спирты, такие как ксилит, сорбит и эритрит и так далее. В качестве натуральных ароматизаторов, кроме упомянутых выше, могут с успехом использоваться натуральные ароматизаторы (тауматин, экстракт стевии (например, ребаудиозида А, глицирризин, и т.д.)) и синтетические ароматизаторы (сахарин, аспартам и т.д.). Содержание натурального углевода обычно в интервале 1÷20 г, предпочтительно в интервале 5÷12 г на 100 мл готовой композиции согласно настоящему изобретению.
В дополнение к вышесказанному, пищевая композиция согласно настоящему изобретению может дополнительно содержать различные добавки, такие как различные нутриенты, витамины и минералы (электролиты), ароматизаторы, такие как синтетические и натуральные ароматизаторы, красители и загустители, пектиновая кислота и ее соли, альгиновая кислота и ее соли, органические кислоты, защитные коллоидные загустители, регуляторы рН, стабилизаторы, консерванты, глицерин, спирты, карбонатные агенты, используемые в газированных напитках, и тому подобное. Кроме того, композиции согласно настоящему изобретению могут содержать натуральные фруктовые соки и жом для производства фруктовых соков и овощных напитков. Эти компоненты могут использоваться по отдельности или в комбинации. Соотношение таких добавок особо не ограничивается, но обычно выбирается в диапазоне от 0 до примерно 20 весовых частей на 100 весовых частей готовой пищевой композиции согласно настоящему изобретению. В другом варианте осуществления настоящее изобретение является способом профилактики, облегчения или лечения дегенеративных неврологических заболеваний, включающим в себя введение композиции, содержащей действующее вещество в виде комбинации смешанного экстракта шелковицы и кожицы Poria cocos. В других примерах настоящее изобретение предлагает использование смешанного экстракта шелковицы и кожицы Poria cocos для профилактики, облегчения или лечения дегенеративных неврологических заболеваний. Дозировка, лекарственная форма, способ введения и прочие характеристики композиции, содержащей смешанный экстракт шелковицы и кожицы Poria cocos для такого способа или использования, такие же, как указано выше.
ПОДРОБНОЕ РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет более подробно раскрыто со ссылкой на следующие примеры и эксперименты. Однако следующие примеры и эксперименты должны только проиллюстрировать настоящее изобретение, область действия настоящего изобретения не ограничена ими.
Пример 1. Получение экстракта кожицы Poria cocos в соответствии с настоящим изобретением
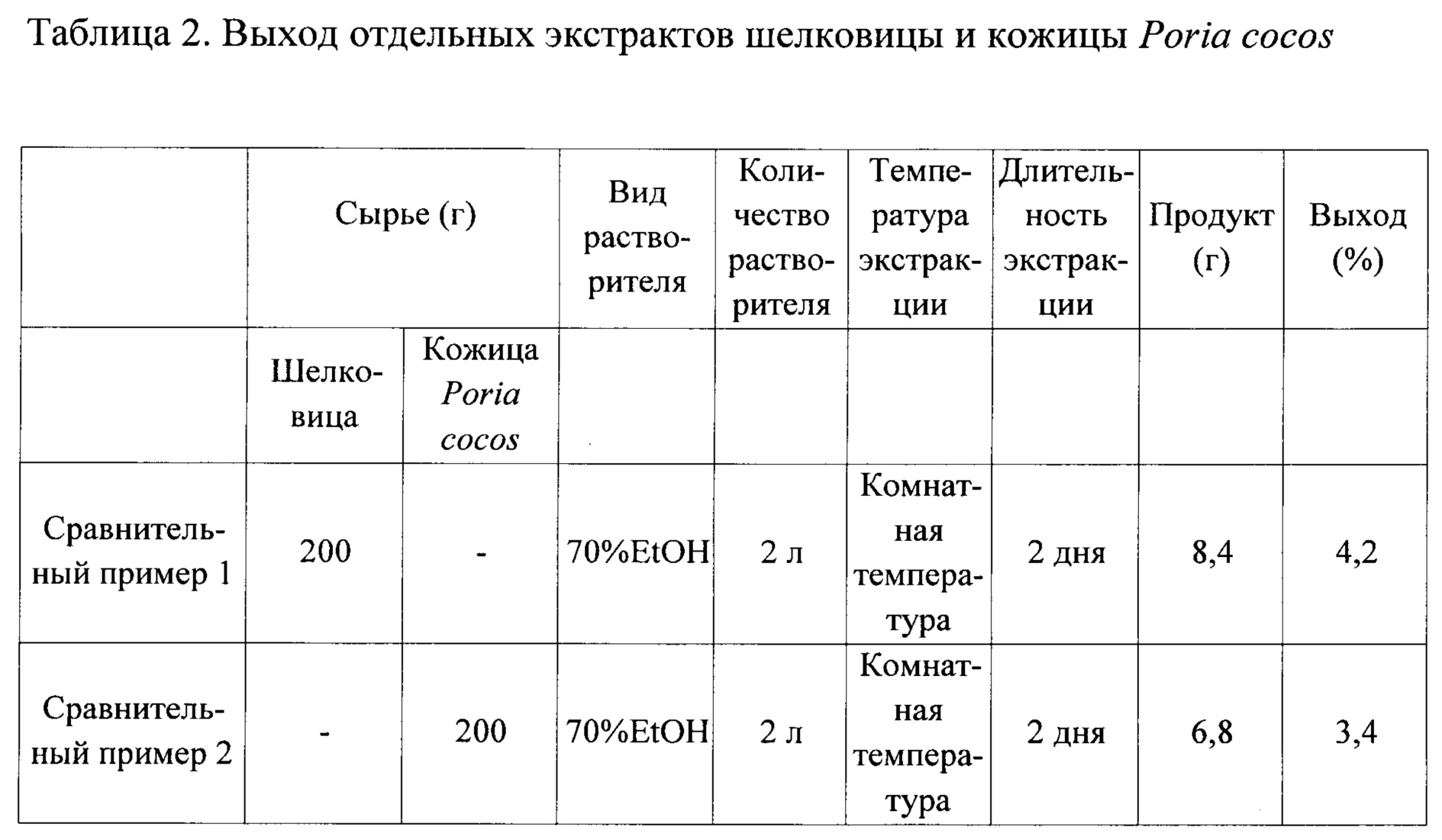
Высушенные шелковица и кожица Poria cocos были приобретены в магазине лекарственных трав на рынке Куаньдут (Kyungdong), после удаления загрязнений использовали для эксперимента хорошо высушенное растительное сырье. Шелковицу и кожицу Poria cocos нарезали с помощью устройства для резки и смешивали при весовом соотношении 5: 1 в количестве 300 г. К растительной смеси добавили 3 л 70% (об.) водного раствора этанола, смесь охлаждали при комнатной температуре в течение 48 часов. После фильтрации смесь концентрировали при пониженном давлении и затем лиофилизировали с получением сырого растительного экстракта (сырой экстракт) для Примера 1 (см. таблицу 1).
Сравнительный пример 1. Получение экстракта шелковицы
200 г того же растительного сырья шелковицы, что и в Примере 1, приготовлены с помощью того же способа, что и в Примере 1, для получения сырого экстракта шелковицы, который был использован как Сравнительный пример 1 (см. таблицу 2).
Сравнительный пример 2. Получение экстракта кожицы Poria cocos
В сравнительном примере 2 для получения сырого экстракта кожицы Poria cocos приготовлены 200 г того же растительного сырья кожицы Poria cocos, что и в Примере 1, с помощью того же способа, что и в Примере 1 (см. таблицу 2).
Сравнительные примеры 3-8. Получение смешанных сырых экстрактов шелковицы и кожицы Poria cocos
В эксперименте использовано то же сырье, что и шелковица и кожица Poria cocos из Примера 1. Шелковицу и кожицу Poria cocos нарезали с помощью устройства для резки, шелковицу и кожицу Poria cocos смешали, как показано в таблице 3, к растительной смеси добавляли 70% водный раствор этанола объемом в 10 раз больше объема растительной смеси, смесь подвергли холодной экстракции при комнатной температуре в течение 48 часов. После концентрирования при пониженном давлении смесь лиофилизировали с получением сырого растительного экстракта (сырой экстракт), который использовали в качестве Сравнительных примеров 3-8.

Экспериментальный пример 1. Проверка эффекта улучшения памяти и защиты нервных клеток за счет смешанных растительных экстрактов
1-1. Подготовка экспериментальных животных
Модель нарушения памяти под действием скополамина
Для эксперимента использовали шестинедельных мышей линии ICR, каждая экспериментальная группа состояла из 8 животных.
Через 30 минут после введения внутрь Исследуемого препарата (Пример), Препарата сравнения (сравнительный пример) и Донепезила (Контрольный препарат), вводили внутрибрюшинно 1 мг/кг скополамина. Контрольным животным вводили такое же количество физиологического раствора. Поведенческие исследования проводились через 30 минут введения скополамина.
Модель с инъекцией Аβ
Для эксперимента использовали шестинедельных мышей линии ICR. Животных анестезировали, фиксировали в стереотаксическом аппарате (Stoelting) и вводили 3 мкл носителя (искусственная спинномозговая жидкость) или Аβ42 в течение 6 минут с помощью микрошприца Гамильтон (с иглой калибра 26).
Животные, которым был введен препарат Аβ42, случайным образом распределяли в экспериментальные группы. Спустя 2 дня после введения Аβ42 экспериментальный препарат и положительный контрольный препарат вводили один раз в день в течение 11 дней.
Лиофилизированный препарат, препарат сравнения и контрольный препарат суспендировали в 3% водном растворе НРМС, все препараты готовили в день эксперимента.
Измерение белка в мозге
Для исследования влияния смешанных растительных экстрактов на выработку индуктора гибели нервных клеток и веществ, участвующих в защите клеток, шестинедельным мышам линии ICR в течение 5 дней вводили исследуемый препарат, препарат сравнения и контрольный препарат. На 5-й день через 4 часа после введения экспериментальных животных умерщвляли и отделяли мозг. В эксперименте использовались все части, за исключением мозжечка и продолговатого мозга.
1-2. Тест с пассивным избеганием
Эксперименты с пассивным избеганием проводились в двух независимо разделенных освещенном и темном квадратных боксах. Освещенные области (20×20×20 см) освещались лампами накаливания мощностью 50 Вт. Светлые и темные области (20×20×20 см) были разнесены на расстояние 1 см друг от друга, где были установлены 2 мм стержни из нержавеющей стали.
В фазе адаптации две секции разделялись гильотинной дверью (5×5 см), гильотинная дверь открывалась через 30 секунд после помещения экспериментальных животных в светлую область. Животные могли свободно перемещаться. Когда они достигали темной области, гильотинная дверь закрывалась и животных извлекали через 3 секунды.
Испытания по формированию рефлекса проводили спустя 24 часа. Через 30 минут введения препарата внутрибрюшинно вводили 1 мг/кг скополамина, а через 30 минут проводили поведенческий эксперимент. Экспериментальных мышей первоначально размещали в освещенной области, через 30 секунд дверь между областями открывалась. После того как экспериментальные мыши входили в темную область, гильотинная дверь закрывалась и немедленно применялось электроболевое раздражение лап животных через стержень из нержавеющей стали в течение 2 секунд с интенсивностью 0,5 мА, через 10 секунд животных вынимали. Мы измеряли время, когда животные входили в темную зону.
После проведения опытов по формированию рефлекса и 24-часового периода отдыха экспериментальных животных помещали в освещенную область для определения сохранения рефлекса и измеряли время до входа в темную область. Как в опытах по формированию, так и в опытах по сохранению рефлекса определяли время, необходимое для того, чтобы мышь вошла всеми четырьмя лапами в темную область из светлой области.
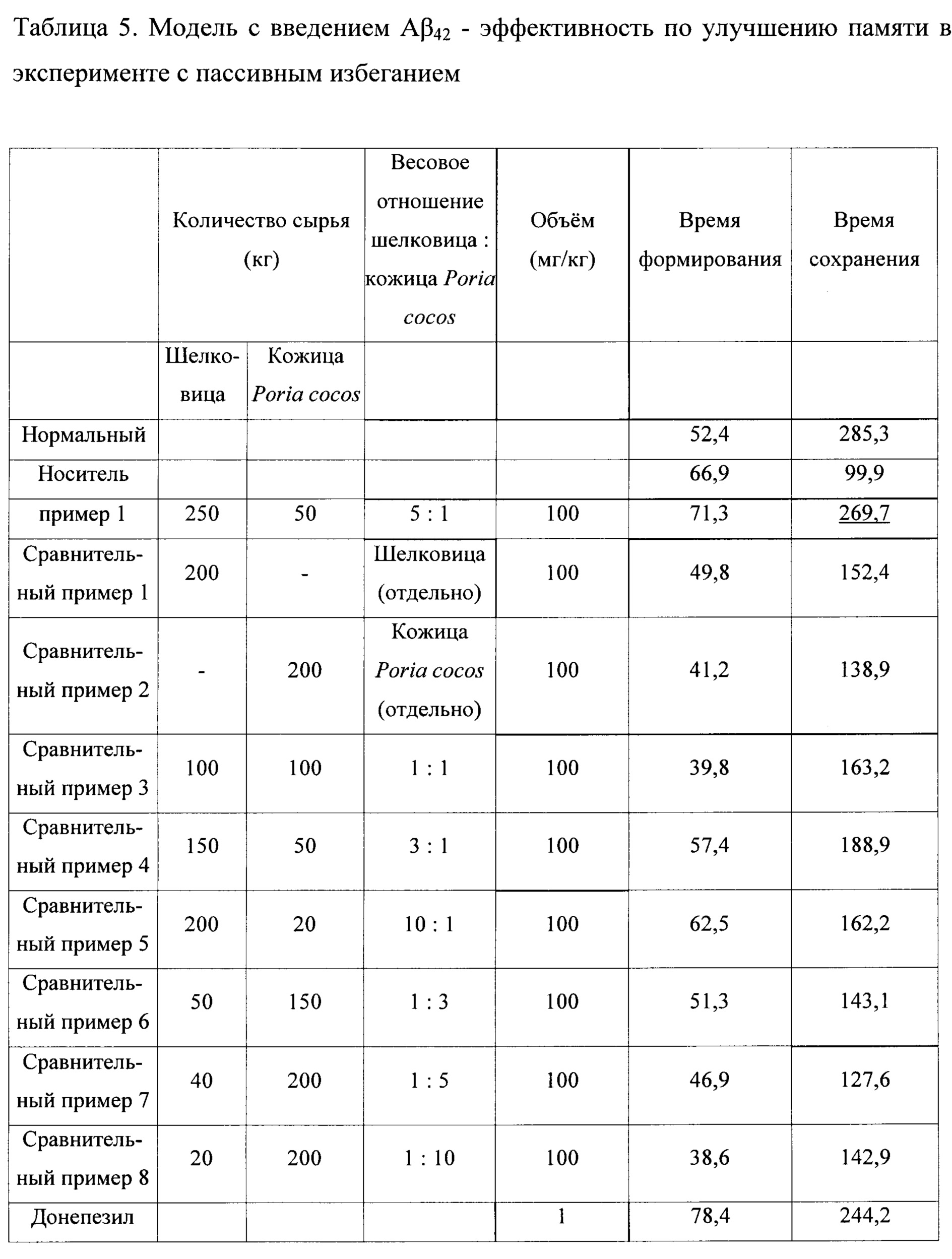
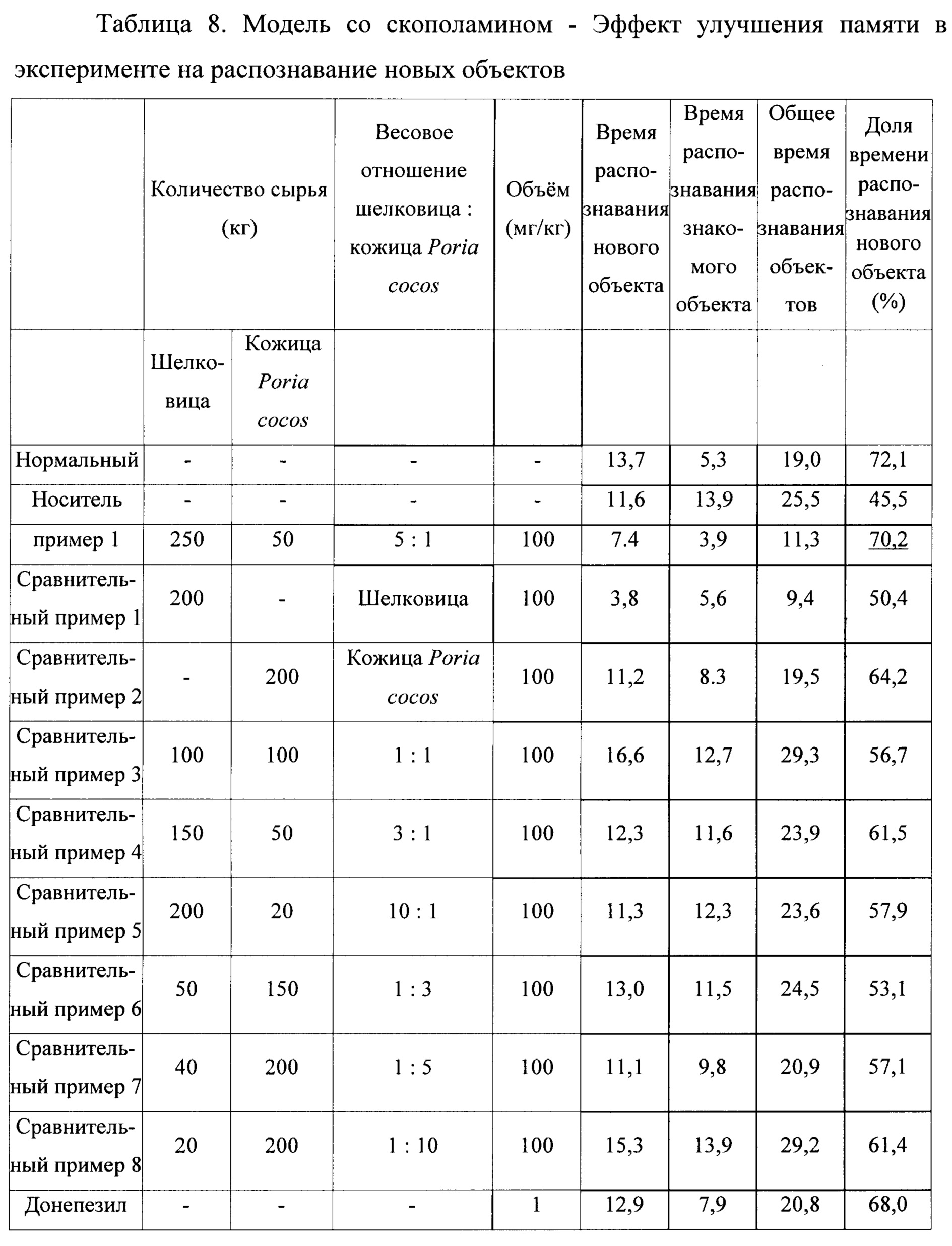
В результате, как показано в таблицах 4 и 5, эффект улучшения памяти был подтвержден как в модели потери памяти, вызванной скополамином, так и в модели деменции Альцгеймера, индуцированной Аβ42. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, смесь шелковицы и кожицы Poria cocos в соотношении 5: 1 показала значительный эффект улучшения пространственной памяти. Смешанный экстракт согласно Примеру 1 показал эффективность, равную или превышающую эффективность 1 мг/кг донепезила (DPZ), который известен как ингибитор ацетилхолинэстеразы.

1-3. Тест с Y-образным лабиринтом
Эксперимент с Y-образным лабиринтом проводили для исследования влияния на кратковременную память. Животных помещали в одну из ветвей Y-образного лабиринта и оставляли на 8 минут без ограничения перемещения. Измеряли спонтанное чередование и общее количество вхождений. Когда животных последовательно вводили в три ветви, это определялось как чередующееся вхождение, рассчитывали соотношение по формуле 1.
Формула 1:

В результате, как показано в таблицах 6 и 7, мы подтвердили эффект улучшения памяти как в модели снижения памяти, вызванного скополамином, так и в модели деменции Альцгеймера, индуцированной Аβ42. В частности, при сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, смесь шелковицы и кожицы Poria cocos в соотношении 5:1, смесь шелковицы и кожицы Poria cocos согласно Примеру 1 показала значительный эффект улучшения когнитивной функции и памяти. В частности, смешанный экстракт из Примера 1 показал лучшую эффективность, чем донепезил (DPZ) в дозе 1 мг/кг, который известен как ингибитор ацетилхолинэстеразы.


1-4. Тест на распознавание новых объектов (РНО)
Внутри черного ящика шириной 45 см, длиной 45 см, высотой 50 см были установлены два пластиковых объекта одинакового размера, но разной формы. Экспериментальным животным разрешалось свободно перемещаться в течение 8 минут, и измерялось время, затрачиваемое на каждый объект (обучающий сеанс). Спустя 24 часа экспериментальных животных помещали в бокс с одним знакомым объектом и одним новым объектом в обучающем сеансе и измеряли время, затрачиваемое на каждый объект (сеанс тестирования). Полученные значения использовали для расчета по формуле (2), которая выражает результат распознавания нового объекта.
Формула 2:

В результате, как показано в таблицах 8 и 9, мы подтвердили эффект улучшения памяти как в модели снижения памяти, вызванного скополамином, так и в модели деменции Альцгеймера, индуцированной Аβ42. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, смесь шелковицы и кожицы Poria cocos в соотношении 5:1 показала значительный эффект улучшения когнитивной функции и памяти. По сравнению с донепезилом (DPZ) 1 мг/кг, который известен как ингибитор ацетилхолинэстеразы, смешанный экстракт из Примера 1 показал аналогичный эффект улучшения когнитивной функции и памяти в модели снижения памяти, вызванного скополамином, и продемонстрировал эффект улучшения когнитивной функции и памяти равный или превышающий соответствующий эффект в модели с введением Аβ42.

1-5. Иммуногистохимическое окрашивание
Для иммуногистохимического окрашивания животным с введенным Аβ, как описано в Экспериментальном примере 1-1, выполняли перфузию 1 × ФСБР (фосфатно-солевой буферный раствор), фиксированный 4% параформальдегидом, после чего удаляли мозг.Мозг фиксировали в том же растворе в течение одного дня и хранили в 30% -ном растворе сахарозы, раствор меняли каждые два дня до замораживания при 4°С. После этого мозговую ткань замораживали до нужной степени при -20°С, помещая в криостат с температурой, оптимальной для резания (ОСТ), затем получали срезы толщиной 30 мкм и хранили при 4°С в растворе консерванта. Иммуногистохимическое окрашивание выполняли с участком гиппокампа. Ткани, промытые ФСБР, обрабатывали 1% H2O2 в течение 15 минут, после чего ткани обрабатывали 0,05 М ФСБР, 1,5% нормальной сыворотки козы, 0,5 мг/мл бычьего сывороточного альбумина, 0,3% тритона Х-100 и первичного козьего антитела NeuN (1:500) и обрабатывали при 4°С в течение 24 часов для предотвращения неспецифических реакций. После удаления первичного антитела ткань в течение 90 минут обрабатывали вторичным антителом, конъюгированным с пероксидазой (1:200), ABC разбавляли в буфере и оставляли для протекания реакций при комнатной температуре в течение примерно 1 часа. После трехкратной промывки с помощью ФСБР ткань проявляли с 0,02% раствора DAB и 0,01% H2O2 и проводили обезвоживание этанолом и ксилолом для получения микроскопических препаратов.
Для окрашивания FJB (Fluoro-Jade-B) срезы тканей фиксировали в течение 5 минут с помощью ФСБР, содержащего 4% параформальдегида, и хранили при -70°С. На следующий день микроскопические препараты, высушенные в течение 3 часов, погружали на 10 минут в 0,06% раствор перманганата нитрата калия. После промывки водой микроскопические препараты погружали на 20 минут в 0,1% раствор уксусной кислоты и 0,0004% FJB (Calbiochem, Сан-Диего, Калифорния, США). Микроскопические препараты трижды промывали дистиллированной водой и сушили при 55°С в течение 10 минут. Для получения изображений использовался мультифокальный микроскоп (Olympus, Япония), фотоизображения были получены с помощью видеокамеры с системой для получения малоконтрастного изображения.
В результате, как показано на рис. 1, при введении смешанного экстракта растительного сырья экспрессия NeuN как маркера нейронных клеток была выше, чем в контрольной группе. Это означает, что в группе смешанного растительного экстракта снижение количества нейронов было уменьшено. Отдельно взятые экстракты шелковицы и кожицы Poria cocos оказывали защитное действие на нейроны, но оно было слабее по эффективности, чем действие смешанных растительных экстрактов. Контрольный препарат донепезил не продемонстрировал нейропротекторного действия.
Как показано на Фиг. 2, по сравнению с контролем, экспрессия маркера апоптоза FJB при применении смешанного растительного экстракта снизилась. Из этого результата следует, что увеличение количества нервных клеток, показанных на рис. 1, опосредуется путем подавления гибели нейронных клеток в результате агрегации бета-амилоидов.
1-6. Измерение образования бета-амилоида в головном мозге
Были проведены эксперименты ИФА (ELISA) по исследованию ингибирующего эффекта смешанных растительных экстрактов в отношении выработки бета-амилоидов, что, как известно, является основной причиной болезни Альцгеймера.
У здоровых животных в Экспериментальном примере 1-1 экстрагировали головной мозг, отделяли область гиппокампа, добавляли RIPA-буфер и гомогенизировали механическим способом. После центрифугирования отбирали супернатант и измеряли концентрацию бета-амилоида (IBL). Измеряли количество образовавшегося Аβ40 в 1 мг белка.
В результате, как показано в таблице 10, было подтверждено, что выработка бета-амилоида заметно уменьшилась благодаря введению смешанного растительного экстракта. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, смесь шелковицы и кожицы Poria cocos в соотношении 5:1 показала более высокий ингибирующий эффект на образование бета-амилоидов. Отдельно взятые растительные экстракты также проявляли активность по снижению бета-амилоидов. Среди них экстракт шелковицы показал относительно сильный ингибирующий эффект в отношении образования бета-амилоидов, а в случае смешанного экстракта растительного сырья эффект снижения бета-амилоидов был выше при более высоком весовом соотношении шелковицы.
Ингибитор ацетилхолинэстеразы донепезил (DPZ), используемый при болезни Альцгеймера, не влияет на выработку бета-амилоидов при дозе 1 мг/кг.

1-7. Измерение уровня NGF (нейротрофический ростовой фактор)
Для подтверждения действия смешанных экстрактов на образование NGF, который, как известно, обладает регенерирующим и дифференцирующим действием на нейроны, были проведены эксперименты с использованием ИФА (ELISA). После экстрагирования головного мозга здоровых животных в Экспериментальном примере 1-1, отделяли область гиппокампа, добавляли RIPA-буфер и гомогенизировали механическим способом. Для измерения NGF, в зависимости от массы каждого головного мозга добавляли соответствующее количество буфера с высоким содержанием соли и детергента и гомогенизировали механическим способом. После добавления 10 мкл 4 н. HCl смесь оставляли на 15 минут, диссоциировалось связывание NGF с рецептором, добавляли 4 н. NaOH и смесь оставляли еще на 15 минут. Отбирали супернатант после центрифугирования и концентрацию NGF измеряли в головном мозге с использованием набора измерения NGF (Millipore). Количество NGF, получаемого в 1 мг белка, показано в таблице.
В результате, как показано в таблице 11, было подтверждено, что выработка NGF значительно увеличилась при введении смешанного растительного экстракта. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, в Примере 1 в соответствии с настоящим изобретением, смесь шелковицы и кожицы Poria cocos в соотношении 5:1 показала более высокую активность по стимулированию выработки NGF. Отдельно взятые растительные экстракты также стимулировали выработку NGF. Среди них, относительно сильный стимулирующий эффект в отношении выработки NGF показал экстракт кожицы Poria cocos. В случае смешанного экстракта растительных материалов стимулирующий эффект в отношении выработки NGF был высоким при высоком весовом соотношении кожицы Poria cocos.
Ингибитор ацетилхолинэстеразы донепезил (DPZ), используемый при болезни Альцгеймера, не влияет на выработку NGF при дозе 1 мг/кг.

Экспериментальный пример 2. Выявление защитного эффекта смешанных экстрактов шелковицы и кожицы Poria cocos в отношении нервных клеток in vitro.
2-1. Измерение активности ацетилхолинэстеразы (AChE) на нейронных клеточных линиях
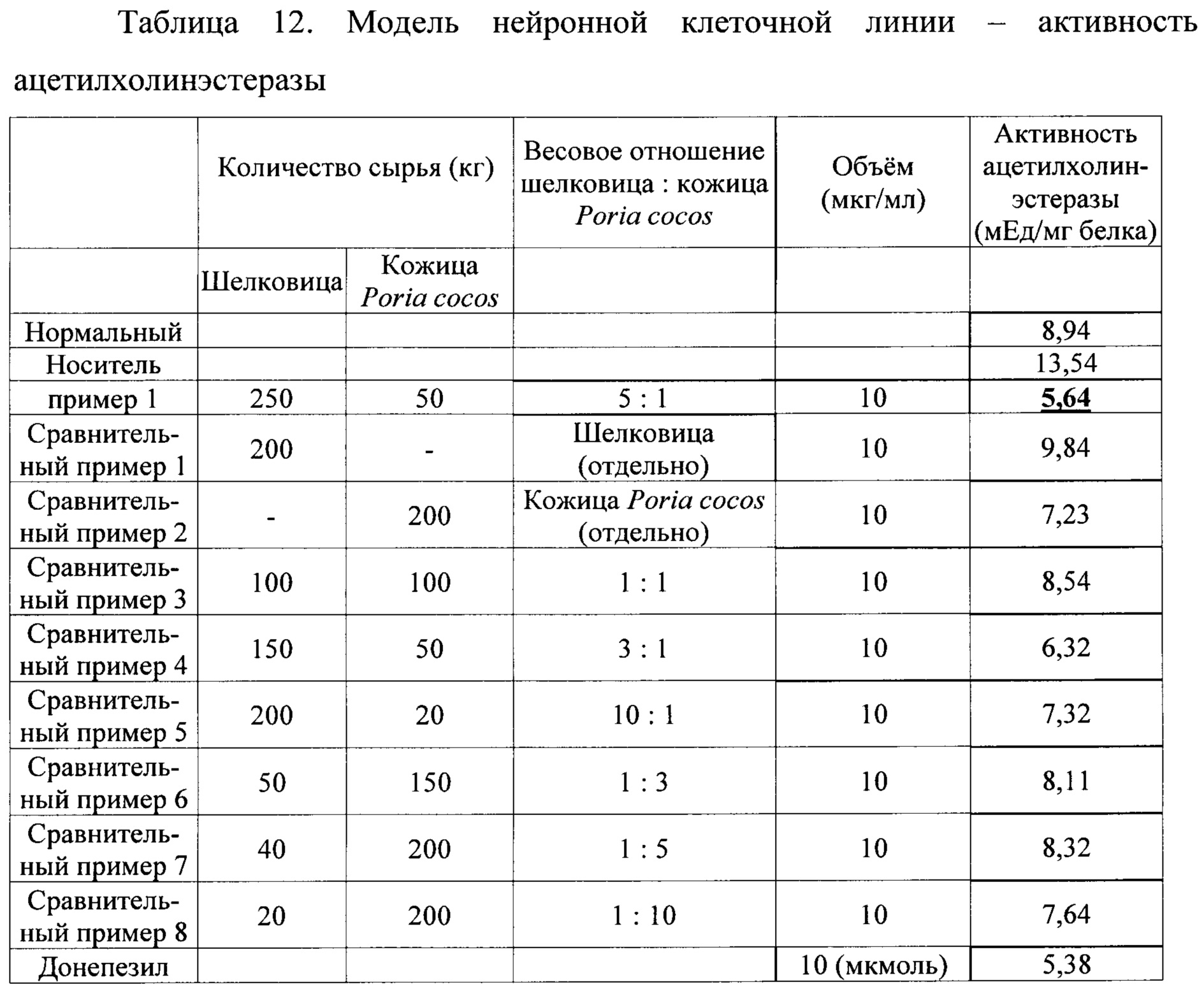
Были разработаны и используются ингибиторы ацетилхолестеразы, поскольку они увеличивают объем памяти и облегчают состояние при деменции, активируя холинергические нейроны, увеличивая концентрацию ацетилхолина в нейротрансмиттере ганглия. Измерение активности ацетилхолинэстеразы проводили для подтверждения ингибирующего действия смешанного растительного экстракта на ацетилхолинэстеразу., Клетки SH-SY5Y (нейронная клеточная линия) были закуплены в KCLB (Корейский банк клеточных линий). Клетки SH-SY5Y (1×106 кл./лунка) инокулировали в течение 48 часов в 6-и луночных культуральных планшетах в среде DMEM/F12 (модифицированная по способу Дульбекко среда Игла), содержащей 10% фетальную бычью сыворотку. Через 5 дней дифференциации с использованием среды DMEM / F12, содержащей 10 мкмоль ретиноевой кислоты и 3% ФБС, проводили обработку для Примеров, Сравнительного примера (10 мкг/мл) и контрольного препарата (донепезил 10 мкмоль) и обработку Аβ42. Лизис клеток выполняли с использованием RIPA-буфера (смесь ингибиторов протеаз: 150 мМ NaCl, 0,5% тритона Х-100, 50 мМ трис-HCl, рН 7,4, 25 мМ NaF, 20 мМ EGTA, 1 мМ DTT, 1 мМ Na3VO4) и содержание белка количественно определяли с использованием ВСА реагента компании Pierce. Активность ацетилхолинэстеразы определяли при помощи ацетилхолина как субстрата в соответствии с методом Элмана. Тиохолин, полученный под действием ацетилхолинэстеразы, подвергали взаимодействию с DTNB, и полученный 5-тио-2-нитробензоат определяли путем измерения изменения оптической плотности при 405 нм.
В результате, как показано в таблице 12, было подтверждено, что активность ацетилхолинэстеразы, увеличенная за счет введения бета-амилоида, была нормализована введением смешанного растительного экстракта. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, смесь шелковицы и кожицы Poria cocos в соотношении 5:1 из Примера 1 в соответствии с настоящим изобретением показала отличную активность по ингибированию ацетилхолинэстеразы. Отдельно взятые растительные экстракты в Сравнительных примерах 1 и 2 продемонстрировали незначительную активность по ингибированию ацетилхолинэстеразы, при этом каждый из отдельно взятых растительных экстрактов показал более низкую эффективность, чем смешанные растительные экстракты. Ингибирующий эффект растительных экстрактов был сходен с таковым у донепезила (DPZ) 10 мкмоль, который является ингибитором ацетилхолинэстеразы и используется при болезни Альцгеймера.
2-2. Цитопротекторный эффект на модели нейронной клеточной линии
Цитопротекторный эффект смешанных растительных экстрактов измеряли с использованием МТТ-теста (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида) на модели токсического поражения нервных клеток, вызванных искусственной агрегацией Аβ42. Клетки SH-SY5Y (1×104 кл./лунка) инокулировали в 96-луночных культуральных планшетах и культивировали в течение 48 часов в среде DMEM/F12 (модифицированная по способу Дульбекко среда Игла питательная смесь F12), содержащей 10% фетальную бычью сыворотку. Через 5 дней дифференциации с использованием среды DMEM/F12, содержащей 10 мкмоль ретиноевой кислоты и 3% ФБС, через 6 часов после обработки с использованием Примеров, Сравнительного примера и контрольного препарата (донепезил 10 мкмоль), клетки обрабатывали Аβ42 в течение 48 часов, и через 4 часа обработки 2 мг/мл МТТ, Формазон растворяли в ДМСО и измеряли поглощение на длине волны 590 нм.
В результате было подтверждено, что цитотоксичность, индуцированная обработкой бета-амилоидом, подавлялась введением смешанного растительного экстракта, как показано в таблице 13. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, смесь шелковицы и кожицы Poria cocos в соотношении 5: 1 показала отличный цитопротекторный эффект.Ингибитор ацетилхолинэстеразы донепезил (DPZ), используемый при болезни Альцгеймера, показал низкий уровень цитопротекторной активности при дозе 10 мкмоль.

2-3. Измерение фосфорилированого тау-белка в нейронных клеточных линиях
Уровни фосфорилированного тау-белка измеряли с целью подтверждения ингибиторного эффекта сырых растительных экстрактов на гиперфосфорилирование тау-белка. Клетки SH-SY5Y (1×106 кл./лунка) инокулировали в 6-луночных культуральных планшетах и культивировали в течение 48 часов в среде DMEM/F12 (модифицированная по способу Дульбекко среда Игла), содержащей 10% ФБС (фетальная бычья сыворотка). Через 5 дней дифференциации с использованием среды DMEM/F12, содержащей 10 мкмоль ретиноевой кислоты и 3% ФБС, через 6 часов после применения примера, сравнительного примера (10 мкг/мл) и контрольного препарата (донепезил, 10 мкмоль), клетки обрабатывали Аβ42 и культивировали в целом в течение 48 часов. После лизиса клеток с использованием RIPA-буфера, содержание белка количественно определяли с использованием ВС А реагента, закупленного от компании Pierce. Уровни фосфорилированного тау-белка измеряли с использованием закупленного в компании Invitrogen набора для ферментного (твердофазного) иммуносорбентного анализа (ИФА) человеческого Тау [pS199].
В результате было подтверждено, что повышение фосфорилирования тау-белка, индуцированное обработкой бета-амилоидом, подавлялась смешанным растительным экстрактом, как показано в таблице 14. При сравнении Сравнительных примеров 1 и 2, относящихся к отдельно взятым экстрактам шелковицы и кожицы Poria cocos, и Сравнительных примеров 3-8, относящихся к смешанным экстрактам шелковицы и кожицы Poria cocos, отличный эффект подавления фосфорилирования тау-белка отмечен у смеси по Примеру 1 шелковицы и кожицы Poria cocos в соотношении 5:1. В частности, эффект подавления фосфорилирования тау-белка был значительно выше у смешанных экстрактов по сравнению с отдельно взятыми экстрактами шелковицы и кожицы Poria cocos. Ингибитор ацетилхолинэстеразы донепезил (DPZ), используемый при болезни Альцгеймера, не проявлял ингибирующего эффекта в отношении фосфорилирования тау-белка при дозе 10 мкмоль.

2-4. Измерение уровня нейротрофического ростового фактора (NGF) в нейронных клеточных линиях
Уровни NGF измеряли с целью определения механизма действия смешанных растительных экстрактов на улучшение когнитивной функции. Клетки SH-SY5Y (1×106 кл./лунка) инокулировали в течение 48 часов в 6-и луночных культуральных планшетах в среде DMEM/F12 (модифицированная по способу Дульбекко среда Игла), содержащей 10% фетальную бычью сыворотку. Через 5 дней дифференциации с использованием среды DMEM/F12, содержащей 10 мкмоль ретиноевой кислоты и 3% ФБС, проводили обработку с использованием примера, сравнительного примера (10 мкг/мл) и контрольного препарата (донепезил 10 мкмоль). Лизис клеток осуществляли с использованием RIPA-буфера, содержание белка количественно определяли с использованием ВСА реагента, закупленного в компании Pierce. Уровни NGF измеряли с использованием закупленного в компании Abeam набора для определения ростового фактора бета-нервов человека при помощи ферментного (твердофазного) иммуносорбентного анализа (ИФА).
В результате, как показано в таблице 15, было подтверждено, что смешанный растительный экстракт повышает выработку NGF. В это время бета-амилоид не влиял на выработку NGF. Сравнение влияния на выработку NGF отдельно взятых растительных экстрактов показало высокую эффективность экстракта кожицы Poria cocos. Среди смешанных растительных экстрактов наиболее эффективной была комбинация 5:1.
Донепезил (DPZ), который используется в качестве ингибитора ацетилхолинэстеразы при болезни Альцгеймера, не продемонстрировал эффекта стимулирования выработки NGF при дозе 10 мкмоль.

Как указано выше, экстракт шелковицы, представляющий собой компонент смешанного растительного экстракта согласно настоящему изобретению, способствует выживанию нейронов и активирует их функцию путем удаления бета-амилоида, считающегося основной причиной деменции при болезни Альцгеймера. Экстракт кожицы Poria cocos, другого компонента, как считается, обладает превосходной эффективностью по защите нервных клеток, в особенности за счет стимулирования выработки NGF, известного как защитный фактор нейронов. Кроме того, каждый из растительных экстрактов не проявлял высокой эффективности в подавлении ингибирующего действия ацетилхолестеразы, которое в настоящее время является основным механизмом действия препаратов, применяемых при деменции Альцгеймера. Однако при смешивании экстрактов эффективность возрастала. Эти результаты показывают, что экстракты шелковицы и кожицы Poria cocos защищают нейроны и синергетически увеличивают способности памяти за счет различных механизмов. Предполагается, что эффективность является отличной, в частности, когда экстракты смешаны при весовом соотношении 5:1.
Таким образом, смешанный растительный экстракт в соответствии с настоящим изобретением препятствует возникновению или развитию заболевания путем ингибирования образования бета-амилоида и фосфорилирования тау-белка, которые вызывают дегенеративные заболевания головного мозга вследствие гибели нейронов, и усиливает функцию памяти за счет ингибирования ацетилхолинэстеразы. Также способствует образованию NGF, который способствует защите нейронов и нейронной дифференциации. Таким образом, он может быть использован для профилактики, улучшения и лечения прогрессирующей деменции из-за постепенной гибели нейронов при болезни Альцгеймера, болезни Крейтцфельдта-Якоба, болезни Хантингтона, рассеянном склерозе, синдроме Гийена-Барре, болезни Паркинсона, болезни Лу Герига. Он также может использоваться для профилактики, облегчения и лечения дегенеративных неврологических заболеваний, включая расстройства позы и движения, прогрессирующую атаксию, мышечную атрофию и слабость, а также сенсорные и двигательные расстройства и т.д.
Далее приводится описание примера получения композиции, содержащей сырой лечебный экстракт по примеру 1 настоящего изобретения. Однако следует понимать, настоящее изобретение этим не ограничивается, указанное является раскрытием отдельного случая.
Пример приготовления 1: Приготовление раствора для инъекций
Стерилизованная дистиллированная вода для инъекций. соответствующее количество
Описанные выше компоненты перемешивают и превращают в раствор объемом 2 мл с помощью обычного способа приготовления раствора для инъекций, после чего заполняют ампулу емкостью 2 мл и стерилизуют для приготовления инъекции.
Пример приготовления 2: Приготовление таблеток
Описанные выше компоненты перемешивают и прессуют в таблетки с помощью обычного способа приготовления таблеток.
Пример приготовления 3: Приготовление капсул
Описанные выше компоненты перемешивают и фасуют в желатиновые капсулы с помощью обычного способа приготовления капсул.
Пример приготовления 4: Приготовление раствора
После добавления воды очищенной общий объем раствора 100 мл
Описанные выше компоненты перемешивают с помощью обычного способа приготовления жидких препаратов, фасуют во флаконы темного стекла вместимостью 100 мл и стерилизуют с получением жидкого препарата.
Реферат
Изобретение относится к фармацевтической композиции, а именно к композиции для профилактики или лечения дегенеративного неврологического заболевания. Фармацевтическая композиция для профилактики или лечения дегенеративного неврологического заболевания, содержащая экстракт смеси, содержащей (i) шелковицу и (ii) кожицу Poria cocos в качестве действующего вещества, при этом смесь экстрагирована с использованием воды, спирта или смеси воды и спирта, и в смеси от 4 до 7 весовых частей шелковицы приходятся на 1 весовую часть кожицы Poria cocos, при этом фармацевтическая композиция способна (i) улучшать пространственную память, (ii) улучшать когнитивную память, (iii) увеличивать экспрессию нейронных клеток (NeuN), (iv) уменьшать экспрессию маркера апоптоза (FJB), (v) ингибировать образование β-амилоида, (vi) способствовать образованию нейротрофического ростового фактора, (vii) ингибировать активность ацетилхолинэстеразы (AChE), (viii) ингибировать цитотоксичность, (ix) подавлять фосфорилирование тау-белка или (х) давать любую комбинацию перечисленного. Композиция для профилактики или лечения дегенеративного неврологического заболевания. Способ профилактики или лечения дегенеративного неврологического заболевания субъекта, нуждающегося в этом, заключающийся в назначении субъекту фармацевтической композиции по любому из пп. 1 и 3-12. Применение фармацевтической композиции для изготовления лекарства для профилактики или лечения дегенеративного неврологического заболевания субъекта, нуждающегося в этом. Вышеописанные композиции эффективны для профилактики или лечения дегенеративных неврологических заболеваний. 4 н. и 18 з.п. ф-лы, 2 ил., 15 табл., 4 пр.

Комментарии