Замещенные азетидиноны, способ их получения, фармацевтическая композиция и способ лечения - RU2148056C1
Код документа: RU2148056C1
Чертежи





















Описание
Мы показали, что представители группы новых замещенных азетидинонов являются мощными ингибиторами эластазы и в этой связи могут найти применение как противовоспалительные и антидегенеративные агенты.
Имеются данные о том, что протеазы из гранулоцитов и макрофагов вовлекаются в механизмы хронической деструкции тканей, связанной с воспалением, в том числе с явлениями, имеющими место в случае ревматоидного артрита и эмфиземы. Соответственно этому, специфические селективные ингибиторы таких протеаз могут рассматриваться как потенциальные противовоспалительные агенты с целью их использования для лечения воспалительных состояний, возникших в результате деструкции соединительной ткани, а именно: в случае ревматоидного артрита, эмфиземы, бронхиального воспаления, хронического бронхита, гломерулонефрита, остеоартрита, спондилита, волчанки, псориаза, атеросклероза, сепсиса, септицемии, шока, инфаркта миокарда, реперфузионного повреждения, периодонтита, муковисцидоза и острого респираторного дистресс-синдрома.
Роль протеаз из гранулоцитов, лейкоцитов или макрофагов связана с осуществлением быстро протекающей серии событий в ходе прогрессирующего развития воспалительных явлений:
(1) Имеет
место быстрая продукция простагландинов (ПГ) и родственных им соединений, синтезирующихся из арахидоновой кислоты. Было показано, что синтез ПГ ингибируется под воздействием родственных аспирину
нестероидных противовоспалительных агентов, включая индометацин и фенилбутазон. Имеется доказательство того, что ингибиторы протеаз препятствуют продукции ПГ;
(2) Кроме того, имеет место
изменение в сосудистой проницаемости, которая вызывает протечку жидкости на место воспаления с образованием отека, факт появления которого обычно используется в качестве маркера для выражения степени
воспаления. Было показано, что этот процесс индуцируется протеолитической или пептид-расщепляющей активностью протеаз, особенно тех из них, которые содержатся в гранулоцитах, и в этой связи могут
ингибироваться с помощью различных синтетических ингибиторов протеаз, например, N-ацилбензизотиазолонами и соответствующими 1,1-диоксидами. Morris Zimmerman et al., J. Biol. Chem., 255, 9848 (1980)
и
(3) Имеет место появление и/или наличие лимфоидных клеток, особенно макрофагов и полиморфноядерных нейтрофилов (ПМЯ). Известно, что из макрофагов и ПМЯ высвобождается множество протеаз, что
представляло собой дальнейшее свидетельство в пользу того, что протеазы выполняют важную роль в процессе воспаления.
В целом, протеазы представляют собой важное семейство ферментов, характеризующихся способностью к расщеплению пептидной связи, при этом членам данного семейства присуща биологическая активность, относящаяся к таким явлениям, как переваривание, образование и растворение кровяных сгустков, образование активных форм гормонов и организмов и т.д., а также к патологическим процессам, таким как деградация структурных белков, соединение суставного хряща/паннуса при ревматоидном артрите и т.д.
Эластаза является одним из представителей протеаз. Она представляет собой фермент, способный к гидролизу компонента соединительной ткани эластина, свойство, не проявляющееся у множества протеаз, имеющихся у млекопитающих. Указанный фермент действует на белковую неконцевую связь, примыкающую к алифатической аминокислоте. При этом особый интерес представляет эластаза нейтрофилов в связи с присущим ей широчайшим спектром активности, направленной против естественных субстратов соединительной ткани. В частности, эластаза из гранулоцитов представляет собой весьма важный фермент в связи с тем, что, как было указано выше, гранулоциты принимают участие в течение острого воспалительного процесса, а также имеют отношение к обострению хронических форм воспаления, свойственных большому числу клинически важных воспалительных заболеваний.
Протеазы могут инактивироваться большим числом ингибиторов, которые блокируют активные сайты энзимов посредством связывания с ними. Встречающиеся в естественном состоянии ингибиторы протеаз образуют часть контрольных или защитных механизмов, наличие которых существенно для нормального функционирования организма. В отсутствие таких контролирующих механизмов протеазы могли бы разрушить любой белок в пределах их досягаемости. Было показано, что натуральные ингибиторы фермента обладают соответствующей конфигурацией, которая позволяет им прочно связываться с данным ферментом. Существование такой конфигурации частично объясняет прочность связи ингибиторов с ферментом (см. Stroud, "A Family of Protein-Cutting Proteins", SCi. Am. July 1974, pp. 74 - 88).
Например, один из натуральных ингибиторов - α1-антитрипсин - представляет собой гликопротеин, содержащийся в сыворотке человека, который обладает широкой ингибиторной активностью, охватывающей, среди прочих энзимов, эластазу из поджелудочной железы и ПМЯ. Этот ингибитор гидролизуется протеазами с образованием стабильного ацильного фермента, в котором активный сайт уже становится недоступным. Выраженное снижение содержания α1-антитрипсина в сыворотке, связанное либо с генетическими причинами, либо с действием оксидантов, сопровождает эмфизему легких, заболевание, для которого характерна прогрессирующая потеря упругости легкого, в результате которой развивается дыхательная недостаточность. Имеются сообщения о том, что в основе этой потери легким его упругости лежит прогрессирующий, неконтролируемый протеолиз или разрушение структуры ткани легкого под действием протеаз, таких, в частности, как эластаза, высвобождаемая из лейкоцитов. J.C. Powers, TIBS, 211 (1976).
Ревматоидный артрит характеризуется прогрессирующей
деструкцией суставного хряща, как на свободной поверхности, ограничивающей суставное пространство, так и на эродированном участке, образованном за счет выступающей в направлении хряща синовиальной
ткани. Такой же процесс деструкции, в то же время, способен вызывать протеин-расщепляющий фермент эластазы, который представляет собой нейтральную протеазу, присутствующую в гранулоцитах человека.
Справедливость этого вывода подтверждают следующие наблюдения:
(1) недавние гистохимические исследования показали, что в месте соединения хряща/паннуса в случае ревматоидного артрита
происходит накопление гранулоцитов; и
(2) последние исследования механическим свойств хряща, развивающихся в ответ на воздействие очищенной эластазы, показали прямое участие ферментов
гранулоцитов, в первую очередь, эластазы, в процессе ревматоидной деструкции хрящевой ткани. H. Menninger, et al., in Biological Functions of Proteinases, H. Holzer and H. Tschesche, eds., Springer
- Verlag, Berlin, Heidelberg, New York, pp. 196 - 206, 1979.
Второй аспект настоящего изобретения относится к применению новых азетидинонов для лечения некоторых видов рака, включающих в том числе нелимфобластные лейкозы, острый миелобластный лейкоз (FAB M1 и FAB M2), острый промиелоцитарный лейкоз (FAB M3), острый миеломоноцитарный лейкоз (FAB M4), острый моноцитарный лейкоз (FAB M5), эритролейкоз, хронический миелобластный лейкоз, хронический миеломоноцитарный лейкоз, хронический моноцитарный лейкоз и состояния, сопровождающие лейкоз, которые связаны с вовлечением в процесс активности ПМЯ нейтральных протеаз, такие как диссеминированное внутрисосудистое свертывание. Мы обнаружили, что раскрываемые в настоящем изобретении замещенные азетидиноны являются ингибиторами протеиназы 3(PR-3), известной также как миелобластин.
См. C. Labdaye, et al. , Proc. Natl. Acad. Sci. USA, vol. 88, 9253 - 9256, (1991). Аутоантиген Вегнера и миелобластин кодируются одной мРНК; D. Campanelli, et al. , J. Exp. Med., vol. 172, 1709 - 1714, (1990). Клонирование кДНК для протеиназы 3: сериновая протеаза, антибиотик и аутоантиген из нейтрофилов человека; и Bories, et al., Cell. vol. 59, 959 - 968 (1989). Даун-регуляция сериновой протеазы - миелобластина - вызывает остановку роста и дифференциацию клеток при промиелоцитарном лейкозе.
Недавно было показано вовлечение даун-регуляции PR-3 в пролиферацию и поддержание дифференциации некоторых лейкозных клеток. В частности, Bories, et al. , показали, что экспрессия фермента, обозначаемого в настоящем изобретении как протеиназа 3/миелобластин, может подвергаться ингибированию при обработке HL-60 лейкозных клеток человека антисмысловым олигодезоксинуклеотидом, при этом такая обработка индуцирует дифференциацию клеток и ингибирует их пролиферацию. Кроме того, нами было показано, что обработка HL-60 лейкозных клеток клеточной линии лейкоза человека, среди прочих, соединениями настоящего изобретения также приводит к ингибированию пролиферации таких клеток и индуцирует их дифференциацию.
Исходя из этого, мы полагаем, что лечение таких видов лейкозов, как нелимфобластные лейкозы, острый миелобластный лейкоз (FAB M1 и FAB M2), острый промиелоцитарный лейкоз (FAB M3), острый миеломоноцитарный лейкоз (FAB M4), острый моноцитарный лейкоз (FAB M5), эритролейкоз, хронический миелобластный лейкоз, хронический миеломоноцитарный лейкоз, хронический моноцитарный лейкоз и состояния, сопровождающие лейкоз, которые вовлекают в процесс аткивность ПМЯ нейтральных протеаз, в частности, состояние диссеминированного внутрисосудистого свертывания, включающее введение терапевтически эффективного количества соединения формулы I приводит к ремиссии заболевания. При этом введение может проводиться либо перорально, либо парентерально.
Настоящее изобретение относится к специфически замещенным азетидинонам формулы I:

Было показано, что эти замещенные азетидиноны могут использоваться в качестве противовоспалительных и антидегенеративных агентов. Настоящее изобретение относится также к фармацевтическим композициям и способам использования указанных специфически замещенным азетидинонам. Эти соединения могут найти применение для лечения некоторых видов лейкозов и состояний, связанных с развитием лейкозов.
Настоящее изобретение относится к мощным ингибиторам эластазы формулы I:

которые применяются для профилактики, контроля и лечения воспалительных и дегенеративных состояний, в первую очередь, таких, как артрит и эмфизема.
Более конкретно, настоящее изобретение относится к соединениям формулы I:

и к их фармацевтически приемлемым солям:
где R представляет собой C1-6алкил; R1 представляет собой C1-6алкил; M представляет этил, пропил, бутил, пентил или гексил; каждый из Ra и Rb представляет независимо друг от друга: (1) водород; (2) C1-6алкил; (3) гидроксигруппу; R2 представляет: (1) водород; (2) C1-6алкил; (3) галогруппу; (4) C1-6алкокси; (5) амино C2-3алкилоксикарбонил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (6) амино C2-3алкиламинокарбонил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (7) гидроксигруппу; (8) аминокарбонил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (9) гидроксиметил; (10) аминокарбонилокси C1-3алкил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (11) цианогруппу; (12) морфолинокарбонилфенил; или (13) морфолинокарбонил;
R3 представляет: (1) C1-6алкил; (2) галогруппу; (3) C1-6 алкокси; (4) амино C2-3алкилоксикарбонил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (5) амино C2-3алкиламинокарбонил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (6) гидроксигруппу; (7) аминокарбонил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (8) гидроксиметил; (9) аминокарбонилокси C1-3алкил, где аминогруппа может быть моно- или ди-замещена C1-6алкилом; (10) цианогруппу; (11) морфолинокарбонилфенил, или (12) морфолинокарбонил,
при условии, что R2 и R3 могут быть объединены друг с другом с образованием метилендиоксигруппы;
R4 представляет

или

где Rx представляет карбокси C1-6алкил, бензилоксикарбонил C1-3алкил или трет-бутоксикарбонил C1-3алкил,
где Q представляет ковалентную связь или группу:

где каждый из R5 и R6 представляет водород; Y представляет собой

или ковалентную связь; R12 представляет водород или C1-3алкил; R7 представляет: (а) этил, пропил, бутил, пентил или гексил; (б) C1-6алкилокси C2-3алкил; (в) гидрокси C2-6алкил; (г) полигидрокси C2-6алкил; (д) карбоксамидо C1-6алкил; (е) C1-6алканоил; (ж) замещенный фенил или фенил-C1-6алкил, при этом заместители представлены X1 и X2, как определено ниже; (з) C2-6алкенил; (и) C6-10циклоалкенил; (к) гетероарил C1-6алкил, при этом упомянутый гетероарил включает пиридинил и имидазолил; (л) карбокси C1-6алкил; (м) карбо-C1-6алкокси C1-3алкил; (н) фенилсульфонил; (о) C1-6алкилсульфонил; (п) бензилокси; (р) морфолинил C1-3алкилсульфонил; (с) тетрагидропиранил; (т) амино C1-3алкилсульфонил, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (у) аминокарбонил, при этом аминогруппа может быть моно- или ди-замещена C1-6 алкилом; (ф) аминокарбонилокси C2-6алкил, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (х) азабициклогруппу, содержащую от 7 до 12 атомов; (ц) ди C1-3алкиламино C2-6алкил, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (ч) бициклоалкил, содержащий от 7 до 12 атомов; (ш) C3-10циклоалкил, возможно замещенный C1-6алкилом; (щ) пиразолидинил; (ь) замещенный или незамещенный пиперидинил или пирролидинил, где в качестве заместителей может быть C1-3алкил, гидрокси-C1-3алкилбензил, карбоксамидо- или аминогруппа, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (аа) замещенный пирролидинил, в котором заместителем является карбоксамидо- или аминогруппа, при этом аминогруппа может быть замещена C1-6алкилом; (бб) пиримидинил; (вв) фосфоно C1-6алкил или (гг) альфа-C1-3алкилбензил, а также моно- или ди-замещенный бензил или моно- или ди-замещенный пиридилметил, при этом заместителями являются X1 или X2;
R8 представляет собой: (а) водород или C1-6алкил; (б) C1-6алкилокси C2-3алкил; (в) гидрокси C2-6алкил; (г) полигидрокси C2-6алкил; (д) карбоксамидо C1-6алкил; (е) C1-6алканоил; (ж) замещенный фенил или фенил-C1-6алкил, при этом заместители представлены X1 и X2, как определено ниже; (з) C2-6алкенил; (и) C6-10циклоалкенил; (к) гетероарил C1-6алкил, при этом упомянутый гетероарил выбирают из группы, включающей пиридинил и имидазолил; (л) карбокси C1-6алкил; (м) карбо-C1-6алкокси C1-3алкил; (н) фенилсульфонил; (о) C1-6алкилсульфонил; (п) бензилокси; (р) морфолинил C1-3алкилсульфонил; (с) тетрагидропиранил; (т) амино C1-3алкилсульфонил, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (у) аминокарбонил, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (ф) аминокарбонилокси C2-6алкил, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (х) азабициклогруппу, содержащую от 7 до 12 атомов; (ц) ди C1-3 алкиламино C2-6алкил, при этом аминогруппа может быть замещена C1-6алкилом; (ч) бициклоалкил, содержащий от 7 до 12 атомов; (ш) C3-10циклоалкил, возможно замещенный C1-6алкилом; (щ) пиразолидинил; (ь) замещенный или незамещенный пиперидинил, в котором заместителем может быть C1-3алкил, гидрокси-C1-3-алкилбензил, карбоксамидо- или аминогруппа, при этом аминогруппа может быть замещена C1-6алкилом; (аа) замещенный пирролидинил, в котором заместителем является карбоксамидо- или аминогруппа, при этом аминогруппа может быть замещена C1-6алкилом; (бб) пиримидинил; (вв) фосфоно C1-6алкил или (гг) альфа-C1-3алкилбензил, а также моно- или ди-замещенный бензил или моно- или ди-замещенный пиридилметил, при этом заместителями являются X1 или X2;
При этом X1 представляет собой: (1) водород; (2) галогруппу; (3) C1-6алкил; (4) гало C1-6алкил; (5) C2-6алкенил; (6) гидрокси C1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) CN-группу; (10) CF3; (11) CH3O; (12) аминогруппу, при этом данная аминогруппа может быть моно- или ди-замещена C1-6алкилом; (13) карбоксигруппу или (14) фенилсульфониламинокарбонил;
X2 представляет собой водород, галогруппу или C1-6алкил;
n представляет собой число 1, 2, 3, 4 или 5;
R9 выбирают из группы, включающей водород, C1-4 алкил и C1-3алкокси C2-3алкил; или фенил, фенил C1-3алкил, пиридил и пиридил C1-3алкил;
каждый из R10 и R11 выбирают независимо друг от друга из группы, включающей водород, C1-4алкил и C1-3алкокси-C1-3алкил, или представляют собой оба вместе O=; или
R7 и R8 вместе с атомом азота, к которому они присоединяются, образуют моно- или ди-замещенное кольцо, выбранное из группы, содержащей (1) пиперидинил или гомопиперидинил; (2) пиперазинил; (3) морфолинил, тиоморфолинил или 1,1-диоксо-4-тиоморфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) насыщенная азабицикло-группа, содержащая от 7 до 12 атомов; (9) азаспиро-группа; (10) тетразолил; (11) пиразолидинил; (12) азетидинил или (13) диазабицикло-группа, содержащая от 7 до 12 атомов, при этом каждый из заместителей выбирают из группы, состоящей из водорода и C1-3алкила, бензилоксикарбонила, фенил-C1-3алкиламинокарбонила, пирролидинилметила, гидрокси C1-3алкила, C1-6алкокси, C1-4 алкилоксикарбонила, аминокарбонила, где упомянутая аминогруппа может быть моно- или ди-замещена C1-6алкилом, и оксогруппы; или
R8 и R9 вместе образуют моно- или ди-замещенное насыщенное моноциклическое кольцо, содержащее от 6 до 7 атомов, включающее 2 атома азота; или
R9 и R12 вместе образуют моно- или ди-замещенное насыщенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов и один атом азота; или
R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моно- или ди-замещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.
Предпочтительные соединения формулы I по п. 1, где Q представляет собой ковалентную связь; Y
представляет собой

R4 представляет собой

Особенно соединения, где R представляет C1-6алкил; R1 представляет C1-6алкил; M представляет C1-6алкил; каждый из Ra и Rb представляет водород; каждый из R2 и R3 представляет независимо друг от друга: (1) водород; (2) C1-6алкил;
или R2 и R3 могут объединяться друг с другом с образованием метилендиоксигруппы;
R4 представляет собой
а)

где Q представляет ковалентную связь; Y представляет собой

R12 представляет водород или C1-3алкил; каждый из R7 и R8 является независимо друг от друга: (а) водородом; (б) C1-6алкилом; (в) C1-6алкокси C2-3алкилом; (г) гидрокси C2-3алкилом; (д) карбоксамидо C1-6алкилом; (е) C1-6алканоилом; (ж) фенилом или фенил C1-6алкилом; (з) C2-6алкенилом; (и) C6-10циклоалкенилом; (к) гетероарил C1-6алкилом, при этом упомянутый гетероарил включает пиридинил имидазолил; (л) карбокси C1-6алкилом; (м) C1-6алкилсульфонилом; (н) бензилокси; (о) морфолинил C1-3алкилсульфонилом; (п) амино C1-3алкилсульфонилом, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (р) аминокарбонилом, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (с) аминокарбонилокси C2-6алкилом, при этом аминогруппа может быть замещена C1-6алкилом; (т) пиразолидинилом; (у) пиперидинилом; (ф) пиримидинилом; (х) альфа-C1-3алкилбензилом, а также моно- или ди-замещенным бензилом, или моно- или ди-замещенным пиридилметилом, при этом заместителями являются X1 или X2;
где X1 представляет собой: (1) водород; (2) галогруппу; (3) C1-6алкил; (4) гало C1-6алкил; (5) C2-6алкенил; (6) гидрокси C1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) аминогруппу, которая может быть замещена C1-6алкилом; или (10) карбоксигруппу;
X2 представляет собой водород, галогруппу или C1-6алкил;
n представляет собой число 1, 2, 3, 4 или 5; каждый из R10 и R11 выбирают независимо друг от друга из группы, состоящей из водорода, C1-4алкила и C1-3 алкокси-C1-3алкила; или
R7 и R8 вместе с азотом, к которому они присоединяются, образуют моно- или ди-замещенное кольцо, выбранное из группы, включающей: (1) пиперидинил; (2) пиперазинил; (3) морфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) тетразолил; (9) пиразолидинил или (10) азетидинил, при этом каждый из заместителей выбирается из группы, содержащей водород и C1-3алкил, бензилоксикарбонил, фенил C1-3алкиламинокарбонил, гидрокси C1-3алкил, C1-6алкокси, C1-4 алкилоксикарбонил и оксогруппу; или R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моноциклическое моно- или ди-замещенное кольцо, содержащее 5, 6 или 7 атомов углерода.
Из них следует выделить соединения, где R представляет собой C1-3алкил; R1 представляет собой C1-3алкил; M представляет C1-6алкил; R2 представляет: (а) водород; (б) C1-6алкил; R3 представляет водород; или R2 и R3 соединяются вместе с образованием
метилендиоксигруппы; R7 и R8 независимо друг от друга выбирают из группы, содержащей: (а) водород; (б) C1-6алкил; (в) C1-3алкокси C2-3алкил; (г)
замещенный бензил, в котором заместителями являются X1 и X2, при этом X1 представлен водородом, а X2 представляет собой: (а) водород; (б) галогруппу или (в)
C1-3алкил; n представляет собой число 1, 2 или 3, а
R10 и R11 выбирают независимо друг от друга из группы, включающей водород, C1-4алкил и C1-3алкокси C1-3алкил;
или R7 и R8 образуют вместе замещенное кольцо, выбранное из группы, содержащей: (а) пиперидинил; (б) пиперазинил и (в) морфолинил;
или R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моно- или ди-замещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.
Либо соединения, где R представляет собой метил или этил; R1 представляет собой метил или этил; M представляет C1-4алкил; R2 представляет: (а) водород; (б)
C1-3алкил, и R3 представляет водород; или R2 и R3 соединяются вместе с образованием метилендиоксигруппы; n представляет число 1 или 2; R10
выбирают из группы, содержащей: (а) C1-3алкил; (б) C1-3алкокси C2-3алкил; (в) водород; R7 и R8 независимо друг от друга выбирают из группы,
содержащей: (а) водород; (б) C1-3алкил; (в) C1-3алкокси-C2-3алкил;
или R7 и R8 вместе с атомом азота, к которому они присоединяются,
образуют замещенное кольцо, выбранное из группы, содержащей (а) пиперидинил, и (б) морфолинил;
или R10 и R12 вместе с атомами углерода, к которым они присоединяются,
образуют моно- или ди-замещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.
Среди предпочтительных соединений формулы I можно назвать соединения, где Q представляет собой ковалентную связь; R4 представляет собой

Y представляет собой

Либо соединения, где R представляет C1-6алкил; R1 представляет C1-6алкил; M представляет C1-6алкил; каждый из Ra и Rb представляет водород; каждый из R2 и R3 представляет независимо друг от друга: (1) водород; (2) C1-6алкил, или R2 и R3 могут объединяться вместе с образованием метилендиоксигруппы; R4 представляет собой

где Q обозначает ковалентную связь; или Y представляет собой
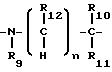
R12 представляет водород или C1-3алкил; каждый из R7 и R8 является независимо друг от друга: (а) водородом; (б) C1-6алкилом; (в) C1-6алкокси C2-3алкилом; (г) гидрокси C2-3алкилом; (д) карбоксамидо C1-6алкилом; (е) C1-6алканоилом; (ж) фенилом или фенил C1-6алкилом; (з) C2-6алкенилом; (и) C6-10циклоалкенилом; (к) гетероарил C1-6алкилом, при этом упомянутый гетероарил включает пиридинил имидазолил; (л) карбокси C1-6алкилом или карбо C1-6алкокси-C1-3алкилом; (м) C1-6алкилсульфонилом; (н) бензилокси; (о) морфолинил C1-3алкилсульфонилом; (п) амино C1-3алкилсульфонилом, при этом аминогруппа может быть моно- или ди-замещена C1-6алкилом; (р) аминокарбонилом, при этом аминогруппа может быть моно- или ди-замещена C1-6 алкилом; (с) аминокарбонилокси C2-6алкилом, при этом аминогруппа может быть замещена C1-6алкилом; (т) пиразолидинилом; (у) пиперидинилом; (ф) пиримидинилом; (х) C3-7 циклоалкилом; (ц) альфа-C1-3алкилбензилом, или моно- или ди-замещенным бензилом, или моно- или ди-замещенным пиридилметилом, при этом заместителями являются X1 или X2;
где X1 представляет собой: (1) водород; (2) галогруппу; (3) C1-6алкил; (4) гало C1-6алкил; (5) C2-6алкенил; (6) гидрокси C1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) ди-C1-3алкиламино или (10) карбоксигруппу;
X2 представляет собой водород, галогруппу или C1-6алкил;
n представляет собой число 1, 2, 3, или 4; R9 выбирают из водорода, C1-4алкила и C1-3алкокси-C2-3алкила; каждый из R10 и R11 выбирают независимо друг от друга из группы, состоящей из водорода, C1-4алкила и C1-3алкокси-C1-3алкила; или R7 и R8 вместе с азотом, к которому они присоединяются, образуют моно- или ди-замещенное кольцо, выбранное из группы, включающей: (1) пиперидинил; (2) пиперазинил; (3) морфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) тетразолил; (9) пиразолидинил или (10) азетидинил, при этом каждый из заместителей выбирается из группы, содержащей водород и C1-3алкил, бензилоксикарбонил, фенил C1-3алкиламинокарбонил, гидрокси C1-3алкил, C1-6алкокси, C1-4алкилоксикарбонил и оксогруппу; или R8 и R9 вместе образуют насыщенное моно- или ди-замещенное моноциклическое кольцо, содержащее 6 или 7 атомов углерода и включающее 2 атома азота; при этом указанное кольцо выбирают из пиперазинила и гомопиперазинила; или R9 и R12 вместе образуют моно- или ди-замещенное насыщенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов, при этом упомянутое кольцо включает один атом азота; или R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моно- или ди-замещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.
Либо
соединения, где R представляет C1-3алкил; R1 представляет C1-3алкил; M представляет C1-6алкил; R2 представляет: (а) водород; (б) C1-6
алкил; R3 представляет водород; или R2 и R3 соединяются вместе с образованием метилендиоксигруппы; R7 и R8 независимо друг от друга выбирают из
группы, содержащей: (а) водород; (б) C1-3алкил; (в) C1-3алкокси C2-3алкил; (г) гидрокси C2-3алкил; (д) карбо C1-4алкоксиметил; (е) замещенный
бензил, в котором заместителями являются X1 и X2, при этом X1 представлен водородом, а X2 представляет собой: (а) водород; (б) галогруппу или (в) C1-3алкил; n представляет собой число 1, 2 или 3, а R9, R10 и R11 отбираются независимо друг от друга из группы, включающей водород, C1-4алкил и C1-3алкокси C2-3алкил;
или R7 и R8 вместе с атомом азота, к которому они присоединяются, образуют замещенное кольцо, выбранное из группы, содержащей: (а)
пиперидинил; (б) пиперазинил и (в) морфолинил; или R8 и R9 вместе образуют моно- или ди-замещенное насыщенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода и
включающее два атома азота.
Либо соединения, где R представляет собой метил или этил; R1 представляет метил или этил; M представляет (а) C1-4алкил; R2
представляет: (а) водород; (б) C1-3алкил; R3 представляет собой водород или R2 и R3 вместе образуют метилендиоксигруппу; n представляет число 1 или 2; R9 и R10 выбирают из группы, содержащей: (а) водород; (б) C1-3алкил; (в) C1-3алкокси C1-3алкил; R7 и R8 независимо друг от друга
выбирают из группы, содержащей: (а) водород; (б) C1-3алкил; (в) C1-3алкокси C2-3алкил; (г) гидроксиэтил; (д) карбоэтоксиметил, или R7 и R8 вместе
с азотом, к которому они присоединяются, образуют моно- или ди-замещенное моноциклическое кольцо,
которое является пиперидинилом или морфолинилом, при этом упомянутое кольцо может быть
замещено водородом или метилом;
или R8 и R9 вместе образуют моно- или ди-замещенное насыщенное моноциклическое кольцо, которое является пиперазинилом.
Из
другой группы соединений можно выделить соединения, где Ra представляет: (1) водород; (2) C1-6алкил; Rb представляет водород или C1-6алкил; R2
представляет собой: (1) водород; (2) C1-6алкил; (3) галогруппу; (4) C1-6алкокси; R3 представляет собой: (1) C1-6алкил; (2) галогруппу; или R2 и
R3 могут соединяться вместе с образованием метилендиоксигруппы; R4 представляет собой

и R7 представляет собой (б) этил, пропил, бутил, пентил и гексил; (в) циклопропил; (г) C1-3алкокси C2-3алкил; (д) гидроксиэтил; (е) карбоэтоксиметил; R8 представляет собой: (а) C1-3алкил; (б) циклопропил; (в) C1-3алкокси C2-3алкил; (г) гидроксиэтил; (д) карбоэтоксиметил; или R7 и R8 вместе с атомом азота, к которому они присоединяются, образуют моно- или ди-замещенное моноциклическое кольцо, которое является пиперидинилом или морфолинилом, при этом упомянутое кольцо может быть замещено водородом или метилом.
Более конкретно из соединений формулы I можно назвать соединения общей формулы

в которой A представляет собой (1) -CH2CH2N(CH3)2; (2) -CH2CO2H; (3) -CH2 -C(O)N(CH2CH2OH)2; (4) -CH2-C(O)N(CH3)CH2C(O)NH2; (5) -CH2C(O)NH-С(CH2OH)3; (6) -CH2C(O)N(CH3)2; (7) -CH2CH2N(CH3)Ac; (8) -CH(CH3)CO2CH2Ph; (9) -CH(CH3)CO2H; (10) -CH(CH3)C(O)N(Et)2; (11) -CH(CH3)CH3N(CH3)2; (12) -CH2CH2CH2N(CH3)2; (13) -CH2CH2N(Et)2; (14) -CH2CH2(4-морфолинил);
(15) -CH2CH2CH2CH2N(CH3)2; (16) -CH2C(O)-PrO-NHCH2Ph; (17) -CH2C(CH3)2N(CH3)2; (18) -CH2CH2N(i-Pr)2; (19) -CH2CH2N(n-Bu)2; (20) -CH2CH2CH2CH2CH2CH2N (CH3)2; (21) -CH2CH2 (1-пиперазинил); (22) -CH2CH2(4-метил-1-пиперазинил); (23) -CH2CH2N(Ph)2; (24) -CH2CH2N(CH2CH= CH2 )2; (25) -CH2CH(Ph)N(CH3)2 или (26) -CH2CH2N(CH3)CH2Ph.
Либо соединения формулы
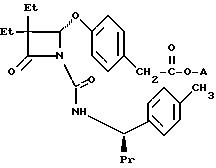
в которой A представляет собой (1) -CH2CH2N(CH3)2; (2) CH2CH2CH2N(CH3)2; (3) -CH2CH2N(Et)2; (4) -CH2CH2-(4-морфолинил); (5) -CH(CH3)CH2N(CH3)2; (6) CH2-C(CH3)2N(CH3)2 или (7) -CH2CH2N(CH3)CH2Ph,
или соединения второй группы формулы

в которой A представляет собой (1) -N(CH2CH2OH)2; (2) 4-метил-1-пиперазинил; (3) 4-морфолинил; (4) -NHCH2CH2N(CH3)2; (5) -N(CH3)CH2CH2N(CH3 )2; (6) -NHCH2CH2CH2N(CH3)2; (7) -NHCH2CH2(-4-пиридил); (8) -NHCH2CO2H; (9) -NHCH(CH3)CO2H; (10) -NHCH2C(O)N(CH2CH2OH)2; (11) -N(CH3)CH2CO2H; (12) -NHCH(CH3)C(O)N(CH2 CH2OH)2; (13) -N(CH3)CH2C(O)N(CH2CH2OH)2; (14) -N(CH3)CH2CH2-(4-морфолинил); (15) -N(CH3)CH2CH2N(CH2CH2OCH3)2;
(16) -N(CH3)CH2CH2N(Et)2; (17) -N(CH3)CH2CH2CH2N(CH3)2; (18) -NHCH2CH(CH3)N(CH3)2; (19) -N(CH3)CH2CH2N(i-Pr)2; (20) -N(n-Pr)2; (21) -N(Et)2; (22) 3-хлоранилино-; (23) 3-метоксианилино-; (24) 4-фторанилино-; (25) -N(CH3)CH2CH2 CH2CO2H; (26) -N(CH3)CH2CH2CH2C(O)NHSO2Ph; (27) -N(CH3)CH2CH2CH2N(CH3 )CH2Ph; (28) -N(CH3)2; (29) -N(CH3)CH2Ph; (30) -N(CH3)CH2CH2N(CH3)CH2Ph; (31) -NH-O-CH2Ph; (32) -N(CH3)(4-карбоксифенил) или (33) -N(CH3)(4-бензолсульфониламинокарбонилфенил).
Либо соединения формулы

в которой A представляет собой (1) -NHCH2CH2N(CH3)2; (2) -NH-CH2CO2H; (3) -N(CH3)CH2CH2N(CH3)2; (4) -N(Et)CH2CH2N(CH3)2; (5) -NHCH2CH2N(Et)2; (6) -NHCH2CH2-(4-морфолинил); (7) -N(CH3)CH2CH2-(4-морфолинил); (8) -N(CH3)CH2CH2N(CH2CH2OCH3)2; (9) -N(CH3)CH2CH2N(Et)2; (10) -N(Ph)CH2CH2N(CH3)2; (11) -N(CH3 )CH2CH2CH2N(CH3)2; (12) -NHCH2CH2N(i-Pr)2; (13) -N(CH3)CH2CH2N(iPr)2; (14) -NHCH2CH2-(1-пиперидинил); (15) -N(CH3)CH2CH2-(1-пиперидинил); (16) -N(CH3)CH2CH2NHCH3; (17) -N(CH3)CH2CH2N(CH3)Ac; (18) -NHCH2CH2-(1-пирролидинил); (19) -N(CH3)CH2CH2-(1-пирролидинил); (20) -NHCH2CH2-(1H-1,2,4-триазол-4-ил); (21) -NH-CH2CH2-(1-имидазолил); (22) -NH-CH2CH2-(2H-тетразол-2-ил); (23) -NH-CH2CH2-(1H-тетразол-1-ил); (24) -N(CH3)CH2CH2N(CH3)Ac; (25) -N(CH3)CH2CH2N(CH3)C(O)NHCH3; (26) -N(CH3)CH2CH2N(CH3)SO2CH3; (27) -NHCH2CH2-(1,1-диоксо-4-тиоморфолинил); (28) -4-диметиламинобензиламино; (29) 3-диметиламиноанилино; (30) -N(CH3)CH2CH2-(1,1-диоксо-4-тиоморфолинил); (31) 4-диметиламиноанилино; (32) -NHCH2CH2-(1-бензил-1H-имидазол-2-ил); (33) -N(CH3)CH2CH2-(2-пиридил); (34) -NHCH2CH2-(4-бензилоксикарбонил-1-пиперазинил); (35) -NHCH2CH2-(1-гомопиперидинил); (36) -N(CH3)CH2CH2-(1-гомопиперидинил); (37) -N(CH3)CH2CH2N(CH3)CH2Ph; (38) -N(n-Pr)2; (39) -N(Et)2; (40) -N(CH3)CH2CH2-(4-оксо-1-пиперидинил); (41) -N(Et)CH2CH2-(1-пиперидинил); (42) -N(CH2Ph)CH2CH2-(1-пиперидинил); (43) 4-фторанилино; (44) 3-хлоранилино; (45) 3-метоксианилино; (46) -N(CH2Ph)CH2CH2N(CH3)2; (47) -N(3-пиколил)-CH2CH2-(1-пиперидинил); (48) -NHCH(CH3)CH2CH2CH2N(Et)2; (49) -NHCH2CH2-(2-S-гидроксиметил-1-пирролидинил); (50) -N(CH3)CH2CH2-(4-третбутоксикарбонил-1-пиперазинил); (51) -N[CH2CH2N(CH3)2]2; (52) -N[CH2CH2N(Et)2]2; (53) -N(CH3)CH2CH2N(CH3)-(3-пиколил); (54) -3,5-диметил-1-пиперазин; (55) -N(CH3)CH2CH2N(CH3)-(4-пиколил); (56) -N(CH3)CH2CH2N(CH3)-(2-пиколил); (57) -N(CH3)CH2CH2-(1-пиперазинил); (58) 1-гомопиперазинил; (59) -N(CH3)CH2CH2N(CH3)CH2CH2Ph; (60) -N(CH3)CH2-[CH(OH)]4CH2OH; (61) -N(CH3)CH2CH2N(CH3CH(CH3Ph; (62) -N(CH3)CH2CH2N(CH2Ph)2; (63) 1-этил-3-пиперидиниламино; (64) -N(CH3)CH2CH2CH2C(O)NHSO3Ph; (65) -N(CH3CH2CH2N(CH3)CH2CH= CH2; (66) -N(CH3)CH2CH2CH2N(CH3) CH2Ph; (67) -N(CH3)-CH2)6-N(CH3)CH2Ph; (68) -N(CH3)CH2CH2OH; (69) -N(CH3)CH2CH2OC(O)N(CH3)2; (70) -N(CH3)CH2CH2N(CH3 )CH2 CO2-t-Bu; (71) -N(CH3)-(1-этил-3-пиперидинил); (72) -N(CH3)CH2CH2N(CH3)- (тетрагидро-2H-пиран-2-илметил); (73) -2,2,6, 6-тетраметилпиперидин-4-иламино; (74) -N(CH3)-(4-карбоксифенил); (75) -N(CH3)CH2CH2N(CH3)- (4-цианобензил); (76) -N(CH3)CH2 CH2N(CH3)- (4-метилбензил); (77) -N(CH3)CH2CH2N(CH3)- (3-цианобензил); (78) -N(CH3)CH2CH2N(CH3)- (4-трифторметилбензил); (79) -N(CH3)CH2CH2N(CH3)-(3-трифторметилбензил); (80) -N(CH3)CH2CH2N(CH3 )-(циклопропилметил); (81) -N(CH3)CH2CH(Ph)N(CH3)2; (82) -N(CH3)CH2Ph; (83) -N(CH3)-(1-бензил-3-пиперидинил); (84) -N(3-пиколил)CH2CH2N(CH3)CH2Ph; (85) -N(CH3)CH2CH2N(CH3)-(4-метоксибензил); (86) -N(4-пиколил)CH2 CH2N(CH3CH2Ph; (87) -N(2-пиколил)CH2CH2N(CH3)CH2Ph; (88) -N(CH3)CH2CH2N(CH3)-(2, 4-диметилбензил); (89) -N(CH3)CH2CH2-(2,6-диметил-4-морфолинил); (90) 4-морфолинил; (91) цис-2,6-диметил-4-морфолинил; (92) -NH-CH2CH2CH2CH3; (93) -N(CH3)CH2CH2N(CH3)-(3-фторбензил); (94) -N(CH3)CH2CH2N(CH3)-(2-хлорбензил); (95) -N(CH3)CH2CH2N(CH3)-(3-метоксибензил); (96) -N(CH3)-(1-бензил-4-пиперидинил); (97) -N(CH3)CH2CH2N(CH3 )-(2-адамантил); (98) -N(CH3-(4-пиперидинил); (99) 5-метил-2,5-диазабицикло[2,2,1] гепт-2-ил; (100) -N(CH3)CH2CO2H; (101) -N(CH3)CH2 CH2CH2N(CH3)CH2CH3; (102) -N(CH3)-(1-метил-4-пиперидинил); (103) -N(CH3)-(1-пропил-4-пиперидинил); (104) -N(CH3 )-(1-этил-4-пиперидинил); (105) -N(CH3)CH2CH(CH3)N(CH3)CH2Ph; (106) -N(CH3)CH2CH(CH3)N(CH3)2; (107) -N(CH3)CH2CH2NH-(2-адамантил); (108) -N(CH3)CH2CH2N(CH3)-(6,6-диметилбицикло-[3,1,1] -гепт-2-ил; (109) -N(CH3)CH2CH2N(CH3)-(1-циклогексен-1-ил); (110) -N(CH3)CH2CH2NHC(CH3)2CH = CH2; (111) 2-S-карбоксамидо-1-пирролидинил; (112) 2-гидроксиметил-1-пиперидинил; (113) 3-диметиламино-1-пирролидинил; (114) -N(CH3)CH2CH2N(CH3) (циклогексилметил); (115) -N(CH3)CH2CH2N(CH2CH = CH2) C(CH3)2CH = CH2; (116) -N(CH3)CH2CH2N(CH3) (4-этилциклогексил); (117) -N(CH3)CH2CH2N(CH3) (2-этилциклогексил); (118) -N(CH3)CH2CH2N(CH3) (4-метилциклогексил); (119) -N(CH3)CH2CH2N(CH3) (циклогексил); (120) -N(CH3)CH2CH2N(CH3)CH2 C(O)N(CH3)2; (121) -N(CH3)CH2CH2N(CH3) (циклогексилметил) или (122) -NHCH2CH2N(Et)CH2CH2 OCH3. Особенно можно выделить соединения формулы I

в которой R представляет собой (1) -CH3; (2) 4-фторфенил; (3) 3-хлорфенил; (4) фенил; (5) бензил; (6) водород; (7) i-Pr; (8) i-Bu; (9) -CH2CO2Et; (10) -CH2CO2H; (11) Et; (12) Pr; (13) 2-пиримидинил; (14) -CH2CH2OC(O)NHCH3; (15) циклопропил или (16) -CH2CH2OH,
или соединения формулы

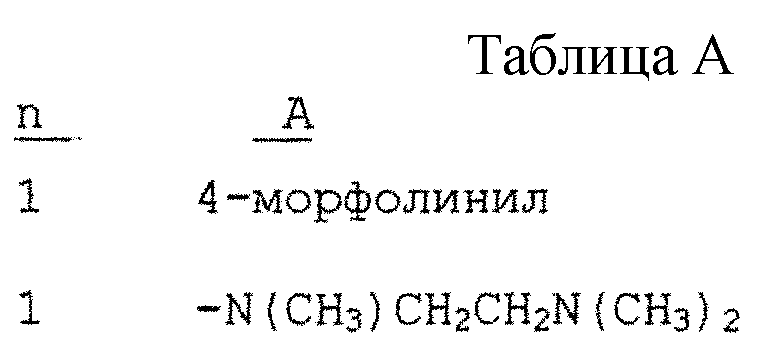
значения n и A в которой даны в табл. А,
или соединения формулы

значения n, R2 и A в которой даны в табл. Б,
а также соединения формулы
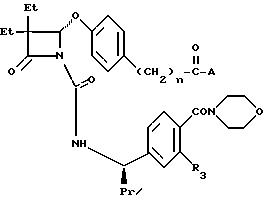
значения n, R3 и A в которой даны в табл. В,
или формулы

значения n, R2, R3 и A в которой даны в табл. Г,
или формулы

значения R2, R6 и A в которой даны в табл. Д.
В частности, предпочтительные соединения выбраны из
(а) Трет-бутоксикарбонилметил(S-R*, S*)]-4- ((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2- азетидинил)окси)бензоат;
(б)
2-(бис)-(2-гидроксиэтил)амино)-2-оксоэтил (S-R*, S*)]-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2- азетидинил)окси)бензоат;
(в)
1-метил-2-оксо-2-(фенилметилокси)этил (2S-(1(S*), 2R*, (R)))-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(г)
1-карбоксиэтил [S-(R*, S*)] -4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(д) 2-(диэтиламино)-1-метил-2-оксоэтил [S-(R*, S*)]-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(е) [S-(R*, S*)]-1-(((4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)окси)-ацетил)-L-пролин;
(ж) [S-(R*, S*)]-1-(((4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)окси)-ацетил-N-бензил-L-пролинамид;
(з) 2-(диметиламино)этил-[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-бензоат;
(и) 1-диметиламино-2-пропил [S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-бензоат;
(к) 3-диметиламино-1-пропил [S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-бензоат;
(л) 2-диэтиламиноэтил [S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-бензоат;
(м) 2-(1-(4-морфолино)этил)-[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(н) 4-диметиламинобутил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(о) 2-диметиламино-2-метил-1-пропил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(п) 2-(диизопропиламино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(р) бензил[S-(R*, S*)] -4-(2-((4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)оксиэтил)-1-пиперазин-карбоксилат;
(с) 2-(дибутиламино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(т) [S-(R*, S*)] -6-(диметиламино)гексил-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(у) 2-(4-метил-1-пиперазинил)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ф) 2-(дифениламино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(х) 2-(ди-2-пропениламино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ц) 2-(диметиламино)-2-фенилэтил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ч) 2-(метил(фенилметил)амино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ш) 2-(диметиламино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-2,6-диметил-бензоат;
(щ) 2-(диэтиламино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-2,6-диметил-бензоат;
(ь) 2-(бис-(1-метилэтил)амино)этил[S-(R*, S*)]-4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-2,6-диметил-бензоат.
Соединение по п. 1, выбранное из группы, включающей:
(а) [S-(R*,
S*)]-2-(4-(((2-диметиламино)этил) метиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(б) [S-(R*, S*)]
-2-(4-(((2-диметиламино)этил)метиламино)-карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)-бутил)-4-оксо-1-азетидинкарбоксамид;
(в) [S-(R*, S*
)]-2-(4-((4-метилпиперазин-1-ил) карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1- азетидинкарбоксамид;
(г) [S-(R*, S*)]-2-(4-((4-метилпиперазин-1-ил)
карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(д) [S-(R*, S*)]-2-(4-((4-циклопропилпиперазин-1-ил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(е) [S-(R*, S*)]-2-(4-((4-циклопропилпиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(ж) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид; или
(з) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(и) [S-(R*, S*)]-2-(4-((((2-диметиламино)этил)этиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)
бутил)-4-оксо-1-азетидинкарбоксамид;
(к) [S-(R*, S*)]-2-(4-((((2-диэтиламино)этил)этиламино)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(л) [S-(R*, S*)]-2-(4-(((4-(2-гидроксиэтил)пиперазин-1-ил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(м) [S-(R*, S*)]-2-(4-(((4-(2-гидроксиэтил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид; или
(н) [S-(R*, S*)]-2-(4-(((4-этоксикарбонилметил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
Либо соединения, представляющие собой:
(а) [S-(R*, S*)]-2-(4-((4-морфолинил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид; или
(б) [S-(R*, S*)]-2-(4-((4-морфолинил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
или представляющее собой:
(а) [S-(R*, S*)]-2-(4-((((2-диметиламино)этил)метиламино)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил) бутил)-4-оксо-1-азетидинкарбоксамид;
(б) [S-(R*, S*)]-2-(4-(((4-метил)пиперазин-1-ил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(в) [S-(R*, S*)] -2-(4-(((4-метил)пиперазин-1-ил) карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(г) [S-(R*, S*)]-2-(4-(((4-циклопропил)пиперазин-1-ил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(д) [S-(R*, S*)]-2-(4-(((4-циклопропил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(е) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,
3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1- азетидинкарбоксамид; или
(ж) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил) фенокси)-3,3-диэтил-N-(1-(3,
4-метилендиоксифенил)бутил)-4-оксо-1- азетидинкарбоксамид;
также соединения, где
R представляет собой C1-3алкил;
R1 представляет собой C1-3
алкил;
M представляет этил, пропил, бутил, пентил или гексил;
R2 представляет:
(а) водород;
(б) C1-6алкил или C1-6алкокси; или
R3 представляет собой водород; или
R2 и R3 объединяются вместе с образованием метилендиоксигруппы;
каждый из R9, R10 и
R11 выбирают независимо друг от друга из группы, состоящей из водорода, C1-4алкила и C1-3алкокси-C1-3алкила;
R7 и R8 вместе с
атомом азота, к которому они присоединяются, образуют моно- или ди-замещенное кольцо, выбранное из группы, включающей:
(1) пиперидинил; (2) пиперазинил; (3) морфолинил; (4) пирролидинил; (5)
пиррил; (6) имидазолил; (7) триазолил; (8) тетразолил; (9) пиразолидинил или (10) азетидинил,
при этом каждый из заместителей выбирают из группы, содержащей водород и C1-3алкил,
бензилоксикарбонил, фенил-C1-3алкиламинокарбонил, пирролидинилметил, гидрокси-C1-3алкил, C1-6алкокси, C1-4алкилоксикарбонил и оксогруппу.
или соединения, где
R представляет метил или этил;
R1 представляет метил или этил;
M представляет этил, пропил, бутил;
R2 представляет:
(а) водород; (б) C1-3алкил или C1-3алкокси.
Особенно соединение A, представляющее собой: [S-(R*, S* )]-2-(4-((4-метилпиперазин-1-ил)карбонил) фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид или его фармацевтически приемлемую соль.
Все соединения проявляют активность ингибитора эластазы лейкоцитов человека.
К их изобретению также относится фармацевтическая композиция, ингибирующая эластазу лейкоцитов человека, включающая активное начало и фармацевтически приемлемый носитель, отличающаяся тем, что содержит в качестве активного начала эффективное количество соединения любого соединения формулы I.
Предпочтительна фармацевтическая композиция, содержащая в качестве активного ингредиента соединение формулы I.
Изобретение относится к способу лечения болезней, вызванных избыточной активностью эластазы, путем введения ингибитора в организм, заключающемуся в том, что в качестве ингибитора вводят нетоксичное, терапевтически эффективное количество соединения I.
Изобретением также является способ получения соединения общей формулы I, в которой
R представляет этил,
R4 означает группу

где Q, Y, R7 и R8 имеют указанные в п. 1 значения, заключающийся в том, что соединение общей формулы

обрабатывают соединением, имеющим формулу:

где R1, R1, R2, R3, R7, R8, Ra, Rb, M, Q и Y имеют указанные значения.
Как было показано выше при соединении R8, R9, R10 и R12 образуются различные кольца. Ниже приведены неограничивающие примеры, показывающие, как формы колец образуются преимущественно при соединении тех или иных заместителей.
R8 и R9 соединяются

R9 и R10 соединяются

R9 и R12 соединяются

R10 и R12 соединяются

R10 и R12 соединяются

В другом своем аспекте настоящее изобретение относится к лечению лейкозов, таких видов, как нелимфобластные лейкозы, острый миелобластный лейкоз (FAB M1 и FAB M2), острый промиелоцитарный лейкоз (FAB M3), острый миеломоноцитарный лейкоз (FAB M4), острый моноцитарный лейкоз (FAB M5), эритролейкоз, хронический миелобластный лейкоз, хронический миеломоноцитарный лейкоз, хронический моноцитарный лейкоз и состояния, сопровождающие лейкоз, которые вовлекают активность ПМЯ нейтральных протеаз, в частности, диссеминированное внутрисосудистое свертывание, с помощью соединений формулы I.
Лечение лейкозных клеток включает: введение терапевтически эффективного количества соединения формулы I, которое приводит к ингибированию протеиназы 3/миелобластина, ингибированию эластазы, ингибированию пролиферации лейкозных клеток, индукции дифференциации лейкозных клеток и ремиссии заболевания.
В одном альтернативном варианте изобретение относится к способу лечения лейкозных клеток, который включает:
введение пациенту при необходимости такого
лечения терапевтически эффективного количества соединения формулы I.
Во втором альтернативном варианте изобретение относится к способу ингибирования протеиназы 3/миелобластина, который
включает:
введение пациенту при необходимости такого ингибирования терапевтически эффективного количества соединения I, как это определено выше.
В третьем альтернативном
варианте изобретение относится к способу ингибирования протеиназы 3/миелобластина и эластазы, который включает:
введение пациенту при необходимости такого ингибирования терапевтически
эффективного количества соединения формулы I или фармацевтически приемлемой его соли, как было определено выше.
В четвертом варианте изобретение относится к способу индуцирования
клеточной дифференциации лейкозных клеток, который включает:
введение пациенту при необходимости такого ингибирования терапевтически эффективного количества соединения I или его
фармацевтически приемлемой соли, как определено выше.
Каждый из упомянутых выше альтернативных вариантов (т.е. относящихся к ингибированию PR3 или к лечению рака) также относится к совместному введению соединения формулы I, определенного выше, и агента или агентов, традиционно используемых для лечения лейкоза, включающего, но не ограничивающегося ими, эпсилон-аминокапроновую кислоту, гепарин, тразилол (апротинин); преднизолон, цитозин арабинозид; бета-меркаптопурин; цитарабин; антрациклин (см. Young et al. (1981) N. Engl. J. Med. 305: 139), такой как даунорубицин, доксорубицин и эпидоксорубицин; производные витамина A, включающие ретиноиды и все транс-изомеры ретиноевой кислоты (см. Ellison R.R. et al. (1968) Blood 32: 507. Арабинозил цитозин: агент, применяемый для лечения лейкоза у взрослых больных: Цитарабин: новые терапевтические горизонты. Semin. Oncol. 12: 1 (1985, Supp 3): Weinstein H.J. et al. (1983) Blood 62: 315. Химиотерапия острого миелобластного лейкоза детей и взрослых, приводящая к усилению терапевтического эффекта).
Соответственно, пятый альтернативный вариант изобретения относится к фармацевтической
композиции, которая включает:
фармацевтический носитель, терапевтически эффективное количество соединения, отобранного из группы, состоящей из эпсилон-аминокапроновой кислоты, гепарина,
тразилола, преднизолона, цитозин арабинозида, бета-меркаптопурина, цитарабина, антрациклина и производного витамина A, а также терапевтически эффективное количество соединения формулы I, как
определено выше.
В шестом альтернативном варианте изобретение относится к способу лечения лейкоза, который включает:
совместное введение пациенту при необходимости такого
лечения терапевтически эффективного количества соединения, отобранного из группы, состоящей из эпсилон-аминокапроновой кислоты, гепарина, тразилола, преднизолона, цитозин арабинозида,
бета-меркаптопурина, цитарабина, антрациклина и производного витамина A; а также терапевтически эффективного количества соединения формулы I, определенного выше.
В седьмом
альтернативном варианте изобретение относится к способу ингибирования протеиназы 3/миелобластина, который включает:
совместное введение пациенту при необходимости такого ингибирования
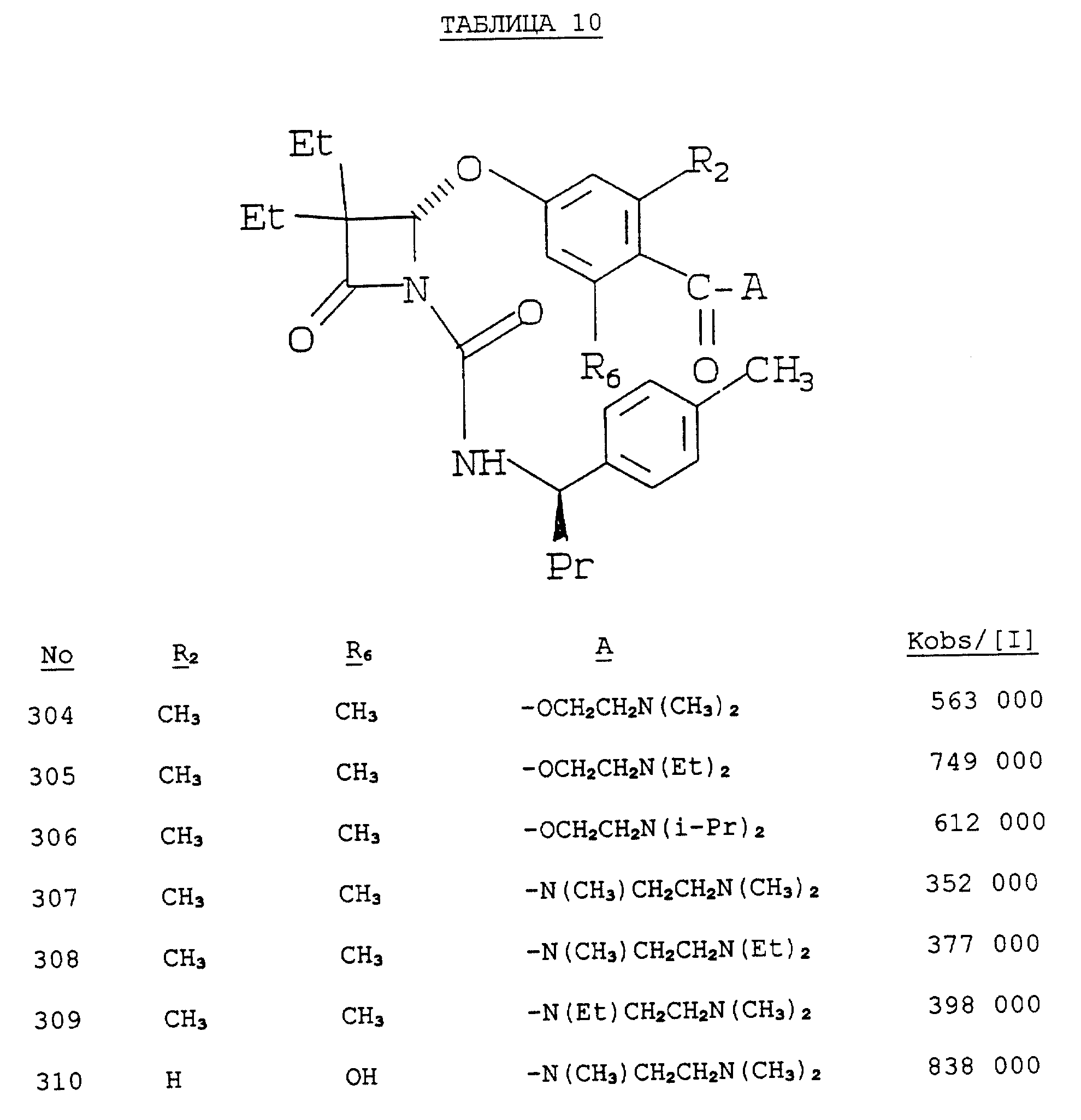
терапевтически эффективного количества соединения, отобранного из группы, состоящей из эпсилон-аминокапроновой кислоты, гепарина, тразилола, преднизолона, цитозин арабинозида, бета-меркаптопурина,
цитарабина, антрациклина и производного витамина A, а также терапевтически эффективного количества соединения формулы I, определенного выше.
В восьмом альтернативном варианте настоящее
изобретение относится к способу ингибирования протеиназы 3/миелобластина, который включает:
введение пациенту при необходимости такого ингибирования терапевтически эффективного количества
соединения, отобранного из группы, содержащей из эпсилон-аминокапроновую кислоту, гепарина, тразолил, преднизолон, цитозин, арабинозид, бета-меркаптопурин, цитарабин, антрациклин и производное
витамина A, а также терапевтически эффективного количества соединения формулы I, определенного выше.
В девятом альтернативном варианте настоящее изобретение относится к способу
индуцирования в лейкозных клетках дифференциации клеток, который включает:
введение пациенту при необходимости такого индуцирования терапевтически эффективного количества соединения,
отобранного из группы, включающей эпсилон-аминокапроновую кислоту, гепарин, тразолил, преднизолон, цитозин арабинозид, бета-меркаптопурин, цитарабин, антрациклин и производное витамина A, а также
терапевтически эффективного количества соединения формулы I, определенного выше.
В десятом альтернативном варианте изобретения представленные в нем соединения могут быть также использованы для лечения заболеваний, связанных со сверхэкспрессией кДНК, таких, в частности, какими являются болезни легких, сопровождающиеся аномально вязкими или уплотненными гнойными выделениями. Показано наличие таких соединений в случае острых или хронических бронхолегочных заболеваний, включающих инфекционную пневмонию, бронхит или трахеобронхит, бронхоэктаз, муковисцидоз, астму, туберкулез или грибковые инфекции. Применимость их также полезна в случае ателактаза в связи с развитием поражения трахеи или бронхов, а также в результате осложнений, возникших после трахеостомии.
Кроме того, соединения настоящего изобретения могут вводиться совместно с кДНК, которая как было показано ранее, также нашла применение в случае заболеваний легких, упомянутых выше, что нашло отражение в документе WO 90/07572.
Соединения настоящего изобретения получают с помощью известных методов или же с применением, помимо прочих, схем синтеза, представленных ниже для иллюстрации. К примеру, способы получения таких соединений описаны в патенте EP 0337549, опубликованном 18 октября 1987 г., который включен в настоящее описание в качестве ссылки.
Настоящее изобретение относится также к способу лечения воспалительных состояний у людей с использованием соединения формулы (I), в частности, с помощью в качестве предпочтительного варианта соединения его активного составляющего.
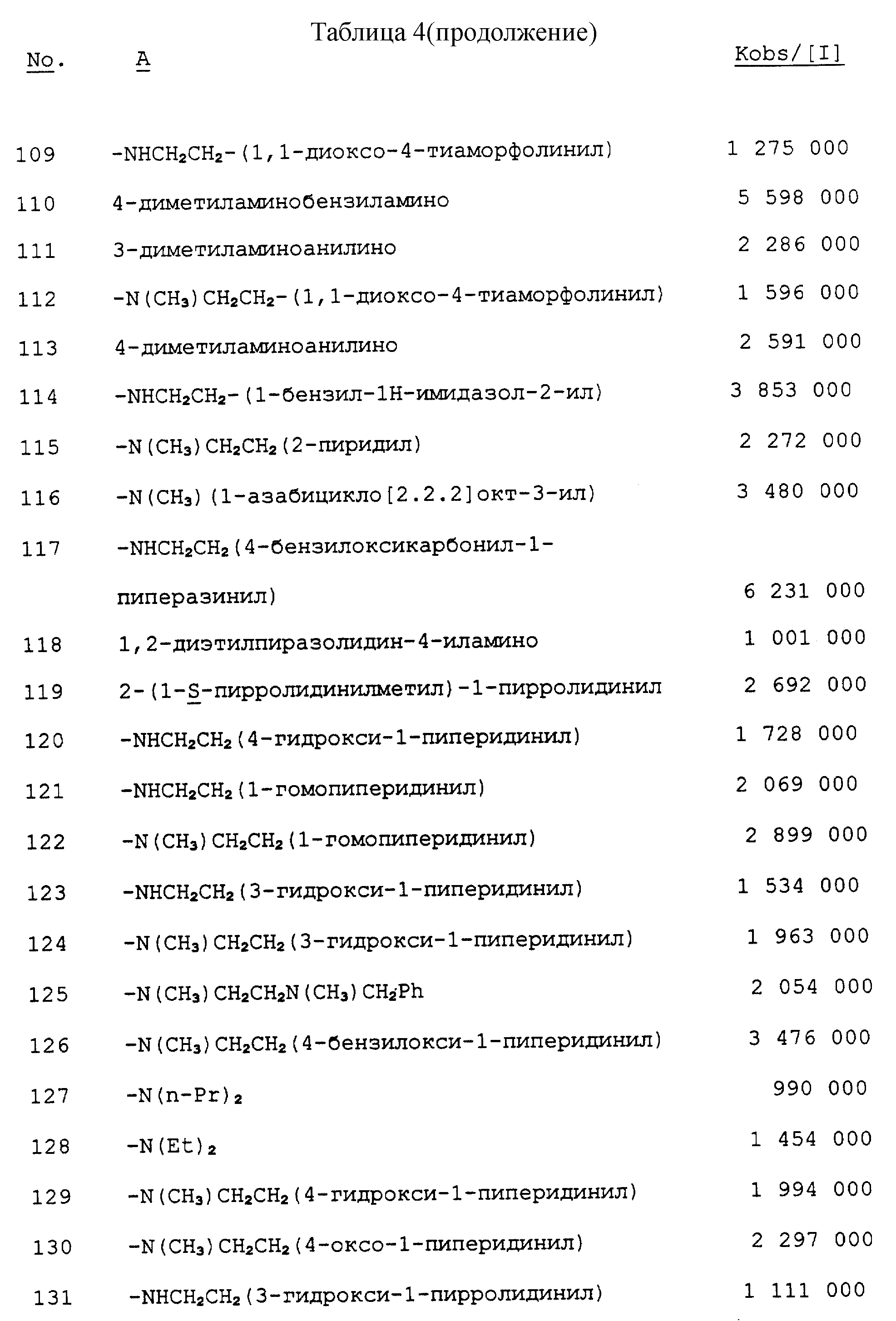
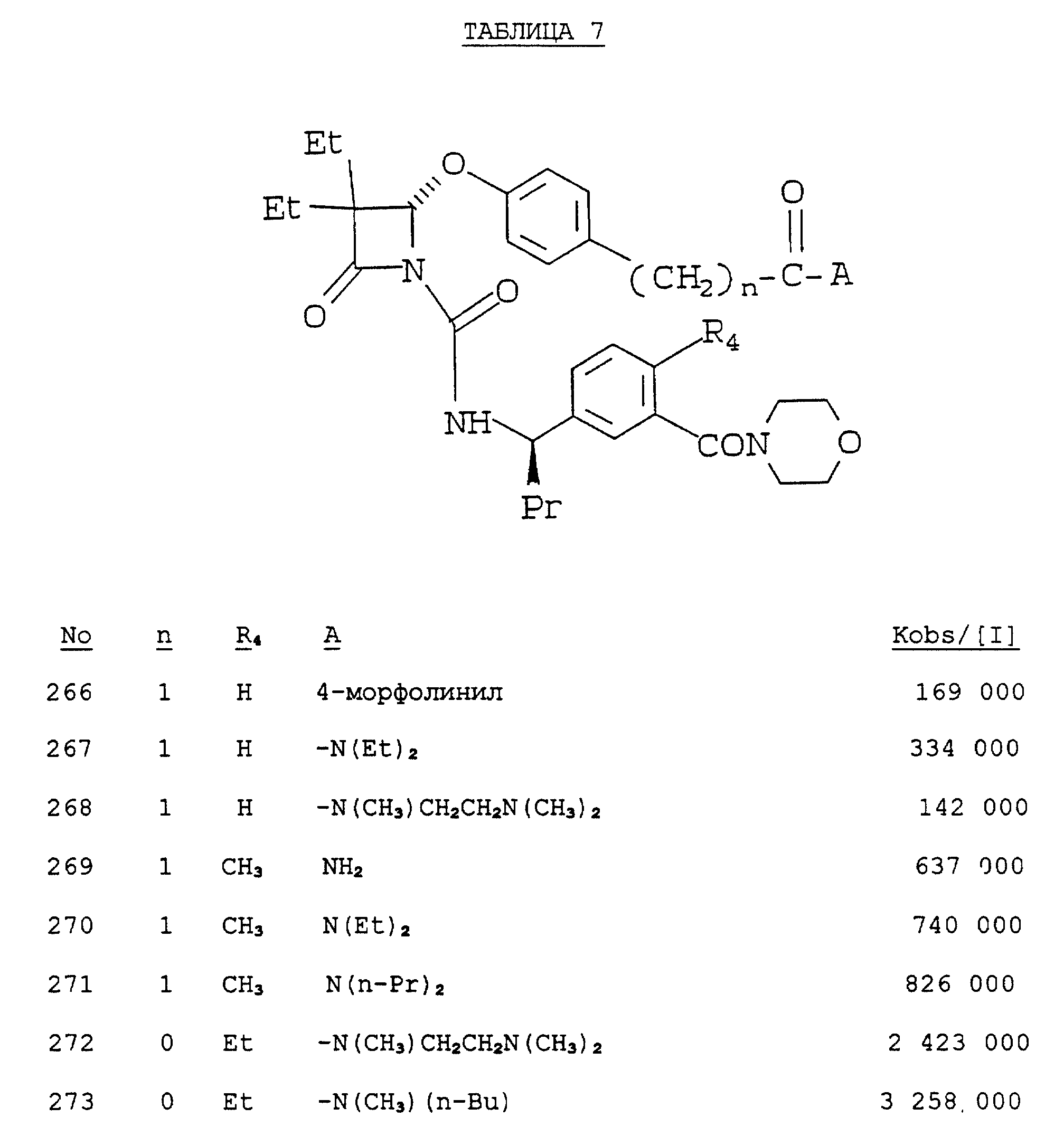
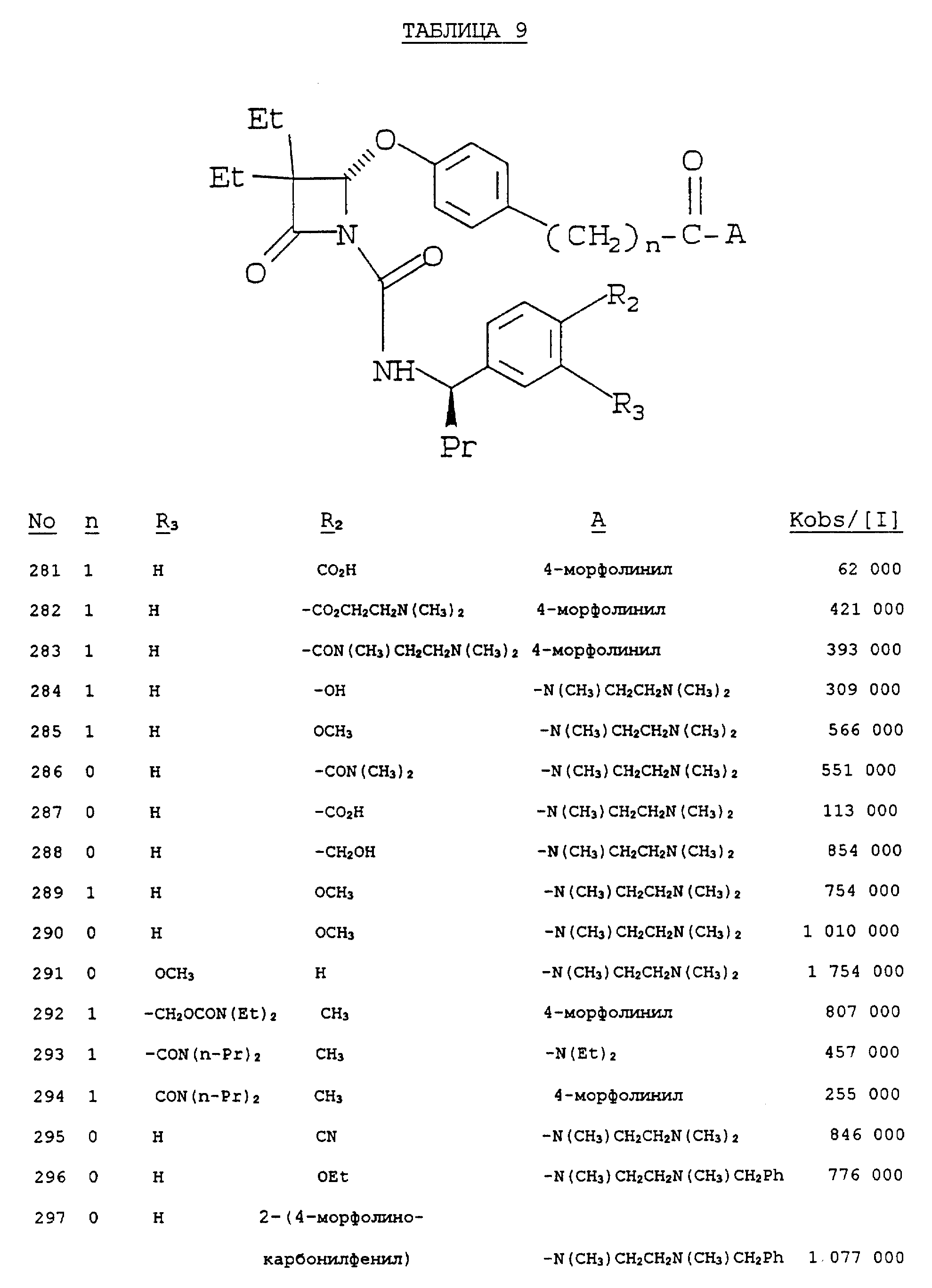
Было показано, что следующие соединения способны выполнять функцию эффективных ингибиторов протеолитической активности нейтрофильной эластазы человека, что и продемонстрировано в таблицах 1 - 10.
Определение активности фермента по ингибированию эластазы из полиморфноядерных нейтрофилов человека в реакции гидролиза
N-t-Бок-аланил-аланил-пролилаланин-п-нитроанилида (Бок-ААПАН) или N-t-Бок-аланил-пролилвалин-п-нитроанилидного (Бок-ААПВН) реагента:
0,05 М TES
(N-трис[гидроксиметил]метил-2-амино-этансульфоновая кислота) буфера, pH 7,5.
0,2 мМ Бок-ААПАН или Бок-ААПВН.
Для приготовления субстрата твердое вещество растворяют вначале в 10,0 мл ДМСО. После этого добавляют буфер при pH 7,5 до конечного объема 100 мл.
Грубый экстракт, содержащий эластазу из полиморфноядерных нейтрофилов (ПМЯ) человека.
Исследуемые ингибиторы (азетидиноны) перед использованием растворяют в ДМСО.
В кювету к 1,0 мл 0,2 мМ Бок-ААПАН добавляют 0,01-0,1 мл ДМСО с ингибитором или без него. После перемешивания проводят измерение при 410 ммк для обнаружения продуктов спонтанного гидролиза тестируемого соединения. Затем добавляют 0,05 мл экстракта ПМЯ и проводят измерение и запись величины ΔOD/мин при 410 ммк. Для этой цели используют спектрофотометр Бекмана, модель 35.
Результаты выражают в виде величины, равной ближайшей тысяче kobs/1, которая представляет собой константу скорости второго порядка, выражаемую в молях инактивируемого фермента в секунду.
Активность эластазы в грубом экстракте ПМЯ можно варьировать от препарата к препарату. При этом проводится контроль каждой партии, а добавляемый в процедуре определения активности объем соотносят с данной активностью.
Настоящее изобретение относится также к способу лечения воспаления у пациентов с применением соединения формулы I, при этом в качестве наиболее предпочтительного соединения рассматривается таковое, содержащее его в виде активного составляющего.
Было показано, что соединения формулы I являются эффективными ингибиторами протеолитической функции эластазы из нейтрофилов человека.
Соответственно этому, соединения формулы I могут использоваться для уменьшения воспаления и/или облегчения боли в случае таких заболеваний, как эмфизема, ревматоидный артрит, остеоартрит, подагра, бронхиальное воспаление, хронический или острый бронхит, муковисцидоз, респираторный дистрессиндром взрослых, атеросклероз, сепсис, септицемия, шок, периодонтит, гломерулонефрит или нефроз, инфаркт миокарда, поражение в результате реперфузии, инфекционный артрит, ревматическая атака и др., а также могут снижать кровотечение в случае острого промиелоцитарного лейкоза и др.
В этом аспекте в соответствии с оценкой специалистов в данной области, терапия, включающая введение соединений формулы I, может представлять собой совместное введение одного или более дополнительных активных агентов. Классы активных агентов включают, не ограничиваясь ими, β2-адренергические агонисты; антихолинергические агенты; стероиды; нестероидные противовоспалительные агенты (NSAID's); муколитические агенты; практически все стабилизаторы; и антибактериальные вещества.
Для целей, указанных в данном описании, β2-адренергические агонисты включают, не ограничиваясь ими, метапротеренол, тербуталин, изоэтарин, албутерол и ритодрин, карбутерол, фенотерол, хинтеренол, римитерол, салмефамол, сотеренол и третохинол.
Для целей, указанных в данном описании, антихолинергические агенты включают, не ограничиваясь ими, атропин и иптратропиум-бромид.
Для целей, указанных в данном описании, муколитические агенты включают, не ограничиваясь ими, ацетилцистеин и гваттенизин.
Для целей, указанных в данном описании, стероиды включают, не ограничиваясь ими, преднизон, беклометазон, будезонид, солумедрол, триамцинолом и метил-преднизолон.
Для целей, указанных в данном описании, большинство клеточных стабилизаторов включают, не ограничиваясь ими, кромолин и кетотафин.
Для целей, указанных в данном описании, нестероидные противовоспалительные агенты включают, не ограничиваясь ими, аспирин, дифлунизал, нафтилсалицилат, фенилбутазолон, оксифенбутазолон, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрия, толметин, ибупрофен, напроксен, фенопрофен и пироксикам.
Для целей, указанных в данном описании, антибактериальные агенты включают такие обширные классы, как пенициллины, цефалоспорины и другие бета-лактамы, аминогликозиды, хинолоны, макролиды, тетрациклины, сульфонамиды, линкозамиды и полимиксины. Пенициллины, в свою очередь, включают, не ограничиваясь ими, пенициллин C, пенициллин V, метициллин, нафциллин, оксациллин, клоксациллин, диклоксациллин, флоксациллин, ампициллин, ампициллин/сулбактам, амоксициллин, амоксициллин/клавуланат, гетациллин, циклациллин, бакампициллин, карбенициллин, карбенициллин инданил, тикарциллин, тикарциллин/клавуланат, азлоциллин, мезлоциллин, пеперациллин и мециллинам. Цефалоспорины и другие бета-лактамы включают, не ограничиваясь ими, цефалотин, цефапирин, цефалексин, цефрадин, цефазолин, цефадроксил, цефаклор, цефамандол, цефатетан, цефокситин, церуроксим, цефоницид, цефорадин, цефиксим, цефотаксим, моксалактам, цефтризоксим, цетриаксом, цетриаксон, цефоперазон, цефтразидим, имипенем и азтреонам. Амоногликозиды включают, не ограничиваясь ими, стрептомицин, гентамицин, тобрамицин, амикацин, нетилмицин, канамицин и неомицин. Хинолоны включают, не ограничиваясь ими, налидиксовую кислоту, норфлоксацин, эноксацин, ципрофлоксацин, офлоксацин, спарфлоксацин и темафлоксацин. Макролиды включают, не ограничиваясь ими, эритромицин, спирамицин и азитромицин. Тетрациклины включают, не ограничиваясь ими, доксициклин, миноциклин и тетрациклин. Сульфонамиды включают, не ограничиваясь ими, сульфиниламид, сульфаметоксазол, сульфацетамид, сульфадиазин, сульфазоксазол и ко-тримоксазол (триметоприм/сульфаметоксазол). Линкозамиды включают, не ограничиваясь ими, клиндамицин и линкомицин. Полимиксины (полипептиды) включают, не ограничиваясь ими, полимиксин В и колистин.
Альтернативно, соединения формулы I используются при лечении ряда видов рака, включая такие, как нелимфобластные лейкозы, острый миелобластный лейкоз (FAB M1 и FAB M2), острый промиелоцитарный лейкоз (FAB M3), острый миеломоноцитарный лейкоз (FAB M4), острый моноцитарный лейкоз (FAB M5), эритролейкоз, хронический миелобластный лейкоз, хронический миеломоноцитарный лейкоз, хронический моноцитарный лейкоз и состояния, сопровождающие лейкоз, которые вовлекают в процесс активность ПМЯ нейтральных протеаз, в частности, состояние диссеминированного внутрисосудистого свертывания.
Аналогично, соединения формулы I могут применяться для ингибирования протеиназы 3/миелобластина, ингибирования эластазы, ингибирования пролиферации лейкозных клеток и ремиссии состояния болезни в случае лейкоза.
Более того, как было описано выше, такое лечение может факультативно включать совместное введение вышеупомянутых соединений с агентом, таким, как любое из соединений, отобранное из приведенной ниже группы, которая содержит эпсилон-аминокапроновую кислоту, гепарин, тразилол, преднизолон, цитозин арабинозид, бета-меркаптопурин, цитарабин, антрациклин и производное витамина А, такое, в частности, как ретиноевая кислота.
Для каждого из указанных видов применения соединения формулы (I) и факультативно используемые для лечения агенты могут вводиться перорально, местно, парентерально путем ингаляции посредством спрея или ректально с помощью дозированных форм, содержащих традиционные нетоксические фармацевтически приемлемые носители, адъюванты и векторы. Применение в контексте настоящего изобретения термина "парентеральный" включает технику подкожного введения, внутривенного, внутримышечного, внутригрудинного введения или вливания. Кроме того, будучи полезными в случае лечения теплокровных животных, таких как мыши, крысы, лошади, собаки, кошки и т.д., соединения настоящего изобретения доказали свою эффективность также при лечении людей.
Для применения с целью лечения соединения формулы (I), как это было описано выше, могут вводиться перорально, местно, парентерально, посредством ингаляции спреем или ректально с применением дозированных форм, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и векторы. Используемый в контексте настоящего изобретения термин "парентеральный" включает технику подкожного введения, внутривенного, внутримышечного, внутригрудинного введения или вливаний. В дополнение к использованию для лечения теплокровных животных, таких как мыши, крысы, лошади, собаки, кошки и т.д., соединения настоящего изобретения, как было показано, эффективны также и в случае лечения людей.
Фармацевтические композиции, содержащие активный ингредиент, могут представлять собой формы, пригодные для перорального введения, такие, к примеру, как таблетки, пастилки, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального использования, могут быть приготовлены с использованием традиционных технологий, уже применяемых в производстве фармацевтических композиций, при этом такие композиции могут содержать один или более агентов, отобранных из группы, включающей подсластители, ароматизирующие агенты, красители и консерванты с целью придания фармацевтическому препарату приятный вкус и эстетичный вид. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, пригодными для производства таблеток. Такими наполнителями могут быть, в частности, инертные разбавители, такие, как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие или дезинтегрирующие агенты, например, кукурузный крахмал или альгиновая кислота, связывающие агенты, такие, в частности, как крахмал, желатин или аравийская камедь; и смазочные вещества, такие, к примеру, как стеарат магния, стеариновая кислота или тальк. Таблетки, в свою очередь, могут быть либо не покрытыми, либо могут покрываться оболочкой с использованием традиционных технологий с целью задержки разложения и последующего всасывания в желудочно-кишечный тракт и обеспечения в результате этого пролонгированного действия в течение длительного периода времени. К примеру, могут использоваться такие замедляющие время разложения таблеток вещества, как глицерил моностеарат или глицерил дистеарат.
Композиции, используемые для перорального введения, могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешивается с твердым инертным разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешивается с водной или масляной средой, в частности, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активные вещества в смеси с наполнителями, пригодными для производства водных суспензий. Такими наполнителями могут быть, например, такие суспендирующие агенты, как карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагант или аравийская камедь; в качестве диспергирующих или увлажняющих агентов могут также использоваться натуральные фосфатиды, такие как лецитин или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и гексита, таких как полиоксиэтиленсорбитол моноолеат, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и ангидридов гексита, например, полиоксиэтиленсорбитан моноолеат. Упомянутые водные суспензии могут также содержать один или более консервантов, таких как этил- или п-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизирующих агентов, один или более подсластителей, таких как сахароза или сахарин.
Масляные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, например: арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком, например, как жидкий парафин. Масляные суспензии могут содержат загустители, такие как воск, твердый парафин или цетиловый спирт.
Подсластители, такие как были указаны выше, а также ароматизирующие агенты могут быть добавлены для придания препарату, принимаемому перорально, приятного вкуса. В такие композиции могут быть также добавлены консерванты в виде оксидантов, в частности аскорбиновая кислота.
Диспергируемые порошки и гранулы, пригодные для приготовления водных растворов при добавлении воды, содержат активный ингредиент в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом, а также с добавлением одного или более консервантов. Примерами диспергирующих или увлажняющих агентов, а также суспендирующих агентов могут служить уже приведенные выше соединения. Кроме того, указанные формы могут содержать дополнительные наполнители, например, подсластители, ароматизирующие вещества и красители.
Фармацевтические композиции настоящего изобретения могут применяться также в виде водномасляных эмульсий. Роль масляной фазы может при этом выполнять растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, в частности жидкий парафин, или их смесь. Пригодные для создания таких форм эмульгаторы могут включать натуральные смолы, такие, в частности, как трагант или аравийская камедь, натуральные фосфатиды, например сою, лецитин, а также эфиры или неполные эфиры, полученные из жирных кислот и ангидридов гексита, например сорбитан моноолеат, и продукты конденсации упомянутых неполных эфиров с этиленоксидом, например полиоксиэтиленсорбитан моноолеат. Эмульсии могут также содержать подсластители и ароматизаторы.
Сиропы и эликсиры могут быть приготовлены с использованием подсластителей, таких как глицерин, пропиленгликоль, сорбит или сахароза. Такие композиции могут также включать снижающий раздражение агент, консервант, а также ароматизаторы и красители. Фармацевтические композиции могут изготавливаться в форме стерильных, пригодных для инъекций водных или маслянистых суспензий. Такая суспензия может быть приготовлена с помощью известных в технике тех пригодных для применения диспергирующих или увлажняющих агентов, а также суспендирующих агентов, которые уже были упомянуты выше. Стерильный, пригодный для инъекции препарат может также представлять собой стерильный, пригодный для инъекции раствор или суспензию в нетоксичном, пригодном для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В качестве приемлемых векторов и растворителей могут быть названы вода. Рингеровский раствор глюкозы в воде, а также изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды могут применяться такие традиционные компоненты, как стерильные, нелетучие масла. Для этой цели может использоваться любое мягкое нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, для приготовления инъецируемых форм могут применяться жирные кислоты, такие, в частности, как олеиновая кислота.
Соединения формулы (I) могут также вводиться в виде суппозиториев, пригодных для ректального способа ввода лекарства. Такие композиции могут быть получены путем смешивания препарата с мягким, не вызывающим раздражения наполнителем, который при обычных температурах представляет собой твердое вещество, однако разжижается при ректальной температуре, поэтому при введении в прямую кишку такой препарат начинает плавиться и высвобождать лекарственные компоненты. В качестве такого рода материалов могут использоваться кокосовое масло и полиэтиленгликоли.
Для местного применения могут использоваться кремы, мази, желе, растворы или суспензии и т.д., содержащие противовоспалительные агенты.
Количество активного(ых) ингредиента(ов), связываемого(ых) с материалами носителя, может варьировать в значительной степени в зависимости от объекта лечения и способа введения препарата. Так, например, композиция, предназначенная для перорального приема человека, может содержать от 5 мг до 2000 мг или 5000 мг (каждого из) активного(ых) ингредиента(ов), связанного(ых) с подходящим в обычно используемом количестве носителем, содержание которого также может варьировать от примерно 5 до примерно 95% от общего состава препарата. Для целей настоящей спецификации указанный широкий диапазон концентраций может включать, не ограничиваясь этими значениями, диапазон 5 - 2000 мг, диапазон 25 - 2000 мг; диапазон 5 - 1000 мг; диапазон 25 - 1000 мг; диапазон 5 - 500 мг; и диапазон 25 - 500 мг. Дозированные формы препарата содержат примерно от 25 до примерно 500 мг активного(ых) ингредиента(ов).
Кроме того, при проведении курсов лечения может быть оправдано первоначальное введение препарата с использованием исходных доз (т.е. 1 - 5 мг активного ингредиента на кг веса пациента), вслед за которым практикуется применение второго диапазона концентраций (т.е. от 0,1 до 1 мг активного ингредиента на кг веса пациента).
Однако должно быть понятно, что специфический уровень дозы, пригодный для каждого конкретного больного, зависит от множества факторов, включающих, в том числе, активность используемого соединения, возраст, вес тела, общее состояние здоровья пациента, пол, режим его питания, продолжительность и способ введения препарата, скорость его введения из организма, наличие сочетания с другими препаратами и какими именно, а также степень тяжести заболевания пациента подвергающегося лечению.
Приведенные ниже примеры иллюстрируют, не ограничивая ни в коей мере область применения настоящего изобретения, методы получения соединения, пригодных для использования в терапии в соответствии со способами, описанными в настоящем изобретении. Исходные материалы могут быть получены с использованием методов, раскрытых в ЕРО 337549, который был опубликован 18 октября 1989 г. и который включен в настоящее описание в качестве ссылки. Где это нужно, соединения могут быть получены с целью дальнейшего использования в виде фармацевтически приемлемых солей. Так, например, основные соединения могут использоваться в форме гидрохлорида, мезилата или другой приемлемой соли.
См. Preformulation in Remington's Pharmaceutical Sciences, Mack Publishing, Easton PA.




Приведенные в настоящем описании производные гликолевой кислоты могут быть приготовлены в соответствии со следующей схемой. Исходная кислота (в виде карбоксилат-аниона) может быть алкилирована (Ex IA) с помощью защищенного соответствующим образом производного альфа-гало-уксусной кислоты с образованием гликолевого эфира 4, в котором затем удаляются защищающие группы (Ex IB) с образованием эфира гликолевой кислоты 5. Аминирование 5 с использованием конденсированного агента, такого как дициклогексилкарбодиимид или карбомилдиинидазол (Ex 2) приводит к получению искомого амида 6. Альтернативно, исходная кислота может быть превращена в свой хлорид 2 (Ex 3A), после чего проводится обработка соответствующим образом защищенной альфа-гидроксиалканоевой кислотой (Ex 3B) в присутствии основания с получением защищенного эфира 7. Удаление защищающих групп (Ex 4) с последующими стадиями превращения в хлорид кислоты и обработки соответствующим амином (Ex 5) приводит к получению искомого амида 9.
Пример
1
A. трет-Бутоксикарбонилметил [S-(R*, S*)]4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)-карбонил) -4-оксо-2-азетидинил)окси)бензоат.
К раствору 0,806 г [S-(R*, S*)] 4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино) карбонил)-4-оксо-2-азетидинил)окси)бензойной кислоты примерно в 3 мл ДМФ добавляют 0,23 г триэтиламина, затем 0,50 г трет-бутилбромацетата и перемешивают полученную смесь в течение ночи при комнатной температуре. После этого добавляют этилацетат (25 мл), и полученную смесь промывают водой 2 • 10 мл, затем 10 мл насыщенного раствора бикарбоната натрия и 20 мл солевого раствора. Органический слой высушивают над сульфатом натрия и концентрируют в вакууме. После хроматографии на силикагеле 60 (колонка 350 мл) и элюции 10% этилацетатом в гексане получают 0,67 г t-бутоксикарбонилметил [S-(R*,S*)]4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата.
Сходным образом может быть приготовлен 2-(диметиламино)-2-оксоэтил, (S-(R*, S*))-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат (соединение 6) и 2-(N-метилацетамидо)этил, [2-(R*, S*)] -4-(((3, 3-диэтил-1-(((1-(4-метил-фенил) бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат (соединение 7).
Б. Карбоксиметил [2-(R*, S*)] -4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат
К вышеупомянутому эфиру добавляют 2 мл анизола, полученную смесь охлаждают в ледяной бане и добавляют 5 мл
ледяной трифторуксусной кислоты. Реакционную смесь перемешивают на холоде в течение трех часов, после чего доводят температуру до комнатной. Через 30 мин реакционную смесь концентрируют в вакууме, а
остаток хроматографируют на силикагеле 60. Элюция 20% этилацетатом в гексане, содержащем 1% уксусную кислоту дает 0,53 г искомого карбоксиметил [S-(R*, S*)]4-((3,
3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата.
Соединение 2
Аналитические данные для C28H34N2O7 + 0,3 H2O
Расчет (в %): C - 65,19, H - 6,75, N - 5,43
Найдено: C - 65,30, H - 6,76, N - 5,23.
Соединение 6
Аналитические данные для C30H39N3O6 + 0,5 H2O
Расчет (в %): C - 65,91; H - 7,38; N - 7,60.
Найдено: C - 65,71, H - 7,73, N - 7,50.
Соединение 7
Аналитические данные для C31H41N3O6 + 0,6 EtOAc
Расчет (в %): C - 66,35, H - 7,64, N - 6,95.
Найдено: C - 66, 52, H - 7,89, N - 6,83.
Пример 2. 2-(бис(2-Гидроксиэтил)амино)-2-оксоэтил-(S-(R*, S*))-4-((3,
3-диэтил-1-(((4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат
К раствору 0,125 г кислой формы 1Б в 2 - 3 мл метиленхлорида добавляют 0,050 г карбонилдиимидазола. Смесь
перемешивают в течение 30 мин при комнатной температуре, во время перемешивания добавляют 0,060 г диэтаноламина совместно с 1 мл ДМФ и 2 мл метиленхлорида. Полученную смесь перемешивают в течение ночи
при комнатной температуре, и затем ее концентрируют в вакууме. После хроматографии остатка на силикагеле с использованием для элюции от 2,5 до 5,0% метанола в метиленхлориде получают 0,123 г искомого
соединения 3 - 2-(бис(2-гидроксиэтил)амино)-2-оксоэтил (S-(R*, S*))-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата.
Соединение 3
Аналитические данные для C32H43N3O8 + 0,4 H2O
Расчет (в %): C - 65,53, H - 7,30, N - 6,95.
Найдено: C - 65,51, H - 7,45, N - 6,95.
Соединение 4
Аналитические данные для C31H40N4O7
Расчет (в %): C - 64,12, H - 6,
94, N - 9,65.
Найдено: C - 64,12, H - 7,18, N - 9,44.
Соединение 5
Аналитические данные для C32H43N3O9 + 0,3
H2O
Расчет (в %): C - 62,08, H - 7,09, N - 6,79.
Найдено: C - 61,89, H - 7,39, N - 6,88.
Соединение 8
Аналитические данные для C40H47N3O8
Расчет (в %): C - 68,85, H - 6,79, N - 6,02.
Найдено: C - 68,79, H - 7,06, N - 5,88.
Пример 3. Получение 1-метил-2-оксо-2-(фенилметокси)этил (2S-(1(S*), R*, -(R*)))-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата - соединения 10.
А. К раствору 1,0 г [S-(R*, S*)] -4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азатидинил)окси)бензойной кислоты в 10 мл метиленхлорида добавляют 2 мл оксалилхлорида и затем ДМФ в количестве, необходимом для катализа. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем концентрируют в вакууме с получением хлорида кислоты, который используют на следующей стадии.
Б. Раствор вышеупомянутого хлорида кислоты в 10 мл метиленхлорида охлаждают в водяной бане и добавляют раствор 1,25 г бензил-L-лактата и 2,0 г триэтиламина в 10 мл метиленхлорида. Смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют в вакууме. Хроматография остатка на силикагеле с использованием метиленхлорида в качестве элюента дает 0,795 г искомого 1-метил-2-оксо-2-(фенилметокси)этил-(2S-(1(S*), R*, -(R)))-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси) бензоата - соединения 10.
Аналитические данные для C36H42N2O7
Расчет (в %): C - 70,34, H - 6,89, N - 4,56.
Найдено: C - 70,45, H - 7,05, N - 4,48.
Пример 4. Получение 1-карбоксиэтил [S-(R*, S* )]-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата.
Смесь 0,69 г бензилового эфира, полученного в примере 3, и 0,2 г 10% Pd/C в 10 мл EtOAc обрабатывают водородом при давлении 40 фунтов на дюйм2. После остановки реакции смесь фильтруют и концентрируют в вакууме с получением 0,56 г 1-карбоксиэтил [S-(R*, S* )]-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азатидинил)окси)бензоата - соединения 11.
Аналитические данные для C29H36N2O7
Расчет (в %): C - 66,40, H - 6,92, N - 5,34.
Найдено: C - 66,66, H - 7,26, N - 5,05.
Пример 5. 2-(Диэтиламино)-1-метил-2-оксоэтил-[S-(R*, S*)]-4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата.
Кислоту (0,250 г) из примера 4 обрабатывают оксалилхлоридом по методике примера 3А, получая соответствующий хлорид кислоты. Этот материал растворяют в 5 метиленхлорида и добавляют 0,4 мл диэтиламина. Через 1 ч реакционную смесь концентрируют в вакууме, а остаток переносят в этилацетат и промывают насыщенным раствором бикарбоната натрия. Органическую фазу высушивают над сульфатом натрия, концентрируют и хроматографируют остаток на силикагеле. После элюции 5% этилацетатом в метиленхлориде получают соединение 12.
Аналитические данные для C33H45N3O6
Расчет (в %): C - 68,37, H - 7,82, N - 7,
25.
Найдено: C - 68,40, H - 7,93, N - 7,40.
Пример 6. (S(R*, S*))-1-(((4-((3, 3-Диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)окси)ацетил)-L-пролин.
А. При замене в методике примера 3 бензи-L-лактата на гидрохлорид бензилового эфира L-пролина получают соответствующий амид бензилового эфира L-пролина - соединение 8.
Аналитические данные для C40H47N3O8
Расчет (в %): C - 68,85, H - 6,79, N - 6,02.
Найдено: C - 68,79, H - 7,06, N - 5,88.
B. Восстановление продукта, полученного в примере 6А в соответствии с процедурой примера 4, дает соединение 9.
Аналитические данные для C33H41N3O8 + 0,5 H2O
Расчет (в %): C - 64,27, H - 6,
86, N - 6,81.
Найдено: C - 64,49, H - 6,90, N - 6,68.
Пример 7. [S-(R*, S*)]-1-(((4-((3,
3-Диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)окси)ацетил-N-бензил-L-пролинамид
Обработка кислоты, полученной в примере 6Б, - соединения 9 - в
соответствии с процедурой примера 3А дает соответствующий хлорид кислоты, при обработке которого бензиламином получают искомый бензиламид - соединение 19.
Аналитические данные для
C40H48N4O7
Расчет (в %): C - 68,95 H - 6,94, N - 8,04.
Найдено: C - 68,93, H - 7,02, N - 7,96.
Пример 8. К раствору хлорида кислоты (полученного из 0,55 г [S-(R*, S*)] 4-((3,3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси) бензойной кислоты, полученной в соответствии с процедурой примера 3А), в 3 мл метиленхлорида добавляют 0,15 г N,N-диметиламиноэтанола. Реакционную смесь перемешивают при комнатной температуре, концентрируют в вакууме и затем переносят в этилацетат (25 мл) и промывают насыщенным раствором бикарбоната натрия. Органическую фазу высушивают над сульфатом натрия и концентрируют в вакууме. После хроматографии на силикагеле с использованием для элюции 2,5% метанола в метиленхлориде получают 0,59 г соединения 1-2-(диметиламино)этил(S-(R*, S*))-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоата.
Аналитические данные для C30H41N3O5
Расчет
(в %): C - 68,81, H - 7,89, N - 8,02.
Найдено: C - 68,85, H - 8,09, N - 7,97.
При замене N,N-диметиламиноэтаноламина подходящими аминоспиртами получают соответствующие эфиры.
Соединение 13
1-Диметиламино-2-пропил [S-(R*, S*)] -4-[[3,
3-диэтил-1-[[[1- (4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C31H43N3O5
Расчет (в %): C
- 69,25, H - 8,06, N - 7,82.
Найдено: C - 68,97, H - 8,01, N - 7,80.
Соединение 14
3-Диметиламино-1-пропил [S-(R*, S*)]-4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C31H43N3O5
Расчет (в %): C
- 69,25, H - 8,06, N - 7,81.
Найдено: C - 68,85, H - 8,19, N - 7,72.
Соединение 16
2-Диэтиламиноэтил [S-(R*, S*)] -4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C32H45N3O6
Расчет (в %): C
- 69,66, H - 8,22, N - 7,62.
Найдено: C - 69,37, H - 8,41, N - 7,51.
Соединение 17
2-(1-[4-Морфолино] этил [S-(R*, S*)]-4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C32H43N3O6
Расчет (в %): C
- 67,94, H - 7,66, N - 7,43.
Найдено: C - 67,67, H - 7,90, N - 7,26.
Соединение 18
4-Диметиламинобутил [S-(R*, S*)] -4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C32H45N3O5 + 0,2 H2O
Расчет (в %): C - 69,21, H - 8,24, N - 7,56.
Найдено: C - 69,35, H - 8,24, N - 7,29.
Соединение 20
2-Диметиламино-2-метил-1-пропил-[S-(R*,
S*)]-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C32H45N3O5
Расчет (в %): C - 69,66, H - 8,22, N - 7,62.
Найдено: C - 69,52, H - 8,47, N - 7,59.
Соединение 21
2-(Диизопропиламино)этил-[S-(R*, S*)] -4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C34H49N3O5
Расчет (в %): C - 70,44, H - 8,52, N - 7,25.
Найдено: C - 70,28, H - 8,76, N - 7,13.
Соединение 22
Бензил-[S-(R*, S*)] -4-[2-[[4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил] амино] карбонил] -4-оксо-2-азетидинил]окси]бензоил]окси]-этил]-1-пиперазин-карбоксилат
Аналитические данные для C40H50N4
O7
Расчет (в %): C - 68,75, H - 7,21, N - 8,02.
Найдено: C - 68,39, H - 7,30, N - 7,84.
Соединение 23
2-(Дибутиламино)этил [S-(R*, S*)] -4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
Аналитические данные для C36H53N3O5
Расчет (в %): C - 71,14, H - 8,79, N - 6,91.
Найдено: C - 71,00, H - 9,03, N - 6,81.
Соединение 24
[S-(R*, S*)]
-6-(Диметиламино)гексил-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси]-бензоат
Аналитические данные для C34H49N3O5 + 1H2O
Расчет (в %): C - 68,31, H - 8,60, N - 7,03.
Найдено: C - 68,34, H - 8,29, N - 6,86.
Соединение 26
2-(4-Метил-1-пиперазинил)этил [S-(R*, S*)]-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси]бензоат
Аналитические данные для C33H46N4O5 + 0,8 H2O
Расчет (в %): C - 66,82, H - 8,09, N - 9,44.
Найдено: C - 67,28, H - 8,10, N - 8,96.
Соединение 28
2-(Дифениламино)этил [S-(R*, S*)] -4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси]бензоат
Аналитические данные
для C40H45N3O5 + 1,4 H2O
Расчет (в %): C - 71,40, H - 7,16, N - 6,25.
Найдено: C - 71,62, H - 6,99, N - 5,99.
Соединение 29
2-(ди-2-Пропениламино)этил [S-(R*, S*)] -4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси]бензоат
Аналитические данные для C34H45N3O5
Расчет (в %): C - 70,93, H - 7,88, N - 7,30.
Найдено: C - 71,18, H - 8,06, N - 7,34.
Соединение 30
2-(Диметиламино)-2-фенилэтил [S-(R*, S*)]-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси]бензоат
Аналитические данные для C36H45N3O5
Расчет (в %): C - 72,09, H - 7,56, N - 7,00.
Найдено: C - 71,75, H - 7,67, N - 6,70.
Соединение 31
2-[Метил(фенилметил)амино] этил [S-(R*, S*)]-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси] бензоат
При использовании [S-(R*, S*)] -4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил] амино] карбонил] -4-оксо-2-азетидинил] окси]-2,6-диметилбензойной кислоты вместо [S-(R*,
S*)]-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]амино] карбонил]-4-оксо-2-азетидинил]окси] бензойной кислоты в процедуре примера 3А и при создании условий для реакции ее с соответствующими
аминоспиртами получают следующие эфиры.
Соединение 304
2-(Диметиламино)этил [S-(R*, S*)] -4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил]
амино]карбонил]-4-оксо-2-азетидинил]окси]-2,6-диметил-бензоат
Соединение 305
2-(Диэтиламино)этил-[S-(R*, S*)] -4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил]амино]карбонил]-4-оксо-2-азетидинил]окси]-2,6-диметил-бензоат
Соединение 306
2-[бис(1-Метилэтил)амино] -этил [S-(R*, S*
)]-4-[[3,3-диэтил-1-[[[1-(4-метилфенил)бутил] амино] карбонил] -4-оксо-2-азетидинил] окси]-2,6-диметил-бензоат
Обработка кислоты [S-(R*, S*)] -4-[[3,
3-диэтил-1-[[[1-(4-метилфенил)бутил] амино] карбонил]-4-оксо-2-азетидинил]окси] бензолуксусной кислоты оксалилхлоридом в соответствии с процедурой примера 3А приводит к получению соответствующего
хлорида кислоты, который после проведения реакции с соответствующим аминоспиртом по методике примера 8 дает следующие аминоэфиры:
Соединение 32
Аналитические данные для C31
H43N3O5
Расчет (в %): C - 69,25, H - 8,06, N - 7,82.
Найдено: C - 69,02, H - 7,86, N - 7,74.
Соединение 33
Аналитические данные для C32H45N3O5
Расчет (в %): C - 69,66, H - 8,22, N - 7,62.
Найдено: C - 69,10, H - 8,17, N - 7,50.
Соединение 34
Аналитические данные для C33H47N3O5
Расчет (в %): C - 70,06, H - 8,38, N - 7,43.
Найдено: C - 69, 70, H - 8,41, N - 7,05.
Соединение 35
Аналитические данные для C33H45N3O6
Расчет (в %): C - 68,37, H - 7,82, N - 7,25.
Найдено: C - 68,55, H - 8,19, N - 7,08.
Соединение 36
Аналитические данные для C32H45N3O5
Расчет (в %): C
- 69,66, H - 8,22, N - 7,62.
Найдено: C - 69,60, H - 8,49, N - 7,55.
Пример 9. К раствору 0,247 г соединения 1 в 2 мл этилацетата добавляют 0,125 г м-хлорпероксибензойной кислоты. После 30 мин стояния при комнатной температуре реакционную смесь концентрируют в вакууме. После хроматографии остатка на силикагеле с использованием для элюции метиленхлорида/метанола/воды 85/15/1,5 получают искомый N-оксид - соединение 15.
Аналитические данные для C30H41N3O8 + 1,4 H2
O
Расчет (в %): C - 63,79, H - 7,82, N - 7,44.
Найдено: C - 63,89, H - 7,85, N - 7,27.
Пример 10. [S-(R*, S*
)]-2-[4-[[[2-(Диметиламино)-этил]амино]карбонил]фенокси]-3,3-диэтил-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
К раствору 0,104 г карбонилдиимидазола в 2 мл метиленхлорида
добавляют раствор 0,227 г [S-(R*, S*)]-4-((3,3-диэтил-1-((1-(4-метилфенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси) бензойной кислоты в 3 мл метиленхлорида. В течение 30 мин
смесь перемешивают при температуре окружающей среды, добавляя при этом 0,100 г N,N-диметилэтилендиамина. После перемешивания в течение ночи при комнатной температуре реакционную смесь вливают в бензол
(50 мл) и промывают водой. Органическую фазу отделяют, высушивают над сульфатом натрия и концентрируют в вакууме. После хроматографии на силикагеле с последующей элюцией 5% метанолом в метиленхлориде
получают 0,160 г 2-[4-[[[2-(диметиламино)этил]амино]карбонил]фенокси]-3,3-диэтил-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамида.
Соединение 73
Аналитические данные
для C30H42N4O4 + 0,4 H2O
Расчет (в %): C - 68,00, H - 8,14, N - 10,57.
Найдено: C - 68,01, H - 8,18, N - 10,62.
Пример 11.
А. (S-(R*, S*))-4-(3,3-Диэтил-1-((4-метилфенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси)бензоилхлорид.
К раствору 0, 150 г [S-(R*, S*)]-4-(3,3-Диэтил-1-(((1-(метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси) бензойной кислоты в 5 мл метиленхлорида, содержащему диметилформамид в количестве, необходимом для катализа, добавляют 0,5 мл оксалилхлорида. В течение 30 мин смесь перемешивают при комнатной температуре и затем концентрируют в вакууме с получением (S-(R*, S*))-4-((3,3-диэтил-1-((1-(4-метилфенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси)бензоилхлорида.
Б. [S-(R*, S* )]-2-[4-[[[2-(диметиламино)-этил]метиламино]-карбонил]-фенокси-3,3-диэтил-N-[1-(4-метилфенил]бутил]-4-оксо-1-азетидинкарбосамид.
Вышеназванный хлорид кислоты растворят в 3 мл метиленхлорида и добавляют раствор 0,20 г N,N,N'-триметилэтилендиамина в 2 мл метиленхлорида. Смесь перемешивают в течение ночи и затем концентрируют в вакууме. Остаток экстрагируют, распределяя между фазами этилацетата и насыщенного раствора бикарбоната натрия. Органическую фазу высушивают над сульфатом натрия и концентрируют в вакууме. Хроматография остатка на силикагеле (5% метанол в метиленхлориде) дает 0,117 г [S-(R*, S*)]-2-[4-[[[2-(диметиламино)этил]метиламино] карбонил] фенокси-3,3-диэтил-N-[1-(4-метилфенил] бутил]-4-оксо-1-азетидинкарбоксамида.
Соединение 75
Аналитические данные для C31H44N4O4 + 0,5 H2O
Расчет (в %): C - 68,23, H - 8,31, N - 10,27.
Найдено: C - 68,20, H - 8,41, N - 10,10.
При замене N, N,N'-триметилэтилендиамина в примере 11Б на нужные амины получают соответствующие амиды.
1)
Соединение 76
Аналитические данные для C32H46N4O4
Расчет (в %): C - 69,79, H - 8,42, N - 10,17.
Найдено: C - 69,02, H - 8, 60, N - 9,54.
2) Соединение 77
Аналитические данные для C32H46N4O4 + 0,75 H2O
Расчет (в %): C - 68,12, H - 8,
49, N - 9,93.
Найдено: C - 68,22, H - 8,48, N - 10,17.
3) Соединение 78
Аналитические данные для C32H44N4O5
Расчет (в %): C - 68,06, H - 7,85, N - 9,92.
Найдено: C - 67,84, H - 8,07, N - 9,62.
4) Соединение 79
Аналитические данные для C33H46N4O5 + H2O
Расчет (в %): C - 66,42, H - 8,11, N - 9,39.
Найдено: C - 66,73, H - 8,19, N - 9,23.
5) Соединение 80
Аналитические данные для C35H52N4O6
Расчет (в %): C - 67,28, H - 8,39, N - 8,97.
Найдено: C - 67,08, H - 8,77, N - 8,41.
6) Соединение 81
Аналитические данные для C33H48N4O4 + H2O
Расчет (в %): C - 68,01, H - 8,65, N - 9,61.
Найдено: C - 68,42, H - 8,59, N - 9,17.
7) Соединение 82
Аналитические данные для C36H46N4O4 + 0,5 H2O
Расчет (в %): C - 71,14, H - 7,79, N - 9,21.
Найдено: C - 71,41, H - 7,68, N - 9,10.
8) Соединение 83
Аналитические данные для C32H46N4O4 + 1,2 H2O
Расчет (в %): C - 67,15, H - 8,52, N - 9,79.
Найдено: C - 67,21, H - 8,26, N - 9,47.
9) Соединение
84
10) Соединение 86
Аналитические данные для C35H52N4O4
Расчет (в %): C - 70,91, H - 8,84, N - 9,45.
Найдено: C - 70,37, H - 8,84, N - 8,77.
11) Соединение 89
Аналитические данные для C31H39N5O4 + 0,7 H2O
Расчет (в %): C
- 66,71, H - 7,29, N - 12,54.
Найдено: C - 66,91, H - 7,40, N - 12,14.
12) Соединение 90
Аналитические данные для C33H46N4
O4 + 0,8 H2O
Расчет (в %): C - 68,67, H - 8,31, N - 9,70.
Найдено: C - 68,82, H - 8,11, N - 9,70.
13) Соединение 91
Аналитические данные для C34H48N4O4 + 0,3 H2O
Расчет (в %): C - 70,11, H - 8,41, N - 9,61.
Найдено: C - 70,17, H - 8,64, N - 9,33.
14) Соединение 92
Аналитические данные для C30H42N4O4 + 1,2 H2O
Расчет (в %): C - 66,14, H - 8,22,
N - 10,92.
Найдено: C - 66,18, H - 8,12, N - 10,31.
15) Соединение 93
Аналитические данные для C32H44N4O6 + 0,3
H2O
Расчет (в %): C - 65,57, H - 7,67, N - 9,56.
Найдено: C - 65,72, H - 7,50, N - 9,34.
16) Соединение 94
Аналитические данные для C32H44N4O4 + 0,3 H2O
Расчет (в %): C - 70,04, H - 8,08, N - 10,21.
Найдено: C - 70,34, H - 8,90, N - 8,93.
17) Соединение 95
Аналитические данные для C33H46N4O4 + 0,5 H2O
Расчет (в %): C - 69,32, H - 8,28, N - 9,80.
Найдено: C - 69,41, H - 8,25, N - 9,58.
18) Соединение 99
Аналитические данные для C38H54N4O4 + 1,5 H2O
Расчет (в %): C - 69,37, H - 8,72, N - 8,51.
Найдено: C - 69,48, H - 8,44, N - 8,36.
19) Соединение 102
Аналитические данные для C40H49
N5O6 + 1,0 H2O
Расчет (в %): C - 67,30, H - 7,20, N - 9,81.
Найдено: C - 67,50, H - 7,24, N - 9,53.
20) Соединение 104
Аналитические данные для C32H41N5O4 + 0,75 H2O
Расчет (в %): C - 67,04, H - 7,47, N - 12,21.
Найдено: C - 67,16, H - 7,56, N - 11,95.
21) Соединение 105
Аналитические данные для C32H44N4O5 + 0,5 H2O
Расчет (в %): C - 66,99,
H - 7,91, N - 9,77.
Найдено: C - 67,00, H - 8,25, N - 9,50.
22) Соединение 106
Аналитические данные для C32H45N5O5
+ 0,8 H2O
Расчет (в %): C - 64,69, H - 7,90, N - 11,78.
Найдено: C - 64,93, H - 8,25, N - 11,12.
23) Соединение 107
Аналитические данные
для C31H44N3O6S + 0,3 H2O
Расчет (в %): C - 61,42, H - 7,41, N - 9,24.
Найдено: C - 61,43, H - 7,54, N - 9,05.
24) Соединение 110
Аналитические данные для C35H44N4O4
Расчет (в %): C - 71,89, H - 7,58, N - 9,58.
Найдено: C - 71,65, H - 7,55, N - 9,34.
25) Соединение 111
Аналитические данные для C34H42N4O4 + 0,5 H2O
Расчет (в %): C
- 70,44, H - 7,47, N - 9,66.
Найдено: C - 70,82, H - 7,46, N - 9,20.
26) Соединение 113
Аналитические данные для C34H42N4
O4 + 0,3 H2O
Расчет (в %): C - 70,88, H - 7,45, N - 9,72.
Найдено: C - 71,12, H - 7,44, N - 9,32.
27) Соединение 115
Аналитические данные для C34H42N4O4 + 0,7 H2O
Расчет (в %): C - 69,99, H - 7,50, N - 9,60.
Найдено: C - 70,14, H - 7,63, N - 9,25.
28) Соединение 116
Аналитические данные для C34H46N4O4 + 1,4 H2O
Расчет (в %): C - 68,06, H - 8,19,
N - 9,33.
Найдено: C - 68,40, H - 8,14, N - 8,87.
29) Соединение 117
Аналитические данные для C40H51N5O6 + 0,6
H2O
Расчет (в %): C - 67,79, H - 7,42, N - 9,88.
Найдено: C - 67,81, H - 7,58, N - 9,76.
30) Соединение 118
Аналитические данные для
C33H47N5O4 + 0,7 H2O
Расчет (в %): C - 67,14, H - 8,26, N - 11,86.
Найдено: C - 67,54, H - 8,51, N - 11,28.
31) Соединение 119
Аналитические данные для C35H48N4O4 + 1,25 H2O
Расчет (в %): C - 68,76, H - 8,32, N - 9,16.
Найдено: C - 69,07, H - 8,19, N - 8,75.
32) Соединение 121
Аналитические данные для C34H48N4O4 + 1H2O
Расчет (в %): C - 68,66, H - 8,47, N - 9,42.
Найдено: C - 69,02, H - 8,32, N - 9,06.
33) Соединение 125
Аналитические данные для C37H48N4O4 + 0,5 H2O
Расчет (в %): C - 71,47, H - 7,94, N - 9,01.
Найдено: C - 71,65, H - 7,91, N - 8,73.
34) Соединение
126
Аналитические данные для C41H54N4O5 + 2H2O
Расчет (в %): C - 68,83, H - 8,25, N - 7,64.
Найдено: C - 69,03, H - 7,79, N - 7,50.
35) Соединение 132
Аналитические данные для C35H50N4O4
Расчет (в %): C - 71,15, H - 8,53, N - 9,
48.
Найдено: C - 70,90, H - 8,74, N - 9,12.
36) Соединение 133
Аналитические данные для C40H52N4O4 + 0,9 H2O
Расчет (в %): C - 71,80, H - 8,10, N - 8,37.
Найдено: C - 71,86, H - 8,17, N - 8,18.
37) Соединение 137
Аналитические данные для C37H48N4O4 + 0,8 H2O
Расчет (в %): C - 70,85, H - 7,97, N - 8,93.
Найдено: C - 71,01, H - 7,97, N - 8,54.
38) Соединение 139
Аналитические данные для C39H51N5O4 + 0,8 H2O
Расчет (в %): C - 70,09, H - 7,93, N - 10,48.
Найдено: C - 70,18, H - 7,79, N - 10,42.
39) Соединение 142
Аналитические данные для C38H55N5O6
Расчет (в %): C - 67,33,
H - 8,18, N - 10,33.
Найдено: C - 67,02, H - 8,31, N - 9,89.
40) Соединение 143
Аналитические данные для C34H51N5O4
Расчет (в %): C - 68,77, H - 8,66, N - 11,80.
Найдено: C - 68,57, H - 8,50, N - 11,53.
41) Соединение 144
Аналитические данные для C38H59N5O4 + 0,4 H2O
Расчет (в %): C - 69,45, H - 9,17, N - 10,65.
Найдено: C - 69,69, H - 9,02, N - 10,35.
42) Соединение 145
Аналитические данные для C36H47N5O4 + H2O
Расчет (в %): C - 68,44, H - 7,82, N - 11,08.
Найдено: C - 68,69, H - 7,74, N - 10,76.
43) Соединение 148
Аналитические данные для C36H47N5O4 + 0,4 H2O
Расчет (в %): C - 69,62, H - 7,56, N - 11,27.
Найдено: C - 69,79, H - 7,70, N - 11,12.
44) Соединение 149
Аналитические данные для C39H50N4O4 + 0,4 H2O
Расчет (в %): C - 72,50, H - 7,93, N - 8,67.
Найдено: C - 72,44, H - 7,99, N - 8,87.
45) Соединение
150
Аналитические данные для C36H47N5O4 + 0,3 H2O
Расчет (в %): C - 69,83, H - 7,74, N - 11,31.
Найдено: C - 69,93, H - 7,65, N - 11,10.
46) Соединение 151
Аналитические данные для C33H47N5O4
Расчет (в %): C - 68,60, H - 8,20, N
- 12,12.
Найдено: C - 68,40, H - 8,16, N - 11,90.
47) Соединение 245
Аналитические данные для C36H44N4O4
Расчет (в %): C - 72,46, H - 7,43, N - 9,39.
Найдено: C - 72,49, H - 7,49, N - 9,25.
48) Соединение 246
Аналитические данные для C37H46
N4O4 + 0,25 H2O
Расчет (в %): C - 72,26, H - 7,61, N - 9,10.
Найдено: C - 72,35, H - 7,83, N - 8,73.
49) Соединение 154
Аналитические данные для C35H48N4O4 + 0,8 H2O
Расчет (в %): C - 69,70, H - 8,29, N - 9,29.
Найдено: C - 69,65, H - 8,27, N - 9,35.
50) Соединение 158
Аналитические данные для C35H48N4O4 + 0,5 H2O
Расчет (в %): C - 73,29, H
- 7,65, N - 8,33.
Найдено: C - 73,71, H - 7,75, N - 7,75.
51) Соединение 159
Аналитические данные для C35H48N4O4
Расчет (в %): C - 73,09, H - 7,66, N - 8,31.
Найдено: C - 73,40, H - 7,75, N - 7,80.
52) Соединение 160
Аналитические данные для C38
H48N4O4 + 1,0 H2O
Расчет (в %): C - 70,78, H - 8,12, N - 8,68.
Найдено: C - 71,00, H - 8,05, N - 8,59.
53)
Соединение 161
Аналитические данные для C43H52N4O4 + 1 H2O
Расчет (в %): C - 73,05, H - 7,70, N - 7,92.
Найдено: C - 73,29, H - 7,95, N - 7,37.
54) Соединение 166
Аналитические данные для C33H46N4O4 + 1,5 H2O
Расчет (в %): C - 67,20, H - 8,37, N - 9,50.
Найдено: C - 67,38, H - 7,98, N - 9,41.
55) Соединение 171
Аналитические данные для C36H52
N4O6 + 1,6 H2O
Расчет (в %): C - 64,95, H - 8,36, N - 8,41.
Найдено: C - 65,26, H - 8,15, N - 8,07.
56) Соединение 177
Аналитические данные для C38H47N5O4
Расчет (в %): C - 71,56, H - 7,43, N - 10,98.
Найдено: C - 71,64, H - 7,62, N - 10, 93.
57) Соединение 178
Аналитические данные для C38H50N4O4
Расчет (в %): C - 72,81, H - 8,04, N - 8,94.
Найдено: C - 72,96, H - 8,17, N - 8,83.
58) Соединение 179
Аналитические данные для C38H47N5O4
Расчет (в %): C - 71,56, H
- 7,43, N - 10,98.
Найдено: C - 72,00, H - 7,55, N - 10,87.
59) Соединение 180
Аналитические данные для C38H47F3N4
O4
Расчет (в %): C - 67,04, H - 6,96, N - 8,23.
Найдено: C - 67,02, H - 7,25, N - 8,23.
60) Соединение 181
Аналитические данные для C38H47F3N4O4
Расчет (в %): C - 67,04, H - 6,96, N - 8,23.
Найдено: C - 66,63, H - 6,98, N - 7,94.
61)
Соединение 182
Аналитические данные для C37H47FN4O4
Расчет (в %): C - 70,45, H - 7,51, N - 8,88.
Найдено: C - 70,28, H - 7,74, N - 8,82.
62) Соединение 185
Аналитические данные для C34H48N4O4
Расчет (в %): C - 70,80, H - 8,39, N - 9,71.
Найдено: C - 70,44, H - 8,45, N - 9,51.
63) Соединение 186
Аналитические данные для C37H48N4O4 +0,8 H2
O
Расчет (в %): C - 70,85, H - 7,97, N - 8,93.
Найдено: C - 71,12, H - 8,25, N - 8,45.
64) Соединение 191
Аналитические данные для C42
H51N5O4 + 0,5 CH2Cl2
Расчет (в %): C - 69,78, H - 7,16, N - 9,58.
Найдено: C - 69,75, H - 7,31, N - 9,68.
65) Соединение 203
Аналитические данные для C37H47N4O4 + 1,1 H2O
Расчет (в %): C - 68,31, H - 7,62, N - 8,61.
Найдено: C - 68,32, H - 7,57, N - 8,53.
66) Соединение 204
Аналитические данные для C37H47ClN4O4
Расчет (в %):
C - 68,66, H - 7,32, N - 8,66.
Найдено: C - 68,32, H - 7,48, N - 8,42.
67) Соединение 205
Аналитические данные для C38H50N4
O5 + 0,7 H2O
Расчет (в %): C - 69,63, H - 7,90, N - 8,54.
Найдено: C - 69,72, H - 7,91, N - 8,54.
68) Соединение 206
Аналитические данные для C39H52N4O6 + 0,8 H2O
Расчет (в %): C - 68,15, H - 7,86, N - 8,15.
Найдено: C - 68,01, H - 8,02, N - 8,15.
Пример 12.
А) [S-(R*, S*)] -3,3-Диэтил-2-[4-[[[2-(4-гидрокси-1-пиперидинил)этил] амино] карбонил]
фенокси]-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
При замене в примере 11Б N,N,N'-триметилэтилендиамина на 1-(2-аминоэтил)-4-бензилоксипиперидин получают [S-(R*,
S*)]-3,3-диэтил-2-[4-[[[2-(4-бензилокси-1- пиперидинил] этил] амино] карбонил] фенокси]-N-[1-[4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид.
Б) [S-(R*, S*)] -3,3-Диэтил-2-[4-[[[2-(4-гидрокси-1- пиперидинил)этил] амино] карбонил] фенокси]-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
Раствор амида, полученный выше на стадии А, в
10 мл ледяной уксусной кислоты, содержащей 22 мг 10% Pd/C, гидрогенизируют в атмосфере водорода под давлением 42 фунта. Когда по ТСХ определяется завершение реакции, смесь фильтруют и концентрируют в
вакууме после добавления 50 мл толуола. Остаток растворяют в этилацетате и промывают насыщенным раствором бикарбоната натрия. Органическую фазу высушивают над сульфатом натрия и концентрируют в
вакууме. Остаток хроматографируют с применением силикагеля (15 г), при этом элюция 5% метанолом в метиленхлориде дает 96 мг [S-(R*, S*)]-3,
3-Диэтил-2-[4-[[[2-(4-гидрокси-1- пиперидинил)этил] амино] карбонил]фенокси]-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид.
Аналитические данные для C33H46N4O5 + 1,3 H2O
Расчет (в %): C - 65,83, H - 8,13, N - 9,30
Найдено: C - 66,10, H - 8,06, N - 8,91
При замене в процедуре примера 12
1-(2-аминоэтил)-4-бензилоксипиперидина на соответствующие амины получают следующие соединения: 123, 124, 129, 131 и 138, например:
1) Соединение 129
Аналитические данные для C34H48N4O5
Расчет (в %): C - 68,89, H - 8,16, N - 9,45.
Найдено: C - 68,68, H - 8,18, N - 8,65.
2) Соединение 131
Аналитические данные для C32H44N4O5 + 1H2O
Расчет (в %): C - 65,92, H - 7,96, N - 9,61.
Найдено: C - 66,07, H - 7, 86, N - 9,45.
3) Соединение 138
Аналитические данные для C33H46N4O5 + 0,5 H2O
Расчет (в %): C - 67,43, H - 8,
06, N - 9,53.
Найдено: C - 67,61, H - 8,06, N - 9,37.
Диаминовые интермедиаты
Описанные в настоящем изобретении диамины, используемые для получения
аминоамидов, коммерчески доступны при проведении следующей процедуры:

Пример 13.
А. Цианометилгомопиперазин
К раствору 1,98 г гомопиперазина в 50 мл ацетона добавляют 4,25 г измельченного в порошок безводного карбоната натрия и 1,3 мл хлорацетонитрита. Через 24
ч реакционную смесь фильтруют и промывают отфильтрованный жмых в 100 мл ацетона. Объединенные фильтраты концентрируют в вакууме, а остаток хроматографируют на силикагеле с использованием для элюции
метиленхлорида. Выход N-цианометилгомопиперазина составляет 2,69 г.
Б. N-(2-аминоэтил)гомопиперазин
К суспензии 1,02 г гидрида лития-алюминия в 50 мл эфира медленно добавляют
раствор 2,65 г N-цианометилгомопиперазина в 25 мл эфира. После добавления полного набора компонентов смесь нагревают до температуры кипения с обратным холодильником в течение 1 ч, затем охлаждают до
комнатной температуры и осторожно останавливают реакцию добавлением последовательно 1 мл воды, 1 мл 15% раствора гидроксида натрия и 3 мл воды. Смесь фильтруют через сульфат натрия, отфильтрованный
жмых тщательно промывают эфиром, а объединенные фильтраты концентрируют в вакууме с получением 2,60 г N-(2-аминоэтил)гомопиперазина.

Пример 14. N-(2-Аминоэтил)гомопиперазин.
А) N-(2-формамидоэтил)гомопиперазин.
К тщательно приготовленному раствору 0,718 г 60% дисперсии гидрида натрия в 75 мл абсолютного этанола, охлажденному до 0oC, добавляют 7,3 мл этилового эфира муравьиной кислоты. Через 5 минут в смесь добавляют раствор 2,55 г N-(2-аминоэтил)гомопиперазина в 25 мл абсолютного этанола. В течение ночи смесь перемешивают при комнатной температуре. После этого добавляют насыщенный раствор бикарбоната натрия (15 мл), затем перемешивают смесь со 150 мл этилацетата, фильтруют через MgSO4, а фильтрат концентрируют в вакууме. После хроматографии остатка на силикагеле (150 г) с использованием для элюции метиленхлорида/метанола/конц. гидроксида аммония (95/5/0,5) получают 2,78 г N-(2-формамидоэтил)гомопиперазина.
Б) N-(2-метиламиноэтил)гомопиперазин
К раствору 2,75 г
N-(2-формамидоэтил)гомопиперазина в 20 мл сухого ТГФ в атмосфере N осторожно добавляют 60 мл боранового раствора ТГФ. По окончании добавления реакционную смесь нагревают при температуре кипения с
обратным холодильником в течение 5 ч и затем перемешивают при комнатной температуре в течение ночи. Реакцию останавливают при осторожном добавлении 20 мл 6N HCl и затем снова кипятят смесь с обратным
холодильником в течение 1 ч. После этого реакционную смесь охлаждают, добавляют 50 мл воды и с помощью твердого KOH осторожно доводят pH до щелочного значения. После экстракции эфиром получают искомый
продукт N-(2-метиламино)гомопиперазин.
Пример 15.

А) N-бензил-N, N'-диметил-N'-(2-фенилэтил)этилендиамин
Смесь 0,900 г N-бензил-N,N'-диметилэтилендиамина, 1,10 г измельченного в порошок карбоната натрия и 0,75 мл 2-фенилэтилбромида кипятят с обратным холодильником в течение 5 ч. Во время кипячения добавляют дополнительно 0,25 мл бромида. Затем реакционную смесь охлаждают и фильтруют. Фильтрат концентрируют в вакууме и хроматографируют на силикагеле с использованием для элюции CH2Cl2/CH3OH/NH4OH (97/3/0,3) с получением 0,875 г N-бензил-N,N'-диметил-N'-(2-фенилэтил)этилендиамина.
Б) N,N'-диметил-N-(2-фенилэтил)этилендиамин
К раствору 0,870 г N-бензил-N,N'-диметил-N'-(2-фенилэтил)этилендиамина в 10 мл этанола и 5 мл уксусной кислоты добавляют 0,18 г
Pd(OH)2/C. Смесь гидрогенизируют при давлении 40 фунтов/дюйм2 в течение 3,5 ч, затем фильтруют и концентрируют в вакууме. Остаток подщелачивают с помощью 1N NaOH и проводят
экстракцию этилацетатом (5 • 25 мл). Объединенные экстракты фильтруют через сульфат натрия и концентрируют с получением N, N'-диметил-N-(2-фенилэтил)этилендиамина.
Пример 16.

Раствор 1,28 г 1-(2-амино-этил)пиперидина и 1,07 г пиридин-3-карбоксальдегида в 40 мл толуола нагревают при температуре кипения с обратным холодильником с помощью уловителя Дин Старк (Dean Stark). При анализе 10 мл перегнанного толуола методом ЯМР было показано отсутствие указанного альдегида. Затем реакционную смесь концентрируют, а полученный имин используют непосредственно в следующей стадии.
Б) К суспензии 0,380 г гидрида лития-алюминия в 30 мл сухого ТГФ, который был охлажден до -10oC, добавляют по каплям раствор вышеназванного имина в 20 мл сухого ТГФ. Примерно через 1 ч реакцию в охлажденной смеси останавливают добавлением 5 мл 5N NaOH, затем указанную смесь разбавляют 100 мл эфира и 20 мл воды. Органическую фазу отделяют, промывают солевым раствором, фильтруют через сульфат натрия и концентрируют с получением 2,17 г 1-[2-(3-пиридил-метиламино)этил] -пиперидина, нужного для проведения последующих реакций.
Пример 17.

К 7,50 г N, N'-диметилэтилендиамина, охлажденного в бане, содержащей лед-этанол, добавляют порциями в течение 30-минутного периода 1,40 г 3-пиколилхлорида. После завершения добавления реакционную смесь перемешивают на холоду в течение 1 ч, концентрируют в вакууме, а полученный остаток распределяют между фазами 50 мл эфира и 10 мл 5N раствора NaOH. Органический слой отделяют, а водные слои дважды экстрагируют по 50 мл эфира. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Хроматография на 150 мл силикагеля с использованием CH2Cl2/CH3OH/NH4OH (90/10/1) в качестве элюента дает 0,930 г N,N'-диметил-N-(3-пиридилметил)этилендиамина.
Пример 18. Аминокислота ---> диамин.
А) К охлажденному на льду раствору 2,29 г N-CBZ-D-пролина в 50 мл CHCl2 добавляют 1,35 г 1-гидроксибензотриазолгидрата и затем 2, 06 г дициклогексилкарбодиимида. Через 20 мин добавляют 0,85 мл пирролидина и перемешивают реакционную смесь в течение ночи, после чего ее фильтруют, а полученный фильтрат концентрируют в вакууме. Остаток распределяют между фазами 100 мл этилацетата и 50 мл 2N соляной кислоты. Органическую фазу отделяют, промывают 50 мл 1,0 раствора гидроксида натрия, высушивают над сульфатом натрия и концентрируют в вакууме. Хроматография на 150 г силикагеля с использованием в качестве элюента этилацетата в гексане различной концентрации (30-100%) дает 2,04 г искомого амида пирролидина.
Б) К раствору 1,519 г амида (полученного в п. А) в 20 мл абсолютного этанола добавляют 75 мг катализатора в виде 10% Pd на углероде. Смесь гидрогенизируют при давлении 40 фунтов/дюйм2 примерно в течение одного часа и затем фильтруют, а фильтрат концентрируют с получением амида D-пролинпирролидина.
В) К суспензии 0,380 г гидрида лития-алюминия в 15 мл сухого тетрагидрофурана аккуратно добавляют раствор амида D-пролина (полученного выше в п. Б) в 10 мл тетрагидрофурана. Смесь кипятят с обратным холодильником в течение 2 часов, затем охлаждают и останавливают реакцию добавлением 2 мл 2,5N гидроксида натрия. Смесь фильтруют через прокладку с сульфатом натрия, а полученный отфильтрованный жмых промывают 2 • 50 мл эфира. Объединенные фильтраты концентрируют в вакууме с получением 0,80 г искомого 2-(1-пирролидинметил)пирролидина.
Пример 19. [S-(R*, S* )]-2-[4-[[(4-Метил)пиперазин-1-ил]карбонил]фенокси]-((3,3-диэтил-N-[1-(метилфенил/бутил]-4-оксо-1- азетидинкарбоксамид.
Раствор [S-(R*, S*)] -4-(((3, 3-диэтил-1-((4-метилфенил)-бутиламино)карбонил)4-оксо-2-азетидинил)окси) бензоилхлорида (3,8 ммол), полученного по методике примера 11А, в 50 мл метиленхлорида охлаждают в ледяной бане и в течение 5 минут к нему добавляют раствор 0,70 г N-метилпиперазина в 10 мл метиленхлорида. Реакционную смесь перемешивают в течение 1 ч и затем вливают в смесь ледяной воды и 10% карбоната калия. Продукт экстрагируют двумя порциями метиленхлорида, промывая каждый слой метиленхлорида порцией солевого раствора. Слои в метиленхлориде объединяют, высушивают над сульфатом натрия и выпаривают. Остаток подвергают чистке методом флэш-хроматографии с использованием для элюции вначале этилацетата, затем 2% триэтиламина/10% метанола/88% этилацетата с получением 2,1 г целевого соединения в виде белого твердого вещества.
Аналитические данные для C30H42N4O4
Расчет (в %): C - 69,64, H - 7,92, N - 10,48.
Найдено: C - 69,62, H - 8,23, N - 10,46.
Пример 20. [S-(R*, S*)]-2-[4-[[(4-Метил)пиперазин-1-ил]карбонил]фенокси] -((3,3-диэтил-N-[1-(3,4-метилендиоксифенил)бутил]
-4-оксо-1-азетидинкарбоксамид
В ходе реакции [S-(R*, S*)]-4-((((3,3-диэтил-1-(3,4-метилендиоксифенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси) бензоилхлорида (3,1
ммол), полученного по методике примера 11А, с N-метилпиперазином по методу, как описано в примере 19, получают 1,75 г целевого соединения.
Аналитические данные для C31H40N4O6
Расчет (в %): C - 65,94, H - 7,14, N - 9,92.
Найдено: C - 65,80, H - 7,31, N - 10,05.
Пример 21. [S-(R*, S*)]-2-[4-[[(4-Гидроксиэтил)пиперазин-1-ил]карбонил] фенокси]-((3,3-диэтил-N-[1-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
В ходе реакции [S-(R*, S*)]-4-(((3,
3-диэтил-1-((4-метилфенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси) бензоилхлорида (3,8 ммол), полученного по методике примера 11А, с N-(2-гидроксиэтил)пиперазином (7,6 ммол) и
диизопропилэтиламином (3,8 ммол) по методу, как описано в примере 19, получают 2,1 г целевого соединения.
Аналитические данные для C32H44N4O5
Расчет (в %): C - 68,06, H - 7,85, N - 9,92.
Найдено: C - 67,88, H - 7,87, N - 10,17.
Пример 22. [S-(R*, S*
)]-2-[4-[[(4-Гидроксиэтил)пиперазин-1-ил]карбонил] фенокси] -((3,3-диэтил-N-[1-(3,4-метилендиоксифенил)бутил] -4-оксо-1-азетидинкарбоксамид
В ходе реакции [S-(R*, S*
)]-4-(((3,3-диэтил-1-((3,4-метилендиоксифенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси) бензоилхлорида (3,1 ммол), полученного по методике примера 11А, с N-(2-гидроксиэтил)пиперазином (6,2 ммол)
и диизопропилэтиламином (3,1 ммол) по методу, как описано в примере 19, получают 1,50 г целевого соединения.
Аналитические данные для C32H42N4O7 • 1,5 H2O
Расчет (в %): C - 61,94, H - 6,89, N - 9,06.
Найдено: C - 61,95, H - 6,92, N - 8,96.
Пример 23. [S-(R*, S*)]-2-[4-[[(4-Циклопропил)пиперазин-1-ил]карбонил] фенокси]-((3,3-диэтил-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
К раствору [S-(R*, S*)]-4-(((3,
3-диэтил-1-((4-метилфенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси) бензоилхлорида (3,8 ммол), полученного по методике примера 11А, в 50 мл метиленхлорида добавляют
N-(циклопропил)пиперазиндигидрохлорид (5,7 ммол) и затем в течение 5-минутного периода при охлаждении в ледяной бане вносят раствор диизопропилэтиламина (15,8 ммол) в 10 мл метиленхлорида. Реакционную
смесь перемешивают в течение 1 ч при 0oC, после чего ее вливают в ледяную воду. Продукт экстрагируют двумя порциями метиленхлорида, при этом каждую порцию промывают солевым раствором. Фазы
с метиленхлоридом объединяют, высушивают над сульфатом натрия, после чего хроматография с использованием этилацетата/50% гексана и затем 70% этилацетата/30% гексана дает 2,1 г целевого соединения в
виде белого твердого вещества.
Аналитические данные для C32H42N4O4
Расчет (в %): C - 70,69, H - 7,91, N - 9,99.
Найдено: C - 70,62, H - 8,04, N - 9,95.
Пример 24. [S-(R*, S*)]-2-[4-[[4-Циклопропил/пиперазин-1-ил]карбонил] фенокси] -(3,3-диэтил-N-[1-(3,
4- метилендиоксифенил)бутил] -4-оксо-1-азетидинкарбоксамид
В ходе реакции [S-(R*, S*)]-4-(((3,3-диэтил-1-((3,
4-метилендиоксифенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси) бензоилхлорида (3,1 ммол), полученного по методике примера 11А, с N-(циклопропил)пиперазином (4,6 ммол) и диизопропилэтиламином (9,3
ммол), как описано в примере 23, получают 1,80 г целевого соединения.
Аналитические данные для C32H42N4O7
Расчет (в %): C - 67,10,
H - 7,17, N - 9,49.
Найдено: C - 67,03, H - 7,31, N - 9,47.
Пример 25. [S-(R*, S*)] -2-[4-[[4- Пиперазин-1-ил]карбонил]фенокси]-3,
3-диэтил-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
Стадия А:
[S-(R*, S*)] -2-[4-[[4-(t-бутоксикарбонил) пиперазин-1-ил]карбонил]фенокси]-((3,
3-диэтил-N-[1-(4-метилфенил)бутил]-4-оксо-азетидинкарбоксамид
[S-(R*, S*)]-4-(((3,3-Диэтил-1-((4-метилфенил)бутиламино)-карбонил)-4-оксо-2-азетидинил)окси)бензоилхлорид
(0,4 ммол), полученный в примере 11А, вступает в реакцию с N-(t-бутоксикарбонил)пиперазином (0,6 ммол) и триэтиламином (1,2 ммол), как описано в примере 23. Полученный таким образом грубый целевой
продукт непосредственно используется далее на следующей стадии Б.
Стадия Б:
[S-(R*, S*)]-2-[4-[Пиперазин-1-ил]карбонил]фенокси]-((3,
3-диэтил-N-[1-(4-метилфенил)бутил]-4-оксо-1-азетидинкарбоксамид
Продукт, полученный на стадии А, растворяют в 0,5 мл анизола, после чего добавляют 2 мл холодной ТФУ. Реакционную смесь
перемешивают при 0oC в течение 1 ч, затем разбавляют метиленхлоридом и выпаривают. Остаток переносят в метиленхлорид, промывают 10% раствором карбоната натрия и солевым раствором,
высушивают над сульфатом натрия и концентрируют. Остаток очищают методом флэш-хроматографии с применением сначала 5%, затем 10% метанола/метиленхлорида, в результате чего получают 0,212 г целевого
продукта.
Аналитические данные для C30H40N4O5 • 1H2O
Расчет (в %): C - 66,89, H - 7,85, N - 10,40.
Найдено: C - 67,06, H - 7,55, N - 10,30.
Пример 26. [S-(R*, S*)]-2-[4-[[(4- Пиперазин-1-ил]карбонил]фенокси]-((3,3-диэтил-N-[1-(3,
4-метилендиоксифенил)бутил] -4-оксо-1-азетидинкарбоксамид
Стадия А: [S-(R*, S*)]-2-[4-[[4-бензилоксикарбонил)пиперазин-1-ил]карбонил] фенокси]-((3,3-диэтил-N-[1-(3,
4-метилендиоксифенил)бутил]-4-оксо-1-азетидинкарбоксамид
В ходе реакции [S-(R*, S*)]-4-(((3,3-Диэтил-1-((3,
4-метилендиоксифенил)бутиламино)карбонил)-4-оксо-2-азетидинил)окси)бензоилхлорида (0,41 ммол), полученного по методике примера 11А, с N-(бензилоксикарбонил)пиперазином (0,77 ммол) и
диизопропилэтиламином (1,6 ммол), как описано в примере 23, получают 290 мг целевого соединения.
Стадия Б: [S-(R*, S*
)]-2-[4-(пиперазин-1-ил]карбонил]-фенокси]-((3,3-диэтил-N-[1-(3,4-метилендиоксифенил)бутил]-4-оксо-1-азетидинкарбоксамид
Раствор 250 мг материала, полученного на стадии А примера 26,
гидрогенизируют под давлением 40 фунтов/дюйм2 в присутствии 50 мг 10% Pd/C в течение 16 ч. Реакционную смесь фильтруют и выпаривают. Остаток подвергают очистке методом препаративной ТСХ с
использованием для элюции 2% ТФУ/10% метанола/88% этилацетата и получают в итоге 150 мг целевого продукта.
Аналитические данные для C30H38N4O6 • 3H2O
Расчет (в %): C - 59,59, H - 7,33, N - 9,29.
Найдено: C - 59,66, H - 7,65, N - 9,61.
Реферат
Изобретение относится к замещенным азетидинонам общей формулы I, приведенной в описании. Соединение формулы I получают взаимодействием соединения формулы II с H-Y-NR7R8-. Технический результат - соединение формулы I является мощным ингибитором эластазы лейкоцитов человека и может использоваться как противовоспалительный и антидегенеративный агенты. 5 с. и 28 з.п. ф-лы, 15 табл., 2 схемы.

Формула

или их фармацевтически приемлемые соли,
где R - C1-6алкил;
R1 - C1-6алкил;
M - C1-6алкил;
Ra и Rb каждый - водород;
R2 и R3 каждый независимо друг от друга - водород, C1-6алкил или R2 и R3 могут быть объединены друг с другом с образованием метилендиоксигруппы;
R4 представляет: a) группу

или b) группу

где Rx - карбокси C1-6алкил, бензилоксикарбонил-C1-3алкил или трет-бутоксикарбонилC1-3алкил, где Q представляет ковалентную связь или группу
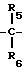
при этом R5 и R6 каждый - водород;
Y представляет собой

R12 - водород или C1-3алкил;
R7 и R8 каждый независимо друг от друга: (а) водород; (б) C1-6алкил; (в) C1-6алкоксиC2-3 алкил; (г) гидроксиC2-6алкил; (д) полигидроксиC2-6алкил; (е) карбоксамидоC1-6алкил; (ж) C1-6алканоил; (з) замещенный фенил или фенилC1-6алкил, при этом заместителями являются X1 и X2, как определено ниже; (и) C2-6алкенил; (к) C6-10циклоалкенил; (л) гетероарилC1-6алкил, при этом гетероарил включает пиридинил и имидазолил; (м) карбоксиC1-6алкил; (н) карбоC1-6алкокси C1-3алкил; (о) фенилсульфонил; (п) C1-6алкилсульфонил; (р) бензилоксигруппа; (с) морфолинилC1-3алкилсульфонил; (т) тетрагидропиранил; (у) аминоC1-3алкилсульфонил, где аминогруппа может быть моно- или дизамещена C1-6алкилом; (ф) аминокарбонил, где аминогруппа может быть моно- или дизамещена C1-6алкилом; (х) аминокарбонилоксиC2-6алкил, где аминогруппа может быть моно- или дизамещена C1-6 алкилом; (ц) азабициклогруппа, содержащая 7 - 12 атомов; (ч) диC1-3алкиламиноC2-6алкил, где аминогруппа может быть моно- или дизамещена C1-6алкилом; (ш) бициклоалкил, содержащий 7 - 12 атомов; (щ) C3-10циклоалкил, замещенный C1-6алкилом; (ь) пиразолидинил; (аа) замещенный или незамещенный пиперидинил, в котором заместителем может быть C1-3алкил, гидроксиC1-3алкилбензил, карбоксамидо- или аминогруппа, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (бб) замещенный пирролидинил, в котором заместителем является карбоксамидо- или аминогруппа, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (вв) пиримидинил; (гг) фосфоноC1-6алкил или (дд) альфа-C1-3алкилбензил, а также моно- или дизамещенный бензил, моно- или дизамещенный пиридилметил, в котором заместителями являются X1 или X2, при этом X1 представляет собой: (1) водород; (2) галогруппу; (3) C1-6алкил; (4) галоC1-6алкил; (5) C2-6алкенил; (6) гидроксиC1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) CN; (10) CF3; (11) CH3O; (12) аминогруппу, при этом данная аминогруппа может быть моно- или дизамещена C1-6алкилом; (13) карбоксигруппу или (14) фенилсульфониламинокарбонил;
X2 - водород, галогруппа или C1-6алкил;
n = 1, 2, 3, 4 или 5;
R9 выбирается из группы, включающей водород, C1-4алкил и C1-3алкоксиC2-3алкил; или фенил, фенилC1-3алкил, пиридил и пиридил-C1-3алкил;
R10 и R11 каждый выбирают независимо друг от друга из группы, включающей водород, C1-6алкил и C1-3алкоксиC1-3алкил или представляют собой оба вместе O=; или
R7 и R8 вместе с азотом, к которому они присоединяются, образуют моно- или дизамещенное кольцо, выбранное из группы, содержащей (1) пиперидинил или гомопиперидинил; (2) пиперазинил; (3) морфолинил, тиоморфолинил или 1,1-диоксо-4-тиоморфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) насыщенную азабициклогруппу, содержащую 7 - 12 атомов; (9) азаспирогруппу; (10) тетразолил; (11) пиразолидинил; (12) азетидинил или (13) диазабициклогруппу, содержащую 7 - 12 атомов, при этом каждый из заместителей выбирается из группы, состоящей из водорода и C1-3алкила, бензилоксикарбонила, фенилC1-3алкиламинокарбонила, гидроксиC1-3алкила, C1-6алкокси, C1-4алкилоксикарбонила, аминокарбонила, где упомянутая аминогруппа может быть моно- или дизамещена C1-6алкилом, и оксогруппы; или
R8 и R9 вместе образуют моно- или дизамещенное моноциклическое кольцо, содержащее 6 - 7 атомов, включающее 2 атома азота; или
R9 и R12 вместе образуют моно- или дизамещенное насыщенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов и включающее один атом азота; или
R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моно- или дизамещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.

или их фармацевтически приемлемые соли,
где R - C1-6алкил;
R1 - C1-6алкил;
M - этил, пропил, бутил, пентил или гексил;
Ra и Rb каждый независимо друг от друга: (1) водород; (2) C1-6алкил; (3) гидроксигруппа;
R2 - (1) водород; (2) C1-6алкил; (3) галогруппа; (4) C1-6алкокси; (5) аминоC2-3алкилоксикарбонил, где аминогруппа может быть моно- или дизамещена C1-6-алкилом; (6) аминоC2-3алкиламинокарбонил, где аминогруппа может быть моно- или дизамещена C1-6алкилом; (7) гидроксигруппа; (8) аминокарбонил, где аминогруппа может быть моно- или дизамещена C1-6-алкилом; (9) гидроксиметил; (10) аминокарбонилоксиC1-3алкил, где аминогруппа может быть моно- или дизамещена C1-6-алкилом; (11) цианогруппа; (12) морфолинокарбонилфенил; или (13) морфолинокарбонил;
R3 - (1) C1-6алкил; (2) галогруппа; (3) C1-6алкокси; (4) аминоC2-3алкилоксикарбонил, где аминогруппа может быть моно- или дизамещена C1-6-алкилом; (5) аминоC2-3алкиламинокарбонил, где аминогруппа может быть моно- или дизамещена C1-6алкилом; (6) гидроксигруппа; (7) аминокарбонил, где аминогруппа может быть моно- или дизамещена C1-6алкилом; (8) гидроксиметил; (9) аминокарбонилоксиC1-3алкил, где аминогруппа может быть моно- или дизамещена C1-6-алкилом; (10) цианогруппа; (11) морфолинокарбонилфенил или (12) морфолинокарбонил, при условии, что R2 и R3 могут быть объединены друг с другом с образованием метилендиоксигруппы;
R4 представляет

или

где Rx - карбоксиC1-6алкил, бензилоксикарбонилC1-3алкил или трет-бутоксикарбонилC1-3алкил,
где Q - ковалентная связь или группа

где R5 и R6 каждый - водород;
Y представляет собой

или ковалентную связь;
R12 - водород или C1-3алкил;
R7 - (а) этил, пропил, бутил, пентил или гексил; (б) C1-6алкилоксиC2-3алкил; (в) гидроксиC2-6алкил; (г) полигидроксиC2-6 алкил; (д) карбоксамидоC1-6алкил; (е) C1-6алканоил; (ж) замещенный фенил или фенилC1-6алкил, при этом заместителями представлены X1 и X2, как определено ниже; (з) C2-6алкенил; (и) C6-10циклоалкенил; (к) гетероарилC1-6алкил, при этом упомянутый гетероарил включает пиридинил и имидазолил; (л) карбоксиC1-6алкил; (м) карбоC1-6алкоксиC1-3алкил; (н) фенилсульфонил; (о) C1-6алкилсульфонил; (п) бензилокси; (р) морфолинилC1-3алкилсульфонил; (с) тетрагидропиранил; (т) аминоC1-3алкилсульфонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (у) аминокарбонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (ф) аминокарбонилоксиC2-6алкил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (х) азабициклогруппа, содержащая 7 - 12 атомов; (ц) диC1-3алкиламиноC2-6алкил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (ч) бициклоалкил, содержащий 7 - 12 атомов; (ш) C3-10циклоалкил, возможно замещенный C1-6алкилом; (щ) пиразолидинил; (ь) замещенный или незамещенный пиперидинил или пирролидинил, где в качестве заместителей может быть C1-3 алкил, гидроксиC1-3алкилбензил, карбоксамидо- или аминогруппа, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (аа) замещенный пирролидинил, в котором заместителем является карбоксамидо- или аминогруппа, при этом аминогруппа может быть замещена C1-6алкилом; (бб) пиримидинил; (вв) фосфоноC1-6алкил или (гг) альфа-C1-3 алкилбензил, а также моно- или дизамещенный бензил или моно- или дизамещенный пиридилметил, при этом заместителями являются X1 или X2;
R8 - (а) водород или C1-6алкил; (б) C1-6алкилоксиC2-3алкил; (в) гидроксиC2-6алкил; (г) полигидроксиC2-6алкил; (д) карбоксамидоC1-6алкил; (е) C1-6 алканоил; (ж) замещенный фенил или фенилC1-6алкил, при этом заместители представлены X1 и X2, как определено ниже; (з) C2-6алкенил; (и) C6-10 циклоалкенил; (к) гетероарилC1-6алкил, при этом упомянутый гетероарил выбирают из группы, включающей пиридинил и имидазолил; (л) карбоксиC1-6алкил; (м) карбоC1-6 алкоксиC1-3алкил; (н) фенилсульфонил; (о) C1-6алкилсульфонил; (п) бензилокси; (р) морфолинилC1-3алкилсульфонил; (с) тетрагидропиранил; (т) аминоC1-3 алкилсульфонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (у) аминокарбонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (ф) аминокарбонилоксиC2-6алкил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (х) азабициклогруппа, содержащая 7 - 12 атомов; (ц) диC1-3алкиламиноC2-6алкил, при этом аминогруппа может быть замещена C1-6алкилом; (ч) бициклоалкил, содержащий 7 - 12 атомов; (ш) C3-10циклоалкил, возможно замещенный C1-6алкилом; (щ) пиразолидинил; (ь) замещенный или незамещенный пиперидинил, в котором заместителем может быть C1-3алкил, гидроксиC1-3алкилбензил, карбоксамидо- или аминогруппа, при этом аминогруппа может быть замещена C1-6алкилом; (аа) замещенный пирролидинил, в котором заместителем является карбоксамидо- или аминогруппа, при этом аминогруппа может быть замещена C1-6алкилом; (бб) пиримидинил; (вв) фосфоноC1-6алкил или (гг) альфа-C1-3алкилбензил, а также моно- или дизамещенный бензил или моно- или дизамещенный пиридилметил, при этом заместителями являются X1 или X2;
при этом X1 - (1) водород; (2) галогруппа; (3) C1-6алкил; (4) галоC1-6алкил; (5) C2-6 алкенил; (6) гидроксиC1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) CN-группа; (10) CF3; (11) CH3O; (12) аминогруппа, при этом данная аминогруппа может быть моно- или дизамещена C1-6алкилом; (13) карбоксигруппа или (14) фенилсульфониламинокарбонил;
X2 - водород, галогруппа или C1-6 алкил;
n = 1, 2, 3, 4 или 5;
R9 выбирают из группы, включающей водород, C1-4алкил и C1-3алкоксиC2-3алкил; или фенил, фенилC1-3 алкил, пиридил и пиридилC1-3алкил;
R10 и R11 каждый выбирают независимо друг от друга из группы, включающей водород, C1-4алкил и C1-3 алкоксиC1-3алкил, или представляют собой оба вместе O=; или
R7 и R8 вместе с атомом азота, к которому они присоединяются, образуют моно- или дизамещенное кольцо, выбранное из группы, содержащей (1) пиперидинил или гомопиперидинил; (2) пиперазинил; (3) морфолинил, тиоморфолинил или 1,1-диоксо-4-тиоморфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) насыщенную азабициклогруппу, содержащую 7 - 12 атомов; (9) азаспирогруппу; (10) тетразолил; (11) пиразолидинил; (12) азетидинил или (13) диазабициклогруппу, содержащую 7 - 12 атомов, при этом каждый из заместителей выбирают из группы, состоящей из водорода и C1-3алкила, бензилоксикарбонила, фенилC1-3алкиламинокарбонила, пирролидинилметила, гидроксиC1-3алкила, C1-6алкокси, C1-4алкилоксикарбонила, аминокарбонила, где упомянутая аминогруппа может быть моно- или дизамещена C1-6алкилом, и оксогруппы; или
R8 и R9 вместе образуют моно- или дизамещенное насыщенное моноциклическое кольцо, содержащее 6 - 7 атомов, включающее 2 атома азота; или
R9 и R12 вместе образуют моно- или дизамещенное насыщенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов и один атом азота; или
R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моно- или дизамещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.

R4 представляет собой

4. Соединение по п.3, где R - C1-6алкил; R1 - C1-6 алкил; M - C1-6алкил; Ra и Rb каждый - водород; R2 и R3 каждый представляет независимо друг от друга: (1) водород; (2) C1-6алкил; или R2 и R3 могут объединяться друг с другом с образованием метилендиоксигруппы; R4 представляет собой

где Q - ковалентная связь; Y представляет собой

R12 - водород или C1-3алкил; R7 и R8 каждый независимо друг от друга - (а) водород; (б) C1-6алкил; (в) C1-6алкоксиC2-3алкил; (г) гидроксиC2-6алкил; (д) карбоксамидоC1-6алкил; (е) C1-6алканоил; (ж) фенил или фенилC1-6алкил; (з) C2-6алкенил; (и) C6-10циклоалкенил; (к) гетероарилC1-6алкил, при этом упомянутый гетероарил включает пиридинил имидазолил; (л) карбоксиC1-6алкил; (м) C1-6алкилсульфонил; (н) бензилокси; (о) морфолинилC1-3алкилсульфонил; (п) аминоC1-3алкилсульфонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (р) аминокарбонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (с) аминокарбонилоксиC2-6алкил, при этом аминогруппа может быть замещена C1-6алкилом; (т) пиразолидинил; (у) пиперидинил; (ф) пиримидинил; (х) альфа-C1-3алкилбензил, а также моно- или дизамещенный бензил, или моно- или дизамещенный пиридилметил, при этом заместителями являются X1 или X2; где X1 - (1) водород; (2) галогруппа; (3) C1-6алкил; (4) галоC1-6алкил; (5) C2-6алкенил; (6) гидроксиC1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) аминогруппа, которая может быть замещена C1-6алкилом; или (10) карбоксигруппа; X2 - водород, галогруппа или C1-6алкил; n = 1, 2, 3, 4 или 5; каждый из R10 и R11 выбирают независимо друг от друга из группы, состоящей из водорода, C1-4алкила и C1-3алкокси-C1-3алкила; или R7 и R8 вместе с азотом, к которому они присоединяются, образуют моно- или дизамещенное кольцо, выбранное из группы, включающей: (1) пиперидинил; (2) пиперазинил; (3) морфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) тетразолил; (9) пиразолидинил или (10) азетидинил, при этом каждый из заместителей выбирается из группы, содержащей водород и C1-3алкил, бензилоксикарбонил, фенилC1-3алкиламинокарбонил, гидроксиC1-3алкил, C1-6алкокси, C1-4алкилоксикарбонил и оксогруппу; или R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моноциклическое моно- или дизамещенное кольцо, содержащее 5, 6 или 7 атомов углерода.
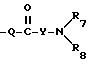
Y представляет собой

8. Соединение по п.7, где R - C1-6алкил; R1 - C1-6алкил; M - C1-6алкил; Ra и Rb каждый - водород; R2 и R3 каждый независимо друг от друга - (1) водород; (2) C1-6алкил, или R2 и R3 могут объединяться вместе с образованием метилендиоксигруппы; R4 представляет собой

где Q - ковалентная связь; или Y представляет собой

R12 - водород или C1-3алкил; R7 и R8 каждый независимо друг от друга: (а) водород; (б) C1-6алкил; (в) C1-6алкоксиC2-3алкил; (г) гидроксиC2-6алкил; (д) карбоксамидоC1-6алкил; (е) C1-6алканоил; (ж) фенил или фенилC1-6алкил; (з) C2-6алкенил; (и) C6-10 циклоалкенил; (к) гетероарилC1-6алкил, при этом упомянутый гетероарил включает пиридинил, имидазолил; (л) карбоксиC1-6алкил или карбоC1-6алкоксиC1-3алкил; (м) C1-6алкилсульфонил; (н) бензилокси; (о) морфолинилC1-3алкилсульфонил; (п) аминоC1-3алкилсульфонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (р) аминокарбонил, при этом аминогруппа может быть моно- или дизамещена C1-6алкилом; (с) аминокарбонилоксиC2-6алкил, при этом аминогруппа может быть замещена C1-6алкилом; (т) пиразолидинил; (у) пиперидинил; (ф) пиримидинил; (х) C3-7циклоалкил; (ц) альфа-C1-3алкилбензил, или моно- или дизамещенный бензил, или моно- или дизамещенный пиридилметил, при этом заместителями являются X1 или X2; где X1 - (1) водород; (2) галогруппа; (3) C1-6алкил; (4) галоC1-6алкил; (5) C2-6алкенил; (6) гидроксиC1-6алкил; (7) C1-6алкилкарбонил; (8) C1-6алкилкарбониламино; (9) диC1-3алкиламино или (10) карбоксигруппа; X2 - водород, галогруппа или C1-6алкил; n = 1, 2, 3 или 4; R9 выбирают из водорода, C1-4алкила и C1-3алкокси-C2-3алкила; каждый из R10 и R11 выбирают независимо друг от друга из группы, состоящей из водорода, C1-4алкила и C1-3алкокси-C1-3алкила; или R7 и R8 вместе с азотом, к которому они присоединяются, образуют моно- или дизамещенное кольцо, выбранное из группы, включающей: (1) пиперидинил; (2) пиперазинил; (3) морфолинил; (4) пирролидинил; (5) пиррил; (6) имидазолил; (7) триазолил; (8) тетразолил; (9) пиразолидинил или (10) азетидинил, при этом каждый из заместителей выбирается из группы, содержащей водород и C1-3алкил, бензилоксикарбонил, фенилC1-3алкиламинокарбонил, гидроксиC1-3алкил, C1-6алкокси, C1-4алкилоксикарбонил и оксогруппу; или R8 и R9 вместе образуют насыщенное моно- или дизамещенное моноциклическое кольцо, содержащее 6 или 7 атомов углерода и включающее 2 атома азота; при этом указанное кольцо выбирают из пиперазинила и гомопиперазинила; или R9 и R12 вместе образуют моно- или дизамещенное насыщенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов, при этом упомянутое кольцо включает один атом азота; или R10 и R12 вместе с атомами углерода, к которым они присоединяются, образуют моно- или дизамещенное моноциклическое кольцо, содержащее 5, 6 или 7 атомов углерода.

и R7 - (б) этил, пропил, бутил, пентил и гексил; (в) циклопропил; (г) C1-3алкоксиC2-3алкил; (д) гидроксиэтил; (е) карбоэтоксиметил; R8 - (а) C1-3алкил; (б) циклопропил; (в) C1-3алкоксиC1-3алкил; (г) гидроксиэтил; (д) карбоэтоксиметил; или R7 и R8 вместе с атомом азота, к которому они присоединяются, образуют моно- или дизамещенное моноциклическое кольцо, которое является пиперидинилом или морфолинилом, при этом упомянутое кольцо может быть замещено водородом или метилом.

в которой A представляет собой (1) -CH2CH2N(CH3 )2; (2) -CH2CO2H; (3) -CH2-C(O)N(CH2CH2OH)2; (4) -CH2-C(O)N(CH3)CH2C(O)NH2; (5) -CH2C(O)NH-C(CH2OH)3; (6) -CH2C(O)N(CH3)2; (7) -CH2CH2N(CH3)Ac; (8) -CH(CH3)CO2 CH2Ph; (9) -CH(CH3)CO2H; (10) -CH(CH3)C(O)N(Et)2; (11) -CH(CH3)CH3N(CH3)2; (12) -CH2CH2CH2N(CH3)2; (13) -CH2CH2N(Et)2; (14) -CH2CH2(4-морфолинил);
(15) -CH2CH2 CH2CH2N(CH3)2; (16) -CH2C(O)-PrO-NHCH2Ph; (17) -CH2C(CH3)2N(CH3)2; (18) -CH2CH2N(i-Pr)2; (19) -CH2CH2N(n-Bu)2; (20) -CH2CH2CH2CH2CH2CH2N(CH3)2; (21) -CH2CH2(1-пиперазинил); (22) -CH2CH2(4-метил-1-пиперазинил); (23) -CH2CH2N(Ph)2; (24) -CH2CH2N(CH2CH= CH2)2; (25) -CH2CH(Ph)N(CH3)2 или (26) -CH2CH2N(CH3)CH2 Ph.

в которой A представляет собой (1) -CH2CH2N(CH3)2; (2) -CH2CH2CH2N(CH3)2; (3) -CH2CH2N(Et)2; (4) -CH2CH2-(4-морфолинил);
(5) -CH(CH3)CH2N(CH3)2; (6) -CH2C(CH3)2N(CH3)2 или (7) -CH2CH2N(CH3)CH2Ph. 14. Соединение по п.2 формулы:
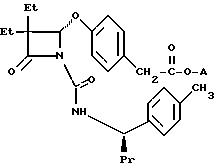
в котором A представляет собой (1) -N(CH2CH2OH)2; (2) 4-метил-1-пиперазинил; (3) 4-морфолинил; (4) -NHCH2CH2N(CH3)2; (5) -N(CH3)CH2CH2N(CH3)2; (6) -NHCH2CH2CH2N(CH3)2; (7) -NHCH2CH2(-4-пиридил); (8) -NHCH2CO2H; (9) -NHCH(CH3)CO2H; (10) -NHCH2C(O)N(CH2CH2OH)2; (11) -N(CH3 )CH2CO2H; (12) -NHCH(CH3)C(O)N(CH2CH2OH)2; (13) -N(CH3)CH2C(O)N(CH2CH2OH)2; (14) -N(CH3)CH2CH2-(4-морфолинил); (15) -N(CH3)CH2CH2N(CH2CH2OCH3)2;
(16) -N(CH3)CH2CH2N(Et)2; (17) -N(CH3)CH2CH2CH2N(CH3)2; (18) -NHCH2CH(CH3 )N(CH3)2; (19) -N(CH3)CH2CH2N(i-Pr)2; (20) -N(n-Pr)2; (21) -N(Et)2; (22) 3-хлоранилино-; (23) 3-метоксианилино-; (24) 4-фторанилино-; (25) -N(CH3)CH2CH2CH2CO2H; (26) -N(CH3)CH2CH2CH2C(O)NHSO2Ph; (27) -N(CH3)CH2CH2CH2N(CH3)CH2Ph; (28) -N(CH3)2; (29) -N(CH3)CH2Ph; (30) -N(CH3 )CH2CH2N(CH3)CH2Ph; (31) -NH-O-CH2Ph; (32) -N(CH3)(4-карбоксифенил) или (33) -N(CH3 )(4-бензолсульфониламинокарбонилфенил).

в котором A представляет собой (1) -NHCH2CH2N(CH3)2; (2) -NH-CH2CO2H; (3) -N(CH3)CH2CH2N(CH3 )2; (4) -N(Et)CH2CH2N(CH3)2; (5) -NHCH2CH2N(Et)2; (6) -NHCH2CH2-(4-морфолинил); (7) -N(CH3)CH2CH2-(4-морфолинил); (8) -N(CH3)CH2CH2N(CH2CH2OCH2)2; (9) -N(CH3 )CH2CH2N(Et)2; (10) -N(Ph)CH2CH2N(CH3)2; (11) -N(CH3)CH2CH2CH2N(CH3 )2; (12) -NHCH2CH2N(i-Pr)2; (13) -N(CH3)CH2CH2N(iPr)2; (14) -NHCH2CH2-(1-пиперидинил); (15) -N(CH3)CH2CH2-(1-пиперидинил); (16) -N(CH3)CH2CH2NHCH3; (17) -N(CH3)CH2CH2N(CH3)Ac; (18) -NHCH2CH2-(1-пирролидинил); (19) -N(CH3)CH2CH2-(1-пирролидинил); (20) -NHCH2CH2-(1H-1,2,4-триазол-4-ил); (21) -NH-CH2CH2-(1-имидазолил); (22) -NH-CH2CH2-(2H-тетразол-2-ил); (23) -NH-CH2CH2-(1H-тетразол-1-ил); (24) -N(CH3)CH2CH2N(CH3)Ac; (25) -N(CH3)CH2CH2N(CH3)C(O)NHCH3; (26) -N(CH3)CH2CH2N(CH3 )SO2CH3; (27) -NHCH2CH2-(1,1-диоксо-4-тиоморфолинил); (28) -4-диметиламинобензиламино; (29) 3-диметиламиноанилино; (30) -N(CH3)CH2 CH2-(1,1-диоксо-4-тиоморфолинил); (31) 4-диметиламиноанилино; (32) -NHCH2CH2-(1-бензил-1H-имидазол-2-ил); (33) -N(CH3)CH2CH2 -(2-пиридил); (34) -NHCH2CH2-(4-бензилоксикарбонил-1-пиперазинил); (35) -NHCH2CH2-(1-гомопиперидинил); (36) -N(CH3)CH2CH2 -(1-гомопиперидинил); (37) -N(CH3)CH2CH2N(CH3)CH2Ph; (38) -N(n-Pr)2; (39) -N(Et)2; (40) -N(CH3)CH2 CH2-(4-оксо-1-пиперидинил); (41) -N(Et)CH2CH2-(1-пиперидинил); (42) -N(CH2Ph)CH2CH2-(1-пиперидинил); (43) 4-фторанилино; (44) 3-хлоранилино; (45) 3-метоксианилино; (46) -N(CH2Ph)CH2CH2N(CH3)2; (47) -N(3-пиколил)-CH2CH2-(1-пиперидинил); (48) -NHCH(CH3)CH2CH2CH2N(Et)2; (49) -NHCH2CH2-(2-S-гидроксиметил-1-пирролидинил); (50) -N(CH3)CH2CH2-(4-третбутоксикарбонил-1-пиперазинил); (51) -N[CH2CH2N(CH3)2]2; (52) -N[CH2CH2N(Et)2]2; (53) -N(CH3)CH2CH2N(CH3)-(3-пиколил); (54) -3,5-диметил-1-пиперазин; (55) -N(CH3)CH2CH2N(CH3)-(4-пиколил); (56) -N(CH3)CH2CH2N(CH3)-(2-пиколил); (57) -N(CH3)CH2CH2-(1-пиперазинил); (58) 1-гомопиперазинил; (59) -N(CH3)CH2CH2N(CH3)CH2CH2Ph; (60) -N(CH3)CH2-[CH(OH)]4CH2OH; (61) -N(CH3)CH2CH2 N(CH3)CH(CH3)Ph; (62) -N(CH3)CH2CH2N(CH2Ph)2; (63) 1-этил-3-пиперидиниламино; (64) -N(CH3)CH2CH2CH2C(O)NHSO3Ph; (65) -N(CH3)CH2CH2N(CH3)CH2CH=CH2; (66) -N(CH3)CH2CH2 CH2N(CH3)CH2Ph; (67) -N(CH3)-(CH2)6-N(CH3)CH2Ph; (68) -N(CH3)CH2CH2OH; (69) -N(CH3)CH2CH2OC(O)N(CH3)2; (70) -N(CH3)CH2CH2N(CH3)CH2CO2-t-Bu; (71) -N(CH3)-(1-этил-3-пиперидинил); (72) -N(CH3)CH2CH2N(CH3)-(тетрагидро-2H-пиран-2-илметил); (73) -2,2,6,6-тетраметилпиперидин-4-иламино; (74) -N(CH3)-(4-карбоксифенил); (75) -N(CH3)CH2CH2N(CH3)-(4-цианобензил); (76) -N(CH3)CH2CH2N(CH3)-(4-метилбензил); (77) -N(CH3)CH2CH2N(CH3)-(3-цианобензил); (78) -N(CH3)CH2CH2N(CH3)-(4-трифторметилбензил); (79) -N(CH3 )CH2CH2N(CH3)-(3-трифторметилбензил); (80) -N(CH3)CH2CH2N(CH3)-(циклопропилметил); (81) -N(CH3)CH2 CH(Ph)N(CH3)2; (82) -N(CH3)CH2Ph; (83) -N(CH3)-(1-бензил-3-пиперидинил); (84) -N(3-пиколил)CH2CH2N(CH3)CH2Ph; (85) -N(CH3)CH2CH2N(CH3)-(4-метоксибензил); (86) -N(4-пиколил)CH2CH2N(CH3)CH2Ph; (87) -N(2-пиколил)CH2CH2N(CH3)CH2Ph; (88) -N(CH3)CH2CH2N(CH3)-(2,4-диметилбензил); (89) -N(CH3)CH2CH2-(2,6-диметил-4-морфолинил); (90) 4-морфолинил; (91) цис-2,6-диметил-4-морфолинил; (92) -NH-CH2CH2CH2CH3; (93) -N(CH3)CH2CH2N(CH3)-(3-фторбензил); (94) -N(CH3)CH2CH2N(CH3)-(2-хлорбензил); (95) -N(CH3)CH2CH2N(CH3)-(3-метоксибензил); (96) -N(CH3)-(1-бензил-4-пиперидинил); (97) -N(CH3)CH2CH2N(CH3)-(2-адамантил); (98) -N(CH3 )-(4-пиперидинил); (99) 5-метил-2,5-диазабицикло[2,2,1]гепт-2-ил; (100) -N(CH3)CH2CO2H; (101) -N(CH3)CH2CH2CH2N(CH3)CH2CH3; (102) -N(CH3)-(1-метил-4-пиперидинил); (103) -N(CH3)-(1-пропил-4-пиперидинил); (104) -N(CH3)-(1-этил-4-пиперидинил); (105) -N(CH3)CH2CH(CH3)N(CH3)CH2Ph; (106) -N(CH3)CH2CH(CH3)N(CH3)2; (107) -N(CH3 )CH2CH2NH-(2-адамантил); (108) -N(CH3)CH2CH2N(CH3)-(6,6-диметилбицикло-[3,1,1] -гепт-2-ил; (109) -N(CH3)CH2 CH2N(CH3)-(1-циклогексен-1-ил); (110) -N(CH3)CH2CH2NHC(CH3)2CH=CH2; (111) 2-S-карбоксамидо-1-пирролидинил; (112) 2-гидроксиметил-1-пиперидинил; (113) 3-диметиламино-1-пирролидинил; (114) -N(CH3)CH2CH2N(CH3)(циклогексилметил); (115) -N(CH3)CH2 CH2N(CH2CH= CH2)C(CH3)2CH= CH2; (116) -N(CH3)CH2CH2N(CH3)(4-этилциклогексил); (117) -N(CH3)CH2CH2N(CH3)(2-этилциклогексил); (118) -N(CH3)CH2CH2N(CH3)(4-метилциклогексил); (119) -N(CH3 )CH2CH2N(CH3)(циклогексил); (120) -N(CH3)CH2CH2N(CH3)CH2C(O)N(CH3)2;
(121) -N(CH3)CH2CH2N(CH3)(циклогексилметил) или (122) -NHCH2CH2N(Et)CH2CH2OCH3.

в которой R представляет собой (1) -CH3; (2) 4-фторфенил; (3) 3-хлорфенил; (4) фенил; (5) бензил; (6) водород; (7) i-Pr; (8) i-Bu; (9) -CH2CO2Et; (10) -CH2CO2H; (11)Et; (12) Pr; (13) 2-пиримидинил; (14) -CH2CH2OC(O)NHCH3; (15) циклопропил или (16) -CH2CH2OH.

в которой значения n и A даны в табл. А.

в которой значения n, R2 и A даны в табл. Б.
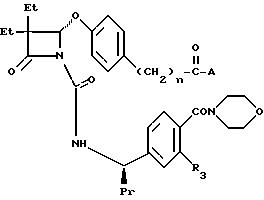
в которой значения n, R3 и A даны в табл. В
20. Соединение по п.2 формулы

в которой значения n, R2, R3 и A даны в табл. Г.

в которой значения R2, R6 и A даны в табл. Д.
(а) трет-бутоксикарбонилметил[S-(R*, S*)] 4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(б) 2-(бис-(2-гидроксиэтил)амино)-2-оксоэтил[S-(R*,S*)]4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(в) 1-метил-2-оксо-2-(фенилметилокси)этил(2S-(1(S*), 2R*, R)))4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(г) 1-карбоксиэтил[S-(R*,S*)]4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(д) 2-(диэтиламино)-1-метил-2-оксоэтил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(е) [S-(R*,S*)]-1-(((4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)окси)ацетил)-L-пролин;
(ж) [S-(R*,S*)]-1-(((4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)окси)ацетил-N-бензил-L-пролинамид;
(з) 2-(диметиламино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(и) 1-диметиламино-2-пропил[S-(R*, S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(к) 3-диметиламино-1-пропил[S-(R*, S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(л) 2-диэтиламиноэтил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(м) 2-(1-(4-морфолино)этил)[S-(R*, S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(н) 4-диметиламинобутил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(о) 2-диметиламино-2-метил-1-пропил[S-(R*, S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(п) 2-(диизопропиламино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(р) бензил[S-(R*,S*)]-4-(2-((4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоил)оксиэтил)-1-пиперазин-карбоксилат;
(с) 2-(дибутиламино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(т) [S-(R*, S*)]-6-(диметиламино)гексил-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(у) 2-(4-метил-1-пиперазинил)этил[S-(R*,S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ф) 2-(дифениламино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(х) 2-(ди-2-пропениламино)этил[S-(R*, S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ц) 2-(диметиламино)-2-фенилэтил[S-(R*, S*)]-4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ч) 2-(метил(фенилметил)амино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)бензоат;
(ш) 2-(диметиламино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-2,6-диметил-бензоат;
(щ) 2-(диэтиламино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-2,6-диметил-бензоат;
(ь) 2-(бис-(1-метилэтил)амино)этил[S-(R*, S*)] -4-((3, 3-диэтил-1-(((1-(4-метилфенил)бутил)амино)карбонил)-4-оксо-2-азетидинил)окси)-2,6-диметил-бензоат;
23. Соединение по п.1, выбранное из группы, включающей:
(а) [S-(R*, S*)]-2-(4-(((2-диметиламино)этил)метиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(б) [S-(R*, S*)]-2-(4-(((2-диметиламино)этил)метиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(в) [S-(R*, S*)]-2-(4-((4-метилпиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(г) [S-(R*, S*)]-2-(4-((4-метилпиперазин-1-ил)карбонил)фенокси)-3, 3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(д) [S-(R*, S*)]-2-(4-((4-циклопропилпиперазин-1-ил)карбонил)фенокси)-3, 3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(е) [S-(R*, S*)]-2-(4-((4-циклопропилпиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3, 4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(ж)[S-(R*, S*)] -2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид или
(з) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(и) [S-(R*, S*)]-2-(4-((((2-диметиламино)этил)этиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(к) [S-(R*, S*)]-2-(4-((((2-диэтиламино)этил)этиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(л) [S-(R*, S*)]-2-(4-(((4-(2-гидроксиэтил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(м) [S-(R*, S*)]-2-(4-(((4-(2-гидроксиэтил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид; или
(н) [S-(R*, S*)]-2-(4-(((4-этоксикарбонилметил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
24. Соединение по п.2, представляющее собой:
(а) [S-(R*,S*)]-2-(4-((4-морфолинил)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид или
(б) [S-(R*, S*)]-2-(4-((4-морфолинил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
25. Соединение по п.1, представляющее собой:
(а) [S-(R*, S*)]-2-(4-((((2-диметиламино)этил)метиламино)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(б) [S-(R*, S*)]-2-(4-(((4-метил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(в) [S-(R*, S*)]-2-(4-(((4-метил)пиперазин-1-ил)карбонил)фенокси)-3, 3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(г) [S-(R*,S*)]-2-(4-(((4-циклопропил)пиперазин-1-ил)карбонил)фенокси)-3, 3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(д) [S-(R*,S*)]-2-(4-(((4-циклопропил)пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3, 4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид;
(е) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(4-метилфенил)бутил)-4-оксо-1-азетидинкарбоксамид; или
(ж) [S-(R*, S*)]-2-(4-((пиперазин-1-ил)карбонил)фенокси)-3,3-диэтил-N-(1-(3,4-метилендиоксифенил)бутил)-4-оксо-1-азетидинкарбоксамид.

где Q, Y, R7 и R8 имеют указанные в п.1 значения,
отличающийся тем, что соединение общей формулы

обрабатывают соединением формулы

где R1, R1, R2, R3, R7, R8, Ra, Rb, M, Q и Y имеют указанные в п.1 значения.
27.10.92 - по пп.1 - 8, 11 - 13, 14 - 19, 21, 22, 26 - 27, 29 - 33;
17.12.92 - по пп.9, 10, 23 - 25, 28.

Комментарии