Производные азола, способы их получения и антигрибковое средство - RU2131417C1
Код документа: RU2131417C1
Чертежи













Описание
Изобретение относится к производным азола, которые полезны в качестве антигрибковых терапевтических средств, и способу их получения, а также их использованию.
Имеются сообщения о большом количестве производных азола, которые обладают антигрибковой активностью (см., например, EP 0122056 A1, EP 0332387 A1 и EP 0122693 A1).
Однако указанные производные азола не являются удовлетворительными при использовании их в качестве фармацевтических средств с точки зрения их антигрибковой активности, спектра антигрибкового действия, побочных эффектов и фармакинетике.
Для использования в качестве антигрибкового терапевтического средства требуются соединения, которые обладают большей безопасностью, лучшим поглощением в условиях in vivo и большей антигрибковой активностью.
Краткое описание изобретения
Настоящее изобретение относится к:
(1) соединениям, представленным формулой (I):

где Ar обозначает необязательно замещенную фенильную группу, R1 и R2, которые могут совпадать или различаться, обозначают атом водорода или низшую алкильную группу или R1 и R2 могут быть объединены и образуют низшую алкиленовую группу, R3 обозначает атом водорода или ацильную группу, V обозначает атом азота или метиновую группу, а A является необязательно замещенной насыщенной циклической амидной группой, присоединенной посредством первого атома азота, или его соль,
(2) соединение, представленное выше в (1), в котором один из R1 и R2 обозначает атом водорода, а другой обозначает низшую алкильную группу.
(3) соединение, представленное выше в (1), в котором Y обозначает атом азота,
(4) соединение,
представленное выше в (4), в котором Ar является галогензамещенной фенильной группой,
(5) соединение, представленное выше в (1), в котором Ar является фенильной группой, замещенной одним или
двумя атомами фтора,
(6) соединение, представленное выше в (1), в котором A обозначает пяти- или шестичленную насыщенную циклическую амидную группу,
(7) соединение, представленное
выше в (1), в котором A обозначает насыщенную циклическую амидную группу, содержащую в кольце второй атом азота,
(8) соединение, представленное выше в (7), в котором второй атом азота
насыщенной циклической амидной группы присоединен к заместителю,
(9) соединение, представленное выше в (1), в котором A обозначает 3-замещенную фенил-2-оксо-1-имидазолидинильную группу
формулы:
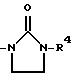
где R4 обозначает замещенную фенильную группу,
(10) соединение, представленное выше в (1), в котором A обозначает 4-замещенную фенил-2,5-диоксо-1-пиперазинильную группу формулы:

где R5 имеет то же значение, что и R4,
(11) соединение, представленное выше в (1), в котором A обозначает насыщенную циклическую амидную группу, содержащую замещенную фенильную группу, имеющую 1 или 2 заместителя, выбранных из группы, включающей атом галогена, галогензамещенную (1-6C)алкильную группу и галогензамещенную (1-6С)алкокси-группу,
(12) соединение, представленное выше в (11), в котором заместителем в замещенной фенильной группе является атом фтора, фторзамещенная низшая алкильная группа или фторзамещенная низшая алкокси-группа,
(13) способ получения соединения формулы (I), представленного выше в (1), или его соли, который включает взаимодействие соединения формулы (II):

где Ar обозначает необязательно замещенную фенильную группу, R1 и R2, которые могут совпадать или различаться, обозначают атом водорода или низшую алкильную группу или R1 и R2 могут быть объединены и образуют низшую алкиленовую группу, A является необязательно замещенной насыщенной циклической амидной группой, связанной посредством первого атома азота, с соединением, представленным формулой (III):

где Y обозначает атом азота или метиленовую группу, или его соль с образованием соединения формулы (I), в котором R3 является атомом водорода, и в случае необходимости - обработку ацилирующим агентом, с целью получения соединения формулы (I), в котором R3 обозначает ацильную группу,
(14) способ получения соединения представленного выше в (9), или его соли, который включает восстановление соединения формулы (I'):

где Ar обозначает необязательно замещенную фенильную группу, R1 и R2, которые могут совпадать или различаться, обозначают атом водорода или низшую алкильную группу или R1 и R2 могут быть объединены и образуют низшую алкиленовую группу, R3 обозначает атом водорода или ацильную группу, Y обозначает атом азота или метиновую группу, а A'' является 3-замещенной фенил-2-оксо-2,3-дигидро-1H-имидазол-1-ильной группой, или его соли, и
(15) антигрибковое терапевтическое средство, которое включает соединение формулы (I), представленное в (1), или его фармацевтически приемлемую соль, наполнитель и носитель.
Примерами заместителей для необязательно замещенной фенильной группы, обозначенной через Ar в формулах (I), (II) и (I'), являются атом галогена (например, фтора, хлора, брома или йода), галогензамещенная низшая (1-4C)алкильная группа, галогензамещенная низшая (1-4C)алкокси-группа, низшая (1-4C)алкилсульфонильная группа и галогензамещенная низшая (1-4C)алкилсульфонильная группа. Заместитель предпочтительно является атомом галогена (например, фтора, хлора, брома или йода) и особенно предпочтительно - фтора. Количество заместителей предпочтительно составляет от 1 до 3, наиболее преимущественно от 1 до 2.
Примерами Ar являются галогензамещенная фенильная группа, галогензамещенная низшая (1-4C)алкилфенильная группа, галогензамещенная низшая (1-4C)алкоксифенильная группа, низшая (1-4C)алкилсульфонилфенильная группа и галогензамещенная низшая (1-4C)алкилсульфонилфенильная группа.
Примерами указанных выше галогензамещенных фенильных групп являются 2,4-дифторфенил, 2,4-дихлорфенил, 4-хлорфенил, 4-фторфенил, 2-хлорфенил, 2-фторфенил, 2-фтор-4-хлорфенил, 2-хлор-4-фторфенил, 2,4,6-трифторфенил и 4-бромфенил.
Примерами галогензамещенных низших (1-4C)алкилфенильных групп являются 4-трифторметилфенильная и аналогичные группы.
Примерами галогензамещенных низших (1-4C)алкоксифенильных групп являются 4-трифторметоксифенил, 4-(1,1,2,2-тетрафторэтокси)фенил, 4-(2,2, 2-трифторэтокси)фенил, 4-(2,2,3,3-тетрафторпропокси)фенил и 4-(2,2,3,3-пентафторпропокси)-фенил.
Примерами низших (1-4C)алкилсульфонилфенильных групп являются 4-метансульфонилфенильная и аналогичная группы.
Примерами галогензамещенных низших (1-4C)алкилсульфонилфенильных групп являются 4-(2,2,2-трифторэтансульфонил)фенил, 4-(2,2,3, 3-тетрафторпропансульфонил)фенил и 4-(2,2,3,3-пентафторпропансульфонил)фенил.
Предпочтительной Ar является фенильная группа, которая, в частности, замещена одним или двумя атомами галогена, такая как 2,4-дифторфенил, 2, 4-дихлорфенил, 4-хлорфенил, 4-фторфенил, 2-хлорфенил, 2-фторфенил, 2-фтор-4-хлорфенил, 2-хлор-4-фторфенил, 2,4,6-трифторфенил и 4-бромфенил, при этом наиболее предпочтительными являются 4-фторфенил, 2-фторфенил и 2,4-дифторфенил.
Примерами низших алкильных групп, обозначенных через R1 или R2 в формулах (I), (II) и (I'), являются алкильные группы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метил, этил, пропил, изо-пропил, бутил, изо-бутил, втор-бутил и трет-бутил, при этом метил является предпочтительным. Предпочтительной комбинацией групп R1 и R2 является атом водорода и атом водорода, атом водорода и метил, или метил и метил. Примерами низших алкиленовых групп, образуемых объединением групп R1 и R2, являются низшие (2-4C)алкиленовые группы с прямой цепью, такие как этилен, пропилен и бутилен, при этом предпочтительным является этилен.
Наиболее предпочтительным является случай, когда одна из групп R1 и R2 является атомом водорода, а другая обозначает метильную группу.
Примерами алкильных групп, представленных группой R3 в формулах (I) и (I'), являются ацильные группы, получаемые из органических карбоновых кислот, такие как алканоильная группа, преимущественно содержащая 1-7 атомов (в частности, формил, ацетил, пропионил, бутирил, изо-бутирил, валерил, изо-валерил, пивалоил, гексаноил или гептаноил), при этом наиболее предпочтительной является группа, содержащая 1-3 атома углерода, арилкарбонильная группа, преимущественно содержащая 7-15 атомов углерода (в частности, бензоил или нафталинкарбонил), при этом наиболее предпочтительной является группа, содержащая 7-11 атомов углерода, алкоксикарбонильная группа, преимущественно содержащая 2-7 атомов углерода (в частности, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изо-пропоксикарбонил, бутоксикарбонил, изо-бутоксикарбонил, втор-бутоксикарбонил или трет-бутоксикарбонил, при этом наиболее предпочтительной является группа, содержащая 2-4 атома углерода, арилоксикарбонильная группа, преимущественно содержащая 7-15 атомов углерода (в частности, феноксикарбонил), при этом наиболее предпочтительной является группа, содержащая 7-11 атомов углерода, аралкилкарбонильная группа, преимущественно содержащая 8-20 атомов углерода (в частности, бензилкарбонил, фенэтилкарбонил, фенпропилкарбонил или нафтилэтилкарбонил), при этом наиболее предпочтительной является группа, содержащая 8-14 атомов углерода. Указанные группы могут содержать от одного до трех подходящих заместителей. Примерами подходящих заместителей являются необязательно галогензамещенная низшая алкильная группа, арильная группа или атом галогена.
Указанными выше ацильными группами являются такие, которые способны гидролизоваться в условиях in vivo. Конкретными их примерами являются формил, ацетил, бензоил или бензилкарбонил.
Насыщенной циклической амидной группой в необязательно замещенной насыщенной циклической амидной группе,
связанной посредством атома азота, которая
обозначается символом A в формулах (I) и (II), преимущественно является насыщенная гетероциклическая группа, содержащая от одного до трех атомов азота,
которая может также содержать один атом
кислорода или серы в кольце, обозначенной формулой:

Вышеуказанные насыщенные циклические амидные группы являются от четырех до восьмичленными циклическими группами и преимущественно пяти- или шестичленными циклическими группами. Примерами таких насыщенных циклических амидных групп являются 2-оксо-1-имидазолидинил, 5-оксо-1-имидазолидинил, 2-оксо-1-пирролидинил, 3-оксо-2-пиразолидинил, 2-оксо-1-пиперазинил, 2-оксо-1-пиперидинил, 3-оксоморфолиногруппа и 2-оксо-1-пергидропиримидинил.
Насыщенная циклическая амидная группа наиболее предпочтительно имеет два атома азота в кольце. Примерами таких насыщенных циклических амидных групп являются 2-оксо-1-имидазолидинил, 2-оксо-1-пиперазинил и 2-оксо-1-пергидропиримидинил.
Примерами заместителей в насыщенной циклической амидной группе, обозначенной символом A, являются оксо-группа, атом галогена (например, фтора, хлора, брома и йода), алифатическая углеводородная группа, которая может иметь заместители, ароматическая углеводородная группа, которая может иметь заместители, и ароматическая гетероциклическая группа, которая может иметь заместители. Количество заместителей в циклической амидной группе составляет от 1 до 3, преимущественно 1 или 2.
В том случае, если заместителями в насыщенной циклической амидной группе, которая обозначается символом A, является необязательно замещенная алифатическая углеводородная группа, примерами алифатических углеводородных групп могут служить алкил, циклоалкил, алкенил или алкинил.
Примерами таких алкильных групп являются алкильные группы с прямой или разветвленной цепью, содержащие от 1 до 12 атомов углерода, такие как метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, гептил, октил, нонил, децил или додецил, предпочтительными из которых являются низшие алкильные группы, содержащие от 1 до 4 атомов углерода (в частности, метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил).
Примерами циклоалкильных групп являются циклоалкильные группы, содержащие от 1 до 8 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклопентил и циклооктил, из которых предпочтительными являются циклоалкильные группы, содержащие от 1 до 6 атомов углерода (в частности, циклопропил, циклобутил, циклопентил или циклогексил).
Примерами алкенильных групп являются алкенильные группы, содержащие от 2 до 4 атомов углерода, такие как винил, пропенил или бутенил, из которых предпочтительными являются алкенильные группы, содержащие от 2 до 3 атомов углерода (в частности, винил или пропенил).
Примерами алкенильных групп являются алкинильные группы, содержащие от 2 до 4 атомов углерода, такие как этинил, пропинил и бутинил, из которых предпочтительными являются алкинильные группы, содержащие от 2 до 3 атомов углерода (в частности, этинил или пропинил).
В том случае, если заместителями в насыщенной циклической амидной группе, которая обозначается символом А, является необязательно замещенная ароматическая углеводородная группа, примерами ароматических углеводородистых групп могут служить арильные группы, содержащие от 6 до 14 атомов углерода. Примерами арильных групп являются фенил, нафтил, бифенилил, антрил или инденил, из которых предпочтительными являются арильные группы, содержащие от 6 до 10 атомов углерода (в частности, фенил или нафтил).
В том случае, если заместителями в насыщенной циклической амидной группе, которая обозначается символом A, является необязательно замещенная ароматическая гетероциклическая группа, примерами ароматических гетероциклических групп могут служить ароматические гетероциклические группы, содержащие по крайней мере один гетероатом, выбранный из атома азота, атома серы или атома кислорода, ароматические гетероциклические группы могут быть конденсированы с бензольным кольцом, пятичленным гетероциклом или шестичленным гетероциклом. Примерами ароматических гетероциклических групп являются такие ароматические гетероциклические группы, как имидазолил, триазолил, тетразолил, пиразолил, пиридил, тиазолил, тиадиазолил, тиенил, фурил, пирролил, пиразинил, пиримидинил, оксазолил и изоксазолил, и конденсированные ароматические гетероциклические группы, такие как бензимидазолил, индазопиримидинил, имидазопиридинил, имидазопиразинил, имидазопиридазинил, бензотиазолил, хинолил, изохинолил, ханазолинил и индолил, среди которых предпочтительными являются пяти- и шестичленные ароматические гетероциклические группы, содержащие от 1 до 3 гетероатомов, выбранных из атома азота, атома серы или атома кислорода (в частности, имидазолил, тиазолил, тиазолил, тиадиазолил, тиенил, фурил, пиридил или пиримидинил).
Примерами заместителей в необязательно замещенной алифатической или ароматической углеводородной группе или необязательно замещенной ароматической гетероциклической группе являются гидроксильная группа, необязательно замещенная карбоксильная группа (в частности, алкоксикарбонильные группы, содержащие от 1 до 6 атомов углерода, такие как карбокси-группа, метоксикарбонильная группа, этоксикарбонильная группа и бутоксикарбонильная группа), нитро-группа, аминогруппа, ациламино-группа (в частности, алканоильные амино-группы, содержащие от 1 до 10 атомов углерода, такие как ацетиламино-группа, пропиониламино-группа и бутириламино-группа), алкиламино-группа, которая содержит в качестве заместителя одну, две или три алкильные группы, имеющие от 1 до 10 атомов углерода (в частности, метиламино-группа, диметиламино-группа, диэтиламино-группа или дибутиламино-группа), необязательно замещенная пяти- или шестичленная гетероциклическая группа (в частности, пирролидинил, морфолино-группа, пиперидино-группа, пиразолидинил, пергидроазепинил, пиперазинил, 4-бензилпиперазинил, 4-ацетилпиперазинил, 4-(4-трифторметоксифенил)-1-пиперазинил, 4-[4-(1, 1,2, 2-тетрафторэтокси)фенил]-1-пиперазинил, 4-[4-(2,2,3,3-тетрафторпропокси)фенил] -1-пиперазинил, 4-[4-(2,2,2-трифторэтокси)фенил] -1-пиперазинил, 4-[4-(2,2,3,3,3-пентафторпропокси)фенил] -1-пиперазинил или 4-(4-фторметилфенил)-1-пиперазинил), алкокси-группа, содержащая от 1 до 6 атомов углерода (в частности, метокси-группа, этокси-группа или бутокси-группа), атом галогена (в частности, фтора, хлора или брома), галоген(1-6C)алкильная группа ( в частности, трифторметил, дихлорметил или трифторэтил), галогено(1-6C)алкокси-группа (в частности, трифторметокси-группа, 1,1,2, 2-тетрафторэтокси-группа, 2, 2,2-трифторэтоксигруппа, 2,2,3,3-тетрафторпропокси-группа, 2,2,3,3,3-пентафторпропокси-группа, 2,2,3,3,4,4,5,5-октафторпентокси-группа или 2-фторэтоксигруппа), оксо-группа, тиоксо-группа, меркапто-группа, алкилтио-группа, содержащая от 1 до 6 атомов углерода (в частности, метилтио-группа, этилтио-группа или бутилтио-группа), алкилсульфонильная группа, содержащая от 1 до 6 атомов углерода (в частности, метансульфонил, этансульфонил или бутансульфонил) и алканоильная группа, содержащая от 1 до 10 атомов углерода (в частности, ацетил, формил, пропионил или бутирил).
Среди возможных заместителей в насыщенной циклической амидной группе, обозначенной символом A, необязательно замещенная алифатическая углеводородная группа, необязательно замещенная ароматическая углеводородная группа и необязательно замещенная ароматическая гетероциклическая группа преимущественно присоединены к атому азота, который входит в обозначенную прерывистой линией часть кольца указанной выше насыщенной циклической амидной группы.
Предпочтительными примерами A являются незамещенная насыщенная циклическая амидная группа, насыщенная циклическая амидная группа, замещенная оксо-группой, насыщенная циклическая амидная группа, замещенная галогенфенильной группой, насыщенная циклическая амидная группа, замещенная галогенфенильной группой и оксо-группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C)алкилфенильной группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C)алкилфенильной группой и оксогруппой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C) алкоксифенильной группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C)алкоксифенильной группой и оксо-группой.
Примерами вышеуказанных незамещенных насыщенных циклических амидных групп являются 2-оксо-1-имидазолидинил, 5-оксо-1-имидазолидинил, 2-оксо-1-пирролидинил, 3-оксо-2-пиразолидинил, 2-оксо-1-пиперазинил, 2-оксо-1-пиперидинил, 3-оксо-морфолино-группа и 2-оксо-1-пергидропиримидинил.
Примерами насыщенных циклических амидных групп, замещенных оксо-группой, являются 2,4-диоксо-1-имидазолидинил, 2,5-диоксо-1-имидазолидинил, 2,4-диоксо-1-пирролидинил, 3,5-диоксо-1-имидазолидинил, 2, 4-диоксо-1-пирролидинил, 3, 5-диоксо-2-пиразолидинил, 2,3-диоксо-1-пиперазинил, 2,5-диоксо-1-пиперазинил, 2,3-диоксо-1-пиперидинил.
Вышеуказанные незамещенная насыщенная циклическая амидная группа и насыщенная циклическая амидная группа, замещенная оксо-группой, преимущественно содержат в кольце еще один атом азота, помимо атома азота, связанного с атомом углерода, несущего заместители R1 и R2. Дополнительный атом азота преимущественно связывается с заместителем, таким как галогенфенильная группа, галогензамещенная (1-6C)алкилфенильная группа и галогензамещенная (1-6C)алкоксифенильная группа, как это поясняется далее.
Примерами насыщенных циклических амидных групп, замещенных галогенфенильной группой, являются 3-галогенфенил-2-оксо-1-имидазолидинил, 3-галогенфенил-2-оксо-1-пирролидинил, 4-галогенфенил-2-оксо-1-пиперазинил и 4-галогенфенил-2-оксо-1-пиперидинил, при этом 3-галогенфенил-2-оксо-1-имидазолидинил является предпочтительным.
Примерами насыщенных циклических амидных групп, замещенных галогенфенильной группой и оксо-группой, являются 3-галогенфенил-2,4-диоксо-1-имидазолидинил, 3-галогенфенил-2,4-диоксо-1-пирролидинил, 4-галогенфенил-2,5-диоксо-1-пиперазинил, 4-галогенфенил-2,3-диоксо-1-пиперазинил и 4-галогенфенил-2, 3-диоксо-1-пиперидинил, при этом 3-галогенфенил-2, 4-диоксо-1-имидазолидинил, 4-галогенфенил-2,5-диоксо-1-пиперазинил и 4-галогенфенил-2,3-диоксо-1-пиперазинил являются предпочтительными.
Примерами насыщенных циклических амидных групп, замещенных галогенсодержащей (1-6C)алкилфенильной группой, являются 3-галогензамещенный (1-6C)алкилфенил-2-оксо-1-имидазолидинил, 3-галогензамещенный (1-6C)алкилфенил-2-оксо-1-пирролидинил, 4-галогензамещенный (1-6C)алкилфенил-2-оксо-1-пиперазинил и 4-галогензамещенный (1-6C)алкилфенил-2-оксо-1-пиперидинил, при этом 3-галогензамещенный (1-6C)алкилфенил-2-оксо-1-имидазолидинил является предпочтительным.
Примерами насыщенных циклических амидных групп, замещенных галогенсодержащей (1-6C)алкилфенильной группой и оксо-группой, являются 3-галогензамещенный (1-6C)алкилфенил-2,4-диоксо-1-имидазолидинил, 3-галогензамещенный (1-6C)алкилфенил-2,4-диоксо-1-пирролидинил, 4-галогензамещенный (1-6C)алкилфенил-2,5-диоксо-1-пиперазинил, 4-галогензамещенный (1-6C)алкилфенил-2,4-диоксо-1-пиперазинил и 4-галогензамещенный (1-6C)алкилфенил-2,4-диоксо-1-пиперидинил, при этом 3-галогензамещенный (1-6C)алкилфенил-2,4-диоксо-1-имидазолидинил, 4-галогензамещенный (1-6C)алкилфенил-2,5-диоксо-1-пиперазинил и 4-галогензамещенный (1-6C)алкилфенил-2,4-диоксо-1-пиперазинил являются предпочтительными.
Примерами насыщенных циклических амидных групп, замещенных галогенсодержащей (1-6C)алкоксифенильной группой, являются 3-галогензамещенный (1-6C)алкоксифенил-2-оксо-1-имидазолидинил, 3-галогензамещенный (1-6C)алкоксифенил-2-оксо-1-пирролидинил, 4-галогензамещенный (1-6C)алкоксифенил-2-оксо-1-пиперазинил и 4-галогензамещенный (1-6C)алкоксифенил-2-оксо-1-пиперидинил, при этом 3-галогензамещенный (1-6C)алкоксифенил-2-оксо-1-имидазолидинил является предпочтительным.
Примерами насыщенных циклических амидных групп, замещенных галогенсодержащей (1-6C)алкоксифенильной группой и оксо-группой, являются 3-галогензамещенный (1-6C)алкоксифенил-2,4-диоксо-1-имидазолидинил, 3-галогензамещенный (1-6C)алкоксифенил-2,4-диоксо-1-пирролидинил, 4-галогензамещенный (1-6C)алкоксифенил-2, 5-диоксо-1-пиперазинил, 4-галогензамещенный (1-6C)алкоксифенил-2,3-диоксо-1-пиперазинил и 4-галогензамещенный (1-6C)алкоксифенил-2,3-диоксо-1-пиперидинил, при этом 3-галогензамещенный (1-6C)алкоксифенил-2,4-диоксо-1-имидазолидинил, 4-галогензамещенный (1-6C)алкоксифенил-2,5-диоксо-1-пиперазинил и 4-галогензамещенный (1-6C)алкоксифенил-2,3-диоксо-1-пиперазинил являются предпочтительными.
Более предпочтительными примерами A являются насыщенная циклическая амидная группа, замещенная галогенфенильной группой, насыщенная циклическая амидная группа, замещенная галогенфенильной группой и оксо-группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C) алкилфенильной группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C)алкилфенильной группой и оксо-группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C)алкоксифенильной группой, насыщенная циклическая амидная группа, замещенная галогенсодержащей (1-6C)алкоксифенильной группой и оксо-группой.
Наиболее предпочтительными примерами A являются 3-галогенфенил-2-оксо-1-имидазолидинил (в частности, 3-(2, 4-дифторфенил)-2-оксо-1-имидазолидинил или 3-(4-фторфенил)-2-оксо-1-имидазолидинил), 3-галогензамещенный низший (1-4C)алкилфенил-2-оксо-1-имидазолидинил (в частности, 3-(4-фторметилфенил)-2-оксо-1-имидазолидинил), 3-галогензамещенный низший (1-4C)алкоксифенил-2-оксо-1- имидазолидинил (в частности, 3-(4-фторметоксифенил)-2-оксо-1-имидазолидинил, 3-[4-(2,2,3,3, -тетрафторпропокси)фенил]-2-оксо-1-имидазолидинил, 3-/4-(1,1,2,2-тетрафторэтоксифенил/-2-оксо-1-имидазолидинил, 3-/4-(2,2,3, 3,3-пентафторпропокси)фенил/-2-оксо-1-имидазолидинил или -3-/4-(2,2, 2-трифторэтокси)фенил/2-оксо-1-имидазолидинил).
Особенно предпочтительными примерами произвольно замещенных
насыщенных циклических амидных групп, связанных посредством атома азота,
являются 3-замещенный фенил-2-оксо-1-имидазолидинил формулы:

где R4 обозначает замещенную фенильную группу, или 4-замещенный фенил-2,5-диоксо-1-пиперазинил формулы:

где R5 имеет то же значение, что и R4.
Примерами замещенных фенильных групп, обозначенных через R4 и R5, являются галогенфенильная группа, галогензамещенная (1-6C)алкилфенильная группа, галогензамещенная (1-6C)алкоксифенильная группа, которые уже рассматривались в качестве заместителей в замещенной циклической амидной группе.
Соединение (I) может также использоваться в виде его соли, и примерами указанных солей являются фармакологически приемлемые соли такие как соль с неорганической кислотой (в частности, хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой, или фосфорной кислотой) и соль с органической кислотой (в частности, уксусной кислотой, винной кислотой, лимонной кислотой, фумаровой кислотой, малеиновой кислотой, толуолсульфоновой кислотой и метансульфоновой кислотой).
Соединение, представленное формулой (I) или его соль (далее обозначается как "соединение по настоящему изобретению") содержит в своей молекуле один или несколько асимметрических атомов углерода, а потому существуют в виде двух или большего количества стереоизомеров. Любые такие стереоизомеры, а также их смеси, входят в объем притязаний по настоящему изобретению. Среди них особенно предпочтительными являются оптически активные соединения, у которых, если R1 обозначает атом водорода, а R2 является метильной группой, как атом углерода, к которому присоединена необязательно замещенная фенильная группа, обозначенная символом Ar, так и другой атом углерода, к которому присоединена группа R2, находятся в (R)-конфигурациях.
Соединения по настоящему изобретению можно получить, например, взаимодействием
соединения формулы (II):

где символы имеют вышеуказанное значение, с соединением формулы (III):

где символы имеют вышеуказанное значение, или его солью с последующей, в случае необходимости, обработкой ацилирующим агентом.
Реакцию обычно проводят в растворителе, который не препятствует ее протеканию. Примерами растворителей, которые не препятствуют протеканию реакции, являются вода, кетоны, такие как ацетон, сульфоксиды, такие как диметилсульфоксид, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксаны, нитрилы, такие как ацетонитрил, ароматические углеводороды, такие как бензол, толуол и ксилол, галогензамещенные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорметан, сложные эфиры, такие как этилацетат, амиды, такие как диметилформамид, ацетамид и диметилацетамид и 1-метил-2-пирролидон, уреилены, такие как 1,3-диметил-2-имидазолидинон, и т.п. Они могут использоваться как индивидуально, так и в смеси друг с другом в подходящей пропорции.
Далее, вышеуказанную реакцию преимущественно проводят в присутствии основания, такого как гидроксиды щелочных металлов (в частности, гидроксид лития, едкое кали и едкий натр), гидриды щелочных металлов (в частности, гидрид калия или гидрид натрия), карбонаты щелочных металлов (в частности, карбонат лития, бикарбонат натрия, карбонат цезия, карбонат калия или карбонат натрия), соли органических кислот (в частности, ацетат натрия), алкоголяты щелочных металлов (в частности, метилат натрия или трет-бутилат калия), тетрабутиламмонийфторид и бис(три-н-бутилстаннил)оксид.
По альтернативному способу целевое соединение можно получить реакцией в указанном выше растворителе, используя вместо соединения (III) соли соединения (III) с металлом (например, щелочным металлом, таким как натрий или калий).
Количество основания обычно составляет приблизительно от 0,001 до 100 эквивалентов, преимущественно приблизительно от 0,01 до 50 эквивалентов по отношению к соединению (I).
Количество соединения (III) или его соли составляет приблизительно от 1 до 100 эквивалентов, преимущественно приблизительно от 1 до 50 эквивалентов по отношению к соединению (I).
Температура проведения реакции специально не ограничивается и обычно составляет приблизительно от 0 до 150oC, преимущественно приблизительно от 10 до 120oC.
Время проведения реакции обычно составляет от нескольких минут до нескольких десятков часов (например, от пяти минут до пятидесяти часов).
Соединения
по настоящему изобретению можно синтезировать, например, взаимодействием соединения формулы (IV):

где символы имеют вышеуказанное значение, или его соли с соединением формулы (V):
H__A
где символы имеют вышеуказанное значение, или его солью и получить соединение формулы (I), в котором R3 обозначает атом водорода.
Вышеуказанную реакцию обычно проводят в растворителе, который не препятствует ее протеканию. Примерами растворителей, которые не препятствуют протеканию реакции, являются вода, кетоны, такие как ацетон, сульфоксиды, такие как диметилсульфоксид, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан, нитрилы, такие как ацетонитрил, ароматические углеводороды, такие как бензол, толуол и ксилол, галогензамещенные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан, сложные эфиры, такие как этилацетат, амиды, такие как диметилформамид, ацетамид и диметилацетамид и 1-метил-2-пирролидон, уреилены, такие как 1, 3-диметил-2-имидазолидинон и т. п. Они могут использоваться как индивидуально, так и в смеси друг с другом в подходящей пропорции.
Далее, вышеуказанную реакцию преимущественно проводят в присутствии основания, такого как гидроксиды щелочных металлов (в частности, гидроксид лития, едкое кали или едкий натр), гидриды щелочных металлов (в частности, гидрид калия или гидрид натрия), карбонаты щелочных металлов (в частности, карбонат лития, бикарбонат натрия, карбонат цезия, карбонат калия или карбонат натрия), соли органических кислот (в частности, ацетат натрия), алкоголяты щелочных металлов (в частности, метилат натрия или трет-бутилат калия), тетрабутиламмонийфторид и бис(три-н-бутилстаннил)оксид и т.п., при этом предпочтительным является тетрабутиламмонийфторид.
По альтернативному способу целевое соединение можно получить реакцией в указанном выше растворителе, используя вместо соединения (V) соль соединения (V) с металлом (например, щелочным металлом, таким как натрий или калий).
Количество основания обычно составляет приблизительно от 0,001 до 100 эквивалентов, преимущественно приблизительно от 0,01 до 50 эквивалентов по отношению к соединению (V).
Количество соединения (V) или его соли составляет приблизительно от 1 до 100 эквивалентов, преимущественно приблизительно от 1 до 50 эквивалентов по отношению к соединению (IV).
Температура проведения реакции специально не ограничивается и обычно составляет приблизительно от 0 до 150oC, преимущественно приблизительно от 10 до 120oC.
Время проведения реакции обычно составляет от нескольких минут до нескольких десятков часов (например, от пяти минут до пятидесяти часов).
Соединение формулы (I), в котором A
обозначает необязательно замещенный 2-оксо-1-имидазолидинил, или его соль можно получить, например, подвергая соединение формулы (VI):

где A' обозначает необязательно замещенную 2-оксо-2,3-дигидро-1H-имидазол-1-ильную группу, а другие символы имеют вышеуказанное значение, или его соль каталитической реакции восстановления.
Вышеуказанную реакцию обычно проводят в присутствии воды или органических растворителей, которые не препятствуют ее протеканию, такие как кетоны (в частности, ацетон или метилэтилкетон), спирты (в частности, метанол, этанол, пропанол, изо-пропиловый спирт или бутанол), сложные эфиры (в частности, этилацетат), углеводороды (в частности, бензол, толуол, гексан и ксилол), органические карбоновые кислоты (в частности, уксусная кислота или пропионовая кислота) и т.п., которые могут использоваться как индивидуально, так и в смеси друг с другом. Эту реакцию обычно проводят в присутствии катализатора. Что касается катализатора, то используют подходящий металлический катализатор, такой как палладий на угле. Указанную реакцию проводят под давлением, начиная от атмосферного давления до приблизительно 150 кг/см2 при температуре от комнатной до температуры более 100oC.
Примерами солей вышеуказанных исходных соединений (III), (IV) и (VI) являются те же, что указанные для соединения (I).
Когда соединение формулы (I), в котором R3 обозначает атом водорода, получают по указанным выше реакциям, то это соединение или его соль можно ацилировать, получая другое соединение формулы (I), в котором R3 обозначает ацильную группу, обработкой соответствующим ацилирующим агентом R3X (R3 является алифатическим или ароматическим остатком, такие как ацетил, пропионил, бутирил, этоксикарбонил, бензоил и замещенный бензоил, а X обозначает уходящую группу, такую как атом галогена, в частности, хлора или брома, или активированную сложноэфирную группу).
Вышеуказанную реакцию обычно проводят в присутствии или в отсутствие растворителя, который не препятствует ее протеканию. Примерами таких растворителей являются кетоны, такие как ацетон, сульфоксиды, такие как диметилсульфоксид, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан, нитрилы, такие как ацетонитрил, ароматические углеводороды, такие как бензол, толуол и ксилол, галогензамещенные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан, сложные эфиры, такие как этилацетат, амиды, такие как диметилформамид, ацетамид и диметилацетамид и 1-метил-2-пирролидон, уреилены, такие как 1,3-диметил-2-имидазолидинон, и т.п. Для увеличения скорости реакции в реакционную систему можно добавлять основание (в частности, диметиламинопиридин, пиридин, пиколин или триэтиламин).
Соединение по настоящему изобретению можно выделять из реакционной смеси и очищать известными способами, такими как экстракция, концентрирование, нейтрализация, фильтрация, перекристаллизация, колоночная хроматография и тонкослойная хроматография.
Соединения по настоящему изобретению могут иметь по крайней мере два стереоизомера. Каждый из таких изомеров и каждая из их смесей включается в концепцию настоящего изобретения и, если необходимо, такой изомер можно получить отдельно. Например, индивидуальный изомер соединения по настоящему изобретению может быть получен по указанным выше реакциям, исходя из индивидуальных изомеров исходных соединений (II), (IV) и (VI). Если получаемый продукт является смесью двух или большего количества изомеров, то их можно разделить на отдельные изомеры обычными методами разделения, такими как метод получения соли с оптически активной кислотой (в частности, камфорсульфоновой кислотой или винной кислотой), применяя различные хроматографические способы или дробную перекристаллизацию и т.д.
Соль соединения (I) можно получить известными способами, например, добавлением вышеуказанной неорганической или органической кислоты к соединению (I).
Исходное соединение (VI) по настоящему изобретению, в котором R1 является атомом водорода, R2 обозначает метильную
группу, атом углерода, к
которому присоединена группа Ar, имеет (S)-конфигурацию, а атом углерода, к которому присоединена группа R2, имеет (R)-конфигурацию (т.е. соединение (VII)), может
быть получено по способу,
представленному на схеме фиг. 1,
где Me обозначает метильную группу, Et обозначает этильную группу, Pr обозначает пропильную группу, Ph является фенильной группой,
DMF обозначает
диметилформамид, а остальные символы имеют вышеуказанное значение.
Исходное вещество (VIII), представленное на схеме, можно получить по методу, представленному на схеме
фиг. 2,
где THP обозначает тетрагидропиранильную группу, DMSO обозначает диметилсульфоксид, а остальные символы имеют вышеуказанное значение.
Исходное соединение (VI) по
настоящему
изобретению, в котором R1 является атомом водорода, R2 обозначает метильную группу, R3 является атомом водорода, а как атом углерода, к которому
присоединена группа
Ar, так и атом углерода, к которому присоединена группа Ar, так и атом углерода, к которому присоединена группа R2, имеют (R)-конфигурации (т.е. соединение (XVII)),
может быть получено,
например по способу, представленному на схеме фиг. 3,
где символы имеют вышеуказанное значение.
Представленное на схеме исходное соединение (XX) можно синтезировать по методикам, приведенным в EP 0548533 A или EP 0421210 A.
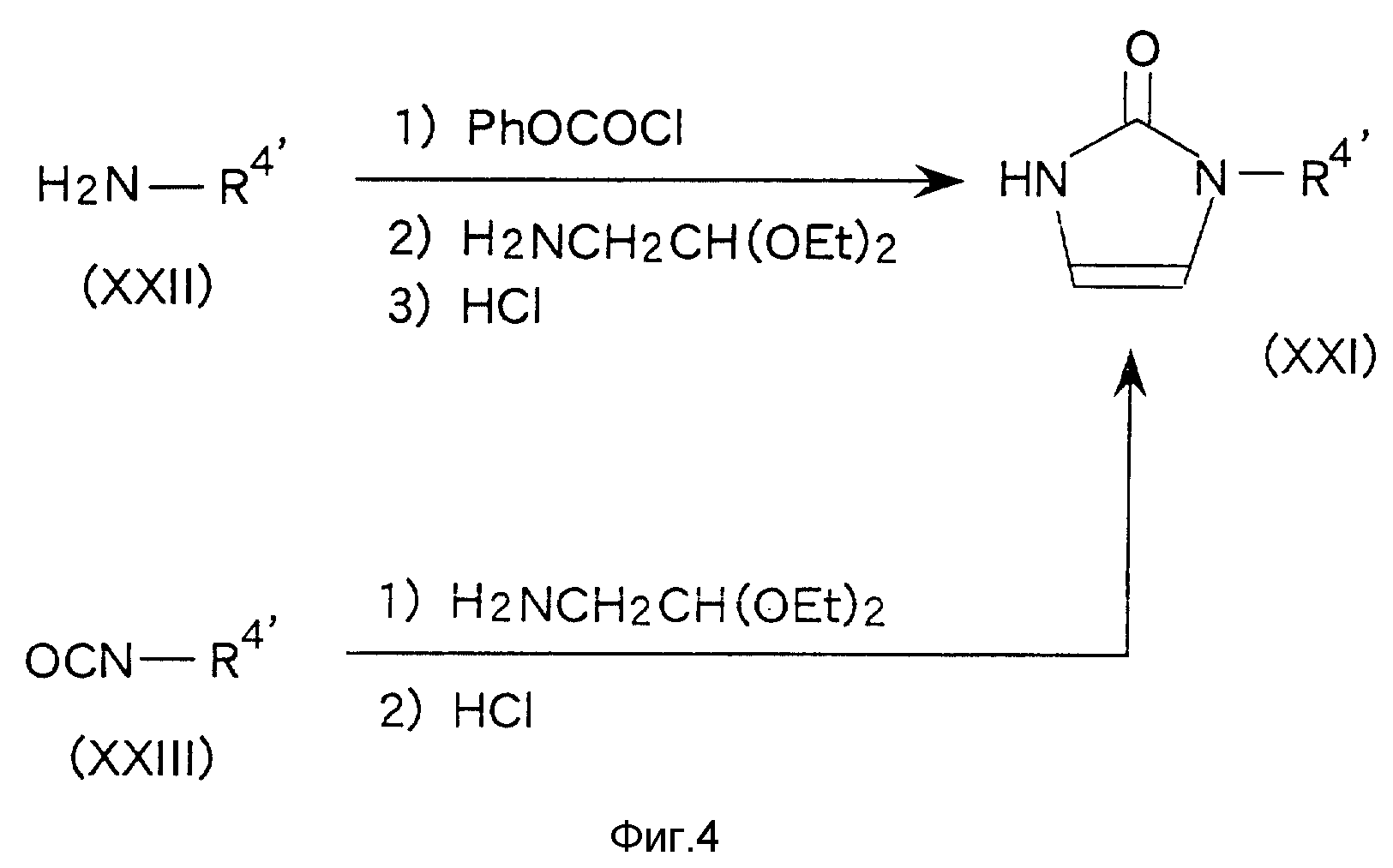
Исходное соединение (XX) по настоящему изобретению, в котором A' обозначает 3-замещенную 2-оксо-2,
3-дигидро-1H-имидазол-1-ильную группу (т.е. соединение (XXI)), можно получить, например, по способу, представленному на схеме фиг. 4,
где R4' является заместителем в
вышеупомянутой
группе, A, а остальные символы имеют вышеуказанное значение.
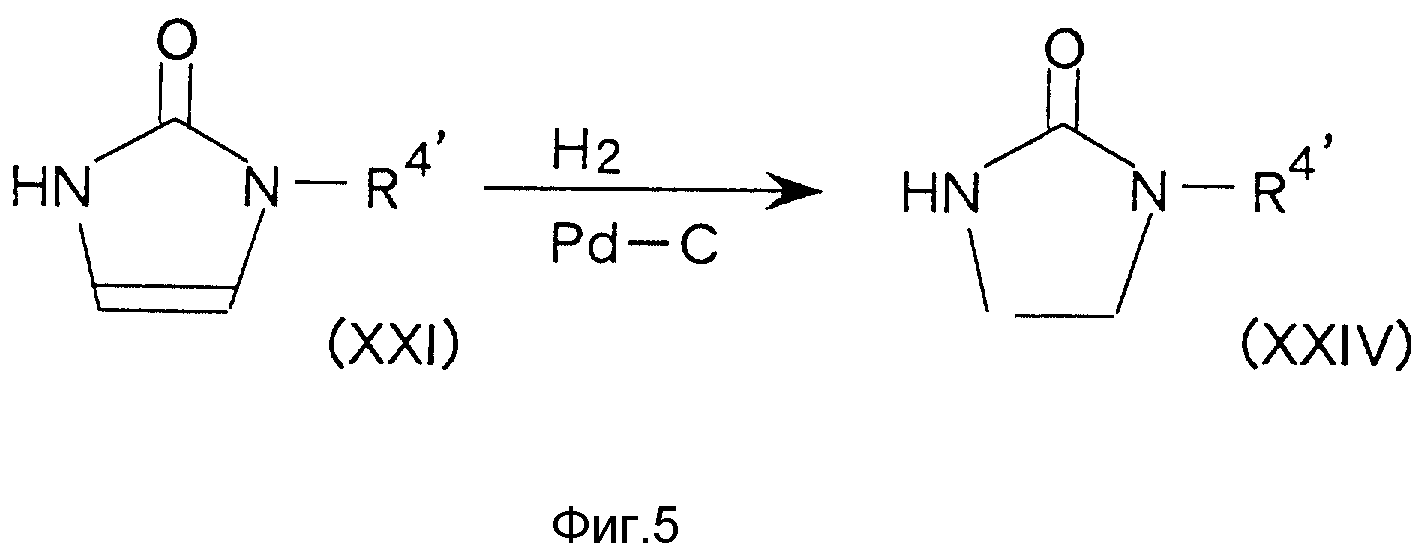
Соединение (V), в котором A обозначает 3-замещенный 2-оксо-1-имидазолидинил (т. е. соединение (XXIV)),
можно получить,
например, по способу, представленному на схеме фиг. 5,
где символы имеют вышеуказанное значение.
Соединение (V), в котором A обозначает 4-замещенный 2,
5-диоксо-1-пиперазинил
(т.е. соединение (XXV)), можно получить, например, по способу, представленному на схеме фиг. 6
где R5' является заместителем в вышеупомянутой группе A, а
остальные символы имеют
вышеуказанное значение.
Соединение (V), в котором A обозначает 4-замещенный 2,3-диоксо-1-пиперазинил (т. е. соединение (XXVIII)), можно получить, например, по
способу, представленному
на схеме фиг. 7,
где символы имеют вышеуказанное значение.
Далее, промежуточное соединение (IX) по настоящему изобретению можно получить, например,
по способу, представленному
на схеме фиг. 8,
где символы имеют вышеуказанное значение.
Вышеуказанные исходные соединения могут быть выделены из реакционной смеси и очищены известными способами, такими как экстракция, концентрирование, нейтрализация, фильтрация, перекристаллизация, колоночная хроматография и тонкослойная хроматография и т.п.
Соединение по настоящему изобретению имеет низкую токсичность и проявляет высокую антигрибковую активность по отношению к широкому спектру микроорганизмов, например, вида Сапо оа (в частности, Candida albicans, Candida utilis, Candida grabrata и т.п.), вида Aspergillus (в частности, Aspergillus niger, Aspergillus fumigatus и т. п. ), вида Cryptococcus (в частности, Cryptococcus neoformansu и т.п.), вида Tricophyton (в частности, Tricophyton rubrum, Tricophyton mantagrophytes и т.п.), вида Microsporum (в частности, Microsporum gypseum и т.п.) и т.д., а потому оно может использоваться для предотвращения или терапии грибковых инфекций (в частности, кандидоза, ретикулоэндотелиарного цитомикоза, криптококкоза, стригущего лишая, микроспорумоза и т. п.) у млекопитающих (например, у человека, домашних животных, домашних птиц и т.д.). Далее, соединения по настоящему изобретению могут также использоваться в сельском хозяйстве в качестве антигрибковых препаратов.
Исходное соединение (VI) для получения соединения (I) по настоящему изобретению, в котором R3 является атомом водорода, также обладает антигрибковой активностью по отношению к вышеуказанным организмам.
При назначении соединения по настоящему изобретению человеку, его безопасно вводить как орально, так и парентерально в виде фармацевтических композиций, таких как препараты для орального назначения (в частности, порошки, гранулы, таблетки, капсулы и т.п.), препараты для парентерального назначения (в частности, инъекции, препараты для наружного назначения (например, для введения через нос или нанесения на кожу), суппозитории (в частности, ректальные или вагинальные) и т.п. в виде смеси с подходящими фармакологически приемлемыми носителями, наполнителями, разбавителями и т.п.
Указанные препараты могут быть приготовлены по способам, которые являются известными и обычно используются в производстве фармацевтических препаратов.
Например, соединение по настоящему изобретению можно вводить в состав инъекций, таких как водные инъекции, вместе с диспергирующими агентами (в частности, Tween 80 (Atlas Powder, США), HC060 (Nikko Chemicals, Япония), карбоксиметилцеллюлозой, альгинатом натрия и т.п.), консервантами (в частности, метилпарабеном, пропилпарабеном, бензиловым спиртом, хлорбутанолом и т. п.), изотоническими средствами (в частности, хлоридом натрия, глицерином, сорбитом, глюкозой и т. п. ), и т.д., или в масляные инъекции, растворяя, суспендируя или эмульгируя его в растительном масле (в частности, оливковом масле, кунжутовом масле, арахисовом масле, хлопковом масле, кукурузном масле и т.д.), пропиленгликоле и т.п.
При приготовлении препаратов для орального назначения соединение по настоящему изобретению формуют под давлением совместно, например, с наполнителями (в частности, лактозой, сахаром, крахмалом и т.п.), разрыхляющими агентами (в частности, крахмалом, карбонатом кальция и т.п.), связующими (в частности, крахмалом, гуммиарабиком, карбоксиметилцеллюлозой, поливинилпирролидоном, гидроксипропилцеллюлозой и т.п.), смазывающими средствами (в частности, тальком, стеаратом магния, полиэтиленгликолем 6000 и т.п.) и т.д. с последующим, если необходимо, нанесением покрытия по известным методам, с целью придания вкуса или для придания препаратам способности выделяться в желудочно-кишечном тракте или же по прошествии некоторого количества времени после приема. Примерами используемых для этих целей соединений являются, например, гидроксипропилметилцеллюлоза, этилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, полиоксиэтиленгликоль, Tween 80, Pluronic F68, фталат ацетата целлюлозы, фталат гидроксипропилметилцеллюлозы, сукцинат ацетата гидроксиметилцеллюлозы Eudragit (Rohm, Германия, сополимер метакриловой и акриловой кислот) и пигменты, такие как оксид титана и красный оксид железа.
При приготовлении препаратов для наружного применения соединение по настоящему изобретению можно также приготовить в виде твердого, полутвердого и жидкого препарата. Например, в случае твердых препаратов соединение по настоящему изобретению используют индивидуально или в смеси с наполнителями (в частности, глюкозой, маннитом, крахмалом, микрокристаллической целлюлозой и т.п.), загустителями (в частности, природными смолами, производными целлюлозы, полимерами акриловой кислоты и т.п.) и т.д. с образованием порошкообразных композиций. В случае полутвердого препарата, предпочтительными являются водные или масляные гели или мази. В случае жидких препаратов продукты представляют собой то же, что и инъекции в виде масляных или водных суспензий. В указанные выше твердые, полутвердые и жидкие препараты можно вводить агенты, корректирующие величину pH (в частности, карбоновую кислоту, фосфорную кислоту, лимонную кислоту, соляную кислоту, едкий натр и т.п.), антисептики (в частности, п-гидроксибензоаты, хлорбутанол, хлорид бензалкония и т. п.) и т.п. Более конкретно они могут использоваться для стерилизации и дезинфекции кожи или слизистых оболочек в виде мази, содержащей, например, приблизительно от 0,1 до 100 мг соединения по настоящему изобретению на грамм с использованием в качестве основного компонента вазелина или ланолина.
В случае суппозиторий соединение по настоящему изобретению можно ввести в масляные или водные основы для получения твердых, полутвердых или жидких суппозиторий. Примерами масляных основ, используемых для этих целей, являются глицериды жирных кислот (в частности, масло какао, Witpsols (Dynamite - Nobel) и т. п.), средние жирные кислоты (в частности, Migriols (Dynamite - Nobel) и т. п.), растительные масла (в частности, кунжутовое масло, соевое масло, хлопковое масло и т.д.) и т.п. Примерами жидких основ являются полиэтиленгликоли, пропиленгликоли и т.д., а в качестве основ водных гелей используют натуральные смолы, производные целлюлозы, виниловые полимеры, полимеры акриловой кислоты и т.д.
Хотя доза соединения по настоящему изобретению может меняться в зависимости от состояния инфекции, пути назначения и т.д., она может составлять для взрослого пациента (с весом тела 50 кг) для терапии candidiasis, например, для орального назначения приблизительно от 0,1 до 100 мг/кг в день, предпочтительно приблизительно от 0,1 до 50 мг/кг и более, предпочтительно приблизительно от 0,1 до 20 мг/кг в день.
Если соединение по настоящему изобретению используют в сельском хозяйстве, в качестве антигрибкового средства, его растворяют или диспергируют в жидком носителе (в частности, растворителе), или смешивают, или наносят на подходящий твердый носитель (в частности, разбавитель или наполнитель) с последующим, если необходимо, добавлением эмульгатора, диспергатора, распределителя, агента, улучшающего проникающую способность, увлажнителя, загустителя, стабилизатора и т.п. с образованием препарата, такого как эмульсия, способного гидратироваться средства, порошка, гранул и т.п. Указанные препараты могут быть получены известными способами. Количество соединения по настоящему изобретению составляет, например, при действии на заболевания риса, приблизительно от 25 до 150 г, преимущественно приблизительно от 40 до 80 г на один акр орошаемого рисового поля.
Примерами жидких носителей являются вода, спирты (в частности, метиловый спирт, этиловый спирт, н-пропиловый спирт, изо-пропиловый спирт, этиленгликоль и т.д.), простые эфиры (в частности, диоксан, тетрагидрофуран т.д.), алифатические углеводороды (в частности, керосин, ламповое масло, топочный мазут и т.д.), ароматические углеводороды (в частности, бензол, толуол и т. д. ), галогензамещенные углеводороды (в частности, хлористый метилен, хлороформ и т.п.), амиды кислот (в частности, диметилформамид, диметилацетамид и т. п.), сложные эфиры (в частности, этилацетат, бутилацетат и т.п.), нитрилы (в частности, ацетонитрил, пропионитрил и т.д.), и т.п. Они могут использоваться как индивидуально, так и в смеси между собой в подходящей пропорции.
Примерами твердых носителей являются растительные порошки (в частности, соевый порошок, табачный порошок, пыльца кукурузы и т.д.), минеральные порошки (в частности, каолин, бентонит и т.д.), глинозем, порошок серы, активированный уголь и т. п. Они могут использоваться как индивидуально, так и в смеси между собой в подходящей пропорции.
Примеры
Настоящее изобретение поясняется далее следующими справочными примерами, рабочими примерами и примерами препаратов. Однако настоящее
изобретение не ограничивается этими примерами.
Спектры1H-ЯМР (ПМР) измерены на спектрометре Varian Cemini тип 200 (200 МГц) с использованием тетраметилсилана в качестве внутреннего стандарта. Все значения по шкале дельта приведены в миллионных долях (м.д.). При использовании смесей растворителей цифры, приведенные в круглых скобках, обозначают относительные содержания каждого растворителя в смеси. Если специально не оговаривается, символ % означает весовой процент. При проведении хроматографии на силикагеле отношение растворителей обозначает смеси растворителей по объему.
Символы, приведенные в
примерах, имеют следующее значение:
с: синглет, д: дублет, т: триплет, кв: квартет, дд: дублет дублетов, тт: триплет триплетов,
м: мультиплет, квинтет: квинтет, септет: септет, шир: широкий;
J: константа взаимодействия.
Справочный пример 1
2-(2,4-Дифторфенил)-2-/(1R)-1-(3,4,5,
6-тетрагидро-2H-пиран-2- ил)оксиэтил/оксиран (82 г) (получают по способу, приведенному в
выложенной заявке Японии Hei-04/74168) и 6,3 г п-толуолсульфоната пиридиния растворяют в этаноле и полученный
раствор перемешивают в течение часа при температуре 55oC. Смесь упаривают при
пониженном давлении. Остаток растворяют в 1 л этилацетата и полученный раствор промывают водой (2 х 200 мл).
Водный слой экстрагируют этилацетатом (2 х 100 мл). Органические вытяжки объединяют,
промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и растворитель упаривают при пониженном
давлении. Остаток очищают хроматографией на силикагеле (элюент: гексан/этилацетат =
от 10/1 к 8/1 и далее к 3/1), получая 31,5 г (1R)-1-/2-(2,4-дифиорфенил)-2-оксиранил/этанола в виде масла
бледно-желтого цвета.
Спектр ПМР (хлороформ-d) δ: 1,14 - 1,23 (3H, м), 1,77, 2,22 (1H), 2,80, 2,92 (1H), 3,27 - 3,32 (1H), 4,00 - 4,20 (1H, м), 6,75 - 6,94 (2H, м), 7,36 - 7,48 (1H, м).
Справочный пример 2
(1R)-1-/2-(2,
4-Дифторфенил)-2-оксиранил/этанол (31,5 г) и 40 г 3,5-динитробензоилхлорида растворяют в 500 мл хлористого метилена и при охлаждении
в бане со льдом по каплям добавляют к полученной смеси 24,1 мл
триэтиламина. Реакционную смесь перемешивают при комнатной температуре в течение 3,5 час, промывают 150 мл воды, а затем 150 мл 5%-ного
водного раствора бикарбоната натрия, сушат над сульфатом магния
и упаривают при пониженном давлении. Выделившиеся кристаллы отфильтровывают и промывают хлористым метиленом. Маточник и промывной
раствор объединяют и растворитель отгоняют при пониженном давлении, к
остатку приливают 25 мл этилацетата и 300 мл метанола и полученную смесь охлаждают в бане со льдом. Выделившиеся кристаллы
отфильтровывают и перекристаллизовывают из смеси 25 мл этилацетата и 250 мл
метанола, получая 27,7 г /(1R)-1-/(2R)-2-(2,4-дифторфенил)-2-оксиранил/этил/-3,5- динитробензоата в виде бесцветных игл с
т.п. 104 - 1,7oC (после перекристаллизации из смеси
этилацетатгексан).
Спектр ПМР (хлороформ-d) δ: 1,46 (3H, дд, J = 6,6 Гц, J = 1,2 Гц), 3,01 (1H, д, J = 4,6 Гц), 3, 23 (1H, д, J = 4,6 Гц), 5,33 (1H, кв, J = 6,6 Гц), 6,85 - 7,07 (2H, м), 7,54 (1H, м), 9,13 (2H, д, J = 2,2 Гц), 9,25 (1H, т, J = 2,2 Гц).
Справочный пример 3
(1R)-1-/(2R)-2-(2,4-дифторфенил)-2-оксиранил/этил/-3,5- динитробензоат (50 г)
растворяют в двух литрах метанолах и при комнатной температуре, добавляют к полученному раствору по каплям 255 мл 1 N
раствора едкого натра. Реакционную смесь перемешивают при комнатной температуре в
течение часа и нейтрализуют, добавляя 127 мл 1 N раствора соляной кислоты. Метанол отгоняют при пониженном давлении, а
затем к полученному остатку добавляют один литр этилацетата и 200 мл воды и
экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором хлорида натрия, сушат над
сульфатом магния и растворитель упаривают при пониженном давлении. Остаток очищают
хроматографией на силикагеле (элюент: этилацетат/гексан = 1/3) и получают 25 г (1R)-1-/(2R)-2-(2,
4-дифторфенил)-2-оксиранил/этанола в виде масла бледно-желтого цвета.
Спектр ПМР (хлороформ-d) δ: 1,17 (3H, дд, J = 6,6 Гц, J = 1,2 Гц), 2,05 (1H, шир), 2,80 (1H, д, J = 5,2 Гц), 3,30 (1H, д, J = 5,2 Гц), 4,01 - 4,17 (1H, м), 6,75 - 6,93 (2H, м), 7,36 - 7,48 (1H, м).
Справочный пример 4
К раствору 16,1 г (1R)-1-/(2R)-2-(2,
4-дифторфенил)-2-оксиранил/этанола в 320 мл тетрагидрофурана добавляют при охлаждении в бане со льдом 63,3 г
трифенилфосфина, 29,5 г бензойной кислоты и 42,0 г диэтилового эфира азодикарбоновой
кислоты и перемешивают смесь при комнатной температуры в атмосфере аргона в течение 6 час. Приливают в смеси 800
мл этилацетата и 500 мл воды и водный слой дополнительно экстрагируют 200 мл
этилацетата. Органические вытяжки объединяют, последовательно промывают водой и насыщенным раствором хлорида натрия, сушат
над сульфатом магния и растворитель упаривают. Остаток очищают хроматографией
на силикагеле (элюент: гексан/этилацетат = от 15/1 до 7/1), получая 19,2 г /(1S)-1-/(2R)-2-(2,
4-дифторфенил)-2-оксиранил/этил/бензоата в виде бесцветного масла.
Спектр ПМР (хлороформ-d) δ: 1,37 (3H, д, J = 6,6 Гц), 2,90 (1H, д, J = 5,2 Гц), 3,28 (1H, д, J = 5,2 Гц), 5, 36 (1H, кв, J = 6,6 Гц), 6,74 - 6,94 (2H, м), 7,38 - 7,60 (4H, м), 7,94 - 7,01 (2H, м).
ИК-спектр (пленка) νmaxсм-1 : 1725, 1615, 1600, 1505, 1450, 1425.
/(1S)-1-/(2R)-2-(2,4-дифторфенил)-2-оксиранил/этил/бензоат (15,9 г) растворяют в 800 мл метанола и при охлаждении льдом приливают к полученной смеси 12,9 мл 28%-ного раствора метилата натрия в метаноле. Реакционную смесь перемешивают при комнатной температуре в течение шести часов. Добавляют к реакционной смеси 63,2 мл 1N раствора соляной кислоты и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: гексан/этилацетат = от 6/1 до 2/1) и получают 9,7 г (1S)-1-/(2R)-2-(2,4-дифторфенил)-2-оксиранил/этанола в виде бесцветного масла.
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, дд, J = 6,4 Гц, J = 2,2 Гц), 2,24 (1H, д, J = 1 Гц), 2,92 (1H, д, J = 5 Гц), 3,28 (1H, д, J = 5 Гц), 4,12 (1H, кв, J = 6,4 Гц), 6,77 - 6,95 (2H, м), 7,34 (1H, м).
ИК-спектр (пленка) νmaxсм-1 : 3420, 2980, 1615, 1600, 1500, 1425.
Справочный пример 5
2,4-Дифторанилин (25 г) и 25,2 пиридина растворяют в 200 мл дихлорметана и при
охлаждении в бане со льдом добавляют к полученной смеси по каплям 33,3 г фенилхлорформиата. Реакционную смесь
перемешивают при охлаждении в бане со льдом в течение 30 минут, промывают водой и сушат.
Растворитель отгоняют, получая смесь фенил-2,4-дифторфенилкарбамата и пиридина. Добавляют 30,7 г
2-(диэтокси)этиламина и перемешивают полученную смесь при комнатной температуре. Выпавшие кристаллы
отделяют фильтрованием и промывают петролейным эфиром, получая 37,8 г N-(2,2-диэтоксиэтил)-N'-(2,
4-дифторфенил)мочевины в виде бесцветных кристаллов.
Полученное производное мочевины (37,5 г) растворяют в смеси 560 мл метанола и 280 мл воды, к полученной смеси добавляют 300 мл 0, 48 М раствора соляной кислоты и перемешивают при комнатной температуре в течение трех дней. Упаривают смесь при пониженном давлении и выпавшие кристаллы отделяют и промывают смесью воды и метанола (5:1), получая 22,8 г 1-(2,4-дифторфенил)-2-(1H, 3H)-имидазолана в виде бесцветного порошка с т.пл. 192-194oC.
Элементный анализ для C9H6F2
N2O:
вычислено (%): C 55,11, H 3,08, N 14,28
найдено (%): C 55,14, H 3,
29, N 14,18.
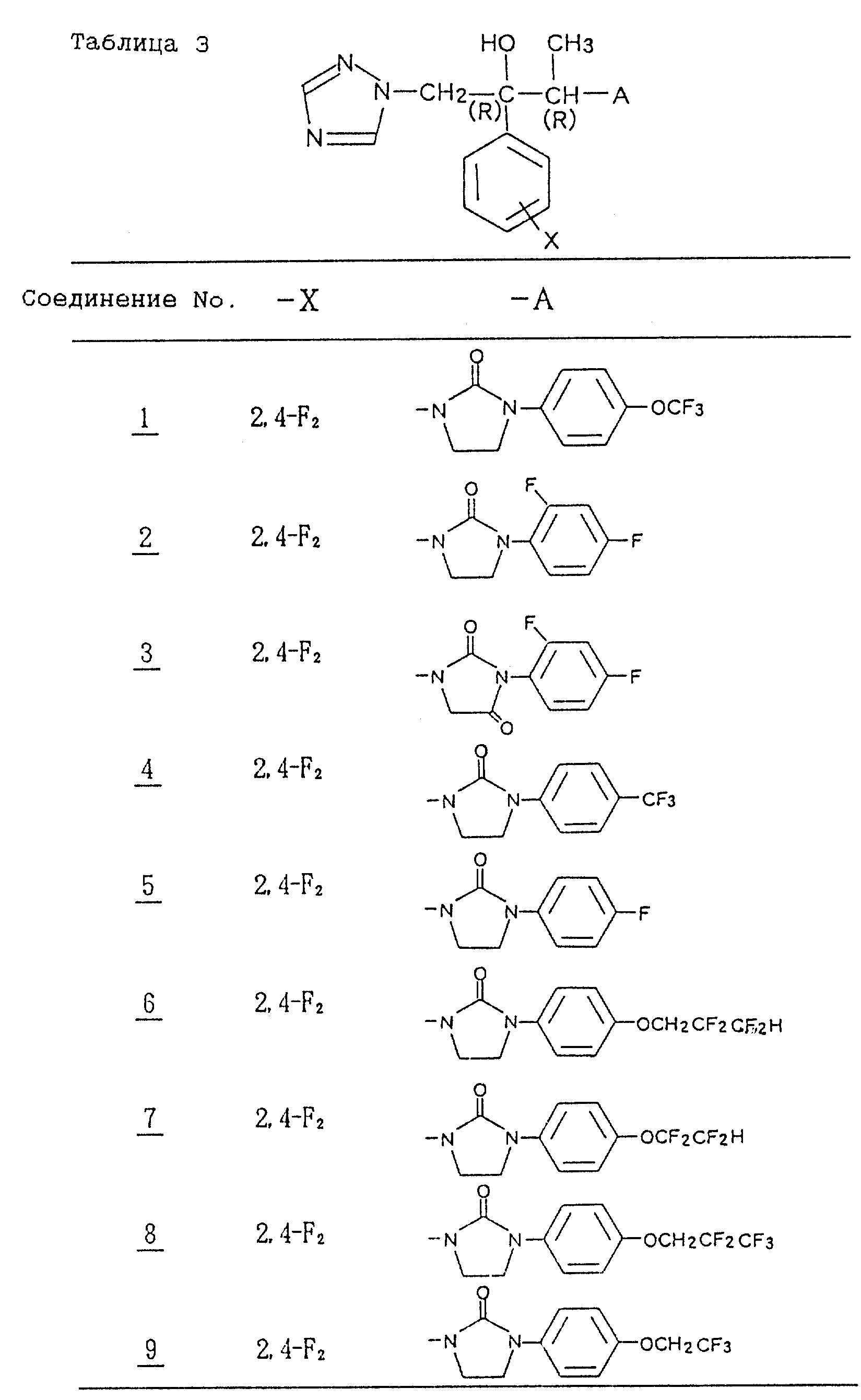
Справочные примеры 6-13
Аналогично методике, приведенной в
справочном примере 5, получают производные имидазолона, приведенные в таблице 1 (табл. 1-9 см. в конце
описания).
Справочный пример 14
Фенил-2,4-дифторфенилкарбамат (5,0 г)
и 4,2 г гидрохлорида этилового эфира глицина растворяют в 30 мл пиридина и нагревают раствор при
температуре 80oC в течение 1 часа. Реакционную смесь упаривают при пониженном давлении и к
остатку добавляют 80 мл этилацетата и 20 мл воды. Слой этилацетата промывают 10 мл водного
раствора хлорида натрия, сушат над сульфатом магния и упаривают при пониженном давлении. К остатку приливают
гексан (50 мл) и выделившееся твердое вещество отфильтровывают, получая 4,58 г N-(2,
4-дифторфенил)-N'-этоксикарбонилметилмочевины в виде бесцветного порошка.
Спектр ПМР (хлороформ-d) δ: 1,29 (3H, т, J = 7 Гц), 4,07 (2H, д, J = 5,4 Гц), 4,24 (2H, кв. , J = 7 Гц), 5,57 (1H, шир), 6,75-6,90 (3H, м), 7,84 - 7,98 (1H, м).
Полученный продукт (4,1 г) растворяют в 80 мл метанола, добавляют 3,0 г 28%-ного раствора метоксида натрия в метаноле и перемешивают при комнатной температуре в течение 2,5 час. К реакционной смеси приливают 15 мг 1 N раствора соляной кислоты и полученную смесь упаривают при пониженном давлении, а затем добавляют 20 мл воды. Смесь экстрагируют 80 мл этилацетата. Экстракт последовательно промывают 20 мл воды и 20 мл насыщенного водного раствора соли и сушат над сульфатом магния, а затем растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из диэтилового эфира и получают 1,0 г 3-(2,4-дифторфенил)2, 4-имидазолидиндиона в виде бесцветного порошка с т.пл. 161-170oC.
Спектр ПМР (хлороформ-d) δ: 4,20 (2H, с), 5,90 (1H, шир), 6,95 - 7,10 (2H, м), 7,25 - 7,40 (1H, м).
Справочный пример 15
1-/(4-(2,2,3,
3-Тетрафторпропокси)фенил/-2-(1H, 3H)-2-имидазола (2,0 г) растворяют в 10 мл уксусной кислоты, добавляют 0,5 г 10%-ного палладия на
угле и полученную смесь перемешивают в атмосфере водорода в течение
7,5 час. Катализатор отфильтровывают и промывают уксусной кислотой. Фильтрат и промывочный раствор объединяют и упаривают при
пониженном давлении. К остатку добавляют 40 мл воды и этилацетат,
органический слой отделяют, сушат (над сульфатом магния) и упаривают при пониженном давлении. Полученные бесцветные кристаллы
промывают ди-изо-пропиловым эфиром и получают 1,86 г 1-/(4-(2,2,3,
3-тетрафторпропокси)фенил/-2-имидазолидинона в виде бесцветных кристаллов с т.пл. 180-181oC.
Спектр ПМР (хлороформ-d) δ: : 3,53 - 3,61 (2H, м), 3,87 - 3,95 (2H, м), 4,32 (2H, тт, J = 11,8 Гц, J = 1,6 Гц), 4,97 (1H, шир), 6,06 (1H, тт, J = 53, J = 5,0 Гц), 6,91 (2H, J = 9,2 Гц), 7,47 (2H, д, J = 9,2 Гц).
ИК-спектр (KBr) νmax : 3250, 1705, 1680, 1515, 1485 см-1.
Элементный анализ для C12H12F4N2O2:
вычислено (%): C 49,32, H 4,14, N 9,
59
найдено (%): C 49,24, H 3,96, N 9,59.
Справочные примеры 16-19
Аналогично методике,
приведенной в справочном примере 15, получают имидазолидиноны, приведенные в
таблице 2.
Справочный пример 20
Ди-изо-пропилэтиламин (0,51 мл) добавляют к раствору 535 мг
(1S)-1-/(2R)-2-(2,4-дифторфенил)-2-оксиранил/этанола в 15 мл дихлорметана при
температуре минус 78oC в атмосфере азота, а затем по каплям 0,49 мл ангидрида трифторметансульфоновой кислоты
в течение трех минут. Полученную смесь перемешивают при температуре минус
78oC в течение 20 минут, а затем в течение 20 минут при температуре минус 20oC, и реакционную смесь при
температуре минус 10oC упаривают приблизительно до объема 9 мл.
Концентрированный раствор подвергают испарительной колоночной хроматографии на силикагеле (3,2 х 4 см), элюируя смесью
дихлорметан-гексан (1:1). Фракции, содержащие продукт, упаривают до объема
приблизительно 3 мл. Полученный остаток добавляют при температуре минус 10oC к раствору натриевой соли
1-(4-фторфторметилфенил)-2(1H, 3H)-имидазолона, полученного из 606 мг
1-(4-трифторметилфенил)-2 (1H, 3H)-имидазолона, 3 мл диметилформамида и 85 мг 60%-ной суспензии гидрида натрия в масле, и
перемешивают смесь в течение десяти минут. Перемешивают в течение 20 минут при
температуре 0oC. К смеси добавляют воду (30 мл) и экстрагируют четыре раза по 30 мл этилацетатом.
Органические вытяжки последовательно промывают дважды по 20 мл водой и один раз насыщенным
водным раствором соли, сушат над сульфатом магния. Растворитель отгоняют при пониженном давлении и получают
маслянистый продукт. Его очищают хроматографией на силикагеле (элюент: гексан/этилацетат =
от 3/1 к 2/1 и далее до 1/1) и получают 362 мг 1-/(1R, 2S)-2-(2,4-дифторфенил)-2,
3-эпокси-1-метилпропил/-3-(4- трифторметилфенил)-2 (1H, 3H)- имидазолона и 209 мг (2R)-2-(2,
4-дифторфенил)-2-/(1R)-1-/(1-(4-трифторметилфенил)-2-имидазоилокси /этил/оксирана.
1-/(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил/-3-(4-трифторметилфенил)-2(1H; 3H)-имидазолон: бесцветные призмы с т.пл. 135-136oC.
Спектр ПМР (хлороформ-d) δ: 1, 37 (3H, д, J = 7,2 Гц), 2,72 (1H, д, J = 4,4 Гц), 2,82 (1H, д, J = 4,4 Гц), 5,09 (1H, кв, J = 7,2 Гц), 6,50 (1H, д, J = 3,2 Гц), 6,64 (1H, д, J = 3,2 Гц), 6,80 - 6,97 (2H, м), 7,35 - 7,50 (1H, м), 7, 69 (2H, д, J = 8,4 Гц), 7,82 (2H, д, J = 8,4 Гц). 60%-ный гидрид натрия в масле (65 мг) диспергируют в 4 мл диметилформамида и при охлаждении на бане со льдом добавляют 118 мг 1,2,4-триазола. Полученную смесь перемешивают при комнатной температуре в течение десяти минут и добавляют к ней раствор 362 мг 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]-3-(4-трифторметилфенил) -2(1H, 3H)-имидазолона, полученного ранее в 2 мл диметилформамида и полученную смесь нагревают в течение пяти часов при температуре 50oC. После охлаждения к реакционной смеси добавляют 8 мл холодной воды и 40 мл этилацетата, а затем водный слой дополнительно дважды экстрагируют этилацетатом. Органические вытяжки объединяют, последовательно промывают дважды водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: этилацетат/гексан = от 1/1 до 2/1 и далее чистым этилацетатом), получая 350 мг 1-[(1R, 2S)-2-(2, 4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3- (4-трифторметилфенил)-2(1H, 3H)-имидазолона в виде бесцветного порошка.
Спектр ПМР (хлороформ-d) δ: 1,21 (3H, д, J = 7,2 Гц), 4,19 (1H, д, J = 14,2 Гц), 5,00 (1H, д, J = 14,2 Гц), 5,11 (1H, д, J = 14,2 Гц), 5,46 (1H, с), 6,71 (1H, д, J = 3,2 Гц), 6,83 (1H, д, J = 3,2 Гц), 6,72 - 6,90 (2H, м), 7,40 - 7,56 (1H, м), 7,72 (2H, д, J = 8,4 Гц), 7,75 (1H, с), 7,83 (2H, д, J = 8,4 Гц), 7,84 (1H, с).
ИК-спектр (пленка) νmax см-1: 3404, 3383, 3000, 1693, 1618, 1599, 1524, 1500, 1429, 1327.
Элементный анализ для C22H18F5N5O2:
вычислено (%): C 55,12,
H 3,78, N 14,61
найдено
(%): C 54,81, H 3,97, N 14,39.
Справочные примеры 21 - 23
Следующие соединения получают аналогично методике, приведенной в справочном
примере 20.
Справочный
пример 21
1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4- триазол-1-ил)пропил]-3-(2,4-дифторфенил)-2(1H,3H)-имидазолон
Бесцветный кристаллический порошок: выход 416
мг (66%), т.пл. 134 - 136oC.
Спектр ПМР (хлороформ-d) δ: 1,21 (3H, д, J=7 Гц), 4,19 (1H, д, J=14,4 Гц), 4,95 (1H, кв, J=7 Гц), 5,11 (1H, д, J=14,4 Гц), 5,52 (1H, шир.), 6,52 (1H, т, J= 2,6 Гц), 6,70 - 6,86 (3H, м), 6,92 - 7,06 (2H, м), 7,40 - 7,68 (2H, м), 7,74 (1H, с), 7,85 (1H, с).
Справочный
пример 22
1[(1R, 2R)-2-(2,
4-Дифторфенил)-2-гидрокси-1-метил-3(1H-1,2,4- триазол-1-ил)пропил]-3-(4-трифторметоксифенил)-2(1H,3H)-имидазолон
Бесцветный кристаллический порошок, выход
500 мг (71%).
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J=7 Гц), 4,19 (1H, д, J=14,4 Гц), 4,97 (1H, кв, J=7 Гц), 5,10 (1H, д, J=14,4 Гц), 5,51 (1H, шир), 6,39 (1H, д, J=3,2 Гц), 6,64 (1H, д, J=3,2 Гц), 6,70 - 6,86 (2H, м), 7,31 (2H, д, J= 9 Гц), 7,38 - 7,54 (1H, м), 7,69 (2H, д, J=9 Гц), 7,74 (1H, с), 7,84 (1H, с).
Справочный пример 23
1-[(1R,
2R)-2-(2,
4-Дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил]-3-(4-фторфенил)-2-(1H,3H)-имидазолон
Бесцветный кристаллический порошок, выход 971 мг (74%).
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J=7 Гц), 4,20 (1H, д, J=14,2 Гц), 4,95 (1H, кв, J=7 Гц), 5,10 (1H, д, J=14,2 Гц), 5,58 (1H, шир), 6,60 (1H, д, J=3,2 Гц), 6,74 (1H, д, J=3,2 Гц), 6,70 - 6,88 (2H, м), 7,05 - 7,20 (2H, м), 7,40 - 7,65 (2H, м), 7,73 (1H, с), 7,85 (1H, с).
Справочный пример 24
К раствору (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола в
30 мл
дихлорметана при температуре минус 60oC в атмосфере азота добавляют 1,31 мл ди-изо-пропиламина, а затем по каплям 1,26 мл ангидрида трифторметансульфоновой кислоты в течение трех
минут.
Полученную смесь перемешивают при температуре минус 60oC в течение 20 минут, а затем в течение 20 минут при температуре минут 20oC. Реакционную смесь подвергают
испарительной
колоночной хроматографии на силикагеле, взяв 27 г силикагеля, и элюируют смесью дихлорметангексан (1: 1). Фракции, содержащие продукт, упаривают до объема приблизительно 9 мл, и
полученный остаток
добавляют при температуре минус 10oC к смеси 1,15 г 3-(2,4-дифторфенил)-2,4- имидазолидиндиона, 18 мл диметилформамида и 0,20 г 60%-ной суспензии гидрида натрия в масле.
Полученную смесь
перемешивают в течение двадцати минут при температуре 0oC. К смеси добавляют воду (20 мл) и экстрагируют 100 мл этилацетата. Органические вытяжки промывают 20 мл
насыщенного водного
раствора хлорида натрия, сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент; гексан/этилацетат = 2/1)
и получают 1,25 г
1-[(1R,2R)-2-(2,4- дифторфенил)2,3-эпокси-1-метилпропил]-3-(2,4-дифторфенил)-2,4- имидазолидиндион в виде твердого вещества белого цвета с т.пл. 124 - 125oC
(перекристаллизовывают из смеси
этилацетат/гексан).
Спектр ПМР (хлороформ-d) δ: 1,30 (3H, д, J=7,2 Гц), 2,81 (1H, д, J=4,6 Гц), 3,08 (1H, д, J=4,6 Гц), 4,06 (1H, д, J=17,8 Гц), 4,22 (1H, д, J=17,8 Гц), 4,97 (1H, кв, J=7,2 Гц), 6,78 - 7,04 (4H, м), 7,20 - 7,45 (2H, м).
Справочные примеры 25 - 29
Следующие соединения получают аналогично методике,
приведенной в справочном примере
24.
Справочный пример 25
1-[(1H,2S)-2-(2,4-Дифторфенил)2,3-эпокси-1-метилпропил)-3-[4,- (2,2,3,
3-тетрафторпропокси)фенил]-2-имидазолидинон
Бесцветный кристаллический
порошок.
Спектр ПМР (хлороформ-d) δ: 1,21 (3H, д, J=7,2 Гц) 2,75 (1H, д, J=7,0 Гц), 3,15 (1H, д, J=7,0 Гц), 3,42 - 3,64 (2H, м), 3,71 - 3,81 (2H м), 4,32 (2H, тт, J=12 Гц, J=1, 4 Гц), 4,80 (1H, кв, J=7,2 Гц), 6,06 (1H, тт, J=53 Гц, J= 5 Гц), 6,76 - 6,9 (2H, м), 6,91 (2H, д, J=9,2 Гц), 7,35 - 7,5 (1H, м), 7,48 (2H, д, J=9,2 Гц).
Справочный пример 26
1-[(1R, 2S)-2-(2,4-Дифторфенил)2,3-эпокси-1-метилпропил] -3- [4-(1,1,2,2-тетрафторпропокси)фенил]-2-имидазолидинон
Бесцветный кристаллический порошок.
Спектр ПМР (хлороформ-d) δ: 1,22 (3H, д, J=7,4 Гц), 2,75 (1H, д, J=5 Гц), 3,14 (1H, д, J=5 Гц), 3,44 - 3,65 (2H, м), 3,73 - 3,84 (2H, м), 4,80 (1H, кв, J=7,4 Гц), 5,89 (1H, тт, J=53 Гц, J=2,8 Гц), 6,77 - 6,93 (2H, м), 7,17 (2H, д, J=9 Гц), 7,46 - 7,34 (1H, м), 7,55 (2Н, д, J=9 Гц).
ИК-спектр (KBr) νmax: 1680, 1615, 1510, 1485, 1425 см-1
Справочный пример 27
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] -3- [4-(2,2,3,3,
3-пентафторпропокси)фенил]-2-имидазолидинон.
Бесцветный призмы, т. пл. 142 - 144oC (перекристаллизовывают из смеси этилацетат - гексан).
Спектр ПМР (хлороформ-d) δ: 1,22 (3H, д, J=7 Гц), 2,75 (1H, д, J=5,0 Гц), 3,15 (1H, д, J=5,0 Гц), 3,42 - 3,61 (2H, м), 3,73 - 3,82 (2H, м), 4,39 (2H, дт, J=12,4 Гц, J=1,2 Гц), 4,80 (1H, кв, J=7 Гц), 6,77 - 6,90 (2H, м), 6,92 (2H, д, J=9,2 Гц), 7,34 - 7,42 (1H, м), 7,48 (2H, д, J=9,2 Гц).
Элементный анализ для C22H19N2O3:
вычислено
(%): C 53,66, H 3,89, N 5,69
найдено (%): C 53,37, H 3,74, N 5,62,
ИК-спектр (KBr) νmax : 1700, 1520, 1485, 1430, 1265 см-1.
Справочный
пример 28
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] -3-[4-(2,
2,2-трифторэтокси)фенил]-2-имидазолидинон
Бесцветный иглы, т.пл. 131 - 132oC
(перекристаллизовывают из эфира).
Спектр ПМР (хлороформ-d) δ: 1,21 (3H, д, J=7, 2 Гц), 2,75 (1H, д, J=5 Гц), 3,15 (1H, д, J=5 Гц), 3,42 - 3,64 (2H, м), 3,73 - 3,82 (2H, м), 4, 32 (2H, кв. J=8,2 Гц), 4,80 (1H, кв, J=7,2 Гц), 6,77 - 6,88 (2H, м), 6,92 (2H, м, J=9 Гц), 7,34 - 7,44 (1H, м), 7,48 (2H, д, J=9 Гц).
Элементный анализ для C21H19F5N2O3:
вычислено (%): C 57,02, H 4,33, N 6,33
найдено (%): C 57,33, H 4,06, N 6,39
ИК-спектр (KBr) νmax : 1695,
1515, 1485, 1425, 1265, 1240 см-1.
Справочный пример 29
1-(4-Хлорфенил)-3-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-2-имидазолидинон
Бесцветный иглы, т.пл. 130 - 131oC (перекристаллизовывают из смеси этилацетат
- гексан).
Спектр ПМР (хлороформ-d) δ: 1,22 (3H, д, J=7 Гц), 2,75 (1H, д, J=5 Гц), 3, 14 (1H, д, J=5 Гц), 3,43 - 3,65 (2H, м), 3,73 - 3,82 (2H, м), 4,80 (1H, кв, J=7 Гц) 6,77 - 6,93 (2H, м), 7,28 (2H, д, J=9 Гц), 7,34 - 7,54 (1H, м), 7,49 (2H, д, J=9 Гц).
Элементный
анализ для C19H17ClF2N2O2:
вычислено (%): C 60,24, H 4,52, N 7,40
найдено (%): C 60,45, H 4,38, N 7,45
ИК-спектр
(KBr) νmax : 1700, 1615, 1600, 1500, 1425, 1270 см-1.
Справочный пример 30
Смесь 8,6 г 4-(2,2,3,3-тетрафторпропокси)анилина, 4,8 г этилового
эфира хлоруксусной кислоты, 4,8 г бикарбоната натрия, 3,0 г йодида натрия и 300 мл ацетона
кипятят с обратным холодильником в течение 21 час. Растворитель отгоняют при пониженном давлении, к остатку
приливают 200 мл ледяной воды и 200 дихлорметана. Дихлорметановый слой отделяют, промывают
водой, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на
колонке с силикагелем (элюируют смесь этилацетат:гексан 1: 3 об/об) и получают 9,4 г
N-этоксикарбонилметил-4-(2,2,3,3-тетрафторпропокси)анилин в виде кристаллов бледно-желтого цвета.
К смеси 2,1 г полученного N-этоксикарбонилметил-4-(2,2,3,3-тетрафторпропокси)анилина, 1,1 мл триэтиламина и 50 мл дихлорметана при охлаждении в бане со льдом добавляют по каплям раствор 0,6 мл хлорацетилхлорида в 6 мл дихлорметана и полученную смесь перемешивают при комнатной температуре в течение пяти часов. К полученному раствору приливают 50 мл дихлорметана и 100 мл ледяной воды. Органический слой отделяют, промывают водой, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на колонке с силикагелем (элюируют смесь этилацетат:гексан [1: 2 об/об] ) и получают 2,4 г N-хлорацетил-N-этоксикарбонилметил-4-(2,2,3, 3-тетрафторпропокси)анилин в виде кристаллов бледно-желтого цвета.
Полученный N-хлорацетил-N-этоксикарбонилметил-4-(2,2,3,3-тетрафторпропокси) анилин (1,9 г) растворяют в 20 мл 10, 5%-ного раствора аммиака в этаноле и перемешивают раствор в течение четырех часов при температуре 60oC. Охлаждают, выпавшие из раствора кристаллы отфильтровывают и промывают охлажденным этанолом, получая 1,5 г 1-[4-(2,2,3,3-тетрафторпропокси)фенил]-2,5-пиперазиндиона в виде бесцветных кристаллов.
Спектр ПМР (ДМСО-d6) δ: 3,95 (2H, с), 4,20 (2H, с), 4, 60 (2H, т, J = 14 Гц), 6,67 (1H, тт, J = 52 Гц, 5,4 Гц), 7,08 (2H, д, J = 9 Гц), 7,30 (2H, д, J = 9 Гц), 8,27 (1H, шир).
Элементный анализ для C13H12F4
N2O3:
вычислено (%): C 48,76, H 3,78, N 8,75
найдено
(%): C 48,99, H 3,65, N 8,88
ВИМС (МН+): 321
ИК-спектр (KBr) νmax: 3440, 3250, 1670, 1650, 1510, 1330 см-1.
Справочный
пример 31
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] -4- [4-(2,2,3,
3-тетрафторпропокси)фенил] -2,5-пиперазиндион получают аналогично методике, приведенной в справочном примере
24.
Бесцветное кристаллическое вещество, т.пл. 155-156oC. Из смеси этилацетат-гексан.
Спектр ПМР (хлороформ-d) δ: 1,25 (3H, д, J = 7,2 Гц), 2,85 (1H, д, J = 5 Гц), 3,10 (1H, д, J = 5 Гц), 4,07 (1H, д, J = 17 Гц), 4,21 (1H, д, J=17 Гц), 4, 23 (1H, д, J = 16 Гц), 4,34 (2H, д, J = 16 Гц), 4,36 (1H, т., J = 12 Гц), 5,37 (1H, кв, J = 7,2 Гц), 6,06 (1H, тт, J = 53 Гц, J = 4,8 Гц), 6,78 - 6,95 (2H, м), 6,98 (2H, д, J = 9 Гц), 7,23 (2H, д, J = 9 Гц), 7,35 = 7,47 (1H, м).
Элементный анализ для C23H20F6N2O4:
вычислено (%): C 54,99, H 4,01, N 5,58
найдено
(%): C 54,77, H 4,03, N 5,36.
Справочный пример 32
1-(4-Трифторметилфенил)-2(1,3H)-имидазолон (1,15 г) растворяют в 20 мл уксусной кислоты. К полученной смеси добавляют
10%-ный палладий на угле (0,3 г) и перемешивают смесь в токе водорода в течение
шести часов. Катализатор отфильтровывают, растворитель отгоняют в вакууме и остаток перекристаллизовывают из смеси
этилацетат - ди-изо-пропиловый эфир и получают 0,95 г
(1-(4-трифторметилфенил)-2-имидазолидинона в виде бесцветных призм с т.пл. 169-171oC (из смеси этилацетат-ди-изо-пропиловый эфир).
Спектр ПМР (хлороформ-d) δ: 3,63 (3H, т, J = 8 Гц), 3,99 (2H, т, J = 8 Гц), 4,95 (1H, шир), 7,59 (2H, д, J = 9 Гц), 7,68 (2H, д, J = 9 Гц).
Элементный анализ для
C10H9F3N2
O:
вычислено (%): C 52,18, H 3,94, N 12,17
найдено (%): С 51,94, H 3,89, N 12,23.
Справочный пример 33
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,
3-эпокси-1-метилпропил] -3- (4-трифторметилфенил)-2-имидазолидинон получают аналогично методике, приведенной в справочном примере 24.
Спектр ПМР (хлороформ-d) δ: 1,24 (3H, д, J = 7,2 Гц), 2,76 (1H, д, J = 4,8 Гц), 3,14 (1H, д, J = 4,8 Гц), 3,48 -3,70 (2H, м), 3,78 - 3,90 (2H, м), 4,83 (1H, кв, J = 7,2 Гц), 6,78 - 6,95 (2H, м), 7,35 - 7, 48 (1H, м), 7,57 (2H, д, J = 8,8 Гц), 7,67 (2H, д, J = 8,8 Гц).
Справочный пример 34
Аналогично методике, приведенной в справочном примере 30, взяв в качестве исходного
соединения 4-(1,1,2,
2-тетрафторэтокси)анилин получают 1-[4-(1,1,2,2-тетрафторэтокси)фенил] -2,5-пиперазиндион в виде бесцветных кристаллов.
Спектр ПМР (ДМСО-d6) δ: 3, 97 (2H, с), 4,27 (2H, с), 6,81 (1H, тт, J = 52 Гц, 3 Гц), 7,32 (2H, д, J = 9 Гц), 7,46 (2H, д, J = 9 Гц), 8,31 (1H, шир).
Т.пл. > 250oC.
Элементный
анализ для C12H10F4N2O3:
вычислено (%): C 47,07, H 3,29, N 9,15
найдено (%): C 46,89, H 3,26, N 9,08
Справочный пример
35
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] -4- [4-(1,1,2,2-тетрафторэтокси)фенил] -2,5-пиперазиндион получают аналогично методике, приведенной в справочном примере 24.
Бесцветное кристаллическое вещество, т.пл. 168-170oC
Спектр ПМР (хлороформ-d) δ: 1,25 (3H, д, J = 7 Гц), 2,85 (1H, д, J = 5 Гц), 3,09 (1H, д, J = 5 Гц), 4,08 (1H,
д, J = 17
Гц), 4,22 (1H, д, J = 17 Гц), 4,26 (1H, д, J = 16 Гц), 4,37 (2H, д, J = 16 Гц), 5,36 (1H, кв. J = 7 Гц), 5,92 (1H, тт, J = 53 Гц, J = 3 Гц), 6,76 - 6,95 (2H, м), 7,29 (4H, с), 7,30 - 7,47
(1H, м).
Элементный анализ для C22H18F6N2O4:
вычислено (%): C 54,11, H 3,71, N 5,74
найдено (%): С 54,08, H 3,
75, N 5,
64
Справочный пример 36
Смесь 4-(2,2,3,3-тетрафторпропокси)анилина (7,4 г), N-(2-бромэтил)фталимида (9,0 г), бикарбоната калия (6,9 г), йодида натрия (5,5 г) и N,
N-диметилформамида
(80 мл) кипятят с обратным холодильником в течение 22 час. Растворитель отгоняют при пониженном давлении, к остатку приливают 200 мл ледяной воды и 200 мл этилацетата. Органический
слой отделяют,
промывают водой, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле (элюируют смесью этилацетат: гексан = 1:2 об/об) и
перекристаллизовывают из смеси этилацетат-ди-изо-пропиловый эфир, получая N-(2-фталимидо)этил-4-(2,2,3,3-тетрафторпропокси)анилин (5,4 г) в виде бесцветных кристаллов.
К смеси полученного N-(2-фталимидо)этил-4-(2,2,3,3-тетрафторпропокси)анилина (3,2 г), 1,2 мл триэтиламина и 60 мл дихлорметана при температуре минус 65oC добавляют по каплям раствор 0,9 мл этилхлорглиоксилата в 10 мл дихлорметана. Полученный раствор перемешивают при температуре минус 40oC в течение 1 часа, а затем приливают 50 мл дихлорметана и 100 мл ледяной воды. Органический слой отделяют, промывают водой, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток перекристаллизовывают из смеси этилацетат - гексан и получают N-этоксалил-N-(2-фталимидо)этил-4-(2,2,3,3-тетрафторпропокси)анилин (3,1 г) в виде бесцветного кристаллического порошка.
Смесь полученного N-этоксалил-N-(2-фталимидо)этил-4-(2,2,3, 3-тетрафторпропокси)анилина (3,4 г), гидразин-гидрата (0,7 мл) и этанола (80 мл) кипятят с обратным холодильником в течение 9 час. Выпавшие кристаллы отфильтровывают из горячего раствора и растворитель из фильтрата упаривают при пониженном давлении. К остатку приливают 150 мл воды и 300 мл этилацетата. Органический слой отделяют, промывают 5%-ным водным раствором бикарбоната натрия, а затем насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель упаривают при пониженном давлении. Остаток очищают хроматографически на силикагеле (элюируют смесью этилацетат: дихлорметан: метанол = 7:7:1 об/об) и получают 1-[4-(2,2,3,3-тетрафторпропокси)фенил]-2,3-пиперазиндион (0,8 г) в виде бесцветного порошка.
Спектр ПМР (ДМСО-d6) δ: 3,44 - 3,55 (2H, м), 3,83 - 3,89 (2H, м), 4,61 (2H, т, J = 13 Гц), 6,68 (1H, тт, J = 52 Гц, 6 Гц), 7,09 (2H, д, J = 9 Гц), 7,34 (2H, д, J = 9 Гц), 8,73 (1H, шир).
Элементный анализ для C13H12F4N2O3:
вычислено (%): C 48,76, H 3,78, N 8,75
найдено (%): C 48,44, H 3,62, N 8,73.
ВИМС (MH+): 321
Справочный пример 37
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(2,2,3,3-тетрафторпропокси)фенил] -2,3-пиперазиндион
получают аналогично методике, приведенной в справочном примере 24.
Бесцветное кристаллическое вещество: т.пл. 197-201oC.
Спектр ПМР (хлороформ-d) δ : 1,26 (3H, д, J = 7 Гц), 2,81 (1H, д, J = 5 Гц), 3,13 (1H, д, J = 5 Гц), 3,61 - 4,04 (1H, м), 4,36 (1H, т, J = 12 Гц), 5,40 (1H, кв, J = 7 Гц), 6,06 (1H, тт, J = 53 Гц, J = 5 Гц), 6,80 - 6,95 (2H, м), 6,97 (2H, д, J = 9 Гц), 7,32 (2H, д, J = 9 Гц), 7,35 - 7,47 (1H, м).
Элементный анализ для C23H20F6N2O6:
вычислено
(%):
C 54,99, H 4,01, N 5,58
найдено (%): C 54,61, H 4,01, N 5,65
Справочный пример 38
Аналогично методике, приведенной в справочном примере 36, взяв в качестве исходного
соединения 4-(1,1,2,2-тетрафторэтокси)анилин, получают 1-[4-(1,1,2,2-тетрафторэтокси)фенил]-2,3-пиперазиндион.
Бесцветный кристаллический порошок с т.пл. 240 - 242oC
Спектр ПМР (ДМСО-d6) δ: 3,46 - 3,53 (2H, м), 3,90 - 3,96 (2H, м), 6,81 (1H, тт, J = 52 Гц, 3 Гц), 7,33 (2H, д, J = 9 Гц), 7,50 (2H, д, J = 9 Гц), 8,78 (1H, шир)
Т.пл.
240 - 242oC
Элементный анализ для C12H10F4N2O3:
вычислено (%): C 47,07, H 3,29, N 9,15
найдено (%): C 46,
86,
H 3,24, N 9,11
Справочный пример 39
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(1,1,2,2-тетрафторпропокси)фенил] -2,3-пиперазиндион получают аналогично
методике, приведенной в справочном примере 24.
Бесцветное кристаллическое вещество: т.пл. 214-215oC
Спектр ПМР (хлороформ-d) δ: 1,25 (3H, д, J = 7 Гц), 2,
80
(1H, д, J = 5 Гц), 3,13 (1H, д, J = 5 Гц), 3,60 - 3,85 (3H, м), 3,95 - 4,08 (3H, м), 5,37 (1H, кв, J = 7 Гц), 5,92 (1H, тт, J = 53 Гц, J = 3 Гц), 6,81 - 6,93 (2H, м), 7,25 (2H, д, J = 8 Гц), 7,34
- 7,
45 (3H, м).
Элементный анализ для C22H18F6N2O4:
вычислено (%): C 54,11, H 3,71, N 5,74
найдено (%): C 53,
88, H
3,68, N 5,72
Справочный пример 40
Аналогично методике, приведенной в справочном примере 1, взяв в качестве исходного соединения 2-(2-фторфенил)- 2-[(1R)-1-(3,4,5,
6-тетрагидро-2H-пиран-2-ил)оксиэтил)оксиран (получают по методике, описанной в EP 0548553 A), получают [(1R)-1-[(2R)-2-(2-фторфенил)-2-оксиранил]этил]-3,5-динитробензоат.
Бесцветные
призмы (перекристаллизовывают из этилацетата) с т.пл. 183-184oC
Спектр ПМР (хлороформ-d) δ: 1,47 (3H, дд, J = 6,6 Гц, 1,6 Гц), 3,03 (1H, д, J = 4,7 Гц), 3,23 (1H, д, J = 4,
7
Гц), 5,35 (1H, кв, J = 6,6 Гц), 7,9 - 7,59 (4H, м), 9,13 (2H, д, J = 2,2 Гц), 9,23 (1H, т, J = 2,2 Гц)
[α] -24,7o (c = 1,0, хлороформ)
Элементный анализ для C17H13F N2O7:
вычислено (%): C 54,26, H 3,48,
N 7,
44
найдено (%): C 54,23 H 3,25, N 7,41
Справочный пример 41
Аналогично методике, приведенной в справочном примере 3, взяв в качестве исходного соединения
[(1R)-1-[(2R)-2-(2-фторфенил)-2-оксиранил]этил]-3,5-динитробензоат, получают [(1R)-1-[(2R)-2-(2-фторфенил)-2-оксиранил]этанол.
Бесцветное маслянистое вещество.
Спектр ПМР (хлороформ-d) δ: 1,17 (3H, дд, J = 6,6 Гц, J = 1,0 Гц), 1,78 (1H, д, J = 8,2 Гц), 2,81 (1H, д, J = 5,3 Гц), 3,32 (1H, д, J = 5,3 Гц), 4,15 (1H, м), 6,99 - 7,47 (4H, м).
Справочный пример 42
Аналогично методике, приведенной в справочном примере 34, взяв в качестве исходного (1R)-1-[(2R)-2-(2-фторфенил)-2-оксиранил] этанол, получают
(1S)-1-[(2R)-2-(2-фторфенил)-2-оксиранил]этанол.
Бесцветное маслянистое вещество.
Спектр ПМР (хлороформ-d) δ: 1,21 (3H, д, J = 7 Гц), 2,27 (1H, д, J = 2 Гц), 2, 96 (1H, д, J = 5 Гц), 3,30 (1H, д, J = 5 Гц), 4,16 (1H, Гц, J = 7 Гц, J = 2 Гц), 7,03 - 7,44 (4H, м).
Справочный пример 43
1-/(1R, 2S)-2-(2-фторфенил)-2,
3-эпокси-1-метилпропил] -3-[4- (1,1,2,2-тетрафторэтокси)фенил] -2-имидазолидинон получают аналогично методике, приведенной в справочном примере 24.
Бесцветное кристаллическое вещество (перекристаллизовывают из ди-изо-пропилового эфира) с т.пл. 148-149oC.
Спектр ПМР (хлороформ-d) δ: 1,24 (3H, д, J = 7,2 Гц), 2,78 (1H, д, J = 5,0 Гц), 3,15 (1H, д, J = 5,0 Гц), 3,45-3,84 (4H, м), 4,85 (1H, кв, J = 7,2 Гц), 5,90 (1H, тт, J = 53,2 Гц, J = 2,8 Гц), 7,02-7,06 (8H, м).
Элементный анализ для C21H19F5
N2O3:
вычислено (%): C 57,02, H 4,33, N 6,33
найдено (%): C 56,90, H 4,36, N 6,31
Справочный пример 44
1-[(1R, 2S)-2-(2-фторфенил)-2,
3-эпокси-1-метилпропил] -3-[4-(2,2,3,3-тетрафторпропокси)фенил] -2-имидазолидион получают аналогично методике, приведенной в справочном примере 24.
Бесцветный кристаллический порошок (перекристаллизовывают из ди-изо-пропилового эфира) с т.пл. 144-145oC.
Спектр ПМР (хлороформ-d) δ: 1,22 (3H, д, J = 7,4 Гц), 2,77 (1H, д, J = 5,0 Гц), 3,16 (1H, д, J = 5,0 Гц), 3,47-3,77 (4H, м), 4,32 (2H, тт, J = 52 Гц, J= 5 Гц), 4,85 (1H, кв, J = 4,7 Гц), 6,07 (1H, тт, J = 53 Гц, J = 5 Гц), 6,89-7,52 (8H, м).
Элементный анализ для C22
H21F5N2O3:
вычислено (%): C 57,90, H 4,64, N 6,14
найдено (%): C 57,94, H 4,60, N 6,19
Справочный пример 45
(2R,
3S)-2-(4-Фторфенил)-3-метил-2-(1H-1,2,4-триазол-1-ил)- метилоксиран (1,5 г), 2,66 г 1-[4-(1,1,2,2-тетрафторэтокси) фенил]-2-(1H, 3H)-имидазолона и 6,3 г карбоната цезия добавляют к 25 мл N,
N-диметилформамида. Полученную смесь перемешивают при нагревании до 80oC в течение пяти часов. После охлаждения смесь разбавляют 100 мл этилацетата и последовательно промывают водой (110
мл
х 2) и насыщенным водным раствором хлорида натрия (100 мл). Органический слой сушат над безводным сульфатом магния и растворитель упаривают при пониженном давлении. Остаток очищают хроматографией
на
силикагеле (элюент: этилацетат/гексан = 2/3), получая 1,21 г 1-[(1R, 2R)-2-(4-фторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)пропил] -3-[4-(1,1,2,2-тетрафторэтокси) фенил] -2-(1H,
3H)-имидазолона в виде бесцветного кристаллического порошка.
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J = 7,2 Гц), 4,19 (1H, д, J = 14 Гц), 4,70 (1H, д, J = 14 Гц), 4,79 (1H, кв, J = 7,2 Гц), 5,92 (1H, тт, J = 2,8 Гц, J = 53 Гц), 6,63 (1H, д, J = 3 Гц), 6,78 (1H, д, J = 3 Гц), 6,94-7,03 (2H, м), 7,28-7,39 (4H, м), 7,66 (2H, д, J = 9 Гц), 7,69 (1H, с), 7,78 (1H, с).
Справочный пример 46
1-[(1R, 2R)-2-(4-Фторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)пропил] -3-[4-(2,2,3,3-тетрафторпропокси) фенил] -2-(1H, 3H)-имидазолон получают
аналогично методике, приведенной в справочном примере 45.
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J = 7 Гц), 4,20 (1H, д, J = 14 Гц), 4,41 (2H, т, J = 12 Гц), 4,68-4,80 (2H, м), 5,42-5,48 (1H, шир), 6,07 (1H, тт, J = 5 Гц, J = 53 Гц), 6,59 (1H, д, J = 3 Гц), 6,76 (1H, д, J = 3 Гц), 6,92-7,04 (2H, м), 7,30-7,39 (4H, м), 7,58 (2H, д, J = 9 Гц), 7,66 (1H, с), 7,78 (1H, с).
Справочный пример 47
1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)пропил]-3-[4-(1,1,2,2-тетрафторпропокси)- фенил]-2(1H, 3H)-имидазолон
получают аналогично методике, приведенной в справочном примере 45.
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J = 7 Гц), 4,19 (1H, д, J = 14 Гц), 4,97 (1H, кв, J = 7 Гц), 5,10 (1H, кв, J = 14 Гц), 5,41-5,59 (1H, шир), 5,93 (1H, тт, J = 53 Гц, J = 2,8 Гц), 6,64 (1H, д, J = 3 Гц), 6,77 (1H, д, J = 3 Гц), 6,74-6,87 (2H, м), 7,30 (2H, д, J = 9 Гц), 7,40-7,56 (1H, м), 7,66 (2H, д, J = 9 Гц), 7,74 (1H, с), 7,85 (1H, с).
Справочный пример 48
1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)пропил]-3-[4-(2,2,3,
3-тетрафторпропокси)- фенил]-2(1H, 3H)-имидазолон получают аналогично методике, приведенной в справочном примере 45.
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J = 7 Гц), 4,20 (1H, д, J = 14 Гц), 4,37 (2H, т, J = 12 Гц), 4,94 (1H, кв, J = 7 Гц), 5,09 (1H, д, J = 14 Гц), 5,54-5,75 (1H, шир), 6,06 (1H, тт, J = 53 Гц, J = 5 Гц), 6,59 (1H, д, J = 3 Гц), 6,72 (1H, д, J = 3 Гц), 6,74-6,86 (2H, м), 7,00 (2H, д, J = 9 Гц), 7,42-7,55 (1H, м), 7,57 (2H, д, J = 9 Гц), 7,72 (1H, с), 7,85 (1H, с).
Справочный пример 49
(2R,
3S)-2-(2-Фторфенил)-3-метил-2-(1H-1,2,4-триазол-1- ил)метилоксиран (1,5 г), 2,66 г (1-[4-(1,1,2,2-тетрафторэтокси) фенил]-2-(1H, 3H)-имидазолона и 0,386 г гидрида натрия в виде 60%-ной суспензии в
масле добавляют к 25 мл N, N-диметилформамида. Полученную смесь перемешивают при нагревании до 80oC в течение 20 час. После охлаждения смесь выливают в 100 мл воды и экстрагируют
этилацетатом (50 мл х 2). Экстракт промывают водой и сушат над безводным сульфатом магния, а затем растворитель упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле (элюент: этилацетат/гексан = 2/3), получая 0,27 г 1-[1R, 2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил] -3-[4-(1,1,2,2-тетрафторэтокси-фенил] -2(1H,
3H)-имидазолона в виде бесцветного кристаллического порошка.
Элементный анализ для C23H20F5N5O3:
вычислено (%): C 54,
23,
H 3,96, N 13,75
найдено (%): C 53,83, H 3,99, N 13,56
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J = 7 Гц), 4,20 (1H, д, J = 14 Гц), 5,05 (1H, кв, J = 7 Гц), 5,16 (1H, д, J
=
14 Гц), 5,30-5,41 (1H, шир), 5,93 (1H, тт, J = 53 Гц, J = 2,8 Гц), 6,65 (1H, д, J = 3 Гц), 6,81 (1H, д, J = 3 Гц), 6,98-7,08 (2H, м), 7,18-7,51 (2H, м), 7,30 (2H, д, J = 9 Гц), 7,70 (1H, д, J = 9
Гц),
7,73 (1H, с), 7,81 (1H, с).
Справочный пример 50
Аналогично методике, приведенной в справочном примере 20, исходя из (1S)-1-[(2R)-2-(2-фторфенил)-2-оксиранил] этанола,
получают следующее соединение.
1-[(1R, 2S)-2-(2-фторфенил)-2,3-эпокси-1-метилпропил] -3-[4-(2,2,3,3- тетрафторпропокси)фенил]-2(1H, 3H)-имидазолон
Бесцветный кристаллический
порошок (перекристаллизовывают из ди-изо-пропилового эфира), т.пл. 118-119oC.
Спектр ПМР (хлороформ-d) δ: 1,37 (3H, д, J = 7 Гц), 2,72 (1H, д, J = 5 Гц), 2,81 (1H, д, J = 6 Гц), 4,36 (2H, тт, J = 12 Гц, J = 2 Гц), 5,12 (1H, кв, J = 7 Гц), 6,07 (1H, тт, J = 53 Гц, J = 5 Гц), 6,45 (1H, д, J = 3 Гц), 6,51 (1H, д, J = 3 Гц), 6,98 (2H, д, J = 9 Гц), 7,04-7,19 (1H, м), 7,28-7,47 (2H, м), 7,57 (2H, д, J = 9 Гц).
1-[(1R, 2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4- триазол-1-ил)пропил]-3-[4-(2,2,3,3-тетрафторпропокси)фенил]- 2(1H,
3H)-имидазолон
Бесцветный кристаллический порошок.
Элементный анализ для C24H22F5N5O3:
вычислено (%): C 55,07,
H 4,24, N 13,38
найдено (%): C 54,98, H 4,18, N 13,35
Спектр ПМР (хлороформ-d) δ: 1,20 (3H, д, J = 7 Гц), 4,21 (1H, д, J = 14 Гц), 4,37 (2H, т, J = 12 Гц), 4,95-5,11 (1H, м),
5,15 (1H, д, J = 14 Гц), 5,34-5,56 (1H, шир), 6,07 (1H, тт, J = 53 Гц, J = 5 Гц), 6,59 (1H, д, J = 3 Гц), 6,76 (1H, д, J = 3 Гц), 6,97-7,07 (2H, м), 7,01 (2H, д, J = 9 Гц), 7,17-7,29 (1H, м), 7,44-7,
52 (1H, м), 7,79 (1H, м), 7,79 (2H, д, J = 9 Гц), 7,72 (1H, с), 7,82 (1H, с).
Справочный пример 51
Аналогично методике, приведенной в справочном примере 1, взяв в качестве
исходного 2-(2-фторфенил)-2-[(1R)-1-(3,4,5,6-тетрагидро-2H- пиран-2-ил)оксиэтил] оксиран (получают по способу, приведенному в EP 0548553 A), получают (1R)-1[2-(2-фторфенил)-2-оксиранил] этанол. К
раствору полученного продукта (34,77 г) в тетрагидрофуране (600 мл) добавляют при охлаждении в бане со льдом 127,21 г трифенилфосфина, 102,88 г 3,5-динитробензойной кислоты и 84,47 г диэтилового
эфира
азодикарбоновой кислоты и полученную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 7 часов. К реакционной смеси приливают 600 мл этилацетата, 100 мл
диизо-пропилового эфира
и 800 мл воды, а затем водный слой дополнительно экстрагируют этилацетатом (600 мл, 400 мл). Органические вытяжки объединяют, последовательно промывают водой и насыщенным
водным раствором хлорида
натрия, сушат над безводным сульфатом магния, а затем растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 5/1),
получая 23,15 г
[(1S)-1-[(2R)-2-(2- фторфенил)-2-оксиранил]этил]-3,5-динитробензоата в виде бесцветных игл.
Спектр ПМР (хлороформ-d) δ: 1,47 (3H, д, J = 7 Гц), 2,97 (1H, д, J = 5 Гц), 3,29 (1H, д, J = 5 Гц), 5,43 (1H, кв, J = 7 Гц), 7,02-7,56 (4H, м), 9,06 (2H, д, J = 2 Гц), 9,21 (1H, т, J = 2 Гц).
Полученный продукт растворяют в 700 мл метанола и при охлаждении в бане со льдом добавляют 146,5 мл 1 N раствора едкого натра.
Реакционную смесь перемешивают при комнатной температуре в течение 1 час. Добавляют 85,5 мл 1 N раствора соляной кислоты и растворитель отгоняют при пониженном давлении. К остатку приливают 500 мл этилацетата и 500 мл воды. Органический слой отделяют, последовательно промывают водой и насыщенным водным раствором натрия, сушат над безводным сульфатом магния, а затем растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1), получая 10,76 г (1S)-1- [(2R)-2-(2-фторфенил)-2-оксиранил] этанола в виде бесцветного маслянистого вещества. Этот продукт идентичен соединению, полученному в справочном примере 42.
Справочный пример
52
Гидрид натрия в виде 60%-ной суспензии в масле (2,4 г) добавляют порциями к перемешиваемому раствору 1-[4-(1,1,2,2-тетрафторэтокси)фенил]-2(1H, 3H)-имидазолона (16,6 г) и полученную смесь
перемешивают при комнатной температуре в течение 30 минут. Добавляют (2R,2S)-2-(2,4-дифторфенил)-3-метил-2-(1H-1,2,4- триазол-1-ил)метилоксиран (10 г) и перемешивают при температуре 80oC в
течение 20 час. Охлаждают, концентрируют при пониженном давлении до объема приблизительно 50 мл и разбавляют ледяной водой (400 мл) и этилацетатом (500 мл). Слой этилацетата отделяют, последовательно
промывают 10%-ным водным раствором фосфорной кислоты (400 мл) и водным раствором хлорида натрия (400 мл х 2) и сушат над безводным
сульфатом магния. Растворитель упаривают, а остаток очищают
колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = от 1/1 до 2/1), получая 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1- метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(1,1,2,
2- тетрафторпропокси)фенил] -2(1H, 3H)-имидазолон (7,56 г) в виде маслянистого вещества, которое идентично соединению, полученному в справочном примере 47.
Рабочий пример 1
1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4- триазол-1-ил)пропил] -3-(4-трифторметоксифенил)-2(1H,3H)-имидазолон (100 г), полученный в справочном примере 22, растворяют в 10 мл
уксусной кислоты, добавляют 50 мг 10%-ного палладия на угле и полученную смесь перемешивают при комнатной температуре в атмосфере водорода в течение восьми часов. Катализатор отфильтровывают, а
фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = от 1/5 до 2/1), получая 66 мо 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,
4-триазол- 1-ил)пропил] -3-(4-трифторметоксифенил)-2-имидазолидинона (соединение 1), бесц. порошок.
Спектр ПМР (хлороформ-d) δ: 1.08 (3H, d, J = 7 Hz), 3.65-4.05 (4H, m), 4,53 (1H, д, J = 14,2 Гц), 4,60-4,80 (1H, м), 5,10 (1H, д, J = 14,2 Гц), 5.40 (1H, шир), 6.68-6.85 (2H, м), 7,31 (2H, д, J = 9 Гц), 7,32-7,48 (1H, м), 7,69 (2H, д, J = 9 Гц), 7,76 (1H, с), 7,88 (1H, с).
Рабочий пример 2
Используя методику, аналогичную приведенной в рабочем примере 1, взяв в качестве исходного 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1- метил-3-(1H-1,2,
4-триазол-1-ил)пропил] -3-(2,4-дифторфенил)-2-(1H, 3H)- имидазолон, получают 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-3-(2,4-дифторфенил)-2-имидазолидинон
(соединение 2).
Бесцветный порошок.
Спектр ПМР (хлороформ-d) δ: 1,07 (3H, д, J = 7 Гц), 3,65-4,05 (4H, м), 4,55 (1H, д, J = 14,2 Гц) 4,55-4,65 (1H, м), 5,10 (1H, д, J = 14,2 Гц), 5,60 (1H, шир), 6,68-7,02 (4H, м), 7,36-7,68 (2H, м), 7,76 (1H, с), 7,93 (1H, с).
Рабочий пример 3
Смесь 0,41 г 1H-1,2,4-триазола, 0,19 г гидрида
натрия
в виде 60%-ной суспензии в масле и 12 мл диметилформамида перемешивают при комнатной температуре в течение 20 минут, к полученной смеси добавляют 0,85 г 1-[(1R2)-2-(2,4-дифторфенил)-2,
4-эпокси-1- метилпропил] -3-(2,4-дифторфенил)-2,4-имидазолидиндиона, полученного в справочном примере 24, и полученную смесь перемешивают при нагревании до 60oC в течение четырех часов.
Охлаждают, добавляют 20 мл воды и смесь экстрагируют 80 мл этилацетата. Экстракт промывают 20 мл насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния и упаривают при
пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: гексан/этилацетат = от 1/2 до 1/5) и получают 0,12 г 1-[(1R,2S)-2-(2,4-дифторфенил)-2-гидрокси-1- метил-3-(1H-1,2,
4-триазол-1-ил)пропил] -3-(2,4-дифторфенил)-2- имидазолидиндиона (соединение 3) в виде твердого вещества белого цвета.
Спектр ПМР (хлороформ-d) δ: 1,10 (3H, д, J = 7 Гц), 4,25 (1H, д, J = 18 Гц), 4,41 (1H, д, J = 14,2 Гц), 4,67 (1H, д, J = 18 Гц), 4,94 (1H, дублет кв. , J = 1,6 Гц, J = 7 Гц), 5,10 (1H, д, J = 14,2 Гц), 5,35 (1H, д, J = 1,6 Гц), 6,70-6,84 (2H, м), 6,94-7,06 (2H, м), 7,27-7,44 (2H, м), 7,80 (1H, с), 7,82 (1H, с).
Рабочий пример 4.
(Метод A)
Используя методику, аналогичную приведенной в рабочем примере 1, взяв в
качестве исходного 1[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил] -3-(4-трифторметилфенил)-2-(1H, 3H)-имидазолон, получают 1-[(1R, 2R)-2-(2,
4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил] -3-(4-трифторметилфенил)-2-имидазолидинон (соединение 4).
(Метод Б)
Проводят ту же реакцию, что и в
рабочем примере 4, взяв в качестве исходного 1-[1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -3- (4-трифторметилфенил)-2-имидазолидинон, полученный по справочному примеру 33, и получают
1-[(1R, 2R)-2-(2.4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1.2,4-триазол- 1-ил)пропил] -3-(4-трифторметилфенил)-2-имидазолидинон (соединение 4) в виде бесцветного порошка.
Элементный
анализ для C22H20F5N5O2;
вычислено (%): C 54,89, H 4,19, N 14,55
найдено (%): C 54,72, H 4,19, N 14,29
Спектр ПМР
(хлороформ-d) δ: 1.07 (3H, д, J = 7 Гц), 3,60 - 4,12 (4H, м), 4,49 (1H, д, J = 14,2 Гц), 4,60 - 4,80 (1H, м), 5,11 (1H, д, J = 14,2 Гц), 5,36 (1H, шир), 6,70 - 6,85 (2H, м), 7,32 - 7,48 (1H,
м),
7,60 (2H, д, J = 8,8 Гц), 7,70 (1H, д, J = 8,8 Гц), 7,76 (1H, c), 7,85 (1H, с).
Рабочий пример 5
Используя методику, аналогичную приведенной в рабочем примере 1, взяв в
качестве исходного 1[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил] -3-(4-фторфенил)-2(1H, 3H)-имидазолон, получают 1-[(1R, 2R)-2-(2,
4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил]-3-(4-фторфенил)-2-имидазолидинон (соединение 5).
Бесцветное кристаллическое вещество с т.пл. 74-78oC (из смеси этилацетат - гексан).
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,0 Гц), 3,65 - 3,73 (1H, м), 3,79 - 4,00 (3H, м), 4,51 (1H, д, J = 14 Гц), 4,60 (1H, м), 5,07 (1H, д, J = 14 Гц), 5,3 - 5,7 (1H, шир), 6,71 - 6,82 (2H, м), 6,99 - 7,11 (2H, м), 7,36 - 7,56 (3H, м), 7,74 (1H, c), 7,87 (1H, c).
ИК-спектр (KBr) νmax : 3420, 1690, 1615, 1510, 1480, 1420 см-1.
Рабочий пример 6
(Метод A)
Используя методику, аналогичную приведенной в рабочем примере 1, взяв в качестве исходного 1-[(1R,
2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил]-3-[4-(2,2,3,3-тетрафторпропокси)фенил]-2(1H, 3H)-имидазолон, получают 1-[(1R, 2R)-2-(2,
4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол)-1-ил) пропил] -3-[4-(2,2,3,3-тетрафторпропокси)фенил]-2-имидазолидинон (соединение 6).
(Метод Б)
Проводят ту же
реакцию,
что и в рабочем примере 3, взяв в качестве исходного 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1- метилпропил] -3-[4-(2,2,3,3-тетрафторпропокси)фенил] -2-имидазолидинон, и получают 1-[(1R,
2R)-2-(2,
4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил] -3-[4-(2,2,3,3-тетрафторпропокси)фенил]-2-имидазолидинон (соединение 6).
Бесцветный кристаллический
порошок
Спектр ПМР (хлороформ-d) δ: 1,07 (3H, д, J = 7 Гц), 3,67 - 3,75 (1H, м), 3,82 - 4,01 (3H, м), 4,50 (2H, тт, J = 12 Гц, J = 1,6 Гц), 4,52 (1H, д, J = 14,4 Гц), 4,5 - 4,65 (1H,
м), 5,08 (1H, д,
J = 14,4 Гц), 5,45 - 5,65 (1H, шир), 6,06 (1H, тт, J = 53 Гц, J = 4,8 Гц), 6,70 - 6,83 (2H, м), 6,94 (2H, д, J = 9,2 Гц), 7,39 - 7,54 (1H, м), 7,50 (2H, д, J = 9.2 Гц), 7,74 (1H, c),
7,88 (1H, c).
Элементный анализ для C24H23F6N5O3:
вычислено (%): C 53,04, H 4,27, N 12,89
найдено (%): C 53,04,
H 4,50, N 12,
82
ИК-спектр (KBr) νmax: 3380, 1690, 1665, 1510, 1485 см-1
Рабочий пример 7
(Метод A)
Используя методику, аналогичную
приведенной в
рабочем примере 1, взяв в качестве исходного 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил]-3-[4-(1,1,2,2-тетрафторэтокси)фенил]-2-(1H,
3H)-имидазолон, получают
1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)-пропил]-3-[4-(1,2,2,2-тетрафторэтокси)фенил] -2- имидазолидинон (соединение 7).
(Метод Б)
Проводят ту же реакцию, что и в рабочем примере 3, взяв в качестве исходного 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1- метилпропил] -3-[4-(1,1,2,2-тетрафторэтокси)фенил]
-2-имидазолидинон, и
получают 1-[(1R,2R)-2-(2,4-трифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил]-3-[4-(1,1,2,2-тетрафторэтокси)фенил]-2-имидазолидинон (соединение 7).
Бесцветный кристаллический порошок.
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,0 Гц), 3,66 - 3,73 (1H, м), 3,80 - 3,95 (3H, м), 4,50 (1H, д, J = 15 Гц), 4,65 (1H, м), 5,10 (1H, д, J = 15 Гц), 5,3 - 5,6 (1H, шир), 5,91 (1H, тт, J = 53 Гц, J = 3,0 Гц), 6,72 - 6,83 (2H, м), 7,21 (2H, д, J = 9,2 Гц), 7,36 - 7,49 (1H, м), 7,58 (2H, д, J = 9,2 Гц), 7,75 (1H, с), 7.86 (1H, c).
Элементный анализ для C23H21F6N5O3:
вычислено (%): C 52,18, H 4,00, N 13,23
найдено (%): C 52,
30, H 3,95, N 13,28
ИК-спектр (KBr) νmax: 3380, 1680, 1615, 1510, 1480, 1425 см-1
Рабочие примеры 8-14
Используя методику, аналогичную
приведенной в рабочем примере 3,
получают следующие соединения.
Рабочий пример 8.
Взяв в качестве исходного 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -3-[4-(2,2,3,3, 3- пентафторпропокси)фенил] -2-имидазолидинон, получают 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил] -3-[4-(2,2,3,3,3-пентафторпропокси)фенил] -2-имидазолидинон (соединение 8).
Бесцветный порошок.
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,2 Гц), 3,66 - 3,73 (1H, м), 3,79 - 4,01 (3H, м), 4,41 (2H, т, J = 12,4 Гц), 4,52 (1H, д, J = 14 Гц), 4,51 - 4,68 (1H, м), 5,08 (1H, д, J = 14 Гц), 5,3 - 5,8 (1H, шир), 6,71 - 6,82 (2H, м), 6,96 (2H, д, J = 9.2 Гц), 7,37 - 7,5 (1H, м), 7,51 (2H, д, J = 9,2 Гц), 7,74 (1H, с), 7, 88 (1H, с).
Элементный анализ для C24H22F7N5O3:
вычислено (%): C 51,34, H 3,95, N 12,47
найдено (%): C 51,14,
H 3,95, N 13,32
ИК-спектр (KBr) νmax: 3420, 1690, 1610, 1510, 1480, 1425 см-1.
Рабочий пример 9
Взяв в качестве
исходного 1-[(1R,
2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -3-[4-(2,2,2- трифторэтокси)фенил] -2-имидазолидинон, получают 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,
4-триазол-1-ил)
пропил]-3-[4-(2,2,2-трифторэтокси)фенил]-2-имидазолидинон (соединение 9).
Бесцветный кристаллический порошок.
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,2 Гц), 3,66 - 3,74 (1H, м), 3,79 - 3,95 (3H, м), 4,34 (2H, кв, J = 8 Гц), 4,52 (1H, д, J = 14 Гц), 4,5 - 4,65 (1H, м), 5,08 (1H, д, J = 14 Гц), 5,4 - 5,7 (1H, шир), 6,71 - 6,81 (2H, м), 6,96 (1H, д, J = 9,2 Гц), 7,38 - 7,5 (1H, м), 7,50 (2H, д, J = 9,2 Гц), 7,74 (1H, с), 7,88 (1H, с).
Элементный анализ для C23H22F5N5O3:
вычислено (%): C 54,01, H 4,34, N 13,69
найдено (%): C 53,67, H 4,27, N 13,79
ИК-спектр (KBr) νmax: 3410, 1690, 1610, 1510, 1480, 1420 см-1.
Рабочий пример 10
Взяв в качестве исходного 1-(4-хлорфенил)-3-[(1R,2S)-2- (2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -2-имидазолидинон, получают
1-(4-хлорфенил)-3-[(1R, 2R)-2- (2,
4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил]-2-имидазолидинон (соединение 10).
Бесцветный кристаллический порошок , т.пл. 138 - 139oC (из смеси диэтиловый эфир - гексан).
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,0 Гц), 3,64 - 3,75 (1H, м), 3,80 - 4,03 (3H, м), 4,50 (1H, д, J = 15 Гц), 4,54 - 4,72 (1H, м), 5,09 (1H, д, J = 15 Гц), 5,3 - 5,6 (1H, шир), 6,73 - 6,83 (2H, м), 7,31 (2H, д, J = 9 Гц), 7,35 - 7,45 (1H, м), 7,52 (2H, д, J = 9 Гц), 7,75 (1H, с), 7,86 (1H, с).
Элементный анализ для
C21H20ClF2N5O2:
вычислено (%): C 56,32, H 4,50, N 15,64
найдено (%): C 56,35, H 4,36, N 15,
93
ИК-спектр (KBr) νmax: 3400, 1695, 1660, 1618, 1500, 1420, 1270 см-1.
Рабочий пример 11
Взяв в качестве исходного 1-[(1R,2S)-2-(2,
4-дифторфенил)-2,3-эпокси-1-метилпропил]
-4- [4-(2,2,3,3-тетрафторпропокси)фенил] -2,5-пиперазиндион, получают 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,
4-триазол-1-ил)-пропил]-3-[4-(2,2,3,3-тетрафторпропокси) фенил]-2,
5-пиперазиндион (соединение 11).
Бесцветный порошок.
Спектр ПМР (хлороформ-d) δ: 1,07 (3H, д, J = 7 Гц), 4,24 - 4,52 (6H, м), 4,74 (1H, д, J = 18 Гц), 5,16 (1H, д, J = 14 Гц), 5,29 (1H, с), 5,36 (1H, кв, J = 7 Гц), 6,06 (1H, тт, J = 53 Гц, J = 5 Гц), 6,74 - 6,83 (2H, м), 7,00 (2H, д, J = 9 Гц), 7,29 (2H, д, J = 9 Гц), 7,31 - 7,47 (1H, м), 7,80 (1H, с), 7,82 (1H, с).
ИК-спектр (KBr) νmax: 3410, 1660, 1610, 1505, 1450, 1315 см-1.
Рабочий пример 12
Взяв в качестве исходного 1-[(1R,
2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -4- [4-(1,1,2,2-тетрафторпропокси)фенил] -2,5-пиперазиндион, получают 1-[(1R,
2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,
4-триазол-1-ил)-пропил]-3-(1,1,2,2-тетрафторпропокси) фенил]-2,5-пиперазиндион (соединение 12).
Белый порошок.
Спектр ПМР (хлороформ-d) δ: 1,07 (3H, д, J = 7 Гц), 4,25 - 4,38 (2H, м), 4,45 (2H, с), 4,74 (1H, д, J = 17 Гц), 5,15 (1H, д, J = 14 Гц), 5,30 - 5,41 (2H, м), 5,92 (1H, тт, J = 53 Гц, J = 3 Гц), 6,73 - 6,82 (2H, м), 7,28 (2H, д, J = 9 Гц), 7,30 - 7, 45 (3H, м), 7,79 (1H, с), 7,82 (1H, с).
Элементный анализ для C24H21F6N5O4:
вычислено (%): C 51,71, H 3,80, N 12,56
найдено (%): C 51,54, H 3,79, N 12,56
Рабочий пример 13
Взяв в качестве исходного 1-[(1R,2S)-2-(2,4-дифторфенил)-2,
3-эпокси-1-метилпропил] -4- [4-(2,2,3,
3-тетрафторпропокси)фенил] -2,3-пиперазиндион, получают 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)-пропил] -3-[4-(2,2,3,
3-тетрафторпропокси) фенил] -2,
5-пиперазиндион (соединение 14).
Белый порошок.
Спектр ПМР (хлороформ-d) δ: 1,07 (3H, д, J = 7 Гц), 3,79 - 3,90 (2H, м), 4,04 - 4,27 (2H, м), 4,36 (2H, т, J = 12 Гц), 4,39 (1H, д, J = 13 Гц), 5,24 (1H, д, J = 13 Гц), 5,27 - 5,40 (2H, м), 6,06 (1H, тт, J = 53 Гц, J = 5 Гц), 6,72 - 6,83 (2H, м), 6,98 (2H, д, J = 9 Гц), 7,31 - 7,44 (3H, м), 7,78 (1H, с), 7,82 (1H, с).
Элементный анализ для C25H23F6N5O4:
вычислено (%): C 52,54, H 4,06, N 12,
25
найдено (%): C 52,34, H 4,
12, N 12,10
Рабочий пример 14
Взяв в качестве исходного 1-[(1R,2S)-2-(2,4-дифторфенил)-2,5-эпокси-1-метилпропил] -4- [4-(1,1,2,
2-тетрафторпропокси)фенил] -2,3-пиперазиндион, получают
1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3- (1H-1,2,4-триазол-1-ил)-пропил]-3-[4-(1,1,2,2-тетрафторпропокси) фенил]-2,3-пиперазиндион
(соединение 15).
Бесцветный кристаллический порошок, т.пл. 174 - 175oC.
Спектр ПМР (хлороформ-d) δ: 1,07 (3H, д, J = 7 Гц), 3,89 - 3,98 (2H, м), 4, 10 - 4,29 (2H, м), 4,40 (2H, т, J = 15 Гц), 5, 25 (2H, д, J = 15 Гц), 5,25 - 5,40 (2H, м), 5,93 (1H, тт, J = 53 Гц, J = 3 Гц), 6,73 - 6,84 (2H, м), 7,28 (2H, д, J = 9 Гц), 7,30 - 7,42 (1H, м), 7,44 (2H, д, J = 9 Гц), 7,79 (1H, с), 7,82 (1H, с).
Элементный анализ для C24H21F6N5O4 • 0,5 H2O:
вычислено (%): C 50,89, H 3,91, N 12,36
найдено
(%): C 51,13, H 4,07, N 12,45
Рабочий пример 15
(Метод A)
Используя методику, аналогичную приведенной в рабочем
примере 1, взяв в качестве исходного 1-[(1R,
2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил) пропил]-3-[4-(1,1,2,2-тетрафторэтокси)фенил]-2(1H,3H)-имидазолон, получают 1-[(1R,
2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1Н, 1,2,
4-триазол-1-ил)пропил] -3-[4-(1,1,2,2-тетрафторэтокси)фенил] -2-имидазолидинон (соединение 16).
(Метод Б)
Проводят ту же
реакцию, что в рабочем примере 3, взяв в качестве
исходного 1-[(1R, 2S)-2-(2-фторфенил)-2,3-эпокси-1-метилпропил] -3-[4-(1,1,2,2-тетрафторэтокси) фенил] -2-имидазолидинон, и получают 1-[(1R,
2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,
4-триазол-1-ил)пропил] -3-[4- (1,1,2,2-тетрафторэтокси)фенил]-2-имидазолидинон (соединение 16).
Бесцветные иглы.
Спектр ПМР (хлороформ-d): δ: 1,06 (3H, д, J = 7,0 Гц), 3,68 - 4,05 (4H, м), 4,51 (1H, д, J = 14,4 Гц), 4,65 - 4,80 (1H, м), 5,15 (1H, д, J = 14,4 Гц), 5,25 (1H, шир), 5,91 (1H, тт, J = 53,2 Гц, J = 3 Гц), 6,95 - 7,63 (3H, м), 7,74 (1H, с), 7,82 (1H, с).
Элементный анализ для C23H22F6N5O3:
вычислено (%): C 54,
01, H 4,34, N 13,69
найдено (%): C 53,96, H 4,
48, N 13,69
Рабочий пример 16
(Метод A)
Используя методику, аналогичную приведенной в рабочем примере 1, взяв в
качестве исходного 1-[(1R,
2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3- [4-(2,2,3,3-тетрафторпропокси)фенил] -2-(1H, 3H), имидазолон, получают 1-[(1R,
2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H,
1,2,4-триазол-1-ил)пропил]-3-[4-(2,2,3,3-тетрафторпропокси)фенил] -2-имидазолидинон (соединение 17)
(Метод Б)
Проводят ту же реакцию,
что и в рабочем примере 3, взяв в качестве
исходного 1-[(1R, 2S)-2-(2-фторфенил)-2,3-эпокси-1-метилпропил] -3-[4-(2,2,3,3-тетрафторпропокси)фенил] -2-имидазолидинон, и получают 1-[(1R,
2R)-2-(2-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,
4-триазол-1-ил)пропил] -3-[4- (2,2,3,3-тетрафторпропокси)фенил]-2-имидазолидинон (соединение 17).
Бесцветный кристаллический порошок.
Спектр ПМР (хлороформ-d): δ: 1,06 (3H, д, J = 7,0 Гц), 3,66 - 4,05 (4H, м), 4,33 (2H, тт, J = 12 Гц, J = 1,6 Гц ), 4,52 (1H, д, J = 14 Гц), 4,60 - 4,77 (1H, м), 5,13 (1H, д, J = 14 Гц), 5,35 (1H, шир), 6,07 (1H, тт, J = 53 Гц, J = 5 Гц), 6,91 - 7,53 (8H, м), 7,73 (1H, с), 7,83 (1H, с).
Элементный анализ для C24H24F5N5O3:
вычислено (%): C
54,86, H 4,60, N 13,33
найдено (%): C 54,66, H 4,57, N 13,26
Рабочий пример 17
Используя методику, аналогичную
приведенной в рабочем примере 1, взяв в качестве исходного
1-[(1R, 2R)-2-(4-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3- [4-(1,1,2,2-тетрафторэтокси)фенил] -2-(1H,
3H)-имидазолон, получают 1-[(1R,
2R)-2-(4-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(1,1,2,2-тетрафторэтокси)фенил] -2-имидазолидинон (соединение 18).
Бесцветный кристаллический порошок.
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,2 Гц), 3,69 - 4,02 (4H, м), 4,42 (1H, кв, J = 12 Гц), 4,48 (1H, д, J = 14 Гц), 4,72 (1H, д, J = 14 Гц), 4,72 (1H, д, J = 14 Гц), 5, 22 - 5,39 (1H, шир), 5,91 (1H, тт, J = 2,4 Гц, J = 53 Гц), 6,93 - 7,01 (2H, м), 7,20 - 7,34 (4H, м), 7,58 (2H, д, J = 9 Гц), 7,65 (1H, с). 7,80 (1H, с).
Элементный анализ для C23H22F5N5O3:
вычислено (%): C 54,01, H 4,34, N 13,69
найдено (%): C 53,82, H 4,32, N 13,
68.
Рабочий пример 18
Используя методику, аналогичную приведенной в рабочем примере 1, взяв в качестве исходного 1-[(1R, 2R)-2-(4-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,
4-триазол-1-ил)пропил] -3- [4-(2,2,3,
3-тетрафторпропокси)фенил] -2(1H, 3H), имидазолон, получают 1-[(1R, 2R)-2-(4-фторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(2,2,3,
3-тетрафторпропокси)фенил] -2-имидазолидинон
(соединение 19).
Бесцветный кристаллический порошок.
Спектр ПМР (хлороформ-d) δ: 1,06 (3H, д, J = 7,2 Гц), 3,70 - 3,93 (4H, м), 4,28 - 4,45 (3H, м), 4,49 (1H, д, J = 14 Гц), 4,72 (1H, д, J = 14 Гц), 5,32 - 5,48 (1H, шир), 6,07 (1H, тт, J = 5 Гц, J = 53 Гц), 6,93 - 7,00 (4H, м), 7,30 - 7,34 (2H, м), 7,50 (2H, д, J = 9 Гц), 7,66 (1H, с), 7,80 (1H, с).
Элементный анализ для C24H25F5N5O3:
вычислено (%): C 54,86, H 4,60, N 13,33
найдено (%): C 54,86, H 4,68, N 12,94
Предпочтительная группа соединений, относящихся к соединению (1) по настоящему изобретению, представлена в таблице 3 и в таблице 4, однако
настоящее изобретение ими не лимитируется.
Препарат 1
Используя соединение 7, полученное по рабочему примеру 7, смешивают указанные ниже компоненты. Смеси упаковывают в
капсулы из желатина и получают капсулы, каждая из
которых содержит соединение 7 в количестве 50 мг.
Соединение 7 (получено по рабочему примеру 7) - 50 мг
Лактоза - 100 мг
Кукурузный крахмал - 10 мг
Стеарат
магния - 10 мг
Всего - 200 мг
Препарат 2
Соединение 4, полученное по рабочему примеру 4, и стеарат магния гранулируют из
водного раствора растворимого крахмала. Полученный
продукт сушат, а затем смешивают с лактозой и кукурузным крахмалом, смесь подвергают формовке прессованием и получают таблетку, содержащую указанные
ниже компоненты.
Соединение 4
(получено по рабочему примеру 4) - 50 мг
Лактоза - 65 мг
Кукурузный крахмал - 30 мг
Растворимый крахмал - 35 мг
Стеарат магния - 20 мг
Всего - 200 мг
Оценку антигрибковой активности соединения по настоящему изобретению проводят следующим методом: кусочек диска из фильтровальной бумаги (фирма
изготовитель - Toyo Seisakusho, 8 мм в диаметре)
окунают в раствор соединения по настоящему изобретению в метаноле с концентрацией 1000 мкг/мл и помещают на агаровую пластину, содержащую различные
грибки, и выдерживают в термостате при температуре
28oC в течение двух дней, а затем измеряют величину зоны ингибирования роста вокруг диска фильтровальной бумаги. Используют следующие
среды для роста культур.
A: Агаровая
среда на основе системы дрожжи-азотистое основание (pH 7,0)
B: агаровая среда на основе системы пептон - дрожжевой экстракт - глюкоза
(pH 7,0).
Спектр антигрибковой активности соединений по настоящему изобретению иллюстрируется данными, приведенными в таблице 5.
Антигрибковая активность соединения по настоящему изобретению по отношению к Candida albicans иллюстрируется данными, приведенными в таблице 6.
Данные о защитном действии соединения по настоящему изобретению в экспериментах по инфицированию мышей приведены в таблицах 7 и 8.
Метод испытаний: мышам Crj: CDF1 в возрасте пять недель внутривенно вводят минимальную детальную дозу Candida albicans AT. Испытуемое соединение суспендируют в 0,2%-ном или 0, 5%-ном растворе натриевой соли карбоксиметилцеллюлозы (СМС). Суспензию вводят орально в один прием сразу же после инфицирования. Активность выражают в терминах величины ED50, которые оценивают по методу Рида и Мюнха на основе коэффициента выживаемости, определяемого через 7 дней после инфекции.
Данные о защитном действии соединения формулы (IV), которое является исходным соединением по настоящему изобретению, в экспериментах по инфицированию мышей приведены в таблице 9.
Метод испытаний. Мышам Crj: CDF1 в возрасте пять недель внутривенно вводят минимальную летальную дозу Candida albicans AT. Испытуемое соединение суспендируют в 0,5%-ном растворе натриевой соли карбоксиметилцеллюлозы (CMC). Суспензию вводят орально в один прием сразу же после инфицирования. Активность выражают в терминах величин ED50, которые оценивают по методу Рида и Мюнха на основе коэффициента выживаемости, определяемого через 7 дней после инфекции.
Соединение по настоящему изобретению или его соль проявляет превосходную антигрибковую активность. Соединение по настоящему изобретению или его соль полезно в качестве антигрибкового средства для подавления или терапии инфекций у млекопитающих. Далее, соединение по настоящему изобретению может использоваться также в качестве антигрибкового средства в сельском хозяйстве.
Реферат
Производные азола формулы 1, где Аr - галогензамещенный фенил; R1, R2 - атом водорода или низший алкил или R1 и R2 вместе образуют низший алкилен; R3 - водород или ацил; Y - атом азота; А - возможно замещенная циклическая амидная группа, связанная посредством первого атома азота, или их соли полезны в качестве антигрибковых средств. 4 c. и 14 з.п. ф-лы, 9 табл., 8 ил.

Формула

где Ar представляет галогензамещенную фенильную группу;
R1 и R2, одинаковые или различные, представляют атом водорода или низшую алкильную группу или R1 и R2 могут объединяться с образованием низшей алкиленовой группы;
R3 представляет атом водорода или ацильную группу;
Y представляет атом азота;
А представляет необязательно замещенную насыщенную циклическую амидную группу, связанную посредством первого атома азота,
или их соли.

где R4 представляет замещенную фенильную группу.

где R5 имеет то же значение, что и R4.

где Ar представляет галогензамещенную фенильную группу;
R1 и R2, одинаковые или различные, представляют атом водорода или низшую алкильную группу или R1 и R2 могут объединяться с образованием низшей алкиленовой группы;
А представляет необязательно замещенную насыщенную циклическую амидную группу, связанную посредством первого атома азота,
с соединением, представленным формулой III

где Y представляет атом азота,
или его солью с образованием соединения формулы I, в котором R3 представляет атом водорода, если необходимо, с последующей обработкой ацилирующим агентом с целью получения соединения формулы I, в котором R3 представляет ацильную группу.

где Ar представляет галогензамещенную фенильную группу;
R1 и R2, одинаковые или различные, представляют атом водорода или низшую алкильную группу или R1 и R2 могут объединяться с образованием низшей алкиленовой группы;
R3 представляет атом водорода или ацильную группу;
Y представляет атом азота;
А'' представляет 3-замещенную фенил-2-оксо-2,3-дигидро-1Н-имидазол-1-ильную группу,
или его соли.
24.09.93 - по пп.2, 3, 4, 5, 6, 12 и 13;
12.08.94 - по пп.1, 7, 8, 9, 10, 11, 14, 15, 16, 17 и 18.

Комментарии