Конденсированные гетероциклические соединения и ингибиторы сквален-синтетазы - RU2129547C1
Код документа: RU2129547C1
Чертежи







Описание
Изобретение относится к конденсированным гетероциклическим соединениям или их солям и к ингибиторам сквален-синтетазы, содержащим эти соединения в качестве эффективного компонента.
Гиперхолестеринемия, высокое кровяное давление и курение известны как три основных фактора риска, которые вызывают ишемические заболевания сердца. Для профилактики и терапии этих ишемических болезней сердца, а также склероза коронарных сосудов весьма важен контроль за концентрацией холестерина в крови.
Среди фармацевтических композиций, предназначенных для снижения содержания холестерина в крови, следует обратить внимание на те, которые контролируют биосинтез холестерина, помимо тех, которые ингибируют его абсорбцию за счет связывания желчной кислоты, включая, среди других, такие, как холестирамин, колестипол /раскрытые, например, в патенте США 4027009/, и тех, которые подавляют кишечную абсорбцию холестерина за счет ингибирования ацилкоэнзима A холестерин-ацил-трансферазы /АСАТ/, включая метинамид /раскрыт во французском патенте N 1476569/. В качестве фармацевтических препаратов для контроля биосинтеза холестерина для медицинского применения предложены: ловастатин /патент США 4231938/, симвастатин /патент США 4444784/, правастатин /патент США 4346227/ и т.д., которые способны ингибировать в особенности 3-гидрокси-3-метил-глутарил-коэнзим /HMG-CoA/-редуктазу. Однако при ингибировании HMG-CoA редуктазы происходит также ингибирование не только биосинтеза холестерина, но и биосинтеза некоторых других компонентов, таких как убихинон, долихол и гем A, которые необходимы для живых организмов, и поэтому возникающие нежелательные побочные эффекты становятся опасными.
Сквален-синтеза представляет собой энзим, который принимает участие в существенной стадии нового способа биосинтеза холестерина. Этот энзим представляет энзим, обеспечивающий катализируемую скваленом восстановительную димеризацию двух молекул фарнезилпирофосфорной кислоты.
С другой стороны, соединения, которые, как ожидают, являются ингибиторами биосинтеза холестерина за счет подавления сквален-синтетазы, раскрыты в Journal of Medicinal Chemistry. Vol. 51, N 10, pp. 1869-1871, 1988, в японских, опубликованных без экспертизы, заявках N H1-213288/1989/ JPA H1/1989/ - 213288/, JPA H2/1990/-101088, JPA H2/1990/-235820, JPA H2 /1990-235821, JPA H3/1991/-20226, JPA H3/1991/-68591, JPA H3/1991/-148288 и в патенте США 5019390, 5135935, WO9215579, WO9309155 и WO9313096.
Известны различные соединения, демонстрирующие противофунгицидную активность за счет ингибирования синтеза сквалена /JPA H4/1992/-279589, EP/475706, EP-494622, EP-503520 и др./.
Ссылки на производные 2-оксо-2,3,4,5-тетрагидро-1H-[1] -бензазепина имеются в J. Med. Chem., 14, 849 /1971/, Chem. Pharm. Bull, 38, 3331/1990/, J. Chem. Soc. PERKIN TPANS. 1, 353/1991/ и в J. Med. Chem. 14, 40/1971/.
Ссылки на производные 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепина имеются в J. Prakt. Chem. 36, 5/1967/, Arch. Pharm. 300, 299/1967/ и в патенте США 3463774.
2,3-Дигидро-2-оксо-1H-1,4-бензодиазепиновые производные, у которых в 3-положении находится алкильная группа, замещенная сложным эфиром, карбоновой кислотой или карбамоилом, а в положении 5- находится арильная группа, раскрыты в J. Heterocycl, Chem. 27, 631/1990/, JPA 63/1988/-24666, Bull, Chim. Farm., 113, 642/1974/, J. Chem. Soc., Chem. Commun, 1973, 721, J. Org. Chem, 38, 3502/1973/ и Journal of the Takeda Research Laboratories, 29, 134/1970/.
Ссылки на производные 2-оксо-2,3,5,6-тетрагидро-1H-4, 1- бензоксазоцина раскрыты в Chem. Pharm. Bull, 34/1/, 140/1986/.
Ссылки на производные 2,4-2,3,4,5-тетрагидро-1H-1,5-бензодиазепина имеются в "Heterocyclic Compounds" ed. by R. Yan Cryer /1991/ John Wiley and Sous, Inc. pp 289-313.
Ссылки на производные 2-оксо-1,2-дигидро-3H-1,3,4, -бензотриазепина имеются в японской открытой патентной выкладке N S 45-11148/1970/ JPB S 45/1970/-11148/.
Ссылки на производные 2-оксо-1,2,4,5-тетрадигидро-3H-1,3-бензодиазепина имеются в J. Chem. Soc. Perkin. Trans. 1/12/, 1331/1976/ и во французском патенте N 2528838.
Убихинон, долихол и гем A, как было известно, синтезированы из фарнезилпирофосфата по схеме биосинтеза холестерина. Поэтому во избежание побочных эффектов за счет потери этих соединений, желательно ингибировать энзимные системы следующие за фарнезилпирофосфатом, особенно, сквален-синтетазу, в схеме биосинтеза холестерина.
Учитывая вышесказанное, авторы изобретения предприняли тщательную исследовательскую работу и обнаружили, что конденсированные циклические соединения прекрасно ингибируют сквален-синтетазу, что и составило предмет изобретения.
Более конкретно, в настоящем изобретении предложено:
/1/. Соединение формулы /I/

где R1 представляет водород или необязательно замещенную углеводородную группу;
R'2 представляет необязательно замещенную фенильную группу, или необязательно замещенную ароматическую гетероциклическую кольцевую группу;
X'4 представляет заместитель, содержащий необязательно этерифицированную карбоксильную группу, необязательно замещенную карбамоильную группу, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, или необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород;
кольцо A представляет необязательно замещенное бензольное кольцо или необязательно замещенное ароматическое гетероциклическое кольцо;
кольцо J1 представляет 7-членное гетероциклическое кольцо, содержащее не более трех составляющих кольцо гетероатомов;
D представляет C или N;
Z1 представляет C, N, S(O)q (q = 0, 1 или 2), или 0;
K представляет C или N;
кольцо J1 необязательно имеет, помимо R1, R'2 и X', другие заместители, при условии, что конденсированное кольцо, состоящее из колец A и J1, не является 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепиновым кольцом, 2-оксо/2,3-дигидро или 2,3,4,5-тетрагидро/-1H-1, 4-бензодиазепиновым кольцом или 2,4-диокси-2,3,4,5-тетрагидро-1H-1,5-бензодиазепиновым кольцом, или его соль.
/2/. Соединение или его соль по п. /1/, где соединение представлено
формулой I'

где R1 представляет водород или необязательно замещенную углеводородную группу;
R'2 представляет необязательно замещенную фенильную группу или необязательно замещенную ароматическую гетероциклическую кольцевую группу;
X' представляет заместитель, содержащий необязательно этерифицированную карбоксильную группу, необязательно замещенную карбомоильную группу, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, или необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород;
кольцо A представляет необязательно замещенное бензольное кольцо или необязательно замещенное ароматическое гетероциклическое кольцо;
кольцо J2 представляет 7-членное гетероциклическое кольцо;
Z2 представляет S(O)q (q = 0, 1 или 2), C или O;
K представляет C или N;
G представляет O или S, при условии, что конденсированное кольцо, состоящее из колец A и J2, не является 2-оксо-1,2,3, 5-тетрагидро-4,1-бензоксазепиновым кольцом или его соль.
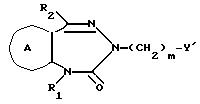
/3/. Ингибитор сквален-синтетазы, содержащий соединение формулы I''

где R1 представляет водород или необязательно замещенную углеводородную группу;
R2 представляет водород, необязательно замещенную алкильную группу, необязательно замещенную фенильную группу, или необязательно замещенную группу ароматического гетероциклического кольца;
X' представляет заместитель, содержащий необязательно этерифицированную карбоксильную группу, необязательно замещенную карбомоильную группу, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу или необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород;
кольцо A представляет необязательно замещенное бензольное кольцо или необязательно замещенное ароматическое гетероциклическое кольцо;
кольцо J' представляет 7- или 8-членное гетероциклическое кольцо, содержащее не более трех составляющих кольцо гетероатомов;
D представляет C или N;
причем кольцо J' необязательно имеет, помимо R1, R2 и X', дополнительные заместители, при условии, что конденсированные кольца A и J' не являются 2-оксо-1,2,3, 5-тетрагидро-4,1-бензоксазепиновым кольцом,
или его фармацевтически приемлемую соль.
/4/. Ингибитор по п. /3/, где соединение представлено формулой I'''

где R1 представляет водород или необязательно замещенную углеводородную группу;
R2 представляет водород, необязательно замещенную алкильную группу, необязательно замещенную фенильную группу или необязательно замещенную ароматическую гетероциклическую группу;
X1 представляет связь или двухвалентную атомную цепочку;
Y представляет необязательно этерифицированную карбоксильную группу, необязательно замещенную карбомоильную группу, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, или необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород;
кольцо A представляет необязательно замещенное бензольное кольцо или необязательно замещенное ароматическое гетероциклическое кольцо;
Z3 представляет =N-, -N(R7)- /где R7 представляет H, алкильную или ацильную группу/; -S-, -S/O/-, S/O2/-, -CH2- или -O-;
G4 представляет O или S;
символом

или его фармацевтически приемлемая соль.
Далее в настоящем изобретении предложен способ получения новых соединений, представленных формулой I, или их солей.
В формулах I, I', I'', I''' в качестве углеводородной группы в выражении "необязательно замещенные углеводородные группы", представленной R1, фигурируют углеводородные группы типа алифатических цепочек, алициклические углеводородные группы и арильные группы и т.д., причем наиболее предпочтительны углеводородные группы типа алифатических цепочек.
В качестве алифатических углеводородных групп типа цепочек можно указать, например, такие разветвленные или неразветвленные алифатические углеводородные группы, как алкильные группы, алкенильные группы, алкинильные группы, и т.д., причем наиболее предпочтительны алкильные группы. В качестве алкильных групп можно указать, например, такие C1-7-алкильные группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор.-бутил, трет-бутил, н-пентил, изопентил, неопентил, 1-метилпропил, н-гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 3,3-диметилпропил, 2-этилбутил, н-гептил и т. д. , причем среди них предпочтительны такие C3-5-алкильные группы, как н-пропил, изопропил, изобутил, неопентил и т.д., причем наиболее предпочтительны изобутил и неопентил. В качестве указанных алкильных групп можно указать, например, такие C2-6-алкенильные группы, как винил, аллил, изопропенил, 2-метилаллил, 1-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-этил-1-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил и т.д., и среди них наиболее предпочтительны винил, аллил, изопропенил, 2-метилаллил, 2-метил-1-пропенил, 2-метил-2-пропенил, 3-метил-2-бутенил и т.д. В качестве указанных алкильных групп можно указать, например, такие C2-6-алкинилы, как этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, и т.д., причем наиболее предпочтительны этинил, 1-пропинил, 2-пропинил.
Примеры алициклических углеводородных групп включают насыщенные или ненасыщенные алициклические углеводородные группы, такие как циклоалкильные группы, циклоалкенильные группы, циклоалкандиенильные группы и т.д. В качестве указанных циклоалкильных групп предпочтительны C3-9-циклоалкильные группы, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, и циклононил и т.д., причем наиболее предпочтительны C3-6-циклоалкильные группы, такие, как циклопропил, циклобутил, циклогептил, циклогексил и т.д. В качестве циклоалкенильных групп можно указать, например 2-циклопентен-1-ил, 3-циклопентен-1-ил, 2-циклогексен-1-ил, 3-циклогексен-1-ил, 1-циклобутен-1-ил, -циклотентен-1-ил и т.д. Примерами указанных циклоалкадиенильных групп могут служить, например, 2-циклопентадиен-1-ил, 2,4-циклогексадиен-1-ил, 2,5-циклогексадиен-1-ил и т.д.
Примерами арильных групп в указанных углеводородных группах являются моноциклические или конденсированные полициклические ароматические углеводородные группы, например фенил, нафтил, антрил, фенантрил, аценафтиленил и т. д., и среди них наиболее предпочтительны фенил, 1-нафтил, 2-нафтил и т.д.
В качестве заместителей у "необязательно замещенных углеводородных групп", представленных R1, можно указать необязательно замещенные циклоалкильные группы или циклоалкенильные группы, необязательно замещенные гетероциклические группы, необязательно замещенные аминогруппы, необязательно замещенные гидроксильные группы, необязательно замещенные тиольные группы, галоиды /например, фтор, хлор, бром, иод/ оксогруппы и т.д., и углеводородные группы, представленные R1, необязательно замещенные 1-5 /предпочтительно 1-3/ из этих заместителей в любом возможном положении. В качестве арильных групп в указанных необязательно замещенных арильных группах можно указать фенил, нафтил, антрил, фенантрил, ацетафтилен и т.д., и среди них фенил, 1-нафтил- и 2-нафтил предпочтительны. В качестве заместителей указанного необязательно замещенного арила, можно указать C1-3-алкоксигруппы /например, метокси, этокси, пропокси и т.д./, атомы галоидов /например, фтор, хлор, бром, иод/, C1-3-алкильные группы /например, метил, этил, пропил и т.д./, и этот арил может быть замещен произвольно одной или двумя из них. В качестве циклоалкильных групп указанных "необязательно замещенных циклоалкильных групп", можно указать C3-7циклоалкильные группы, включая циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д. Тип и количество заместителей в указанных необязательно замещенных циклоалкильных группах практически те же, что и в случае вышеуказанных арильных групп. В качестве циклоалкильных групп в указанных необязательно замещенных циклоалкенильных группах можно указать, наряду с другими, такие C3-6 -циклоалкенильные группы, как циклопропенил, циклобутенил, циклопентенил, циклогексенил и т.д. Типы и количество заместителей у указанных необязательно замещенных циклоалкенильных групп практически те же, что и в случае вышеупомянутых необязательно замещенных арильных групп. В качестве гетероциклических групп в указанных необязательно замещенных гетероциклических группах можно указать ароматические гетероциклические группы, содержащие в качестве составляющих циклическую систему атомов по крайней мере один гетероатом, выбранный из кислорода серы и азота, и насыщенные или ненасыщенные неароматические гетероциклические группы /алифатические гетероциклические группы/. В качестве ароматических гетероциклических групп можно указать ароматические моноциклические гетероциклические группы /например, фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, фуразанил, 1,2,3-тиадиазолил, 1,2, 4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-трииазолил, 1,2,4-триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, триазинил и т.д./ и ароматические конденсированные гетероциклические группы/, например, бензофуранил, изобензофуранил, бензо[b] тиенил, индолил, изоиндолил, 1H-индазолил, бензимидазолил, бензоксазолил, 1,2-бензоизоксазолил, бензотиазолил, 1,2-бензоизотиазолил, 1H-бензотриазолил, хинолил, изохинолил, циннолинил, хиназолинил, хиноксалинил, фталазинил, нафтиридинил, пуринил, птеридинил, карбазолил, α- карболинил, β- карболинил, γ- карболинил, акридинил, феноксазинил, фенотиазинил, феназинил, феноксатиинил, тиантренил, фенатридинил, фенантролинил, индолизин, пирро[1,2-b] пиридазинил, пиразоло[1,5-b]пиридил, имидазо[1,2-a] пиридил, имидазо[1, 5-a]пиридил, имидазо[1,2-b]пиридазинил, имидазо[1,2-b]пиримидинил, 1,2,4-триазоло[4,3-a]пиридил, 1,2,4-триазоло[4,3-b]пириданизил и т. д./, и, среди них предпочтительны фурил, тиенил, индолил, изоиндолил, пиразинил, пиридил, пиримидинил. Примеры указанных неароматических гетероциклических групп включают оксаринил, азетидинил, оксетанил, тиетанил, пирролидинил, тетрагидрофурил, тиоланил, пиперидил, тетрагидропиранил, морфолинил, тиоморфолинил, пиперазинил и т.д. В качестве заместителей у указанных замещенных гетероциклических групп можно указать C1-3-алкильные группы /например, метил, этил, пропил и т.д./. Примеры заместителей у указанных необязательно замещенных аминогрупп, необязательно замещенных гидроксильных групп и необязательно замещенных гидроксильных групп и необязательно замещенных тиольных групп включают низший /C1-3/алкил /например, метил, этил, пропил и т.д./. И, если углеводородные группы в необязательно замещенных углеводородных группах представленных R1 являются алициклическими углеводородными группами или арильными группами, они могут содержать в качестве заместителей C1-3-алкильные группы /например, метил, этил, пропил и т.д./.
Далее примеры R1 включают необязательно замещенные C1-6-ацильные группы, такие как формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, диметилацетил, триметилацетил и т.д. Указанные ацильные группы могут содержать от одного до пяти соответствующих заместителей в любом возможном положении. Такие заместители включают атомы галоидов /например, фтор, хлор, бром/.
В формулах I, I', I'' и I'' в качестве заместителей у "необязательно замещенных фенильных групп" представленных
R2 и R'2, можно указать галоид /например, фтор, хлор, бром, иод/, необязательно замещенный низший алкил, необязательно замещенную низшую алкокси, необязательно замещенную
гидроксильную группу, нитро, циано, и т.д., и фенильная группа может быть, предпочтительно, замещена 1-3 /предпочтительно, 1-2/ из этих заместителей в любом возможном положении. В качестве низшего
алкила можно указать, например, С1-4-алкильные группы, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и т.д., и особенно метил и этил предпочтительны. В
качестве низшей алкокси можно указать C1-4-алкоксигруппы, включая метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и т.д., и особенно
предпочтительны метокси и этокси. В качестве заместителей указанных необязательно замещенных низших алкильных групп или необязательно замещенных низших алкоксигрупп, можно указать атомы галоидов
/например, фтор, хлор, бром, иод и т.д./, и от одной до пяти из них могут быть необязательно замещенных в любом возможном положении. В качестве заместителей указанных необязательно замещенных
гидроксильных групп можно указать, например, C1-4-алкильные группы /например, метил, этил, пропил, изопропил, бутил, трет-бутил и т.д./, C3-6-циклоалкильные группы /циклопропил,
циклобутил, циклопентил, циклогексил и т.д./, арильные группы /например, фенил, 1-нафтил, 2-нафтил и т.д./, аралкильные группы /например, бензил, фенэтил и т.д./. Эти заместители могут образовывать
кольца, взятые вместе с соседними заместителями, например такие кольца, как

Указанные кольца могут быть замещены низшим /C1-3/алкилом/ /например, метилом, этилом, пропилом, изопропилом и т.д./ и т.п. В качестве ароматических гетероциклических групп "необязательно замещенных ароматических гетероциклических групп", представленных R2 или R'2, можно указать ароматические гетероциклические группы, подробно описанные для R1, и наиболее предпочтительны среди них фурил, тиенил, индолил, изоиндолил, пиразинил, пиридил, пиримидинил, имидазолил и т.д. В качестве заместителей указанных ароматических гетероциклических групп можно указать C1-3-алкильные группы /например, метил, этил, пропил и т.д./.
В формулах I'' и I''' в качестве алкильных групп "необязательно замещенных алкильных групп", представленных R2, можно указать C1-6-низшие алкильные группы /например, метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил и т.д./, и, среди них наиболее предпочтительны C1-4-алкильные группы, включая метил, этил, пропил, изопропил, бутил и трет-бутил. В качестве заместителей указанных необязательно замещенных алкильных групп можно указать галоиды /например, фтор, хлор, бром, иод/, C1-4-низшие алкоксигруппы /например, метокси, этокси, пропокси, изопропокси, бутокси, третбутокси и т.д./.
Среди вышеуказанных групп, представленных R2 или R'2, предпочтительно необязательны замещенные фенильные группы, предпочтительно замещенные фенильные группы, и наибольшее предпочтение отдается фенильным группам, замещенным галоидом, низшей алкокси и т.д.
В вышеуказанных формулах I, I' и I'' в качестве заместителя, содержащего необязательно этерифицированную карбоксильную группу, представленную X', можно указать необязательно этерифицированные карбоксильные группы и заместители, которые содержат необязательно этерифицированную карбоксильную группу и т.д. Указанные необязательно этерифицированные карбоксильные группы практически те же, что и в случае указанных далее необязательно этерифицированных карбоксильных групп, представленных Y.
В качестве "заместителя, содержащего необязательно замещенную карбамоильную группу", представленную X', можно указать необязательно замещенные карбамоильные группы и заместители, содержащие необязательно замещенную карбамоильную группу, и т. д. Указанные необязательно замещенные карбамоильные группы практические те же, что и в случае указанных далее необязательно замещенных карбамоильных групп, представленных Y.
В качестве "заместителя, содержащего необязательно замещенную гидроксильную группу", представленную X', можно указать необязательно замещенные гидроксильные группы и заместитель с необязательно замещенной гидроксильной группой, и т.д. Указанные необязательно замещенные гидроксильные группы практически такие же, что и в случае указанных далее необязательно замещенных гидроксильных групп, представленных Y.
В качестве "заместителя, содержащего необязательно замещенные аминогруппу", представленную X', можно указать необязательно замещенные аминогруппы и заместители, содержащие необязательно замещенные аминогруппы, и т.д. Указанные необязательно замещенные аминогруппы практически такие же, что и в случае указанных далее необязательно замещенных аминогрупп, представленных Y.
В качестве "заместителя, содержащего необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород", представленный X', можно указать необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород и заместитель, содержащий необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород, и т.д. Указанные необязательно замещенные гетероциклические радикалы, практически такие же, что и в случае указанных далее в необязательно замещенных гетероциклических радикалов, представленных Y.
Примеры X' включают группы, представленные формулой /a/:

где X представляет связь или двухвалентную или трехвалентную атомную цепочку;
Y представляет необязательно этерифицированную карбоксильную группу, необязательно замещенную карбомоильную группу, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу или необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород;
символ

В формуле /a/ в качестве "двухвалентной атомной цепочки", представленной X, можно указать, предпочтительно, любую из двухвалентных цепочек, содержащей 1-7 атомов, предпочтительно, 1-4, представляющих неразветвленную цепочку, или они могут иметь боковые цепочки.
Так, например, можно указать цепочки формулы

где m и n независимо представляют 0, 1, 2 или 3;
E представляет связь или атом кислорода, атом серы, сульфоксид, сульфон, -N(R3)-, -NHCO-, -CON(R5)- или -NHCONH-, где R4 и R5 представляют H, необязательно замещенную алкильную группу, необязательно замещенную аралкильную группу или необязательно замещенную фенильную группу; а R3 представляет H, низшую алкильную группу, аралкильную группу или ацильную группу.
В качестве алкильных групп "необязательно замещенных низших алкильных групп", представленных R4 и R5, можно указать C1-6-неразветвленные или разветвленные низшие алкильные группы /например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил и т.д. /.
В качестве заместителей указанных необязательно замещенных низших алкильных групп можно указать ароматические гетероциклические группы /например, фурил, индолил, изоиндолил, пиразинил, пиридил, пиримидил, имидазолил и т.д. /, необязательно замещенную аминогруппу, необязательно замещенную гидроксильную группу, необязательно замещенную тиольную группу, необязательно этерифицированную карбоксильную группу, атомы галоидов /например, фтор, хлор, бром, иод/, и т.д. В качестве заместителей указанной необязательно замещенной аминогруппы, необязательно замещенной гидроксильной группы и необязательно замещенной тиольной группы можно указать низший /C1-3/алкил /например, метил, этил, пропил и т.д./, или тому подобные. Примеры указанных необязательно этерифицированных карбоксильных групп включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, феноксикарбонил, 1-нафтоксикарбонил и т.д., предпочтительно метоксикарбонил, этоксикарбонил и пропоксикарбонил.
В качестве аралкильных групп "необязательно замещенных аралкильных групп", представленных R4 и R5, можно указать бензил, нафтилметил, фенилпропил, фенилбутил и т.д. В качестве заместителей указанных необязательно замещенных аралкильных групп можно указать атомы галоидов /например, фтор, хлор, бром, иод/, C1-3-алкоксигруппы /например, метокси, этокси, пропокси/, гидоксильную группу, аминогруппу, карбоксильную группу, сульфгидрильную группу, и т.д.
В качестве заместителей "необязательно замещенных фенильных групп", представленных R4 и R5, можно указать атомы галоидов /например, фтор, хлор, бром, иод/,
C1-3-алкокси /например, метокси, этокси, пропокси и т.д./, C1-3алкил /например, метил, этил, пропил и т.д./,
при условии, что R4 могут отличаться в каждой
цепи.
И, в качестве каждой "низшей алкильной группы" и "аралкильной групы", представленной R3, можно указать C1-4-низшие алкильные группы /например, метил, этил, пропил, бутил, трет-бутил и т.д./, C7-15-аралкильные группы /например, бензил, фенэтил, фенилпропил, фенилбутил, нафтилметил и т.д./.
В качестве "ацильной группы", представленной R3, можно указать низшие алканоильные группы /например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и т.д./, низшие алкеноильные группы /например, акрилоил, метакрилоил, кротоноил, изокротоноил и т.д./, циклоалканкарбонильные группы /например, циклопропанкарбонил, циклобутанкарбонил, циклопентанкарбонил, циклогексанкарбонил и т.д./, низшие алкансульфонильные группы /например, мезил, этансульфонил, пропансульфонил и т.д./, ароильные группы /например, бензоил, паратолуолил, 1-нафтоил, 2-нафтоил и т. д./, арил/низший/алканоильные группы /например, фенилацетил, фенилпропионил, гидроатропоил, фенилбутирил и т. д. / арил/низший/алкеноильные группы /например, циннамоил, атропоил и т.д./, аренсульфонильные группы /например, бензолсульфонил, пара-толуолсульфонил и т.д./.
Кроме того, в качестве X можно указать углеродную цепочку, содержащую двойную связь или -L-C/OH/- /где L представляет связь или разветвленную или неразветвленную алкиленовую цепочку/. Когда говорят "углеродная цепочка, содержащая двойную связь", предпочтительно, имеют ввиду те, в которых число атомов углерода, составляющих неразветвленную часть, составляет 1-7, более предпочтительно 1-4, и они могут необязательно иметь боковую цепь. Хотя двойная связь указанной углеродной цепочки может находиться как в неразветвленной части и/или разветвленной части цепи, предпочтительно, чтобы она находилась в неразветвленной части цепи. Количество двойных связей в указанной углеродной цепочке не ограничено поскольку это имеет смысл, и предпочтительно, оно составляет 1-2.
Примеры углеродных цепочек, содержащих указанную двойную связь, включают метин, винилен, пропенилен, бутинилен, бутадиенилен, метилпропенилен, этилпропенилен, пропилпропенилен, метилбутенилен, этилбутенилен, пропилбутенилен, метилбутадиенилен, этилбутадиенилен, пропилбутадиенилен, пентенилен, гексенилен, гептенилен, гексадиенилен и гептадиенилен, предпочтительно метин, винилен, пропенилен, бутенилен и бутадиенилен. В тех случаях, когда указанная углеродная цепочка является трехвалентной, она связывается с атомом углерода на кольце Y1, Y2 или Y' в любом возможном положении двойной связью.
Примеры "разветвленных или неразветвленных алкиленовых цепочек", представленные L, включают разветвленные или неразветвленные C1-6-алкиленовые цепочки, более конкретно, такие двухвалентные, как метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, пропилен, этилметилен, этилэтилен, пропилэтилен, бутилэтилен, метилтетраметилен и метилтриметилен и, предпочтительно, такие C1-3 как метилен, этилен, триметилен и пропилен.
Среди приведенных выше примеров групп, представленных X', группы формулы /b/
-X1 - Y,
где X1 представляет связь или двухвалентную атомную цепочку;
Y представляет необязательно этерифицированную карбоксильную группу, необязательно замещенную карбомоильную группу, необязательно замещенную гидроксильную группу, необязательно замещенную
аминогруппу, или необязательно замещенный гетероциклический радикал, содержащий протонизируемый водород, являются предпочтительными.
В формуле b "двухвалентные атомные цепочки", представленные X1, практически те же, что и в случае вышеуказанных двухвалентных атомных цепочек, представленных X.
В формулах a и b в качестве "двухвалентных атомных цепочек", представленных X или X1, более предпочтительно можно указать разветвленные или неразветвленные алкиленовые цепочки, в которых число атомов углерода, составляющих неразветвленную цепочку, составляет 1-7 /предпочтительно, 1-4/. Примеры указанных алкиленовых цепочек включают такие двухвалентные цепочки, как метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, гептаметилен, пропилен, этилметилен, этилэтилен, пропилэтилен, бутилэтилен, метилтетраметилен и метилтриметилен, и предпочтительно, C1-4, такие, как метилен, этилен, триметилен и пропилен.
В формулах a и b в качестве "необязательно этерифицированных карбоксильных групп", представленных Y, можно указать низший алкоксикарбонил /например, метоксикарбонил/, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, втор-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил и т.д./, арилоксикарбонил /например, феноксикарбонил, 1-нафтоксикарбонил, бензилоксикарбонил и т.д./. Среди них предпочтительны карбоксильная группа, метоксикарбонил и этоксикарбонил. Примеры заместителей "необязательно замещенной карбомоильной группы", представленных Y, включают необязательно замещеннный низший /C1-6/алкил /например, метил, этил, н/пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил и т. д. /, необязательно замещенные C3-6-циклоалкильные группы /например, циклопропил, циклобутил, циклопентил, циклогексил и т.д./, необязательно замещенные арильные группы /например, фенил, 1-нафтил, 2-нафтил, и т. д. /, необязательно замещенные аралкильные группы/ /например, бензил, фенэтил и т.д./, и один или два из этих заместителей могут быть независимо замещены. В качестве заместителей на указанном необязательно замещенной низшей /C1-6/алкильной и необязательно замещенной C3-6 -циклоалкильной группе, можно указать карбоксильную группу, необязательно этерифицированную низшим /C1-5/алкилом /например, метилом, этилом, пропилом, изопропилом, бутилом, трет-бутилом, пентилом, изопентилом, неопентилом и т.д./, ароматические гетероциклические группы /например, фурил, тиенил, индолил, изоиндолил, пиразинил, пиридил, пиримидил, имидазолил и т.д./, аминогруппу, гидроксильную группу, фенильную группу и т.д., и от одного из трех заместителей могут быть независимо замещены.
В качестве заместителей указанных необязательно замещенных арильных групп и необязательно замещенных аралкильных групп, можно указать атомы галоидов /например, фтор, хлор, бром, иод/, карбоксильные группы, необязательно этерифицированные низшим /C1-4 /алкилом /метилом, этилом, пропилом, изопропилом, бутилом, трет-бутилом и т.д./. И два заместителя на атоме азота могут образовывать циклическую аминогруппу вместе с атомом азота. Примеры таких циклических аминогрупп включают 1-азетидинил, 1-пирролидинил, пиперидино, морфолино, 1-паперазинил и так далее.
Примеры заместителей "необязательно замещенных гидроксильных групп", представленных Y, включают низший /C1-4/алкил /например, метил, этил, пропил, изопропил, бутил, трет-бутил, и т. д./, C3-6-циклоалкильные группы /например, циклопропил, циклобутил, циклопентил, циклогексил и т.д./, необязательно замещенные арильные группы /например, фенил, 1-нафтил, 2-нафтил и т. д./, необязательно замещенные аралкильные группы /например, бензил. фенэтил и т. д. /. В качестве заместителей указанных необязательно замещенных арильных групп и необязательно замещенных аралкильных групп можно указать атомы галоидов /например, хлор, фтор, бром, иод/, карбоксильные группы, необязательно этерифицированых низшим C1-4-алкилом /например, метилом, этилом, пропилом, изопропилом, бутилом, трет-бутилом и т.д./, и т.д.
Примеры заместителей "необязательно замещенных аминогрупп", представленных Y, включают низший /C1-4-алкил /например, метил, этил, пропил, изопропил, бутил трет-бутил и т.д./, C3-6 -циклоалкильные группы /например, циклопропил, циклобутил, циклопентил, циклогексил и т.д./, необязательно замещенные арильные группы /например, фенил, 1-нафтил, 2-нафтил и т.д./, необязательно замещенные аралкильные группы /например, бензил, фенэтил и т.д./. В качестве заместителей указанных необязательно замещенных арильных групп и необязательно замещенных аралкильных групп можно указать атомы галоидов /например, фтор, хлор, бром, иод/, карбоксильные группы, необязательно этерифицированные низшим /C1-4-алкилом /например, метилом, этилом, пропилом, изопропилом, бутилом, трет-бутилом и т.д./. Два заместителя на атоме азота могут образовывать вместе с этим атомом азота циклическую аминогруппу. Примеры циклических аминогрупп включают 1-азетидинил, 1-пирролидинил, пиперидино, морфолино, 1-пиперазинил и т.д.
В качестве гетероциклических радикалов "необязательно замещенного гетероциклического радикала, содержащего протонизируемый водород",
представленного Y, можно указать 5-7-членный /предпочтительно, 5-членный/ моноциклический гетероциклический радикал, содержащий по крайней мере один гетероатом, выбранный из группы, состоящей из N, S
и O, более предпочтительно, N-содержащий гетероциклический радикал. Наиболее предпочтительны тетразол-5-ил и группы формулы

где i обозначает -O- или -S-; обозначает

Указанный гетероциклический радикал может быть защищен необязательно замещенным низшим алкилом /предпочтительно, C1-4-алкилом/, ацилом и т.д. В качестве необязательно замещенных низших алкилов можно указать метил, трифенилметил, метоксиметил, этоксиметил, пара-метоксибензил, пара-нитробензил и т.д. Примеры указанных ацилов включают низший/C2-5/алканоил, бензоил и т. д.
Среди вышеуказанных групп, представленных X', предпочтительны алкильные группы, замещенные необязательно этерифицированной карбоксильной группой или алкильной группой, замещенной необязательно замещенным гетероциклическим радикалом, содержащим протонизируемый водород.
В формулах I, I', I'' и I''' в качестве ароматических гетероциклических колец, представленных кольцом A, можно указать ароматические и гетероциклические группы,
подробно описанные в отношении R1. Среди них предпочтительны группы формулы
В качестве заместителей "необязательно замещенных бензольных колец" и "необязательно замещенных ароматических гетероциклических групп" можно указать галоид /например, фтор, хлор, бром, иод/, C1-4 необязательно замещенные низшие алкильные группы /например, метил, этил, пропил, бутил, трет-бутил и т. д. /, C1-4 необязательно замещенные низшие алкоксигруппы /метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси и т.д./, нитрогруппы, цианогруппы и т.д. Кольцо A может иметь 1-3 из этих заместителей, предпочтительно 1-2. Эти заместители вместе с соответствующими соседними заместителями могут образовывать кольцо. В качестве заместителей указанных необязательно замещенных низших алкильных групп или необязательно замещенных низших алкоксигрупп можно указать атомы галоидов /например, фтор, хлор, бром, иод/, и т.д., которые могут иметь 1-3 заместителя в произвольных положениях. Для колец A предпочтительны те, которые замещены метоксигруппой или атомом хлора, и особенно предпочтительны те, которые замещены атомом хлора.
В формуле /I/ в качестве гетероциклических колец "7-членного гетероциклического кольца, содержащего не более трех составляющих кольцо гетероатомов", представленных кольцом J1, можно указать насыщенные или ненасыщенные 7-членные гетероциклические кольца, содержащие, в качестве атомов, составляющих гетероциклическое кольцо, по крайней мере один гетероатом, выбранный из O, S(O)q (q = 0, 1 или 2) и N, при условии, что количество гетероатомов среди атомов, составляющих циклическую систему /атомов кольца/ указанного гетероциклического кольца, не превышает трех.
Кольцо J1, помимо групп, представленных R2, R'2 и X', может необязательно иметь один или два соответствующих заместителя в любом возможном положении. В качестве указанных заместителей, если они связаны с атомом азота кольца J1 / Z1 представляет N /, можно указать C1-6-разветвленные или неразветвленные алкильные группы /например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил и т.д./, ацильные группы, такие, как C1-4ацильные группы /например, формил, ацетил, пропионил, бутироил и т.д./. Указанный алкил или указанный ацил могут иметь от одного до пяти атомов галоидов /например, фтора, хлора, брома, иод/. И, если указанный заместитель связан с атомом углерода или кольцом J1, можно указать оксо, тиооксо и необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу и т.д. Указанные необязательно замещенная гидроксильная группа и указанная необязательно замещенная аминогруппа практически те же, что и "необязательно замещенная гидроксильная группа" и "необязательно замещенная аминогруппа", представленные Y.
Кольцо J1 предпочтительно, замещено оксо или тиооксо, помимо групп R1, R'2 и X', в любом возможном положении.
D в качестве атома, составляющего циклическое кольцо /атом кольца/, предпочтительно, представляет C. K, в качестве составляющего кольцо атома, предпочтительно, представляет C.
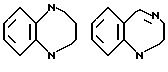
В качестве конденсированных колец, состоящих из колец A и J1 можно указать





В качестве формулы I предпочтительна формула I'.
В формуле I' в качестве 7-членных
гетероциклических колец, представленных кольцом J2, можно указать насыщенные 7-членные гетероциклические кольца, содержащие в качестве атомов, составляющих циклическое кольцо, по крайней
мере один гетероатом, выбранный из O, S(O)q (q = 0, 1 или 2) и N
Z2 в качестве составляющего кольца атома, предпочтительно представлено S(O)q (q = 0, 1 или
2). K, в качестве составляющего кольцо атомов, предпочтительно, представлено С.
В формуле I', G более предпочтительно, представляет O.
Кроме того, в качестве формулы I',
представленной формулой

где R1, X', кольцо A, Z2 и G имеют практически указанные ранее значения;
кольцо B представляет замещенную фенильную группу, при условии, что, если Z2 представлено -O-, а кольцо A необязательно замещенным бензольным кольцом, G, предпочтительно представляет S.
Примеры заместителей "замещенной фенильной группы", представленные кольцом B, практически те же, что и в случае вышеуказанных заместителей "необязательно замещенной фенильной группы", представленной R'2.
В формуле I'' в качестве гетероциклических колец 7- или 8-членного гетероциклического кольца, содержащего не более трех составляющих кольцо гетероатомов", представленного кольцо J', можно указать насыщенные или ненасыщенные 7- или 8-членные гетероциклические кольца, содержащие в качестве составляющих циклическое кольцо гетероатомов, по крайней мере один гетероатом, выбранный из O, S(О)q (q = 0, 1, 2) и N, при условии, что количество гетероатомов среди атомов, составляющих циклическую систему /атомов кольца/ указанного гетероциклического кольца, составляет не более трех.
Кольцо J' может необязательно иметь, помимо групп, представленных R1, R5 и X' один или два соответствующих заместителя в подходящих положениях. В качестве указанных заместителей, если они связаны с атомом азота в кольце J', можно указать C1-6- разветвленные или неразветвленные алкильные группы /например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил и т.д./, такие ацильные группы, как C1-4-ацильные группы/ например, формил, ацетил, пропионил, бутироил и т.д./. Указанный алкил или указанный ацил могут содержать от одного до пяти атомов галоида /например, фтор, хлор, бром, иод/. А если указанный заместитель связан с атомом углерода или кольцом J', можно указать оксо, тиооксо, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу и т.д. Указанная необязательно замещенная гидроксильная группа и указанная необязательно замещенная аминогруппа практически те же, что и "необязательно замещенная гидроксильная группа" и "необязательно замещенная аминогруппа", представленные Y.
Кольцо J' предпочтительно замещено оксо или тиооксо, помимо групп R1, R2 и X' в любом возможном положении.
В качестве
конденсированных колец, состоящих из кольца A и кольца J', можно указать следующие:





D в качестве составляющего кольцо атома предпочтительно представляет C.
Формула I''
предпочтительна в виде формулы I'''
Z3 предпочтительно, представляет S(O)q (q = 0, 1 или 2)
G предпочтительно представляет O.
В формуле I''' в качестве алкильных групп, представленных R7, можно указать C1-6-разветвленные или неразветвленные низшие алкильные группы /например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил и т.д./, которые могут необязательно быть замещены 1-5 атомами галоидов /например, фтора, хлора, брома, иода/.
В качестве ацильных групп, представленных R7, можно указать C1-4ацильные группы /например, формил, ацетил, пропионил, бутироил и т.д./, которые могут быть необязательно замещены 1-5 атомами галоидов /например, фтора, хлора, брома, иода/.
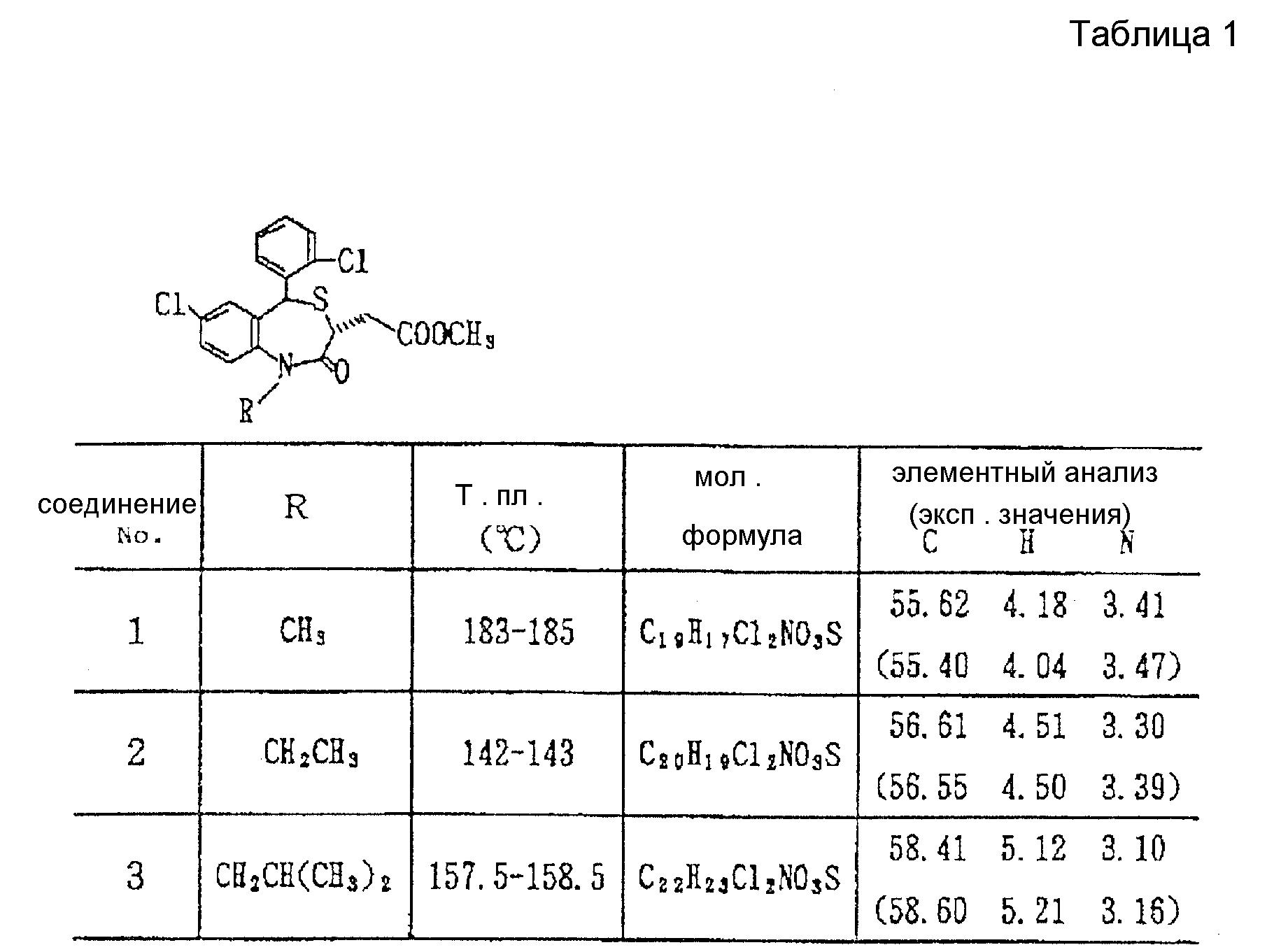
В настоящем изобретении специально раскрыты следующие соединения:
3,5-цис-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,
5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты
метиловый сложный эфир;
3,5-транс-7-хлор-5-/2-хлорфенил/-1-пропил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
3,
5-транс-7-хлор-5-/2-хлорфенил/-1-изобутил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
3,5-транс-7-хлор-5-/2-метоксифенил/-2-оксо-1-пропил-1,2,3,
5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
3,5-транс-7-хлор-5-/2-метоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты
метиловый сложный эфир;
3,5-транс-7-хлор-5-/2-метоксифенил/-1-изобутил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
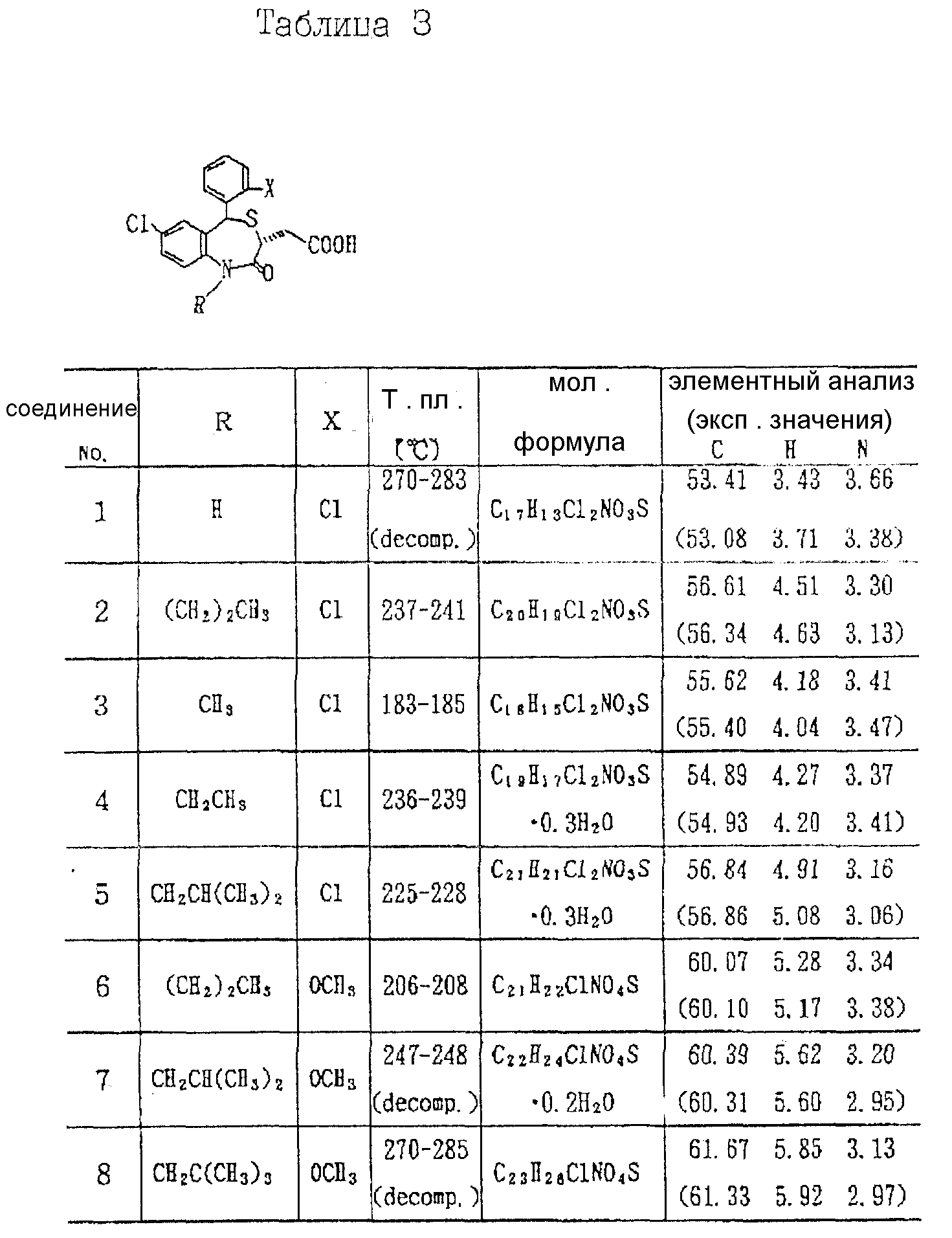
3,
5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлорфенил/-1-изобутил-2-оксо- 1,2,3,5-тетрагидро-4,
1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-метоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/2-метоксифенил/-1-изобутил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
/3R/-7-хлор-5-/2-хлорфенил/-2,3-дигидро-1-изобутил-2-оксо-1H- 1,
4-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
/3R/-7-хлор-5-/2-хлорфенил/-2,3-дигидро-1-изобутил-2-оксо-1H- 1,4-бензотиазепин-3-уксусная кислота;
/3R,
5S/-7-хлор-5-/2-хлорфенил/-2,3,4,5-тетрагидро-1-изобутил- 2-оксо-1H-1,4-бензотиазепин-3-уксусная кислота;
/3S/-7-хлор-5-/2-хлорфенил/-2,3-дигидро-1-изобутил- 2-оксо-1H-1,
4-бензотиазепин-3-уксусной кислоты метиловый сложный эфир;
/3S/-7-хлор-5-/2-хлорфенил/-2,3-дигидро-1-изобутил- 2-оксо-1H-1,4-бензотиазепин-3-уксусная кислота;
/N-/3,
5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-ацетил/глицина метиловый сложный эфир;
/N-/3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,
5- тетрагидро-4,1-бензотиазепин-3-ацетил/глицин;
3,5-транс-7-хлор-5-/2-хлорфенил/-3-диметиламинокарбонилметил- 1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-безнотиазепин,
7-хлор-5-/2-хлорфенил/-1-изобутил-2-оксо-2,3,4,5-тетрагидро-1H- [1]-бензазепин-3-уксусной кислоты этиловый сложный эфир;
7-хлор-5-/2-хлорфенил/-1-изобутил-2-оксо-2,3,4,
5-тетрагидро-1H- [1]-бензазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-1,2,3,5-тетрагидро- 2-тиооксо-4,1-бензазепин-3-уксусной кислоты этиловый сложный эфир;
3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-1,2,3,5-тетрагидро- 2-тиооксо-4,1-бензазепин-3-уксусная кислота;
7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-тиено[2,
3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир;
3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота;
3,
5-транс-7-хлор-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир;
3,
5-цис-7-хлор-5-/2-метоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир;
3,
5-транс-7-хлор-5-/2-метоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота;
3,5-цис-7-хлор-5-/2-метоксифенил/-1-неопентил-2-оксо-1,2,3,
5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота;
3,5-транс-7-хлор-1-изобутил-5-/2-метоксифенил/-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый
сложный эфир;
3,5-цис-7-хлор-1-изобутил-5-/2-метоксифенил/-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир;
3,
5-транс-7-хлор-1-изобутил-5-/2-метоксифенил/-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота;
3,5-цис-7-хлор-1-изобутил-5-/2-метоксифенил/-2-оксо- 1,2,3,5-тетрагидро-4,
1-тиено[2,3-e]оксазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2,3-диметоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2,
4-диметоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2,3-диметоксифенил/-1-изобутил-2-оксо- 1,2,3,5-тетрагидро-4,
1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2,4-диметоксифенил/-1-изобутил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/3-гидрокси-2-метоксифенил/-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/4-гидрокси-2-метоксифенил/-1- неопентил-2-оксо-1,
2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/3-гидрокси-2-метоксифенил/-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/4-гидрокси-2-метоксифенил/-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/3-этокси-2-метоксифенил/-1- неопентил-2-оксо-1,2,3,
5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/4-этокси-2-метоксифенил/-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/3-этокси-2-метоксифенил/-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/4-этокси-2-метоксифенил/-1- изобутил-2-оксо-1,2,3,
5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлор-2-метоксифенил/-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/2-хлор-4-метоксифенил/-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлор-3-метоксифенил/-1- изобутил-2-оксо-1,2,3,
5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлор-4-метоксифенил/-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/2-хлор-3-гидроксифенил/-1- неопентин-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлор-4-гидроксифенил/-1- неопентин-2-оксо-1,2,3,
5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,5-транс-7-хлор-5-/2-хлор-3-гидроксифенил/-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота;
3,
5-транс-7-хлор-5-/2-хлор-4-гидроксифенил/-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота и т.д.
В качестве солей соединении 1, 1', 1'' и 1''' можно указать фармацевтически приемлемые соли, например, такие неорганические соли, как гидрохлорид, гидробромид, сульфат, нитрат, фосфат и т.д.; такие органические соли, как ацетат, тартрат, цитрат, фумарат, малеат, толуолсульфонат, метансульфонат и т. д. ; такие соли металлов, как натриевая соль, калиевая соль, кальциевая соль, алюминиевая соль и т.д., и такие соли оснований, как соли триэтиламина, гуандина, аммония, гидразина, хинина, цинхолина и т.д.
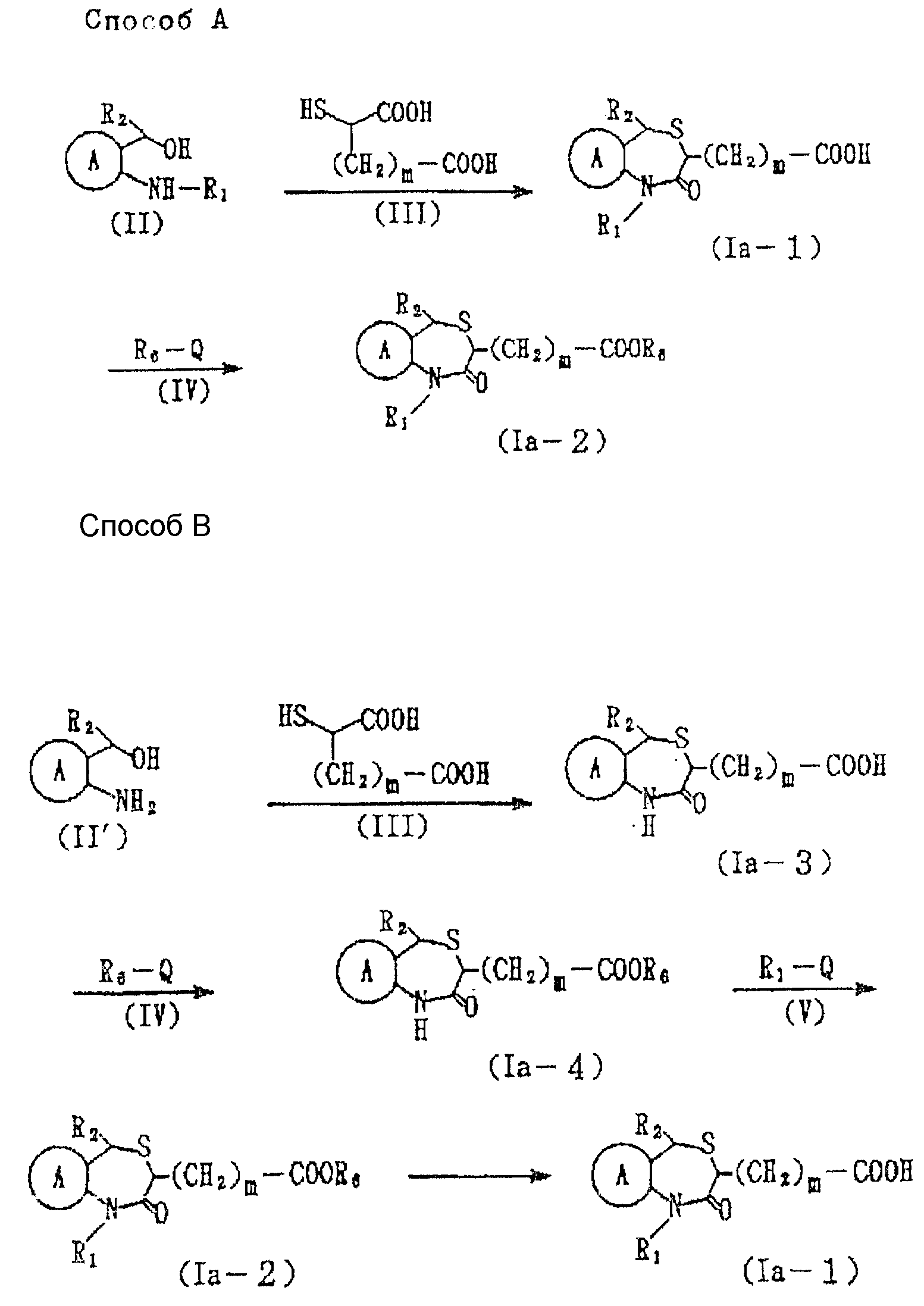
Способ получения соединений настоящего изобретения следующий:
Соединение формулы Ia

где Y' представляет необязательно этерифицированную карбоксильную группу, значения которой были указаны для Y;
остальные символы имеют указанные ранее значения, можно получить следующими способами (способы A и B см. в конце описания), где R6 представляет алкильную часть этерифицированной карбоксильной группы, определяемой Y'; Q представляет галоид, а остальные символы имеют указанные ранее значения.
Получение соединения формулы Ia-1 из соединения формулы II в способе A, и соединения формулы Ia-3 из соединения формулы II' в способе B, можно вести в растворителе, например в таком растворителе эфирного типа, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком растворителе углеводородного типа, как бензол, толуол, гексан, гептан и т.д., в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д.; в ацетоне, диметилформамиде, диметилсульфоксиде и уксусной кислоте, и при необходимости, в присутствии кислоты /соляной, бромистоводородной, иодистоводородной, серной, фосфорной, метансульфокислоты, толуолсульфокислоты/. Относительно одного моля соединения, представленного формулой II или II', соединение представленной формулой III обычно используют в количестве от 1 до 10 молей, предпочтительно около 1-2 молей. Интервал температур составляет 0-200oC, предпочтительно от около 50 до 100oC. Время реакции обычно составляет от 1 до 24 ч, предпочтительно от около 1 до 3 ч.
Способ получения соединения формулы Ia-2 из соединения формулы Ia-4 в способе B можно вести в таком растворителе, как например, диэтиловый эфир тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д. в диметилформамиде или диметилсульфоксиде, и, при необходимости, в присутствии основания /например, гидрида натрия, гидрида лития и т.д./. Относительно одного моля соединения, представленного формулой Ia-4, соединение, представленное формулой V, используют обычно в количестве от 1 до 10 молей, предпочтительно, около 1-2 молей. Температура реакции составляет величину от 0 до 200oC, предпочтительно, от около 20 до 100oC. Время реакции составляет от 1 до 24 ч, предпочтительно, от около 1 до 5 ч.
Получение соединения формулы Ia-2 из соединения формулы Ia-1 в способе A и получение соединения Ia-4 из соединения формулы Ia-3 в способе B можно вести в растворителе, например в воде или таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксин и т.д.; в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д.; в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д., в ацетоне или диметилформамиде, и, при необходимости, в присутствии основания /например, бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидрида натрия гидрида калия гидроксида натрия, гидроксида натрия, гидроксида бария и т. д./. Относительно одного моля соединения, представленного формулой Ia-1, или формулой Ia-3, соединение, представленное формулой IV, используют обычно в количестве в интервале от 1 до 10 молей, предпочтительно, от около 1 до 2 молей. Температура реакции в интервале от 0 до 100oC, предпочтительно, от около 25 до 50oC. Время реакции обычно составляет от 1 до 24 ч, предпочтительно от около 3 до 10 ч.
Получение соединения формулы Ia-1 из соединения формулы Ia-2 в способе B можно вести в таком растворителе, как, например, вода или в таком растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д., в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д., в ацетоне или диметилформамиде, и, в зависимости от необходимости, в присутствии основания /например, бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидрида натрия, гидрида калия, гидроксида натрия, гидроксида калия, гидроксида бария, и т.д./. Температура реакции может быть в интервале от 0 до 100 предпочтительно, от около 20 до 50oC. Время реакции обычно составляет 1-24 ч, предпочтительно, 3-10 ч.
Соединения
формулы Ib

где все символы имеют указанные ранее значения,
можно получить следующими способами C и D (см. в конце описания), где R представляет такую аминозащитную группу, как карбоксибензилокси, трет-бутоксикарбонил и т.д., а остальные символы имеют указанные ранее значения.
В способах C и D получение соединения формулы VIII из соединения формулы VI или соединения формулы VIII' и соединение формулы VI' можно вести в растворителе, например в эфирном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д., и в таком галоидсодержащем растворителе, как дихлорметан, хлороформ и т.д., в ацетонитриле или диметилформамид, используя такой концентрирующий агент как диэтилцианофосфонат, дициклогексилкарбодиимид и т.д., и, при необходимости, в присутствии основания /например, триэтиламина, 4-диметиламинопиридина, N-метилпиперидина и т.д./. По отношению к одному молю соединения, представленного формулой VI или формулой VI', соединение, представленное формулой VII, обычно используют в количестве от 1 до 5 молей, предпочтительно, от около 1 до около 1,5 моля. Температура реакции попадает в интервал от 0 до 100oC, предпочтительно от около 20 до 50oC. Время реакции составляет от 1 до 24 ч, предпочтительно от около 2 до около 5 ч. В этом случае, когда используют конденсирующий агент, на один моль соединения формулы VI или формулы VI', его используют обычно в количестве от 1 до 5 молей, предпочтительно от около 1 до 2 молей.
Получение соединения формулы Ib-1 из соединения формулы VIII в способе C или соединения формулы Ib-3 из соединения формулы VIII' в способе D можно вести, например, в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан и т.д., в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д. в ацетоне, диметилформамиде, ацетонитриле, в галоидсодержащем растворителе таком, как дихлорметан, хлороформ и т.д., способами, известными рег se, например, если R представляет карбобензилоксигруппу, каталитическим восстановлением, используя палладий, платину или т.п., в качестве катализатора, тогда как, если R представляет трет-бутоксикарбонил, подвергая соединение, полученное за счет удаления аминозащитной группы R, растворению, или суспензированию в кислоте /например, соляной, бромноватой, трифторуксусной/ для каталитического восстановления, например, в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т. д., таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т. д., таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол, и т.д., в диметилформамиде, ацетонитриле и, при необходимости, в присутствии кислоты /например, соляной, бромноватой, уксусной, пропионовой, метансульфокислоты, толуолсульфокислоты, серной кислоты и т.д./. Температура реакции обычно бывает от 0o до 100oC, предпочтительно, от около 30 до 70oC. Время реакции обычно составляет от 1 до 24 ч, предпочтительно от 3 до 10 ч.
Получение соединения Ib-1 из соединения формулы Ib-3 в способе D можно осуществить практически тем же способом что и получение соединения формулы Ia-2 из соединения формулы Ia-4 в способе B для получения соединения, представленного формулой Ia, как описано ранее. И получение соединения, представленного формулой Ib-2 из соединения, представленного формулой Ib-1 в способе C, и соединения формулы Ib-2 из соединения, представленного формулой Ib-1 в способе D, можно осуществить практически тем же способом, что и способ получения соединения формулы Ia-1 из соединения формулы Ia-2 в способе D для получения соединения, представленного формулы Ia, описанный ранее.
Соединение формулы Ic

где символы имеют указанные ранее значения, можно получить следующим способами:


где все символы имеют указанные ранее значения.
Соединение формулы X из соединения IX, полученного способом, раскрытым в J. Med. Chem. 27,1508 /1984/, J. Med. Chem, 14, 851, /1971/, можно получит практически по способу получения соединения формулы Ia-2 из соединения формулы Ia-4 в способе B для получения соединения, представленного формулой Ia. Получение соединения формулы Ic-1 из соединения формулы X можно вести в таком растворителе, как например, таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т. д. , углеводородом растворителе, как бензол, толуол, гексан, гептан и т.д., диметилформамид или диметилсульфоксил, в присутствии гидрида натрия, гидрида лития, литийдиизопропиламида и т. д. Относительно одного моля соединения формулы X, соединения формулы XI обычно используют в качестве от 1 до 5 молей, предпочтительно, от около 1 до 2 молей. Интервал температур реакции составляет -78oC до 50oC, предпочтительно, от -78oC до 0oC. Время реакции обычно составляет от 1 до 24 ч, предпочтительно от 3 до 10 ч. Получение соединения формулы Ic-2 из соединения формулы Ic-1 ведут практически так же, как и получение соединения, представленного формулой Ia-2 в способе B.
Соединение формулы Ib

где символы имеют указанные ранее значения, можно получить способами E, F и G (см. в конце описания).
Соединения XIII из VI', XV из XIV в способе E, или соединения XVI из VI, XVII из II в способе F, можно получить, используя per se реакции ацилирования.
Ацилирование можно вести в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком галоидном растворителе, как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод, в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д.., в диметилформамиде, диметилсульфоксиде и т.д., и, при необходимости, в присутствии воды и основания /например, органического основания, такого как 4-диметиламинопиридин, триэтиламин, триэтилендиамин, тетраметилэтилендиамин и т.д., бикарбонат натрия, бикарбонат калия, карбонат натрия, карбонат калия, гидрид натрия, гидрид калия и т.д./. На один моль соединения формулы IV', XIV, VI или II обычно используют от 1 до 10 молей хлорангидрида или метансульфонхлорида, предпочтительно, от 1 до 3 молей. Температура реакции обычно бывает в интервале от -50 до 100oC, предпочтительно, от около 0o до 50oC. Время реакции обычно составляет от около 5 до 10 ч.
Соединение XIII' из соединения XIII в способе E, VI из VI' и II из II' в способе F можно вести в растворителе, например в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д., в таком спиртовом растворителе, как метанол, этанол, пропанол и т.д., в ацетоне, диметилформамиде и т. д. , и, при необходимости, в присутствии основания /например, бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидрида натрия, гидрида калия и т.д./. На один моль соединения формулы VIII, VI' или II', соединение, представленное формулой V обычно используют в количестве от 1 до 10 молей, предпочтительно, от 1 до 2 молей. Температурный интервал реакции от 0 до 100oC, предпочтительно, от около 20 до 50oC. Время реакции обычно составляет от 1 до 24 ч, предпочтительно от около 3 до 10 ч.
Соединение Id-I их XV в способе E, II' их VI' и восстановление карбонильной группы VVII из XVI в способе F можно вести, обрабатывая комплексом металлгидрида /например, литийалюминийгидрида, натрийалюминийгидрида, натрийтриэтоксиалюминийгидрида, натрийборгидрида и т.д./ в протонном растворителе /метаноле, этаноле, пропаноле, бутаноле и т.д./ или в апротонном растворителе /например, этиловом эфире, тетрагидрофуране, диоксане и т.д./. На один моль соединения формулы XV, VI' или XVI такой комплекс металлгидрида обычно используют в количестве в интервале от 0,3 до 5 молей, предпочтительно, от 0,5 до 2 молей. Температура реакции обычно бывает в интервале от -20 до 100oC, предпочтительно, от около 20 до 50oC.
Циклизацию Id-2 из соединения формулы XVII в способе F ведут в растворителе, например, в эфирном растворителе, таком, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д., в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д., в ацетоне, диметилформамиде и т.д., и, при необходимости, в присутствии основания /например, бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидрида натрия, гидрида калия и т.д./. На один моль соединения формулы XVII эти основания обычно используют в количестве от одного до 5 молей, предпочтительно, от около 1 до 2 молей. Температура реакции составляет интервал от -20 до 100oC. Реакция обычно протекает в течение 1-20 ч, предпочтительно от около 2 до 5 ч.
Реакцию получения соединения XIV из XIII' в способе E можно вести в спирте, представленном формулой IV, и, при необходимости, в присутствии такой неорганической кислоты, как соляная бромистоводородная, серная и т.д., или такой органической кислоты, как толуолсульфокислота, метансульфокислота и т. д. Температура реакции обычно в интервале от -20 до 100oC, предпочтительно от около 20 до 50oC. Время реакции обычно составляет 10-100 ч, предпочтительно 10-48 ч.
Соединение Id-4 из Id-1 в способе E, и соединение Id-4 из Id-2 в способе F можно получить практически тем же способом, что и соединение Ia-1 из Ia-2 в способе B в синтезе соединения, представленного формулой Ia.
Соединения, представленные Id-3 и Id-5 в способе G, можно получить известными per se способами.
Соединение формулы Id'

где символы имеют указанные ранее значения,
можно получить, окисляя соединение формулы Ik'

где символы имеют указанные ранее значения.
В качестве растворителя можно использовать любой растворитель, который не мешает реакции, например, ацетон, диоксан, дихлорметан, дихлорэтан, хлороформ и т. д., а в качестве окисляющего агента можно использовать перманганат, хромовую кислоту, пероксид никеля и т.д. На один моль соединения Ik' используют от 0,5 до 20 молярных эквивалентов окисляющего агента, предпочтительно от 1 до 3 молярных эквивалентов. Температура реакции обычно от 0 до 100oC, предпочтительно, от 15 до 50oC. Время реакции составляет от 0,5 до 5 ч, предпочтительно от около 1 до 2 ч.
Соединения формулы Ie

можно получить следующим способом:




где символы имеют указанные ранее значения.
Соединение формулы XXIII из соединения формулы VI или формулы XXII можно получить, используя на один моль соединения формулы VI или формулы XXII, обычно от 1 до 10 молей, предпочтительно 1-2 моля, соединения формулы XXIV в растворителе, например, эфирном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как бензол, толуол, гексан или гептан; в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д.; или в таком растворителе, как диметилформамид, диметилсульфоксид и т.д. Температура реакции бывает от 0 до 200oC, предпочтительно от около 50 до 100oC. Время реакции составляет от 1 до 48 ч, предпочтительно от около 10 до 24 ч.
Соединение формулы Ie из соединения формулы XXIII можно получить, используя на один моль соединения формулы XXIII, обычно 1-10 молей, предпочтительно 1-2 моля карбонилирующего агента, включая трифосген, 1, 1'-карбонилдиимидазол, 4-нитрофенил, хлороформат или т.п., в таком растворителе, который не мешает реакции, например, в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран или диоксан; в таком углеводородном растворителе, как бензол, толуол, гексан или гептан; в таком спиртовом растворителе, как метанол, этанол, пропанол или бутанол; в таком растворителе как диметилформамид или диметилсульфоксид. Температура реакции обычно бывает в интервале от 0 до 200oC, предпочтительно, от около 50 до 100oC. Время реакции составляет от 0,5 до 24 ч, предпочтительно от около 1 до 5 ч.
Соединение формулы If
где символы имеют указанные ранее значения,
можно получить следующим способом (см. в конце описания),
где символы имеют указанные ранее значения.
Соединение формулы XXVII из соединений формул XXV и XXVI можно получить, используя на один моль соединения формулы XXV от 1 до 5 молярных эквивалентов, предпочтительно от 1 до 1,5 молярных эквивалентов соединения, представленного формулой XXVI, в таком эфирном растворителе, как диметиламид, этиловый эфир, тетрагидрофуран, диоксан и т.д., в присутствии гидрида натрия, гидрида лития, алкиллития или т.п. Температура реакции бывает в интервале от -78 до 100oC, предпочтительно, от около -20 до 30oC. Время реакции составляет от 0,1 до 5 ч, предпочтительно от около 0,5 до 2 ч.
Соединение формулы XXVIII из соединения формулы XXVII можно получить, обрабатывая комплексом металлгидрида /например, литийалюминийгидридом, натрийалюминийгидридом, натрийборгидридом, литийборгидридом и т. д. / в растворителе, например, в протонном растворителе /метаноле, этаноле, пропаноле, бутаноле и т.д./ или в апротонном растворителе /например, этиловом эфире, тетрагидрофуране, диоксане и т.д./. Такой комплекс металлгидрида обычно используют на один моль соединения формулы XXVII, в количестве от 0,3 до 5 молярных эквивалентов, предпочтительно, от около 0,5 до 2 молярных эквивалентов. Температура реакции бывает в интервале от -20 до 100oC, предпочтительно от около 0 до 20oC. Время реакции обычно составляет от 0,5 до 10 ч, и предпочтительно, от 1 до 5 ч.
Соединение формулы XXIX можно получить, окисляя соединение формулы XXVIII. В качестве растворителя можно использовать любой растворитель, который не мешает реакции. Так, например, это соединение можно получить, используя, например, диметилсульфоксид и оксалилхлорид, или пиридин и триоксид серы, например, в таком растворителе, как диоксан, тетрагидрофуран, дихлорметан, дихлорэтан, хлороформ или т.п. В этом случае на один моль соединения, представленного формулой XXVIII, окисляющего агента используют от 0,5 до 20 молярных эквивалентов, предпочтительно, от 1 до 3 молярных эквивалентов. Время реакции составляет от 0,1 до 10 ч, предпочтительно от около 0,2 до 2 ч. Температура реакции составляет от -78 до 50oC, предпочтительно от -78 до 20oC. При необходимости реакцию можно вести в присутствии основания /например, 4-диметиламинопиридина, триэтиламина, триэтилендиамина, тетраметиленэтилендиамина и т.д./.
Соединение, представленное формулой XXX, можно получить, подвергая соединение, представленное формулой XXIX и соединение, представленное формулой XXXV, восстановительному аминированию. Так, например, на один моль соединения, представленного формулой XXIX, используют от 0,5 до 10 молярных эквивалентов, предпочтительно от 0,5 до 1,5 молярных эквивалентов соединения формулы XXXV и от 0,3 до 5 молярных эквивалентов, предпочтительно от 0,5 до 1,5 молярных эквивалентов комплекса металлгидрида /например, натрийборгидрида, литийалюминийгидрида, натрийцианоборгидрида и т.д./, в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д.; в углеводородном растворителе, таком как бензол, толуол, гексан, гептан и т.д.; или в спиртовом растворителе, таком как метанол, этанол, пропанол и т.д. Температура реакции бывает в интервале значений от 0 до 100oC, предпочтительно от около 30 до 60oC. Время реакции обычно составляет 1-24 ч, предпочтительно от около 3 до 10 ч.
Соединение формулы XXXI можно получить, осуществляя взаимодействие соединения формулы XXX с трифторуксусным ангидридом или с хлоридом трифторуксусной кислоты. Реакцию можно вести, используя на один моль соединения формулы XXX, от 0,5 до 3 молярных эквивалентов, предпочтительно 1-2 молярных эквивалента, трифторуксусного ангидрида или хлорида трифторуксусной кислоты, в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д.; таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д.; таком галоидном растворителе, как дихлорметан, дихлорэтан, хлороформ и т. д. ; или диметилформамиде, при температуре в интервале от 0 до 100oC, предпочтительно от около 20 до 50oС, в течение от около 5 мин до около 5 ч, предпочтительно от около 0,1 до 1 ч. Эту реакцию можно вести, при необходимости, в присутствии основания /например, органического основания, такого как 4-диметиламинопиридин, триэтиламин, триэтилендиамин, тетраметилендиамин, и т.д., или бикарбонат натрия, бикарбонат калия, карбонат калия, карбонат натрия и т.д./.
Соединение формулы XXXII можно получить в результате каталитического гидрирования соединения формулы XXXI, используя в качестве катализатора палладий на угле, в спиртовом растворителе, таком, как метанол, этанол, пропанол, бутанол и т.д.; в диметилформамиде, ацетонитриле, этиловом сложном эфире уксусной кислоты и т.п. Давление водорода составляет от 1 до 100 атмосфер, предпочтительно 1-10 атмосфер, температура реакции от 0 до 200oC, предпочтительно от около 20 до 50oC.
Соединение формулы XXXIII можно получить в результате взаимодействия соединения формулы XXXII и галоидированной углеводородной группы; или в реакции восстановительного аминирования альдегидной или кетонной группы. Условия его получения практически те же, что и условия получения соединения Ia-2 из Ia-4 в способе B в случае получения соединения, представленного вышеуказанной формулой Ia, или условия получения XXX из XXIV в случае получения соединения формулы If.
Соединение формулы XXXIV можно получить в результате гидролиза соединения формулы XXXIII в таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д.; или в эфирном растворителе, таком как тетрагидрофуран, диоксан и т.д.; в присутствии такой кислоты, как соляная, серная, фосфорная и т.д. Температура реакции составляет интервал от 0 до 100oC, предпочтительно, от 30 до 70oC, а время реакции составляет 1-48 ч, предпочтительно от около 10 до 20 ч.
Соединение формулы If-1 из XXXIV можно получить практически так же, как в способе получения Ie-2 из XXIII в случае получения соединения формулы Ie. А соединение формулы If-2 из If-1 можно получить практически тем же способом, что и получение Ia-1 из Ia-2 в способе B получения соединения формулы Ia.
Соединение формулы Ig

где символы имеют указанные ранее значения,
можно получить следующим способом:



где символы имеют указанные ранее значения.
Соединение формулы XXXVI можно получить практически так же, как получают соединение Ia-2 из Ia-4 в способе B в случае получения соединения, представленного формулой Ia, или восстановительным аминированием, которое практически одинаково с получением XXX из XXIX в случае получения соединения формулы If.
Соединение формулы XXXVII можно получить при взаимодействии соединения формулы XXXVI с малонилдихлоридом, например в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком галоидном растворителе, как дихлорметан, хлороформ и т.д., в таком растворителе, как этиловый сложный эфир уксусной кислоты, ацетонитрил, вода и т.д. На один моль соединения XXXVI малонилдихлорид используют в количестве от 1 до 10 молярных эквивалентов, предпочтительно от около 1 до 2 молярных эквивалентов. Температура реакции попадает в интервал от -20 до 100oC, предпочтительно от 0 до 70oC, а время реакции составляет от 0,5 до 24 ч, предпочтительно, от около 1 до 3 ч.
Соединение формулы Ig-1 можно получить при взаимодействии соединения формулы XXXVII с соединением формулы XXXVIII в присутствии, например, гидрида натрия, алкиллития и т.д. Так, например, в таком растворителе, как диметилформамид, ацетонитрил, диэтиловый эфир, тетрагидрофуран, диоксан и т.д., на один моль соединения формулы XXXVII используют от 0,5 до 5 молярных эквивалентов, предпочтительно от 1 до 2 молярных эквивалентов соединения формулы XXXVIII и от 0,5 до 3 молярных эквивалентов, предпочтительно от 1 до 1,5 молярных эквивалентов гидрида натрия или алкиллития. Температура реакции составляет от -20 до 100oC, предпочтительно от 0 до 30oC, а время реакции от 0,5 до 24 ч, предпочтительно от около 1 до 3 ч.
Соединение
формулы Ih

где символы имеют указанные ранее значения,
можно получить следующим способом:



Соединение формулы XXXIX можно получить, гидрируя соединение формулы XXVIII в присутствии палладиевого катализатора или гидразина и катализатора - никеля Рэнея и т. д. В качестве растворителя можно использовать такой спиртовой растворитель, как метанол, этанол, пропанол, и т.д.; этиловый сложный эфир уксусной кислоты, тетрагидрофуран, диметилформамид или ацетонитрил.
Соединение формулы XXXX, XXXXI, Ih-1 и h-2 можно получить практически так же, как в способе G получения соединения формулы Id.
Соединение формулы Ii

где символы имеют указанные ранее значения,
можно получить в результате реакции соединения формулы ij
где символы имеют указанные ранее значения,
с дифенилфосфорилазидом в растворителе в присутствии основания, с последующей обработкой продукта реакции кислотой в растворителе. В качестве растворителя можно использовать для реакции соединения формулы Ij и дифенилфосфорилазида любой растворитель, который не мешает ходу реакции, и в качестве примера можно указать такой галоидный растворитель, как дихлорметан, дихлорэтан, хлороформ и т.д., такой эфирный растворитель, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., диметилформамид и т.д. В качестве основания, которое можно использовать, следует указать триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин и т.д. На один моль соединения формулы Ij используют от 1 до 10 молярных эквивалентов дифенилфосфорилазида, предпочтительно, от 1,5 до 3 молярных эквивалентов. Температура реакции составляет интервал от -20 до 50oC, предпочтительно от около 0 до 20oC. Время реакции составляет от 0,5 до 5 ч, предпочтительно около 1-2 ч.
В случае обработки полученного продукта кислотой в качестве растворителя используют воду, диоксан, диметилформамид и т.д., и в качестве кислоты можно использовать такие минеральные кислоты, как серную, соляную, азотную, бромистоводородную кислоту, и т. д. Температура реакции составляет интервал от около 50 до 100oC. Время реакции составляет от 0,5 до 5 ч, предпочтительно около 1-2 ч.
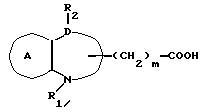
Соединение формулы Ik

где символы имеют указанные ранее значения,
можно получить, восстанавливая соединение формулы Im

где m' = 1, 2 или 3;
остальные символы имеют указанные ранее значения.
Так, например, соединение Ik можно получить, обрабатывая соединение Im комплексом металлгидрида /например, литийалюминийгидридом, натрийалюминийгидридом, боргидридом натрия и т.д./ в протонном растворителе /метаноле, этаноле, пропаноле, бутаноле и т.д./, или апротонном растворителе /например, этиловом эфире, тетрагидрофуране, диоксане и т.д./. На один моль соединения формулы Im используют от 0,3 до 5 молярных эквивалентов, предпочтительно, около 0,5-2 молярных эквивалентов комплекса металлгидрида. Температура реакции попадает в интервал от -20 до 100oC, предпочтительно от около 0 до 20oC. Время реакции составляет обычно от 0,5 до 10 ч, предпочтительно от около 1 до 3 ч.
Соединение формулы Ik можно также получить, превращая аминную часть соединения формулы Ii в гидроксильную группу. Так, например, соединение Ik можно получить, добавляя нитрит натрия к соединению Ii в растворителе в присутствии кислоты, затем, обрабатывая полученный таким образом азид в растворителе в присутствии основания. Для получения диазосоединения, на один моль соединения формулы Ii используют от 0,5 до 3 молярных эквивалентов, предпочтительно от 1 до 1,5 молярных эквивалентов нитрита натрия в растворителе, например в воде, в водном диоксане или водном диметилформамиде. В качестве кислоты можно использовать любую кислоту, если только она не мешает реакции, например уксусную кислоту, серную кислоту и т.д. Температура реакции попадает в интервал от -20 до 20oC, предпочтительно от 0 до 5oC, а время реакции составляет от 5 до 60 мин, предпочтительно от около 10 до 30 мин.
Соединение формулы XXXXII
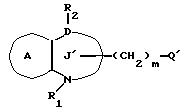
где Q' представляет галоид /хлор, бром, иод/;
другие символы имеют указанные ранее значения,
которое является промежуточным соединением для синтеза, можно получить практически так же, как в случае получения соединения формулы Ik из соединения формулы Ii, в результате взаимодействия соединения формулы Ii с нитритом натрия в соляной кислоте /реакция диазотизации/, бромистоводородной кислоте или иодистоводородной кислоте, с последующим нагреванием полученного продукта. Температура реакции в интервале от 20 до 200oC; предпочтительно от 50 до 100oC. Время реакции составляет от 5 мин до 2 ч, предпочтительно от около 15 до 30 мин.
Соединение формулы In

где Y'' представляет среди значений, указанных для Y, этерифицированную карбоксильную группу, возможно замещенную карбомоильную группу, гидроксильную группу, водород, галоид /хлор, бром, иод/;
другие символы имеют указанные ранее значения,
можно получить в результате конденсации соединения формулы Ij и соединения формулы XXXXIII

где символы имеют указанные ранее значения.
Соединение формулы Ij и соединение формулы XXXXIII конденсируют в присутствии конденсирующего агента в растворителе, и, при необходимости, в присутствии основания. Примерами используемых растворителей могут служить такие углеводородные растворители, как бензол, толуол, гексан, гептан и т.д., такие галоидные растворители, как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод и т.д., такие эфирные растворители, как этиловый эфир, тетрагидрофуран, диоксан и т.д., ацетонитрил, диметилформамид и т.д. Примеры оснований включают триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин и т.д., в качестве конденсирующего агента следует указать агенты, используемые в синтезе пептидов, например, дициклогексилкарбодиимид, диэтилцианофосфонат, 1-этил-3-/3-диметиламинопропил/карбодиимид и т. д. На один моль соединения формулы /Ij/ используют от 0,5 до 2 молярных эквивалентов, предпочтительно от 1 до 1,2 молярных эквивалентов соединения формулы XXXXIII, и от 0,5 до 5 молярных эквивалентов, предпочтительно от 1 до 2 молярных эквивалентов конденсирующего агента. Температура реакции составляет от 0 до 100oC, предпочтительно, от 2 до 50oC. Время реакции составляет от 0,5 до 24 ч, предпочтительно около 1-5 ч.
Соединение формулы Io

где символы имеют указанные ранее значения,
можно получить при взаимодействии соединения формулы Ij с дифенилфосфорилазидом в растворителе в присутствии основания с последующей реакцией полученного продукта с соединением формулы XXXXIII в растворителе. Для реакции соединения формулы Ij с дифенилфосфорилазидом можно использовать любой растворитель, который не мешает реакции, и примерами таких растворителей могут служить такие галоидные растворители, как дихлорметан, хлороформ, дихлорэтан и т.д., такие эфирные растворители, как эфир, тетрагидрофуран, диоксан и т. д. , или диметилформамид. В качестве возможных оснований можно указать триэтиламин, 4-диметиламинопиридин, триэтилениамин, тетраметилэтилендиамин. На один моль соединения формулы Ij используют от 1 до 10 молярных эквивалентов, предпочтительно от 1,5 до 3 молярных эквивалентов диметилфосфорилазида. Температура реакции от -20 до 50oC, предпочтительно от 0 до 20oC. Время реакции составляет от 0,5 до 5 ч, предпочтительно от около 1 до 2 ч.
Примеры растворителей, которые можно использовать в реакции полученного таким образом продукта с соединением формулы XXXXIII, включают такие галоидные растворители, как дихлорметан, дихлорэтан, хлороформ и т.д., такие эфирные растворители, как эфир, тетрагидрофуран, диоксан и т.д., ацетонитрил, диметилформамид и т. д. При необходимости используют основание, в качестве оснований можно указать такие органические основания, как триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин и т.д. На один моль соединения формулы Ij используют 0,5 до 3 молярных эквивалентов, предпочтительно, от 1 до 1,5 молярных эквивалентов соединения формулы XXXXIII. Температура реакции от 0 до 150oC, предпочтительно от 30 до 100oC. Время реакции составляет от 0,5 до 24 ч, предпочтительно от около 1 до 3 ч.
Соединение формулы Ip

где символы имеют указанные ранее значения,
можно получить, конденсируя соединение формулы Ii с соединением формулы XXXXIV

где символы имеют указанные ранее значения.
Эту реакцию можно вести точно также, как и в способе получения соединения формулы In.
Соединение формулы Iq
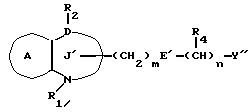
где E' представляет атом кислорода или -NH- среди групп, определенных ранее для E';
остальные символы имеют указанные ранее значения,
можно получить в результате реакции соединения формулы Ii и соединения, представленного формулой Ik с соединением формулы XXXXV
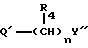
где символы имеют указанные ранее значения.
Более конкретно, соединение формулы Ii или соединение формулы Ik подвергают взаимодействию с соединением формулы XXXXV в растворителе, например таком спиртовом растворителе, как метанол, этанол, пропанол, бутанол и т.д., таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т. д. , в диметилформамиде и т.д., в присутствии основания, например, такого неорганического основания, как бикарбонат натрия, карбонат калия и т.д., такого органического основания, как триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин и т.д., гидрид натрия и т. д. На один моль соединения формулы Ii или формулы Ik используют от 0,5 до 1,5 молярных эквивалентов соединения формулы XXХV, а на один моль соединения формулы Ii или соединения формулы Ik используют от 1 до 5 молярных эквивалентов, предпочтительно 1-2 молярных эквивалента основания. Температура реакции от 0 до 200oC, предпочтительно от 20 до 100oC. Время реакции составляет от 0,5 до 24 ч, предпочтительно от около 1 до 3 ч.
Соединение формулы Ir

где символы имеют указанные ранее значения,
можно получить в результате реакции соединения формулы XXXXII с соединением формулы XXXXVI

где символы имеют указанные ранее значения.
Примеры возможных растворителей включают такие апротонные растворители, как этиловый эфир, тетрагидрофуран, диоксан, ацетонитрил, диметилформамид и т. д. , и при необходимости такие неорганические основания, как бикарбонат натрия, бикарбонат калия, карбонат натрия, карбонат калия и т.д., такие органические основания, как триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин и т.д., гидрид натрия, фторид цезия и т.д. На один моль соединения формулы XXXXII используют от 0,5 до 5 молярных эквивалентов, предпочтительно от 1 до 2 молярных эквивалентов соединения формулы XXXXVI. Температура реакции от 0 до 20oC, предпочтительно от 20 до 100oC. Время реакции составляет от 10 мин до 5 ч, предпочтительно от около 30 мин до 2 ч.
Соединение формулы Is

где символы имеют указанные ранее значения,
можно получить, гидролизуя соединение формулы It

где Y'' представляет этерифицированную карбоксильную группу среди групп, определенных для Y.
Более конкретно, соединение формулы It гидролизуют в таком растворителе, как вода, метанол, этанол, пропанол, бутанол и т.д. в присутствии гидроксида щелочного металла /например, гидроксида натрия, гидроксида калия, гидроксида бария, гидроксида лития и т.д./ или бикарбоната натрия, бикарбоната калия, карбоната натрия или карбоната калия, или в присутствии минеральной кислоты /азотной, соляной, бромистоводородной, фолиевой кислоты, серной кислоты и т. д. / или трифторуксусной кислоты при температуре от 10 до 150oC, предпочтительно от 10 до 50oC. Время реакции меняется в зависимости от температуры, и обычно составляет от 1 до 24 ч, предпочтительно от 2 до 10 ч.
Соединение формулы Iu
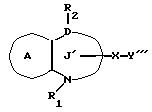
где Y'''' представляет необязательно замещенную карбомоильную группу среди групп, указанных для Y;
остальные символы имеют указанные ранее значения,
можно получить в результате конденсации соединения формулы Iv

где символы имеют указанные ранее значения,
с амином, содержащим те же заместители, что и "необязательно замещенная карбамоильная группа" определенная для Y''''. Реакцию можно вести практически в тех же условиях, что и в случае получения соединения, представленного формулой 3 In.
Соединение формулы Iw

где R8 представляет заместитель "необязательно замещенной гидроксильной группы", определенный для Y;
остальные символы имеют указанные ранее значения,
можно получить практически так же, как в способе получения соединения формулы Iq из соединения формулы Ix

где символы имеют указанные ранее значения,
и соединения формулы XXXXVII
HO-R8
где символы имеют указанные ранее значения.
Соединение формулы Iy
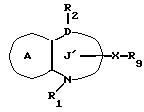
где R9 представляет необязательно замещенную аминогруппу, определенную для Y;
остальные символы имеют указанные ранее значения,
можно получить практически тем же способом, что и соединение формулы Iq из соединения формулы XXXXVIII
H-R9
где символы имеют указанные ранее значения,
и соединения формулы Ix.
Соединение формулы Iz

где символы имеют указанные ранее значения, можно получить в результате взаимодействия соединения формулы Iα

где символы имеют указанные ранее значения,
с метахлорпербензойной кислотой в растворителе, например в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т.д., таком галоидном растворителе, как дихлорметан, хлороформ и т.д., в ацетонитриле, диметилформамиде и т.д. На 1 моль соединения Iα используют обычно от 1 до 5 молей, предпочтительно, от 1 до 1,5 молей метахлорпербензойной кислоты. Температура реакции находится в интервале от 0 до 100oC, предпочтительно от 0 до 30oC. Время реакции составляет от 1 до 10 ч, предпочтительно от около 1 до 2 ч.
Соединение формулы Iβ

где символы имеют указанные ранее значения,
можно получить, используя в качестве исходного материала соединение формулы Iz или формулы Iα , практически так же, как в случае получения соединения формулы Iz из соединения формулы Iα .
Соединение формулы Iγ

где символы имеют указанные ранее значения,
можно получить, восстанавливая соединение формулы Iδ

где символы имеют ранее указанные значения,
в растворителе, например, в воде, в таком спиртовом растворителе, как метанол, этанол, пропанол и т.д., в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т.д., в таком углеводородном растворителе, как дихлорметан, хлороформ и т.д., используя в качестве восстанавливающего агента литийалюминийгидрид, боргидрид натрия, цианоборгидрид натрия и т.д. На 1 моль соединения формулы Iδ используют от 0,2 до 5 молярных эквивалентов, предпочтительно от около 0,3 до 1 молярного эквивалента восстанавливающего агента. Температура реакции от 0 до 100oC, предпочтительно от 20 до 50oC. Время реакции от 0,5 до 10 ч, предпочтительно от около 1 до 3 ч.
Соединение формулы
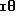

где символы имеют указанные ранее значения,
можно получить в результате взаимодействия соединения формулы Iπ

где символы имеют указанные ранее значения,
с реагентом Лоуессона или пентасульфидом фосфора в растворителе, например таком спиртовом растворителе, как метанол, этанол, пропанол и т.д., в таком эфирном растворителе, как диэтиловый эфир, тетрагидрофуран, диоксан и т. д., таком углеводородном растворителе, как бензол, толуол, гексан, гептан и т. д. , таком галоидном растворителе, как дихлорметан, хлороформ и т.д., гексаметилфосфорамиде, диметилсульфоксиде и т.д. На 1 моль соединения формулы Iπ используют от 1 до 10 молярных эквивалентов, предпочтительно, от 1 до 3 молярных эквивалентов реагента Лоуессна или ментасульфида фосфора. Температура реакции от 0 до 150oC, предпочтительно от около 50 до 100oC. Время реакции от одного до 24 ч, предпочтительно от около 3 до 10 ч.
Соединение формулы Iλ

где символы имеют указанные ранее значения,
можно получить в результате взаимодействия соединения формулы Iγ с соединением формулы XXXXIX
R7-Q',
где символы имеют указанные ранее значения,
практически в тех же условиях, что и в случае получения соединения XIII в способе E, VI, II в способе F в соединениях, представленных формулой Id.
В то время, как соединения, представленные общими формулами I, I', I'' и I''' настоящего изобретения обладают ингибирующим действием на сквален-синтетазу или противогрибковым действием, среди соединений настоящего изобретения существуют соединения, способные ингибировать другие энзимы в схеме биосинтеза холестерина. Если это так, то соединения, представленные формулами I, I', I'' и I''' должны ингибировать биосинтез холестерина, что необходимо для профилактики или терапии гиперхолестеринэмии или коронарного склероза у млекопитающих /например, мышей, крыс, кроликов, собак, кошек, коров, свиней и людей/, и также для профилактики или терапии грибковых инфекций.
Эти соединения можно вводить людям орально или парэнтерально. Композиции для орального введения могут быть в твердой или жидкой форме, более конкретно, в виде таблеток /включая таблетки с сахарным покрытием и покрытые пленкой таблетки/, пилюль, гранул, капсул /включая мягкие капсулы/, сиропов, эмульсий, суспензий или т.п. Эти композиции можно получить известными per se способами, и они содержат носители или эксципиенты, которые обычно используют в фармацевтических препаратах, например, такие носители или эксципиенты, как лактоза, крахмал, сахароза или стеарат магния для получения таблеток.
Композиции для не-орального введения представлены растворами для инъекций и суппозиториями, а препараты для инъекций включают препараты для инъекций через кожу, подкожные и внутримышечные. Эти препараты для инъекций можно получить известными per se способами, более конкретно, за счет суспендирования или эмульгирования соединений настоящего изобретения в стерильной воде и маслах, которые обычно используют для получения композиции для инъекций. Водные жидкости, предназначенные для использования при приготовлении растворов для инъекций, включают физиологический раствор и изотонический раствор, и, при необходимости, подходящий суспендирующий агент, например, натрийкарбоксиметилцеллюлозу, неионный поверхностно активный агент или т.п. В качестве масел можно указать кунжутное масло, соевое масло и т.д., и наряду с этим можно использовать бензилбензоат, бензиловый спирт и т. д., в качестве агентов способствующих растворению. Приготовленные таким образом препараты для инъекций обычно заполняют в соответствующие ампулы.
Соединения I, I', I'' и I''' или их соли обладают низкой токсичностью и безопасны в использовании. Хотя дневная доза зависит от состояния и веса организма предлагаемого пациента, типа соединения, способа введения и т.д., в случае введения соединения настоящего изобретения для терапии гиперхолестеринэмии, дневная доза при оральном приеме для взрослых составляет от около 1 до 500 мг, предпочтительно, от около 10 до 200 мг. В этих пределах токсичность не наблюдается.
Эффективная дневная доза соединений I, I', I'' и I''' при введении млекопитающим /например, для взрослых людей в качестве ингибитора сквален-синтетазы, составляет от около 1 до 500 мг, предпочтительно, от около 10 до 200 мг в случае орального введения, тогда как в случае не-орального введения /например, в виде инъекций, суппозиториев и т.д./, этот интервал составляет от около 0,1 до 100 мг, предпочтительно, от около 1 до 50 мг.
Кроме того, соединения I, I', I'' и I''' демонстрируют широкий спектр антибактериальных активностей, что определено в способах разбавления бульона или агара.
Эффективные дневные дозы для взрослых соединений I, I', I'' и I''' для борьбы с грибками при введении млекопитающим /например, людям и т.п./ составляют от около 0,1 до 100 мг, предпочтительно, от около 1 до 50 мг в случае орального введения тогда, как в случае не-орального введения /например, инъекций, суппозиториев и т.п./, этот интервал составляет от около 0,1 до 100 мг, предпочтительно, от 1 до 50 мг.
В настоящем изобретении сокращения названий аминокислот даны в соответствии с номенклатурой IUPAC-IUB, или даны тривиальные названия. Так например, Tryp: триптофан, Ser: серин, Asp: аспаргиновая кислота, Glu: глутамовая кислота, Gly: глицин, Leu: лейцин, Ala: аланин, Me: метил, Et: этил, и Ph: фенил. В тех случаях, когда аминокислоты имеют оптические изомеры, они представлены L-изомерами, если нет других указаний.
Нижеследующие примеры, примеры композиций и тестовые примеры предназначены лишь для целей иллюстрации изобретения и ни коим образом не являются ограничивающими.
В приводимых далее описаниях, стереоизомеры получены в зависимости от типов соединений, если группы X' и R2 или R2' связаны с насыщенными атомами углерода. Те изомеры, в которых группу X' и R2 или R2' ориентированы в направлении плоскости колец J1, J2 или J', называются цис-изомерами, тогда как те, в которых группы X' и R2 или R2' ориентированы в противоположном направлении друг к другу, называются транс-изомерами.
Пример 1. 3,5-транс-7-Хлор-5-/2-хлорфенил/-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир
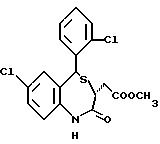
2-Амино-5-хлор -α- /2-хлорфенил/бензиловый спирт /6 г/ и тиояблочную кислоту /3,42 г/ растворяют в смеси концентрированной соляной кислоты /60 мл/ и уксусной кислоты /60 мл/, и полученный раствор перемешивают в течение 3 ч при 100oC. Реакционную смесь охлаждают, к ней добавляют 100 мл 3 н. водного раствора гидроксида натрия. Полученную смесь экстрагируют дихлорметансодержащим тетрагидрофураном, 10% /объем/объем/. Полученный экстракт промывают насыщенным водным раствором аммонийхлорида, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток растворяют в диметилформамиде, содержащем 3% ксилола /объем/объем/ и полученный раствор нагревают в течение ночи при кипении с обратным холодильником. Растворитель отгоняют. К остатку добавляют метанол /50 мл/ и концентрированную серную кислоту /0,5 мл/. Полученную смесь кипятят в течение 3 ч с обратным холодильником. Растворитель отгоняют. Остаток растворяют в дихлорметане, полученный раствор промывают насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из смеси дихлорметан/петролейный эфир, до получения 5,6 г бесцветных кристаллов, т.пл. 200-205oC.
Элементный анализ для C18H15Cl2NO3•O•3H2O:
Рассчитано: C 53,82; H 3,91; N 3,49
Найдено: C 53,78; H 4,04; N 3,
22
Пример 2. 3,5-цис-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир
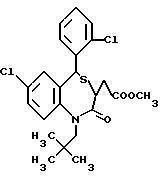
5-Хлор
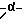
Элементный анализ для C23H25Cl2NO3S:
Рассчитано: C 59,23; H 5,40; S 6,87; N 3,00
Найдено: C 58,99; H 5,32; S 6,80; N 2,76
Пример 3. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

Остаток, полученный при концентрировании маточного раствора, полученного после элиминирования цис-изомера за счет фильтрования после перекристаллизации в примере 2, растворяют в 30 мл метанола. К этому раствору добавляют карбонат калия /0,87 г/, и полученную смесь перемешивают в течение 3 ч при комнатной температуре. Реакционную смесь концентрируют, растворяют в дихлорметане. Полученный раствор промывают водой, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем /элюент гексан; этиловый эфир уксусной кислоты 3:1 /объем/объем/ до получения твердого продукта, который перекристаллизовывают из смеси дихлорметан/петролейный эфир до получения 2,73 г бесцветных кристаллов. Т. плавления 133-136oC.
Элементный анализ: для C23H25Cl2NO3S:
Рассчитано: C 59,23; H 5,40; N 3,00; S 6,87
Найдено: C 59,36; H 5,30; N 2,84; S 6,86
Пример 4. 3,5-транс-7-Хлор-/2-хлорфенил/-1-пропил-2-оксо-1,2,3,5- тетрагидро-4,
1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

Раствор метилового сложного эфира 3, 5-транс-7-хлор-/2-хлорфенил/- 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты /0,5 г/, полученного в примере 1, в 5 мл диметилформамида охлаждают до 0oC. К этому раствору добавляют гидрид натрия /36 мг/, и полученную смесь перемешивают в течение 5 мин при 0oC. К этому раствору добавляют 0,19 г 1-бромпропана, и полученную смесь перемешивают в течение 3 ч при комнатной температуре. К реакционной смеси добавляют воду, и экстрагируют дихлорметаном. Полученный раствор промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и отгоняют растворитель. Остаток очищают на хроматографической колонке с силикагелем /гексан: этиловый эфир уксусной кислоты = 3: 1 /объем/объем/ в качестве элюента/ до получения 0,56 г бесцветного маслянистого соединения.
ИК νмакс см-1: 1740, 1670
1H ЯМР /CDCl3/ δ 0,978 /3H, т, J = 7,6 Гц/, 1,563-1,
881 /2H, м/, 2,445 /1H, дд, J = 4,0, 17,0 Гц/, 3,170 (1H, дд, J = 10,6, 17,0 Гц/, 3,477 /1H, ддд, J = 5,1, 10,2, 13,6 Гц/, 3,673 /3H, с/, 3,720 (1H, дд, J = 10,6 Гц/, 4,215 /1H, ддд, J = 6,0, 10,4, 13,
6 Гц/, 6,023 /1H, с/, 6,633 /1H, д, J = 2,2 Гц/, 7,214-7,477, 7,766-7,798 /6H, м/.
Пример 5. Практически тем же способом, что и в примере 4, получают следующие соединения (см. табл. 1 в конце описания).
Пример 6. 7-Хлор-5-/2-метоксифенил/-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

2-Амино-5-хлор -α- /2-метоксифенил/бензиловый спирт /1 г/ и тиояблочную кислоту /0,6 г/ обрабатывают практически по способу примера 1, и получают 1,34 г бледно-желтого аморфного вещества ИК νмакс /KBr/ см-1: 1740, 1680
1H ЯМР /CDCl3/ δ : 2,394 - 2,535 /1H, м/, 3,031 - 3,187 /1H, м/; 3,64, 3,691 /6H, каждый с/, 3,792 - 3,925 /1H, м/, 5,512, 6,237 /1H/, 6,744 - 6,783 /7H, м/.
Пример 7. 3,
5-транс-7-Хлор-5-/2-метоксифенил/-2-оксо-1-пропил- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

7-Хлор-5-/2-метоксифенил/-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /0,5 г/, полученный в примере 6, обрабатывают по способу примера 4, в результате чего получают 0,17 г бесцветных кристаллов, Т. плавления 81 - 107oC.
Элементный анализ для C22H24ClNO4S
• O • 3H2O:
Рассчитано: C 60,14; H 5,64; N 3,19.
Найдено: C 59,97; H 5,81; N 3,01.
Пример 8. 5-Хлор -α - /2-метоксифенил/-2-/неопентиламино/бензиловый спирт или 2-изобутиламино-5-хлор -α- /2-метоксифенил/бензиловый спирт обрабатывают по способу примеров 2 и 3 до получения следующих соединений, приведенных в табл. 2.
Пример 9. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусная кислота
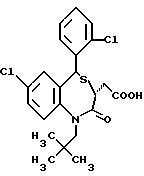
К смеси 2 мл воды и 4 мл метанола добавляют 3,5-транс- 7-хлор-5-/2-хлорфенил/-неопентил-2-оксо-1,2,3,5-тетрагидро- 4, 1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /0,15 г/, полученный в примере 3, и карбонат калия /0,07 г/. Полученную смесь нагревают до 60oC в течение 2 ч при кипячении с обратным холодильником, добавляют 50 мл воды. Раствор подкисляют 1н. HCl, экстрагируют дихлорметаном. Полученный экстракт промывают насыщенным водным раствором аммонийхлорида, сушат над безводным сульфатом натрия. Растворитель отгоняют. Остаток перекристаллизовывают из смеси дихлорметан/петролейный эфир до получения 0,12 г бесцветных кристаллов. Т. плавления 269 - 271oC.
Элементный анализ для C22H23Cl2NO3S:
Рассчитано: C 58,41; H 5,12; N 3,10; S 7,09
Найдено: C 58,39; H 5,19; N 2,84; S 6,78
Пример 10. Практически по способу примера 9 получают соединения, приведенные в табл. 3 (см. в конце описания).
Пример 11. /3R/-7-Хлор-5-/2-хлорфенил/-2,3-дигидро-2-оксо- 1H-1,
4-бензодиазепин-3-уксусной кислоты сложный метиловый эфир

/1/, /3R/-3-Бензилоксикарбониламино-3-/N-/4-хлор-2- /2-хлорбензоил/фенил/карбамоил/пропионовой кислоты метиловый сложный эфир.
В 50 мл дихлорметана растворяют N-бензилоксикарбонил-D-аспаргиновой кислоты бета-метиловый сложный эфир /4,3 г/. Полученный раствор охлаждают до 0oC, добавляют 1,6 г N-метилморфолина и 2,2 г изобутилхлорформата. Полученную смесь перемешивают в течение 10 мин при комнатной температуре, добавляют раствор 2-амино-2', 5-дихлорбензофенона /4,1 г/ в 20 мл дихлорметана. Полученную смесь нагревают в течение 20 мин с обратным холодильником. Реакционную смесь перемешивают в течение 2 дней при комнатной температуре, добавляют 100 мл дихлорметана. Смесь промывают 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным водным солевым раствором с последующей сушкой над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из смеси гексан/этилацетат/ 3 : 1 /объем/объем/ до получения 3,73 г бледно-желтых кристаллов.
Т. плавления 160 - 162oC.
/2/,/3R/-7-Хлор-5-/2-хлорфенил/-2, 3-дигидро-2-оксо-1H- 1,4-бензодиазепин-3-уксусной кислоты метиловый сложный эфир.
К раствору соединения, полученного в /1/ /3,76/г/ в 60 мл метанола добавляют 10% Pd/C /0,5 г/ и концентрированную HCl /0,59 мл/. Полученную смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Катализатор удаляют, а растворитель отгоняют. Остаток растворяют в смешанном растворителе /дихлорметан : тетрагидрофуран = 9 : 1/ /100 мл/. Полученный раствор промывают водным раствором бикарбоната натрия и насыщенным водным солевым раствором, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток растворяют в диметилформамиде /20 мл/, добавляют уксусную кислоту /1 мл/ и перемешивают в течение 2 ч при 60oC. К реакционной смеси добавляют 50 мл этилацетата, перемешивают в течение 2 ч при 60oC. К реакционной смеси добавляют 50 мл этилацетата, промывают 5% водным раствором кислого сульфата калия, насыщенным водным раствором бикарбоната натрия и насыщенным водным солевым раствором. Затем растворитель отгоняют, а остаток перекристаллизовывают из этилацетата до получения 2,97 г бесцветных кристаллов. Т. плавления 168 - 170oC.
Элементный анализ для C18H14Cl2N2O3 • O • 75H2O:
Рассчитано:
C 55,33; H 4,00; N 7,17
Найдено: C 54,92; H 3,60; N 7,21
Пример 12. /3R/-1-Изобутил-7-хлор-5-/2-хлорфенил/-2,3- дигидро-2-оксо-1H-1,4-бензодиазепин-3-уксусной кислоты метиловый
сложный эфир

/3R/-7-Хлор-5-/2-хлорфенил/-2,3-дигидро-2-оксо-1H-1,4- бензодиазепин-3-уксусной кислоты метиловый сложный эфир /0,5 г/, полученный в примере 11 и изопропилбромид /0,23 г/ обрабатывают практически по способу примера 4 до получения 0,3 г бесцветного маслянистого соединения.
ИК νмакс /чистый/ см-1: 1740, 1680, 1600
1H-ЯМР /CDCl3/ δ : 0,795 /3H, д, J = 6,4 Гц/, 0,882 /3H, д, J = 6,6 Гц/, 1,759 /1H,
м/, 3,220 /1H, дд, J = 7,0, 16,8 Гц/, 3,438 /1H, дд, J = 7,4, 16,8 Гц/, 3,528 /1H, кв, J = 4,8, 14,2 Гц/, 3,723 /3H, с/, 4,167 /1H, т, J = 7,1 Гц/, 4,332 /1H, дд, J = 10,0, 14,2 Гц/, 7,078 /1H, д, J
= 2,4 Гц/ 7,371 - 7,532 /6H, м/.
Пример 13. /3R/-1-Изобутил-7/хлор-5-/2-хлорфенил/- 2,3-дигидро-2-оксо-1H-1,4-бензодиазепин-3-уксусная кислота

/3R/-1-Изобутил-7-хлор-5-/2-хлорфенил/-2,3-дигидро-2-оксо-1H- 1,4-бензодиазепин-3-уксусной кислоты метиловый сложный эфир /0,23 г/, полученный в примере 12, обрабатывают практически по способу примера 9 до получения 0,11 г бесцветных кристаллов. Т. плавления 175 - 178oC.
Элементный анализ для C21H20Cl2N2O3 • O • 2H2
Рассчитано: C 59,65; H 4,86; N 6,62
Найдено: C 59,54; H 4,96; N 6,62
Пример
14. /3R, 5S/-1-Изобутил-7-хлор-5-/2-хлорфенил/-2,3,4,5- тетрагидро-2-оксо-1H-1,4-бензодиазепин-3-уксусная кислота

В смешанном растворителе /метан : вода = 6 : 1/ /0,7 мл/ растворяют /3R/-1-изобутил-7-хлор-5-/2-хлорфенил/-2,3-дигидро- 2-оксо-1H-1,4-бензодиазепин-3-уксусную кислоту /30 мг/, полученную в примере 13. К этому раствору добавляют боргидрид натрия /10 мг/. Реакционную смесь перемешивают в течение двух ч при комнатной температуре, добавляют дихлорметан /50 мл/ и воду /50 мл/. Водный слой подкисляют, органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом натрия. Растворитель удаляют, а остаток перекристаллизовывают из смеси дихлорметан/петролейный эфир до получения 17 мг бесцветных кристаллов. Т. плавления 184 - 188oC.
Элементный анализ для C21H22Cl2N2O3, H2O:
Рассчитано: C 57,41; H 5,50; N 6,38
Найдено: C 57,56; H 5,16; N 6,40
Пример 15. /3S/-7-Хлор-5-/2-хлорфенил/-2,3-дигидро-2-оксо-1H- 1,
4-бензодиазепин-3-уксусной кислоты метиловый сложный эфир

N-Бензилоксикарбонил-L-аспаргиновой кислоты бета-метиловый сложный эфир обрабатывают по способу примера 11 до получения некристаллизующегося твердого продукта.
ИК νмакс KBr/ cм-1 : 1740,
1690, 1610
1H-ЯМР /CDCl3/

Пример 16. /3S/-1-Изобутил-7-хлор-5-/2-хлорфенил/2,3-дигидро-2- оксо-1H-1,
4-бензодиазепин-3-уксусной кислоты метиловый сложный эфир

/3S/-7-Хлор-5-/2-хлорфенил/-2, 3-дигидро-2-оксо-1H-1,4- бензодиазепин-3-уксусной кислоты метиловый сложный эфир, полученный в примере 15, обрабатывают по способу примера 4 до получения бледножелтого маслянистого соединения
ИК νмакс /чистый/ см-1: 1740, 1680, 1610.
1H-ЯМР /CDCl3/ δ : 0,794 /3H, д, J=6,6 Гц/, 0,881 /3H, д, J = 6,8 Гц/, 1,728 /1H, м/, 3,219 /1H, дд, J = 7,0, 16,8 Гц/, 3,437 /1H, дд, J = 7,4, 16,8 Гц/, 3,528 /1H, кв. J = 4,4, 14,2 Гц/, 3,723 /3H, с/, 4,166 /1H, т, J = 7,1 Гц/, 4,332 /1H, дд, J = 10,0 14,2 Гц/, 7,077 /1H, д, J = 2,4 Гц/, 7,370-7,530 /6H, м/.
Пример 17. /3S/-7-Хлор-5-/2-хлорфенил/-2,3-дигидро-1-изобутил- 2-оксо-1H-1,4-бензодиазепин-3-уксусная кислота

/3S/-1-Изобутил-7-хлор-5-/2-хлорфенил/2,3-дигидро-2-оксо-1H- 1,4-бензодиазепин-3-уксусной кислоты метиловый сложный эфир обрабатывают практически по способу примера 9 до получения бесцветного твердого соединения. Т. плавления 171-179oC.
Элементный анализ для C21H20Cl2N4O3:
Рассчитано: C 60,15; H 4,81; N 6,68
Найдено: C 60,41; H 4,89; N 6,85
Пример 18. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,
5-тетрагидро-4,1-бензодиазепин-3-уксусной кислоты метилового сложного эфира S-оксид

К раствору 3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензодиазепин-3-уксусной кислоты метилового сложного эфира /1 г/, полученного в примере 3, в 10 мл дихлорметана добавляют 0,37 г метахлорпербензойной кислоты, перемешивают 10 мин при комнатной температуре. К реакционной смеси добавляют 50 мл дихлорметана, промывают насыщенным водным раствором бикарбоната натрия, и водный слой экстрагируют дихлорметаном. Органический слой промывают насыщенным водным солевым раствором, сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток перекристаллизовывают из смеси дихлорметангексан до получения 0,59 г бесцветных кристаллов. Т. плавления 166-169oC.
Элементный анализ для C23H25Cl2NO4
S •I•7H2O:
Рассчитано: C 53,85; H 5,58; N 2,73
Найдено: C 53,70; H 5,27; N 2,36
Пример 19. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2- оксо-1,2,
3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового сложного эфира S-оксид

3, 5-транс-7-Хлор-5-/2-хлорфенил/-1-непентил-2-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового сложного эфира S-оксид /0,5 г/, полученный в примере 18, обрабатывают практически по способу примера 9 до получения 0,38 г бесцветных кристаллов. Т. плавления 230-235oC.
Элементный анализ для C22H23Cl2NO4S:
Рассчитано: C 56,41; H 4,95; N 2,99
Найдено: C 56,36; H 5,04; N 3,04
Пример 20. 3,5-транс-7-Хлор-5-/2-хлорфенил/-L-неопентил-2-оксо-1,2,3,5-тетрагидро-4,
1-бензотиазепин-3-уксусной кислоты метилового сложного эфира S-диоксид

К раствору 3, 5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин уксусной кислоты метилового сложного эфира /0,3 г/, полученного в примере 3, в 10 мл дихлорметана добавляют 0,25 г метахлорпербензойной кислоты и полученную смесь перемешивают в течение 2 ч при комнатной температуре, а затем обрабатывают реакционную смесь по способу примера 18 до получения 1,01 г бесцветных кристаллов. Т. плавления 218-224oC.
Элементный анализ: для C23H25Cl2NO5S:
Рассчитано: C 46,14; H 5,06; N 2,81
Найдено: C 46,22; H 5,16; N 2,69
Пример 21. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты S-диоксид

3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусную кислоту /0,3 г/, полученную в примере 9, обрабатывают практически по способу примера 18 и примера 20 до получения 0,14 г бесцветных кристаллов. Т. плавления 245-249oC.
Элементный анализ для C22H23Cl2NO5S • O•2H2O:
Рассчитано: C 54,15; H 4,83; N 2,87
Найдено: C 54,08; H 4,83; N 2,
65
Пример 22. N-/3,5-транс/-1-Неопентил-7-хлор-5-/2-хлорфенил/-2- оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-ацетил/глициновый метиловый сложный эфир
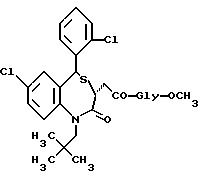
В 2 мл дихлорметана растворяют 3,5-транс-7-хлор-5-/2- хлорфенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин- 3-уксусную кислоту /0,1 г/, полученную в примере 9, и гидрохлорид метилового сложного эфира глицина /31 мг/. При 0oC к этому раствору добавляют 54 мг диэтилцианофосфоната и 49 мг триэтиламина. Полученную смесь перемешивают в течение 30 мин при комнатной температуре. К реакционной смеси добавляют 50 мл дихлорметана, промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным солевым раствором, с последующей сушкой над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из смеси дихлорметан/петролейный эфир до получения 99 мг бесцветных кристаллов. Т. плавления 188-189oC.
Элементный анализ для C25H28Cl2N2O4S:
Рассчитано: C 57,36; H
5,39; N 5,35
Найдено: C 57,36; H 5,39; N 5,19
Пример 23. N-/3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2- оксо-1-2,3,5-тетрагидро-4,1-бензотиазепин-3-ацетил/глицин

Соединение, полученное в примере 22 /50 мг/ гидролизуют по способу примера 9 до получения 35 мг бесцветных кристаллов, Т. плавления 229 - 230oC.
Элементный анализ для C24H26Cl2N2 O4S•O•3H2O:
Рассчитано: C 55,99; H 5,21; N 5,44
Найдено: C 55,98; H 5,09; N 5,29
Пример 24. 3,5-транс-7-Хлор-5-/2-хлорфенил/-3- диметиламинокарбонилметил-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,
1- бензотиазепин

К раствору 3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2- оксо-1,2,3, 5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты /1 г/, полученной в примере 9, и диметиламингидрохлорида /0,2 г/ в 20 мл дихлорметана добавляют диэтилцианофосфонат /375 мг/ и триэтиламин /558 г/. Полученную смесь перемешивают в течение 30 мин при комнатной температуре. К реакционной смеси добавляют 100 мл дихлорметана, промывают 5% HCl, насыщенным водным раствором бикарбоната натрия и водным солевым раствором, затем растворитель отгоняют. Остаток перекристаллизовывают из смеси дихлорметан/петролейный эфир до получения 0,98 г бесцветных кристаллов. T. плавления 190 - 193oC.
Элементный анализ для C24H28Cl2N2 O2S:
Рассчитано: C 60,12; H 5,89; N 5,84
Найдено: C 59,99; H 5,88; N 5,92
Пример 25. 7-Хлор-5-/2-хлорфенил/-1-изобутил-2-оксо-2,3,4,5- тетрагидро-1H-[1]-безазепин-3-уксусной кислоты этиловый эфир

По способу, раскрытому в J. Med. Chem. 27, 1508 /1984/, J. Med. Chem. 14, 851 /1971/ синтезируют промежуточные соединения.
/1/.
3-/Этоксикарбонил/-4-/2-хлорфенил/-4-фенил-3-бутеновую кислоту, маслянистое соединение
ИК νмакс /чистое/ см-1: 1730, 1715, 1705
/2/.
4-/2-Хлорфенил/-4-фенилмасляной кислоты этиловый сложный эфир, маслянистое соединение
ИК νмакс /чистое/ см-1: 1730.
1H ЯМР /CDCl3/ δ : 1,23/3H, т, J = 7,1 Гц/, 2,2 - 2,5 /4H, м/, 4,10/2H, кв, J = 7,1 Гц/, 4,45 - 4,6 /1H, м/, 7,0 - 7,4 /9H, м/,
/3/. 4-/2-Хлорфенил/-4-фенилмасляная кислота.
T. плавления 133 - 135oC.
Элементный анализ для C16H15ClO2:
Рассчитано: C 69,95; H 5,50
Найдено: C 70,10; H 5,42
/4/. 4-/2-Хлорфенил/-1-тетралон, маслянистое соединение
ИК νмакс /чистое/ см-1; 1685
1H ЯМР /CDCl3/ δ : 2,2 - 2,5 /2H, м/, 2,
6 - 2,8 /2H, м/, 4,85 /1H, т, J = 5,9 Гц/, 6,7 - 7,5 /7H, м/, 8,05 - 8,2 /1H, м/.
/5/ 4-/2-хлорфенил/-1-тетралоноксим. T. плавления 114 - 115oC.
/6/ 5-/2-хлорфенил/-2,3,4,5-тетрагидро-1H-/1/бензазепин-2-он
T. плавления 226 - 227oC
Элементный анализ для C16H14ClNO:
Рассчитано: C 70,72;
H 5,19; N 5,15
Найдено: C 70,94; H 5,20; N 5,20
/7/. 5-/2-Хлорфенил/-1-изобутил-2,3,4,5-тетрагидро-1H-[1] - бензоазепин-2-он.
К раствору 5-/2-хлорфенил/-2,3,4,
5-тетрагидро-1H-[1]- бензазепин-2-она /2,8 г/ и изобутилбромида /2,24 мл/ в 20 мл диметилформамида добавляют гидрид натрия /0,82 г, 60% масла/ при 0oC. Полученную смесь перемешивают при
комнатной температуре в течение 4 ч, растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем до получения 2,98 г бесцветных кристаллов. T. плавления 139 - 140o
C
Элементный анализ для C20H22ClNO:
Рассчитано: C 73,27; H 6,76; N 4,27
Найдено: C 73,08; H 6,69; N 4,36
/8/.
7-Хлор-5-/2-хлорфенил/-1-изобутил-2,3,4,5-тетрагидро-1H- [1]-бензазепин-2-он
Раствор 5-/2-хлорфенил/-1-изобутил-2,3,4,5-тетрагидро-1H-[1]- бензазепин-2-она /2,7 г/ и N-хлорсукцинимида /1,65
г/ в 10 мл диметилформамида перемешивают в течение 7 ч при 70oC. К реакционной смеси добавляют 100 мл этилового сложного эфира уксусной кислоты, промывают разбавленной соляной кислотой и
насыщенным водным раствором бикарбоната натрия с последующей сушкой над безводным сульфатом натрия. Растворитель удаляют, а остаток перекристаллизовывают из смеси гексан/этиловый эфир уксусной кислоты
до получения 2,39 г бесцветных кристаллов. T. плавления 152 - 154oC.
/9/. 7-Хлор-5-/2-хлорфенил/-1-изобутил-2-оксо-2,3,4,5- тетрагидро-1H-[1] -бензазепин-3-уксусной кислоты этиловый сложный эфир.
К 5 мл тетрагидрофурана добавляют 0,25 мл изопропиламина, и полученную смесь охлаждают до -15oC, добавляют 1,58 М гексановый раствор н-бутиллития /1, 14 мл/, и полученную смесь перемешивают в течение 45 мин при -15oC. К реакционной смеси добавляют 7-хлор- 5-/2-хлорфенил/-2,3,4,5-тетрагидро-1H-[1] -бензазепин-2-она /0,5 г/, растворенного 5 мл тетрагидрофурана, перемешивают в течение 15 мин при 0oC.
Реакционную смесь охлаждают до -78oC, добавляют этиловый сложный эфир иодоуксусной кислоты /0,25 мл/. Полученную смесь перемешивают в течение 15 мин при -78oC, затем в течение часа при 0oC. К реакционной смеси добавляют 1н. соляную кислоту /50 мл/, экстрагируют этиловым эфиром уксусной кислоты. Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния. Растворитель отгоняют, остаток очищают на хроматографической колонке с силикагелем до получения 0,1 г маслянистого соединения.
ИК νмакс /чистый/ см-1: 1730, 1660
1H ЯМР /CDCl3/ δ : 0,5 - 1,
15 /6H, м/, 1,15 - 1,4 /3H, м/, 1,7 - 3,1 /5H, м/, 3,1 - 3,9 /2H, м/, 4,0 - 4,1 /2H, м/, 4,4 - 4,8 /1H, м/, 6,4 - 7,6 /7H, м/.
SIMS /м/ / : 449 /MH+/ (химически
индуцированный MC)
Пример 26. 7-Хлор-5-/2-хлорфенил/-1-изобутил-2-оксо-2,3,4,5- тетрагидро-1H-[1]-бензазепин-3-уксусная кислота

Соединение примера 25 /90 мг/ обрабатывают практически по способу примера 9 до получения 50 мг бесцветных кристаллов.
T. плавления 165 - 171oC.
Элементный анализ для C22H23Cl2NO3:
Рассчитано: C 62,86; H 5,51; N 3,33
Найдено: C 62,
77; H 5,61; N 3,29
Пример 27. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-1,2,3,4- тетрагидро-2-тиооксо-4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир
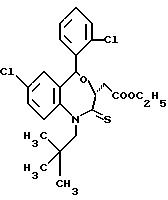
Раствор 3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,4-тетрагидро-4, 1-бензоксазепин-3-уксусной кислоты этилового сложного эфира /1,0 г/ и реагента Лоуессона /1,3 г/ в толуоле /15 мл/ нагревают в течение 8 ч с обратным холодильником. Нерастворимую часть отфильтровывают, полученный фильтрат концентрируют при пониженном давлении. Концентрат очищают на хроматографической колонке с силикагелем до получения 0,68 г желтых кристаллов. T. плавления 200 - 201o C.
Элементный анализ для C24H27Cl2 NO3S:
Рассчитано: C 60,00; H 5,66; N 2,92
Найдено: C 60,10; H 5,78; N 2,65
Пример 28, 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-1,2,3,4- тетрагидро-2-тиооксо-4,1-бензоксазепин-3-уксусная кислота

Соединение примера 27 /0,4 г) обрабатывают практически по способу примера 9 до получения 0,1 г желтых кристаллов.
T. плавления 248 - 249oC.
Элементный анализ: для C22H23Cl2NO3 S:
Рассчитано: C 58,41; H 5,12; N 3,10
Найдено: C 58,48; H 5,33; N 3,01
Пример 29. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1,2,4,5-тетрагидро-2-тиооксо-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

3,5-транс-7-Хлор-5-/2-хлорфенил/-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-уксусной кислоты этиловый эфир /1,0 г/, полученный в примере 1, обрабатывают по способу примера 27 до получения 0,95 г желтых кристаллов. T. плавления 194 - 197oC.
Элементный анализ для C18H15Cl2NO2 S2:
Рассчитано: C 52,43; H 3,67; N 3,40
Найдено: C 52,41; H 3,53; N 3,10
Пример 30. 7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,
1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир

/1/. 5-Хлор-3-/2-хлорбензоил/-2-неопентиламинотиофен.
В смешанном растворителе из 200 мл метанола и 100 мл уксусной кислоты растворяют 2-амино-5-хлор-3-/2-хлорбензоил/тиофен/10,89 г/. К полученному раствору добавляют 8,69 мл пивалальдегида /8,69 мл/ и молекулярные сита 3

Элементный анализ для C16H17Cl2NOS:
Рассчитано: C 56,14; H 5,01; N 4,09
Найдено: C 56,18; H 5,17; N 3,89
/2/. 3-/N-/5-Хлор-3-/2-хлорбензоил/-2-тиенил/-N-неопентил-карбамоил/акриловой кислоты
этиловый сложный эфир.
К раствору 5-хлор-3-/2-хлорбензоил/-2-неопентиламино-тиофена /4,85 г/, триэтиламина /5,92 мл/ в небольшом количестве диметиламинопиридина в диметилформамиде /60 мл/ прикапывают раствор моноэтилового эфира хлорида фумаровой кислоты /4,60 г/ в 20 мл диметилформамида. Реакционную смесь перемешивают при комнатной температуре в течение ночи, выливают в воду, экстрагируют этиловым эфиром уксусной кислоты. Полученный экстракт промывают 1M водным раствором кислотного сульфата калия и насыщенным водным солевым раствором, сушат над безводным сульфатом магния. Растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем, с последующей перекристаллизацией из смеси гексан/этиловый эфир уксусной кислоты до получения 4,3 г бесцветных кристаллов. T. плавления 79 - 81oC.
Элементный анализ для C22H23NO4S• O•5H2O:
Рассчитано: C 55,35; H 5,07;
N 2,93
Найдено: C 55,25; H 4,83; N 3,00
/3/. 3-/5-Хлор-3-α-гидрокси-2-хлорбензил/-2-тиенил/-N- неопентилкарбамоил /акриловой кислоты сложный эфир.
К раствору 3-/N-/5-хлор-3-/2-хлорбензоил/-2-тиенил/-N- неопентилкарбамоил/акриловой кислоты сложного этилового эфира /2,37 г/ и гептагидрата трихлорида цезия /2,98 г/ в 100 мл метанола постепенно добавляют 303 мг боргидрида натрия при комнатной температуре. Полученную смесь перемешивают в течение 20 мин при комнатной температуре, добавляют ацетон, затем растворитель отгоняют. К полученному остатку добавляют 1M кислотный сульфат калия и сложный эфир уксусной кислоты. Органический слой промывают насыщенным водным солевым раствором, сушат над сульфатом магния. Растворитель отгоняют, а полученный остаток очищают на хроматографической колонке с силикагелем до получения некристаллического твердого вещества /2,47 г/.
1H-ЯМР /CDCl3/ δ : 0,91, 1,00 /9H/, 1,20 - 1,35 /3H, м/, 2,50 - 2,59 //1H, м/, 2,90 - 4,28 /4H, м/, 5,95, 6,05 /1H/, 6,52 - 7,60 /7H, м/.
/4/ 7-хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2, 3-e]оксазепин-3-уксусной кислоты этиловой сложный эфир.
К раствору 3-/N-/5-хлор-3-/ альфа -гидрокси-2-хлорбензил/ -2-тиенил/-N-неопентилкарбамоил/акриловой кислоты этилового сложного эфира /2,37 г/ в 50 мл этанола добавляют 700 мг карбоната калия. Полученную смесь перемешивают в течение 8 ч при комнатной температуре. Реакционную смесь выливают в воду, которую экстрагируют этиловым эфиром уксусной кислоты. Полученный экстракт промывают насыщенным водным солевым раствором, сушат над безводным сульфатом магния. Растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем до получения бледно-желтого маслянистого соединения /1,73 г/.
1H ЯМР /CDCl3| δ : 0,99, 1,02 /9H, каждый c/, 1,26, 1,28 /3H, каждый т. /, 2,60 - 3,09 /3H, м/, 4,08 - 4,25 /2H, м/, 4,38, 4,57 /1H, каждый д/, 4,67, 4,92 /1H, каждый дд/, 5,87, 6,42 /1H, каждый c/, 6,06, 6,51/1H, каждый c/, 7,20 - 7,66 /4H, м/.
Пример 31. 3,
5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e]бензоксазепин-3-уксусная кислота

Соединение, полученное в примере 30 /1,64 г/, растворяют в смешанном растворителе из 30 мл метанола и 30 мл тетрагидрофурана. К раствору добавляют карбонат калия, перемешивают в течение 2 ч при 60oC. Реакционную смесь подкисляют 1н. соляной кислотой, выливают затем в воду, экстрагируют этиловым эфиром уксусной кислоты. Органический слой сушат над безводным сульфатом магния. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем до получения твердого вещества, которое затем перекристаллизовывают из смеси гексан/этиловый эфир уксусной кислоты до получения 68 мг бесцветных кристаллов.
T. плавления 202 - 204oC.
Элементный анализ для C20H21
Cl2NO4 S:
Рассчитано: C 54,30; H 4,78; N 3,17
Найдено: C 54,20; H 4,62; N 3,16
Пример 32. 3,5-транс-7-Хлор-5-/2-метоксифенил/-1-неопентил-2- оксо-1,2,3,
5-тетрагидро-4,1-тиено[2,3-e] оксазепин-3-уксусной кислоты этиловый сложный эфир и 3,5- цис-7-хлор-5-/2-метоксифенил/-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-тиено[2,3-e] оксазепин-3- уксусной
кислоты этиловый сложный эфир


По способу примера 30 получают эти соединения:
/1/. 5-Хлор-3-/2-метоксибензоил/-2-неопентиламинотиофенон
T. плавления 117 - 118o C.
Элементный анализ для C17H20ClNO2S:
Рассчитано: C 60,43; H 5,97; N 4,15
Найдено: C 60,15; H 5,92; N 4,10
/2/.
3-/N-/5-Хлор-3-/2-метоксибензоил/-2-тиенил-N- неопентилкарбамоил/акриловой кислоты этиловый сложный эфир, маслянистое соединение
1H ЯМР /CDCl3/ δ : 0,96/9H, с/, 1,
26/3H, т, J = 7,2 Гц/, 3,57 /1H, д, J = 13,7 Гц/, 3,73 /3H, с/, 3,74/1H, д, J = 13,7 Гц/, 4,18/2H, кв., J = 7,2 Гц/, 6,75/1H, с/, 6,81/1H, д, J = 15,3 Гц/, 6,90 - 7,04 /2H, м/, 7,12 /1H, д, J = 15,3
Гц/, 7,31 - 7,51 /2H, м/,
/3/ 3-/N-/5-/хлор-3-/α-гидрокси-2-метоксибензил/-2-тиенил/-N- неопентилкарбамоил/акриловой кислоты сложный эфир, маслянистое соединение
1H
ЯМР /CDCl3/ δ : 0,91/9H,с/, 1,00/9H, каждый c/, 1,24, 1,28 /3H, каждый т/, 2,80 - 2,91/, 3,32 /1H/, 3,74, 3,82/3H, каждый c/, 4,06 - 4,27 /3H, м/, 5,81, 5,93 /1H, каждый д/, 6,40 - 7,
34 /7H, м/,
/4/ 3,5-транс-7-хлор-5-/2-метоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e] оксазепин-3-уксусной кислоты этиловый сложный эфир
T. плавления 148
- 150oC
Элементный анализ для C23H28ClNO5S:
Рассчитано: C 59,28; H 6,06; N 3,01
Найдено: C 59,17; H 5,95; N 2,90
3,
5-цис-7-Хлор-5-/2-метоксифенил/-1-неопентил/-2-оксо-1,2,3,5- тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир.
1H ЯМР /CDCl3/ δ : 0,97 /9H, с/, 1,26 /3H, т, J = 7,1 Гц/, 2,81 /1H, дд, J = 8,1, 17,0 Гц/, 2,96/1H,д, J=14,2 Гц/, 3,01/IH,дд, J=5,8, 17,0 Гц, 3,89 /3H, с/, 4,10-4,23 /2H, м/, 4,54 /1H, д, J = 14,2 Гц/, 4,90 /1H, дд, J = 5,7, 8,1 Гц/, 6,42 /1H, с/, 6,56 /1H, с/, 6,88-6,97 /2H, м/, 7,22-7,32 /1H, м/, 7,35-7,41 /1H, м/.
Пример 33. 3,5-цис-7-Хлор-5-/2-метоксифенил/-1-неопентил/-2- оксо-1,2,3,
5-тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота

Транс-форму этилового сложного эфира /0,51 г/, полученного в примере 32, обрабатывают по способу примера 31 до получения 0,18 г бесцветных кристаллов.
Т. плавления 220-222oC.
Элементный
анализ для C21H24ClNO5S:
Рассчитано: C 57,59; H 5,52; N 3,20
Найдено: C 57,54; H 5,58; N 3,18
Пример 34. 3,
5-цис-7-Хлор-5-/2-метоксифенил/-1-неопентил/-2- оксо-1,2,3,5-тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота

Цис-форму этилового сложного эфира примера 32 /0,28 г/ обрабатывают по способу примера 31 до получения 0,16 г бесцветных кристаллов. Т. плавления 189-191oC.
Элементный анализ для C21H24ClNO5S:
Рассчитано: C 57,59; H 5,52; N 3,20
Найдено: C 57,36; H 5,42; N 3,11
Пример
35. 3,5-транс-7-Хлор-1-изобутил-5-/2-метоксифенил/-2- оксо-1,2,3,5-тетрагидро-4,1-тиено[2,3-e] оксазепин/2/уксусной кислоты этиловый сложный эфир и 3,
5-цис-7-хлор-1-изобутил-5-/2-метоксифенил/- 2-оксо-1,2,3,5-тетрагидро-4,1-тиено[2,3-e] оксазепин-3-уксусной кислоты этиловый сложный эфир


Эти соединения получают по способу примера 30.
/1/. 5-Хлор-2-изобутиламино-3-/2-метоксибензоил/тиофен
Т. плавления 83-84oC.
Элементный анализ для C16H18ClNO2
S:
Рассчитано: C 59,34; H 5,60; N 4,33
Найдено: C 59,41; H 5,63; N 4,30
/2/. 3-/N-/5-Хлор-3-/2-метоксибензоил/-2-тиенил/-N- изобутилкарбамоил/акриловой кислоты этиловый
сложный эфир в виде маслянистого соединения
1H ЯМР /CDCl3/ δ: 0,92 /6H, шир/, 1,28 /3H, т, J = 7,1 Гц/, 1,89-2,12 /1H, м/, 3,12-3,27 /1H, м/, 3,75 /3H, с/, 3,80-4,
00 /1H, м/, 4,20 /2H, кв, J = 7,1 Гц/, 6,76-7,54 /7H, м/.
/3/. 3-/N-/5-хлор-3-/ α- гидрокси-2-метоксибензил/-2-тиенил/-N- изобутилкарбамоил/акриловой кислоты этиловый сложный
эфир в виде маслянистого соединения
1H ЯМР /CDCl3/ δ: 0,80-1,00 /6H, м/, 1,19-1,32 /3H, м/, 1,88-2,16 /1H, м/, 2,69-3,24 /2H, м/, 3,74, 3,79 /3H, каждый с/, 3,87-4,
26 /3H, м/, 5,80-5,99 /1H, м/, 6,49-7,64 /7H, м/.
/4/. 3,5-транс-7-Хлор-1-изобутил-5-/2-метоксифенил/-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e] оксазепин-3-уксусной кислоты этиловый сложный эфир. Т. плавления 126-128oC.
Элементный анализ для C22H26ClNO5S:
Рассчитано: C 58,46; H 5,80; N 3,10
Найдено: C
58,23; H 5,72; N 3,03
3,5-цис-7-Хлор-1-изобутил-5-/2-метоксифенил/-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусной кислоты этиловый сложный эфир в виде маслянистого
соединения.
1H ЯМР /CDCl3/ δ : 0,96 /6H, д, J = 6,6 Гц/, 1,27 /3H, т, J = 7,1 Гц/, 2,05-2,24 /1H, м/, 2,81 /1H, дд, J = 8,1, 17,0 Гц/, 3,00 /1H, дд, J = 5, 6, 17,0 Гц/, 3,09 /1H, дд, J = 5,3, 14,1 Гц/, 3,88 /3H, с/, 4,17 /2H, кв, J = 7,1 Гц/, 4,31 /1H, дд, J = 9,3, 14,1 Гц/, 4,89 /1H, дд, J = 5,6, 8,1 Гц/, 6,41 /1H, с/, 6,48 /1H, с/, 6,86-6,96 /2H, м/, 7, 20-7,34 /2H, м/.
Пример 36. 3,5-транс-7-Хлор-1-изобутил-5-/2-метоксифенил/-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота

Транс-форму сложного эфира /0,68 г/, полученного в примере 35, обрабатывают по способу примера 31 до получения 0,22 г бесцветных кристаллов. Т. плавления 183-185oC.
Элементный анализ для C20H22ClNO5S:
Рассчитано: C 56,67; H 5,23; N 3,30
Найдено: C 56,40; H 5,18; N 3,29
Пример 37. 3,5-цис-7-Хлор-1-изобутил-5-/2-метоксифенил/-2-оксо- 1,2,3,5-тетрагидро-4,1-тиено[2,3-e]оксазепин-3-уксусная кислота

Цис-форму сложного эфира примера 35 /0,59 г/ обрабатывают по способу примера 31 до получения 0,27 г бесцветного твердого вещества. Т. плавления 144-146oC.
Элементный анализ для C20H22ClNO5S:
Рассчитано: C 56,67; H 5,23; N 3,30
Найдено: C 56,94; H 5,24; N 3,58
Пример 38. 3,5-транс-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

5-хлор

Элементный анализ для C25H30ClNO5S•O•3H2O:
Рассчитано: C 60,36; H 6,20; N 2,86
Найдено: C 60,43;
H 6,21; N 2,75
Пример 39. 3,5-транс-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксуснай кислота
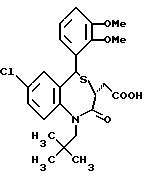
3,5-транс-7-Хлор-5-/2-диметоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир, полученный в примере 38 /10 г/ обрабатывают по способу примера 9 до получения 7,7 г бесцветных кристаллов. Т. плавления 263-277oC.
Элементный анализ для C24H28ClNO5S:
Рассчитано: C 60,31; H 5,91; N 2,93
Найдено: C 60,03; H 5,86; N 2,84
Пример 40. N-//3R,5S/-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил- 2-оксо-1,2,3,
5-тетрагидро-4,1-бензотиазепин-3-ацетил/-L-лейциновый метиловый сложный эфир и N-//3S,5R/-7-Хлор-5-/2,3-диметоксифенил/-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-ацетил/-L-лейцина
метиловый сложный эфир


В дихлорметане /150 мл/ растворяют 3,5-транс-7-хлор-5-/2.3-диметоксифенил/-1-неопенитил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусную кислоту /7,1 г/ и L-лейциновый метиловый сложный эфир /2,7 г/. К раствору добавляют диэтилцианофосфонат /3,6 г/ и триэтиламин /3.5 г/. Полученную смесь перемешивают в течение 30 мин при комнатной температуре, промывают 5% HCl, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором соли. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем, используя в качестве элюента смесь гексан: этиловый эфир уксусной кислоты = 4:1, до получения 4,13 г N-//3R, 5S/-7-хлор-5/2,3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4, 1-бензотиазепин-3-ацетид/-L-лейцина метилового сложного эфира из первой фракции в виде бесцветных кристаллов. Т.плавления 121-123oC.
(α) -235,2o /C=0,39, MeOH/
1H-ЯМР /CDCl3/ δ : 0,932 /6H, т, J = 6,2 Гц/, 0,989
/9H, с/, 1,49 - 1,67 /3H, м/, 2,322 /1H, дд, J = 3,2, 14, 2 Гц/, 2,97 /1H, дд, J = 10,6, 14,2 Гц/, 3,187 /1Г, д, J = 14,0 Гц/, 3,696 /3H, с/, 3.715 /3H, с/, 3,779 /1H, дд, J = 3,2, 10,6 Гц/, 3,889 /3H,
с/, 4,420 /1H, д, J = 14,0 Гц/, 4,47 - 4,59 /1H, м/, 6,05 - 6,10 /1H, шир./, 6,270 /1H, с/, 6,814 - 7,400 /6H, м/.
Из второй фракции получают 4,15 г N-//3S, 5R/-7-хлор-5-/2, 3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1_ бензотиазепин-3-ацетил/-L-лейцина метилового сложного эфира в виде некристаллического твердого продукта.
(α)
1H-ЯМР /CDCl3/ δ : 0,89 - 0,92
/6H, м/, 0,996 /9H, м/, 1,51 - 1,66 /3H, м/, 2,323 /1H, дд, J = 4,2, 14,4 Гц/, 2,990 /1H, дд, J =10,2, 14,4 Гц/, 3,226 /1H, д, J = 13,8 Гц/, 3,69 - 3,78 (7H, м/, 3,890 /3H, с/, 4,44 - 4,54 /2H, м/, 6,
281 /1H, с/, 6,37 - 6,41 /1H, шир/, 6,801 - 7,396 /6H, м/.
Пример 41. /3R, 5S/-7-Хлор-5-/2,3-диметоксфенил/2-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1- бензотиазепин-3-уксусной
кислоты метиловый сложный эфир

К раствору N-//3R, 5S/-7-хлор-5-/2, 3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-ацетил/-L-лейцина метилового сложного эфира /4,13 г/, полученного в примере 40, в 100 мл метанола добавляют 50 мл концентрированной HCl, и полученную смесь нагревают в течение 24 ч с обратным холодильником. Реакционную смесь экстрагируют дихлорметаном, и полученный экстракт сушат над безводным сульфатом натрия, затем растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем/элюент: уксусная кислота: этиловый эфир = 3:1 объем/объем. Полученный твердый продукт перекристаллизовывают из смешанного растворителя /дихлорметанпетролейный эфир/ до получения 2,87 г бесцветных кристаллов. Т. плавления 170-171oC.
Пример 42. /3S, 5R/-7-Хлор-5-/2,
3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1/ бензотиазепин-3-уксусной кислоты метиловый сложный эфир

N-//3S, 5R/-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1- бензотиазепин-3-ацетил/-L-лейцина метиловый сложный эфир /4,15 г/, полученный в примере 40, обрабатывают практически по способу примера 41 до получения 2,70 г бесцветных кристаллов. Т. плавления 168-170oC.
Пример 43. /3R, 5S/-7-Хлор-5-/2,
3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусная кислота

/3R, 5S/-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /2,6 г/, полученный в примере 4, обрабатывают по способу примера 9 до получения 1,98 г бесцветных кристаллов. Т.плавления 263-271oC.
(α)
Элементный анализ для C24H28ClNO5S:
Рассчитано: C 60,31; H 5,90; N 2,93
Найдено: C 60,09;
H 6,08; N 2,99
Пример 44. /3S, 5R/-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусная кислота

/3S, 5R/-7-Хлор-5-/2,3-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /2,5 г/, полученный в примере 42, обрабатывают, практически по способу примера 9 до получения 1,88 г бесцветных кристаллов. Т. плавления 261-270oC.
(α)
Элементный анализ для C24H28ClNO5
S:
Рассчитано: C 60,31; H 5,90; N 2,93
Найдено: C 60,13; H 5,89; N 2,97
Пример 45. 3,5-транс-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,
1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

5-хлор -α- 2, 4-диметоксифенил/-2-/неопентиламино/бензиловый спирт /38,9 г/ и тиояблочную кислоту /16,1 г/ обрабатывают по способу примера 1 до получения 32,5 г бесцветных кристаллов. Т.плавления 190-191o C.
Элементный анализ для C25H30ClNO5S:
Рассчитано: C 61,03; H 6,15; N 2,85
Найдено: C 60,95; H 6,12; N 2,75
Пример 46. 3,
5-транс-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусная кислота
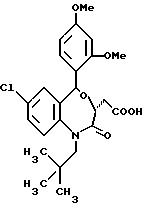
3,5-транс-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /27 г/, полученный в примере 45, обрабатывают по способу примера 9 до получения 26,6 г бесцветных кристаллов. Т. плавления 157-160oC.
Элементный анализ для C24H28ClNO5S:
Рассчитано: C 60,31; H 5,91; N 2,93
Найдено: C 60,57; H 5,83; N 2,66
Пример 47. N-//3S, 5R/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,
1-бензотиазепин-3-ацетил/-L-аланина трет-бутиловый сложный эфир и N-//3R, 5S/-7-хлор-5-/2,4-диметоксифенил/-4-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-ацетил/-L-аланина трет-бутиловый
сложный эфир


3,5-транс-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусную кислоту /15 г/ и L-аланина трет-бутиловый сложный эфир /гидрохлорид/ /6,0 г/ обрабатывают по способу примера 40 до получения 6,31 г N-/3S, 5R/-7-хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-ацетил/-L-аланина трет-бутилового сложного эфира в виде некристаллического твердого продукта из первой фракции.
1H-ЯМР (CDCl3/
Из второй фракции получают 7,91 г N//3R, 5S/-7-хлор-5-/2,4-диметоксифенил/-1-/неопентил-2-оксо-1,2,3,5- тетрагидро-4, 1-бензотиазепин-3-ацетил/-L-аланина трет-бутилового сложного эфира в виде некристаллического твердого продукта.
1H ЯМР /CDCl3/ δ : 0,968 /9H, с/, 1,338 /3H, д, J = 7,0 Гц/, 1,440 /9H, с/, 2,332 /1H, дд, J = 3,6, 15,2 Гц/, 2,937 /1H, дд, J = 10,4, 15,2 Гц/, 3,186 /1H, д, J = 13,8 Гц/, 3,660 /3H, с/, 3,781 /1H, дд, J = 3,6, 10,4 Гц/, 4,369 /1H, кв, J = 7,0 Гц/, 4,447 /1H, д, J = 13,8 Гц/, 6,240 /1H, с/, 6,470 /1H, д, J = 2,4 Гц/, 6,603 /1H, дд, J = 2,4, 8,6 Гц/, 6,841 /1H, с/, 7,264 /2H, м/, 7,629 /1H, д, J = 8,6 Гц/.
Пример 48. /3S,
5R/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

N-//3S, 5R/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-ацетил/-L-аланина трет-бутиловый сложный эфир /6,31 г/, полученный в примере 47, обрабатывают практически по способу примера 41 до получения бесцветных кристаллов. Т.плавления 187-188oC.
Пример 49. /3R, 5S/-7-Хлор-5-/2,
4-диметоксифенил/-1-неопентил-2-оксо 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

N-//3R, 5S/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-ацетил/-L-аланина трет-бутиловый сложный эфир /7,91 г/, полученный в примере 47, обрабатывают по способу примера 41 до получения 3,89 г бесцветных кристаллов. Т.плавления 188-190oC.
Пример 50. /3S, 5R/-7-Хлор-5-/2,
4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-уксусная кислота

/3S, 5R/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /3,5 г/, полученный в примере 48, обрабатывают по способу примера 9 до получения 3,22 г бесцветных кристаллов. Т.плавления 147-151oC.
(α)
Элементарный анализ для C24H28ClNO5S:
Рассчитано: C 60,31; H 5,91; N 2,93
Найдено: C 60,58;
H 5,82; N 2,79
Пример 51. /3R, 5S/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусная кислота

/3R, 5S/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир /3, 37 г/, полученный в примере 49, обрабатывают по способу примера 9 до получения 3,28 г бесцветных кристаллов. Т.плавления 148-152oC.
(α)
Элементарный анализ для C24H28ClNO5
S:
Рассчитано: C 60,31; H 5,91; N 2,93
Найдено: C 60,32; H 5,83; N 2,87
Пример 52. 7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-3H-1,
3-бензодиазепин-3-уксусной кислоты метиловый сложный эфир

/1/. α - /5/Хлор-2-нитрофенил/-2-хлорфенилуксусной кислоты метиловый сложный эфир
Раствор гидрида натрия /3,4 г/, 2-хлорфенилуксусной кислоты метилового сложного эфира /28,3 г/ и 4-хлор-1, 2-динитробензола /27 г/ в 100 мл диметилформамида перемешивают в течение часа при 0oC. Реакционную смесь добавляют к разбавленной соляной кислоте /300 мл/, экстрагируют этиловым эфиром уксусной кислоты. Экстракт промывают насыщенным водным солевым раствором, сушат над безводным сульфатом натрия, и растворитель отгоняют. Оставшийся маслянистый продукт очищают на хроматографической колонке с силикагелем /элюент: гексан: этиловый эфир уксусной кислоты = 10:1, объем/объем, перекристаллизовывают из гексана до получения 26,3 г желтых кристаллов. Т.плавления 96-97oC.
Элементарный анализ для C15H11Cl2NO4:
Рассчитано: C 52,96; H 3,26; N 4,12
Найдено: C 53,04; H 3,34; N 4,06
/2/.
2-/2-Нитро-5-хлорфенил/-2-/2-хлорфенил/этанол.
Смешанный раствор α- /5-хлор-2-нитрофенил/-2-хлорфенилуксусной кислоты метилового сложного эфира /26,3 г/ и 2 г боргидрида лития в 200 мл тетрагидрофурана перемешивают в течение 4 ч при комнатной температуре. Этот раствор добавляют к 20% водному раствору уксусной кислоты /50 мл/ экстрагируют этиловым эфиром уксусной кислоты. Полученный экстракт промывают водой, сушат над безводным сульфатом натрия, и растворитель отгоняют. Оставшееся маслянистое соединение очищают на хроматографической колонке с силикагелем до получения 11,0 г маслянистого соединения.
1H ЯМР /CDCl3/ δ: 1,90 /1H, шир/, 4,15-4,33 /2H, м/, 5,270 /1H, т, J = 6,2 Гц/, 7,20-7,40 /6H, м/, 7,867 /1H, д, J = 8,4
Гц/
/3/. α- /5-Хлор-2-нитрофенил/-2-хлорфенилацетальдегид
Раствор диметилсульфоксида /6,7 мл/ в 30 мл дихлорметана добавляют к раствору оксалилхлорида /6,2 мл/ в 300 мл
дихлорметана при -78oC. Полученную смесь перемешивают еще 10 мин при -78oC. К этому растворе добавляют раствор 2-/2-нитро-5-хлорфенилэтанола /11,04 г/ в 100 мл дихлорметана при
-78oC и полученную смесь перемешивают еще 15 мин при -78oC.
К реакционной смеси добавляют 37 мл триэтиламина, нагревают до 0oC, добавляют насыщенный водный раствор аммоний хлорида /124 мл/. Органический слой промывают водой, сушат над безводным сульфатом натрия, и растворитель отгоняют. Оставшееся маслянистое соединение очищают на хроматографической колонке с силикагелем /элюент:гексан:этиловый эфир уксусной кислоты = 3:1 объем/объем до получения 9,15 г маслянистого соединения.
1H ЯМР /CDCl3 / δ : 6,299 /1H, с/, 6,836 /1H, д, J = 2,2 Гц/, 7,14 - 7,65 /5H, м/, 8,096 /1H, д, J = 88 Гц/, 9,887 /1H, с/.
/4/ N-/2-/2-хлорфенил/-2-/2-нитро-5-хлорфенил/этил/глицина
метиловый сложный эфир
К раствору α- /5-хлор-2-нитрофенил/-2-хлорфенилацетальдегида /1,68 г/ в 15 мл метанола добавляют гидрохлорид метилового сложного эфира глицина /0,69 г/ и 0,45 г
ацетата натрия. Полученную смесь перемешивают 30 мин при комнатной температуре, добавляют 0,35 г цианоборгидрида натрия. К этой смеси добавляют хлористый водород в течение 5 мин. Полученный раствор
перемешивают в течение 3 ч при 50o, добавляют 1н. водный раствор гидроксида натрия /50 мл/, и экстрагируют дихлорметаном. Полученный экстракт промывают водой, затем растворитель отгоняют.
Оставшийся маслянистый продукт очищают на хроматографической колонке с силикагелем /элюент гексан:этиловый эфир уксусной кислоты = 3:1 объем/объем/ до получения 1,1 г маслянистого соединения.
1H ЯМР /CDCl3/ δ : 3,200 /2H, дд, J = 6,8, 12,2 Гц/, 3,366 /1H, дд, J = 7,6, 12,2 Гц/, 3,482 /2H, с/, 3,731 /3H, с/, 5,255 /1H, т, J = 7,2 Гц/, 7,22-7,44 /6H, м/, 7,846 /1H, д, J = 8,6 Гц/.
/5/. N-/2-/2-Хлорфенил/-2-/2-нитро-5-хлорфенил/этил/-N-трифторацетил/глицина метиловый сложный эфир.
К раствору N-/2-/2-хлорфенил/-2-/2-нитро-5-хлорфенил/этил/-глицина метилового сложного эфира /4,9 г/ и 3,0 г пиридина в 50 мл дихлорметана добавляют 2,97 мл трифторуксусного ангидрида, и полученную смесь перемешивают 10 мин при комнатной температуре. Полученный раствор промывают 1н. водным раствором гидрохлорида натрия и насыщенным водным солевым раствором, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем /элюент гексан:этиловый эфир уксусной кислоты = 5:1 объем/объем до получения 5,95 г маслянистого соединения.
1H ЯМР /CDCl3/ δ : 3,786 /3H, с/, 4,138 /1H, дд, J = 7,0, 14,0 Гц/, 4,215 /2H, с/, 4,434 /1H, дд, J = 8,8, 14,0 Гц/, 5,473 /1H, дд, J = 7,0, 8,8 Гц/, 7,27 - 7,52 /6H, м/, 7,874 /1H, д, J = 8,4 Гц/.
/6/ N-/2-/2-амино-5-хлорфенил/-2-/2-хлорфенил/этил/-N-/трифторацетил/глицина метиловый сложный эфир
К раствору
N-/2-/2-хлорфенил/-2-/2-нитро-5-хлорфенил/этил/-N- /трифторацетил/глицина метиловому сложному эфиру /1 г/ в этиловом эфире уксусной кислоты /20 мл/ добавляют 10% Pd/C катализатор /100 мг/. Полученную
смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. После завершения реакции катализатор удаляют, и растворитель отгоняют. Остаток очищают на
хроматографической колонке с силикагелем /элюируя смесью гексан:этиловый эфир уксусной кислоты = 4:1 объем/объем до получения 0,39 г маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 3,705/1/4 x 3H, с/, 3,742/3/4 x 3H, с/ 3,473 4,247 /4H, м/, 4,72 - 4,80/1/4 x 1H, м/, 4,874 /3/4 x 1H, дд, J = 5,8, 9,4 Гц/, 6,57 - 6,63 /7H, м/, 7,05 - 7,44 /61H, м/.
/7/ N-/2-/5-хлор-2-неопентиламинофенил/-2-/2-хлорфенил/ этил/-N-/трифторацетилглицина метиловый сложный эфир.
К раствору N-/2-/2-амино-5-хлорфенил/-2-/2-хлорфенил/этил/- N-/трифторацетил/глицина метиловому сложному эфиру /0,39 г/ в 5 мл метанола добавляют 0,05 мл уксусной кислоты и 78 мг пивалальдегида. Полученную смесь перемешивают в течение 30 мин при комнатной температуре, добавляют 57 мг цианоборгидрида натрия. Полученную смесь перемешивают в течение часа при комнатной температуре, затем добавляют 50 мл дихлорметана. Этот раствор промывают 1н. водным раствором боргидрида натрия, затем водой, а затем отгоняют растворитель. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 5 : 1 объем/объем до получения 0,27 г маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 0,851 /9H, с/, 2,65 - 2,83 /2H, м/, 3, 316/1/4 x 1H, д, J = 17,4 Гц/, 3,51 - 3,60 /1H, м/, 3,702/1/4 x 3H, с/, 3,748/3/4 x 3H, с/, 3,873 /1H, дд, J = 9,8, 13,4 Гц/, 4,055/3/4 x 1H, J = 17,9 Гц/, 4,274 /1H, дд, J = 5,8, 13,4 Гц/, 4,72 - 4, 86 /1H, м/, 6,53 - 6,60 /1H, м/, 7,11 - 7,40 /6H, м/.
/8/ N-/2-/5-хлор-2-неопентиламинофенил/-2-/2-хлорфенил/ этил/глицина метиловый сложный эфир
К раствору
N-/2-/5-хлор-2-неопентиламинофенил/-2- /2-хлорфенил/этил/-N-/трифторацетилглицина метилового и сложного эфира /0,2 г/ в 3 мл метанола добавляют концентрированную соляную кислоту /0,6 мл/ нагревают с
обратным холодильником в течение одного дня. К этой реакционной смеси добавляют 1 н. водный раствор гидроксида натрия /8 мл/, экстрагируют дихлорметаном. Полученный экстракт промывают водой,
растворитель отгоняют, в результате чего получают 72 мг маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 0,823 /9H, с/, 2,659 /1H, д/, J = 11,2 Гц/, 2,769 /1H, д, J = 11,2 Гц/, 3,029 /1H, дд, J = 5,2, 11,8 Гц/, 3,279 /1H, дд, J = 8,4, 11,8 Гц/, 3,427 /1H, д, J = 17,6 Гц/, 3,528 /1H, д, J = 17,6 Гц/, 3,741 /3H, с/, 4,563 /1H, дд, J = 5,2, 8,4 Гц/, 6,538 /1H, д, J = 8,8 Гц/, 6,99 - 7,42 /6H, м/.
/9/ 7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-3H-1,3-бензодиазепин-3-уксусной кислоты метиловый сложный эфир.
К раствору N-/2-/5-хлор-2-неопентиламинофенил/-2- /2-хлорфенил/этил/глицина метилового эфира /0,47 г/ и 0,21 г триэтиламина в 5 мл толуола добавляют трифосген /0,14 г/. Полученную смесь нагревают в течение 5 ч при 70oC. К реакционной смеси добавляют 50 мл дихлорметана, промывают 1н. соляной кислотой и водой, затем растворитель отгоняют. Остаток перекристаллизовывают из гексана до получения 0,30 г бесцветных кристаллов. Т. плавления 142 - 148oC.
1H-ЯМР /CDCl3/ δ : 0,940 /9H, с/, 3,492 /1H, д, J = 14,4 Гц/, 3,639 /1H, д, J = 17,2 Гц/, 3,715 /3H, с/, 3,976 /2H, д, J = 8,6 Гц/, 4,038 /1H, д, J = 17,2 Гц/, 4,308 /1H, д, J = 14,4 Гц/, 5,317 /1H, д, J = 8,6 Гц/, 6,645 /1H, д, J = 1,8 Гц/, 7,14 - 7,50 /6H, м/.
Пример 53. 7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-3H-1,3-бензодиазепин-3-уксусная кислота

7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5- тетрагидро-3H-1,3-бензодиазепин-3-уксусной кислоты метиловый сложный эфир /0,30 г/ обрабатывают по способу примера 9 до получения 0,21 г бесцветных кристаллов.
Т. плавления 228 - 231oC.
Элементный анализ для C22H24Cl2N2
O3:
Рассчитано: C 60,70; H 5,56; N 6,43
Найдено: C 60,37; H 5,49; N 6,15
Пример 54. 3,6-транс-8-Хлор-6-/2-хлорфенил/-1-неопентил- 2-оксо-2,3,5,6-тетрагидро-1H-4,
1-бензоксазоцин-3-уксусной кислоты этиловый сложный эфир

/1/. 2-/2-Амино-5-хлорфенил/-2-/2-хлорфенил/этанол.
К раствору 2-/2-нитро-5-хлорфенил/-2-/2-хлорфенил/этанола /7,0 г/, полученного в примере 52-/2/ в 70 мл этанола добавляют 3,4 г гидразингидрата и никель Ренея /0,1 г/. Полученную смесь перемешивают в течение 30 минут при комнатной температуре. Катализатор удаляют, растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 2 : 1 объем/объем до получения 4,44 г маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 4, 107 /2H, д, J = 6,6 Гц/, 4,587 /1H, т, J = 6,6 Гц/, 6,597 /1H, д, J = 8,4 Гц/, 7,01 - 7,43 /6H, м/.
/2/ 2-/5-хлор-2-неопентиламинофенил/-2-/2-хлорфенил/этанол
К раствору
2-/2-амино-5-хлорфенил/-2-/2-хлорфенил/этанола /4,44 г/ в метаноле /50 мл/ добавляют 1,4 мл уксусной кислоты и 2,0 г пивалальдегида. Полученную смесь перемешивают в течение 30 мин при комнатной
температуре. К раствору добавляют 1,5 г циано боргидрида натрия, и полученную смесь перемешивают еще час при комнатной температуре. Затем реакционную смесь обрабатывают по способу примера 52-/7/ до
получения 5,5 г маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 0,813 /9H, с/, 2,654 /1H, д, J = 11,4 Гц/, 2,766 /1H, д, J = 11,4 Гц/, 4,11 - 4,15 /2H, м/, 4, 590 /1H, т, J = 6,3 Гц/, 6,549 /1H, д, J = 8,6 Гц/, 7,01 - 7,44 /6H, м/.
/3/ 3-/N-/2-/1-/2-хлорфенил/-2-гидроксиэтил/-4-хлорфенил/- N-неопентилкарбамоил/акриловой кислоты этиловый сложный эфир.
К 300 мл дихлорметана добавляют 2-/5-хлор-2-неопентил-аминофенил/-2-/-хлорфенил/этанол/5,5/-бикарбонат натрия /1,7 г/. К полученной смеси добавляют моноэтиловый сложный эфир хлорида фумаровой кислоты /2,6 г/, перемешивают в течение одного часа при комнатной температуре. К реакционной смеси добавляют 100 мл дихлорметана, промывают водой и сушат над безводным сульфатом натрия. Растворитель отгоняют, остаток очищают на хроматографической колонке с силикагелем /элюент : этиловый эфир уксусной кислоты = 5 : 1 объем/объем/ до получения 6,9 в виде маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 0,679 /1/2•9H, с/, 0,941 /1/2•9H, с/, 1,210 /1/2•3H, т, J = 7,2 Гц/, 1,249 /1/2•3H, т, J = 7,2 Гц/, 2,300 /1/2•1H, д, J = 13,8 Гц/, 2,879 /1/2•1H, д, J = 13,4 Гц/, 3,96 - 4,29 /4H, 1/2•1H, м/, 4,60 - 4,67 /1H, м/, 4,821 /1/2•1H, т, J = 7,0 Гц/, 5,863 1/2•1H, д, J = 15,2 Гц/, 6,167 /1/2, д, J = 15,2 Гц/, 6,69 - 7,81 /8H, м/.
/4/. 8-Хлор-6-/2-хлорфенил/-1-неопентил-2-оксо-2,3,5,6- тетрагидро-1H-4,1-бензоксазоцин-3-уксусной кислоты этиловый сложный эфир.
К 70 мл дихлорметана добавляют 3-/N-/2-/1-/2-хлорфенил/- 2-гидроксиэтил/-4-хлорфенил/-N-неопентилкарбамоил/акриловой кислоты этилового сложного эфира /6,8 г/, 18-краун-6 /3,78 г/ и карбонат калия. Полученную смесь перемешивают в течение 3 дней при комнатной температуре. Нерастворимую часть отфильтровывают, растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый сложный эфир уксусной кислоты = 5 : 1 объем/объем/ до получения 1,64 г некристаллического твердого продукта.
1H ЯМР /CDCl3/

Пример
55. 3,6-транс-8-Хлор-6-/2-хлорфенил/-1-неопентил-2- оксо-2,3,5,6-тетрагидро-1H-4,1-бензоксазоцин-3-уксусная кислота
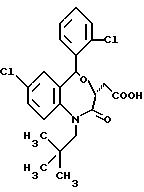
3,6-транс-8-Хлор-6-/2-хлорфенил/-1-неопентил-2- оксо-2,3,5,6-тетрагидро-1H-4,1-бензоксазоцин-3-уксусной кислоты этиловый сложный эфир /1,2 г/, полученный в примере 54, обрабатывают по способу примера 9 до получения 0,23 г бесцветных кристаллов. Т. плавления 127 - 133oC.
Элементный анализ для C23H25Cl2NO4 • H2O:
Рассчитано: C 58,98; H 5,81; N 2,99
Найдено: C 58,82; H 5,43; N 2,97
Пример 56. 7-Хлор-5-/2-хлорфенил/-1-неопентил-1,
2-дигидро-2-оксо- 3H-1,3,4-бензотриазепин-3-уксусной кислоты этиловый сложный эфир

/1/. 5-Хлор-2-неопентиламинофенил-2-хлорфенилтиокетон.
К раствору 2-амино-2', 5-дихлорбензофенона /10 г/ в 50 мл метанола добавляют пивалальдегид /3,4 г/ и 5 мл уксусной кислоты. Полученную смесь перемешивают 30 мин при 0oC. К этому раствору добавляют цианоборгидрид натрия /3,1 г/, и полученную смесь перемешивают в течение одного дня при 60oC. Раствор концентрируют, добавляют дихлорметан /100 мл/. Полученную смесь промывают водой и сушат над безводным сульфатом натрия. Затем растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем /элюент гексан: этиловый эфир уксусной кислоты = 20:1 объем/объем до получения 6,3 г твердого соединения желтого цвета. К раствору этого соединения /0,5 г/ в 5 мл толуола добавляют 0,3 г реагента Лоуессона, и полученную смесь нагревают в течение двух ч с обратным холодильником. К реакционной смеси добавляют этиловый эфир уксусной кислоты /50 мл/ промывают водой, а затем сушат над безводным сульфатом натрия. Растворитель отгоняют, в результате чего получают 0,54 г красноватого масляного соединения.
/2/. 2-Неопентиламино-2',
5-дихлорбензофенонэтоксикарбонилметилгидразон
К раствору 5-хлор-2-неопентиламинофенил-2-хлорфенилтиокетона /0,54 г/ в 7 мл этанола добавляют гидрохлорид гидразиноацетата /0,11 г/. Полученную
смесь перемешивают один день при 70oC. К реакционной смеси добавляют 50 мл дихлорметана, промывают водой и сушат над безводным сульфатом натрия. Растворитель отгоняют. Остаток очищают на
хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 15 : 1 объем/объем/ до получения 0,16 г маслянистого продукта.
1H ЯМР /CDCl3/ δ : 0,95 /9H, с/, 1,273 /3H, т, J = 7,2 Гц/, 2,964 /2H, д, J = 5,8 Гц/, 4,04 /4,27/4H, м/, 5,969 /1H, т, J = 5,8 Гц/, 6,681 /1H, д, J = 9,0 Гц/, 6,879 /1H, д. J = 2,6 Гц/, 7,15 - 7,50 /5H, м/.
/3/. 7-Хлор-5-/2-хлорфенил/-1-неопентил-1,2-дигидро-2-оксо-3H-1,2,4-бензотриазепин-3-уксусной кислоты этиловый сложный эфир.
К раствору 2-неопентиламино-2', 5- дихлорбензофеноэтоксикарбонилметилгидразона /0,16 г/ и 90 мг триэтиламина в 2 мл толуола добавляют 54 мг трифосгена. Полученную смесь перемешивают в течение часа при 70oC, добавляют этиловый эфир уксусной кислоты /50 мл/. Полученную смесь промывают водой, сушат над безводным сульфатом натрия. Растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 3:1 объем/объем/ до получения 0,16 г маслянистого соединения.
1H-ЯМР /CDCl3/ δ : 0,883 /9H, с/, 1,238 /3H, т, J = 7,0 Гц/, 3,376 /1H, д, J = 14,0 Гц/, 4,184 /2H, кв, J = 7,0 Гц/, 4,319 /1H, д, J = 16,8 Гц/, 4,363 /1H, д, J = 14,0 Гц/, 4,484 /1H, д, J = 16,8 Гц/, 6,857 /1H, д, J = 2,6 Гц/, 7,20 - 7,50 /6H, м/.
Пример 57. 7-Хлор-5-/2-хлорфенил/-1-неопентил-1,2-дигидро- 2-оксо-3H-1,3,4-бензотриазепин-3-уксусная кислота

К раствору 7-хлор-5-/2-хлорфенил/-1-неопентил-1,2-дигидро- 2-оксо-3H-1,3,4-бензотриазепин-3-уксусной кислоты этилового эфира, полученного в примере 56 /0,16 г/ в 3 мл этанола добавляют 1н. водный раствор гидроксида натрия /0,3 мл/. Полученную смесь перемешивают 4 ч при комнатной температуре. К реакционной смеси добавляют 50 мл воды, подкисляют 1 н. HCl, затем раствор концентрируют. К полученному концентрату добавляют 50 мл дихлорметана, промывают водой, затем растворитель отгоняют. Остаток перекристаллизовывают из смеси дихлорметан-петролейный эфир до получения 91 мг бесцветных кристаллов. Т. плавления 181 - 183oC.
Элементный анализ для C21H21Cl2N3O3:
Рассчитано: C 58,07; H 4,87; N 9,67
Найдено: C 57,90; H 5,13; N 9,46
Пример 58. 3,5-транс-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил- 3-/тетразол-5-ил/метил-1,2,3,5-тетрагидро-4,
1-бензотиазепин-2-он
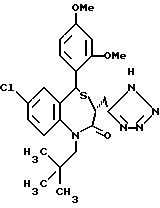
/1/. 3-/3,5/транс-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил- 2-оксо-1,2, 3,5-тетрагидро-4,1-бензотиазепин-3-ацетиламино/пропионитрил.
К раствору 3-/3,5/транс-7-хлор-5-/2,4-диметоксифенил/-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты, полученной в примере 46 /1 г/ и 150 мг 3-аминопропионитрила /150 мг/ в 10 мл дихлорметана добавляют 340 мг диэтилцианофосфоната и 320 мг триэтиламина. Полученную смесь перемешивают в течение 10 мин при комнатной температуре. К реакционной смеси добавляют 100 мл дихлорметана, промывают 1 н. водным раствором NaOH и водой, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из гексана до получения 1,07 г бесцветных кристаллов.
Т. плавления 93 - 103oC.
Элементный анализ для C27H32ClN3O4S:
Рассчитано: C 61,18; H 6,08; N 7,93
Найдено: C 61,41; H 6,11; N 7,84
/2/. 3-/3,5/транс-7-Хлор-3-/2-цианоэтил/тетразол-5-ил/метил-5- /2,
4-диметоксифенил/-1-неопентил-1,2,3,5-тетрагидро-4,1-бензотиазепин-2-он.
3-/3,5/транс-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4, 1-бензотиазепин-3-ацетиламино/пропионитрил /0,1 г/, трифенилфосфин /99 мг/, диэтилазодикарбоксилат /66 мг/ и триметилсилилазид /44 мг/ в 2 мл тетрагидрофурана перемешивают один день при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении. Полученный концентрат очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 1:1 объем/объем/ до получения 59 мг некристаллического твердого вещества.
1H-ЯМР /CDCl3/

/3/ 3,5-транс-7-хлор-5-/2,4-диметоксифенил/-1-неопентил-3- тетразол-5-ил/метил-1,2,3,5-тетрагидро-4,1-бензотиазепин-2-он
В смешанный растворитель,
состоящий из 1 мл метанола и 1 мл тетрагидрофурана, добавляют 59 мг 3,5/-транс-7-хлор-3-/1-/2- цианоэтил/тетразол-5-ил/метил-5-/2,4-диметоксифенил/-2-неопентил- 1,2,3,5-тетрагидро-4,
1-бензотиазепин-2-она. К этому раствору добавляют 1 н. водный раствор гидроксида натрия /0,11 мл/, перемешивают в течение 6 ч при комнатной температуре.
К реакционной смеси добавляют воду /50 мл/. Раствор подкисляют, экстрагируют дихлорметаном. Полученный экстракт промывают насыщенным водным раствором аммонийхлорида, сушат над безводным сульфатом натрия. Растворитель отгоняют, остаток перекристаллизовывают из дихлорметана до получения 26 мг бесцветных кристаллов. Т. плавления 168 - 173oC.
Элементный анализ для C24H28ClN5O3S:
Рассчитано: C 57,42; H 5,62; N 13,95
Найдено: C 57,28; H 5,22; N 13,84
Пример 59. /3R, 5R/-7-Хлор-5-/2,
3-диметоксифенил/-1-неопентил-3- /тетразол-5-ил/метил-1,2,3,5-тетрагидро-4,1-бензотиазепин-2-он

Используя /3R, 5S/-7-хлор-5-/2,3-диметоксифенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусную кислоту, по способу примера 58 получают:
/1/. /3R, 5S/-7-хлор-5-/2, 3-диметоксифенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензотиазепин-3-ацетиламино/-пропионитрил.
1H-ЯМР /CDCl3/ δ : 0,991 /9H, с/, 2,335 /1H, дд, J = 3,8, 14,8 Гц/, 2,54 - 2,63 /2H, м/, 2,938 /1H, дд, J = 10,6, 14,8 Гц/, 3,27 /1H, д, J = 13,6 Гц/, 3,39 - 3,50 /2H, м/, 3,720 /3H, с/, 3,778 /1H, дд, J = 3,8, 10,6 Гц/, 3,892 /3H, с/, 4,455 /1H, д, J = 13,6 Гц/, 6,279 /1H, с/, 6,0 - 6,66 /1H, шир/, 6,821 /1H, д, J = 1,8 Гц/, 6,981 /1H, дд, J = 1,4, 8,0 Гц/, 7,16 - 7,39 /4H, м/.
/2/ /3R, 5S/-7-Хлор-3-/1-/2-цианоэтил/тетразол-5-ил/метил-5- тиазепин-2-он.
1H-ЯМР /CDCl3/ δ : 0,962 /9H, с/, 2,97 - 3,17 /4H, м/, 3,473 /1H, дд, J = 10,6, 14,6Гц/, 3,729 /3H, с/, 3,902 /3H, с/, 4,02 /1H, дд. J = 3,6, 10,6 Гц/, 4,306 /1H, д, J = 14,0 Гц/, 4,74 - 4,81 /2H, м/, 6,333 /1H, с/, 6,84 - 7,77 /6H, м/.
/3/. /3R,3S/-7-Хлор-5-/2, 3-диметоксифенил/-1-неопентил-3- /тетразол-5-ил/метил-1,2,3,5-тетрагидро-4,1-бензотиазепин-2-он. Т. плавления 139 - 144oC.
Элементный анализ для C24H28
ClN5O3S:
Рассчитано: C 57,42; H 5,62; N 13,95
Найдено: C 57,55; H 5,76; N 13,78
Пример 61. /3R,
3S/-7-Хлор-5-/2-хлорфенил/-3-/2-гилроксиэтил/-1- неопентил-1,2,3,5-тетрагидро-4,1-бензотазепин

К 20 мл тетрагидрофурана добавляют /3R,3S/-7-хлор-/-2-хлорфенил/-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусную кислоту /2 г/, и литийалюминийгидрид /0,4 г/.
Полученную смесь нагревают в течение 6 ч с обратным холодильником, предварительно, добавив воду. Нерастворимую часть отфильтровывают. Полученный фильтрат концентрируют, очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 2:1 объем/объем/ до получения 1,65 г некристаллического твердого продукта.
1H ЯМР /CDCl3 / δ : 0,963 /9H, с/, 1,69 - 1,83 /2H, м/, 2,45 /1H, шир/, 2,563 /1H, д, J = 14,6 Гц/, 3,09 /1H, д, J = 10,6 Гц/, 3,72 - 3,84 /4H, м/, 3,96 - 4,14 /1H, м/, 6,344 /1H, д, J = 2,4 Гц/, 6,596 /1H, с/, 7,05 - 7,71 /6H, м/.
Пример 62. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-3- /тетразол-5-ил/-метиламинокарбонилметил-2-оксо-1,2,3,5-тетрагидро-4,1- бензотиазепин

К раствору 3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил- оксо-1,2,3,5-тетрагидро-4, 1-бензотиазепин-3-уксусной кислоты в диметилформамиде /0,2 г/ из примера 9 и аминоацетонитрилбисульфата /0,12 г/ добавляют диэтилцианофосфонат /0,12 г/ и триэтиламин /0,14 мл/. Полученную смесь перемешивают в течение 40 мин при 0oC. К реакционной смеси добавляют смесь льда с водой и экстрагируют этиловым эфиром уксусной кислоты. Полученный экстракт промывают водой, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из гексана до получения 0,19 г 3, 5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил-3- /цианометиламинокарбонилметил/-2-оксо-1,2,3,5-тетрагидро-4,1- бензотиазепина. Т. плавления 233 - 234oC. К раствору 0,2 г этого соединения в 2 мл толуола добавляют 50 мг триметилсилилазида и 30 мг оксида дибутилолова /IV/. Полученную смесь перемешивают в течение 24 ч при температуре в интервале от 110 до 120oC. Реакционную смесь концентрируют, добавляют 20 мл этилового эфира, промывают разбавленным водным раствором гидроксида натрия. Водный слой подкисляют 1 н. HCl, и экстрагируют этиловым эфиром уксусной кислоты. Органический слой промывают водой, и затем сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из смеси дихлорметан-гексан до получения 0,21 г бесцветных кристаллов. Т. плавления 264 - 265oC.
Элементный анализ для C24H26Cl2N6O2 • 0.8H2:
Рассчитано: C 53,31; H 5,00; N 15,54
Найдено: C 53,58; H 5,14; N 15,33
Пример 63. 7-Хлор-5-/2-хлорфенил/-2,4-диоксо-1-неопентил- 2,3,4,5-тетрагидро-1H-1,5-бензодиазепин-3-уксусной
кислоты этиловый сложный эфир

/1/. 2',5-дихлор-2-неопентиламинодифениламин.
К 50 мл этанольного раствора 2-амино-2',5-дихлорфениламина /2,35 г/ добавляют пивалальдегид /1,21 мл/ и уксусную кислоту /0,67 г/. Полученную смесь перемешивают в течение часа при комнатной температуре. К реакционной смеси добавляют цианоборгидрид натрия /0,97 г/ и перемешивают в течение ночи. Реакционную смесь концентрируют, добавляют этиловый эфир уксусной кислоты /100 мл/. Полученную смесь промывают водой, и сушат над безводным сульфатом натрия, а затем отгоняют растворитель. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : толуол = 5:1 объем/объем/ до получения 1,7 г маслянистого соединения.
1H ЯМР /CDCl3/

/2/. 7-Хлор-5-/2-хлорфенил/-2,4-диоксо-1-неопентил-2,3,4, 5- тетрагидро-1H-1,5-бензодиазепин.
К 25 мл раствора в тетрагидрофуране 2',5-дихлор-2-неопентил- аминодифениламина /3,7 г/ прикапывают 5 мл тетрафуранового раствора малонилхлорида /1, 33 мл/ при 0oC. Полученную смесь перемешивают в течение часа при комнатной температуре, затем в течение 2 ч при 60oC. Реакционную смесь концентрируют, добавляют этиловый эфир уксусной кислоты /100 мл/. Полученную смесь промывают водой, сушат над безводным сульфатом натрия, отгоняют растворитель. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 2:1 объем/объем/ до получения 1,20 г бесцветных кристаллов. Т. плавления 245 - 246oC.
Элементный анализ для C20H20
Cl2N2O2:
Рассчитано: C 61,39; H 5,15; N 7,16
Найдено: C 61,10; H 5,04; N 6,99
/3/. 7-Хлор-5-/2-хлорфенил/-2,4-диоксо-1-неопентил-2,3,4,
5- тетрагидро-1H-1,5-бензодиазепин-3-уксусной кислоты этиловый сложный эфир.
К раствору 7-Хлор-5-/2-хлорфенил/-2,4-диоксо-1-неопентил-2,3,4,5- тетрагидро-1H-1,5-бензодиазепина /0,3 г/ и этилового эфира хлоруксусной кислоты /0,11 мл/ в 2 мл диметилформамида добавляют гидрид натрия /60% масло, 40 мг/, и полученную смесь перемешивают в течение 30 мин при комнатной температуре. К реакционной смеси добавляют гидрид натрия /40 мг • 3/ и этиловый эфир хлоруксусной кислоты /0,11 мл/, перемешивают в течение 3 ч. Затем добавляют этиловый эфир уксусной кислоты /50 мл/, промывают водой. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем элюент гексан : этиловый эфир уксусной кислоты = 4:1 объем/объем/ до получения 0,25 г бесцветных кристаллов. Т. плавления 152 - 153oC.
Элементный анализ для C24H26Cl2N2O4:
Рассчитано: C 60,38; H 5,49; N 5,
87
Найдено: C 60,22; H 5,61; N 6,05
Пример 64. 7-Хлор-5-/2-хлорфенил/-2,4-диоксо-1-неопентил- 1,3,4,5-тетрагидро-1H-1,5-бензодиазепин-3-уксусная кислота

7-Хлор-5-/2-хлорфенил/-2,4-диоксо-1-неопентил- 2,3,4,5-тетрагидро-1H-1,5-бензодиазепин-3-уксусной кислоты этиловый сложный эфир /0,2 г/, полученный в примере 63, обрабатывают по способу примера 57 до получения 0,18 г бесцветных кристаллов. Т. плавления 282 - 285oC.
Элементный
анализ для C22H22Cl2N2O4:
Рассчитано: C 58,81; H 4,94; N 6,23
Найдено: C 58,71; H 5,15; N 6,21
Пример 65. /3R,
5S/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензодиазепин-3-уксусной кислоты натриевая соль

В 50 мл метанола растворяют /3R,5S/-7-Хлор-5-/2,4-диметоксифенил/-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензодиазепин-3-уксусную кислоту /1,275 г/, полученную в примере 51. К этому раствору добавляют 1 н. водный раствор гидроксида натрия /2,57 мл/, затем все это концентрируют. Полученный концентрат промывают этиловым эфиром уксусной кислоты до получения 1,23 г бесцветных кристаллов, которые плавятся не ниже 300oC.
(α)
Элементный анализ для C24H27ClNO5SNa • O•7H2O:
Рассчитано: C 56,24; H 5,
58; N 2,73
Найдено: C 56,16; H 5,80; N 2,81
Пример 66. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1,2,3,5-тетрагидро- 4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

К раствору 3,5-транс-7-хлор-5-/2-хлорфенил/-2-оксо-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового сложного эфира /0,5 г/ в 5 мл дихлорметана добавляют тетрабутиламмонийборгидрид /0,96 г/. Полученную смесь кипятят с обратным холодильником в течение 7 ч. Растворитель отгоняют. К остатку добавляют 1 н. HCl /8 мл/, и полученную смесь кипятят с обратным холодильником в течение 10 мин. Раствор нейтрализуют 1н. водным раствором NaOH, экстрагируют дихлорметаном. Полученный экстракт сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 3 : 1 объем/объем/, до получения 0,13 г бесцветного маслянистого продукта.
1H ЯМР /CDCL3/ δ : 2,97 /1H, дд, J = 5,8, 16,0 Гц/, 3,20 /1H, дд, J = 8,0, 16,0 Гц/, 3,26 /1H, дд, J = 2,4, 13,4 Гц/, 3,35 - 3,42 /1H, м/, 3,61 /1H, дд, J = 4,8, 13,4 Гц/, 3,68 /3H<с/, 5,96 /1H, с/, 6,55 /1H, д, J = 2,2 Гц/, 6,83 /1H, д, J = 8,2 Гц/, 7,03 /1H, дд, J = 2,4, 8,2 Гц/, 7,28 - 7,56 /4H, м/.
Пример 67. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1,2,3,5-тетрагидро-4,1-бензоксазепин -3-уксусной кислоты этиловый сложный эфир
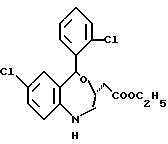
/1/. 5-Хлор-2-/2,4-диметоксибензиламин-α- /2-хлорфенил/-бензиловый спирт.
2-Амино-5-хлор -α - /2-хлорфенил/бензиловый спирт /20 г/ и 2,4-диметоксибензальдегид /12,5 г/ обрабатывают по способу примера 30 до получения 33 г маслянистого соединения.
1H ЯМР /CDCL3/ δ : 3,75 /3H, с/, 3,76 /3H, с/, 4,23 /2H, с/, 6,10 /1H, с/, 6,35 - 6,44 /2H, м/, 6,63 /1H, д, J = 8,8 Гц/, 6,88 /1H, д, J = 2,6 Гц/, 7,03 - 7,12 /2H, м/, 7,24 - 7,45 /4H, м/,
/2/ 3-/N-/4-хлор-2-/2-хлор -α- гидроксибензил/фенил/-N-/2,4- диметоксибензил/карбамоилакриловой кислоты сложный этиловый эфир 5-хлор-2-/2,4-диметоксибензиламино -α
- /2-хлорфенил/бензиловый спирт /33 г/ и моноэтиловый сложный эфир хлорида фумаровой кислоты /12,8 г/ обрабатывают по способу примера 30 до получения 48,9 г маслянистого соединения.
1H ЯМР /CDCl3/ δ : 1,18 - 1,35 /3H, м/, 3,46 /3H, с/, 3,78 /3H, с/, 3,82 - 3,83 /2H, каждый с/, 3,94 - 4,34 /2H, м/, 4,64 /1/2 • 1H, д, J = 14,2 Гц/, 5,48 /1/2 • 1H, J = 14,2 Гц/, 6,02 - 8,00 /12H, м/.
/3/ 3,5-транс-7-хлор-5-/2-хлорфенил/-1-/2,4-диметоксибензил/- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир.
К раствору соединения /48,9 г/, полученного в /2/ в 500 мл этанола, добавляют 12,4 г карбоната калия. Полученную смесь перемешивают в течение ночи при комнатной температуре. Растворитель отгоняют. К остатку добавляют 200 мл дихлорметана, промывают водой, сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток перекристаллизовывают из смешанного растворителя, состоящего из дихлорметана и гексана до получения 41,4 г бесцветных кристаллов.
Т. плавления 135 - 136oC.
/4/. 3, 5-транс-7-Хлор-5-/2-хлорфенил/-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир.
Соединение, полученное в /3/ /5 г/, 10 г персульфата калия и вторичный кислый фосфат калия /3,3 г/ добавляют к смешанному растворителю, состоящему из 80 мл ацетонитрила и 40 мл воды, кипятят с обратным холодильником в течение 2 ч. К реакционной смеси добавляют воду, экстрагируют этилацетатом. Полученный экстракт сушат над безводным сульфатом натрия. Растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем /элюент гексан : этиловый эфир уксусной кислоты = 3:1 объем/объем/, до получения 1,83 г бесцветных кристаллов. Т. плавления 132 - 137oC.
/5/. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1,2,3,5-тетрагидро-4, 1- бензоксазепин-3-уксусной кислоты этиловый сложный эфир.
Соединение, полученное в /4/ /1,8 г/, обрабатывают по способу примера 66 до получения 0,69 г бесцветного маслянистого
продукта
1H ЯМР /CDCl3/ δ : 1,14 /3H, т, J = 7,2 Гц/, 2,54 /1H, дд, J = 6,6, 15,0 Гц/, 2,73 /1H, дд, J = 7,4, 15,0 Гц/, 3,29 - 3,32 /2H, м/, 4,05 /2H, кв, J = 7,2
Гц/, 4,20 - 4,32 /1H, м/, 6,33 /1H, с/, 6,4 /1H, д, J = 2,4 Гц/, 6,72 /1H, д, J = 8,4 Гц/, 7,04 - 7,43 /5H, м/.
Пример 68. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропил- 1,2,3,
5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

К раствору 3, 5-транс-7-хлор-5-/2-хлорфенил/-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового сложного эфира /0,1 г/, полученного в примере 66, в 2 мл метанола, добавляют пропиональдегид /76 мг/ и 24 мг уксусной кислоты. Полученную смесь перемешивают в течение 30 мин при комнатной температуре. К реакционной смеси добавляют цианоборгидрид натрия /25 мг/, перемешивают в течение часа при комнатной температуре. К реакционной смеси добавляют 50 мл дихлорметана, промывают водой сушат над безводным сульфатом натрия. Растворитель отгоняют, в результате чего получают 0,13 г бесцветного маслянистого продукта.
1H ЯМР /CDCl3/ δ : 0,99 /3H, т, J = 7,4 Гц/, 1,46 - 1,63 /2H, м/, 2,76 - 3,05 /5H, м/, 3,24 - 3,46 /2H, м/, 3,68 /3H, с/, 6,43 /1H, с/, 6,53 /1H, д, J = 2,4 Гц/, 7,05 - 7,42 /5H, м/, 7,73 - 7,77 /1H, м/.
Пример 69. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропил-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
этиловый сложный эфир

3,5-транс-7-Хлор-5-/2-хлорфенил/-1,2,3,5-тетрагидро-4, 1- бензоксазепин-3-уксусной кислоты этиловый сложный эфир /0,1 г/, полученный в примере 67, обрабатывают по способу примера 68 до получения бесцветного маслянистого продукта /0,06 г/.
1H ЯМР /CDCl3/ δ : 0,98 /2H, т, J = 7,2 Гц/, 1,19 / 3H, т, J = 7,2 Гц/, 1,57 - 1,74 /2H, м/, 2,53 /1H, дд, J = 5,8, 15,0 Гц/, 2,74 /1H, дд, J = 7,6, 15,0 Гц/, 2,92 - 3,06 /2H, м/, 3,27 - 3,47 /2H, м/, 4,10 /2H, ДКВ J = 1,4, 7,2 Гц/, 4,17 - 4,25 /1H, м/, 6,39 /1H, д, J = 2,4 Гц/, 6,43 /1H, с/, 6,90 /1H, д, J = 8,6 Гц/, 7,14 /1H, дд, J = 2,6, 8,6 Гц/, 7,28 - 7,63 /4H, м/.
Пример 70. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропил-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты гидрохлорид

К раствору 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропил-1,2,3,5- тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового сложного эфира /0,13 г/, полученного в примере 68, в 1 мл диоксана, добавляют 6 н. HCl /1 мл/, и полученную смесь кипятят с обратным холодильником в течение 30 мин. Растворитель отгоняют, а остаток перекристаллизовывают из смеси этанол-гексан до получения 57 мг бесцветных кристаллов. Т. плавления 165 - 168oC.
Элементный анализ для C20H21Cl2NO2
S•HCl•O•3H2O:
Рассчитано: C 53,12; H 5,04; N 3,10
Найдено: C 53,21; H 5,03; N 3,34
Пример 71. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропил-1,2,3,
5- тетрагидро-4,1-бензоксазепин-3-уксусная кислота

3, 5-транс-7-Хлор-5-/2-хлорфенил/-1-пропил-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир /0,15 г/, полученный в примере 69, обрабатывают по способу примера 70 до получения 50 мг бесцветных кристаллов. Т. плавления 105 - 112oC.
Элементный анализ для C20H21Cl2NO3 •HCl•O•
6H2O:
Рассчитано: C 54,40; H 5,30; N 3,17
Найдено: C 54,33; H 5,37; N 3,17
Пример 72. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропионил- 1,2,3,5-тетрагидро-4,
4-бензотиазепин-3-уксусной кислоты метиловый сложный эфир

К раствору 3, 5-транс-7-хлор-5-/2-хлорфенил/- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового сложного эфира /100 мг/, полученного в примере 66, в 2 мл дихлорметана добавляют бикарбонат натрия /59 мг/. К полученной смеси добавляют пропионилхлорид /60 мг/. Полученную смесь перемешивают в течение 2 ч при комнатной температуре и добавляют 50 мл дихлорметана. Полученную смесь промывают водой, растворитель отгоняют. Остаток перекристаллизовывают из смеси этиловый эфир-петролейный эфир до получения 90 мг бесцветных кристаллов.
Т. плавления 191 - 194oC.
1H ЯМР /CDCl3/ δ : 1,14 /3H, т, J = 7,2 Гц/, 2,07 - 2,33 /2H, м/, 2,83 /1H, дд, J = 7,6, 16,8 Гц/, 3,02 /1H, дд, J = 7,2, 16,8 Гц/, 3,24 /1H, дд, J = 3,0, 13,6 Гц/, 3,32 - 3,44 /1H, м/, 3,68 /3H, с/, 4,85 /1H, дд, J = 5,0, 13,6 Гц/, 6,00 /1H, с/, 6,60 /1H, д, J = 2,2 Гц/, 7,11 - 7,63 /6H, м/.
Пример 73. 3,
5-транс-7-Хлор-5-/2-хлорфенил/-1-пропионил- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир

3,5-транс-7-Хлор-5-/2-хлорфенил/- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир /100 мг/, полученный в примере 67, обрабатывают по способу примера 72 до получения 70 мг маслянистого продукта.
1H ЯМР /CDCl3/ δ : 1,07 /3H, т, J = 7,0 Гц/, 1,16 /3H, т, J = 7,4 Гц/, 2,14 - 2,52 /2H, м/, 2,61 /1H, дд, J = 5,4, 15,4 Гц/, 2,88 /1H, дд, J = 9,2, 15,4 Гц/, 3,25 /1H, дд, J = 3,2, 13,6 Гц/, 3,85 - 4,16 /2H, м/, 4,24 - 4,40 /1H, м/, 4,56 /1H, дд, J = 6,0, 13,6 Гц/, 6,29 /1H, с/, 6,50 /1H, д. J = 2,2 Гц/, 7,16 - 7,68 /6H, м/.
Пример 74. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропионил- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота

К раствору 3,5-транс-7-хлор-5-/2-хлорфенил/-1-пропионил- 1,2,3,5-тетрагидро-4,1-бензотиазепин-3-уксусной кислоты метилового эфира /90 мг/, полученного в примере 72, в 2 мл диоксана добавляют 1 мл 2 н HCl. Полученную смесь кипятят с обратным холодильником в течение 2 ч, добавляют 50 мл дихлорметана. Полученную смесь промывают водой, растворитель отгоняют. Остаток перекристаллизовывают из смеси этиловый эфир-гексан до получения 52 мг бесцветных кристаллов.
Т. плавления 230 - 232oC.
Элементный анализ для C20H19Cl2NO3S:
Рассчитано: C 56,61; H 4,51; N 3,30
Найдено: C 56,26; H 4,65; N 3,51
Пример
75. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропионил- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота

3,5-транс-7-Хлор-5-/2-хлорфенил/-1-пропионил-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-уксусной кислоты этиловый сложный эфир /70 мг/, полученный в примере 73, обрабатывают по способу примера 74 до получения 43 мг бесцветных кристаллов.
Т. плавления 187 - 190oC.
Элементный анализ для C20H19Cl2NO4:
Рассчитано: C 58,84; H 4,69; N 3,43
Найдено: C 58,75; H 4,67; N 3,59
Пример 76. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-1,2,3,5- тетрагидро-4,
1-бензоксазепин-3-уксусной кислоты трет-бутиловый сложный эфир
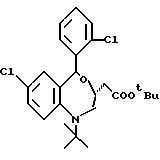
/1/. 3, 5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты трет-бутиловый эфир.
К раствору 3, 5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил-2-оксо- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты /2 г/ в 20 мл дихлорметана добавляют 1 мл изобутена и концентрированную серную кислоту /0,05 мг/. Полученную смесь оставляют выстаиваться в течение 24 ч в герметизированном реакторе. Раствор промывают водой и сушат над безводным сульфатом натрия. Растворитель отгоняют, а остаток очищают на хроматографической колонке с силикагелем /гексан : этиловый эфир уксусной кислоты = 5:1 объем/объем/ до получения 1,67 г бесцветных кристаллов. Т. плавления 145 - 147oC.
/2/. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты трет-бутиловый сложный эфир.
К дихлорметановому раствору соединения /1 г/, полученного в /1/, добавляют тетрабутиламмонийборгидрид /1,57 г/. Полученную смесь обрабатывают по способу примера 66 до получения 0,52 г бесцветного маслянистого продукта.
1 H ЯМР /CDCl3/ δ : 0,95 /9H, с/, 1,44 /9H, с/, 2,33 /1H, дд, J = 5,0, 15,4 Гц/, 2,55 /1H, дд, J = 7,8, 15,4 Гц/, 2,56 /1H, д, J = 13,2 Гц/, 3,09 / 1H, дд, J = 1,8, 11,2 Гц/, 3,63 - 3, 78 /2H, м/, 4,12 - 4,26 /1H, м/, 6,32 /1H, с/, 6,59 /1H, с/, 7,11 - 7,76 /6H, м/.
Пример 77. 3,5-транс-7-Хлор-5-/2-хлорфенил/-1-неопентил- 1,2,3,5-тетрагидро-4,
1-бензоксазепин-3-уксусная кислота

К раствору 3,5-транс-7-хлор-5-/2-хлорфенил/-1-неопентил- 1, 2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты трет-бутилового эфира /0,5 г/, полученного в примере 76, в 5 мл диоксана добавляют 2 н. водный раствор хлористого водорода /1 мл/. Полученную смесь кипятят с обратным холодильником в течение 3 ч. Реакционную смесь нейтрализуют 1 н. NaOH, добавляют 100 мг дихлорметана, промывают водой. Растворитель отгоняют. Остаток очищают на хроматографической колонке с силикагелем /элюент дихлорметан-метанол = 0:1: 0,1 объем/объем/ до получения 85 мг бесцветных кристаллов.
Т. плавления 195 - 208oC.
Элементный анализ для C22H25Cl2NO3•O•2H2O:
Рассчитано: C 62,04; H 6,01; N 3,29
Найдено: C 62,14; H 6,
01; N 3,42
Оценка активности ингибирования сквален-синтетазы.
Активность ингибирования сквален-синтетазы оценивают для растворов энзимов, как указано далее в экспериментальных примерах 1 и 2.
Более конкретно, раствор энзима /содержание протеина 0,8 мкг/, приготовленный в экспериментальных примерах 1 и 2, добавляют к раствору /полный объем 50 мкл/, содержащему 5 мкМ [1-3H]фарнезилфосфата /специфическая активность 25 мкКи/ моль/, 1мМ NADPH, 5 мМ MgCl2, 6 мМ глутатиона, 100 мМ буферного раствора фосфата калия /pH 7, 4/ и тестируемый препарат /который используют в виде водного раствора или раствора в ДМСО/, затем реакции дают протекать при 37oC в течение 45 мин. К этой реакционной смеси добавляют 150 мкл смеси хлороформ : метанол /1:2/, реакционную смесь суспендируют, добавляют 50 мкл хлороформа и 50 мкл 3 н. водного раствора гидроксида натрия. 50 мкл хлороформового слоя /нижний слой, содержащего реакционную смесь, состоящего в основном, из сквалена, и 3 мл жидкого сцинтиллятора на основе толуола, смешивают, и определяют радиоактивность этой смеси с помощью сцинтилляционного счетчика. Активность ингибирования сквален-синтетазы выражают концентрацией ингибируемой 50% радиоактивности, в хлороформовом слое /IC50 молярная концентрация /М//.
Экспериментальный пример 1. Получение крысиного энзима.
Самца крысы линии SD /в возрасте 6 недель/ умерщвляют обескровливанием и извлекают печень. Около 10 г печени промывают солевым раствором, охлажденным льдом, гомогенизируют в 15 мл ледяного буферного раствора /100 мМ фосфата калия /pH 7,4/, 15 мМ никотинамида, 2 мМ MgCl2/, затем центрифугируют в течение 20 мин /4o C/ при 10000 об/мин. Надосадочный слой отделяют, и центрифугирование продолжают в течение 90 мин /4oC/ при 105000 об/мин. Полученный осадок суспендируют в 100 мМ охлажденного льдом фосфатного буферного раствора /pH 7,4/, который снова центрифугируют в течение 90 мин /4oC/ при 105000 об/мин. Полученный осадок /микросомную фракцию/ суспендируют в ледяном 100 мМ калийфосфатном буфере /pH 7,4/ около 40 мг/мл концентрация протеина, определенная с помощью ВСА набора для анализа протеина Pias Co. Ltd./. Эту суспензию и используют в качестве раствора энзима.
Экспериментальный пример 2. Получение человеческого энзима.
Клетки печени человека HepG2 /около 1 • 109 клеток/, полученных при инкубировании в Дюльбеко-модифицированной среде Игла /37oC в присутствии 5% CO2/, суспендируют в 10 мл ледяного буферного раствора /100 мМ калийфосфатного буфера /pH 7,4/, 30 мМ никотинамида и 2, 5 мМ MgCl2/. Клетки дробят, обрабатывая ультразвуком /дважды по 30 секунд/. Из этого получают микросомную фракцию по способу экспериментального примера 1, и ее суспендируют в ледяном 100 мМ калийфосфатном буфере /pH 7,4/ /около 4 мг/мл концентрация протеина/. Эту суспензию и используют в качестве энзимного раствора. Полученные результаты приведены в табл. 4 (см. в конце описания).
Примеры композиций.
Агент, ингибирующий сквален-синтетазу, содержащий в качестве эффективного компонента соединение, представленное формулами I, I', I'', I''' настоящего
изобретения, или его соль, в тех случаях, когда его используют в качестве терапевтического агента при гиперхолестеринэмии, можно приготовить, например, в соответствии со следующими рецептами:
1. Капсулы, мг:
/1/ Соединение примеров 10 - 8 - 10
/2/ Лактоза - 90
/3/ Микрокристаллическая целлюлоза - 70
/4/ Стеарат магния - 10
Одна капсула - 180
мг.
/1/, /2/ и /3/ и половину /4/ смешивают, полученную смесь гранулируют, к ней добавляют остаток /4/. Полученную смесь заполняют в желатиновые капсулы.
2. Таблетки,
мг:
/1/ Соединение примера 10-8 - 10
/2/ Лактоза - 35
/3/ Кукурузный крахмал - 150
/4/ Микрокристаллическая целлюлоза - 30
/5/ Стеарат магния - 5
Одна таблетка - 230 мг.
/1/, /2/ и /3/ и 2/3 от /4/ и 1/2 от /5/ смешивают, полученную смесь гранулируют, добавляют остаток /4/ и /5/. Полученную смесь гранулируют, добавляют остаток /4/ и /5/. Полученную смесь прессуют и получают таблетки.
3. Препараты для инъекций, мг:
/1/ Натриевая соль соединения примера 10-8 - 10
/2/ Инозитол - 100
/3/ Бензиловый спирт - 20
Одна ампула - 130 мг.
/1/, /2/ и /3/ растворяют в дистиллированной воде для инъекций до получения полного объема 2 мл, помещают в ампулу, которую запаивают. Все манипуляции производят в стерильных условиях.
4. Капсулы, мг:
/1/ Соединение примера 9 - 10
/2/ Лактоза - 90
/3/ Микрокристаллическая
целлюлоза - 70
/4/ Стеарат магния - 10
Одна капсула - 180 мг.
/1/, /2/ и /3/ и 1/2 /4/ смешивают, полученную смесь гранулируют, добавляют остаток /4/. Полученную смесь заполняют в желатиновую капсулу.
5. Таблетки, мг:
/1/ Соединение примера 9 - 10
/2/ Лактоза - 35
/3/ Кукурузный крахмал - 150
/4/ Микрокристаллическая целлюлоза - 30
/5/ Стеарат магния - 5
Одна таблетка - 230 мг
/1/, /2/ и /3/ и 2/3 /4/ и 1/2 /5/ смешивают, полученную смесь гранулируют, добавляют
остаток /4/ и /5/. Полученную смесь прессуют в виде таблетки.
6. Препараты для инъекций, мг:
/1/ Натриевая соль соединения примера 9 - 10
/2/ Инозитол - 100
/3/ Бензиловый спирт - 20
Одна ампула - 130 мг
/1/, /2/ и /3/ растворяют в дистиллированной воде для инъекций до получения полного объема 2 мл, помещают в ампулу, ампулу запаивают.
Все манипуляции осуществляют в стерильных условиях.
Реферат
Конденсированные гетероциклические соединения формулы I, где R1 - водород, C1-7-алкил, необязательно замещен оксогруппой; R'2-фенил, замещенный галоидом или низшей алкоксигруппой, X'-C1-4-алкилен, замещенный карбоксилом, алкоксикарбонил, гидроксил, теразол-5-ил, карбамоил, замещенный низшим алкилом, тетразол-5-илом, карбоксилом, или низшим алкоксикарбонилом; кольцо А - бензольное кольцо, замещенное галоидом, или тиенил, замещенный галоидом; кольцо J1-7-членное гетероциклическое кольцо, содержащее не более трех гетероатомов в кольце; D, К представляют С или N; Z1 - С, О, N или S(O)q; q = 0, 1, 2; кольцо J необязательно содержит помимо R1, R'2 и Х' оксо- или тиоксозаместитель, прекрасно ингибируют сквален-синтетазу. 2 с. и 20 з.п. ф-лы, 4 табл.

Формула

где R1 представляет водород или C1-7-алкильную группу, необязательно замещенную оксогруппой;
R'2 представляет фенильную группу, замещенную галоидом или низшей алкоксигруппой; X' - C1-4-алкилен, замещенный карбоксильной группой, низшей алкоксикарбонильной группой, гидроксильной группой, тетразол-5-илом, карбамоильной группой, замещенной низшим алкилом, необязательно замещенным тетразол-5-илом, карбоксильной группой или низшим алкоксикарбонилом;
кольцо А представляет бензольное кольцо, замещенное галоидом, или тиенил, замещенный галоидом;
кольцо J1 - 7-членное гетероциклическое кольцо, содержащее не более трех гетероатомов в кольце;
D представляет С или N;
Z1 - C, O, N или S(O)q (где q = 0, 1 или 2);
K - С или N;
кольцо J1 необязательно содержит помимо R1, R'2 и X' такой дополнительный заместитель, как оксо- или тиоксо-, при условии, что конденсированное кольцо, состоящее из колец А и J1, не является 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепиновым кольцом или 2-оксо-2,3-дигидро-1Н-1,4-бензодиазепиновым кольцом,
или их соль.

или его соль,
где R1 представляет водород или C1-7-алкильную группу, необязательно замещенную оксогруппой;
R'2 представляет фенильную группу, замещенную галоидом или низшей алкоксигруппой;
X' - C1-4 -алкилен, замещенный карбоксильной группой, низшей алкоксикарбонильной группой, гидроксильной группой, тетразол-5-илом, карбамоильной группой, замещенной низшим алкилом, необязательно замещенным тетразол-5-илом, карбоксильной группой или низшим алкоксикарбонилом;
кольцо А - бензольное кольцо, замещенное галоидом, или тиенил, замещенный галоидом;
кольцо J2 - 7-членное гетероциклическое кольцо;
Z2 - S(O)q (где q = 0, 1 или 2), С или О;
K представляет С или N;
G - О или S, при условии, что конденсированное кольцо, состоящее из колец А и J2, не является 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепиновым кольцом.
8. Соединение или его соль по п.1, где дополнительным заместителем кольца J1 является оксо- или тиоксо-.



10. Соединение или его соль по п.2, где Z2 - S(O)q (где q = 0, 1 или 2).
19. Ингибитор по п.12, отличающийся тем, что дополнительным заместителем кольца J1 является оксо- или тиоксо-.






21. Ингибитор по п. 12, отличающийся тем, что соединение представлено формулой I'''
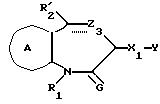
где R1 представляет водород или C1-7-алкильную группу, необязательно замещенную оксогруппой;
R'2 представляет фенильную группу, замещенную галогеном или низшей алкоксикарбонильной группой;
X1 - C1-4-алкилен;
Y представляет карбоксильную группу, низшую алкоксикарбонильную группу, гидроксильную группу, тетразол-5-ил, карбамоильную группу, замещенную низшим алкилом, необязательно замещенным тетразол-5-илом, карбоксильной группой или низшим алкоксикарбонилом;
кольцо А - бензольное кольцо, замещенное галогеном, или тиенил, замещенный галогеном;
Z3 представляет =N-, -NH-, -S-, -S(O)-, -S(O)2-, -CH2-, или -О-;
G - O или S;
символ


или его фармацевтически приемлемой солью.
24.09.93 - R1 представляет водород или C1-7 -алкильную группу; R'2 представляет фенильную группу, замещенную галогеном или низшей алкоксикарбонильной группой; X' - C1-4-алкилен, замещенный карбоксильной группой, низшей алкоксикарбонильной группой, гидроксильной группой; карбамоильной группой, замещенной низшим алкилом, необязательно замещенным карбоксильной группой или низшим алкоксикарбонилом; кольцо А - бензольное кольцо, замещенное галогеном; D представляет С; Z1 - О или S; K представляет С; кольцо J1, необязательно имеющее, кроме, R1, R'2 или X', такой дополнительный заместитель, как оксо- или тиоксо-, или соль.

Комментарии