Способ получения фармацевтической композиции для лечения состояний беспокойства, производные пиперидина, фармацевтическая композиция для лечения состояний беспокойства или эпилепсии - RU2142952C1
Код документа: RU2142952C1
Чертежи
Описание
Настоящее изобретение относится к классу пиперидиновых соединений, обладающих анксиолитическим действием и способностью связывания с сигма-рецепторами и, следовательно, полезных для лечения психических и неврологических расстройств.
Из уровня техники известны различные родственные соединения.
Так, в патентах США NN 3 686 186 и 3 745 165 описаны спиро[фталан-1,4'-пиперидин] и спиро[изохроман-3,4'-пиперидин] новые соединения, необязательно имеющие бензильный заместитель у N-атома пиперидина. Указано, что фталановые соединения являются полезными в качестве антидепрессантов, как показано за счет их способности обращать резерпиновую гипотермию, тогда как изохромановые соединения, как было установлено, являются полезными в качестве гипотриглицеридемических агентов.
В открытой выкладке заявки на патент ФРГ N 2 458 176 и соответствующем патенте США N 3 985 889 описаны 1,3-дигидроспиро[изобензофуран-1,4'-пиперидин] или 1,3-дигидроспиро[изобензофуран-1,3'-пирролидиновые] соединения, замещенные у N-атома кольца низшим алкилом, циклоалкилом или фенил (C2-4)-алкилом и необязательно имеющие оксогруппу, присоединенную к фурановому кольцу, которые являются полезными в качестве транквилизаторов, как показано по их способности оказывать влияние на поведение и депрессивный рефлекс и на мускульную релаксацию, и они заявлены также как полезные для лечения боли, как показано в опыте на мышах с индуцированным 2-фенил-1,4-хиноном писчим спазмом. Однако, представлены фармакологические данные только для одного такого соединения без оксогруппы в фурановом кольце, а именно 1,3-дигидро-1'-метилспиро[изобензофуран-1,4'- пиперидинового] соединения, и специально описаны только четыре таких соединения, имеющих другой заместитель, чем метил у N-атома пиперидина, а именно 1'-циклопропилметил-, 1'-[3-(4-фторбензоил)пропил] -, 1'-[4,4-бис(4-фторфенил)бутил] - и 1'-ацетил-1,3-дигидроспиро[изобензофуран-1, 4'-пиперидин]. Не имеется указаний об их действии на сигма-рецепторы.
В японской патентной публикации JP Кокай 55 143.980 описан очень широкий класс соединений спиро[хроманпиперидина], которые необязательно замещены у N-атома пиперидина алкилом, циклоалкилом, аллилом, арилом, аралкилом или арилциклоалкилом и необязательно замещены в хромановом кольце оксогруппой. Однако, что касается таких спирохромановых соединений, не имеющих оксозаместителя в хромановом кольце, специально описаны только метильная, фенильная или бензильная группы у N-атома пиперидинового кольца. Эти соединения заявлены как обладающие антиаллергической активностью и нет никаких данных о воздействии на центральную нервную систему.
Известен также европейский патент ЕР N 0 414 289 A1, описывающий производные 1,2,3,4-тетрагидро-спиро[нафталин-1,4'- пиперидина] и 1,4-дигидро-спиро[нафталин-1,4'-пиперидина], замещенных у N-атома пиперидина "углеводородом", и указано, что они обладают селективной активностью антагонистов сигма-рецепторов. Термин "углеводород", как определено в указанном патенте, охватывает все возможные группы с прямой цепью, циклические, гетероциклические и т.п.; однако, специально раскрыты только соединения, имеющие бензил, фенилэтил, циклоалкилметил, фурил- или тиенилметил или низший алкил или алкенил в качестве "углеводородного" заместителя. Было установлено, что соединения вытесняют тритированный дитолилгуанидин (ДТГ) из сигма-центров с мощностью более 200 нМ. В качестве особенно предпочтительного соединения упоминается 1'-бензил-1,2,3, 4-тетрагидро- спиро[нафталин-1,4-пиперидин]. В европейской патентной публикации описаны соответствующие производные спиро[индан-1,4'-пиперидина] и спиро[бензоциклогептен-5,4'-пиперидина]. Также установлено, что соединения только замещают тритированный дитолилгуадинин (ДТГ) из сигма-центров с мощностью более 200 нМ.
ЕР заявка N ЕР-A2-0 431 943 относится к другому, очень широкому классу спиропиперидиновых соединений, замещенных у N-атома пиперидина. Указанные соединения указаны как полезные антиаритмические агенты и для улучшения функции сердечного насоса.
В указанной заявке подтверждены примерами несколько соединений, основная часть которых содержит оксо- и/или сульфониламинный заместитель в спироциклической кольцевой системе. У остальных соединений большая часть имеет другой полярный заместитель, такой как нитро, амино, конденсированная имидазогруппа и т.п., присоединенный к спиро-ядру, и/или имеют некоторые полярные заместители, такие как сульфониламино, нитро, амино и т.п., у заместителя при N-атоме пиперидина. Кроме того, некоторые соединения имеют гетероарилалкильный заместитель у N-атома пиперидина, тогда как только очень немногие из подтвержденных примерами соединений не имеют таких заместителей, а именно пара 6-метокси-спиро[2Н-1-бензопиран-2,4'-пиперидинов] , имеющих фенильный заместитель у N-атома пиперидина и несколько спиро[3H-1-бензопиран-3,4'-пиперидинов] , имеющих бензильный, фенетильный, гексильный или гептильный заместитель у N-атома пиперидина, и нет никаких данных о влиянии соединений на сигма-рецепторы.
В патенте США N 4 420 485 описаны 1'-[3-(6-фтор-1,2-бензоизоксазол-3-ил)пропил]-спиро[бензофуран-2(Н),4'- пиперидины], необязательно имеющие один или два заместителя в бензофурановом кольце. Соединения заявлены как полезные в качестве антигипертензивных агентов, о лечении ими психических или неврологических расстройств.
В открытой выкладке заявки на патент ФРГ N 28 27 874, соответствующей патенту США N 4 251 538, в общем описан класс 3-[4-(4-фенилпиперидин-1-ил)бутил] индольных производных, необязательно замещенных в индольной пиперидиновой или тетрагидропиридильной и/или фенильной группах. Указано, что соединения оказывают антагонистическое допамину действие и ингибирующее повторное повышение серотонина действие на центральную нервную систему, а, следовательно, являются полезными для лечения болезни Паркинсона и депрессии. Однако, документально это не подтверждено, отсутствуют фармакологические данные и определенно отсутствуют предположения или указания на ингибирующее сигма-рецепторы действие.
Кроме того, большинство соединений, перечисленных в описании, из которых очевидно получено в действительности только несколько, являются тетрагидропиридильными соединениями и/или они имеют оксозаместитель в бутильной цепи. Упомянуто только несколько пиперидиновых соединений без оксозаместителей в бутильной цепи, а именно 3-[4-(4-фенил-1-пиперидил)бутил]-индол и 1-метил-, 1-фенил- и 2-метилпроизводные их, а также их производные, замещенные галоидом, метилом или трифторметилом в 4-фенильном заместителе в пиперидильной группе. В отношении физических данных приведена только точка плавления для одного такого соединения.
Международная заявка на патент N WO 91/09594, опубликованная 11 июля 1991 года, относится, между прочим, к 4-фенилпиперидиновым соединениям, являющимся сигма-рецепторными лигандами, и имеющими необязательно замещенный "гетероарил"-алкильный, -алкенильный, -алкинильный, -алкокси или -алкоксиалкильный заместитель у N-атома пиперидина. Термин "гетероарил"-алкил определяется упоминанием очень широкого класса таких заместителей. Однако, специально раскрыты только четыре N-замещенных 4-фенилпиперидиновых соединения, которые все являются 1-(фенил-низший алкил)-4- фенилпиперидинами и только четыре соединения, имеющие "гетероарил"-алкильный заместитель, специально упомянуты, все они являются пиперазиновыми (а не пиперидиновыми) соединениями. Установлено, что эти соединения являются антипсихотическими агентами.
При изучении биологии и функции сигма-рецепторов было представлено доказательство, что сигма-рецепторные лиганды могут быть полезными при лечении психоза и расстройства движения, таким как дистония и замедленная дискенезия, и моторных нарушений, ассоциированных с хореей Хантингтона или синдромом Туретта, и при болезни Паркинсона (Walker F.M. et al., Pharmacological Reviews, 1990, 42, 355). Известный сигма-рецепторный лиганд римказол клинически показал эффект при лечении психоза (Snyder S.H., Largent B.L.J.Neuropsychiatry 1989, 1, 7) и была описана группа сигма-рецепторных лигандов, показывающих антигаллюциногенную активность в модели на животных (Международная заявка на патент N WO 9103243).
Кроме того, уже сообщалось, что сигма-рецепторные лиганды были вовлечены в модуляцию случаев, медиированных НМДА рецептором, в мозгу и действуют как антиишемические агенты в тестах in vitro (Rao T.S. et al., Molecular Pharmacology, 1990, 37, 978). Помимо ишемии, они также могут быть полезными при лечении других таких случаев, медиированных НМДА рецептором, например, эпилепсии и судорог.
Также было найдено, что некоторые сигма-рецепторные лиганды проявляют анти-ишемическое действие на моделях животных (Early et al., Brain Research 1991, 546, 281-286). Было показано влияние сигма-лигандов на уровни центрального ацетилхолина на моделях животных (Matsuno et. al., Brain Research 1992, 575, 315-319; Junien et al., Eur.J. Pharm. 1991, 200, 343-345) и, следовательно, может обладать мощностью при лечении старческой дементии типа Альцгеймера.
Описаны также некоторые производные гуанидина, обладающие сигма-рецепторной активностью, являющиеся полезными как анксиолитики (Международная патентная заявка N WO 9014067).
Следовательно, полагают, что агенты, мощно действующие на сигма-рецепторы в центральной нервной системе, могут быть потенциально полезными при лечении таких состояний.
Обнаружено, что определенный класс пиперидиновых соединений связывается у сигма-рецепторов с мощностями, которые обычно имеют величину на 2-3 порядка большую, чем предельная мощность, указанная в европейской патентной публикации EP 0 414 289 A1. Кроме того, было найдено, что соединения указанного класса показывают анксиолитическое действие на моделях животных.
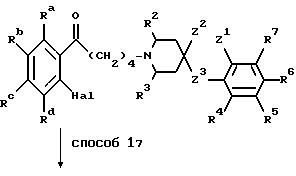
Указанный класс соединений включает соединения общей
формулы I
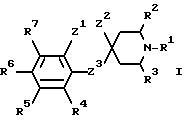
где R1 является:
а) группой -D-B-A-R,
в которой В является спейсерной группой, имеющей до 19 членов, выбранной из алкилена, алкенилена и алкинилена, которые могут быть с разветвленной или прямой цепью и необязательно замещены гидроксилом, который снова может быть этерифицирован алифатической карбоновой кислотой, имеющей от двух до двадцати четырех атомов углерода включительно,
A является связью или двухвалентной группой, выбранной из О, S, SO, SO2, и
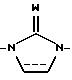
W является О или S, а пунктирная линия означает необязательную связь;
R является алкилом, алкенилом, циклоалкилом, циклоанкенилом, фенилом, циклоалкилалкилом, циклоалкенилалкилом, фенилалкилом, дифенилалкилом, любая алкильная группа необязательно замещена одной или двумя гидроксильными группами, которые снова могут быть необязательно этерифицированы алифатической карбоновой кислотой, имеющей от двух до двадцати четырех атомов углерода включительно, и любая фенильная группа необязательно замещена одним или более заместителями в фенильном кольце; и
D является CR5R7, где R5 и R7 независимо выбраны из заместителей, определенных ниже для R4-R7, или циклоалкиленовой группой; или
б) группой, имеющей общую формулу II
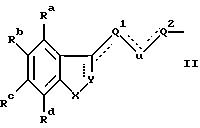
где X является CHR10, О, S, SO, SO2 или NR10, R10 является водородом, низшим алкилом или алкенилом, циклоалкилом или циклоалкилалкилом, циклоалкенилом или циклоалкенилалкилом, ацилом, аминоалкилом, моно- или диалкиламиноалкилом, сульфонилом или аралкилом или фенилом, необязательно замещенным одним или двумя заместителями, независимо выбранными среди галогена, низшего алкила, гидроксила, трифторметила и циано, или R10 является гетероароматической группой, предпочтительно 2-тиенилом, 3-тиенилом, 2-фуранилом, 3-фуранилом, 2-тиазолилом, 2-оксазолилом, 2-имидазолилом, 2-пиридилом, 3-пиридилом или 4-пиридилом;
одна или две пунктирных линии могут быть связью;
когда пунктирная линия, выходящая из Y, указывает связь, Y является N или CH; или
когда указанная пунктирная линия не является связью, Y является CH2; NH, C=O или C=S;
Ra-Rd независимо выбраны из водорода, галогена, низшего алкила, низшего алкокси, гидроксила, низшего алкилтио, низшего алкилсульфонила, низшего алкил- или диалкиламино, циано, трифторметила или трифторметилтио;
U является CH2, О или S; или
когда одна из пунктирных линий, выходящих из U, указывает связь, U является CH; связь между U и Q1 или Q2 соответственно также может быть тройной связью и в таком случае U является "C";
Q1 выбран среди связи, алкилена или алкенилена, a Q2 является алкиленом, имеющим по крайней мере два C-атома, алкениленом или группой Q2'D, где Q2' имеет те же значения, что и Q2, a D имеет значения, указанные ранее, Q1 и Q2 имеют вместе от 2 до 20 атомов углерода и необязательно замещены одним или несколькими гидроксилами, любая такая гидроксильная группа необязательно этерифицирована алифатической карбоновой кислотой, имеющей 2-24 атома углерода включительно; и
R2 и R3 независимо являются водородом, низшим алкилом или они могут быть связаны вместе с образованием в результате этиленового или пропиленового мостика;
R4-R7 независимо выбраны из водорода, галогена, низшего алкила, низшего алкокси, гидроксила, низшего алкилтио, низшего алкил- или диалкиламино, циано, трифторметила или трифторметилтио; и
i) Z1 и Z2 связаны вместе, в этом случае Z1 является CH2, О или S;
Z2 и Z3 независимо являются (CH2)n, n равно 0 или 1, О или S, при условии, что Z1 не может быть S или О, когда Z2 является S или О, и что Z2 и Z3 оба не могут быть (CH2)n, когда n равно 0:
или Z1 и Z2 вместе могут являться группой -CH=CH-;
или когда Z3 является (CH2)n, где n равно 0, Z1 и Z2 могут вместе представлять собой трехчленную двухвалентную группу, необязательно содержащую одну ненасыщенную связь и необязательно содержащую один О или S-гетероатом; или
ii) когда R1 является группой, как определено в б), Z1 и Z2 также могут быть несвязанными, в этом случае Z1 является группой, как определено для R4-R7, Z2 является водородом и Z2 является (CH2)n, где n равно 0;
при условии, что когда Z1-Z3 имеют значения, определенные в i), где Z3 является (CH2)n, где n равно 0 и Z1 и Z2 вместе являются 2- или 3-членной двухвалентной углеводородной группой, необязательно содержащей одну ненасыщенную связь, и R1 является группой, определенной в а), тогда D-B-A-R не может быть фенил-C1-3-алкилом, низшим алкилом или низшим алкенилом;
и солей присоединения кислот или предшественники лекарств.
Согласно настоящему изобретению предлагаются также пиперидиновые соединения, имеющие указанную выше общую формулу I, или их соли присоединения кислот или предшественники лекарств для получения фармацевтической рецептуры для лечения состояния беспокойства, психоза, эпилепсии, судорог, расстройств движения, моторных нарушений, амнезии, сердечно-сосудистых заболеваний, старческой дементии типа болезни Альцгеймера или Паркинсона.
Некоторые из соединений общей формулы I могут существовать в виде оптических изомеров, и такие оптические изомеры также являются предметом изобретения.
Термин алкил означает C1-C20-алкильную группу с прямой или разветвленной цепью, подобным образом алкенил означает C2-C20-алкенил с прямой или разветвленной цепью, имеющий одну или несколько ненасыщенных связей в цепи. Термин циклоалкил означает карбоциклическое кольцо, имеющее 3-8 атомов углерода включительно, или бициклический или трициклический карбоцил, такой как адамантил.
Термины низший алкил, низший алкокси, низший алкилтио и т.п. означают такие разветвленные или неразветвленные группы, имеющие от одного до шести атомов включительно. Примерами таких групп являются метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2-метил-1-пропил, метокси, этокси, 1-пропокси, 2-пропокси, метилтио, этилтио, 1-пропилтио, 2-пропилтио, метилсульфонил, этилсульфонил или т. п.
Галоген означает фтор, хлор, бром или йод.
Термин "сульфонил" используют при обозначении алкил- или арилзамещенного сульфонила, подобным образом "ацил" используют для обозначения алкил- или арилкарбонила.
Термин "одна или две пунктирные линии могут быть связью" означает, что каждая из пунктирных линий может быть, а может не быть связью, а именно, что цикл и боковая связь соответственно могут иметь, а могут не иметь двойную связь в положениях пунктирных линий в формуле II, при условии, что только две одновременно указывают связь и что соседние пунктирные линии, обе не указывают связь.
Необязательные заместители в фенильных группах в определении R могут независимо быть выбраны среди галогена, низшего алкила, низшего алкокси, гидроксила, низшего алкилтио, низшего алкилсульфонила, низшего алкил- или диалкиламино, циано, трифторметила или трифторметилтио. Каждая фенильная группа может нести один или несколько заместителей.
Соли присоединения кислот являются фармацевтически приемлемыми солями соединений формулы I, образованными с нетоксичными кислотами. Примерами таких органических солей являются соли малеиновой, фумаровой, бензойной, аскорбиновой, эмбоновой, янтарной, щавелевой, бис-метиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспаргиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, p-аминобензойной, глютаминовой, бензолсульфоновой и теофиллинуксусной кислоты, а также 8-галотеофиллины, например, 8-бромтеофиллин. Примерами таких неорганических солей являются соли соляной, (бромистоводородной, серной, сульфаминовой, фосфорной и азотной кислот.
Расстройства движения и моторные нарушения, которые могут быть вылечены препаратом согласно изобретению, являются, например, дистонией и замедленной дискенезией и моторными нарушениями, ассоциированными с хореей Хантингтона или синдромом Туретта. Дистония может быть острой или замедленной и может быть вызвана нейролептиками или иметь другую причину.
Церебрососудистые заболевания являются такими заболеваниями, вызванными церебральным инфарктом, церебральным кровоизлиянием, церебральным артериосклерозом, субарахноидным кровоизлиянием, церебральным тромбозом, церебральной эмболией или подобным, например, ишемией, гипоксией, аноксией.
Было обнаружено, что соединения согласно изобретению замещают тритированный дитолилгуанидин (ДТГ) из сигма-центров in vitro с мощностью выше примерно 40 нМ, а главным образом, выше 1 нМ, т.е. они связываются на сигма-рецепторах намного более сильно, чем лиганды сигма-рецепторов, такие как, например, ВМУ 14802 и римказол. Кроме того, было доказано, что большая часть настоящих соединений является очень селективными лигандами на сигма-рецепторах. Например, по сравнению с α1- адреносепторами и рецепторами допамина D2, было найдено, что основная часть настоящих соединений имеет отношения сродства (ИК50 альфа/сигма и допамин/сигма, соответственно) 30-10000. Кроме того, соединения показывают очень мощное анксиолитическое действие на поведение животных в тесте при очень низких дозах, а именно величины ЭК50 в интервале нг-мкг/кг.
Когда Z1 и Z2 связаны вместе, предпочтительно по крайней мере один из Z1, Z2 и Z3 обозначает О или S, а более предпочтительно Z3 является (CH2)n, где n равно 0, и Z2 является "О" или "S" и Z1 является CH2 или Z1 и Z2 вместе являются CH2-O-CH2. Другими предпочтительными группами являются те, когда Z1 является CH2, Z2 является О и Z3 является CH2; или Z3 является О и Z1-Z2 является CH=CH; или Z1 является О, Z3 является О и Z2 является (CH2)n, где n=0.
Особенно предпочтительными соединениями являются:
1'-(3-адамантилокси-1-пропил)спиро[3H-2-бензофуран-3,4'- пиперидин];
1'-[4-(1-бензил-3-индол)-1-бутил] -спиро[изобензофуран-1(3H),4'- пиперидин];
1'-(3-(3-фенилимидазолидин-2-он-1-ил)-1-пропил) спиро[изобензофуран-1(3H),4'-пиперидин];
1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] -спиро [изобензофуран-1(3H), 4'-пиперидин];
1,
4-дигидро-1'-[4-[1-(4-фторфенил)-3-индолил]-1- бутил]спиро[3H-2-бензопиран-3,4'-пиперидин];
1'-(4-(1-р-толуолсульфонил-3-индолил)-1-бутил) спиро[изобензофуран-1(3H),4'-пиперидин];
1'-[4-[5-фтор-1-(4-фторфенил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин];
6-фтор-1'-[4-[1-(4-фторфенил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин];
1'-[4-[1-(4-метилфенил)-3-индолил]-1-бутил]спиро[1Н- 2-бензопиран-4(3H), 4'-пиперидин];
1-(4-фторфенил)-3-[4-(4-(4-фторфенил)-1-пиперидил)-1- бутил]индол;
1'-[4-(1-(2-тиазолил)-3-индолил)-1- бутил] спиро[изобензофуран-1(3H), 4'-пиперидин];
1'-[3-(5-фторбензофуран-3-ил)-1- пропил] спиро[изобензофуран-1(3H),4'-пиперидин];
1'-[4-(5-фторбензофуран-3-ил)-1-бутил] -спиро[изобензофуран- 1(3H),4'-пиперидин];
1'-[4-[1-(4-фторфенил)-5-трифторметилиндазол-3-ил] -1- бутил] спиро[изобензофуран-1(3H),4'-пиперидин];
4-фторфенил-3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил] -5- трифторметилиндазол;
1'-(4-(1,2-бензизоксазол-3-ил)-1-бутил) спиро[изобензофуран-1(3H),4'-пиперидин]; и
1'-[3-(бензо[B] тиофен-3-илтио)-1- пропил]спиро[изобензофуран-1(3H),4'-пиперидин].
Некоторые из соединений, использованных в соответствии с изобретением, являются новыми и,
следовательно, в другом аспекте настоящее изобретение относится к новым производным пиперидина, имеющим формулу I, как определено выше, при условии, что, если R1 является группой формулы II,
как определено выше в б), Z1, Z2 и Z3 имеют значения, указанные ранее в ii), X является NH, Y является CH и пунктирная линия, выходящая из Y, является связью, тогда
-Q1-U-Q2- не может быть алкилом, имеющим менее 5 атомов углерода;
если R1 является группой формулы II, как определено выше, где Z3 является О,
Z1 является CH2, Z2 является (CH2)n, n равно О, X является О, Y является N, пунктирная линия, выходящая из Y, указывает связь, и -Q1
-U-Q2- означает -(CH2)3, тогда Rc не может быть фтором;
если Z3 является О, Z2 и Z1, оба являются CH2 и
D-В-A-R является необязательно замещенным фенетилом, тогда R6 не может быть метокси; и
если Z1 является О, Z2 и Z3, оба являются CH2,
тогда D-B-A-R не может быть фенетилом, или необязательно гидроксил-замещенным гексилом или гептилом.
Настоящее изобретение также включает фармацевтическую композицию, состоящую из, по крайней мере, одного нового пиперидинового соединения согласно изобретению, как определено выше, или фармацевтически приемлемой его соли присоединения кислоты или предшественника лекарства в сочетании с одним или более фармацевтически приемлемых носителей или разбавителей.
Фармацевтическая композиция согласно настоящему изобретению или те, которые получены в соответствии с настоящим изобретением, могут быть введены любым подходящим путем, например, орально, в виде таблеток, капсул, порошков, сиропов и т.п., или парентерально в виде растворов для инъекций. Для приготовления таких композиций могут быть использованы способы, известные на данном уровне техники, и могут быть использованы любые фармацевтически приемлемые носители, разбавители, эксципиенты или другие вспомогательные вещества, обычно используемые на данном уровне техники.
Обычно предложенные соединения вводят в единичной дозированной форме, содержащей указанное соединение в количестве в интервале примерно 0,01-50 мг.
Суммарная дневная доза обычно находится в интервале примерно 0,05-100 мг, а более предпочтительно от примерно 0,1 до 20 мг активного соединения изобретения.
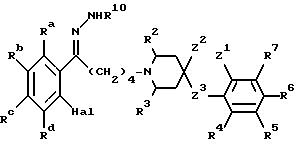
Соединения формулы I могут быть получены:
а) при восстановлении амидного карбонила соединения формулы III
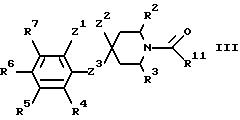
где R2-R7 и Z1-Z3 имеют указанные ранее значения, a R11 является такой группой, что CH2-R11 является группой, включающей определение R1;
б) при алкилировании соединения формулы IV
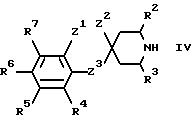
где R2-R7 и Z1-Z3 имеют указанные ранее значения, алкилирующим агентом формулы R1-V, где R1 имеет указанные ранее значения, а V является подходящей отщепляемой группой, такой как галоген, мезилат или тозилат;
в) при восстановительном алкилировании аминов формулы IV альдегидами формулы R11-CHO или карбоновыми кислотами формулы R11-COOH или кетонами формулы R12-CO-R13, где R2-R7, R11 и Z1 -Z3 имеют указанные ранее значения, a R12 и R13 являются такими группами, что R12-CH-R13 является группой, включаемой определением R1;
г) при восстановлении C=Y1 двойной связи в соединении формулы V
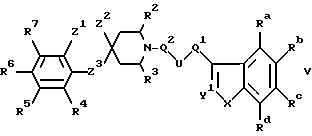
где Ra-Rd, X, U, Q1, Q2, R2-R7 и Z1-Z3 имеют указанные ранее значения, a Y1 является CH или N;
д) при окислении соединения формулы VI в оксосоединение формулы VII:
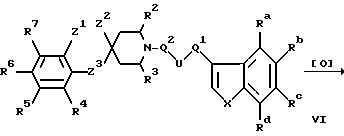
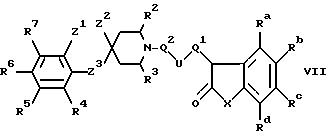
где Ra-Rd, X, U, Q1, Q2, R2-R7 и Z1-Z3 имеют указанные ранее значения;
е) при алкилировании соединения формулы VIII для получения соединения общей формулы I, где X= NR10', R10' является низшим алкилом, алкенилом, циклоалкилом, циклоалкилалкилом, циклоалкенилом или циклоалкенилалкилом,
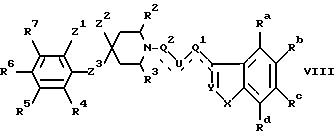
где Ra-Rd, Y, U, Q1, Q2, R2-R7 и Z1-Z3 имеют указанные ранее значения, алкилирующим агентом формулы R10'-V1, где R10' имеет указанные ранее значения, a V1 является подходящей отщемляемой группой, например, галогеном, мезилатом или тозилатом; или ацилированием соединения формулы VIII ацилирующим агентом, имеющим формулу R10''-CO-Hal, где Hal является галогеном и R10'' является группой, которая вместе с CH2 образует группу R10', и последующим восстановлением ацилированного соединения формулы VIII;
ж) арилированием соединения формулы VIII для получения соединения общей формулы I, где X=NR10''', R10''' является необязательно замещенным фенилом или гетероарилом, арилирующим агентом формулы Ar-V1, где Ar является необязательно замещенным фенилом или гетероарилом, a V1 имеет указанные ранее значения;
з) для получения соединения общей формулы I, где X=NCO-R10' или N-СО-Ar, где R10' и Ar имеют указанные ранее значения, ацилируют соединение формулы VIII ацилирующим агентом формулы R10'-CO-Hal или Ar-CO-Hal, где Hal имеет указанные ранее значения;
и) для получения соединения общей формулы I, где X=NSO2R10' или NSO2Ar, где R10' и Ar имеют указанные ранее значения, сульфонилируют соединения формулы VIII сульфонилирующим агентом формулы R10'SO2Hal или ArSO2Hal, где Hal имеет указанные ранее значения;
к) восстановительным алкилированием соединений формулы VIII карбонильными соединениями формулы R14 -CO-R15, где R14 и R15 являются такими группами, что R14-CH-R15 является группой R10, как определено ранее;
л) при проведении реакции замыкания цикла гидразона IX в индазольное производное X
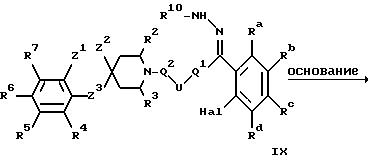
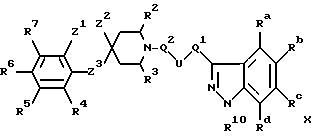
где Ra-Rd, U, Q1, Q2, R2-R7, R10 и Z1 -Z3 имеют указанные ранее значения и Hal является галогеном;
м) восстановлением кватернизированного производного пиридина формулы XI
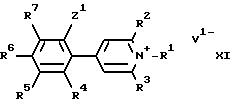
в которой R1-R7, Z1 и V1 имеют указанные ранее значения;
после чего выделяют соединение формулы I в виде свободного основания или его фармацевтически приемлемой соли присоединения кислоты.
Восстановление по способу а) предпочтительно может быть проведено в инертном органическом растворителе, таком как диэтиловый эфир или тетрагидрофуран, в присутствии литийалюминийгидрида при температуре кипения с обратным холодильником.
Амиды формулы III удобно получать при обработке производных пиперидина формулы IV подходящими хлорангидридами карбоновых кислот формулы R11-COCl в присутствии основания (карбоната калия или триэтиламина). Когда R11-CH2 означает группу формулы -D-B-A-R, соответствующие хлорангидриды карбоновых кислот формулы R11-COCl являются или коммерчески доступными или получены по стандартным методикам.
Когда R11-CH2 означает группу формулы II, соответствующие хлорангидриды карбоновых кислот формулы XII
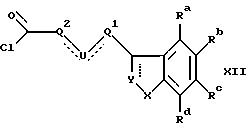
где Ra-Rd, X, Y, U и Q1 имеют указанные ранее значения, a Q2' является такой группой, что Q2'-CH2 является группой Q2, как определено ранее, получают из соответствующих карбоновых кислот известными способами.
Производные пиперидина формулы IV, где Z1 и Z2 связаны вместе, получают следующим образом:
спиро[изобензофуран-1(3H), 4'-пиперидин] - согласно способу, описанному Marxer,
et al, J.Org.Chem., 1975, 40, 1427.
2,3-дигидро-спиро[1H-инден-1,4'-пиперидин] и 3,4-дигидро- спиро[нафтален-1(2H),4'-пиперидин] - по методике, описанной во французском патенте N 1 335 831.
1'-метил-спиро[бензо[c]тиофен-1(3H),4'-пиперидин] - по методике, описанной Parham et al., J.Org.Chem. 1976, 41, 2628. Соответствующее деметилированное производное получают при обработке этилхлорформатом с последующим щелочным гидролизом промежуточного этилкарбамата.
1'-фенилметил-спиро[1H-2-бензопиран-4(3H),4'-пиперидин] - согласно методике, описанной Yamamoto et al, J.Med.Chem., 1981, 24, 194. Соответствующее дебензилированное производное получают при гидрировании в присутствии палладиевого катализатора.
3, 4-дигидро-1'-фенилметил-спиро[2H-1-бензопиран-2,4'- пиперидин] - по методике, описанной Yamamoto et al, Chem.Pharm. Bull. 1981, 29, 3494. Соответствующее дебензилированное производное получают при обработке этилхлорформатом с последующим щелочным гидролизом промежуточного этилкарбамата.
1'-фенилметил-спиро[2H-1-бензопиран-2,4'-пиперидин] получают по методике, описанной Yamamoto et al, Chem.Pharm.Bull, 1981, 29, 3494. Соответствующее дебензилированное производное получают гидрированием в присутствии палладиевого катализатора.
1'-фенилметил-спиро[3H-2-бензопиран-3,4'-пиперидин] -1(4H)-он - по методике, описанной Yamamoto et al, Y.Med.Chem. 1981, 24, 194. Восстановление литийалюминийгидридом с последующей обработкой фосфорной кислотой по методике, описанной Marxer et al, J.Org.Chem. 1975, 40, 1427, получают 1,4-дигидро-1'-фенилметил- спиро[3H-2-бензопиран-3,4'-пиперидин] , который дебензилируют гидрированием в присутствии палладиевого катализатора.
1'-бензилспиро[4H-1-бензопиран-4,4'-пиперидин] получают по способу, аналогичному способу, описанному в EP 0 414 289 A1 для синтеза 1'-бензил-1, 4-дигидроспиро[нафталин-1,4'-пиперидина] . Гидрирование в присутствии палладиевого катализатора дает 2,3-дигидроспиро[4H-1-бензопиран-4,4'-пиперидин].
Спиро[1,3-бензодиоксол-2, 4'-пиперидин] получают при кипячении с обратным холодильником 1-этоксикарбонил-4-пиперидина и катехола в толуольном растворе в присутствии р-толуолсульфоновой кислоты при непрерывном удалении воды с последующим удалением бензильной группы при гидрировании в присутствии палладиевого катализатора.
Заместители R-R вводят, применяя подходящим образом замещенные исходные соединения и методики, аналогичные описанным выше.
Производные пиперидина формулы IV, где Z1 и Z2 не соединены, получают известным способом (патент США N 2 891 066; McElvain et al, J.Amer.Chem.Soc. , 1950, 72, 3134; Bally et al, Chem.Ber. 1887, 20, 2590).
Алкилирование соединения формулы IV по способу б) удобно осуществлять в инертном органическом растворителе, таком как подходяще кипящий спирт или кетон, предпочтительно в присутствии основания (карбонат калия или триэтиламин) при температуре кипения с обратным растворителем.
Алкилирующие реагенты формулы R1-V, где R1 означает -D-B-A-R, где A является O, S или связью, а D, В и R имеют указанные ранее значения, получают по стандартным литературным методикам. Соответствующие сульфоксиды и сульфоны получают при окислении сульфидов по методикам, известным на данном уровне техники.
Такие алкилирующие агенты, в которых A представляет собой группу
Получение алкилирующих агентов формулы R1-V, где R1 означает группу, имеющую общую формулу II, проиллюстрировано примерами в следующих реакционных схемах. В формулах реакционных схем Ra-Rd, V и Ar имеют указанные ранее значения, а E означает 1-пиперидильную группу общей формулы IV. Индены формулы II удобно получать по схеме 1, в которой Ra -Rd и V имеют указанные ранее значения.
Схема 1
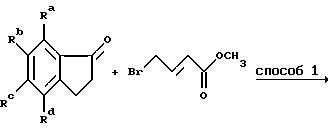
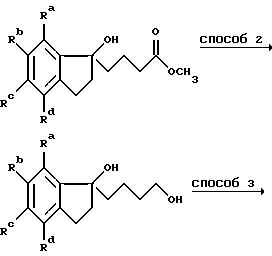
Способ 1 представляет собой традиционную конденсацию Реформатского с активированным цинком. Способ 2 состоит из восстановления литийалюминийгидридом, проводимого в инертном органическом растворителе, таком как диэтиловый эфир или тетрагидрофуран, при кипячении с обратным холодильником.
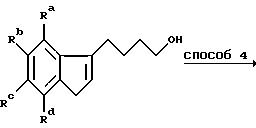
Удаление в способе 3 предпочтительно проводят в подходящем спирте, например метаноле, в присутствии сильной минеральной кислоты, например концентрированной соляной кислоты. Предпочтительно способ 4 представляет собой обработку метансульфонилхлоридом в присутствии триэтиламина в дихлорметане, таким образом получают соответствующий метансульфонат, но альтернативно может быть проведено превращение гидроксила в галоид с помощью подходящего реагента, например тионилхлорида.
Инданы формулы II получают по схеме 2, в которой Ra-Rd и V имеют указанные ранее
значения
Схема 2
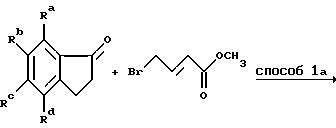
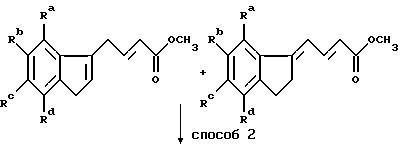
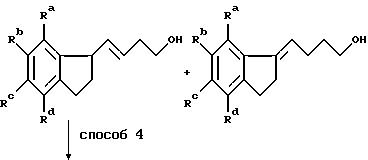
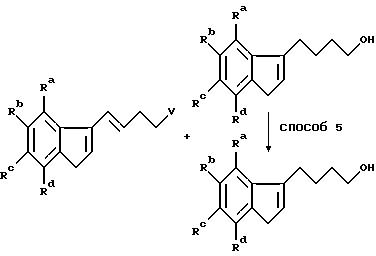
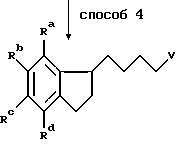
Способ 1a является аналогом способа 1 с той модификацией, что удаление воды осуществляют непосредственно на сыром продукте с помощью концентрированной соляной кислоты. Полученную смесь изомеров восстанавливают по способу 2. Один из полученных изомеров выделяют, тогда как оставшуюся смесь гидрируют в традиционном аппарате Парра (способ 5) в присутствии подходящего катализатора из благородного металла, например, палладия или платины.
Индолы формулы II наиболее удобно получать или из индолалкановой кислоты, например, индолбутановой кислоты, как описано в европейской заявке на патент N 376607, или согласно схеме 3, в которой Ra -Rd, Ar и V имеют указанные ранее значения.
Схема 3
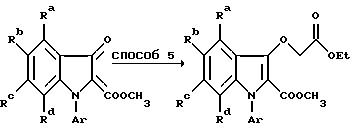
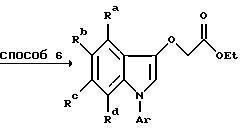
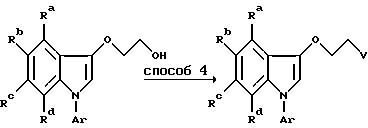
Исходный индоксиловый эфир получают по способу, описанному в патенте США N 4 710 500. Алкилирование в способе 5 осуществляют в инертном, удобно кипящем, органическом растворителе, например, спирте или кетоне, предпочтительно в присутствии основания (карбоната калия или триэтиламина). Декарбоксилирование в способе 6 предпочтительно проводят термически, после гидролиза диэфира в дикислоту, в подходящем инертном растворителе, например, хинолине, диметилформамиде, или N-метил-2-пирролидоне (НМП) в присутствии меди.
Индол-3-илоксипропильные производные также могут быть получены при нагревании смеси 3-ацетоксииндолов и 1,3-пропиленгликоля в присутствии серной кислоты, в результате чего получают 3-(индол-3- илокси)-1-пропанольные производные, которые превращают в соответствующие метансульфонаты или галоидные соединения по способу 4.
Бензофураны и 2,3-дигидробензофураны формулы II получают по схемам 4 и 5, в которых Ra-Rd и E имеют указанные ранее значения.
Схема 4
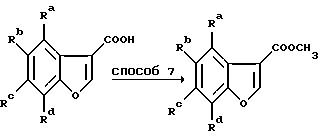
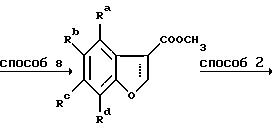
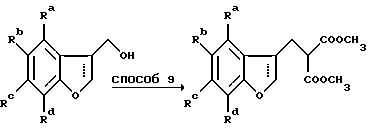
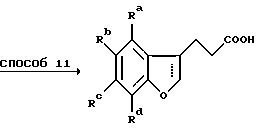
Способ 7 представляет собой удобное превращение в метиловый эфир путем обработки карбоновой кислоты тионилхлоридом с последующим добавлением метанола к промежуточному хлорангидриду карбоновой кислоты, 2,3-дигидробензофураны получают при восстановлении магнием (способ 8) на этой стадии, тогда как бензофураны получают при пропускании этой стадии. Способ 9 состоит из превращения спиртовой группы в соответствующий хлорид с помощью тионилхлорида с последующей обработкой диметилмалонатом в подходящем растворителе, например НМП, в присутствии основания, предпочтительно трет.бутоксида калия. Способ 11 подобен способу 6 с тем исключением, что декарбоксилирование осуществляют без добавления меди.
Схема 5
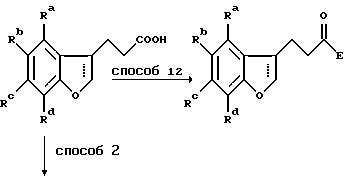
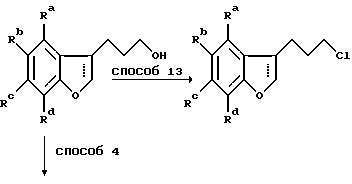
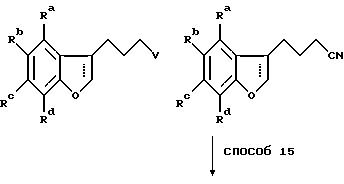
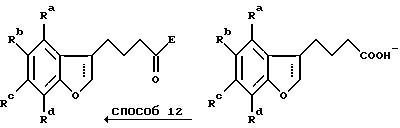
Способ 12 состоит в традиционном превращении карбоновой кислоты в амид через хлорангидрид карбоновой кислоты. Удлинение боковой цепи осуществляют при превращении гидроксильной группы в хлорид при обработке предпочтительно тионилхлоридом в дихлорметане в присутствии нескольких капель диметилформамида (способ 13) с последующей обработкой цианидной солью, например цианидом калия, в подходящем апротонном диполярном растворителе, предпочтительно диметилсульфоксиде, при 100-200oC (способ 14). Гидролиз цианогруппы осуществляют минеральной кислотой при повышенной температуре (способ 15).
Бензо[b]тиофены и 2,3-дигидробензо[b]тиофены формулы II получают по способам, аналогичным способам, описанным в схемах 4 и 5. Бензо[b]тиофен-3-илметилоксиэтильные производные получают из метилбензо[b]тиофен-3-карбоксилата при восстановлении в метанольное производное литийалюминийгидридом с последующим алкилированием этилбромацетатом и дальнейшим восстановлением в бензо[b] тиофен-3-илметилоксиэтанольные производные, которые превращают в целевые соединения по способу 4. Бензофуран-3- илметилоксиэтильные производные получают аналогично.
Бензо[b]тиофен-5, 5-диоксидные производные получают окислением соответствующих производных бензо[b] тиофена по стандартным литературным методикам. 2,3-диоксииндолы формулы II получают по способам, аналогичным способу г). Индолы формулы II получают по способам, аналогичным способу д). Индазолы формулы II получают по способам, аналогичным способу к).
Восстановительное алкилирование аминов формулы IV по способу в) осуществляют по стандартным литературным методикам. Альдегиды, карбоновое кислоты и кетоны формулы R11-CHO, R11-COOH и R12-COR13, соответственно, являются или коммерчески доступными или получены по стандартным методикам, или по способам, аналогичным способам, описанным в схемах 1-5.
Восстановление C=Y1 двойной связи по методу г) удобно осуществлять каталитическим гидрированием в спирте на платиновом катализаторе или путем гидрирования дибораном или предшественником диборана, таким как триэтиламинный или диметилсульфоксидный комплекс, в тетрагидрофуране или диоксане от 0oC до температуры кипения с обратным холодильником, с последующим кислотным гидролизом промежуточного боранового производного.
Альтернативно, двойная связь может быть восстановлена боргидридом натрия в метаноле в присутствии трифторуксусной кислоты (смотри, например, Berger et al, J. Med.Chem., 1977, 20, 600).
Окисление соединения формулы VI по способу г) осуществляют по Szabo-Pustay et al, Synthesis, 1979, 276.
Алкилирование, ацилирование или сульфонилирование соединений формулы VIII по способам е), з) и и), соответственно, осуществляют в инертном растворителе, таком как подходяще кипящий спирт или кетон, предпочтительно в присутствии основания (карбонат калия или триэтиламин). Алкилирующие реагенты R10'-V1, ацилирующие агенты R10''-CO-V1, R10'-CO-V1 и Ar-CO-V1 и сульфонилирующие агенты R10'-SO2-V1 и Ar-SO2-V1 соответственно являются коммерчески доступными или полученными по стандартным методикам.
Арилирование соединения формулы VIII по способу ж) наиболее удобно осуществлять при использовании хорошо известной реакции Уильманна. Арилирующие реагенты Ar-V1 являются коммерчески доступными.
Восстановительное алкилирование соединений формулы VIII по способу к) осуществляют по стандартным литературным методикам.
Замыкание цикла соединений формулы IX по способу л) наиболее удобно осуществлять при нагревании соединения формулы IX в подходящем инертном органическом растворителе, таком как диметилформамид, в присутствии основания, предпочтительно трет.бутоксида калия.
Гидразоны формулы IX получают по схеме 6, в которой Ra-Rd, R10 и Hal имеют указанные ранее значения.
Схема 6
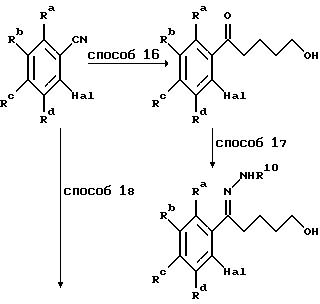
Способ 16 заключается в добавлении реагента Гриньяра 4-хлор-1-бутанола к о-галобензонитрилам в стандартных условиях для реакций Гриньяра. Превращение в гидразон (способ 17) осуществляют при кипячении с обратным холодильником в этаноле в присутствии гидразина. Альтернативно, гидроксильное производное, полученное по способу 16, может быть превращено в амин через соответствующий мезилатный аналог по способу 4 и а) перед превращением кетогруппы.
Восстановление по способу м) наиболее удобно осуществлять путем каталитического гидрирования в спирте на палладиевом катализаторе. Соединения формул V, VI и VIII получают по способам а), б), к), л) или м). Соединения формулы XI получают при обработке соединения формулы R1-V1 4-арилпиридином в спирте с подходящей температурой кипения.
Далее изобретение иллюстрируется примерами, которые не ограничивают данное изобретение.
Пример 1.
1'-бутилспиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 1а.
Смесь 2 г спиро[изобензофуран-1(3Н),4'-пиперидина], 4 г n-бутилбромида, 5 г карбоната калия и 0,2 г йодида калия в 100 мл 4-метил-2-пентанона кипятят с обратным холодильником в течение 16 часов. После охлаждения реакционную смесь промывают 100 мл воды и концентрируют в вакууме. Целевое соединение кристаллизуют в виде оксалатной соли из ацетона при добавлении щавелевой кислоты. Перекристаллизовывают из смеси этанол/эфир. Выход 1,2 г, т.пл. 171-173oC.
Подобным образом также получают:
1'-пентилспиро[изобензофуран-1(3H), 4'-пиперидин] ,
оксалат, 1b, т.пл. 170-172oC.
Пример 2
1'-(4-фенил-1-бутил)спиро[изобензофуран-1(3H),4'-пиперидин], фумарат, 2а
К охлажденному льдом раствору 20 г
4-фенил-1-бутанола и 15 г триэтиламина в 200 мл дихлорметана прибавляют по каплям раствор 12 мл метансульфонилхлорида в 50 мл дихлорметана. После перемешивания в течение 1 часа при 10oC
реакционную смесь разбавляют водой. Водную фазу экстрагируют дихлорметаном, объединенные органические фазы сушат над сульфатом магния, отгоняют летучие компоненты в вакууме, получают 29 г
светло-желтого масла, 4-фенил-1- бутилметансульфоната, которое является достаточно чистым для использования на следующей стадии. Смесь 2 г спиро[изобензофуран- 1(3Н),4'-пиперидина], 6 г
4-фенил-1-бутил-метансульфоната и 14 г карбоната калия в 75 мл 4-метил-2-пентанона кипятят с обратным холодильником в течение 20 часов. После охлаждения реакционной смеси ее фильтруют и концентрируют
в вакууме. Оставшееся вязкое масло наносят на колонку с силикагелем (элюент: эфир/метанол/триэтиламин = 93: 5: 2), получают бесцветное масло, которое кристаллизуется в виде фумаратной соли, 2а, из
ацетона при добавлении фумаровой кислоты. Выход 0,7 г, т.пл. 197-199oC.
Подобным образом также получают:
1'-(4-циклогексил-1-бутил)спиро[изобензофуран-1(3H),
4'- пиперидин], оксалат, 2б, т.пл. 139-142oC;
2,3-дигидро-1'-(4-фенил-1-бутил)спиро[1H-инден-1,4'- пиперидин] , фумарат, 2в, т.пл.207-211oC;
1'-(4-фенил-1-бутил)спиро[бензо[c] тиофен-1(3Н), 4'- пиперидин], малеат, 2г, т.пл. 176-177oC;
3,4-дигидро-1'-(4-фенил-1-бутил)спиро[нафталин-1(2H),4'- пиперидин], фумарат, 2д,
т.пл. 191-193oC;
1'-(4-фенил-1-бутил)спиро[1H-2-бензопиран-4(3H), 4'- пиперидин], малеат, 2е, т.пл. 169-170oC;
1,
4-дигидро-1'-(4-фенил-1-бутил)спиро[3H-2-бензопиран-3,4' -пиперидин], малеат, 2ж, т.пл. 152-153oC;
3,4-дигидро-1'-(4-фенил-1-бутил)спиро[2H-1-бензопиран-2,4' -пиперидин], оксалат,
2з, т.пл. 155-157oC;
1'-(4-фенил-1-бутил)спиро[2H-1-бензопиран-2,4'- пиперидин], фумарат, 2и, т.пл. 184-185oC;
1'-(3-циклогексилокси-1-пропил)спиро[изобензофуран-1(3H),4' -пиперидин], фумарат, 2к, т.пл.154-155oC;
1'-(3-фенокси-1-пропил)спиро[изобензофуран-1(3H), 4'- пиперидин], 2л, т. пл.
143-144oC;
1'-(3-фенокси-1-пропил)спиро[3H-2-бензопиран-3,4'- пиперидин] , малеат, 2м, т.пл. 171-173oC;
1'-(3-адамантилокси-1-пропил)спиро[3Н-2-бензопиран-3,
4'- пиперидин] , малеат, 2н, т.пл. 221-224oC;
1'-(3-метилтио-1-пропил)спиро[изобензофуран-1(3Н), 4'- пиперидин] , оксалат, 2о, т.пл. 126-127oC;
1'-(3-циклогексилтио-1-пропил)спиро[изобензофуран-1(3Н), 4'- пиперидин], оксалат, 2п, т.пл. 170-174oC;
1'-(3-фенилтио-1-пропил)спиро[изобензофуран-1(3H), 4'- пиперидин] , оксалат,
2р, т.пл. 152-155oC;
1'-(3-метилсульфонил-1-пропил)спиро[изобензофуран-1(3H), 4'- пиперидин], 2с, т.пл. 163-164oC;
1'-(3-циклогексилсульфонил-1-пропил)спиро[изобензофуран-1 (3H), 4'-пиперидин], 2т, т.пл. 118-120oC;
1'-(3-фенилсульфонил-1-пропил)спиро[изобензофуран-1(3Н)4'- пиперидин] , 2у,
т.пл. 197-202oC;
8'-(4-фенил-1-бутил)спиро[изобензофуран-1(3Н), 3'-8- азабицикло[3,2,1] октан], малеат, 2ф, т.пл. 180-181oC;
1'-[4-(3-индолил-1-бутил]
-спиро[изобензофуран-1(3Н),4'- пиперидин], 2х, т.пл. 150-155oC;
1'-[4-(3-индолил)-1-бутил] -спиро[1H-2-бензопиран-4(3H), 4'- пиперидин], оксалат, 2ц, т.пл. 222-225oC;
1'-[5-(3-индолил)-1-пентил] -спиро[1H-2-бензопиран-4(3H),4'- пиперидин], оксалат, 2ч, т.пл. 145-146oC;
1'-[6-(3-индолил)-1-гексил] -спиро[1H-2-бензопиран-4(3Н),4'- пиперидин],
оксалат, 2ш, т.пл. 117-118oC;
1'-[4-(5,6-дихлор-3-индолил)-1-бутил]-спиро[изобензофуран-1(3H),4'- пиперидин], 2щ, т.пл. 122-123oC;
1'-[4-(5-фтор-3-индолил)-1-бутил] -спиро[изобензофуран-1(3Н), 4'- пипeридин], 2аа, т.пл. 185-187oC;
1'-[4-(1-метил-3-индолил)-1-бутил] -спиро[изобензофуран-1(3Н), 4'- пиперидин],
2бб, т.пл. 101-102oC;
3-[4-(4-фенил-1-пиперидил)-1-бутил]индол, 2вв, т.пл. 131-132oC;
3-[4-(4-(3,4-дихлорфенил)-1-пиперидил)-1-бутил] индол, 2гг, т.пл.
118-119oC;
5,6-дихлор-3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил] индол, 2дд, т.пл. 120-121oC;
3-[6-(4-(4-фторфенил)-1-пиперидил)-1-гексил]индол, 2ее, т.пл.
90-91oC;
3-[4-(4-(2-метоксифенил)-1-пиперидил)-1-бутил]индол, оксалат, 2жж, т.пл. 183-188oC;
1'-[4-(1-бензил-3-индолил)-1-бутил] -спиро[изобензофуран-1(3H),
4'- пиперидин], 2зз, т.пл. 166-168oC;
3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил] индол-2-он, 2ии, т.пл. 108-110oC;
6-фтор-1'-(4-(3-индолил)-1-бутил)спиро[изобензофуран-1(3H), 4'- пиперидин], 2кк, т.пл.189-191oC.
Пример 3.
1'-(4-(3-циклогексилимидазолидин-2-он-1-ил)-1-бутил) спиро[изобензофуран-1(3H),4'-пиперидин], гидрохлорид, 3а
Смесь 2,0 г 1-циклогексил-3-(4-хлор-1-бутил)-2- имидазолидинона, (полученного по
способу, описанному в открытой выкладке заявки на патент ФРГ 2035370), 1,5 г спиро[изобензофуран- 1(3H),4'-пиперидина], 4,4 г карбоната калия и 0,1 г йодида калия в 60 мл метилизобутилкетона кипятят с
обратным холодильником в течение 17 часов. После охлаждения до комнатной температуры смесь фильтруют и удаляют в вакууме растворитель. Оставшееся масло очищают хроматографией на колонке (силикагель,
элюент: этилацетат/гептан/триэтиламин = 9: 1: 1). Целевое соединение кристаллизуется в виде гидрохлорида из смеси ацетон/эфир при добавлении эфирного раствора HCl. Выход 1,9 г, т.пл. 203-207oC>
Подобным образом также получают:
1'-(2-(3-фенилимидазолидин-2-он-1-ил)-1-этил) спиро[изобензофуран-1(3Н), 4'-пиперидин], гидрохлорид, 3б, т.пл. 151-154oC;
1'-(3-(3-фенилимидазолидин-2-он-1-ил)-1-пропил) спиро[изобензофуран-1(3Н),4'-пиперидин], гидрохлорид, 3в, т.пл. 232-250oC;
1'-(2-(3-циклогексилимидазолидин-2-он-1-ил)-1-этил) спиро[изобензофуран-1(3H),4'-пиперидин], гидрохлорид, 3г, т.пл. 160-161oC.
Пример 4
1'-пропил-спиро[изобензофуран-1(3H),4'-пиперидин], малеат, 4а
К смеси 3 г спиро[изобензофуран-1(3Н),4'-пиперидина], 5 г карбоната калия и 100 мл воды в 100 мл толуола прибавляют по каплям 3 г
пропионилхлорида. После 3 часов перемешивания при комнатной температуре отделяют толуольную фазу, промывают водой и концентрируют в вакууме. Оставшееся масло растворяют в 100 мл тетрагидрофурана и
прибавляют 1 г литийалюминийгидрида. После 3 часов кипячения реакционной смеси с обратным холодильником смесь охлаждают и последовательно прибавляют 2 мл воды, 1 мл 9 N NaOH и 5 мл воды. Смесь
фильтруют и кристаллизуют целевое соединение в виде малеатной соли, 4а, из этилацетата при добавлении малеиновой кислоты. Перекристаллизовывают из смеси ацетон/эфир. Выход 0,7 г, т.пл. 107-109oC.
Подобным образом также получают:
1'-(5-метил-1-гексил)-спиро[изобензофуран-1(3Н),4'- пиперидин], оксалат, 4б, т.пл. 162-164oC;
1'-(2-фенил-1-этил)-спиро[изобензофуран-1(3Н), 4'- пиперидин] , малеат, 4в, т.пл. 161-163oC;
1'-(3-фенил-1-пропил)-спиро[изобензофуран-1(3Н), 4'- пиперидин], малеат, 4г, т.пл.
142-144oC;
1'-(5-фенил-1-пентил)-спиро[изобензофуран-1(3H), 4'-пиперидин], оксалат, 4д, т.пл. 115-117oC;
1'-(6-фенил-1-гексил)-спиро[изобензофуран-1(3H),
4'- пиперидин], оксалат, 4е, т.пл. 156-157oC;
1'-октадеканил-спиро[изобензофуран-1(3Н), 4'-пиперидин], оксалат, 4ж, т. пл. 208-210oC.
Пример 5
1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] - спиро[изобензофуран-1(3Н), 4'-пиперидин], 5а
Смесь 3 г 2х, 5 г 1-фтор-4-йодбензола, 0,5 г медного порошка и 2 г карбоната калия в 50 мл НМП
выдерживают 5 часов при 160-170oC. После фильтрации прибавляют воду, затем экстрагируют эфиром. Удаление растворителя в вакууме дает красное масло, которое наносят на колонку с силикагелем
(элюент: этилацетат). Целевое соединение, 5а, кристаллизуется в виде оксалатной соли из ацетона при добавлении щавелевой кислоты. Выход 1,3 г, т.пл. 169-170oC.
Подобным образом также получают.
1,4-дигидро-1'-[4-[1-(4-фторфенил)-3-индoлил]-1- бутил]спиpo[3H-2-бензопиран-3,4'-пиперидин], малеат, 5б, т.пл. 142-143oC;
1'-[4-[1-(3-тиенил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин], 5в, т.пл. 182-183oC;
1'-[4-[1-(2-тиенил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3H),
4'-пиперидин], 5г, т.пл. 198-202oC;
1'-[4-[1-(3-фуранил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин], 5д, т.пл. 141-142oC;
1-(4-фторфенил)-3-[4-(4-фенил-1-пиперидил)-1-бутил] индол, оксалат, 5е, т.пл. 171-173oC;
1'-[4-[1-(4-пиридил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин], оксалат,
5ж, т.пл. 127-129oC.
Пример 6
1'-(4-(1-метансульфонил-3-индолил)-1-бутил) спиро[изобензофуран-1(3Н), 4'-пиперидин], оксалат, 6а
Раствор 20 г NaOH в 20 мл
воды охлаждают до 10oC и прибавляют раствор 4 г 4-(3-индолил)-1-бутанола в 60 мл метиленхлорида вместе с 0,8 г кислого сульфата тетрабутиламмония. Прибавляют по каплям 2,5 мл
метансульфонилхлорида в 25 мл метиленхлорида при 15oC, затем перемешивают 20 минут при комнатной температуре. Разделяют фазы и органическую фазу промывают водой. Сушат над сульфатом магния
и удаляют растворитель в вакууме, получают масло, которое очищают хроматографией на колонке (силикагель, элюент: эфир/метиленхлорид/гептан = 1:1:1), получают 1,8 г тяжелого масла,
4-(1-метансульфонил-3-индолил)-1-бутилметансульфонат, который превращают в целевое соединение по способу, описанному в примере 2. Оксалатную соль кристаллизуют из ацетона при добавлении щавелевой
кислоты. Выход 1,0 г, т.пл. 83-85oC.
Подобным образом получают также:
1'-(4-(1-р-толуолсульфонил-3-индолил)-1-бутил) спиро[изобензофуран-1(3Н),4'-пиперидин],
оксалат, 6б, т.пл. 201-204oC;
6-фтор-1'-(4-(1-(2-тиенил)сульфонил-3-индолил)-1-бутил) спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 6в, т.пл. 184-186oC.
Пример 7
1'-(4-(1-ацетил-3-индолил)-1-бутил)спиро[изобензофуран- 1(3H),4'-пиперидин], оксалат, 7
Раствор 0,8 мл ацетилхлорида в 10 мл метиленхлорида прибавляют по каплям
при 15oC к смеси 1,8 г 2х, 1 г гидроксида натрия и 0,2 г кислого сульфата тетрабутиламмония в 40 мл метиленхлорида. После часа перемешивания при комнатной температуре прибавляют воду,
отделяют органическую фазу и сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме, получают вязкое масло, которое очищают хроматографией на колонке (силикагель, элюент:
гептан/этилацетат/триэтиламин = 60:40:4). Целевое соединение кристаллизуют в виде оксалатной соли из ацетона при добавлении щавелевой кислоты. Выход 0,45 г, т.пл. 139-140oC.
Пример 8
1'-[3-[1-(4-фторфенил)-3-индолилокси] -1- пропил] спиро[изобензофуран-1(3Н),4'-пиперидин], оксалат, 8а
Смесь 24 г 3-ацетилокси-1-фенилиндола, 240 мл 1,3-диоксипропана и 10
мл концентрированной серной кислоты нагревают 2 часа при 80oC. Прибавляют воду и затем экстрагируют эфиром. Эфирную фазу сушат над сульфатом магния, затем удаляют растворитель в вакууме,
получают 3-(1-фенил-3-индолилокси)-1- пропанол, достаточно чистый для использования на следующей стадии.
Целевое соединение получают по способу, описанному в примере 2, используя спиро[изобензофуран-1(3H),4'-пиперидин], и кристаллизуют в виде оксалатной соли из ацетона при добавлении щавелевой кислоты. Выход 2 г, т.пл. 151-154oC.
Подобным образом
также были получены:
1'-[3-[6-хлор-1-(4-фторфенил)-3-индолилокси]-1- пропил]спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 8б, т.пл.180-181oC;
1'-[3-[5-хлор-1-(4-фторфенил)-3-индолилокси]-1-бутил] спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 8в, т.пл. 115-118oC;
5-хлор-1-(4-фторфенил)-3-[3-(4-(4-метилфенил)-1- пиперидинил)-1-пропилокси]индол, 8г, т.пл. 111-112oC.
Пример 9
1'-[4-[1-(4-фторфенил)-3-индолил]
-1-бутил]спиро[1H-2- бензопиран-4(3Н), 4'-пиперидин], малеат, 9а
Прибавляют по каплям 500 мл тетрагидрофуранового раствора 103 г метил-4(3-индолил)-бутирата к суспензии 25 г
литийалюминийгидрида в 1000 мл тетрагидрофурана при 40oC с последующим перемешиванием в течение часа при комнатной температуре. Обычная обработка дает 96 г 4-(3-индолил)-1- бутанола в виде
масла. Арилирование 1-фтор-4-йодбензола по методике примера 5 дает 4-[1-(4-фторфенил)-3-индолил] -1-бутанол, который превращают в целевое соединение 9а по методике, описанной в примере 2, используя
спиро[1H-2-бензопиран-4(3H), 4'-пиперидин] . Малеатную соль кристаллизуют из ацетона при добавления малеиновой кислоты. Выход 1,5 г, т.пл. 189-190oC.
Подобным образом также
получают:
1'-[4-[5-фтор-1-(4-фторфенил)-3-индолил] -1- бутил]спиро[изобензофуран-1(3Н),4'-пиперидин], оксалат, 9б, т.пл. 164-165oC;
1'-[4-[1-(4-фторфенил)-3-индолил]
-1- бутил]спиро[бензо[c]тиофен-1(3H), 4'-пиперидин], малеат, 9в, т.пл. 179-180oC;
8'-[4-[1-(4-фторфенил)-3-индолил] -1- бутил] спиро[изобензофуран-1(3Н), 3'-8-азабицикло[3,2,
1]октан], малеат, 9г, т.пл. 161-162oC;
6-фтор-1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил]спиро [изобензофуран-1(3H),4'-пиперидин], гидрохлорид, 9д, т.пл. 227-231oC;
1'-[4-[1-(4-фторфенил)-3-индолил]-1-бутил]-6- изопропил]спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 9е, т.пл. 129-144oC;
7-фтор-1'-[4-[1-(4-фторфенил)-3-индолил]
-1- бутил]спиро[изобензофуран-1(3Н),4'-пиперидин], оксалат, 9ж, т.пл. 186-189oC;
1'-[4-[1-(4-фторфенил)-3-индолил]-1-бутил]-5- метил]спиро[изобензофуран-1(3Н),4'-пиперидин],
оксалат, 9з, т.пл. 154-156oC;
1'-[4-[1-(4-метилфенил)-3-индолил]-1-бутил]спиро[1H- 2-бензопиран-4(3H), 4'-пиперидин], фумарат, 9и, т.пл. 186-188oC;
1'-[4-[5-фтор-1-(3-тиенил)-3-иидолил] -1-бутил] -спиро [изобензофуран-1(3H),4'-пиперидин], фумарат, 9к, т.пл. 184-186oC;
1'-[4-[1-(3-пиридинил)-3-индолил]
-1-бутил]спиро[1H-2- бензопиран-4(3H), 4'-пиперидин], фумарат, 9л, т.пл. 185-187oC;
1-(4-фторфенил)-3-[4-(4-(4-фторфенил)-1-пиперидил)-1- бутил]индол, оксалат, 9м, т.пл.
190-191oC;
1-(4-фторфенил)-3-[4-(4-(4-метилфенил)-1-пиперидин)-1- бутил]индол, малеат, 9н, т.пл. 130-132oC;
1-(4-фторфенил)-3-[4-(4-(4-изопропилфенил)-1-пиперидил) -1-бутил]индол, малеат, 9о, т.пл. 160-162oC;
1-(4-фторфенил)-3-[4-(4-(4-диметиламинофенил)-1- пиперидил)-1-бутил]индол,
фумарат, 9п, т.пл. 180-182oC;
1-фенил-3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил] индол, оксалат, 9р, т.пл. 174-176oC;
1'-[4-(1-(2-тиазолил)-3-индолил)-1- бутил] спиро[изобензофуран-1(3H), 4'-пиперидин], фумарат, 9с, т.пл. 165-167oC;
6-трифторметил-1'-[4-[1-(4-фторфенил)-3-индолил]-1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин], фумарат, 9т, т.пл. 100-105oC;
4-фтор-1'-[4-[1-(4-фторфенил)-3-индолил]
-1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 9у, т.пл. 160-163oC;
1-(4-фторфенил)-3-[4-(4-(3-трифторметилфенил)-1- пиперидил)-1-бутил]индол, малеат, 9ф, т.пл.
112-113oC;
2,3-дигидро-1'-[4-[1-(4-фторфенил)-3-индолил]-1- бутил]спиро[4H-1-бензопиран-4,4'-пиперидин], оксалат, 9х, т.пл. 187-192oC;
6-фтор-1'-[4-[5-фтор-1-(4-фторфенил)-3-индолил]- 1-бутил]спиро[изобензофуран-1(Н),4'-пиперидин], оксалат, 9ц, т.пл. 144-146oC.
Пример 10
1'-(4-(бензо[b]
тиофен-3-ил)-1-бутил) спиро[изобензофуран-1(3Н),4'-пиперидин], малеат, 10а
Раствор 69 г метил-бензол[b]тиофен-3-илацетата в 100 мл сухого тетрагидрофурана прибавляют по каплям к суспензии 10
г литийалюминийгидрида в 500 мл сухого тетрагидрофурана при комнатной температуре, затем кипятят 1 час с обратным холодильником. Гидролизуют воду, фильтруют и удаляют растворитель, получают масло,
которое наносят на колонку с силикагелем (элюент: метиленхлорид), получают 34,5 г бензо[b]тиофен-3-илэтанол в виде масла.
Продукт растворяют в 200 мл метиленхлорида, прибавляют 20 мл тионилхлорида, затем 5 часов кипятят с обратным холодильником. Удаляют растворитель и избыток тионилхлорида в вакууме, получают 45 г 3-(2-хлор-1-этил)-бензо[b] тиофена в виде масла.
Хлорид превращают в 4-бензо[b] тиофен-3-ил-1-бутанол путем обработки диметилмалонатом с последующим гидролизом, декарбоксилированием восстановлением по методике, описанной в примере 11.
Целевое соединение 10а получают из 4-бензо[b]тиофен-3-ил- 1-бутанол и спиро[изобензофуран-1(3H),4'-пиперидина] по способу, описанному в примере 2. Выход 2,2 г, т.пл. 144-145o C.
Подобным образом также получают:
1,4-дигидро-1'-(4-(бензо[b] тиофен-3-ил)-1-бутил) спиро[3H-2-бензопиран-3,4'-пиперидин], малеат, 10б, т.пл. 172-173oC;
1'-(4-(5-метилбензо[b] тиофен-3-ил)-1-бутил) спиро[изобензофуран-1(3H), 4'-пиперидин], малеат, 10в, т.пл. 164-165oC.
Пример 11
2,
3-дигидро-5-фтор-3-[3-(4-(4-фторфенил)-1-пиперидил)-1- пропил] бензофуран, 11а
К суспензии 118 г 5-фторбензофуран-3-карбоновой кислоты в 800 мл дихлорметана прибавляют 200 мл тионилхлорида и
1 мл диметилформамида. После 3 часов кипячения с обратным холодильником реакционную смесь концентрируют в вакууме и оставшееся масло растворяют в 800 мл дихлорметана. Медленно прибавляют 1,5 л
метанола и перемешивают смесь 1 час. После удаления растворителя в вакууме остается 125 г метил-5-фторбензофуран-3-карбоксилата в виде масла.
Масло растворяют в 1,8 л метанола и прибавляют 7 г магниевой стружки. После начала реакции добавляют дополнительно 80 г магния порциями в течение 1,5 часов, поддерживая температуру реакции 30-40oC. Реакционную смесь перемешивают 1 час, затем добавляют водный аммоний хлорид. Экстрагируют эфиром, сушат эфирную фазу над сульфатом натрия, затем удаляют растворитель в вакууме, остается вязкое масло, метил-2, 3-дигидро-5-фторбензофуран-3-карбоксилат (120 г).
Масло растворяют в 500 мл сухого эфира и прибавляют по каплям к суспензии 32 г литийалюминийгидрида в 600 мл сухого эфира. Смесь 3 часа кипятят с обратным холодильником, потом гидролизуют водой. Фильтрация и удаление растворителя в вакууме дают 95 г 2,3-дигидро- 5-фтор-3-оксиметилбензофурана, который превращают в 155 г 2, 3-дигидро-5-фторбензофуран-3-илметилметансульфоната по способу, описанному в примере 2.
Растворяют 262 г диметилмалоната в 2 л НМП и прибавляют порциями 202 г трет. бутоксида калия, поддерживая температуру 15-20oC. Смесь нагревают при 60oC и прибавляют по каплям раствор 155 г 2,3-дигидро-5-фторбензофуран-3-илметилметансульфоната в 150 мл НМП. Смесь перемешивают 4 часа при 70-75oC, потом добавляют холодную воду. Экстрагируют эфиром, сушат эфирную фазу над сульфатом магния, затем удаляют растворитель в вакууме, получают 160 г 2-(2, 3-дигидро-5-фторбензофуран-3-илметил)малоната в виде масла, которое является достаточно чистым для дальнейшего синтеза.
Масло растворяют в 2 л этанола и прибавляют смесь 120 г твердого гидроксида калия и 200 мл воды, потом 2 часа кипятят с обратным холодильником. Реакционную смесь концентрируют в вакууме, прибавляют воду, потом экстрагируют эфиром. Водную фазу подкисляют концентрированной соляной кислотой и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния и отгоняют растворитель в вакууме, получают вязкое масло, которое растворяют в 1 л НМП и выдерживают 2 часа при 150oC. Добавляют воду и экстрагируют эфиром, получают после сушки над сульфатом магния и удаления в вакууме растворителя 77 г 3-(2, 3-дигидро-5- фторбензофуран-3-ил)-пропионовой кислоты. Восстановление литийалюминийгидридом по описанному выше способу дает 51 г 3-(2,3-дигидро-5-фторбензофуран-3-ил)-1-пропанола, который превращают в 3-(2,3-дигидро-5-фторбензофуран-3-ил)-1 пропилметансульфонат по способу, описанному в примере 2.
Целевое соединение 11а получают из 4,2 г 3-(2, 3-дигидро-5- фторбензофуран-3-ил)-1-пропилметансульфоната и 5,5 г 4-(4-фторфенил)пиперидина по способу, описанному в примере 2. Выход 1,8 г, т.пл. 83-85oC.
Подобным образом
также получают:
1'-[3-(2,3-дигидро-5-фторбензофуран-3-ил)-1- пропил]спиро[изобензофуран-1(3H),4'-пиперидин], 11б, т.пл. 62-63oC;
Пример 12
1'-[4-(2,
3-дигидро-5-фторбензофуран-3-ил)-1-бутил]- спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 12
3-(2,3-дигидро-5-фторбензофуран-3-ил)-1-пропанол, полученный по методике примера 11 (51 г)
растворяют в 300 мл дихлорметана прибавляют 0,5 мл диметилформамида. Прибавляют по каплям 50 мл тионилхлорида в течение 20 минут, затем перемешивают 3 часа. Добавляют охлажденную льдом воду, отделяют
органическую фазу, сушат над сульфатом магния и концентрируют в вакууме, получают 46 г 3-(3-хлор-1-пропил)-2,3-дигидро-5-фторбензофурана в виде масла.
Суспендируют 12 г цианида калия в 180 мл диметилсульфоксида нагревают до 80oC. Прибавляют по каплям раствор 42 г 3-(3-хлор-1- пропил)-2,3-дигидро-5-фторбензофурана в 40 мл диметилсульфоксида затем 15 минут нагревают при 140oC. После охлаждения прибавляют эфир и воду, отделяют эфирную фазу, промывают водой и сушат над сульфатом магния. После удаления растворителя в вакууме получают вязкое масло, которое наносят на колонку с силикагелем, получают 20 г 4-(2,3-дигидро-5-фторбензофуран-3-ил)бутиронитрила в виде масла.
Цианид растворяют в 100 мл ледяной уксусной кислоты, потом добавляют 200 мл концентрированной соляной кислоты. После 5 часов кипячения с обратным холодильником добавляют воду, потом экстрагируют этилацетатом. Сушка органической фазы над сульфатом магния и удаление растворителя в вакууме дает 20 г 4-(2,3-дигидро-5- фторбензофуранил)масляной кислоты.
Растворяют 8 г кислоты в 50 мл дихлорметана и прибавляют 0,5мл диметилформамида. Прибавляют 20 мл тионилхлорида, потом кипятят с обратным холодильником 1,5 часа. Реакционную смесь дважды концентрируют в вакууме с гептаном, получают 7 г хлорангидрида 4-(2,3-дигидро-5-фторбензофуран-3-ил)масляной кислоты в виде масла.
Охлаждают до 5oC раствор 2 г спиро[изобензофурана-1(3Н)4'- пиперидина] и 3 мл триэтиламина в 50 мл дихлорметана и прибавляют по каплям раствор 3 г хлорангидрида 4-(2,3-дигидро-5- фторбензофуран-3-ил)масляной кислоты в 25 мл дихлорметана. После 1 часа перемешивания при комнатной температуре реакционную смесь промывают соленой водой и сушат над сульфатом магния. При удалении растворителя в вакууме получают 4,4 г вязкого масла, которое растворяют в 25 мл сухого тетрагидрофурана и прибавляют по каплям к суспензии 2,6 г литийалюминийгидрида в 60 мл сухого тетрагидрофурана. Реакционную смесь кипятят с обратным холодильником в течение 2 часов и гидролизуют водой. Фильтрация и удаление растворителя в вакууме дают вязкое масло, которое наносят на колонку с силикагелем (элюент: гептан/этилацетат/триэтиламин = 70:25:5), получают 2,9 г целевого соединения 12, которое кристаллизуют в виде оксалатной соли из ацетона при добавлении щавелевой кислоты. Выход 2,2 г т.пл. 102-103oC.
Пример 13
1'-[4-(2,3-дигидро-3-индолил)-1-бутил] спиро[1,3- бензодиоксол-2,4'-пиперидин], оксалат, 13а
К раствору 4
г 25б и 10 г BH3-NMe3; в 100 мл диоксана, прибавляют 12 мл концентрированной соляной кислоты. После 0,5 часа перемешивания смесь 2 часа кипятят с обратным холодильником. Смесь
охлаждают до комнатной температуры и прибавляют 40 мл 6N соляной кислоты, потом 1 час кипятят с обратным холодильником. Подщелачивают реакционную смесь водным гидроксидом натрия и экстрагируют
дихлорметаном. Органическую фазу сушат над сульфатом магния и отгоняют растворитель в вакууме. Получают оранжевое масло, которое наносят на колонку с силикагелем (элюент: этилацетат/гептан/триэтиламин
= 70:28:2). Целевое соединение 13а кристаллизуют в виде оксалатной соли из ацетона при добавлении щавелевой кислоты. Выход 2,3 г, т.пл. 182-184oC.
Подобным образом также
были получены:
1'-[4-(2,3-дигидро-3-индолил)-1- бутил] спиро[изобензофуран-1(3H), 4'-пиперидин], оксалат, 13б, т. пл. 161-164oC;
1'-[4-(2,3-дигидро-3-индолил)-1-бутил]
спиро[1H-2- бензопиран-4(3H),4'-пиперидин], оксалат, 13в, т.пл. 105-107oC;
2,3-дигидро-3-[4-(4-(2-метоксифенил)-1-пиперидинил)-1- бутил]индол, оксалат, 13 г, т.пл. 160-162oC.
Пример 14
1'-[2-[5-хлор-1-(4-фторфенил)-3-индолилокси]-1- этил]спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 14а
К раствору 50 г
метил-5-хлор-1-(4-фторфенил)-3-индолон-2- карбоксилата и 40 г карбоната калия в 500 мл ацетона прибавляют по каплям при кипячении с обратным холодильником 35 г этилбромацетата в 100 мл ацетона. После
6 часов кипячения с обратным холодильником смесь фильтруют и отгоняют в вакууме растворитель. Прибавление воды и экстракция эфиром дает после сушки над сульфатом магния и отгонки растворителя в
вакууме 62 г вязкого масла метил-5- хлор-3-этоксикарбонилметокси-1-(4-фторфенил)-индол-2-карбоксилата.
Масло растворяют в 800 мл этанола и прибавляют 30 г гидроксида калия. Кипятят 4 часа с обратным холодильником, прибавляют 4 г колотого льда, затем подкисляют соляной кислотой, получают бесцветное твердое вещество, которое растворяют в 250 мл НМП. Прибавляют 5 г медной бронзы и смесь выдерживают 4 часа при 200oC. Добавление воды и экстракция этилацетатом дают после сушки над сульфатом магния и удаления растворителя в вакууме 27 г 5-хлор-1-(4- фторфенил)-3-индолилоксиуксусной кислоты.
Кислоту растворяют в 500 мл тетрагидрофурана и прибавляют 4 г литийалюминийгидрида. После 3 часов кипячения с обратным холодильником реакционную смесь гидролизуют водой, фильтруют и концентрируют в вакууме, получают 18 г 5-хлор-1-(4-фторфенил)- 3-(2-оксиэтилокси)-индола в виде масла.
Масло растворяют в 250 мл дихлорметана и прибавляют 10 мл триэтиламина. Прибавляют по каплям 10 мл метансульфонилхлорида при 0-5oC, затем перемешивают 4 часа. Реакционную смесь промывают водой, сушат над сульфатом магния и концентрируют в вакууме, получают 21 г 5-хлор-1-(4-фторфенил)-3-индолилоксиметансульфоната в виде вязкого масла.
1'-[2-[5-хлор-1-(4-фторфенил)-3-индолилокси]-1- этил]спиро[изобензофуран-1(3Н),4'-пиперидин], 14а, получают из 3 г 5-хлор-1-(4-фторфенил)-3-индолилоксиэтилметансульфоната и спиро[изобензофуран-1(3H), 4'-пиперидин] по способу примера 2 с последующей очисткой хроматографией на колонке (силикагель, элюент: этилацетат). Целевое соединение кристаллизуют в виде оксалатной соли из ацетона. Выход 0,8 г, т.пл.216-217oC.
Подобным образом также получают;
5-хлор-1-(4-фторфенил)-3-[2-(4-(4-фторфенил)-1- пиперидинил)-1-этилэтокси]индол, 14б, т.пл. 102-105o
C.
Пример 15
1'-(3-(5-фторбензофуран-3-ил)-1-пропил] спиро[изобензофуран- 1(3Н),4'-пиперидин], оксалат, 15
Получают целевое соединение из 3 г
3-(5-фторбензофуран-3-ил)- пропионовой кислоты и 2 г спиро[изобензофуран-1(3H),4'- пиперидина] по способу, описанному в примере 12. Получают 3-(5-фторбензофуран-3-ил)-пропионовую кислоту по методике,
подобной методике получения 3-(2,3-дигидро-5-фторбензофуран-3-ил)-пропионовой кислоты примера 11, но опуская восстановление магниевой стружкой. Целевое соединение 8 кристаллизуют в виде оксалатной
соли из ацетона при добавлении щавелевой кислоты. Выход 2,6 г, т.пл.157-159oC.
Пример 16
1'-[4-(5-фторбензофуран-3-ил)-1-бутил] -спиро[изобензофуран- 1(3H),
4'-пиперидин], оксалат, 16
Получают целевое соединение из 3,5 г 4-(5-фторбензофуран-3- ил)масляной кислоты и 3 г спиро[изобензофуран-1(3Н),4'-пиперидина] по способу, описанному в примере 12.
Получают 4-(5-фторбензофуран- 3-ил)масляную кислоту по способу, аналогичному получению 4-(2,3-дигидро-5-фторбензофуран-3-ил)масляной кислоты, описанному в примере 12, применяя
3-(5-фторбензофуран-3-ил)-1-пропанол вместо соответствующего дигидро-аналога. 3-(5-фторбензофуран-3-ил)-1- пропанол получают по способу, описанному в примере 11, но опуская восстановление магниевой
стружкой. Целевое соединение 16 кристаллизуют в виде оксалатной соли из ацетата при добавлении щавелевой кислоты. Выход 4,8 г, т.пл. 154-156oC.
Пример 17
1'-[4-[1-(4-фторфенил)-5-трифторметилиндозол-3-ил] -1- бутил] спиро[изобензофуран-1(3Н),4'-пиперидин], 17а
К суспензии 135 г магниевых стружек в 300 мл сухого тетрагидрофурана медленно
прибавляют 140 г этилбромида, растворенного в 500 мл сухого тетрагидрофурана, потом 20 минут кипятят с обратным холодильником. Прибавляют по каплям раствор 274 г 4-хлор-1-бутанола в 500 мл
тетрагидрофурана при температуре кипения с обратным холодильником. После 20 минут перемешивания Гриньяровский раствор фильтруют и прибавляют порциями к раствору 200 г
2-хлор-4- трифторметилбензонитрила в 600 мл сухого тетрагидрофурана. Реакционную смесь перемешивают 16 часов при комнатной температуре, потом прибавляют 2N соляную кислоту и лед. Экстрагируют эфиром,
сушат эфирную фазу над сульфатом магния и удаляют растворитель в вакууме, получают вязкое масло, которое наносят на колонку с силикагелем (элюент: дихлорметан/эфир = 3:1), получают 101 г
4-(2-хлор-5-трифторметилбензоил)-1-бутанола в виде масла.
Растворяют 80 г масла в 800 мл этанола и прибавляют 160 мл гидразингидрата, потом 20 часов кипятят с обратным холодильником. Реакционную смесь охлаждают и концентрируют в вакууме. Прибавляют воду, потом экстрагируют эфиром. Эфирную фазу сушат над сульфатом магния и удаляют растворитель в вакууме, получают 79 г гидразона 4-(2-хлор-5-трифторметилбензоил)-1-бутанола в виде масла. Растворяют 20 г гидразона в диметилформамиде и прибавляют 10 г трет. бутоксида калия. Смесь выдерживают при 100-120oC в течение 30 минут, потом прибавляют водный хлорид аммония, экстрагируют этилацетатом, сушат этилацетатную фазу над сульфатом магния и удаляют растворитель в вакууме, получают вязкое масло, которое наносят на колонку с силикагелем (элюент: этилацетат), получают 2,7 г кристаллического 4-(5-трифторметил-3-индазолил)-1-бутанола, т. пл. 177-179oC. Арилируют 2,7 г индазола 5 г 1-фтор-4-йодбензола по способу, описанному в примере 5, получают 2,7 г 4-[1-(4-фторфенил)-5- трифторметил-3-индазолил] -1-бутанола, т.пл. 77-79oC, который превращают в соответствующий метансульфонат по способу, описанному в примере 2. Получают целевое соединение 17а из 2 г метансульфоната и 2 г спиро[изобензофуран-1(3Н), 4'- пиперидина] по способу, описанному в примере 2. Выход 1,7 г, т. пл. 74-76o C.
Подобным образом также получают:
4-фторфенил-3-[4-(4-(4-фторфенил)-1-пиперидинил)- 1-бутил]-5-трифторметилиндазол, 17б, т.пл. 124-125oC.
Пример
18
1'-[4-(3-трифторметилиндазол-3-ил)-1-(бутил]-спиро [изобензофуран-1(3Н), 4'-пиперидин], 18
Получают 4-(2-хлор-5-трифторметилбензоил)-1-бутанол по методике примера 17 и превращают
его в соответствующий метансульфонат по способу, описанному в примере 2. Обработка спиро[изобензофуран-1(3Н),4'-пиперидином] по способу, описанному в примере 2, получают
1'-[4-(2-хлор-5-трифторметилбензоил)-1- бутил]-спиро[изобензофуран-1(3H),4'-пиперидин]. Превращение в соответствующий гидразон и замыкание цикла по способу, описанному в примере 17, дает целевое
соединение 18, т.пл. 146-147oC.
Пример 19
1'-(4-(1,2-бензизоксазол-3-ил)-1-бутил)спиро[изобензофуран- 1(3H),4'-пиперидин], оксалат, 19а, т.пл. 164-165o
C
Раствор 18 г 1,2-бензизоксазол-3-уксусной кислоты (полученной по G.Casini et al, J.Het.Chem.6, 1969, 279), 150 мл эфира, насыщенного сухим HCl и 200 мл метанола перемешивают 2 часа при
комнатной температуре. Удаляют летучие в вакууме, получают 17 г метил-1,2-бензизоксазол-3-ацетата в виде масла. Масло растворяют в 100 мл тетрагидрофурана и прибавляют по каплям к суспензии 6 г
литийалюминийгидрида в 200 мл тетрагидрофурана при 0-10oC, потом перемешивают 30 минут при 15oC. Обычная обработка дает 13 г 2-(1,2-бензизоксазол-3-ил)этанола в виде масла.
Превращают 13 г этанольного производного в соответствующий метансульфонат по способу, описанному в примере 2 (выход 20 г). Раствор 20 г метансульфоната в 20 мл диметилсульфоксида прибавляют к суспензии 15 г цианида натрия в 40 мл диметилсульфоксида при 70oC, потом 30 минут перемешивают при 70-80oC. Прибавляют воду и эфир, разделяют фазы и сушат эфирную фазу над сульфатом магния. После удаления растворителя в вакууме получают 13 г 3-(1,2-бензизоксазол-3-ил)пропионитрила в виде твердого продукта с т.пл. 67oC. Нитрил растворяют в 200 мл метанола и прибавляют 200 мл насыщенного HCl эфира, потом 16 часов перемешивают при комнатной температуре. Реакционную смесь концентрируют в вакууме, прибавляют воду и эфир и разделяют фазы. Сушат эфирную фазу над сульфатом магния и отгоняют растворитель в вакууме, получают 13 г метил-3-(1,2-бензизоксазол-3-ил)пропионата в виде масла.
При повторении указанных выше стадий превращают 3-(1, 2-бензизоксазол-3-ил)пропинат в метил-4-(1,2-бензизоксазол-2- ил)бутират, который восстанавливают литийалюминийгидридом по методике, описанной выше, в 4-(1,2-бензизоксазол-3-ил)-1- бутанол. По способу, описанному в примере 2, получают 4-(1,2-бензизоксазол-3-ил)-1-бутилметансульфонат.
Получают целевое соединение 19а из 3,4 г 4-(1,2-бензизоксазол- 3-ил)-1-бутилметансульфоната и 2 г спиро[бензофуран-1(3Н), 4'- пиперидина] по способу, описанному в примере 2. Оксалатную соль кристаллизуют из ацетона при добавлении щавелевой кислоты. Выход 2,4 г т.пл. 164-165oC.
Подобным образом получают также:
3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил]-1,2- бензизоксазол, оксалат, 19б, т.пл. 174-175oC;
1-(4-(1,
2-бензизоксазол-3-ил)-1-бутил)спиро[3H-2- бензопиран-3,4'-пиперидин], оксалат 19в, т.пл. 162-163oC;
3-[4-(4-(2,6-дихлорфенил)-1-пиперидил)-1-бутил]-1,2- бензизоксазол, фумарат, 19г,
т.пл. 196-197oC.
Пример 20
1'-(3-(1,2-бензизоксазол-3-ил)-1-пропил) спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 20, т.пл. 131-132oC.
Получают целевое соединение 20 из 3,2 г 3-(1,2-бензизоксазол-3-ил)-1-пропанола (полученного, как описано в примере 19) и 2 г спиро[изобензофуран-1(3Н), 4'-пиперидина] по методике примера 2. Продукт кристаллизуют из ацетона в виде оксалатной соли при добавлении щавелевой кислоты. Выход 2,3 г, т.пл. 131-132oC.
Пример 21
3-[3-(4-(4-фторфенил)-пиперидин-1-ил)-1-пропилокси] -1,2- бензизотиазол, 21
Смесь 15 г 4-(4-фторфенила)-пиперидина, 20 г этил-3-бромпропионата и 14 г карбоната калия в метилизобутилкетоне
кипятят с обратным холодильником 16 часов. После фильтрации и удаления растворителя в вакууме получают 26 г сырого этил-3-(4-(4- фторфенил)-1-пиперидил)пропионата в виде масла, которое используют
непосредственно на следующей стадии.
Масло растворяют в 70 мл сухого тетрагидрофурана и прибавляют по каплям к суспензии 6,5 г литийалюминийгидрида в 250 мл сухого тетрагидрофурана при 15oC в атмосфере азота. После 30 минут перемешивания при комнатной температуре прибавляют 6,5 мл воды, 7 мл 10 N гидроксида натрия и 30 мл воды последовательно. После фильтрации и удаления растворителя получают 20 г сырого 3-(4-(4-фторфенил)-1-пиперидил)-1-пропанола в виде масла, которое является достаточно чистым для использования на следующей стадии. Раствор 10 г 3-(4-(4-фторфенил)-1-пиперидин)-1-пропанола в 150 мл сухого толуола обрабатывают порциями с 50%-ной суспензии 3 г гидрида натрия в ксилоле. Раствор 3,6 г 3-хлор-1,2-бензизотиазола в 30 мл сухого толуола прибавляют по каплям при комнатной температуре, потом перемешивают 1,5 часа при комнатной температуре. Прибавляют лед, разделяют фазы и водную фазу экстрагируют эфиром.
Сушка объединенных органических фаз над сульфатом магния и удаление растворителя в вакууме дает масло, которое наносят на хроматографическую колонку (силикагель, элюент: этилацетат/гептан/триэтиламин = 50:50:4). Целевое соединение 21 кристаллизуют из смеси изопропилового эфира/гептана. Выход 1,5 г, т.пл. 91-92oC.
Пример 22
1'-(4-(1,
2-бензизотиазол-3-ил)-1-бутил)- спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 22
Растворяют 17 г 4-(1,2-бензизотиазол-3-ил)масляной кислоты (C.Branca et al, Phytochemistry, 14, 1975,
2545) в 500 мл сухого толуола и охлаждают до -10oC. Прибавляют по каплям 120 мл 1 М раствора ди-трет.бутилалюминийгидрида в толуоле при -10oC, потом перемешивают 2 часа при
комнатной температуре. Прибавляют 300 мл 2 М разбавленной серной кислоты, разделяют фазы, водную фазу экстрагируют эфиром и объединенные органические фазы сушат над сульфатом магния. Растворители
отгоняют в вакууме, получают вязкое масло, которое очищают на хроматографической колонке (силикагель, элюент: эфир). Получают 4-(1,2-бензизотиазол-3-ил)-1-бутанол (5,2 г) в виде масла.
Получают целевое соединение 22 из 4-(1,2-бензизотиазол-3-ил)- 1-бутанола и спиро[изобензофуран-1(3H),4'-пиперидина] по способу, описанному в примере 2. Оксалатную соль кристаллизуют из ацетона при добавлении щавелевой кислоты. Выход 2 г, т.пл. 151-152oC.
Пример 23
1-(4-фторфенил)-3-[4-[3-(4-фторфенил)-8- азабицикло[3,2,1]-окт-2-ен-8-ил]-1-бутил]-индол, 23
Смесь 600 мл сухого эфира и 500 мл 15%-ного бутиллития в гексане охлаждают до -45oC. Прибавляют по каплям раствор 145 г 4-бром-1-фторбензола в 350 мл сухого эфира при -45oC,
потом перемешивают 1 час. Прибавляют по каплям раствор 85 г 8-метил- 8-aзaбициклo[3,2,1]октан-3-она в 400 мл сухого эфира при -50oC, потом перемешивают 30 минут, повышая температуру до
-20oC. Реакционную смесь выливают в 2 М соляную кислоту и разделяют на фазы. Эфирную фазу экстрагируют 2 М соляной кислотой и подщелачивают объединенные водные фазы водным гидроксидом
натрия. Экстракция ацетилацетатом, сушка органической фазы над сульфатом магния и удаление растворителя в вакууме дает 96 г 3-(4-фторфенил)-3-окси-8-метил-8-азабицикло[3,2,1]октана в виде твердого
продукта, т.пл. 169oC.
Продукт растворяют в 500 мл трифторуксусной кислоты, потом 1 час кипятят с обратным холодильником. Реакционную смесь концентрируют в вакууме, добавляют воду и подщелачивают смесь водным гидроксидом натрия (pH > 9). Экстракция ацетилацетатом, сушка органической фазы над сульфатом магния и удаление растворителя в вакууме дают 3-(4-фторфенил)-8-метил-8- азабицикло[3,2,1]окт-2-ен в виде твердого продукта (91 г, т.пл. 62-63oC).
Продукт растворяют в 550 мл 1,1,1-трихлорэтана и нагревают при 70oC. Прибавляют по каплям раствор 14 мл 2,2,2-трихлорэтилхлорформата в 25 мл 1,1,1-трихлорэтана при 70oC, потом 1 час кипятят с обратным холодильником. Прибавляют дополнительно 24 мл 2, 2,2-трихлорэтилхлорформата, потом 5 часов кипятят с обратным холодильником. Удаление летучих в вакууме и очистка хроматографией на колонке (силикагель, элюент: метиленхлорид) дает 3-(4-фторфенил)-8-(2, 2,2-трихлорэтилоксикарбонил)-8-азабицикло[3,2,1] окт-2-ен (59 г) в виде масла.
Растворяют 17 г (4-фторфенил)-8- (2,2,2-трихлорэтилоксикарбонил)-8-азабицикло[3,2,1]окт-2-ена в 170 мл ледяной уксусной кислоты, потом прибавляют 20 мл воды. Смесь нагревают до 50oC и прибавляют 40 г цинкового порошка порциями. После 2 часов перемешивания при 50oC смесь фильтруют и концентрируют в вакууме. Прибавляют воду и подщелачивают смесь водным гидроксидом натрия. Экстракция этилацетатом, сушка органической фазы над сульфатом магния и удаление растворителя в вакууме дает 7 г 3-(4-фторфенил)-8-азабицикло[3,2,1]окт-2-ена в виде масла.
Получают целевое соединение 23 из 3-(4-фторфенил)-8- азабицикло[3,2,1] окт-2-ена по способу, описанному в примере 9. Выход 1,9 г, т.пл.74-75oC.
Пример 24
3-[4-[3-(4-фторфенил)-8-азабицикло[3,2,1]октан-8-ил]-1- бутил]-1,2-бензизоксазол, оксалат, 24, т.пл. 169-170oC
Раствор 10 г 3-(4-фторфенил)-8-азабицикло[3,2,1]окт-2-ена растворяют в 150 мл ледяной уксусной кислоты. Прибавляют 0,5 г оксида платины, потом обрабатывают газообразным водородом при давлении 3
атм в обычном аппарате Парра. Фильтрация и удаление растворителя в вакууме дает вязкое масло. Прибавляют воду и подщелачивают смесь (pH > 9) водным гидроксидом натрия. Экстрагируют этилацетатом,
сушат органическую фазу над сульфатом магния и удаляют растворитель в вакууме, получают 9 г 3-(4-фторфенил)-8-азабицикло[3,2,1]октана в виде масла. Получают целевое соединение 24 из
3-(4-фторфенил)-8- азабицикло[3,2,1]октана и 4-(1,2-бензизоксазол-3-ил)-1- бутилметансульфоната (полученного, как описано в примере 19) по способу, описанному в примере 2. Оксалатную соль
кристаллизуют из ацетона при добавлении щавелевой кислоты. Выход 1,1 г, т.пл. 169-170oC.
Пример 25
1'-(4-фенил-1-бутил)-спиро[1,3-бензодиоксол- 2,4'-пиперидин] ,
малеат, 25а
Смесь 17 г 1-этоксикарбонил-4-пиперидинона, 13 г пирокатехола и 2,5 г р-толуолсульфоновой кислоты в 250 мл сухого толуола кипятят с обратным холодильником при непрерывном удалении
воды. Через 3 часа реакционную смесь концентрируют в вакууме, прибавляют 200 мл 2%-ного гидроксида натрия, потом экстрагируют дихлорметаном. После сушки над сульфатом магния и удаления растворителя в
вакууме оставшееся красное масло наносят на колонку с силикагелем (элюент: этилацетат/гептан = 1:1), получают 22 г светло-желтого масла, 1'-этоксикарбонил-спиро[1,3-бензодиоксол-2,4'- пиперидина].
Масло растворяют в 250 мл этанола, прибавляют 10 г гидроксида натрия и 20 мл воды, смесь кипятят с обратным холодильником в течение 20 часов. Удаление растворителя в вакууме, добавление соленой воды и последующая экстракция дихлорметаном дает после сушки органической фазы над сульфатом магния и удаления растворителя в вакууме красное масло, которое наносят на колонку с силикагелем (элюент: этилацетат/метанол/триэтиламин = 4:5:1), получают 10 г бесцветных кристаллов спиро[1,3-бензодиоксол-2,4'- пиперидина], т.пл. 108-110oC.
Целевое соединение 25а, полученное из 2,3 г 4-фенил-1-бутил- метансульфоната и 1,9 г спиро[1,3-бензодиоксол-2,4'-пиперидина] по способу, описанному в примере 2, кристаллизуют в виде малеатной соли из ацетона с добавлением малеиновой кислоты. Выход 1,6 г, т.пл. 156-157oC.
Подобным образом также получают:
1'-[4-(3-индолил)-1-бутил]-спиро[1,3-бензодиоксол-2,4'- пиперидин], 25б, т.пл.
144-149oC.
Пример 26
1'-[4-(4-фторфенил)-4-окси-1-бутил] -спиро[изобензофуран- 1(3Н), 4'-пиперидин], оксалат, 26а
Растворяют 2 г
1'-(3-(4-фторбензоил)-1-пропил)- спиро[изобензофуран-1(3H), 4'-пиперидина] , оксалата, полученного из 1-хлор-3-(4-фторбензоил)-пропана и спиро[изобензофуран-1(3Н),4'- пиперидина] по способу описанному
в примере 1, в 100 мл этанола. Прибавляют 0,1 г оксида палладия и смесь гидрируют в аппарате Парра при давлении водорода 3 атм в течение 16 часов. Фильтрация и концентрирование в вакууме дают после
добавления смеси этилацетат/ацетон кристаллический 26а. Выход 1,5 г, т.пл.75-80oC.
Подобным образом также получают:
1'-(4-фенил-4-окси-1-бутил)- спиро[изобензофуран-1(3Н), 4'-пиперидин] , 26б, т.пл. 139-140oC;
1'-(4-циклогексил-4-окси-1-бутил)-спиро[изобензофуран- 1(3Н), 4'-пиперидин], оксалат,
26в, т.пл. 87-89oC.
Пример 27
1'-(4-(1H-инден-3-ил)-1-бутил-спиро[изобензофуран-1(3H), 4'- пиперидин], 27
Суспензию 80 г активированного цинка в 200 мл
сухого тетрагидрофурана кипятят с обратным холодильником и прибавляют несколько кристалликов йода. Прибавляют по каплям раствор 100 г 1-инданона и 200 г метил-4-бромкротоната в 500 мл сухого
тетрагидрофурана, потом кипятят с обратным холодильником в течение 1 часа. После охлаждения прибавляют лед и водный хлорид аммония, потом экстрагируют дихлорметаном. Удаление растворителя в вакууме
дает вязкое масло, которое очищают на колонке с силикагелем (элюент: дихлорметан/эфир = 1:1), получают 78 г метил-4(1-оксииндан-1-ил)-кротоната. Растворяют 20 г кротоната в 200 мл сухого эфира и
прибавляют этот раствор каплями к суспензии 10 г литийалюминийгидрида в 150 мл сухого эфира. После часа кипячения с обратным холодильником реакционную смесь гидролизуют водой. Фильтрация, сушка
эфирной фазы над сульфатом магния и удаление растворителя в вакууме дает 18 г 4-(1-оксииндан-1-ил)-1-бутанола в виде масла.
Растворяют 16 г спирта в 250 мл метанола и прибавляют 40 мл концентрированной соляной кислоты. После 30 минут перемешивания при комнатной температуре реакционную смесь концентрируют в вакууме, прибавляют воду и экстрагируют смесь эфиром. Сушка эфирной фазы над сульфатом магния и удаление растворителя в вакууме дают вязкое масло, которое наносят на колонку с силикагелем (элюент: дихлорметан/эфир = 9:1), получают 1,8 г 4-((1H)инден-3-ил)-1- бутанола.
По способу, описанному в примере 2, спирт превращают в соответствующий метансульфонат и получают целевое соединение 27, используя спиро[изобензофуран-1(3H),4'-пиперидин], т.пл. 79-80oC.
Пример 28
1'-[4-(индан-1-ил)-1-бутил] -спиро[изобензофуран- 1(3Н)4'-пиперидин] , оксалат, 28
Суспензию 40 г активированного цинка в 150 мл сухого
тетрагидрофурана кипятят с обратным холодильником и прибавляют несколько кристаллов йода. Раствор 50 г 1-инданона и 100 г метил-4-бромкротоната в 400 мл сухого тетрагидрофурана прибавляют по каплям,
потом 1 час кипятят с обратным холодильником. После охлаждения прибавляют лед и устанавливают pH 1 концентрированной соляной кислотой, потом экстрагируют дихлорметаном. Концентрирование органической
фазы дает вязкое масло, которое растворяют в 400 мл метанола. Прибавляют 100 мл концентрированной соляной кислоты и смесь 30 минут перемешивают. Удаление растворителя в вакууме, добавление воды и
экстракция эфиром дают после сушки над сульфатом магния и удаления растворителя в вакууме 34 г масла. Масло растворяют в 300 мл сухого эфира и прибавляют по каплям к суспензии 21 г
литийалюминийгидрида. После 2 часов кипячения с обратным холодильником реакционную смесь гидролизуют водой. Фильтрация и удаление растворителя в вакууме дает смесь изомеров, из которой может быть
выделено 6 г 4-(1-инданил)-бут-3- ен-1-ола хроматографией на колонке (силикагель, элюент: дихлорметан/эфир = 9:1). Оставшуюся смесь изомеров (9 г) растворяют в 150 мл метанола и гидрируют при давлении
водорода 3 атм в обычном аппарате Парра в присутствии 5%-ного палладия на угле в течение 12 часов. Фильтрация и удаление растворителя в вакууме дает 6 г 4-(1-инданил)-1-бутанола.
Превращают спирт в целевое соединение 28 через соответствующий метансульфонат по методикам, описанным в примере 2, используя спиро[изобензофуран-1(3Н),4'-пиперидин], т.пл. 114-115oC.
Пример 29
1'-[4-(1-инданил)-бут-3-ен-1-ил] -спиро[изобензофуран- 1(3H),4'-пиперидин], оксалат, 29
Превращают 4-(1-инданил)-бут-3-ен-1-ол, полученный, как описано в примере
28, в соответствующий метансульфонат по методике примера 2. Целевое соединение получают по методике примера 2, используя спиро[изобензофуран-1(3Н), 4'-пиперидин], т.пл. 108-109oC.
Пример 30
1'-(4-(2,3-дигидро-1-(4-фторфенил)-3-индолил)-1-бутил)- спиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 30
Прибавляют по каплям к раствору 5 г 5а в 30 мл
трифторуксусной кислоты 0,5 г цианбромгидрида натрия в 25 мл метанола. После 2 часов перемешивания при комнатной температуре смесь концентрируют в вакууме, прибавляют 50 мл этилацетата, потом
промывают 2 х 50 мл 2 N гидроксида натрия. Сушка органической фазы над сульфатом натрия и удаление растворителя в вакууме дают целевое основание, которое кристаллизуют в виде оксалата из ацетона при
добавлении щавелевой кислоты. Выход 0,7 г, т.пл. 172-173oC.
Пример 31
1'-[3-(бензо[b] тиофен-3-илтио)-1- пропил]спиро[изобензофуран-1(3H),4'-пиперидин], малеат,
31а
Кипятят с обратным холодильником в течение 18 часов раствор 20 г бензо[b]тиофен-3-она, 25 г 3-меркаптопропионовой кислоты, 3 мл 2 N соляной кислоты в 80 мл ксилола. Прибавляют 100 мл воды
и 300 мл эфира и разделяют фазы. Эфирную фазу экстрагируют 150 мл 2 N гидроксида натрия, потом подкисляют щелочную фазу концентрированной соляной кислотой.
Экстракция эфиром, сушка эфирной фазы над сульфатом магния и удаление растворителя дают 15,6 г вязкого масла, 3-бензо[b]тиофен- 3-илтио)-пропионовой кислоты.
Кислоту растворяют в 100 мл тетрагидрофурана и прибавляют по каплям к суспензии 4 г литийалюминийгидрида в 150 мл тетрагидрофурана. После 3 часов кипячения с обратным холодильником реакционную смесь закаливают водой, потом при обычной обработке получают 12,7 г 3-(бензо[b]тиофен-3-илтио)-1-пропанола в виде масла.
Целевое соединение 31а получают по способу примера 2, используя спиро[изобензофуран-1(3H),4'-пиперидин], и кристаллизуют в виде малеата из ацетона с добавлением малеиновой кислоты. Выход 0,9 г, т.пл. 154-155oC.
Подобным образом также получают:
1'-[3-(бензо[b]
тиофен-3-илтио)-1-пропил] спиро[3H-2- бензопиран-3,4'-пиперидин], малеат, 31б, т.пл. 169-170oC.
Пример 32
1'-[4-(2,
3-дигидробензо[b]тиофен-3-илиден)-1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин]-S,S-диоксид, малеат, 32
Раствор 4,4 г 4-(3-бензо[b]тиофен-3-ил)-1- бутилметансульфоната, полученного, как
описано в примерах 10 и 2, в 12 мл ледяной уксусной кислоты обрабатывают по каплям 30%-й водной перекисью водорода при комнатной температуре, потом 20 минут нагревают при 80oC. При
охлаждении кристаллизуется продукт, 4-(3-бензо[b]тиофен-S,S-диоксид-3-ил)-1-бутилметансульфонат. Выход 3,7 г, т.пл. 100-101oC.
Обрабатывают 1,4 г метансульфоната 1,2 г спиро[изобензофуран- 1(3Н), 4'-пиперидин] •HCl по методике, описанной в примере 2, получают целевое соединение 32, которое кристаллизуют в виде малеата из ацетона при добавлении малеиновой кислоты. Выход 1 г, т.пл. 186-187oC.
Пример 33
1'-[4-(2,3-дигидро-бензо[b] тиофен-3-ил)-1-бутил] спиро[изобензофуран-1(3Н),4'-пиперидин]-S,S-диоксид, малеат, 33
Окисление 8,5 г 4-(бензо[b]тиофен-3-ил)масляной кислоты по способу, описанному в примере 32, дает 9,2 г соответствующего S,S-диоксида. Раствор 4 г кислоты в 25 мл тетрагидрофурана прибавляют по
каплям к суспензии 1,3 г литийалюминийгидрида в 50 мл тетрагидрофурана при 0oC, потом 2 часа перемешивают при комнатной температуре. Обычная обработка дает 3 г 4-(2,3-дигидро- бензо[b]
тиофен-S, S-диоксид-3-ил)-1-бутанол, который превращают в целевое соединение при обработке спиро[изобензофуран-1(3Н),4'- пиперидином] по способу примера 2. Продукт кристаллизуют в виде фумарата из
смеси ацетон/этанол при добавлении фумаровой кислоты. Выход 1,5 г, т.пл. 197-198oC.
Пример 34
1'-[3-(бензо[b] тиофен-3-илокси)-1- пропил] спиро[изобензофуран-1(3H),
4'-пиперидин], малеат, 34
Смесь 30 г бензо[b]тиофен-3-она, 73 г этил-3-бромпропионата, 55 г карбоната калия, 1,3 г йодида калия и 600 мл ацетона кипятят с обратным холодильником в течение 18
часов. Фильтрация и удаление растворителя в вакууме дают красное масло, которое растворяют в 200 мл эфира и сушат над сульфатом магния. Прибавляют эфирный раствор по каплям к суспензии 5 г
литийалюминийгидрида в 100 мл эфира, потом 1 час кипятят с обратным холодильником. Обычная обработка дает вязкое масло, которое наносят на колонку с силикагелем (элюент: изопропиловый эфир), получают
3-(бензо[b]тиофен-3-илокси)-1-пропанол (0,54 г) в виде масла.
Получают целевое соединение по способу, описанному в примере 2, используя спиро[изобензофуран-1(3H),4'-пиперидин], и кристаллизуют в виде малеатной соли из смеси ацетон/эфир при добавлении малеиновой кислоты. Выход 0,34 г, т.пл. 116-117oC.
Пример 35
1'-[2-(бензо[b]
тиофен-3-илметокси)-1- этил] спиро[изобензофуран-1(3H), 4'-пиперидин], фумарат, 35а
Раствор 15 г метилбензо[b]тиофен-3-карбоксилата в 50 мл эфира прибавляют по каплям к суспензии 3,5 г
литийалюминийгидрида в 100 мл эфира, потом 2 часа кипятят с обратным холодильником. Обычная обработка дает 13,5 г бензо[b] тиофен-3-илметанола в виде масла.
Масло растворяют в 50 мл тетрагидрофурана и прибавляют по каплям к суспензии гидрида натрия (5 г в 80%-й парафиновой суспензии) в 100 мл тетрагидрофурана, потом 1 час кипятят с обратным холодильником. Прибавляют 35 г этилбромацетата в 50 мл тетрагидрофурана при 60oC, затем 1 час кипятят с обратным холодильником. Прибавляют дополнительные 20 г этилбромацетата, потом кипятят 7 часов с обратным холодильником. Реакцию закаливают водой и отгоняют летучие в вакууме. Оставшееся масло наносят на колонку с силикагелем (элюент: этилацетат/гептан 2:8), получают 5 г этилбензо[b]тиофен-3-илметилоксиацетата в виде масла. Восстановление литийалюминийгидридом, как описано выше, дает 3,8 г 2-(бензо[b]тиофен-3-илметилокси)этанола в виде масла.
Целевое соединение 35а получают по способу, описанному в примере 2, используя спиро[изобензофуран-1(3H),4'-пиперидин], и кристаллизуют в виде фумаратной соли из смеси ацетон/этанол при добавлении фумаровой кислоты. Выход 0,55 г, т.пл. 149-150oC.
Подобным образом также получают:
1'-[2-(5-фторбензофуран-3-илметилокси)-1- этил] спиро[изобензофуран-1(3H),4'-пиперидин],
оксалат, 35б, т.пл. 148-149oC;
1'-[2-(бензофуран-3-илметилокси)-1-этил] - 4-фторспиро[изобензофуран-1(3H),4'-пиперидин], оксалат, 35в, т.пл. 120-122oC.
Пример 36
1'-[4-(1-(2-диметиламино-1-этил)-3-индолил)-1- бутил]спиро[изобензофуран-1(3H),4'-пиперидин], дигидрохлор, 36
Раствор 5 г 4-(3-индолил)-1-бутанола в 50 мл сухого ДМФ
охлаждают до 10oC, потом обрабатывают 3 г трет.бутоксида калия. После перемешивания в течение 5 минут прибавляют по каплям 3,5 г 2-хлор-N,N-диметилацетамида, растворенного в 10 мл сухого
ДМФ, при 10-15oC. После часа перемешивания при комнатной температуре прибавляют воду, потом экстрагируют этилацетатом. Сушка органической фазы над сульфатом магния и удаление растворителя в
вакууме дают вязкое масло, 4-(1-диметиламинокарбонилметил-3- индолил)-1-бутанол, (7 г), которое превращают в 1'-[4-(1-диметиламинокарбонилметил-3-индолил)-1-бутил] спиро[изобензофуран-1(3H),
4'-пиперидин] по способу, описанному в примере 2, используя спиро[изобензофуран-1(3H),4'-пиперидин]. Выход 5,7 г вязкого масла. Обычное восстановление литийалюминийгидридом дает целевое соединение 36,
которое кристаллизуют в виде дигидрохлорида из ацетона при добавлении соляной кислоты. Выход 2,4 г, т.пл. 244-245oC.
Фармакология
Представители соединений формулы
I были испытаны в соответствии с установленным и надежным фармакологическим тестом следующим образом.
Ингибирование3H-ДТГ связывания с сигма-рецепторами в мозгу крыс in vitro.
По этому способу ингибирование лекарством связывания 2 нM3H-ДТГ (1,3-ди-о-толилгуанидина) с сигма-рецепторами в гомогенатах или мембранах мозга крыс без мозжечка было определено in vitro, как модифицировано Weber et al, Proc,Natl.Acad.Sci.l986, 83, 8784.
Препараты ткани
Гомогенат: Обезглавливают крыс (150-152 г) и быстро извлекают
мозг (без мозжечка) и помещают на лед, взвешивают и гомогенизируют в 100 объемах охлажденного льдом (0oC) 50 пM Трис-буфера (pH 7,7) в промытом этанолом стекло/тефлоновом гомогенизаторе при
0oC, хранят на льду до использования.
P2-мембраны: Мозги гомогенизируют в 10 объемах 0,32 М сахарозе в промытом этанолом стекло/тефлоновом гомогенизаторе 10 ходами поршня вверх и вниз. Гомогенат центрифугируют в течение 10 минут при 900 • gm при 4oC. Декантируют надосадочную жидкость и центрифугируют в течение 20 минут при 50,000 gm при 4oC. Полученный в результате шарик повторно суспендируют в 10 объемах охлажденного льдом 50 пM Трис-буфера (pH 7,7) и инкубируют в течение 30 минут при 37oC. Суспензию мембран затем центрифугируют в течение дополнительных 20 минут при 50,000 gm при 4oC. Шарик повторно суспендируют в 50 объемах охлажденного льдом Трис-буфера и используют немедленно.
Анализ на связывание.
Смешивают 0,5 мл 50 mM Трис-буфера (pH 7,7), 0,25 мл дисплейсера (6 х 100 мкМ, 6 х [испытуемое соединение] или Трис-буфер) и 0,25 мл 6 х 2 нМ3H-ДТГ в пластиковых пробирках для испытаний емкостью 5 мл и выдерживают при 4oC до использования. Реакция связывания происходит немедленно при смешивании 0,5 мл суспензии ткани с этим раствором и инкубации при 25oC в течение 20 минут. Фильтр из стекловолокна (ВатманGF(B) помещают на фильтрующую машину, которую затем герметично закрывают. Непосредственно перед фильтрацией накладывают вакуум и фильтры промывают 0,1% раствором PEl из распыливающей бутылочки, потом один раз промывают Трис-буфером.
Реакцию связывания прекращают при фильтрации анализируемой смеси при пониженном давлении (750 мбар) с последующими тремя дополнительными промывками 5 мл охлажденного льдом Трис-буфера. Затем фильтры помещают в бутылочки для подсчета и добавляют 4 мл сцинцилляционного раствора. Бутылочки подсчитывают в сцинциллярном счетчике Бекманна.
Буферы и растворы.
50 мл Трис-буфер pH 7,7: 7,38 г Тризма - 7,7 плюс дистиллированная вода до 1 л.
100 мл 10% полиэтиленимина (PEl): 100 мл дистиллированной воды прибавляют к примерно 20 г 50%. PEl, который солюбилизируют при перемешивании и нагревании. Разбавляют (1+99) перед использованием.
6 х 2 нМ3H-ДTГ: точный объем зависит от действительной концентрации ванны, но ее готовят по возможности близкой к 12 нМ. Контейнеры для радиоактивного раствора промывают 96%-м этанолом перед использованием.
6 х 100 мкМ ДТГ: 14,36 мг/100 мл хранят замороженным аликвотами по 10 мл.
3H-ДТГ получают из HEH Рисерч Продактс, Дюпон Денмарк. Удельная активность 62,3 Кю/ммоль.
Известные сигма-рецепторные лиганды ВМУ 14802 и римказол включены в тест с целью сравнения.
Из таблицы видно, что соединения, использованные в настоящем изобретении, являются очень мощными сигма-рецепторными лигандами по сравнению со стандартными соединениями, которые являются известными на данном уровне техники сигма-рецепторными лигандами, мощности испытуемых соединений были лучше 40 нМ, а для большинства испытанных соединений лучше 1 нМ.
Кроме того, была определена способность настоящих соединений ингибировать связывание3H-Празозина с α1 адреносепторами в мембранах мозга крыс in vitro по Hyttel et al, J. Neurochem, 1985, 44, 1615; Skarsfeldt T.et al, J. Pharmacol, 1986, 125, 323.
Дополнительно соединения изобретения были испытаны в отношении активности связывания допамин D2 рецептора van der Welde et al, Eur.J.Pharmacol, 1987, 134, 211.
Для большинства соединений сродство к α1 адреносепторами и D2 рецепторами было слабым по сравнению с мощным связыванием с сигма-рецепторами. Следовательно, многие из соединений являются очень селективными сигма-рецепторными лигандами, имеющими отношения способностей связывания (ИК50 альфа/ИК50 сигма и ИК50 допамин/ИК50 сигма, соответственно) 30-10000.
Тест дискриминации свет/темнота на крысах.
Испытание проводили в соответствии с F.C.Colpaert et al, Psychpharmacology (1985) 86:45-54, В тесте использовались крысы Вистар WU.
Тест проводят с использованием бокса с двумя отсеками активности, в котором может быть легко определено действие анксиолитических соединений на снижение отвращения к яркому окружающему свету. Бокс сконструирован как экспериментальный бокс с открытым верхом, одна треть которого, отделенная от остальной части, выкрашена черным и освещается красным светом. Остальная часть бокса окрашена белым и ярко освещена. Пол каждой площадки разделен на квадраты. Регистрируется изменение поведения. Данные, полученные от групп по дозам, анализируют, используя однофакторный анализ вариации и тест Дуннетта. Испытуемые соединения вводили интраперитонально за 45 минут до испытаний.
В этом модельном тесте было испытано несколько соединений и показаны значительные анксиолитические активности при величинах ED50 в интервале нг-мкг/кг.
Примеры рецептур
Фармацевтические рецептуры изобретения могут быть приготовлены известными на данном уровне темники
способами.
Например: таблетки могут быть получены при смешивании активного ингредиента с обычными вспомогательными веществами и/или разбавителями и последующем прессовании смеси в обычной таблетирующей машине. Примеры вспомогательных веществ или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, смолы и т.п. Любые другие вспомогательные вещества или добавки, обычно используемые для таких целей, такие как красители, отдушки, консерванты и т.п., могут быть использованы при условии, что они совместимы с активными ингредиентами.
Растворы для инъекций могут быть получены при растворении активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно стерильной воде, установлении желаемого объема, стерилизации раствора и заполнения подходящих ампул или бутылочек. Любые подходящие добавки, традиционно используемые на данном уровне техники, могут быть добавлены, такие как тонизирующие агенты, консерванты, антиоксиданты и т.п.
Типичные примеры рецептур изобретения являются следующими:
1) Таблетки, содержащие 0,5 мг Соединения 3в,
рассчитаны на свободное основание:
Соединение 3в - 0,5 мг
Лактоза - 18 мг
Картофельный крахмал - 27 мг
Сахароза - 58 мг
Сорбит - 3 мг
Тальк - 5
мг
Желатин - 2 мг
Повидон - 1 мг
Стеарат магния - 0,5 мг
2) Таблетки, содержащие 5 мг Соединения 2н, рассчитаны на свободное основание:
Соединение 2н - 5
мг
Лактоза - 16 мг
Картофельный крахмал - 45 мг
Сахароза - 106 мг
Сорбит - 6 мг
Тальк - 9 мг
Желатин - 4 мг
Повидон - 3 мг
Стеарат магния - 0,60 мг
3) Сироп, содержащий на миллилитр:
Соединение 6б - 2,5 мг
Сорбит - 500 мг
Трагакант - 7 мг
Глицерин - 50 мг
Метил-парабен
- 1 мг
Пропил-парабен - 0,1 мг
Этанол - 0,005 мл
Вода - до 1 мл
4) Раствор для инъекций, содержащий на миллилитр:
Соединение 17а - 1 мг
Уксусная
кислота - 17,9 мг
Стерильная вода - до 1 мл
5) Раствор для инъекций, содержащий на миллилитр:
Соединение 17б - 0,1 мг
Сорбит - 42,9 мг
Уксусная кислота - 0,
63 мг
Гидроксид натрия - 22 мг
Стерильная вода - до 1 млу
Реферат
Описывается способ получения фармацевтической композиции для лечения состояний беспокойства и эпилепсии, включающий смешивание активного ингредиента и фармацевтически приемлемого носителя, отличающийся тем, что в качестве активного ингредиента используют соединение пиперидина общей формулы (I), где значения R1 - R7, Z1 - Z3 указаны в п.1 формулы. Описывается фармацевтическая композиция для лечения состояний беспокойства или эпилепсии. 3 с. и 18 з.п.ф-лы, 1 табл.
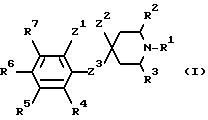
Формула
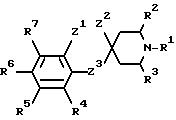
где R1 является
а) группой -D-B-A-R, где В является до 19-членной алкиленовой группой, разветвленной или с прямой цепью, возможно замещенной гидроксилом;
А является связью или двухвалентной группой, выбранной из O, S, SO, SO2 и
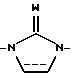
где W является О или S и пунктирная линия означает необязательную связь;
R представляет собой С1-С20-алкил, С3-С8-циклоалкил, адамантил, фенил, С4-С20-циклоалкилалкил, или фенил(С1-С20)-алкил, при этом любая фенильная группа, необязательно, замещена одним или более заместителями, выбранными из галогена, С1-С6-алкила, С1-С6-алкокси, гидрокси, трифторметила;
D представляет собой CR8R9, где R8 и R9 независимо выбраны для заместителей, определенных ниже для R4 - R7;
или в) группой общей формулы II
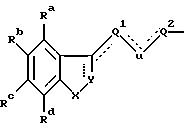
где Х представляет собой CHR10, O, S, SO, SO2 или NR10, причем R10 является водородом, С1-С6-алкилом, С3-С8-циклоалкилом, адамантилом или С3 -С8-циклоалкил(С1-С6)-алкилом, ацилом, амино(С1-С6)алкилом, моно- или ди(C1-C6)алкиламино(С1-С6 )-алкилом, алкилсульфонилом, фенилсульфонилом, фенил(С1-С6)алкилом или фенилом, необязательно замещенным одним или несколькими заместителями, независимо выбранными из галогена, С1-С6-алкила, С1-С6-алкоксила, гидроксила, трифторметила, и циано, или R10 является 2-тиенилом, 3-тиенилом, 2-фуранилом, 3-фуранилом, 2-тиазолилом, 2-пиридилом, 3-пиридилом, 4-пиридилом;
одна или две пунктирные линии могут быть связью;
когда пунктирная линия, выходящая из Y, указывает связь, Y является N или CH, или, когда пунктирная линия не указывает на связь, Y является СН2 или NH;
Ra-Rd независимо выбирают из водорода, галогена, С1-С6-алкила, С1-С6-алкоксила, С1-С6-алкилтио, С1-С6-алкилсульфонила и трифторметила;
U является CH2, O, S; или, когда одна из пунктирных линий, выходящих из U, указывает связь, U является СН;
связь между Q1 и Q2 соответственно и U также может быть тройной связью, и в таком случае U является С;
Q1 выбран из связи, алкилена или алкенилена и Q2 является алкиленом, имеющим, по крайней мере, два атома С, или алкениленом, Q1 и Q2 имеют вместе 2 - 20 атомов углерода:
R2 и R3 независимо являются водородом, С1-С6-алкилом или они могут быть связаны вместе, образуя этиленовый или пропиленовый мостик;
R4 - R7 независимо выбирают из водорода, галогена, С1-С6-алкила, гидроксила, С1-С6-алкила или ди(С1-С6)алкиламина, и трифторметила;
i) Z1 и Z2 связаны вместе, в этом случае Z1 является СН2, О или S; Z2 и Z3 независимо являются связью, СН2, О или S при условии, что Z1 не может быть S или О, когда Z2 является S или О, и Z2 и Z3 не могут быть связью, или Z1 и Z2 могут вместе представлять собой группу -СН=СН- при условии, что по крайней мере один из Z1, Z2, Z3 являются О или S; или когда Z3 является связью, Z1 и Z2 вместе могут представлять трехчленную двухвалентную группу, содержащую один О- или S-гетероатом; или
ii) когда R1 является группой, определенной в в), Z1 и Z2 также могут быть несвязанными, в этом случае Z1 является группой, определенной для R4-R7, Z2 является водородом и Z3 является связью; при условии, что D-B-A-R не может быть С1-С6-алкилом или С1-С6-алкенилом, циклоалкил-С1-3-алкилом и, необязательно, замещенным фенил-С1-4-алкилом; если Z2 является связью и один из Z1 и Z3 является О, тогда другие Z1 и Z3 не могут быть СН2,
или соли его присоединения кислоты.
1'-(3-адамантилокси-1-пропил)спиро[3Н-2-бензопиран-3,4'-пиперидин];
1'-[4-(1-бензил-3-индолил)-1-бутил] -спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'(3-(3-фенилимидазолидин-2-он-1-ил)-1-пропил)спиро[изобензофуран-1-(3Н), 4'-пиперидин];
1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] -спиро[изобензофуран-1-(3Н), 4'-пиперидин];
1,4-дигидро-1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил]спиро[3H-2-бензопиран-3,4-'пиперидин];
1'-[4-[1-р-толуолсульфонил-3-индолил)-1-бутил)спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'-[4-[5-фтор-1-(4-фторфенил)-3-индолил] -1-бутил] спиро[изобензофуран-1(3H), 4'-пиперидин];
6-фтор-1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] спиро[изобензофуран-1(3H), 4'-пиперидин];
1'-[4-[1-(4-метилфенил)-3-индолил]-1-бутил]спиро[1Н-2-бензопиран-4-(3Н), 4'-пиперидин];
1-(4-фторфенил)-3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил]индол;
1'-[4-(1-2-триазолил)-3-индолил)-1-бутил] спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'[3-(5-фторбензофуран-3-ил)-1-пропил] спиро[изобензофуран-1(3Н), 4'-пиперидин];
1-[4-(5-фторбензофуран-3-ил)-1-бутил] -спиро[изобензофуран-1(3H), 4'-пиперидин];
1'-[4-[1-(4-фторфенил)-5-трифторметилиндазол-3-ил] -1-бутил] спиро[изобензофуран-1(3Н),4-пиперидин];
4-фторфенил-3-[4-(4-(4-фторфенил)-1-пиперидинил)-1-бутил]-5-трифторметилиндазол;
1'-(4-(1,2-бензизоксазол-3-ил)-1-бутил)спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'-[3-(бензо[b] тиофен-3-илтио)-1-пропил]спиро[изобензофуран-1(3Н), 4'-пиперидин].
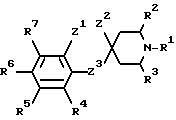
где R1 является
а) группой -D-B-A-R, где В является до 19-членной алкиленовой группой, разветвленной или с прямой цепью, возможно замещенной гидроксилом;
А является связью или двухвалентной группой, выбранной из 0, S, SO, SO2 и
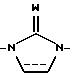
где W является O или S и пунктирная линия означает необязательную связь;
R представляет собой С1-С20-алкил, С3-С8-циклоалкил, адамантил, фенил, С4-С20-циклоалкилалкил, или фенил(С1-С20)алкил, при этом любая фенильная группа, необязательно, замещена одним или более заместителями, выбранными из галогена, С1-С6-алкила, С1-С6-алкокси, гидроксилатрифторметила;
D представляет собой СR8R9, где R8 и R9 независимо выбраны для заместителей, определенных ниже для R4-R7; или
в) группой общей формулы II
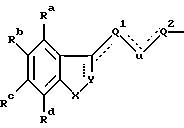
где Х представляет собой CHR10, О, S, SO, SO2 или NR10, причем R10 является водородом, С1-С6-алкилом, С3-С8-циклоалкилом, адамантилом или С3 -С8-циклоалкил(С1-С6)-алкилом, ацилом, амино(С1-С6)-алкилом, моно- или ди(С1-С6)-алкиламино(С1-С6 )-алкилом, алкилсульфонилом, фенилсульфонилом, фенил(С1-С6)алкилом или фенилом, необязательно замещенным одним или несколькими заместителями, независимо выбранными из галогена, С1-С6-алкила, С1-С6-алкоксила, гидроксила, трифторметила, и циано, или R10 является 2-тиенилом, 3-тиенилом, 2-фуранилом, 3-фуранилом, 2-тиазолилом, 2-пиридилом, 3-пиридилом, 4-пиридилом;
одна или две пунктирные линии могут быть связью;
когда пунктирная линия, выходящая из Y, указывает связь, Y является N или СН; или когда пунктирная линия не указывает на связь, Y является СН2 или NH;
Ra-Rd независимо выбирают из водорода, галогена, С1-С6-алкила, С1-С6-алкоксила, С1-С6-алкилтио, С1-С6-алкилсульфонила и трифторметила;
U является СН2, O, S; или когда одна из пунктирных линий, выходящих из U, указывает связь, U является СН;
связь между Q1 и Q2, соответственно, и U также может быть тройной связью, и в таком случае U является С;
Q1 выбран из связи, алкилена или алкенилена и Q2 является алкиленом, имеющим, по крайней мере, два атома С, или алкениленом, Q1 и Q2, имеют вместе 2 - 20 атомов углерода;
R2 и R3 независимо являются водородом, С1-С6-алкилом или они могут связаны вместе, образуя этиленовый или пропиленовый мостик;
R4 - R7 независимо выбирают из водорода, галогена, С1-С6-алкила, гидроксила, С1-С6-алкила или ди(С1-С6)алкиламина и трифторметила;
i) Z1 и Z2 связаны вместе, в этом случае Z1 является СН2, О или S; Z2 и Z3 независимо являются связью, СН2, О или S, при условии, что Z1 не может быть S или О, когда Z2 является S или О, и что Z2 и Z3 не могут быть связью, или Z1 и Z2 могут вместе представлять собой группу -СН=СН-, при условии, что по крайней мере, один из Z1, Z2, Z3 являются О или S; или когда Z3 является связью, Z1 и Z2 вместе могут представлять трехчленную двухвалентную группу, содержащую один О- или S-гетероатом; и, необязательно, содержащую ненасыщенную связь; или
ii) когда R1 является группой, определенной в в), Z1 и Z2 также могут быть несвязанными, в этом случае Z1 является группой, определенной для R4-R7; Z2 является водородом и Z3 является связью при условии, что если R1 является группой формулы II, определенной под в), Z1, Z2 и Z3 определены под ii),
Х является О;
Y является N;
пунктирная линия, выходящая из Y, указывает на связь;
-Q1-U-Q2 указывает - (СН2)3, тогда Rс не может быть фтором;
если R1 является группой формулы II, определенной под в), Z1, Z2 и Z3 определены под ii),
Х является NH;
Y является CH;
пунктирная линия, выходящая из Y, указывает на связь, тогда -Q1-U-Q2 не может быть алкилом, имеющим менее 5 атомов углерода;
если Z2 является связью и один из Z1 и Z3 является О, тогда другие Z1 и Z3 не могут быть СН2;
D-B-A-R не может быть С1-6-алкилом или С1-С6-алкенилом, циклоалкил-С1-С3-алкилом и, необязательно, замещенным фенил-С1-С4-алкилом;
если Z1 является О и Z2 и Z3 являются оба СН2, тогда D-B-A-R не может быть, необязательно, гексилом или гептилом, замещенным гидроксилом;
или соли его присоединения кислоты.
1'-(3-адамантилокси-1-пропил)спиро[3H-2-бензопиран-3,4'-пиперидин];
1'[4-1-бензил-3-индолил)-1-бутил] -спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'-(3-(3-фенилимидазолидин-2-он-1-ил)-1-пропил)спиро[изобензофуран-1(3Н),4'-пиперидин];
1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] -спиро[изобензофуран-1(3Н), 4'-пиперидин];
1, 4-дигидро-1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] спиро[3Н-2-бензопиран-3,4'-пиперидин];
1'-(4-(1-р-толуолсульфонил-3-индолил)-1-бутил)спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'-[4-[5-фтор-1-(4-фторфенил)-3-индолил/-1-бутил] спиро[изобензофуран-1(3Н),4'-пиперидин];
6-фтор-1'-[4-[1-(4-фторфенил)-3-индолил] -1-бутил] спиро[изобензофуран-1(3Н),4'-пиперидин];
1'-[4-[1-(4-метилфенил)-3-индолил]-1-бутил]-спиро[1H,2-бензопиран-4(3Н), 4'-пиперидин];
1-(4-фторфенил)-3-[4-(4-(4-фторфенил)-1-пиперидил)-1-бутил]индол;
1'-[4-(1-(2-триазолил)-3-индолил)-1-бутил] спиро[изобензофуран-1(3Н), 4'-пиперидин];
1'-[3-(5-фторбензофуран-3-ил)-1-пропил] спиро[изобензофуран-1(3Н),4'-пиперидин];
1'-[4-(5-фторбензофуран-3-ил)-1-бутил]спиро[изобензофуран-1(3Н),4'-пиперидин];
1'-[4-[1-(4-фторфенил)-5-трифторметилиндазол-3-ил] -1-бутил] спиро[изобензофуран-1(3Н),4'-пиперидин];
4-фторфенил-3-[4-(4-(4-фторфенил)-1-пиперидинил]-1-бутил]-5-трифторметилиндазол;
1'-(4-(1,2-бензизоксазол-3-ил)-1-бутил] спиро[изобензофуран-1(3Н), 4'-пиперидин]; и
1'-[3-(бензо[b] тиофен-3-илтио)-1-пропил] спиро[изобензофуран-1(3Н),4'-пиперидин].
13.06.91 - все признаки изобретения за исключением следующих: А является двухвалентной группой, выбранной из O, S, SO, SO2 или
где W является О и S, и пунктирная линия обозначает необязательную связь, R - адамантил, D представляет собой CR8R9, где R8 и R9 независимо выбраны из заместителей, определенных для R4 - R7, R10 - адамантил, фенил(С1-С6)алкил, амино(С1-С6)алкил, моно- или ди(С1 -С6)алкиламино(С1-С6)алкил, связь между Q1 и Q2, соответственно, и U может быть тройной связью и в таком случае U является С;
10.02.92 - А является двухвалентной группой, выбранной из O, S, SO, SO2 или
где W является О и S, и пунктирная линия обозначает необязательную связь, R - адамантил, D представляет собой CR8R9, где R8 и R9 независимо выбраны из заместителей, определенных для R4 - R7, R10 - адамантил, фенил(С1-С6)алкил, амино(С1-С6)алкил, моно- или ди(С1-С6 )алкиламино(С1-С6)алкил, связь между Q1 и Q2, соответственно, и U может быть тройной связью и в таком случае U является С.

Комментарии